Результат интеллектуальной деятельности: Способ получения тканеспецифического матрикса для тканевой инженерии хряща
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к области биотехнологии и регенеративной медицины, и может быть использовано для восстановления дефектов хряща человека как отдельно, так и в составе длительно функционирующих специализированных биомедицинских продуктов в комбинации с гелеобразными матриксами, как без клеток, так и в виде клеточно- и тканеинженерных эквивалентов.
Предлагаемый способ может быть использован в специализированных отделениях, занимающихся реконструктивной хирургией поврежденной хрящевой ткани и/или стимулированием in situ процессов регенерации хрящевой ткани, а также в специализированных лабораториях при исследованиях клеточно- и тканеинженерных конструкций (КИК и ТИК) хряща.
В настоящее время для восстановления структуры и функций необратимо поврежденных хрящевых тканей технологии регенеративной медицины и тканевой инженерии предлагают имплантацию аутологичных хондроцитов или мезенхимальных стромальных клеток (МСК), культивированных на трехмерных биосовместимых матриксах. Особое внимание уделяется структуре и составу матриксов, так как, кроме соответствующих механических свойств, дающих возможность хирургического применения, они должны обеспечивать адгезию и пролиферацию клеток, быть биосовместимыми, биорезорбируемыми, заменяясь, в конечном итоге, собственной функциональной тканью.
Матриксы для КИК и ТИК хряща производят из неспецифических полимерных материалов синтетического или природного происхождения в виде гидрогелей, губок или волокнистых сеток. Благодаря значительному соответствию представленным выше требованиям, среди матриксов предпочтение отдается полимерам природного происхождения (биополимерам) и их производным: альгинаты, коллаген, желатин, хитозан, гиалуроновая кислота, полиэфиры бактериального происхождения [Rai V, Dilisio MF, Dietz NE, Agrawal DK. Recent strategies in cartilage repair: A systemic review of the scaffold development and tissue engineering. J Biomed Mater Res A. 2017; 105(8): 2343-2354.]. Однако эти матриксы не обладают тканеспецифической каркасностью и потому нуждаются в декорировании (дополнительном покрытии) или модифицировании их поверхности путем введения структур-сайтов для адгезии клеток.
Известны способы изготовления нативного матрикса различных органов путем децеллюляризации: печень, почки, сосуды, поджелудочная железа. Децеллюляризация представляет собой процедуру обработки тканей, обеспечивающую разрушение клеток при максимальном сохранении внеклеточного матрикса (ВКМ), чьи белки, в отличие от клеток, несут незначительное количество антигенов, вызывающих реакцию отторжения трансплантата в силу молекулярного эволюционного консерватизма [Bernard MP, Chu ML, Myers JC, Ramirez F, Eikenberry EF, Prockop DJ. Nucleotide sequences of complementary deoxyribonucleic acids for the pro. alpha. 1 chain of human type I procollagen. Statistical evaluation of structures that are conserved during evolution. Biochemistry. 1983; 22(22):5213-5223.], обеспечивая при этом для культивируемых клеток наиболее биохимически и функционально адекватное микроокружение. Каркасные белки нативных матриксов интегративно содержат в своем составе остатки тканевых структур (гликопротеиды внеклеточного вещества, структурные белки межклеточных контактов и факторы прикрепления клеток), которые позволяют оптимизировать условия для пролонгированной жизнедеятельности прикрепившихся клеток.
Для осуществления децеллюляризации тканей, целых органов или их фрагментов применяют разнообразные методы обработки. Наибольшее распространение получило использование для этой цели поверхностно-активных веществ (ПАВ), в частности ионного додецилсульфата натрия и не ионного - Тритона Х-100 [Porzionato A, Stocco Е, Barbon S, Grandi F, Macchi V, De Caro R. Tissue-Engineered Grafts from Human Decellularized Extracellular Matrices: A Systematic Review and Future Perspectives. Int J Mol Sci. 2018 Dec 18; 19(12). pii: Е4117]. Отметим, что важной проблемой при использовании ПАВ является сложность их удаления.
Следует отметить, что некоторые виды тканей в силу специфических особенностей строения, например, повышенная плотность в случае хрящевой ткани, не удается эффективно децеллюляризировать обработкой ПАВ или их смесями. Для удаления клеток из такого рода тканей необходим комплексный подход, заключающийся в комбинации обработки ПАВ с другими физическими (ультразвук, температура, ионная сила), химическими (альтернативные децеллюляризирующие агенты) или биологическими (ферменты) воздействиями [Huang Z, Godkin О, Schulze-Tanzil G. The Challenge in Using Mesenchymal Stromal Cells for Recellularization of Decellularized Cartilage. Stem Cell Rev. 2017 Feb; 13(1):50-67].
В качестве аналога предлагаемого способа нами выбран известный способ изготовления децеллюляризированного матрикса [Utomo L., Pleumeekers М.М., Nimeskern L.,  Stok K.S., Hildner F., van Osch G.J. Preparation and characterization of a decellularized cartilage scaffold for ear cartilage reconstruction. Biomed. Mater. 2015; 10: 015010.]
Stok K.S., Hildner F., van Osch G.J. Preparation and characterization of a decellularized cartilage scaffold for ear cartilage reconstruction. Biomed. Mater. 2015; 10: 015010.]
Сущность способа-аналога заключается в следующем.
Для получения тканеспецифического децеллюляризованного матрикса хряща использовали ухо теленка или человека. Ушной хрящ человека испоьзовали целиком, а из уха теленка высекали фрагменты, представляющие собой диски диаметром 8 мм.
Децеллюляризацию проводили в четыре стадии:
1. Два цикла «замораживания-оттаивания» (1 цикл включает 24 часа инкубации при -20°С и 24 часа при 45°С) в гипотоническом TRIS буфере, рН=8.0.
2. Экспозиция в течение 24 часов в децеллюляризующем составе, включающем додецилсульфат натрия, этилендиаминтетрауксусную кислоту и апротинин.
3. Дополнительная обработка в течение 24 часа при 37°С раствором эластазы в TRIS буфере (рН=8,6) с добавлением апротинина.
4. Обработка в течение 3 часов при 37°С раствором нуклеаз (50 ед/мл ДНКазы и 2,5 ед/мл РНКазы) в TRIS буфере рН 7.5.
5. Деконтаминация в 0,1% растворе надуксусной килоты в фосфатном буфере.
6. Окончательная трехкратная отмывка в фосфатном буфере: 2 раза по 30 минут, а затем 24 часа при температуре 45°С.
Особенностью известного метода является дополнительная обработка раствором эластазы, примененном в низких концентрациях (0,03 ед/мл), в результате чего удается добиться достаточно полной децеллюляризации хрящевой ткани. В результате получают децеллюляризованный матрикс, состоящий из белков ВКМ, который при рецеллюляризации позволяет прикрепиться тканеспецифическим клеткам.
К недостаткам известного способа относятся:
 риск нарушения структуры матрикса за счет снижения количества эластина в ВКМ, связанного с обработкой эластазой;
риск нарушения структуры матрикса за счет снижения количества эластина в ВКМ, связанного с обработкой эластазой;
 длительная отмывка от детергентов при повышенной температуре (45°С, 24 часа) может привести к денатурации белков ВКМ;
длительная отмывка от детергентов при повышенной температуре (45°С, 24 часа) может привести к денатурации белков ВКМ;
 невозможность инъекционного введения, в связи с размерами фрагментов, превышающими диаметр игл, рекомендуемых при лечении поражений суставного хряща (510 мкм);
невозможность инъекционного введения, в связи с размерами фрагментов, превышающими диаметр игл, рекомендуемых при лечении поражений суставного хряща (510 мкм);
 стерилизация и хранение децеллюляризованного матрикса хряща в растворе надуксусной кислоты, что не является стандартизированным способом стерилизации и способно приводить к его деструкции и снижению биосовместимых свойств.
стерилизация и хранение децеллюляризованного матрикса хряща в растворе надуксусной кислоты, что не является стандартизированным способом стерилизации и способно приводить к его деструкции и снижению биосовместимых свойств.
В качестве прототипа нами выбран способ получения тканеспецифического децеллюляризованного матрикса хрящевой ткани [Chan LK, Leung VY, Tarn V, Lu WW, Sze KY, Cheung KM. Decellularized bovine intervertebral disc as a natural scaffold for xenogenic cell studies. Acta Biomater. 2013; 9(2): 5262-5272], сущность которого заключается в следующем.
Для получения тканеспецифического децеллюляризованного матрикса хряща использовали бычьи межпозвоночные диски. С помощью хирургического бура получают фрагменты, представляющие собой диски толщиной 2 мм. Далее фрагменты подвергают 6 циклам «замораживания-оттаивания» (1 цикл включает 1 час инкубации при 37°С и 1 час инкубации в жидком азоте при температуре -196°С). Путем экспозиции в специальном децеллюляризующем составе, включающем 0,1% додецилсульфат натрия и этилендиаминтетрауксусную кислоту, с последующей отмывкой от детергента в фосфатном буфере в течение суток, получают децеллюляризованный матрикс, состоящий из белков ВКМ, который при рецеллюляризации позволяет прикрепиться тканеспецифическим клеткам.
К недостаткам прототипа относятся:
 сохранение большого остаточного количества ядерного материала (21-24% от исходного);
сохранение большого остаточного количества ядерного материала (21-24% от исходного);
 низкая эффективность децеллюляризующих растворов и отмывки от детергентов вследствие большого диффузионного расстояния и короткого периода инкубации;
низкая эффективность децеллюляризующих растворов и отмывки от детергентов вследствие большого диффузионного расстояния и короткого периода инкубации;
 невозможность инъекционного введения, в связи с размерами фрагментов, превышающими диаметр игл, рекомендуемых при лечении поражений суставного хряща (510 мкм);
невозможность инъекционного введения, в связи с размерами фрагментов, превышающими диаметр игл, рекомендуемых при лечении поражений суставного хряща (510 мкм);
 отсутствие стандартизованного стерилизации децеллюляризованного матрикса хряща;
отсутствие стандартизованного стерилизации децеллюляризованного матрикса хряща;
 низкая площадь эффективной поверхности для адгезии и пролиферации клеток относительно объема вследствие крупного размера частиц и отсутствия пористости.
низкая площадь эффективной поверхности для адгезии и пролиферации клеток относительно объема вследствие крупного размера частиц и отсутствия пористости.
Техническая проблема заключается в разработке доступного и дешевого способа получения матрикса хряща, сохраняющего нативный состав и тканеспецифичность, который может быть использован для имплантации путем инъекционного введения, как отдельно, так и в составе КИК и ТИК.
Технический результат заключается в:
- повышении полноты удаления клеток за счет микронизации и предлагаемого оригинального комплексного воздействия физических (замораживание/оттаивание), химических (смесь ионных и не ионных ПАВ) и биологических (ДНКаза) факторов, примененных в оптимальной комбинации;
- облегчении рецеллюляризации матрикса клетками за счет увеличения площади для заселения при сохранении объема и упрощении наблюдения за ней за счет увеличения площади адгезированных поверхностей матрикса путем его предварительной микронизации;
- обеспечении сохранения тканеспецифичности за счет подбора эффективной комбинации воздействий и их режимов, обеспечивающих эффективную децеллюляризацию при сохранении архетектоники и состава матрикса близкими к естественным;
- исключении возможности токсического воздействия матрикса на организм за счет стандартизации и длительности экономичной технологии отмывки от ПАВ с использованием бидистиллированной воды;
- обеспечении тканеспецифическим матриксом отдельно и в сочетании с гелеобразным матриксом формирования ТИК хряща при культивировании в дифференцировочной культуральной среде как с тканеспецифическими клетками (хондроцитами), так и с МСК;
- применении стандартизованного режима стерилизации тканеспецифического матрикса хряща за счет использования радиации в дозе 1,5 Мрад, не влияющей на цитотоксичность и уничтожающей все виды микроорганизмов как в вегетативной, так и в споровой форме;
- обеспечении возможности инъекционного введения, в том числе в полость сустава;
- исключении недостатков прототипа, касающихся сохранения большого остаточного количества ядерного материала, низкой эффективности децеллюляризующих растворов и отмывки от детергентов вследствие большого диффузионного расстояния и короткого периода инкубации.
Сущность изобретения заключается в следующем.
Для получения тканеспецифического матрикса для тканевой инженерии хряща проводят измельчение хряща свиньи, его децеллюляризацию. При этом сначала суставной хрящ свиньи нарезают фрагментами размером не более 0,5 см, а затем измельчают полученные фрагменты и выделяют частицы размером от 100 мкм до 250 мкм. После чего выполняют децеллюляризацию полученных частиц, для этого проводят
сначала не менее 3 циклов, каждый из которых включает охлаждение при температуре -196°С в течение одного часа с последующим оттаиванием при 35°-40°С в течение одного часа;
затем последовательную инкубацию в растворах поверхностно-активных веществ (ПАВ) с повышающейся концентрацией при перемешивании со скоростью 10-500 оборотов в минуту, используя в качестве растворов ПАВ:
а) 20-500 мл раствора фосфатного буфера, полученного из состава 138 мМ NaCl, 2.67 мМ KCl, 1.47 мМ KH2 PO4, 8.1 мМ Na2 HPO4, дистиллированная вода до 1 л с рН 7,4 (ФБС), содержащего 1% Тритон X 100 и 0,1% натриевой соли додецилсульфата натрия (ДДС);
б) 20-500 мл раствора ФБС, содержащего 2% Тритон X 100 и 0,1% ДДС;
в) 20-500 мл раствора ФБС, содержащего 3% Тритон X 100 и 0,1% ДДС;
после чего инкубацию в течение 12-48 часов при температуре 37°С в 1-10 мл раствора, содержащего 30-50 Е/мл ДНКазы I типа в буферном растворе, полученном из состава 10 мМ Трис-HCl, 2,5 мМ MgCl2, 0.5 мМоль CaCl2, дистиллированная вода до 1 л с рН 7.6.
Далее производят отмывку частиц хряща путем последовательного выполнения следующих этапов:
ополаскивание 100-500 мл бидистиллированной воды,
экспозиция в течение суток в 20-500 мл бидистиллированной воды при комнатной температуре и периодическом перемешивании со скоростью 10-500 об/мин в течение одного часа трижды на протяжении суток,
экспозиция, по меньшей мере, 48 часов при комнатной температуре в бидистиллированной воде, содержащей ампицилин из расчета 10-20 мкг/мл и амфотерицин из расчета 1,5-2,0 мкг/мл,
ополаскивание в 20-500 мл бидистиллированной воды.
После чего отмытые частицы децеллюляризированного хряща высушивают и стерилизуют γ-облучением в дозе 1,5 Мрад с получением образцов искомого матрикса.
До стерилизации частицы хряща могут быть сохранены при температуре -30°С до - 80°С.
Стерильные образцы матрикса хряща хранят при температуре 4-8°С.
Способ осуществляется следующим образом.
1. Суставной хрящ свиньи выделяют механически, нарезают фрагментами размером не крупнее 0,5 см, замораживают при - 80°С и хранят при этой температуре до момента начала помола.
2. Получают мелкодисперсные частицы хряща свиньи (МДЧХс) измельчением фрагментов хряща с применением криомельницы (25 Гц в течение 2 минут при температуре -196°С), позволяющей производить помол в условиях непрерывного охлаждения жидким азотом.
3. Фракции частиц требуемого размера в диапазоне 100-250 мкм выделяют просеиванием помола через набор сит с соответствующим размером пор.
4. Децеллюляризацию навески (1-1,5 г) МДЧХс осуществляют в три стадии:
а. охлаждением МДЧХс в сосуде Дьюара при -196°С в течение одного часа с последующим оттаиванием при 35°С-40°С в течение одного часа (цикл замораживание/оттаивание должен быть повторен не менее трех раз).
б. обработкой МДЧХ в трех сменах фосфатного буфера (138 мМ NaCl, 2.67 мМ KCl, 1.47 мМ KH2 PO4, 8.1 мМ Na2 HPO4, рН 7,4 (ФБС), рН=7.4), объемом 20-500 мл, содержащего 0,1% додецилсульфат натрия и повышающуюся концентрацию Тритона X100 (1, 2 и 3%, соответственно) при комнатной температуре и периодическом перемешивании на магнитной мешалке (3 раза в сутки, 1 час, 10-500 об/мин);
в. после ополаскивания 400 мл бидистиллированной воды МДЧХс инкубировали в течение 12-48 часов при температуре 37°С в 1-10 мл буферного раствора (10 мМ Трис-HCl, 2,5 мМ MgCl2, 0.5 мМоль CaCl2; рН=7.6), содержащего 30-50 Е/мл ДНКазы I типа (Qiagen, Германия).
5. Отмывку навески (1-1,5 г) МДЧХс от детергентов производят в четыре этапа:
а. ополаскиванием 100-500 мл бидистиллированной воды;
б. отмывкой в 20-500 мл бидистиллированной воды при комнатной температуре и периодическом перемешивании на магнитной мешалке в течение суток (3 раза, 1 час, 10-500 об/мин) в течение 24 часов.
в. окончательной отмывкой при комнатной температуре в бидистиллированной воде (не менее 48 часов), содержащей антибиотик (ампицилин, 10-20 мкг/мл) и антимикотик (амфотерицин, 1,5-2,0 мкг/мл).
г. Децеллюляризированный МДЧХс ополаскивали в 20-500 мл бидистиллированной воды (для удаления антибиотика и антимикотика), удаляли лишнюю влагу с использованием бумажных фильтров и нейлоновых мембран с размером пор 10 мкм.
6. Децеллюляризированный МДЧХс переносили в криопробирки объемом 2 мл и хранили до момента стерилизации при температуре -30°С - -80°С.
7. Проводили стерилизацию образцов гамма-облучением в дозе 1,5 Мрад.
8. Стерильный децеллюляризованный матрикс хранили при температуре 4-8°С.
Для доказательства возможности достижения заявленного назначения - пригодности децеллюляризованного тканеспецифического для посадки на него клеток и создания ТИК хряща, как при использовании как отдельно, так и в комбинации с гелеобразными матриксами, и достижения указанного технического результата приводим следующие данные.
Пример 1.
Получение децеллюляризованного матрикса из хряща свиньи по предложенному способу:
1. Суставной хрящ свиньи выделяют механически, нарезают фрагментами размером не крупнее 0,5 см, замораживают при - 80°С и хранят при этой температуре до момента начала помола.
2. Получают мелкодисперсные частицы хряща свиньи (МДЧХс) измельчением фрагментов хряща с применением криомельницы (25 Гц в течение 2 минут при температуре -196°С), позволяющей производить помол в условиях непрерывного охлаждения жидким азотом.
3. Фракции частиц требуемого размера в диапазоне 100-250 мкм выделяют просеиванием помола через набор сит с соответствующим размером пор.
4. Децеллюляризацию навески (1-1,5 г) МДЧХс осуществляют в три стадии:
а. охлаждением МДЧХс в сосуде Дьюара при -196°С в течение одного часа с последующим оттаиванием при 40°С в течение одного часа. Цикл замораживание/оттаивание должен быть повторен не менее трех раз.
б. обработкой МДЧХ в трех сменах ФБС, рН=7.4, объемом 500 мл, содержащего 0,1% додецилсульфат натрия и повышающуюся концентрацию Тритона X100 (1, 2 и 3%, соответственно) при комнатной температуре и периодическом перемешивании на магнитной мешалке (3 раза в сутки, 1 час, 500 об/мин);
в. после ополаскивания 400 мл бидистиллированной воды МДЧХс инкубировали в течение 48 часов при температуре 37°С в 1 мл буферного раствора (10 мМ Трис-HCl, 2,5 мМ MgCl2, 0.5 мМоль CaCl2; рН=7.6), содержащего 50 Е/мл ДНКазы I типа (Qiagen, Германия).
5. Отмывку навески (1-1,5 г) МДЧХс от детергентов производят в четыре этапа:
а. ополаскиванием 500 мл бидистиллированной воды;
б. отмывкой в 500 мл бидистиллированной воды при комнатной температуре и периодическом перемешивании на магнитной мешалке в течение суток (3 раза, 1 час, 500 об/мин) в течение 24 часов.
в. окончательной отмывкой при комнатной температуре в бидистиллированной воде (не менее 48 часов), содержащей антибиотик (ампицилин, 10 мкг/мл) и антимикотик (амфотерицин, 1,5 мкг/мл).
г. Децеллюляризированный МДЧХс ополаскивали в 500 мл бидистиллированной воды (для удаления антибиотика и антимикотика), удаляли лишнюю влагу с использованием бумажных фильтров и нейлоновых мембран с размером пор 10 мкм.
б. Децеллюляризированный МДЧХс переносили в криопробирки объемом 2 мл и хранили до момента стерилизации при температуре -80°С.
7. Проводили стерилизацию образцов гамма-облучением в дозе 1,5 Мрад.
8. Стерильный децеллюляризованный матрикс хранили при температуре 4°С.
Удаление клеток из микрочастиц хряща свиньи подтверждали с использованием гистологического окрашивания гематоксилином и эозином.
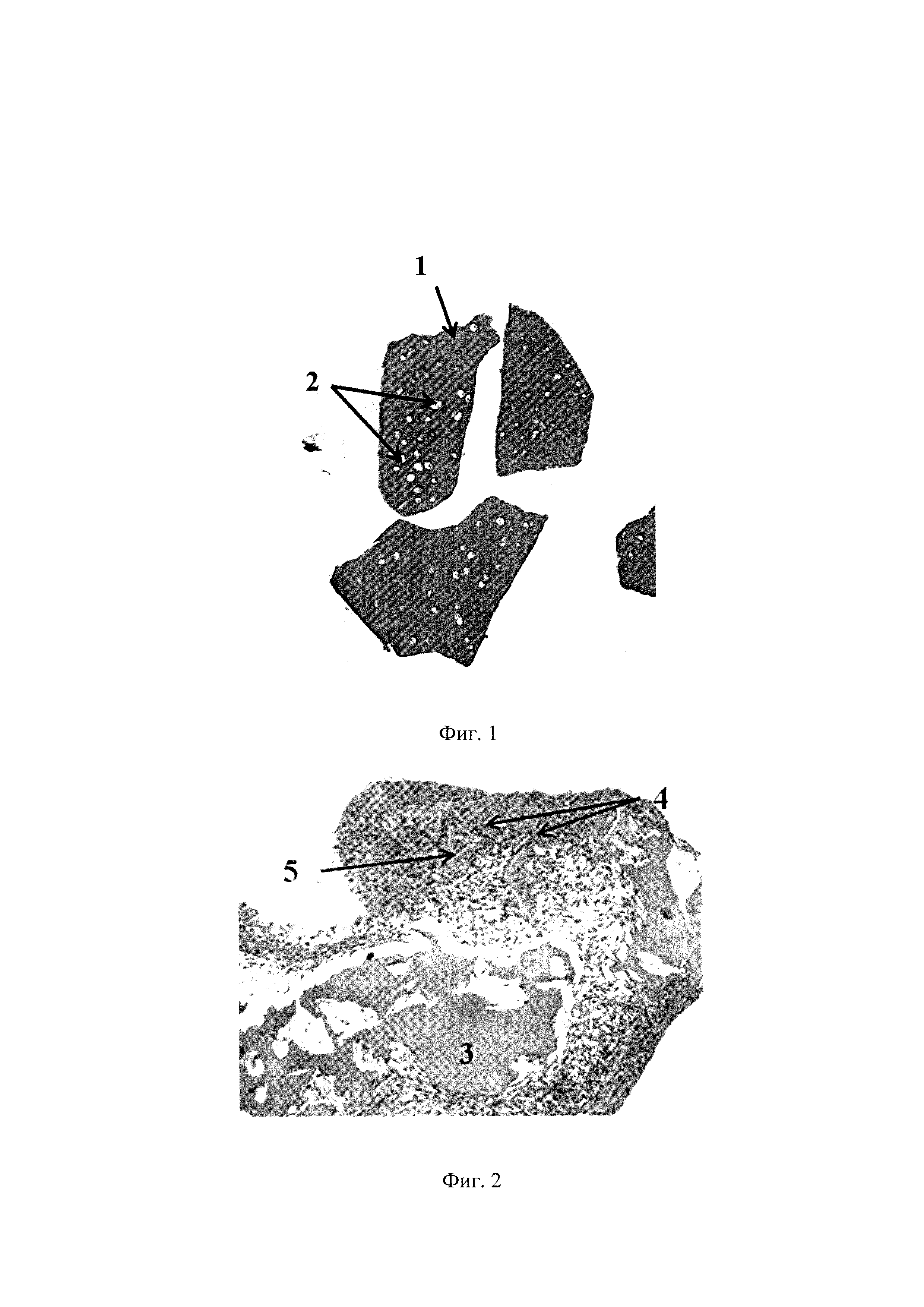
На фиг. 1 представлена гистологическая картина тканеспецифического децеллюляризованного матрикса хряща, полученного с помощью предлагаемого способа. Ув. X100. Окрашивание гематоксилином и эозином. 1 - сохраненный внеклеточный матрикс; 2 - пустые лакуны без клеток.
Как видно на фиг. 1, сохранившиеся клетки в образце не обнаруживаются, визуализируются лишь пустые лакуны.
Полученные результаты свидетельствуют об отсутствии целых клеток, неотъемлемым компонентом которых является ДНК, в децеллюляризованном матриксе.
Пример 2.
Получение децеллюляризованного матрикса из хряща свиньи по предложенному способу:
1. Суставной хрящ свиньи выделяют механически, нарезают фрагментами размером не крупнее 0,5 см, замораживают при - 80°С и хранят при этой температуре до момента начала помола.
2. Получают МДЧХс измельчением фрагментов хряща с применением криомельницы (25 Гц в течение 2 минут при температуре -196°С), позволяющей производить помол в условиях непрерывного охлаждения жидким азотом.
3. Фракции частиц требуемого размера в диапазоне 100-250 мкм выделяют просеиванием помола через набор сит с соответствующим размером пор.
4. Децеллюляризацию навески (1-1,5 г) МДЧХс осуществляют в три стадии:
а. охлаждением МДЧХс в сосуде Дьюара при -196°С в течение одного часа с последующим оттаиванием при 35°С в течение одного часа. Цикл замораживание/оттаивание должен быть повторен не менее трех раз.
б. обработкой МДЧХ в трех сменах фосфатного буфера (138 мМ NaCl, 2.67 мМ KCl, 1.47 мМ KH2 PO4, 8.1 мМ Na2 HPO4, рН 7,4 (ФБС), рН=7.4), объемом 20 мл, содержащего 0,1% додецилсульфат натрия и повышающуюся концентрацию Тритона Х100 (1, 2 и 3%, соответственно) при комнатной температуре и периодическом перемешивании на магнитной мешалке (3 раза в сутки, 1 час, 10 об/мин);
в. после ополаскивания 400 мл бидистиллированной воды МДЧХс инкубировали в течение 12 часов при температуре 37°С в 10 мл буферного раствора (10 мМ Трис-HCl, 2,5 мМ MgCl2, 0.5 мМоль CaCl2; рН=7.6), содержащего 30 Е/мл ДНКазы I типа (Qiagen, Германия).
5. Отмывку навески (1-1,5 г) МДЧХс от детергентов производят в четыре этапа:
а. ополаскиванием 100 мл бидистиллированной воды;
6. отмывкой в 20 мл бидистиллированной воды при комнатной температуре и периодическом перемешивании на магнитной мешалке в течение суток (3 раза, 1 час, 10 об/мин) в течение 24 часов.
в. окончательной отмывкой при комнатной температуре в бидистиллированной воде (не менее 48 часов), содержащей антибиотик (ампицилин, 20 мкг/мл) и антимикотик (амфотерицин, 2,0 мкг/мл).
г. Децеллюляризированный МДЧХс ополаскивали в 20 мл бидистиллированной воды (для удаления антибиотика и антимикотика), удаляли лишнюю влагу с использованием бумажных фильтров и нейлоновых мембран с размером пор 10 мкм
б. Децеллюляризированный МДЧХс переносили в криопробирки объемом 2 мл и хранили до момента стерилизации при температуре -30°С.
7. Проводили стерилизацию образцов гамма-облучением в дозе 1,5 Мрад.
8. Стерильный децеллюляризованный матрикс хранили при температуре 8°С.
Для доказательства возможности инъекционного введения тканеспецифического децеллюляризованного матрикса хряща полученного по предложенному способу (см. примеры 1 и 2), оценивали распределение частиц по размеру с помощью лазерного дифракционного анализатора SALD-7101 (Shimadzu, Япония). В качестве жидкой дисперсионной среды использовали глицерин.
Диапазон размеров частиц тканеспецифического децеллюляризованного матрикса хряща в суспензии составил 96-220 мкм, при этом преобладали частицы с размером 161±11 мкм, что указывает на возможность наименее инвазивного инъекционного введения матрикса.
Пример 3.
Для доказательства высокой степени удаления клеток из матрикса, полученного по предложенному способу (см. пример 1), степень децеллюляризации МДЧХс оценивали с использованием модифицированного метода [Larynx decellularization: combining freeze-drying and sonication as an effective method / S.H. Hung, C.H. Su, F.P. Lee, H. Tseng // J. Voice. - 2013. - V. 27. - P. 289-294]. Для количественного определения децеллюляризированных и недецеллюляризированных частиц в образцах, прошедших децеллюляризацию в разных режимах, проводили окрашивание в 24-луночном планшете раствором ДНК-связывающего флуоресцентного красителя DAPI в концентрации 1 мкг/мл (6 мг хряща на 1 лунку).
В каждом образце, с использованием флуоресцентного микроскопа Nikon Ti, определяли количество частиц:
 не децеллюляризированных, богатых клетками;
не децеллюляризированных, богатых клетками;
 не децеллюляризированных, содержащих отдельные клетки;
не децеллюляризированных, содержащих отдельные клетки;
 децеллюляризованные.
децеллюляризованные.
На дне лунки произвольным образом выбирали 15 полей зрения при увеличении Х40. В каждом поле определяли количество частиц каждого типа. Результаты по всем полям суммировали, и количество частиц каждого типа в образце рассчитывали в процентах от общего количества частиц. В качестве положительных контролей использовали частицы нативного хряща после криопомола; частицы хряща после криопомола, прошедшие децеллюляризацию с использованием ПАВ аналогично с опытным образцом; частицы хряща после криопомола, прошедшие децеллюляризацию, включающую комбинацию 3 циклов «замораживания/оттаивания» и обработки ПАВ аналогично с опытным образцом.
Также определяли количество ДНК в тканеспецифическом децеллюляризованном матриксе хряща с применением флуоресцентных красителя PicoGreen. Для выделения ДНК использовали набор DNeasy Blood & Tissue Kit (QIAGEN, Германия) согласно инструкции.
В таблице 1 представлено влияние режима децеллюляризации на количество ДНК в частицах децеллюляризованного хряща.


Как видно из таблицы, предложенный способ децеллюляризации суставного хряща свиньи обеспечивает полное отсутствие частиц с ДНК в образцах.
Анализ содержания ДНК показал снижение количества ядерного материала в тканеспецифическом децеллюляризованном матриксе хряща до 9,11±1,13 нг/ мг ткани (2,5% от количества ДНК в исходной ткани). Полученные результаты свидетельствовали об эффективности проведенной децеллюляризации, после которой матрикс был в значительной очищен от ядерного материала (по принятым критериям количественное содержание ДНК должно составлять менее 50 нг/мг в сухой ткани [Crapo P.М., Gilbert Т.W., Badylak S.F. An overview of tissue and whole organ decellularization processes // Biomaterials. - 2011. - Vol. 32. - №.12. - P. 3233-3243.]).
Снижение ДНК подтверждает высокую степень децеллюляризации матрикса, полученного предложенным способом, в отличие от контрольных образцов.
Пример 4.
Для доказательства обеспечения тканеспецифическим матриксом, полученным по предложенному способу (см. пример 1), формирования ТИК хряща, приводим результаты изучения адгезии, пролиферации и дифференцировки различных типов клеток на этом матриксе.
На матрикс осуществляли посадку тканеспецифичных клеток хряща - хондробластов человека, и мезенхимальных стромальных клеток жировой ткани человека (МСК ЖТч), способных дифференцироваться в клетки хрящевой ткани. Клеточная культура МСК ЖТч была получена из фрагмента подкожной жировой клетчатки от здорового донора по стандартной методике [Surguchenko V.A., Ponomareva A.S., Kirsanova L.A., Skaleckij N.N., Sevastianov V.I. The cell-engineered construct of cartilage on the basis of biopolymer hydrogel matrix and human adipose tissue-derived mesenchymal stromal cells (in vitro study) // J. Biomed. Mat. Soc. Part A 2015; 103(2): 463-470]. Были использованы хондробласты из фрагментов хряща реберных дуг человека, полученные в процессе хирургических вмешательств при информационном согласии пациента. Материал отмывали в растворе Хенкса с добавлением культурального антибиотика-антимикотика. Ткань измельчали ножницами до получения однородной массы, состоящей из фрагментов объемом ~1 мм3, после чего инкубировали в 0.1% растворе коллагеназы I типа при 37°С в течение 12 ч. В эксперименте были использованы клетки 3 пассажа.
В каждую лунку конической формы 96-луночного культурального планшета помещали 200 мкл суспензии с рабочей концентрацией 1×106 клеток в 1 мл хондрогенной дифференцировочной среды (культуральная среда DMEM HG с добавкой GlutaMAX™, содержащая 10% ITS+, 1% пируват натрия, 0.25% аскорбат-2-фосфата, 0.0001% дексаметазона, 0.002% TGF-β1 и 1% культурального антибиотика-антимикотика) и 20 мг децеллюляризованного матрикса хряща. После чего планшет центрифугировали при 500 g в течение 5 минут. Далее планшет помещали в СО2-инкубатор при стандартных условиях (5% CO2, 37°С). Замену культуральной среды в лунках производили ежедневно. Изучение результатов прикрепления, пролиферации и дифференцировки клеток проводили на 14 сутки культивирования. В качестве контрольного использовали биополимерный микрогетерогенный коллагенсодержащий матрикс (БМКГ) (АО «Биомир сервис», г. Краснознаменск) марки «лонг».
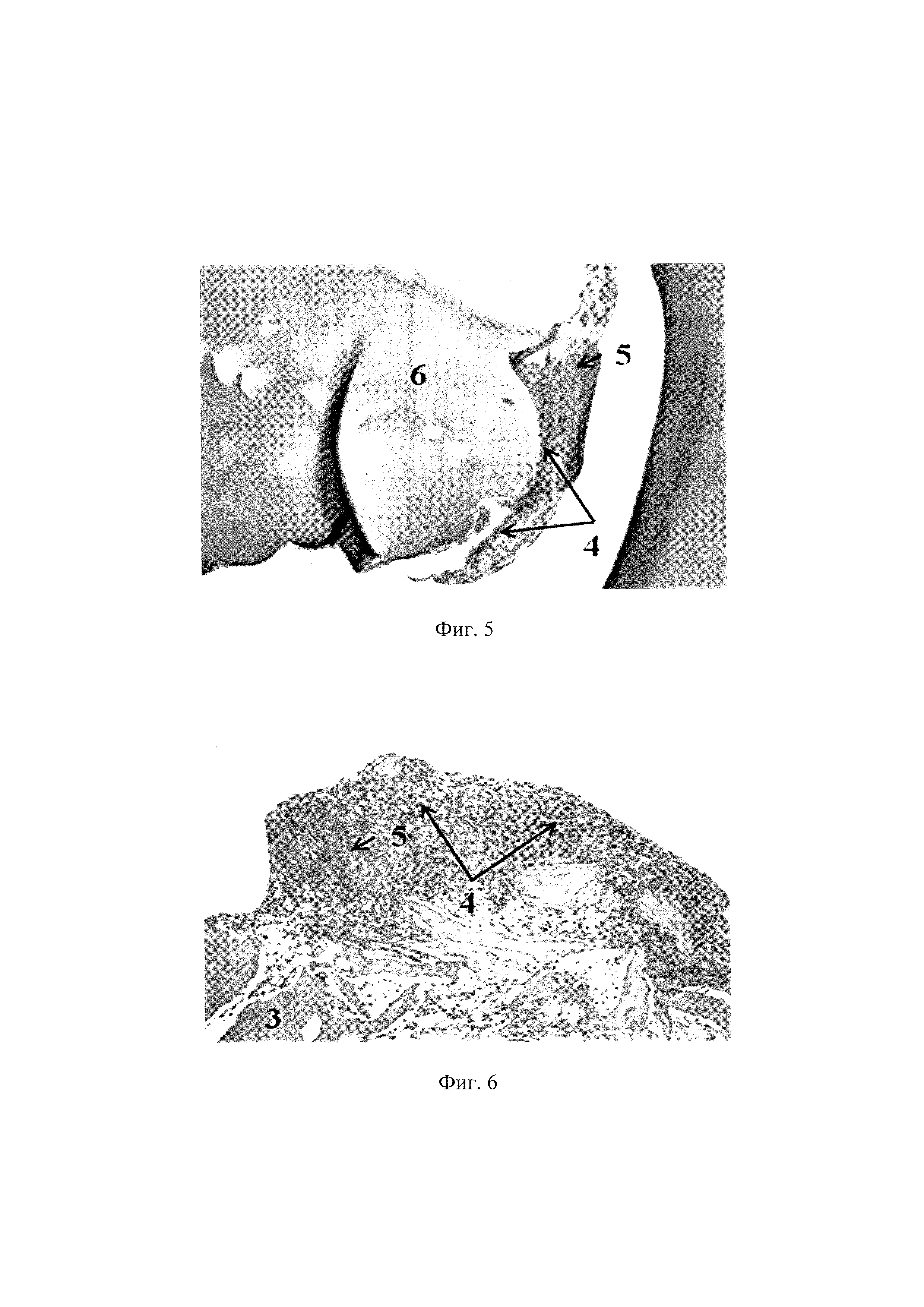
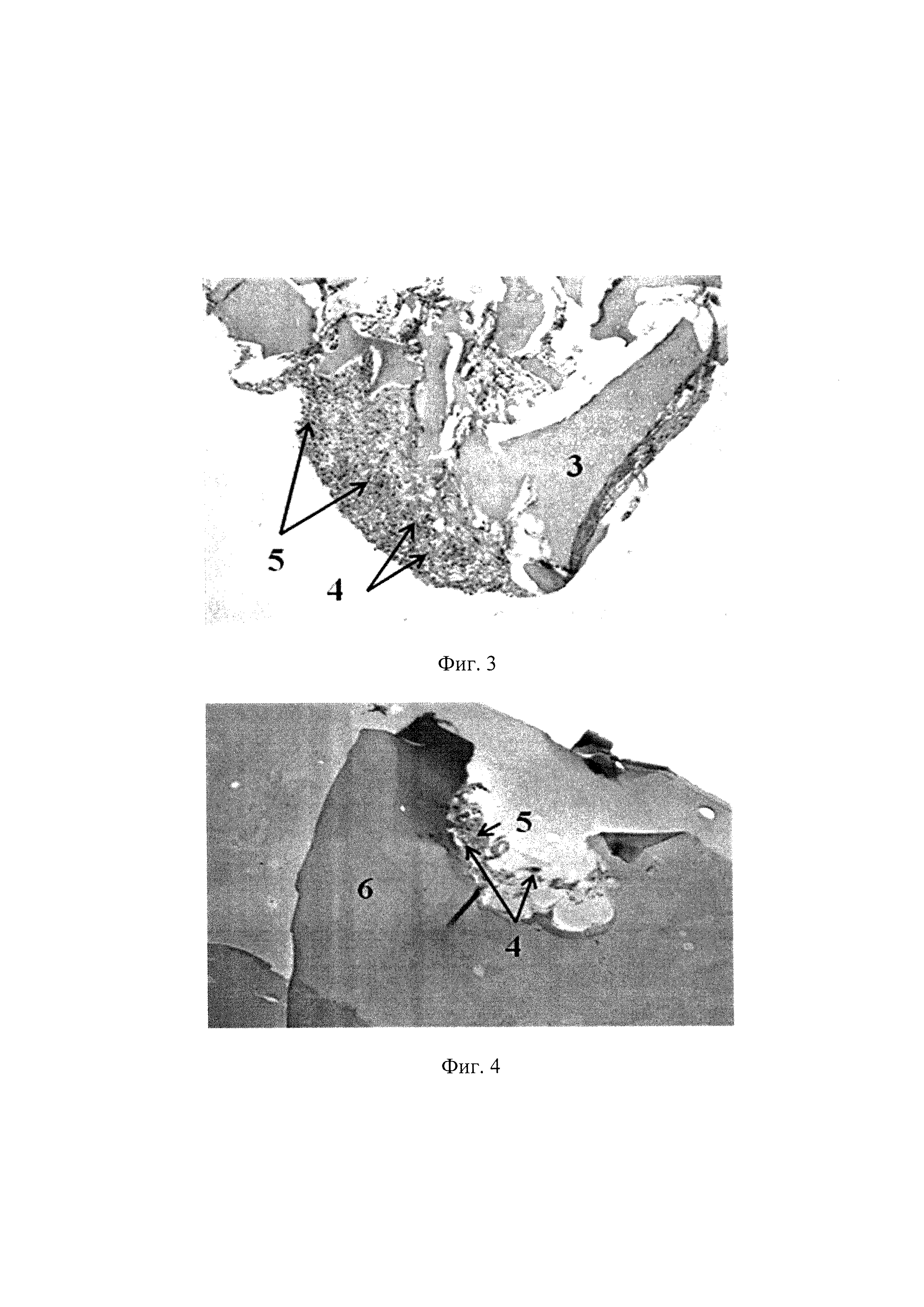
На фиг. 2 представлена ТИК, включающая хондробласты и децеллюляризованный матрикс суставного хряща свиньи. Ув. X100. Окрашивание альциановым синим на гликозаминогликаны, где 3 - тканеспецифический децеллюляризованный матрикс, 4 - клетки, 5 - наработанный клетками ВКМ.
На фиг. 3 представлена ТИК, включающая МСК ЖТч и децеллюляризованный матрикс суставного хряща свиньи. Ув. X100, окрашивание альциановым синим на гликозаминогликаны, где 3 - тканеспецифический децеллюляризованный матрикс, 4 - клетки, 5 - наработанный клетками ВКМ.
На фиг. 4 представлена ТИК, включающая хондробласты и БМКГ марки «лонг» (контрольный матрикс). Ув. X100. Окрашивание альциановым синим на гликозаминогликаны, где 6 - БМКГ, 4 - клетки, 5 - наработанный клетками ВКМ.
На фиг. 5 представлена ТИК, включающая МСК ЖТч и БМКГ марки «лонг» (контрольный матрикс). Ув. Х200.. Окрашивание альциановым синим на гликозаминогликаны (6 - БМКГ, 4 - клетки, 5 - наработанный клетками ВКМ).
Проведенный анализ позволил установить, что все типы клеток активно адгезируют и пролиферируют на поверхности частиц матриксов. При этом, положительное окрашивание всех образцов альциановым синим на гликозаминогликаны свидетельствовало о наработке клетками, вступившими в дифференцировку в хондрогенном направлении, специфичного для хрящевой ткани ВКМ. Однако клеточная масса на поверхности децеллюляризованного матрикса была значимо больше, чем на нетканеспецифическом контрольном.
Таким образом, выраженные адгезивные и пролиферативные свойства децеллюляризованного матрикса по отношению к тканеспецефическим клеткам и клеткам, обладающим способностью к дифференцировке в хондрогенном направлении, доказывают сохранность тканеспецифических свойств децеллюляризованного матрикса и наибольшую пригодность для использования в качестве матрикса для создания ТИК хрящевой ткани.
Пример 5.
Исследование децеллюляризованного матрикса свиньи на цитотоксичность проводили в соответствии с ГОСТ Р ИСО 10993-1-2011) [Межгосударственный стандарт ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4. Исследование изделий контактирующих с кровью»; ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro»].
В эксперименте использовали децеллюляризованный матрикс хряща свиньи, полученный по предложенному способу (см. пример 1), клетки МСК ЖТч, полученные по стандартной методике [Surguchenko V.A., Ponomareva A.S., Kirsanova L.A., Skaleckij N.N., Sevastianov V.I. The cell-engineered construct of cartilage on the basis of biopolymer hydrogel matrix and human adipose tissue-derived mesenchymal stromal cells (in vitro study) // J. Biomed. Mat. Soc. Part A 2015; 103(2): 463-470] и полную ростовую культуральную среду (культуральная среда DMEM/F12 добавкой GlutaMAX™; сыворотка эмбриональная телячья, стерильная, тестированная на цитотоксичность и отсутствие микоплазмы - 10%; комплексная антимикробная добавка Gibco® Antibiotic-Antimycotic- 1%; HEPES1 мМ; фактор роста фибробластов (FGF-basic) 1 мкг/л). В эксперименте использовали клетки III-го пассажа.
Все манипуляции проводили в асептических условиях. МСК ЖТч высевали в культуральные плоскодонные 24-луночные планшеты и инкубировали при температуре 37°С в стандартных условиях: влажной атмосфере, содержащей (5±1) % CO2, до образования монослоя со степенью конфлюэнтности 80-85%. На поверхность образовавшегося монослоя клеток помещали исследуемые образцы матриксов.
В эксперименте исследовали как цитотоксичность непосредственно МДЧХс методом прямого контакта, так и вытяжек из матрикса. Для приготовления вытяжек 1 пелету образца массой 0,03 г помещали на 24 часа в 0,5 мл культуральной среды в стандартных условиях. После чего указанный объем вытяжки добавляли к полной ростовой среде в лунке планшета с монослоем клеток.
Первичный учет результатов в варианте с клетками МСК ЖТч, согласно нормативам проводили через 24 часа. Для выявления возможного пролонгированного цитотоксического эффекта наблюдение за ростом клеток вели вплоть до 3 суток.
Отрицательным контролем служила культуральная среда для клеток МСК ЖТч, содержащая сыворотку, положительным - стандартный раствор цинка в азотной кислоте Zn 1-2 wt. % HNO3, разведение 1:200 раствором 0,9% NaCl для инъекций).
Оценка цитотоксического эффекта образцов мелкодисперсного матрикса из децеллюляризированного хряща свиньи, как методом вытяжек, так и методом прямого контакта, показали отсутствие цитотоксичности. Данные фазово-контрастной микроскопии подтверждаются кривыми роста МСК ЖТч.
Исключение возможности токсического воздействия матрикса на организм за счет стандартизации технологии отмывки от ПАВ подтверждается исследованиями цитотоксичности.
Пример 6.
Для доказательства обеспечения тканеспецифическим матриксом, полученным по предложенному способу (см. пример 1), совместно с гелеобразным матриксом формирования ТИК хряща, приводим результаты изучения адгезии, пролиферации и дифференцировки хондробластов человека и МСК ЖТч.
Клеточная культура МСК ЖТч была получена из фрагмента подкожной жировой клетчатки от здорового донора по стандартной методике [Surguchenko V.A., Ponomareva A.S., Kirsanova L.A., Skaleckij N.N., Sevastianov V.I. The cell-engineered construct of cartilage on the basis of biopolymer hydrogel matrix and human adipose tissue-derived mesenchymal stromal cells (in vitro study) // J. Biomed. Mat. Soc. Part A 2015; 103(2): 463-470 ]. Были использованы хондробласты из фрагментов хряща реберных дуг человека, полученные в процессе хирургических вмешательств при информационном согласии пациента. Материал отмывали в растворе Хенкса с добавлением культурального антибиотика-антимикотика. Ткань измельчали ножницами до получения однородной массы, состоящей из фрагментов объемом ⋅~1 мм3, после чего инкубировали в 0.1% растворе коллагеназы I типа при 37°С в течение 12 ч. В эксперименте были использованы клетки 3 пассажа.
В каждую лунку конической формы 96-луночного культурального планшета помещали 200 мкл суспензии с рабочей концентрацией 1×106 клеток в 1 мл хондрогенной дифференцировочной среды (культуральная среда DMEM HG с добавкой GlutaMAX™, содержащая 10% ITS+, 1% пируват натрия, 0.25% аскорбат-2-фосфата, 0.0001% дексаметазона, 0.002% TGF-β1 и 1% культурального антибиотика-антимикотика) и 20 мг децеллюляризованного матрикса хряща, смешанного с 60 мг БМКГ марки «лайт» (АО «Биомир сервис», г. Краснознаменск). После чего планшет центрифугировали при 500 g в течение 5 минут. Далее планшет помещали в CO2-инкубатор при стандартных условиях (5% CO2, 37°С). Замену культуральной среды в лунках производили ежедневно. Изучение результатов прикрепления, пролиферации и дифференцировки клеток проводили на 14 сутки культивирования.
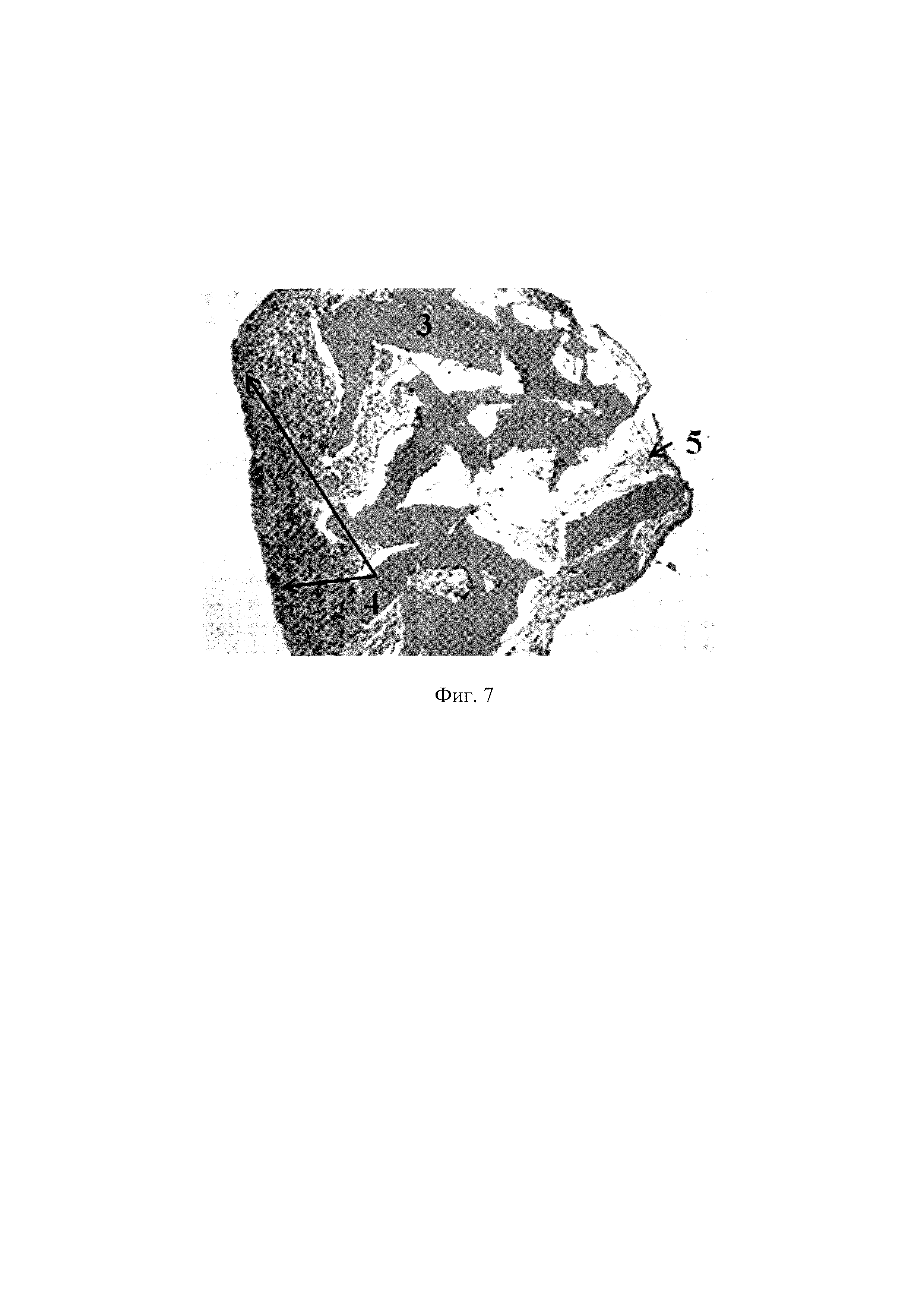
На фиг. 6 представлена ТИК, включающая хондробласты и децеллюляризованный матрикс суставного хряща свиньи, смешанный с БМКГ марки «лайт». Ув. X100. Окрашивание альциановым синим на гликозаминогликаны, где 3 - тканеспецифический децеллюляризованный матрикс, 4 - клетки, 5 - наработанный клетками ВКМ.
На фиг. 7 представлена ТИК, включающая МСК ЖТч и децеллюляризованный матрикс суставного хряща свиньи, смешанный с БМКГ марки «лайт». Ув. X100. Окрашивание альциановым синим на гликозаминогликаны, где 3 - тканеспецифический децеллюляризованный матрикс, 4 - клетки, 5 - наработанный клетками ВКМ.
Через 14 дней культивирования в хондрогенной среде наблюдали активную пролиферацию хондробластов и МСК ЖТ, при этом визуализировалась резорбция тканеспецифического децеллюляризованного матрикса хряща. Отметим, что увеличение количества клеток сопровождалось наработкой клетками специфического для ткани ВКМ, содержащего в своем составе гликозаминогликаны.
Проведенные исследование подтверждает пригодность тканеспецифического децеллюляризованного матрикса при использовании в комбинации с гелеобразным матриксом для формирования ТИК хрящевой ткани человека.
Аналогичные результаты получены при проведении экспериментов в соответствии с примерами 3-6 с использованием матрикса хряща, полученного в соответствии с примером 2.
Пример 7.
Для доказательства биосовместимости децеллюляризированных мелкодисперсных частиц хряща свиньи был привлечен метод определения величины гемолиза.
В эксперименте использовали кровь кролика, смешанную в соотношении 9:1 с 3,8%-ым раствором цитрата натрия в качестве антикоагулянта.
Образцы МДЧХс переносили в бюксы и добавляли 0,9% раствор натрия хлорида в соотношение масса образца (г) : эстрагирующая жидкость (мл) = 1:30.
Для приготовления контрольной пробы в пробирку наливали 3 мл 0,9% раствор натрия хлорида. Для приготовления пробы со 100%-ным гемолизом в пробирку наливали 3 мл дистиллированной воды.
Все пробирки с растворами инкубировали при температуре 37°С в течение 120 мин. Затем в каждую пробирку добавляли цитратную кровь кролика из расчета 200 мкл на 10 мл экстракта, перемешивали и вновь инкубировали в термостате при температуре 37°С в течение 1 часа. После инкубации пробирки помещали в центрифугу для осаждения крови при ускорении 2000 об/мин в течение 20 мин. На биохимическом анализаторе «Стат факс 1904+» измеряли оптическую плотность супернатанта при длине волны 545 нм. Количественным критерием метода служила относительная величина гемолиза (αr) в %, определяемая по формуле:
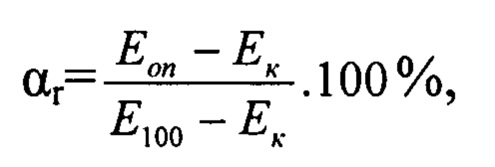
где: Еоп - оптическая плотность опытной пробы;
Ек - оптическая плотность контрольной пробы;
Е100 - оптическая плотность пробы со 100%-ным гемолизом.
Образец признается гемосовместимым по тесту на гемолиз, если αг ≤ 2%.
Результаты тестирования биосовместимых свойств МДЧХс, децеллюляризованных согласно предлагаемому методу, показали, что гемолиз, индуцированный контактом с чужеродной поверхностью, практически отсутствует (αг ≤ 0,1%), следовательно, децеллюляризованные МДЧХс соответствуют требованиям ГОСТ Р ИСО 10993-1-2011, предъявляемым к биосовместимым материалам.