Результат интеллектуальной деятельности: Способ изготовления средства для клеточно-опосредованной генной терапии и средство для клеточно-опосредованной генной терапии
Вид РИД
Изобретение
Изобретение относится к медицине, а именно, к методам клеточно-опосредованной генной терапии с помощью генетически модифицированного лейкоконцентрата (ГМЛ), полученного из цельной крови пациента и аденовирусных векторов, несущих один, или комбинацию клонированных (терапевтических) генов человека, и которое может быть использовано для персонифицированной терапии (аутотрансплантация) с целью временной продукции рекомбинантных биологически активных белковых молекул, специфически воздействующих на определенный патологический процесс.
Направление в клеточной терапии, основанное на генетической модификации стволовых клеток перед трансплантацией, применяется в практической медицине для терапии первичных иммунодефицитных состояний путем коррекции врожденной генетической мутации [Aiuti А., Roncarolo M.G., Naldini L. Gene therapy for ADA-SCID, the first marketing approval of an ex vivo gene therapy in Europe: paving the road for the next generation of advanced therapy medicinal products. // EMBO Mol. Med. 2017. Vol. 9. №6. P. 737-740.]. Метод предполагает генетическую модификацию аутологичных гемопоэтических стволовых клеток, т.е. коррекцию функции мутированного гена с помощью трансдукции клеток пациента вирусным вектором, несущим соответствующий нормальный рекомбинантный (терапевтический) ген человека.
В клинических испытаниях аналогичный способ был использован для лечения Х-сцепленной адренолейкодистрофии. Способ основан на аутотрансплантации генетически модифицированных гемопоэтических стволовых клеток, в которых была проведена генетическая коррекция мутированного гена ABCD1 с помощью лентивирусного вектора [Carder N. и др. Hematopoietic Stem Cell Gene Therapy with a Lentiviral Vector in X-Linked Adrenoleukodystrophy // Science (80-.). 2009. Vol. 326. №5954. P. 818-823].
Приведенные выше способы нацелены на нормализацию функции мутированного гена для восстановления функциональной активности зрелых лейкоцитов и не предполагают их использование как носителей терапевтических генов, обеспечивающих временную продукцию рекомбинантных биологически активных белковых молекул в межклеточное пространство (тканевую жидкость) с целью паракринной и/или эндокринной регуляции функциональной активности клеток мишеней для достижения положительного терапевтического эффекта у пациента.
Известен способ доставки терапевтических генов на клеточных носителях, кодирующих секреторные формы нейротрофических факторов, например для лечения бокового амиотрофического склероза: миобласты, экспрессирующие глиальный нейротрофический фактор (GDNF) [Mohajeri М.Н., Figlewicz D.A., Bohn М.С. Intramuscular Grafts of Myoblasts Genetically Modified to Secrete Glial Cell Line-Derived Neurotrophic Factor Prevent Motoneuron Loss and Disease Progression in a Mouse Model of Familial Amyotrophic Lateral Sclerosis // Hum. Gene Ther. 1999. Vol. 10. №11. P. 1853-1866], или нейрональные клетки-предшественницы из коры головного мозга человека генно-модифицированные для сверхэкспрессии глиального нейротрофического фактора (GDNF) [Behrstock S. и др. Human neural progenitors deliver glial cell line-derived neurotrophic factor to parkinsonian rodents and aged primates. // Gene Ther. 2006. Vol. 13. №5. P. 379-88; Klein S.M. и др. GDNF delivery using human neural progenitor cells in a rat model of ALS. // Hum. Gene Ther. 2005. Vol. 16. №4. P. 509-21]. Для лечения болезни Альцгеймера предложен способ, при котором ген, кодирующий фермент непрелизин, доставляли в мозг путем трансплантации генетически модифицированных фибробластов [Hemming M.L. и др. Reducing amyloid plaque burden via ex vivo gene delivery of an Abeta-degrading protease: a novel therapeutic approach to Alzheimer disease. // PLoS Med. 2007. Vol. 4. №8. P. е262]. В клиническом испытании для лечения болезни Альцгеймера использовали способ трансплантации в мозг пациентов аутологичных фибробластов, несущих рекомбинантный ген фактора роста нервов [Tuszynski М.Н. и др. A phase 1 clinical trial of nerve growth factor gene therapy for Alzheimer disease. // Nat. Med. 2005. Vol. 11. №5. P. 551-5]
Недостатком данного технического решения является получение генно-клеточного препарата путем культивирования клеток различного генеза in vitro до и после введения рекомбинантного генетического материала. При этом известно, что культивирование клеток in vitro сопряжено с рисками подготовки клеточного материала (биопсия и выделение требуемого клеточного типа), поддержания жизнеспособности клеток (применение продуктов животного происхождения и антибиотиков) и получения конечного генно-клеточного препарата в достаточной дозе для терапевтического использования. Не маловажными являются проблемы, связанные с временными и финансовыми затратами.
Для стимулирования ангиогенеза при ишемических заболеваний сердца известен способ получения генно-клеточного препарата на основе стволовых клеток крови пуповины, несущих рекомбинантные гены сосудистого эндотелиального фактора роста и ангиопротеина-1 [Chen Н.K. et al. Combined cord blood stem cells and gene therapy enhances angiogenesis and improves cardiac performance in mouse after acute myocardial infarction // Eur. J. Clin. Invest. 2005. Vol. 35, №11. P. 677-686.]. Существенным недостатком препарата является интеграция предложенного аденоассоциированного вирусного вектора в геном трансплантируемых клеток и последующая возможная их опухолевая трансформация. Кроме того, выделение стволовых клеток из крови пуповины значительно усложняет процедуру получения генно-клеточного препарата.
Известен способ введения рекомбинантных терапевтических генов в лейкоциты, полученные из крови пуповины человека, с помощью двухкассетной генетической плазмидной конструкции pBud-VEGF-GDNF, содержащую фрагменты ДНК, кодирующие VEGF и GDNF. Этот способ позволяет получать генетически модифицированные клетки, сверхэкспрессирующие два ростовых фактора - сосудистый эндотелиальный фактор роста (VEGF) и глиальный нейротрофический фактор (GDNF) [Пат. 2431669 РФ, МПК C12N 15/00 (2006.01). Способ получения лекарственного препарата генетически модифицированных клеток / Исламов Р.Р.; заявитель и патентообладатель Казанский государственный университет «им. В.И. Ульянова-Ленина», Казанский государственный медицинский университет, Исламов P.P., Ризванов А.А., Киясов А.П. - №2009123656/10; заявл. 23.06.2009; опубл. 27.12.2010.]. Однако, данный способ введения рекомбинантного гена в эукариотические клетки с использованием плазмидного вектора, имеет существенные недостатки. Трансфекция клеток осуществляется in vitro с помощью метода электропорации (пропускание электрического разряда через клеточную суспензию, что приводит к временному образованию пор в клеточной мембране, через которую плазмидный вектор проникает внутрь клетки), а плазмидный вектор имеет очень короткий срок экспрессионной активности.
Известен способ использования, генетически модифицированных лейкоцитов в терапевтических целях, в котором применяются генетически модифицированные мононуклеарные клетки из крови пуповины для стимулирования нейрорегенерации. Способ используется для стимулирования посттравматической регенерации спинного мозга с помощью генетически модифицированных лейкоцитов (мононуклеарной фракции) крови пуповины, трансдуцированных генетическим вектором на основе аденовируса человека 5 серотипа (Ad5), несущим ген глиального нейротрофического фактора (GDNF) [Пат. 2521225 РФ, МПК А61K 48/00 (2006.01). Способ стимулирования регенерации спинного мозга с помощью генетически модифицированных клеток крови пуповины человека / Челышев Ю.А.; заявитель и патентообладатель Казанский государственный университет «им. В.И. Ульянова-Ленина», Казанский государственный медицинский университет, Казанский институт биохимии и биофизики Казанского научного центра Российской академии наук, Исламов P.P., Ризванов А.А., Киясов А.П., Шаймарданова Г.Ф., Соловьева В.В. - №2013100684/15; заявл. 09.01.2013; опубл. 27.05.2013.].
Известен способ для лечения инсульта головного мозга с использованием генетически модифицированных лейкоцитов крови пуповины, одновременно трансдуцированных тремя клонированными генами человека, а именно геном сосудистого эндотелиального фактора роста (VEGF), геном глиального нейротрофического фактора (GDNF) и геном нейрональной молекулы клеточной адгезии (NCAM) [Пат. 2676701 РФ, МПК А61K 31/7088 (2006.01). Средство для сдерживания гибели нейронов при ишемическом инсульте головного мозга и способ клеточно-опосредованной генной терапии ишемического инсульта головного мозга средством сдерживания гибели нейронов при ишемическом инсульте головного мозга / Исламов Р.Р.; заявитель и патентообладатель Казанский государственный медицинский университет, Исламов P.P., Соколов М.Е. - №2017142047; заявл. 01.12.2017; опубл. 10.01.2019.].
Вышеуказанные способы с использованием крови пуповины имеют существенные ограничения в использовании в практической медицине, что обусловлено с трудностями получения клеточного материала, его небольшим количеством для трансплантации, невозможностью проводить повторных курсов генно-клеточной терапии, а также не высоким уровнем трансдукции лейкоцитов крови пуповины с помощью генетического вектора на основе аденовируса человека 5 серотипа (Ad5).
Близким к заявляемому способу является способ изготовления активированной лейкоцитарной композиции из аллогенных или аутологичных образцов крови, включающий инкубацию лейкоцитов человека при определённой температуре в течение определенного времени, подвергание лейкоцитов гипоосмотическому шоку и последующее добавление к лейкоцитам физиологически приемлемого солевого раствора, содержащего неорганические соли, органические осмолиты для восстановления лейкоцитами изотоничности [Пат. 2548741 РФ, МПК А61K 35/14 (2015.01). Активированная лейкоцитарная композиция / Ширван Митчел; заявитель и патентообладатель МАКРОКЬЮЭ, ЛТД. - №2011139016/15; заявл. 05.03.2010; опубл. 10.04.2013.]. Активированная лейкоцитарная композиция, полученная по вышеупомянутому способу, применяется для лечения ран путем инъекции непосредственно в рану или в ткани, окружающие рану, изготовления повязки, содержащей указанную композицию, для лечения ран. В данном способе активация лейкоцитов не предусматривает введение в лейкоциты рекомбинантного генетического материала для модификации их функциональной активности.
Способы изготовления безопасного лекарственного средства, содержащего рекомбинантный генетический материал, для временной продукции рекомбинантных биологически активных белковых молекул на основе доступного клеточного материала и эффективного генетического вектора, невидимого для иммунной системы реципиента в составе средства, для аутотрансплантации в настоящее время не известны.
Задачей решаемой заявляемым изобретением является создание генетически модифицированного лейкоконцентрата (ГМЛ) безопасного для аутотрансплантации в терапевтических целях на основе лейкоцитов периферической крови пациента и рекомбинантных аденовирусов Ad5 с модифицированным фибером (Ad5/35F), несущих клонированный (терапевтический) ген человека, или комбинацию генов, без использования методов культивирования клеток in vitro.
Поставленная задача решается способом изготовления средства для клеточно-опосредованной генной терапии из стандартной единицы цельной крови, с последовательным получением лейкотромбослоя из цельной крови и лейкоконцентрата из лейкотромбослоя, в который добавляют гидроксиэтилкрахмал в соотношение 1:1, полученную смесь лейкотромбослоя с гидроксиэтилкрахмалом центрифугируют с последующим получением надосадочной жидкости содержащей плазму, гидроксиэтилкрахмал и лейкоциты, затем к надосадочной жидкости добавляют физиологический раствор, центрифугируют с получением лейкоконцентрата, в который добавляют рекомбинантный репликативно-дефектный вирусный вектор Ad5/35F (MOI = 5), доставляющий рекомбинантный генетический материал (терапевтический ген человека, или комбинацию генов) в CD45 - позитивные клетки и средством для клеточно-опосредованной генной терапии, включающее лейкоконцентрат и генетические векторы, несущие один, или комбинацию клонированных генов человека в соотношении лейкоцит: вирусный вектор - 1:5.
Сущность предлагаемого изобретения иллюстрируется примерами этапов изготовления лейкоконцентрата из образца цельной крови человека, изготовления генетически модифицированного лейкококонцентрата, путем трансдукции лейкоконцентрата аденовирусным вектором Ad5/35F, несущим ген репортерного зеленого флуоресцирующего белка (GFP), оценки способности генетически модифицированного лейкоконцентрата (ГМЛ-GFP) продуцировать репортерный зеленый флуоресцирующий белок и способов применения генетически модифицированного лейкоконцентрата (ГМЛ) для клеточно-опосредованной генной терапии.
Пример 1. Изготовление генетически модифицированного лейкоконцентрата.
Первый этап. Изготовление лейкоконцентрата из стандартной единицы цельной крови (450 мл).
1. Получение лейкотромбослоя из донорской крови человека.
Лейкотромбослой получают автоматизированным методом из стандартной единицы цельной крови (450 мл) при помощи автоматического сепаратора крови Macopress Smart (Macopharma, Франция), объем полученного лейкотромбослоя после сепарации составляет 50 мл.
2. Получение лейкоконцентрата из лейкотромбослоя.
2.1. В контейнер для крови (Macopharma, Франция) с лейкотромбослоем добавляют 6% раствор гидроксиэтилкрахмала (Стабизол ГЭК 6%, Берлин-Хеми АГ, Германия) в соотношении 1:1;
2.2. Смесь лейкотромбослоя со Стабизол ом переливают в контейнер для крови «Комполаст-300» (ОАО «Синтез», Россия) и центрифугируют при 350 rpm и температуре 10°С в течение 10 минут с помощью центрифуги Presvac (Аргентина);
2.3. Надосадочную жидкость, содержащую лейкоциты, плазму и стабизол из контейнера для крови экстрагируют путем выдавливания с помощью фракционатора компонентов крови ФК-01 (ООО "Лидкор", Екатеринбург);
2.4. К надосадочной жидкости добавляют 200 мл стерильного физиологического раствора и центрифугируют при 1300 rpm и температуре 10°С в течение 10 минут с помощью центрифуги Presvac;
2.5. Полученную надосадочную жидкость (физиологический раствор) из контейнера для крови экстрагируют путем выдавливания с помощью фракционатора компонентов крови ФК-01 таким образом, чтобы в контейнере для крови осталось 30-50 мл физиологического раствора, содержащего клеточную суспензию (лейкоконцентрат).
Лейкоконцентрат, полученный из стандартной единицы крови, оценивали с помощью клеточного анализатора АВХ Micros ОТ 60 (HORIBA АВХ, Франция) для каждого образца цельной крови. Усредненные результаты анализов 22-х образцов лейкоконцентрата, изготовленного в соответствии со способом настоящего изобретения, представлены в таблице 1. Количество жизнеспособных лейкоцитов, содержащихся в лейкоконцентрате, оценивали путем окрашивания трипановым синим и подсчетом окрашенных (нежизнеспособных клеток) в гемоцитометре. Процент жизнеспособных клеток составил 98-99%.
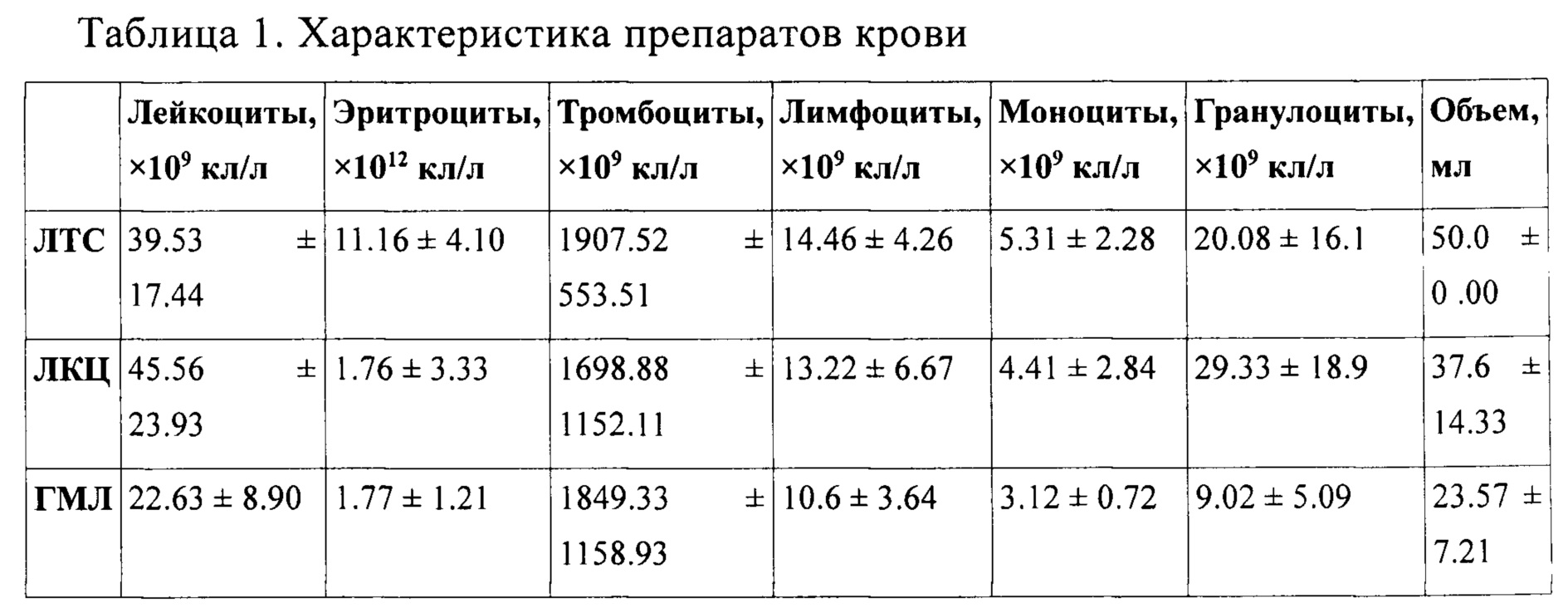
ЛТС - лейкотромбослой, ЛКЦ - лейкоконцентрат, ГМЛ - генетически модифицированный лейкоконцентрат
Анализ полученных результатов свидетельствует, что в результате способа настоящего изобретения из стандартной единицы цельной крови (450 мл), получают контейнер для крови, содержащий 37-51 мл лейкоконцентрата (45.56±23.93×106 лейкоцитов в 1 мл физиологического раствора). Количество эритроцитов в гемаконе контейнере с лейкоконцентратом составляет 1.76±3.33×109/мл.
Второй этап. Изготовление генетически модифицированного лейкоконцентрата (ГМЛ-GFP).
1. Рекомбинантный репликативно-дефектный вирусный вектор, несущий ген репортерного зеленого флуоресцирующего белка (Ad5/35F-GFP), создан на основе аденовируса человека 5 серотипа с модифицированным фибером (Ad5/35F) в НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи (г. Москва), как было описано ранее (Рогожин В.Н. и др. // Acta naturae. 2011. Т. 3 №3 (10). С. 103-110).
2. В контейнер для крови, содержащий лейкоконцентрат, через порт с помощью стерильного шприца вводят необходимый объем Ad5/35F-GFP в физиологическом растворе, где MOI (multiplicity of infection -множественность инфицирования) был равен 5 (MOI = 5).
3. Лейкоконцентрат в контейнере для крови инкубируют в течение 12 часов при комнатной температуре (21-22°С), при постоянном покачивании на шейкере (ELMI).
4. Через 12 часов в контейнер для крови, содержащий генетически модифицированный лейкоконцентрат (ГМЛ-GFP), добавляют 200 мл стерильного физиологического раствора и центрифугируют при 1000 rpm и температуре 10°С в течение 10 минут с помощью центрифуги Presvac.
5. Надосадочную жидкость (физиологический раствор) из контейнера для крови экстрагируют путем выдавливания с помощью фракционатора компонентов крови ФК-01 таким образом, чтобы в контейнере для крови остается 23-30 мл физиологического раствора, включающего клеточную суспензию - генетически модифицированный лейкоконцентрат (ГМЛ-GFP), содержащий ген репортерного зеленого флуоресцирующего белка (GFP) (Таблица 1). Количество жизнеспособных лейкоцитов в ГМЛ при подсчете в гемоцитометире, как было описано выше, составило 84-85%.
Третий этап. Анализ продукции рекомбинантной белковой молекулы генетически модифицированными лейкоцитами.
Через 12 часов после трансдукции лейкоконцентрата часть клеток из контейнера для крови переносили на низкоадгезионные чашки (Corning® Costar® Ultra-Low) и добавляли среду RPMI-1640 (ПанЭко, Россия). Клетки культивировали в инкубаторе при 37°С, во влажной атмосфере, содержащей 5% СО2. Через 60 часов культивирования GFP-позитивные клетки визуализировали с помощью флуоресцентной микроскопии. Процент GFP-позитивных клеток выявляли с помощью метода проточной цитометрии. Результаты свидетельствуют, что через 72 часа после изготовления генетически модифицированного лейкоконцентрата (ГМЛ-GFP), содержащего ген зеленого флуоресцирующего белка, лейкоциты эффективно синтезируют рекомбинантный белок, а процент генетически модифицированных лейкоцитов, трансдуцированных в соотношении лейкоцит: вирусный вектор, как 1:5, в присутствии известного количества эритроцитов, составляет 2,5%.
Пример 2. Способы применения генетически модифицированного лейкоконцентрата (ГМЛ) для аутотрансплантации (персонифицированная терапия) в лечебных целях для временной продукции рекомбинантных биологически активных белковых молекул, специфически воздействующих на определенный патологический процесс, считать частью изобретения.
Средство для клеточно-опосредованной генной терапии, изготовленный по способу, изложенному в Примере 1 на первом и втором этапах, до его применения может храниться в контейнере для крови при комнатной температуре (21-22°С), или в холодильной камере (при 4-6°С) течение 12 часов или быть замороженным по стандартной технологии заготовки препаратов крови для длительного хранения.
Повышение концентрации генетической конструкции (Ad5/35F-GFP), используемой для трансдукции лейкоконцентрата, позволяет увеличивать процент генетически модифицированных клеток до 5%, или 10%, или 20%.
Используемое количество средства для клеточно-опосредованной генной терапии для трансплантации позволяет регулировать уровень продукции рекомбинантного белка у пациента.
Средство для клеточно-опосредованной генной терапии предполагает возможность многократного приготовления и многократной аутотрансплантации для патогенетической терапии пациента.
Использование средства для клеточно-опосредованной генной терапии для аутотрансплантации (персонифицированная терапия) включает этапы: (1) забора стандартной единицы периферической крови у пациента, (2) изготовление ГМЛ, содержащего терапевтические рекомбинантные гены человека для патогенетической терапии известной нозологической формы, (3) аутоинфузию ГМЛ на следующие сутки после забора крови.
Средство для клеточно-опосредованной генной терапии для патогенетической терапии примерных нозологических форм может содержать следующие комбинации рекомбинантных терапевтических генов человека: комбинация генов, кодирующих сосудистый эндотелиальный фактор роста (VEGF), глиальный нейротрофический фактор (GDNF) и нейрональную молекулу клеточной адгезии (NCAM), для сдерживания гибели нейронов при нейродегенеративных заболеваниях, нейротравме, ишемическом инсульте; комбинация генов, кодирующих сосудистый эндотелиальный фактор роста (VEGF) и ангиогенин (ANG), для восстановления микрососудистого русла при ишемии скелетной и сердечной мышцы; комбинация генов, кодирующих фактор некроза опухоли (TNFα) и Fas-лиганд (FasL), для активация апоптоза в трансформированных клетках при онкологических заболеваниях; комбинация генов, кодирующих интерлейкины (IL-4 и IL-10), для коррекции воспалительной реакции при аутоиммунных заболеваниях; комбинация генов, кодирующих лактоферрин (LTF) и дефензин (DEFB), для усиления иммунитета при бактериальных заболеваниях; комбинация генов, кодирующих интерфероны (IFNα, IFNβ и IFNγ), для усиления иммунитета при вирусных заболеваниях; комбинация генов, кодирующих морфогенетические белки кости (ВМР2 и ВМР7), для стимулирования регенерации костной ткани; гены, кодирующие факторы свертываемости крови (F5 и F8), для коррекции нарушения свертывания крови; ген, кодирующий бутирилхолинэстеразу (BCFIE), для продукции молекул-ловушек ядов и токсинов при отравлениях ФОС антихолинэстеразного действия. Использование лейкоконцентрата в качестве носителя терапевтического гена или комбинации генов обладает следующими преимуществами: лейкоциты являются клетками с высокой синтетической и секреторной активностью. Лейкоциты обладают высоким миграционным потенциалом из кровеносного русла в ткани организма. Лейкоциты имеют высокую эффективность трансдукции аденовирусным вектором с модифицированным фибером (Ad5/35F) через молекулу CD46.
Трансдукция лейкоцитов ex vivo предупреждает прямое токсическое и иммуногенное действие аденовирусного вектора на организм реципиента, известное при прямой (in vivo) генной терапии. Генетически модифицированный лейкоконцентрат обеспечит временную продукцию рекомбинантных биологически активных белковых молекул в организме реципиента. Дозированная концентрация генетического вектора при трансдукции лейкоконцентрата или количество используемого генетически модифицированного лейкоконцентрата для инфузии позволяют контролировать уровень продуцируемых терапевтических молекул в организме пациента. Пригодность применения для аутотрансплантации, а также возможность многократной инфузии генетически модифицированного лейкоконцентрата. Возможность системного (в/в) или локального (п/к, в/м) введения. Центры заготовки крови могут производить генетически модифицированный лейкоконцентрат (ГМЛ) по оригинальной технологии с использованием разрешенных к применению генетических конструкций, содержащих терапевтические гены человека.

