Результат интеллектуальной деятельности: Способ количественного определения в вакцинном препарате антигена, адсорбированного на частицах гидроксида алюминия
Вид РИД
Изобретение
Область техники
Изобретение относится к иммунологии и может быть использовано для количественного определения содержания антигена, адсорбированного на частицах гидроокиси алюминия, в рекомбинантной вакцине.
Уровень техники.
Вакцины, предназначенные для иммунизации людей, могут иметь в своем составе адъюванты, способствующие развитию протективного иммунного ответа. В качестве адъюванта часто используется гидроксид алюминия, и, таким образом, вакцинный препарат представляет собой антигены, адсорбированные на частицах гидроксида алюминия.
Контроль качества вакцинного препарата предполагает количественное определение содержания антигена в конечном продукте в сравнении с контрольным вакцинным препаратом с доказанной эффективностью действия.
Одним из подходов к количественному определению антигена в адсорбированной вакцине является проведение иммуноферментного анализа с предварительной десорбцией антигена с частиц гидроокиси алюминия. Для этой цели используют различные поверхностно-активные вещества, фосфат-анион. (Shanmugham R., Thirumeni N., Rao V.S. et al. Immunocapture Enzyme-Linked Immunosorbent Assay for Assessmentof In Vitro Potency of Recombinant Hepatitis В Vaccine. Clinical and vaccine immunology. 2010, 17 (8): 1252-1260).
Определение антигена в адсорбированной вакцине возможно также и без десорбции антигена с частиц гидроксида алюминия. Так, известен способ контроля содержания антигена, адсорбированного на частицах гидроксида алюминия с помощью конкурентного иммуноферментного анализа. Способ включает предварительную сенсибилизацию лунок планшета антигеном, после чего в опытных планшетах проводят инкубацию испытуемых и контрольных образцов, сорбированных на гидроксиде алюминия, со специфичными антителами в различных разведениях. На следующей стадии смесь вакцины с антителами переносят в сенсибилизированный планшет и инкубируют, а затем, после отмывки, инкубируют с антивидовыми антителами. Количество антитела, которое связывается с реакционным сосудом, обратно пропорционально количеству антигена, который присутствовал в реакционном растворе, что позволяет рассчитать количество антигена (патент ЕР 2343552 А1, 07.01.2000, Competitive enzyme immunoassay for assessing total antigen content of aluminum-adsobed antigens).
Наиболее близким аналогом заявленного изобретения является способ, описанный в патенте ЕР 2705365 B1 Immunoassay for direct determination of antigen content of products comprising adjuvant-coupled -antigen particles. Указанный метод предполагает определение аллергена в препарате, представляющем собой аллерген, адсорбированный на частицах гидроокиси алюминия по остаточному количеству антител, специфичных к аллергену, не связавшихся с вакцинным препаратом в процессе предварительной инкубации твердофазным иммуноферментным методом. После предварительной инкубации препарата со специфическими иммуноглобулинами не связавшиеся иммуноглобулины выявляются твердофазным иммуноферментным методом. В лунках 96-луночного планшета сорбируют антиген. Кроличьи антитела класса IgG, специфичные к аллергену, предварительно инкубируют с различными концентрациями аллергена, сорбированного на гидроокиси алюминия. После инкубации смесь вносят в лунки планшета, таким образом оставшиеся в растворе антитела связываются с антигеном на планшете. На следующей стадии после отмывки связанные антитела выявляют конъюгатом анти-кроличьих антител с пероксидазой хрена. Содержание связанных антител в опытных лунках сравнивают с лунками контроля, содержащего антитела к аллергену, без аллергена, сорбированного на алюминии.
Недостатком способа является наличие стадии внесения антивидовых антител при проведении иммуноферментного анализа, что увеличивает общее время определения антигена, а также возможность влияния частиц гидроксида алюминия на результаты этого определения, поскольку неполное удаление частиц геля гидроксида алюминия в процессе отмывки может приводить к изменению оптической плотности исследуемого раствора при проведении ИФА, и, как следствие, к получению ложноположительных результатов, а также затруднять диффузию моноклональных антител, принимающих участие в иммунохимической реакции.
Задачей изобретения является разработка метода определения содержания антигенных компонентов вакцины, адсорбированных на гидроокиси алюминия.
Техническим результатом изобретения является возможность определения антигенов в вакцинном препарате, адсорбированных на частицах гидроксида алюминия, исключая стадию десорбции антигенов с этих частиц.
С помощью предлагаемого изобретения возможно определение антигена в исследуемой вакцине по остаточному количеству антител, не связавшихся с вакцинным препаратом в процессе предварительной инкубации. Использование специфических моноклональных антител, конъюгированных с пероксидазой хрена, позволяет проводить выявление специфичных антигенов прямым твердофазным иммуноферментным методом только в одну стадию. Заявленный способ также включает стадию центрифугирования, благодаря чему отделение комплексов антитело-антиген-гидроксид алюминия не занимает много времени, а также сводит к минимуму влияние гидроксида алюминия на получаемые результаты.
Для решения поставленной задачи мы предлагаем способ количественного определения адсорбированного на частицах гидроксида алюминия антигена, заключающийся в том, что на первом этапе осуществляют предварительную иммобилизацию свободного исследуемого антигена в лунках 96-луночного планшета для иммуноферментного анализа, на втором этапе к разведениям вакцинного препарата, содержащего частицы гидроксида алюминия с сорбированным на них исследуемым антигеном добавляют моноклональные антитела к данному антигену, конъюгированные с пероксидазой, на третьем этапе производят отделение центрифугированием не связавшихся антител, конъюгированных с пероксидазой, от частиц гидроксида алюминия с образовавшимся иммунным комплексом, на четвертом этапе отделяют надосадочную жидкость и помещают ее в планшет с иммобилизованным исследуемым антигеном, определяют количество не связавшихся антител прямым твердофазным иммуноферментным методом, после чего определяют содержание антигена, адсорбированного на частицах гидроксида алюминия в составе вакцинного препарата.
В частном случае изобретения содержание антигена определяют по калибровочному графику, построенному для вакцинного препарата с известным содержанием антигена.
В частном случае антиген представляет собой рекомбинантные анатоксин и OprF P.aeruginosa.
Краткое описание чертежей и иных поясняющих материалов
Фиг. 1. Схематическое представление изобретения
I - стадия инкубации антигена, сорбированного на частицах гидроксида алюминия и специфических антител, меченых пероксидазой хрена,
1- частицы гидроксида алюминия
II - стадия отделения комплекса антиген-Аl(ОН)3-антитело-ПХ от несвязавшихся антител, меченых ПХ, центрифугированием.
III - стадия определения несвязавшихся антител, меченых ПХ, прямым твердофазным иммуноферментным методом.
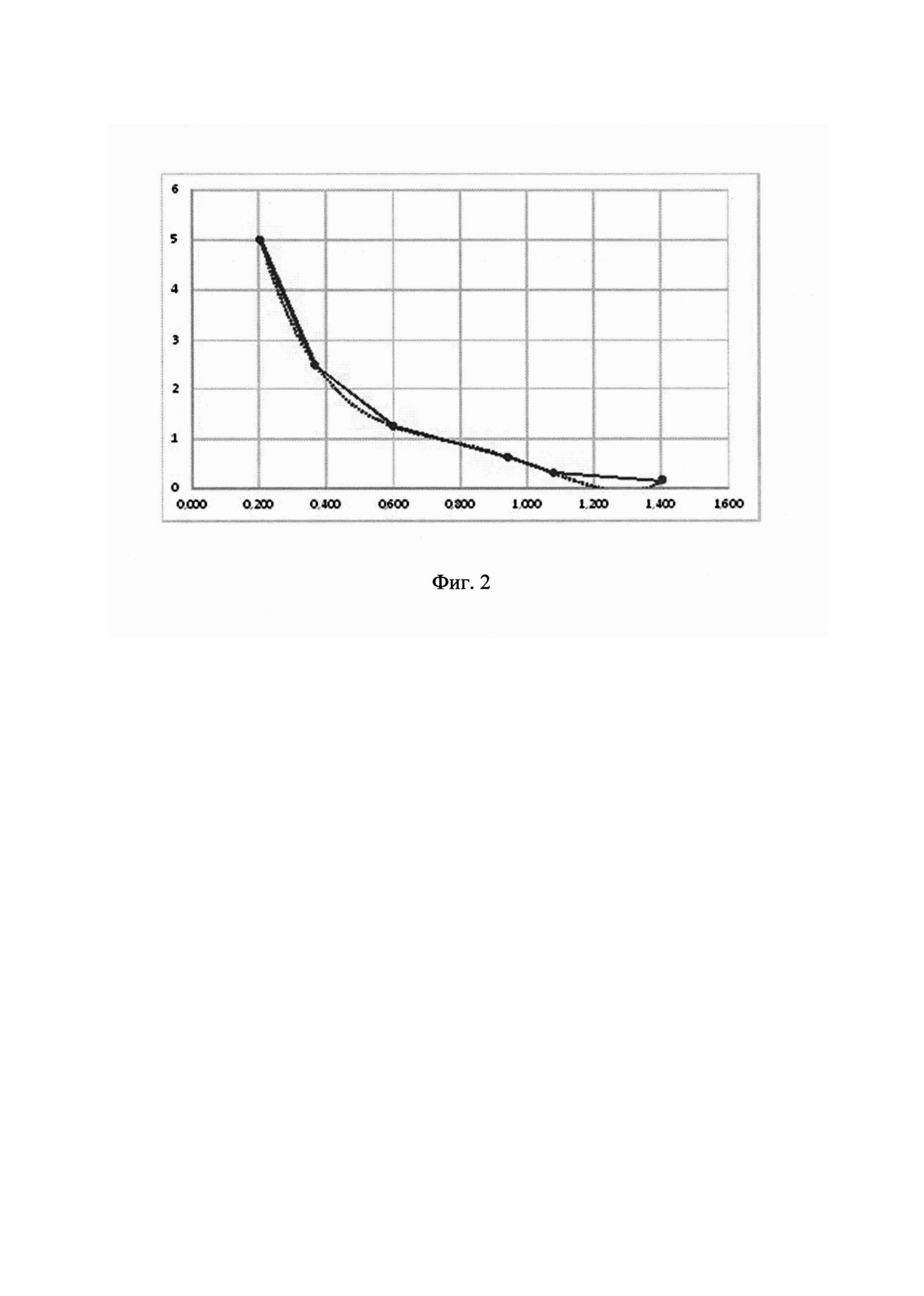
Фиг.2. Калибровочный график с обратной зависимостью для количественного определения OprF в вакцинном препарате, где по оси абсцисс - оптическая плотность (ОП),
по оси ординат - концентрация OprF в РВС, мкг/мл.
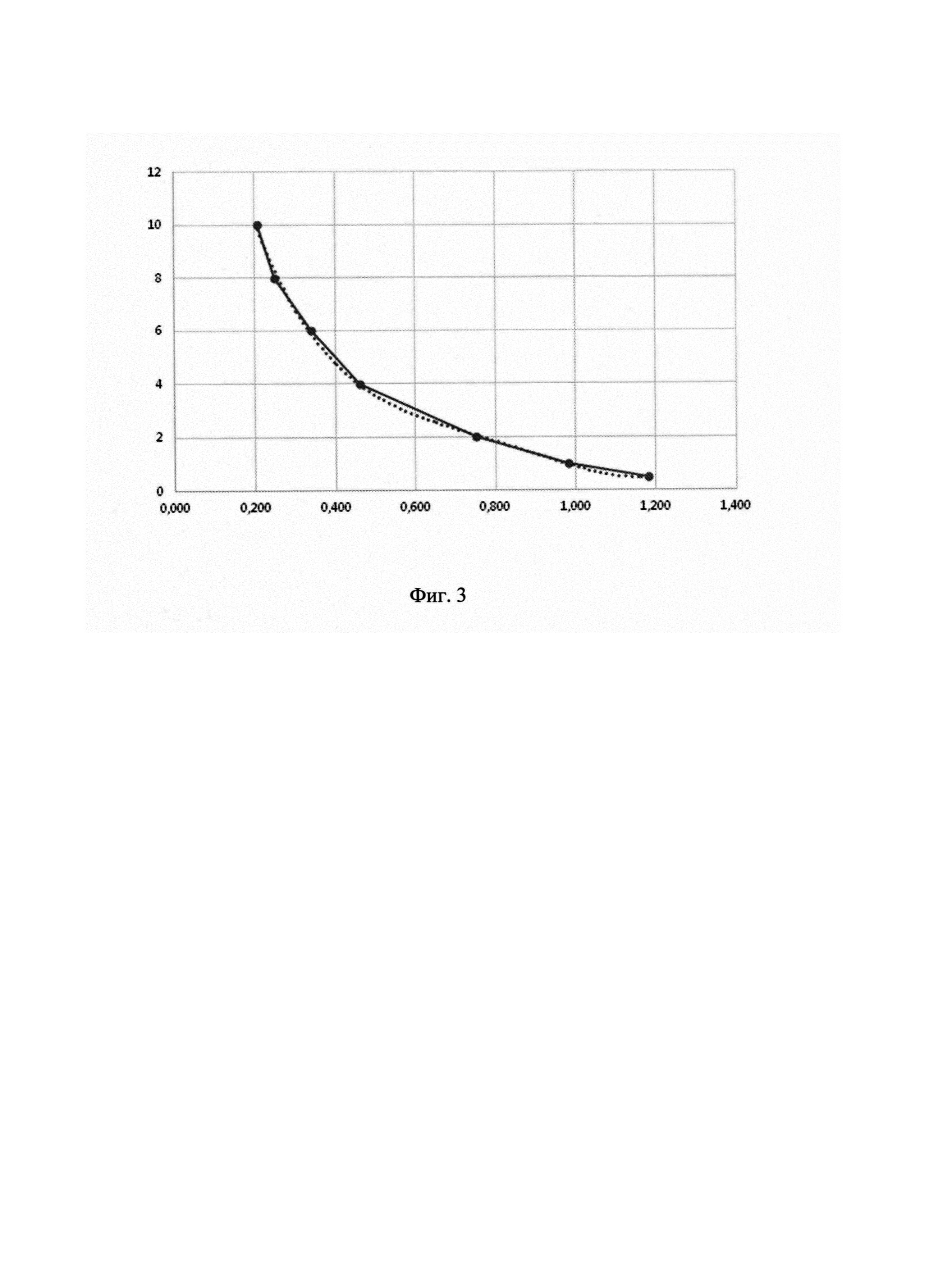
Фиг. 3. Калибровочный график с обратной зависимостью для количественного определения анатоксина аТох в вакцинном препарате, где по оси абсцисс - ОП, по оси ординат - концентрация анатоксина аТох в РВС, мкг/мл
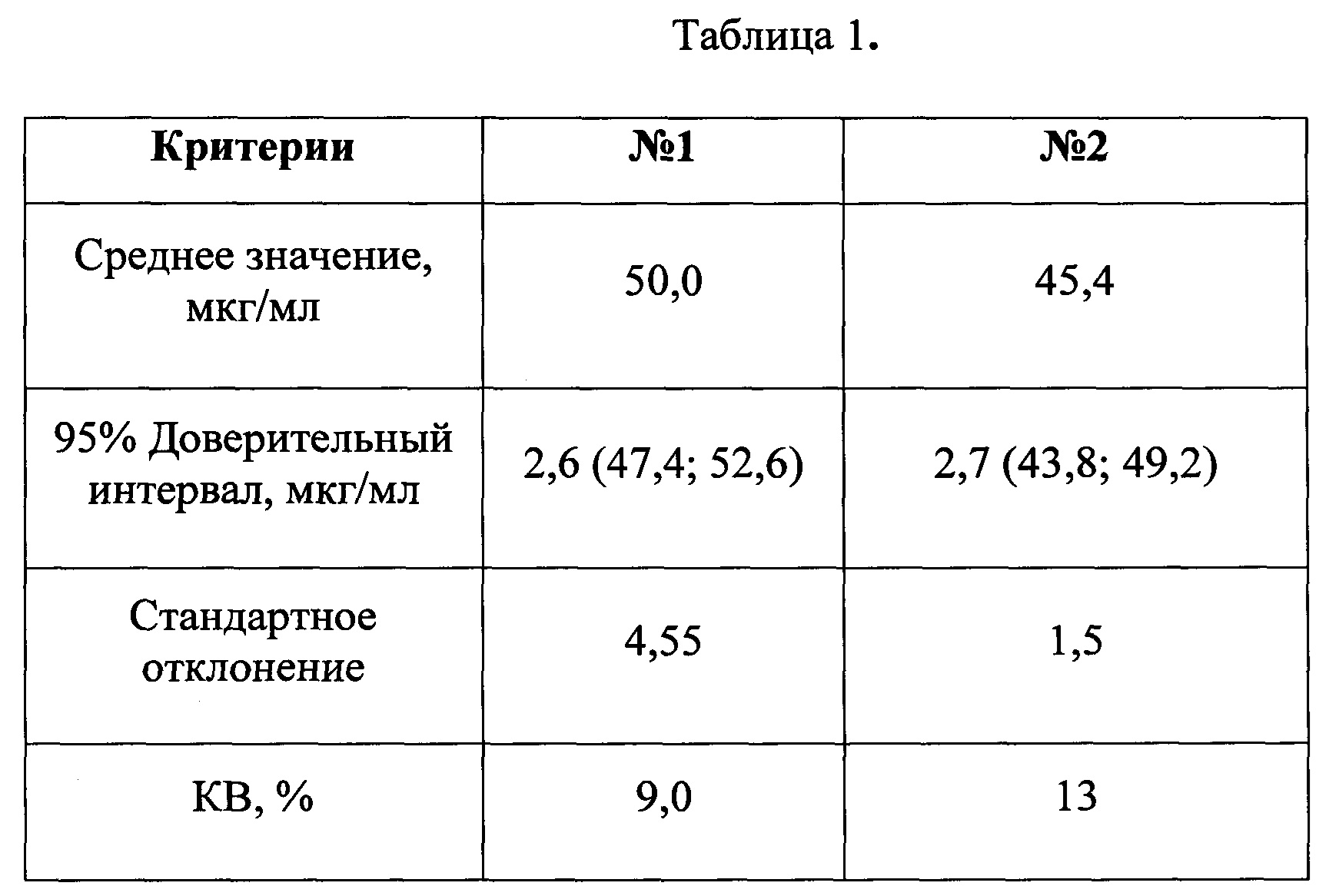
Таблица 1. Определение количественного содержания OprF в двух сериях вакцины.
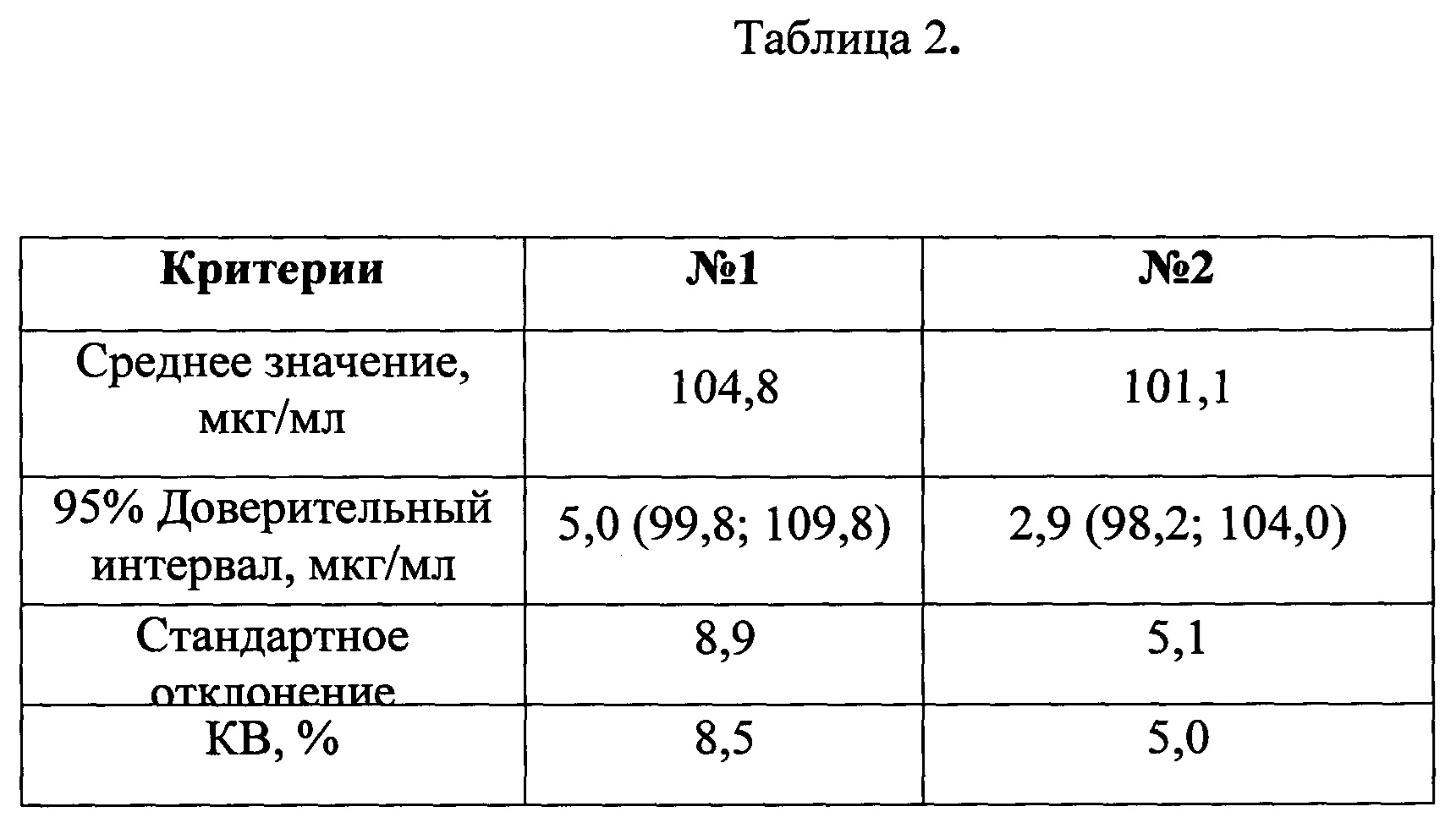
Таблица 2. Определение количественного содержания анатоксина в двух сериях вакцины.
Осуществление изобретения
В 96-луночные планшеты (Corning, США) вносили по 100 мкл изучаемые антигены в 0,1 М карбонатно-бикарбонатном буфере рН 9,6 в концентрации 5 мкг/мл. Планшеты выдерживали в течение ночи при температуре 4-8°С. После инкубации планшеты промывали один раз деионизованной водой, далее на 1 час при комнатной температуре вносили блокирующий раствор, представляющий собой 0,02 М фосфатный буферный раствор рН 7,2; содержащий 5% сахарозы, 0,09% казеината натрия, 0,05% Tween 20. После удаления блокирующего раствора планшеты высушивали в ламинарном потоке в течение 2 часов, запаивали в полиэтиленовые пакеты и хранили при 4-8°С до использования.
Выявление изучаемого антигена в вакцинных препаратах проводили следующим образом. Параллельно анализировали разведения стандартной и исследуемой серии вакцины. На первой стадии в пробирках смешивали конъюгат моноклональных антител с пероксидазой хрена (ПХ), специфичных к изучаемому антигену, с разными разведениями вакцинных препаратов (от 0,5 до 10 мкг/мл в пересчете изучаемый антиген), и выдерживали пробы при температуре 22±4°С в течение 40 мин, периодически перемешивая. Образовавшийся комплекс антител, меченных пероксидазой, с антигеном, сорбированным на частицах гидроксида алюминия, отделяли центрифугированием. Не связавшиеся с антигеном антитела, меченные ПХ, оставались в надосадочных жидкостях, которые исследовали методом иммуноферментного анализа.
Для постановки ИФА использовали полистироловые планшеты, сенсибилизированные изучаемым антигеном. В лунки планшета вносили по 100 мкл надосадочных жидкостей, выдерживали на шейкере при температуре 37°С, скорости вращения 500 об/мин в течение 30 мин. После отмывки вносили по 100 мкл 33 мМ цитратного буферного раствора рН 4,0, содержащего 0,01% перекиси водорода и 0,5 мМ 3,3',5,5'-тетраметилбензидина. Через 15 мин реакцию останавливали добавлением 50 мкл 2 N серной кислоты, измеряли оптическую плотность (ОП) в двухволновом режиме при основной длине волны 450 нм и длине волны сравнения 680 нм.
Строили калибровочный график зависимости оптической плотности от концентрации изучаемого антигена в стандартной серии. Регистрируемая оптическая плотность была обратно пропорциональна концентрации антигена в анализируемых образцах.
Пример.
В 96-луночные планшеты (Corning, США) вносили по 100 мкл рекомбинантных анатоксина или OprF в 0,1 М карбонатно-бикарбонатном буфере рН 9,6 в концентрации 5 мкг/мл. Планшеты выдерживали в течение ночи при температуре 4-8°С. После инкубации планшеты промывали один раз деионизованной водой, далее на 1 час при комнатной температуре вносили блокирующий раствор, представляющий собой 0,02 М фосфатный буферный раствор рН 7,2; содержащий 5% сахарозы, 0,09% казеината натрия, 0,05% Tween 20. После удаления блокирующего раствора планшеты высушивали в ламинарном потоке в течение 2 часов, запаивали в полиэтиленовые пакеты и хранили при 4-8°С до использования.
Количественное определение адсорбированного на гидроокиси алюминия антигена в составе вакцинного препарата проводили с использованием стандартной серии вакцины с содержанием аТох - 100 мкг/мл и OprF - 50 мкг/мл.
Выявление анатоксина и OprF в вакцинных препаратах проводили следующим образом. Параллельно анализировали разведения стандартной и исследуемой серии вакцины. На первой стадии в пробирках смешивали конъюгат моноклональных антител с пероксидазой хрена, специфичных к анатоксину или OprF, с разными разведениями вакцинных препаратов (от 0,5 до 10 мкг/мл в пересчете на анатоксин или на OprF), и выдерживали пробы при температуре 22±4°С в течение 40 мин, периодически перемешивая. Образовавшийся комплекс антител, меченных пероксидазой, с антигеном, сорбированным на частицах гидроксида алюминия, отделяли центрифугированием. Не связавшиеся с антигеном антитела, меченные ПХ, оставались в надосадочных жидкостях, которые исследовали методом иммуноферментного анализа.
Для постановки ИФА использовали полистироловые планшеты, сенсибилизированные аТох или OprF. В лунки планшета вносили по 100 мкл надосадочных жидкостей, выдерживали на шейкере при температуре 37°С, скорости вращения 500 об/мин в течение 30 мин. После отмывки вносили по 100 мкл 33 мМ цитратного буферного раствора рН 4,0, содержащего 0,01% перекиси водорода и 0,5 мМ 3,3',5,5'-тетраметилбензидина. Через 15 мин реакцию останавливали добавлением 50 мкл 2 N серной кислоты, измеряли оптическую плотность (ОП) в двухволновом режиме при основной длине волны 450 нм и длине волны сравнения 680 нм.
Строили калибровочный график зависимости оптической плотности от концентрации рекомбинантных анатоксина или OprF в стандартной серии. Регистрируемая оптическая плотность была обратно пропорциональна концентрации антигена в анализируемых образцах.
На основании установленной стандартной серии произведено количественное содержание OprF в двух сериях вакцины.
В каждом эксперименте на основании серий разведений стандартной серии были построены калибровочные графики зависимости оптической плотности от количественного содержания OprF в анализируемой пробе с учетом обратной зависимости. Калибровочные образцы представляли собой последовательные разведения в диапазоне концентраций 0,075-10 мкг/мл. Для определения приемлемости интерполяции, на основании установленной стандартной серии проводили обратный пересчет концентраций калибровочных образцов. Коэффициент вариации (KB, %) рассчитывали по ОП в четырех повторах. Типичный калибровочный график представлен на рис 2., результаты определения - в таблице 1.
На основании установленной стандартной серии произведено определение количественного содержания анатоксина в двух сериях вакцины.
В каждом эксперименте на основании серий разведений стандартной серии были построены калибровочные графики зависимости оптической плотности от количественного содержания анатоксина в анализируемой пробе с учетом обратной зависимости. Калибровочные образцы представляли собой последовательные разведения в диапазоне концентраций 0,5-10 мкг/мл. Для определения приемлемости интерполяции, на основании установленной стандартной серии проводили обратный пересчет концентраций калибровочных образцов. Коэффициент вариации (KB, %) рассчитывали по ОП в четырех повторах. Типичный калибровочный график представлен на рис 3., результаты определения - в таблице 2.
Таким образом, преимуществами предлагаемого метода являются исключение стадии десорбции и использование специфических моноклональных антител, конъюгированных с пероксидазой корня хрена, что обеспечивает возможность быстрого количественного определения рекомбинантных анатоксина и OprF в вакцине, представляющей собой смесь адсорбированных на частицах гидроксида алюминия анатоксина и OprF.