Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pPA-OPRF-ATOX-OPRI, кодирующая синтез гибридного рекомбинантного белка, включающего аминокислотные последовательности белков F и I наружной мембраны и атоксического варианта экзотоксина A Pseudomonas aeruginosa, штамм Escherichia coli PA-OPRF-ATOX-OPRI - продуцент гибридного рекомбинантного белка и способ получения указанного белка
Вид РИД
Изобретение
Изобретение относится к биотехнологии, а именно к получению гибридного рекомбинантного белка, включающего аминокислотные последовательности белков F и I наружной мембраны и атоксического варианта экзотоксина A Pseudomonas aeruginosa (далее рекомбинантный белок OprF-aTox-OprI) для медицинских и ветеринарных целей, а также к рекомбинантным штаммам Escherichia coli (далее Е. coli) и плазмидам для получения рекомбинантных белков.
Синегнойная палочка (Pseudomonas aeruginosa (далее P. aeruginosa)) - условно патогенный микроорганизм рода Pseudomonas является одним из основных возбудителей гнойно-воспалительных заболеваний человека и псевдомоноза норок (геморрагической пневмонии). Благодаря неприхотливости в отношении питательных веществ и устойчивости к факторам внешней среды и лекарственным препаратам, в частности, к широкому спектру антибиотиков, синегнойные инфекции получили широкое распространение. Установлено, что около 5-10% здоровых людей являются носителями различных штаммов P. aeruginosa (в норме колонизируют кишечник) и около 70% пациентов, находящихся в стационаре [1].
Вакцинация может быть одним из эффективных средств защиты против условно патогенных микроорганизмов и, в частности, P. aeruginosa. С этой целью в СССР разрабатывались препараты на основе инактивированных бактерий, компонентов клеток и экзопродуктов: поливалентная синегнойная корпускулярная вакцина [2-4], пиоиммуноген [5-6], псевдомонас-вакцина [7-10]. В настоящее время все эти препараты по тем или иным причинам в клинической практике не используются.
В НИИ вакцин и сывороток им. Мечникова г. Уфы для профилактики и терапии синегнойных инфекций был разработан препарат на основе экзотоксина А P. aeruginosa - анатоксин синегнойной палочки [11-12]. Но выпуск данного препарата был приостановлен в связи с реорганизацией предприятий.
Создание эффективных иммунопрепаратов против синегнойной палочки сопряжено с трудностями, заключающимися в том, что патогенез инфекций, развивающихся с участием синегнойной палочки, обусловлен воздействием целого ряда факторов патогенности, среди которых выделить наиболее значимый для разработки вакцины представляется сложной задачей. Однако известно, что при инфицировании и проникновении возбудителя в ткани макроорганизма, первичные иммунные реакции формируются в основном на поверхностные антигены бактериальной клетки (компоненты мембраны и клеточной стенки).
Исследование поверхностных белков выявило, что наибольшей иммуногенностью обладают некоторые белки наружной мембраны (outer protein - Opr) P. aeruginosa, которые отвечают за межклеточный транспорт и сохранение структуры бактериальной мембраны. Наиболее иммунологически исследован мажорный порообразующий белок F наружной мембраны (далее OprF) с молекулярной массой 37,6 кДа, который обладает высокой иммуногенностью. Эти данные обусловили исследования по разработке вакцин на основе очищенных мембранных белков [13]. Однако содержание белков наружной мембраны незначительно относительно суммарных белков бактериальной клетки, и получение подобных препаратов проблематично.
Мембранный белок I (OprI) является структурным липопротеином и в большом количестве содержится в наружной мембране. Секвенирование гена белка OprI показало, что аминокислотная последовательность этого белка почти на 30% схожа с последовательностью липопротеина Е. coli [14]. Отличие заключается в том, что, OprI имеет один ковалентно-связанный жирнокислотный остаток, тогда как липопротеин Е. coli - три [15].
Экзотоксин А - один из главных патогенетических факторов при развитии генерализированных форм инфекций, вызываемых P. aeruginosa [16]. Данный секретируемый белок имеет молекулярную массу около 70 кДа и состоит из полипептидной цепи длиной в 613 аминокислот, формирующей следующие домены: N-концевой домен I (аминокислотные остатки 1-252), необходимый для взаимодействия с поверхностью клеток-мишеней; домен II (аминокислотные остатки 253-404), обеспечивающий эффективный перенос токсина в цитозоль клеток; С-концевой домен III (аминокислотные остатки 405-613), отвечающий за цитотоксическую функцию [17]. Механизм цитотоксического действия экзотоксина А состоит в следующем: экзотоксин А взаимодействует с рецептором α2-макроглобулина, белком родственным рецептору липопротеина низкой плотности (LRP1) или CD91, присутствующим на эпителиальных и антиген презентирующих клетках. После связывания с рецептором токсин проникает в клетку при помощи рецептор-опосредованного эндоцитоза, где происходит расщепление домена II в области REDLK при помощи фуриновой протеазы. Домен III, обладающий токсической активностью, катализирует инактивацию эукариотического фактора элонгации 2 (eEF-2) при помощи АДФ-рибозилирования, что приводит к ингибированию белкового синтеза и клеточной гибели [18]. Для защиты организма от поражения экзотоксином А возможно использование препаратов анатоксина, то есть очищенного нативного токсина, химически обработанного для устранения токсичности и сохранения иммуногенности. Созданные для иммунотерапии и иммунопрофилактики отечественные препараты на основе экзотоксина А представляли собой атоксичные формы белка, полученные очисткой культуральной токсинсодержащей среды P. aeruginosa, с последующей детоксикацией [19-22]. Показано, что после их применения в организме человека и животных происходило образование протективных антител. Однако трудоемкость технологических этапов получения, очистки, обезвреживания, а также нестандартность методов оценки специфической активности препаратов, обуславливают целесообразность создания вакцин на основе рекомбинантного анатоксина.
В настоящее время при создании вакцинных препаратов большое внимание уделяется использованию генно-инженерных методов. Суть их заключается во встраивании генов, отвечающих за синтез отдельных протективных антигенов возбудителя, в геном непатогенного микроорганизма (например, Е. coli или Saccharomyces cerevisiae). В процессе культивирования полученных продуцентов синтезируются целевые продукты, которые после универсальной очистки могут использоваться для приготовления вакцины. Такая стратегия позволяет вычленить и использовать наиболее иммуногенные компоненты бактерии. При этом в процессе производства вакцин исключается контакт с культурами патогенных микроорганизмов, что является существенным технологическим преимуществом, обеспечивающим безопасность персонала и окружающей среды.
Ранее были получены две рекомбинантные формы белка OprF P. aeruginosa (полноразмерная и С-концевая область, включающая 192-342 аминокислотные остатки). Показано, что эти белки обладали иммуногенными свойствами, сыворотки к ним проявляли бактериостатический эффект. Рекомбинантные формы белка OprF, а также иммунные сыворотки к ним способствовали защите мышей от экспериментальной инфекции, вызываемой P. aeruginosa [23]. С целью разработки препарата, предназначенного для стимуляции антитоксического иммунитета, то есть для нейтрализации значимого фактора патогенности экзотоксина А, получены рекомбинантный экзотоксина [24] и его атоксические формы [25]. Получены два гибридных рекомбинантных белка: первый (рекомбинантный белок OprF-ETA P. aeruginosa) содержал слитые аминокислотные последовательности белка OprF и атоксической формы экзотоксина А P. aeruginosa, а второй (рекомбинантный белок F-I наружной мембраны P. aeruginosa) содержал слитые аминокислотные последовательности двух мембранных белков OprF и OprI. Показано, что эти белки обладали протективным эффектом, который оказался в полтора раза выше, чем при использовании отдельных рекомбинантных белков OprF или анатоксина [26, 27].
Несмотря на удовлетворительные защитные свойства, эти гибридные рекомбинантные белки обладали некоторыми недостатками. В очищенном препарате OprF-ETA искомый полноразмерный гибридный белок составлял только одну треть всех рекомбинантных продуктов. Вероятно, при синтезе гибридного рекомбинантного белка OprF-ETA в клетках штамма-продуцента, кроме образования целевого продукта накапливалось несколько укороченных вариантов. Этот факт может вызвать затруднения при стандартизации препарата, предназначенного для получения вакцины. Другой гибридный белок (рекомбинантный белок F-I) включал только последовательности мембранных белков. Для эффективной иммунологической защиты организма от P. aeruginosa, кроме присутствия антител, связывающихся с поверхностными антигенами микроорганизма, важно достаточное содержание антител для нейтрализации молекул токсина, продуцируемого бактериями.
Таким образом, задачей настоящего изобретения является получение штамма-продуцента, содержащего плазмиду, кодирующую гибридный рекомбинантный белок, лишенный указанных недостатков.
Заявляется:
1. Рекомбинантная плазмидная ДНК pPA-OPRF-ATOX-OPRI, кодирующая синтез рекомбинантного белка OprF-aTox-OprI P. aeruginosa, размером 8217 пар оснований, расщепляющаяся в результате гидролиза специфическими нуклеазами рестрикции: Xba I-Hind III фрагмент ДНК, размером 177 пар оснований, содержащая последовательность сайта посадки рибосомы и последовательности, кодирующие стартовый кодон и шесть гистидинов; Hind III- Hind III фрагмент ДНК размером 1059 пар оснований, содержащего последовательность гена oprF P. aeruginosa; Hind III-Xho I фрагмент ДНК размером 1598 пар оснований, кодирующий первые два и часть третьего домена экзотоксина А P. aeruginosa; Xho I-Xho I фрагмент ДНК размером 210 пар оснований, содержащий последовательность гена oprI P. aeruginosa; Sph I - Hind III фрагмент ДНК размером 425 пар оснований, содержащего модифицированный промотор бактериофага Т7, лактозный оперон, последовательность сайта посадки рибосомы и последовательности, кодирующие стартовый кодон и шесть гистидинов; EcoR I - BamH I фрагмент ДНК размером 57 пар оснований, содержащего сайт посадки рибосомы, стартовый ATG-кодон и последовательность, кодирующую шесть гистидинов, при этом в результате экспрессии данной конструкции происходит синтез рекомбинантного продукта с массой около 110 кДа.
2. Штамм бактерий Е. coli PA-OPRF-ATOX-OPRI - продуцент рекомбинантного белка OprF-aTox-OprI P. aeruginosa, полученный путем трансформации родительского штамма бактерий Е. coli BL21(DE3) рекомбинантной плазмидной ДНК pPA-OPRF-ATOX-OPRI по п. 1.
3. Способ получения рекомбинантного белка OprF-aTox-OprI P. aeruginosa с использованием штамма Е. coli PA-OPRF-ATOX-OPRI по п. 2, включающий его культивирование в питательной среде, разрушение клеток микроорганизма и выделение «телец-включений», очистку полученного продукта с использованием аффинной хроматографии на никель-активированных сорбентах и растворением с ренатурацией очищенного препарата в нативных условиях при помощи ступенчатого диализа.
Техническим результатом заявленного изобретения является: 1) рекомбинантная плазмидная ДНК pPA-OPRF-ATOX-OPRI, кодирующая синтез гибридного рекомбинантного белка OprF-aTox-OprI, включающего аминокислотные последовательности белков F и I наружной мембраны и атоксического варианта экзотоксина А P. aeruginosa; 2) штамм Е. coli PA-OPRF-ATOX-OPRI - продуцент гибридного рекомбинантного белка OprF-aTox-OprI, включающего аминокислотные последовательности белков F и I наружной мембраны и атоксического варианта экзотоксина А P. aeruginosa; 3) способ получения указанного белка гибридного рекомбинантного белка OprF-aTox-OprI, включающего аминокислотные последовательности белков F и I наружной мембраны и атоксического варианта экзотоксина А P. aeruginosa.
В сравнении с рекомбинантным белком OprF-ETA, препарат рекомбинантного белка OprF-aTox-OprI является более гомогенным. В результате капиллярного электрофореза выявлено, что выход полноразмерного рекомбинантного белка OprF-aTox-OprI составлял 96,4%, в отличие от рекомбинантного белка OprF-aTox, который присутствовал в количестве 34,17% в очищенном препарате (Рис. 3).
В сравнении с рекомбинантным белком F-I, препарат рекомбинантный белок содержит в своем составе аминокислотную последовательность экзотоксина А P. aeruginosa (атоксический вариант), что в результате иммунизации, может обеспечивать стимуляцию защитных эффектов против одного из основных факторов патогенности синегнойной палочки экзотоксина А.
В сравнении со способом получения гибридных рекомбинантных белков OprF-ETA и F-I, способ получения гибридного рекомбинантного белка OprF-aTox-OprI усовершенствован. Способ включает получение «телец-включений», содержащих целевой рекомбинантный продукт, которые после дальнейшего лизиса в растворе мочевине используются для хроматографической очистки. Это позволяет получать рекомбинантный препарат с более высоким уровнем очистки.
Технической задачей изобретения является получение рекомбинантной плазмидной ДНК pPA-OPRF-ATOX-OPRI, кодирующей гибридный рекомбинантный белок, включающего аминокислотные последовательности белков F и I наружной мембраны и атоксического варианта экзотоксина A Pseudomonas aeruginosa (OprF-aTox-OprI) и штамма-продуцента рекомбинантного белка OprF-aTox-OprI с использованием Е. coli штамма BL21(DE3).
Указанная задача решалась созданием рекомбинантной плазмидной ДНК рРА-OPRF-ATOX-OPRI и штамма Е. coli PA-OPRF-ATOX-OPRI.
Плазмида pPA-OPRF-ATOX-OPRI имеет 8217 пар оснований и характеризуется наличием следующих фрагментов:
Hind III фрагмент ДНК размером 1059 пар оснований, содержащего последовательность гена oprF P. aeruginosa.
Hind III - Xho I - фрагмент ДНК размером 1598 пар оснований, кодирующую первые два и часть третьего домена экзотоксина А P. aeruginosa.
Xho I - Xho I - фрагмент ДНК размером 210 пар оснований, содержащего последовательность гена oprI P. aeruginosa.
Xba I - Hind III - фрагмент ДНК размером 177 пар оснований, содержащего последовательность сайта посадки рибосомы и последовательности, кодирующие стартовый кодон и шесть гистидинов.
Sph I - Hind III - фрагмент ДНК размером 425 пар оснований, содержащего модифицированный промотор бактериофага Т7, лактозный оперон, последовательность сайта посадки рибосомы и последовательности кодирующие стартовый кодон и шесть гистидинов.
EcoR I - BamH I фрагмент ДНК размером 57 пар оснований, содержащего сайт посадки рибосомы, стартовый ATG-кодон и последовательность, кодирующую шесть гистидинов.
Заявленный рекомбинантный белок OprF-aTox-OprI, закодированный в плазмиде рРА-OPRF-ATOX-OPRI имеет аминокислотную последовательность SEQ ID NO: 1.
На фиг. 1 представлена схема плазмиды pPA-OPRF-ATOX-OPRI. X - сайт рестрикции Xho I, Н - сайт рестрикции Hind III, oprF - последовательность, кодирующая OprF, I - последовательность, кодирующая первый домен экзотоксина А, II - последовательность, кодирующая второй домен экзотоксина А, ΔIII - последовательность, кодирующая третий делеционный домен экзотоксина A, oprI - последовательность, кодирующая OprI, 6His - последовательность, кодирующая шесть гистидинов, кан - ген устойчивости к канамицину.
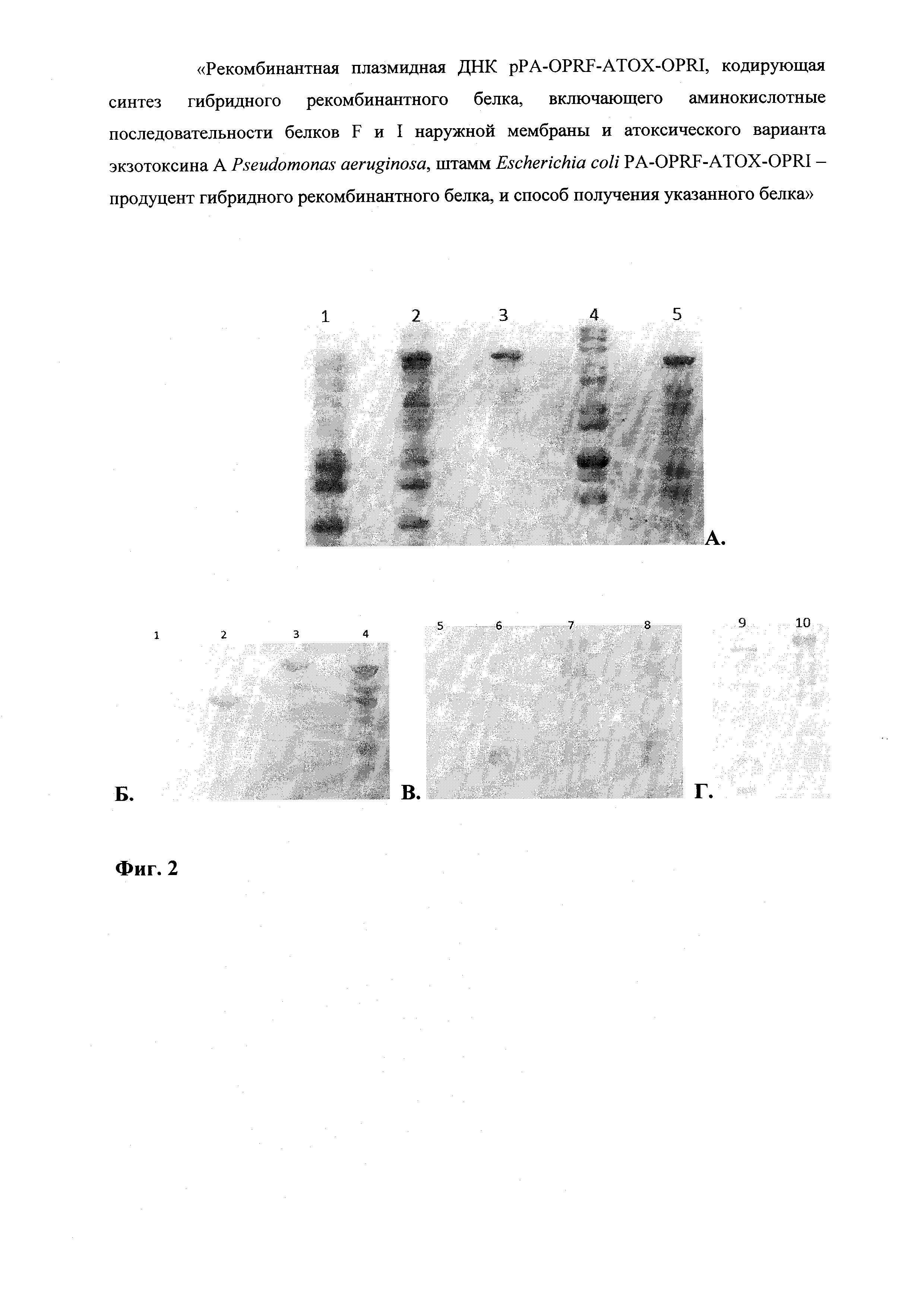
На фиг.2 представлен анализ белковых продуктов, полученных в результате экспрессии в клетках Е. coli последовательностей рекомбинантных генов, расположенных в плазмиде pPA-OPRF-ATOX-OPRI.
Фиг. 2А - ПААГ окрашенный Кумасси R-250, Фиг. 2Б - нитроцеллюлозная мембрана после иммуноблоттинга с сывороткой к рекомбинантному анатоксину, Фиг. 2В - нитроцеллюлозная мембрана после иммуноблоттинга с сывороткой к рекомбинантному белку OprF, Фиг. 2Г - нитроцеллюлозная мембрана после иммуноблоттинга с сывороткой к рекомбинантному OprI.
На фиг. 2А Треки: 1 - продукты не индуцированного продуцента рекомбинантного белка; 2 - продукты индуцированного продуцента рекомбинантного белка; 3 - очищенный гибридный рекомбинантный белок OprF-aTox-OprI; 4 - маркер молекулярной массы (#SM0661; тяжелые фрагменты 200, 150 и 120 кДа); 5 -очищенный гибридный рекомбинантный белок OprF-aTox.
На фиг. 2Б, В, Г Треки: 1, 5, 9 - биомасса исходных нетрансформированньгх клеток штамма BL21(DE3); 2 - рекомбинантный белок аТох; 3, 7, 10 - гибридный рекомбинантный белок OprF-aTox-OprI; 4, 8 - гибридный рекомбинантный белок OprF-aTox; 6 - рекомбинантный белок OprF
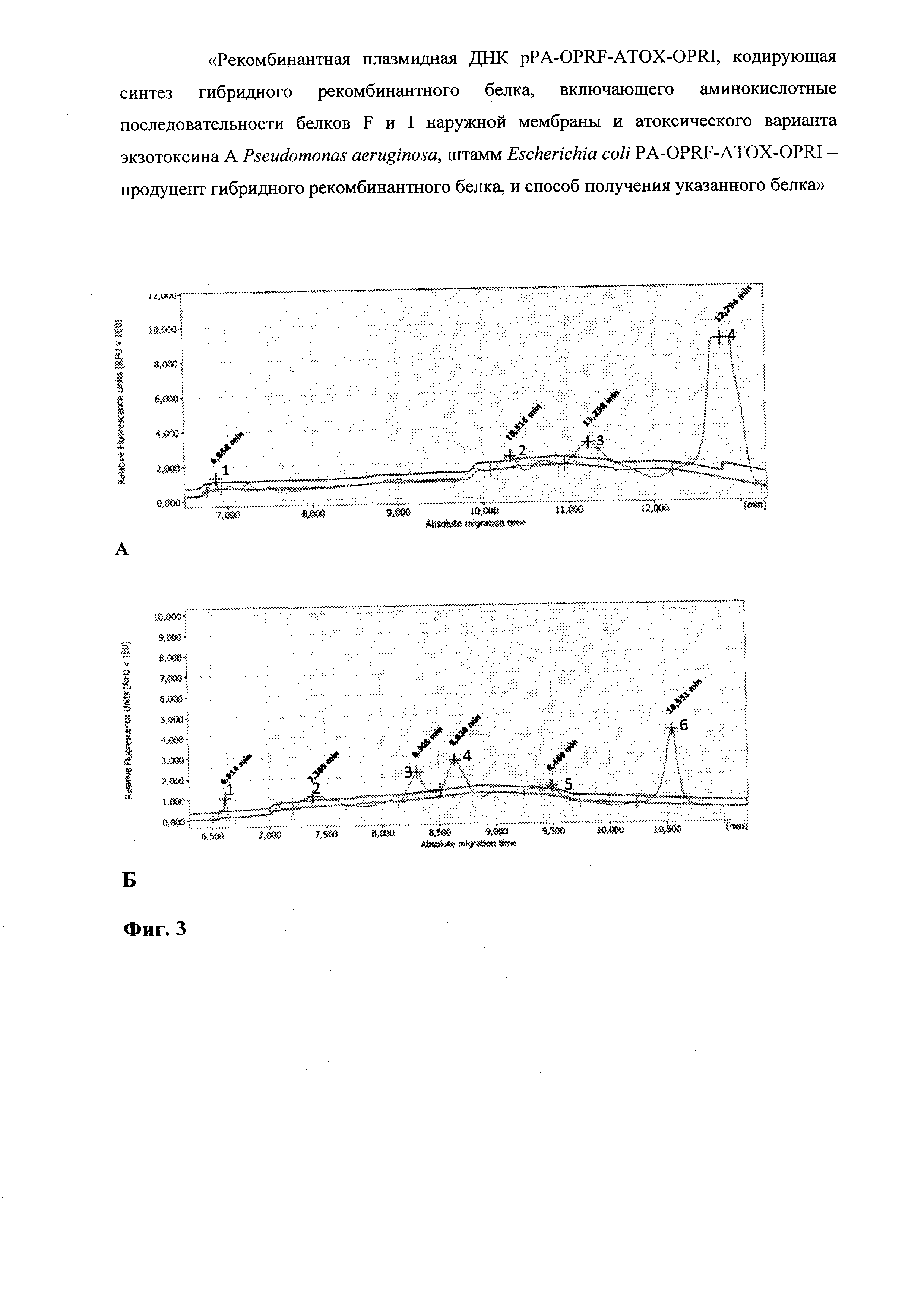
На фиг. 3 представлен анализ очищенного гибридного рекомбинантного белка OprF-aTox-OprI методом капиллярного электрофореза в сравнении с гибридным рекомбинантным белком OprF-aTox.
На фиг. 3А представлен капиллярный электрофорез гибридного рекомбинантного белка OprF-aTox-OprI. Процентное соотношение полипептидных фракций: Пик 1 - 0,3%; Пик 2 - 1%; Пик 3 - 2,3%; Пик 4 - 96,4% - искомый белок OprF-aTox OprI На фиг. 3Б представлен капиллярный электрофорез гибридного рекомбинантного белка OprF-aTox. Процентное соотношение полипептидных фракций: Пик 1 - 4,75%; Пик 2 - 13,79%; Пик 3 - 17,78%; Пик 4 - 22,47%; Пик 5 - 7,04%; Пик 6-34,17% -полноразмерный белок OprF-aTox.
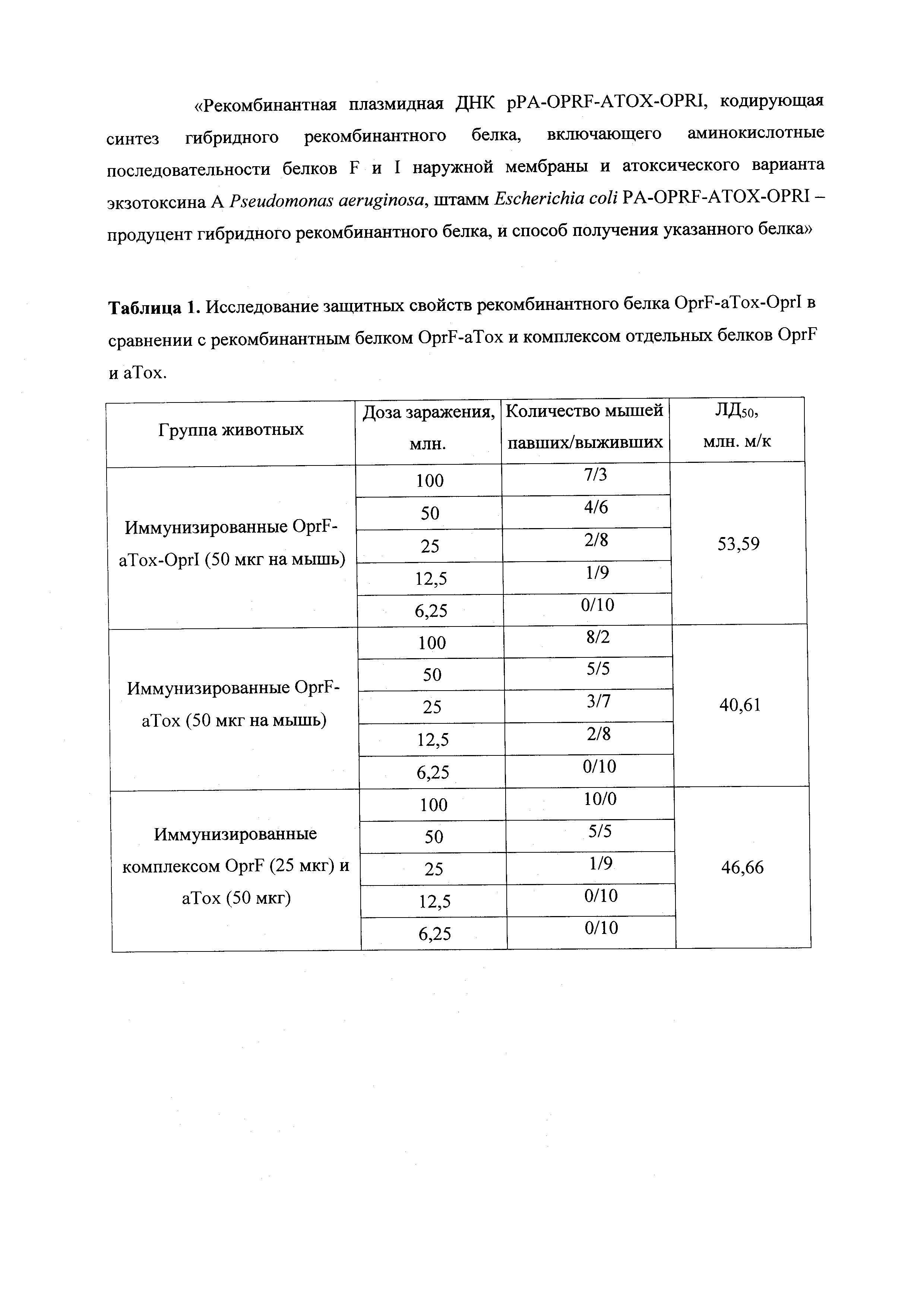
В таблице 1 представлены данные по анализу защитных свойств гибридного рекомбинантного белка OprF-aTox-OprI от живой вирулентной культуры P. aeruginosa штамма РА103 в сравнении с гибридным рекомбинантным белком OprF-aTox и комплексом из отдельных белков OprF и аТох.
Штамм Е. coli PA-OPRF-ATOX-OPRI получен трансформацией клеток родительского штамма Е. coli BL21(DE3), с использованием традиционной генно-инженерной технологии.
Штамм Е. coli PA-OPRF-ATOX-OPRI характеризуется следующими признаками: Культурально-морфологические признаки:
Клетки мелкие, прямые, утолщенной палочковидной формы, грамотрицательные, неспороносные.
Клетки хорошо растут на простых питательных средах. При росте на агаре «Дифко» колонии круглые, гладкие, выпуклые, мутные, блестящие, светло-бежевые, края ровные. При росте в жидких средах (на минимальной среде с глюкозой или LB-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки:
Аэроб. Температурный диапазон роста 4-42°С при оптимуме рН в пределах 6,5-7,5.
В качестве источника азота микроб использует минеральные соли в аммонийной и нитратной формах и органические соединения в виде аминокислот, пептона, триптона, дрожжевого экстракта и т.д.
В качестве источника углерода микроб использует аминокислоты, глицерин, углеводы. Клетки проявляют устойчивость к канамицину (до 100 мкг/мл).
Штамм Е. coli PA-OPRF-ATOX-OPRI - продуцент рекомбинантного белка OprF-aTox-Oprl.
Способ, условия и состав среды для хранения штамма:
LB-бульон с 10% глицерином и антибиотиками при -70°С в ампулах и в лиофилизированном состоянии в ампулах при 4°С.
Штамм Е. coli PA-OPRF-ATOX-OPRI идентифицирован по «Определителю Берги» (1974) как штамм вида Е. coli.
Особенностью заявляемого способа является разработка технологии, позволяющей получать комплексный высокоочищенный антиген P. aeruginosa сравнительно более простым способом и в более короткие сроки по сравнению с традиционными методами получения бактериальных белков. При этом в одном белковом препарате объединены поверхностные антигены, необходимые для стимуляции иммунитета против микробной клетки и анатоксин, необходимый для стимуляции иммунитета, с целью нейтрализации экзотоксина А. Объединение трех антигенов в одном белковом препарате способствует более унифицированному методу их получения.
Способ включает следующие этапы:
Культивирование в питательной среде штамма Е. coli PA-OPRF-ATOX-OPRI;
Осаждение биомассы центрифугированием;
Выделение «телец-включений»;
Разрушение «телец-включений» при растворении их в денатурирующем буфере, содержащем 8 М мочевину.
Очистка с помощью аффинной хроматографии на никель-активированных сорбентах;
Ренатурация очищенного рекомбинантного анатоксина с помощью ступенчатого диализа.
Оптимальными условиями проведения отдельных стадий получения рекомбинантного анатоксина являются следующие:
Получение препарата рекомбинантного белка OprF-aTox-OprI с использованием «телец-включений»;
Разрушение «телец-включений» осуществляют в результате растворения биомассы в 8 М буферном растворе мочевины;
Удаление нерастворимых компонентов клетки осуществляют центрифугированием;
Хроматографическую очистку проводят в 8 М буферном растворе мочевины, с использованием аффинного связывания рекомбинантного белка, который содержит дополнительную шести гистидиновую последовательность на N-конце;
Ренатурацию проводят при температуре 4°С путем ступенчатого диализа против физиологического раствора (0,9% NaCl).
Выход рекомбинантного белка OprF-aTox-OprI в результате применения способа в оптимальном режиме составляет не менее 7,7 мг очищенного рекомбинантного белка OprF-aTox-OprI с 1 л культуральной среды.
Сущность и преимущества заявляемой группы изобретений иллюстрируется следующими примерами.
Пример 1. Получение рекомбинантной плазмиды ДНК pPA-OPRF-ATOX-OPRI.
Основой для получения плазмиды ДНК pPA-OPRF-ATOX-OPRI служила плазмидная конструкция, предназначенная для экспрессии слитого рекомбинантного белка OprF-aTox P. aeruginosa (pPA-OPRF-ATOX) [26]. Данная конструкция представляла собой плазмиду рЕТ28(b) со встроенным по сайту рестрикции Hind III фрагментом ДНК, содержащим последовательность гена oprF и встроенным по сайтам Hind III и Xho I геном экзотоксина А P. aeruginosa с делецией области кодирующей 106 С-концевых аминокислотных остатков.
В качестве матрицы для получения гена oprI служила плазмидная конструкция, предназначенная для экспрессии рекомбинантного белка OprI [21]. При амплификации гена oprI с целью его встраивания в конструкцию с геном анатоксина использовалась следующая пара праймеров: 5'- ААССTCGAGCAGCAGCСАСТССAAAGAAАС и 5'-ТТССТСGAGТТАСТТGCGGCTGGCТТТТТСС. Первый праймер соответствовал 67-88 нуклеотидам последовательности гена oprI, а второй был комплементарен концу гена oprI. Оба праймера содержали на 5'-конце дополнительный сайт рестрикции Xho I (подчеркнут).
Процесс амплификации гена oprI состоял из следующих стадий: прогревания при 95°С в течение 3 минут; 35 циклов ПЦР (94°С - 30 секунд, 65°С - 30 сек, 72°С - 20 сек и инкубации при 72°С в течении 1 мин. ПЦР проводили при следующих реакционных условиях: 50 mM KCl, 10 mM Tris - HCl, 0,1% Triton Х-100, 1,5 mM MgCl, 0,120 mM dNTP, (рН 9,0). На 50 мкл реакционной смеси использовали 3 ед. TAQ-полимеразы (Fermentas) и 0,1 мкг геномной ДНК. Реакцию проводили в амплификаторе Palm Cycler (Corbett Research, Австралия).
Амплифицированную ДНК обработали рестриктазой Xho I. Одновременно этой же рестриктазой обработали плазмидную конструкцию, предназначенную для экспрессии слитого рекомбинантного белка OprF-aTox.
Оба рестрикта очищали в агарозном геле и объединили в одну конструкцию в результате реакции лигирования. В результате была получена рекомбинантная плазмида pPA-OPRF-ATOX-OPRI (фиг. 1). Аминокислотная последовательность рекомбинантного белка, полученная в результате трансляции встроенных слитых генов в плазмиде pPA-OPRF-ATOX-OPRI (осуществлялась в компьютерной программе OMIGA), представлена на втором рисунке (фиг. 2).
Пример 2. Получение штамма Е. coli PA-OPRF-ATOX-OPRI - продуцента рекомбинантного белка OprF-aTox-OprI.
Штамм-продуцент Е. coli PA-OPRF-ATOX-OPRI получали путем трансформации клеток родительского штамма Е. coli BL21(DE3) рекомбинантной плазмидой рРА-OPRF-ATOX-OPRI с последующим отбором рекомбинантных клонов на среде, содержащей канамицин (50 мкг/мл) при температуре 37°С.
Первичный отбор рекомбинантных плазмид проводили с использованием рестриктного анализа и секвенирования.
Далее отбор продуцентов проводили по способности контролируемого синтеза рекомбинантного белка в клетках. Для этого инокулировали бактериальной колонией 3 мл среды LB, содержащей канамицин в концентрации 50 мкг в мл. Выращивали в термостатированном шейкере со скоростью орбитального вращения 170 об/мин в течение 12-16 часов и температуре 37°С. Затем в 5 мл свежей среды вносили 250 мкл выросшей культуры и инкубировали в прежних условиях в течение 1,5-2 часа до достижения культурой активной фазы роста (0,6 оптических единиц при длине волны 600 нм). Добавляли 5 мкл 1 М водного раствора химического индуктора изопропил-β-d-тиогалактопиранозид (далее ИПТГ). Инкубацию продолжали в прежних условиях 3 часа, после чего осаждали полученную биомассу.
В качестве контроля использовали бактериальную культуру продуцента, инкубированную при тех же условиях, но без добавления ИПТГ. Белковые продукты анализировали электрофорезом в полиакриламидном геле по методу Лэммли.
В результате экспрессии конструкции pPA-OPRF-ATOX-OPRI в клетках Е. coli штамма BL21(DE3) наблюдался синтез рекомбинантного продукта с массой около 110 кДа (фиг. 3А). Расчетная масса рекомбинантного белка OprF-aTox-OprI составляла 107,2 кДа. Рекомбинантный белок имел на N-конце дополнительную аминокислотную последовательность, включающую шесть гистидиновых остатков для их очистки в колонках с Ni-сефарозой.
Пример 3. Получение препарата высокоочищенного рекомбинантного белка OprF-aTox-OprI из штамма Е. coli PA-OPRF-ATOX-OPRI.
Получение рекомбинантного белка OprF-aTox-OprI проводили в 4 этапа:
1 этап. Культивирование штамма Е. coli PA-OPRF-ATOX-OPRI с индукцией экспрессии рекомбинантного гена.
2 этап. Выделение «телец-включений»
3 этап. Хроматографическая очистка рекомбинантного белка OprF-aTox-OprI.
4 этап.Растворение и ренатурация рекомбинантного белка OprF-aTox-OprI.
Культивирование штамма Е. coli PA-OPRF-ATOX-OPRI с индукцией экспрессии рекомбинантного гена.
Выращивали посевной материал штамма Е. coli PA-OPRF-ATOX-OPRI в 1 л среды LB содержащей канамицин в концентрации 50 мкг в мл. Культивирование проводили течение 12 ч при температуре 37°С в термостатированном шейкере со скоростью орбитального вращения 170 об/мин.
Полученную культуру асептически вносили в лабораторный ферментер ФА-10 фирмы «Проинтех» с 10 л стерильной среды LB, содержащей канамицин в концентрации 50 мкг в мл. Выращивание в ферментере проводили при температуре 37°С, концентрации растворенного кислорода 30%, оборотов мешалки 300 об/мин.
При достижении плотности культуры 0,6 оптических единиц при длине волны 600 нм в ферментер вносили 10 мл 1 М водного раствора ИПТГ. Инкубацию продолжали в прежних условиях 3 часа.
Выделение «телец-включений»
Биомассу осаждали в центрифуге Beckman Avanti J-E (ротор JA-14) со скоростью вращения 4000 об/мин в течение 10 мин. Осадок собирали и растворяли в 300 мл фосфатного буфера (рН 7,2), содержащего 5 mM EDTA, 7 mМ β-меркаптоэтанола и обрабатывали ультразвуком (bight, 3 сек, 3 раза).
Полученный лизат центрифугировали на центрифуге Beckman Avanti J-E (ротор JA-14) 10000 об/мин при 4°С в течение 30 минут. Осадок собирали и растворяли в 300 мл следующего раствора: Tris-HCl (40 mM, рН 8,8), 10 mМ NaCl, 6 mМ MgCl2, 10 mМ СаСl2. К суспензии добавляли 3 мкл РНКазы А (10 мг/мл) и 15 мкл ДНКазы I. Повторно обрабатывали ультразвуком и инкубировали при 37°С в течение 15 минут. Осаждали на центрифуге Beckman Avanti J-E (ротор JA-14) 10000 об/мин при 4°С в течение 30 минут.
Осадок растворяли в 200 мл фосфатного буфера, содержащего 5 mM EDTA, 20% сахарозы и 1% Triton Х-100 и инкубировали 10 минут при 4°С. Затем центрифугировали в течение 30 минут при 10000 об/мин, 4°С. Процедуру повторяли дважды.
Хроматографическая очистка рекомбинантного белка OprF-aTox-OprI.
Полученный осадок растворяли в одном литре следующего раствора: 8 М мочевина; 0,1 M NaH2PO4; 0,01 М Tris-HCl; рН - 8,0. Растворение биомассы проводили в орбитальном шейкере при вращении 70 об/мин в течение 12 ч при комнатной температуре.
Затем осаждали нерастворимую фракцию в центрифуге Beckman Avanti J-E (ротор JA-14) со скоростью вращения 10000 об/мин при комнатной температуре в течение часа. Супернатант переносили в чистую стерильную колбу.
К супернатанту добавляли 20 мл суспензии Ni-агарозы (QIAGEN), и инкубировали 1 час на комнатной температуре в орбитальном шейкере при легком покачивании (60 об/мин).
Полученную суспензию пятью этапами пропускали через колонку для хроматографии (Bio-Rad) объемом 250 мл и диаметром 5 см. В результате из колонки удалялась жидкая фаза лизата, и оставался сорбент со связанным рекомбинантным белком.
Далее через колонку пропускали два литра промывочного первого раствора (8 М мочевина; 0,1 М NaH2PO4; 0,01 М Tris-HCl; рН - 6,3) и 500 мл второго отмывочного раствора (8 М мочевина; 0,1 М NaH2PO4; 0,01 М Tris-HCl; рН - 5,9).
Для элюции рекомбинантного белка через колонку пропускали элюционный раствор (8 М мочевина; 0,1 M NaH2PO4; 0,01 М Tris-HCl; рН - 4,5), собирая фракции, содержащие рекомбинантный белок. С аликвотами от собранных фракций проводили оценочный электрофорез в полиакриламидном геле.
Растворение и ренатурация рекомбинантного белка OprF-aTox-OprI. Ступенчатый диализ проводили при температуре 4°С, с использованием магнитной мешалки.
Диализный мешок, наполненный 100 мл хроматографически очищенного рекомбинантного белка, помещали в емкость, содержащую 1 литр следующего раствора: 6 М мочевина; физиологический раствор (0,9% NaCl). Через два часа поочередно меняли буферные растворы с содержанием 4, 2 и 1 М мочевины.
Затем в емкость для диализа наливали физиологический раствор (0,9% NaCl). Его трижды меняли каждые два часа.
Содержание белка в препарате определяли спектрофотометрически при длине волны 280 нм. При расчете концентрации рекомбинантных белков использовали коэффициент экстинкции 0.96, рассчитанный в программе OMIGA.
Препараты очищенного рекомбинантного белка OprF-aTox-OprI хранили в аликвотах по 10 мл в стерильных пробирках при -70°С.
Пример 4. Оценка чистоты и специфичности препарата рекомбинантного белка OprF-aTox-Oprl.
Оценку чистоты препарата рекомбинантного белка проводили визуально по окрашенному раствором Кумасси R-250 полиакриламидному гелю (фиг. 3А) и методом капиллярного электрофореза на приборе QIAxcel Advanced Sistem (Qiagen Германия).
В препарате очищенного рекомбинантного белка OprF-aTox-OprI отсутствовали примеси белков клеток-продуцента (фиг. 3А, трек 3). В результате капиллярного электрофореза выявлено, что выход гибридного рекомбинантного белка OprF-aTox-OprI составил 96,4%. При этом в препарате присутствовали примеси, которые визуально не были заметны при электрофорезе в ПААГ (фиг. 4Б).
Полноразмерный белок OprF-aTox, который синтезировался в результате экспрессии исходной плазмиды pPA-OPRF-ATOX, присутствовал в количестве 34,17%. Помимо основной фракции в препарате было несколько фракций укороченных вариантов рекомбинантного белка. В общей сложности выявлено шесть пиков в результате капиллярного электрофореза (фиг. 3А, трек 5 и фиг. 4Б).
Очищенный рекомбинантный белок OprF-aTox-OprI был специфичным в иммуноблоттинге при реакции с мышиной сывороткой против рекомбинантных белков OprF и OprI, а также против синегнойного анатоксина, в той же степени, что и с отдельными рекомбинантными белками, против которых были получены данные сыворотки (фиг. 3Б, В и Г).
Пример 5. Оценка защитных свойств рекомбинантного белка OprF-aTox-OprI.
Для оценки защитных свойств рекомбинантного белка OprF-aTox-OprI использовали живую вирулентную культуру P. aeruginosa штамма РА103, который характеризуется высоким уровнем синтеза экзотоксина А и подобен большинству штаммов, встречающихся в клинике.
Исследование рекомбинантного белка OprF-aTox-OprI проводили в сравнении с комплексом отдельных белков OprF и анатоксина, а также со слитым рекомбинантным белком OprF-aTox. Для этой цели сформировали три группы животных. Первая группа состояла из мышей, получавших инъекции по 50 мкг гибридного белка OprF-aTox-OprI. Второй группе животных вводили препарат слитого рекомбинантного белка OprF-aTox в дозе 50 мкг на мышь. Третью группу животных иммунизировали комплексом из отдельных рекомбинантных белков OprF (25 мкг) и анатоксина (50 мкг). Препараты белков вводили двукратно с двухнедельным интервалом. Через две недели после курса иммунизации мышам вводили различные дозы (от 6,25 до 100 млн. микробных клеток) живой вирулентной культуры P. aeruginosa. Подсчет погибших и выживших животных проводили в течение семи последующих дней (табл.1). Для группы животных, иммунизированных слитым белком OprF-aTox-OprI ЛД50 составил 53,59 млн. м.к.; мышей иммунизированных слитым белком OprF-aTox - 40,61 млн. м.к.; комплексом белков OprF и анатоксина - 46,66 млн. м.к.
Ссылки.
1. Зверев В.В., Бойченко М.Н. Медицинская микробиология, вирусология и иммунология. В 2-х т. Том 2: учеб. пособие для студентов учреждений высшего профессионального образования М.: ГЭОТАР-Медиа, 2010. - С. 480
2. Мороз А.Ф., Констанинов Б.А., Анциферова Н.Г., Радкевич С.А., Ковырялкина О.В. Применение поливалентной синегнойной вакцины для профилактики послеоперационных гнойно-септических осложнений в кардиохирургии // Современная госпитальная инфекция. Тезисы докладов. Л., - 1980, - С. 92.
3. Мороз А.Ф. Применение поливалентной вакцины с защитным эффектом против Pseudomonas aeruginosa // I Всесоюзная конференция по ранам и раневой инфекции. М., - 1977, - С. 73-74.
4. Титова Т.И., Сидорова Т.Н., Радкевич С.А. и др. Получение и изучение свойств поливалентной корпускулярной синегнойной вакцины // Журн. микробиол. - 1985. - №8. - С. 80-84
5. Станиславский Е.С., Joo I. Вакцины против Pseudomonas aeruginosa инфекции: итоги и перспективы исследований // Бактериальные антигены, Сборник трудов - Москва, - 1982. - С.3-14.
6. Станиславский Е.С., Joo I., Северцева М.К. и др. Иммунологическая эффективность и безвредность в эксперименте пиоиммуногена-вакцины против инфекции Pseudomonas aeruginosa II Журн. микробиол. - 1982. - №5. - С. 70-75
7. Бандман О.А., Едвабная Л.С., Булк В.Ф. и др. Бесклеточная вакцина псевдомонас: иммунохимическая характеристика и иммуногенность // Журн. микробиол. - 1987. - №11. - С. 44-47.
8. Едвабная Л.С., Зайднер И.Г., Макаренко Т.А. и др. Белковые протективные антигены Pseudomonas aeruginosa // Журн. микробиол. - 1985. - №11. - С. 18-23.
9. Макаренко Т.А., Балаян С.С, Сергиенко А.И. и др. Иммунологический ответ у доноров-добровольцев, иммунизированных вакциной псевдомонас // Журн. микробиол. - 1991.-№11.-С.39-41.
10. Макаренко Т.А., Станиславский Е.С. Иммунологическое изучение белков клеточной стенки Pseudomonas aeruginosa // Журн. микробиол. - 1996. - №2. - С. 7-9.
11. Пат. 1410527 С СССР, С12Р 1/04. Способ получения экзотоксина А синегнойной палочки // Н.А. Михайлова, Т.Н. Кузнецова, Ф.А. Шаймухаметов, А.Ф. Мороз, И.А. Баснакьян. - Заявл. 10.09.86; Опубл. 09.06.95 // БИПМ. - 1995,
12. Пат. 1481962 С СССР, А61К 35/74. Способ обезвреживания очищенного экзотоксина А синегнойной палочки // Н.А. Михайлова, Ф.А. Шаймухаметов, Т.Н. Кузнецова, А.Ф. Мороз. - Заявл. 15.07.87; Опубл. 09.06.95 // БИПМ. - 1995.
13. Lee NG, Jung SB, Ahn BY, Kim YH, Kim JJ, Kim DK, Kim IS, Yoon SM, Nam SW, Kim HS, Park WJ. Immunization of burn-patients with a Pseudomonas aeruginosa outer membrane protein vaccine elicits antibodies with protective efficacy // Vaccine - 2000 - №18 - P. 1952-1961.
14. Получение рекомбинантного I наружной мембраны Pseudomonas aeruginosa и оценка его антигенных свойств / Гатыпова Е.В. [и др.] //: Ж. микробиологии, эпидемиологии и иммунологии. - М., 2008. - N 6. - С. 50-53
15. Гатыпова Е.В. Получение рекомбинантных белков OprL и OprI наружной мембраны Pseudomonas aeruginosa и исследование их иммунобиологических свойств, диссертация на соискание ученой степени кандидата биологических наук, Москва, 2009, 116 с.
16. Liu P. V. Exotoxins of Pseudomonas aeruginosa. I. Factors that influence the production of exotoxin A. J. Infect. Dis. 1986 128:506-513.
17. Allured V.S., Collier R.J., Carroll S.F. and McKay D.B. Structure of exotoxin A of Pseudomonas aeruginosa at 3 A angstrom resolution. Proc Natl Acad Sci USA, 1986, 83: 1320-1324.
18. Armstrong S., Yates S.P. and Merrill A.R. Insight into the Catalytic Mechanism of Pseudomonas aeruginosa Exotoxin A. The journal of biological chemistry, 2002, Vol. 277, No. 48, Issue of November 29, pp. 46669-46675.
19. Бодрова Г.Н. Получение и изучение активности антитоксической противосинегнойной плазмы. Диссертация на соискание уч. степ. канд. мед. наук. 1997.
20. Михайлова Н.А., Кузнецова Т.Н., Шаймухаметов Ф.А., Мороз А.Ф. и Баснакьян И.А. Пат. 1410527 С СССР, С12Р 1/04. Заявл. 10.09.86; Опубл. 09.06.95.
21. Михайлова Н.А., Шаймухаметов Ф.А., Кузнецова Т.Н., Мороз А.Ф. Пат. 1481962 С СССР А61К 35/74. Способ обезвреживания очищенного экзотоксина А синегнойной палочки. Заявл. 15.07.87; Опубл. 09.06.95.
22. Подгорная Л.Г., Дзюбан Н.Ф. Антигенные свойства анатоксина синегнойнолй палочки и протективное действие антитоксической противосинегнойной сыворотки. Ж. микроб. 1986, №6 67-69.
23. Kaloshin А.А., Gatypova E.V., Mikhailova N.A. Obtaining Recombinant Forms of the Outer Membrane Protein F of Pseudomonas aeruginosa and Assessment of Their Immunogenic Properties. Applied Biochemistry and Microbiology, 2011, 47(8):780-788.
24. Исаков M.A., Калошин A.A., Михайлова Н.А. Получение рекомбинантного экзотоксина A Pseudomonas aeruginosa. Биотехнология. 2009, №3, с. 29-33.
25. Исаков М.А., Солдатенкова А.В, Калошин А.А., Михайлова Н.А. Изучение иммунобиологических свойств рекомбинантных атоксичных форм экзотоксина A Pseudomonas aeruginosa. Журнал микробиологии, эпидемиологии и иммунобиологии. 2011. №.2, с. 37-42.
26. Калошин А.А., Солдатенкова А.В., Михайлова Н.А. Пат. 2529359 Российская Федерация, МПК 2529359 С2. Рекомбинантная плазмидная ДНК рРА-OPRF-ETA, кодирующая синтез рекомбинантного белка OPRF-ETA Pseudomonas aeruginosa, штамм Escherichia coli PA OPRF-ETA- продуцент рекомбинантного белка OPRF-ETA Pseudomonas aeruginosa и способ получения рекомбинантного белка OPRF-ETA Pseudomonas aeruginosa. Заявл. 19.09.2012; Опубл. 27.03.2014, Бюл. №9 - 2 с.
27. Калошин А.А., Михайлова Н.А. Пат. 2537006 Российская Федерация, МПК 2537006 С2. Рекомбинантная плазмидная ДНК pPA-OPRFI, кодирующая гибридный рекомбинантный белок F-I наружной мембраны Pseudomonas aeruginosa, штамм Escherichia coli PA- OPRFI-продуцент гибридного рекомбинантного белка F-I наружной мембраны Pseudomonas aeruginosa и способ получения гибридного рекомбинантного белка F-I наружной мембраны Pseudomonas aeruginosa. Заявл. 25.10.2011; Опубл. 27.12.2014, Бюл. №36 - 13 с.
К заявке «Рекомбинантная плазмидная ДНК pPA-OPRF-ATOX-OPRI, кодирующая синтез гибридного рекомбинантного белка, включающего аминокислотные последовательности белков F и I наружной мембраны и атоксического варианта экзотоксина A Pseudomonas aeruginosa, штамм Escherichia coli PA-OPRF-ATOX-OPRI -продуцент гибридного рекомбинантного белка, и способ получения указанного белка»
Аминокислотная последовательность рекомбинантного белка OprF-aTox-OprI P. aeruginosa SEQ ID NO: 1