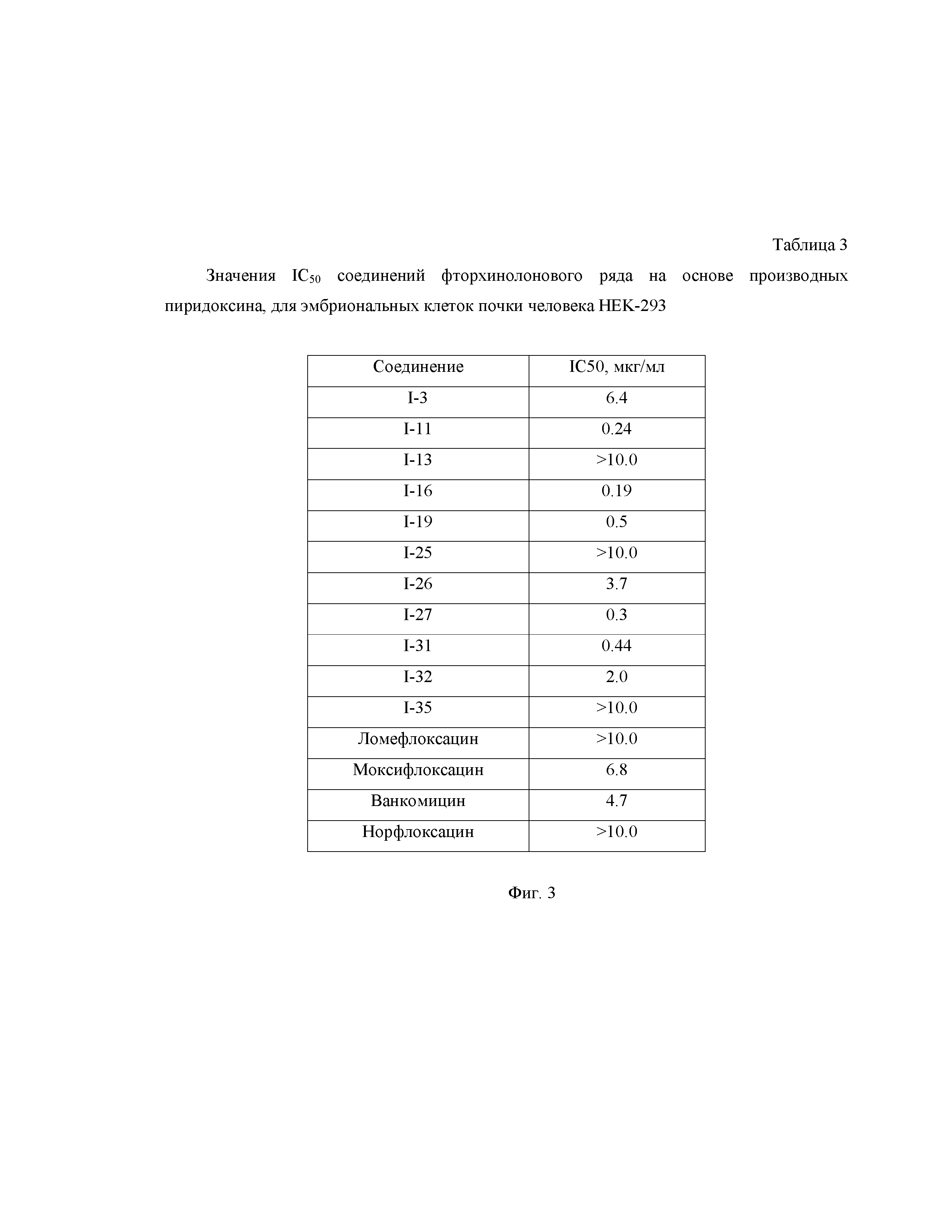Результат интеллектуальной деятельности: Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами
Вид РИД
Изобретение
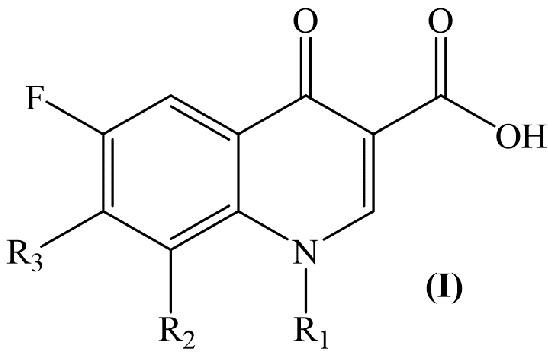
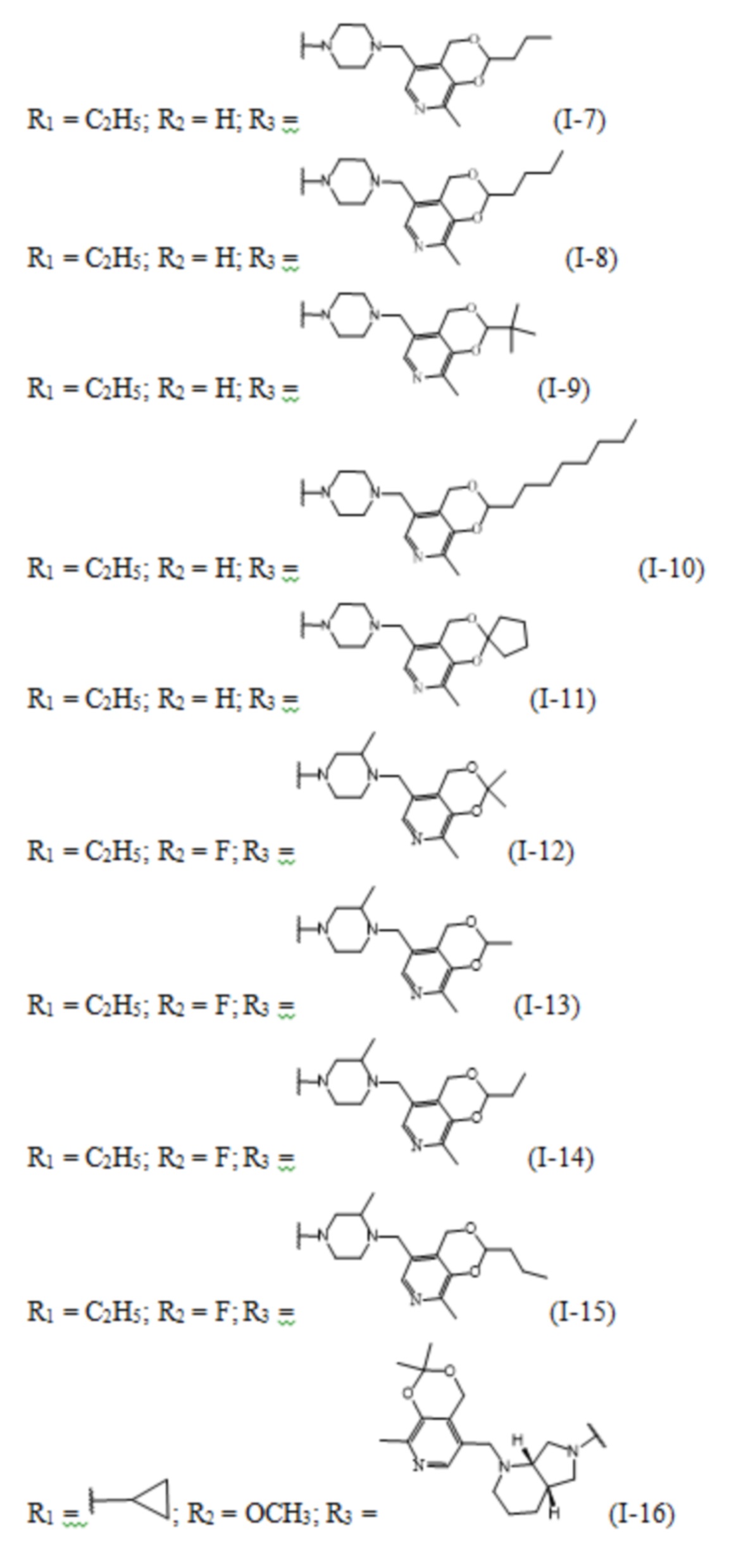
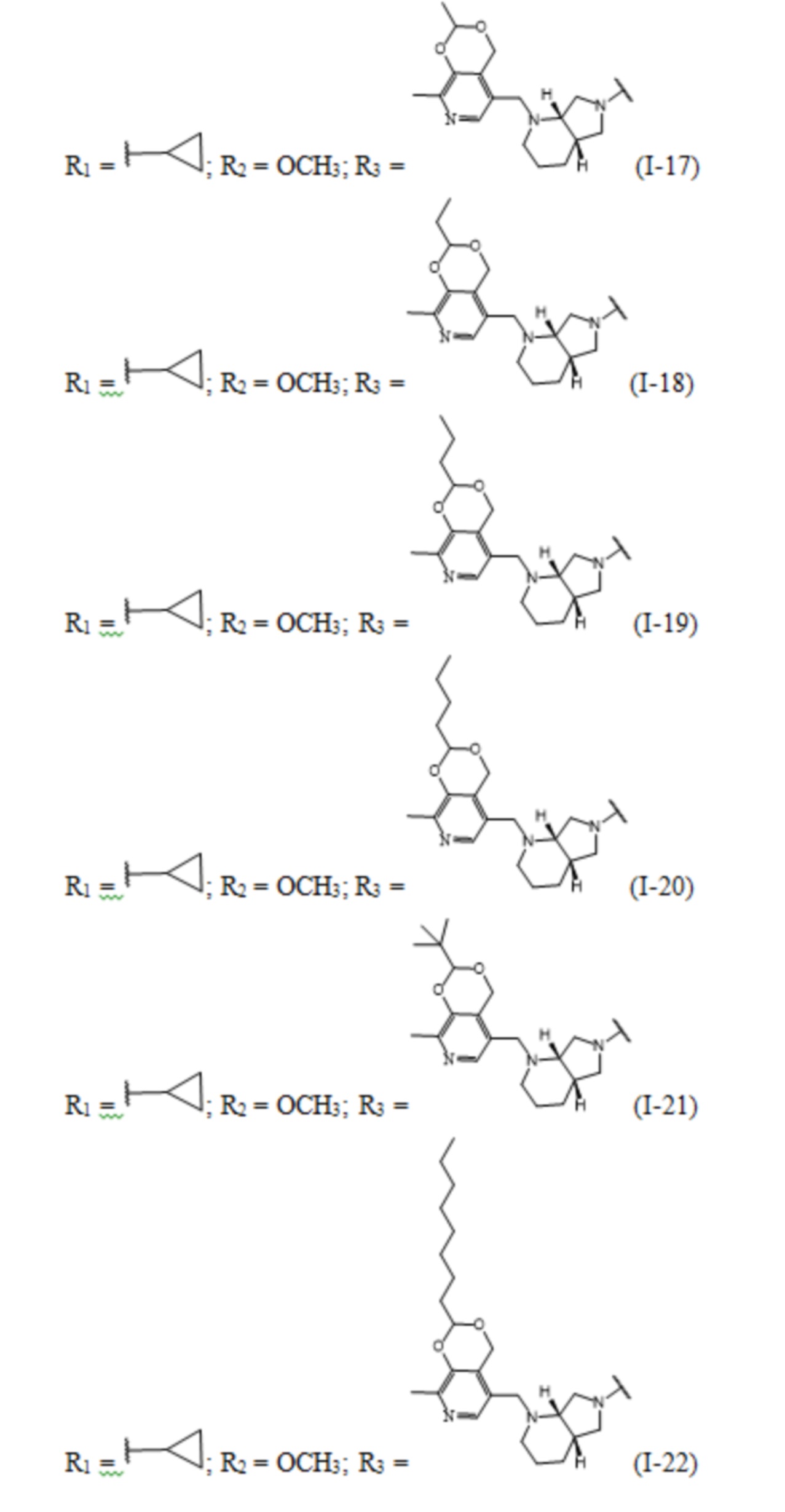
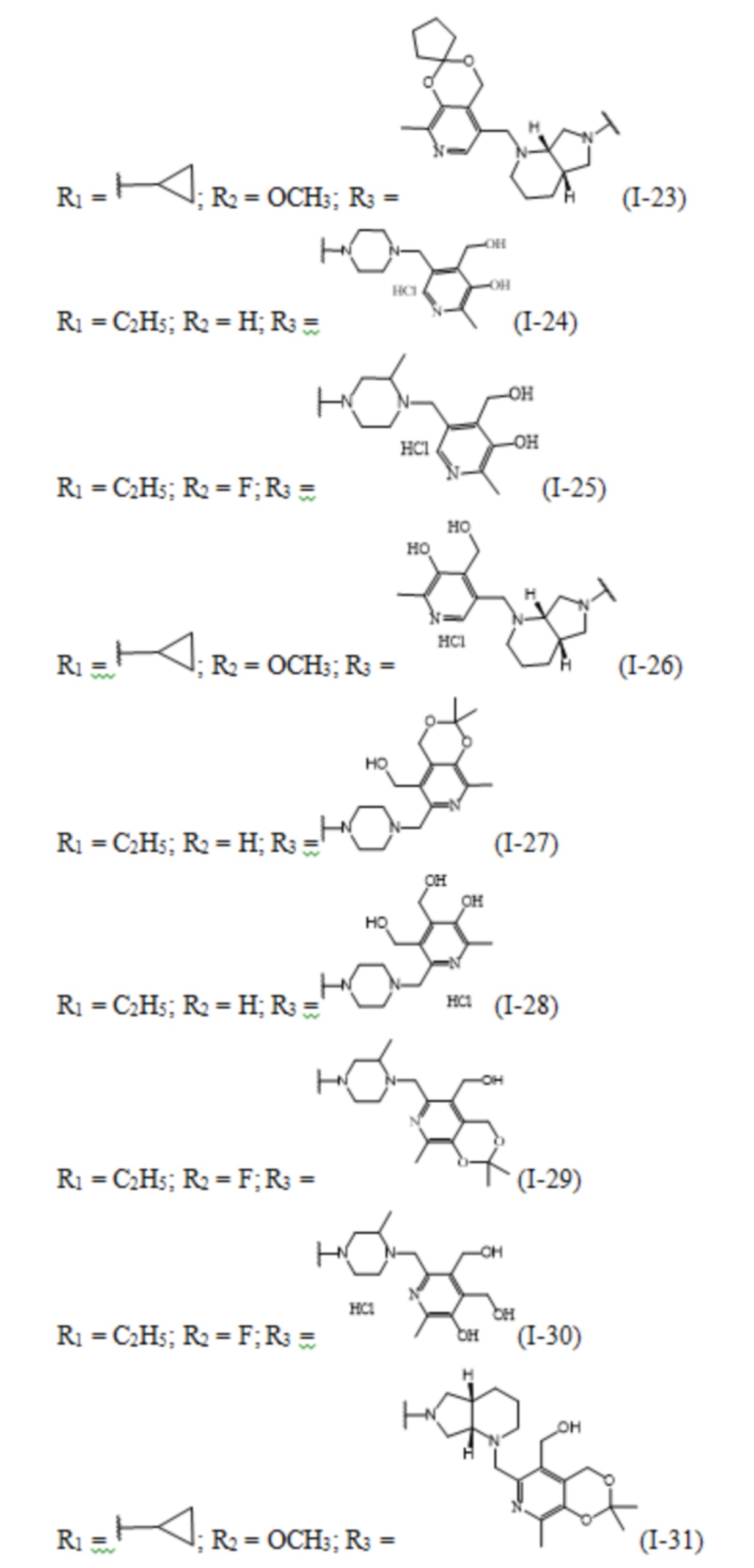
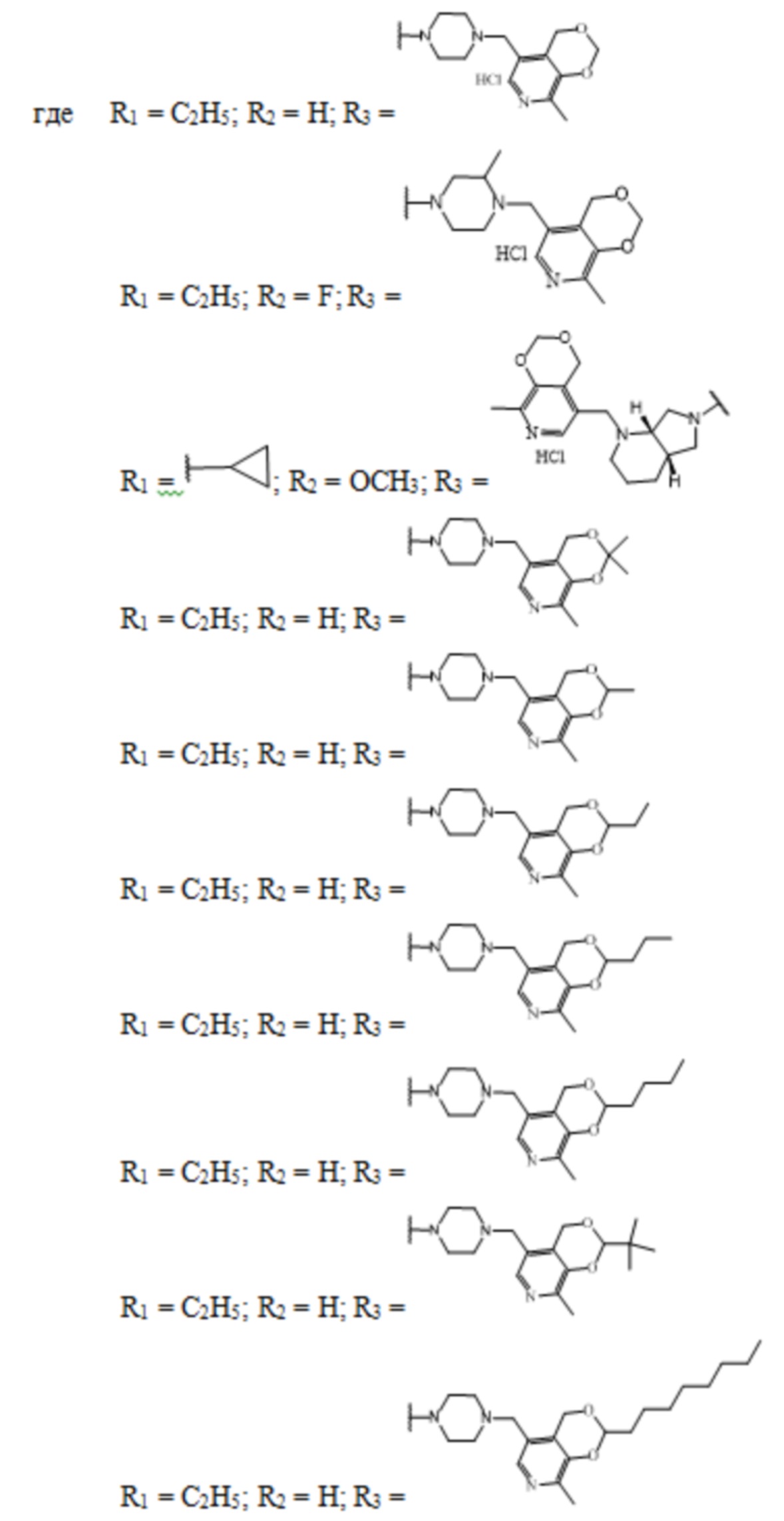
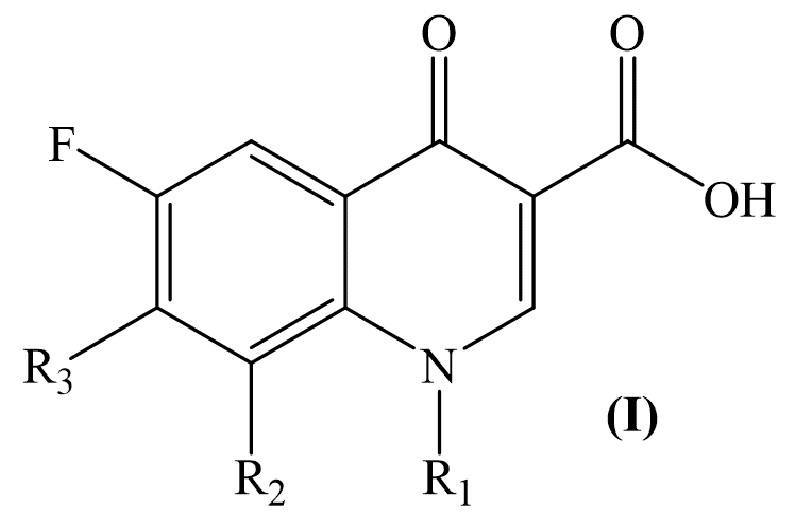
Изобретение относится к химии органических гетероциклических соединений, а именно – к новым соединениям фторхинолонового ряда на основе производных пиридоксина общей формулы (I), проявляющим антибактериальные свойства. Соединения могут найти применение в медицине и ветеринарии.


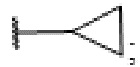
Патогенные микроорганизмы являются одной из основных причин возникновения локальных и системных инфекций. В последние годы наблюдается заметный рост числа и распространенности инфекционных заболеваний, обусловленных появлением новых высоковирулентных штаммов микроорганизмов и повышением их резистентности к существующим антибиотикам. Несмотря на наличие эпизодически возникающих острых бактериальных и вирусных инфекций, одной из основных причин смертности в развитых странах остаются хорошо известные бактерии - стафилококк золотистый, кишечная и синегнойная палочки. В частности, по данным ВОЗ, золотистый стафилококк возглавляет список бактерий, которыми наиболее часто заражаются в медицинских учреждениях. Особую опасность для человека представляют метициллин-устойчивые штаммы золотистого стафилококка, которые вызывают сепсис и тяжелые формы инфекций кожи и мягких тканей (фурункулезы, флегмона, синдром ошпаренной кожи), являясь причиной гибели до 31% зараженных ими пациентов.
Одним из наиболее эффективных классов антибактериальных препаратов, использующихся в современной практике, являются фторхинолоны. Фторхинолоны отличаются широким спектром антимикробного действия, включая стафилококки, высокой бактерицидной активностью и хорошей фармакокинетикой, что позволяет применять их для лечения инфекций различной локализации. Наличие у ряда препаратов лекарственных форм для внутривенного введения и приема внутрь, в сочетании с высокой биодоступностью, позволяет проводить ступенчатую терапию, которая, при сопоставимой клинической эффективности, существенно дешевле парентеральной.
Из препаратов группы фторхинолонов следует выделить: гатифлоксацин, ломефлоксацин, офлоксацин, ципрофлоксацин, левофлоксацин, спарфлоксацин и моксифлоксацин, которые входят в Перечень жизненно необходимых и важнейших лекарственных препаратов РФ [Распоряжение правительства РФ № 2738-р от 10.12.2018, с 63-64].
Ломефлоксацин - антибактериальное средство группы фторхинолонов II поколения. Воздействует на бактериальный фермент ДНК-гиразу, обеспечивающую сверхспирализацию, образует комплекс с её тетрамером (субъединицы гиразы А2В2) и нарушает транскрипцию и репликацию ДНК, приводит к гибели микробной клетки. Активен в отношении широкого ряда грамотрицательных аэробных микроорганизмов: Citrobacter diversus, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Moraxella catarrhalis, Proteus mirabilis, Pseudomonas aeruginosa (только для инфекций мочевыводящих путей) и др.; грамположительных аэробных микроорганизмов: Staphylococcus aureus (включая метициллин-устойчивые штаммы), Staphylococcus epidermidis (включая метициллин-устойчивые штаммы). Также ломефлоксацин активен в отношении бактерий, которые продуцируют бета-лактамазы [Яковлев В.П. Антибактериальные препараты группы фторхинолонов // Рус. мед. журн. – 1997. – Вып. 5. – С. 1405-1413.].
Ломефлоксацин применяют при инфекциях мочевыводящих путей (в том числе профилактике инфекции до и после трансуретральных хирургических вмешательств): цистите, пиелонефрите, уретрите; при инфекциях ЖКТ (дизентерия, брюшной тиф, сальмонеллез, холера) и желчевыводящих путей; инфекциях органов дыхания (в т.ч. обострение хронического бронхита); гнойных инфекциях кожи и мягких тканей, инфицированных ран, ожогов, гонореи, хламидиозе (в т.ч. хламидийном конъюнктивите и блефароконъюнктивите), простатите, остеомиелите; бактериальных инфекциях переднего отдела глаза: конъюнктивите, блефарите, блефароконъюнктивите, в т.ч. хламидийной этиологии [Sárközy G. Quinolones: a class of antimicrobial agents // Vet. Med. – 2001. – V. 46. – P. 257–274].
Существенным недостатком ломефлоксацина является ограничение приема по возрасту – противопоказано назначение этого препарата детям и подросткам, так как он вызывает нарушение роста [Белобородова Н.В., Падейская Е.Н., Бирюков А.В. Фторхинолоны в педиатрии - за и против // Педиатрия – 1996. – Вып. 2. – С. 76-84.].
Так же к недостаткам ломефлоксацина относят и довольно часто встречающиеся побочные проявления действия препарата – боль в животе, тошнота, дисбактериоз, бессонница, головокружение, проявление аллергических реакций (отек Квинке, крапивница, зуд), фотосенсибилизация а также запрет на его употребление в период беременности и лактации [Norrby S.R. Side-effects of quinolones: comparisons between quinolones and other antibiotics // Eur. J. Clin. Microbiol. Infect. Dis. – 1991. – V. 10. – P. 378-383].
Норфлоксацин - антибактериальное средство группы фторхинолонов II поколения. Ингибирует бактериальную ДНК-гиразу, нарушает синтез ДНК белков, что приводит к гибели бактерий. Норфлоксацин активен в отношении большинства штаммов аэробных грамположительных бактерий - Enterococcus faecalis, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Streptococcus agalactiae, аэробные грамотрицательных бактерий — Citrobacter freundii, Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Neisseria gonorrhoeae, Proteus mirabilis, Proteus vulgaris, Pseudomonas aeruginosa, Serratia marcescens [Яковлев В.П. Антибактериальные препараты группы фторхинолонов // Рус. мед. журн. – 1997. – Вып. 5. – С. 1405-1413].
Норфлоксацин применяется при острых и хронических инфекциях мочевыводящих путей (неосложненных и осложненных), вызванных чувствительными к препарату возбудителями.
К недостатком норфлоксацина можно отнести побочные действия препарата - тошноту, понос, головную боль, чувство усталости, сонливость. К настоящему времени к норфлоксацину резистентны большинство стафилококков, стрептококков и энтерококков [Rubinstein E. History of Quinolones and Their Side Effects // Chemotherapy – 2001. – V. 47. – P. 3–8].
Моксифлоксацин - антибактериальное средство группы фторхинолонов IV поколения. Ингибирует топоизомеразу II (ДНК-гираза) и топоизомеразу IV - ферменты, необходимые для репликации, транскрипции, репарации и рекомбинации бактериальной ДНК. Нарушает синтез ДНК микробной клетки, оказывает бактерицидное действие. Проявляет активность в отношении широкого спектра грамположительных и грамотрицательных микроорганизмов, анаэробных, кислотоустойчивых и атипичных бактерий: Mycoplasma spp., Chlamydia spp., Legionella spp. Эффективен в отношении бактериальных штаммов, резистентных к бета-лактамным антибиотикам имакролидам. Активен в отношении большинства штаммов микроорганизмов: грамположительных - Staphylococcus aureus (включая штаммы, нечувствительные к метициллину), Streptococcus pneumoniae (включая штаммы, устойчивые к пенициллину и макролидам); грамотрицательные - Haemophilus influenzae (включая как продуцирующие, так и не продуцирующие бета-лактамазу штаммы), Haemophilus parainfluenzae, Klebsiella pneumoniae, Moraxella catarrhalis (включая как продуцирующие, так и не продуцирующие бета-лактамазу штаммы), Escherichia coli, Enterobacter cloacae; атипичные - Chlamydia pneumoniae, Mycoplasma pneumoniae [Keating G.M., Scott L.J. Moxifloxacin A Review of its Use in the Management of Bacterial Infections // Drugs – 2004. – V. 64. – P. 2347-2377].
Применяется моксифлоксацин при инфекциях верхних и нижних дыхательных путей: остром синусите, обострениях хронического бронхита, внебольничной пневмонии; инфекциях кожи и мягких тканей.
Побочные эффекты у моксифлоксацина выражены редко, тем не менее иногда наблюдаются случаи тошноты, диареи и головокружения. Также необходимо отметить высокую (на порядок) стоимость моксифлоксацина в сравнении с фторхинолонами II поколения [Ball P., Stahlmann R., Kubin R., Choudhri S., Owens R. Safety profile of oral and intravenous moxifloxacin: Cumulative data from clinical trials and postmarketing studies // Clinical Therapeutics – 2004. – V. 26. – P. 940-950].
Исследование взаимоотношений структура-биологическая активность в ряду производных фторхинолонов выявило, что наибольшее влияние на их биологическое действие оказывает природа заместителя при атоме С-7. Наиболее часто в качестве таких заместителей оказываются пяти- и шестичленные азотсодержащие гетероциклы, такие как пиперазин, пиримидин, 1,2,3-триазол, пирролидин и их замещенные производные [Emamia S., Shafiee A., Foroumadi A. Quinolones: Recent Structural and Clinical Developments // Iran. J. Pharm. Res. – 2005. – V. – P. 123-136].
В статье [Gamal El-Din A.A. Abuo-Rahma, Sarhan H.A., Gamal F.M. Gad. Design, synthesis, antibacterial activity and physicochemical parameters of novel N-4-piperazinyl derivatives of norfloxacin // Bioorg. Med. Chem. – 2009. – V. 17 – P. 3879–3886] описаны производные норфлоксацина, модифицированные по атому азота пиперазинового кольца в реакции Манниха. Данные производные обладали существенно большей антибактериальной активностью по отношению к штаммам P. aeruginosa, E. coli, K. pneumonia и S. aureus чем норфлоксацин.
В статье [McPherson J. C. III, Runner R., Buxton T. B., Hartmann J. F., Farcasiu D., Bereczki I., Roth E., Tollas S., Ostorházi E., Rozgonyi F., Herczegh P. Synthesis of osteotropic hydroxybisphosphonate derivatives of fluoroquinolone antibacterials // Eur. J. Med. Chem. – 2012. – V. 47. – P. 615-618] предложено эффективное использование бисфонатов фторхинолонов, полученных модификацией пиперазинового атома азота, показывающие возможность направленной доставки антимикробных агентов для лечения инфекций костной ткани.
В заявке на патент [US2012322766. Use of oxazolidinone-quinoline hybrid antibiotics for the treatment of anthrax and other infections . Опубл.- 20.12.2012] описаны «гибридные» фторхинолоны, модифицированные по атому С-7 хинолонового кольца фрагментами оксазалидинонов эффективные в лечении сибирской язвы и других инфекционных заболеваний.
В патенте [РФ № 2636761 «Антибактериальные средства на основе производных ципрофлоксацина», опубл. 01.12.2017] описаны производные ципрофлоксацина, модифицированные по атому С-7 хинолонового кольца фрагментами производных пиридоксина (витамина В6). Полученные соединения проявили сопоставимую с ципрофлоксацином антибактериальную активность в отношении грамположительных бактерий, однако их активность в отношении грамотрицательных бактерий была существенно ниже.
В патенте [РФ №2634122 «Фторхинолоны на основе 4-дезоксипиридоксина», опубл. 24.10.2017] описаны производные фторхинолонов, содержащие в качестве заместителя при атоме C-7 хинолонового кольца фрагмент 4-дезоксипиридоксина, антагониста витамина В6. Полученные соединения проявили сопоставимую с моксифлоксацином и ципрофлоксацином антибактериальную активность.
Задачей заявленного технического решения является создание новых соединений фторхинолонового ряда на основе производных пиридоксина - норфлоксацина, моксифлоксацина и ломефлоксацина, обладающих антибактериальной активностью, с целью расширения арсенала известных средств указанного назначения.
Технический результат заявленного технического решения - новые соединения общей формулы (I), содержащие в своем составе как фрагмент природного соединения (пиридоксина, входящего в группу витамина В6), так и фрагмент препарата фторхинолонового ряда, и обладающие антибактериальной активностью:

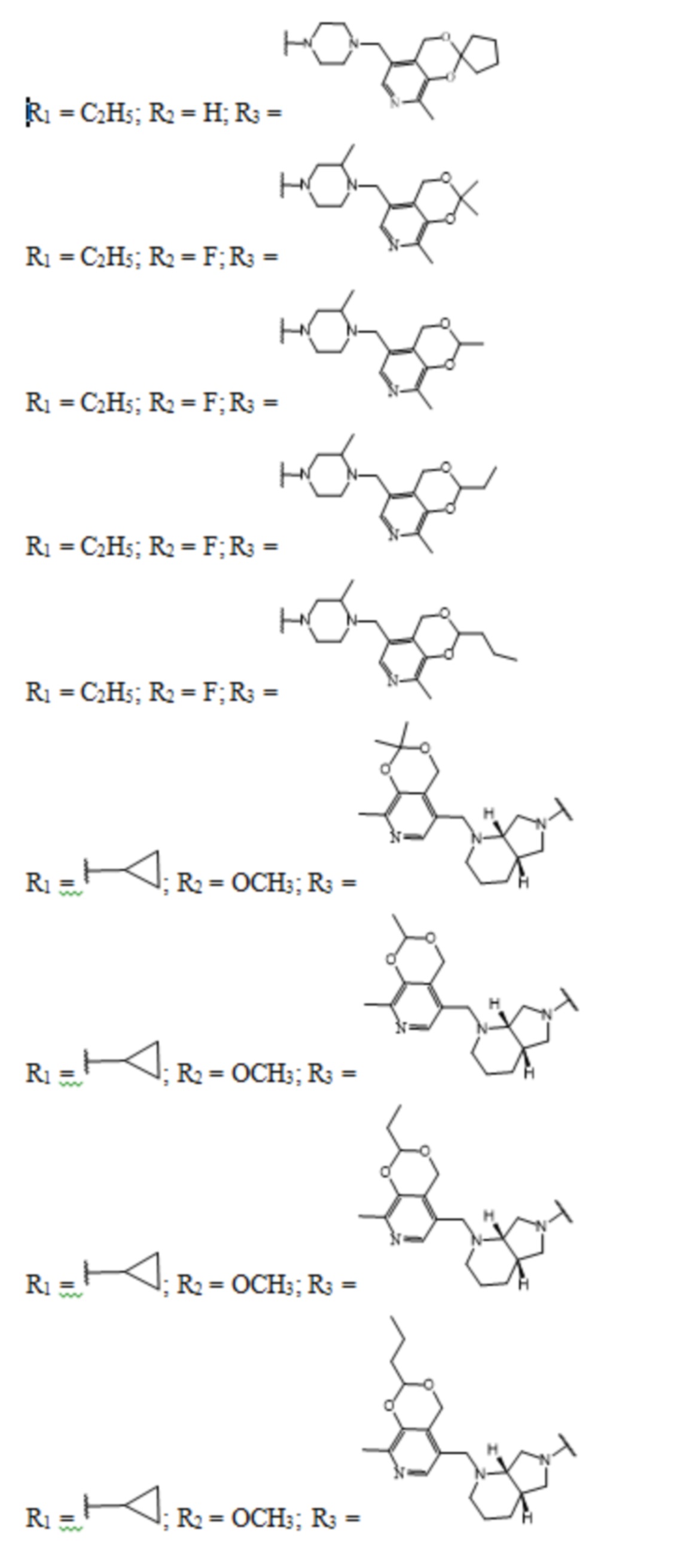

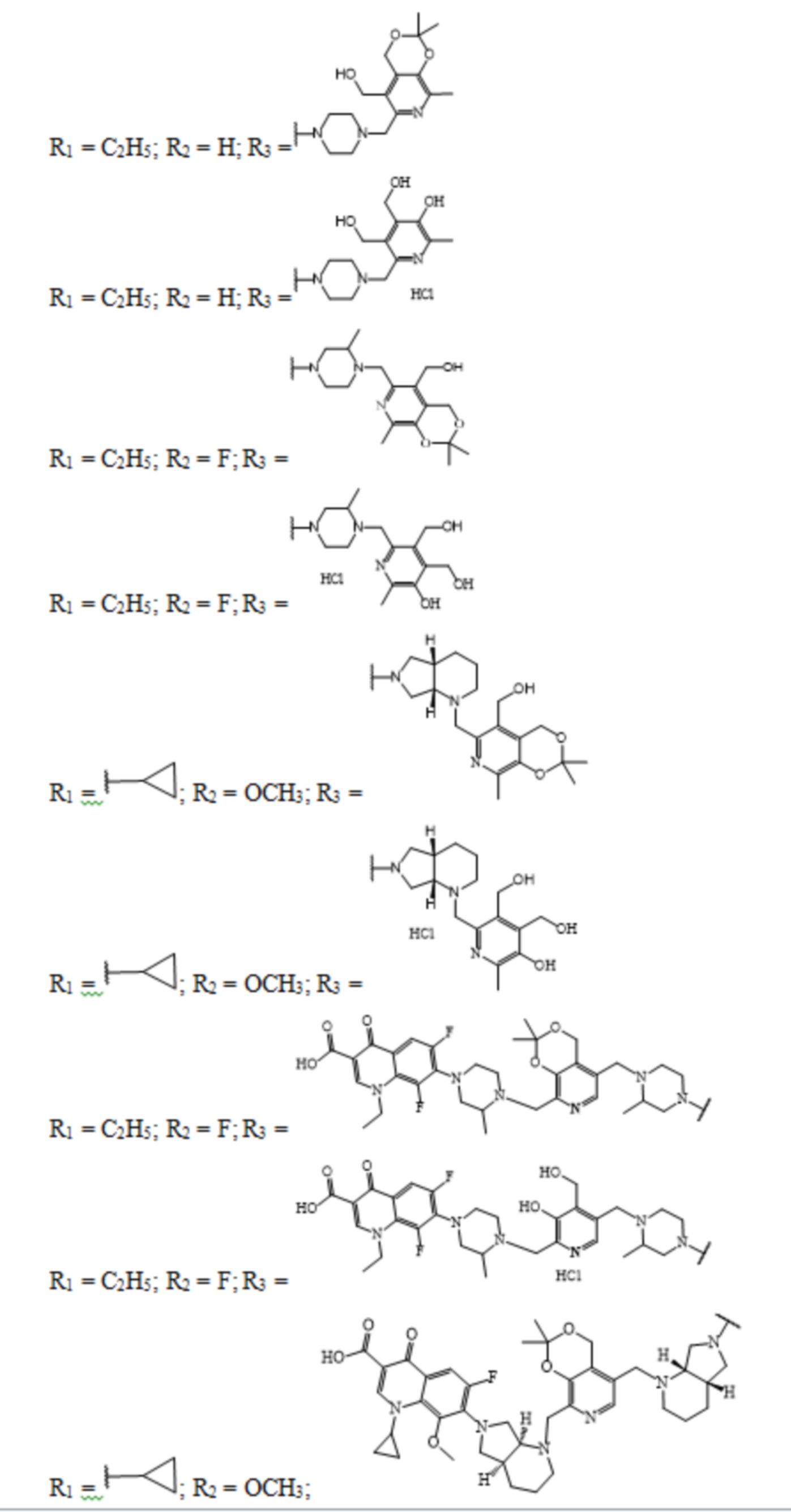

Заявленное техническое решение иллюстрируется Фиг.1 – Фиг.4:
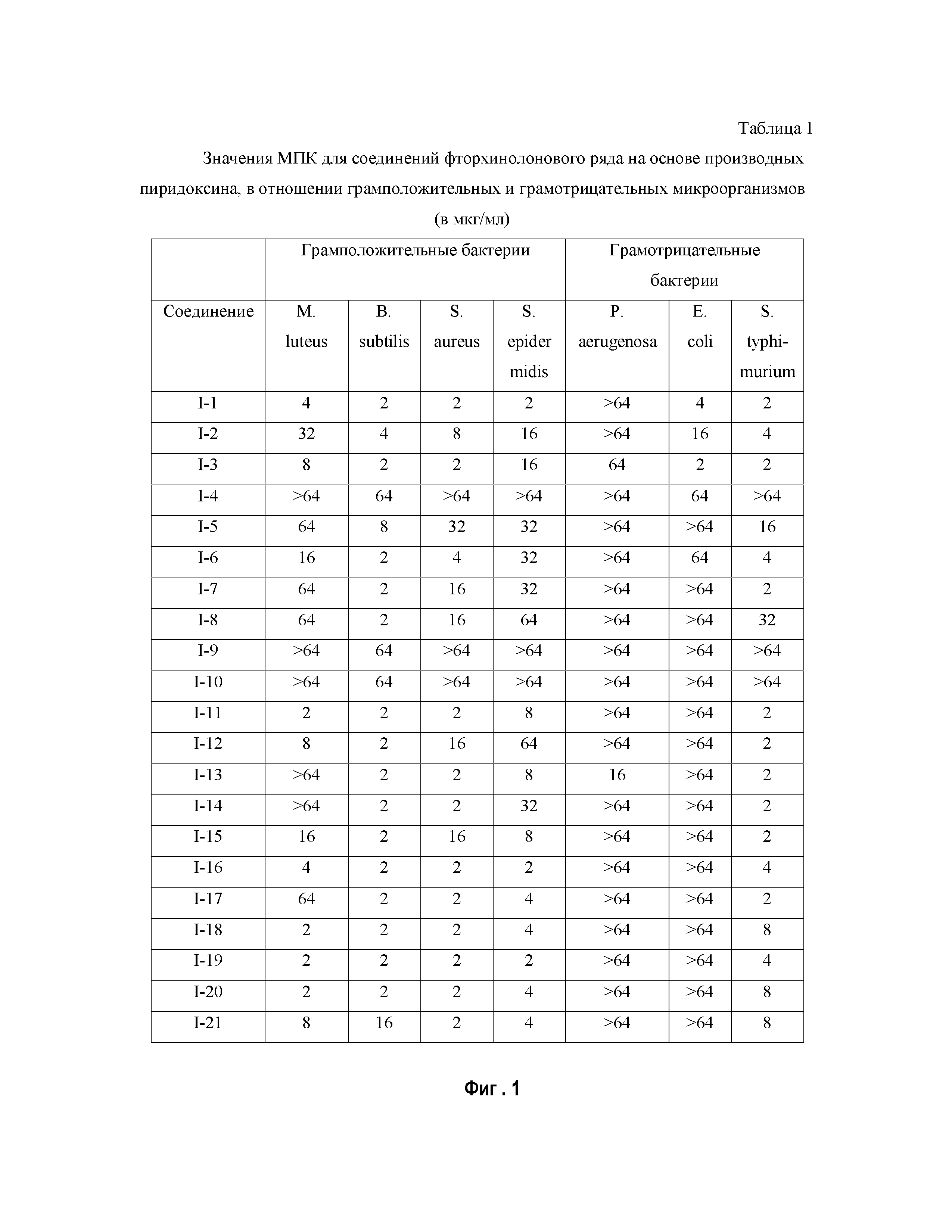
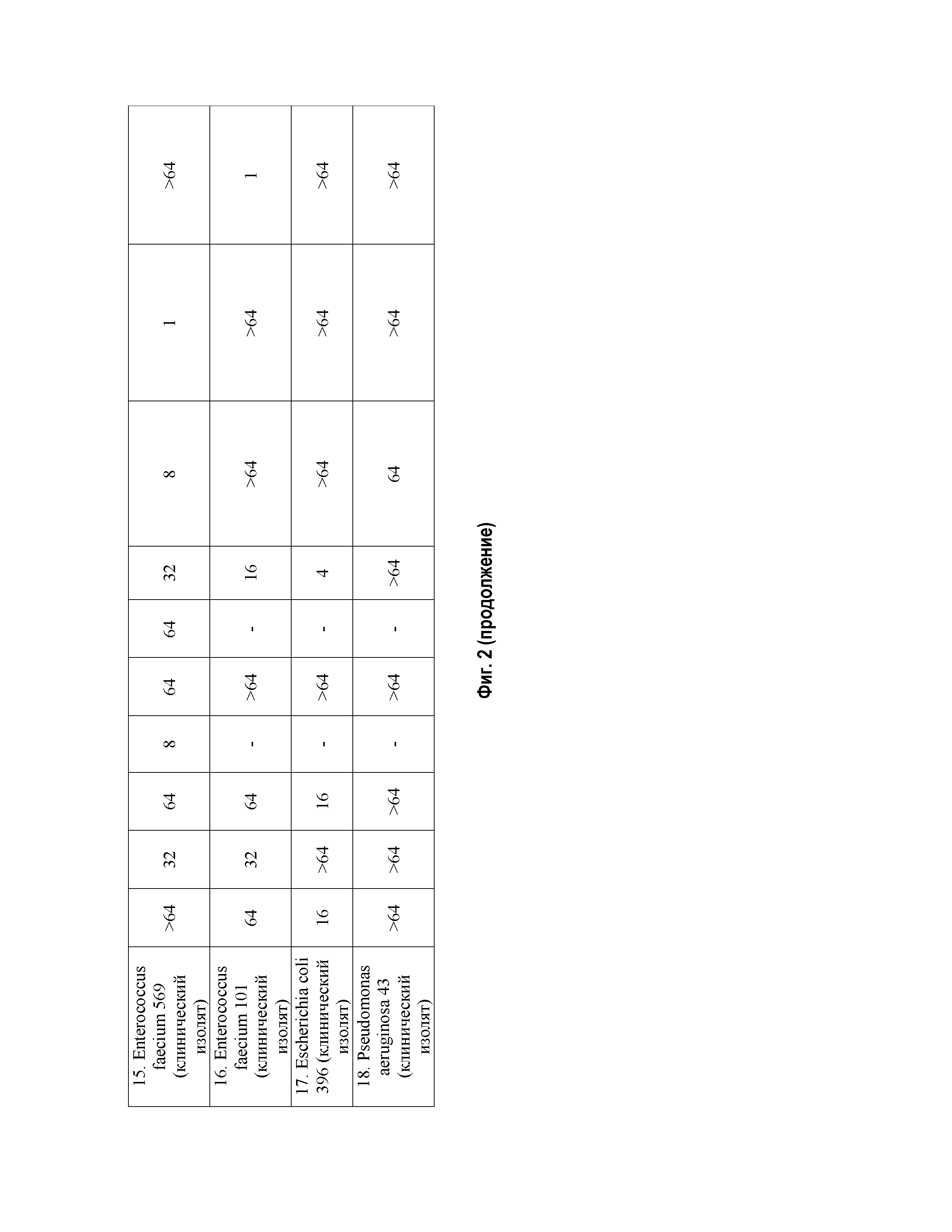
На Фиг.1 представлена Таблица 1, где приведены значения МПК для соединений фторхинолонового ряда на основе производных пиридоксина, в отношении грамположительных и грамотрицательных микроорганизмов (в мкг/мл).
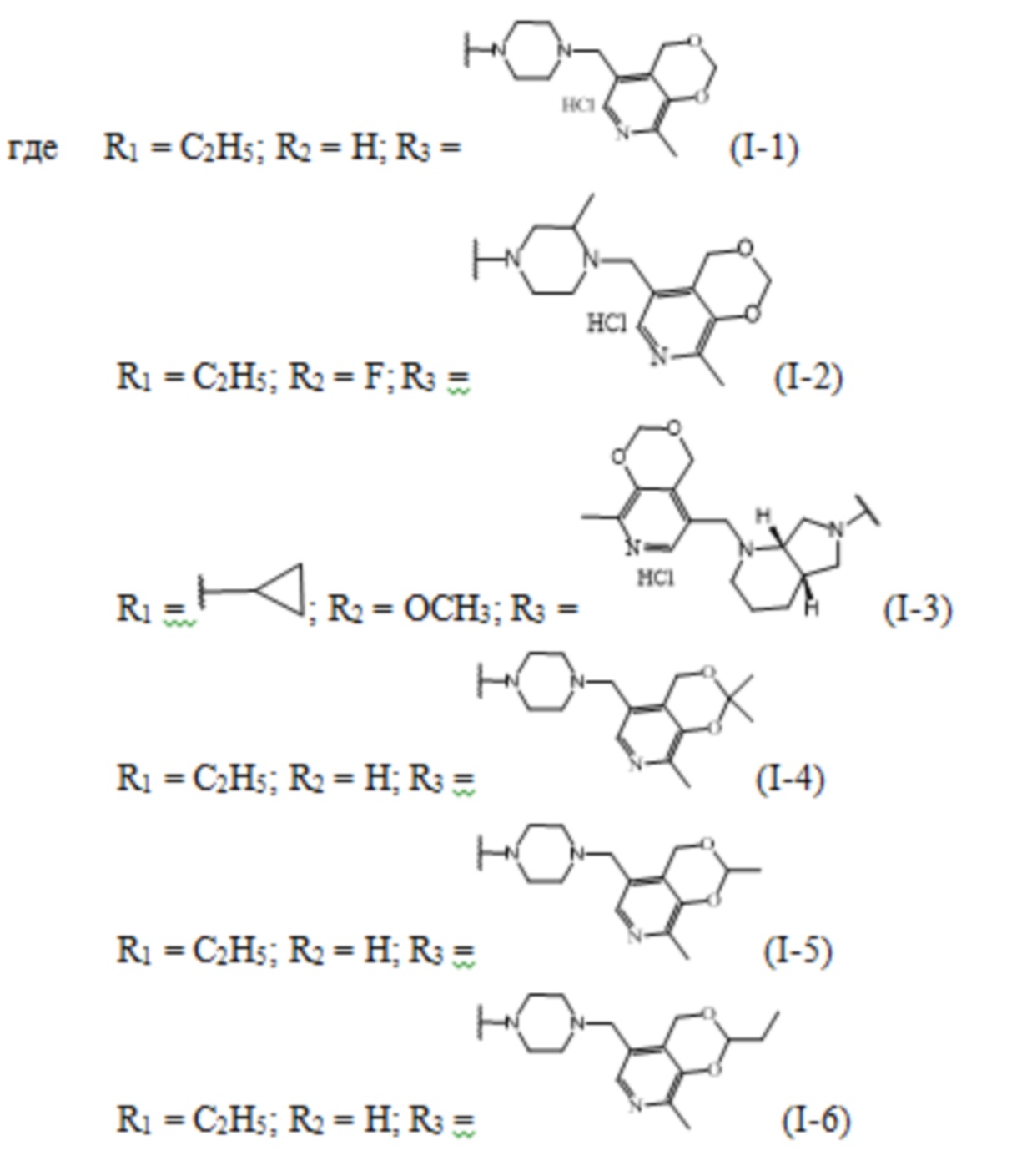
На Фиг.2 представлена Таблица 2, где приведены значения МПК соединений фторхинолонового ряда на основе производных пиридоксина, на полирезистентных штаммах грамположительных и грамотрицательных микроорганизмов.
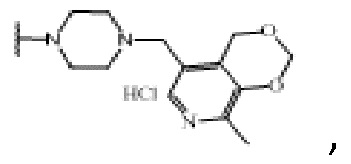
На Фиг.3 представлена Таблица 3, где приведены значения IС50 соединений фторхинолонового ряда на основе производных пиридоксина, для эмбриональных клеток почки человека HEK-293.
На Фиг.4 представлена Таблица 4, где приведены результаты исследования ДНК-повреждающей активности соединений фторхинолонового ряда на основе производных пиридоксина, в SOS-хромотесте.
Задача решается, и заявленный технический результат достигается получением заявленных новых соединений формулы (I), обладающих антибактериальными свойствами.
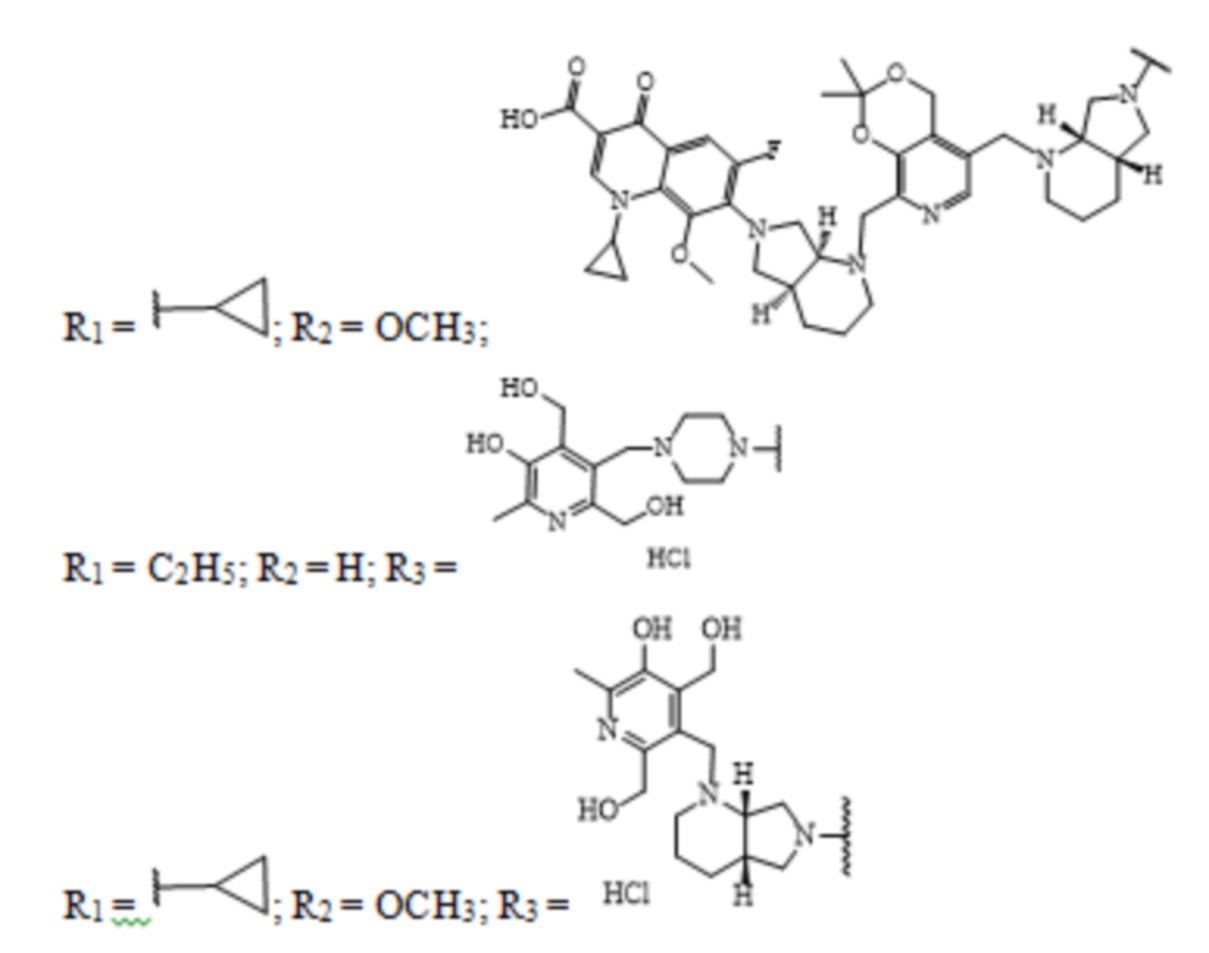
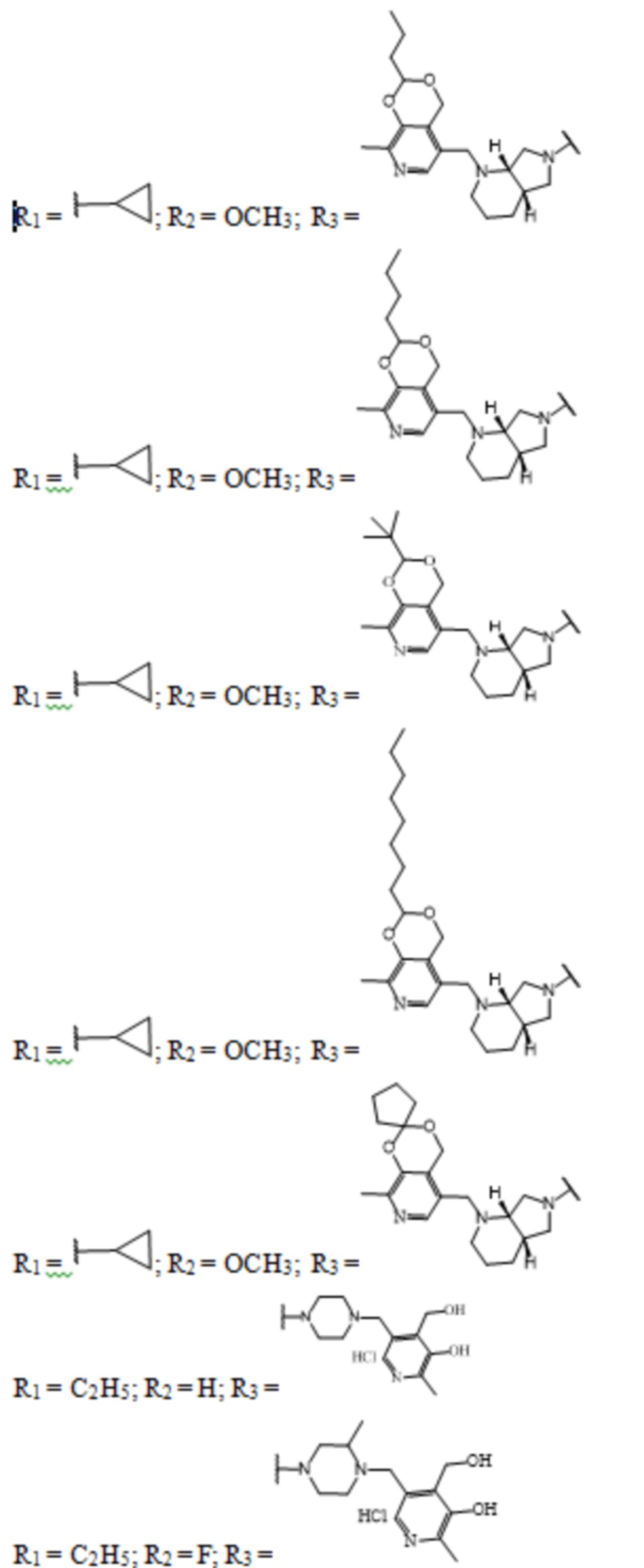
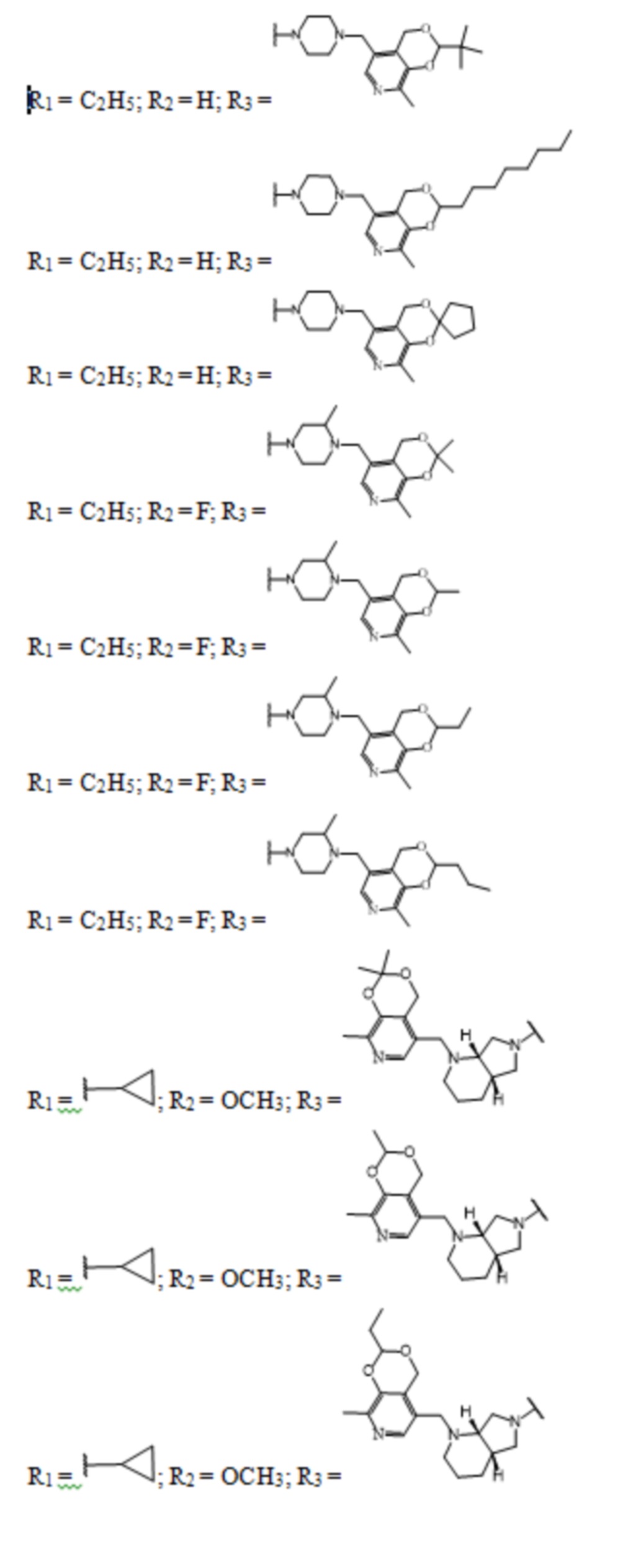
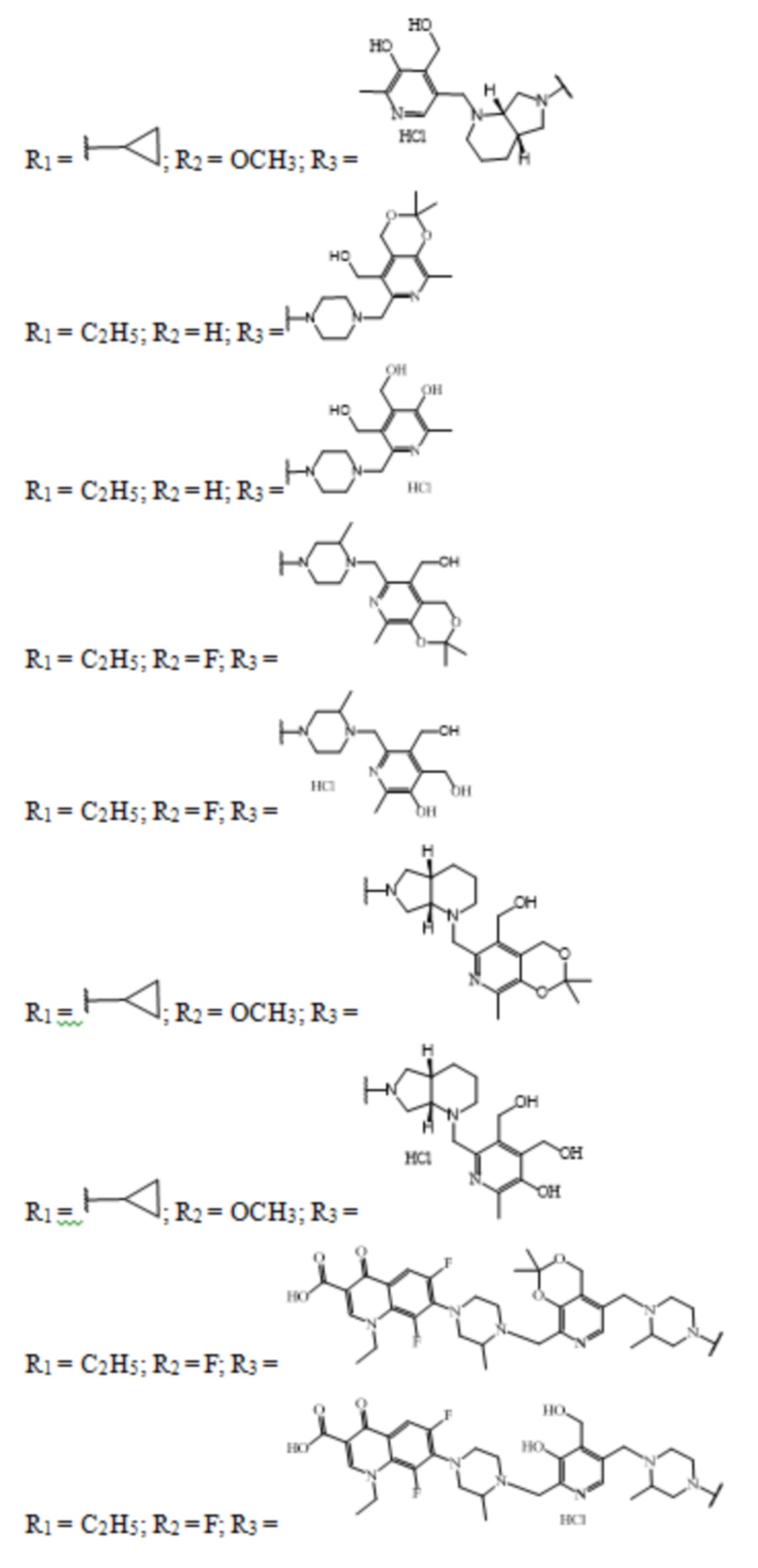
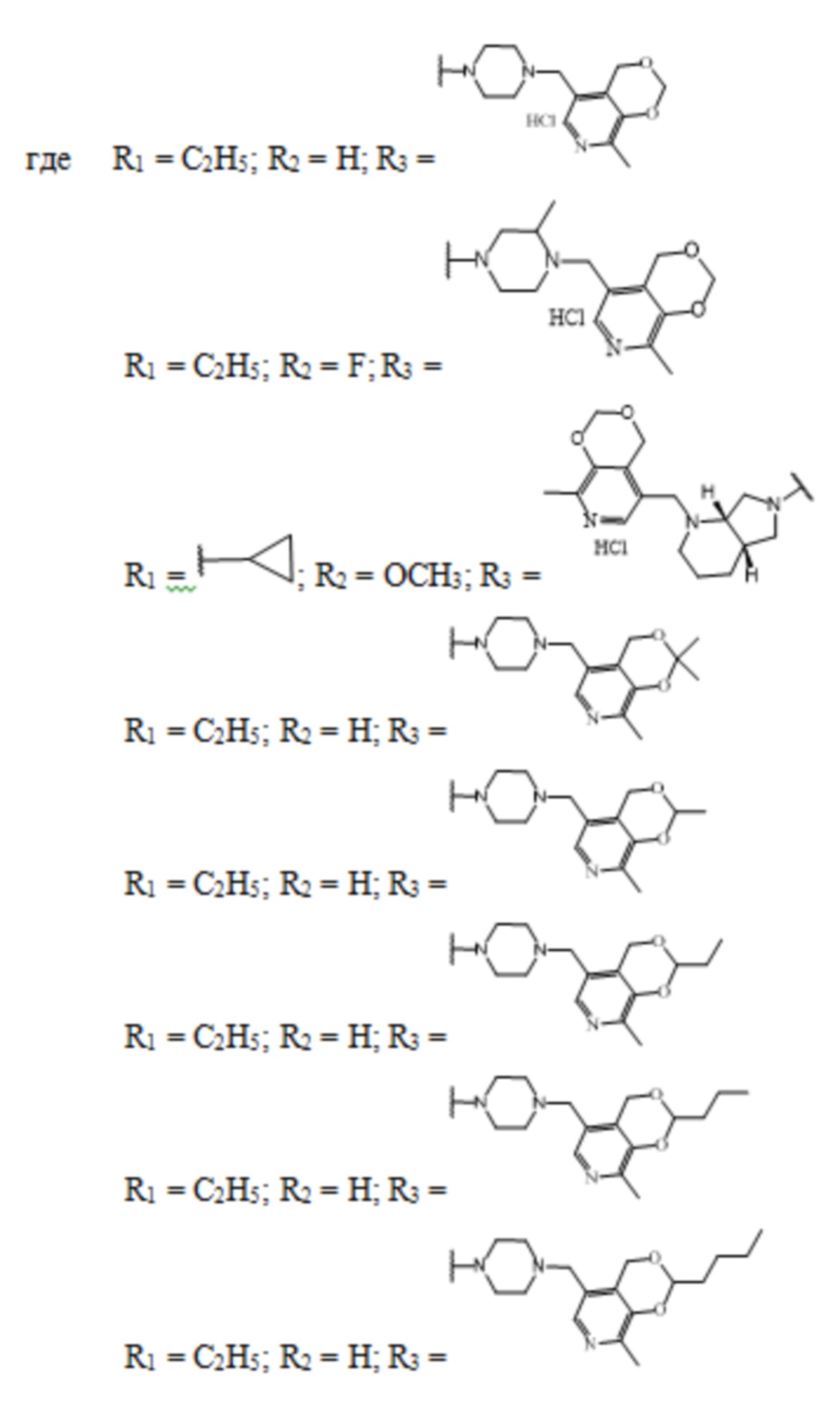
Заявленные соединения получены согласно нижеприведенным схемам 1-6, где заявленные соединения обозначены номерами I-1 – I-37.
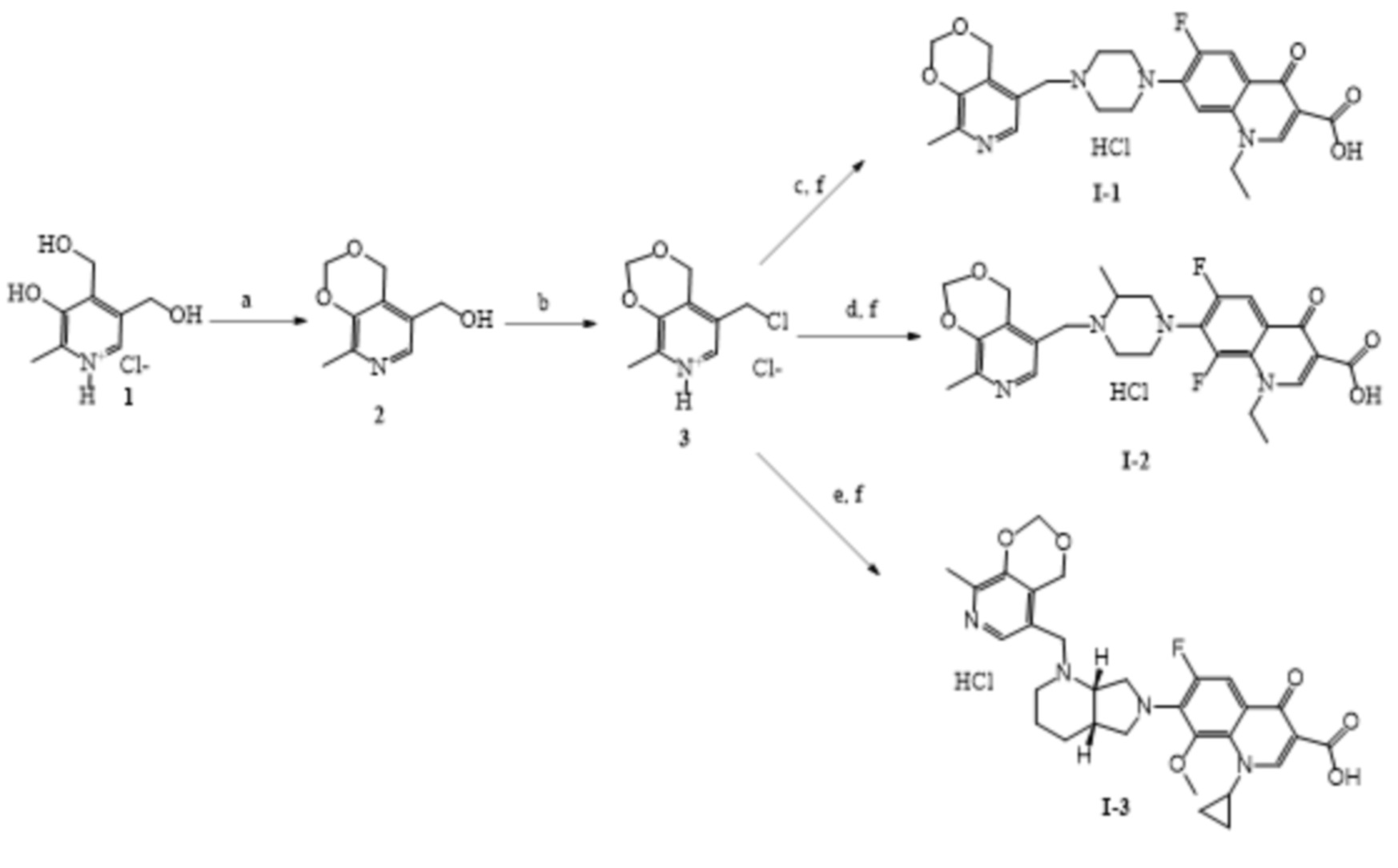
Схема 1.
(a) C6H6, параформ, p-TsOH, кипячение, 6 ч;
(b) CHCl3, SOCl2, 20 °C, 3ч;
(c) ДМФА, норфлоксацин, KI, NaHCO3, 80 °C, 4 ч;
(d) ДМФА, ломефлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч;
(е) ДМФА, моксифлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч;
(f) H2O, HCl, 20 °C.
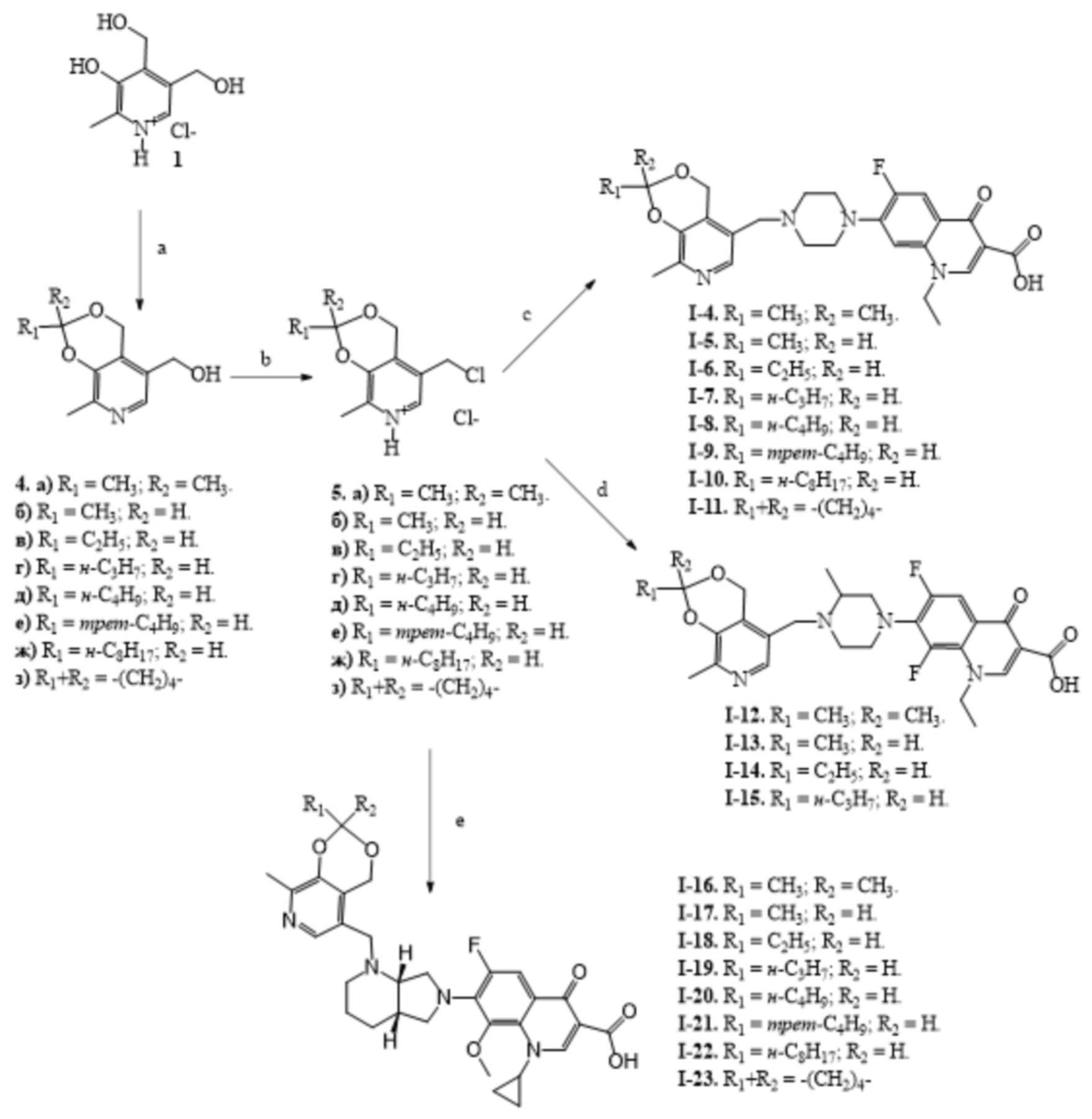
Схема 2.
(a) CH3C(O)H, HCl, 3 - 5 °C, 3ч или C6H6, R1C(O)H, p-TsOH, кипячение, 6-8 ч;
(b) CHCl3, SOCl2, 20 °C, 3 ч;
(c) ДМФА, норфлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч;
(d) ДМФА, ломефлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч;
(e) ДМФА, моксифлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч.
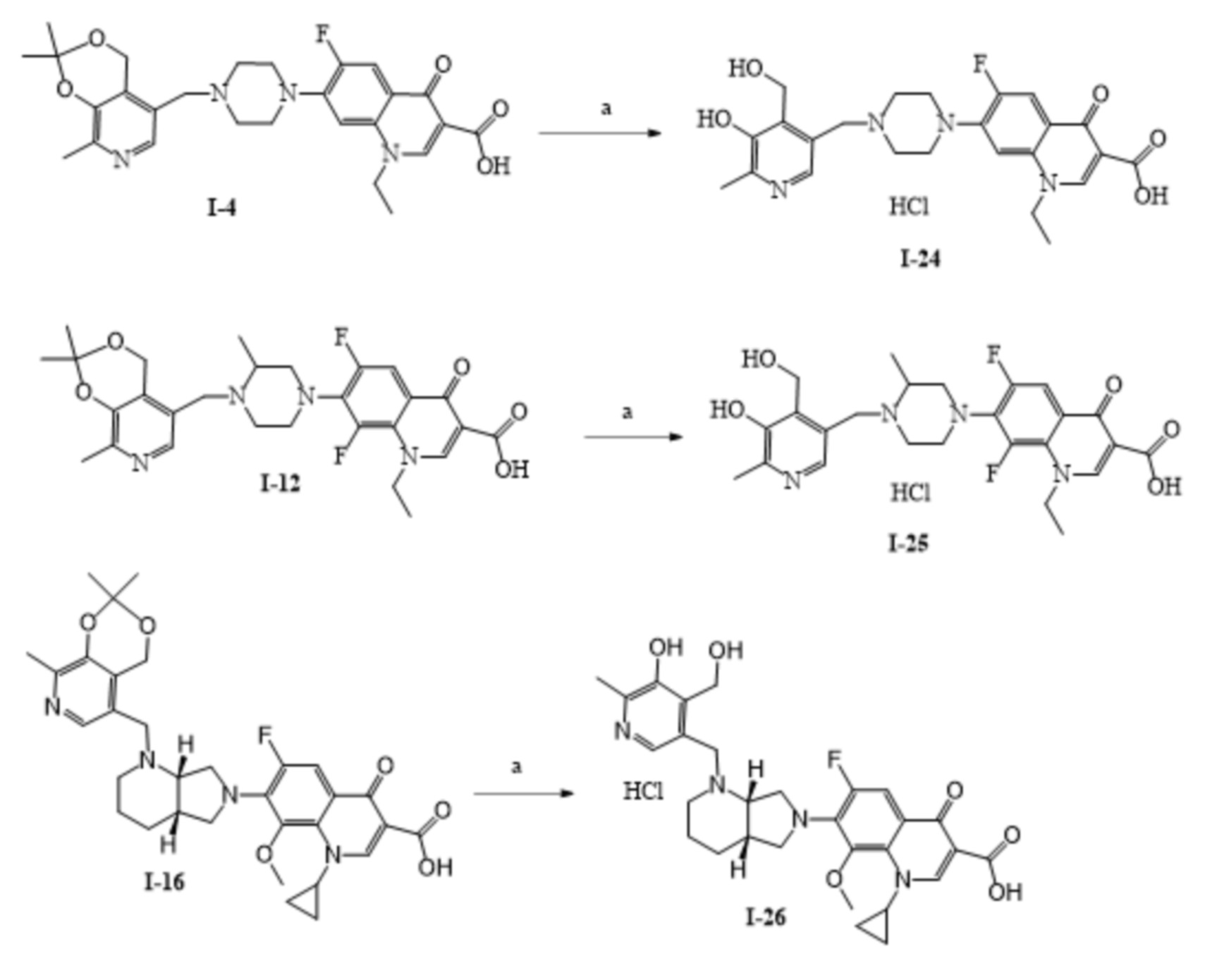
Схема 3.
(a) H2O, HCl, 20 °C, 24 ч.
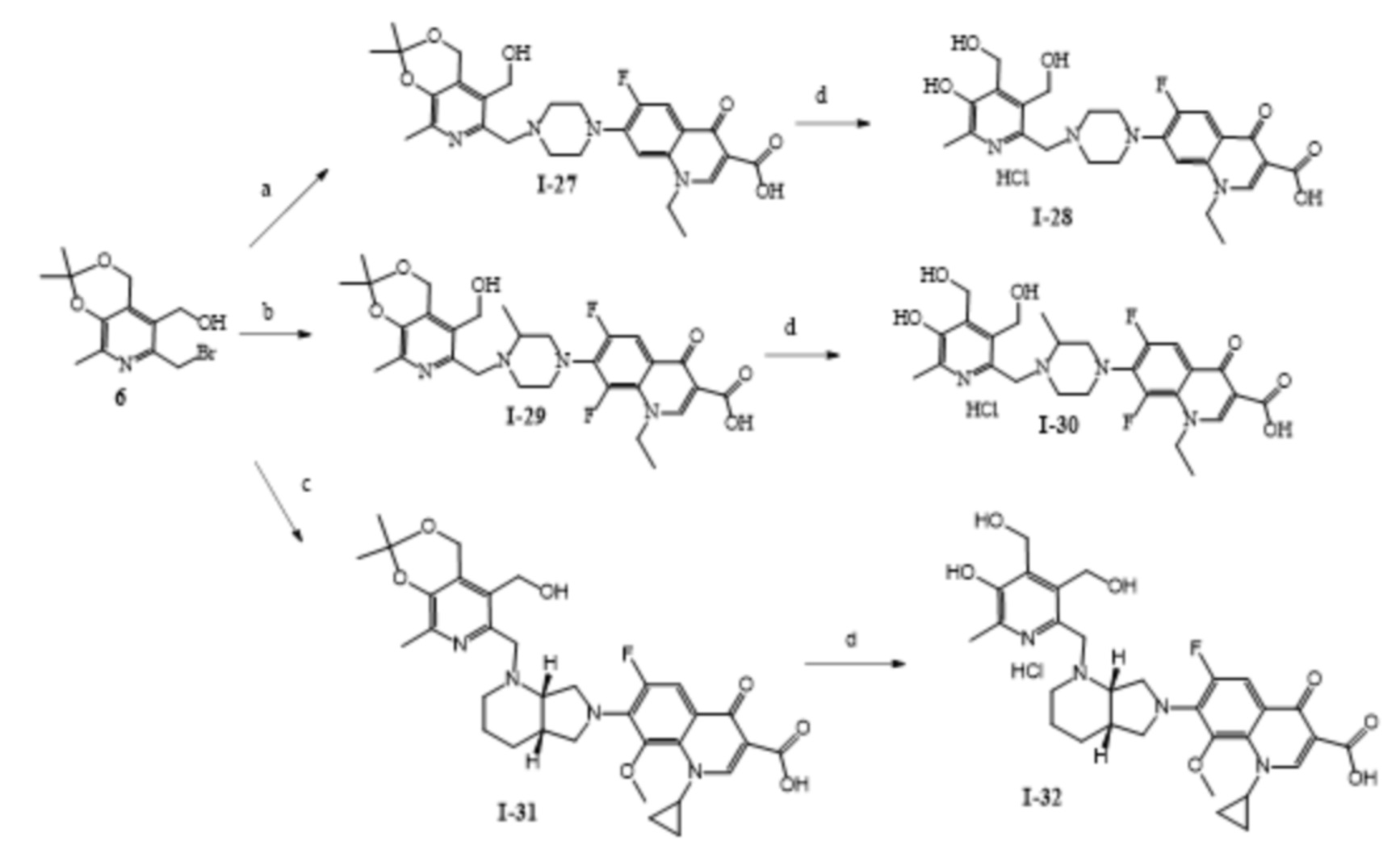
Схема 4.
(a) ДМФА, норфлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч;
(b) ДМФА, ломефлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч;
(c) ДМФА, моксифлоксацин гидрохлорид, KI, NaHCO3, 80 °C, 4 ч;
(d) H2O, HCl, 25 °C, 24 ч.
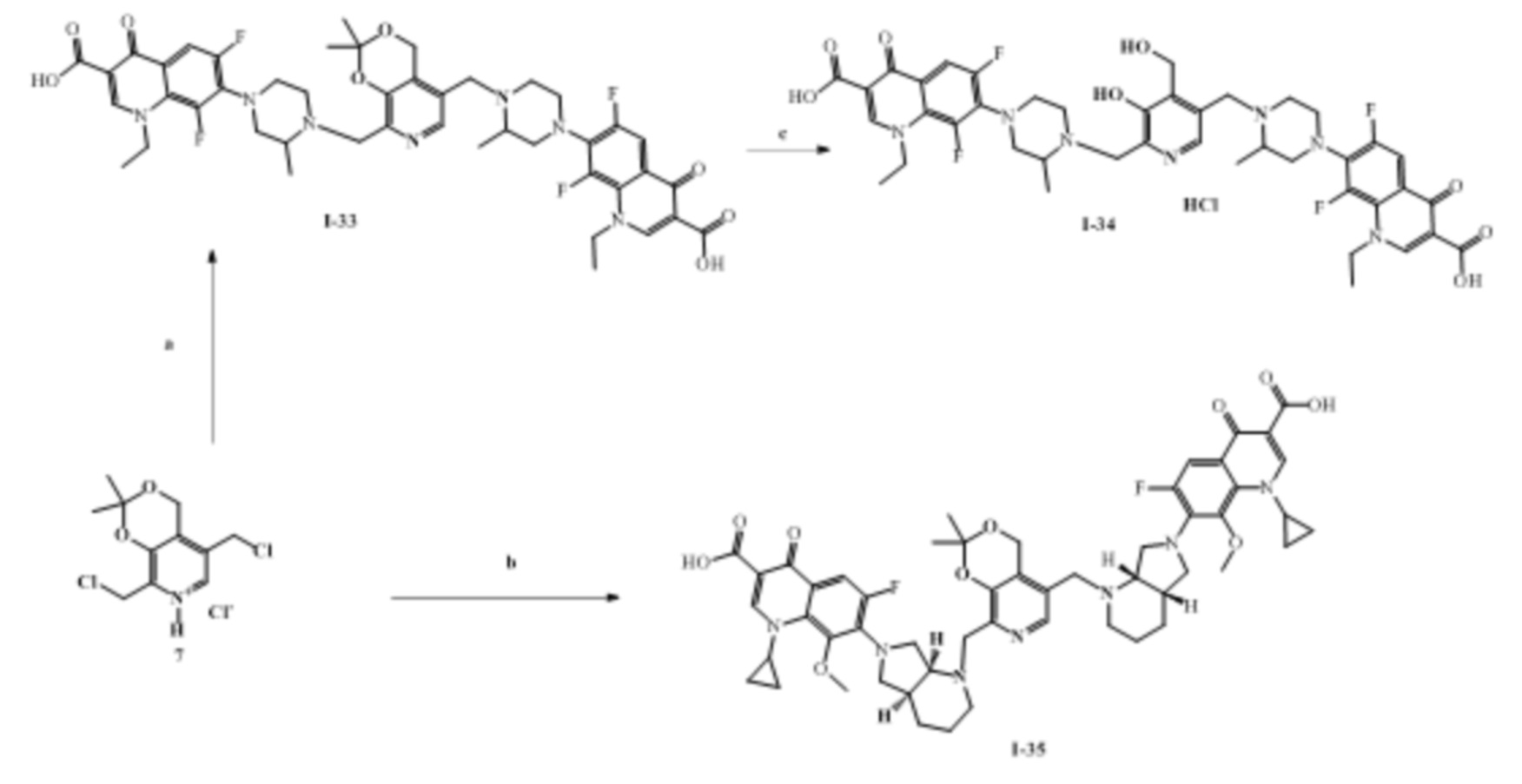
Схема 5.
(a) ДМФА, ломефлоксацин гидрохлорид, KI, NaHCO3, 90 °C, 8 ч;
(b) ДМФА, моксифлоксацин гидрохлорид, KI, NaHCO3, 70 °C, 8 ч;
(c) H2O, HCl, 25 °C, 24 ч.
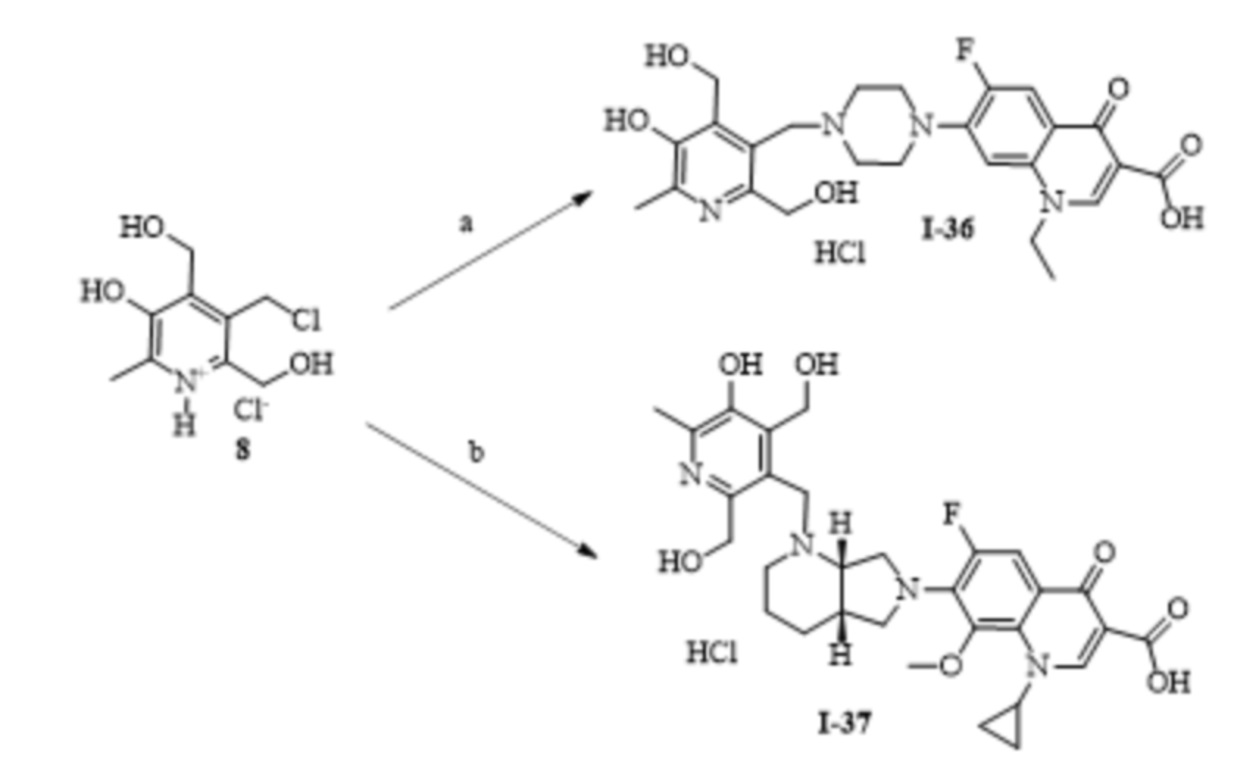
Схема 6.
(a) ДМФА, H2O, норфлоксацин гидрохлорид, KI, NaHCO3, 60 °C, 10 ч;
(b) ДМФА, моксифлоксацин гидрохлорид, KI, NaHCO3, 60 °C, 10 ч.
Характеристики новых соединений приведены далее в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1Н и 13С ЯМР-спектроскопии. Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13С). Температуры плавления определялись с помощью прибора Stanford Research Systems MPA-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates.
HRMS-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, AB Sciex (Германия) из раствора в метаноле методом ионизации – турбоионный спрей (TIS) – при энергии столкновения с молекулами азота 10 еВ.
Примеры конкретного выполнения заявленного технического решения
Следующие соединения были получены по известным литературным методикам:
- соединения 2, 3, 4в-з, 5б-з [S.V. Sapozhnikov, N.V. Shtyrlin, A.R. Kayumov, A.E. Zamaldinova, A.G. Iksanova, Е.V. Nikitina, Е.S. Krylova, D.Yu. Grishaev, K.V. Balakin, Yu.G. Shtyrlin // Med. Chem. Res. – 2017 – V. 26, Iss. 12. – P. 3188-3202] 4a [Cohen A., Huges E.G. Synthetical Experiments in the B Group of Vitamins. Part V. Novel Derivatives of Pyridoxine. // J. Chem. Soc. - 1952. - P. 4384-4386],
- соединение 4б [И.С. Арустамова, В.Г. Кульневич. Некоторые превращения 5-оксиметил-8-метил-1,3-диоксинопиридинов // Журн. орг. химии. – 1985. – Т. 21, Вып. 11. – С. 2433-2438],
- соединение 5а [Tomita I., Brooks H.G., Metzler D.E. Synthesis of vitamin B6 derivatives. II. 3-Hydroxy-4-hydroxymethyl-2-methyl-5-pyridine acetic acid and related substances // J. Heterocycl. Chem. – 1966 - V.3., N.2. - P. 178-183], 6 [M.V. Pugachev, N.V. Shtyrlin, S.V. Sapognikov, L.P. Sysoeva, A.G. Iksanova, E.V. Nikitina, R.Z. Musin, O.A. Lodochnikova, E.A. Berdnikov, Yu.G. Shtyrlin Bis-phosphonium salts of pyridoxine: the relationship between structure and antibacterial activity // Bioorg. Med. Chem. – 2013. – V. 21, Iss. 23. - P. 7330-7342],
- соединение 7 [Iwata, M. Kuzuhara, H. Functionalized Dithia(2,5)pyridinophanes as Vitamin B6Analogues. Synthesis, Properties, and Catalytic Activity for Racemization Reaction // Bull. Chem. Soc. Jpn. – 1985 – V. 58, 2502],
- соединение 9 [M.V. Pugachev, N.V. Shtyrlin, E.V. Nikitina, L.P. Sysoeva, T.I. Abdullin, A.G. Iksanova, A.A. Ilaeva, E.A. Berdnikov, R.Z. Musin, Yu.G. Shtyrlin Synthesis and antibacterial activity of novel phosphonium salts on the basis of pyridoxine // Bioorg. Med. Chem. – 2013. – V. 21, Iss. 14. - P. 4388-4395.]
Пример 1. Получение гидрохлорида 1-этил-6-фтор-4-оксо-7-(4-((8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (I-1).
К раствору 0.5 г (2.1 ммоль) соединения 3 в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.61 г (1.9 ммоль) норфлоксацина, 0.34 г (4.0 ммоль) гидрокарбоната натрия и 0.16 г (0.1 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Полученный осадок суспензируют в воде и добавляют эквимольное количество 0.1 Н HCl. Растворитель удаляют в вакууме. Выход: 0.35 г (36%), серое кристаллическое вещество, т.пл. 178-182 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.41 т (3H, 3JH-H = 7.0 Гц, CH2CH3), 2.50 c (3H, CH3), 3.26-3.98 м (8H, 4CH2 пиперазино), 4.36 уш с (2Н, CH2-N), 4.62 кв (2H, 3JH-H = 7.0 Гц, CH2CH3), 5.34 с (2Н, СН2), 5.44 с (2H, CH2), 7.26 д (1H, 4JH-F = 7.3 Гц, СHар), 7.98 д (1H, 3JH-F = 13.1 Гц, СHар), 8.59 c (1H, СH), 8.97 c (1H, СH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 14.51 с (CH2CH3), 15.99 с (CH3), 46.45 уш с (CH2пиперазино), 49.23 с (CH2пиперазино), 50.65 с (CH2CH3), 51.92 уш с (CH2-N), 64.24 с (CH2), 91.33 с (CH2), 106.45 с (Cар), 107.19 с (Cар), 111.47 д (2JC-F = 23.4 Гц, Cар), 119.93 д (3JC-F = 6.8 Гц, Cар), 122.04 уш с (Cар), 135.35 уш c (Cар), 137.18 c (Cар), 139.09 уш c (Cар), 143.97 д (2JC-F = 9.3 Гц, Cар), 145.45 c (Cар), 148.40 c (Cар),148.74 c (Cар), 152.70 д (1JC-F = 249.7 Гц, Cар-F), 166.10 с (C(O)OH), 176.18 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 483.2038, C25H28FN4O5. Вычислено [М-Cl]+ 483.2044.
Пример 2. Получение гидрохлорида 1-этил-6,8-дифтор-7-(3-метил-4-((8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-2).
К раствору 0.54 г (2.3 ммоль) соединения 3 в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.81 г (2.1 ммоль) гидрохлорида ломефлоксацина, 0.55 г (6.5 ммоль) гидрокарбоната натрия и 0.05 г (0.3 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляют в вакууме. Сухой остаток экстрагировают этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном и водой. Полученный осадок суспензируют в воде и добавляют эквимольное количество 0.1 Н HCl. Растворитель удаляют в вакууме. Выход 0.31 г (27 %), жёлтое кристаллическое вещество. Т.пл. 167-173 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.14 д (3H, 3JH-H = 6.0 Гц, CH3пиперазин), 1.43 т (3H, 3JH-H = 6.7 Гц, CH2CH3), 2.21-2.25 м (1H, CHпиперазин), 2.31 c (3H, CH3), 2.61-2.67 м (2H, CH2пиперазин), 3.05-3.42 м (4H, 2CH2пиперазин), 3.14, 3.94 АВ-система (2H, 2JH-H = - 14.0 Гц, CH2N),. 4.52-4.64 м (2H, CH2), 4.99, 5.11 АВ-система (2H, 2JH-H = - 16.0 Гц, CH2), 5.33, 5.35 АВ-система (2H, 2JH-H = - 5.7 Гц, CH2), 7.86 д (1H, 3JH-F = 11.8 Гц, СHар), 7.92 c (1H, СH), 8.93 c (1H, СH), 14.93 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6), δ, м.д.: 14.11 с (CH2CH3), 15.93 д (6JC-F= - 4.8 Гц, CH3), 18.25 с (CH3), 49.74 уш с (Cпиперазин), 50.69 уш с (Cпиперазин), 52.40 с (CH2), 53.71 д (4JC-F = 16.0 Гц, CH2CH3), 55.39 уш с (Cпиперазин), 56.97 уш с (Cпиперазин), 63.72 с (CH2O), 90.77 с (OCH2O), 106.96 дд (2JC-F = 21.4 Гц, 4JC-F = 2.4 Гц, CHар), 107.00 c (Cар), 120.37 д (2JC-F = 9.2 Гц, Cар), 127.27 д (2JC-F = 5.7 Гц, Cар), 128.26 c (Cар), 128.44 c (Cар), 133.72 дд (2JC-F = -14.2 Гц, 2JC-F = - 14.2 Гц, Cар), 140.92 c (Cар), 145.40 c (Cар), 145.91 дд (1JC-F = 248.5 Гц, 4JC-F = 6.4 Гц, Cар-F), 146.93 c (Cар), 151.18 c (Cар), 154.52 дд (1JC-F = 250.1 Гц, 4JC-F = 5.5 Гц, Cар-F), 166.57 с (C(O)OH), 175.54 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 515.2101, C26H29F2N4O5. Вычислено [М-Cl]+ 515.2106.
Пример 3. Получение гидрохлорида 1-циклопропил-6-фтор-8-метокси-7-(1-((8-метил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октагидро-1Н-пирроло[3,4-b]пиридин-6-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновая кислоты (I-3).
К раствору 0.50 г (2.1 ммоль) соединения 3 в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.84 г (1.9 ммоль) гидрохлорида моксифлоксацина, 0.49 г (5.8 ммоль) гидрокарбоната натрия и 0.16 г (0.95 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Полученный осадок суспензируют в воде и добавляют эквимольное количество 0.1 Н HCl. Растворитель удаляют в вакууме. Выход 0.30 г (26 %), жёлтое кристаллическое вещество. Т.пл. 121-127 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 0.76-1.32 м (4H, 2CH2), 1.40-2.12 м (4H, 2CH2), 2.50 м (3H, CH3), 2.34-4.66 м (14H, 4N-CH2, 2N-CH, СН, OCH3), 5.08-5.78 м (4Н, 2СН2), 7.70 уш c (1Н, СHар), 8.53 д (1H, 3JH-F = 26.0 Гц, СHар), 8.68 c (1Н, СHар).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 8.50 с (CH2), 9.46 с (CH2), 17.30 с (CH3), 20.50 с (CH2), 22.67 с (CH2), 34.97 с (СH), 40.56 с (СH), 49.50 с (CH2), 51.85 д (4JC-F = 6.1 Гц, CH2N), 53.06 д (4JC-F = 7.0 Гц, CH2N), 55.56 с (CH2), 59.31 с (CH3O), 61.58 с (CH2), 63.80 с (CH), 90.94 с (CH2), 106.44 с (Сар), 106.54 д ( JC-F = 21.0 Гц, Cар), 118.33 д (JC-F = 2.6 Гц, Cар), 132.72 с (Cар), 134.39 с (Cар), 136.30 д (JC-F = 10.3 Гц, Cар), 140.53 с (Cар), 142.02 с (Cар), 146.74 с (Cар), 147.50 с (Cар), 150.20 с (Cар), 152.59 д (1JC-F = 245.8 Гц, Cар-F), 165.79 с (C(O)OH), 175.99 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 565.2457, C30H34FN4NO6. Вычислено [М-Cl]+ 565.2462.
Пример 4. Получение 1-этил-6-фторо-4-оксо-7-(4-((2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (I-4).
К раствору 1.26 г (4.77 ммоль) соединения 5a в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 1.33 г (3.98 ммоль) норфлоксацина гидрохлорида, 1.068 г (12.71 ммоль) гидрокарбоната натрия и 0.33 г (1.99 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Затем растворитель удаляют в вакууме, сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.59 г (24%), светло-желтое кристаллическое вещество. Т.пл. 218-221 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.56 c (6H, 2CH3), 1.57 т (3H, 3JH-H = 7.2 Гц, CH2СH3), 2.43 c (3H, CH3), 2.64 м (4H, пиперазино 2CH2), 3.29 м (4H, пиперазино 2CH2), 3.48 c (2H, CH2N), 4.30 кв (2H, 3JH-H = 7.2 Гц, CH2CH3), 5.01 c (2H, CH2O), 6.80 д (1H, 4JH-F = 6.8 Гц, СHар), 7.93 c (1H, СHар), 8.00 д (1H, 3JH-F = 13.0 Гц, СHар), 8.64 c (1H, СHпир), 15.06 уш с (1H, OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.55 с (CH2СH3), 18.51 с (CH3), 24.85 с (C(CH3)2), 49.87 с (CH2СH3), 50.00 д (4JC-F = 4.8 Гц, пиперазино 2CH2), 52.64 с (пиперазино 2CH2), 57.52 с (CH2), 58.86 с (CH2), 99.78 с (C(CH3)2), 103.92 д (4JC-F = 3.1 Гц, Cар), 108.39 с (Cар), 112.78 д (2JC-F = 23.3 Гц, Cар), 120.60 д (3JC-F = 7.8 Гц, Cар), 126.41 (Cар), 126.71 c (Cар), 137.18 c (Cар), 140.38 c (Cар), 146.11 д (2JC-F = 10.6 Гц, Cар-N), 146.29 c (Cар), 147.19 c (Cар), 147.67 c (Cар), 153.59 д (1JC-F = 251.7 Гц, Cар-F), 167.28 с (C(O)OH), 177.02 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 511.2351. C27H32FN4O5. Вычислено [М+H]+ 511.2357.
Пример 5. Получение 1-этил-6-фтор-4-оксо-7-(4-((2,8-диметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислота (I-5).
К раствору 0.17 г (0.80 ммоль) соединения 5б в 10 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.26 г (0.73 ммоль) норфлоксацина гидрохлорида, 0.13 г (1.55 ммоль) гидрокарбоната натрия и 0.06 г (0.36 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.10 г (33%), серое кристаллическое вещество, т.пл. 188-192 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.57 уш т (3Н, CH2CH3), 1.61 д (3H, 3JH-H = 5.0 Гц, CHCH3), 2.47 c (3H, CH3), 2.65 уш с (4H, 2CH2пиперазино), 3.30 уш с (4H, 2CH2пиперазино), 3.47 уш м (2H, CH2-N), 4.31 уш с (2Н, CH2CH3), 5.04, 5.10 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2O), 5.20 кв (1H, 3JH-H = 5.0 Гц, CHCH3), 6.81 уш с (1H, 4JH-H = - 1.2 Гц, СHар), 7.97 уш c (1H, СHар), 8.03 д (1H, 3JH-F = 13.0 Гц, СHар), 8.65 c (1H, СHар), 15.06 с (1H, OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.59 с (CH2CH3), 18.01 с (CH3), 20.76 с (CHCH3), 49.94 д (4JC-F = 7.8 Гц, CH2пиперазино), 50.00 с (CH2пиперазино), 52.66 c (CH2CH3), 57.44 с (CH2), 64.50 с (CH2), 97.44 с (CHCH3), 104.01 д (3JC-F = 1.8 Гц, Cар), 108.56 с (Cар), 112.96 д (2JC-F = 23.3 Гц, Cар), 120.84 д (3JC-F = 7.6 Гц, Cар), 127.15 с (Cар), 128.98 c (Cар), 137.22 c (Cар), 140.10 с (Cар), 146.09 д (2JC-F = 10.8 Гц, Cар), 146.95 c (Cар), 147.26 c (Cар), 148.32 c (Cар), 153.66 д (1JC-F = 251.9 Гц, Cар-F), 167.27 с (C(O)OH), 177.13 д (4JC-F = 1.8 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 497.2195, C26H30FN4O5. Вычислено [М+H] 497.2200.
Пример 6. Получение 1-этил-6-фтор-4-оксо-7-(4-((2-этил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (I-6).
К раствору 0.50 г (1.89 ммоль) соединения 5в в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.55 г (1.72 ммоль) норфлоксацина, 0.30 г (3.57 ммоль) гидрокарбоната натрия и 0.14 г (0.90 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.44 г (50%), серое кристаллическое вещество, т.пл. 188-192 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.09 т (3H, 3JH-H = 7.5 Гц, CH2CH3), 1.58 т (3H, 3JH-H = 7.2 Гц, CHCH2CH3), 1.87-1.98 м (2H, CH2CH3), 2.53 c (3H, CH3), 2.68 уш м (4H, 2CH2пиперазино), 3.31 м (4H, 2CH2пиперазино), 3.48, 3.53 АВ-система (2Н, 2JH-H = 13.7 Гц, CH2-N), 4.31 кв (2H, 3JH-H = 7.2 Гц, CH2CH3), 5.02 т (1H, 3JH-H = 5.1 Гц, CHCH2CH3), 5.06, 5.13 АВ-система (2Н, 2JH-H = - 16 Гц, СН2O), 6.82 д (1H, 4JH-F = 6.8 Гц, СHар), 8.02 c (1H, CНар), 8.04 д (1H, 3JH-F = 13.0 Гц, СHар), 8.66 c (1H, СHар), 15.07 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 7.97 с (CH2CH3), 14.62 с (CH2CH3), 17.73 с (CH3), 27.67 с (CH2CH3), 49.92 с (CH2CH3), 49.94 д (4JC-F = -5.1 Гц, CH2пиперазино), 52.67 с (CH2пиперазино), 57.36 с (CH2), 64.58 с (CH2), 101.14 с (CHCH2CH3), 104.01 д (3JC-F = 2.7 Гц, Cар), 108.55 с (Cар), 113.00 д (2JC-F = 23.3 Гц, Cар), 120.88 д (3JC-F = 7.5 Гц, Cар), 129.77 c (Cар), 137.20 c (Cар), 139.35 c (Cар), 146.07 д (2JC-F = 9.9 Гц, Cар), 146.73 c (Cар), 147.29 c (Cар), 148.51 c (Cар), 153.66 д (1JC-F = 251.7 Гц, Cар-F), 167.34 с (C(O)OH), 177.14 д (4JC-F = 2.0 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 511.2351, C27H32FN4O5.Вычислено [М+H]+ 511.2357.
Пример 7. Получение 1-этил-6-фтор-4-оксо-7-(4-((2-пропил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (I-7).
К раствору 0.50 г (2.06 ммоль) соединения 5г в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 0.6 г (1.88 ммоль) норфлоксацина, 0.33 г (3.93 ммоль) гидрокарбоната натрия и 0.16 г (0.96 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.3 г (31%), серое кристаллическое вещество, т.пл. 221-224 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.02 т (3H, 3JH-H = 7.3 Гц, CH2CH2CH3), 1.50-1.66 м (5H, CH2CH3 + CH2CH2CH3), 1.82-1.96 м (2H, CH2CH2CH3), 2.56 c (3H, CH3), 2.69 уш с (4H, 2CH2пиперазино), 3.33 уш с (4H, 2CH2пиперазино), 3.44-3.59 уш м (2Н, CH2N), 4.32 кв (2H, 3JH-H = 7.1 Гц, CH2CH3), 5.09 уш т (1H, CHCH2CH2CH3), 5.07, 5.13 АВ-система (2Н, 2JH-H = - 16.5 Гц, СН2), 6.82 д (1H, 4JH-F = - 6.5 Гц, СHар), 8.05 с (1H, СHар), 8.05 д (1H, 3JH-F = 12.4 Гц, СHар), 8.67 c (1H, СHар), 15.04 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.05 с (CH2CH3), 14.61 с (CH2CH2CH3), 17.11 с (CH3), 17.76 с (CH2CH2CH3), 36.43 с (CH2CH2CH3), 49.90 с (CH2пиперазино), 49.96 д (4JC-F = - 5.0 Гц, CH2пиперазино), 52.68 с (CH2CH3), 57.37 с (CH2N), 64.58 с (CH2O), 100.26 с (CНCH2CH2CH3), 104.02 д (3JC-F = - 3.0 Гц, Cар), 108.57 с (Cар), 112.99 д (2JC-F = - 23.6 Гц, Cар), 120.88 д (3JC-F = 7.9 Гц, Cар), 137.22 c (Cар), 139.54 д (4JC-F = - 3.8 Гц, Cар), 146.08 д (2JC-F = - 10.4 Гц, Cар), 146.74 c (Cар), 147.28 c (CHар), 148.54 c (Cар), 153.67 д (1JC-F = 251.4 Гц, Cар-F), 167.31 с (C(O)OH), 177.14 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 525.2508, C28H34FN4O5.Вычислено [М+H] 525.2513.
Пример 8. Получение 1-этил-6-фтор-4-оксо-7-(4-((2-бутил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (I-8).
К раствору 0.50 г (1.70 ммоль) соединения 5д в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.50 г (1.57 ммоль) норфлоксацина, 0.28 г (3.33 ммоль) гидрокарбоната натрия и 0.13 г (0.78 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.19 г (23%), серое кристаллическое вещество, т.пл. 204-209 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.95 т (3H, 3JH-H = 7.2 Гц, CH2CH2CH2CH3), 1.37-1.46 м (2H, CH2CH2CH2CH3), 1.49-1.56 м (2H, CH2CH2CH2CH3), 1.58 т (3H, 3JH-H = 7.2 Гц, CH2CH3), 1.87-1.94 м (2H, CH2CH2CH2CH3), 2.52 c (3H, CH3), 2.64–2.71 уш м (4H, 2CH2пиперазино), 3.27-3.35 уш м (4H, 2CH2пиперазино), 3.48, 3.51 АВ-система (2Н, 2JH-H = - 13.6 Гц, CH2N), 4.31 кв (2H, 3JH-H = 7.2 Гц, CH2CH3), 5.06 т (1H, 3JH-H = 4.7 Гц, CHCH2CH2CH2CH3), 5.05, 5.12 АВ-система (2Н, 2JH-H = - 16 Гц, СН2), 6.82 д (1H, 4JH-F = - 6.8 Гц, СHар), 8.01 с (1H, СHар), 8.04 д (1H, 3JH-F = 13.0 Гц, СHар), 8.66 c (1H, СHар), 15.07 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.11 с (CH2CH3), 14.61 с (CH2CH2CH2CH3), 17.69 с (CH3), 22.58 с (CH2CH2CH2CH3), 25.82 с (CH2CH2CH2CH3), 34.11 с (CH2CH2CH2CH3), 49.91 с (CH2пиперазино), 49.93 уш д (CH2пиперазино), 52.66 с (CH2CH3), 57.34 с (CH2N), 64.59 с (CH2O), 100.47 с (CНCH2CH2CH2CH3), 104.03 д (3JC-F = - 2.8 Гц, Cар), 108.52 с (Cар), 112.95 д (2JC-F = - 23.4 Гц, Cар), 120.84 д (3JC-F = 7.8 Гц, Cар), 127.52 с (Cар), 129.80 c (Cар), 137.21 c (Cар), 139.33 д (4JC-F = - 4.2 Гц, Cар), 146.06 д (2JC-F = - 10.5 Гц, Cар), 146.68 c (Cар), 147.28 c (Cар), 148.55 c (Cпир), 153.65 д (1JC-F = 251.6 Гц, Cар-F), 167.31 с (C(O)OH), 177.12 д (4JC-F = - 1.8 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 539.2664, C29H36FN4O5.Вычислено [М+H]+ 539.2670.
Пример 9. Получение 1-этил-6-фтор-4-оксо-7-(4-((2-трет-бутил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (I-9).
К раствору 0.50 г (1.71 ммоль) соединения 5е в 20 мл абсолютного ДМФА при 20 °C последовательно добавляли 0.50 г (1.57 ммоль) норфлоксацина, 0.28 г (3.23 ммоль) гидрокарбоната натрия и 0.13 г (0.78 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.28 г (34%), серое кристаллическое вещество, т.пл. 266-273 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.08 с (9H, C(CH3)3), 1.59 т (3H, 3JH-H = 7.1 Гц, CH2CH3), 2.57 c (3H, CH3), 2.68 уш с (4H, 2CH2пиперазино), 3.33 уш с (4H, 2CH2пиперазино), 3.49, 3.53 АВ-система (2Н, 2JH-H = - 12.5 Гц, CH2N), 4.32 кв (2H, 3JH-H = 7.1 Гц, CH2CH3), 4.69 с (1H, CHC(CH3)3), 5.04, 5.15 АВ-система (2Н, 2JH-H = - 16.6 Гц, СН2), 6.83 д (1H, 4JH-F = - 6.7 Гц, СHар), 8.04 с (1H, СHар), 8.07 д (1H, 3JH-F = 13.0 Гц, СHар), 8.68 c (1H, СHар), 15.04 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.59 с (CH2CH3), 18.01 с (CH3), 24.42 с (C(CH3)3), 35.13 с (C(CH3)3), 49.88 с (CH2пиперазино), 49.98 д (4JC-F = - 4.3 Гц, CH2пиперазино), 52.67 с (CH2CH3), 57.55 с (CH2N), 65.02 с (CH2O), 103.96 д (3JC-F = 2.9 Гц, Cар), 105.31 с (Cар), 108.52 с (Cар), 112.93 д (2JC-F = - 23.5 Гц, Cар), 120.77 д (3JC-F = 7.8 Гц, Cар), 127.07 с (Cар), 128.92 c (Cар), 137.21 c (Cпир), 140.07 с (Cар), 146.11 д (2JC-F = - 10.5 Гц, Cар), 147.13 c (Cар), 147.24 c (Cар), 148.58 c (Cар), 153.64 д (1JC-F = 251.7 Гц, Cар-F), 167.28 с (C(O)OH), 177.11 д (4JC-F = - 2.1 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 539.2664, C29H36FN4O5.Вычислено [М+H]+ 539.2670.
Пример 10. Получение 1-этил-6-фтор-4-оксо-7-(4-((2-октил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (I-10).
К раствору 0.50 г (1.70 ммоль) соединения 5ж в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.50 г (1.57 ммоль) норфлоксацина, 0.28 г (3.33 ммоль) гидрокарбоната натрия и 0.13 г (0.78 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.19 г (20%), серое кристаллическое вещество, т.пл. 185-190 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.88 т (3H, 3JH-H = 6.4 Гц, CH2CH2CH2CH2CH2CH2CH2CH3), 1.17-1.45 м (10H, CH2CH2CH2CH2CH2CH2CH2CH3), 1.46-1.65 м (2H, CH2CH2CH2CH2CH2CH2CH2CH3), 1.58 т (3H, 3JH-H = 7.2 Гц, CH2CH3), 1.82-1.96 м (2H, CH2CH2CH2CH2CH2CH2CH2CH3), 2.49 c (3H, CH3), 2.66 уш с (4H, 2CH2пиперазино), 3.20-3.39 уш м (4H, 2CH2пиперазино), 3.46, 3.49 АВ-система (2Н, 2JH-H = - 14.0 Гц, CH2-N), 4.31 кв (2H, 3JH-H = 7.2 Гц, CH2CH3), 5.05 т (1H, 3JH-H = 5.4 Гц, CHCH2CH2CH2CH2CH2CH2CH2CH3), 5.04, 5.11 АВ-система (2Н, 2JH-H = - 16.4 Гц, СН2), 6.81 д (1H, 4JH-F = - 6.6 Гц, СHар), 7.98 с (1H, СHар), 8.03 д (1H, 3JH-F = 13.0 Гц, СHар), 8.66 c (1H, СHар), 15.07 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.24 с (CH2CH3), 14.61 с (CH2(CH2)6CH3), 17.72 с (CH3), 22.79 с (CH2(CH2)6CH3), 23.68 с (CH2(CH2)6CH3), 29.33 с (CH2(CH2)6CH3), 29.49 с (CH2(CH2)6CH3), 29.59 с (CH2(CH2)6CH3), 31.98 с (CH2(CH2)6CH3), 34.41 с (CH2(CH2)6CH3), 49.91 с (CH2пиперазино), 49.94 уш c (CH2пиперазино), 52.68 с (CH2CH3), 57.35 с (CH2N), 64.59 с (CH2O), 100.47 с (CНCH2(CH2)6CH3), 104.03 д (3JC-F = 2.4 Гц, Cар), 108.54 с (Cар), 112.96 д (2JC-F = - 23.3 Гц, Cар), 120.85 д (3JC-F = 7.9 Гц, Cар), 127.53 с (Cар), 129.79 уш c (Cар), 137.22 c (Cар), 139.38 уш с (Cар), 146.06 д (2JC-F = -10.3 Гц, Cар), 146.69 c (Cар), 147.28 c (Cар), 148.56 c (Cар), 153.65 д (1JC-F = 251.6 Гц, Cар-F), 167.31 с (C(O)OH), 177.12 д (4JC-F = - 1.8 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 595.3290, C33H44FN4O5. Вычислено [М+H]+ 595.3290.
Пример 11. Получение 1-этил-6-фтор-7-(4-((8-метил-4H-спиро[[1,3]диоксино[4,5-c]пиридин-2.1'-циклопентан]-5-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-11).
К раствору 0.50 г (1.65 ммоль) соединения 5з в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.53 г (1.49 ммоль) гидрохлорида норфлоксацина, 0.39 г (4.64 ммоль) гидрокарбоната натрия и 0.13 г (0.78 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушиваютдосуха и промывают ацетоном. Выход: 0.20 г (25%), серое кристаллическое вещество, т.пл. 228-234 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.58 т (3H, 3JH-H = 6.9 Гц, CH2CH3), 1.76-1.90 м (4H, -CH2CH2CH2CH2-), 1.90-2.01 м (4H, -CH2CH2CH2CH2-), 2.47 c (3H, CH3), 2.65 уш с (4H, 2CH2пиперазино), 3.30 уш с (4H, 2CH2пиперазино), 3.49 с (2Н, CH2N), 4.31 кв (2H, 3JH-H = 6.9 Гц, CH2CH3), 5.06 с (2Н, СН2), 6.81 д (1H, 4JH-F = - 6.5 Гц, СHар), 7.97 с (1H, СHар), 8.03 д (1H, 3JH-F = 13.0 Гц, СHар), 8.66 c (1H, СHар), 15.05 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.58 с (CH2CH3), 18.23 с (CH3), 23.65 с (-CH2CH2CH2CH2-), 36.24 с (-CH2CH2CH2CH2-), 49.87 с (CH2пиперазино), 50.01 д (4JC-F = - 4.4 Гц, CH2пиперазино), 52.66 с (CH2CH3), 57.45 с (CH2N), 60.28 с (CH2O), 103.95 д (3JC-F = 2.6 Гц, Cар), 108.48 с (Cар), 112.88 д (2JC-F = 23.2 Гц, Cар), 120.71 д (3JC-F = 7.7 Гц, Cар), 126.77 с (Cар), 127.91 c (Cар), 137.21 c (Cар), 140.09 с (Cар), 146.10 д (2JC-F = - 10.5 Гц, Cар), 146.95 c (Cар), 147.23 c (Cар), 147.57 c (Cар), 153.62 д (1JC-F = 251.6 Гц, Cар-F), 167.29 с (C(O)OH), 177.09 д (4JC-F = - 2.1 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 537.2508, C29H34FN4O5. Вычислено [М+H]+ 537.2508.
Пример 12. Получение 1-этил-6,8-дифтор-7-(3-метил-4-((2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-12).
К раствору 1.18 г (4.5 ммоль) соединения 5а в 40 мл абсолютного ДМФА при 20 °C последовательно добавляют 1.59 г (4.12 ммоль) гидрохлорида ломефлоксацина, 1.07 г (12.74 ммоль) гидрокарбоната натрия и 0.10 г (0.60 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном и водой. Выход 1.48 г (66%), жёлтое кристаллическое вещество, т.пл. 184-186 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.19 д (3H, 3JH-H = 6.2 Гц, CH3пиперазино), 1.53 с (6Н, 2СН3), 1.50-1.55 уш т (3Н, CH2CH3), 2.20-2.28 м (1Н, СНпиперазино), 2.36 c (3H, CH3), 2.59-2.71 м (2H, CH2пиперазино), 3.05-3.38 м (2H, CH2пиперазино), 3.23-3.30 уш м (2H, CH2пиперазино), 3.08, 3.34 АВ-система (2H, 4JH-H = - 12 Гц, CH2N), 4.39-4.49 м (2Н, CH2CH3), 4.84, 5.16 АВ-система (2Н, 2JH-H = -16.7 Гц, СН2), 7.83-7.88 м (1H, СHар), 7.86 c (1H, СHар), 8.55 с (1H, СHар), 14.66 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.75 с (CH3пиперазино), 16.37 д (5JC-F = 4.7 Гц, CH2CH3), 18.52 с (CH3), 24.57 с (C(СН3)2), 24.95 с (C(СН3)2), 50.31 с (CH2пиперазино), 51.21 уш c (CH2пиперазино), 53.27 с (CHпиперазино), 54.65 д (4JC-F = 16.5 Гц, CH2CH3), 56.02 с (CH2N), 57.36 м (CH2пиперазино), 59.03 с (CH2O), 99.57 с (C(СН3)2), 107.96 с (Cар), 108.21 дд (JC-F = 23.2 Гц, JC-F = 2.3 Гц, Cар), 121.15 д (JC-F = 8.5 Гц, Cар), 126.33 с (Cар), 127.03 с (Cар), 127.16 уш д (Cар), 134.39 т (JC-F = 13.6 Гц, Cар), 140.61 c (Cар), 145.85 дд (1JC-F = 248.6 Гц, 3JC-F = 6.3 Гц, Cар), 146.13 с (Cар), 147.40 c (Cар), 150.00 c (Cар), 155.11 дд (1JC-F = 251.7 Гц, 3JC-F = 6.4 Гц, Cар), 166.59 с (C(O)OH), 176.21 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 543.2511, C28H33F2N4O5. Вычислено [М+Н]+ 543.2414.
Пример 13. Получение 1-этил-6,8-дифтор-7-(3-метил-4-((2,8-диметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-13).
К раствору 0.50 г (2.0 ммоль) соединения 5б в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.71 г (1.81 ммоль) гидрохлорида ломефлоксацина, 0.47 г (5.60 ммоль) гидрокарбоната натрия и 0.05 г (0.30 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном и водой. Выход 0.20 г (21%), жёлтое кристаллическое вещество, т.пл. 195-202 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 1.19-1.25 м (6H, 2CH3пиперазино), 1.56 т (4Н, 3JH-H = 6.3 Гц, 2CH2CH3), 1.61 д (6H, 3JH-H = 5.0 Гц, 2СНCH3), 2.24-2.35 м (4Н, 2СН пиперазино), 2.47 c (6H, 2CH3), 2.60-2.79 м (4H, 2CH2пиперазино), 3.06-3.22 м (4H, 2CH2пиперазино), 3.30 уш с (4H, 2CH2пиперазино), 3.36-3.43 м (2H, CH2N), 3.91-4.03 м (2H, CH2N), 4.40-4.52 м (4Н, 2CH2CH3), 4.93-5.37 м (6Н, 2СН2O + 2СНCH3), 7.92-8.01 м (4H, 4СHар), 8.60 с (2H, 2СHар), 14.64 с (2H, 2C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 14.51 с (CH3пиперазино), 15.03 с (CH3пиперазино), 16.47 д (5JC-F = 4.8 Гц, CH2CH3), 18.48 с (CH3), 18.49 с (CH3), 20.79 с (СНCH3), 50.08 с (CH2пиперазино), 50.50 с (CH2пиперазино), 51.30 уш c (CH2пиперазино), 53.34 с (CHпиперазино), 53.46 с (CHпиперазино), 54.74 д (4JC-F = 16.3 Гц, CH2CH3), 56.06 с (CH2N), 56.11 с (CH2N), 57.70 уш с (CH2пиперазино), 64.40 с (CH2O), 65.01 с (CH2O), 97.10 с (СНCH3), 97.23 с (СНCH3), 108.18 с (Cар), 108.48 д (JC-F = 23.4 Гц, Cар), 121.42 д (JC-F = 8.1 Гц, Cар), 127.11-127.44 м (Cар), 127.70 с (Cар), 127.80 с (Cар), 128.06 с (Cар), 134.29-134.69 м (Cар), 141.06 c (Cар), 140.35 c (Cар), 145.99 дд (1JC-F = 248.1 Гц, 3JC-F = 5.3 Гц, Cар), 147.08 с (Cар), 147.16 c (Cар), 148.02 c (Cар), 150.09 c (Cар), 155.24 дд (1JC-F = 251.7 Гц, 3JC-F = 6.5 Гц, Cар), 166.75 с (C(O)OH), 176.37 уш с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 529.2257, C27H31F2N4O5. Вычислено [М+Н]+ 529.2257.
Пример 14. Получение 1-этил-7-(4-((2-этил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)-3-метилпиперазин-1-ил)-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-14).
К раствору 0.50 г (1.87 ммоль) соединения 5в в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.71 г (1.84 ммоль) гидрохлорида ломефлоксацина, 0.44 г (5.24 ммоль) гидрокарбоната натрия и 0.04 г (0.34 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном и водой. Выход 0.13 г (13%), жёлтое кристаллическое вещество, т.пл. 206-209 °С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 1.10 т (6H, 3JH-H = 7.5 Гц, 2СНCH2CH3), 1.20 д (3H, 3JH-H = 6.5 Гц, CH3пиперазино), 1.24 д (3H, 3JH-H = 9.2 Гц, CH3пиперазино), 1.55 т (6Н, 3JH-H = 6.9 Гц, 2CH2CH3), 1.86-1.97 м (4Н, 2СНCH2CH3), 2.22-2.35 м (2Н, 2СНпиперазино), 2.45 c (6H, 2CH3), 2.57-2.78 м (4H, 2CH2пиперазино), 3.09-3.16 м (4H, 2CH2пиперазино), 3.30 уш с (4H, 2CH2пиперазино), 3.35-3.42 м (4H, 2CH2N), 3.90-4.00 м (4H, 2CH2N), 4.40-4.52 м (4Н, 2CH2CH3), 4.93-5.37 м (6Н, 2СН2O + 2СНCH3), 7.94 (2H, 2СHар), 7.95 м (2H, 2СHар), 8.59 с (2H, 2СHар), 14.65 с (1H, C(O)OH), 14.66 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 8.00 с (СНCH2CH3), 8.03 с (СНCH2CH3), 14.54 с (CH3пиперазино), 15.08 с (CH3пиперазино), 16.48 д (5JC-F = 4.8 Гц, CH2CH3), 18.26 с (CH3), 18.27 с (CH3), 27.72 с (СНCH2CH3), 27.73 с (СНCH2CH3), 50.16 уш с (CH2пиперазино), 50.58 уш с (CH2пиперазино), 51.24 уш с (CH2пиперазино), 53.32 с (CHпиперазино), 53.45 с (CHпиперазино), 54.75 д (4JC-F = 16.5 Гц, CH2CH3), 56.15 уш с (CH2N), 57.91 уш с (CH2пиперазино), 64.51 с (CH2O), 65.10 с (CH2O), 100.82 с (СНCH2CH3), 100.93 с (СНCH2CH3), 108.19 с (Cар), 108.50 д (JC-F = 23.2 Гц, Cар), 121.45 д (JC-F = 8.4 Гц, Cар), 127.20 с (Cар), 127.27 с (Cар), 127.55 с (Cар), 127.92 с (Cар), 128.33 с (Cар), 128.59 с (Cар), 134.27-134.61 м (Cар), 140.60 c (Cар), 140.89 c (Cар), 145.98 дд (1JC-F = 249.4 Гц, 3JC-F = 6.7 Гц, Cар), 146.98 с (Cар), 147.06 c (Cар), 148.17 c (Cар), 150.10 c (Cар), 155.24 дд (1JC-F = 251.9 Гц, 3JC-F = 6.4 Гц, Cар), 166.76 с (C(O)OH), 176.38 уш с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 543.2414, C28H33F2N4O5. Вычислено[М+Н]+ 543.2414.
Пример 15. Получение 1-этил-7-(4-((2-пропил-8-метил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)-3-метилпиперазин-1-ил)-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-15).
К раствору 0.50 г (1.76 ммоль) соединения 5г в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.63 г (1.63 ммоль) гидрохлорида ломефлоксацина, 0.42 г (5.00 ммоль) гидрокарбоната натрия и 0.04 г (0.24 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном и водой. Выход 0.22 г (24%), жёлтое кристаллическое вещество, т.пл. 204-205 °С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 1.02 т (6H, 3JH-H = 7.4 Гц, 2СНCH2CH2CH3), 1.20 т (6Н, 3JH-H = 6.5 Гц, 2CH2CH3), 1.48-1.63 м (10H, 2CH3пиперазино, 2СНCH2CH2CH3), 1.80-1.94 м (4Н, 2СНCH2CH2CH3), 2.20-2.34 м (2Н, 2СНпиперазино), 2.42 c (6H, 2CH3), 2.58-2.78 м (4H, 2CH2пиперазино), 3.01-3.44 уш м (4H, 2CH2пиперазино), 3.29 уш с (4H, 2CH2пиперазино), 3.44-3.44 м (2H, 2CH2N), 3.90-4.04 м (2H, 2CH2N), 4.37-4.54 м (4Н, 2CH2CH3), 5.01 т (1H, 3JH-H = 5.2 Гц, СНCH2CH2CH3), 5.05 т (1H, 3JH-H = 5.1 Гц, СНCH2CH2CH3), 4.93, 5.11 АВ-система (2Н, 2JH-H = -16.2 Гц, СН2), 4.96, 5.35 АВ-система (2Н, 2JH-H = - 16.2 Гц, СН2), 7.91 уш с (2H, 2СHар), 7.93 уш д (2H, 3JH-F = 11.1 Гц, 2СHар), 8.58 с (2H, 2СHар), 14.65 с (1H, C(O)OH), 14.66 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 14.08 с (СНCH2CH2CH3), 14.55 с (CH3пиперазино), 15.09 с (CH3пиперазино), 16.47 д (5JC-F = 4.7 Гц, CH2CH3), 17.14 с (СНCH2CH2CH3), 17.16 с (СНCH2CH2CH3), 18.48 с (CH3), 18.50 с (CH3), 29.81 с (СНCH2CH2CH3), 50.10 уш с (CH2пиперазино), 50.52 с (CH2пиперазино), 51.30 м (CH2пиперазино), 53.37 с (CHпиперазино), 53.49 с (CHпиперазино), 54.73 д (4JC-F = 16.6 Гц, CH2CH3), 56.11 с (CH2N), 57.50-57.92 м (CH2пиперазино), 64.50 с (CH2O), 65.10 с (CH2O), 99.82 с (СНCH2CH2CH3), 99.94 с (СНCH2CH2CH3), 108.19 с (Cар), 108.49 д (JC-F = 23.3 Гц, Cар), 121.42 д (JC-F = 8.6 Гц, Cар), 127.20 с (Cар), 127.27 с (Cар), 127.32 с (Cар), 127.67 с (Cар), 127.92 с (Cар), 128.20 с (Cар), 134.26-134.75 м (Cар), 141.07 c (Cар), 141.37 c (Cар), 144.61-144.85 м (Cар), 147.17 с (Cар), 147.25 c (Cар), 148.08 c (Cар), 150.09 c (Cар), 155.24 дд (1JC-F = 251.6 Гц, 3JC-F = 6.7 Гц, Cар), 166.75 с (C(O)OH), 176.38 уш c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 557.2570, C29H35F2N4O5. Вычислено[М+Н]+ 557.2570.
Пример 16. Получение 1-циклопропил-6-фтор-8-метокси-4-оксо-7-(1-((2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)октагидро-6H-пиролло[3,4-b]пиридин-6-ил)-1,4-дигидрохинолин-3-карбоновой кислота (I-16).
К раствору 3.93 г (14.88 ммоль) соединения 5а в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 5.00 г (11.43 ммоль) моксифлоксацина гидрохлорида, 3.17 г (37.77 ммоль) гидрокарбоната натрия и 1.14 г (6.87 ммоль) иодида калия. Реакционную смесь перемешивают 5 ч при 80 °С. Затем растворитель удаляют в вакууме, сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и очищают с помощью колоночной хроматографии (элюент CHCl3:C2H5OH = 7:1). Выход 1.70 г (25%), светло-желтое кристаллическое вещество, т.пл. 110-112 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.85-0.99 м (2Н, CH2циклопропил), 1.06-1.19 м (2Н, CH2циклопропил), 1.40 c (3H, CH3), 1.42 c (3H, CH3), 1.47-1.66 м (4Н), 2.10-2.14 м (1Н), 2.29 c (3H, CH3), 2.32-2.39 м (1H), 2.61-2.65 м (1Н), 2.65 м (1Н), 3.01 м (1Н), 3.14, 3.66 АВ-система (2H, 2JH-H = - 13.6 Гц, CH2), 3.51 c (3H, CH3O), 3.60-3.71 м (2Н), 3.83-3.86 м (1Н), 3.91-3.96 м (1Н), 3.98 м (2Н), 4.66, 4.91 АВ-система (2H, 2JH-H = - 16.6 Гц, CH2), 7.70 д (1H, 3JH-F = 14.1 Гц, СHар), 7.81 c (1H, СHар), 8.69 c (1H, СHар), 15.02 уш с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 9.35 c (CH2), 9.82 c (CH2), 18.47 c (CH3), 22.56 c (CH2), 23.90 c (CH2), 24.62 c (С(CH3)2), 24.85 c (С(CH3)2), 37.57 c (CH), 40.53 c (CH), 49.67 c (CH2), 52.10 д (CH2, 4JC-F = 6.0 Гц, CH2N), 54.38 д (4JC-F = 6.5 Гц, CH2N), 55.15 с (CH2), 58.79 с (CH3O), 61.24 c (CH2), 62.24 c (CH), 99.65 c (С(CH3)2), 107.63 с (Cар), 108.04 д (2JC-F = 24.0 Гц, Cар), 118.18 д (3JC-F = 9.1 Гц, Cар), 126.38 с (Cар), 127.30 c (Cар), 134.63 с (Cар), 137.65 д (2JC-F = 10.9 Гц, Cар-N), 140.01 c (Cар), 146.20 с (Cар), 147.34 с (Cар), 149.66 с (Cар), 153.52 с (1JC-F = 250.5 Гц, C-F), 167.24 с (C(O)OH), 176.81 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 593.2770, C32H38FN4O6. Вычислено [М+H]+ 593.2775.
Пример 17. Получение 1-циклопропил-7-(1-((2,8-диметил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил)-6-фтор-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-17).
К раствору 0.50 г (2.00 ммоль) соединения 5б в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.79 г (1.81 ммоль) гидрохлорида моксифлоксацина, 0.47 г (5.59 ммоль) гидрокарбоната натрия и 0.15 г (0.90 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.40 г (38%), жёлтое кристаллическое вещество, т.пл. 120-130 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.91-1.07 м (4H, 2CH2циклопропил), 1.11-1.28 м (4H, 2CH2циклопропил), 1.53 д (3H, 3JH-H = 5.1 Гц, СНCH3), 1.53 д (3H, 3JH-H = 5.1 Гц, СНCH3), 1.48-1.56 м (8H), 2.15-2.27 м (2H), 2.34-2.46 м (2H), 2.38 с (3H, CH3), 2.40 с (3H, CH3), 2.62-2.75 м (2H), 3.01-3.15 м (2H), 3.19, 3.73 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2N), 3.23, 3.70 АВ-система (2Н, 2JH-H = - 12.0 Гц, СН2N), 3.57 с (3H, OCH3.), 3.57 с (3H, OCH3), 3.63-3.78 м (6H), 3.84-3.93 м (2H), 3.95-4.03 м (2H), 4.79, 4.95 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 4.85, 5.12 АВ-система (2Н, 2JH-H = -16.0 Гц, СН2), 5.07 кв (1H, 3JH-H = 5.1 Гц, СНCH3), 5.14 кв (1H, 3JH-H = 5.1 Гц, СНCH3), 7.79 д (1H, 3JH-F = 14.3 Гц, СHар), 7.79 д (2H, 3JH-F = 14.0 Гц, СHар), 7.90 c (1H, СHар.), 7.91 c (1H, СHар.) 8.76 c (2H, 2СHар), 15.04 с (2H, 2С(О)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 9.40 с (CH2), 9.45 с (CH2), 9.80 с (CH2), 9.83 с (CH2), 14.33 с (CHCH3), 18.40 с (CH3), 22.62 с (CH2), 22.68 с (CH2), 23.93 с (CH2), 23.96 с (CH2), 37.56 с (СH), 37.64 с (СH), 40.53 с (СH), 49.59 с (CH2), 49.71 с (CH2), 51.72 д (4JC-F = 4.6 Гц, CH2N), 52.05 д (4JC-F = 3.9 Гц, CH2N), 54.32 д (4JC-F = 7.3 Гц, CH2N), 54.55 д (4JC-F = 5.9 Гц, CH2N), 55.13 с (CH2), 55.46 с (CH2), 61.21 с (CH3O), 61.32 с (CH3O), 61.98 с (CH2), 62.36 с (CH2), 64.20 с (CH), 64.63 с (CH), 97.12 с (CHCH3), 97.17 с (CHCH3), 107.70 с (Сар), 107.72 с (Сар), 108.08 д (JC-F = 24.1 Гц, Cар), 108.14 д (JC-F = 24.1 Гц, Cар), 118.22 д (JC-F = 8.9 Гц, Cар), 118.37 д (JC-F = 8.9 Гц, Cар), 127.70 с (Cар), 127.79 с (Cар), 127.93 с (Cар), 134.63 с (Cар), 137.59 д (JC-F = 10.8 Гц, Cар), 137.63 д (JC-F = 10.9 Гц, Cар), 140.34-140.77 м (Сар), 146.93 с (Cар), 147.00 с (Cар), 147.97 с (Cар), 147.98 с (Cар), 149.71 с (Cар), 153.51 д (1JC-F = 250.7 Гц, Cар-F), 153.61 д (1JC-F = 250.8 Гц, Cар-F), 167.24 с (C(O)OH), 176.85 д (C=O), 176.86 с (4JC-F = - 2.3 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 579.2610, C31H36FN4O6. Вычислено [М+H]+ 579.2613.
Пример 18. Получение 1-циклопропил-7-(1-((2-этил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил)-6-фторо-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-18).
К раствору 0.50 г (2.20 ммоль) соединения 5в в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.87 г (1.99 ммоль) гидрохлорида моксифлоксацина, 0.52 г (6.19 ммоль) гидрокарбоната натрия и 0.17 г (1.02 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.32 г (27%), жёлтое кристаллическое вещество, Т.пл. 137-140 °С (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 0.90-1.11 м (4H, 2CH2циклопропил), 1.12-1.29 м (4H, 2CH2циклопропил), 1.03 т (3H, 3JH-H = 7.5 Гц, СНCH2CH3), 1.03 т (3H,3JH-H = 7.5 Гц, СНCH2CH3), 1.50-1.80 м (8H), 1.82-1.94 м (4H, СНCH2CH3), 2.15-2.30 м (2H), 2.38-2.50 м (2H), 2.50 с (3H, CH3), 2.53 с (3H, CH3), 2.63-2.73 м (2H), 3.02-3.18 м (2H), 3.22, 3.73 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2N), 3.29, 3.82 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2N), 3.59 с (3H, OCH3.), 3.60 с (3H, OCH3), 3.53-3.93 м (8H), 3.96-4.04 м (2H), 4.89, 4.98 АВ-система (2Н, 2JH-H = - 18.0 Гц, СН2), 4.82, 5.15 АВ-система (2Н, 2JH-H = -16.0 Гц, СН2), 4.92 т (1H, 3JH-H = 4.9 Гц, СНСН2CH3), 4.98 т (1H, 3JH-H = 4.9 Гц, СНСН2CH3), 7.79 д (1H, 3JH-F = 14.0 Гц, СHар), 7.98 c (1H, СHар), 7.98 c (1H, СHар) 8.77 c (2H, 2СHар), 14.99 с (2H, 2С(О)OH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 7.66 с (СНCH2CH3), 7.69 с (СНCH2CH3), 8.55 с (CH2), 8.66 с (CH2), 9.37 с (CH2), 9.49 с (CH2), 17.93 с (CH3), 18.03 с (CH3), 21.65 с (CH2), 21.91 с (CH2), 23.03 с (CH2), 23.08 с (CH2), 26.98 с (СНCH2CH3), 37.10 с (СH), 40.66 с (СH), 49.82 с (CH2), 49.92 с (CH2), 52.84 д (4JC-F = 6.8 Гц, CH2N), 53.09 с (CH2N), 53.31 д (4JC-F = 5.3 Гц, CH2N), 53.36 д (4JC-F = 5.0 Гц, CH2N), 54.07 с (CH2), 54.50 с (CH2), 61.21 с (CH3O), 61.30 с (CH3O), 62.09 с (CH2), 62.46 с (CH2), 63.53 с (CH), 64.00 с (CH), 99.91 с (СНСН2CH3), 100.09 с (СНСН2CH3), 106.24 с (Сар), 106.27 с (Сар), 106.45 д (JC-F = 22.8 Гц, Cар), 116.71 д (JC-F = 7.8 Гц, Cар), 116.78 д (JC-F = 8.0 Гц, Cар), 127.93 с (Cар), 127.96 с (Cар), 128.51 с (Cар), 128.61 с (Cар), 134.50 с (Cар), 134.55 с (Cар), 137.25 д (JC-F = 10.4 Гц, Cар), 137.33 д (JC-F = 10.5 Гц, Cар), 140.18 с (Cар), 140.29 с (Cар), 140.36 с (Cар), 140.44 с (Cар), 145.09 с (Cар), 145.16 с (Cар), 147.06 с (Cар), 147.20 с (Cар), 150.09 с (Cар), 152.78 д (1JC-F = 249.6 Гц, Cар-F), 152.89 д (1JC-F = 249.7 Гц, Cар-F), 165.95 с (C(O)OH), 175.93 д (4JC-F = 2.3 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 593.2770, C32H38FN4O6. Вычислено [М+H]+ 593.2770.
Пример 19. Получение 1-циклопропил-7-(1-((2-пропил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил)-6-фторо-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-19).
К раствору 0.50 г (2.10 ммоль) соединения 5г в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.83 г (1.90 ммоль) гидрохлорида моксифлоксацина, 0.49 г (5.83 ммоль) гидрокарбоната натрия и 0.16 г (0.96 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровываютю, фильтрат высушивают досуха и промывают ацетоном. Выход 0.35 г (30%), жёлтое кристаллическое вещество, т.пл. 118-120 °С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 0.89-1.09 м (4H, 2CH2циклопропил), 0.96 т (3H, 3JH-H = 7.1 Гц, СНCH2CH2CH3), 0.98 т (3H,3JH-H = 7.1 Гц, СНCH2CH2CH3), 1.10-1.28 м (4H, 2CH2циклопропил), 1.43-1.89 м (16H), 2.15-2.28 м (2H), 2.36-2.51 м (2H), 2.42 с (3H, CH3), 2.45 с (3H, CH3), 2.63-2.75 м (2H), 3.01-3.17 м (2H), 3.19, 3.71 АВ-система (2Н, 2JH-H = - 14.0 Гц, СН2N), 3.26, 3.75 АВ-система (2Н, 2JH-H = - 14.0 Гц, СН2N), 3.57 с (3H, OCH3.), 3.58 с (3H, OCH3), 3.53-3.83 м (6H), 3.83-3.93 м (2H), 3.95-4.04 м (2H), 4.78, 5.13 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 4.85, 4.95 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 4.93 т (1H, 3JH-H = 5.1 Гц, СНСН2СН2CH3), 4.99 т (1H, 3JH-H = 5.3 Гц, СНСН2СН2CH3), 7.79 д (2H, 3JH-F = 14.0 Гц, СHар), 7.92 c (1H, СHар), 7.93 c (1H, СHар.) 8.77 c (2H, 2СHар), 15.05 с (2H, 2С(О)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 9.31 с (CH2), 9.45 с (CH2), 9.82 с (CH2), 9.95 с (CH2), 13.99 с (СНCH2CH2CH3), 17.05 с (СНCH2CH2CH3), 17.46 с (CH3), 17.52 с (CH3), 22.43 с (CH2), 22.59 с (CH2), 23.76 с (CH2), 23.88 с (CH2), 36.30 с (СНCH2CH2CH3), 37.54 с (СH), 37.69 с (СH), 40.53 с (СH), 49.77 с (CH2), 50.04 с (CH2), 51.94 д (4JC-F = 5.7 Гц, CH2N), 52.56 уш с (CH2N), 54.16 д (4JC-F = 7.5 Гц, CH2N), 54.49 д (4JC-F = 5.4 Гц, CH2N), 54.90 с (CH2), 55.26 с (CH2), 61.33 с (CH3O), 61.41 с (CH3O), 62.16 с (CH2), 62.42 с (CH2), 64.29 с (CH), 64.73 с (CH), 100.17 с (СНСН2СН2CH3), 100.28 с (СНСН2СН2CH3), 107.75 с (Сар), 107.77 с (Сар), 108.13 д (JC-F = 24.1 Гц, Cар), 108.18 д (JC-F = 24.1 Гц, Cар), 118.36 д (JC-F = 8.6 Гц, Cар), 118.50 д (JC-F = 8.5 Гц, Cар), 128.85 с (Cар), 128.93 с (Cар), 129.70 с (Cар), 129.80 с (Cар), 134.65 с (Cар), 137.53 д (JC-F = 10.8 Гц, Cар), 137.57 д (JC-F = 11.0 Гц, Cар), 140.54 с (Cар), 140.60 с (Cар), 140.67 с (Cар), 146.14 с (Cар), 146.25 с (Cар), 148.49 с (Cар), 148.56 с (Cар), 149.74 с (Cар), 153.53 д (1JC-F = 250.3 Гц, Cар-F), 153.61 д (1JC-F = 250.6 Гц, Cар-F), 167.21 с (C(O)OH), 176.85 с (C=O), 176.87 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 607.2926, C33H40FN4O6. Вычислено [М+H]+ 607.2926.
Пример 20. Получение 1-циклопропил-7-(1-((2-бутил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил)-6-фторо-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-20).
К раствору 0.50 г (1.71 ммоль) соединения 5д в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.68 г (1.56 ммоль) гидрохлорида моксифлоксацина, 0.40 г (4.76 ммоль) гидрокарбоната натрия и 0.13 г (0.78 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляли в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.30 г (31%), жёлтое кристаллическое вещество, т.пл. 108-114 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 0.88-1.09 м (4H, 2CH2циклопропил), 0.92 т (3H, 3JH-H = 7.0 Гц, СНCH2CH2CH2CH3), 0.93 т (3H,3JH-H = 6.8 Гц, СНCH2CH2CH2CH3), 1.10-1.28 м (4H, 2CH2циклопропил), 1.30-1.91 м (20H), 2.14-2.27 м (2H), 2.34-2.45 м (2H), 2.37 с (3H, CH3), 2.40 с (3H, CH3), 2.64-2.73 м (2H), 3.01-3.13 м (2H), 3.17, 3.69 АВ-система (2Н, 2JH-H = - 14.0 Гц, СН2N), 3.24, 3.73 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2N), 3.56 с (3H, OCH3), 3.57 с (3H, OCH3), 3.54-3.82 м (6H), 3.85-3.93 м (2H), 3.95-4.03 м (2H), 4.77, 5.11 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 4.84, 4.94 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 4.89 т (1H, 3JH-H = 5.2 Гц, СНCH2СН2СН2CH3), 4.96 т (1H, 3JH-H = 5.2 Гц, СНCH2СН2СН2CH3), 7.78 д (1H, 3JH-F = 14.1 Гц, СHар), 7.78 д (1H, 3JH-F = 14.1 Гц, СHар), 7.89 c (1H, СHар), 7.90 c (1H, СHар) 8.76 c (2H, 2СHар), 15.06 с (2H, 2С(О)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 9.32 с (CH2), 9.45 с (CH2), 9.79 с (CH2), 9.92 с (CH2), 14.06 с (СНCH2CH2CH2CH3), 17.66 с (CH3), 17.70 с (CH3), 22.46 с (CH2), 22.51 с (CH2), 22.62 с (CH2), 23.79 с (CH2), 23.90 с (CH2), 25.76 с (CH2), 34.00 с (СНCH2CH2CH2CH3), 37.53 с (СH), 37.66 с (СH), 40.54 с (СH), 49.69 с (CH2), 49.94 с (CH2), 51.78 д (4JC-F = 4.4 Гц, CH2N), 52.42 д (4JC-F = 4.4 Гц, CH2N), 54.19 д (4JC-F = 7.1 Гц, CH2N), 54.51 д (4JC-F = 5.9 Гц, CH2N), 54.93 с (CH2), 55.32 с (CH2), 61.29 с (CH3O), 61.37 с (CH3O), 62.10 с (CH2), 62.38 с (CH2), 64.30 с (CH), 64.74 с (CH), 100.27 с (СНСН2СН2СН2CH3), 100.38 с (СНСН2СН2СН2CH3), 107.70 с (Сар), 107.71 с (Сар), 108.07 д (JC-F = 23.9 Гц, Cар), 108.13 д (JC-F = 24.1 Гц, Cар), 118.28 д (JC-F = 8.7 Гц, Cар), 118.42 д (JC-F = 8.7 Гц, Cар), 128.45 с (Cар), 128.57 с (Cар), 129.35 уш с (Cар), 134.64 с (Cар), 137.55 д (JC-F = 10.8 Гц, Cар), 137.58 д (JC-F = 10.8 Гц, Cар), 138.85-139.14 м (Cар), 140.50 с (Cар), 140.56 с (Cар), 140.63 с (Cар), 146.30 с (Cар), 146.43 с (Cар), 148.37 с (Cар), 148.43 с (Cар), 149.71 с (Cар), 153.52 д (1JC-F = 250.7 Гц, Cар-F), 153.60 д (1JC-F = 250.8 Гц, Cар-F), 167.22 с (C(O)OH), 176.83 д (4JC-F = 2.2 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 621.3083, C34H42FN4O6. Вычислено [М+H]+ 621.3083.
Пример 21. Получение 1-циклопропил-7-(1-((2-трет-бутил-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил)-6-фторо-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-21).
К раствору 0.50 г (1.71 ммоль) соединения 5е в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.68 г (1.56 ммоль) гидрохлорида моксифлоксацина, 0.40 г (4.76 ммоль) гидрокарбоната натрия и 0.13 г (0.78 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.36 г (36%), жёлтое кристаллическое вещество, т.пл. 191-196 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 0.89-1.08 м (4H, 2CH2циклопропил), 1.00 с (18H, 2СНC(CH3)3), 1.10-1.29 м (4H, 2CH2циклопропил), 1.52-1.84 м (8H), 2.13-2.31 м (2H), 2.39-2.53 м (2H), 2.53 с (3H, CH3), 2.56 с (3H, CH3), 2.63-2.74 м (2H), 2.99-3.25 м (2H), 3.20, 3.79 АВ-система (2Н, 2JH-H = - 12.0 Гц, СН2N), 3.31, 3.85 АВ-система (2Н, 2JH-H = - 12.0 Гц, СН2N), 3.59 с (3H, OCH3), 3.60 с (3H, OCH3), 3.50-3.91 м (8H), 3.96-4.05 м (2H), 4.87, 5.16 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 4.82, 4.96 АВ-система (2Н, 2JH-H = - 18.0 Гц, СН2), 4.56 с (1H, СНC(CH3)3), 4.65 с (1H, СНC(CH3)3), 7.80 д (2H, 3JH-F = 14.1 Гц, СHар), 7.98 c (1H, СHар.), 8.77 c (1H, СHар), 8.78 c (1H, СHар), 15.00 с (2H, 2С(О)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 9.19 с (CH2), 9.46 с (CH2), 9.82 с (CH2), 10.03 с (CH2), 17.36 с (CH3), 17.57 с (CH3), 22.31 с (CH2), 22.60 с (CH2), 23.66 с (CH2), 23.87 с (CH2), 24.26 с (СНC(CH3)3), 24.29 с (СНC(CH3)3), 35.04 с (СНC(CH3)3), 37.57 с (СH), 37.74 с (СH), 40.53 с (СH), 49.81 с (CH2), 50.21 с (CH2), 52.02 с (CH2N), 52.93 с (CH2N), 54.11 д (4JC-F = 6.9 Гц, CH2N), 54.45 д (4JC-F = 5.8 Гц, CH2N), 54.91 с (CH2), 54.94 с (CH2), 55.37 с (CH2), 55.41 с (CH2), 61.36 с (CH3O), 62.25 с (CH2), 62.48 с (CH2), 64.76 с (CH), 65.24 с (CH), 105.38 с (СНC(CH3)3), 105.46 с (СНC(CH3)3), 107.72 с (Сар), 107.74 с (Сар), 108.10 д (JC-F = 21.9 Гц, Cар), 108.17 д (JC-F = 23.9 Гц, Cар), 118.22 д (JC-F = 7.9 Гц, Cар), 118.37 д (JC-F = 8.5 Гц, Cар), 128.69-129.87 уш м (Cар), 134.63 с (Cар), 134.68 с (Cар), 137.43-137.78 м (Cар), 138.20 с (Cар), 140.52 с (Cар), 146.20 с (Cар), 146.36 с (Cар), 148.71 с (Cар), 148.80 с (Cар), 149.73 с (Cар), 153.51 д (1JC-F = 250.7 Гц, Cар-F), 153.55 д (1JC-F = 250.9 Гц, Cар-F), 167.22 с (C(O)OH), 176.83 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 621.3083, C34H42FN4O6. Вычислено [М+H] 621.3088.
Пример 22. Получение 1-циклопропил-6-фторо-8-метокси-7-(1-((8-метил-2-октил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-22).
К раствору 0.50 г (1.43 ммоль) соединения 5ж в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.57 г (1.30 ммоль) гидрохлорида моксифлоксацина, 0.34 г (4.05 ммоль) гидрокарбоната натрия и 0.11 г (0.63 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель отгоняют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.26 г (30%), жёлтое кристаллическое вещество, т.пл. 87-90 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 0.88 т (3H, 3JH-H = 6.5 Гц, СН(CH2)7CH3), 0.88 т (3H, 3JH-H = 7.1 Гц, СН(CH2)7CH3), 0.91-1.08 м (4H, 2CH2циклопропил), 1.10-1.40 м (24H, 2CH2циклопропил, 2СНCH2CH2(CH2)5CH3), 1.41-1.91 м (16H), 2.15-2.31 м (2H), 2.35-2.52 м (2H), 2.44 с (3H, CH3), 2.47 с (3H, CH3), 2.63-2.75 м (2H), 3.02-3.16 м (2H), 3.20, 3.71 АВ-система (2Н, 2JH-H = - 14.0 Гц, СН2N), 3.27, 3.75 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2N), 3.58 с (3H, OCH3), 3.59 с (3H, OCH3), 3.52-3.93 м (8H), 3.95-4.04 м (2H), 4.80, 5.13 АВ-система (2Н, 2JH-H = - 18.0 Гц, СН2), 4.87, 4.95 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 4.93 т (1H, 3JH-H = 4.8 Гц, СНC8H17), 4.99 т (1H, 3JH-H = 5.0 Гц, СНC8H17), 7.79 д (2H, 3JH-F = 14.0 Гц, СHар), 7.94 c (1H, СHар), 7.95 c (1H, СHар), 8.77 c (2H, 2СHар), 15.03 с (2H, 2С(О)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д. (смесь двух диастереомеров): 9.35 с (CH2), 9.48 с (CH2), 9.78 с (CH2), 9.90 с (CH2), 14.24 с (СН(CH2)7CH3), 17.87 с (CH3), 22.52 с (CH2), 22.68 с (CH2), 22.79 с (CH2), 23.65 с (CH2), 23.84 с (CH2), 23.95 с (CH2), 29.34 с (CH2), 29.44 с (CH2), 29.55 с (CH2), 31.97 с (CH2), 34.33 с (CH2), 37.53 с (СH), 37.66 с (СH), 40.53 с (СH), 49.64 с (CH2), 49.87 с (CH2), 51.67 д (4JC-F = 5.2 Гц, CH2N), 52.28 д (4JC-F = 2.1 Гц, CH2N), 54.27 д (4JC-F = 7.2 Гц, CH2N), 54.57 д (4JC-F = 4.8 Гц, CH2N), 54.98 с (CH2), 55.37 с (CH2), 61.28 с (CH3O), 61.36 с (CH3O), 62.06 с (CH2), 62.35 с (CH2), 64.32 с (CH), 64.75 с (CH), 100.23 с (СНC8H17), 100.33 с (СНC8H17), 107.73 с (Сар), 107.75 с (Сар), 108.10 д (JC-F = 23.9 Гц, Cар), 108.17 д (JC-F = 24.2 Гц, Cар), 118.31 д (JC-F = 8.7 Гц, Cар), 118.45 д (JC-F = 8.8 Гц, Cар), 128.27 с (Cар), 128.40 с (Cар), 129.02 с (Cар), 129.17 с (Cар), 134.64 с (Cар), 137.55 д (JC-F = 11.0 Гц, Cар), 137.59 д (JC-F = 10.5 Гц, Cар), 139.14-139.50 м (Cар), 140.51 с (Cар), 140.57 с (Cар), 140.64 с (Cар), 146.47-146.61 м (Cар), 148.30 с (Cар), 148.36 с (Cар), 149.72 с (Cар), 153.53 д (1JC-F = 250.6 Гц, Cар-F), 153.61 д (1JC-F = 250.4 Гц, Cар-F), 167.22 с (C(O)OH), 176.85 д (4JC-F = 2.1 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 677.3709, C38H50FN4O6. Вычислено [М+H]+ 677.3709.
Пример 23. Получение 7-(1-((8-метил-4H-спиро[[1,3]диоксино[4,5-c]пиридин-2,1'-циклопентан]-5ил)метил)октагидро-6Н-пирроло[3,4-b]пиридин-6-ил)-1-циклопропил-6-фторо-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-23).
К раствору 0.50 г (1.60 ммоль) соединения 5з в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.69 г (1.58 ммоль) гидрохлорида моксифлоксацина, 0.39 г (4.64 ммоль) гидрокарбоната натрия и 0.13 г (0.78 ммоль) иодида калия. Реакционную смесь перемешивают 4 ч при 80 °С. Растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.27 г (28%), жёлтое кристаллическое вещество, т.пл. 128-132 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.88-1.08 м (2H, CH2циклопропил), 1.10-1.28 м (2H, CH2циклопропил), 1.50-2.00 м (12H), 2.13-2.26 м (1H), 2.39-2.54 м (1H), 2.47 с (3H, CH3), 2.64-2.74 м (1H), 3.04-3.13 уш м (1H), 3.24, 3.76 АВ-система (2Н, 2JH-H = - 14.0 Гц, СН2N), 3.59 с (3H, OCH3), 3.54-3.82 м (3H), 3.84-3.92 м (1H), 3.96-4.04 м (1H), 4.78, 5.04 АВ-система (2Н, 2JH-H = - 16.0 Гц, СН2), 7.79 д (1H, 3JH-F = 14.1 Гц, СHар), 7.95 c (1H, СHар) 8.77 c (1H, СHар), 15.02 с (1H, С(О)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 9.36 с (CH2), 9.89 с (CH2), 17.77 с (CH3), 22.49 с (CH2), 23.56 с (CH2), 23.58 с (CH2), 23.84 с (CH2), 36.04 с (CH2), 36.19 с (CH2), 37.62 с (СH), 40.53 с (СH), 49.90 с (CH2), 52.35 д (4JC-F = 6.5 Гц, CH2N), 54.32 д (4JC-F = 6.0 Гц, CH2N), 55.04 с (CH2), 60.20 с (CH3O), 61.34 с (CH2), 62.32 с (CH), 107.74 с (С(-CH2CH2CH2CH2-)), 108.13 д (JC-F = 24.0 Гц, Cар), 111.43 с (Сар), 118.36 д (JC-F = 8.8 Гц, Cар), 128.18 м (Cар), 134.66 с (Cар), 137.59 д (JC-F = 10.6 Гц, Cар), 140.49 с (Cар), 140.56 с (Cар), 146.81 с (Cар), 147.13 с (Cар), 149.72 с (Cар), 153.56 д (1JC-F = 250.7 Гц, Cар-F), 167.21 с (C(O)OH), 176.85 д (4JC-F = 3.0 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 619.2926, C34H40FN4O6. Вычислено [М+H]+ 619.2926.
Пример 24. Получение гидрохлорида 1-этил-6-фторо-7-(4-((5-гидрокси-4-гидроксиметил-6-метилпиридин-3-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-24).
0.20 г (0.39 ммоль) соединения I-4 и конц HCl (1 мл) в 20 мл воды перемешивают 24 ч при 25 °C. Далее раствор нейтрализуют с помощью гидрокарбоната натрия до pH = 6. Выпавший осадок отфильтровывают и промывают последовательно ацетоном и водой. Далее осадок высушивают в вакууме и добавляют эквимольное количество 0.1 Н. HCl. Получившийся раствор высушивают в вакууме. Выход 0.14 г (70%), светло-желтое кристаллическое вещество, т.пл. 230-232 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.41 т (3H, 3JH-H = 7.0 Гц, СH3), 2.64 c (3H, CH3), 3.48 м (4H, 2CH2пиперазино), 3.59-3.92 м (4H, 2CH2пиперазино), 4.64 кв (2H, 3JH-H = 7.0 Гц, CH2), 4.69 c (2H, CH2), 4.95 c (2H, CH2), 7.27 д (1H, 4JH-F = 7.1 Гц, СHар), 7.96 д (1H, 3JH-F = 13.1 Гц, СHар), 8.97 c (1H, СHпир).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 14.48 с (CH2CH3), 15.56 с (CH3), 46.42 с (CH2пиперазино), 49.15 с (CH2CH3), 50.69 с (CH2), 52.70 с (CH2пиперазино), 55.47 с (CH2), 106.50 с (Cар), 107.18 с (Cар), 111.44 д (2JC-F = 22.8 Гц, Cар), 119.63 д (3JC-F = 7.6 Гц, Cар), 126.38 с (Cпир), 135.29 уш c (C), 137.14 c (Cар), 143.86 c (Cар), 143.96 с (Cар), 148.75 с (Cар), 152.17 c (Cар), 153.70 д (1JC-F = 249.5 Гц, Cар-F), 166.04 с (C(O)OH), 176.18 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 471.2038, C24H28FN4O5. Вычислено [М-Cl]+ 471.2044.
Пример 25. Получение гидрохлорида 5-((4-(3-карбокси-1-этил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-7-ил)-2-метилпиперазин-1-ил)метил)-3-гидрокси-4-(гидроксиметил)-2-метилпиридиний хлорида (I-25).
0.50 г (0.92 ммоль) соединения I-12 растворяют в 20 мл водного раствора HCl c pH = 3 и оставляют на день при комнатной температуре. После этого раствор нейтрализуют до pH = 6 и выпавший осадок отфильтровывают и высушивают. Полученный осадок суспензируют в воде и добавляют эквимольное количество 0.1 Н HCl. Выход 0.45 г (60%), жёлтое кристаллическое вещество, т.пл. 201-216 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.45 т (3Н, 3JH-H = 6.3 Гц, CH2CH3), 1.46 д (3H, 3JH-H = 6.5 Гц, CH3пиперазино), 2.50 c (3H, CH3), 2.90-3.74 м (7Н, СНпиперазино + 3CH2пиперазино), 4.11 уш с (1H, CH2-N), 4.52-4.78 м (3Н, CH2-N + CH2CH3), 4.87, 4.91 АВ-система (2Н, 2JH-H = - 12.0 Гц, СН2), 7.89 д (1H, 3JH-F = 11.5 Гц, СHар), 8.31 c (1H, СHар), 8.95 с (1H, СHар), 9.92 уш с (1H, OH), 14.82 с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 14.53 с (CH3пиперазино), 16.01 д (5JC-F = 5.0 Гц, CH2CH3), 17.97 с (CH3), 48.01 с (CH2пиперазино), 49.42 уш с (CH2пиперазино), 50.96 с (CHпиперазино), 53.74 д (4JC-F = 15.4 Гц, CH2CH3), 54.22 с (CH2-N), 55.60 с (CH2пиперазино), 58.30 уш с (CH2), 107.03 д (JC-F = 20.3 Гц, Cар), 107.09 с (Cар), 121.11 д (JC-F = 8.5 Гц, Cар), 127.11 с (Cар), 127.16 с (Cар), 132.67 дд (JC-F = 16.2 Гц, JC-F = 14.1 Гц, Cар), 138.34 c (Cар), 139.32 c (Cар), 146.16 дд (1JC-F = 251.4 Гц, 3JC-F = 6.0 Гц, Cар), 150.59 с (Cар), 151.28 c (Cар), 154.45 дд (1JC-F = 249.6 Гц, 3JC-F = 5.6 Гц, Cар), 165.48 с (C(O)OH), 175.48 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 503.2101, C25H29F2N4O5. Вычислено[М-Cl]+ 503.2101.
Пример 26. Получение гидрохлорида 1-циклопропил-6-фтор-7-(1-((5-гидрокси-4-(гидроксиметил)-6-метилпиридин-3-ил)метил)октагидро-6H-пиролло[3,4-b]пиридин-6-ил)-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-26).
0.65 г (1.07 ммоль) соединения I-16 и конц. HCl (1 мл) в 20 мл воды перемешивают 24 ч при 25 °C. Далее раствор нейтрализуют с помощью гидрокарбоната натрия до pH = 6. Выпавший осадок отфильтровывают и промывают последовательно этанолом и водой. Далее осадок высушивают в вакууме и добавляют эквимольное количество 0.1 Н. HCl. Получившийся раствор высушивают в вакууме. Выход 0.40 г (62%), светло-зеленое кристаллическое вещество. Т.пл. >175 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.01 м (2Н, CH2циклопропил), 1.12-1.14 м (2Н, CH2циклопропил), 1.47-1.49 м (1Н), 1.63-1.77 м (3Н), 2.51 c (3H, CH3), 2.65-2.75 м (2Н), 3.02 м (1Н), 3.61 c (3H, CH3O), 3.61-3.84 м (3Н), 4.07-4.16 м (3Н), 4.07 уш с (1Н), 4.77, 4.84 АВ-система (2H, 2JH-H = - 14.0 Гц, CH2), 7.66 д (1H, 3JH-F = 13.9 Гц, СHар), 8.26 c (1H, СHар), 8.66 c (1H, СHар), 15.11 уш с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 8.99 c (CH2), 16.81 c (CH3), 20.47 уш c (CH2), 22.18 уш c (CH2), 35.72 c (CH), 40.67 c (CH), 48.30 уш c (CH2пиперазино), 53.22 с (CH2), 53.89 уш с (CH2), 55.42 с (CH3), 61.70 уш c (CH2), 106.35 с (Cар), 106.57 с (Cар), 117.49 д (3JC-F = 8.3 Гц, Cар), 134.47 с (Cар), 136.69 д (2JC-F = 10.6 Гц, Cар-N), 141.13 c (Cар), 150.27 с (Cар), 150.99 уш с (Cар), 153.93 с (1JC-F = 249.9 Гц, Cар-F), 165.85 с (C(O)OH), 175.98 д (4JC-F = 2.5 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 553.2457, C29H34FN4O6. Вычислено [М-Cl]+ 553.2457.
Пример 27. Получение 1-этил-6-фтор-7-(4-((5-(гидроксиметил)-2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-6-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-27).
К раствору 0.55 г (1.82 ммоль) соединения 6 в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.62 г (1.73 ммоль) норфлоксацина гидрохлорида, 0.30 г (3.56 ммоль) гидрокарбоната натрия. Реакционную смесь перемешивают 4 ч при 80 °С. Затем растворитель удаляют в вакууме, сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и промывают ацетоном. Выход 0.76 г (77%), белое кристаллическое вещество, т.пл. 210-213 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.51 т (3H, 3JH-H = 7.2 Гц, СH3), 1.53 c (6H, 2CH3), 2.36 c (3H, CH3), 2.77 уш м (4H, 2CH2пиперазино), 3.27 уш м (4H, 2CH2пиперазино), 3.83 c (2H, CH2N), 4.27 кв (2H, 3JH-H = 7.2 Гц, CH2), 4.43 с (2H, CH2), 4.93 c (2H, CH2), 6.77 д (1H, 4JH-F = 6.8 Гц, СHар), 7.93 д (1H, 3JH-F = 12.9 Гц, СHар), 8.60 c (1H, СHар), 15.02 уш с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.56 с (CH2CH3), 18.49 с (CH3), 24.81 с (С(CH3)2), 49.65 уш с (2CH2пиперазино), 49.87 с (CH2), 52.27 с (2CH2пиперазино), 57.76 с (CH2), 59.02 с (CH2), 63.06 с (CH2), 99.66 с (С(CH3)2), 104.29 д (4JC-F = 1.9 Гц, Cар), 108.46 с (Cар), 112.87 д (2JC-F = 23.2 Гц, Cар), 121.02 д (3JC-F = 7.8 Гц, Cар), 125.64 (Cар), 130.19 c (Cар), 137.09 c (Cар), 145.76 c (Cар), 145.92 д (2JC-F = 10.5 Гц, Cар-N), 146.14 c (Cар), 147.31 c (Cар), 153.62 с (1JC-F = 251.8 Гц, Cар-F), 167.21 с (C(O)OH), 177.05 д (4JC-F = 2.0 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 541.2457, C28H34FN4O6. Вычислено [М+H]+ 541.2457.
Пример 28. Получение 1-этил-6-фтор-7-(4-((5-гидрокси-3,4-бис(гидроксиментил)-6-метилпиридин-2-ил)метил)пиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-28).
К раствору 0.39 г (0.72 ммоль) соединения I-27 в 20 мл H2O приливают 0.5 мл концентрированной соляной кислоты, после чего реакционную смесь перемешивают при 25 °C в течение 24 ч. Затем реакционную смесь нейтрализуют с помощью NaHCO3 до pH = 6, выпавший осадок отфильтровывают. Далее осадок высушивают в вакууме и добавляют эквимольное количество 0.1 н раствора соляной кислоты. Получившийся раствор высушивают в вакууме. Выход 0.35 г (97%), белое кристаллическое вещество, т.пл. 227-230 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.41 т (3H, 3JH-H = 7.0 Гц, СH3), 2.45 c (3H, CH3), 3.51 уш м (4H, 2CH2пиперазино), 3.70 уш м (4H, 2CH2пиперазино), 4.57 c (2H, CH2), 4.62 уш м (4H, 2CH2), 4.80 c (2H, CH2), 7.26 д (1H, 4JH-F = 7.1 Гц, СHар), 7.94 д (1H, 3JH-F = 13.1 Гц, СHар), 8.96 c (1H, СHар), 9.75 уш c (1H, OH), 15.27 уш с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 14.52 с (CH2CH3), 19.23 с (CH3), 46.42 д (4JC-F = 3.7 Гц, 2CH2пиперазино), 49.15 с (CH2), 51.07 с (2CH2пиперазино), 55.80 с (CH2), 55.96 с (CH2), 56.58 с (CH2), 106.44 уш с (Cар), 107.17 с (Cар), 111.41 д (2JC-F = 22.7 Гц, Cар), 119.87 д (3JC-F = 7.5 Гц, Cар), 133.61 (Cар), 134.26 c (Cар), 137.13 c (Cар), 138.43 c (Cар), 144.01 д (2JC-F = 10.4 Гц, Cар-N), 145.79 c (Cар), 148.70 c (Cар), 150.19 c (Cар), 152.67 с (1JC-F = 249.4 Гц, Cар-F), 166.05 с (C(O)OH), 176.15 д (4JC-F = 2.0 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 501.2144, C25H30FN4O6. Вычислено [М-Cl]+ 501.2144.
Пример 29. Получение 1-этил-6,8-дифтор-7-(4-((5-(гидроксиметил)-2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-6-ил)метил)-3-метилпиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-29).
К раствору 0.65 г (2.15 ммоль) соединения 6 в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.79 г (2.05 ммоль) ломефлоксацина гидрохлорида и 0.34 г (4.05 ммоль) гидрокарбоната натрия. Реакционную смесь перемешивают 10 ч при 50 °С. Затем осадок отфильтровают, растворитель удаляют в вакууме. Далее сухой остаток последовательно промывают этиловым спиртом, водой и ацетоном. Выход 0.84 г (72%), белое кристаллическое вещество, т.пл. 210-213 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м. д.: 1.21 д (3H, 3JH-H = 5.9 Гц, CH3CH), 1.42 т (3H, 3JH-H = 6.5 Гц, CH3CH2), 1.48 c (3H, С(СH3)2), 1.49 c (3H, С(СH3)2), 2.27 c (3H, СH3), 2.64 уш м (2H, CH2пиперазино), 3.05 уш м (1H, CH2пиперазино), 3.16 уш м (1H, CH2пиперазино), 3.27-3.32 уш м (3H, CH2+CH), 3.39, 4.25 AB-система (2JH-H = - 11.8 Гц, CH2N), 4.46, 4.54 AB-система (2JH-H = - 12.8 Гц, CH2O), 4.56 уш м (2H, СH2), 4.94, 4.98 AB-система (2JH-H = - 16.4 Гц, CH2O), 5.41 уш с (1H, OH), 7.82 д (1H, 3JH-F = 11.8 Гц, CH), 8.91 c (1H, NCH), 14.81 уш с (1H, C(O)OH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м. д.: 14.34 с (CH2CH3), 15.90 д (5JС-F = 4.9 Гц, СH3CH), 18.23 с (СH3), 24.24 с (С(СH3)2), 24.76 с (С(СH3)2), 50.06 уш c (CH2пиперазино), 50.50 уш c (CH2пиперазино), 53.70 д (4JС-F = 15.9 Гц, CH2CH3), 55.74 уш c (CH2пиперазино), 56.08 c (CH), 57.00 c (CH2), 57.92 c (CH2), 58.42 c (CH2), 99.14 c (С(СH3)2), 106.83 c (Cар), 106.97 c (Cар), 107.05 д (4JС-F = 1.7 Гц, Cар), 120.43 д (3JС-F = 8.2 Гц, Cар), 126.31 c (Cар), 127.21 д (JС-F = 7.1 Гц, Cар), 129.90 c (Cар), 133.58 т (JС-F = 13.8 Гц, JС-F = 13.8 Гц, Cар), 143.81 c (Cар), 144.67 c (Cар), 146.53 c (Cар), 147.17 д (JС-F = 5.7 Гц, Cар), 151.15 c (Cар), 154.33 дд (1JС-F = 255.2 Гц, 3JС-F = 6.2 Гц, Cар-F), 165.52 c (C(O)OH), 175.49 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 573.2519, C29H35F2N4O6. Вычислено [М+H]+ 573.2519.
Пример 30. Получение гидрохлорида 1-этил-6,8-дифтор-7-(4-((5-гидрокси-3,4-бис(гидроксиметил)-6-метилпиридин-2-ил)метил)-3-метилпиперазин-1-ил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-30).
К раствору 0.33 г (0.58 ммоль) соединения I-29 в 20 мл H2O приливают 0.5 мл концентрированной соляной кислоты, после чего реакционную смесь перемешивают при 25 °C в течение 24 ч. Затем реакционную смесь нейтрализуют с помощью NaHCO3 до pH = 6, выпавший осадок отфильтровывают. Далее осадок высушивают в вакууме и добавляют эквимольное количество 0.1 н раствор соляной кислоты. Получившийся раствор высушивают в вакууме. Выход 0.29 г (88%), желтое кристаллическое вещество, т.пл. 185-187 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м. д.: 1.43-1.49 м (6H, CH3CH + CH3CH2), 2.44 c (3H, СH3), 3.31-3.46 уш м (3H), 3.56-3.82 уш м (5H), 4.44, 4.71 AB-система (2JH-H = - 14.4 Гц, CH2), 4.59 уш м (2H, СH2), 4.62 c (2H, СH2), 4.80 c (2H, CH2O), 5.46 уш с (1H, OH), 5.83 уш с (1H, OH), 7.92 д (1H, 3JH-F = 11.5 Гц, CHар), 8.96 c (1H, NCH), 10.44 уш c (1H, OH), 14.80 уш с (1H, C(O)OH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м. д.: 13.12 с (CH2CH3), 15.96 д (5JС-F = 5.9 Гц, СH3CH), 19.14 с (СH3), 47.04 уш c (CH2пиперазино), 50.12 уш c (CH2пиперазино), 53.01 c (CH2), 53.73 д (4JС-F = 15.8 Гц, CH2CH3), 55.82 c (CH2), 55.94 c (CH2), 57.95 c (CH2), 106.94 уш c (Cар), 107.15 c (Cар), 107.16 с (Cар), 121.35 д (JС-F = 8.4 Гц, Cар), 127.14 д (JС-F = 6.2 Гц, Cар), 132.41 т (JС-F = 14.1 Гц, JС-F = 14.1 Гц, Cар), 133.79 с (Cар), 134.42 c (Cар), 138.32 c (Cар), 145.78 c (Cар), 146.30 дд (1JС-F = 251.5 Гц, 3JС-F = 6.1 Гц, Cар-F), 150.06 c (Cар), 151.42 c (Cар), 154.47 дд (1JС-F = 249.3 Гц, 3JС-F = 5.5 Гц, Cар-F), 165.46 c (C(O)OH), 175.52 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 533.2206, C26H31F2N4O6. Вычислено [М-Cl]+ 533.2206.
Пример 31. Получение 1-Циклопропил-6-фтор-7-(1-((5-(гидроксиметил)-2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-6-ил)метил)октагидро-6H-пирроло[3,4-b]пиридин-6-ил)-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-31).
К раствору 0.45 г (1.49 ммоль) соединения 6 в 20 мл абсолютного ДМФА при 20 °C последовательно добавляют 0.59 г (1.35 ммоль) моксифлоксацина гидрохлорида, 0.23 г (2.74 ммоль) гидрокарбоната натрия. Реакционную смесь перемешивают 4 ч при 80 °С. Затем осадок отфильтровывают, растворитель удаляют в вакууме. Далее сухой остаток растворяют в хлороформе и очищают с помощью колоночной хроматографии (этиловый спирт/хлороформ = 1:3). Выход 0.35 г (42%), светло-желтое кристаллическое вещество, т.пл. 138-140 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.88-1.04 м (2Н, CH2циклопропил), 1.12-1.25 м (2Н, CH2циклопропил), 1.50 м (3Н), 1.50 c (3H, CH3), 1.51 c (3H, CH3), 1.70 м (2Н), 2.34 c (3H, CH3), 2.38 м (1Н), 2.45 м (1Н), 2.65 м (1Н), 3.39 м (1Н), 3.48 м (1Н), 3.56 c (3H, CH3O), 3.62 м (1Н), 3.74 м (1Н), 3.81 м (1Н), 3.98 м (2Н), 4.10 м (1Н), 4.35, 4.32 АВ-система (2H, 2JH-H = - 13.0 Гц, CH2), 4.91, 4.88 АВ-система (2H, 2JH-H = - 16.0 Гц, CH2), 7.72 д (1H, 3JH-F = 14.0 Гц, СHар), 8.73 c (1H, СHар), 15.02 уш с (1H, C(O)OH).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 9.28 c (CH2), 9.89 c (CH2), 18.38 c (CH3), 22.95 c (CH2), 24.03 c (CH2), 24.68 c (С(CH3)2), 24.85 c (С(CH3)2), 36.92 c (CH), 40.47 c (CH), 47.43 c (CH2), 49.25 уш с (CH2), 55.28 д (4JC-F = 7.5 Гц, CH2), 57.63 с (CH2), 58.95 с (CH3), 61.26 c (4JC-F = 14.1 Гц, CH2), 61.41 c (CH), 99.57 c (С(CH3)2), 107.60 с (Cар), 107.97 д (2JC-F = 24.2 Гц, Cар), 118.34 д (JC-F = 8.7 Гц, Cар), 125.61 с (Cар), 128.57 д (JC-F = 12.1 Гц, Cар), 130.05 с (Cар), 132.14 д (JC-F = 9.9 Гц, Cар), 134.58 с (Cар), 137.63 д (JC-F = 10.6 Гц, Cар), 140.54 д (JC-F = 7.0 Гц, Cар), 145.82 с (Cар), 149.69 с (Cар), 153.52 с (1JC-F = 251.0 Гц, Cар-F), 167.14 с (C(O)OH), 176.74 д (4JC-F = 2.7 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 623.2876, C33H40FN4O7. Вычислено [М+H]+ 623.2876.
Пример 32. Получение гидрохлорида 1-циклопропил-6-фтор-7-(1-((5-гидрокси-3,4-бис(гидроксимектил)-6-метилпиридин-2-ил)метил)октагидро-6H-пиролло[3,4-b]пиридин-6-ил)-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-32).
К раствору 0.20 г (0.32 ммоль) соединения I-31 в 20 мл H2O приливают 0.5 мл концентрированной соляной кислоты, после чего реакционную смесь перемешивают при 25 °C в течение 24 ч. Затем реакционную смесь нейтрализуют с помощью NaHCO3 до pH = 6, выпавший осадок отфильтровывают. Далее осадок высушивают в вакууме и добавляют эквимольное количество 0.1 н раствор соляной кислоты. Получившийся раствор высушивают в вакууме. Выход 0.11 г (55%), белое кристаллическое вещество, т.пл. 172-174 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.00 м (2H, CH2циклопропил), 1.13 м (2H, CH2циклопропил), 1.65 м (1Н), 1.81 м (1Н), 1.88 м (2Н), 2.41 c (3H, CH3), 2.78 м (1Н), 3.27 м (1Н), 3.38 м (1Н), 3.61 c (3H, CH3O), 3.83 м (1Н), 3.91 м (1Н), 4.09 м (1Н), 4.15 м (2Н), 4.62, 4.60 АВ-система (2H, 2JH-H = - 13.6 Гц, CH2), 4.65, 4.50 АВ-система (2H, 2JH-H = - 14.4 Гц, CH2), 4.79 c (2H, CH2O), 7.68 д (1H, 3JH-F = 13.8 Гц, СHар), 8.67 c (1H, СHар), 9.93 уш с (1H, OH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 8.87 c (CH2), 9.16 c (CH2), 18.52 c (CH3), 19.53 c (CH2), 21.70 c (CH2), 34.93 c (CH), 40.66 c (CH), 48.82 c (CH2), 49.54 уш с (CH2), 53.96 д (4JC-F = 6.6 Гц, CH2), 55.63 с (CH2), 55.88 с (CH3), 60.77 c (CH2), 61.83 c (CH), 106.44 с (Cар), 106.51 д (2JC-F = 23.4 Гц, Cар), 117.95 д (JC-F = 8.8 Гц, Cар), 134.36 с (Cар), 134.43 с (Cар), 135.40 с (Cар), 136.39 д (JC-F = 10.7 Гц, Cар), 137.78 с (Cар), 141.49 д (JC-F = 7.8 Гц, Cар), 145.41 с (Cар), 150.39 с (Cар), 150.74 с (Cар), 153.03 с (1JC-F = 249.9 Гц, Cар-F), 165.83 с (C(O)OH), 176.05 д (4JC-F = 2.6 Гц, C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 583.2563, C30H36FN4O7. Вычислено [М-Cl]+ 583.2563.
Пример 33. Получение 7,7'-(((2,2-Диметил-4H-[1,3]диоксино[4,5-c]пиридин-5,8-диил)бис(метилен))бис(3-метилпиперазин-4,1-диил))бис(1-этил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-33).
К раствору 0.20 г (0.67 ммоль) соединения 7 в 20 мл абсолютного ДМФА при 20 °C добавляют 0.52 г (1.34 ммоль) ломефлоксацина гидрохлорида, 0.28 г (3.33 ммоль) гидрокарбоната натрия и 0.02 г (0.12 ммоль) иодида калия. Реакционную смесь перемешивают 8 ч при 90 °С. Затем осадок отфильтровывают, растворитель удаляют в вакууме. Далее сухой остаток растворяют в хлороформе и перекристаллизовывают из ацетонитрила. Выход 0.30 г (50%), светло-коричневое кристаллическое вещество, т.пл. 222-227 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м. д.: 1.22 д (3H, 3JH-H = 6.2 Гц, CH3CH), 1.29 уш с (3H, CH3CH), 1.55-1.59 м (11H, 2CH3CH2 + С(СH3)2), 2.32 уш м (1H, CH2), 2.56 уш м (1H, CH2), 2.71-2.74 уш м (2H, CH2), 3.12 уш м (1H, CH2), 3.15-3.19 уш м (2H, CH2), 3.31-3.40 м (5H, CH2 + CH + CH2N), 3.62 уш с (1H, CH2), 3.98-4.01 уш с (2H, CH2N), 4.44-4.47 уш м (4H, 2СH2), 4.92, 5.23 AB-система (2H, 2JH-H = - 16.8 Гц, CH2O), 7.93 д (1H, 3JH-F = 10.8 Гц, СHар), 7.95 д (1H, 3JH-F = 11.0 Гц, СHар), 8.06 c (1H, СHар), 8.59 c (2H, СHар), 14.62 уш с (1H, C(O)OH), 14.67 уш с (1H, C(O)OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м. д.: 14.92 уш с (CH2CH3), 16.17 уш с (CH2CH3), 16.47 с (CHСH3), 16.51 с (CHСH3), 24.69 с (СH3), 24.88 с (С(СH3)2), 25.05 с (СH3), 50.59 уш c (CH2пиперазино), 51.30 уш c (CH2пиперазино), 51.77 уш c (CH2пиперазино), 52.53 c (CH2), 54.67 c (CH2), 54.83 c (CH2), 55.96 с (CH2), 56.17 c (CH), 57.73 c (CH2), 59.19 c (CH2), 99.87 с (С(СH3)2), 108.17 c (Cар), 108.22 c (Cар), 108.38 д (JС-F = 11.6 Гц, Cар), 108.60 д (JС-F = 8.4 Гц, Cар), 121.48 д (JС-F = 9.1 Гц, Cар), 127.26 уш м (JС-F = 7.1 Гц, Cар), 134.41 уш м (Cар), 141.37 c (Cар), 146.97 c (Cар), 140.08 с (Cар), 150.14 c (Cар), 155.20 д (1JС-F = 251.9 Гц, Cар-F), 155.20 д (1JС-F = 251.9 Гц, Cар-F), 155.26 д (1JС-F = 252.2 Гц, C Cар-F), 166.76 c (C(O)OH), 166.82 c (C(O)OH), 176.39 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 892.3657, C45H49F4N7O8. Вычислено [М+H]+ 892.3652.
Пример 34. Получение гидрохлорида 7,7'-(4,4'-((3-гидрокси-4-(гидроксиметил)пиридин-2,5-диил)бис(метилен))бис(3-метилпиперазин-4,1-диил))бис(1-этил-6,8-дифтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-34).
К раствору 0.07 г (0.08 ммоль) соединения I-33 в 20 мл H2O приливают 0.5 мл концентрированной соляной кислоты, после чего реакционную смесь перемешивают при 25 °C в течение 24 ч. Затем реакционную смесь нейтрализуют с помощью NaHCO3 до pH = 6, выпавший осадок отфильтровывают. Далее осадок высушивают в вакууме и добавляют эквимольное количество 0.1 н раствора соляной кислоты. Получившийся раствор высушивают в вакууме. Выход 0.07 г (количественный), светло-коричневое кристаллическое вещество, т.пл. 224-229 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м. д.: 1.18-1.22 т (3H, 3JH-H = 6.4 Гц, CH3CH2), 1.25 д (3H, 3JH-H = 6.0 Гц, CH3CH), 1.44-1.45 м (6H, 2CH3CH2 + CH3CH), 2.33-2.36 уш м (1H, CH2), 2.62-2.67 уш м (2H, CH2), 2.89-2.95 уш м (2H, CH2), 3.09-3.12 уш м (1H, CH2), 3.21-3.53 уш м (9H, 3CH2 + CH + CH2N), 3.76-3.84 уш м (1H, CH2N), 4.21-4.23 м (1H, CH2N), 4.60 с (4H, 2CH2CH3), 4.23, 4.76 AB-система (2H, 2JH-H = - 16.8 Гц, CH2O), 7.86 д (1H, 3JH-F = 10.1 Гц, CH), 7.88 д (1H, 3JH-F = 10.4 Гц, СHар), 7.96 д (1H, J = 4.1 Гц, СHар), 8.91 c (1H, СHар), 8.92 c (1H, СHар), 14.82 уш с (2H, 2C(O)OH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м. д.: 15.95 уш с (CH3), 15.99 уш с (СH3), 24.69 с (СH3), 29.04 с (СH3), 50.39 уш c (CH2), 51.71 уш c (CH2), 52.89 c (CH2), 53.77 c (CH2), 53.95 c (CH2), 54.32 с (CH2), 56.86 c (CH), 59.70 c (CH2), 106.81 уш c (Cар), 107.06 д (JС-F = 8.0 Гц, Cар), 107.10 c (Cар), 127.27 уш м (Cар), 137.02 уш м (Cар), 141.19 c (Cар), 152.05 c (Cар), 154.57 д (1JС-F = 255.0 Гц, Cар-F), 154.62 д (1JС-F = 249.0 Гц, Cар-F), 155.26 д (1JС-F = 252.2 Гц, Cар-F), 165.82 c (C(O)OH), 175.46 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 852.3339, C42H46F4N7O8. Вычислено [М-Cl]+ 852.3339.
Пример 35. Получение 7,7'-(((2,2-Диметил-4H-[1,3]диоксино[4,5-c]пиридин-5,8-диил)бис(метилен))бис(октагидро-6H-пиролло[3,4-b]пиридин-1,6-диил))бис(1-циклопропил-6-фтор-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-35).
К раствору 0.19 г (0.64 ммоль) соединения 7 в 20 мл абсолютного ДМФА при 20 °C добавляют 0.55 г (1.26 ммоль) моксифлоксацина гидрохлорида, 0.27 г (3.21 ммоль) гидрокарбоната натрия и 0.02 г (0.12 ммоль) иодида калия. Реакционную смесь перемешивают 8 ч при 70 °С. Затем осадок отфильтровывают, растворитель удаляют в вакууме. Далее сухой остаток растворяют в этиловом спирте и очищают с помощью колоночной хроматографии (этиловый спирт/хлороформ = 1:5). Выход 0.55 г (88%), светло-зеленое кристаллическое вещество, т.пл. 130-132 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м. д.: 0.90-0.94 м (2H, CH2циклопропил), 0.98-1.01 м (2H, CH2циклопропил), 1.12-1.21 м (4H, 2CH2циклопропил), 1.30 с (3H, CH3), 1.39 с (3H, CH3), 1.46-1.69 м (8H), 2.13-2.17 м (1H), 2.32-2.39 м (2H), 2.61-2.65 м (1H), 3.00-3.07 м (2H), 3.17-3.20 м (2H), 3.40 м (2H), 3.51 с (3H, CH3O), 3.55 с (3H, CH3O), 3.65-3.88 м (8H), 3.98-4.05 м (4H), 4.69, 4.93 АВ-система (2H, 2JH-Н = - 16.4 Гц, CH2O), 7.68 д (1H, 3JH-F = 13.8 Гц, СHар), 7.70 д (1H, 3JH-F = 14.0 Гц, СHар), 7.92 с (1H, СHар), 7.98 с (1H, СHар), 8.70 c (1H, СHар), 15.01 с (1H, C(O)OH), 15.08 с (1H, C(O)OH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м. д.: 9.09 c (CH2), 9.32 c (CH2), 9.77 c (CH2), 9.99 c (CH2), 22.13 c (CH3), 22.50 c (C), 23.50 c (C), 23.79 c (C), 24.41 c (CH3), 24.61 c (CH3), 36.55 c (CH), 37.49 c (CH), 40.52 c (CH), 40.61 c (CH), 49.62 c (CH2), 50.93 c (CH2), 53.69 д (4JC-F = 4.3 Гц, CH2N), 53.84 д (4JC-F = 5.3 Гц, CH2N), 54.35 д (4JC-F = 5.9 Гц, CH2N), 54.75 уш с (CH2), 55.05 с (CH2), 58.80 с (CH), 61.05 с (CH2), 61.21 с (CH2), 61.93 c (CH2), 62.69 c (CH2), 99.70 с (C(CH3)2), 107.37 с (Cар), 107.49 c (Cар), 107.65 c (Cар), 107.75 c (Cар), 107.79 c (Cар), 117.68 д (JC-F = 8.0 Гц, Cар), 118.08 д (JC-F = 8.8 Гц, Cар), 127.01 с (Cар), 128.70 с (Cар), 134.56 с (Cар), 137.58 д (JC-F = 10.6 Гц, Cар), 137.68 д (JC-F = 10.6 Гц, Cар), 140.42 д (Cар), 146.80 с (Cар), 149.49 с (Cар), 149.60 с (Cар), 153.47 д (1JC-F = 250.8 Гц, Cар-F), 153.68 д (1JC-F = 250.4 Гц, Cар-F), 167.15 с (C(O)OH), 167.23 с (C(O)OH), 176.68 c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М]+ 991.4364, C53H59F2N7O10. Вычислено [М]+ 991.4291.
Пример 36. Получение гидрохлорида 1-этил-6-фтор-7-(4-((5-гидрокси-2,4-бис(гидроксиметил)-6-метилпиридин-3-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-36).
К раствору 0.80 г (3.15 ммоль) соединения 8 в 100 мл смеси ДМФА-вода (4:1) при 20 °C последовательно добавляют 1.02 г (2.87 ммоль) норфлоксацина гидрохлорида, 0.75 г (8.93 ммоль) гидрокарбоната натрия и 0.10 г (0.60 ммоль) йодида калия. Реакционную смесь перемешивают 10 ч при 60 °С. Растворитель удаляют в вакууме, сухой остаток суспензируют в воде и кипятят. Нерастворимую часть отфильтровывают, суспензируют в ацетоне и кипятят. Остаток заливают водой и добавляют концентрированную соляную кислоту до гомогенизации раствора. Полученный раствор высушивают досуха и заливают ДМФА. Нерастворившуюся часть отделяют, растворяют в воде и добавляют эквимольное количество бикарбоната натрия. Выпавший осадок отфильтровывают, суспензируют в воде и добавляют концентрированную соляную кислоту до гомогенизации раствора. Полученный раствор высушивают досуха. Выход 1.02 г (85%), бежевое кристаллическое вещество, т.пл. 215-218 °С (разл.).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.41 т (3H, 3JH-H = 7.1 Гц, CH2СH3), 2.69 c (3H, CH3), 3.54 уш м (4H, 2CH2пиперазино), 3.67 уш м (6H, 2CH2пиперазино + CH2N), 4.61 кв (2H, 3JH-H = 7.1 Гц, CH2СH3), 4.77 уш с (2H, CH2OH), 4.98 c (2H, CH2OH), 7.25 д (1H, 4JH-F = 7.2 Гц, СHар), 7.96 д (1H, 3JH-F = 13.0 Гц, СHар), 8.96 c (1H, СHар).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.51 с (CH2СH3), 15.50 с (CH3), 46.88 уш с (CH2пиперазино), 49.23 с (CH2), 50.97 с (CH2пиперазино), 51.41 с (CH2), 55.83 с (CH2), 58.56 с (CH2), 106.69 уш с (Cар), 107.20 с (Cар), 111.49 д (2JC-F = 23.2 Гц, Cар), 120.01 д (3JC-F = 7.6 Гц, Cар), 125.06 (Cар), 137.16 c (Cар), 143.94 д (2JC-F = 10.3 Гц, Cар-N), 144.10 c (Cар), 146.91 c (Cар), 148.81 c (Cар), 151.46 c (Cар), 152.75 с (1JC-F = 249.3 Гц, Cар-F), 166.11 с (C(O)OH), 176.23 с (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 501.2144, C25H30FN4O6. Вычислено [М-Cl]+ 501.2144.
Пример 37. Получение гидрохлорида 1-циклопропил-6-фтор-7-(1-((5-гидрокси-2,4-бис(гидроксимектил)-6-метилпиридин-2-ил)метил)октагидро-6H-пиролло[3,4-b]пиридин-6-ил)-8-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-37).
К раствору 1.24 г (4.88 ммоль) соединения 8 в 100 мл смеси ДМФА-вода (4:1) при 20 °C последовательно добавляют 1.94 г (4.43 ммоль) моксифлоксацина гидрохлорида, 1.56 г (18.57 ммоль) гидрокарбоната натрия и 0.15 г (0.90 ммоль) йодида калия. Реакционную смесь перемешивают 10 ч при 60 °С. Растворитель удаляют в вакууме, сухой остаток суспензируют в воде и кипятят. Нерастворимую часть отфильтровывают, заливают водой и добавляют концентрированную соляную кислоту до гомогенизации раствора. Полученный раствор высушивают досуха и очищают с помощью обращенно-фазовой колоночной хроматографии (элюент вода-ацетонитрил 5:1). Полученный раствор высушивают досуха. Выход 0.26 г (10%), светло-желтое кристаллическое вещество, т.пл. 195-200 °С (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 0.96-1.14 м (4H, 2CH2циклопропил), 1.63-1.81 м (4Н), 2.62 c (3H, CH3), 2.78 м (1Н), 3.10 м (2Н), 3.38-3.78 м (4Н), 3.61 c (3H, CH3O), 4.55 м (2Н, CH2), 4.71-4.80 м (2H, CH2), 4.83, 4.91 АВ-система (2H, 2JH-H = - 13.4 Гц, CH2), 4.85 c (2H, CH2O), 7.69 д (1H, 3JH-F = 13.9 Гц, СHар), 8.68 c (1H, СHар).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 8.84 c (CH2), 9.38 c (CH2), 16.18 c (CH2), 35.80 c (CH), 40.68 c (CH), 50.84 c (CH2), 55.18 с (CH2), 59.46 с (CH2), 61.99 c (CH), 106.46 с (Cар), 106.69 c (Cар), 117.83 д (JC-F = 8.6 Гц, Cар), 134.54 с (Cар), 136.57 д (JC-F = 10.5 Гц, Cар), 141.28 с (Cар), 141.29 д (JC-F = 7.5 Гц, Cар), 150.50 с (Cар), 150.85 с (Cар), 152.99 с (1JC-F = 250.3 Гц, Cар-F), 165.93 с (C(O)OH), 176.09 уш c (C=O).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 583.2563. C30H36FN4O7. Вычислено [М-Cl]+ 583.2563.
Пример 38. Исследование антибактериальной активности заявленных фторхинолонов на основе производных пиридоксина.
Измерение антибактериальной активности заявленных соединений проводилось на штаммах Staphylococcus aureus АТСС 29213 (музейный штамм), Staphylococcus epidermidis (клинический изолят), Micrococcus luteus (клинический изолят), Bacillus subtilis 168 (музейный штамм), Escherichia coli АТСС 25922 (музейный штамм), Salmonella typhimurium TA100 (музейный штамм), Pseudomonas aeruginosa АТСС 27853 (музейный штамм). Сравнительная оценка спектра антибактериального действия на эталонных штаммах и клинических изолятах грамположительных микроорганизмов проводилась с использованием микрометода определения минимальной подавляющей концентрации (МПК) методом серийных разведений в бульоне Мюллера-Хинтон [Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890-04). Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 04.03.2004 г.].
Метод разведения основан на использовании двойных последовательных разведений концентраций заявленных соединений от максимальной к минимальной. При этом в различных концентрациях вносят в жидкую питательную среду (бульон). Оценку роста культур проводят визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест - соединений с ростом культуры без них. Наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная концентрация заявленного соединения недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации заявленного соединения рост микроорганизма ухудшается.
Первую наименьшую концентрацию заявленного соединения (из серии последовательных разведений), где визуально не определяется бактериальный рост, принято считать минимальной подавляющей концентрацией (МПК).
Для приготовления инокулюма использовали чистую, суточную культуру бактерий, выросших на плотной питательной среде (агаризованная среда LB). В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 0.5 по стандарту МакФарланда (1.5∙108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 107 КОЕ/мл LB-бульоном. Инокулюм использовали в течение 15 минут после приготовления; чистота бактериальных штаммов контролировалась перед каждым экспериментом.
В лунки каждого планшета вносили по 100 мкл бульона Мюллера-Хинтон; в первую лунку вносили заявленное соединение в концентрации 128 мкг/мл в объеме 100 мкл и последовательным двукратным разведением доводили его концентрацию до 0.25 мкг/мл. Затем в каждую лунку вносили приготовленный инокулюм, разводя тем самым вдвое концентрацию заявленных соединений (до 64.0 мкг/мл). Каждое соединение в эксперименте титровали трижды. В качестве контроля включали лунки, не содержащие тестируемых соединений (контроль роста культуры). Кроме того, ставился контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 36 °С в течение 24 часов.
За МПК принимали минимальную концентрацию заявленных соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов.
В качестве препаратов сравнения использовали широко применяемые известные антибактериальные средства фторхинолонового ряда - ципрофлоксацин, норфлоксацин, ломефлоксацин и моксифлоксацин. Также в качестве препарата сравнения заявителем использован так называемый «антибиотик последней надежды» ванкомицин.
Как видно из представленных в Таблице 1 данных, ряд из заявленных соединений обладают сопоставимой с препаратами сравнения антибактериальной активностью по отношению к исследуемым штаммам грамположительных бактерий (соединения I-1, I-11, I-16, I-18, I-19, I-20, I-26, I-27, I-31, I-32, I-37). В отношении грамотрицательных бактерий наиболее активными оказались соединения I-1, I-2, I-3, I-13, I-25, I-29, I-30, I-33, I-34, I-35, I-36 и I-37, чья активность существенно превосходила ванкомицин и ломефлоксацин, но несколько уступала норфлоксацину и моксифлоксцину.
Для соединений I-2, I-3, I-13, I-19, I-25, I-26 и I-35 было проведено углубленное исследование антибактериальной активности на клинических штаммах микроорганизмов (Staphylococcus aureus 700699 ATCC, Staphylococcus aureus 100 MRSA, Staphylococcus aureus 5 MRSA, Staphylococcus aureus 6 MRSA, Staphylococcus aureus 3797 MRSA, Staphylococcus aureus 3798 MRSA, Staphylococcus aureus 4603 MRSA, Staphylococcus haemoliticus 161, Staphylococcus haemoliticus 1025, Staphylococcus haemoliticus 602, Staphylococcus haemoliticus 585, Staphylococcus epidermidis 681, Staphylococcus epidermidis 9, Enterococcus faecalis 560, Enterococcus faecium 569, Enterococcus faecium 101, Escherichia coli 396, Pseudomonas aeruginosa 43), представленные в Таблице 2.. В качестве препаратов сравнения использовались ванкомицин, моксифлоксацин и ломефлоксацин. Наиболее активными из полученных соединений оказались соединения I-3 и I-25, чья активность существенно превосходила ломефлоксацин, была сопоставимой с ванкомицином, но несколько уступала моксифлоксацину.
Пример 39. Исследования токсичности наиболее активных из новых синтезированных соединений фторхинолонового ряда, содержащих фрагменты производных пиридоксина, in vitro.
Цитотоксичность наиболее активных из заявленных соединений (I-3, I-11, I-13, I-16, I-19, I-25, I-26, I-27, I-31, I-32, I-35), оценивали с использованием пролиферативного МТТ-теста.
Линия клеток HEK-293 (эмбриональные клетки почки человека) была получена из ATCC и культивировалась в 75 см2 флаконах при 37 °C и 5% CO2. Клетки пересевали 1 раз в неделю в отношении 1:10. Клетки культивировали в среде α-MEM с добавлением 10%-ной эмбриональной телячьей сыворотки, L-глутамина и 1% пенициллина-стрептомицина до образования монослоя. Для получения клеточной суспензии монослой клеток трипсинизировали раствором Трипсина-ЭДТА с последующей инактивацией трипсина добавлением среды α-MEM с сывороткой. Далее клетки осаждали центрифугированием при 500 g. Осадок ресуспендировали.
Оценку жизнеспособности и подсчет плотности производили после окраски клеток 0.4%-ным раствором трипанового синего в камере Нойбауэра. В эксперименте использовали суспензии с количеством жизнеспособных клеток не менее 90%. Клетки (10 тыс. клеток в лунке) культивировали в 495 мкл среды α-MEM для исследования водонерастворимых соединений или в 450 мкл среды для исследования водорастворимых соединений в стандартных условиях в 48-луночном культуральном планшете в течение суток (для их прикрепления к поверхности дна лунки). Далее добавляли 5 мкл раствора водонерастворимых или 50 мкл водорастворимых соединений и инкубировали в стандартных условиях в течение 24 часов. Далее среду с препаратами заменяли на чистую среду α-MEM 400 мкл и добавляли по 100 мкл МТТ-реагента (5 мг/мл), инкубировали в CO2-инкубаторе при температуре 37 °С в течение 3.5 часов, затем убирали среду и добавляли 300 мкл ДМСО. По истечении 10 минут измеряли оптическую плотность клеточных растворов при 555 нм (референтная длина волны – 650 нм) на планшетном ридере TECAN (Швейцария). Рассчитывали концентрацию полумаксимального ингибирования роста клеток (IС 50), принимая жизнеспособность клеток в контрольных лунках за 100%.
Как видно из представленных в Таблице 3 данных, токсичность соединений I-3, I-13, I-25, I-26 и I-35 оказалась сопоставимой с препаратами сравнения. Другие соединения оказались более токсичными.
Одним из тестов на повреждение ДНК является тест на определение индукции SOS-ответа бактериальной клетки на воздействие испытуемого агента, так называемый SOS-хромотест. Для проверки испытуемых соединений ночную культуру бактерий S.typhimurium TA2035/pSK1002 разводили в среде LB в 10 раз. Полученную культуральную жидкость разливали по 3 мл в пробирки и растили 4 часа в присутствии исследуемых соединений в концентрациях 4 мкг/мл, 20 мкг/мл, 40 мкг/мл. Затем клетки собирали центрифугированием и определи активность β-галактозидазы в клетках. Тестируемое вещество считали мутагенным, если активность β-галактозидазы в опыте достоверно превышало таковое в контроле (растворителе) более чем в 2 раза. Как видно из представленных в Таблице 4 данных, все 3 исследованных соединения (I-3, I-19, I-26) не обладают ДНК-повреждающим действием.
Таким образом, из описанного выше можно сделать вывод, что заявителем достигнуты поставленные цели и заявленный технический результат, а именно - созданы новые соединения общей формулы (I), содержащие в своем составе как фрагмент природного соединения (пиридоксина, входящего в группу витамина В6), так и фрагмент препарата фторхинолонового ряда, обладающие антибактериальной активностью, с целью расширения арсенала известных средств указанного назначения.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», так как может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий.