Результат интеллектуальной деятельности: Способ определения фибриногена и оценка его функциональности
Вид РИД
Изобретение
Изобретение относится к лабораторной диагностике и может быть использовано для определения фибриногена при термокоагуляции цитратной плазмы и оценка его функциональности.
Фибриноген это основной протеин плазмы крови, который необходим для надлежащего свертывания крови. Количество фибриногена, присутствующего в крови, прямо пропорционально способности крови образовывать тромбы. Фибриноген в крови трансформируется в фибрин в процессе образования тромба, таким образом, дефицит фибриногена будет выражаться в неадекватном образовании фибрина и неадекватном свертывании.
Недостаток содержания фибриногена в крови плазмы может быть вызван снижением образования фибриногена, которое может быть результатом печеночной недостаточности или вызвано врожденной гипофибриногенемией. Диссеминированная внутрисосудистая коагуляция крови, являющаяся патологическим случаем, может также создать большее, чем нормальное потребление фибриногена, пригодного для использования в процессе образования тромба. Очевидно, что недостаток фибриногена может привести к кровотечению.
Избыточное содержание фибриногена в крови также представляет патологическое состояние, которое, как правило, связано с воспалительными процессами. Высокое содержание фибриногена в крови может способствовать возникновению гиперкоагуляции, что нежелательно. Физиологическое повышение содержания фибриногена также обнаружено у беременных женщин.
Установлено, что увеличение концентрации фибриногена в крови также представляет фактор риска для сердечно-сосудистых заболеваний. Из вышеуказанного очевидно, что мониторинг содержания фибриногена в крови является полезной процедурой в определении состояния здоровья пациента, а также может быть полезен как маркер, позволяющий заранее определять предтромботическое состояние у человека.
Существует в настоящее время ряд методов количественного определения фибриногена плазмы крови. Используемые в настоящее время методы требуют, чтобы плазма была полностью отделена от красных кровяных клеток и более того, согласно этим методам необходимо, чтобы произошло превращение фибриногена в фибрин в отделенной плазме. Затем фибрин определяют количественно либо гравиметрическим способом, либо используя нефелометрию или химические методы анализа.
В клинической практике наиболее широко используется определение фибриногена по Клауссу, основанное на исследовании времени образования сгустка при добавлении высокой концентрации тромбина к разбавленной в 10-20 раз цитратной плазме. Тест выполняется на коагулометрах, при этом логарифм времени образования сгустка обратно пропорционален логарифму концентрации фибриногена. Калибровочная кривая показывает укорочение времени свертывания при увеличении концентрации фибриногена [Долгов В.В., Свиридов П.В. Лабораторная диагностика нарушений гемостаза. - М. - Тверь: ООО «Издательство «Триада» 2005. - 227 с.] Основными ограничениями метода определения ФГ по Клауссу является чувствительность результатов к гипо-, дис- и гиперфибриногенемии, а также к продуктам деградации фибрина, которые влияют на процесс полимеризации фибрин-мономеров и могут быть причиной ложно низких результатов. Метод выполняется только в лабораторных условиях на специальном оборудовании (центрифуга, коагулометр [Полевода О.А., Галстян Г.М., Берковский А.Л., Сергеева Е.В. Способ определения функционального фибриногена // Патент РФ №2669796. Опубл. 16.10.2018. Бюл. № 29].
Известно также определение ФГ с помощью тромбоэластографии (ТЭГ). Метод ТЭГ не требует центрифугирования крови, является прикроватным, широко используется в отделениях интенсивной терапии. Определение уровня ФГ с помощью ТЭГ заключается в регистрации максимальной амплитуды тромбоэластограммы после добавления к цитратной крови ингибитора тромбоцитарного гликопротеина IIb/IIa (абциксимаба) и активатора внешнего пути свертывания, лиофилизированного тканевого фактора. Максимальная амплитуда, регистрируемая при этом на тромбоэластограмме, отражает уровень ФГ [Rossaint R., Bouillon B., Cerny V., Coats T.J., Duranteau J., Fernandez-Mondejar E., et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Critical Care; 2016; 20: 100]. Определенный таким образом ФГ коррелирует с концентрацией ФГ, определенной по Клауссу. В то же время известно, что ФГ, определенный с помощью ТЭГ, может переоценивать (завышать) концентрацию ФГ [Agren A., Wikman A.T., Ostlund A., Edgren G. TEG® functional fibrinogen analisis may overestimate fibrinogen levels // Anasthesia and analgesia. 2014; 118: 933-935]. Возможной причиной завышения ФГ является то, что при этом методе не всегда удается полностью ингибировать тромбоциты, что показано при сравнении его с методом ТЭГ, использующим другой ингибитор тромбоцитов. Существенным недостатком является также доступность метода из-за высокой стоимости, ограничивающая его широкое использование, а возможное присутствие в пробе гепарина, который может получать пациент, требует выполнения теста с гепариназой.
В настоящее время накоплены многочисленные данные о важной патогенетической роли перекисного окисления липидов, являющегося неотъемлемой составляющей окислительного стресса, в инициации и развитии многих острых и хронических заболеваний. Однако активные кислородные метаболиты (АКМ), наряду с окислительной модификацией липидов, вызывают также и одновременную окислительную модификацию белков, приводящую к патологическим изменениям их свойств и функций, к фрагменации и агрегации [Stadtmy E.R., Levite R.L.Protein oxidation // Ann N.Y. Acad Sci. 2000, 899; 191-208]. Обсуждение окислительной модификации белков в организме до недавнего времени носило, в основном, теоретический характер и только в нескольких исследованиях этот процесс рассматривался как одна из возможных причин нарушения функции ферментов и изменения структуры некоторых важных белковых молекул при окислительном стрессе. При окислительной модификации белков в них образуются альдегидные и кетонные группы аминокислотных остатков (карбонильные группы), повышенный уровень которых, наряду с гидроперекисями липидов, также является маркером свободно-радикального окисления и окислительного стресса [Зенков Н.К., Ланкин В.З., Меньшикова Е.Б. Окислительный стресс: биохимический и патофизиологический аспекты // М.: МАИК «Наука/Интерпериодика», 2001, 343 с.].
Применительно к процессам окислительной модификации белков при патологии сердечно-сосудистой системы атеросклеротического генеза большой интерес представляет на сегодняшний день окисление гликопротеина, фибриногена крови. Поскольку повышенный уровень фибриногена является диагностически и прогностически значимым маркером не только атеросклероза, но многих других хронических воспалительных заболеваний, и его окислительная модификация еще более значительно потенцирует нарушения системы гемостаза, сопряженные с эндотелиальной дисфункцией, что в конечном итоге приводит к нарушению агрегации тромбоцитов, эритроцитов, а также к повышенной секреции цитокинов [Ройтман Е.В., Азизова О.А., Морозов Ю.А., Асейчев А.В. Влияние окисленного фибриногена на свертывающую систему крови // Бюл. Экспер. Биол. и мед., 2004, 138, 5: 467-469.].
Известны также способы определения окислительной модификации фибриногена плазмы крови [Рагино Ю.И., Баум В.А., Полонская Я.В. Патент РФ №2298189. Опубл. 27.04.2007. Бюл, №12; Швачко А.Г., Пирязев А.П., Азизова О.А., Сергиенко В.И., Быкова А.А. Способ определения окислительной модификации фибриногена плазмы крови по содержанию карбонильных групп в фибриновом сгустке // Патент РФ №2595806. Опубл. 27.08.2016. Бюл. №24]. Суть обоих методов заключается в предварительном приготовлении фибринового сгустка по Рутбергу, определении его массы. Затем к сгустку добавляют равные объемы физраствора и 20% ТХУ для денатурации и осаждения фибриногена. Далее определяют окислительную модификацию фибрина в сгустке с 2,4-динитрофенилгидразином (2,4-ДНФГ), как описано в работе [Дубинина Е.Е., Бурмистров С.О., Ходов Д.А., Поротов Г.Е. Окислительная модификация белков сыворотки крови человека, метод ее определения // Вопр. мед. химии, 1995, 41, 1:24-26.].
Недостатком описанных методов является необходимость выделения фибринового сгустка, причем инкубация в течение 10 мин не достаточна для коагуляции окисленного фибриногена. Метод трудно выполним в условиях рутинных исследований.
Наиболее близким техническим решением к заявляемому способу является способ определения ФГ, описанная еще в 1971 году Милларом. Суть метода заключается в измерении полосы осажденного нагреванием фибриногена в центрифугированной фракции плазмы крови. После отделения плазмы от остальной части образца крови, плазму отбирают в гематокритную микропробирку и в этой пробирке ее нагревают в течение трех минут при температуре 56°C на водяной бане. Нагретый образец затем центрифугируют так, чтобы образовалась полоса осажденного фибрина в плазме. Количество фибриногена в образце затем определяют путем деления высоты слоя фибрина на высоту первоначального слоя плазмы. Этот метод позволяет объемный процент осажденного термоагрегированного фибриногена перевести непосредственно в концентрацию фибриногена и предполагает, что объем агрегированного фибриногена, выражаемый в мл/100 мл плазмы, по существу составляет один процент (1%) концентрации фибриногена в образце крови, выражаемой в мг/100 мл крови [Millar H.R., Simpson J.G., Stalker A.L. An evalution of the heat precipitation method for plasma fibrinogen estimation // J. Clin. Pathol, 1971, 24: 827-830].
Вышеописанные процедуры для количественного определения фибриногена относительно сложны и требуют затрат времени, поскольку их осуществление связано с предварительной обработкой образца цельной крови для отделения плазмы от других компонент крови. Отделенная плазма крови затем переносится в другую емкость для проведения дальнейших операций и анализов. Сложность общей процедуры количественного определения фибриногена приводит к необходимости проведения этого анализа в исследовательской лаборатории, поскольку его трудно осуществить в условиях клинико-диагностических лабораторий, а также не отражает функциональности фибриногена.
Задачей настоящего изобретения является расширение арсенала лабораторных тестов для определения фибриногена и его функциональности.
Технический результат заявленного изобретения заключается в повышении точности за счет полной термокоагуляции фибриногена из цитратной плазмы крови человека, упрощении методики, что делает ее доступной для рутинных исследований содержания и функциональности фибриногена.
Технический результат достигается тем, что для повышения точности определения фибриногена проводят термокоагуляцию фибриногена инкубацией цитратной плазмы при 56°С в течение 5 мин, после инкубации тщательно перемешивают и отбирают аликвоту и вносят её в лунки 96-ти луночных плоскодонных иммунологических планшет, добавляют физиологический раствор, тщательно перемешивают и турбидиметрически при длине волны 450 нм определяют степень помутнения с использованием фотометра для иммуноферментного анализа. В качестве бланка используют исходную цитратную плазму. Содержание фибриногена определяют по формуле:
ФГ, г/л = ΔА450 × 5,29,
где: ΔА450 - изменение оптической плотности в опытной пробе (А450(опыт)-А450(бланк)); 5,29 - расчетный коэффициент перевода изменения оптической плотности опытной пробы в г/л, представляющий собой отношение белка в преципитате фибриногена к изменению оптической плотности в пробе при термокоагуляции цитратной плазмы. Рассчитывают функциональность фибриногена как разность между количествами фибриногена, определенными данным способом и по методу Клаусса, рассчитывают разницу в % и при разнице более 10% определяют как нарушенную функциональность фибриногена.
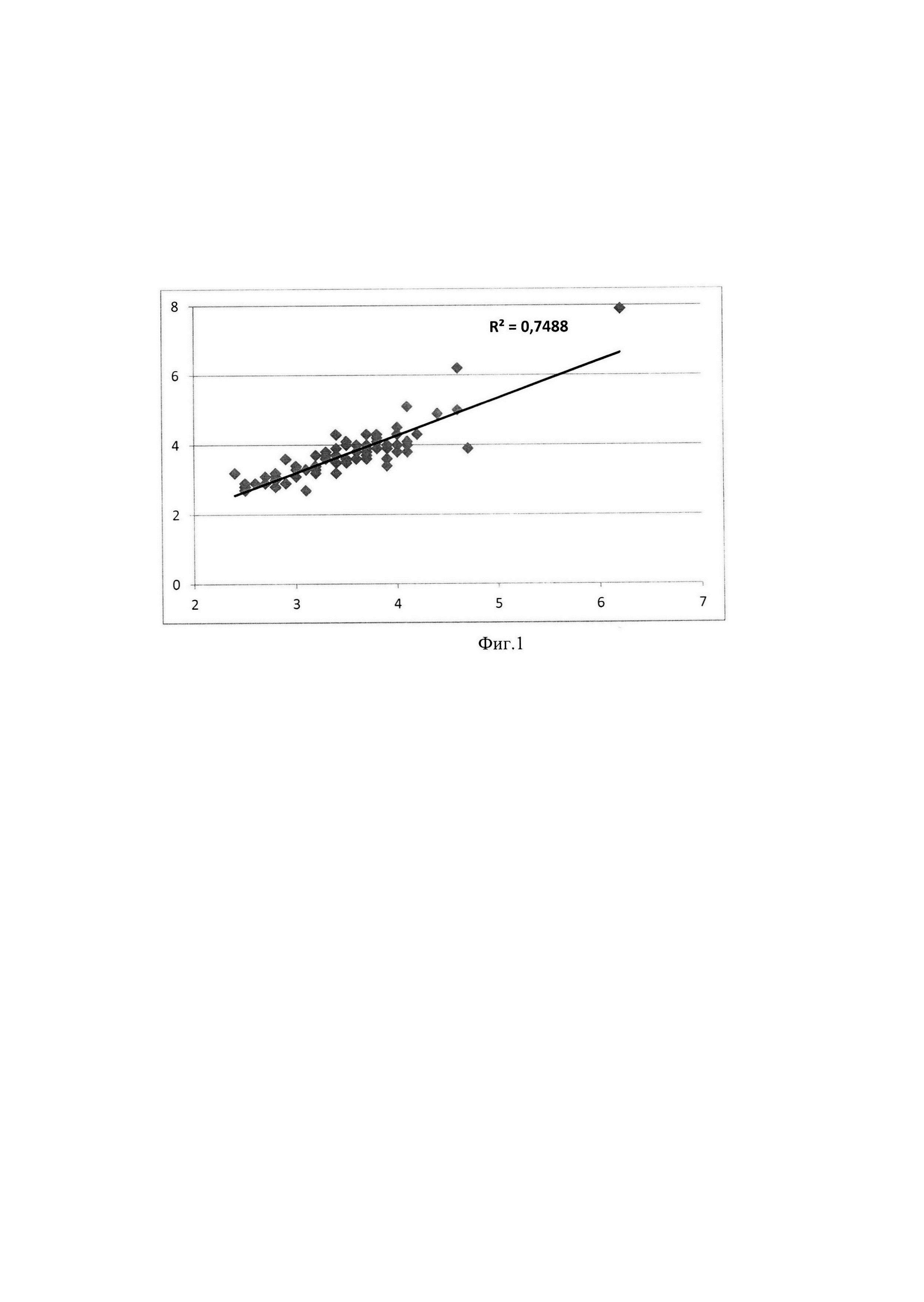
Способ поясняется фигурой 1, на которой представлен корреляционный анализ фибриногена по Клауссу и предлагаемому методу, где по оси Х - фибриноген по Клауссу, по оси Y - фибриноген по разработанному методу.
Способ осуществляют следующим образом: проводят стандартный забор крови в раствор 3,8% цитрата натрия в соотношении 9:1, готовят тромбоцит-обедненную плазму путем центрифугирования при 3000 об/мин в течение 10 мин. проводят предварительно термокоагуляцию фибриногена инкубацией цитратной плазмы при 56°С в течение 5 мин, после инкубации тщательно перемешивают и отбирают 50 мкл аликвоты и вносят её в лунки 96-луночных плоскодонных иммунологических планшет, добавляют 150 мкл физиологического раствора, тщательно перемешивают и турбидиметрически при длине волны 450 нм измеряют степень помутнения с использованием фотометра для иммуноферментного анализа. В качестве бланка используют исходную цитратную плазму (50 мкл исходной цитратной плазмы + 150 мкл физиологического раствора). Содержание фибриногена определяют по формуле:
ФГ, г/л = ΔА450 × 5,29,
где: ΔА450 - изменение оптической плотности в опытной пробе [А450(опыт)-А450(бланк)];
5,29 - расчетный коэффициент перевода изменения оптической плотности опытной пробы в г/л фибриногена.
Определение коагуляции фибриногена в цитратной плазме при 56°С в зависимости от времени инкубации. Аликвоты цитратной плазмы разливали по 200 мкл вносили в микропробирки тапа «эппендорф», плотно закрывали и инкубировали в течение 3, 5, 10, 15 и 30 мин. После инкубации тщательно перемешивали и отбирали пробы по 50 мкл в лунки 96-ти луночной плоскодонной планшеты. Добавляли по 150 мкл физ. раствора, тщательно перемешивали и измеряли термокоагуляцию фибриногена по изменению мутности проб турбидиметрически с использованием фотометра для иммуноферментного анализа при длине волны 450 нм. В качестве бланка ставили контроль исходной плазмы (к 50 мкл плазмы добавляли 150 мкл физ.раствора). Изменение оптической плотности (ОП) при термокоагуляции фибриногена рассчитывали как разность между величинами ОП опытной пробы и бланка. Полученные результаты представлены в таблице 1.
Таблица 1
Изменение оптической плотности проб в зависимости от времени
инкубации цитратных плазм при 56°С
|
Как видно из данных, представленных в таблице 1, наиболее оптимальным временем инкубации для термокоагуляции ФГ является 5 минутная инкубация.
Определение общего белка в преципитате термокоагулированного фибриногена. В микропробирки типа «эппендорф» вносили по 100 мкл цитратной плазмы, плотно закрывали крышками и инкубировали 5 мин при 56°С. После инкубации пробы центрифугировали 10 мин при 8000 об/мин для осаждения термокоагулированного ФГ, тщательно декантировали. Преципитат промывали 1 мл дистиллированной воды, повторно центрифугировали и после декантации растворяли в 75 мкл 1,0 М NaOH. Содержание общего белка в преципитированных пробах определяли с реактивом Лоури. Полученные результаты представлены в таблице 2.
Таблица 2
Содержание общего белка в преципитированных центрифугированием термокоагулированного ФГ
|
Для перевода изменений оптической плотности термокоагулированного ФГ в г/л рассчитывали переводной коэффициент как отношение белка в преципитате к ΔА450. Полученные результаты представлены в таблице 2.
Как видно из данных, представленных в таблице 2, переводной коэффициент колебался от 4,0 до 5,29 единиц, в среднем 5,29. Расчетные значения ФГ с использованием данного коэффициента (5,29) по сравнению с ФГ, преципитированным центрифугированием после термокоагуляции показали, что из 24 тестированных проб в 2 пробах ФГ, рассчитанный по предлагаемому методу был больше 10%, чем в преципитатах термоагрегированного ФГ, и только в одной пробе в преципитате ФГ был больше.
Таким образом расчетный коэффициент для перевода изменений оптической плотности при термокоагуляции ФГ позволяет в 88% (разница между ФГ в преципитате и ФГ расчетный - не более 10%) практичеси количественно определять ФГ в г/л.
Сравнительные исследования содержания ФГ в цитратной плазме по Клауссу, методу Рутберга и предлагаемым методом. Определение ФГ предлагаемым способом. Для этого аликвоты цитратной плазмы по 100 мкл вносили в микропробирки тапа «эппендорф», плотно закрывали крышкой и инкубировали в течение 5 мин. После инкубации тщательно перемешивали и отбирали пробы по 50 мкл в лунки 96-ти луночной плоскодонной иммунологической планшеты. Добавляли по 150 мкл физ. раствора, тщательно перемешивали и измеряли термо-коагуляцию фибриногена по изменению мутности проб турбидиметрически с использованием фотометра для иммуноферментного анализа при длине волны 450 нм. В качестве бланка ставили контроль нативной цитратной плазмы (к 50 мкл плазмы добавляли 150 мкл физ. раствора). Изменение оптической плотности (ОП) при термокоагуляции фибриногена расчитывали как разность между величинами ОП опытной пробы и бланка. Концентрацию ФГ расчитывали по формуле:
ФГ, г/л = ΔА450 × 5,29,
где: ΔА450 - изменение оптической плотности в опытной пробе [А450(опыт)-А450(бланк)];
5,29 - расчетный коэффициент перевода изменения оптической плотности опытной пробы (термокоагулированный фибриноген) в г/л.
Для определения ФГ по модифицированной методике по Рутбергу в лунки 96-ти луночных плоскодонных иммунологических планшет (опытные пробы) вносят последовательно 50 мкл цитратной плазмы, 84 мкл буфера VBS с pH 7,4, 16 мкл 10% раствора ПЭГ-3350 (таким образом, что бы в пробе присутствовало 0,6% ПЭГ-3350) и 50 мкл мкл 0,25 М Ca2+. В контрольные пробы вместо ПЭГ-3350 вносят 16 мкл буфера VBS с pH 7,4 и в пробы бланка к 50 мкл цитратной плазмы добавляют 150 мкл буфера VBS с pH 7,4. Пробы тщательно перемешивают и инкубируют в течение 60 мин при 37°С. Определяют степень коагуляции плазмы турбидиметрически по изменению поглощения в пробах при длине волны 450 нм через 30 и 60 мин инкубации. Далее аккуратно снимают фибриновые сгустки с опытных и контрольных проб, максимально удаляют сыворотку крови «отжиманием» на фильтровальную бумагу, фибриновый сгусток помещают в пробирки типа «эппендорф» и добавляют 1 мл дистиллированной воды для отмывки фибринового сгустка от сыворотки крови. После центрифугируют в течение 10 мин при 8000 об/мин для осаждения фибриновых сгустков, тщательно декантируют и преципитат, фибриновый сгусток, растворяют в 1/2 исходного объема плазмы в 1,0 N NaOH (в 25 мкл) путем инкубации в течение 10 мин при 56°С. Содержание белка в растворенном фибриновом сгустке определяют стандартным способом с использованием биуретового реактива.
Параллельно в исходных цитратных плазмах определяли фибриноген по Клауссу с использованием коммерческих наборов «Фибриноген» (Hemosil, Италия) на автоматическом гемокоагулометрическом анализаторе ACL 8/9/1000 System, (Instrum. Lab. Company, США). Полученные результаты представлены в таблице 3.
Как видно из данных, представленных в таблице 3, только в 7 пробах из 24 цитратных плазм ФГ предлагаемым способом и ФГ, по Клауссу имели близкие величины (колебания <10%), что составляет 29%. В остальных 17 пробах колебания составили от 14 до 33%. В то время как ФГ по Рутбергу (количественный метод) и ФГ по Клауссу в 10 пробах имели близкие величины (разница менее 10%), что составило 42% от тестированных проб. В 14 пробах разница ФГ составил от 11 до 54%.
Таким образом полученные результаты позволяют определять содержание фибриногена фотометрически по изменению мутности проб при термокоагуляции цитратной плазмы при длине волны 450 нм поле 5 минутной инкубации. Расчета содержания ФГ проводят по формуле: ФГ (г/л) = ΔА450×5,29, где: ΔА450 - изменение оптической плотности при коагуляции плазмы; 5,12 - расчетный коэффициент для перевода изменений оптической плотности пробы при коагуляции плазмы в г/л, представляющий собой отношение белка в преципитате ФГ к изменению оптической плотности в пробе при термокоагуляции плазмы. Рассчитывают функциональность фибриногена как разность между количествами фибриногена, определенными данным способом и по методу Клаусса и при разнице более 10% определяют как нарушенную функциональность фибриногена.
Таблица 3
Сравнительные данные ФГ, определенных по Клауссу, Рутбергу и разработанным методом
|
Определение ФГ тремя разными методами (по Клауссу, Рутбергу и предлагаемый способ) расширяют арсенал как для количественной оценки уровня ФГ, так и функциональности (окисленности) молекул ФГ. Как отмечалось выше с увеличением степени окисления фибриногена снижается скорость превращения в фибрин под действием тромбина. Данный эффект в методе определения ФГ по Клауссу должен давать заниженный результат, что нами и показано двумя независимыми способами, модифицированным методом по Рутбергу и разработанным способом. Дальнейшие исследования содержания ФГ по Клауссу и предлагаемым методом должны на большем материале подтвердить причину расхождения уровня ФГ за счет изменения функциональности (окисленности) фибриногена (заниженные результаты по Клауссу), с одной стороны, и наличие образования комплексов окисленного фибриногена с окисленными липопротеинами низкой плотности, активированными белками системы комплемента C3b и C4b и с другими белками крови (завышенный результат по белку в фибриновом сгустке). Предлагаемый способ, таким образом, позволяет более углубленно, количественно оценивать уровень фибриногена и его функциональность. Далее нами был проведен корреляционный анализ данных определения ФГ по Клауссу и разработанным способом. На фигуре 1 представлен график корреляционного анализа фибриногена в 82 пробах цитратной плазмы, определенных методом Клаусса и по предлагаемому методу. Получен высокий коэффициент корреляции R2=0,7488. Статистический анализ показывает, что разработанный способ определения фибриногена является корректным для рутинных исследований фибриногена и может быть внедрен в лабораторную практику для исследований не только количества фибриногена, но и его функциональности в дополнение к методу определения фибриногена по Клауссу.
Способ определения фибриногена при термокоагуляции цитратной плазмы и оценки его функциональности, включающий термокоагуляцию цитратной плазмы путем инкубации в течение 5 мин при 56°С с последующей фотометрической регистрацией при длине волны 450 нм, отличающийся тем, что расчет содержания фибриногена проводят по формуле: ФГ (г/л) = ΔА× 5,29, где ΔА- изменение оптической плотности пробы при термокоагуляции цитратной плазмы; 5,29 - расчетный коэффициент перевода изменения оптической плотности опытной пробы в г/л фибриногена, представляющий собой отношение белка в преципитате фибриногена к изменению оптической плотности в пробе при термокоагуляции плазмы, рассчитывают функциональность фибриногена как разность между количествами фибриногена, определенными данным способом и по методу Клаусса, рассчитывают разницу в % и при разнице более 10% определяют как нарушенную функциональность фибриногена.