Результат интеллектуальной деятельности: ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ В ПНЕВМОКОККОВЫХ ВАКЦИНАХ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым иммуногенным композициям для применения в пневмококковых вакцинах. Иммуногенные композиции по настоящему изобретению типично будут содержать антигены конъюгированных капсульных сахаридов (гликоконъюгаты), где сахариды имеют происхождение из серотипов Streptococcus pneumoniae. Задачей настоящего изобретения является предложение иммуногенных композиций для защиты против S. pneumoniae серогруппы 9.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Инфекции, вызываемые пневмококками, являются важной причиной заболеваемости и смертности во всем мире. Пневмония, лихорадочная бактериемия и менингит являются наиболее распространенными проявлениями инвазивного пневмококкового заболевания, тогда как распространение бактерий в пределах респираторного тракта может приводить к инфекции среднего уха, синуситу или рецидивирующему бронхиту. По сравнению с инвазивным заболеванием, неинвазивные проявления обычно являются менее тяжелыми, но гораздо более распространенными.
Возбудитель пневмококковых заболеваний - Streptococcus pneumoniae (пневмококк) - представляет собой грамположительный инкапсулированный кокк, окруженный полисахаридной капсулой. Различия в составе данной капсулы обеспечивают серологическое различение между примерно 91 типом капсулы, некоторые из которых часто ассоциированы с пневмококковым заболеванием, другие - реже. Инвазивные пневмококковые инфекции включают пневмонию, менингит и лихорадочную бактериемию; среди обычных неинвазивных проявлений - средний отит, синусит и бронхит.
Пневмококковые конъюгатные вакцины (PCV) представляют собой пневмококковые вакцины, используемые для защиты против заболевания, вызванного S. pneumoniae (пневмококк). В настоящее время существуют три PCV вакцины, доступные на глобальном рынке: ПРЕВНАР® (именуемый в некоторых странах превенар) (семивалентная вакцина), СИНФЛОРИКС® (десятивалентная вакцина) и ПРЕВНАР 13® (тринадцативалентная вакцина).
Специфические серотипы, вызывающие заболевание, помимо 13 в ПРЕВНАР 13®, отличаются в зависимости от региона, популяции и могут изменяться со временем из-за приобретения устойчивости к антибиотикам, введения пневмококковой вакцины и долговременных тенденций неизвестного происхождения.
Добавление конъюгатов в иммуногенную композицию не является простым процессом, так как комбинация конъюгатов в одной многовалентной инъекции может приводить к конкуренции между разными компонентов и может оказывать вредное влияние на иммуногенность любого индивидуального конъюгата.
Это явление мешающего воздействия может ограничивать число конъюгатов, которые могут быть включены в многовалентную вакцину. Следовательно, получение защиты против большого числа серотипов, при ограничении числа конъюгатов в композиции, может быть очень затруднительным, несмотря на значительную ценность.
Задачей настоящего изобретения является предложение иммуногенных композиций для подходящей защиты против S. pneumoniae, в частности против S. pneumoniae серогруппы 9, при ограничении числа конъюгатов.
Серогруппа 9 Streptococcus pneumoniae состоит из четырех разных типов: 9V, 9А, 9L и 9N, каждый из которых продуцирует его собственный, специфичный для типа капсульный полисахарид (Richards, J.С. and М.В. Perry, 1988, In A.M. Wu (ed.), The molecular immunology complex carbohydrates. Plenum, New York, pp. 593-594).
Задачей настоящего изобретения является предложение иммуногенных композиций для подходящей защиты против S. pneumoniae серотипов 9V, 9А, 9L и 9N с ограниченным числом конъюгатов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуногенной композиции, содержащей по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 9V, для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N, 9A и/или 9L. Предпочтительно указанная композиция не содержит капсульный сахарид из S. pneumoniae серотипов 9N, 9А и 9L.
В одном аспекте настоящее изобретение относится к применению иммуногенной композиции, содержащей по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 9V, для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипа 9N, 9А и/или 9L. Предпочтительно указанная композиция не содержит капсульный сахарид из S. pneumoniae серотипов 9N, 9А и 9L.
В одном аспекте приведенные выше иммуногенные композиции дополнительно содержат по меньшей мере один гликоконъюгат из S. pneumoniae серотипов 4, 6В, 14, 18С, 19F и/или 23F.
В одном аспекте приведенные выше иммуногенные композиции дополнительно содержат по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 1, 5 и/или 7F.
В одном аспекте приведенные выше иммуногенные композиции дополнительно содержат по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 6А и/или 19А.
В одном аспекте приведенные выше иммуногенные композиции дополнительно содержат по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 3, 15В, 22F, 33F, 12F, 10А, 11А и/или 8.
В другом аспекте приведенные выше иммуногенные композиции дополнительно содержат по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 2, 15С, 17F и/или 20.
В другом аспекте иммуногенные композиции представляют собой 7-, 8-, 9-, 10-, 11-, 12-, 13-, 14-, 15-, 16-, 17-, 18-, 19-, 20-, 21-, 22-, 23- или 24-валентную пневмококковую конъюгатную композицию.
В другом аспекте гликоконъюгаты иммуногенных композиций индивидуально конъюгированы с CRM197.
В одном аспекте гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 9V, 14 и/или 23F иммуногенных композиций индивидуально конъюгированы с PD (белок D Haemophilus influenza), и, при наличии, гликоконъюгат из S. pneumoniae серотипа 18С конъюгирован с ТТ (столбнячный анатоксин), и гликоконъюгат из S. pneumoniae серотипа 19F конъюгирован с DT (дифтерийный токсин).
В одном аспекте гликоконъюгаты получают с использованием химии CDAP (1-циано-4-диметиламинопиридиния тетрафторборат) или посредством химии восстановительного аминирования.
Иммуногенная композиция может дополнительно содержать антигены из других патогенов и/или по меньшей мере один адъювант, такой как фосфат алюминия, сульфат алюминия или гидроксид алюминия.
В одном аспекте иммуногенные композиции способны вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом серотипов 9N, 9А и/или 9L S. pneumoniae в концентрации по меньшей мере 0,35 мкг/мл при определении посредством анализа ELISA (твердофазный иммуноферментный анализ).
В одном аспекте иммуногенные композиции способны вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9N, 9А и/или 9L у по меньшей мере 50% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
В одном аспекте иммуногенные композиции способны значимо увеличивать долю респондеров в отношении S. pneumoniae серотипа 9N, 9А и/или 9L по сравнению с популяцией до иммунизации.
В одном аспекте иммуногенные композиции способны значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипа 9N, 9L и/или 9А по сравнению с популяцией до иммунизации.
В одном аспекте иммуногенные композиции предназначены для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N, 9L и/или 9А.
В одном аспекте иммуногенные композиции предназначены для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванного S. pneumoniae серотипов 9N, 9А и/или 9L, у субъекта, для применения для предупреждения инфекции S. pneumoniae серотипов 9N, 9А и/или 9L у субъекта, или для применения в способе для защиты или лечения человека, чувствительного к инфекции S. pneumoniae серотипов 9N, 9А и/или 9L, посредством введения указанных иммуногенных композиций через системный путь или путь через слизистую.
В одном аспекте настоящее изобретение относится к применению иммуногенной композиции, раскрытой в настоящем документе, для изготовления лекарственного средства для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванного S. pneumoniae серотипов 9N, 9А и/или 9L, у субъекта, для применения для предупреждения инфекции S. pneumoniae серотипов 9N, 9А и/или 9L у субъекта, или для применения в способе для защиты или лечения человека, чувствительного к инфекции S. pneumoniae серотипов 9N, 9А и/или 9L, посредством введения указанных иммуногенных композиций через системный путь или путь через слизистую.
В одном аспекте изобретение относится к способу предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированного с S. pneumoniae серотипов 9N, 9А и/или 9L, у субъекта, включающему введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте изобретение относится к способу предупреждения инфекции S. pneumoniae серотипов 9N, 9А и/или 9L у субъекта, включающему введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
Изобретение дополнительно относится к набору, содержащему иммуногенную композицию, раскрытую в данном документе и в информационном листке, где в указанном информационном листке упоминается способность композиции вызывать выработку функциональных антител против S. pneumoniae серотипов 9А, 9L и/или 9N, и к способу производства указанного набора.
В WO 2013/191459 раскрыта 15-валентная иммуногенная композиция, содержащая гликоконъюгаты из S. pneumoniae и серотипа 9N и 9V. Аналогично, в WO 2014/092377 и китайских патентных заявках № CN 101590224 и CN 103656631 раскрыты иммуногенные композиции, объединяющие гликоконъюгаты из S. pneumoniae как серотипа 9N, так и 9V.
Неожиданно обнаружили, что конъюгат полисахарида серотипа 9V, помимо вызывания выработки функциональных реакционноспособных антител к серогруппе 9V, может дополнительно вызывать выработку функциональных, перекрестно реагирующих антител к другим серотипам в пределах серогруппы 9: 9А, 9L и/или 9N.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
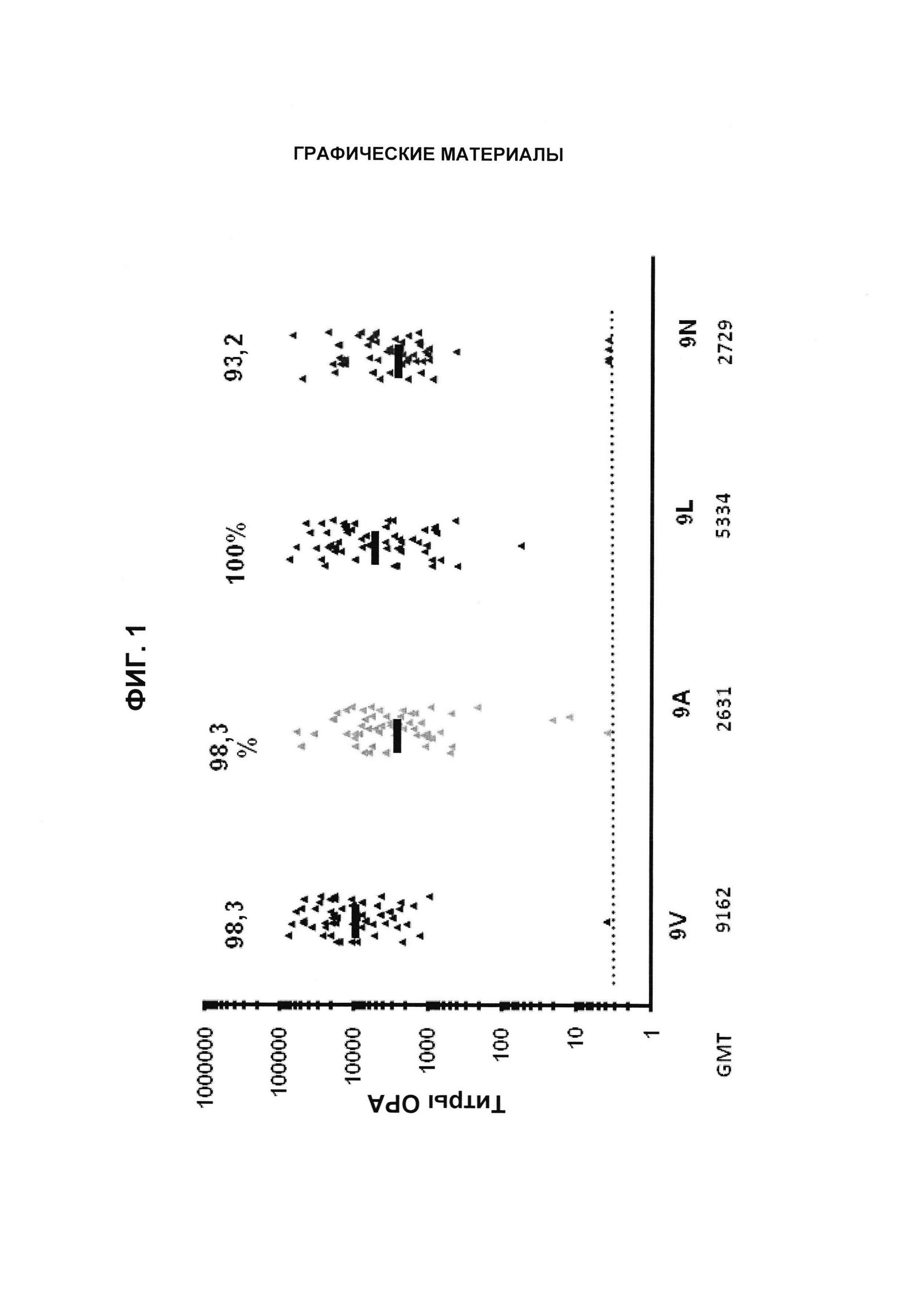
Фиг. 1. Перекрестно-функциональные ответы ОРА. Поднабор из 59 сывороток от взрослых, вакцинированных 13-валентными пневмококковыми конъюгатными вакцинами (Исследование США 6115А1-004; идентификатор ClinicalTrials.gov: NCT00427895), оценивали в ОРА на предмет присутствия функциональных антител против серотипов 9V, 9А, 9L и 9N. Над каждой группой указан процент образцов с позитивным титром ОРА (то есть большим или равным 1:8). По абсциссе под каждой группой перечислены средние геометрические титров (GMT).
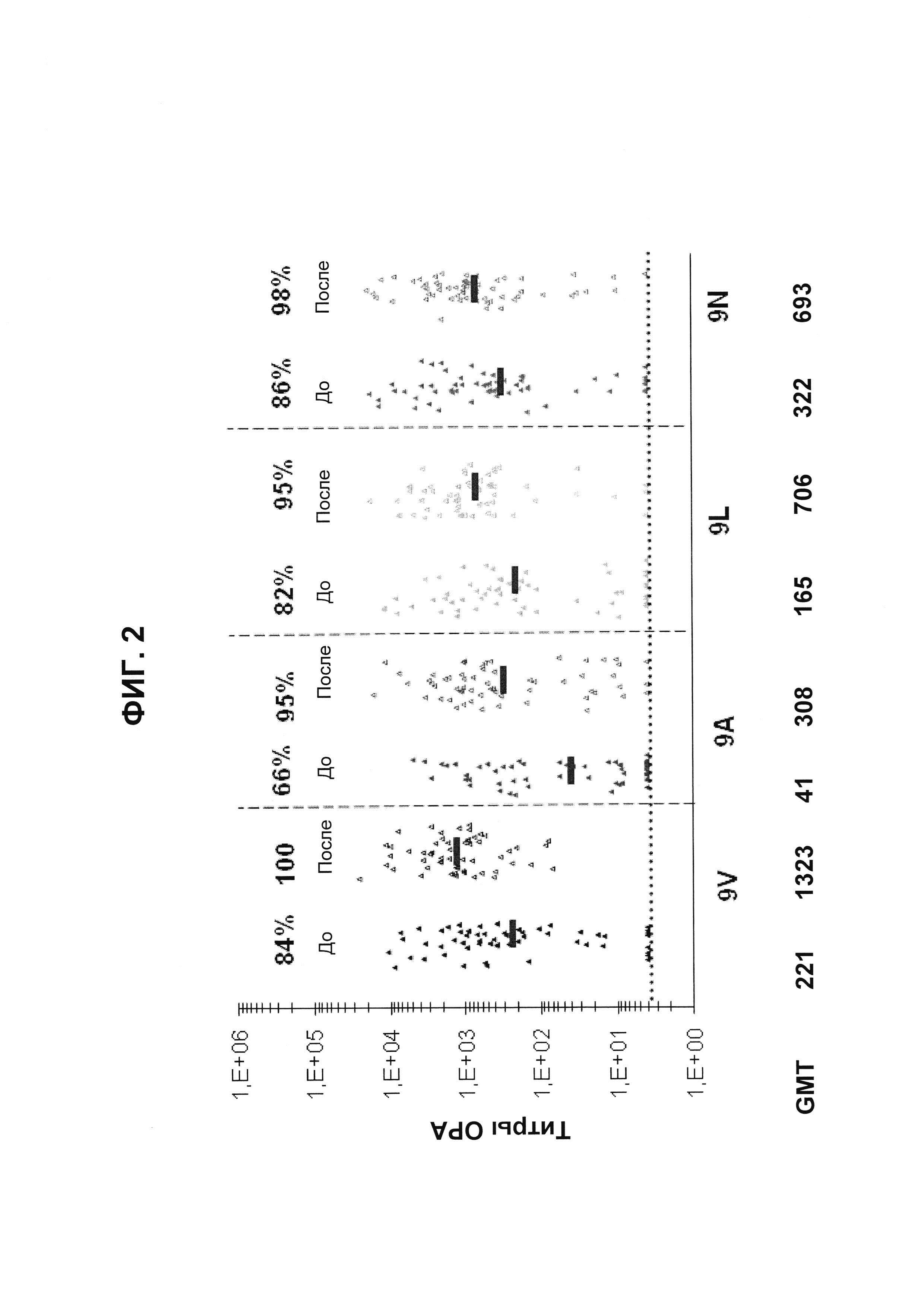
Фиг. 2. Перекрестно-функциональные ответы ОРА шестидесяти шести соответствующих сывороток до/после вакцинации. Поднабор из панели 66 соответствующих сывороток до и после вакцинации от взрослых, вакцинированных 13-валентной пневмококковой конъюгатной вакциной (исследование 6115А1-3005; идентификатор ClinicalTrials.gov: NCT00546572), оценивали в ОРА на предмет присутствия функциональных антител против серотипов 9V, 9А, 9L и 9N. Над каждой группой указан процент образцов с позитивным титром ОРА (то есть большим или равным 1:8). По абсциссе под каждой группой перечислены средние геометрические титров (GMT).
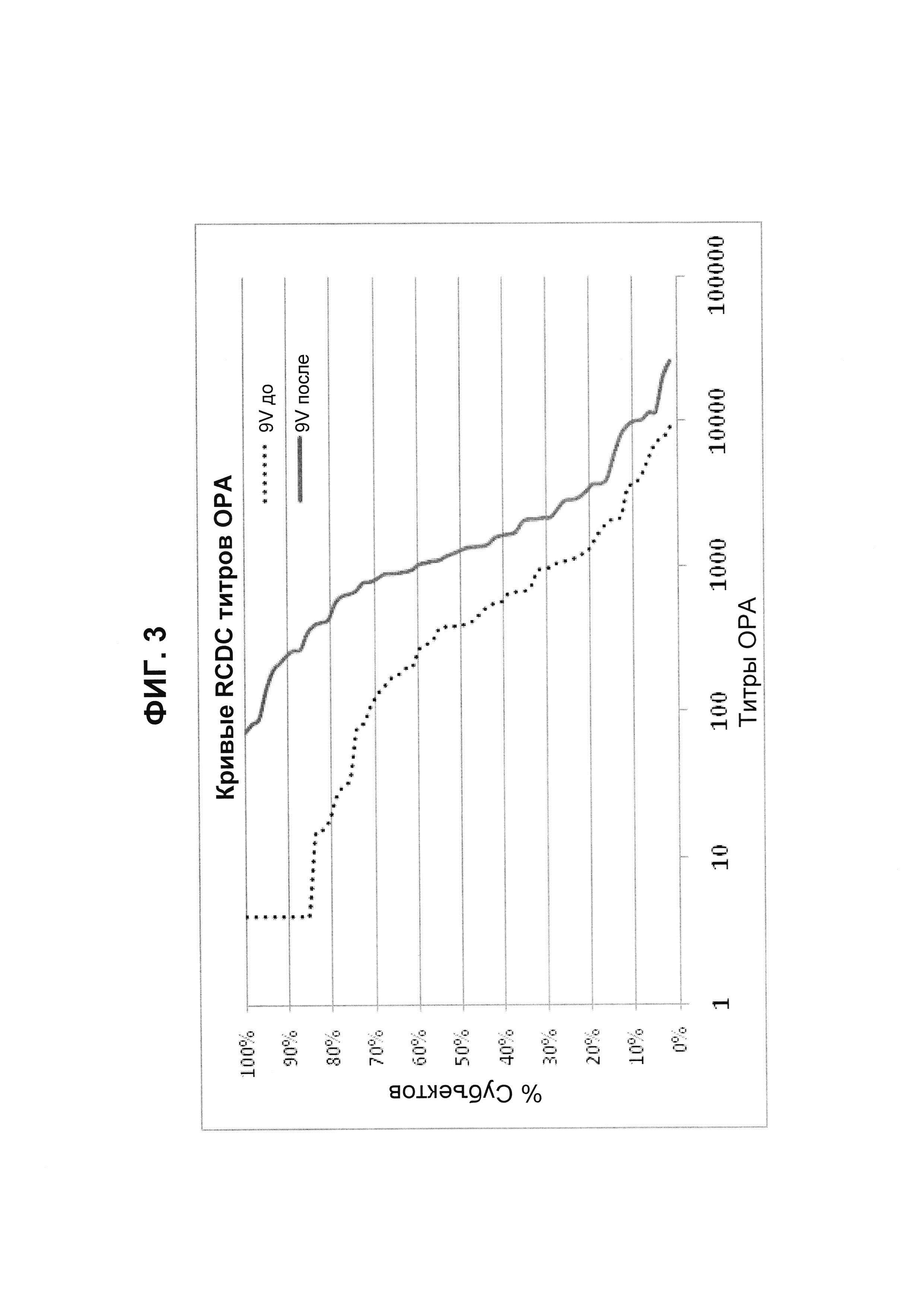
Фиг. 3. Кривые обратного интегрального распределения (RCDC) до и после иммунизации - пневмококковый серотип 9V (Pn9V).
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9V из соответствующей панели сывороток до и после вакцинации (N равно 66) при вакцинации 13-валентной пневмококковой конъюгатной вакциной (исследование 6115А-3005; идентификатор ClinicalTrials.gov: NCT00546572). Графики представляют процент сывороток с позитивным титром ОРА (то есть большим или равным 1:8).
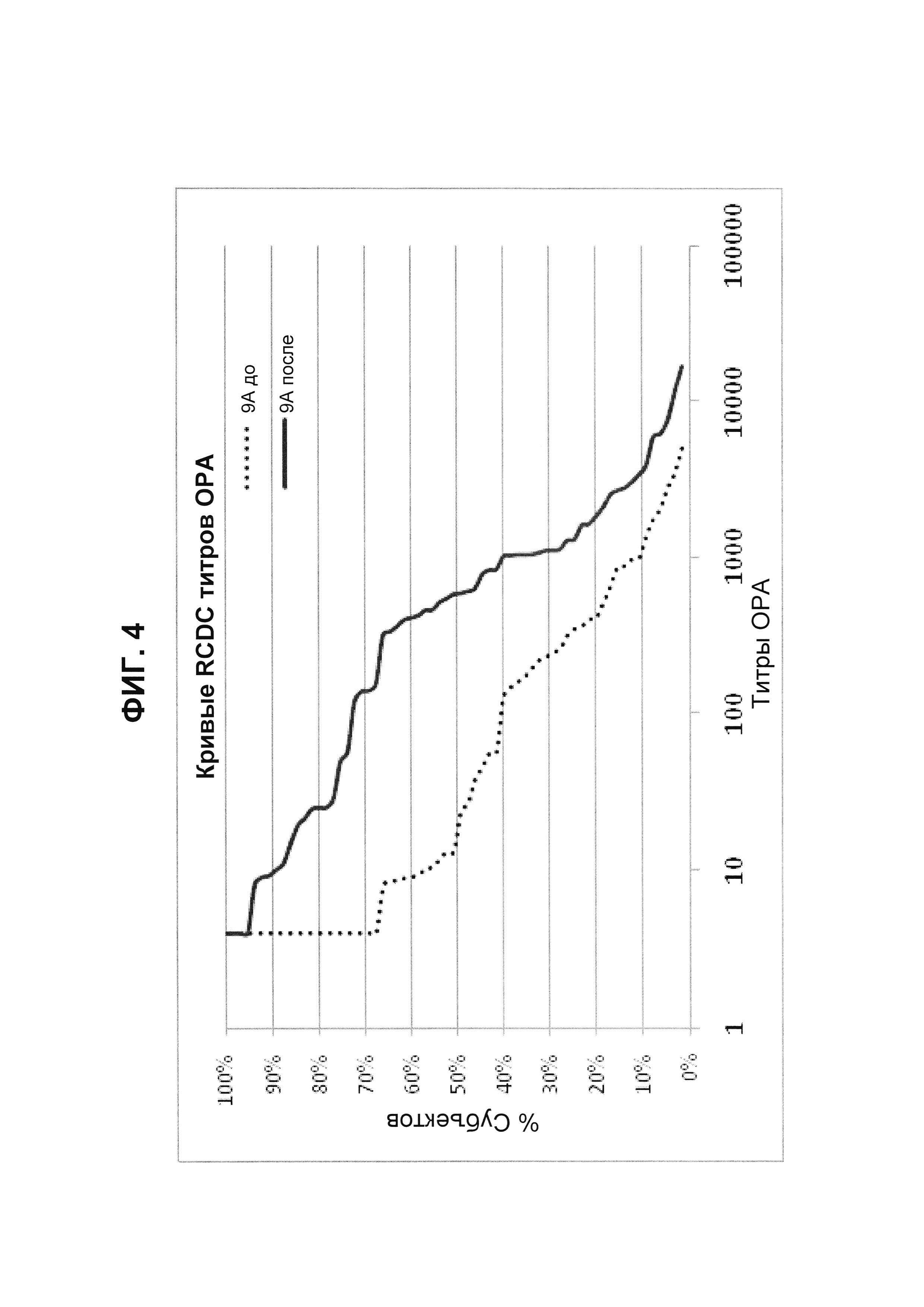
Фиг. 4. Кривые обратного интегрального распределения (RCDC) до и после иммунизации - пневмококковый серотип 9А (Pn9А).
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9А из соответствующей панели сывороток до и после вакцинации (N равно 66) при вакцинации 13-валентной пневмококковой конъюгатной вакциной (исследование 6115А-3005; идентификатор ClinicalTrials.gov: NCT00546572). Графики представляют процент сывороток с позитивным титром ОРА (то есть большим или равным 1:8).
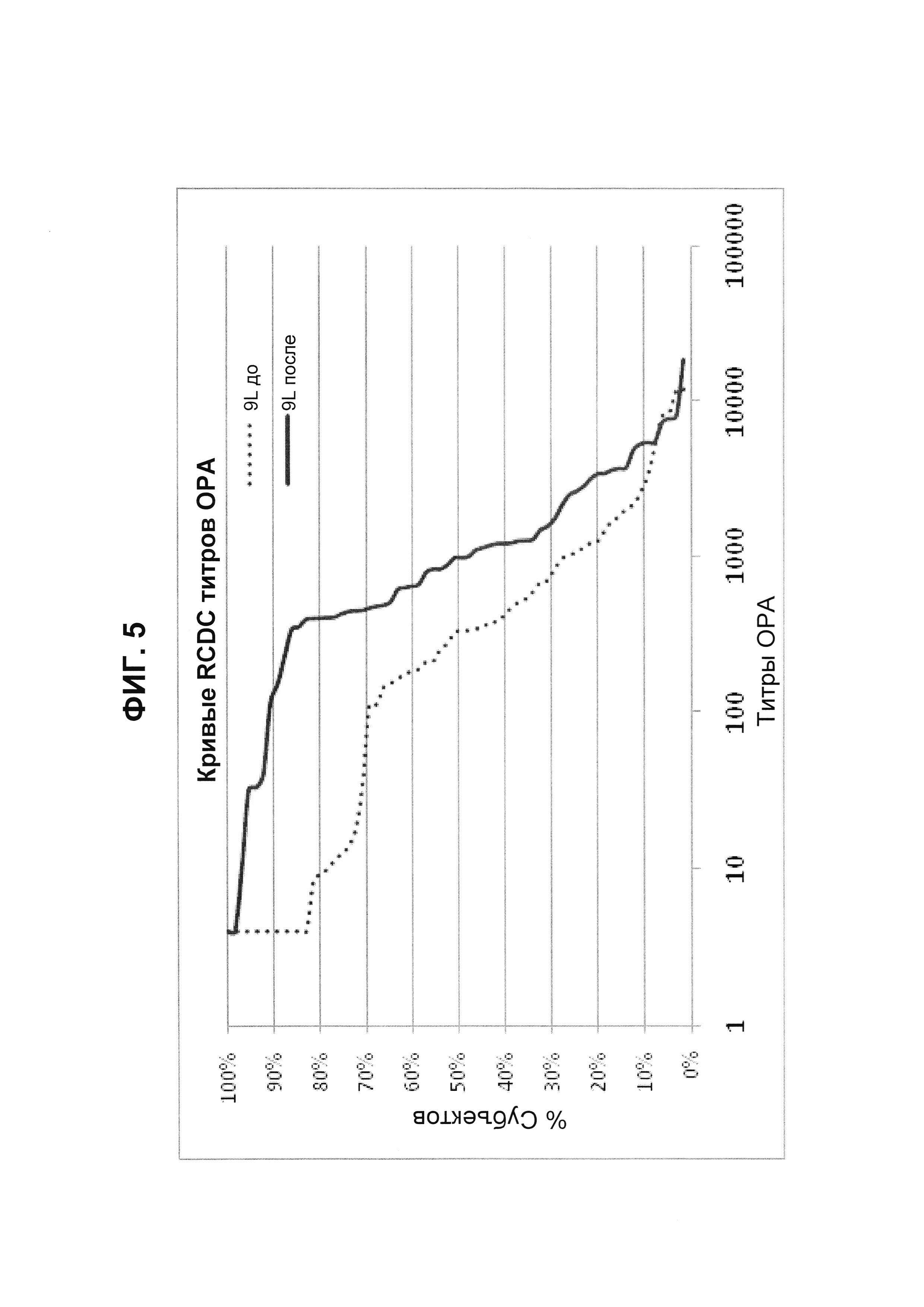
Фиг. 5. Кривые обратного интегрального распределения (RCDC) до и после иммунизации - пневмококковый серотип 9L (Pn9L).
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9L из соответствующей панели сывороток до и после вакцинации (N равно 66) при вакцинации 13-валентной пневмококковой конъюгатной вакциной (исследование 6115А-3005; идентификатор ClinicalTrials.gov: NCT00546572). Графики представляют процент сывороток с позитивным титром ОРА (то есть большим или равным 1:8).
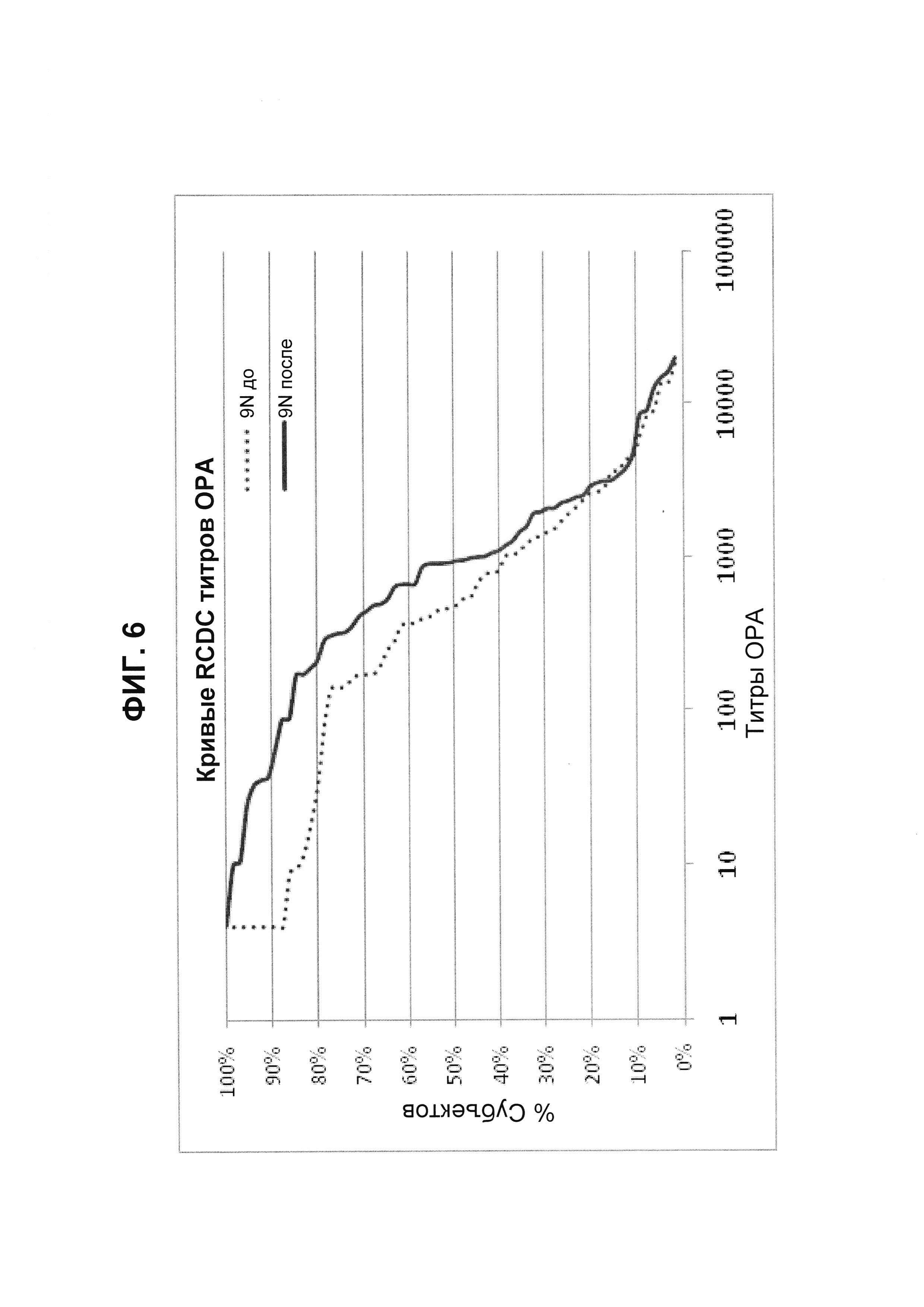
Фиг. 6. Кривые обратного интегрального распределения (RCDC) до и после иммунизации - пневмококковый серотип 9N (Pn9N).
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9N из соответствующей панели сывороток до и после вакцинации (N равно 66) при вакцинации 13-валентной пневмококковой конъюгатной вакциной (исследование 6115А-3005; идентификатор ClinicalTrials.gov: NCT00546572). Графики представляют процент сывороток с позитивным титром ОРА (то есть большим или равным 1:8).
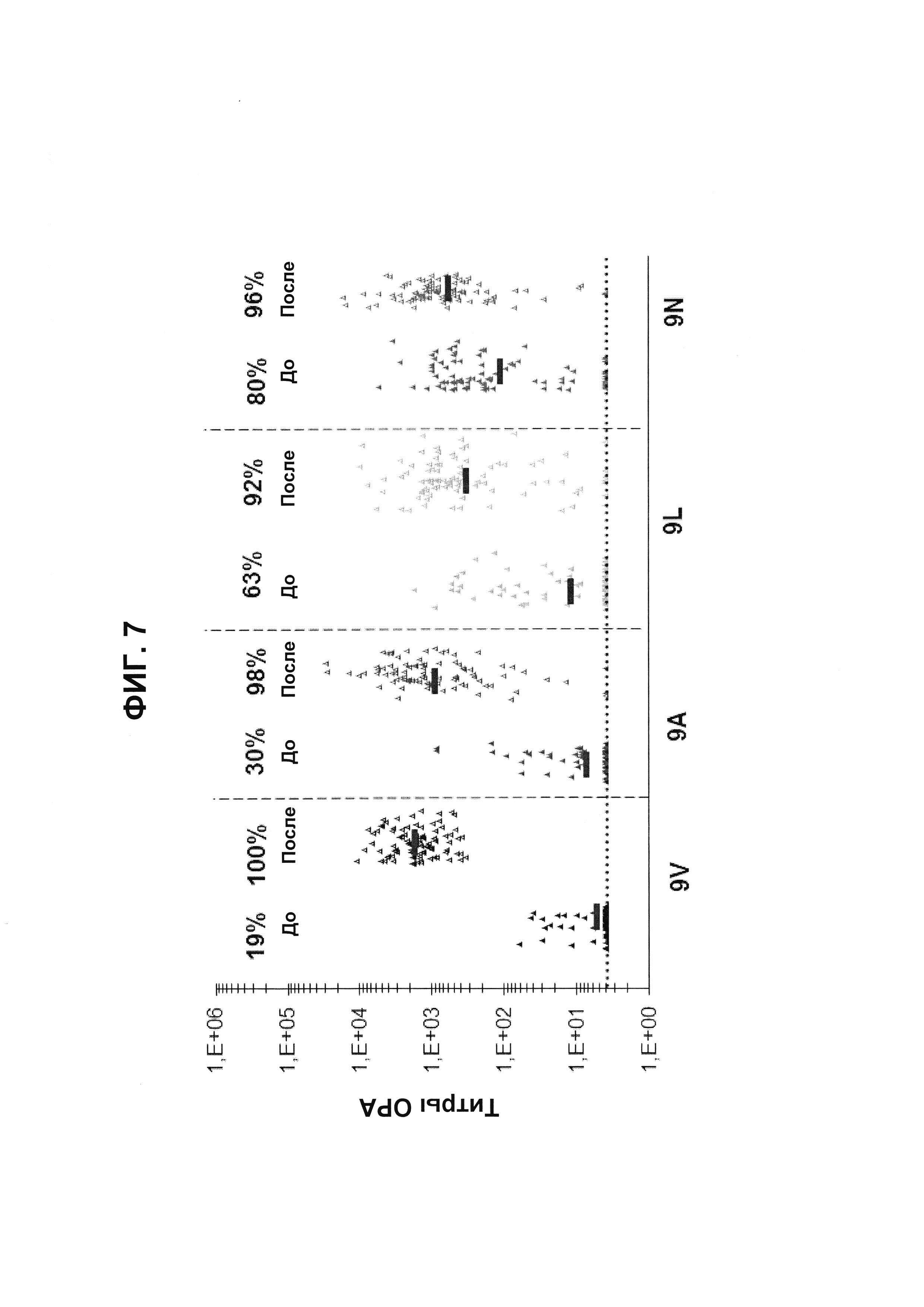
Фиг. 7. Перекрестно-функциональные ответы ОРА на серогруппу 9 из соответствующих сывороток до/после вакцинации из исследования В1851088 (идентификатор ClinicalTrials.gov: NCT01646398) после иммунизации 13vPnC.
Поднабор панели 91 соответствующей сыворотки до и после вакцинации от взрослых, вакцинированных 13vPnC (исследование В1851088), оценивали в ОРА на предмет присутствия функциональных антител против серотипов 9V, 9А, 9L и 9N. Над каждой группой указан процент образцов с позитивным титром ОРА (то есть большим или равным 1:8).
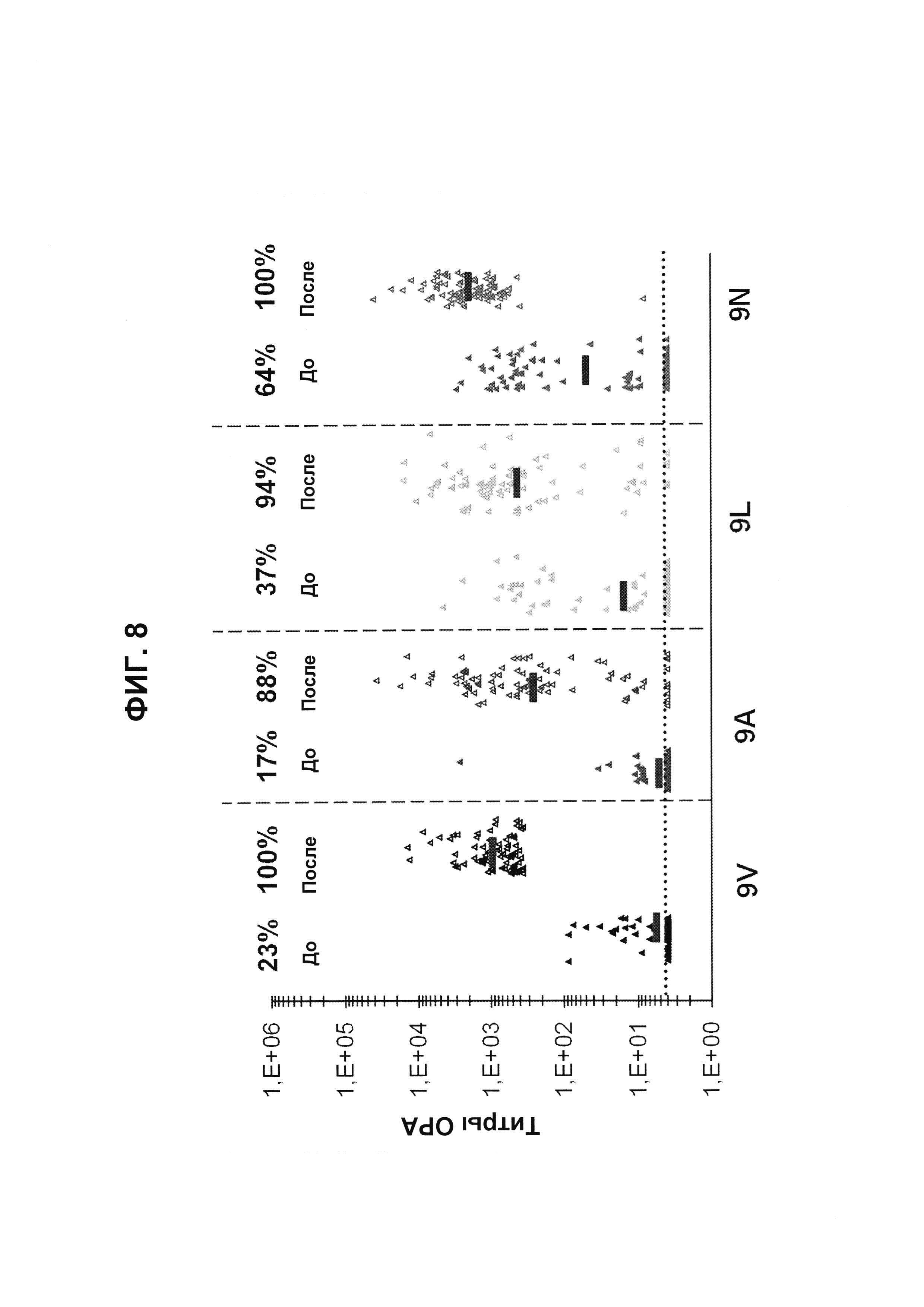
Фиг. 8. Перекрестно-функциональные ответы ОРА на серогруппу 9 из соответствующих сывороток до/после вакцинации из исследования В1851088 после иммунизации 23vPS.
Поднабор панели 83 соответствующих сывороток до и после вакцинации от взрослых, вакцинированных 23vPS (исследование В1851088), оценивали в ОРА на предмет присутствия функциональных антител против серотипов 9V, 9А, 9L и 9N. Над каждой группой указан процент образцов с позитивным титром ОРА (то есть большим или равным 1:8).
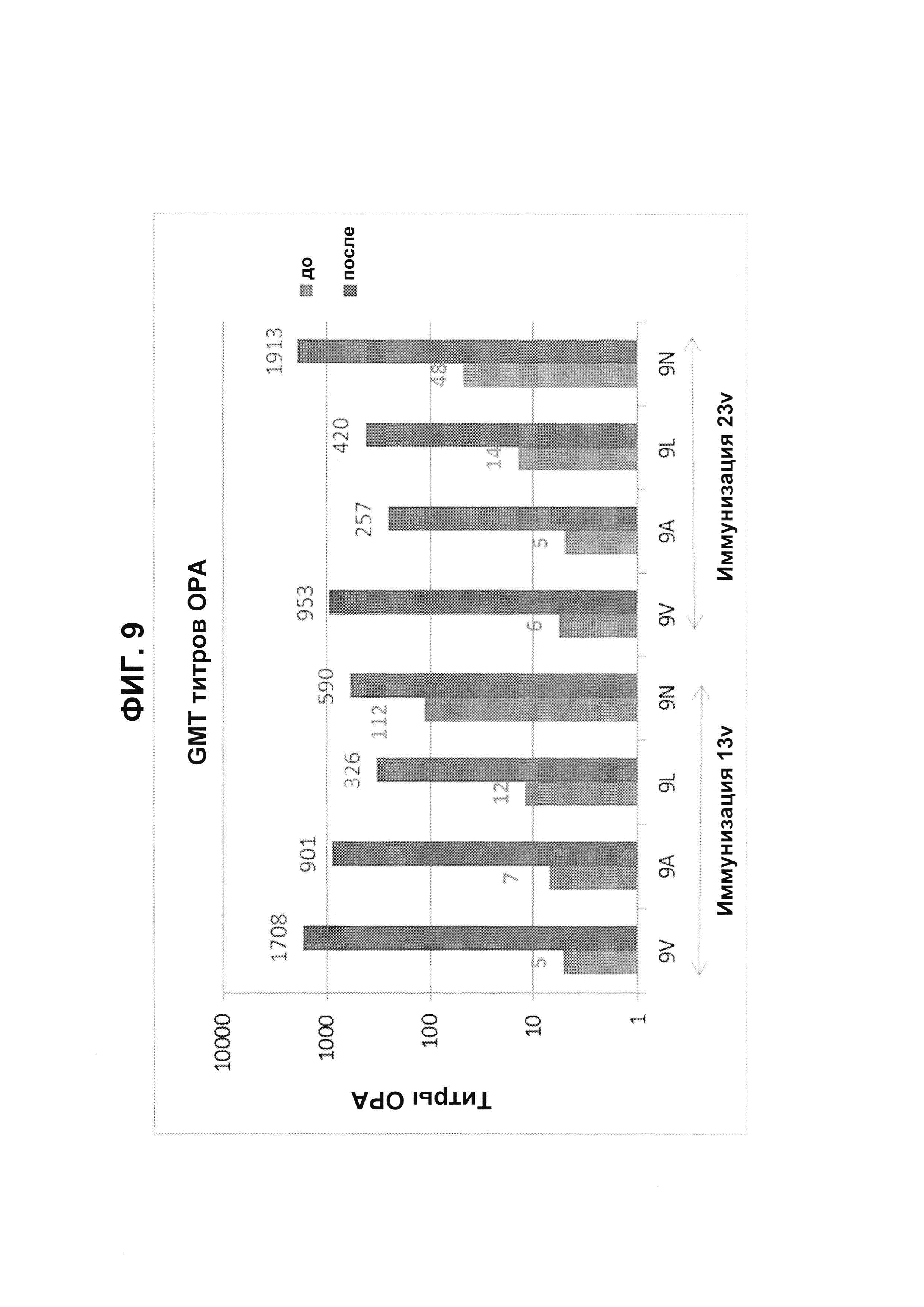
Фиг. 9. Перекрестно-функциональные титры ОРА на серогруппу 9 из соответствующих сывороток до/после вакцинации из исследования В1851088 после иммунизации 13vPnC (13v) или 23vPS (23v).
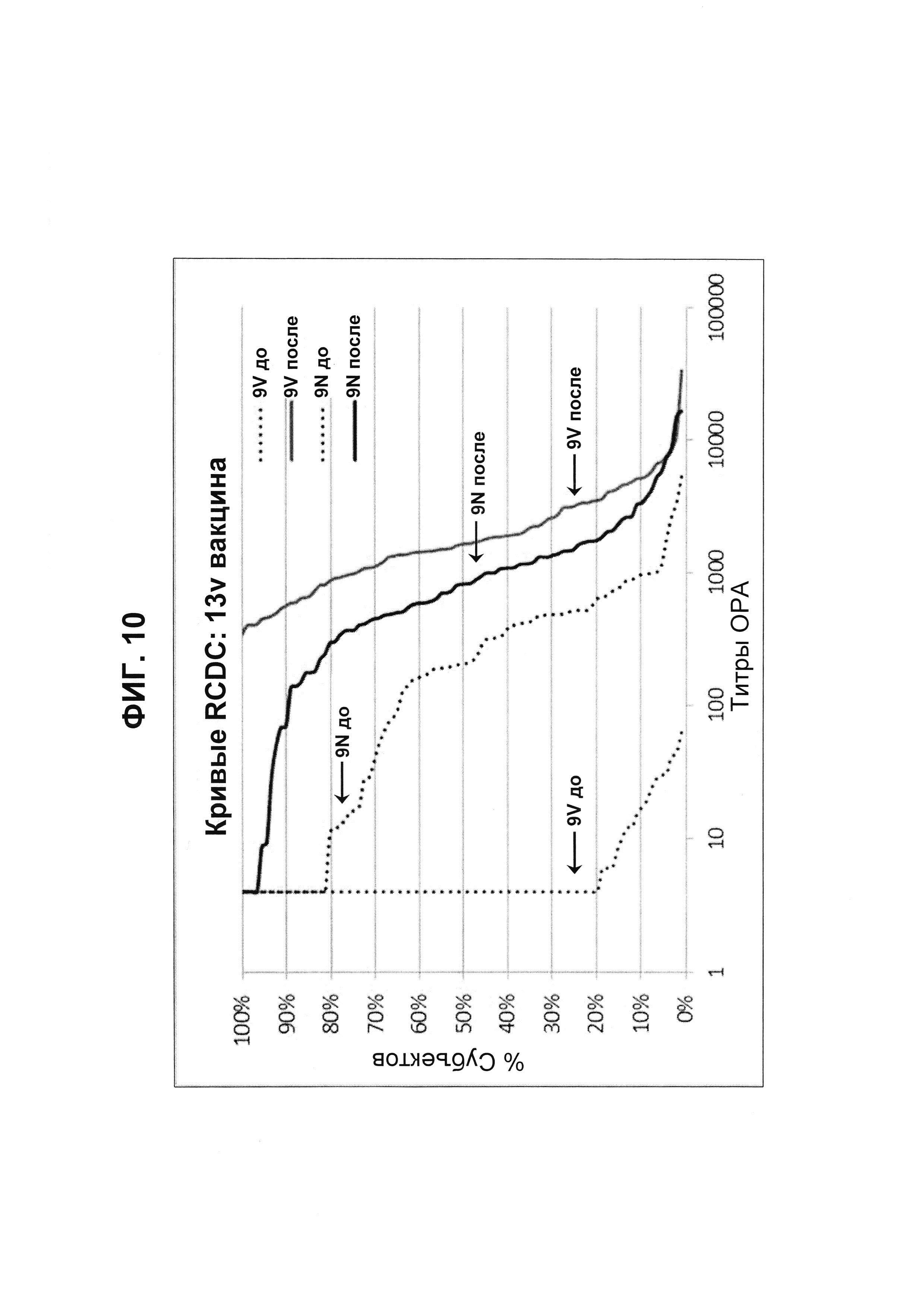
Фиг. 10. Кривые обратного интегрального распределения (RCDC) Pn9V и Pn9N 13vPnC из исследования В1851088.
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9V и 9N из панели соответствующих сывороток до и после вакцинации (N равно 91) при вакцинации 13vPnC (японское исследование В1851088).
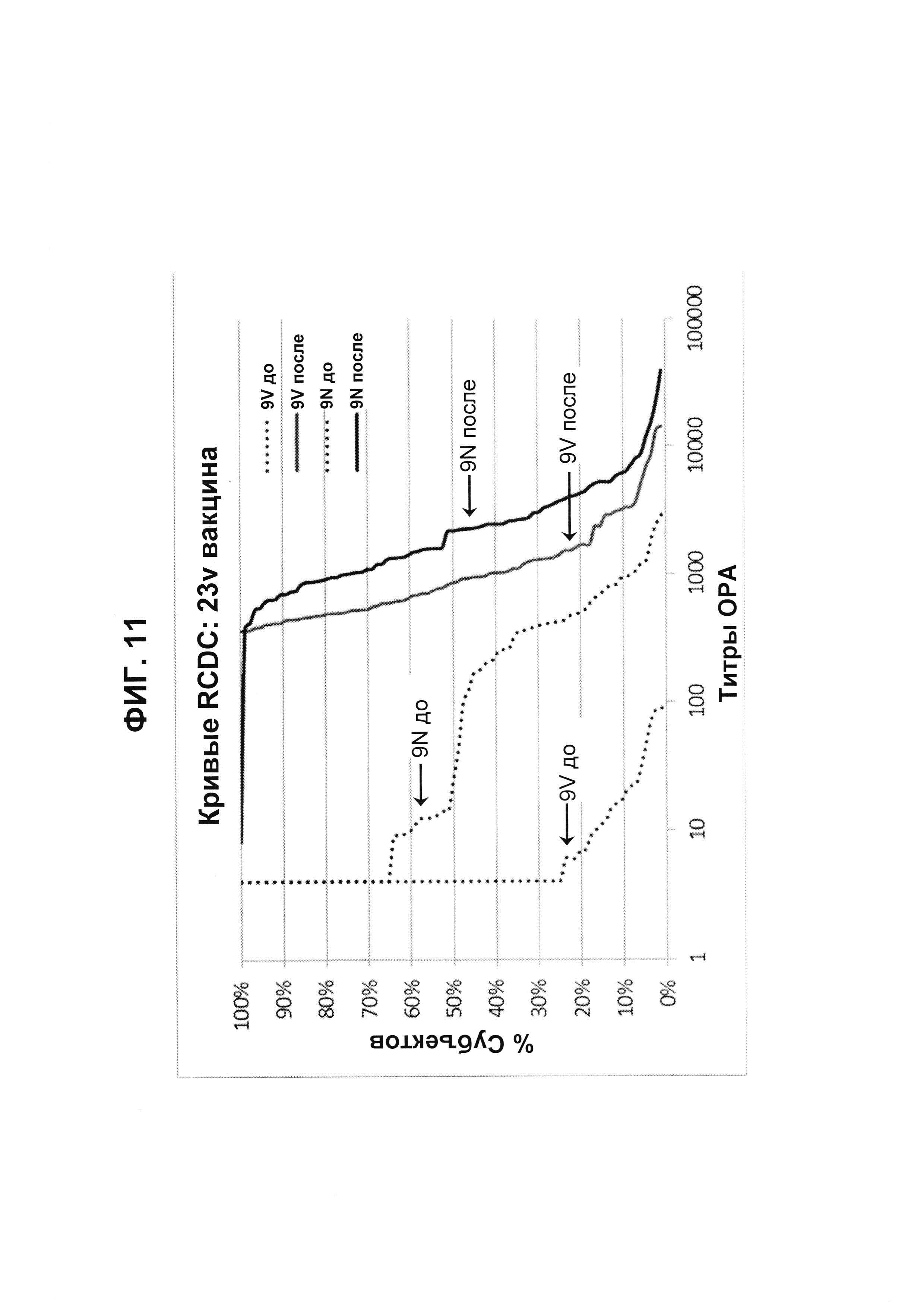
Фиг. 11. Кривые обратного интегрального распределения (RCDC) Pn9V и Pn9N 23vPS из исследования В1851088.
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9V и 9N из панели соответствующих сывороток до и после вакцинации (N равно 83) при вакцинации 23vPS (японское исследование В1851088).
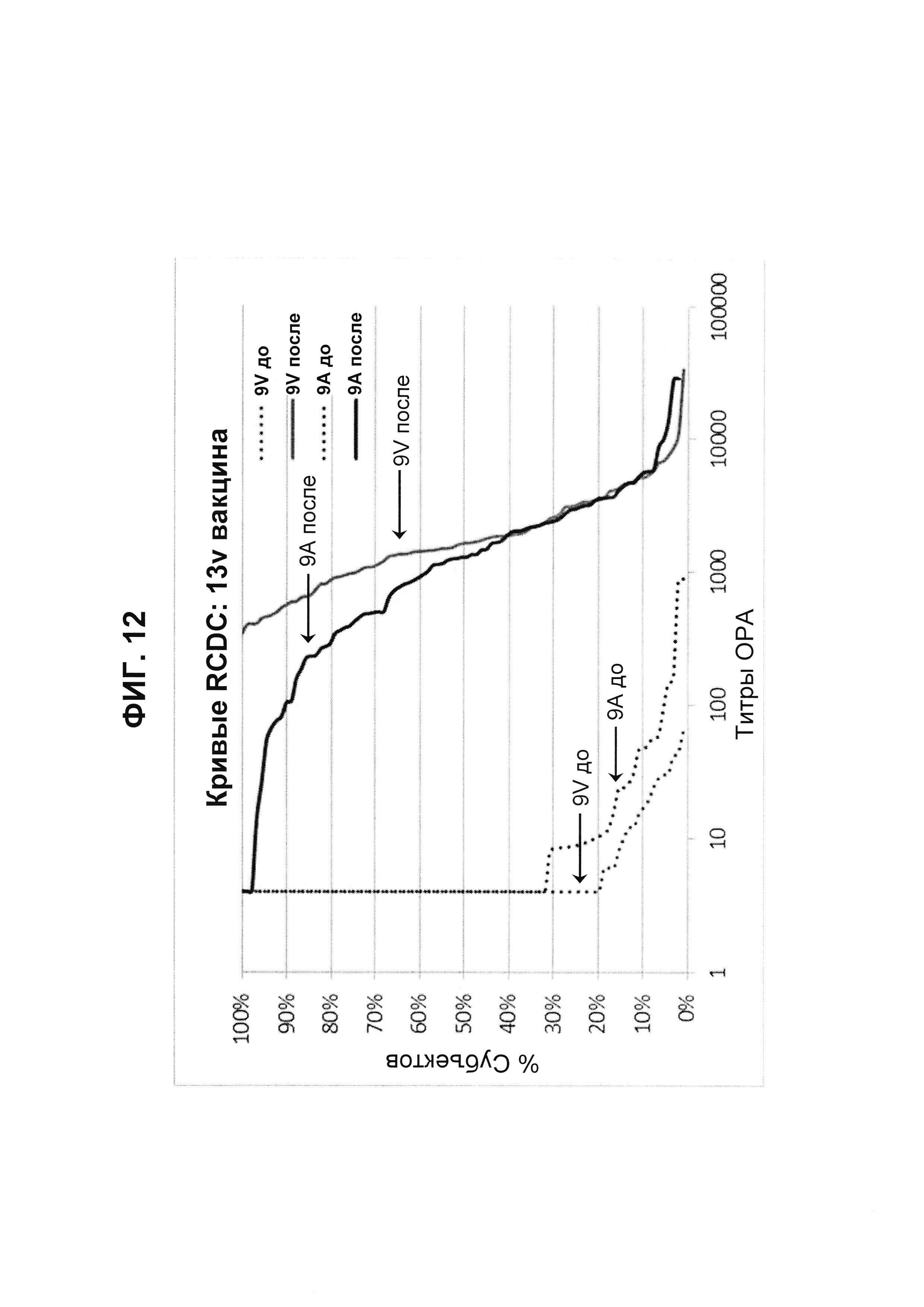
Фиг. 12. Кривые обратного интегрального распределения (RCDC) Pn9V и Pn9A 13vPnC из исследования В1851088.
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9V и 9А из панели соответствующих сывороток до и после вакцинации (N равно 91) при вакцинации 13vPnC (японское исследование В1851088).
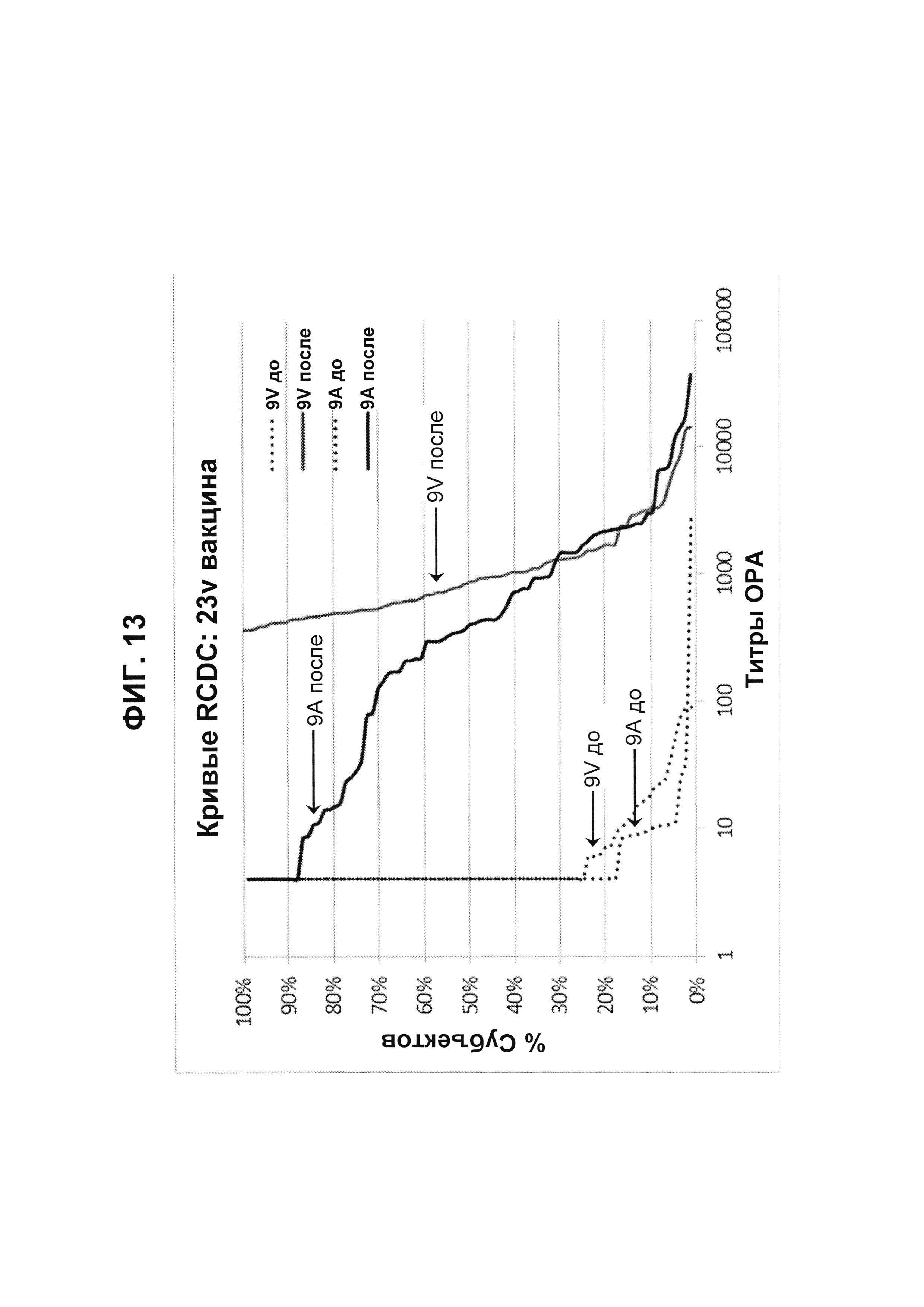
Фиг. 13. Кривые обратного интегрального распределения (RCDC) Pn9V и Pn9А 23vPS из исследования В1851088.
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9V и 9А из панели соответствующих сывороток до и после вакцинации (N равно 83) при вакцинации 23vPS (японское исследование В1851088).
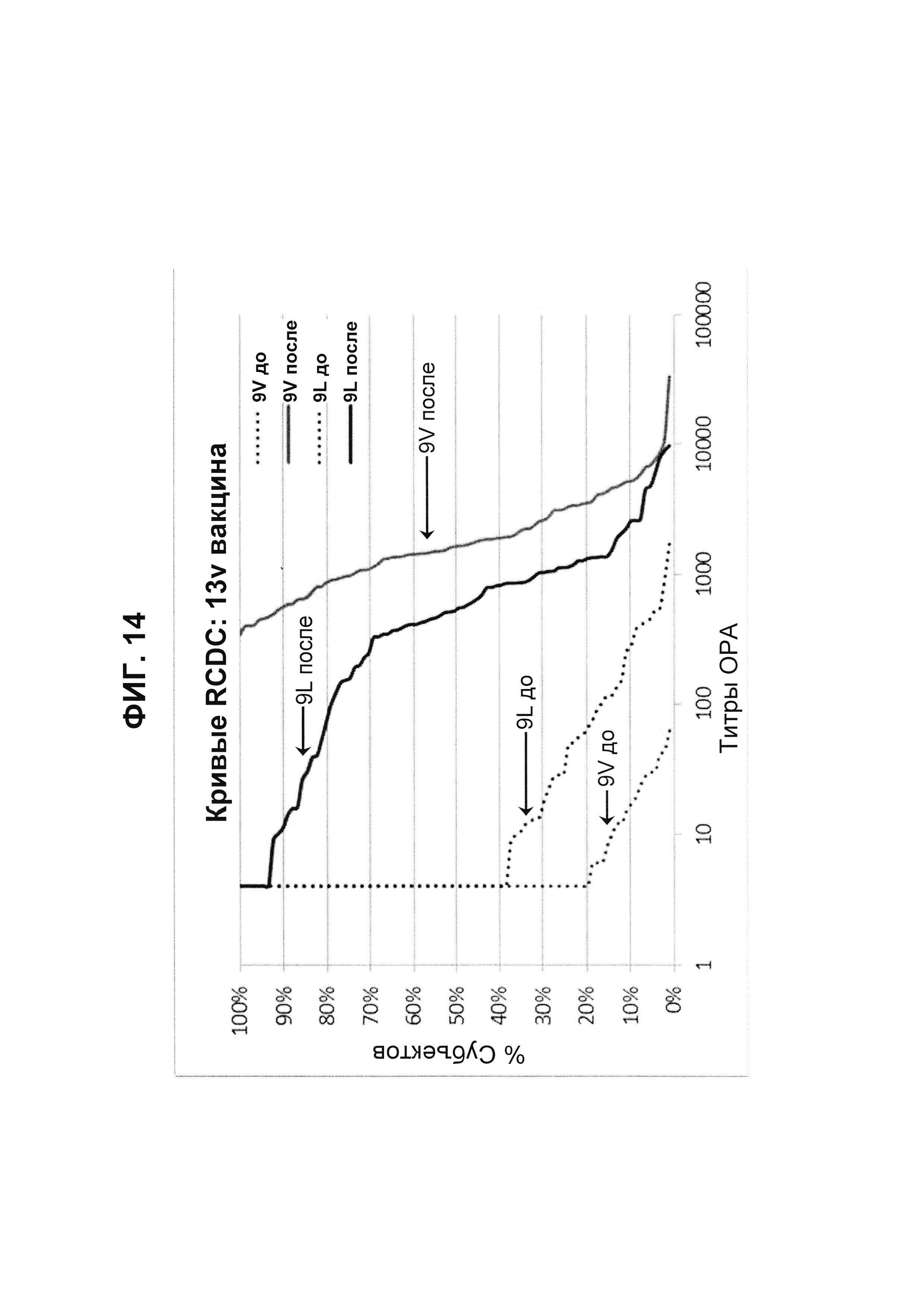
Фиг. 14. Кривые обратного интегрального распределения (RCDC) Pn9V и Pn9L 13vPnC из исследования В1851088.
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9V и 9L из панели соответствующих сывороток до и после вакцинации (N равно 91) при вакцинации 13vPnC (японское исследование В1851088).
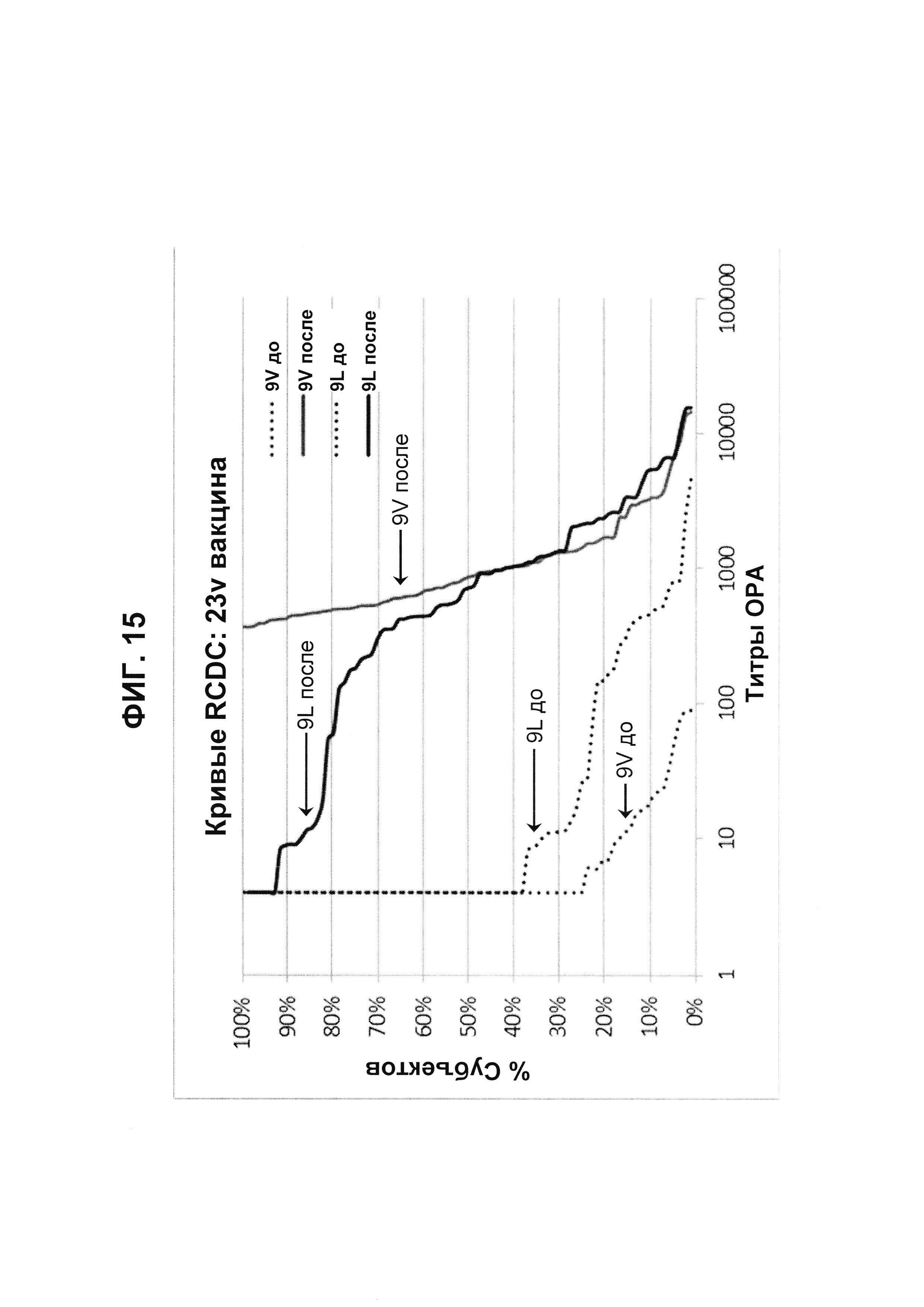
Фиг. 15. Кривые обратного интегрального распределения (RCDC) Pn9V и Pn9L 23vPS из исследования В1851088.
Кривые обратного интегрального распределения титров ОРА в отношении серотипа 9V и 9L из панели соответствующих сывороток до и после вакцинации (N равно 83) при вакцинации 23vPS (японское исследование В1851088).
1. Иммуногенные композиции по изобретению
Иммуногенные композиции по настоящему изобретению типично будут содержать антигены конъюгированных капсульных сахаридов (также именуемых гликоконъюгатами), где сахариды имеют происхождение из серотипов S. pneumoniae.
Предпочтительно число капсульных сахаридов S. pneumoniae может варьировать от 1 серотипа (или «v» - валентности) до 24 разных серотипов (24v). В одном воплощении присутствует один серотип. В одном воплощении присутствует 2 разных серотипа. В одном воплощении присутствует 3 разных серотипа. В одном воплощении присутствует 4 разных серотипа. В одном воплощении присутствует 5 разных серотипов. В одном воплощении присутствует 6 разных серотипов. В одном воплощении присутствует 7 разных серотипов. В одном воплощении присутствует 8 разных серотипов. В одном воплощении присутствует 9 разных серотипов. В одном воплощении присутствует 10 разных серотипов. В одном воплощении присутствует 11 разных серотипов. В одном воплощении присутствует 12 разных серотипов. В одном воплощении присутствует 13 разных серотипов. В одном воплощении присутствует 14 разных серотипов. В одном воплощении присутствует 15 разных серотипов. В одном воплощении присутствует 16 разных серотипов. В одном воплощении присутствует 17 разных серотипов. В одном воплощении присутствует 18 разных серотипов. В одном воплощении присутствует 19 разных серотипов. В одном воплощении присутствует 20 разных серотипов. В одном воплощении присутствует 21 разный серотип. В одном воплощении присутствует 22 разных серотипа. В одном воплощении присутствует 23 разных серотипа. В одном воплощении присутствует 24 разных серотипа. Капсульные сахариды конъюгированы с белком-носителем с образованием гликоконъюгатов, как описано здесь ниже.
Если белок-носитель является одинаковым для 2 или более чем 2 сахаридов в композиции, данные сахариды могут быть конъюгированы с той же самой молекулой белка-носителя (молекулы-носители, имеющие 2 или более чем 2 разных сахарида, конъюгированных с ними) [см., например, WO 2004/083251].
Однако, в предпочтительном воплощении каждый сахарид индивидуально конъюгирован с разными молекулами белка-носителя (каждая молекула белка-носителя имеет только один тип сахарида, конъюгированного с ней). В указанном воплощении говорят то, что капсульные сахариды индивидуально конъюгированы с белком-носителем.
Для задач изобретения термин «гликоконъюгат» указывает капсульный сахарид, ковалентно связанный с белком-носителем. В одном воплощении капсульный сахарид непосредственно связан с белком-носителем. Во втором воплощении бактериальный сахарид связан с белком через спейсер/линкер.
1.1. Белок-носитель по изобретению
Компонентом гликоконъюгата по изобретению является белок-носитель, с которым конъюгирован сахарид. Термины «белковый носитель» или «белок-носитель» или «носитель» здесь могут быть использованы взаимозаменяемо. Белки-носители должны поддаваться стандартным методикам конъюгирования.
В предпочтительном воплощении белок-носитель гликоконъюгатов выбран из группы, состоящей из DT (дифтерийный токсин), ТТ (столбнячный анатоксин) или фрагмента С ТТ, CRM197 (нетоксичный, но антигенно идентичный вариант дифтерийного токсина), цепи А мутанта дифтерийного токсина CRM197 (CN 103495161), других мутантов DT (таких как CRM176, CRM228, CRM45 (Uchida et al. (1973) J. Biol. Chem. 218:3838-3844), CRM9, CRM102, CRM103 или CRM107; и других мутаций, описанных Nicholls и Youle в Genetically Engineered Toxins, Ed: Frankel, Marcel Dekker Inc. (1992); делеции или мутации Glu-148 до Asp, Gln или Ser, и/или Ala 158 до Gly, и других мутаций, раскрытых в патентах США №4709017 и 4950740; мутации по меньшей мере одного или более чем одного остатка Lys 516, Lys 526, Phe 530 и/или Lys 534, и других мутаций, раскрытых в патентах США №5917017 и 6455673; или фрагмента, раскрытого в патенте США №5843711, пневмококкового пневмолизина (ply) (Kuo et al. (1995) Infect Immun 63:2706-2713), включая ply, детоксифицированный некоторым образом, например dPLY-GMBS (WO 2004/081515 и WO 2006/032499) или dPLY-формол, PhtX (белки полигистидинового триадного семейства), включая PhtA, PhtB, PhtD, PhtE (последовательности PhtA, PhtB, PhtD или PhtE раскрыты в WO 00/37105 и WO 00/39299) и слияний белков Pht, например слияний PhtDE, слияний PhtBE, Pht А-Е (WO 01/98334, WO 03/054007, WO 2009/000826), OMPC (менингококковый белок наружной мембраны - обычно экстрагируется из Neisseria meningitidis серогруппы В (ЕР 0372501), PorB (из N. meningitidis), PD (белок D Haemophilus influenzae; см., например, ЕР 0594610 В), или их иммунологически функциональных эквивалентов, синтетических пептидов (ЕР 0378881, ЕР 0427347), белков теплового шока (WO 93/17712, WO 94/03208), коклюшных белков (WO 98/58668, ЕР 0471177), цитокинов, лимфокинов, факторов роста или гормонов (WO 91/01146), искусственных белков, содержащих многочисленные эпитопы человеческих Т-клеток CD4+, из разных антигенов, имеющих происхождение из патогенов (Falugi et al. (2001) Eur J Immunol 31:3816-3824), таких как белок N19 (Baraldoi et al. (2004) Infect Immun 72:4884-4887), пневмококкового поверхностного белка PspA (WO 02/091998), белков поглощения железа (WO 01/72337), токсина А или В Clostridium difficile (WO 00/61761), белков, связывающих трансферрин, пневмококкового белка адгезии (PsaA), рекомбинантного экзотоксина A Pseudomonas aeruginosa (в частности, его нетоксичных мутантов (таких как экзотоксин А, несущий замену глутаминовой кислоты 553 (Douglas et al. (1987) J. Bacteriol. 169(11): 4967-4971)). В качестве белков-носителей также могут быть использованы другие белки, такие как овальбумин, гемоцианин фисуреллы (KLH), бычий сывороточный альбумин (BSA) или очищенное белковое производное туберкулина (PPD). Другие подходящие белки-носители включают инактивированные бактериальные токсины, такие как холерный анатоксин (например, как описано в WO 2004/083251), LT (термолабильный) Escherichia coli, ST (термостабильный) E. coli и экзотоксин А из P. aeruginosa.
В предпочтительном воплощении белок-носитель гликоконъюгатов независимо выбран из группы, состоящей из ТТ, DT, мутантов DT (таких как CRM197), белка D Н. influenzae, PhtX, PhtD, слияний PhtDE (в частности, слияний, описанных в WO 01/98334 и WO 03/054007), детоксифицированного пневмолизина, PorB, белка N19, PspA (пневмококковый поверхностный белок А), ОМРС, токсина А или В С. difficile и PsaA.
В одном воплощении белок-носитель гликоконъюгатов по изобретению представляет собой DT (дифтерийный анатоксин). В другом воплощении белок-носитель гликоконъюгатов по изобретению представляет собой ТТ (столбнячный анатоксин).
В другом воплощении белок-носитель гликоконъюгатов по изобретению представляет собой PD (белок D H. influenzae; см., например, ЕР 0594610 В).
Белок CRM197 представляет собой нетоксичную форму дифтерийного токсина, но иммунологически неотличим от дифтерийного токсина. CRM197 продуцирует Corynebacterium diphtheriae, инфицированная нетоксигенным фагом β197tox-, созданным посредством нитрозогуанидинового мутагенеза токсигенного коринефага бета (Uchida et al. (1971) Nature New Biology 233:8-11). Белок CRM197 имеет ту же самую молекулярную массу, что и дифтерийный токсин, но отличается от него заменой одного основания (гуанидина на аденин) в структурном гене. Эта замена одного основания вызывает аминокислотную замену (глутаминовой кслоты на глицин) в зрелом белке и устраняет токсические свойства дифтерийного токсина. Белок CRM197 является безопасным и эффективным зависимым от Т-клеток носителем для сахаридов. Дополнительные подробности относительно CRM197 и его получения можно найти, например, в патенте США №5614382. В одном воплощении капсульные сахариды по изобретению конъюгированы с белком CRM197 или цепью А CRM197 (см. CN 103495161). В одном воплощении капсульные сахариды по изобретению конъюгированы с цепью A CRM197, полученной посредством экспрессии генетически рекомбинантной Е. coli (см. CN 103495161). В одном воплощении все капсульные сахариды по изобретению конъюгированы с CRM197. В одном воплощении все капсульные сахариды по изобретению конъюгированы с цепью A CRM197.
Соответственно, в частых воплощениях гликоконъюгаты по изобретению содержат CRM197 в качестве белка-носителя, где капсульный полисахарид коалентно связан с CRM197.
1.2 Капсульный сахарид по изобретению
Термин «сахарид» во всем настоящем описании изобретения может указывать полисахарид или олигосахарид и включает обоих. В частых воплощениях сахарид представляет собой полисахарид, в частности капсульный полисахарид S. pneumoniae.
Капсульные полисахариды получают стандартными методиками, известными обычным специалистам в данной области.
В настоящем изобретении капсульные полисахариды можно получать, например, из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 15С, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F S. pneumoniae. Типично капсульные полисахариды продуцируют посредством выращивания каждого серотипа S. pneumoniae в среде (например, в среде на основе сои), затем данные полисахариды поучают из бактериальной культуры. Бактериальные штаммы S. pneumoniae, используемые для получения соответствующих полисахаридов, которые используются в гликоконъюгатах по изобретению, можно получать из установленных коллекций культур или клинических образцов.
Популяцию организма (каждого серотипа S. pneumoniae) часто масштабируют от посевного флакона до посевных бутылей и осуществляют пассажи через один или более чем один посевной ферментер увеличенного объема, пока не достигаются объемы ферментации производственного масштаба. В конце цикла роста клетки лизируют, и лизатный бульон затем собирают для последующей переработки (очистки) (см., например, WO 2006/110381, WO 2008/118752 и публикации заявок на патент США №2006/0228380, 2006/0228381, 2008/0102498 и 2008/0286838).
Индивидуальные полисахариды типично очищают посредством центрифугирования, осаждения, ультрафильтрации и/или колоночной хроматографии (см., например, WO 2006/110352 и WO 2008/118752).
Очищенные полисахариды могут быть активированы (например, химически активированы) для того, чтобы сделать их способными реагировать (например, либо непосредственно с белком-носителем, либо через линкер, такой как спейсер еТЕС ((2-((2-оксоэтил)тио)этил)карбаматный)) и затем включены в гликоконъюгаты по изобретению, как здесь описано далее.
Капсульные полисахариды S. pneumoniae содержат повторяющиеся олигосахаридные элементы, которые могут содержать вплоть до 8 остатков сахаров.
В одном воплощении капсульным сахаридом по изобретению может быть один олигосахаридный элемент или сахаридная цепь из повторяющихся олигосахаридных элементов, имеющая длину короче, чем нативная. В одном воплощении капсульный сахарид по изобретению представляет собой один повторяющийся олигосахаридный элемент релевантного серотипа.
В одном воплощении капсульный сахарид по изобретению может представлять собой олигосахариды. Олигосахариды имеют малое число повторяющихся звеньев (типично 5-15 повторяющихся звеньев) и их типично получают синтетически или посредством гидролиза полисахаридов.
Хотя предпочтительно, чтобы все капсульные сахариды по настоящему изобретению и в иммуногенных композициях по настоящему изобретению представляли собой полисахариды. Капсульные полисахариды с высокой молекулярной массой способны индуцировать иммунные ответы определенных антител из-за эпитопов, присутствующих на антигенной поверхности. Выделение и очистка капсульных полисахаридов с высокой молекулярной массой предпочтительно рассматриваются для применения в конъюгатах, композициях и способах по настоящему изобретению.
В некоторых воплощениях очищенные полисахариды до конъюгирования имеют молекулярную массу от 5 кДа до 4000 кДа. В других таких воплощениях полисахарид имеет молекулярную массу от 10 кДа до 4000 кДа, от 50 кДа до 4000 кДа, от 50 кДа до 3000 кДа, от 50 кДа до 2000 кДа, от 50 кДа до 1500 кДа, от 50 кДа до 1000 кДа, от 50 кДа до 750 кДа, от 50 кДа до 500 кДа, от 100 кДа до 4000 кДа, от 100 кДа до 3000 кДа, от 100 кДа до 2000 кДа, от 100 кДа до 1500 кДа, от 100 кДа до 1000 кДа, от 100 кДа до 750 кДа, от 100 кДа до 500 кДа, от 100 кДа до 400 кДа, от 200 кДа до 4000 кДа, от 200 кДа до 3000 кДа, от 200 кДа до 2000 кДа, от 200 кДа до 1500 кДа, от 200 кДа до 1000 кДа или от 200 кДа до 500 кДа.
В других воплощениях капсульный полисахарид имеет молекулярную массу от 70 кДа до 150 кДа, от 80 кДа до 160 кДа, от 90 кДа до 250 кДа, от 100 кДа до 1000, от 100 кДа до 500 кДа, от 100 кДа до 400 кДа, от 100 кДа до 160 кДа, от 150 кДа до 600 кДа, от 200 кДа до 1000 кДа, от 200 кДа до 600 кДа, от 200 кДа до 400 кДа, от 300 кДа до 1000 кДа, от 300 кДа до 600 кДа, от 300 кДа до 500 кДа или от 500 кДа до 600 кДа. Любое целое число в пределах любого из приведенных выше интервалов рассматривается в качестве воплощения данного раскрытия.
Полисахарид может становиться слегка уменьшенным в размере на протяжении нормальных процедур очистки. Дополнительно, как здесь описано, полисахарид может быть подвергнут методикам изменения размера до конъюгирования. Может быть использовано механическое или химическое изменение размера. Химический гидролиз можно проводить с использованием уксусной кислоты. Механическое изменение размера можно проводить с использованием гомогенизации со срезанием под высоким давлением. Интервалы молекулярной массы, упомянутые выше, относятся к очищенным полисахаридам до конъюгирования (например, до активации).
В предпочтительном воплощении очищенные полисахариды представляют собой капсульные полисахариды из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 15С, 17F, 18С, 19А, 19F, 20, 22F, 23F или 33F S. pneumoniae, где капсульный полисахарид имеет молекулярную массу, попадающую в один из интервалов молекулярной массы, как описано здесь выше.
Термин «молекулярная масса» полисахарида или конъюгата белок-носитель-полисахарид в том виде, в котором он здесь используется, относится к молекулярной массе, рассчитанной посредством гель-фильтрации (SEC) в комбинации с многоугловым детектором рассеяния лазерного света (MALLS).
В некоторых воплощениях пневмококковые сахариды из серотипов 9V, 18С, 11А, 15В, 22F и/или 33F по изобретению являются О-ацетилированными. В некоторых воплощениях пневмококковые сахариды из серотипов 9V, 11А, 15В, 22F и/или 33F по изобретению являются О-ацетилированными.
Степень О-ацетилирования полисахарида может быть определена любым способом, известным в данной области, например, протонным NMR (ядерный магнитный резонанс) (см., например, Lemercinier et al. (1996) Carbohydrate Research 296: 83-96, Jones et al. (2002) J. Pharmaceutical and Biomedical Analysis 30: 1233-1247, WO 2005/033148 и WO 00/56357). Другой общеиспользуемый способ описан в Hestrin (1949) J. Biol. Chem. 180: 249-261. Предпочтительно присутствие О-ацетильных групп определяют посредством анализа ион-HPLC (высокоэффективная жидкостная хроматография).
Описанные здесь очищенные полисахариды химически активируют для получения сахаридов, способных реагировать с белком-носителем. Данные пневмококковые конъюгаты получают отдельными способами и готовят в виде композиции в форме однократной дозы, как описано ниже.
1.3 Гликоконъюгаты по изобретению
Очищенные сахариды химически активируют для получения сахаридов (то есть активированных сахаридов), способных реагировать с белком-носителем либо непосредственно, либо через линкер. Сразу после активации каждый капсульный сахарид по отдельности конъюгируют с белком-носителем с образованием гликоконъюгата. В одном воплощении каждый капсульный сахарид конъюгируют с тем же самым белком-носителем. Химическая активация сахаридов и последующее конъюгирование с белком-носителем могут быть достигнуты посредством раскрытых здесь способов активации и конъюгирования.
Капсульные полисахариды из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 15С, 17F, 18С, 19А, 19F, 20, 22F, 23F и/или 33F S. pneumoniae получают, как раскрыто выше.
В одном воплощении полисахариды активируют 1-циано-4-диметиламинопиридиния тетрафторборатом (CDAP) с образованием цианатного сложного эфира. Активированный полисахарид затем связывается непосредственно или через спейсерную (линкерную) группу с аминогруппой на белке-носителе (предпочтительно CRM197). Например, спейсер мог бы быть цистамином или цистеамином с образованием тиолированного полисахарида, который мог бы быть связан с носителем через тиоэфирную связь, полученную после реакции с белком-носителем, активированным малеимидом (например, с использованием сложного N-[γ-малеимидобутирлокси]сукцинимидилового эфира (GMBS)) или галогенацетилированного белка-носителя (например, с использованием йодацетимида, N-сукцинимидилбромацетата (SBA; SIB), N-сукцинимидил(4-йодацетил)аминобензоата (SIAB), сульфосукцинимидил(4-йодацетил)аминобензоата (сульфо-SIAB), N-сукцинимидилйодацетата (SIA) или сукцинимидил 3-[бромацетамидо]пропионата (SBAP)). Предпочтительно цианатный сложный эфир (возможно полученный посредством химии CDAP) связывается с гександиамином или дигидразидом адипиновой кислоты (ADH), и сахарид, дериватизированный амином, конъюгируется с белком-носителем (например, с CRM197) с использованием карбодиимидной химии (например, EDAC (N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид) или EDC (N-(3-диметиламинопропил)-N'-этилкарбодиимид)) через карбоксильную группу на белке-носителе. Такие конъюгаты описаны, например, в WO 93/15760, WO 95/08348 и WO 96/129094.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 15С, 17F, 18С, 19А, 19F, 20, 22F, 23F и/или 33F получают с использованием химии CDAP. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F и 23F получают с использованием химии CDAP. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6А, 6В, 7F, 8, 9V, 14, 18С, 19F и 23F получают с использованием химии CDAP. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19А, 19F и 23F получают с использованием химии CDAP. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6А, 6В, 7F, 8, 9V, 14, 18С, 19А, 19F и 23F получают с использованием химии CDAP. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 14, 18С, 19А, 19F и 23F получают с использованием химии CDAP.
В других подходящих методиках для конъюгирования используют карбодиимиды, гидразиды, активные сложные эфиры, норборан, п-нитробензойная кислота, N-гидроксисукцинимид, S-NHS (сульфо-N-47гидроксисульфосукцинимид), EDC (1-этил-3-[3-диметиламинопропил]карбодиимид), TSTU (N,N,N',N'-тетраметил-O-(N-сукцинимидил)урония тетрафторборат). Многие описаны в публикации международной патентной заявки № WO 98/42721. В конъюгирование может быть вовлечен карбонильный линкер, который может быть образован посредством реакции свободной гидроксильной группы сахарида с CDI (1,1'-карбонилдиимидазол) (см. Bethell et al. (1979) 1. Biol. Chern. 254: 2572-2574; Hearn et al. (1981) J. Chromatogr. 218: 509-518), с последующей реакцией с белком с образованием карбаматной связи. В это могут быть вовлечены восстановление аномерного конца до первичной гидроксильной группы, возможная защита/снятие защиты первичной гидроксильной группы, реакция первичной гидроксильной группы с CDI с образованием карбаматного промежуточного соединения CDI и связывание карбаматного промежуточного соединения CDI с аминогруппой на белке.
В предпочтительном воплощении по меньшей мере один капсульный полисахарид из серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 15С, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F S. pneumoniae конъюгируют с белком-носителем посредством восстановительного аминирования (как, например, описано в публикациях заявок на патент США №2006/0228380, 2007/184072, 2007/0231340 и 2007/0184071, WO 2006/110381, WO 2008/079653 и WO 2008/143709).
В одном воплощении настоящего изобретения гликоконъюгат из S. pneumoniae серотипа 6А получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгат из S. pneumoniae серотипа 19А получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгат из S. pneumoniae серотипа 3 получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 6А и 19А получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 3, 6А и 19А получают посредством восстановительного аминирования.
В предпочтительном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 4, 6В, 9V, 14, 18С, 19F и 23F получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 6В, 9V, 14, 18С, 19F и 23F получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 9V, 14, 18С, 19F и 23F получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 9V, 14, 18С, 19F и 23F получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19F и 23F получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F получают посредством восстановительного аминирования. В одном воплощении настоящего изобретения все гликоконъюгаты из S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F получают посредством восстановительного аминирования.
В другом предпочтительном воплощении все гликоконъюгаты из S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F, 22F и 23F получают посредством восстановительного аминирования.
В другом предпочтительном воплощении все гликоконъюгаты из S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 15В, 18С, 19А, 19F, 22F и 23F получают посредством восстановительного аминирования.
В другом предпочтительном воплощении все гликоконъюгаты из S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11A, 12F, 14, 15В, 18С, 19А, 19F, 22F и 23F получают посредством восстановительного аминирования.
В другом предпочтительном воплощении все гликоконъюгаты из S. pneumoniae серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F получают посредством восстановительного аминирования.
В другом предпочтительном воплощении все гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 12F, 14, 15С, 18С, 19А, 19F, 22F, 23F и 33F получают посредством восстановительного аминирования.
В другом предпочтительном воплощении все гликоконъюгаты из S. pneumoniae серотипов 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 15С, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F получают посредством восстановительного аминирования.
Восстановительное аминирование включает две стадии: (1) окисление полисахарида, (2) восстановление активированного полисахарида и белка-носителя с образованием конъюгата. Перед окислением полисахарид возможно гидролизуется. Можно использовать механический или химический гидролиз. Химический гидролиз можно проводить с использованием уксусной кислоты. Стадия окисления может включать реакцию с перйодатом. Для задачи настоящего изобретения термин «перйодат» включает как перйодат, так и йодную кислоту; данный термин также включает как метаперйодат (IO4-), так и ортоперйодат (IO65-), и включает разные соли перйодата (например, перйодат натрия и перйодат калия). В одном воплощении капсульный полисахарид окисляется в присутствии метаперйодата, предпочтительно в присутствии перйодата натрия (NaIO4). В другом воплощении капсульный полисахарид окисляется в присутствии ортоперйодата, предпочтительно в присутствии перйодной кислоты.
В одном воплощении окисляющий агент является стабильным нитроксильным или нитроксидным радикальным соединением, таким как пиперидин-N-окси или пирролидин-N-окси соединения, в присутствии окислителя для селективного окисления первичных гидроксилов (как описано в WO 2014/097099). В указанной реакции реальный окислитель в каталитическом цикле представляет собой соль N-оксоаммония. В одном аспекте указанное стабильное нитроксильное или нитроксидное радикальное соединение представляет собой пиперидин-N-окси или пирролидин-N- окси соединения. В одном аспекте указанное стабильное нитроксильное или нитроксидное радикальное соединение содержит группировку TEMPO (2,2,6,6-тетраметил-1-пиперидинилокси) или PROXYL (2,2,5,5-тетраметил-1-пирролидинилокси). В одном аспекте указанное стабильное нитроксильное радикальное соединение представляет собой TEMPO или его производное. В одном аспекте указанный окислитель представляет собой молекулу, имеющую группировку N-галогено. В одном аспекте указанный окислитель выбран из группы, состоящей из N-хлорсукцинимида, N-бромсукцинимида, N-йодсукцинимида, дихлоризоциануровой кислоты, 1,3,5-трихлор-1,3,5-триазинан-2,4,6-триона, дибромизоциануровой кислоты, 1,3,5-трибром-1,3,5-триазинан-2,4,6-триона, дийодизоциануровой кислоты и 1,3,5-трийод-1,3,5-триазинан-2,4,6-триона. Предпочтительно указанный окислитель представляет собой N-хлорсукцинимид.
В предпочтительном воплощении капсульные полисахариды из серотипов 12F S. pneumoniae конъюгируют с белком-носителем посредством восстановительного аминирования, где окисляющий агент представляет собой свободный радикал 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO), и N-хлорсукцинимид (NCS) служит в качестве соокислителя (как описано в WO 2014/097099). Следовательно, в одном аспекте гликоконъюгаты из S. pneumoniae серотипа 12F могут быть получены способом, включающим стадии: (а) осуществления взаимодействия сахарида 12F с 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO) и N-хлорсукцинимидом (NCS) в водном растворителе с получением активированного сахарида; и (б) осуществления взаимодействия активированного сахарида с белком-носителем, содержащим одну или более чем одну аминогруппу (указанный способ далее обозначается «TEMPO/NCS-восстановительное аминирование»).
Возможно реакцию окисления гасят посредством добавления гасящего агента. Гасящий агент может быть выбран из вицинальных диолов, 1,2-аминоспиртов, аминокислот, глутатиона, сульфита, бисульфата, дитионита, метабисульфита, тиосульфата, фосфитов, гипофосфитов или фосфорной кислоты (таких как глицерин, этиленгликоль, пропан-1,2-диол, бутан-1,2-диол или бутан-2,3-диол, аскорбиновая кислота).
После стадии окисления полисахарида говорят, что полисахарид является активированным, и он здесь ниже называется «активированный полисахарид». Активированный полисахарид и белок-носитель могут быть лиофилизированы (подвергнуты сублимационной сушке) либо независимо (дискретная лиофилизация), либо совместно (солиофилизация). В одном воплощении активированный полисахарид и белок-носитель солиофилизируют. В другом воплощении активированный полисахарид и белок-носитель лиофилизируют независимо.
В одном воплощении лиофилизация происходит в присутствии невосстанавливающего сахара, возможно невосстанавливающие сахара включают сахарозу, трегалозу, рафинозу, стахиозу, мелецитозу, декстран, маннит, лактит и палатинит.
Второй стадией способа конъюгирования является восстановление активированного полисахарида и белка-носителя с образованием конъюгата (так называемое восстановительное аминирование) с использованием восстанавливающего агента. Восстановители, которые являются подходящими, включают цианоборгидриды (такие как цианоборгидрид натрия, триацетоксиборгидрид натрия или боргидрид натрия или цинка в присутствии кислот Бренстеда или Льюиса), аминобораны, такие как пиридинборан, 2-пиколинборан, 2,6-диборанметанол, диметиламин-боран, t-BuMeiPrN-BH3, бензиламин-ВН3 или 5-этил-2-метилпиридинборан (РЕМВ) или боргидридную обменную смолу. В одном воплощении восстанавливающий агент представляет собой цианоборгидрид натрия.
В одном воплощении реакцию восстановления проводят в водном растворителе (например, выбранном из PBS (забуференный фосфатом физиологический раствор), MES (2-морфолиноэтансульфоновая кислота), HEPES (2-[4-(2-гидроксиэтил)пиперазин-1-ил]-этансульфоновая кислота), Bis-tris, ADA (N-(2-ацетамидо)иминодиуксусная кислота), PIPES (1,4-пиперазиндиэтансульфоновая кислота), MOPSO (3-морфолино-2-гидроксипропансульфоновая кислота), BES (N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота), MOPS (3-(N-морфолино)пропансульфоновая кислота), DIPSO (3-(N,N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновая кислота), MOBS (4-(N-морфолино)бутансульфоновая кислота), HEPPSO (4-(2-гидроксиэтил)пиперазин-1-(2-гидроксипропансульфоновая кислота)), POPSO (пиперазин-N,N'-бис(2-гидроксипропансульфоновая кислота)), TEA (триэтиламин), EPPS (4-(2-гидроксиэтил)-1-пиперазинпропансульфоновая кислота), бицина или НЕРВ (N-(2-гидроксиэтил)пиперазин-N'-(4-бутансульфоновая кислота)), с рН от 6,0 до 8,5, от 7,0 до 8,0 или от 7,0 до 7,5), в другом воплощении реакцию проводят в апротонном растворителе. В одном воплощении реакцию восстановления проводят в растворителе DMSO (диметилсульфоксид) или DMF (диметилформамид). Растворитель DMSO или DMF можно использовать для разведения активированного полисахарида и белка-носителя, который был лиофилизирован.
В конце реакции восстановления могут быть непрореагировавшие альдегидные группы, остающиеся в конъюгатах, они могут подвергаться кэпированию с использованием подходящего кэпирующего агента. В одном воплощении данный кэпирующий агент представляет собой боргидрид натрия (NaBH4). После конъюгирования (реакция восстановления и возможно кэпирование) гликоконъюгаты могут быть очищены (обогащены в отношении количества конъюгата полисахарид-белок) рядом методик, известных специалисту. Данные методики включают диализ, операции концентрирования/диафильтрации, осаждение при фильтрации тангенциальным потоком/элюирование, колоночную хроматографию (хроматография на DEAE (диэтиламиноэтил) или на основе гидрофобных взаимодействий) и глубинное фильтрование. В одном воплощении гликоконъюгаты очищают посредством диафильтрации либо ионообменной хроматографии или гель-фильтрации.
В одном воплощении гликоконъюгаты подвергают стерилизующему фильтрованию.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F и 23F получают с использованием химии CDAP и гликоконъюгат из S. pneumoniae серотипа 6А получают посредством восстановительного аминирования.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F и 23F получают с использованием химии CDAP и гликоконъюгат из S. pneumoniae серотипа 19А получают посредством восстановительного аминирования.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F и 23F получают с использованием химии CDAP и гликоконъюгаты из S. pneumoniae серотипа 6А и 19А получают посредством восстановительного аминирования.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F и 23F получают с использованием химии CDAP и гликоконъюгаты из S. pneumoniae серотипа 3, 6А и 19А получают посредством восстановительного аминирования.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F, 22F и 23F получают с использованием химии CDAP и гликоконъюгат из S. pneumoniae серотипа 6А получают посредством восстановительного аминирования.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F, 22F и 23F получают с использованием химии CDAP и гликоконъюгат из S. pneumoniae серотипа 19А получают посредством восстановительного аминирования.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F, 22F и 23F получают с использованием химии CDAP и гликоконъюгаты из S. pneumoniae серотипа 6А и 19А получают посредством восстановительного аминирования.
В одном воплощении настоящего изобретения гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 8, 9V, 14, 18С, 19F, 22F и 23F получают с использованием химии CDAP и гликоконъюгаты из S. pneumoniae серотипа 3, 6А и 19А получают посредством восстановительного аминирования.
В одном воплощении гликоконъюгаты по изобретению получают с использованием конъюгирования с еТЕС (2-((2-оксоэтил)тио)этил)карбамат), как, например, описано в WO 2014/027302. Указанные гликоконъюгаты содержат сахарид, ковалентно конъюгированный с белком-носителем через один или более чем один спейсер еТЕС, где сахарид ковалентно конъюгируется со спейсером еТЕС через карбаматную связь, и где белок-носитель ковалентно конъюгируется со спейсером еТЕС через амидную связь. Связанные с еТЕС гликоконъюгаты по изобретению могут быть представлены общей формулой (I):
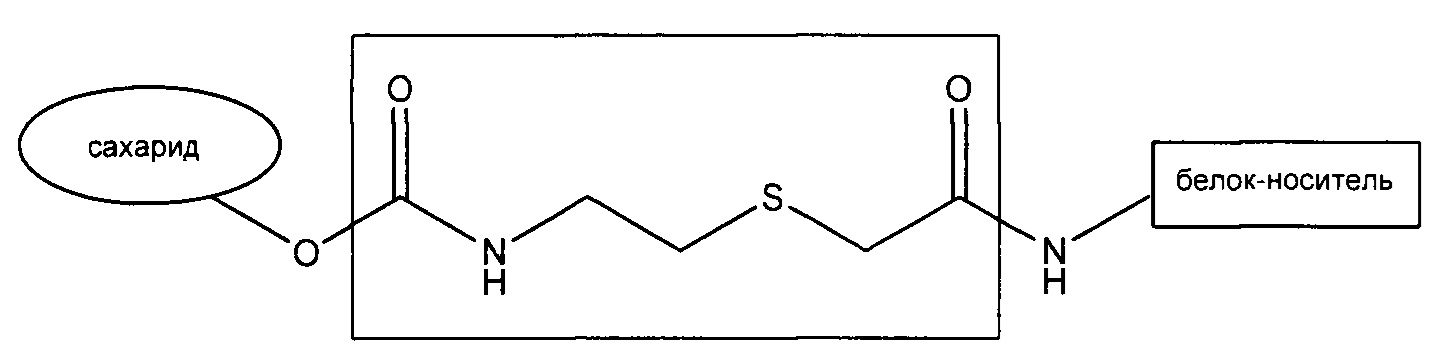
где атомы, которые содержат спейсер еТЕС, содержатся в центральном прямоугольнике. Спейсер еТЕС включает семь линейных атомов (то есть -C(O)NH(CH2)2SCH2C(O)-) и дает стабильные тиоэфирные и амидные связи между сахаридом и белком-носителем. Синтез гликоконъюгата, связанного еТЕС, включает реакцию активированной гидроксильной группы сахарида с аминогруппой тиоалкиламинного реактива, например цистамина или цистеинамина или его соли, образуя карбаматную связь с сахаридом с получением тиолированного сахарида. Получение одной или более чем одной свободной сульфгидрильной группы осуществляется посредством реакции с восстанавливающим агентом с получением активированного тиолированного сахарида. Реакция свободных сульфгидрильных групп активированного тиолированного сахарида с активированным белком-носителем, имеющим одну или более чем одну α-галогенацетамидную группу на аминосодержащих остатках, генерирует тиоэфирную связь с образованием конъюгата, где белок-носитель присоединяется к спейсеру еТЕС через амидную связь.
В указанных гликоконъюгатах по изобретению сахарид может представлять собой полисахарид или олигосахарид. Белок-носитель может быть выбран из любого подходящего носителя, как описано здесь или известно специалистам в данной области. В частых воплощениях сахарид представляет собой полисахарид. В некоторых таких воплощениях белок-носитель представляет собой CRM197. В некоторых таких воплощениях гликоконъюгат, связанный еТЕС, содержит капсульный полисахарид S. pneumoniae серотипа 33F.
В особенно предпочтительных воплощениях гликоконъюгат, связанный еТЕС, содержит капсульный полисахарид пневмококкового серотипа 33F (Pn33F), который ковалентно конъюгирован с CRM197 через спейсер еТЕС (гликоконъюгаты серотипа 33F, связанные посредством еТЕС).
В некоторых воплощениях гликоконъюгат из S. pneumoniae серотипов 1, 7F, 9V и/или 18С по изобретению является О-ацетилированным. В некоторых воплощениях гликоконъюгат из S. pneumoniae серотипов 1, 7F и 9V является О-ацетилированным, и гликоконъюгат из S. pneumoniae серотипа 18С является де-О-ацетилированным.
В некоторых воплощениях гликоконъюгат из S. pneumoniae серотипа 1 содержит сахарид, который имеет степень О-ацетилирования от 10 до 100%, от 20 до 100%, от 30 до 100%, от 40 до 100%, от 50 до 100%, от 60 до 100%, от 70 до 100%, от 75 до 100%, от 80 до 100%, от 90 до 100%, от 50 до 90%, от 60 до 90%, от 70 до 90% или от 80 до 90%. В других воплощениях степень О-ацетилирования больше или равна 10%, больше или равна 20%, больше или равна 30%, больше или равна 40%, больше или равна 50%, больше или равна 60%, больше или равна 70%, больше или равна 80%, больше или равна 90% или составляет примерно 100%.
В некоторых воплощениях гликоконъюгат из S. pneumoniae серотипа 7F содержит сахарид, который имеет степень О-ацетилирования от 10 до 100%, от 20 до 100%, от 30 до 100%, от 40 до 100%, от 50 до 100%, от 60 до 100%, от 70 до 100%, от 75 до 100%, от 80 до 100%, от 90 до 100%, от 50 до 90%, от 60 до 90%, от 70 до 90% или от 80 до 90%. В других воплощениях степень О-ацетилирования больше или равна 10%, больше или равна 20%, больше или равна 30%, больше или равна 40%, больше или равна 50%, больше или равна 60%, больше или равна 70%, больше или равна 80%, больше или равна 90% или составляет примерно 100%.
В некоторых воплощениях гликоконъюгат из S. pneumoniae серотипа 9V содержит сахарид, который имеет степень О-ацетилирования от 10 до 100%, от 20 до 100%, от 30 до 100%, от 40 до 100%, от 50 до 100%, от 60 до 100%, от 70 до 100%, от 75 до 100%, от 80 до 100%, от 90 до 100%, от 50 до 90%, от 60 до 90%, от 70 до 90% или от 80 до 90%. В других воплощениях степень О-ацетилирования больше или равна 10%, больше или равна 20%, больше или равна 30%, больше или равна 40%, больше или равна 50%, больше или равна 60%, больше или равна 70%, больше или равна 80%, больше или равна 90% или составляет примерно 100%.
В некоторых воплощениях гликоконъюгат из S. pneumoniae серотипа 18С содержит сахарид, который имеет степень О-ацетилирования от 10 до 100%, от 20 до 100%, от 30 до 100%, от 40 до 100%, от 50 до 100%, от 60 до 100%, от 70 до 100%, от 75 до 100%, от 80 до 100%, от 90 до 100%, от 50 до 90%, от 60 до 90%, от 70 до 90% или от 80 до 90%. В других воплощениях степень О-ацетилирования больше или равна 10%, больше или равна 20%, больше или равна 30%, больше или равна 40%, больше или равна 50%, больше или равна 60%, больше или равна 70%, больше или равна 80%, больше или равна 90% или составляет примерно 100%. Хотя предпочтительным является то, что гликоконъюгат из S. pneumoniae серотипа 18С является де-О-ацетилированным. В некоторых указанных воплощениях гликоконъюгат из S. pneumoniae серотипа 18С содержит сахарид, который имеет степень О-ацетилирования от 0 до 50%, от 0 до 40%, от 0 до 30%, от 0 до 20%, от 0 до 10%, от 0 до 5% или от 0 до 2%. В других воплощениях степень О-ацетилирования меньше или равна 50%, меньше или равна 40%, меньше или равна 30%, меньше или равна 20%, меньше или равна 10%, меньше или равна 5%, меньше или равна 2%, или меньше или равна 1%.
Под % О-ацетилирования подразумевается процентная доля данного сахарида относительно 100% (где каждое повторяющееся звено является полностью ацетилированным по отношению к его ацетилированной структуре).
В некоторых воплощениях гликоконъюгаты по настоящему изобретению содержат сахарид, имеющий молекулярную массу от 10 кДа до 2000 кДа. В других таких воплощениях сахарид имеет молекулярную массу от 50 кДа до 1000 кДа. В других таких воплощениях сахарид имеет молекулярную массу от 70 кДа до 900 кДа. В других таких воплощениях сахарид имеет молекулярную массу от 100 кДа до 800 кДа. В других таких воплощениях сахарид имеет молекулярную массу от 200 кДа до 600 кДа. В других таких воплощениях сахарид имеет молекулярную массу от 100 кДа до 1000 кДа; от 100 кДа до 900 кДа; от 100 кДа до 800 кДа; от 100 кДа до 700 кДа; от 100 кДа до 600 кДа; от 100 кДа до 500 кДа; от 100 кДа до 400 кДа; от 100 кДа до 300 кДа; от 150 кДа до 1000 кДа; от 150 кДа до 900 кДа; от 150 кДа до 800 кДа; от 150 кДа до 700 кДа; от 150 кДа до 600 кДа; от 150 кДа до 500 кДа; от 150 кДа до 400 кДа; от 150 кДа до 300 кДа; от 200 кДа до 1000 кДа; от 200 кДа до 900 кДа; от 200 кДа до 800 кДа; от 200 кДа до 700 кДа; от 200 кДа до 600 кДа; от 200 кДа до 500 кДа; от 200 кДа до 400 кДа; от 200 кДа до 300 кДа; от 250 кДа до 1000 кДа; от 250 кДа до 900 кДа; от 250 кДа до 800 кДа; от 250 кДа до 700 кДа; от 250 кДа до 600 кДа; от 250 кДа до 500 кДа; от 250 кДа до 400 кДа; от 250 кДа до 350 кДа; от 300 кДа до 1000 кДа; от 300 кДа до 900 кДа; от 300 кДа до 800 кДа; от 300 кДа до 700 кДа; от 300 кДа до 600 кДа; от 300 кДа до 500 кДа; от 300 кДа до 400 кДа; от 400 кДа до 1000 кДа; от 400 кДа до 900 кДа; от 400 кДа до 800 кДа; от 400 кДа до 700 кДа; от 400 кДа до 600 кДа; от 500 кДа до 600 кДа. Любое целое число в пределах любого из приведенных выше интервалов рассматривается в качестве воплощения данного описания. В некоторых таких воплощениях гликоконъюгат получают с использованием восстановительного аминирования.
В некоторых воплощениях гликоконъюгат по изобретению имеет молекулярную массу от 400 кДа до 15000 кДа; от 500 кДа до 10000 кДа; от 2000 кДа до 10000 кДа; от 3000 кДа до 8000 кДа или от 3000 кДа до 5000 кДа. В других воплощениях гликоконъюгат имеет молекулярную массу от 500 кДа до 10000 кДа. В других воплощениях гликоконъюгат имеет молекулярную массу от 1000 кДа до 8000 кДа. В других воплощениях гликоконъюгат имеет молекулярную массу от 2000 кДа до 8000 кДа или от 3000 кДа до 7000 кДа. В других воплощениях гликоконъюгат по изобретению имеет молекулярную массу от 200 кДа до 20000 кДа; от 200 кДа до 15000 кДа; от 200 кДа до 10000 кДа; от 200 кДа до 7500 кДа; от 200 кДа до 5000 кДа; от 200 кДа до 3000 кДа; от 200 кДа до 1000 кДа; от 500 кДа до 20000 кДа; от 500 кДа до 15000 кДа; от 500 кДа до 12500 кДа; от 500 кДа до 10000 кДа; от 500 кДа до 7500 кДа; от 500 кДа до 6000 кДа; от 500 кДа до 5000 кДа; от 500 кДа до 4000 кДа; от 500 кДа до 3000 кДа; от 500 кДа до 2000 кДа; от 500 кДа до 1500 кДа; от 500 кДа до 1000 кДа; от 750 кДа до 20000 кДа; от 750 кДа до 15000 кДа; от 750 кДа до 12500 кДа; от 750 кДа до 10000 кДа; от 750 кДа до 7500 кДа; от 750 кДа до 6000 кДа; от 750 кДа до 5000 кДа; от 750 кДа до 4000 кДа; от 750 кДа до 3000 кДа; от 750 кДа до 2000 кДа; от 750 кДа до 1500 кДа; от 1000 кДа до 15000 кДа; от 1000 кДа до 12500 кДа; от 1000 кДа до 10000 кДа; от 1000 кДа до 7500 кДа; от 1000 кДа до 6000 кДа; от 1000 кДа до 5000 кДа; от 1000 кДа до 4000 кДа; от 1000 кДа до 2500 кДа; от 2000 кДа до 15000 кДа; от 2000 кДа до 12500 кДа; от 2000 кДа до 10000 кДа; от 2000 кДа до 7500 кДа; от 2000 кДа до 6000 кДа; от 2000 кДа до 5000 кДа; от 2000 кДа до 4000 кДа или от 2000 кДа до 3000 кДа.
В других воплощениях гликоконъюгат по изобретению имеет молекулярную массу от 3000 кДа до 20000 кДа; от 3000 кДа до 15000 кДа; от 3000 кДа до 10000 кДа; от 3000 кДа до 7500 кДа; от 3000 кДа до 5000 кДа; от 4000 кДа до 20000 кДа; от 4000 кДа до 15000 кДа; от 4000 кДа до 12500 кДа; от 4000 кДа до 10000 кДа; от 4000 кДа до 7500 кДа; от 4000 кДа до 6000 кДа или от 4000 кДа до 5000 кДа.
В других воплощениях гликоконъюгат по изобретению имеет молекулярную массу от 5000 кДа до 20000 кДа; от 5000 кДа до 15000 кДа; от 5000 кДа до 10000 кДа; от 5000 кДа до 7500 кДа; от 6000 кДа до 20000 кДа; от 6000 кДа до 15000 кДа; от 6000 кДа до 12500 кДа; от 6000 кДа до 10000 кДа или от 6000 кДа до 7500 кДа.
Молекулярную массу гликоконъюгата измеряют посредством SEC-MALLS (гель-фильтрация с многоугловым детектором рассеяния лазерного света). Любое целое число в пределах любого из приведенных выше интервалов рассматривается как воплощение данного описания.
В предпочтительном воплощении гликоконъюгат серотипа 22F по изобретению содержит по меньшей мере 0,1; 0,2; 0,3; 0,4; 0,5; 0,6 или 0,7; или примерно 0,8 мМ ацетат на мМ полисахарид серотипа 22F. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,5; 0,6 или 0,7 мМ ацетат на мМ полисахарид серотипа 22F. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,6 мМ ацетат на мМ полисахарид серотипа 22F. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,7 мМ ацетат на мМ полисахарид серотипа 22F.
В предпочтительном воплощении гликоконъюгат серотипа 33F по изобретению содержит по меньшей мере 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; или 0,8 мМ ацетат на мМ капсульный полисахарид серотипа 33F. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,5; 0,6 или 0,7 мМ ацетат на мМ капсульный полисахарид серотипа 33F. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,6 мМ ацетат на мМ капсульный полисахарид серотипа 33F. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,7 мМ ацетат на мМ капсульный полисахарид серотипа 33F. В предпочтительном воплощении присутствие О-ацетильных групп определяют посредством анализа ион-HPLC.
В предпочтительном воплощении гликоконъюгат серотипа 15В по изобретению содержит по меньшей мере 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; или 0,8 мМ ацетат на мМ капсульный полисахарид серотипа 15В. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,5; 0,6 или 0,7 мМ ацетат на мМ капсульный полисахарид серотипа 15В. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,6 мМ ацетат на мМ капсульный полисахарид серотипа 15В. В предпочтительном воплощении гликоконъюгат содержит по меньшей мере 0,7 мМ ацетат на мМ капсульный полисахарид серотипа 15В. В предпочтительном воплощении присутствие О-ацетильных групп определяют посредством анализа ион-HPLC.
В предпочтительном воплощении гликоконъюгат серотипа 15В по изобретению содержит по меньшей мере 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; или 0,8 мМ глицерин на мМ капсульный полисахарид серотипа 15В. В предпочтительном воплощении гликоконъюгат серотипа 15В по изобретению содержит по меньшей мере 0,5; 0,6 или 0,7 мМ глицерин на мМ капсульный полисахарид серотипа 15В. В предпочтительном воплощении гликоконъюгат серотипа 15В по изобретению содержит по меньшей мере 0,6 мМ глицерин на мМ капсульный полисахарид серотипа 15В. В предпочтительном воплощении гликоконъюгат серотипа 15В по изобретению содержит по меньшей мере 0,7 мМ глицерин на мМ капсульный полисахарид серотипа 15В.
В предпочтительном воплощении гликоконъюгат серотипа 11А по изобретению содержит по меньшей мере 0,3; 0,5; 0,6; 1,0; 1,4; 1,8; 2,2; 2,6; 3,0; 3,4; 3,8; 4,2; 4,6 или примерно 5,0 мМ ацетат на мМ полисахарид серотипа 11А. В предпочтительном воплощении гликоконъюгат серотипа 11А содержит по меньшей мере 1,8; 2,2 или 2,6 мМ ацетат на мМ полисахарид серотипа 11А. В одном воплощении гликоконъюгат содержит по меньшей мере 0,6 мМ ацетат на мМ полисахарид серотипа 11А. В предпочтительном воплощении гликоконъюгат серотипа 11А по изобретению содержит по меньшей мере 0,6; 1,0; 1,4; 1,8; 2,2; 2,6; 3,0; 3,4; 3,8; 4,2 или примерно 4,6 мМ ацетат на мМ полисахарид серотипа 11А и меньше чем примерно 5,0 мМ ацетат на мМ полисахарид серотипа 11А. В одном воплощении гликоконъюгат серотипа 11А по изобретению содержит по меньшей мере 0,6; 1,0; 1,4; 1,8; 2,2; 2,6 или примерно 3,0 мМ ацетат на мМ полисахарид серотипа 11А и меньше чем примерно 3,4 мМ ацетат на мМ полисахарид серотипа 11А. В одном воплощении гликоконъюгат серотипа 11А по изобретению содержит по меньшей мере 0,6; 1,0; 1,4; 1,8; 2,2; 2,6 или примерно 3,0 мМ ацетат на мМ полисахарид серотипа 11А и меньше чем примерно 3,3 мМ ацетат на мМ полисахарид серотипа 11А. Любое приведенное выше число рассматривается как воплощение данного описания.
В предпочтительном воплощении гликоконъюгат серотипа 11А по изобретению содержит по меньшей мере 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 или примерно 1,0 мМ глицерин на мМ полисахарид серотипа 11А. В предпочтительном воплощении гликоконъюгат серотипа 11А содержит по меньшей мере 0,2; 0,3 или 0,4 мМ глицерин на мМ полисахарид серотипа 11А. В предпочтительном воплощении гликоконъюгат серотипа 11А по изобретению содержит по меньшей мере 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8 или примерно 0,9 мМ глицерин на мМ полисахарид серотипа 11А и меньше чем примерно 1,0 мМ глицерин на мМ полисахарид серотипа 11А. В предпочтительном воплощении гликоконъюгат серотипа 11А по изобретению содержит по меньшей мере 0,3; 0,4; 0,5; 0,6 или примерно 0,7 мМ глицерин на мМ полисахарид серотипа 11А и меньше чем примерно 0,8 мМ глицерин на мМ полисахарид серотипа 11А. Любое приведенное выше число рассматривается как воплощение данного описания.
Другим способом характеризации гликоконъюгатов по изобретению является характеризация по числу остатков лизина в белке-носителе (например, CRM197), которые становятся конъюгированными с сахаридом, которое может быть охарактеризовано в виде интервала конъюгированных лизинов (степень конъюгирования). Доказательство модификации лизина белка-носителя из-за ковалентных связей с полисахаридами может быть получено посредством аминокислотного анализа с использованием традиционных способов, известных специалистам в данной области. Конъюгирование приводит к уменьшению числа выделенных остатков лизина по сравнению с исходным веществом белка-носителя, используемым для получения конъюгированных веществ. В предпочтительном воплощении степень конъюгирования гликоконъюгата по изобретению составляет от 2 до 15, от 2 до 13, от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 5, от 2 до 4, от 3 до 15, от 3 до 13, от 3 до 10, от 3 до 8, от 3 до 6, от 3 до 5, от 3 до 4, от 5 до 15, от 5 до 10, от 8 до 15, 8 до 12, от 10 до 15 или от 10 до 12. В одном воплощении степень конъюгирования гликоконъюгата по изобретению составляет примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14 или примерно 15. В предпочтительном воплощении степень конъюгирования гликоконъюгата по изобретению составляет от 4 до 7. В некоторых таких воплощениях белок-носитель представляет собой CRM197.
Гликоконъюгаты по изобретению также могут характеризоваться отношением (масса/масса) сахарида к белку-носителю. В некоторых воплощениях отношение полисахарида к белку-носителю в гликоконъюгате (масс./масс.) составляет от 0,5 до 3 (например, примерно 0,5; примерно 0,6; примерно 0,7; примерно 0,8; примерно 0,9; примерно 1,0; примерно 1,1; примерно 1,2; примерно 1,3; примерно 1,4; примерно 1,5; примерно 1,6; примерно 1,7; примерно 1,8; примерно 1,9; примерно 2,0; примерно 2,1; примерно 2,2; примерно 2,3; примерно 2,4; примерно 2,5; примерно 2,6; примерно 2,7; примерно 2,8; примерно 2,9 или примерно 3,0). В других воплощениях отношение сахарида к белку-носителю (масс./масс.) составляет от 0,5 до 2,0; от 0,5 до 1,5; от 0,8 до 1,2; от 0,5 до 1,0; от 1,0 до 1,5 или от 1,0 до 2,0. В других воплощениях отношение сахарида к белку-носителю (масс./масс.) составляет от 0,8 до 1,2. В предпочтительном воплощении отношение капсульного полисахарида к белку-носителю в конъюгате составляет от 0,9 до 1,1. В некоторых таких вопощениях белок-носитель представляет собой CRM197.
Гликоконъюгаты и иммуногенные композиции по изобретению могут содержать свободный сахарид, который не конъюгирован ковалентно с белком-носителем, но, тем не менее, присутствует в композиции гликоконъюгата. Свободный сахарид может быть нековалентно ассоциирован с (то есть нековалентно связан, адсорбирован на или захвачен в или с) гликоконъюгатом.
В предпочтительном воплощении гликоконъюгат содержит меньше чем примерно 50%, 45%, 40%, 35%, 30%, 25%, 20% или 15% свободного полисахарида по сравнению с общим количеством полисахарида. В предпочтительном воплощении гликоконъюгат содержит меньше чем примерно 25% свободного полисахарида по сравнению с общим количеством полисахарида. В предпочтительном воплощении гликоконъюгат содержит меньше чем примерно 20% свободного полисахарида по сравнению с общим количеством полисахарида. В предпочтительном воплощении гликоконъюгат содержит меньше чем примерно 15% свободного полисахарида по сравнению с общим количеством полисахарида.
Гликоконъюгаты также могут характеризоваться их распределением размера молекул (Kd). Для определения относительного распределения размера молекул конъюгата можно использовать средк гель-фильтрации (CL-4В). Гель-фильтрация (SEC) используется в колонках с подачей под влиянием гравитации для получения профиля распределения размера молекул конъюгатов. Большие молекулы, исключаемые из пор в среде, элюируются быстрее, чем маленькие молекулы. Для отбора элюата колонок используют сборщики фракций. Фракции тестируют колориметрически посредством анализа сахаридов. Для определения Kd колонки калибруют для установления фракции, в которой молекулы полностью исключаются (V0), (Kd равно 0), и фракции, представляющей максимальное удерживание (Vi), (Kd равно 1). Фракция, в которой достигается конкретная характеристика образца (Ve), относится к Kd посредством выражения Kd = (Ve - V0)/(Vi - V0).
В предпочтительном воплощении по меньшей мере 30% гликоконъюгата имеет Kd, меньшее или равное 0,3 в колонке CL-4B. В предпочтительном воплощении по меньшей мере 40% гликоконъюгата имеет Kd, меньшее или равное 0,3 в колонке CL-4B. В предпочтительном воплощении по меньшей мере 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% или 85% гликоконъюгата имеет Kd, меньшее или равное 0,3 в колонке CL-4B. В предпочтительном воплощении по меньшей мере 60% гликоконъюгата имеет Kd, меньшее или равное 0,3 в колонке CL-4B. В предпочтительном воплощении от 50% до 80% гликоконъюгата имеет Kd, меньшее или равное 0,3 в колонке CL-4B. В предпочтительном воплощении от 65% до 80% гликоконъюгата имеет Kd, меньшее или равное 0,3 в колонке CL-4B.
Частота присоединения сахаридной цепи к лизину на белке-носителе является другим параметром для характеристики гликоконъюгатов по изобретению. Например, в некоторых воплощениях по меньшей мере одна ковалентная связь между белком-носителем и полисахаридом встречается на каждые 4 повторяющихся сахаридных звена полисахарида. В другом воплощении ковалентная связь между белком-носителем и полисахаридом встречается по меньшей мере один раз на каждые 10 сахаридных повторяющихся звеньев полисахарида. В другом воплощении ковалентная связь между белком-носителем и полисахаридом встречается по меньшей мере один раз на каждые 15 сахаридных повторяющихся звеньев полисахарида. В другом воплощении ковалентная связь между белком-носителем и полисахаридом встречается по меньшей мере один раз на каждые 25 сахаридных повторяющихся звеньев полисахарида.
В частых воплощениях белок-носитель представляет собой CRM197, и ковалентная связь через спейсер еТЕС между CRM197 и полисахаридом встречается по меньшей мере один раз на каждые 4, 10, 15 или 25 сахаридных повторяющихся звеньев полисахарида.
В других воплощениях конъюгат содержит по меньшей мере одну ковалентную связь между белком-носителем и сахаридом для каждых 5-10 сахаридных повторяющихся звеньев; каждых 2-7 сахаридных повторяющихся звеньев; каждых 3-8 сахаридных повторяющихся звеньев; каждых 4-9 сахаридных повторяющихся звеньев; каждых 6-11 сахаридных повторяющихся звеньев; каждых 7-12 сахаридных повторяющихся звеньев; каждых 8-13 сахаридных повторяющихся звеньев; каждых 9-14 сахаридных повторяющихся звеньев; каждых 10-15 сахаридных повторяющихся звеньев; каждых 2-6 сахаридных повторяющихся звеньев; каждых 3-7 сахаридных повторяющихся звеньев; каждых 4-8 сахаридных повторяющихся звеньев; каждых 6-10 сахаридных повторяющихся звеньев; каждых 7-11 сахаридных повторяющихся звеньев; каждых 8-12 сахаридных повторяющихся звеньев; каждых 9-13 сахаридных повторяющихся звеньев; каждых 10-14 сахаридных повторяющихся звеньев; каждых 10-20 сахаридных повторяющихся звеньев; каждых 4-25 сахаридных повторяющихся звеньев или каждых 2-25 сахаридных повторяющихся звеньев. В частых воплощениях белок-носитель представляет собой CRM197.
В другом воплощении по меньшей мере одна связь между белком-носителем и сахаридом встречается на каждые 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 сахаридных повторяющихся звеньев полисахарида. В одном воплощении белок-носитель представляет собой CRM197. Любое целое число в пределах любого из приведенных выше интервалов рассматривается как воплощение данного описания.
1.4 Комбинация гликоконъюгатов по изобретению
В одном воплощении иммуногенная композиция по изобретению содержит любой из раскрытых здесь гликоконъюгатов.
1.4.1 Комбинации гликоконъюгатов
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 9V.
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат каждого из двух следующих серотипов S. pneumoniae: 9V и 4, 9V и 6В, 9V и 14, 9V и 18С, 9V и 19F или 9V и 23F.
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат каждого из семи следующих серотипов S. pneumoniae: 9V, 4, 6В, 14, 18С, 19F и 23F.
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат каждого из восьми следующих серотипов S. pneumoniae: 9V, 1, 4, 6В, 14, 18С, 19F и 23F; 9V, 4, 5, 6В, 14, 18С, 19F и 23F; 9V, 4, 6В, 7F, 14, 18С, 19F и 23F.
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат каждого из десяти следующих серотипов S. pneumoniae: 9V, 1, 5, 4, 6В, 7F, 14, 18С, 19F и 23F.
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат каждого из одиннадцати следующих серотипов S. pneumoniae: 9V, 1, 4, 5, 6А, 6В, 7F, 14, 18С, 19F и 23F; 9V, 1, 4, 5, 6В, 7F, 14, 18С, 19А, 19F и 23F.
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат каждого из двенадцати следующих серотипов S. pneumoniae: 9V, 1, 4, 5, 6А, 6В, 7F, 14, 18С, 19А, 19F и 23F.
В одном воплощении иммуногенная композиция по изобретению содержит по меньшей мере один гликоконъюгат каждого из тринадцати следующих серотипов S. pneumoniae: 9V, 1, 3, 4, 5, 6А, 6В, 7F, 14, 18С, 19А, 19F и 23F.
1.4.2 Дополнительные комбинации гликоконъюгатов
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат S. pneumoniae серотипа 15В.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат S. pneumoniae серотипа 22F.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат S. pneumoniae серотипа 33F.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат S. pneumoniae серотипа 8.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат S. pneumoniae серотипа 10А.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат S. pneumoniae серотипа 11А.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат S. pneumoniae серотипа 12F.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат каждого из двух следующих серотипов S. pneumoniae:
15В и 22F,
15В и 33F,
15В и 12F,
15В и 10А,
15В и 11А,
15В и 8,
22F и 33F,
22F и 12F,
22F и 10А,
22F и 11А,
22F и 8,
33F и 12F,
33F и 10А,
33F и 11А,
33F и 8,
12F и 10А,
12F и 11А,
12F и 8,
10A и 11А,
10А и 8 или
11А и 8.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат каждого из трех следующих серотипов S. pneumoniae:
15В и 22F, и 33F,
15В и 22F, и 12F,
15В и 22F, и 10А,
15В и 22F, и 11А,
15В и 22F, и 8,
15В и 33F, и 12F,
15В и 33F, и 10А,
15В и 33F, и 11А,
15В и 33F, и 8,
15В и 12F, и 10А,
15В и 12F, и 11А,
15В и 12F, и 8,
15В и 10А, и 11А,
15В и 10А, и 8,
15В и 11А, и 8,
22F и 33F, и 12F,
22F и 33F, и 10А,
22F и 33F, и 11А,
22F и 33F, и 8,
22F и 12F, и 10А,
22F и 12F, и 11А,
22F и 12F, и 8,
22F и 10А, и 11А,
22F и 10А, и 8,
22F и 11А, и 8,
33F и 12F, и 10А,
33F и 12F, и 11А,
33F и 12F, и 8,
33F и 10А, и 11А,
33F и 10А, и 8,
33F и 11А, и 8,
12F и 10А, и 11А,
12F и 10А, и 8,
12F и 11А, и 8 или
10А и 11А, и 8.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат каждого из четырех следующих серотипов S. pneumoniae:
15В и 22F, и 33F, и 12F,
15В и 22F, и 33F, и 10А,
15В и 22F, и 33F, и 11А,
15В и 22F, и 33F, и 8,
15В и 22F, и 12F, и 10А,
15В и 22F, и 12F, и 11А,
15В и 22F, и 12F, и 8,
15В и 22F, и 10А, и 11А,
15В и 22F, и 10А, и 8,
15В и 22F, и 11А, и 8,
15В и 33F, и 12F, и 10А,
15В и 33F, и 12F, и 11А,
15В и 33F, и 12F, и 8,
15B и 33F, и 10А, и 11А,
15В и 33F, и 10А, и 8,
15В и 33F, и 11А, и 8,
15В и 12F, и 10А, и 11А,
15В и 12F, и 10А, и 8,
15В и 12F, и 11А, и 8,
15В и 10А, и 11А, и 8,
22F и 33F, и 12F, и 10А,
22F и 33F, и 12F, и 11А,
22F и 33F, и 12F, и 8,
22F и 33F, и 10А, и 11А,
22F и 33F, и 10А, и 8,
22F и 33F, и 11А, и 8,
22F и 12F и 10А и 11А,
22F и 12F, и 10А, и 8,
22F и 12F, и 11А, и 8,
22F и 10А, и 11А, и 8,
33F и 12F, и 10А, и 11А,
33F и 12F, и 10А, и 8,
33F и 12F, и 11А, и 8,
33F и 10А, и 11А, и 8 или
12F и 10А, и 11А, и 8.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат каждого из пяти следующих серотипов S. pneumoniae:
15В и 22F, и 33F, и 12F, и 10А,
15В и 22F, и 33F, и 12F, и 11А,
15В и 22F, и 33F, и 12F, и 8,
15В и 22F, и 33F, и 10А, и 11А,
15В и 22F, и 33F, и 10А, и 8,
15В и 22F, и 33F, и 11А, и 8,
15В и 22F, и 12F, и 10А, и 11А,
15В и 22F, и 12F, и 10А, и 8,
15В и 22F, и 12F, и 11А, и 8,
15В и 22F, и 10А, и 11А, и 8,
15В и 33F, и 12F, и 10А, и 11А,
15В и 33F, и 12F, и 10А, и 8,
15В и 33F, и 12F, и 11А, и 8,
15В и 33F, и 10А, и 11А, и 8,
15В и 12F, и 10А, и 11А, и 8,
22F и 33F, и 12F, и 10А, и 11А,
22F и 33F, и 12F, и 10А, и 8,
22F и 33F, и 12F, и 11А, и 8,
22F и 33F, и 10А, и 11А, и 8,
22F и 12F, и 10А, и 11А, и 8 or
33F и 12F, и 10А, и 11А, и 8.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат каждого из шести следующих серотипов S. pneumoniae:
15В и 22F, и 33F, и 12F, и 10А, и 11А,
15В и 22F, и 33F, и 12F, и 10А, и 8,
15В и 22F, и 33F, и 12F, и 11А, и 8,
15В и 22F, и 33F, и 10А, и 11А, и 8,
15В и 22F, и 12F, и 10А, и 11А, и 8,
15В и 33F, и 12F, и 10А, и 11А, и 8 или
22F и 33F, и 12F, и 10А, и 11А, и 8.
В одном воплощении любая иммуногенная композиция, определенная в 1.4.1 выше, дополнительно содержит по меньшей мере один гликоконъюгат каждого из семи следующих серотипов S. pneumoniae: 15В и 22F, и 33F, и 12F, и 10А, и 11А, и 8.
В одном воплощении любая иммуногенная композиция, приведенная выше, дополнительно содержит гликоконъюгаты из S. pneumoniae серотипа 2.
В одном воплощении любая иммуногенная композиция, приведенная выше, дополнительно содержит гликоконъюгаты из S. pneumoniae серотипа 17F.
В одном воплощении любая иммуногенная композиция, приведенная выше, дополнительно содержит гликоконъюгаты из S. pneumoniae серотипа 20.
В одном воплощении любая иммуногенная композиция, приведенная выше, дополнительно содержит гликоконъюгаты из S. pneumoniae серотипа 15С.
Предпочтительно все гликоконъюгаты приведенной выше иммуногенной композиции индивидуально конъюгированы с белком-носителем.
В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 9V конъюгированы с CRM197. В одном воплощении любой из иммуногенных композиций, приведенных выше, гликоконъюгаты из S. pneumoniae серотипа 22F конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 33F конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 15В конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 12F конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 10А конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 11А конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 8 конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипов 4, 6В, 14, 18С, 19F и 23F конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипов 1, 5 и 7F конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипов 6А и 19А конъюгированы с CRM197. В одном воплощении любой иммуногенной композиции, приведенной выше, гликоконъюгаты из S. pneumoniae серотипа 3 конъюгированы с CRM197. В одном воплощении любой из иммуногенных композиций, приведенных выше, гликоконъюгаты из S. pneumoniae серотипа 2 конъюгированы с CRM197. В одном воплощении любой из иммуногенных композиций, приведенных выше, гликоконъюгаты из S. pneumoniae серотипа 20 конъюгированы с CRM197. В одном воплощении любой из иммуногенных композиций, приведенных выше, гликоконъюгаты из S. pneumoniae серотипа 15С конъюгированы с CRM197.
В одном воплощении все гликоконъюгаты иммуногенных композиций, приведенных выше, индивидуально конъюгированы с CRM197.
В одном воплощении гликоконъюгат из S. pneumoniae серотипа 9V любой иммуногенной композиции, приведенной выше, индивидуально конъюгирован с PD.
В одном воплощении гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 9V, 14 и/или 23F любой из иммуногенных композиций, приведенных выше, индивидуально конъюгированы с PD.
В одном воплощении гликоконъюгат из S. pneumoniae серотипа 18С любой из иммуногенных композиций, приведенных выше, конъюгирован с ТТ.
В одном воплощении гликоконъюгат из S. pneumoniae серотипа 19F любой из иммуногенных композиций, приведенных выше, конъюгирован с DT.
В одном воплощении гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 9V, 14 и/или 23F любой из иммуногенных композиций, приведенных выше, индивидуально конъюгированы с PD, гликоконъюгат из S. pneumoniae серотипа 18С конъюгирован с ТТ, и гликоконъюгат из S. pneumoniae серотипа 19F конъюгирован с DT.
В одном воплощении приведенная выше иммуногенная композиция содержит от 7 до 24 разных серотипов S. pneumoniae. В одном воплощении приведенная выше иммуногенная композиция содержит гликоконъюгаты из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 разных серотипов.
В одном воплощении приведенная выше иммуногенная композиция содержит от 7 до 20 разных серотипов S. pneumoniae. В одном воплощении приведенная выше иммуногенная композиция содержит гликоконъюгаты из 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 разных серотипов. В одном воплощении приведенная выше иммуногенная композиция содержит гликоконъюгаты из 16 или 20 разных серотипов.
В одном воплощении приведенная выше иммуногенная композиция представляет собой 8-, 9-, 10-, 11-, 12-, 13-, 14-, 15-, 16-, 17-, 18-, 19- или 20-валентную пневмококковую конъюгатную композицию. В одном воплощении приведенная выше иммуногенная композиция представляет собой 14-, 15-, 16-, 17-, 18- или 19-валентную пневмококковую конъюгатную композицию. В одном воплощении приведенная выше иммуногенная композиция представляет собой 16-валентную пневмококковую конъюгатную композицию. В одном воплощении приведенная выше иммуногенная композиция представляет собой 19-валентную пневмококковую конъюгатную композицию. В одном воплощении приведенная выше иммуногенная композиция представляет собой 20-валентную пневмококковую конъюгатную композицию.
В одном воплощении иммуногенная композиция по изобретению содержит гликоконъюгаты из S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F.
В одном воплощении иммуногенная композиция по изобретению содержит гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F.
В одном воплощении иммуногенная композиция по изобретению содержит конъюгированные сахариды S. pneumoniae из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F.
В одном воплощении иммуногенная композиция по изобретению содержит конъюгированные сахариды S. pneumoniae из серотипов 1, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F.
В одном воплощении гликоконъюгаты иммуногенной композиции по изобретению состоят из гликоконъюгатов из S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F. В одном воплощении гликоконъюгаты иммуногенной композиции по изобретению состоят из гликоконъюгатов из серотипов 1, 4, 5, 6А, 6В, 7F, 9V, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F. В одном воплощении гликоконъюгаты иммуногенной композиции по изобретению состоят из гликоконъюгатов из серотипов 1, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11А, 12F, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F. В одном воплощении гликоконъюгаты иммуногенной композиции по изобретению состоят из гликоконъюгатов из 1, 4, 5, 6А, 6В, 7F, 8, 9V, 10А, 11A, 12F, 14, 15В, 18С, 19А, 19F, 22F, 23F и 33F.
Предпочтительно все гликоконъюгаты иммуногенной композиции по изобретению индивидуально конъюгированы с белком-носителем. В одном воплощении гликоконъюгаты иммуногенной композиции, приведенной выше, индивидуально конъюгированы с CRM197.
1.4.3 Дополнительные комбинации гликоконъюгатов
В одном воплощении любые иммуногенные композиции, определенные в 1.4.1 или 1.4.2 выше, не содержат капсульный сахарид из S. pneumoniae серотипа 9N.
В одном воплощении любые иммуногенные композиции, определенные в 1.4.1 или 1.4.2 выше, не содержат капсульный сахарид из S. pneumoniae серотипа 9А.
В одном воплощении любые иммуногенные композиции, определенные в 1.4.1 или 1.4.2 выше, не содержат капсульный сахарид из S. pneumoniae серотипа 9L.
В одном воплощении любые иммуногенные композиции, определенные в 1.4.1 или 1.4.2 выше, не содержат капсульный сахарид из S. pneumoniae серотипов 9N и 9А.
В одном воплощении любые иммуногенные композиции, определенные в 1.4.1 или 1.4.2 выше, не содержат капсульный сахарид из S. pneumoniae серотипов 9N и 9L.
В одном воплощении любые иммуногенные композиции, определенные в 1.4.1 или 1.4.2 выше, не содержат капсульный сахарид из S. pneumoniae серотипов 9А и 9L.
В одном воплощении любые иммуногенные композиции, определенные в 1.4.1 или 1.4.2 выше, не содержат капсульный сахарид из S. pneumoniae серотипов 9N, 9А и 9L.
После конъюгирования капсульного полисахарида с белком-носителем гликоконъюгаты очищают (обогащают в отношении количества конъюгата полисахарид-белок) рядом методик. Данные методики включают операции концентрирования/диафильтрации, осаждение/элюирование, колоночную хроматографию и глубинную фильтрацию. См., напимер публикацию заявки на патент США №2007/0184072 и WO 2008/079653. После очистки индивидуальных гликоконъюгатов их смешивают с приготовлением иммуногенной композиции по настоящему изобретению.
2 Дозировка иммуногенных композиций
2.1 Количество полисахарида
Количество гликоконъюгата(ов) в каждой дозе выбирают как количество, которое индуцирует иммунопротективный ответ без значимых неблагоприятных побочных эффектов у типичных вакцинируемых. Такое количество будет варьировать в зависимости от того, какой конкретный иммуноген используют и как он представлен.
Количество конкретного гликоконъюгата в иммуногенной композиции может быть рассчитано на основе общего количества полисахарида для данного конъюгата (конъюгированного и неконъюгированного). Например, гликоконъюгат с 20% свободного полисахарида будет иметь примерно 80 мкг конъюгированного полисахарида и примерно 20 мкг неконъюгированного полисахарида в 100 мкг дозе полисахарида. Количество гликоконъюгата может варьировать в зависимости от стрептококкового серотипа. Концентрация сахарида может быть определена посредством анализа уроновых кислот.
«Иммуногенное количество» разных полисахаридных компонентов в иммуногенной композиции может разниться, и каждая может содержать примерно 1,0 мкг, примерно 2,0 мкг, примерно 3,0 мкг, примерно 4,0 мкг, примерно 5,0 мкг, примерно 6,0 мкг, примерно 7,0 мкг, примерно 8,0 мкг, примерно 9,0 мкг, примерно 10,0 мкг, примерно 15,0 мкг, примерно 20,0 мкг, примерно 30,0 мкг, примерно 40,0 мкг, примерно.50,0 мкг, примерно 60,0 мкг, примерно 70,0 мкг, примерно 80,0 мкг, примерно 90,0 мкг или примерно 100,0 мкг любого конкретного полисахаридного антигена.
Обычно каждая доза будет содержать от 0,1 мкг до 100 мкг полисахарида для данного серотипа, конкретно от 0,5 мкг до 20 мкг, более конкретно от 1 мкг до 10 мкг и даже более конкретно от 2 мкг до 5 мкг. Любое целое число в пределах любого из приведенных выше интервалов рассматривается как воплощение данного изобретения.
В одном воплощении каждая доза будет содержать 1 мкг, 2 мкг, 3 мкг, 4 мкг, 5 мкг, 6 мкг, 7 мкг, 8 мкг, 9 мкг, 10 мкг, 15 мкг или 20 мкг полисахарида для данного серотипа.
2.2 Количество носителя
В общем, каждая доза будет содержать от 5 мкг до 150 мкг белка-носителя, конкретно от 10 мкг до 100 мкг белка-носителя, более конкретно от 15 мкг до 100 мкг белка-носителя, более конкретно от 25 до 75 мкг белка-носителя, более конкретно от 30 мкг до 70 мкг белка-носителя, более конкретно от 30 до 60 мкг белка-носителя, более конкретно от 30 мкг до 50 мкг белка-носителя и даже более конкретно от 40 до 60 мкг белка-носителя. В одном воплощении указанный белок-носитель представляет собой CRM197.
В одном воплощении каждая доза будет содержать примерно 25 мкг, примерно 26 мкг, примерно 27 мкг, примерно 28 мкг, примерно 29 мкг, примерно 30 мкг, примерно 31 мкг, примерно 32 мкг, примерно 33 мкг, примерно 34 мкг, примерно 35 мкг, примерно 36 мкг, примерно 37 мкг, примерно 38 мкг, примерно 39 мкг, примерно 40 мкг, примерно 41 мкг, примерно 42 мкг, примерно 43 мкг, примерно 44 мкг, примерно 45 мкг, примерно 46 мкг, примерно 47 мкг, примерно 48 мкг, примерно 49 мкг, примерно 50 мкг, примерно 51 мкг, примерно 52 мкг, примерно 53 мкг, примерно 54 мкг, примерно 55 мкг, примерно 56 мкг, примерно 57 мкг, примерно 58 мкг, примерно 59 мкг, примерно 60 мкг, примерно 61 мкг, примерно 62 мкг, примерно 63 мкг, примерно 64 мкг, примерно 65 мкг, примерно 66 мкг, примерно 67 мкг, 68 мкг, примерно 69 мкг, примерно 70 мкг, примерно 71 мкг, примерно 72 мкг, примерно 73 мкг, примерно 74 мкг или примерно 75 мкг белка-носителя. В одном воплощении указанный белок-носитель представляет собой CRM197.
3 Дополнительные антигены
Иммуногенные композиции по изобретению содержат конъюгированные сахаридные антигены S. pneumoniae (гликоконъюгаты). Они также могут дополнительно включать антигены из других патогенов, особенно из бактерий и/или вирусов. Предпочтительные дополнительные антигены выбраны из следующих: дифтерийный анатоксин (D), столбнячный анатоксин (Т), коклюшный антиген (Р), который типично является бесклеточным (Ра), поверхностный антиген вируса гепатита В (HBV) (HBsAg), антиген вируса гепатита A (HAV), конъюгированный капсульный сахарид Haemophilus influenzae типа b (Hib), инактивированная полиовирусная вакцина (IPV).
В одном воплощении иммуногенные композиции по изобретению содержат D-T-Pa. В одном воплощении иммуногенные композиции по изобретению содержат D-T-Pa-Hib, D-T-Pa-IPV или D-T-Pa-HBsAg. В одном воплощении иммуногенные композиции по изобретению содержат D-T-Pa-HBsAg-IPV или D-T-Pa-HBsAg-Hib. В одном воплощении иммуногенные композиции по изобретению содержат D-T-Pa-HBsAg-IPV-Hib.
Коклюшные антигены: Bordetella pertussis вызывает коклюш. Коклюшные антигены в вакцинах являются либо клеточными (цельноклеточыми, в виде инактивированных клеток В. pertussis) либо бесклеточными. Получение клеточных коклюшных антигенов хорошо задокументировано (например, их можно получать посредством тепловой инактивации культуры В. pertussis фазы I). Однако предпочтительно в изобретении используют бесклеточные антигены. Когда используют бесклеточные антигены, предпочтительно использовать один, два или (предпочтительно) три из следующих антигенов: (1) детоксифицированный коклюшный токсин (коклюшный анатоксин или РТ); (2) нитчатый гемагглютинин (FHA); (3) пертактин (также известный как 69 килоДальтонный белок наружной мембраны). FHA и пертактин могут быть обработаны формальдегидом перед применением согласно изобретению. РТ предпочтительно детоксифицируют посредством обработки формальдегидом и/или глутаральдегдом. Бесклеточные коклюшные антигены предпочтительно адсорбированы на одном или более чем одном адъюванте соли алюминия. В качестве альтернативы, они могут быть добавлены в неадсорбированном состоянии. Когда добавляют пертактин, тогда он предпочтительно уже адсорбирован на адъюванте гидроксиде алюминия. РТ и FHA могут быть адсорбированы на адъюванте гидроксиде алюминия или фосфате алюминия. Адсорбция всех из РТ, FHA и пертактина на гидроксиде алюминия является наиболее предпочтительной.
Инактивированная полиовирусная вакцина: полиовирус вызывает полиомиелит. В предпочтительных воплощениях изобретения используют IPV, а не пероральную полиовирусную вакцину. До введения пациентам полиовирусы должны быть инактивированы, и этого может достигать посредством обработки формальдегидом. Полиомиелит может быть вызван одним из трех типов полиовируса. Данные три типа являются аналогичными и вызывают идентичные симптомы, но они являются антигенно различными, и инфекция одним типом не защищает против инфекции другими. Следовательно, в данном изобретении предпочтительно использовать три антигена полиовируса: полиовирус типа 1 (например, штамм Mahoney), полиовирус типа 2 (например, штамм MEF-1) и полиовирус типа 3 (например, штамм Saukett). Данные вирусы предпочтительно выращивают, очищают и инактивируют индивидуально и затем объединяют с получением массы трехвалентной смеси для применения в изобретении.
Дифтерийный анатоксин: Corynebacterium diphtheriae вызывает дифтерию. Дифтерийный токсин можно обрабатывать (например, с использованием формалина или формальдегида) для устранения токсичности при сохранении способности индуцировать специфичные антитела против токсина после инъекции. Данные дифтерийные анатоксины используют в вакцинах против дифтерии. Предпочтительными дифтерийными анатоксинами являются анатоксины, полученные посредством обработки формальдегидом. Дифтерийный анатоксин можно получать посредством выращивания С. diphtheriae в ростовой среде с последующей обработкой формальдегидом, ультрафильтрацией и осаждением. Анатоксиновое вещество можно затем обрабатывать посредством способа, включающего стерилизующую фильтрацию и/или диализ. Дифтерийный анатоксин предпочтительно адсорбируется на адъюванте гидроксиде алюминия.
Столбнячный анатоксин: Clostridium tetani вызывает столбняк. Столбнячный токсин может быть обработан с образованием защитного анатоксина. Анатоксины используют в столбнячных вакцинах. Предпочтительными столбнячными анатоксинами являются анатоксины, полученные посредством обработки формальдегидом. Столбнячный анатоксин может быть получен посредством выращивания С. tetani в ростовой среде с последующей обработкой формальдегидом, ультрафильтрацией и осаждением. Данное вещество можно затем обрабатывать способом, включающим стерилизующую фильтрацию и/или диализ.
Антигены вируса гепатита А: вирус гепатита A (HAV) является одним из известных агентов, который вызывает вирусный гепатит. Предпочтительный компонент HAV основан на инактивированном вирусе, и инактивации может достигать посредством обработки формалином.
Вирус гепатита В (HBV) является одним из известных агентов, которые вызывают вирусный гепатит. Главным компонентом капсида является белок, известный как поверхностный антиген HBV, или, более традиционно - HBsAg, который типично представляет собой полипептид из 226 аминокислот с молекулярной массой примерно 24 кДа. Все существующие вакцины против гепатита В содержат HBsAg, и при введении данного антигена нормальному вакцинируемому он стимулирует продукцию антител против HBsAg, которые защищают против инфекции HBV.
Для изготовления вакцины HBsAg получали двумя способами: очистки антигена в форме частиц из плазмы хронических носителей гепатита В или экспрессии белка посредством способов генной инженерии (например, рекомбинантной экспрессией в дрожжевых клетках). В отличие от природного HBsAg (то есть в виде продукта, очищенного из плазмы), экспрессируемый в дрожжах HBsAg обычно является негликозилированным, и он является самой предпочтительной формой HBsAg для применения в изобретении.
Конъюгированные антигены Haemophilus influenzae типа b: Haemophilus influenzae типа b (Hib) вызывает бактериальный менингит. Вакцины против Hib типично основаны на капсульном сахаридном антигене, получение которого хорошо задокументировано. Сахарид Hib можно конъюгировать с белком-носителем для того, чтобы усиливать его иммуногенность, особенно у детей. Типичными белками-носителями являются столбнячный анатоксин, дифтерийный анатоксин, CRM197, белок D Н. influenzae и белковый комплекс наружной мембраны из менингококка серогруппы В. Сахаридная группировка конъюгата может содержать полноразмерный полирибозилрибитолфосфат (PRP) в том виде, в котором его получают из бактерий Hib, и/или фрагменты полноразмерного PRP. Конъюгаты Hib могут быть или могут не быть адсорбированы на адъюванте соли алюминия.
В одном воплощении иммуногенные композиции по изобретению дополнительно включают конъюгированный капсульный сахарид N. meningitidis серогруппы Y (MenY), и/или конъюгированный капсульный сахарид N. meningitidis серогруппы С (MenC).
В одном воплощении иммуногенные композиции по изобретению дополнительно включают конъюгированный капсульный сахарид N. meningitidis серогруппы А (MenA), конъюгированный капсульный сахарид N. meningitidis серогруппы W135 (MenW135), конъюгированный капсульный сахарид N. meningitidis серогруппы Y (MenY) и/или конъюгированный капсульный сахарид N. meningitidis серогруппы С (MenC).
В одном воплощении иммуногенные композиции по изобретению дополнительно включают конъюгированный капсульный сахарид N. meningitidis серогруппы W135 (MenW135), конъюгированный капсульный сахарид N. meningitidis серогруппы Y (MenY) и/или конъюгированный капсульный сахарид N. meningitidis серогруппы С (MenC).
4 Адъюванты
В некоторых воплощениях раскрытые здесь иммуногенные композиции могут дополнительно содержать по меньшей мере один адъювант (например, один, два или три адъюванта). Термин «адъювант» относится к соединению или смеси, которая усиливает иммунный ответ на антиген. Адъюванты могут действовать, прежде всего, в качестве системы доставки, прежде всего в качестве иммуномодулятора, или имеют сильные характеристики обоих. Подходящие адъюванты включают адъюванты, подходящие для применения у млекопитающих, включая человека.
Примеры известных подходящих адъювантов типа системы доставки, которые можно использовать у человека, включают алюминиевые квасцы (например, фосфат алюминия, сульфат алюминия или гидроксид алюминия), фосфат кальция, липосомы, эмульсии типа «масло в воде», такие как MF59 (4,3% масс./об. сквалена, 0,5% масс./об. полисорбат 80 (Tween 80), 0,5% масс./об. сорбитана триолеат (Span 85)), эмульсии типа «вода в масле», такие как монтанид (Montanide), и микрочастицы или наночастицы поли(D,L-лактид-согликолида) (PLG), но не ограничиваются ими.
В одном воплощении раскрытые здесь иммуногенные композиции содержат соли алюминия (алюминиевые квасцы) в качестве адъюванта (например, фосфат алюминия, сульфат алюминия или гидроксид алюминия). В предпочтительном воплощении раскрытые здесь иммуногенные композиции содержат фосфат алюминия или гидроксид алюминия в качестве адъюванта. В одном воплощении раскрытые здесь иммуногенные композиции содержат от 0,1 мг/мл до 1 мг/мл или от 0,2 мг/мл до 0,3 мг/мл элемента алюминия в форме фосфата алюминия. В одном воплощении раскрытые здесь иммуногенные композиции содержат примерно 0,25 мг/мл элемента алюминия в форме фосфата алюминия.
Примеры известных подходящих адъювантов иммуномодулирующего типа, которые можно использовать у человека, включают сапониновые экстракты из коры дерева Aquilla (QS21, Quil А), агонисты TLR4 (Toll-подобный рецептор 4), такие как MPL (монофосфориллипид A), 3DMPL (3-O-деацилированный MPL) или GLA-AQ, мутанты LT/CT, цитокины, такие как разные интерлейкины (например, IL-2, IL-12) или GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор) и тому подобное, но не ограничиваются ими.
Примеры известных подходящих адъювантов иммуномодулирующего типа с характеристиками как доставки, так и иммуномодулирования, которые можно использовать у человека, включают ISCOM (иммуностимулирующие комплексы) (см., например,  et al. (1998) J. Leukocyte Biol. 64: 713; WO 90/03184, WO 96/11711, WO 00/48630, WO 98/36772, WO 00/41720, WO 2006/134423 и WO 2007/026190) или GLA-EM, который представляет собой комбинацию агониста TLR4 и эмульсии типа «масло в воде», но не ограничиваются ими.
et al. (1998) J. Leukocyte Biol. 64: 713; WO 90/03184, WO 96/11711, WO 00/48630, WO 98/36772, WO 00/41720, WO 2006/134423 и WO 2007/026190) или GLA-EM, который представляет собой комбинацию агониста TLR4 и эмульсии типа «масло в воде», но не ограничиваются ими.
Для ветеринарных применений, включающих экспериментирование на животных, но не ограничивающихся им, можно использовать полный адъювант Фрейнда (CFA), неполный адъювант Фрейнда (IFA), эмульсиген, N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглутамин (CGP 11637, именуемый нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (CGP 19835А, именуемый МТР-РЕ) и RIBI, который содержит три компонента, экстрагированных из бактерий, монофосфориллипид А, трегалозы димиколат и скелет клеточной стенки (MPL плюс TDM плюс CWS) в эмульсии 2% сквалена/Tween 80.
Дополнительные типичные адъюванты для увеличения эффективности пневмококковых вакцин, как здесь раскрыто, включают: (1) композиции эмульсий типа «масло в воде» (с другими или без других специфических иммуностимулирующих агентов, таких как мурамилпептиды (см. ниже) или компонентами бактериальной клеточной стенки), такие как, например, (a) SAF, содержащий 10% сквалан, 0,4% Tween 80, 5% плюроник-блокполимер L121, и thr-MDP либо подвергнутый микропсевдоожижению до субмикрометровой эмульсии, либо перемешанный на вихревой мешалке с получением эмульсии с частицами большего размера, и (б) адъювантная система RIBI™ (RAS), (Ribi Immunochem, Hamilton, МТ), содержащая 2% сквален, 0,2% Tween 80 и один или более чем один компонент бактериальной клеточной стенки, такой как монофосфолипид A (MPL), трегалозы димиколат (TDM) и скелет клеточной стенки (CWS), предпочтительно MPL плюс CWS (DETOX™); (2) могут быть использованы сапониновые адъюванты, такие как QS21, STIMULON™ (Cambridge Bioscience, Worcester, MA), Abisco® (Isconova, Швеция) или Iscomatrix® (Commonwealth Serum Laboratories, Австралия), или полученные из них частицы, такие как ISCOM (иммуностимулирующие комплексы), причем данные ISCOM могут быть лишены дополнительного детергента (например, WO 00/07621); (3) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (4) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (WO 99/44636)), интерферны (например, интерферон-гамма), макрофагальный колониестимулирующий фактор (M-CSF), фактор некроза опухолей (TNF) и т.д.; (5) монофосфориллипид A (MPL) или 3-О-деацилированный MPL (3dMPL) (см., например, GB-2220221, ЕР 0689454), возможно при существенном отсутствии алюминиевых квасцов при использовании с пневмококковыми сахаридами (см., например, WO 00/56358); (6) комбинации 3dMPL, например, с QS21 и/или эмульсиями типа «масло в воде» (см., например, ЕР 0835318, ЕР 0735898, ЕР 0761231); (7) простой эфир полиоксиэтилена или сложный эфир полиоксиэтилена (см. например, WO 99/52549); (8) поверхностно-активное вещество сложный эфир полиоксиэтиленсорбитана в комбинации с октоксинолом (WO 01/21207) или поверхностно-активное вещество простой или сложный алкиловый эфир полиоксиэтилена в комбинации с по меньшей мере одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (WO 01/21152); (9) сапонин и иммуностимулирующий олигонуклеотид (например, олигонуклеотид CpG) (WO 00/62800); (10) иммуностимулятор и частица соли металла (см., например, WO 00/23105); (11) сапонин и эмульсия типа «масло в воде», например, WO 99/11241; (12) сапонин (наример, QS21) плюс 3dMPL плюс IM2 (возможно плюс стерол), например, WO 98/57659; (13) другие вещества, которые действуют в качестве иммуностимулирующих агентов для усиления эффективности композиции. Мурамилпептиды включают N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP), N-25-ацетил-нормурамил-L-аланил-D-изоглутамин (нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (МТР-РЕ) и т.д.
В одном воплощении настоящего изобретения иммуногенные композиции, как здесь раскрыто, содержат олигонуклеотид CpG в качестве адъюванта. Термин «олигонуклеотид CpG» в том виде, как он здесь используется, относится к иммуностимулирующему олигонуклеотиду CpG (CpG ODN), и, соответственно, данные термины используются взаимозаменяемо, если не указано иначе. Иммуностимулирующие олигодезоксинуклеотиды CpG содержат один или более чем один иммуностимулирующий мотив CpG, который представляет собой неметилированные цитозин-гуаниновые динуклеотиды, возможно в пределах определенных предпочтительных контекстов оснований. Статус метилирования иммуностимулирующего мотива CpG обычно относится к остатку цитозина в динуклеотиде. Иммуностимулирующий олигонуклеотид, содержащий по меньшей мере один неметилированный динуклеотид CpG, представляет собой олигонуклеотид, который содержит 5'-неметилированный цитозин, связанный фосфатной связью с 3'-гуанином, и который активирует иммунную систему через связывание с Toll-подобным рецептором 9 (TLR-9). В другом воплощении иммуностимулирующий олигонуклеотид может содержать один или более чем один метилированный динуклеотид CpG, который будет активировать иммунную систему через TLR-9, но не так сильно, как если бы мотив(ы) CpG был(и) неметилированным(и). Иммуностимулирующие олигонуклеотиды CpG могут содержать один или более чем один палиндром, который, в свою очередь, может охватывать динуклеотид CpG. Олигонуклеотиды CpG были описаны в ряде выданных патентов, опубликованных патентных заявок и других публикаций, включая патенты США №6194388, 6207646, 6214806, 6218371, 6239116 и 6339068.
В одном воплощении настоящего изобретения раскрытые здесь иммуногенные композиции содержат любой олигонуклеотид CpG, описанный от страницы 3, строка 22 до страницы 12, строка 36 WO 2010/125480.
Были идентифицированы разные классы иммуностимулирующих олигонуклеотидов CpG. Они называются класс А, В, С и Р, и более подробно описаны от страницы 3, строка 22 до страницы 12, строка 36 WO 2010/125480. Способы по изобретению охватывают применение этих разных классов иммуностимулирующих олигонуклеотидов CpG.
В одном воплощении настоящего изобретения раскрытые здесь иммуногенные композиции содержат олигонуклеотид CpG класса А. В одном воплощении настоящего изобретения раскрытые здесь иммуногенные композиции содержат олигонуклеотид CpG класса В.
Последовательности олигонуклеотидов CpG класса В по изобретению представляют собой последовательности, широко описанные выше, а также раскрытые в опубликованных WO 96/02555, WO 98/18810 и в патентах США №6194388, 6207646, 6214806, 6218371, 6239116 и 6339068. Типичные последовательности включают последовательности, раскрытые в данных последних заявках и патентах, но не ограничиваются ими.
В одном воплощении олигонуклеотид CpG «класса В» по изобретению имеет следующую нуклеиновокислотную последовательность:
5' TCGTCGTTTTTCGGTGCTTTT 3' (SEQ ID NO: 1), или
5' TCGTCGTTTTTCGGTCGTTTT 3' (SEQ ID NO: 2), или
5' TCGTCGTTTTGTCGTTTTGTCGTT 3' (SEQ ID NO: 3), или
5' TCGTCGTTTCGTCGTTTTGTCGTT 3' (SEQ ID NO: 4), или
5' TCGTCGTTTTGTCGTTTTTTTCGA 3' (SEQ ID NO: 5).
В любых из данных последовательностей все связи могут быть фосфоротиоатными связями. В другом воплощении в любой из данных последовательностей одна или более чем одна связь может быть фосфодиэфирной, предпочтительно между «С» и «G» мотива CpG, создавая полумягкий олигонуклеотид CpG. В любой из данных последовательностей этилуридин или галоген могут быть заменой для 5'-Т; примеры таких замен на галоген включают бромуридиновые или йодуридиновые замены.
Некоторые неограничивающие примеры олигонуклеотидов класса В включают:
5' T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*G*C*T*T*T*T 3' (SEQ ID NO: 6), или
5' T*C*G*T*C*G*T*T*T*T*T*C*G*G*T*C*G*T*T*T*T 3' (SEQ ID NO: 7), или
5' T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3' (SEQ ID NO: 8), или
5' T*C*G*T*C*G*T*T*T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T 3' (SEQ ID NO: 9), или
5' T*C*G*T*C*G*T*T*T*T*G*T*C*G*T*T*T*T*T*T*T*C*G*A 3' (SEQ ID NO: 10),
где «*» относится к фосфоротиоатной связи.
В одном воплощении настоящего изобретения раскрытые здесь иммуногенные композиции содержат олигонуклеотид CpG класса С.
В одном воплощении настоящего изобретения раскрытые здесь иммуногенные композиции содержат олигонуклеотид CpG класса Р.
В одном воплощении олигонуклеотид включает по меньшей мере одну фосфоротиоатную связь. В другом воплощении все межнуклеотидные связи олигонукеотида представляют собой фосфоротиоатные связи. В другом воплощении олигонуклетид включает по меньшей мере одну фосфодиэфир-подобную связь. В другом воплощении фосфодиэфир-подобная связь представляет собой фосфодиэфирную связь. В другом воплощении с олигонуклеотидом конъюгирована липофильная группа. В одном воплощении липофильная группа представляет собой холестерин.
В одном воплощении все межнуклеотидные связи раскрытых здесь олигонуклеотидов CpG представляют собой фосфодиэфирные связи («мягкие» олигонуклеотиды, как описано в WO 2007/026190). В другом воплощении олигонуклеотиды CpG по изобретению делаются устойчивыми к деградации (например, стабилизируются). Термин «стабилизированный олигонуклеотид» относится к олигонуклеотиду, который является относительно устойчивым к деградации in vivo (например, посредством экзо- или эндонуклеазы). Стабилизацию нуклеиновой кислоты можно осуществлять посредством модификаций остова. Олигонуклеотиды, имеющие фосфоротиоатные связи, дают максимальную активность и защищают олигонуклеотид от деградации внутриклеточными экзо- и эндонуклеазами.
Иммуностимулирующие олигонуклеотиды могут иметь химерный остов, который имеет комбинации фосфодиэфирных и фосфоротиоатных связей. Для задач настоящего изобретения термин «химерный остов» относится к частично стабилизированному остову, в котором по меньшей мере одна межнуклеотидная связь является фосфодиэфирной или фосфодиэфир-подобной, и в котором по меньшей мере одна другая межнуклеотидная связь является стабилизированной межнуклеотидной связью, в котором по меньшей мере одна фосфодиэфирная или фосфодиэфир-подобная связь и по меньшей мере одна стабилизированная связь являются отличными. Когда фосфодиэфирная связь предпочтительно локализована в мотиве CpG, такие молекулы называются «полумягкими», как описано в WO 2007/026190.
Другие модифицированные олигонуклеотиды включают комбинации фосфодиэфирных, фосфоротиоатных, метилфосфонатных, метилфосфоротиоатных, фосфородитиоатных и/или п-этокси связей.
Модифицированный ODN (олигодезоксирибонуклеотид) со смешанным остовом может быть синтезирован, как описано в WO 2007/026190.
Размер олигонуклеотида CpG (то есть число нуклеотидных остатков по длине олигонуклеотида) также может способствовать стимулирующей активности олигонуклеотида. Для облегчения поглощения в клетки олигонуклеотид CpG по изобретению предпочтительно имеет минимальную длину 6 нуклеотидных остатков. Олигонуклеотиды любого размера, большего чем 6 нуклеотидов (даже с длиной, составляющей многие т.н.), способны индуцировать иммунный ответ при наличии достаточных иммуностимулирующих мотивов, так как более длинные олигонуклеотиды деградируют в клетках. В некоторых воплощениях олигонуклеотиды CpG имеют длину от 6 до 100 нуклеотидов, предпочтительно от 8 до 30 нуклеотидов. В важных воплощениях нуклеиновые кислоты и олигонуклеотиды по изобретению не являются плазмидами или экспрессионными векторами.
В одном воплощении раскрытый здесь олигонуклеотид CpG содержит замены или модификации, как, например, в основаниях и/или сахарах, как описано в абзацах 134-147 WO 2007/026190.
В одном воплощении олигонуклеотид CpG по настоящему изобретению является химически модифицированным. Примеры химических модификаций известны специалисту и описаны, например, в Uhlmann et al. (1990) Chem. Rev. 90: 543; S. Agrawal, Ed., Humana Press, Totowa, USA 1993; Crooke. et al. (1996) Annu. Rev. Pharmacol. Toxicol. 36: 107-129 и Hunziker et al., (1995) Mod. Synth. Methods 7: 331-417. Олигонуклеотид согласно изобретению может иметь одну или более чем одну модификацию, где каждая модификация располагается в конкретном фосфодиэфирном межнуклеозидном мостике и/или на конкретном β-D-рибозном звене, и/или в конкретном положении природного нуклеозидного основания по сравнению с олигонуклеотидом такой же последовательности, который состоит из природной ДНК или РНК.
В некоторых воплощениях изобретения нуклеиновые кислоты, содержащие CpG, могут быть просто смешаны с иммуногенными носителями согласно способам, известным специалистам в данной области (см., например, WO 03/024480).
В конкретном воплощении настоящего изобретения любая из раскрытых здесь иммуногенных композиций содержит от 2 мкг до 100 мг олигонуклеотида CpG, предпочтительно от 0,1 мг до 50 мг олигонуклеотида CpG, предпочтительно от 0,2 мг до 10 мг олигонуклеотида CpG, предпочтительно от 0,3 мг до 5 мг олигонуклеотида CpG, даже более предпочтительно от 0,5 мг до 2 мг олигонуклеотида CpG, даже более предпочтительно от 0,75 мг до 1,5 мг олигонуклеотида CpG. В предпочтительном воплощении любая из раскрытых здесь иммуногенных композиций содержит примерно 1 мг олигонуклеотида CpG.
5 Композиция
Иммуногенные композиции по изобретению могут быть приготовлны в жидкой форме (то есть растворы или суспензии) или в лиофилизированной форме. Жидкие композиции можно преимущественно вводить непосредственно из их упакованной формы и, таким образом, они являются идеальными для инъекции без необходимости восстановления в водной среде, что, в противном случае, требовалось бы для лиофилизированных композиций по изобретению.
Приготовление иммуногенной композиции по настоящему изобретению можно осуществлять с использованием признанных в данной области способов. Например, индивидуальные пневмококковые конъюгаты могут быть приготовлены с физиологически приемлемым носителем для получения композиции. Примеры таких носителей включают воду, забуференный физиологический раствор, полиолы (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и растворы декстрозы, но не ограничиваются ими.
В настоящем описании предложена иммуногенная композиция, содержащая любую комбинацию раскрытых здесь гликоконъюгатов, и фармацевтически приемлемый эксципиент, носитель или разбавитель.
В одном воплощении иммуногенная композиция по изобретению представлена в жидкой форме, предпочтительно в водной жидкой форме.
Иммуногенные композиции по изобретению могут содержать один или более чем один буфер, соль, двухвалентный катион, неионный детергент, криопротектор, такой как сахар, и антиоксидант, такой как ловушка свободных радикалов или хелатор, или любые их множественные комбинации.
В одном воплощении иммуногенная композиция по изобретению содержит буфер. В одном воплощении указанный буфер имеет рKа от примерно 3,5 до примерно 7,5. В некоторых воплощениях буфер является фосфатным, сукцинатным, гистидиновым или цитратным. В некоторых воплощениях буфер представляет собой сукцинат в конечной концентрации от 1 мМ до 10 мМ. В одном конкретном воплощении конечная концентрация сукцинатного буфера составляет примерно 5 мМ.
В одном воплощении иммуногенная композиция по изобретению содержит соль. В некоторых воплощениях соль выбрана из групп, состоящих из хлорида магния, хлорида калия, хлорида натрия и их комбинаций. В одном конкретном воплощении соль представляет собой хлорид натрия. В одном конкретном воплощении иммуногенная композиция по изобретению содержит хлорид натрия в концентрации 150 мМ.
В одном воплощении иммуногенные композиции по изобретению содержат поверхностно-активное вещество. В одном воплощении поверхностно-активное вещество выбрано из группы, состоящей из полисорбата 20 (TWEEN™20), полисорбата 40 (TWEEN™40), полисорбата 60 (TWEEN™60), полисорбата 65 (TWEEN™65), полисорбата 80 (TWEEN™80), полисорбата 85 (TWEEN™85), TRITON™ N-101, TRITON™ Х-100, окстоксинола 40, ноноксинола-9, триэтаноламина, триэтаноламинполипептидолеата, полиоксиэтилен-660 гидроксистеарата (PEG-15, Solutol Н 15), полиоксиэтилен-35-рицинолеата (CREMOPHOR® EL), соевого лецитина и полоксамера. В одном конкретном воплощении поверхностно-активное вещество представляет собой полисорбат 80. В некоторых указанных воплощениях конечная концентрация полисорбата 80 в композиции составляет по меньшей мере от 0,0001% до 10% полисорбата 80 по массе (масс./масс.). В некоторых указанных воплощениях конечная концентрация полисорбата 80 в композиции составляет по меньшей мере от 0,001% до 1% полисорбата 80 по массе (масс./масс.). В некоторых указанных воплощениях конечная концентрация полисорбата 80 в композиции составляет по меньшей мере от 0,01% до 1% полисорбата 80 по массе (масс./масс.). В других воплощениях конечная концентрация полисорбата 80 в композиции составляет 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09% или 0,1% полисорбата 80 (масс./масс.). В другом воплощении конечная концентрация полисорбата 80 в композиции составляет 1% полисорбата 80 (масс./масс.).
В некоторых воплощениях иммуногенная композиция по изобретению имеет рН от 5,5 до 7,5, более предпочтительно - рН от 5,6 до 7,0, даже более предпочтительно - рН от 5,8 до 6,0.
В одном воплощении согласно настоящему изобретению предложен контейнер, заполненный любой из раскрытых здесь иммуногенных композиций. В одном воплощении контейнер выбран из группы, состоящей из флакона, шприца, бутыли, ферментера, биореактора, мешка, банки, ампулы, картриджа и одноразового шприца-ручки. В некоторых воплощениях контейнер является силиконизированным.
В одном воплощении контейнер по настоящему изобретению сделан из стекла, металлов (например, сталь, нержавеющая сталь, алюминий и т.д.) и/или полимеров (например, термопластмассы, эластомеры, термопластмассы-эластомеры). В одном воплощении контейнер по настоящему изобретению сделан из стекла.
В одном воплощении согласно настоящему изобретению предложен шприц, заполненный любыми раскрытыми здесь иммуногенными композициями. В некоторых воплощениях шприц является силиконизированным и/или сделан из стекла.
Типичная доза иммуногенной композиции по изобретению для инъекции имеет объем от 0,1 мл до 2 мл, более предпочтительно от 0,2 мл до 1 мл, даже более предпочтительно объем примерно 0,5 мл.
Следовательно, контейнер или шприц, как определено выше, заполнен объемом от 0,1 мл до 2 мл, более предпочтительно от 0,2 мл до 1 мл, даже более предпочтительно объемом примерно 0,5 мл любой определенной здесь иммуногенной композиции.
6 Способность иммуногенных композиций по изобретению вызывать выработку перекрестно реагирующих антител
В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом S. pneumoniae серотипов 9N, 9А и/или 9L при определении посредством анализа ELISA.
В методе ELISA (твердофазный иммуноферментный анализ) антитела из сывороток вакцинированных субъектов инкубируют с полисахаридами, которые были адсорбированы на твердой подложке. Связавшиеся антитела выявляют с использованием вторичных выявляющих антител, конъюгированных с ферментом.
В одном воплощении указанный анализ ELISA представляет собой стандартизированный анализ ELISA, как определено ВОЗ (Всемирная организация здравоохранения) в «Training Manual For Enzyme Linked Immunosorbent Assay For The Quantitation Of Streptococcus Pneumoniae Serotype Specific IgG (Pn PS ELISA).» (доступна на http://www.vaccine.uab.edu/ELISA%20protocol.pdf, доступ осуществлялся 31 марта, 2014 г.).
ELISA измеряет специфичные для типа антитела IgG против капсульного полисахарида (PS) S. pneumoniae, присутствующие в человеческой сыворотке. При добавлении разведений человеческой сыворотки в планшеты для микротитрования, покрытые специфичным для типа капсульным PS, антитела, специфичные в отношении данного капсульного PS связываются с планшетами для микротитрования. Антитела, связанные с планшетами, выявляют с использованием антитела козы против человеческого IgG, меченного щелочной фосфатазой, с последующей инкубацией с субстратом - п-нитрофенилфосфатом. Оптическая плотность окрашенного конечного продукта пропорциональна количеству антитела против капсульного PS, присутствующего в сыворотке.
В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом S. pneumoniae серотипа 9N в концентрации по меньшей мере 0,05 мкг/мл, 0,1 мкг/мл, 0,2 мкг/мл, 0,3 мкг/мл, 0,35 мкг/мл, 0,4 мкг/мл или 0,5 мкг/мл при определении посредством анализа ELISA.
В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом S. pneumoniae серотипа 9А в концентрации по меньшей мере 0,05 мкг/мл, 0,1 мкг/мл, 0,2 мкг/мл, 0,3 мкг/мл, 0,35 мкг/мл, 0,4 мкг/мл или 0,5 мкг/мл при определении посредством анализа ELISA.
В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом S. pneumoniae серотипа 9L в концентрации по меньшей мере 0,05 мкг/мл, 0,1 мкг/мл, 0,2 мкг/мл, 0,3 мкг/мл, 0,35 мкг/мл, 0,4 мкг/мл или 0,5 мкг/мл при определении посредством анализа ELISA.
В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9N, 9А и/или 9L при определении посредством опсонофагоцитарного анализа in vitro (ОРА) (см. Пример 1). В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9N при определении посредством опсонофагоцитарного анализа in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9А при определении посредством опсонофагоцитарного анализа in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9L при определении посредством опсонофагоцитарного анализа in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9N и 9А при определении посредством опсонофагоцитарного анализа in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9N и 9L при определении посредством опсонофагоцитарного анализа in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9А и 9L при определении посредством опсонофагоцитарного анализа in vitro (ОРА).
Пневмококковый опсонофагоцитарный анализ (ОРА), в котором измеряется уничтожение клеток S. pneumoniae фагоцитарными эффекторными клетками в присутствии функционального антитела и комплемента, считается важным заменителем для оценки эффективности пневмококковых вакцин.
Опсонофагоцитарный анализ in vitro (ОРА) можно проводить посредством совместного инкубирования смеси клеток Streptococcus pneumoniae, инактивированной нагреванием человеческой сыворотки, подлежащей тестированию, дифференцированных клеток HL-60 (фагоциты) и экзогенного источника комплемента (например, комплемент детеныша кролика). Опсонофагоцитоз идет во время инкубации, и бактериальные клетки, которые покрываются антителом и комплементом, уничтожаются при опсонофагоцитозе. Колониеобразующие единицы (CFU) выживающих бактерий, которые избегают опсонофагоцитоза, определяют путем высаживания на чашки смеси анализа. Титр ОРА определяют как обратное разведение, которое приводит к 50%-ному уменьшению числа бактерий по сравнению с контрольными лунками без опытной сыворотки. Титр ОРА интерполируют из двух разведений, которые охватывают этот 50%-ный порог уничтожения.
Положительным результатом в данных ОРА уничтожающего типа считают конечный титр 1:8 или более.
В одном воплощении иммуногенная композиция по изобретению способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9N у по меньшей мере 50% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9N у по меньшей мере 60%, 70%, 80%, 90% или по меньшей мере 93% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
В одном воплощении иммуногенная композиция по изобретению способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9А у по меньшей мере 50% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9А у по меньшей мере 60%, 70%, 80%, 90% или по меньшей мере 95% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
В одном воплощении иммуногенная композиция по изобретению способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9L у по меньшей мере 50% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА). В одном воплощении иммуногенная композиция по изобретению способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9L у по меньшей мере 60%, 70%, 80%, 90% или по меньшей мере 95% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
В некоторых воплощениях субъекты могут иметь специфичные для серотипа титры ОРА до пневмококковой вакцинации, например, из-за природного воздействия S. pneumoniae (например, в случае взрослых субъектов).
Следовательно, можно проводить сравнение активности ОРА сыворотки до и после иммунизации иммуногенной композицией по изобретению и сравнивать в отношении их ответа на серотипы 9А, 9L и 9N для оценки потенциального увеличения респондеров (см. Пример 1).
В одном воплощении иммуногенная композиция по изобретению значимо увеличивает долю респондеров (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
Следовательно, в одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать долю респондеров против S. pneumoniae серотипа 9N (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать долю респондеров против S. pneumoniae серотипа 9А (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать долю респондеров против S. pneumoniae серотипа 9L (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать долю респондеров против S. pneumoniae серотипов 9N и 9А (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать долю респондеров против S. pneumoniae серотипов 9N и 9L (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать долю респондеров против S. pneumoniae серотипов 9А и 9L (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать долю респондеров против S. pneumoniae серотипов 9N, 9А и 9L (то есть индивидов с сывороткой, имеющей титр по меньшей мере 1:8 при определении посредством ОРА in vitro) по сравнению с популяцией до иммунизации.
Сравнение активности ОРА сыворотки до и после иммунизации иммуногенной композицией по изобретению также можно осуществлять посредством сравнения потенциального увеличения титров ОРА.
Следовательно, сравнение активности ОРА сыворотки до и после иммунизации иммуногенной композицией по изобретению можно проводить и сравнивать в отношении их ответа на серотипы 9А, 9L и 9N для оценки потенциала увеличения титров ОРА (см. Пример 1).
В одном воплощении иммуногенные композиции по изобретению способны значимо увеличивать титр ОРА субъектов-людей по сравнению с популяцией до иммунизации.
Следовательно, в одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипа 9N по сравнению с популяцией до иммунизации. В одном воплощении кратность увеличения титра ОРА против S. pneumoniae серотипа 9N составляет по меньшей мере 1,2; 1,5; 1,75; 2,0 или 2,1.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипа 9А по сравнению с популяцией до иммунизации. В одном воплощении кратность увеличения титра ОРА против S. pneumoniae серотипа 9А составляет по меньшей мере 1,5; 2,0; 3,0; 4,0; 5,0; 6,0; 6,5; 7,0 или 7,5.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипа 9L по сравнению с популяцией до иммунизации. В одном воплощении кратность увеличения титра ОРА против S. pneumoniae серотипа 9L составляет по меньшей мере 1,5; 2,0; 2,5; 3,0; 3,5; 4,0 или 4,2.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипов 9N и 9А по сравнению с популяцией до иммунизации. В одном воплощении кратность увеличения титра ОРА против S. pneumoniae серотипа 9N составляет по меньшей мере 1,2; 1,5; 1,75; 2,0 или 2,1 и кратность увеличения титра ОРА против S. pneumoniae серотипа 9А составляет по меньшей мере 1,5; 2,0; 3,0; 4,0; 5,0; 6,0; 6,5; 7,0 или 7,5.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипов 9N и 9L по сравнению с популяцией до иммунизации. В одном воплощении кратность увеличения титра ОРА против S. pneumoniae серотипа 9N составляет по меньшей мере 1,2; 1,5; 1,75; 2,0 или 2,1 и кратность увеличения титра ОРА против S. pneumoniae серотипа 9L составляет по меньшей мере 1,5; 2,0; 2,5; 3,0; 3,5; 4,0 или 4,2.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипов 9А и 9L по сравнению с популяцией до иммунизации. В одном воплощении кратность увеличения титра ОРА против S. pneumoniae серотипа 9А составляет по меньшей мере 1,5; 2,0; 3,0; 4,0; 5,0; 6,0; 6,5; 7,0 или 7,5 и кратность увеличения титра ОРА против S. pneumoniae серотипа 9L составляет по меньшей мере 1,5; 2,0; 2,5; 3,0; 3,5; 4,0 или 4,2.
В одном воплощении иммуногенная композиция по изобретению способна значимо увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипов 9N, 9А и 9L по сравнению с популяцией до иммунизации. В одном воплощении кратность увеличения титра ОРА против S. pneumoniae серотипа 9N составляет по меньшей мере 1,2; 1,5; 1,75; 2,0 или 2,1, кратность увеличения титра ОРА против S. pneumoniae серотипа 9А составляет по меньшей мере 1,5; 2,0; 3,0; 4,0; 5,0; 6,0; 6,5; 7,0 или 7,5 и кратность увеличения титра ОРА против S. pneumoniae серотипа 9L составляет по меньшей мере 1,5; 2,0; 2,5; 3,0; 3,5; 4,0 или 4,2.
7 Применения иммуногенных композиций по изобретению
8 одном воплощении раскрытые здесь иммуногенные композиции предназначены для применения в качестве лекарственного средства.
Описанные здесь иммуногенные композиции можно использовать в разных терапевтических и профилактических способах для предупреждения, лечения или уменьшения интенсивности бактериальной инфекции, заболевания или состояния у субъекта. В частности, описанные здесь иммуногенные композиции можно использовать для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae, у субъекта.
Таким образом, в одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипов 9N, 9А и 9L, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипа 9N, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипа 9А, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипа 9L, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипов 9N и 9А, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипов 9N и 9L, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипов 9А и 9L, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипов 9N, 9А и/или 9L, у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипа 9N у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипа 9А у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте согласно изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипа 9L у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по изобретению.
В одном аспекте иммуногенные композиции по настоящему изобретению служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9N, 9А и 9L, у субъекта.
В одном аспекте иммуногенные композиции по настоящему изобретению служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипа 9N, у субъекта. В одном аспекте иммуногенные композиции по настоящему изобретению служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипа 9А, у субъекта. В одном аспекте иммуногенные композиции по настоящему изобретению служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипа 9L, у субъекта.
В одном аспекте иммуногенные композиции по настоящему изобретению служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9N и 9А, у субъекта. В одном аспекте иммуногенные композиции по настоящему изобретению служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9N и 9L, у субъекта. В одном аспекте иммуногенные композиции по настоящему изобретению служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9А и 9L, у субъекта.
В одном воплощении любая раскрытая здесь иммуногенная композиция служит для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипов 9N, 9А и/или 9L.
В одном воплощении любая раскрытая здесь иммуногенная композиция служит для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N. В одном воплощении любая раскрытая здесь иммуногенная композиция служит для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9А. В одном воплощении любая раскрытая здесь иммуногенная композиция служит для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9L.
В одном воплощении любая раскрытая здесь иммуногенная композиция служит для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипов 9N и 9А. В одном воплощении любая раскрытая здесь иммуногенная композиция служит для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипов 9N и 9L. В одном воплощении любая раскрытая здесь иммуногенная композиция служит для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипов 9А и 9L.
В одном аспекте настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9N, 9А и 9L, у субъекта.
В одном аспекте настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9N и 9А, у субъекта. В одном аспекте настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9N и 9L, у субъекта. В одном аспекте настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9А и 9L, у субъекта.
В одном воплощении настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипов 9N, 9А и/или 9L.
В одном воплощении настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипа 9N. В одном воплощении настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипа 9А. В одном воплощении настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипа 9L.
В одном воплощении настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипов 9N и 9А. В одном воплощении настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипов 9N и 9L. В одном воплощении настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипов 9А и 9L.
В одном аспекте согласно настоящему изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипов 9N, 9А и/или 9L у субъекта. В одном аспекте согласно настоящему изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипа 9N у субъекта. В одном аспекте согласно настоящему изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипа 9А у субъекта. В одном аспекте согласно настоящему изобретению предложен способ индуцирования иммунного ответа на S. pneumoniae серотипа 9L у субъекта. В одном воплощении раскрытые здесь иммуногенные композиции служат для применения в качестве вакцины. Более конкретно, раскрытые здесь иммуногенные композиции могут быть использованы для предупреждения у субъекта инфекций S. pneumoniae серотипов 9N, 9А и/или 9L. Таким образом, в одном аспекте согласно изобретению предложен способ предупреждения у субъекта инфекции S. pneumoniae серотипов 9N, 9А и/или 9L, включающий введение данному субъекту иммунологически эффективного количества иммуногенной композиции по изобретению. В некоторых таких воплощениях инфекция выбрана из группы, состоящей из пневмонии, синусита, среднего отита, острого среднего отита, менингита, бактериемии, сепсиса, эмпиемы плевры, конъюнктивита, остеомиелита, септического артрита, эндокардита, перитонита, перикардита, мастоидита, панникулита, инфекции мягких тканей и абсцесса мозга. В одном аспекте субъект, подежащий вакцинации, представляет собой млекопитающее, такое как человек, кошка, овца, свинья, лошадь, корова или собака.
В одном аспекте раскрытые здесь иммуногенные композиции служат для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипов 9N, 9А и/или 9L, у субъекта. В некоторых таких воплощениях инфекция, заболевание или состояние выбраны из группы, состоящей из пневмонии, синусита, среднего отита, острого среднего отита, менингита, бактериемии, сепсиса, эмпиемы плевры, конъюнктивита, остеомиелита, септического артрита, эндокардита, перитонита, перикардита, мастоидита, панникулита, инфекции мягких тканей и абсцесса мозга.
В одном аспекте раскрытая здесь иммуногенная композиция служит для применения в способе предупреждения у субъекта инфекции S. pneumoniae серотипов 9N, 9А и/или 9L. В некоторых таких воплощениях инфекция выбрана из группы, состоящей из пневмонии, синусита, среднего отита, острого среднего отита, менингита, бактериемии, сепсиса, эмпиемы плевры, конъюнктивита, остеомиелита, септического артрита, эндокардита, перитонита, перикардита, мастоидита, панникулита, инфекции мягких тканей и абсцесса мозга. В одном аспекте субъект, подлежащий вакцинации, представляет собой млекопитающее, такое как человек, кошка, овца, свинья, лошадь, корова или собака.
В одном аспекте настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных с S. pneumoniae серотипов 9N, 9А и/или 9L, у субъекта. В некоторых таких воплощениях инфекция, заболевание или состояние выбраны из группы, состоящей из пневмонии, синусита, среднего отита, острого среднего отита, менингита, бактериемии, сепсиса, эмпиемы плевры, конъюнктивита, остеомиелита, септического артрита, эндокардита, перитонита, перикардита, мастоидита, панникулита, инфекции мягких тканей и абсцесса мозга.
В одном аспекте настоящее изобретение направлено на применение раскрытой здесь иммуногенной композиции для изготовления лекарственного средства для предупреждения у субъекта инфекции S. pneumoniae серотипов 9N, 9А и/или 9L. В некоторых таких воплощениях инфекция выбрана из группы, состоящей из пневмонии, синусита, среднего отита, острого среднего отита, менингита, бактериемии, сепсиса, эмпиемы плевры, конъюнктивита, остеомиелита, септического артрита, эндокардита, перитонита, перикардита, мастоидита, панникулита, инфекции мягких тканей и абсцесса мозга. В одном аспекте субъект, подлежащий вакцинации, представляет собой млекопитающее, такое как человек, кошка, овца, свинья, лошадь, корова или собака.
Иммуногенные композиции по настоящему изобретению можно использовать для защиты или лечения человека, чувствительного к инфекции S. pneumoniae серотипов 9N, 9А и/или 9L, посредством введения иммуногенных композиций через системный путь или путь через слизистую. В одном воплощении раскрытые здесь иммуногенные композиции вводят внутримышечным, внутрибрюшинным, внутрикожным или подкожным путями. В одном воплощении раскрытые здесь иммуногенные композиции вводят посредством внутримышечной, внутрибрюшинной, внутрикожной или подкожной инъекции. В одном воплощении раскрытые здесь иммуногенные композиции вводят посредством внутримышечной или подкожной инъекции.
В одном воплощении иммуногенные композиции по настоящему изобретению содержат по меньшей мере один гликоконъюгат из S. pneumoniae 9V (такие как гликоконъюгаты из раздела 1.3 выше).
8 Субъект, подлежащий лечению иммуногенными композициями по изобретению
Как здесь раскрыто, описанные здесь иммуногенные композиции можно использовать в разных терапевтических или профилактических способах для предупреждения, лечения или уменьшения интенсивности бактериальной инфекции, заболевания или состояния у субъекта.
В предпочтительном воплощении указанный субъект представляет собой человека. В наиболее предпочтительном воплощении указанный субъект представляет собой новорожденного (то есть в возрасте младше, чем три месяца), младенца (то есть в возрасте от 3 месяцев до одного года) или ребенка, начинающего ходить (то есть в возрасте от одного года до четырех лет).
В одном воплощении раскрытые здесь иммуногенные композиции предназначены для применения в качестве вакцины.
В таком воплощении субъект, подлежащий вакцинации, может находиться в возрасте меньше, чем 1 год. Например, субъект, подлежащий вакцинации, может находиться в возрасте примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11 или примерно 12 месяцев. В одном воплощении субъект, подлежащий вакцинации, находится в возрасте примерно 2, 4 или 6 месяцев. В другом воплощении субъект, подлежащий вакцинации, находится в возрасте меньше, чем 2 года. Например, субъект, подлежащий вакцинации, может находиться в возрасте от примерно 12 до примерно 15 месяцев. В некоторых случаях требуется всего лишь одна доза иммуногенной композиции по изобретению, но при некоторых обстоятельствах может быть дана вторая, третья или четвертая доза (см. раздел 9 ниже).
В одном воплощении настоящего изобретения субъект, подлежащий вакцинации, представляет собой взрослого человека в возрасте 50 лет или старше, более предпочтительно взрослого человека в возрасте 55 лет или старше. В одном воплощении субъект, подлежащий вакцинации, представляет собой взрослого человека в возрасте 65 лет или старше, 70 лет или старше, 75 лет или старше, или 80 лет или старше.
В одном воплощении субъект, подлежащий вакцинации, представляет собой индивида с ослабленным иммунитетом, в частности человека. Индивида с ослабленным иммунитетом обычно определяют как человека, который демонстрирует ослабленную или пониженную способность к формированию нормальной гуморальной или клеточной защиты на заражение инфекционными агентами.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает заболеванием или состоянием, которое ослабляет иммунную систему и приводит к недостаточному антительному ответу для защиты против пневмококковоо заболевания или его лечения.
В одном воплощении указанное заболевание представляет собой первичную иммунонедостаточность. Предпочтительно указанная первичная иммунонедостаточность выбрана из группы, состоящей из объединенных Т- и В-клеточных иммунонедостаточностей, недостаточностей антител, хорошо определенных синдромов, заболеваний, связанных с иммунной дисрегуляцией, фагоцитарных расстройств, расстройств врожденного иммунитета, аутовоспалительных расстройств и недостаточностей комплемента. В одном воплощении указанная первичная иммунонедостаточность выбрана из иммунонедостаточности, раскрытой в интервале от строки 11 на странице 24 до строки 19 на странице 25 WO 2010/125480.
В конкретном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает заболеванием, выбранным из группы, состоящей из HIV-инфекции (вирус иммунодефицита человека), синдрома приобретенного иммунодефицита (AIDS), рака, хронических расстройств сердца или легкого, застойной сердечной недостаточности, сахарного диабета, хронической печеночной недостаточности, алкоголизма, цирроза, утечек цереброспинальной жидкости, кардиомиопатии, хронического бронхита, эмфиземы, хронической обструктивной болезни легких (COPD), дисфункции селезенки (такой как серповидноклеточная анемия), отсутствия функции селезенки (аспления), злокачественного заболевания крови, лейкоза, множественной миеломы, болезни Ходжкина, лимфомы, почечной недостаточности, нефротического синдрома и астмы.
В одном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает от нарушений питания.
В конкретном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, принимает лекарственное средство или лечение, которое уменьшает устойчивость организма к инфекции. В одном воплощении указанное лекарственное средство выбрано из лекарственного средства, раскрытого от строки 33 страницы 26 до строки 4 страницы 26 WO 2010/125480.
В конкретном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, является курильщиком.
В конкретном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, имеет число белых кровяных клеток (число лейкоцитов) меньше 5×109 клеток на литр или меньше 4×109 клеток на литр, или меньше 3×109 клеток на литр, или меньше 2×109 клеток на литр, или меньше 1×109 клеток на литр, или меньше 0,5×109 клеток на литр, или меньше 0,3×109 клеток на литр, или меньше 0,1×109 клеток на литр.
Количество белых кровяных клеток (количество лейкоцитов): число белых кровяных клеток (WBC) в крови. WBC обычно измеряют как часть СВС (полный анализ крови). Белые кровяные клетки представляют собой клетки, борющиеся с инфекцией в крови, и они отличаются от красных (переносящих кислород) клеток крови, известных как эритроциты. Существуют разные типы белых кровяных клеток, включающие нейтрофилы (полиморфоядерные лейкоциты; PMN), палочкоядерные гранулоциты (немного незрелые нейтрофилы), лимфоциты Т-типа (Т-клетки), лимфоциты В-типа (В-клетки), моноциты, эозинофилы и базофилы. Все типы белых кровяных клеток отражают в количестве белых кровяных клеток. Нормальный интервал для количества белых кровяных клеток обычно составляет от 4300 до 10800 клеток на кубический миллиметр крови. Оно также может называться количеством лейкоцитов и может выражаться в международных единицах как 4,3-10,8×109 клеток на литр.
В конкретном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, страдает нейтропенией. В конкретном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, имеет количество нейтрофилов меньше 2×109 клеток на литр или меньше 1×109 клеток на литр, или меньше 0,5×109 клеток на литр, или меньше 0,1×109 клеток на литр, или меньше 0,05×109 клеток на литр.
Низкое количество белых клеток крови или «нейтропения» представляет собой состояние, характеризуемое ненормально низкими уровнями нейтрофилов в циркулирующей крови. Нейтрофилы представляют собой специфический вид белых клеток крови, которые помогают предупреждать инфекции и бороться с инфекциями. Самой обычной причиной того, что раковые пациенты испытывают нейтропению является то, что она представляет собой побочный эффект химиотерапии. Индуцированная химиотерапией нейтропения увеличивает риск инфекции пациента и срывает лечение рака.
В конкретном воплощении настоящего изобретения субъект с ослабленным иммунитетом, подлежащий вакцинации, имеет количество клеток CD4+ меньше 500/мм3 или количество клеток CD4+ меньше 300/мм3, или количество клеток CD4+ меньше 200/мм3, количество клеток CD4+ меньше 100/мм3, количество клеток CD4+ меньше 75/мм3 или количество клеток CD4+ меньше 50/мм3.
Результаты анализов клеток CD4 обычно приводят как число клеток в мм3. Нормальное количество CD4 составляет от 500 до 1600, а количество CD8 - от 375 до 1100. Количество CD4 значительно снижается у людей с HIV.
В одном воплощении изобретения любой субъект с ослабленным иммунитетом, раскрытый здесь, представляет собой человека мужского пола или человека женского пола.
9 Схема
В некоторых случаях нужна всего лишь одна доза иммуногенной композиции согласно изобретению, но при некоторых обстоятельствах, таких как состояния большего иммунодефицита, можно давать вторую, третью или четвертую дозу. После исходной вакцинации субъекты могут получать одну или несколько повторных иммунизаций с адекватным разделением во времени.
В одном воплощении схемой вакцинации иммуногенной композицией по изобретению является одна доза. В конкретном воплощении указанная однодозная схема предназначена для здоровых людей в возрасте по меньшей мере 2 года.
В одном воплощении схемой вакцинации иммуногенной композицией по изобретению является схема с многократными дозами. В конкретном воплощении указанная схема с многократными дозами состоит из серии из 2 доз, разделенных интервалом от примерно 1 месяца до примерно 2 месяцев. В конкретном воплощении указанная схема с многократными дозами состоит из серии из 2 доз, разделенных интервалом примерно 1 месяц, или серии из 2 доз, разделенных интервалом примерно 2 месяца.
В другом воплощении указанная схема с многократными дозами состоит из серии из 3 доз, разделенных интервалом от примерно 1 месяца до примерно 2 месяцев. В другом воплощении указанная схема с многократными дозами состоит из серии из 3 доз, разделенных интервалом примерно 1 месяц, или серии из 3 доз, разделенных интервалом примерно 2 месяца.
В другом воплощении указанная схема с многократными дозами состоит из серии из 3 доз, разделенных интервалом от примерно 1 месяца до примерно 2 месяцев, с последующей четвертой дозой от примерно 10 месяцев до примерно 13 месяцев после первой дозы. В другом воплощении указанная схема с многократными дозами состоит из серии из 3 доз, разделенных интервалом примерно 1 месяц, с последующей четвертой дозой от примерно 10 месяцев до примерно 13 месяцев после первой дозы, или серией из 3 доз, разделенных интервалом примерно 2 месяца, с последующей четвертой дозой от примерно 10 месяцев до примерно 13 месяцев после первой дозы.
В одном воплощении схема с многократными дозами состоит из по меньшей мере одной дозы (например, 1, 2 или 3 доз) в возрасте первого года, с последующей по меньшей мере одной дозой у ребенка, начинающего ходить.
В одном воплощении схема с многократными дозами состоит из серии из 2 или 3 доз, разделенных интервалом от примерно 1 месяца до примерно 2 месяцев (например, 28-56 суток между дозами), начиная с возраста 2 месяца, и с последующей дозой у ребенка, начинающего ходить, в возрасте 12-18 месяцев. В одном воплощении указанная схема со многими дозами состоит из серии из 3 доз, разделенных интервалом от примерно 1 до 2 месяцев (например, 28-56 суток между дозами), начиная с возраста 2 месяца, и с последующей дозой у ребенка, начинающего ходить, в возрасте 12-15 месяцев. В другом воплощении указанная схема с многократными дозами состоит из серии из 2 доз, разделенных интервалом от примерно 2 месяцев, начиная с возраста 2 месяца, и с последующей дозой у ребенка, начинающего ходить, в возрасте 12-18 месяцев.
В одном воплощении схема с многократными дозами состоит из серии из 4 доз вакцины в возрасте 2, 4, 6 и 12-15 месяцев.
В одном воплощении примирующую дозу дают в сутки 0, и одну или более чем одну бустерную дозу дают с интервалами, которые варьируют от примерно 2 до примерно 24 недель, предпочтительно с интервалом дозирования 4-8 недель.
В одном воплощении примирующую дозу дают в сутки 0, и бустерную дозу дают примерно через 3 месяца.
10 Набор и способ
В одном воплощении изобретение направлено на набор, содержащий раскрытую здесь иммуногенную композицию и информационный листок.
В одном воплощении в указанном информационном листке упоминается способность композиции вызывать выработку функциональных антител против S. pneumoniae серотипов 9А, 9L и/или 9N.
В одном воплощении в указанном информационном листке упоминается способность композиции вызывать выработку функциональных антител против S. pneumoniae серотипа 9N.
В одном воплощении в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипов 9А, 9L и/или 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции.
В одном воплощении в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипа 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции.
В одном воплощении в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипов 9А, 9L и/или 9N в человеческой популяции.
В одном воплощении в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипа 9N в человеческой популяции.
В одном воплощении изобретение направлено на способ получения набора, содержащего иммуногенную композицию и информационный листок, где указанный способ включает стадию:
- получения иммуногенной композиции по настоящему изобретению и
- объединения в одном и том же наборе указанной иммуногенной композиции и информационного листка, где в указанном информационном листке упоминается способность указанной композиции вызывать выработку функциональных антител против S. pneumoniae серотипов 9А, 9L и/или 9N.
В одном воплощении изобретение направлено на способ получения набора, содержащего иммуногенную композицию и информационный листок, где указанный способ включает стадию:
- получения иммуногенной композиции по настоящему изобретению и
- объединения в одном и том же наборе указанной иммуногенной композиции и информационного листка, где в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипов 9А, 9L и/или 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции.
В одном воплощении изобретение направлено на способ получения набора, содержащего иммуногенную композицию и информационный листок, где указанный способ включает стадию:
- получения иммуногенной композиции по настоящему изобретению и
- объединения в одном и том же наборе указанной иммуногенной композиции и информационного листка, где в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипов 9А, 9L и/или 9N в человеческой популяции.
В одном воплощении изобретение направлено на способ получения набора, содержащего иммуногенную композицию и информационный листок, где указанный способ включает стадию:
- получения иммуногенной композиции по настоящему изобретению;
- печати информационного листка, где в указанном информационном листке упоминается способность указанной композиции вызывать выработку функциональных антител против S. pneumoniae серотипов 9А, 9L и/или 9N;
- объединения в одном и том же наборе указанной иммуногенной композиции и указанного информационного листка.
В одном воплощении изобретение направлено на способ получения набора, содержащего иммуногенную композицию и информационный листок, где указанный способ включает стадию:
- получения иммуногенной композиции по настоящему изобретению;
- печати информационного листка, где в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипов 9А, 9L и/или 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции;
- объединения в одном и том же наборе указанной иммуногенной композиции и указанного информационного листка.
В одном воплощении изобретение направлено на способ получения набора, содержащего иммуногенную композицию и информационный листок, где указанный способ включает стадию:
- получения иммуногенной композиции по настоящему изобретению;
- печати информационного листка, где в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипов 9А, 9L и/или 9N в человеческой популяции;
- объединения в одном и том же наборе указанной иммуногенной композиции и указанного информационного листка.
11 Способы
В одном воплощении изобретение направлено на способ, включающий стадию:
- инъецирования субъекту иммунологически эффективного количества иммуногенных композиции, определенных в настоящем документе;
- отбора образца сыворотки от указанного субъекта;
- тестирования указанного образца сыворотки на предмет опсонофагоцитарной активности уничтожения против S. pneumoniae серотипа 9N посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
В одном воплощении изобретение направлено на способ, включающий стадию:
- инъецирования субъекту иммунологически эффективного количества любой из иммуногенных композиций, определенных в настоящем документе;
- отбора образца сыворотки от указанного субъекта;
- тестирования указанного образца сыворотки на предмет опсонофагоцитарной активности уничтожения против S. pneumoniae серотипа 9А посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
В одном воплощении изобретение направлено на способ, включающий стадию:
- инъецирования субъекту иммунологически эффективного количества любой из иммуногенных композиций, определенных в настоящем документе;
- отбора образца сыворотки от указанного субъекта;
- тестирования указанного образца сыворотки на предмет опсонофагоцитарной активности уничтожения против S. pneumoniae серотипа 9L посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
В одном воплощении изобретение направлено на способ, включающий стадию:
- инъецирования субъекту иммунологически эффективного количества любой из иммуногенных композиций, определенных в настоящем документе;
- отбора образца сыворотки от указанного субъекта;
- тестирования указанного образца сыворотки на предмет опсонофагоцитарной активности уничтожения против S. pneumoniae серотипов 9N, 9А и/или 9L посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
Конкретные воплощения изобретения изложены в следующих пронумерованных пунктах:
1. Иммуногенная композиция, содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 9V для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N, 9А и/или 9L.
2. Иммуногенная композиция по п. 1, которая не содержит капсульный сахарид из S. pneumoniae серотипа 9N.
3. Иммуногенная композиция по любому из пп. 1-2, которая не содержит капсульный сахарид из S. pneumoniae серотипа 9А.
4. Иммуногенная композиция по любому из пп. 1-3, которая не содержит капсульный сахарид из S. pneumoniae серотипа 9L.
5. Иммуногенная композиция по п. 1, которая не содержит капсульный сахарид из S. pneumoniae серотипов 9N, 9А и 9L.
6. Иммуногенная композиция по любому из пп. 1-5, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 4.
7. Иммуногенная композиция по любому из пп. 1-6, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 6В.
8. Иммуногенная композиция по любому из пп. 1-7, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 14.
9. Иммуногенная композиция по любому из пп. 1-8, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 18С.
10. Иммуногенная композиция по любому из пп. 1-9, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 19F.
11. Иммуногенная композиция по любому из пп. 1-10, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 23F.
12. Иммуногенная композиция по любому из пп. 1-5, дополнительно содержащая гликоконъюгаты из S. pneumoniae серотипов 4, 6В, 14, 18С, 19F и 23F.
13. Иммуногенная композиция по любому из пп. 1-12, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 1.
14. Иммуногенная композиция по любому из пп. 1-13, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 5.
15. Иммуногенная композиция по любому из пп. 1-14, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 7F.
16. Иммуногенная композиция по любому из пп. 1-15, дополнительно содержащая гликоконъюгаты из S. pneumoniae серотипов 1, 5 и 7F.
17. Иммуногенная композиция по любому из пп. 1-16, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 6А.
18. Иммуногенная композиция по любому из пп. 1-17, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 19А.
19. Иммуногенная композиция по любому из пп. 1-15, дополнительно содержащая гликоконъюгаты из S. pneumoniae серотипов 6А и 19А.
20. Иммуногенная композиция по любому из пп. 1-19, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 3.
21. Иммуногенная композиция по любому из пп. 1-20, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 15В.
22. Иммуногенная композиция по любому из пп. 1-21, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 22F.
23. Иммуногенная композиция по любому из пп. 1-22, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 33F.
24. Иммуногенная композиция по любому из пп. 1-23, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 12F.
25. Иммуногенная композиция по любому из пп. 1-24, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 10А.
26. Иммуногенная композиция по любому из пп. 1-25, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 11А.
27. Иммуногенная композиция по любому из пп. 1-26, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 8.
28. Иммуногенная композиция по любому из пп. 1-20, дополнительно содержащая гликоконъюгаты из S. pneumoniae серотипов 22F и 33F.
29. Иммуногенная композиция по любому из пп. 1-20, дополнительно содержащая гликоконъюгаты из S. pneumoniae серотипов 15В, 22F и 33F.
30. Иммуногенная композиция по любому из пп. 1-23, дополнительно содержащая гликоконъюгаты из S. pneumoniae серотипов 12F, 10А, 11А и 8.
31. Иммуногенная композиция по любому из пп. 1-30, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 2.
32. Иммуногенная композиция по любому из пп. 1-31, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 17F.
33. Иммуногенная композиция по любому из пп. 1-32, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 20.
34. Иммуногенная композиция по любому из пп. 1-30, дополнительно содержащая гликоконъюгаты из S. pneumoniae серотипов 2, 17F и 20.
35. Иммуногенная композиция по любому из пп. 1-34, дополнительно содержащая по меньшей мере один гликоконъюгат из S. pneumoniae серотипа 15С.
36. Иммуногенная композиция по любому из пп. 1-35, которая представляет собой 7-, 8-, 9-, 10-, 11-, 12-, 13-, 14-, 15-, 16-, 17-, 18-, 19-, 20-, 21-, 22-, 23- или 24-валентную пневмококковую конъюгатную композицию.
37. Иммуногенная композиция по любому из пп. 1-35, которая представляет собой 14-, 15-, 16-, 17-, 18-, 19- или 20-валентную пневмококковую конъюгатную композицию.
38. Иммуногенная композиция по любому из пп. 1-35, которая представляет собой 16-валентную пневмококковую конъюгатную композицию.
39. Иммуногенная композиция по любому из пп. 1-35, которая представляет собой 20-валентную пневмококковую конъюгатную композицию.
40. Иммуногенная композиция по любому из пп. 1-39, в которой указанные гликоконъюгаты индивидуально конъюгированы с CRM197.
41. Иммуногенная композиция по любому из пп. 1-39, где все гликоконъюгаты индивидуально конъюгированы с CRM197.
42. Иммуногенная композиция по любому из пп. 1-39, где гликоконъюгаты из S. pneumoniae серотипов 1, 4, 5, 6В, 7F, 9V, 14 и/или 23F индивидуально конъюгированы с PD.
43. Иммуногенная композиция по любому из пп. 9-39 или 42, где гликоконъюгат из S. pneumoniae серотипа 18С конъюгирован с ТТ.
44. Иммуногенная композиция по любому из пп. 10-39 или 42-43, в которой гликоконъюгат из S. pneumoniae серотипа 19F конъюгирован с DT.
45. Иммуногенная композиция по любому из пп. 1-44, где указанные гликоконъюгаты получают с использованием химии CDAP.
46. Иммуногенная композиция по любому из пп. 1-44, где указанные гликоконъюгаты получают посредством восстановительного аминирования.
47. Иммуногенная композиция по любому из пп. 1-44, где указанный гликоконъюгат из S. pneumoniae серотипа 6А получают посредством восстановительного аминирования.
48. Иммуногенная композиция по любому из пп. 1-44 или 47, где указанный гликоконъюгат из S. pneumoniae серотипа 19А получают посредством восстановительного аминирования.
49. Иммуногенная композиция по любому из пп. 1-44 или 47-48, где указанный гликоконъюгат из S. pneumoniae серотипа 3 получают посредством восстановительного аминирования.
50. Иммуногенная композиция по любому из пп. 1-49, дополнительно содержащая антигены из других патогенов.
51. Иммуногенная композиция по любому из пп. 1-49, дополнительно содержащая антигены, выбранные из следующих: дифтерийный анатоксин (D), столбнячный анатоксин (Т), коклюшный антиген (Р), который типично является бесклеточным (Ра), поверхностный антиген вируса гепатита В (HBV) (HBsAg), антиген вируса гепатита A (HAV), конъюгированный капсульный сахарид Haemophilus influenzae типа b (Hib), инактивированная вакцина на основе полиовируса (IPV).
52. Иммуногенная композиция по любому из пп. 1-51, дополнительно содержащая по меньшей мере один адъювант, наиболее предпочтительно любой из раскрытых здесь адъювантов.
53. Иммуногенная композиция по любому из пп. 1-51, дополнительно содержащая по меньшей мере один адъювант, выбранный из группы, состоящей из фосфата алюминия, сульфата алюминия и гидроксида алюминия.
54. Иммуногенная композиция по любому из пп. 1-51, содержащая от 0,1 мг/мл до 1 мг/мл элемента алюминия в форме фосфата алюминия в качестве адъюванта.
55. Иммуногенная композиция по любому из пп. 1-54, которая способна вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом серотипа 9N S. pneumoniae в концентрации по меньшей мере 0,35 мкг/мл при определении посредством анализа ELISA.
56. Иммуногенная композиция по любому из пп. 1-55, которая способна вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом серотипа 9А S. pneumoniae в концентрации по меньшей мере 0,35 мкг/мл при определении посредством анализа ELISA.
57. Иммуногенная композиция по любому из пп. 1-56, которая способна вызывать у человека выработку антител IgG, которые способны к связыванию с полисахаридом серотипа 9L S. pneumoniae в концентрации по меньшей мере 0,35 мкг/мл при определении посредством анализа ELISA.
58. Иммуногенная композиция по любому из пп. 1-57, которая способна вызывать у человека выработку функциональных антител, которые способны уничтожать S. pneumoniae серотипа 9N, 9А и/или 9L при определении посредством опсонофагоцитарного анализа in vitro (ОРА).
59. Иммуногенная композиция по любому из пп. 1-58, которая способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9N по меньшей мере у 50% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
60. Иммуногенная композиция по любому из пп. 1-59, которая способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9А по меньшей мере у 50% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
61. Иммуногенная композиция по любому из пп. 1-60, которая способна вызывать титр по меньшей мере 1:8 против S. pneumoniae серотипа 9L по меньшей мере у 50% субъектов при определении посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
62. Иммуногенная композиция по любому из пп. 1-61, которая способна значительно увеличивать долю респондеров против S. pneumoniae серотипа 9N по сравнению с популяцией до иммунизации.
63. Иммуногенная композиция по любому из пп. 1-62, которая способна значительно увеличивать долю респондеров против S. pneumoniae серотипа 9А по сравнению с популяцией до иммунизации.
64. Иммуногенная композиция по любому из пп. 1-63, которая способна значительно увеличивать долю респондеров против S. pneumoniae серотипа 9L по сравнению с популяцией до иммунизации.
65. Иммуногенная композиция по любому из пп. 1-64, которая способна значительно увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипа 9N по сравнению с популяцией до иммунизации.
66. Иммуногенная композиция по любому из пп. 1-65, которая способна значительно увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипа 9А по сравнению с популяцией до иммунизации.
67. Иммуногенная композиция по любому из пп. 1-66, которая способна значительно увеличивать титры ОРА субъектов-людей против S. pneumoniae серотипа 9L по сравнению с популяцией до иммунизации.
68. Иммуногенная композиция по любому из пп. 1-67 для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N.
69. Иммуногенная композиция по любому из пп. 1-67 для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9А.
70. Иммуногенная композиция по любому из пп. 1-67 для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9L.
71. Иммуногенная композиция по любому из пп. 1-67 для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N и 9А.
72. Иммуногенная композиция по любому из пп. 1-67 для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N и 9L.
73. Иммуногенная композиция по любому из пп. 1-67 для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9А и 9L.
74. Иммуногенная композиция по любому из пп. 1-67 для применения в способе иммунизации субъекта против инфекции S. pneumoniae серотипа 9N, 9А и 9L.
75. Иммуногенная композиция по любому из пп. 1-67 для применения в способе предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванного у субъекта S. pneumoniae серотипов 9N, 9А и/или 9L.
76. Иммуногенная композиция по любому из пп. 1-67 для применения для предупреждения у субъекта инфекции S. pneumoniae серотипов 9N, 9А и/или 9L.
77. Иммуногенная композиция по любому из пп. 1-67 для применения в способе защиты или лечения человека, чувствительного к инфекции S. pneumoniae серотипов 9N, 9А и/или 9L, посредством введения указанных иммуногенных композиций через системный путь или путь через слизистую.
78. Способ предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, ассоциированных у субъекта с S. pneumoniae серотипов 9N, 9А и/или 9L, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по любому из пп. 1-67.
79. Способ предупреждения у субъекта инфекции S. pneumoniae серотипов 9N, 9А и/или 9L, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по любому из пп. 1-67.
80. Иммуногенная композиция по любому из пп. 1-67, где указанный субъект представляет собой человека в возрасте меньше чем 1 год.
81. Иммуногенная композиция по любому из пп. 1-67, где указанный субъект представляет собой человека в возрасте меньше, чем 2 года.
82. Иммуногенная композиция по любому из пп. 1-67, где указанный субъект представляет собой взрослого человека в возрасте 50 лет или старше.
83. Иммуногенная композиция по любому из пп. 1-82 для применения в схеме вакцинации с многократными дозами.
84. Набор, содержащий раскрытую здесь иммуногенную композицию и информационный листок.
85. Набор, содержащий иммуногенную композицию по любому из пп. 1-67 и информационный листок.
86. Набор по п. 85 или 86, где в указанном информационном листке упоминается способность композиции вызывать выработку функциональных антител против S. pneumoniae серотипов 9А, 9L и/или 9N.
87. Набор по п. 85 или 86, где в указанном информационном листке упоминается способность композиции вызывать выработку функциональных антител против S. pneumoniae серотипа 9N.
88. Набор по п. 85 или 86, где в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипов 9А, 9L и/или 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции.
89. Набор по п. 85 или 86, где в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипа 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции.
90. Набор по любому из пп. 85-89, где в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипов 9А, 9L и/или 9N в человеческой популяции.
91. Набор по любому из пп. 85-89, где в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипа 9N в человеческой популяции.
92. Способ получения набора, содержащего иммуногенную композицию и информационный листок, включающий стадию:
- получения иммуногенной композиции по любому из пп. 1-67 и
- объединения в одном и том же наборе указанной иммуногенной композиции и информационного листка, где в указанном информационном листке упоминается способность указанной композиции вызывать выработку функциональных антител против S. pneumoniae серотипов 9А, 9L и/или 9N.
93. Способ получения набора, содержащего иммуногенную композицию и информационный листок, включающий стадию:
- получения иммуногенной композиции по любому из пп. 1-67 и
- объединения в одном и том же наборе указанной иммуногенной композиции и информационного листка, где в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипов 9А, 9L и/или 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции.
94. Способ получения набора, содержащего иммуногенную композицию и информационный листок, включающий стадию:
- получения иммуногенной композиции по любому из пп. 1-67 и
- объединения в одном и том же наборе указанной иммуногенной композиции и информационного листка, где в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипов 9А, 9L и/или 9N в человеческой популяции.
95. Способ получения набора, содержащего иммуногенную композицию и информационный листок, включающий стадию:
- получения иммуногенной композиции по любому из пп. 1-67;
- печати информационного листка, где в указанном информационном листке упоминается способность указанной композиции вызывать выработку функциональных антител против S. pneumoniae серотипов 9А, 9L и/или 9N;
- объединения в одном и том же наборе указанной иммуногенной композиции и указанного информационного листка.
96. Способ получения набора, содержащего иммуногенную композицию и информационный листок, включающий стадию:
- получения иммуногенной композиции по любому из пп. 1-67;
- печати информационного листка, где в указанном информационном листке упоминается способность композиции вызывать выработку антикапсульных антител против S. pneumoniae серотипов 9А, 9L и/или 9N в концентрации, большей или равной 0,35 мкг/мл, в человеческой популяции;
- объединения в одном и том же наборе указанной иммуногенной композиции и указанного информационного листка.
97. Способ получения набора, содержащего иммуногенную композицию и информационный листок, включающий стадию:
- получения иммуногенной композиции по любому из пп. 1-67;
- печати информационного листка, где в указанном информационном листке упоминается способность композиции вызывать титры ОРА против S. pneumoniae серотипов 9А, 9L и/или 9N в человеческой популяции;
- объединения в одном и том же наборе указанной иммуногенной композиции и указанного информационного листка.
98. Способ, включающий стадию:
- инъецирования субъекту иммунологически эффективного количества иммуногенной композиции, определенной в любом из пп. 1-67;
- отбора образца сыворотки от указанного субъекта;
- тестирования указанного образца сыворотки на предмет опсонофагоцитарной активности уничтожения против S. pneumoniae серотипа 9N, 9А и/или 9L посредством анализа опсонофагоцитарного уничтожения in vitro (ОРА).
99. Способ индуцирования иммунного ответа на S. pneumoniae серотипов 9N, 9А и/или 9L у субъекта, включающий введение субъекту иммунологически эффективного количества иммуногенной композиции по любому из пп. 1-67.
100. Применение иммуногенной композиции по любому из пп. 1-67 для изготовления лекарственного средства для иммунизации субъекта против инфекции S. pneumoniae серотипа 9N, 9А и/или 9L.
101. Применение иммуногенной композиции по любому из пп. 1-67 для изготовления лекарственного средства для предупреждения, лечения или уменьшения интенсивности инфекции, заболевания или состояния, вызванных S. pneumoniae серотипов 9N, 9А и/или 9L у субъекта.
102. Применение иммуногенной композиции по любому из пп. 1-67 для изготовления лекарственного средства для предупреждения инфекции серотипами 9N, 9А и/или 9L S. pneumoniae у субъекта.
Термин «примерно» в том виде, в котором он здесь используется, означает нахождение в пределах статистически значимого интервала значения, такого как заявленный интервал концентраций, временные рамки, молекулярная масса, температура или рН. Такой интервал может находиться в пределах одного порядка значений, типично в пределах 20%, более типично в пределах 10% и даже более типично в пределах 5%о или в пределах 1% данного значения или интервала. Иногда такой интервал может находиться в пределах экспериментальной ошибки, типичной для стандартных способов, используемых для измерения и/или определения данного значения или интервала. Допустимая вариация, охватываемая термином «примерно», будет зависеть от конкретной исследуемой системы и может быть легко оценена обычным специалистом в данной области. Всякий раз, когда в пределах данной заявки перечислен интервал, каждое целое число в пределах данного интервала также рассматривается как воплощение данного изобретения.
Авторами изобретения подразумевается то, что термины «содержащий», «содержать» и «содержит» являются здесь в каждом случае возможно заменимыми терминами «состоящий из», «состоят из» и «состоит из» соответственно.
Все ссылки или патентные заявки, процитированные в данном описании изобретения патента влючены сюда посредством ссылки.
Изобретение проиллюстрировано в сопровождающих примерах. Приведенные ниже примеры осуществлены с использованием стандартных методик, которые являются хорошо известыми и обычными для специалистов в данной области, за исключением тех случаев, когда подробно описано иное. Данные примеры являются иллюстративными, но не ограничивают изобретение.
ПРИМЕРЫ
Пример 1. Оценка перекрестно реагирующих опсонофагоцитарных иммунных ответов в пределах серогруппы 9 Streptococcus pneumoniae
Пневмококковый опсонофагоцитарны анализ (ОРА), в котором измеряют уничтожение клеток S. pneumoniae фагоцитарными эффекторными клетками в присутствии функционального антитела и комплемента, считается важным заменителем для оценки эффективности пневмококковых вакцин.
Материалы и методы
Два случайным образом отобранных поднабора иммунных сывороток от взрослых, вакцинированных 13-валентной пневмококковой конъюгатной вакциной (13vPnC), тестировали в анализах ОРА в отношении серотипов 9V, 9А, 9L и 9N. Сыворотки отбирали из клинических испытаний США 6115А1-004 (N равно 59, после вакцинации) и 6115А1-3005 (N равно 66, соответствующие до и после вакцинации) соответственно.
Исследование 6115А1-3005 (идентификатор ClinicalTrials.gov: NCT00546572) представляло собой рандомизированное, активно контролируемое, модифицированное, двойное слепое испытание фазы 3, оценивающее безопасность, переносимость и иммуногенность ПРЕВНАР 13® по сравнению с 23-валентной пневмококковой полисахаридной вакциной (23vPS) у амбулаторных пожилых индивидов в возрасте 70 лет и старше, которые получали 1 дозу 23vPS по меньшей мере за 5 лет до включения в исследование (см. http://clinicaltrials.gov/ct2/show/NCT00546572, доступ к которому осуществлялся 31 марта 2014 г. ).
Исследование 6115А1-004 (идентификатор ClinicalTrials.gov: NCT00427895) представляло собой рандомизированное, активно контролируемое, модифицированное, двойное слепое испытание фазы 3, оценивающее безопасность, переносимость и иммуногенность 13-валентной пневмококковой конъюгатной вакцины (13vPnC) по сравнению с 23-валентной пневмококковой полисахаридной вакциной (23vPS) у взрослых в возрасте от 60 до 64 лет, которые являются «наивными» в отношении 23vPS, и исследование безопасности, переносимости и иммуногенности 13vPnC у взрослых в возрасте от 18 до 59 лет, которые являются «наивными» в отношении 23vPS (см. http://clinicaltrials.gov/show/NCT00427895, доступ к которому осуществлялся 31 марта 2014 г. ).
13-валентная пневмококковая конъюгатная вакцина (13vPnC), тестируемая в данных исследованиях, содержала конъюгаты из пневмококковых серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, индивидуально конъюгированные с белком-носителем дифтерийным перекрестно реагирующим веществом 197 (CRM197).
ОРА используют для измерения функциональных антител против S. pneumoniae серотипов 9V, 9N, 9А и/или 9L в человеческих сыворотках. Опытную сыворотку помещают в реакции анализа, в котором измеряют способность иммуноглобулина, специфичного к капсульному полисахариду, опсонизировать бактерии, запускать отложение комплемента, облегчая посредством этого фагоцитоз и уничтожение бактерий посредством фагоцитов. Титр ОРА определяют как обратное разведение, которое приводит к 50%-ному уменьшению числа бактерий по сравнению с контрольными лунками без опытной сыворотки. Титр ОРА интерполируют из двух разведений, которые охватывают этот 50%-ный порог уничтожения.
Методики ОРА были основаны на способах, описанных в Hu et al., (2005) Clin Diagn Lab Immunol 12: 287-295. Опытную инактивированную нагреванием сыворотку серийно разводили в 2,5 раза и добавляли совместно с бактериями-мишенями на планшеты для анализа, и инкубировали в течение 30 минут при встряхивании. Затем добавляли в лунки дифференцированные клетки HL-60 (фагоциты) и сыворотку детеныша кролика (в возрасте от 3 до 4 недель, PEL-FREEZ®, Арканзас, конечная концентрация 12,5%) с приблизительным отношением эффектора к мишени 200:1 и инкубировали при 37°С при встряхивании. Для завершения реакции во все лунки добавляли 80 мкл 0,9% NaCl, перемешивали, и 10 мкл аликвоту переносили в лунки фильтровальных планшетов MULTISCREEN® HTS HV (MILLIPORE®), содержащие 200 мкл воды. Жидкость фильтровали через планшеты под вакуумом, и в каждую лунку добавляли 150 мкл среды HYSOY® и осуществляли фильтрование через нее. Фильтровальные планшеты затем инкубировали при 37°С, 5% CO2, в течение ночи и затем фиксировали обесцвечивающим раствором (Bio-Rad Laboratories, Inc., Hercules, CA). В данных планшетах затем проводили окрашивание кумасси синим и обесцвечивание один раз. Колонии визуализировали и подсчитывали на анализаторе Cellular Technology Limited (CTL) (Shaker Heights, OH) IMMUNOSPOT®. Титр ОРА антитела определяли как обратное значение наименьшего разведения сыворотки, приводящего к 50%-ному уменьшению числа бактериальных колоний по сравнению с контрольными лунками с бактерией-эффекторной клеткой-комплементом, которые не содержали сыворотку.
Статистический анализ: рассчитывали двухсторонние корреляции Пирсона.
Результаты - ответы ОРА в 9V, 9А, 9L и 9N
Перекрестно-функциональный ответ от иммунных сывороток взрослых, иммунизированных 13vPnC, против серотипов 9А, 9L и 9N оценивали в соответствующих микроколониальных опсонофагоцитарных анализах (mcOPA), наряду с гомологичным функциональным ответом на серотип 9V. Тестировали два случайным образом выбранных поднабора иммунных сывороток от взрослых, вакцинированных 13vPnC. Данные сыворотки отбирали из клинических испытаний США 6115А1-004 (N равно 59, после вакцинации) и 6115А1-3005 (N равно 66, соответствующие до и после вакцинации) соответственно.
Субъекты в исследовании 6115А1-004 были ранее «наивными» в отношении любой пневмококковой вакцинации и получали одиночную дозу 13vPnC в качестве части протокола исследования. Иммунная сыворотка из исследования 6115А1-004 демонстрирует аналогичную процентную долю респондеров в отношении всех серогрупп со значениями 98,3%, 98,3%, 100% и 93,2% для 9V, 9А, 9L и 9N соответственно (Фиг. 1), поддерживая результаты из 6115А1-3005 (Фиг. 2). Относительно хорошие корреляции титра ОРА наблюдали между серотипами 9V и 9А (корреляция по Пирсону, ρ равно 0,5456, р меньше 0,0001) или 9L (ρ равно 0,7353, р меньше 0,0001), но не с 9N (ρ равно 0,1217, р меньше 0,3627).
Субъекты в исследовании 6115А1-3005 ранее получали 1 дозу 23vPS по меньшей мере за 5 лет до включения в исследование и получали одиночную дозу 13vPnC в качестве части протокола исследования. Набор соответствующих сывороток до и после вакцинации (N равно 66) от взрослых, иммунизированных 13vPnC (исследование 6115А1-3005) оценивали на ОРА в отношении гомологичного ответа на серотип 9V и в отношении перекрестной реактивности антител против 9V на серотипы 9А, 9L и 9N. Как показано на Фиг. 2, относительно высокий иммунитет (процентная доля респондеров) на 9А (84%), 9А (66%), 9L (82%) и 9N (86%) был выявлен в анализе ОРА, вероятно, из-за их предыдущей иммунизации 23vPS, которая включает неконъюгированные полисахариды из серотипов 9V и 9N. Однако процентная доля респондеров увеличивалась до 95% или более для всех четырех серотипов после вакцинации 13vPnC, которая содержит только конъюгат серотипа 9V из серогруппы 9. Кратность увеличения значений титра продемонстрирована в Таблице 1 и является аналогичной между серотипами, также свидетельствуя о перекрестной реактивности.
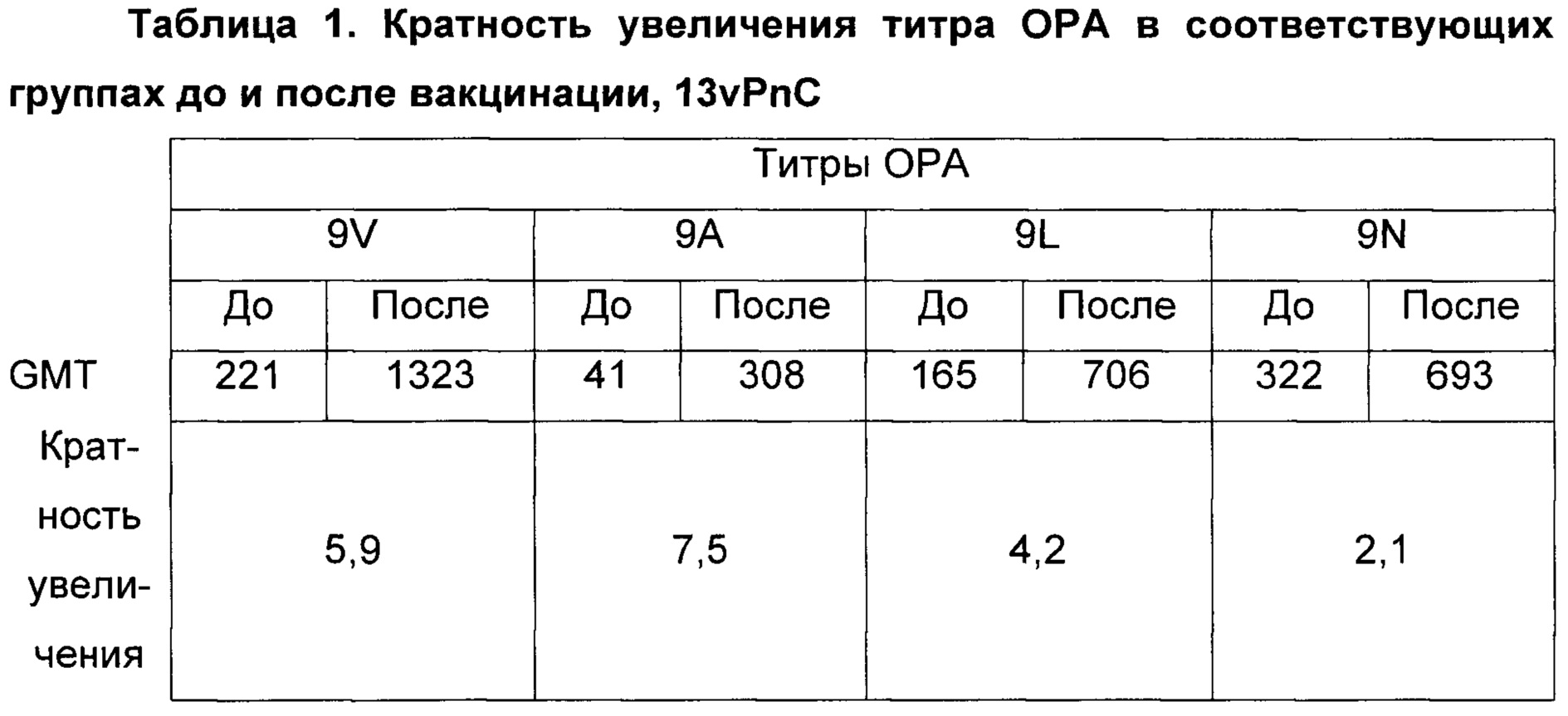
Более всеохватывающий анализ распределения титров ОРА показан на кривых обратного интегрального распределения (RCDC) на Фиг. 3-6. RCDC демонстрируют увеличение специфичного для серотипа иммунного ответа после вакцинации для серотипов 9V, 9А, 9L и, в меньшей степени, 9N. Корреляцию кратности увеличения титра индивидуальных соответствующих / образцов между 9V, 9А, 9V/9L и 9V/9N также анализировали с использованием корреляции Пирсона. Относительно хорошие корреляции кратностей увеличения титров наблюдали между серотипами 9V и 9А (корреляция Пирсона, ρ равно 0,8720, р меньше 0,0001) или 9N (ρ равно 0,5801, р меньше 0,0001), но в меньшей степени с 9L (ρ равно 0,1804, р меньше 0,1640).
Заключение
На основании этих данных, вакцина 13vPnC вероятно обеспечивает более широкое покрытие серотипов посредством педоставления дополнительной защиты против серотипов 9А, 9L и 9N.
Пример 2. Дополнительная оценка перекрестно реагирующих опсонофагоцитарных иммунных ответов в пределах серогруппы 9 Streptococcus pneumoniae
Способность индуцированных 13vPnC антител, специфичных к серотипу 9V, функционально перекрестно реагировать с бактериями из серотипов 9А, 9L и 9N (то есть умерщвлять бактерии в ОРА на серотипы 9А, 9L и 9N) дополнительно оценивали в сыворотке из третьего клинического исследования.
Материалы и методы
Случайным образом отобранные поднаборы иммунных сывороток от взрослых, вакцинированных 13-валентной пневмококковой конъюгатной вакциной (13vPnC), тестировали в анализах ОРА в отношении серотипов 9V, 9А, 9L и 9N. Сыворотки отбирали из сыворотки до и после вакцинации из японского клинического исследования на взрослых В1851088 (идентификатор ClinicalTrials.gov: NCT01646398).
Исследование В1851088 представляло собой рандомизированное, модифицированное, двойное слепое активно контролируемое, испытание фазы 3, оценивающее безопасность, переносимость и иммуногенность 13-валентной пневмококковой конъюгатной вакцины у пожилых взрослых японцев в возрасте 65 лет и старше, которые являются «наивными» в отношении пневмококковой вакцины (см. https://clinicaltrials.gov/ct2/show/NCT01646398, доступ к которому осуществлялся 30 ноября 2015 г.).
13-валентная пневмококковая конъюгатная вакцина (13vPnC), тестируемая в данных исследованиях, содержала конъюгаты из пневмококковых серотипов 1, 3, 4, 5, 6А, 6В, 7F, 9V, 14, 18С, 19А, 19F и 23F, индивидуально конъюгированные с белком-носителем дифтерийным перекрестно реагирующим веществом 197 (CRM197).
ОРА и статистический анализ проводили, как описано в Примере 1.
Результаты - ответы ОРА в 9V, 9А, 9L и 9N
Субъекты в исследовании В1851088 ранее не были вакцинированы пневмококковыми вакцинами и получали одну дозу либо 13vPnC, либо 23vPS (23-валентная пневмококковая полисахаридная вакцина, состоящая из смеси очищенных капсульных полисахаридов из типов 1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19F, 19А, 20, 22F, 23F и 33F) в качестве части протокола исследования. Перекрестно функциональный ответ на серотипы 9А, 9L и 9N в иммунных сыворотках от взрослых японцев, иммунизированных 13vPnC или 23vPS, оценивали в соответствующих ОРА на серогруппу 9.
Поднабор сывороток до и после иммунизации от взрослых, вакцинированных 13vPnC или 23vPS, тестировали в анализах ОРА для серотипов 9А, 9L и 9N. Титры ОРА на 9V были получены из описанных клинических данных. Сыворотки отбирали из ветви 13vPnC (N равно 91, соответствующие до и после вакцинации) и ветви 23vPS (N равно 83, соответствующие до и после вакцинации) японского клинического испытания В1851088. Выбирали сыворотки от субъектов, титры ОРА которых до вакцинации были низкими или негативными относительно 9V из описанных клинических данных. Все субъекты из В1851088 не подвергались предварительному воздействию вакцины 23vPS.
У субъектов до вакцинации наблюдали относительно низкий исходный титр ОРА в отношении серогруппы 9. После вакцинации либо 13vPnC, либо 23vPS ответы ОРА на серогруппу 9 возрастали до высоких показателей положительных ответов: 100%, 98%, 92% и 96% для 9V, 9А, 9L и 9N соответственно от субъектов, вакцинированных 13vPnC, и 100%, 88%, 94% и 100% для 9V, 9А, 9L и 9N соответственно от субъектов, вакцинированных 23vPS (Фиг. 7 и Фиг. 8).
В то время как 13vPnC содержит только полисахарид серотипа 9V из серогруппы 9, 23vPS содержит полисахариды как из 9V, так и из 9N. Следовательно, ответы на серотип 9N являются гомологичными после вакцинации 23vPS и гетерологичными (перекрестная реакция от серотипа 9V) после вакцинации 13vPnC.
GMT ОРА на серогруппу 9 после вакцинации являются высокими для всех серотипов серогруппы 9, независимо от полученной вакцины (Фиг. 9). Фиг. 10- Фиг. 15 демонстрируют кривые обратного интегрального распределения для ответов ОРА на серогруппу 9 в отношении вакцинации либо 13vPnC, либо 23vPS.
Функциональные перекрестно реагирующие ответы ОРА на серогруппу 9 оценивали в образцах сыворотки из трех исследований пневмококковой вакцины (6115А1-004, 6155А1-3005 (пример 1) и В1851088 (пример 2)). Неожиданно, иммунный ответ на серотип 9V, индуцированный 13vPnC, в разной степени перекрестно реагировал со всеми гетерологичными серотипами в пределах серогруппы 9 (9А, 9L и 9N). На основе этих данных вакцина 13vPnC должна обеспечивать дополнительную защиту против серотипов 9А, 9L и 9N в дополнение к ожидаемой защите против серотипа 9V.
Все публикации и патентные заявки, упомянутые в данном описании изобретения, ориентированы на уровень специалистов в области, к которой относится данное изобретение. Все публикации и патентные заявки являются тем самым включенными посредством ссылки в той же самой степени, как если бы каждая индивидуальная публикация или патентная заявка была конкретно и индивидуально указана как включенная посредством ссылки.
Хотя приведенное выше изобретение и было описано с некоторыми подробностями посредством иллюстрации и примера в целях ясности понимания, в пределах объема приложенной формулы изобретения могут практиковаться определенные изменения и модификации.