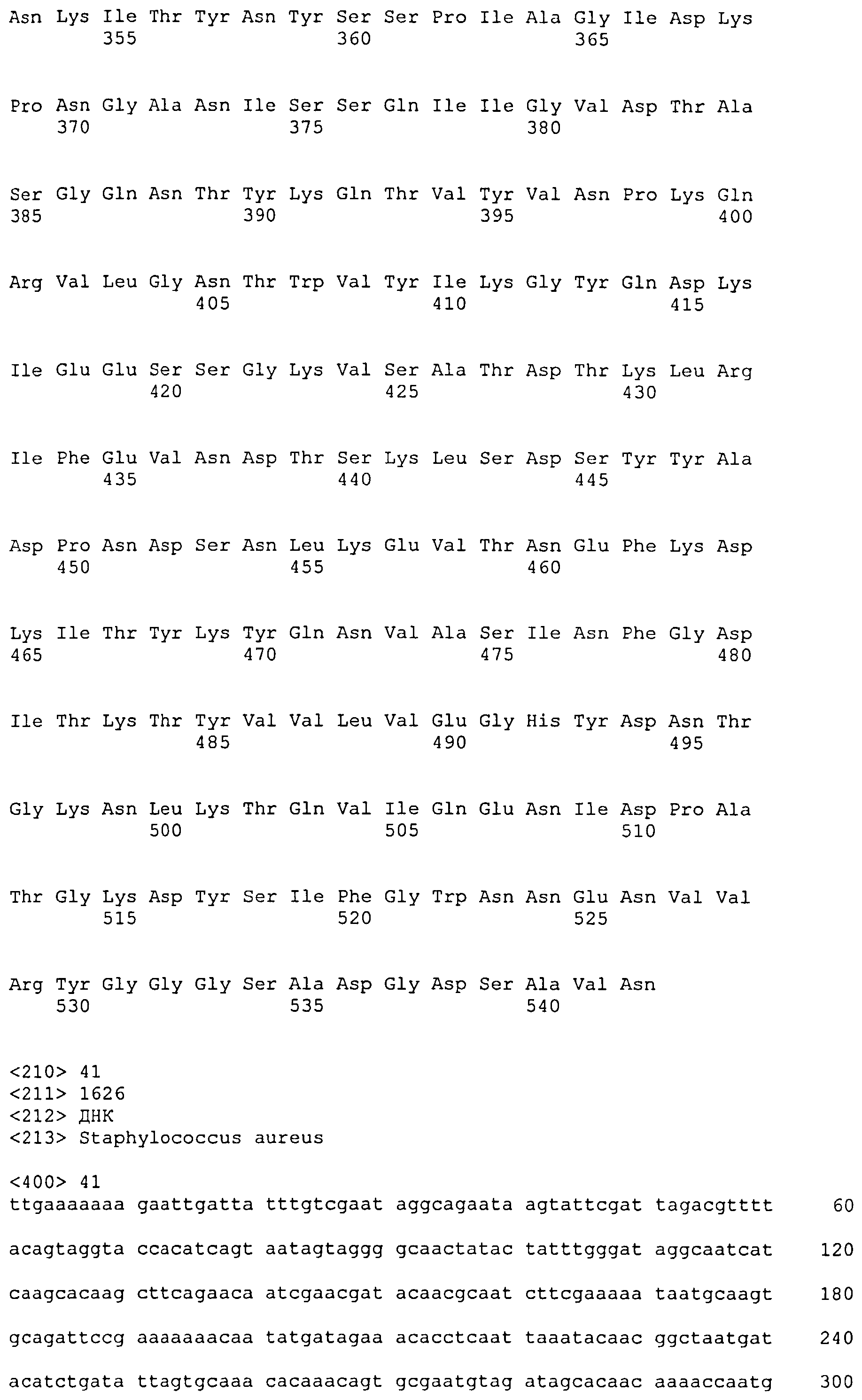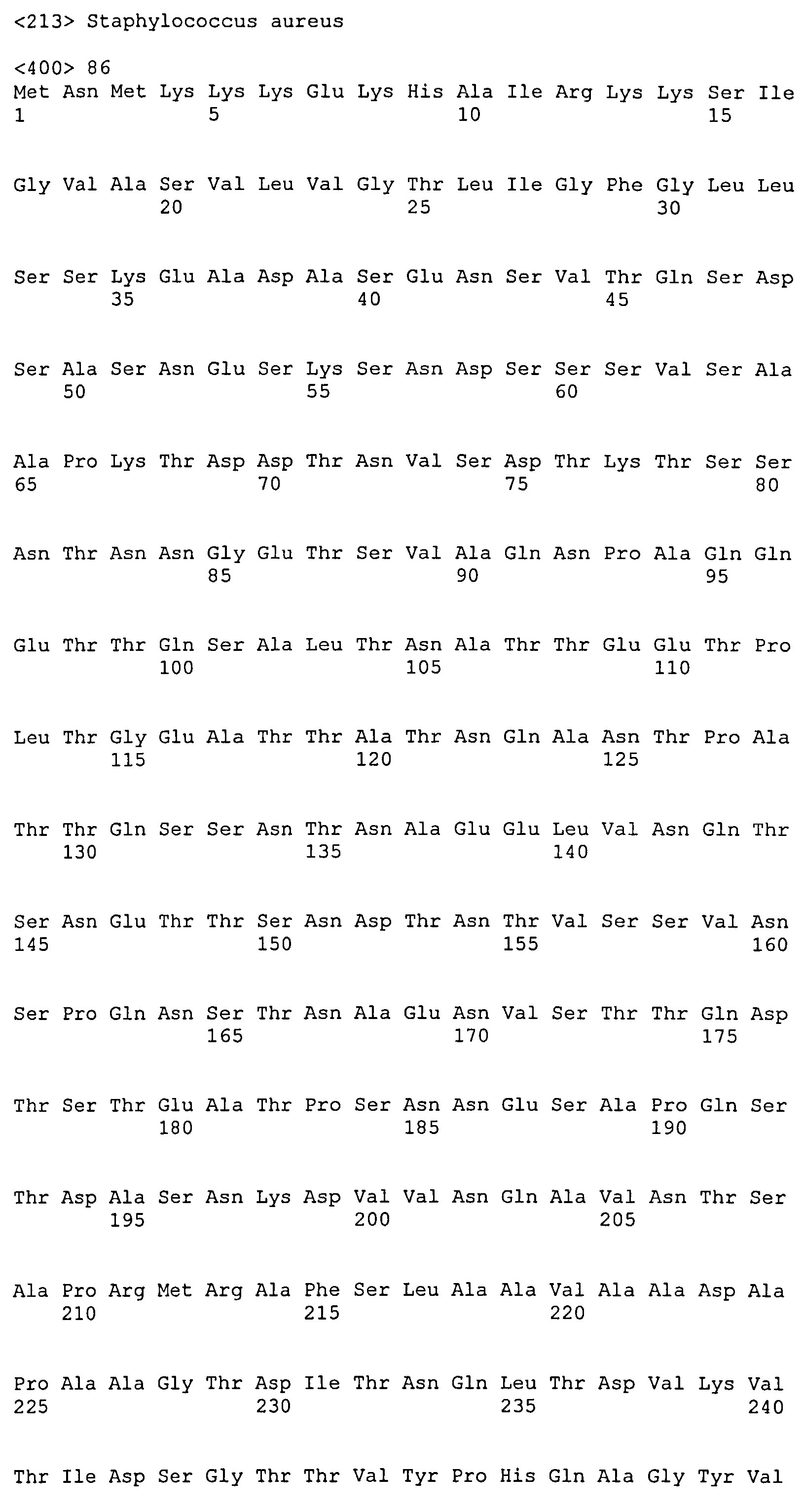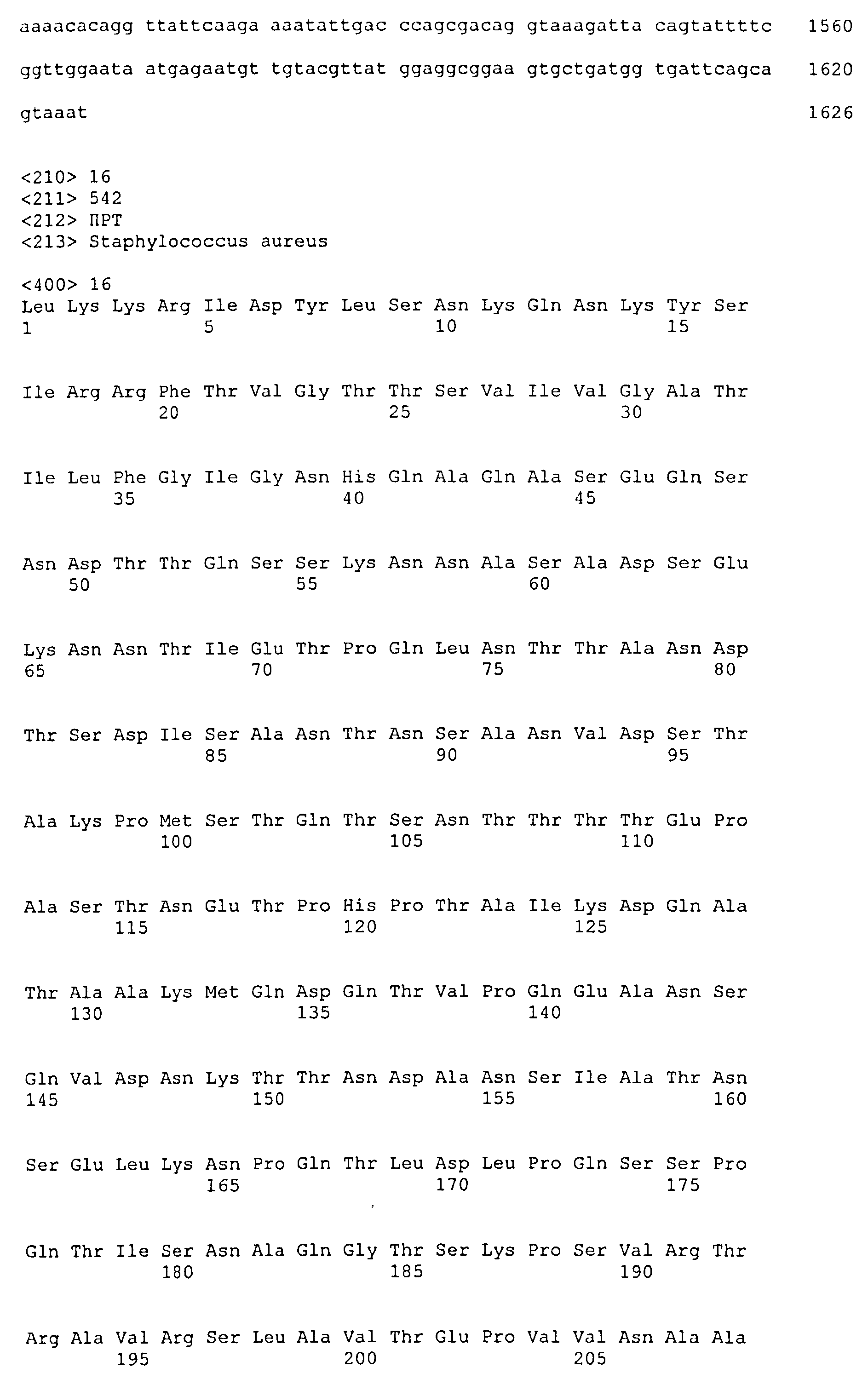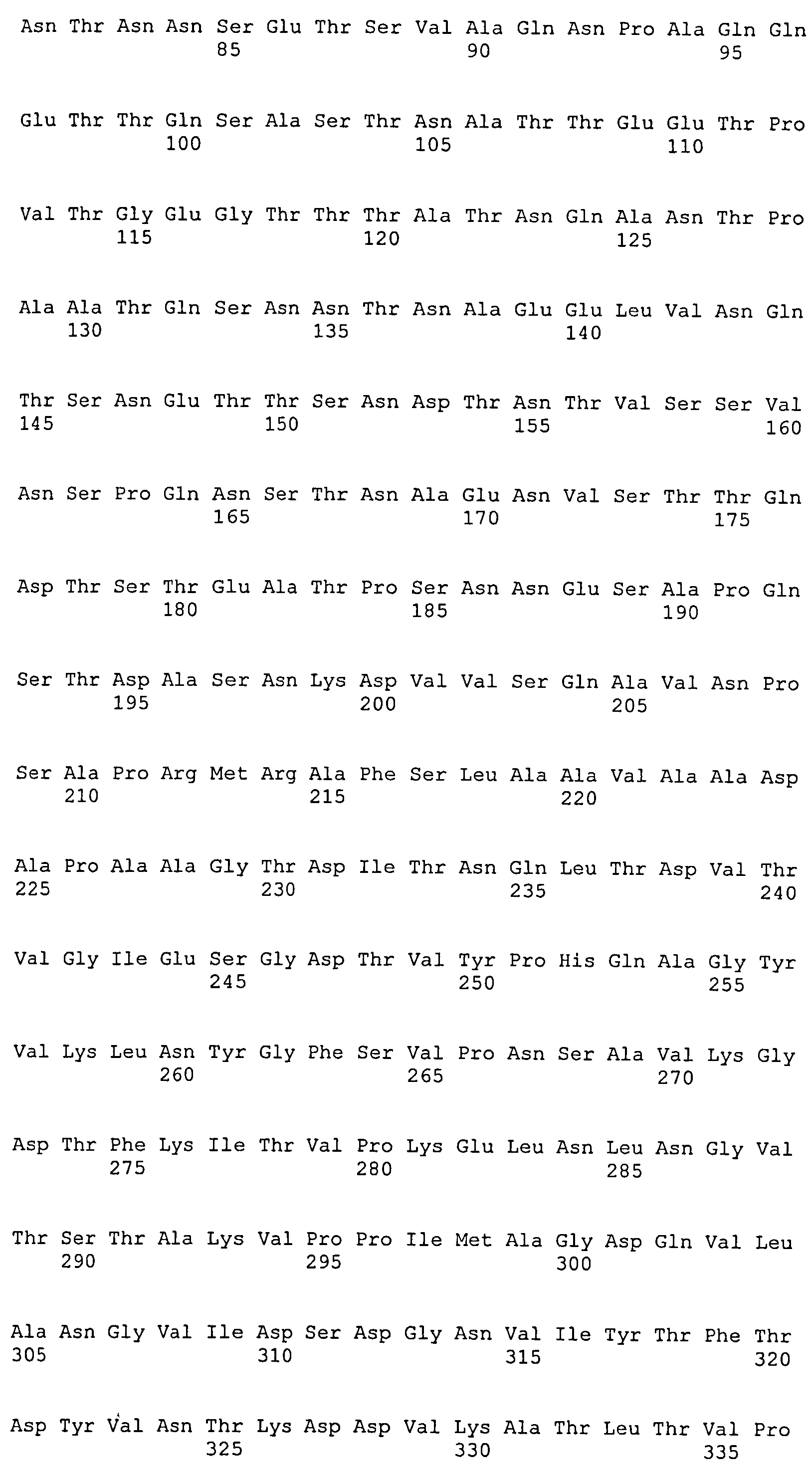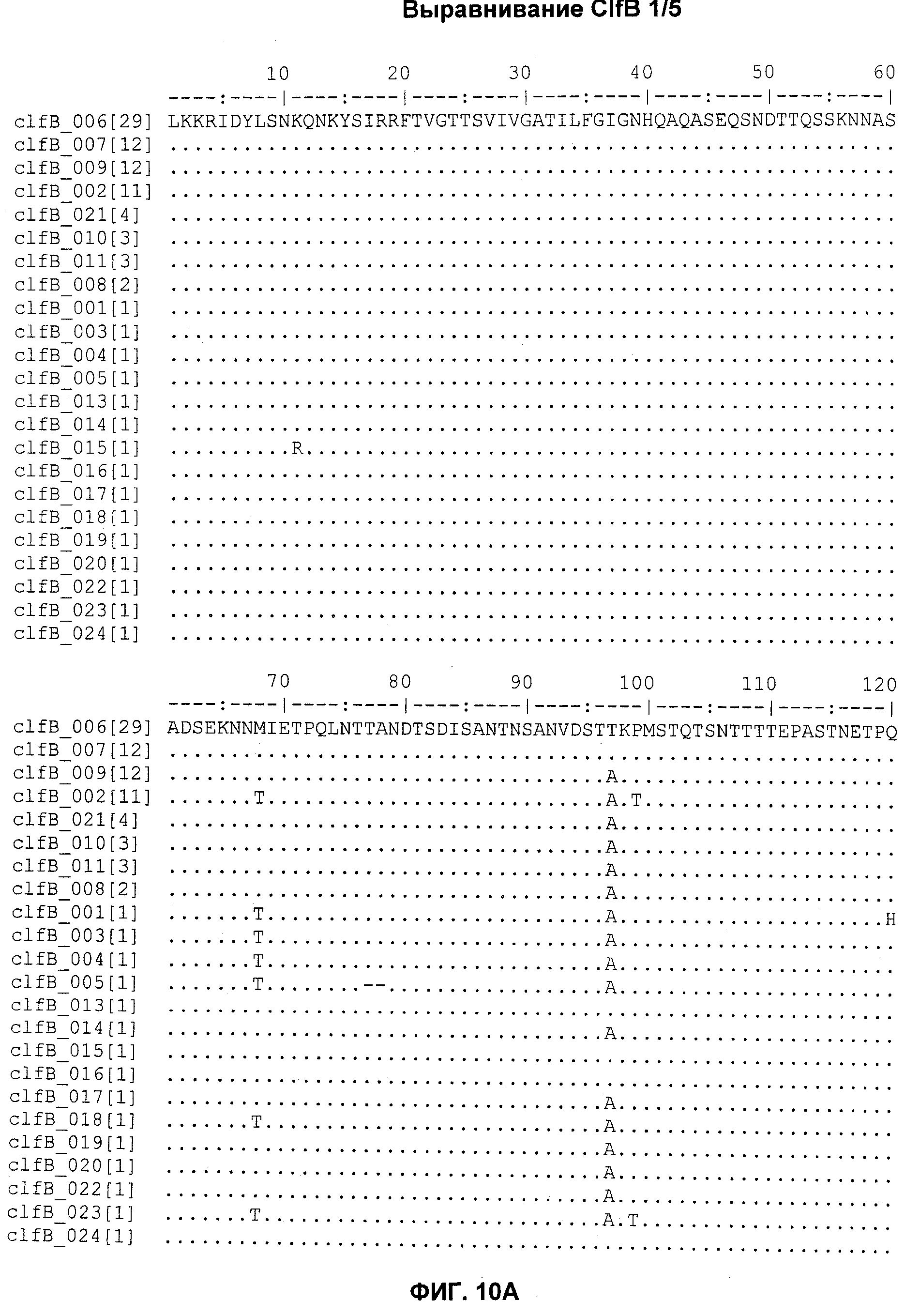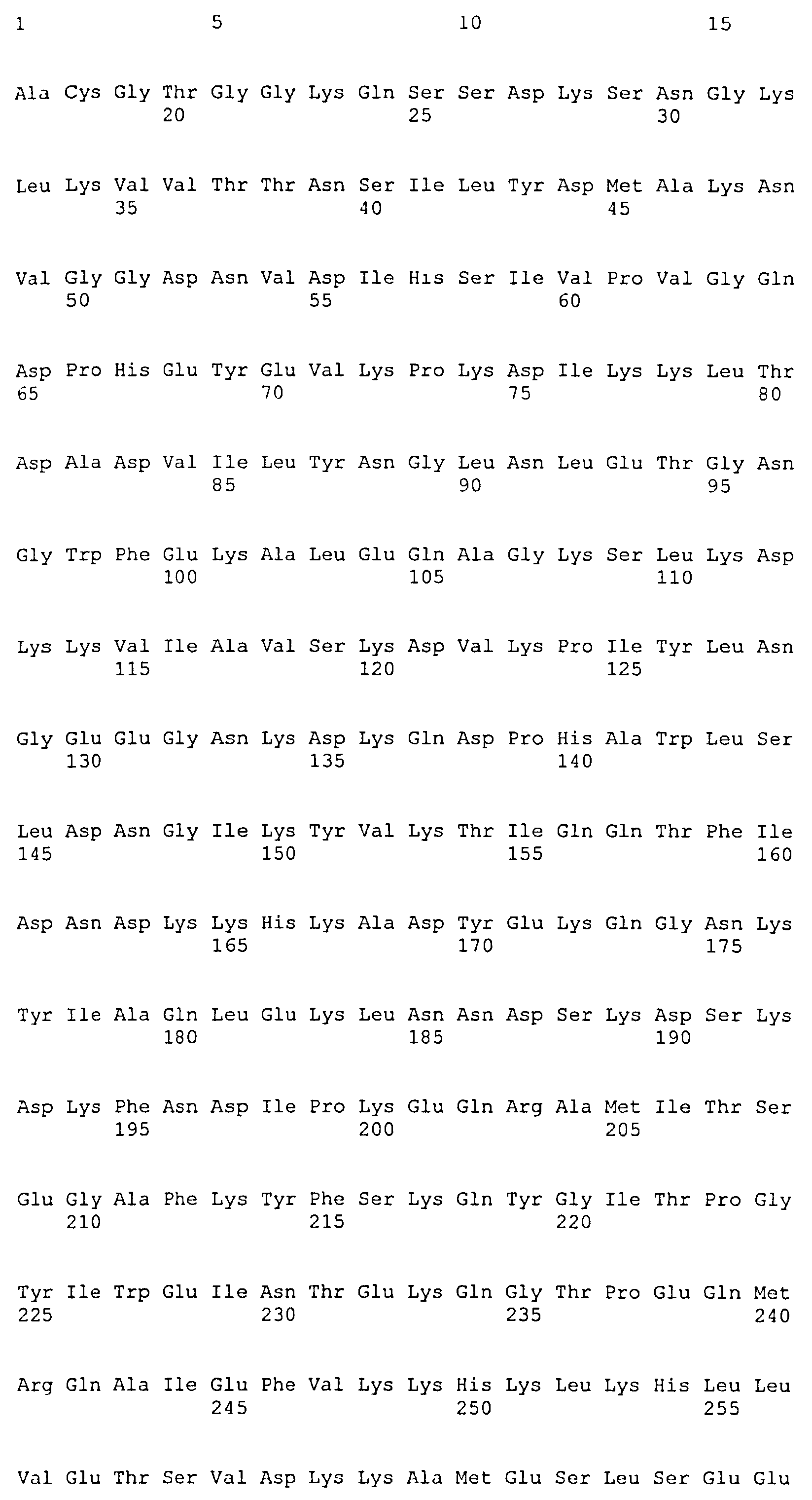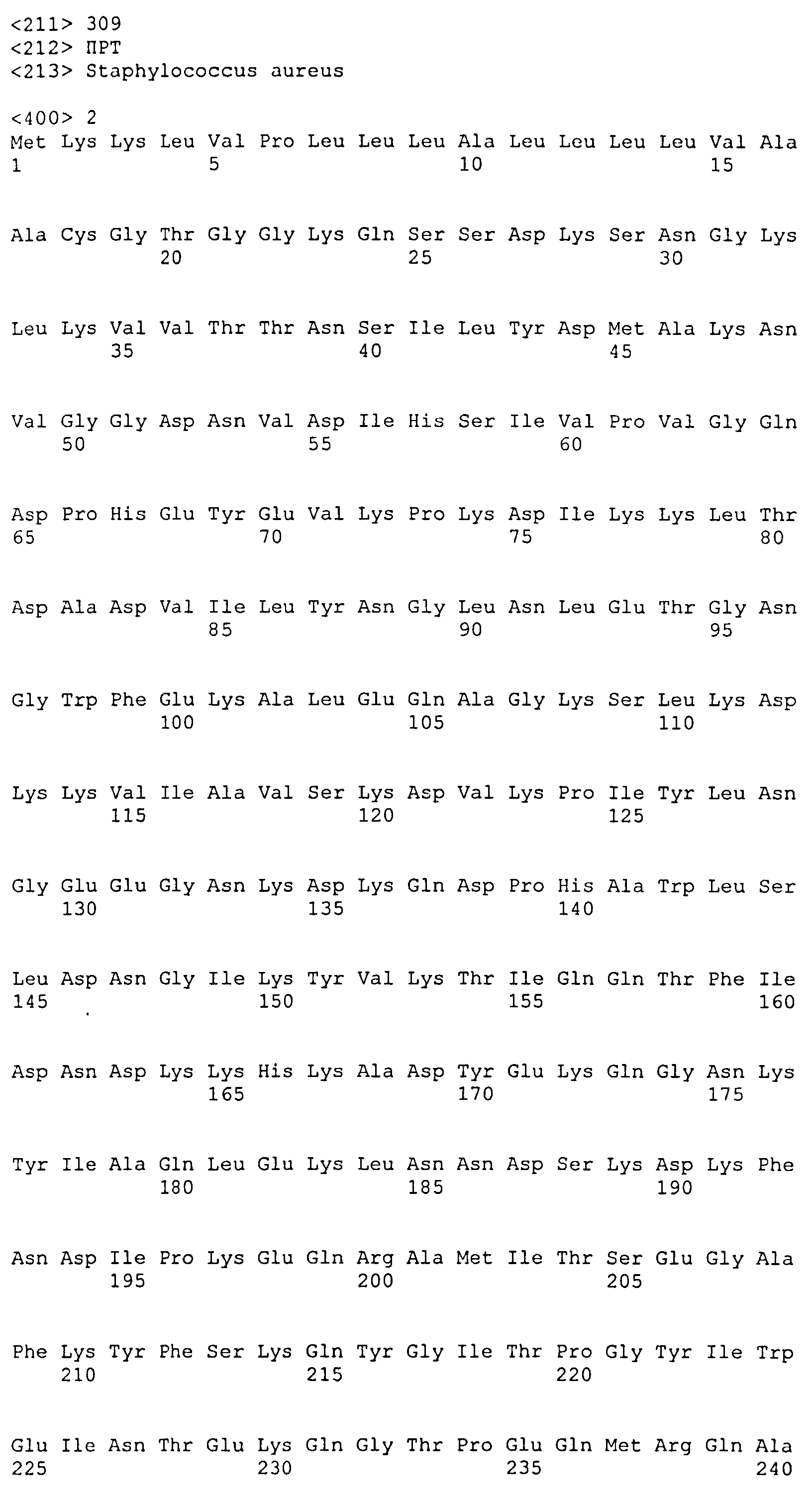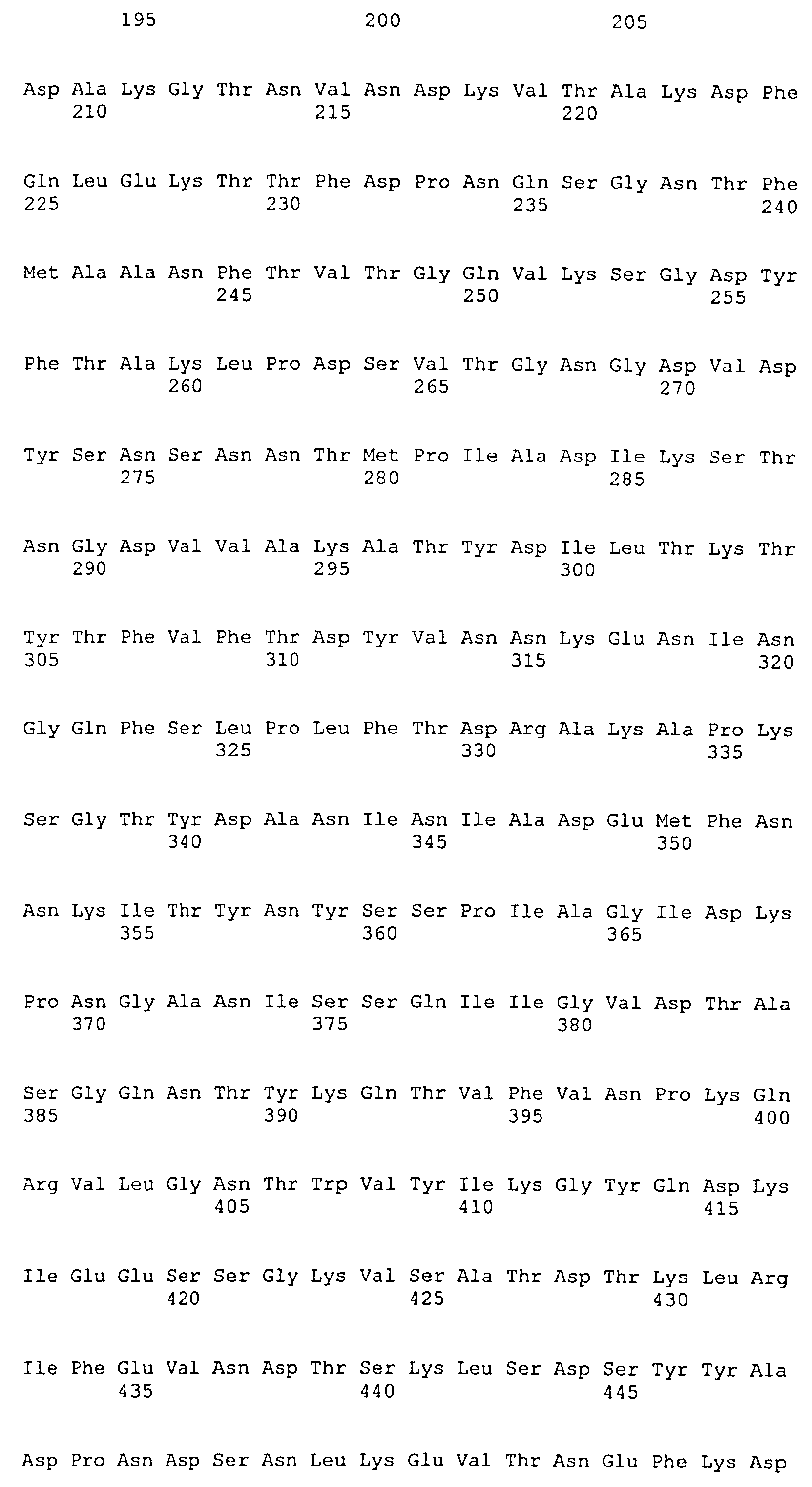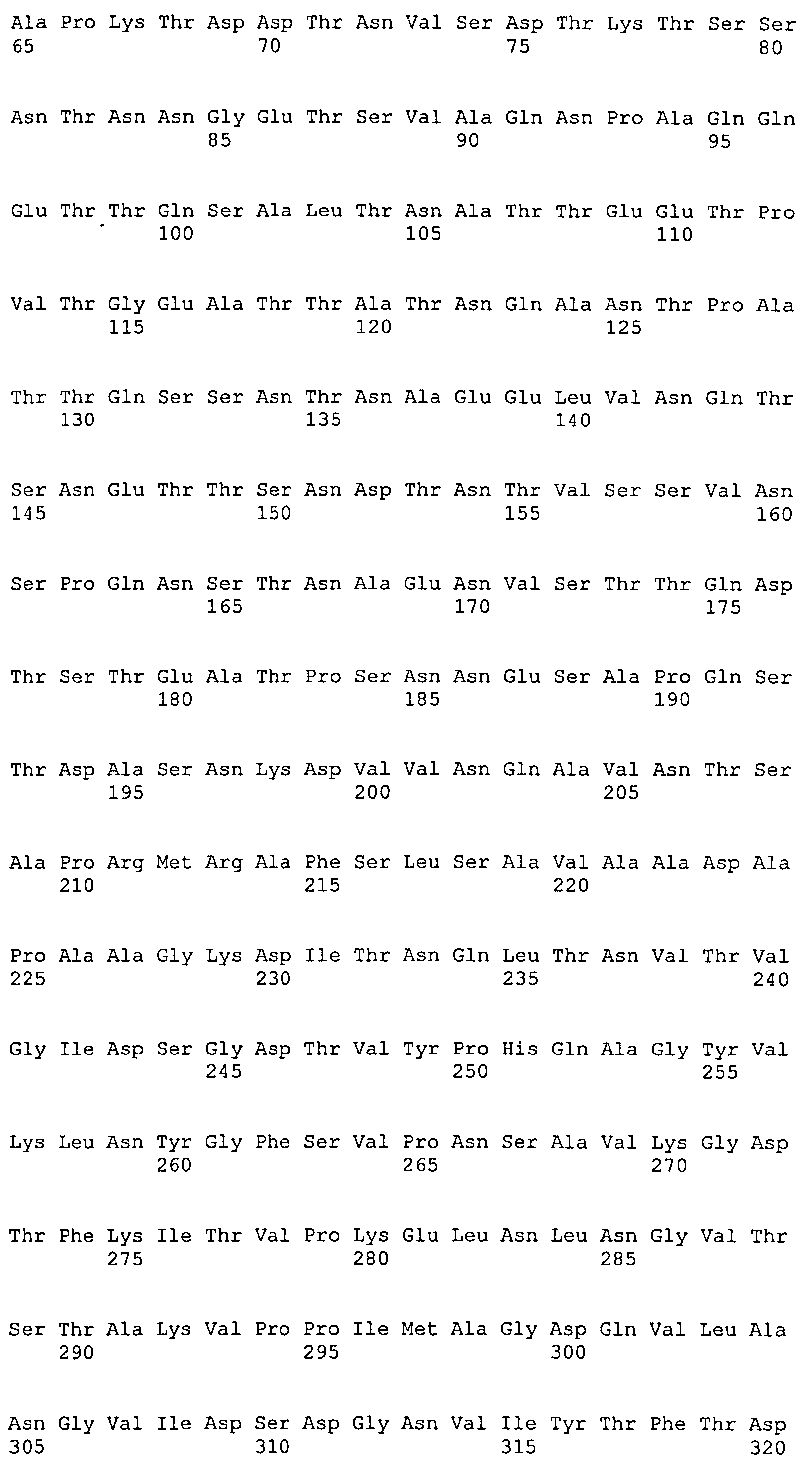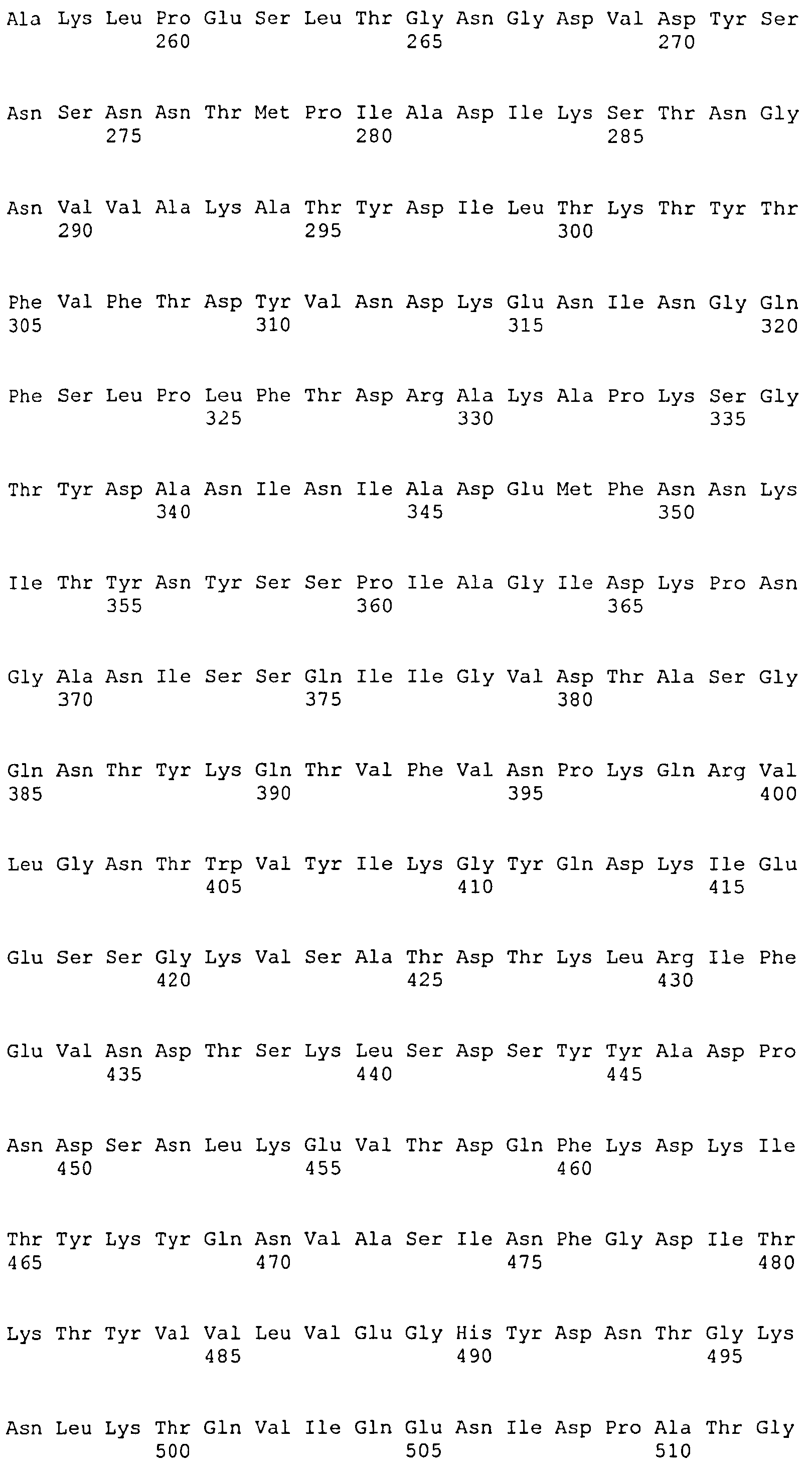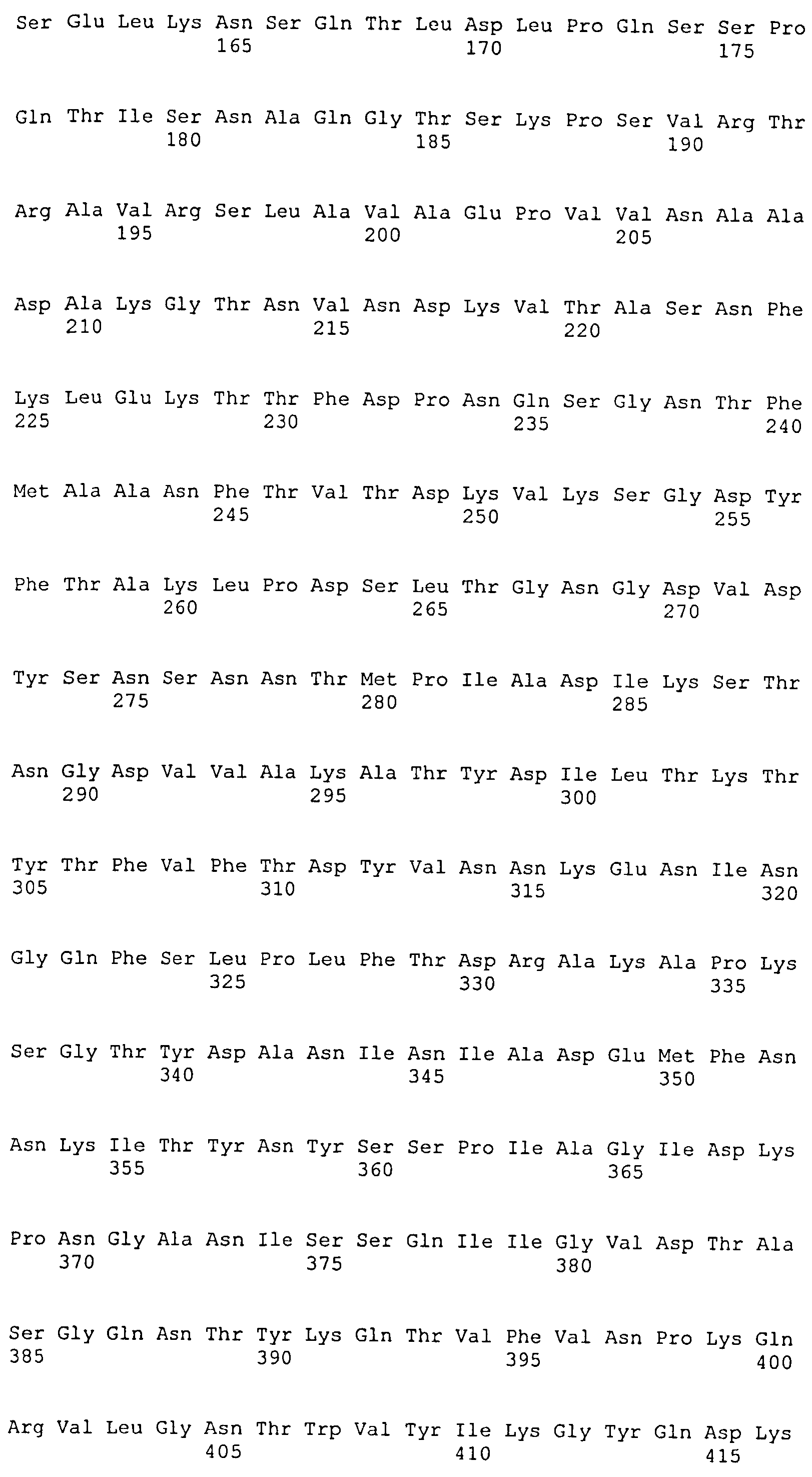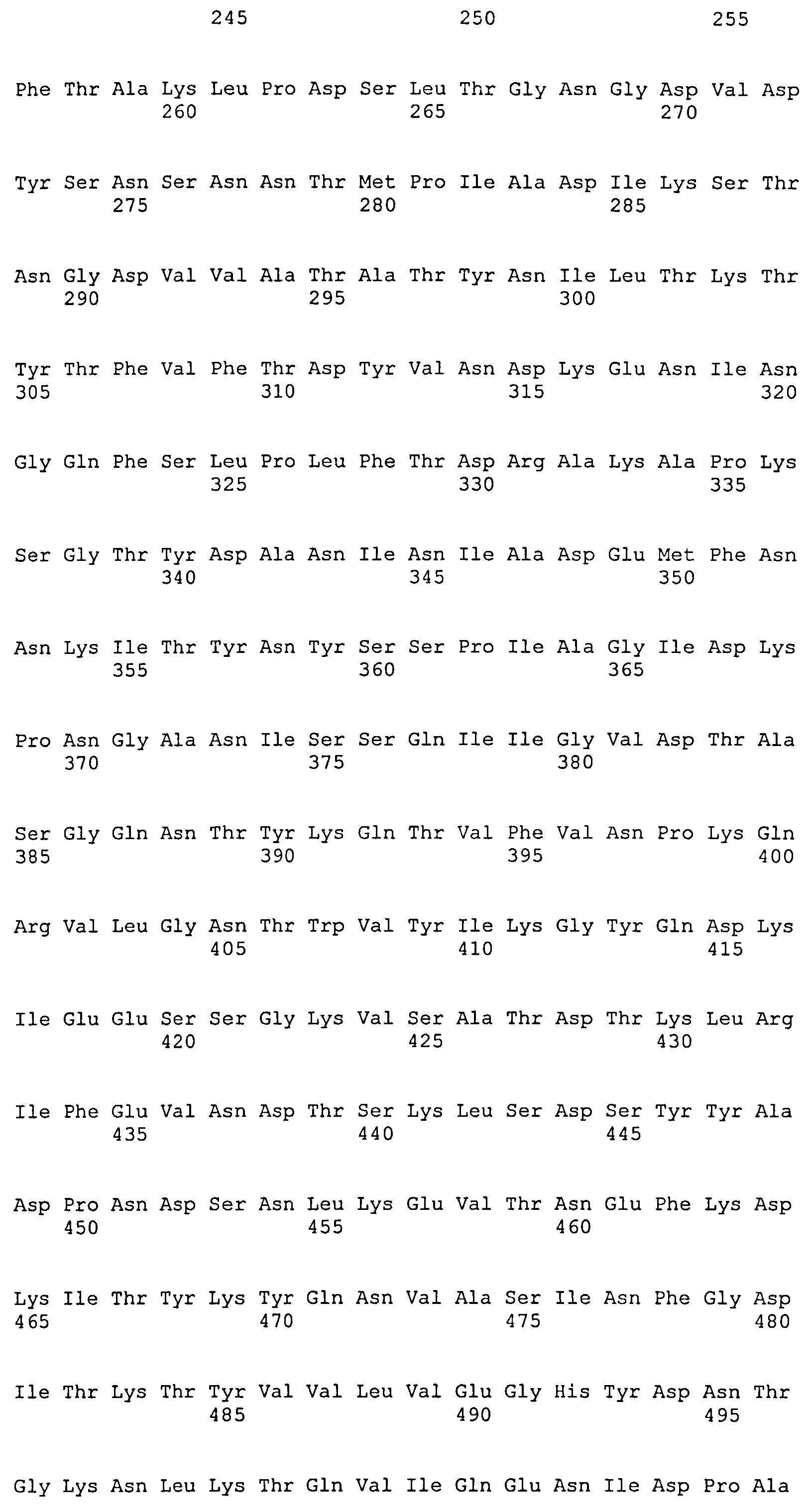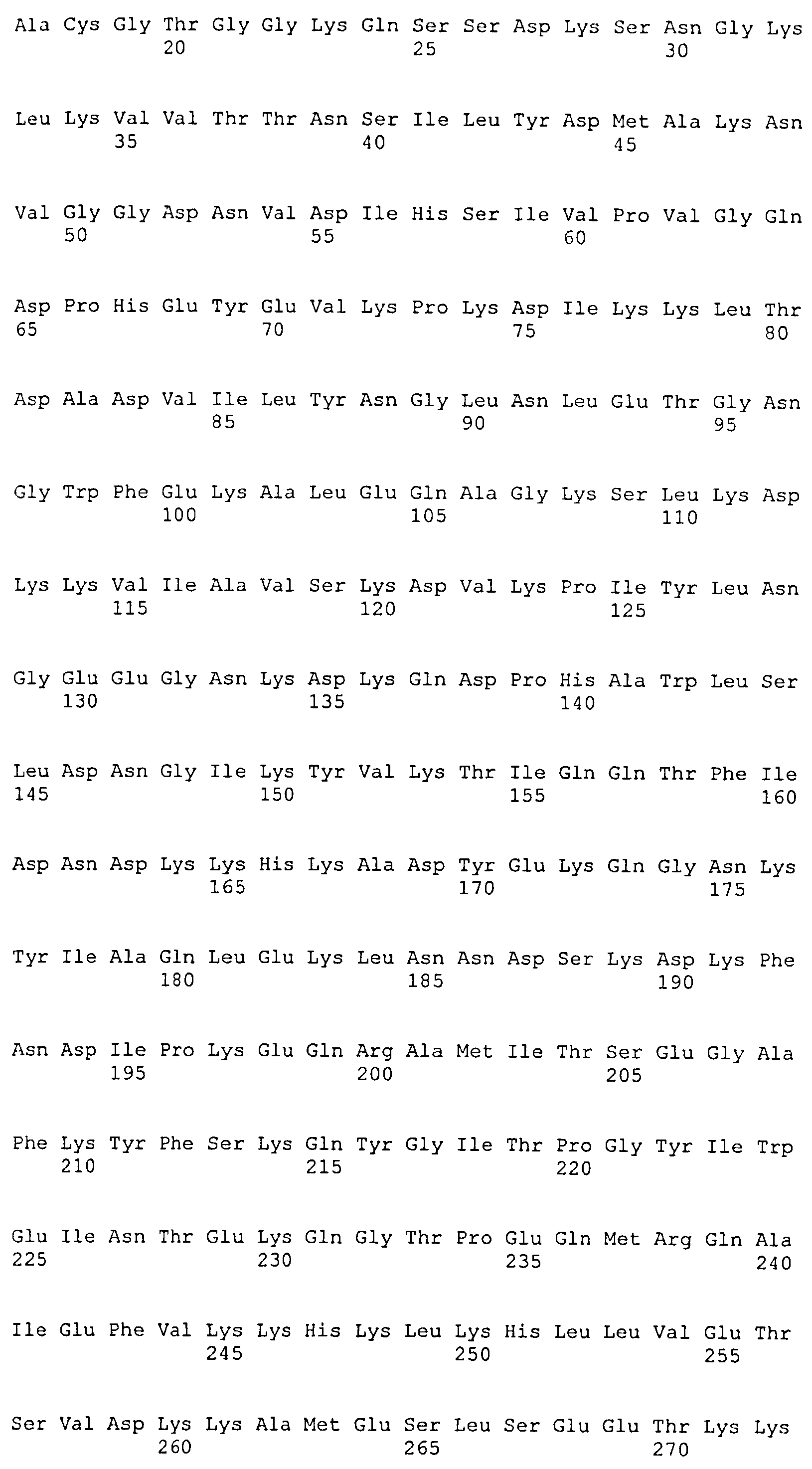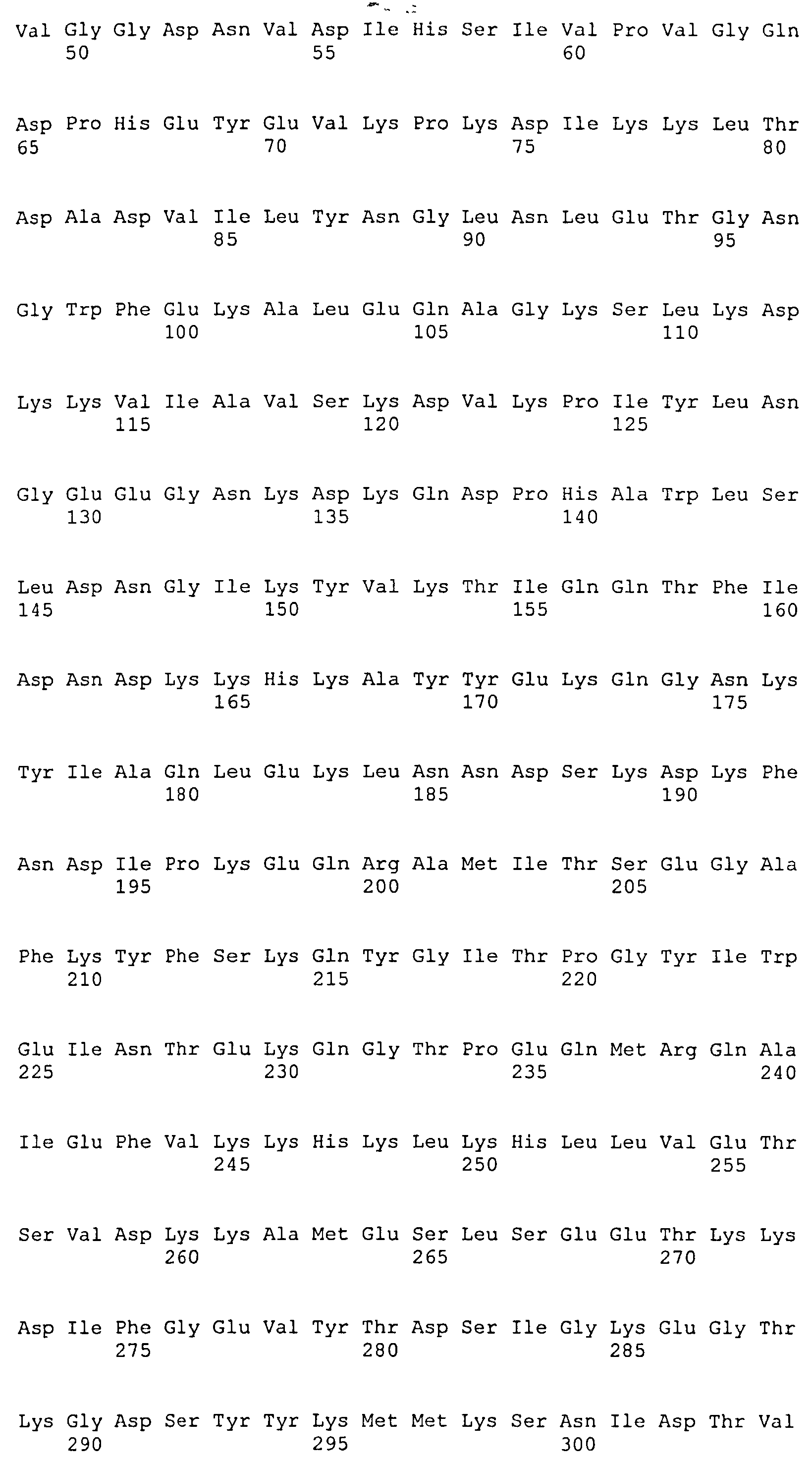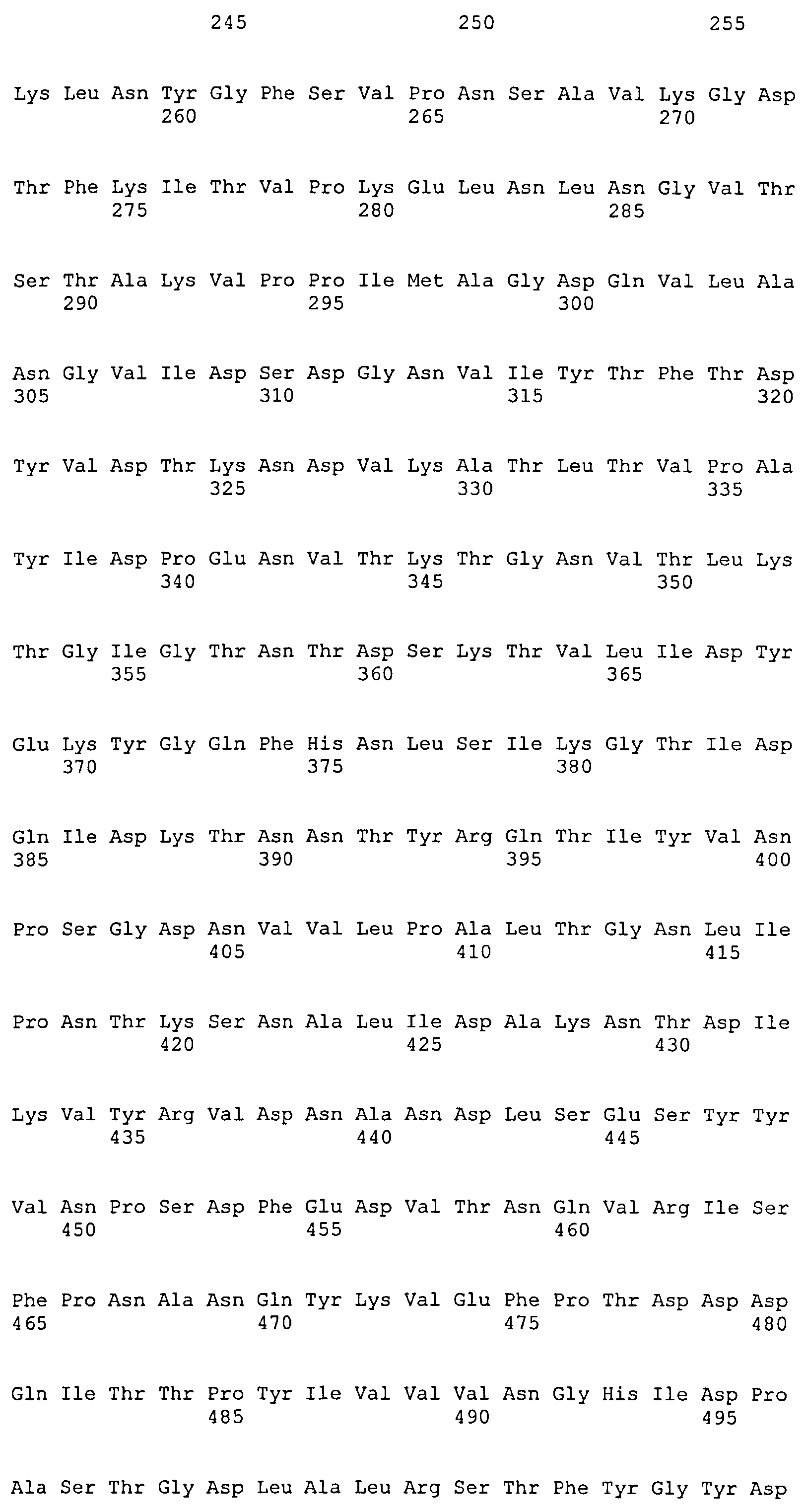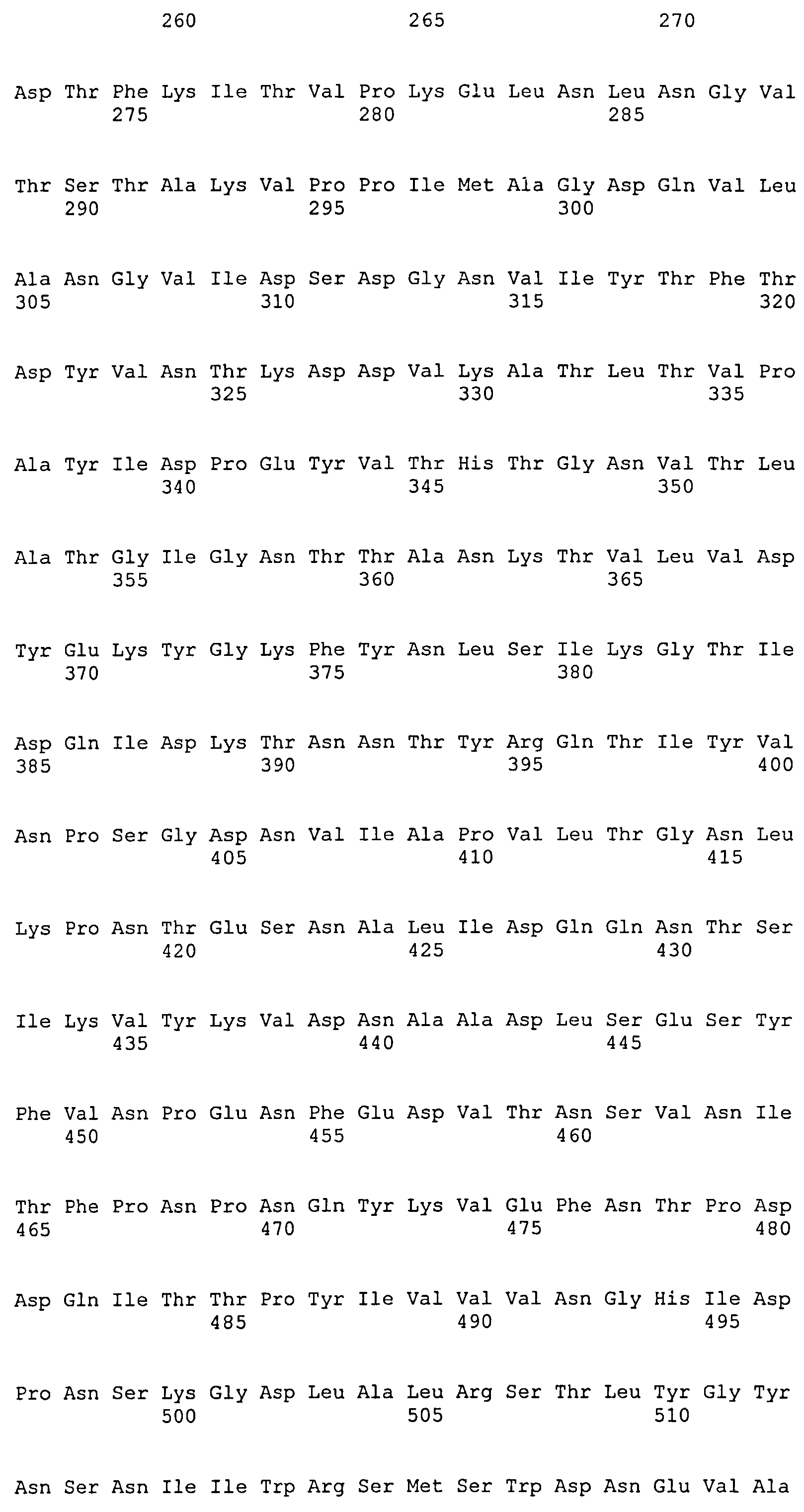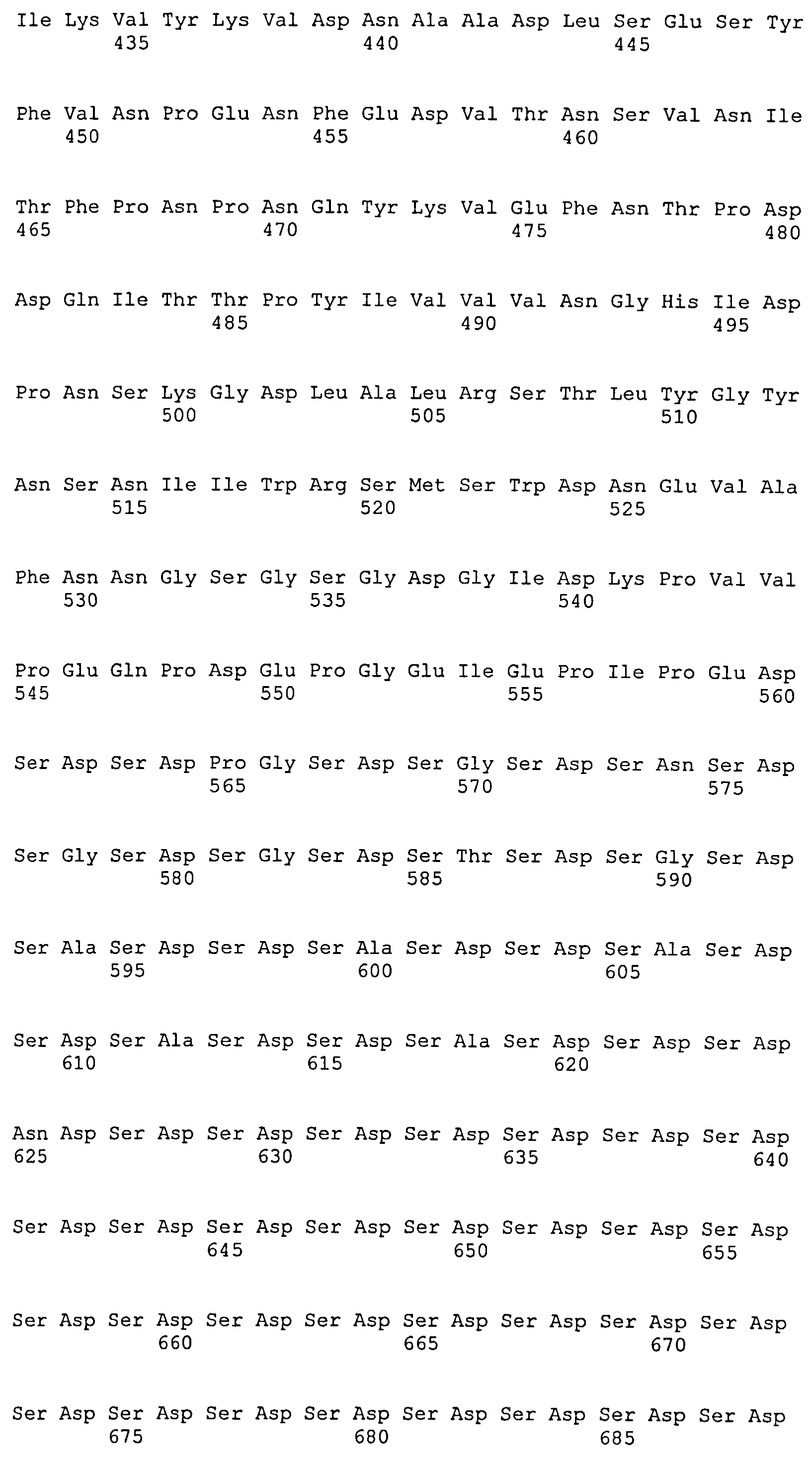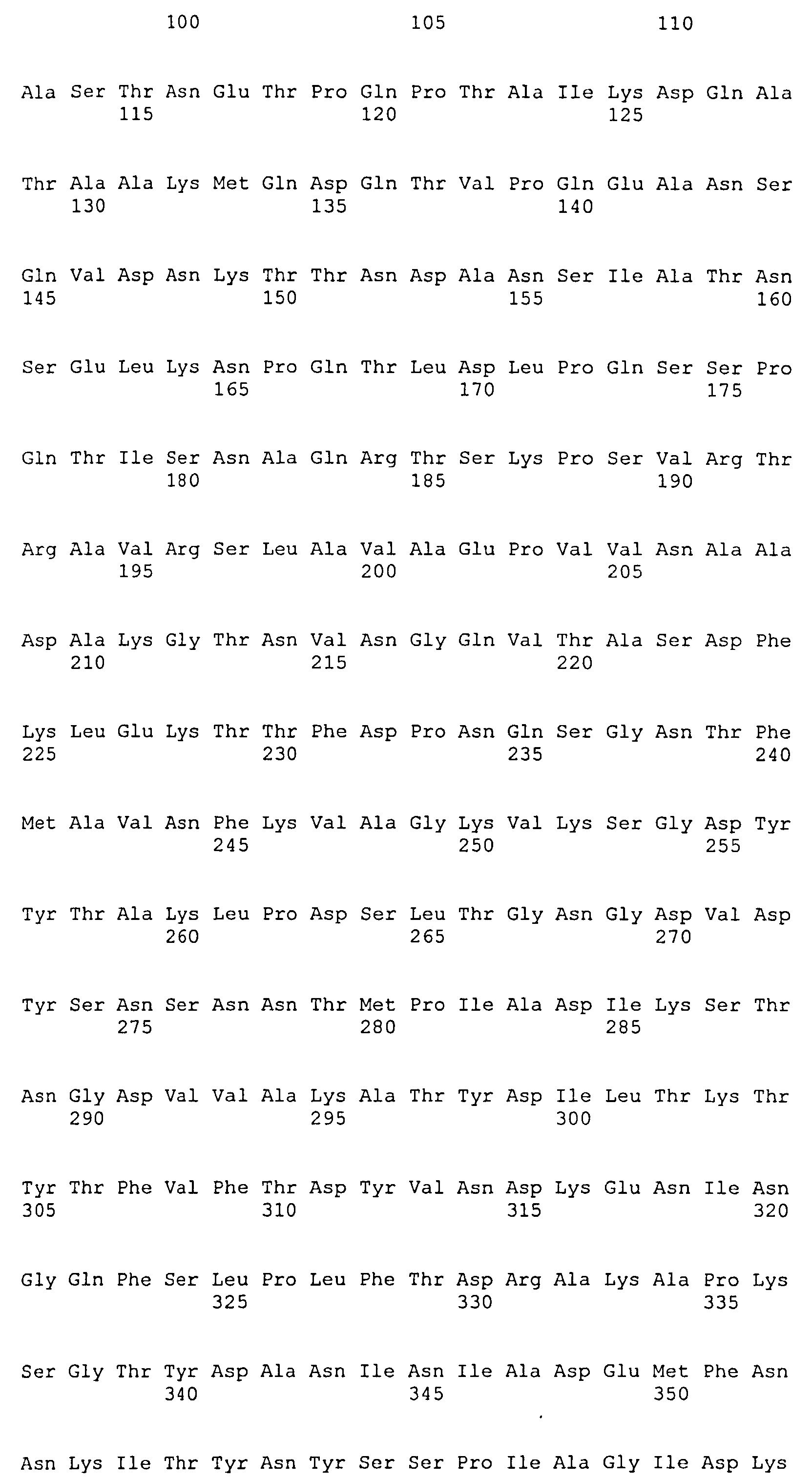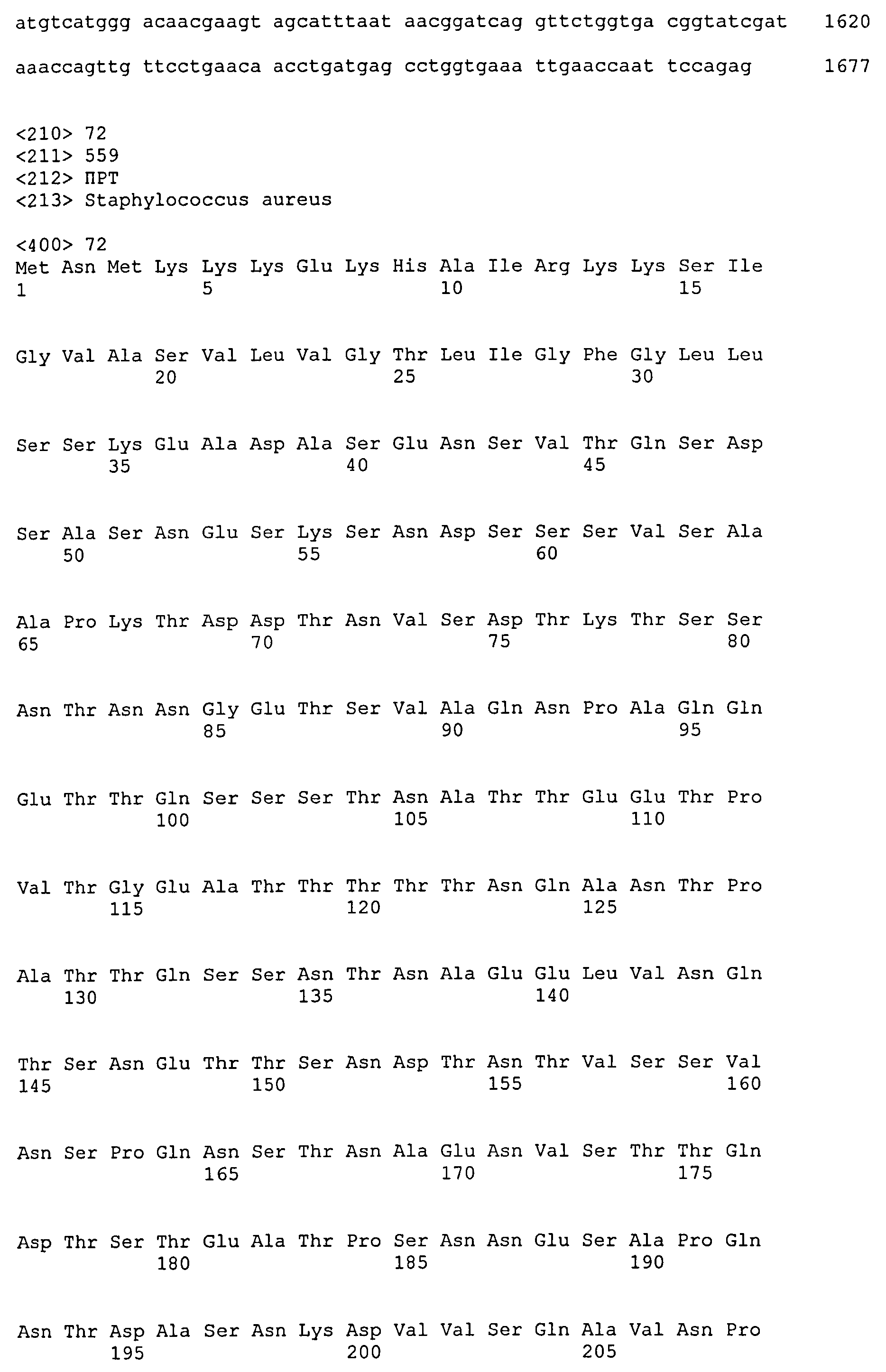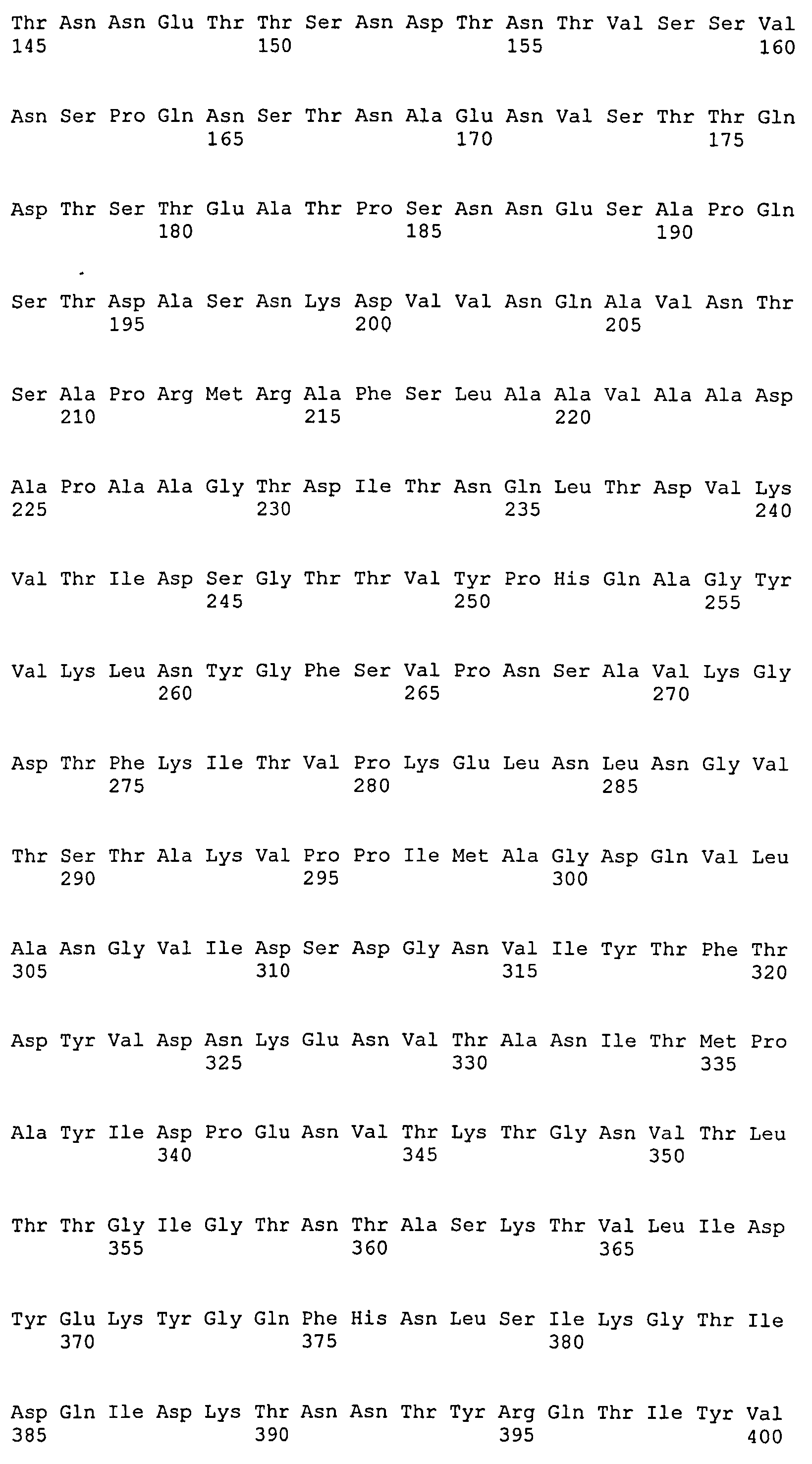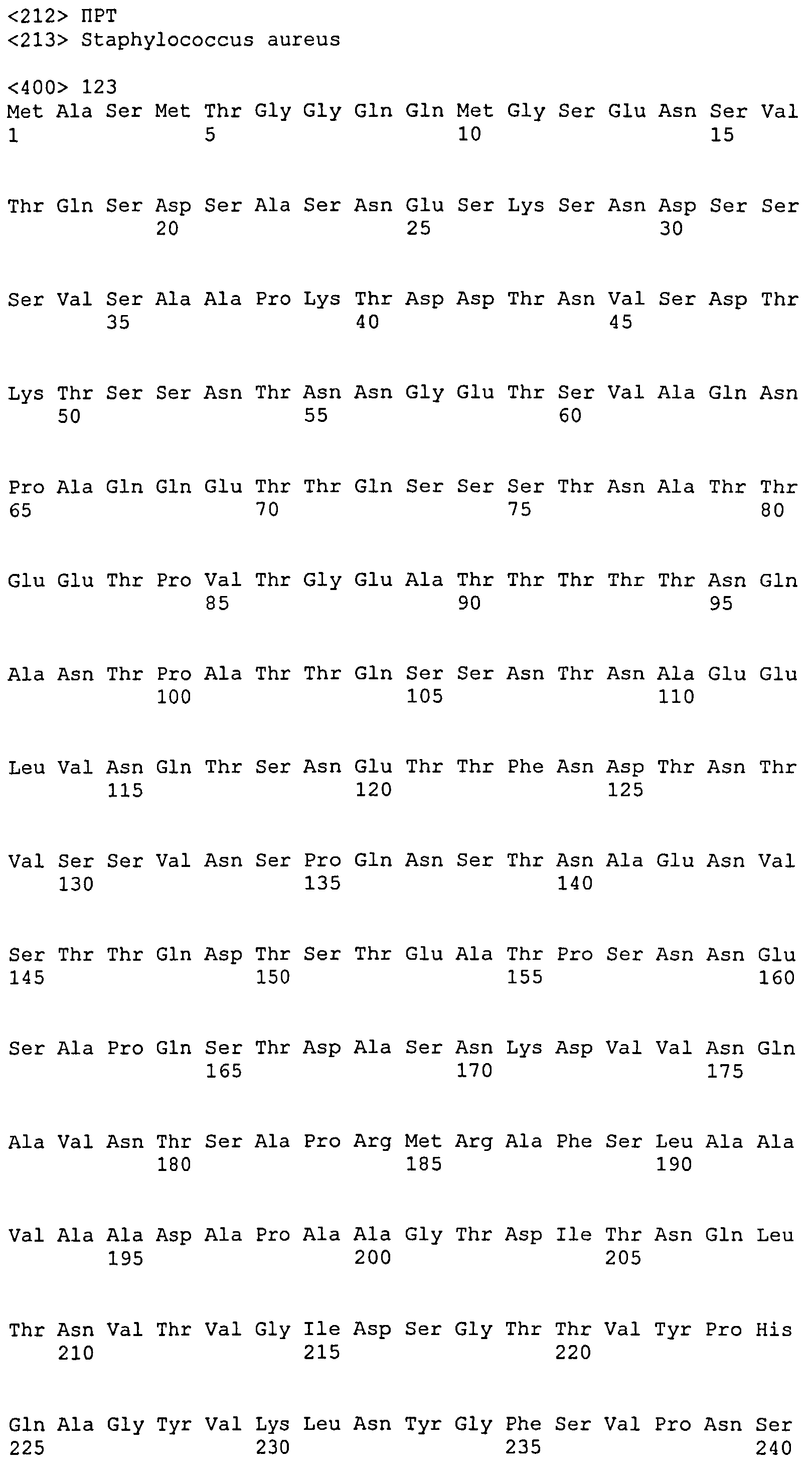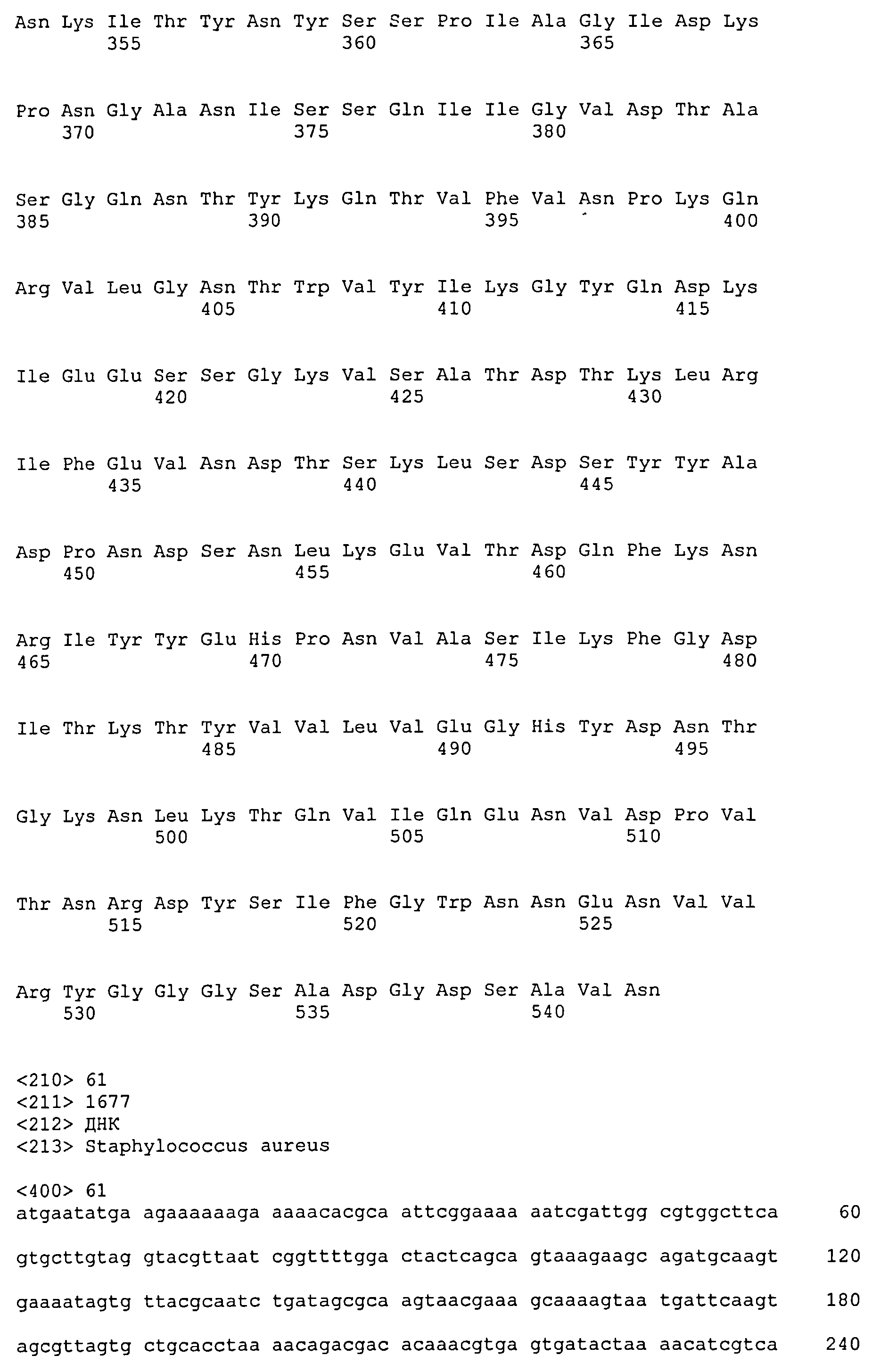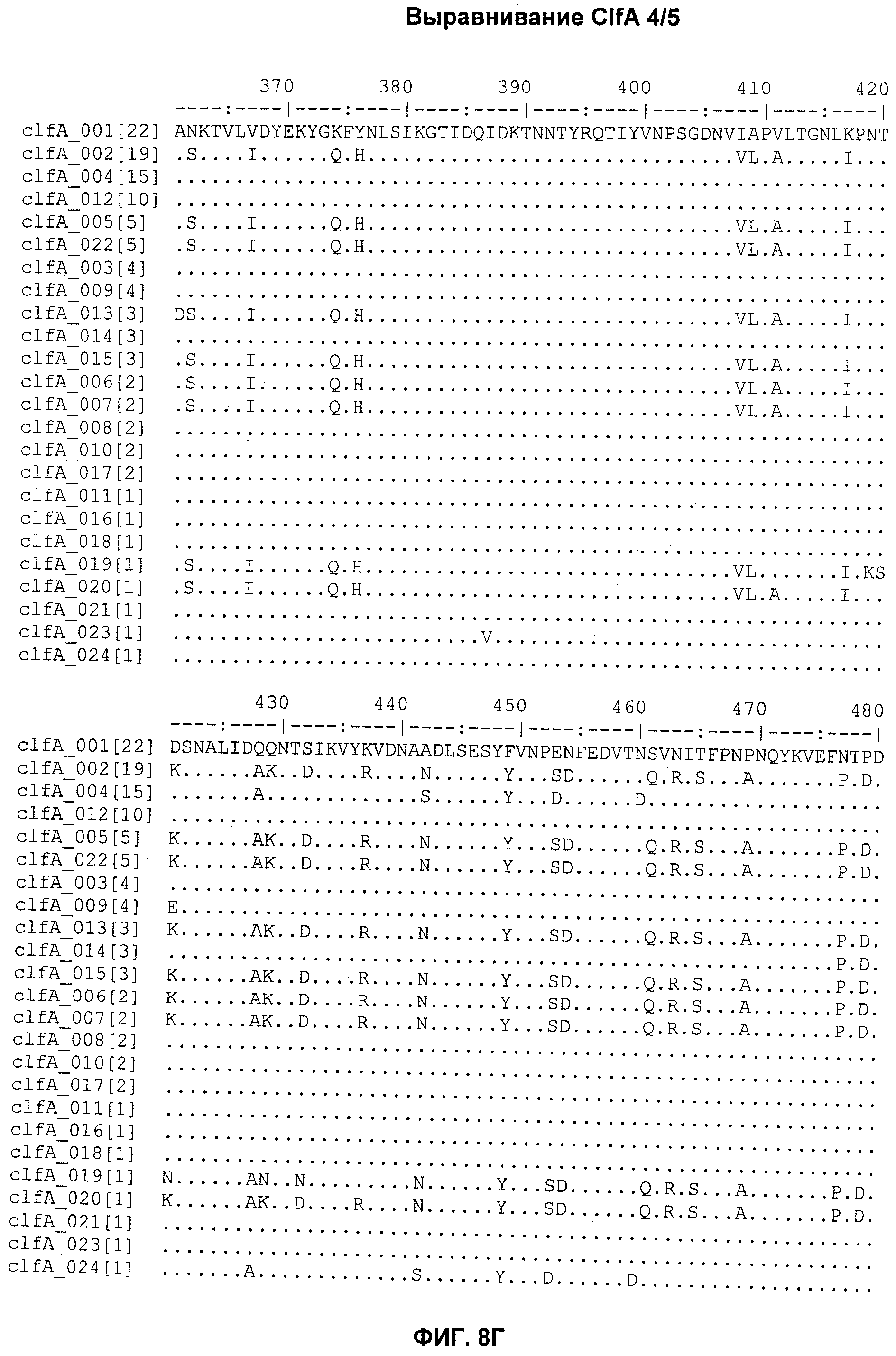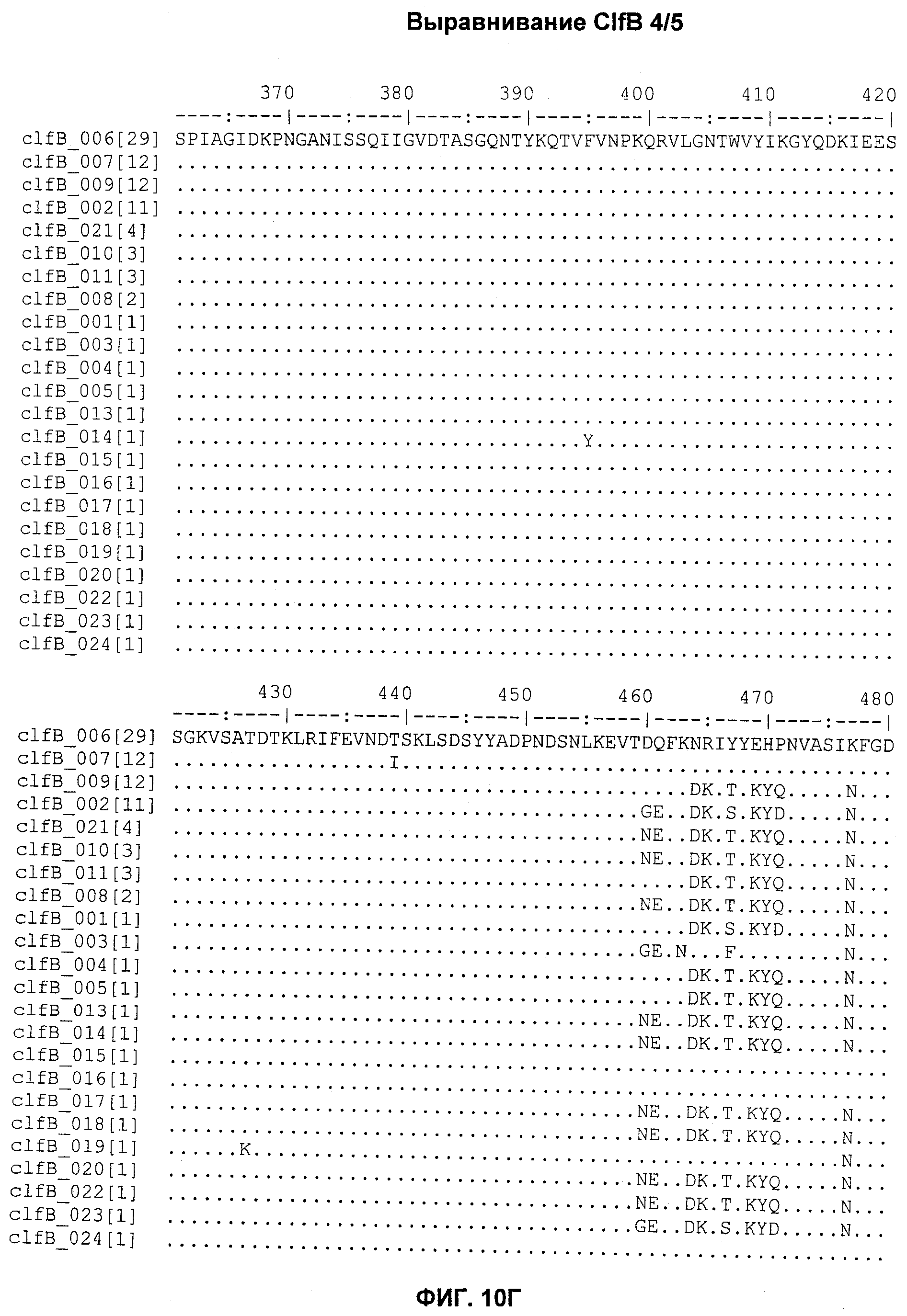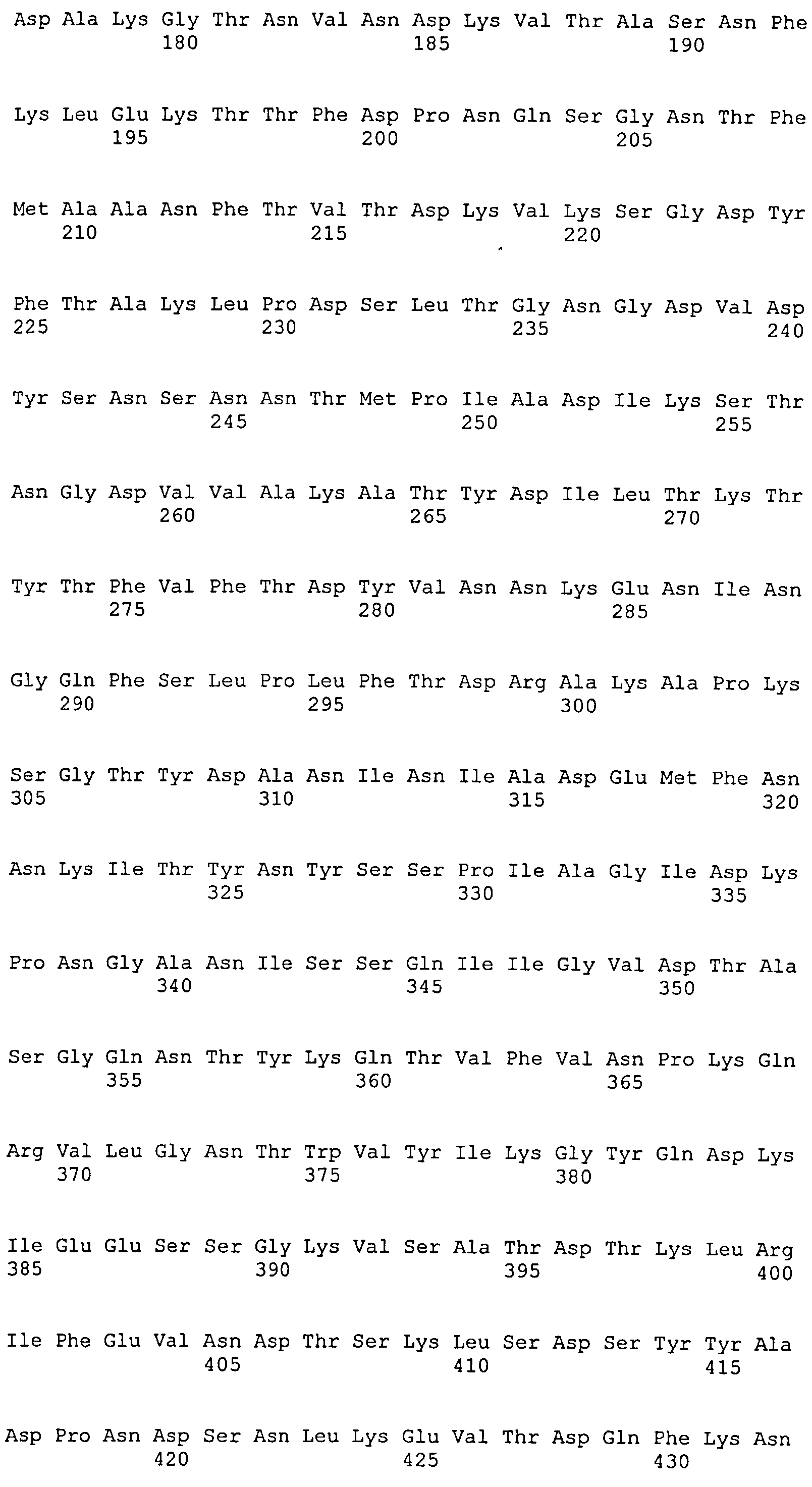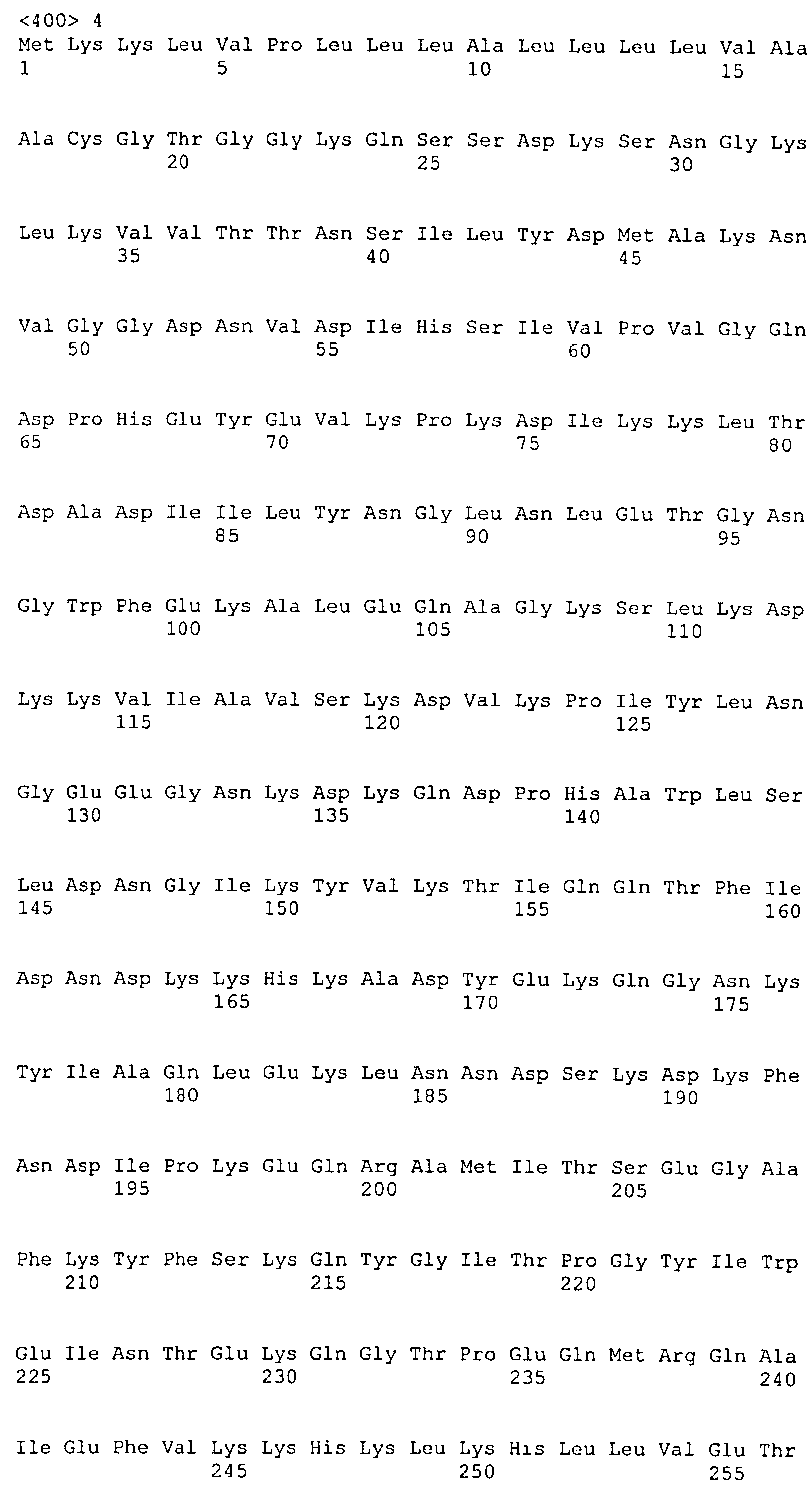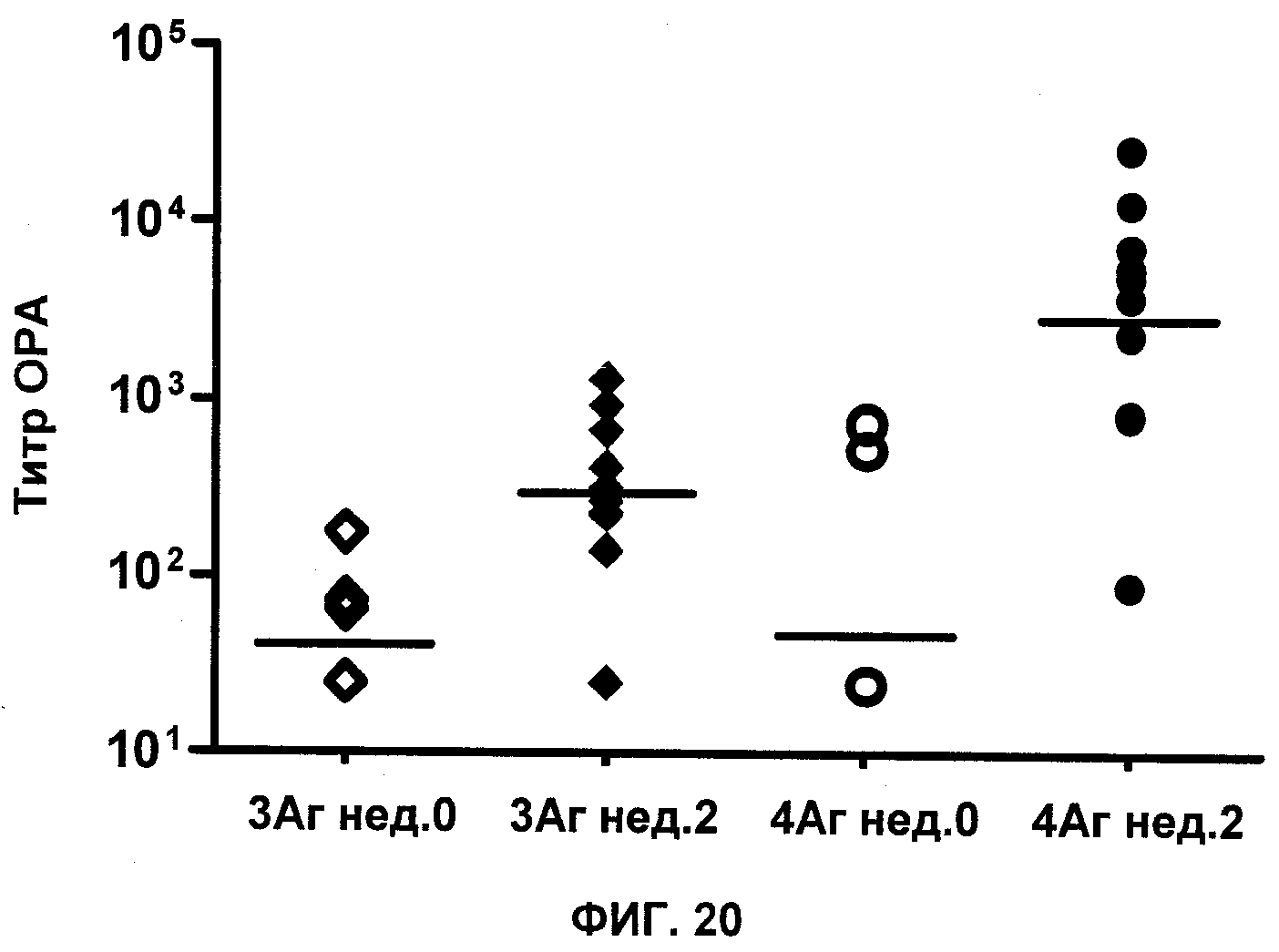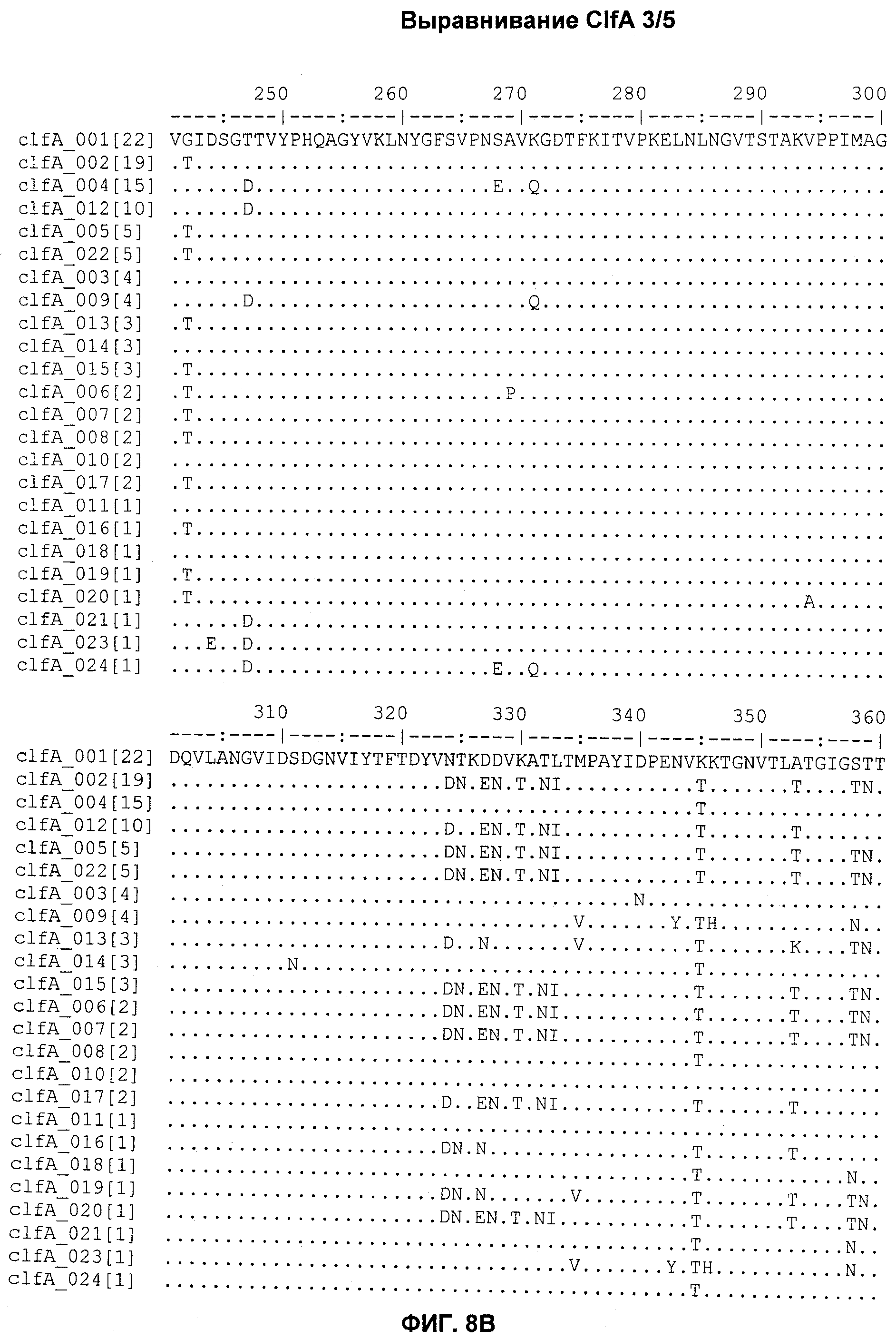Результат интеллектуальной деятельности: ИММУНОГЕННЫЕ КОМПОЗИЦИИ АНТИГЕНОВ STAPHYLOCOCCUS AUREUS
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка испрашивает приоритет предварительной заявки на патент США №61/219134, поданной 22 июня 2009 года, все содержание которой тем самым включено сюда посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуногенным композициям, содержащим полипептиды и капсульные полисахариды, выделенные из Staphylococcus aureus. Кроме того, изобретение относится к способам индуцирования иммунного ответа у субъектов против Staphylococcus aureus с использованием иммуногенных композиций полипептидов Staphylococcus aureus и капсульных полисахаридов. Образующиеся в результате антитела также можно использовать для лечения или предупреждения инфекции Staphylococcus aureus посредством пассивной иммунотерапии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Люди являются природным резервуаром для Staphylococcus aureus (S. aureus). Здоровые индивидуумы могут быть колонизированы S. aureus на коже, в ноздрях и в горле постоянно (10-35%), периодически (20-75%) или находиться в состоянии неносительства (5-70%) без ассоциированного заболевания. Смотрите Vandenbergh et al., J. Clin. Micro. 37:3133-3140 (1999). Впоследствии заболевание случается, когда у индивидуумов ослабевает иммунитет вследствие нарушений в иммунных барьерах, как, например, во время хирургического вмешательства, установки постоянных катетеров или других устройств, травмы или ран. Возникающая в результате инфекция S. aureus может вызывать широкий спектр разных заболеваний, которые варьируют от легких инфекций кожи до эндокартита, остеомиелита, бактериемии, сепсиса и других форм заболевания с сопровождающим высоким процентом смертности. Большой человеческий резервуар увеличивает возможность для эволюции и распространения адаптированных патогенных типов клонов.
Инвазивные стафилококковые инфекции от грамположительных кокков S. aureus и S. epidermidis вызывают особую озабоченность из-за того, что они представляют собой возрастающую проблему для здравоохранения во всем мире. В особенности, S. aureus отвечает за большинство внутрибольничных (нозокомиальных) инфекций, и его распространенность среди внебольничных (community onset) инфекциях возрастает. Например, заболеваемость инвазивным, устойчивым к метициллину S. aureus (MRSA) была оценена как 31,8 на 100000 человек, включая 18650 смертельных случаев в Соединенных Штатах в 2005 году. Смотрите Klevens R.M. et al., JAMA, 298:1763-71 (2007).
За последние 20 лет стафилококковые заболевания претерпели резкий подъем, причем этот подъем идет параллельно с применением внутрисосудистых устройств и инвазивных процедур. Данное увеличение частоты заболевания вызывает все большую озабоченность из-за параллельного увеличения устойчивости к антибиотикам, следовательно, существует срочная потребность в иммуногенных композициях для применения в вакцинах или для индукции поликлональных или моноклональных антител для придания пассивного иммунитета в качестве средства для предупреждения или лечения стафилококковой инфекции и ассоциированных заболеваний.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на многоантигенную или многокомпонентную иммуногенную композицию, содержащую по меньшей мере три антигена, выделенных из бактерии-стафилококка. Антигены, которые представляют собой полипептиды и полисахариды, могут быть получены, среди прочего, непосредственно из бактерии с использованием методик выделения, известных специалистам в данной области, или они могут быть продуцированы с использованием протоколов синтеза, или они могут быть продуцированы рекомбинантно с использованием методик генной инженерии, также известных специалистам в данной области, или посредством комбинации любого из вышеупомянутого. В определенных воплощениях иммуногенная композиция по изобретению содержит три или более чем три антигена, выбранных из выделенного полипептида фактора слипания A S. aureus (ClfA), выделенного полипептида фактора слипания В S. aureus (ClfB), выделенного капсульного полисахарида типа 5 (СР5) S. aureus, конъюгированного с белком-носителем, выделенного капсульного полисахарида типа 8 (СР8) S. aureus, конъюгированного с белком-носителем, и выделенного белка MntC S. aureus. Кроме того, согласно настоящему изобретению предложены способы индуцирования иммунного ответа против бактерии-стафилококка, способы предупреждения, уменьшения тяжести или задержки начала заболевания, вызываемого бактерией-стафилококком, и способы предупреждения, уменьшения тяжести или задержки начала по меньшей мере одного симптома заболевания, вызванного инфекцией бактерией-стафилококком.
Соответственно, в одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания А S. aureus (ClfA), выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем.
В одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания А S. aureus (ClfA), выделенный фактор слипания В S. aureus (ClfB), выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем.
В одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания А S. aureus (ClfA), выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем.
В одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания А S. aureus (ClfA), выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем.
В одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем.
В одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания В (ClfB) S. aureus, выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем.
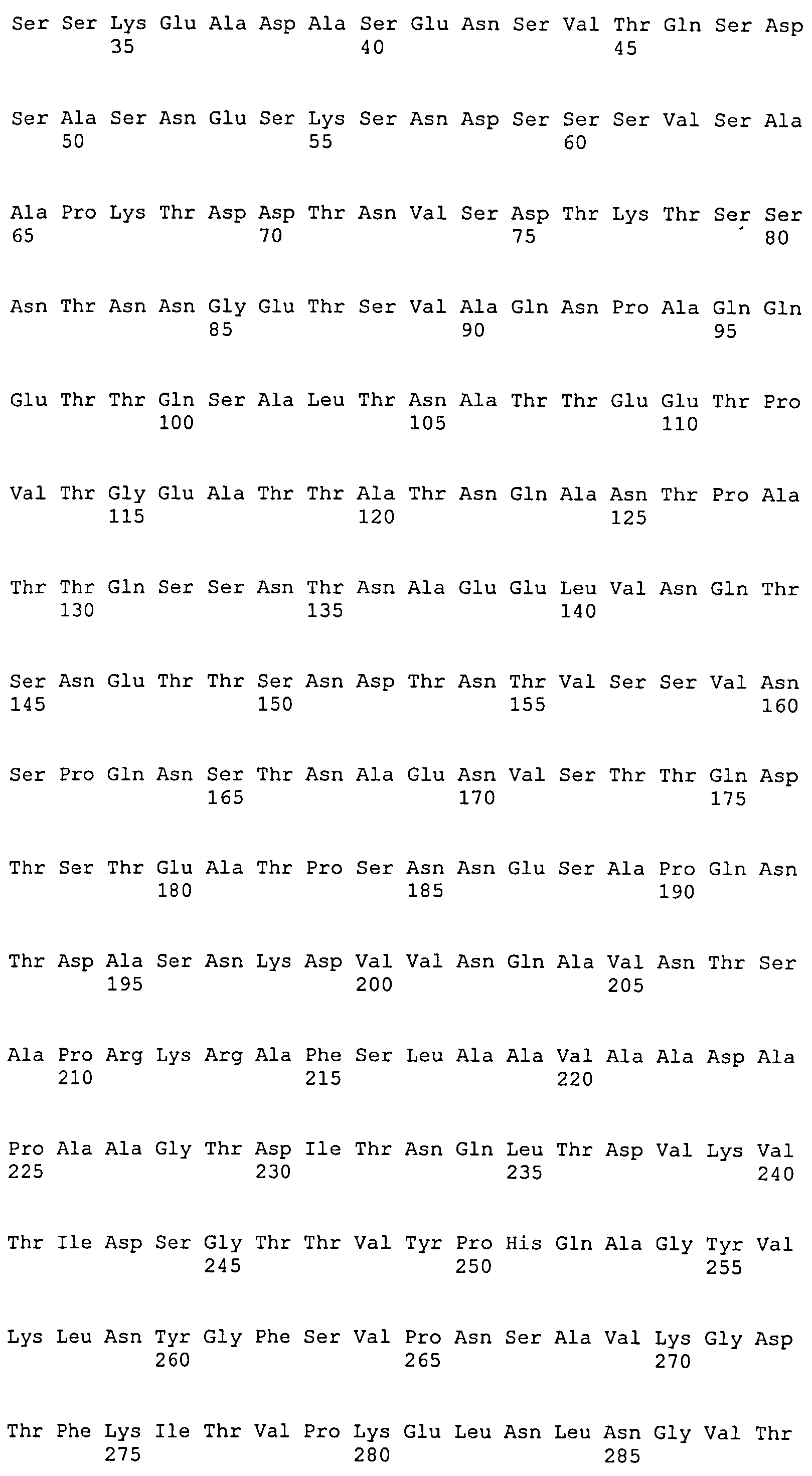
В одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания A (ClfA) S. aureus, выделенный полипептид фактора слипания В (ClfB) S. aureus и выделенный белок MntC S. aureus.
В одном воплощении согласно изобретению предложена иммуногенная композиция, содержащая выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем.
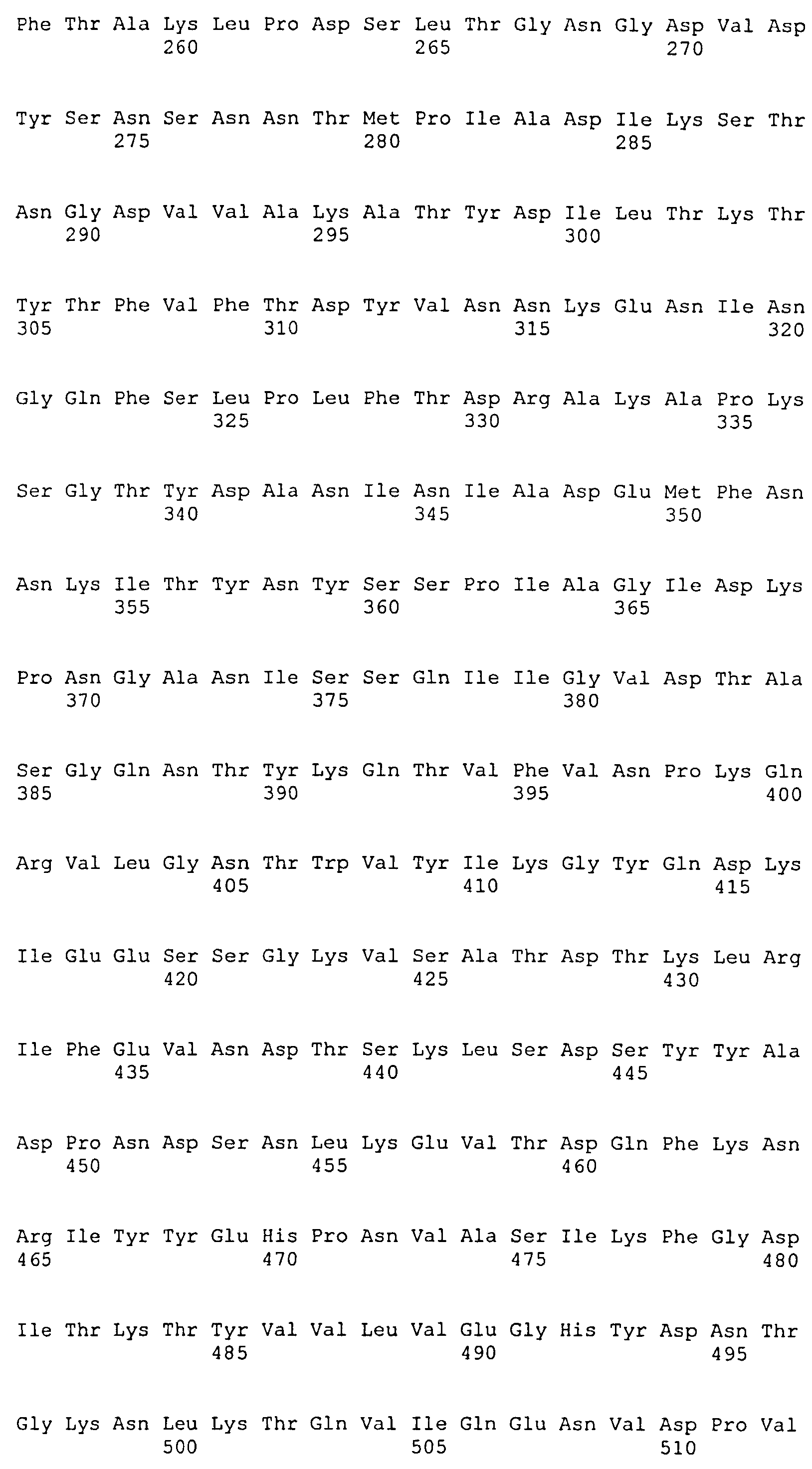
В одном воплощении иммуногенная композиция содержит выделенный фрагмент полипептида ClfA, где фрагмент полипептида ClfA содержит фибриногенсвязывающий домен ClfA. В одном воплощении фрагмент полипептида ClfA содержит фибриногенсвязывающий домен, содержащий домены N1, N2 и N3 ClfA. В одном воплощении фрагмент полипептида ClfA содержит фибриногенсвязывающий домен, содержащий домены N2 и N3 ClfA. В одном воплощении композиции, содержащие фибриногенсвязывающий домен ClfA, демонстрируют ослабленное связывание с фибриногеном. В одном воплощении фибриногенсвязывающий домен ClfA связывается с фибриногеном в меньшей степени по сравнению со связыванием с фибриногеном, наблюдаемым для нативного фибриногенсвязывающего домена ClfA. В одном воплощении композиции, содержащие фибриногенсвязывающий домен ClfA, демонстрируют ослабленное связывание с фибриногеном и имеют аминокислотную замену по одному или более чем одному из Tyr 338, Tyr 256, Pro 336, Lys 389, Ala 254 и Ile 387 полноразмерного белка, содержащего сигнальную последовательность. В одном воплощении композиции, содержащие фибриногенсвязывающий домен ClfA, демонстрируют аминокислотную замену по одному или более чем одному из Tyr 338, Tyr 256, Pro 336, Lys 389, Ala 254 и Ile 387, где аминокислота в любом одном или более чем одном из этих положений заменена на Ala или Ser. В одном воплощении композиция содержит фибриногенсвязывающий домен ClfA, где Tyr в положении 338 заменен на Ala.
В одном воплощении иммуногенная композиция содержит выделенный фрагмент полипептида ClfB, где фрагмент полипептида ClfB содержит фибриногенсвязывающий домен ClfB. В одном воплощении фрагмент полипептида ClfB содержит фибриногенсвязывающий домен, содержащий домены N1, N2 и N3 ClfB. В одном воплощении фрагмент полипептида ClfB содержит фибриногенсвязывающий домен, содержащий домены N2 и N3 ClfB. В одном воплощении композиции, содержащие фибриногенсвязывающий домен ClfB, демонстрируют ослабленное связывание с фибриногеном. В одном воплощении фибриногенсвязывающий домен ClfB связывается с фибриногеном в меньшей степени по сравнению со связыванием с фибриногеном, наблюдаемым для нативного фибриногенсвязывающего домена ClfB.
В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 5 (СР5) S. aureus, который представляет собой высокомолекулярный полисахарид с молекулярной массой от 20 до 1000 кДа. В одном воплощении высокомолекулярный полисахарид типа 5 имеет молекулярную массу от 50 до 300 кДа. В одном воплощении высокомолекулярный полисахарид типа 5 имеет молекулярную массу от 70 до 150 кДа.
В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 5 S. aureus, который O-ацетилирован на 10%-100%. В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 5 S. aureus, который O-ацетилирован на 50%-100%. В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 5 S. aureus, который O-ацетилирован на 75%-100%.
В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 8 S. aureus, который представляет собой высокомолекулярный полисахарид с молекулярной массой от 20 до 1000 кДа. В одном воплощении высокомолекулярный полисахарид типа 8 имеет молекулярную массу от 50 до 300 кДа. В одном воплощении высокомолекулярный полисахарид типа 8 имеет молекулярную массу от 70 до 150 кДа.
В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 8 S. aureus, который O-ацетилирован на 10%-100%. В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 8 S. aureus, который O-ацетилирован на 50%-100%. В одном воплощении иммуногенная композиция содержит капсульный полисахарид типа 8 S. aureus, который O-ацетилирован на 75%-100%.
В одном воплощении капсульный полисахарид 5 и/или 8, присутствующий в иммуногенной композиции, конъюгирован с белком-носителем. В одном воплощении белок-носитель представляет собой анатоксин CRM197 Corynebacterium diphtheriae (С. diphtheriae).
В одном воплощении иммуногенная композиция содержит MntC S. aureus, который представляет собой липидированный белок. В одном воплощении иммуногенная композиция содержит MntC S. aureus, который не является липидированным белком.
В одном воплощении согласно изобретению предложена иммуногенная композиция, как здесь описано, дополнительно содержащая по меньшей мере один белок из семейства белков с серин-аспартатными повторами (Sdr), выбранный из группы, состоящей из SdrC, SdrD и SdrE.
В одном воплощении согласно изобретению предложена иммуногенная композиция, как здесь описано, дополнительно содержащая белок с поверхностной детерминантой В железа (IsdB).
В каждом из описанных здесь воплощений, в которых иммуногенная композиция содержит три или более чем три из перечисленных антигенов, данная композиция может дополнительно содержать другие иммуногенные и/или неиммуногенные вещества. В определенных воплощениях каждая иммуногенная композиция может, в качестве альтернативы, «состоять по существу из» или «состоять из» трех или более чем трех перечисленных антигенов и дополнительно содержать одно или более чем одно неиммуногенное вещество, как здесь описано более подробно.
В одном воплощении согласно изобретению предложена иммуногенная композиция, как здесь описано, дополнительно содержащая любой из следующих антигенов: Орр3а, DltD, HtsA, LtaS, IsdA, IsdC, SdrF, SdrG, SdrH, SrtA, SpA, Sbi FmtB, альфа-гемолизин (hla), бета-гемолизин, фибронектинсвязывающий белок A (fnbA), фибронектинсвязывающий белок В (fnbB), коагулаза, Fig, map, лейкоцидин Пантона-Валентина (pvl), альфа-токсин и его варианты, гамма-токсин (hlg) и варианты, ica, иммунодоминантный ABC транспортер, Mg2+ транспортер, Ni ABC транспортер, RAP, автолизин, рецепторы ламинина, IsaA/PisA, IsaB/PisB, SPOIIIE, SsaA, EbpS, Sas A, SasF, SasH, EFB (FIB), SBI, Npase, ЕВР, сиалосвязывающий белок II кости, предшественник ауреолизина (AUR)/Sepp1, Cna, и их фрагментов, таких как М55, TSST-1, mecA, экзополисахарид поли-N-ацетилглюкозамин (PNAG/dPNAG), GehD, EbhA, EbhB, SSP-1, SSP-2, HBP, витронектинсвязывающий белок, HarA, EsxA, EsxB, энтеротоксин А, энтеротоксин В, энтеротоксин С1 и новый автолизин. В определенных воплощениях изобретения, когда иммуногенная композиция содержит определенные формы СР5 и/или СР8, она может дополнительно не содержать PNAG.
В одном воплощении иммуногенная композиция дополнительно содержит адъювант. В одном воплощении иммуногенная композиция дополнительно содержит фармацевтически приемлемый носитель.
В одном воплощении иммуногенную композицию используют для приготовления вакцины в виде препарата. В одном воплощении вакцину используют для индукции иммунного ответа против S. aureus у субъекта. В одном воплощении иммуногенную композицию используют для получения композиции антител для придания субъекту пассивного иммунитета.
В одном воплощении согласно изобретению предложен способ индукции иммунного ответа против S. aureus, включающий введение субъекту иммуногенного количества любой из описанных здесь иммуногенных композиций и фармацевтически приемлемого носителя.
В одном воплощении согласно изобретению предложен способ предупреждения или уменьшения инфекции S. aureus или способ предупреждения или уменьшения тяжести по меньшей мере одного симптома, ассоциированного с инфекцией, вызванной S. aureus, причем данные способы включают введение субъекту иммуногенного количества любой из описанных здесь иммуногенных композиций и фармацевтически приемлемого носителя.
В одном воплощении способы индукции иммунного ответа против S. aureus включают доставку иммуногенных композиций с адъювантом. В одном воплощении предложены способы индукции иммунного ответа против S. aureus для доставки иммуногенных композиций с фармацевтически приемлемым носителем.
В одном воплощении иммунный ответ, индуцированный описанными здесь иммуногенными композициями, предупреждает или ослабляет заболевание или состояние, ассоциированное со стафилококковым организмом у субъекта, или предупреждает или ослабляет один или более чем один симптом, ассоциированный со стафилококковым организмом у субъекта. В одном воплощении заболевание выбрано из группы, состоящей из инвазивного заболевания, вызванного S. aureus, сепсиса и носительства.
В одном воплощении индуцированный иммунный ответ включает генерирование антител, имеющих опсонофагоцитирующую активность (ОРА) против S. aureus. В одном воплощении индуцированный иммунный ответ включает генерирование более высоких титров опсонофагоцитирующих антител специфичных в отношении S. aureus, по сравнению с титром, наблюдаемым у неиммунизированных субъектов. В одном воплощении опсонофагоцитарный титр составляет по меньшей мере 1:20.
В одном воплощении S. aureus, против которого индуцируется иммунный ответ, представляет собой MRSA. В одном воплощении S. aureus, против которого индуцируется иммунный ответ, представляет собой MSSA (чувствительный к метициллину S. aureus). В одном воплощении S. aureus, против которого индуцируется иммунный ответ, представляет собой VRSA (устойчивый к ванкомицину S. aureus). В одном воплощении S. aureus, против которого индуцируется иммунный ответ, представляет собой VISA (S. aureus, обладающий промежуточной устойчивостью к ванкомицину).
В одном воплощении согласно изобретению предложен способ предупреждения стафилококковой инфекции у субъекта, подвергающегося хирургической процедуре, включающий введение субъекту иммунологически эффективного количества любой из иммуногенных композиций, как здесь описано, до хирургической процедуры. Хирургическая процедура может быть плановой (elective) хирургической процедурой или внеплановой (non-elective) хирургической процедурой. В одном воплощении хирургическая процедура представляет собой кардиоторакальную хирургическую процедуру. В одном воплощении субъект представляет собой человека, домашнее (veterinary) животное или домашний скот.
В одном воплощении согласно изобретению предложен способ придания субъекту пассивного иммунитета, включающий стадии (1) получения препарата антител с использованием иммуногенных композиций по изобретению и (2) введения препарата антител субъекту для придания пассивного иммунитета.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
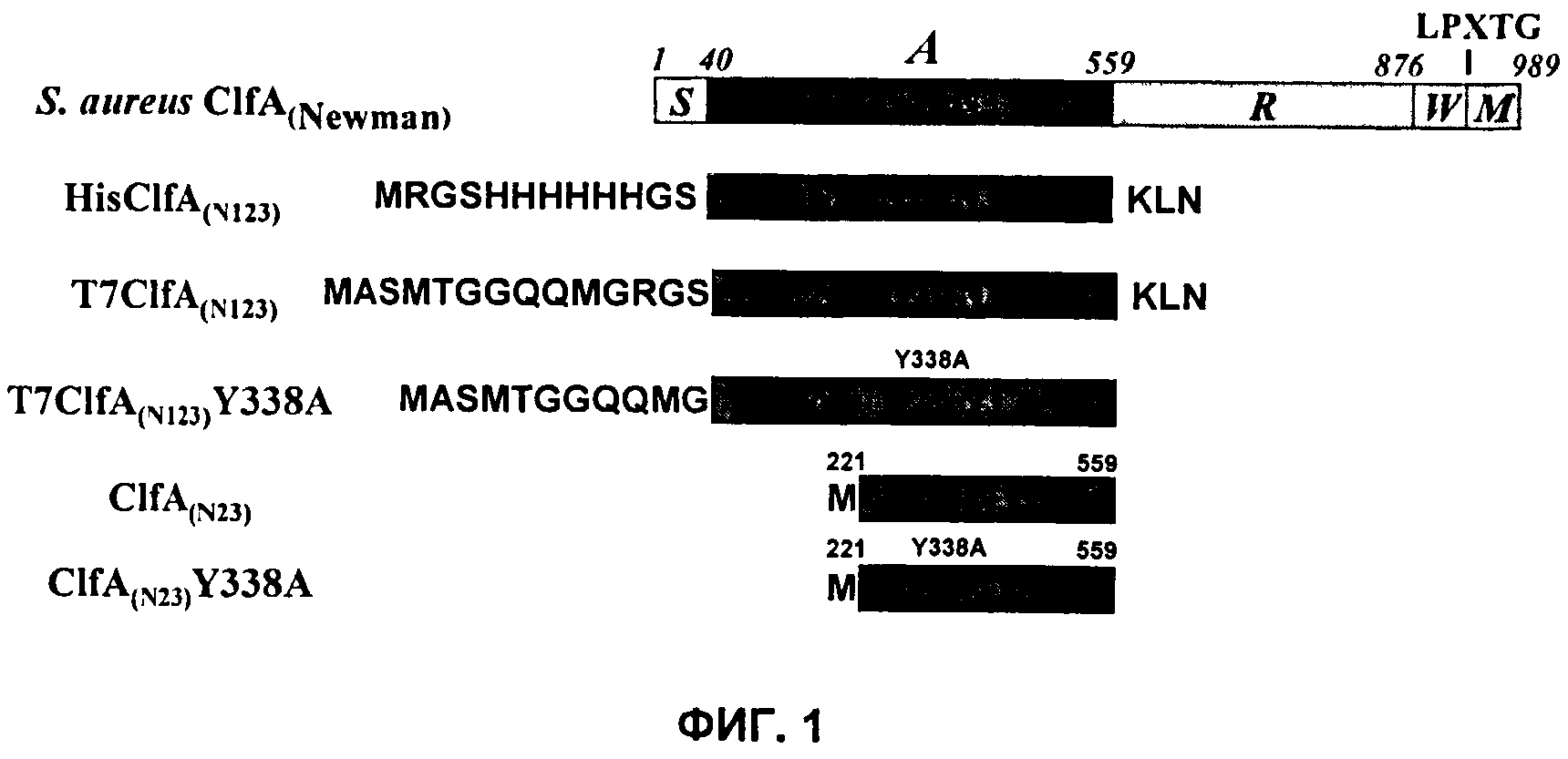
На Фиг.1 показаны разные формы рекомбинантного ClfA и раскрыты SEQ ID NO:125 и 127-129, соответственно, в порядке появления.
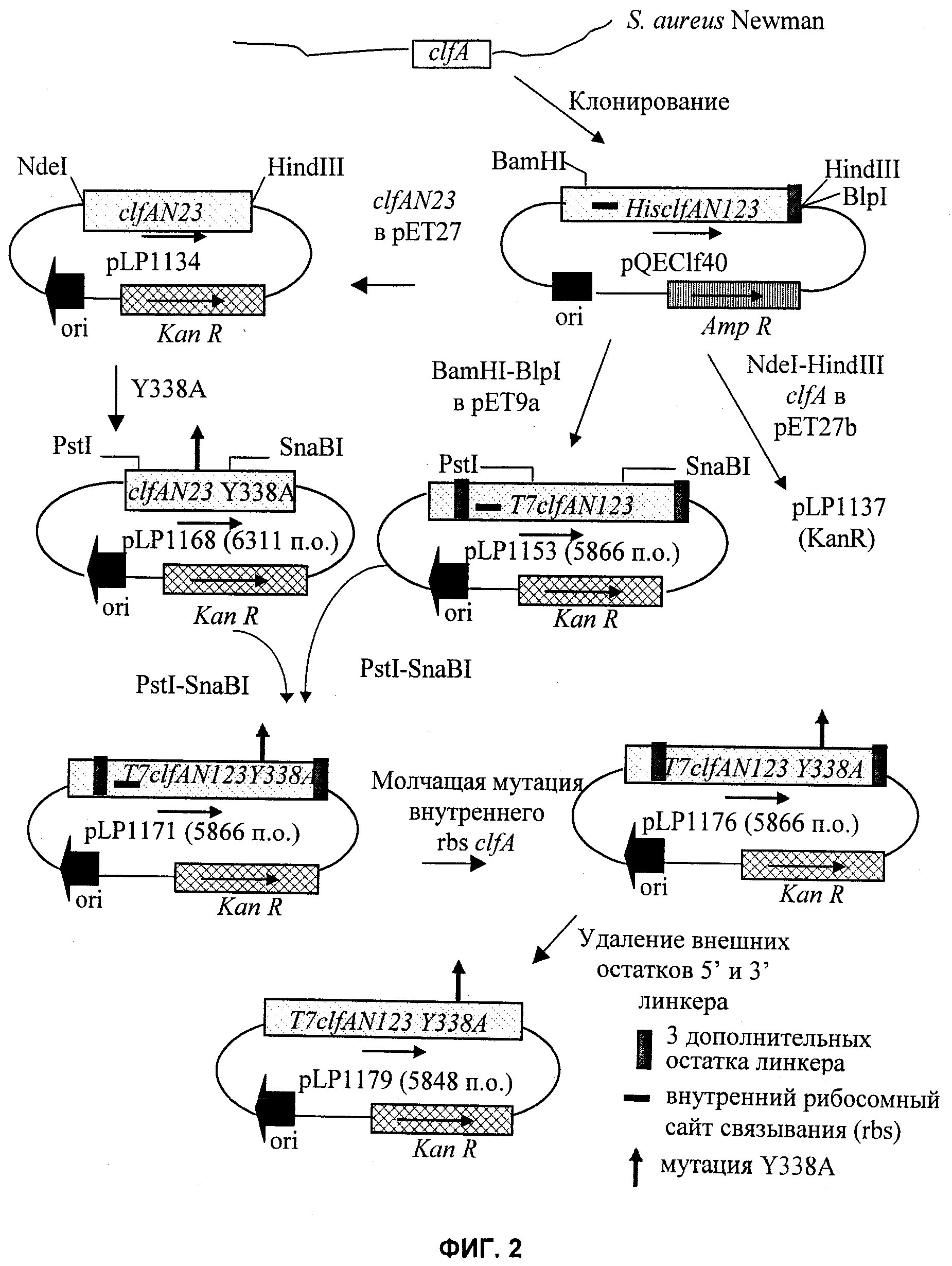
На Фиг.2 показаны стадии клонирования, использованные для конструирования pLP1179 для экспрессии ClfA. bp - пар(а) оснований.
На Фиг.3 показан экспрессионный вектор T7ClfA(N123)Y338A, pLP1179.
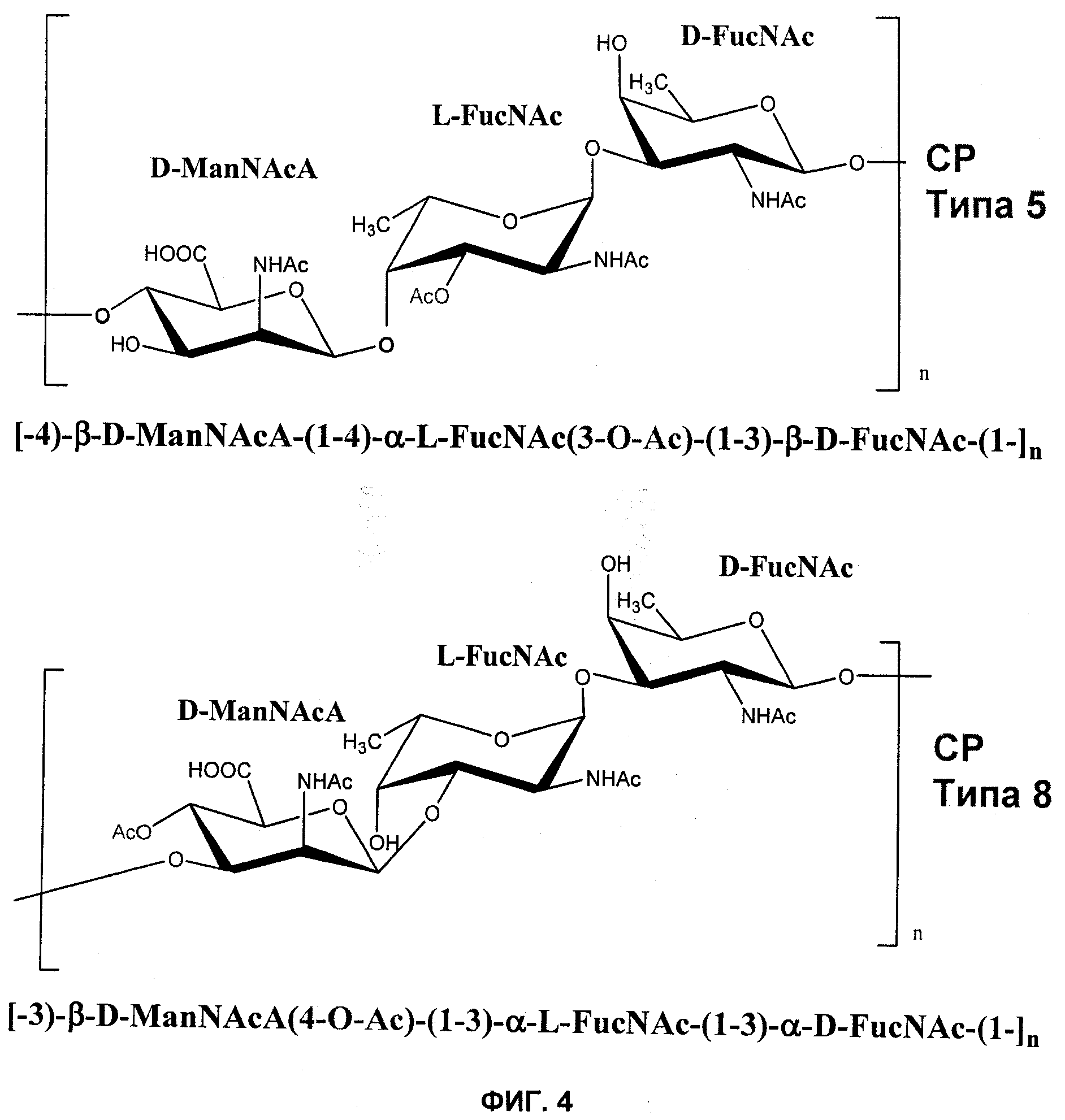
На Фиг.4 показана повторяющаяся структура полисахаридов СР5 и СР8.
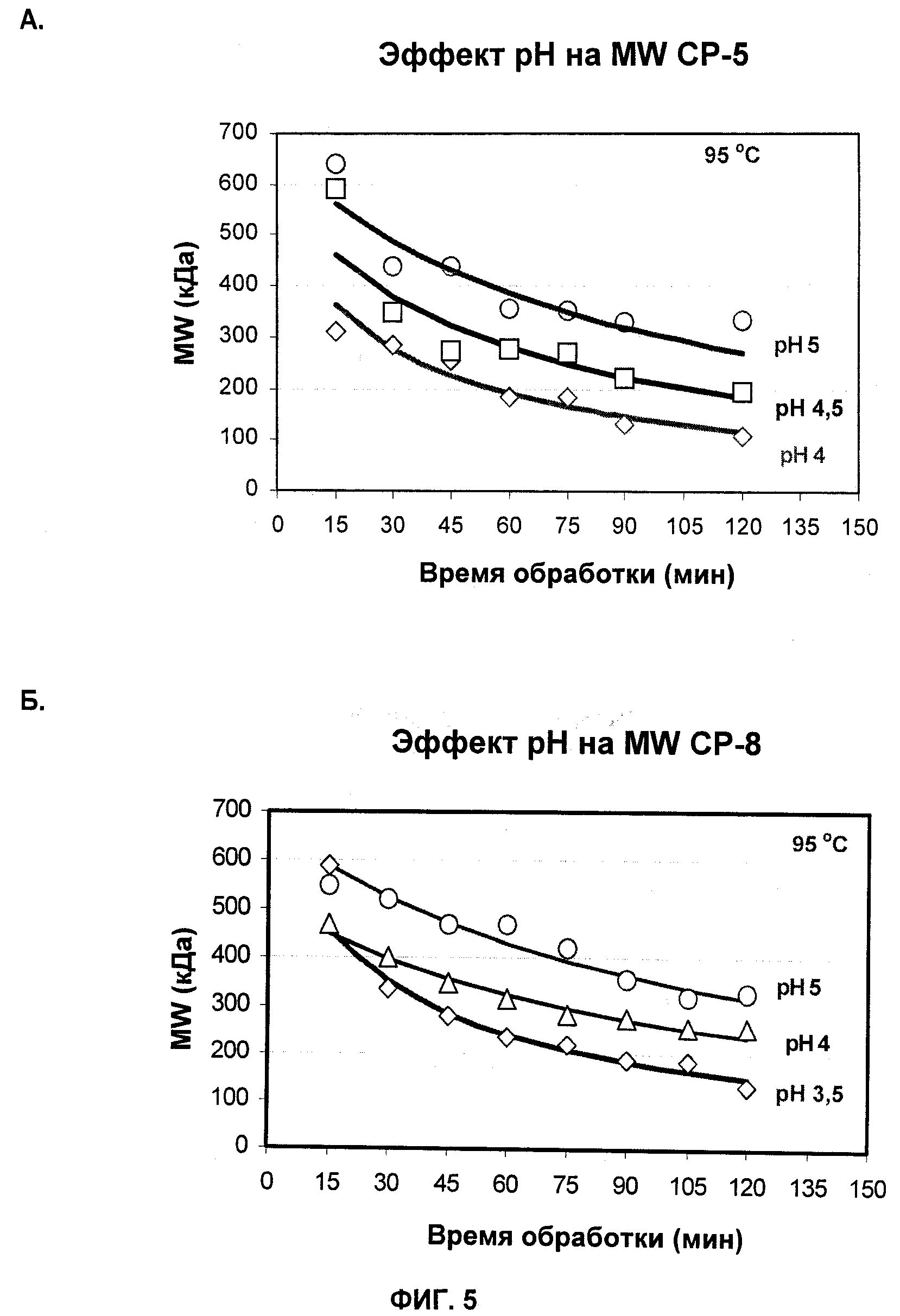
На Фиг.5А и 5Б показаны профили молекулярной массы СР5 (А) и СР8 (Б), продуцированных при различных рН жидкой питательной среды.
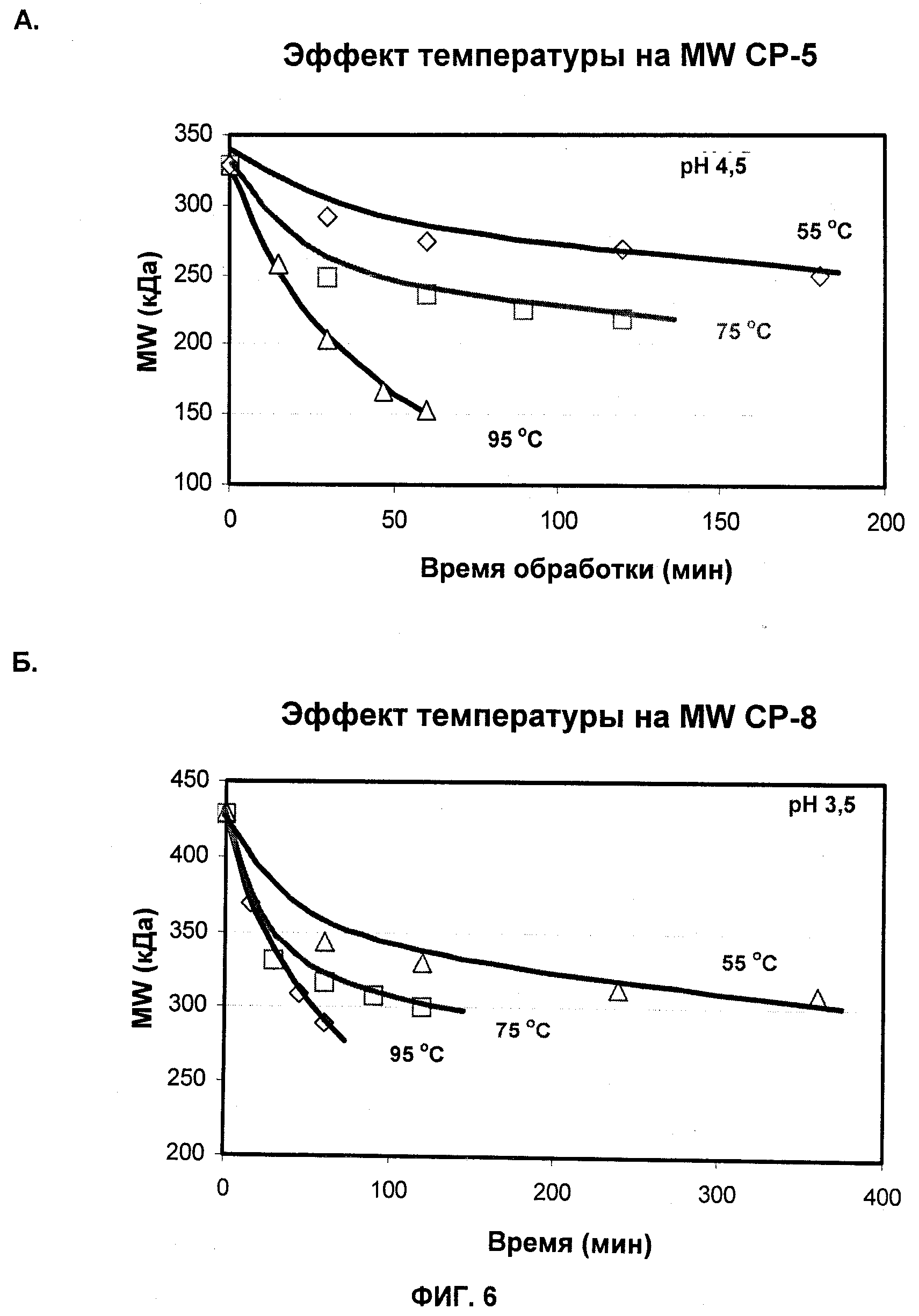
На Фиг.6А и 6Б показаны профили молекулярной массы СР5 (А) и СР8 (Б), продуцированных при различных температурах.
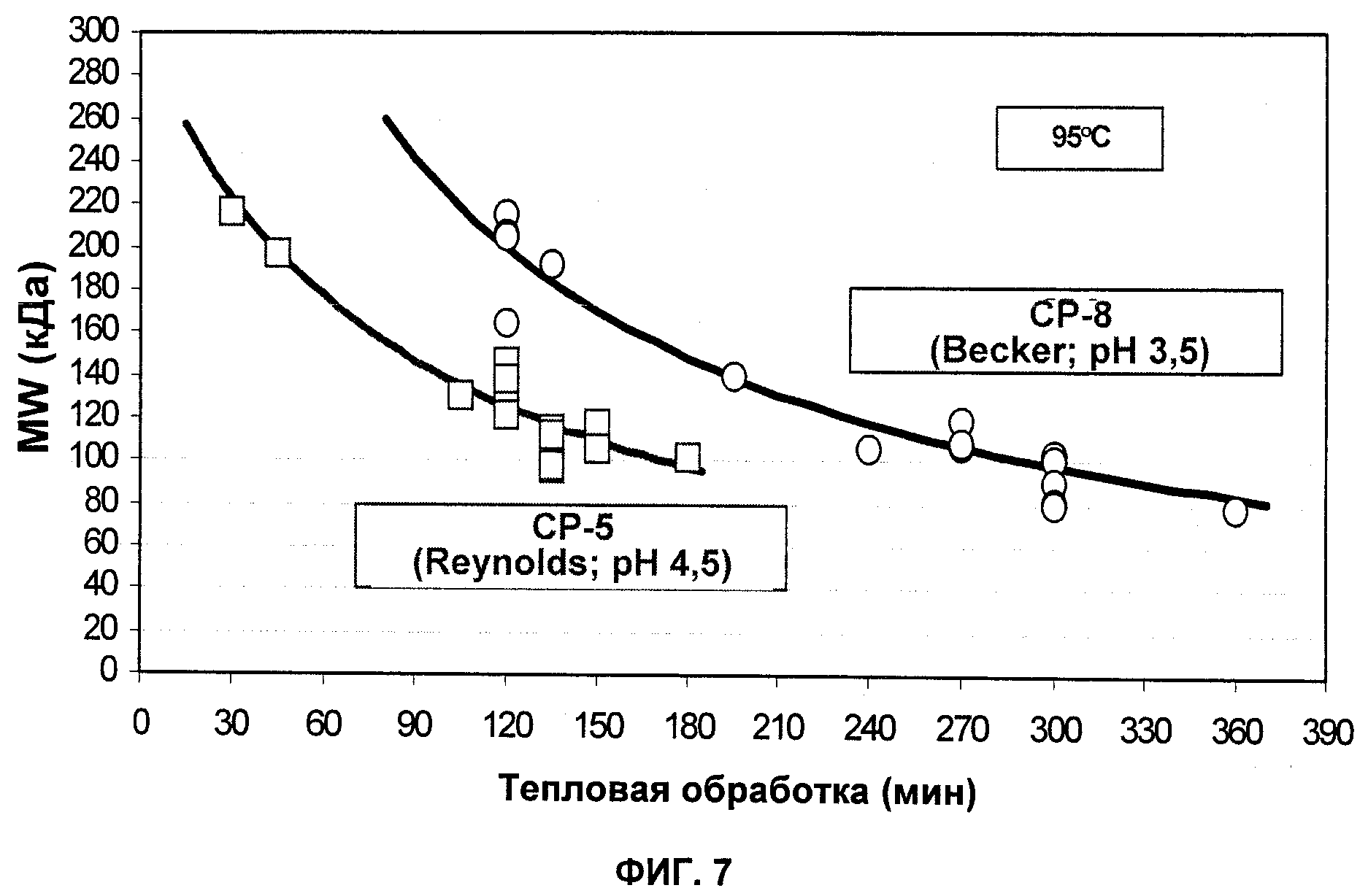
На Фиг.7 продемонстрирована корреляция молекулярной массы очищенных СР5 и СР8 со временем обработки для мягкого кислотного гидролиза.
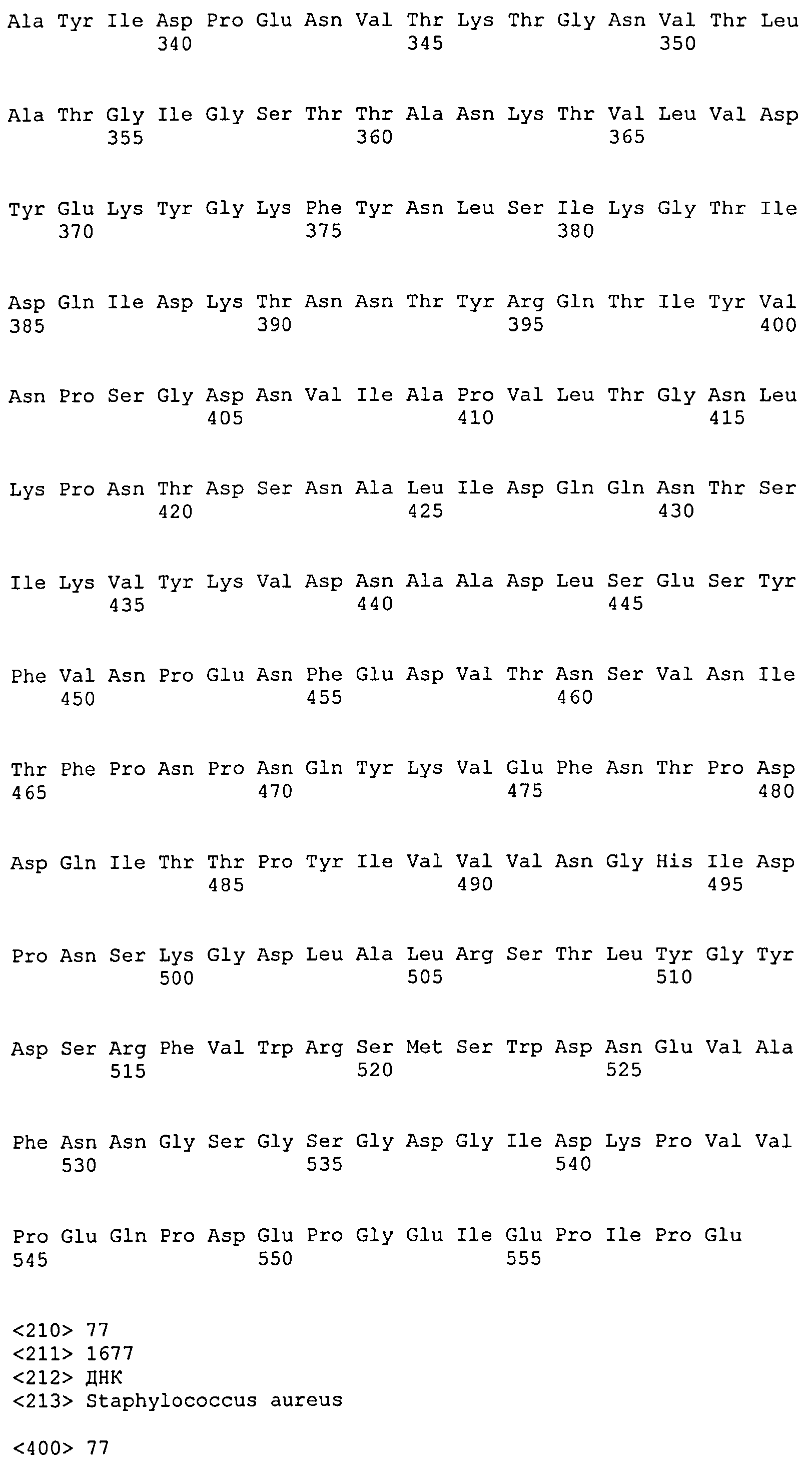
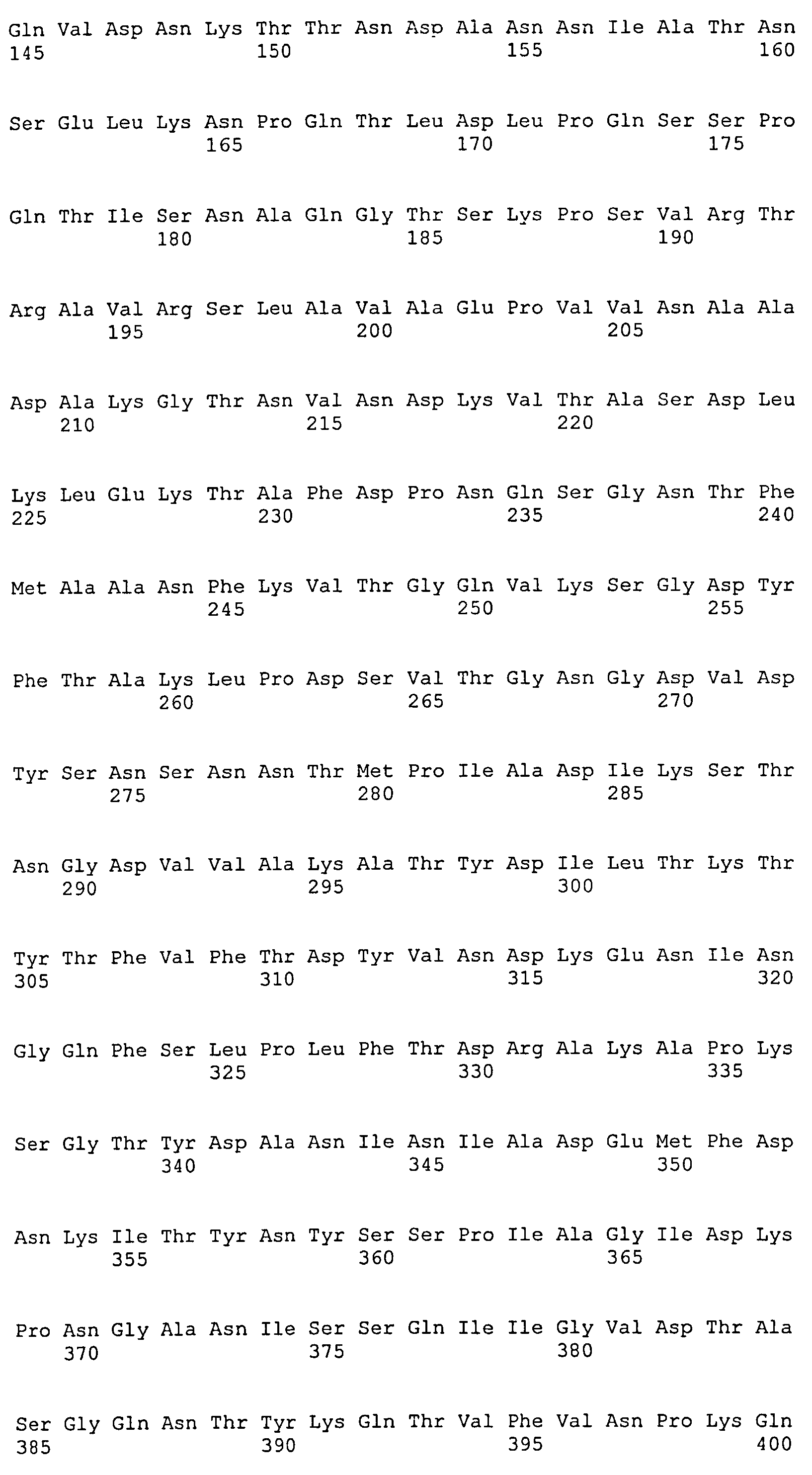
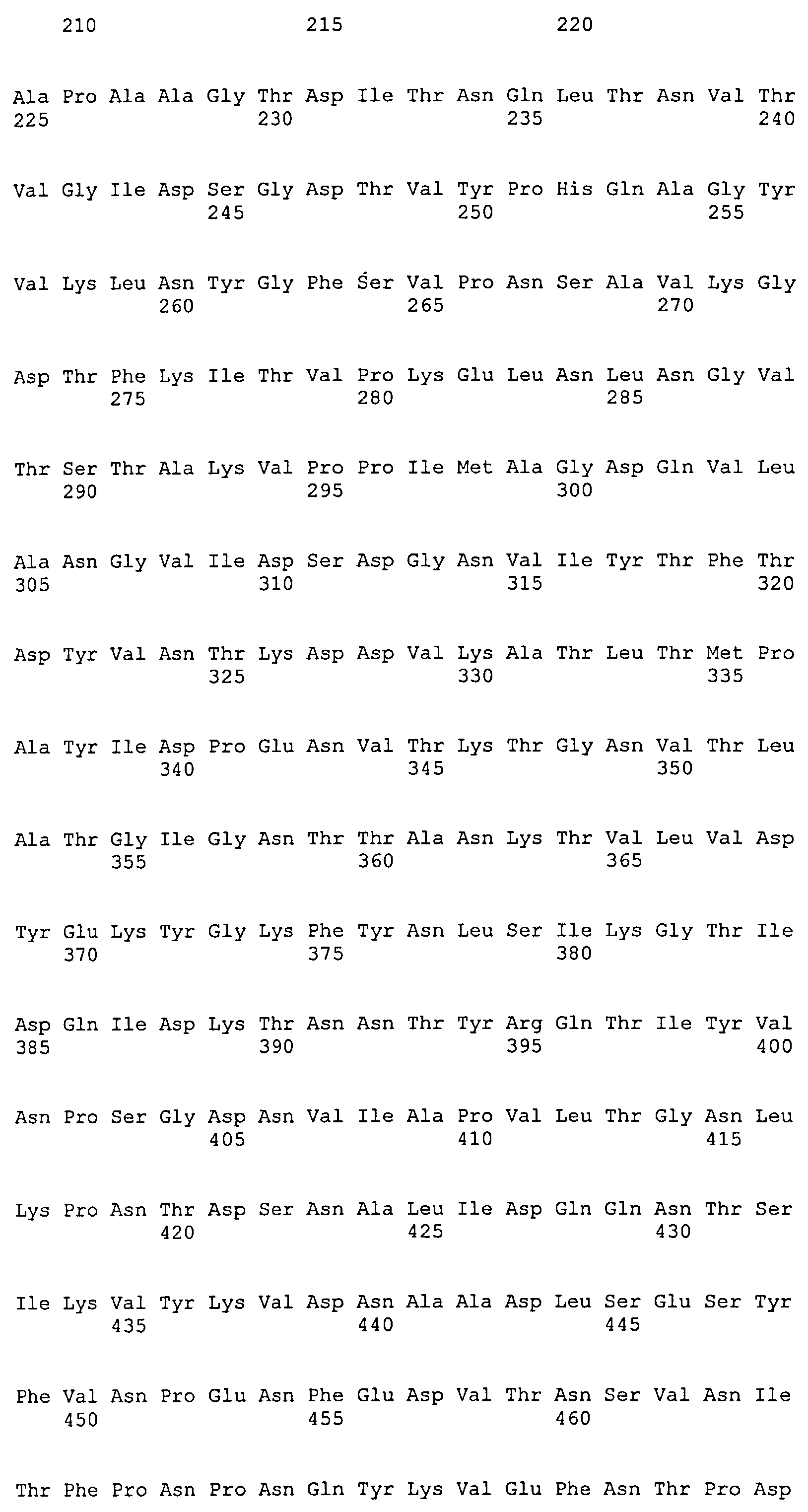
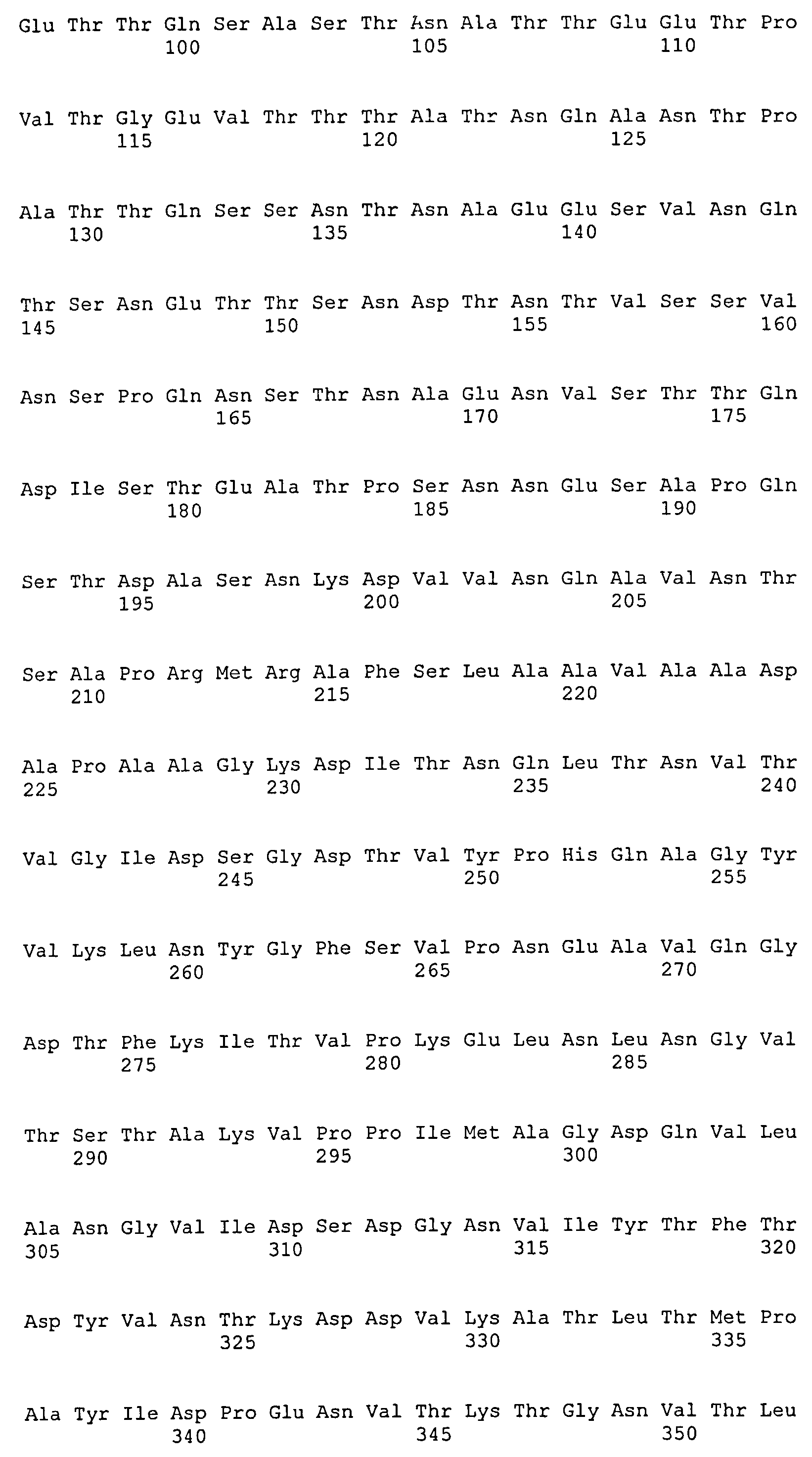
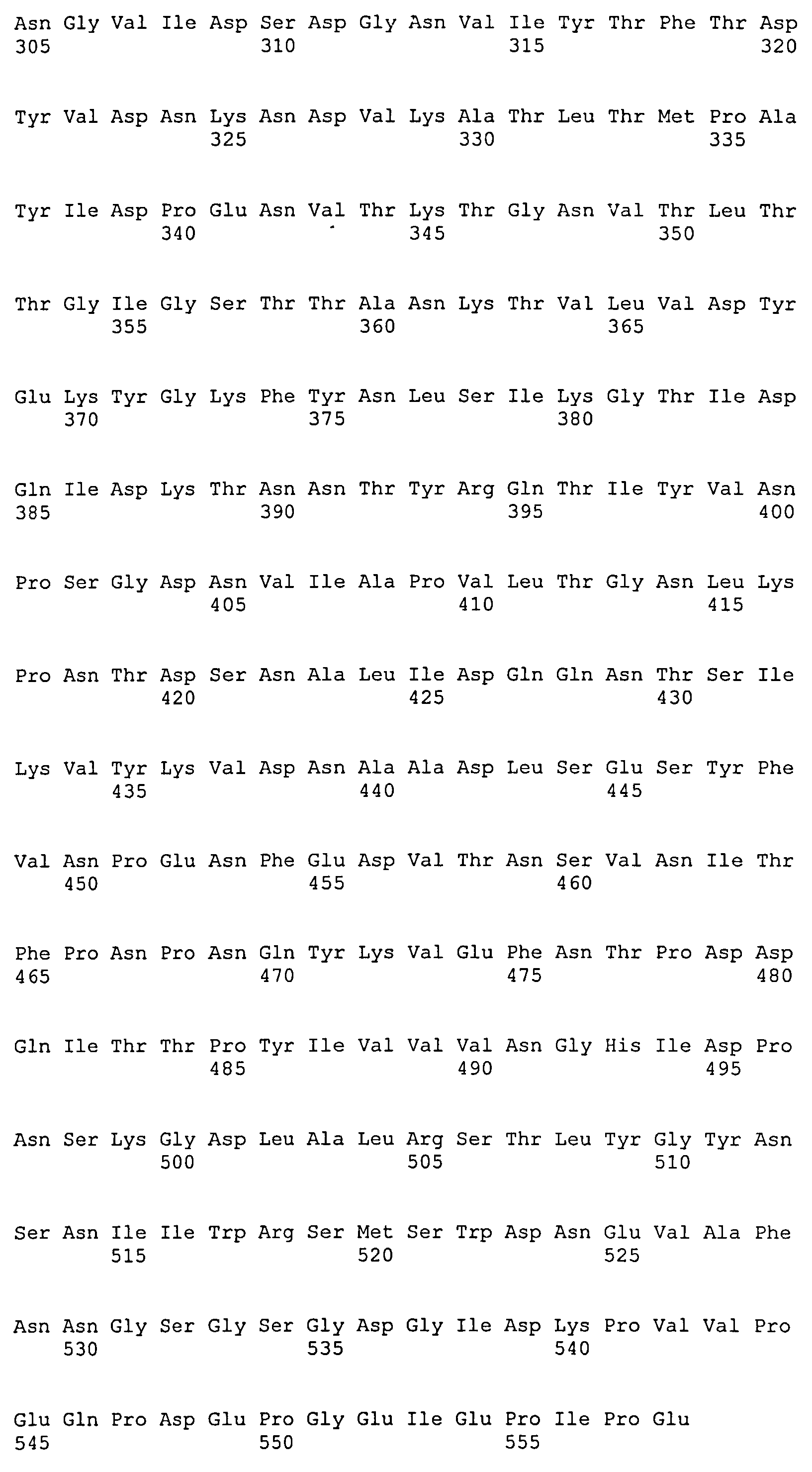
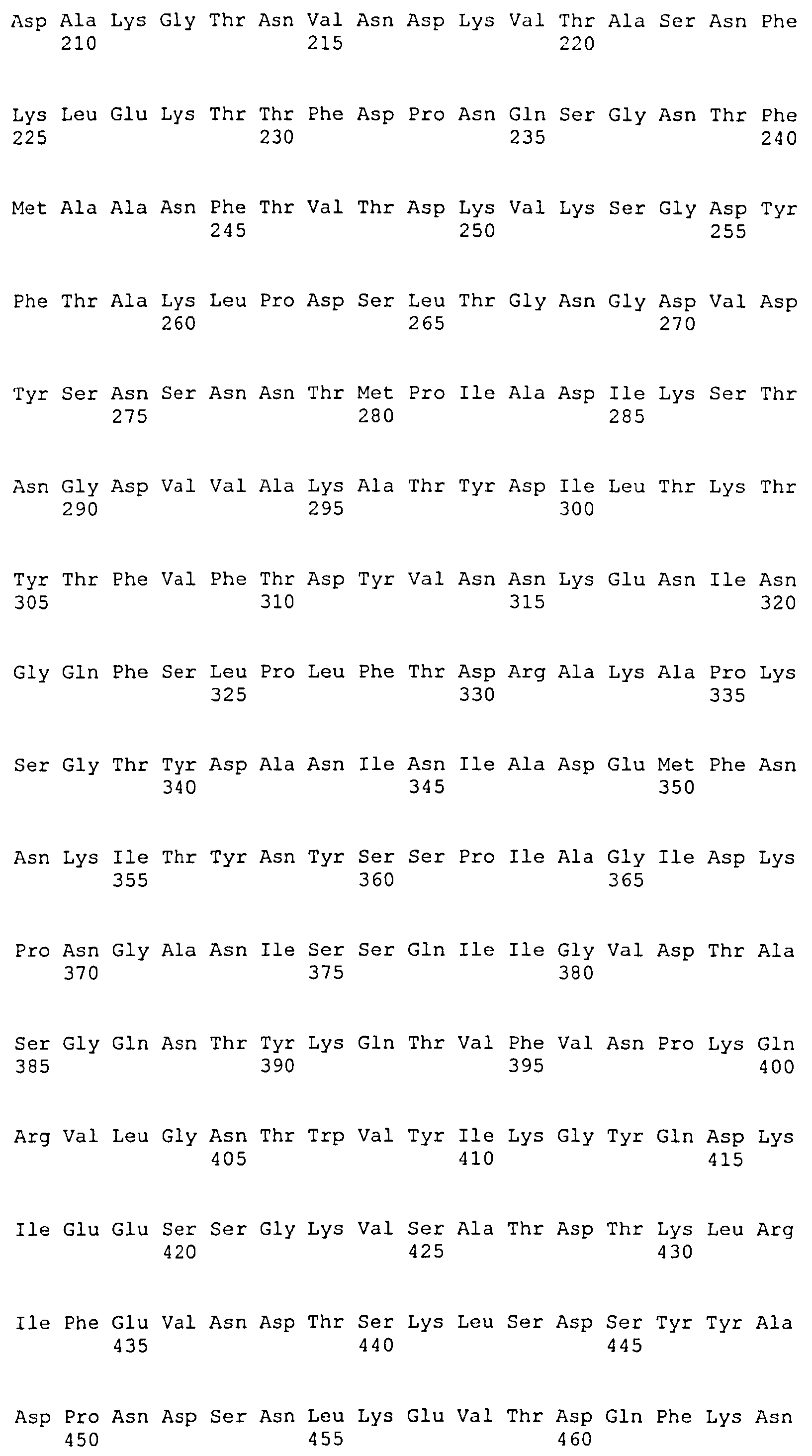
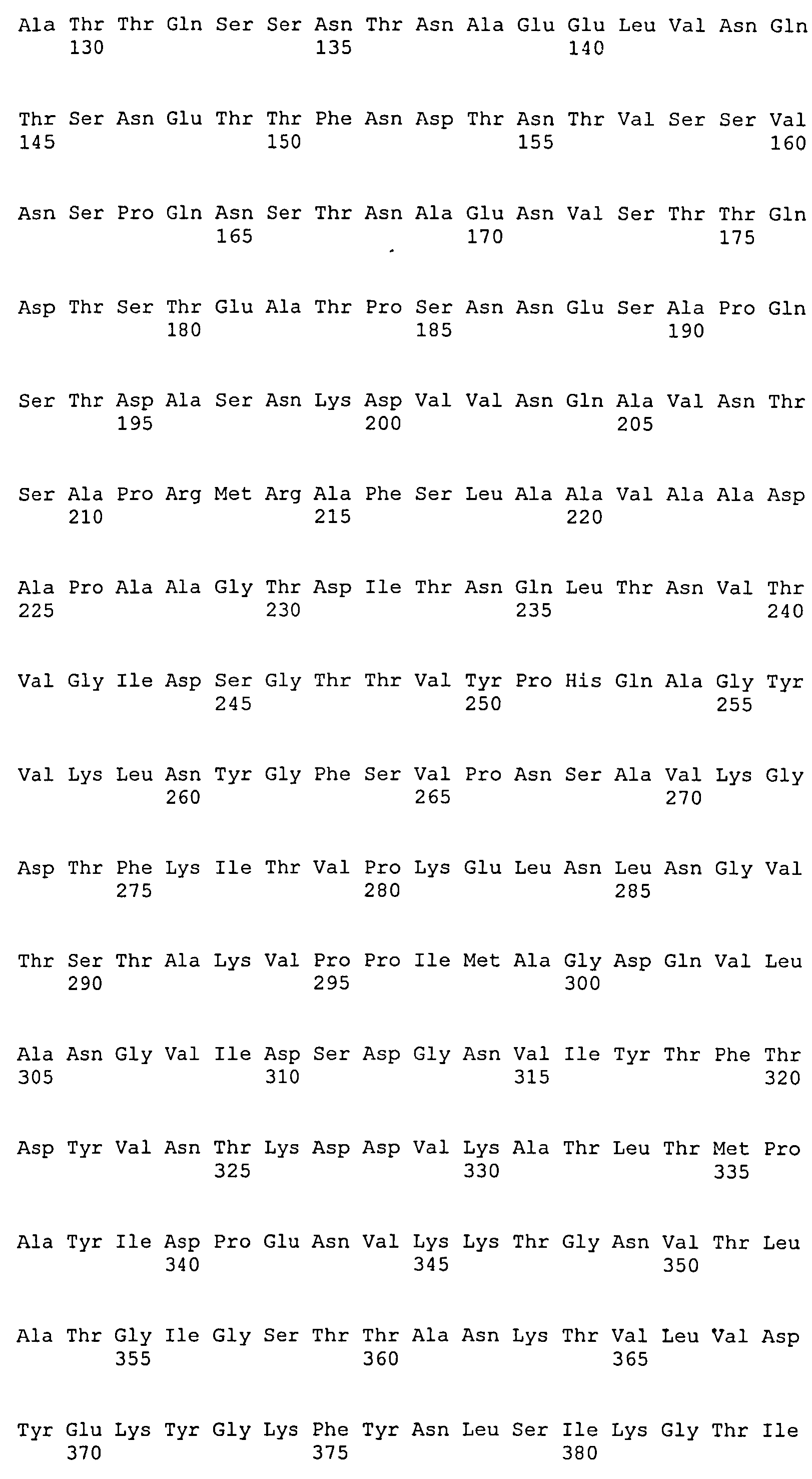
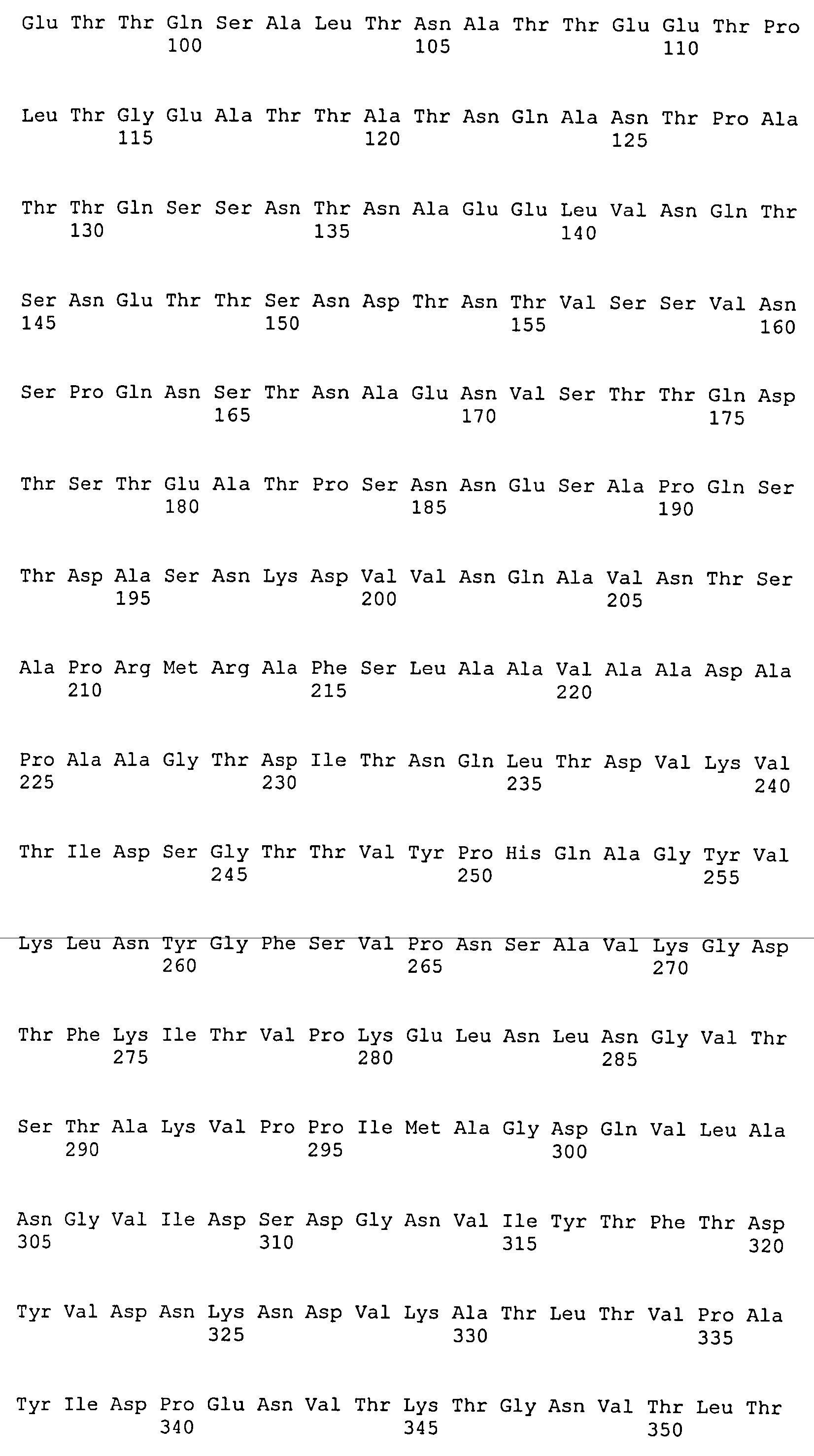
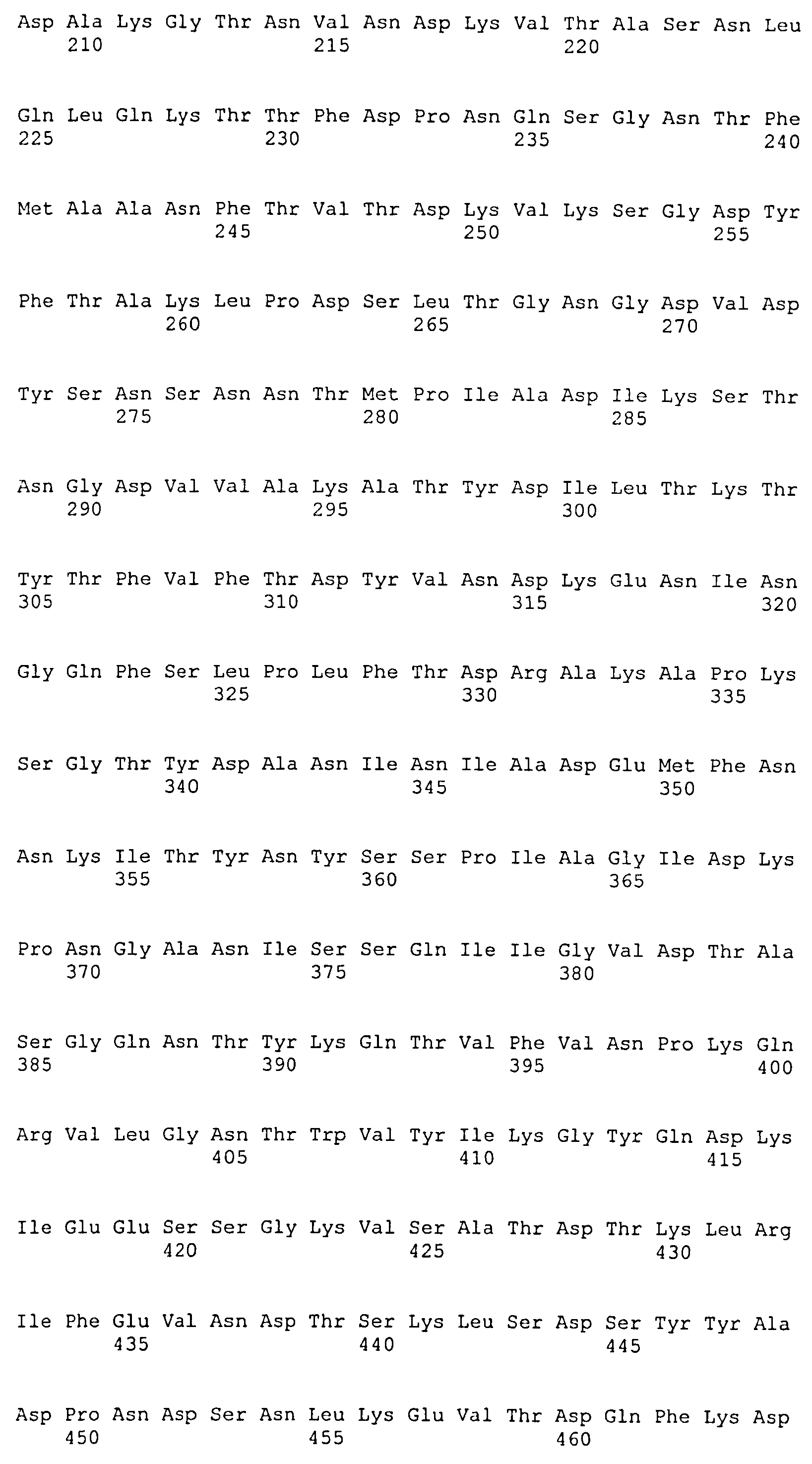
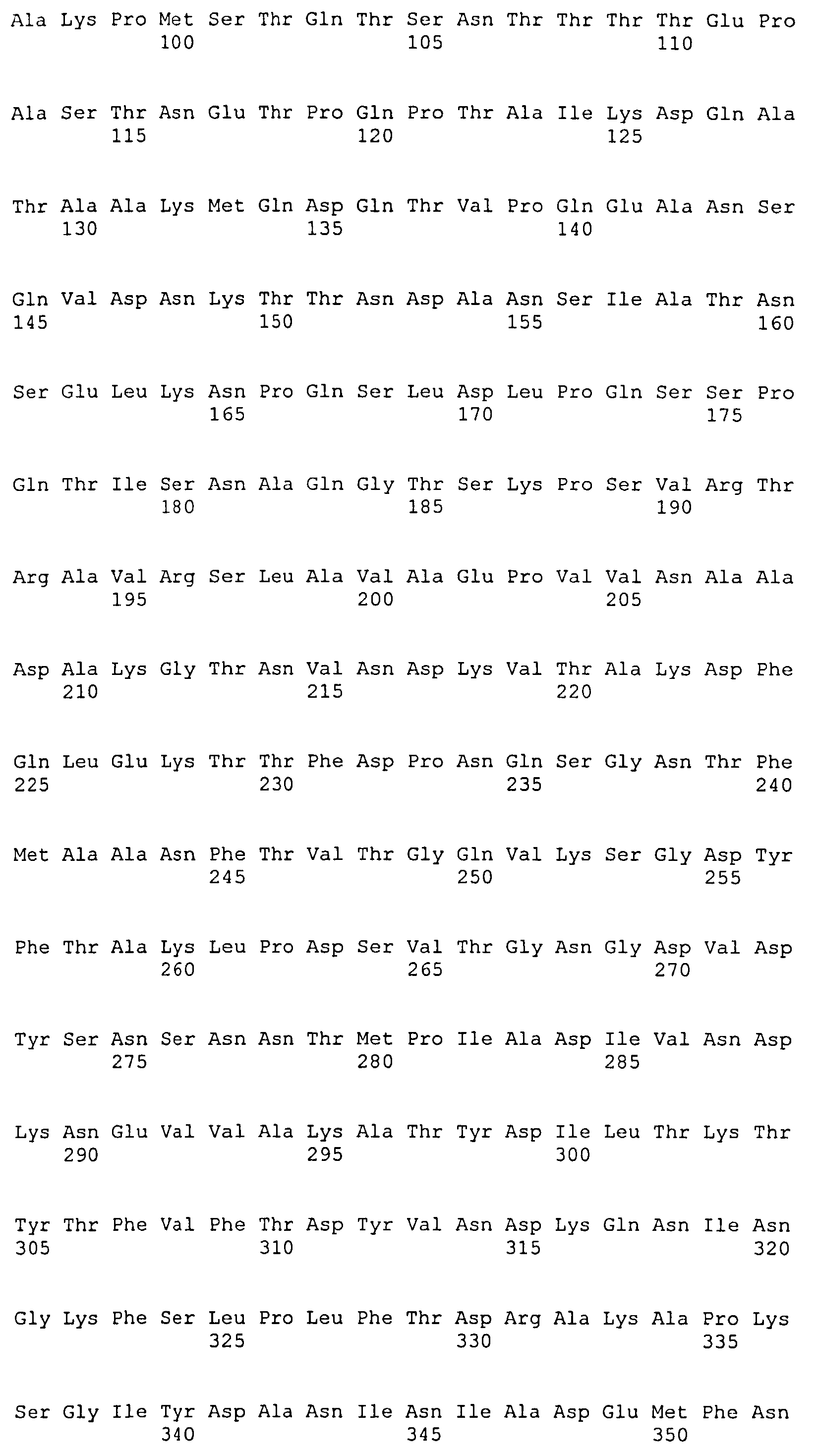
На Фиг.8А-8Д показано выравнивание ClfA между разными штаммами S. aureus (SEQ ID NO:62, 64, 68, 84, 70, 104, 66, 78, 86, 88, 90, 72, 74, 76, 80, 94, 82, 92, 96, 98, 100, 102, 106 и 108, соответственно, в порядке появления).
На Фиг.9 показано филогенетическое древо ClfA.
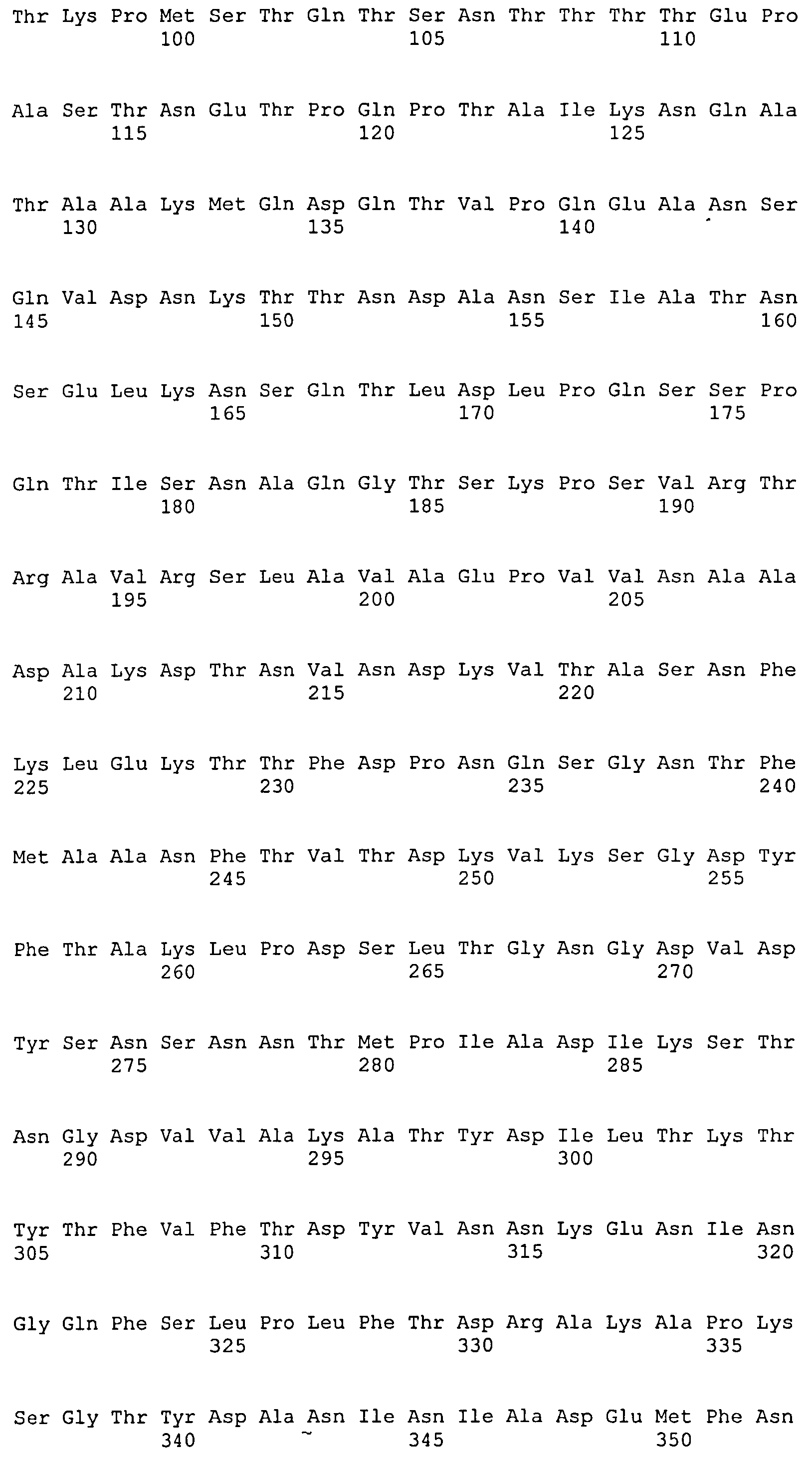
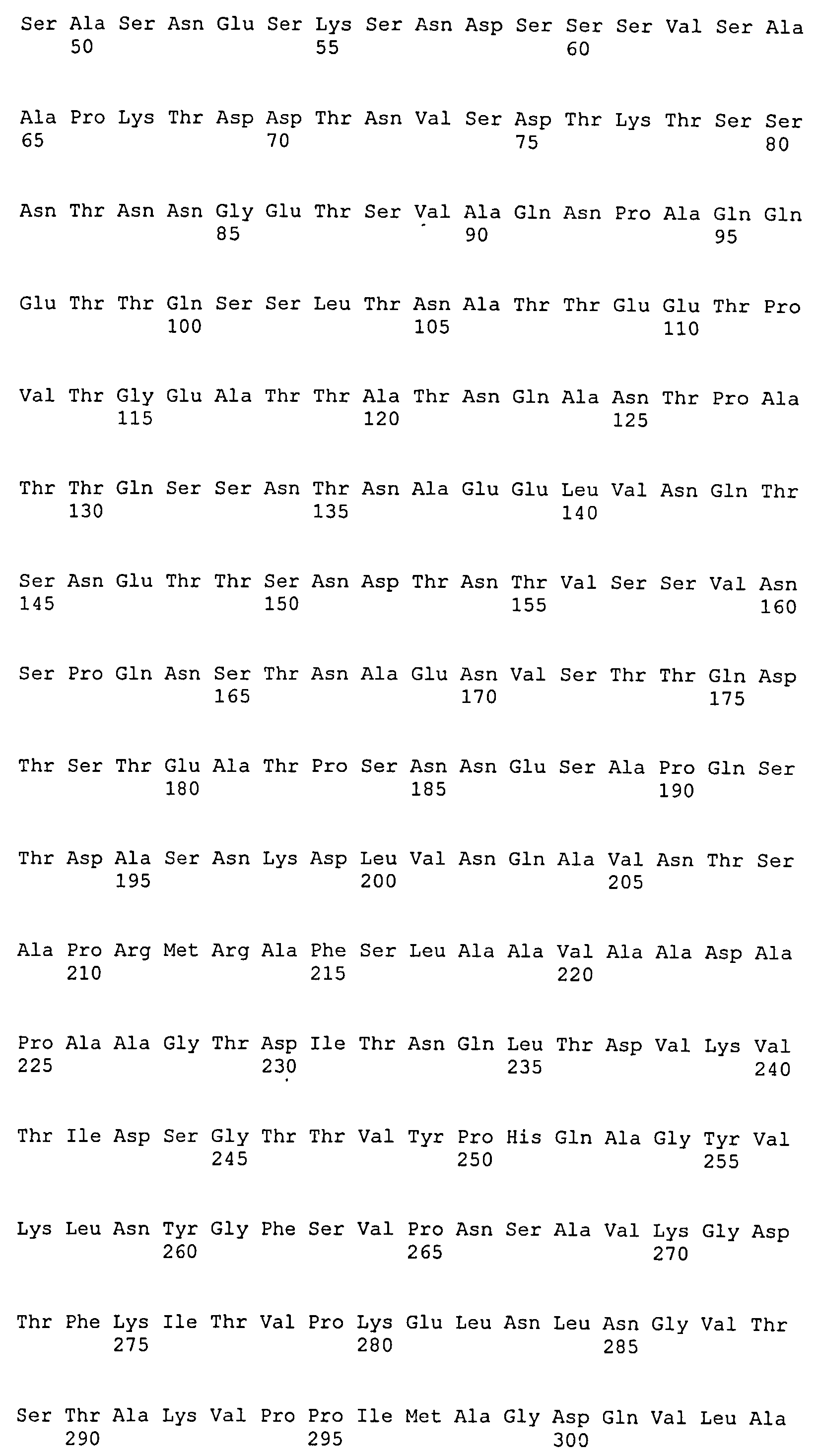
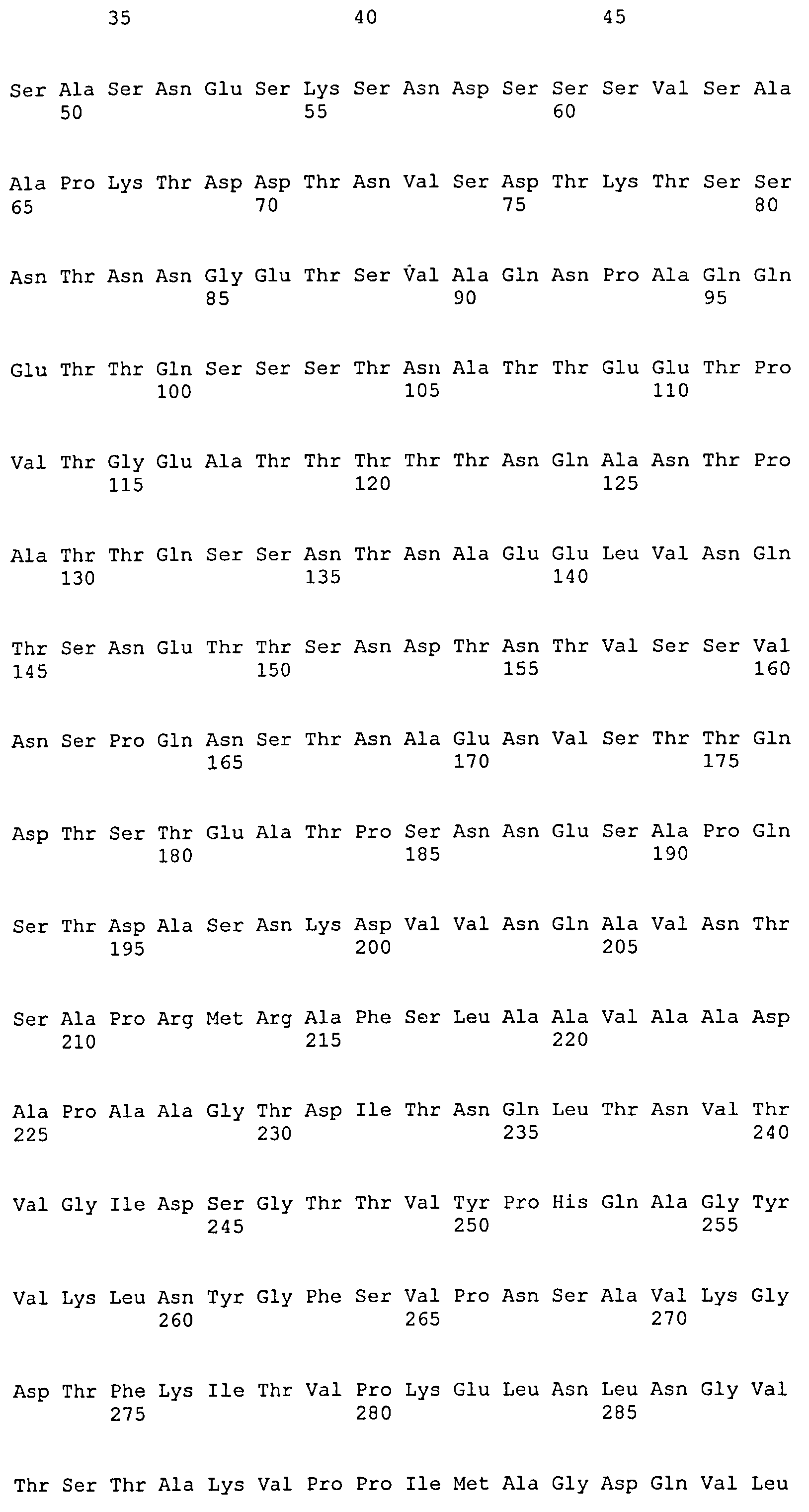
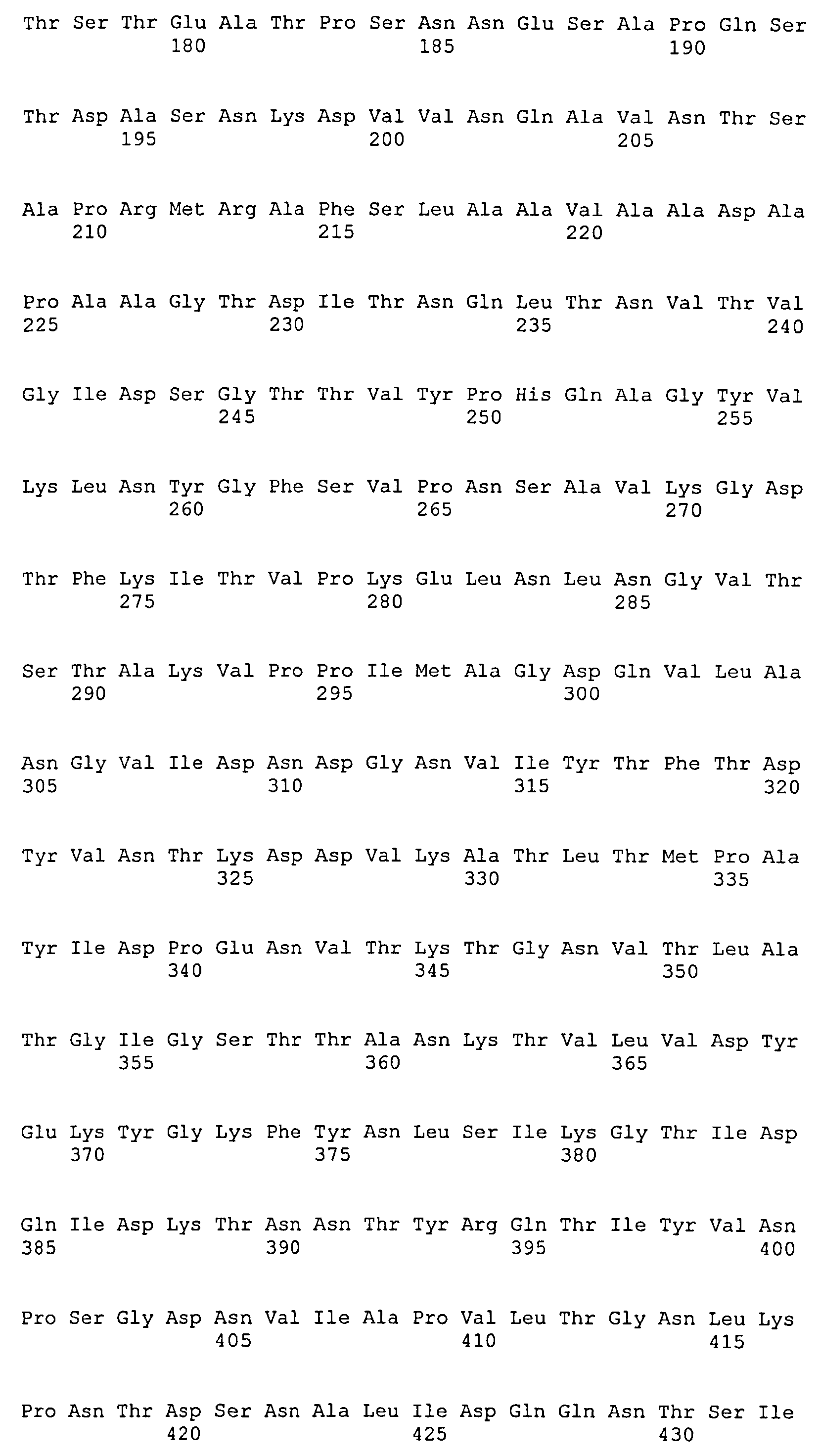
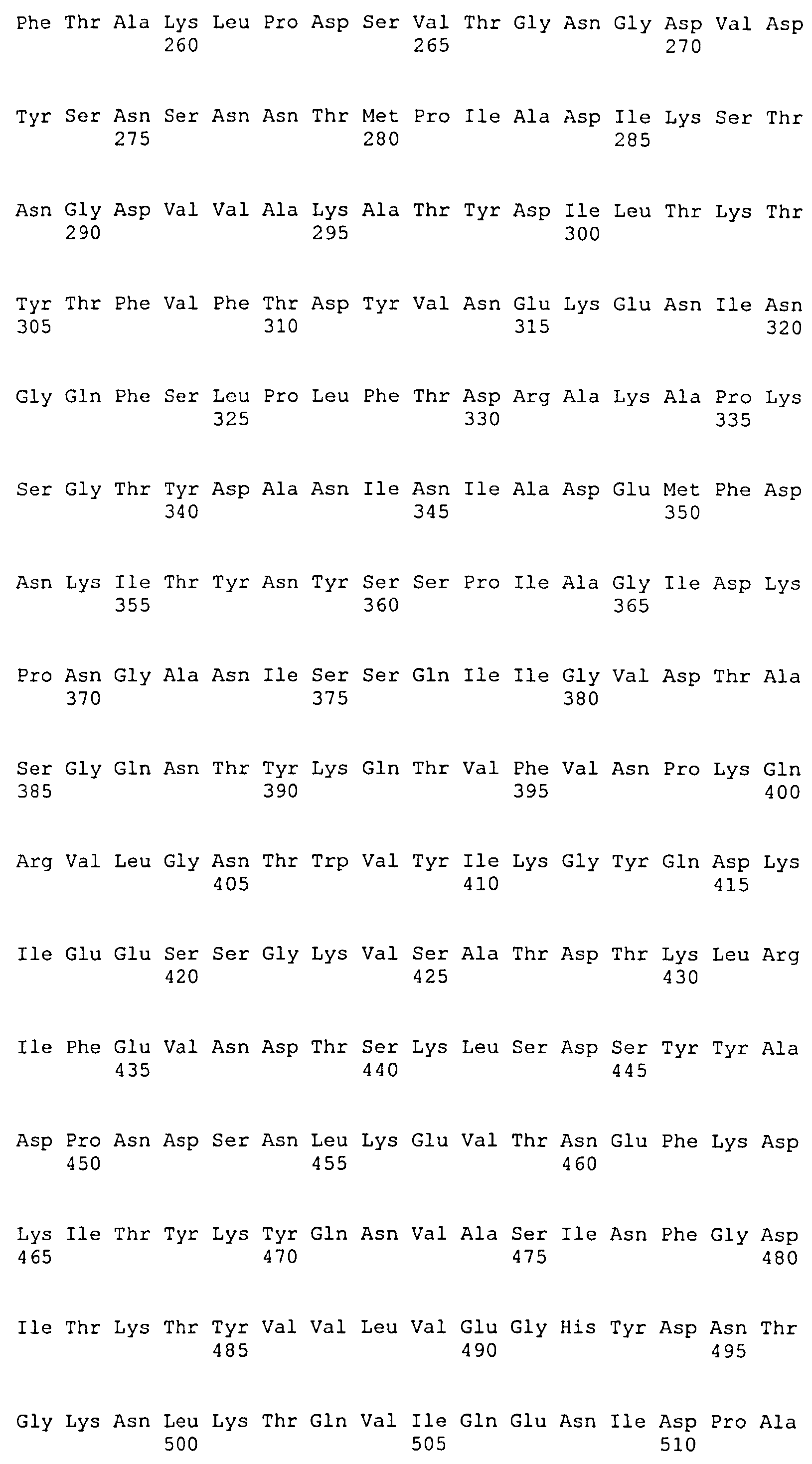
На Фиг.10А-10Д показано выравнивание ClfB между разными штаммами S. aureus (SEQ ID NO:26, 28, 32, 18, 54, 34, 36, 30, 16, 20, 22, 24, 38, 40, 42, 44, 46, 48, 50, 52, 56, 58 и 60, соответственно, в порядке появления).
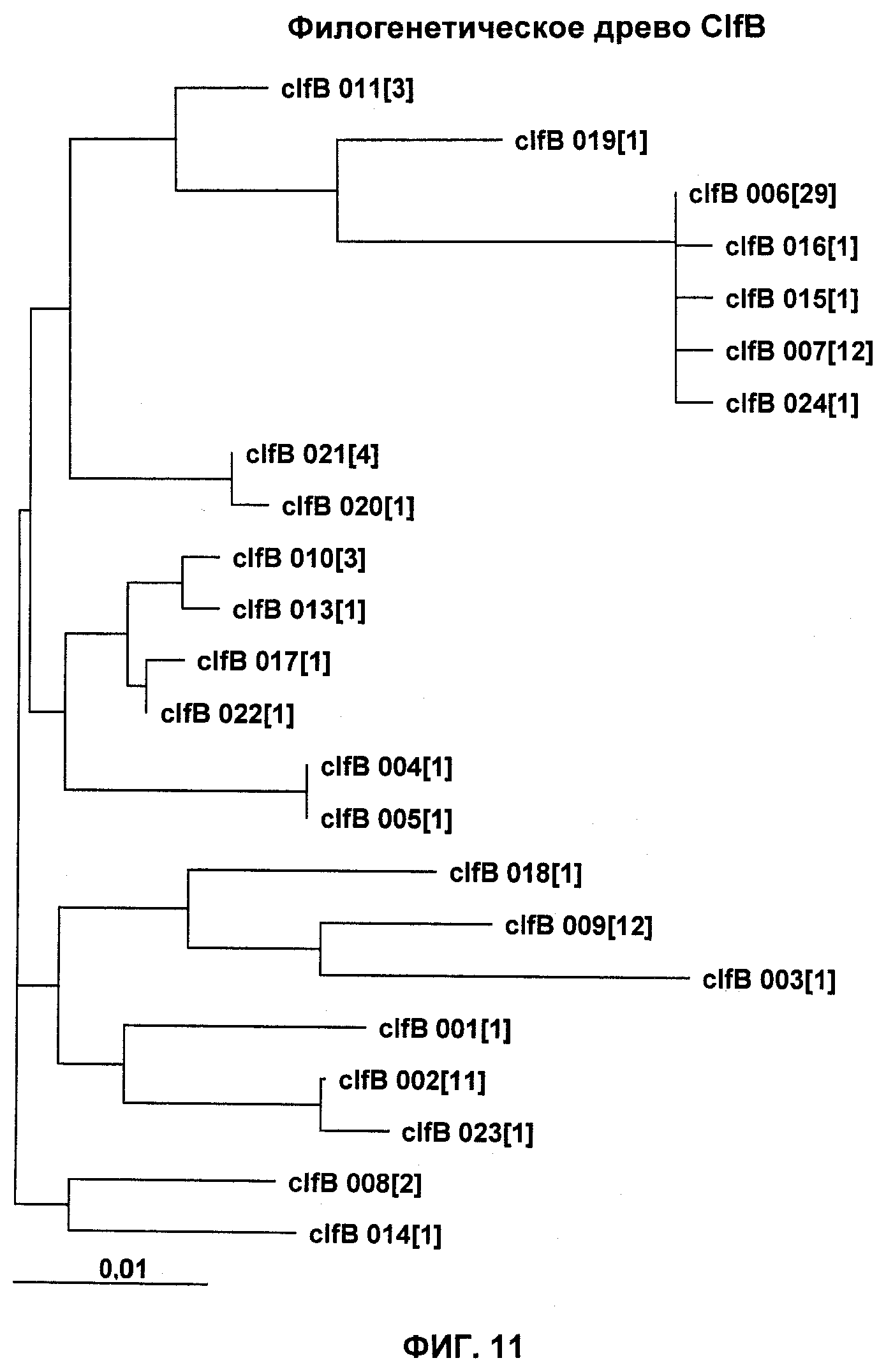
На Фиг.11 показано филогенетическое древо ClfB.
На Фиг.12 показано выравнивание MntC между разными штаммами S. aureus (SEQ ID NO:2, 8, 10, 4, 6, 14 и 12, соответственно, в порядке появления).
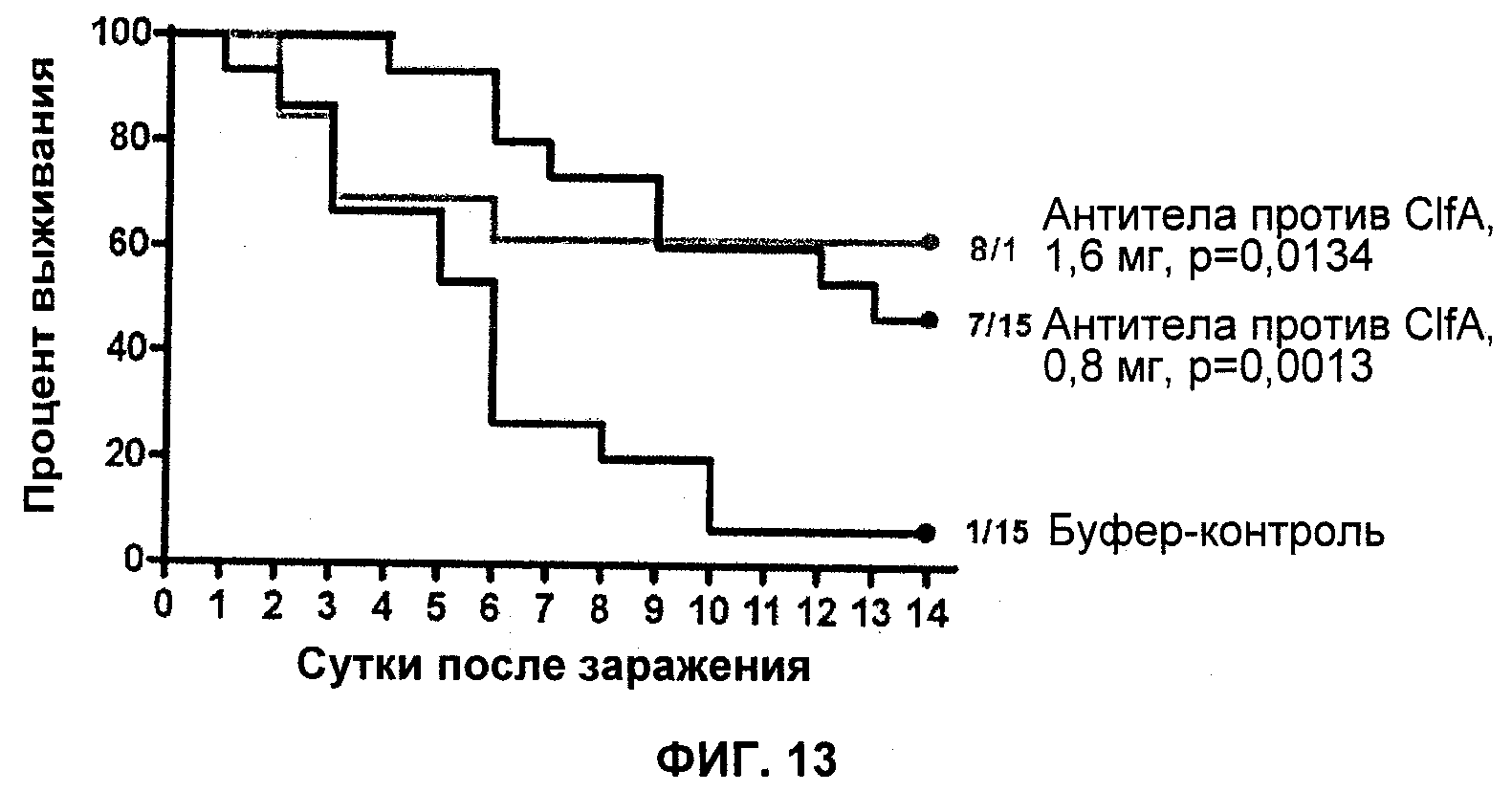
На Фиг.13 продемонстрировано то, что поликлональные кроличьи антитела против ClfA уменьшают число колоний S. aureus 659-018 в мышиной модели сепсиса.
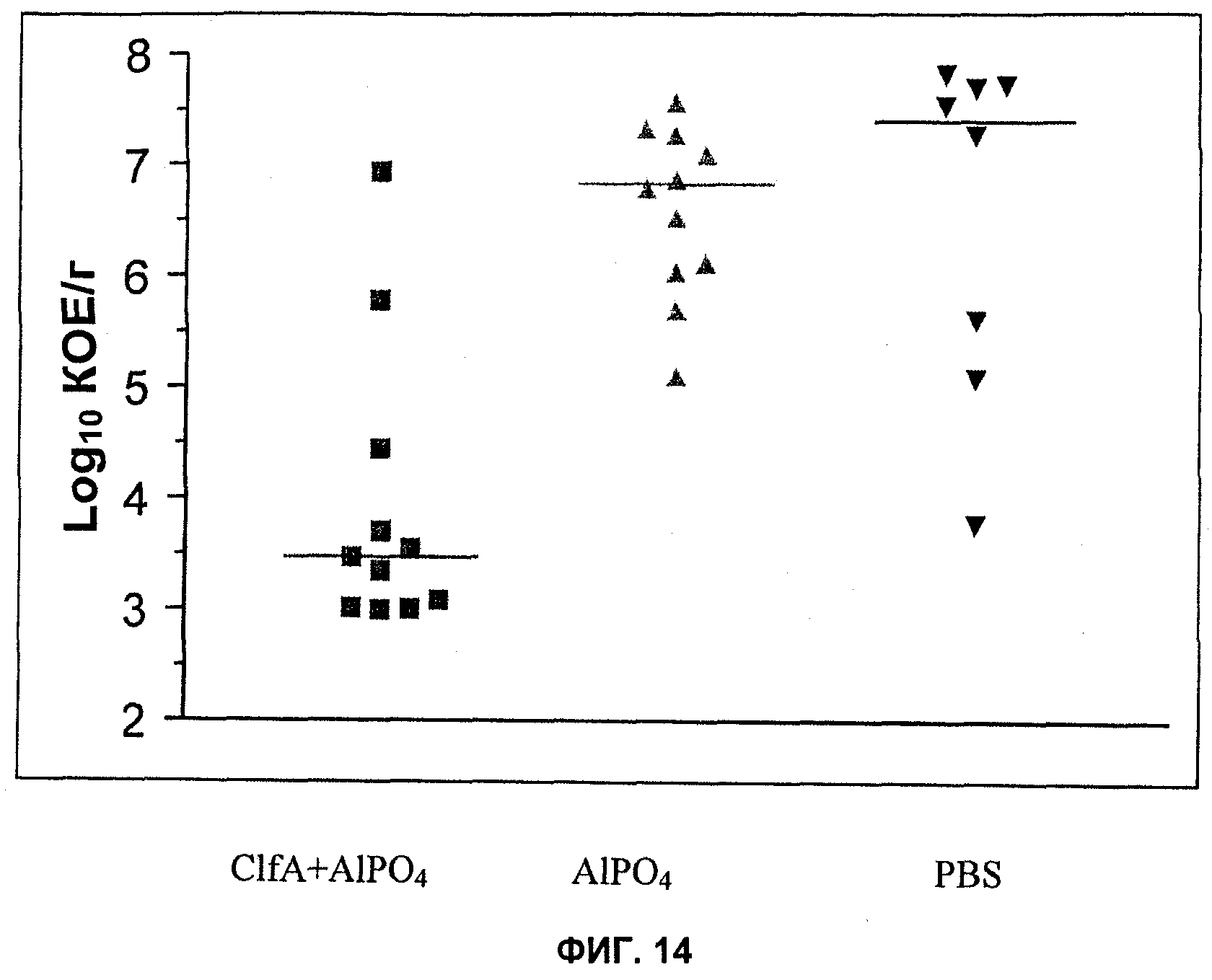
На Фиг.14 продемонстрировано то, что активная иммунизация ClfA уменьшает колонизацию сердца S. aureus PFESA0003 в кроличьей модели инфекционного эндокардита.
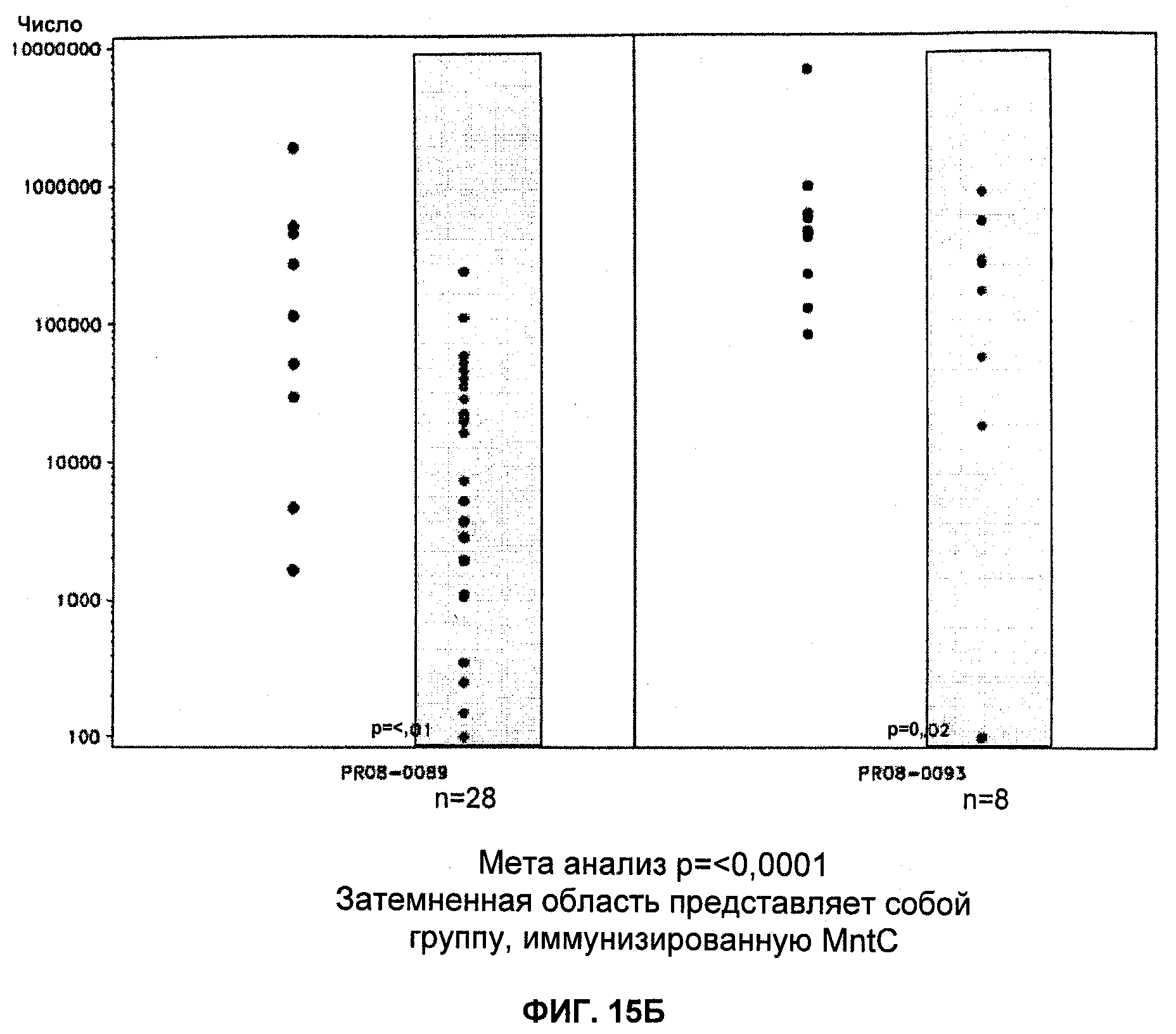
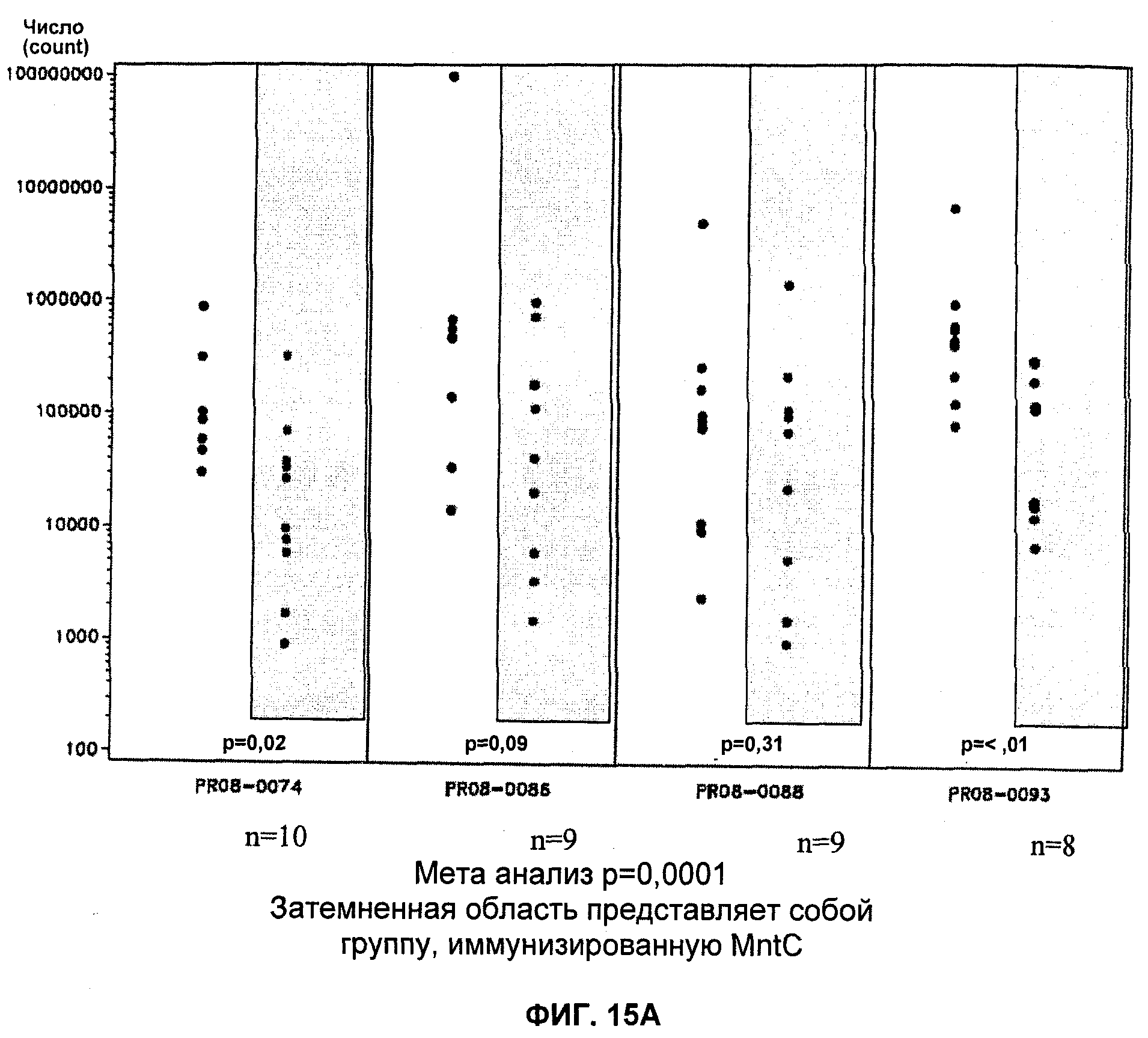
На Фиг.15А и 15Б продемонстрировано то, что иммунизация MntC уменьшает уровень S. aureus в крови. А: штамм PFESA0237 S. aureus; Б: штамм PFESA0266 S. aureus.
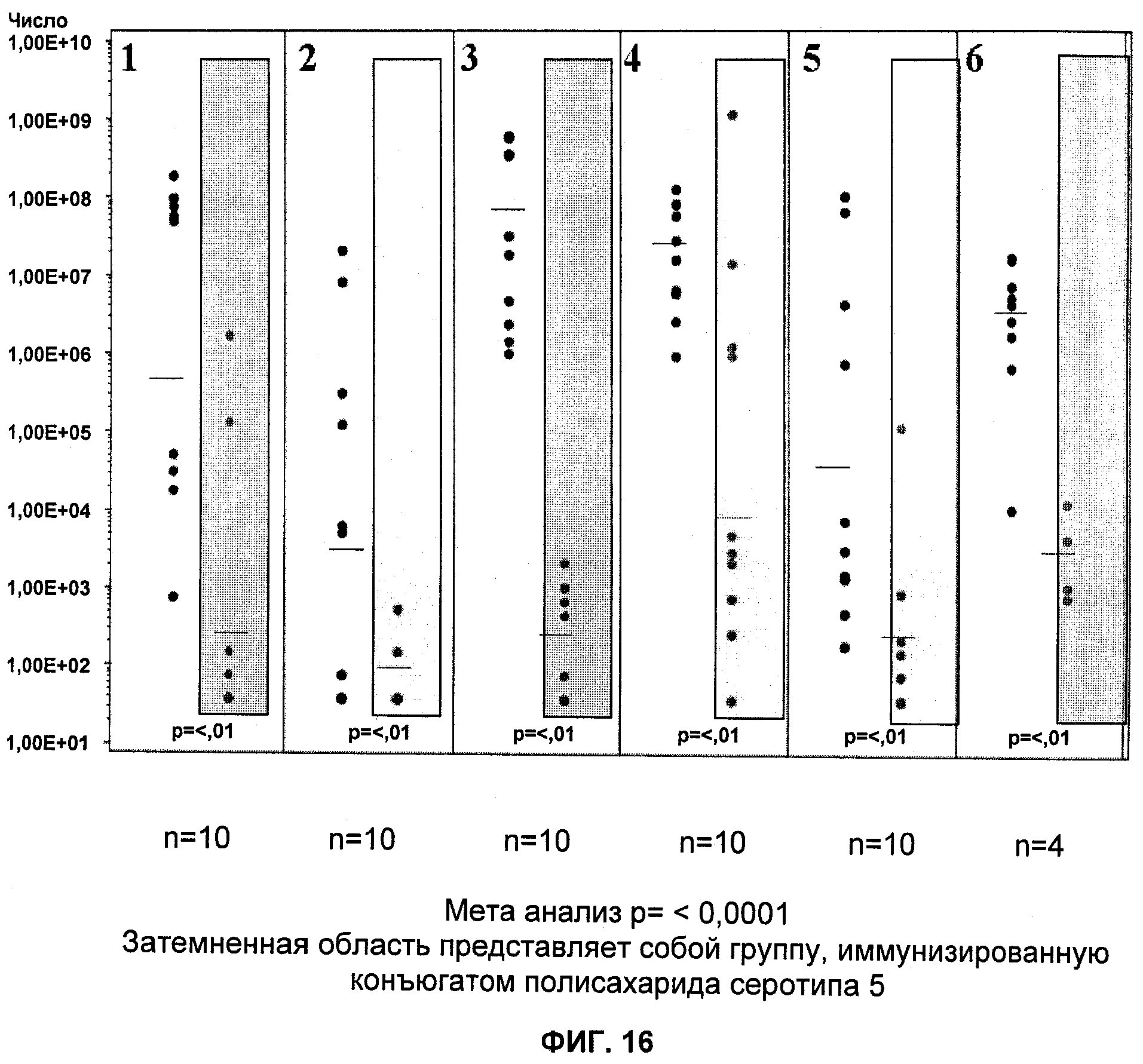
На Фиг.16 продемонстрировано то, что иммуногенная композиция на основе конъюгата СР5- S. aureus-CRM197 стабильно демонстрирует защиту в мышиной модели пиелонефрита.
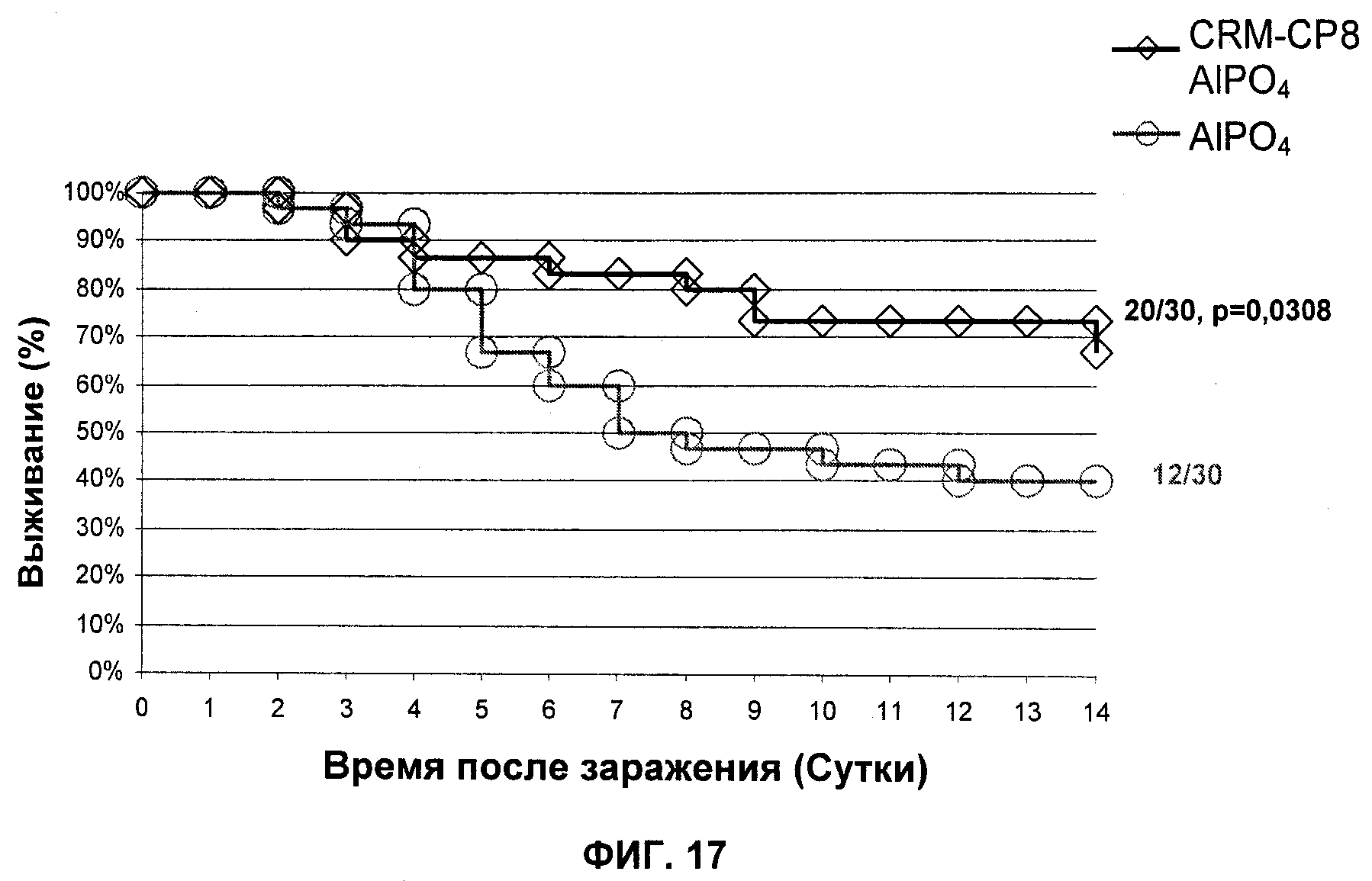
На Фиг.17 продемонстрировано то, что вакцинация иммуногенной композицией на основе конъюгата СР8- CRM197 уменьшает смертность в модели сепсиса.
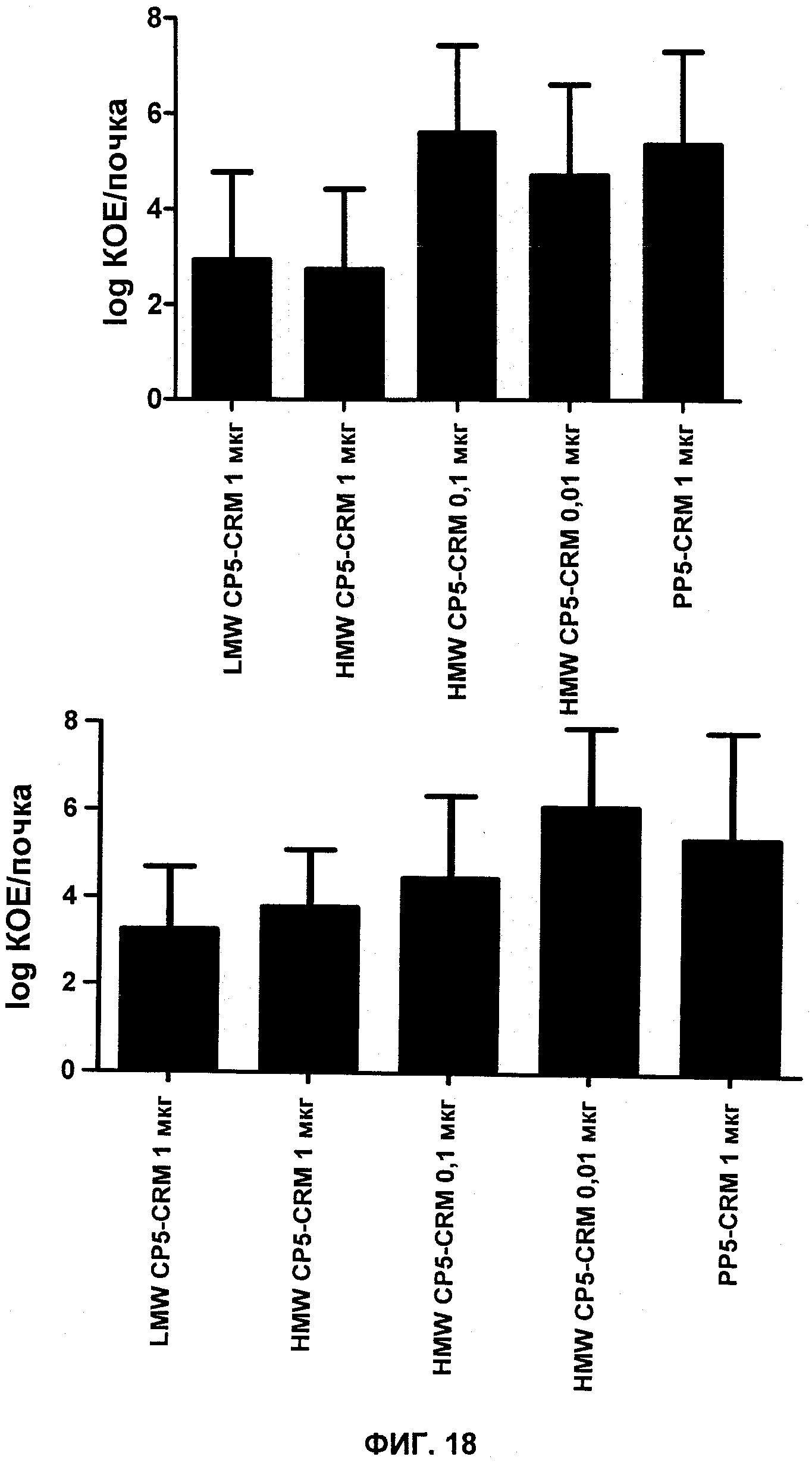
На Фиг.18 показаны колониеобразующие единицы (КОЕ), выделенные из почек после заражения S. aureus PFESA0266, у мышей, вакцинированных CP5-CRM с высокой молекулярной массой (HMW), CP5-CRM с низкой молекулярной массой (LMW) или контрольным PP5-CRM.
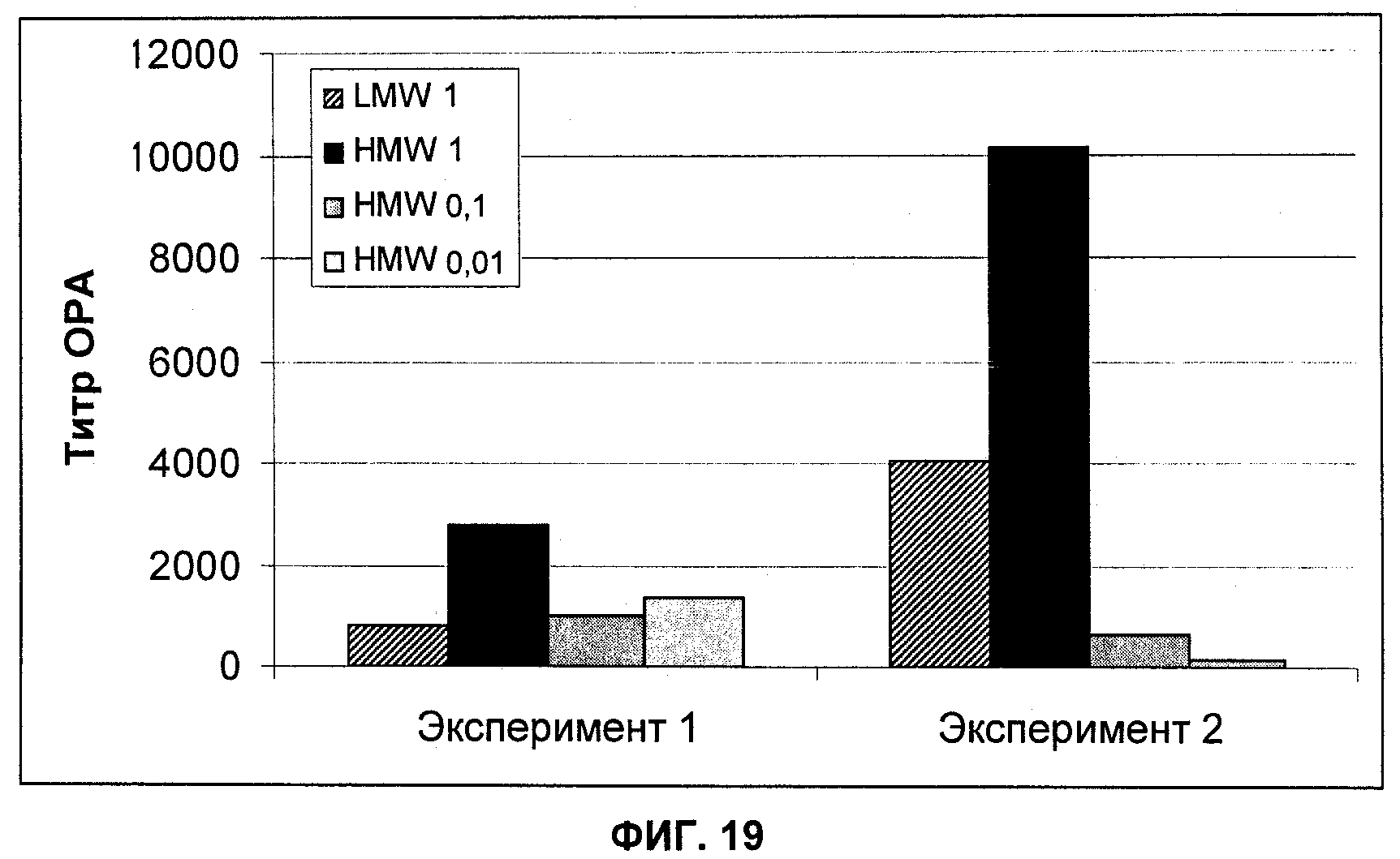
На Фиг.19 показано сравнение титров ОРА (опсоническая активность) (среднее геометрическое (geomean)) из сыворотки, полученной от мышей, вакцинированных разными композициями конъюгата полисахарида (CP5-CRM с высокой молекулярной массой (HMW), CP5-CRM с низкой молекулярной массой (LMW)). Группы состояли из 5-9 мышей.
На Фиг.20 продемонстрирован титр ОРА для сыворотки примата, не являющегося человеком, до (нед. 0, незакрашенные символы) и через 2 недели (нед. 2, закрашенные символы) после вакцинации разными комбинациями антигенов S. aureus. 3-антигенная вакцина (3Ag) состояла из трех антигенов, и 4-антигенная вакцина (4Ag) состояла из четырех антигенов. Каждая композиция имеет два конъюгата СР и либо 1, либо 2 пептида.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Прежде чем будут раскрыты настоящие способы и методологии лечения, следует понимать то, что данное изобретение не ограничивается конкретными способами и описанные экспериментальные условия, такие как способы и условия, могут варьировать. Также следует понимать, что используемая здесь терминология предназначена только для целей описания конкретных воплощений и не подразумевается, что она является ограничивающей.
Хотя в воплощении на практике или тестировании изобретения можно использовать любые способы и материалы, подобные или эквивалентные описанным здесь способам и материалам, сейчас описаны предпочтительные способы и материалы. Все упомянутые здесь публикации включены сюда посредством ссылки во всей их полноте.
Используемые здесь термины имеют значения, признанные и известные специалистам в данной области, однако, для удобства и полноты, конкретные термины и их значения изложены ниже.
При использовании здесь формы единственного числа включают в себя отсылки к множественному числу, если контекст ясно не диктует иное. Таким образом, например, ссылки на «способ» включают один или более чем один способ и/или стадии описанного здесь типа, и/или которые станут очевидными специалистам в данной области после прочтения данного описания, и так далее.
Термин «примерно» или «приблизительно» означает в пределах статистически значимого интервала величины. Такой интервал может находиться в пределах порядка величины, типично в пределах 20%, однако более типично в пределах 10% и даже более типично в пределах 5% данной величины или интервала. Допустимая вариация, охватываемая термином «примерно» или «приблизительно», зависит от конкретной исследуемой системы и может быть легко оценена специалистом обычной квалификации в данной области. Всякий раз, когда в пределах данной заявки перечислен интервал, каждое целое число в пределах интервала также рассматривается как воплощение изобретения.
«Антитело» представляет собой молекулу иммуноглобулина, способную к специфичному связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., через по меньшей мере один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. Подразумевается, что данный термин в том виде, как он здесь используется, если контекст на указывает на иное, охватывает не только интактные поликлональные или моноклональные антитела, но также сконструированные антитела (например, химерные, гуманизированные и/или дериватизированные для изменения эффекторных функций, стабильности и других биологических активностей) и их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv) и однодоменные антитела, включая антитела акулы и верблюдовых), и слитые белки, содержащие часть, представляющую собой антитело, мультивалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела, до тех пор, пока они демонстрируют желательную биологическую активность) и фрагменты антител, как здесь описано, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или их подкласс), и нет необходимости в том, чтобы антитело принадлежало к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константного домена тяжелых цепей антитела, иммуноглобулины можно приписать к разным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и несколько из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2 у человека. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Субъединичные структуры и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
«Фрагменты антитела» содержат только часть интактного антитела, где данная часть предпочтительно сохраняет по меньшей мере одну из функций, обычно ассоциированных с данной частью, когда она находится в интактном антителе, предпочтительно большинство из этих функций или все эти функции.
Термин «антиген» обычно относится к биологической молекуле, обычно к белку, пептиду, полисахариду, липиду или конъюгату, которая содержит по меньшей мере один эпитоп, с которым может селективно связываться когнатное антитело; или, в некоторых случаях, к иммуногенной субстанции, которое может стимулировать продукцию антител или ответы Т-клеток, или и то, и другое, в животном, включая композиции, которые инъецируют животному или которые животное абсорбирует. Может быть генерирован иммунный ответ на целую молекулу или на одну или более чем одну из разных частей молекулы (например, эпитоп или гаптен). Данный термин можно использовать для отнесения к индивидуальной молекуле или к гомогенной или гетерогенной популяции антигенных молекул. Антиген распознается антителами, рецепторами Т-клеток или другими элементами специфичного гуморального и/или клеточного иммунитета. Термин «антиген» включает все родственные антигенные эпитопы. Эпитопы данного антигена можно идентифицировать с использованием любого числа методик картирования эпитопов, хорошо известных в данной области. Смотрите, например, Epitope Mapping Protocols в Methods in Molecular Biology, Vol.66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, N. J. Например, линейные эпитопы могут быть определены путем, например, параллельного синтеза большого числа пептидов на твердых подложках, пептидов, соответствующих частям молекулы белка, и проведением реакции пептидов с антителами, в то время, как пептиды все еще присоединены к подложкам. Такие методики известны в данной области и описаны, например, в патенте США №4708871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1986) Molec. Immunol. 23:709-715, которые все включены сюда посредством ссылки во всей их полноте. Сходным образом, конформационные эпитопы могут быть идентифицированы путем определения пространственной конформации аминокислот, как, например, путем рентгеновской кристаллографии и 2-мерного ядерного магнитного резонанса. Смотрите, например, Epitope Mapping Protocols, выше. Кроме того, для целей настоящего изобретения, термин «антиген» также может быть использован в отношении белка, который включает модификации, такие как делеции, вставки и замены (обычно консервативные по природе, но они могут быть неконсервативными), нативной последовательности, до тех пор, пока белок сохраняет способность вызывать иммунный ответ. Данные модификации могут быть преднамеренными, такими как полученные посредством сайт-направленного мутагенеза, или посредством конкретных синтетических процедур, или посредством подхода генной инженерии, или могут быть случайными, такими как при мутациях у хозяина, который продуцируют антигены. Кроме того, антиген может быть извлечен, получен или выделен из микроба, например, бактерии, или может представлять собой целый организм. Сходным образом, олигонуклеотид или полинуклеотид, который экспрессирует антиген, как, например, в приложениях по иммунизации нуклеиновыми кислотами, также включен в данное определение. Также включены синтетические антигены, например полиэпитопы, фланкирующие эпитопы и другие антигены, полученные рекомбинантным путем или путем синтеза (Bergmann et al. (1993) Eur. J. Immunol. 23:2777 2781; Bergmann et al. (1996) J. Immunol. 157:3242 3249; Suhrbier, A. (1997) Immunol. and Cell Biol. 75:402 408; Gardner et al. (1998) 12th World AIDS Conference, Geneva, Switzerland, Jun. 28 - Jul. 3, 1998).
Термин «адъювант» относится к соединению или смеси, которая усиливает иммунный ответ на антиген, как описано далее и проиллюстрировано примерами здесь.
«Бактериемия» представляет собой временное присутствие бактерий в крови. Бактериемия может развиваться в септицемию или сепсис, который будет рассматриваться как инфекция и представляет собой постоянное присутствие бактерий в крови с ассоциированными клиническими признаками/симптомами. Не все бактерии способны выживать в крови. Лишь те, которые действительно имеют специальные генетические признаки, которые обеспечивают эту способность. Также важную роль играют факторы хозяина.
Термин «капсульный полисахарид» или «полисахарид капсулы» относится к полисахаридной капсуле, которая находится снаружи от клеточной стенки большинства изолятов стафилококков. Например, S. aureus включает компонент клеточной стенки, состоящий из пептидогликанового комплекса, который делает возможным выживание организма при неблагоприятных осмотических условиях и также включает уникальную тейхоевую кислоту, связанную с пептидогликаном. Находящаяся снаружи от клеточной стенки тонкая полисахаридная капсула покрывает большинство изолятов S. aureus. Эту серологически особую капсулу можно использовать для серотипирования различных изолятов S. aureus. Было показано, что многие из клинически значимых изолятов включают два типа капсулы: серотип 5 (СР5) и серотип 8 (СР8). Структуры СР5 и СР8 схематически показаны на Фиг.4.
Термин «конъюгаты» в том виде, как он здесь используется, включает капсульный полисахарид, обычно с желательным интервалом молекулярной массы, и белок-носитель, где капсульный полисахарид конъюгирован с белком-носителем. Конъюгаты могут содержать или могут не содержать некоторое количество свободного капсульного полисахарида. Фраза «свободный капсульный полисахарид» в том виде, как она здесь используется, относится к капсульному полисахариду, который является нековалентно ассоциированным с (т.е. нековалентно связанным с, адсорбированным на или захваченным в или с) конъюгированным капсульным полисахаридом-белком-носителем. Термины «свободный капсульный полисахарид», «свободный полисахарид» и «свободный сахарид» могут быть использованы взаимозаменяемо и предназначены для передачи того же самого значения. Независимо от природы молекулы-носителя, она может быть конъюгирована с капсульным полисахаридом либо непосредственно, либо через линкер. Термины «конъюгировать», «конъюгированный» и «конъюгирование» в том виде, как они здесь используются, относятся к способу, посредством которого бактериальный капсульный полисахарид ковалентно присоединяется к молекуле-носителю. Конъюгирование усиливает иммуногенность бактериального капсульного полисахарида. Конъюгирование можно проводить согласно способам, описанным ниже, или способами, известными в данной области.
Как описано выше, настоящее изобретение относится к конъюгатам, содержащим капсульные полисахариды серотипа 5 (СР5) S. aureus, конъюгированные с белками-носителями, и конъюгатам, содержащим капсульные полисахариды серотипа 8 (СР8) S. aureus, конъюгированные с белками-носителями. Согласно одному воплощению изобретения предложены конъюгаты, содержащие капсульный полисахарид серотипа 5 S. aureus, конъюгированный с белком-носителем, и капсульный полисахарид серотипа 8 S. aureus, конъюгированный с белком-носителем, где: капсульный полисахарид типа 5 имеет молекулярную массу от 50 кДа до 800 кДа; капсульный полисахарид типа 8 имеет молекулярную массу от 50 до 700 кДа; иммуногенные конъюгаты имеют молекулярные массы от примерно 1000 кДа до примерно 5000 кДа; и конъюгаты содержат меньше, чем примерно 30% свободного полисахарида по отношению к общему полисахариду. В одном воплощении конъюгаты содержат меньше, чем примерно 25%, примерно 20%, примерно 15%, примерно 10% или примерно 5% свободного полисахарида по отношению к общему полисахариду. В одном воплощении полисахарид типа 5 или 8 имеет молекулярную массу от 20 кДа до 1000 кДа.
В одном воплощении конъюгат имеет молекулярную массу от примерно 50 кДа до примерно 5000 кДа. В одном воплощении конъюгат имеет молекулярную массу от примерно 200 кДа до примерно 5000 кДа. В одном воплощении иммуногенный конъюгат имеет молекулярную массу от примерно 400 кДа до примерно 2500 кДа. В одном воплощении иммуногенный конъюгат имеет молекулярную массу от примерно 500 кДа до примерно 2500 кДа. В одном воплощении иммуногенный конъюгат имеет молекулярную массу от примерно 600 кДа до примерно 2800 кДа. В одном воплощении иммуногенный конъюгат имеет молекулярную массу от примерно 700 кДа до примерно 2700 кДа. В одном воплощении иммуногенный конъюгат имеет молекулярную массу от примерно 1000 кДа до примерно 2000 кДа; от примерно 1800 кДа до примерно 2500 кДа; от примерно 1100 кДа до примерно 2200 кДа; от примерно 1900 кДа до примерно 2700 кДа; от примерно 1200 кДа до примерно 2400 кДа; от примерно 1700 кДа до примерно 2600 кДа; от примерно 1300 кДа до примерно 2600 кДа; от примерно 1600 кДа до примерно 3000 кДа.
Соответственно, в одном воплощении белок-носитель в иммуногеном конъюгате по изобретению представляет собой CRM197, и CRM197 ковалентно связан с капсульным полисахаридом через карбаматную связь, амидную связь или обе связи. Число остатков лизина в белке-носителе, которые становятся конъюгированными с капсульным полисахаридом, можно охарактеризовать как интервал конъюгированных лизинов. Например, в данной иммуногенной композиции CRM197 может содержать от 5 до 15 лизинов из 39 ковалентно связанных с капсульным полисахаридом. Другим способом выражения этого параметра является то, что от 12% до 40% лизинов CRM197 ковалентно связаны с капсульным полисахаридом. В некоторых воплощениях часть CRM197 полисахарида, ковалентно связанная с CRM197, содержит от 5 до 22 лизинов, ковалентно связанных с полисахаридом. В некоторых воплощениях часть CRM197 полисахарида, ковалентно связанная с CRM197, содержит от 5 до 23 лизинов, ковалентно связанных с полисахаридом. В некоторых воплощениях часть CRM197 полисахарида, ковалентно связанная с белком-носителем, содержит от 8 до 15 лизинов, ковалентно связанных с полисахаридом. В некоторых воплощениях часть CRM197 полисахарида, ковалентно связанная с белком-носителем, содержит от 8 до 12 лизинов, ковалентно связанных с полисахаридом. Например, в данной иммуногенной композиции CRM197 может содержать от 18 до 22 лизинов из 39 ковалентно связанных с капсульным полисахаридом. Другим способом выражения этого параметра является то, что от 40% до 60% лизинов CRM197 ковалентно связаны с капсульным полисахаридом. В некоторых воплощениях CRM197 содержит от 5 до 15 лизинов из 39 ковалентно связанных с СР8. Другим способом выражения этого параметра является то, что от 12% до 40% лизинов CRM197 ковалентно связаны с СР8. В некоторых воплощениях CRM197 содержит от 18 до 22 лизинов из 39 ковалентно связанных с СР5. Другим способом выражения этого параметра является то, что от 40% до 60% лизинов CRM197 ковалентно связаны с СР5.
Как обсуждалось выше, число остатков лизина в белке-носителе, конъюгированном с капсульным полисахаридом, можно охарактеризовать интервалом конъюгированных лизинов, который можно выразить как молярное отношение. Например, молярное отношение конъюгированных лизинов к CRM197 в иммуногеном конъюгате СР8 может составлять от примерно 18:1 до примерно 22:1. В одном воплощении интервал молярного отношения конъюгированных лизинов к CRM197 в иммуногеном конъюгате СР8 может составлять от примерно 15:1 до примерно 25:1. В некоторых воплощениях интервал молярного отношения конъюгированных лизинов к CRM197 в иммуногеном конъюгате СР8 может составлять от примерно 14:1 до примерно 20:1; от примерно 12:1 до примерно 18:1; от примерно 10:1 до примерно 16:1; от примерно 8:1 до примерно 14:1; от примерно 6:1 до примерно 12:1; от примерно 4:1 до примерно 10:1; от примерно 20:1 до примерно 26:1; от примерно 22:1 до примерно 28:1; от примерно 24:1 до примерно 30:1; от примерно 26:1 до примерно 32:1; от примерно 28:1 до примерно 34:1; от примерно 30:1 до примерно 36:1; от примерно 5:1 до примерно 10:1; от примерно 5:1 до примерно 20:1; от примерно 10:1 до примерно 20:1 или от примерно 10:1 до примерно 30:1. Также молярное отношение конъюгированных лизинов к CRM197 в иммуногеном конъюгате СР5 может составлять примерно от 3:1 до 25:1. В одном воплощении интервал молярного отношения конъюгированных лизинов к CRM197 в иммуногеном конъюгате СР5 может составлять от примерно 5:1 до примерно 20:1. В одном воплощении интервал молярного отношения конъюгированных лизинов к CRM197 в иммуногеном конъюгате СР5 может составлять от примерно 4:1 до примерно 20:1; от примерно 6:1 до примерно 20:1; от примерно 7:1 до примерно 20:1; от примерно 8:1 до примерно 20:1; от примерно 10:1 до примерно 20:1; от примерно 11:1 до примерно 20:1; от примерно 12:1 до примерно 20:1; от примерно 13:1 до примерно 20:1; от примерно 14:1 до примерно 20:1; от примерно 15:1 до примерно 20:1; от примерно 16:1 до примерно 20:1; от примерно 17:1 до примерно 20:1; от примерно 18:1 до примерно 20:1; от примерно 5:1 до примерно 18:1; от примерно 7:1 до примерно 16:1 или от примерно 9:1 до примерно 14:1.
Другим способом выражения числа лизиновых остатков в белке-носителе, конъюгированном с капсульным полисахаридом, может быть интервал конъюгированных лизинов. Например, в данном иммуногеном конъюгате СР8 CRM197 может содержать от 5 до 15 лизинов из 39, ковалентно связанных с капсульным полисахаридом. В качестве альтернативы, данный параметр можно выразить как процентное содержание. Например, в данном иммуногеном конъюгате СР8 процентное содержание конъюгированных лизинов может составлять от 10% до 50%. В некоторых воплощениях от 20% до 50% лизинов может быть ковалентно связано с СР8. Однако, альтернативно, от 30% до 50% лизинов CRM197 может быть ковалентно связано с СР8; от 10% до 40% лизинов CRM197; от 10% до 30% лизинов CRM197; от 20% до 40% лизинов CRM197; от 25% до 40% лизинов CRM197; от 30% до 40% лизинов CRM197; от 10% до 30% лизинов CRM197; от 15% до 30% лизинов CRM197; от 20% до 30% лизинов CRM197; от 25% до 30% лизинов CRM197; от 10% до 15% лизинов CRM197; или от 10% до 12% лизинов CRM197 ковалентно связаны с СР8. Также в данном иммуногеном конъюгате СР5 CRM197 может содержать от 18 до 22 лизинов из 39, ковалентно связанных с капсульным полисахаридом. В качестве альтернативы, данный параметр можно выразить как процентное содержание. Например, в данном иммуногеном конъюгате СР5 процентное содержание конъюгированных лизинов может составлять от 40% до 60%. В некоторых воплощениях от 40% до 60% лизинов может быть ковалентно связано с СР5. Однако, альтернативно, от 30% до 50% лизинов CRM197 может быть ковалентно связано с СР5; от 20% до 40% лизинов CRM197; от 10% до 30% лизинов CRM197; от 50% до 70% лизинов CRM197; от 35% до 65% лизинов CRMigy; от 30% до 60% лизинов CRM197; от 25% до 55% лизинов CRM197; от 20% до 50% лизинов CRM197; от 15% до 45% лизинов CRM197; от 10% до 40% лизинов CRM197; от 40% до 70% лизинов CRM197 или от 45% до 75% лизинов CRM197 ковалентно связаны с СР5.
Частота присоединения цепи капсульного полисахарида к лизину на молекуле носителя является другим параметром для характеризации конъюгатов капсульных полисахаридов. Например, в одном воплощении по меньшей мере одна ковалентная связь между CRM197 и полисахаридом встречается по меньшей мере на каждые 5-10 сахаридных повторяющихся единиц капсульного полисахарида. В другом воплощении существует по меньшей мере одна ковалентная связь между CRM197 и капсульным полисахаридом на каждые 5-10 сахаридных повторяющихся единиц; каждые 2-7 сахаридных повторяющихся единиц; каждые 3-8 сахаридных повторяющихся единиц; каждые 4-9 сахаридных повторяющихся единиц; каждые 6-11 сахаридных повторяющихся единиц; каждые 7-12 сахаридных повторяющихся единиц; каждые 8-13 сахаридных повторяющихся единиц; каждые 9-14 сахаридных повторяющихся единиц; каждые 10-15 сахаридных повторяющихся единиц; каждые 2-6 сахаридных повторяющихся единиц; каждые 3-7 сахаридных повторяющихся единиц; каждые 4-8 сахаридных повторяющихся единиц; каждые 6-10 сахаридных повторяющихся единиц; каждые 7-11 сахаридных повторяющихся единиц; каждые 8-12 сахаридных повторяющихся единиц; каждые 9-13 сахаридных повторяющихся единиц; каждые 10-14 сахаридных повторяющихся единиц; каждые 10-20 сахаридных повторяющихся единиц; каждые 5-10 сахаридных повторяющихся единиц капсульного полисахарида. В другом воплощении по меньшей мере одна связь между CRM197 и капсульным полисахаридом встречается на каждые 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 сахаридных повторяющихся единиц капсульного полисахарида.
Химическая активация полисахаридов и последующее конъюгирование с белком-носителем могут быть достигнуты традиционными способами. Смотрите, например, патенты США №4673574 и 4902506. Альтернативно, можно использовать другие способы активации и конъюгирования.
Термины «белок-носитель» или «белковый носитель» в том виде, как они здесь используются, относятся к любой белковой молекуле, которая может быть конъюгирована с антигеном (таким как капсульные полисахариды), против которого является желательным иммунный ответ. Конъюгирование антигена, такого как полисахарид, с белком-носителем может сделать антиген иммуногенным. Белки-носители предпочтительно представляют собой белки, которые являются нетоксичными и нереактогенными и которые можно получать в достаточном количестве и с достаточной чистотой. Примерами белков-носителей являются токсины, анатоксины или любое мутантное перекрестно-реагирующее вещество (CRM197) столбнячного токсина, дифтерийного токсина, коклюшного токсина, токсина из видов Pseudomonas, E. coli, видов Staphylococcus и видов Streptococcus. Белки-носители должны поддаваться стандартным методикам конъюгирования. В конкретном воплощении настоящего изобретения CRM197 используют в качестве белка-носителя.
CRM197 (Wyeth/Pfizer, Sanford, NC) представляет собой нетоксичный вариант (т.е. анатоксин) дифтерийного токсина, выделенного из культур штамма С7 Corynebacterium diphtheria (β197), выращенного в среде на основе казаминовых кислот и дрожжевого экстракта. CRM197 очищают посредством ультрафильтрации, осаждения с сульфатом аммония и ионообменной хроматографии. Культуру штамма С7 Corynebacterium diphtheriae (β197), которая продуцирует белок CRM197, была депонирована в Американской коллекции типовых культур (Rockville, Maryland) и ей был присвоен номер доступа АТСС 53281. Другие дифтерийные анатоксины также подходят для применения в качестве белков-носителей.
Другие подходящие белки-носители включают инактивированные бактериальные токсины, такие как столбнячный анатоксин, коклюшный анатоксин, холерный анатоксин (например, как описано в международной патентной заявке WO2004/083251), LT (термолабильный токсин) E. coli, ST (термостабильный токсин) Е. coli и экзотоксин А из Pseudomonas aeruginosa. Также можно использовать бактериальные белки наружной мембраны, такие как белковый комплекс "с" наружной мембраны (ОМРС), порины, трансферринсвязывающие белки, пневмолизин, пневмококковый поверхностный белок A (PspA), пневмококковый белок-адгезин A (PsaA), энтеротоксин (токсин А) и цитотоксин (токсин В) С. difficile или белок D Haemophilus influenzae. В качестве белков-носителей также можно использовать другие белки, такие как овальбумин, гемоцианин лимфы улитки (KLH), бычий сывороточный альбумин (BSA) или очищенное белковое производное туберкулина (PPD).
После конъюгирования капсульного полисахарида с белком-носителем, конъюгаты полисахарид-белок очищают (обогащают в отношении количества конъюгата полисахарид-белок) различными методиками. Эти методики включают, например, операции концентрирования/диафильтрации, осаждение/элюцию, колоночную хроматографию и глубинную фильтрацию. Смотрите примеры ниже.
После очистки индивидуальных конъюгатов их можно объединять для приготовления в виде препарата иммуногенной композиции по настоящему изобретению, которую можно использовать, например, в вакцине. Приготовление в виде препарата иммуногенной композиции по настоящему изобретению можно осуществлять с использованием известных в данной области способов.
Отмечается, что в данном описании такие термины как «содержит», «содержал», «содержащий», «вмещает», «вмещающий» и тому подобное, могут иметь значение, приписываемое им в патентном законе США; например, они могут означать «включает в себя», «включал в себя», «включающий в себя» и тому подобное. Такие термины относятся к включению конкретных ингредиентов или набора ингредиентов без исключения любых других ингредиентов. Такие термины как «состоящий по существу из» и «состоит по существу из» имеют значение, приписываемое им в патентном законе США; например, они позволяют включение дополнительных ингредиентов или стадий, которые не умаляют новые или основные характеристики изобретения, т.е. они исключают дополнительные неперечисленные ингредиенты или стадии, которые умаляют новые или основные характеристики изобретения, и они исключают ингредиенты или стадии предшествующего уровня техники, такие как документы в данной области, которые здесь перечислены или включены сюда посредством ссылки, особенно, так как целью данного документа является определить воплощения, которые являются патентоспособными, например, новыми, неочевидными, изобретательскими, в свете предшествующего уровня техники, например, по сравнению с документами, процитированными здесь или включенными сюда посредством ссылки. И термины «состоит из» и «состоящий из» имеют значение, приписываемое им в патентном законе США; а именно то, что данные термины являются закрытыми (close-ended). Соответственно, данные термины относятся к включению конкретного ингредиента или набора ингредиентов и к исключению всех других ингредиентов.
«Консервативная аминокислотная замена» относится к замене одного или более чем одного аминокислотного остатка белка другими аминокислотными остатками, имеющими похожие физические и/или химические свойства. Заменители для аминокислоты в пределах последовательности могут быть выбраны из других членов класса, к которому принадлежит аминокислота. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Аминокислотами, содержащими структуры ароматического кольца, являются фенилаланин, триптофан и тирозин. Полярные нейтральные аминокислоты включают глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные (кислые аминокислоты) включают аспарагиновую кислоту и глутаминовую кислоту. Ожидается, что такие изменения не будут влиять на кажущуюся молекулярную массу, определенную электрофорезом в полиакриламидном геле, или на изоэлектрическую точку. Особенно предпочтительными заменами являются замена Lys на Arg и наоборот, так чтобы можно было сохранить положительный заряд; Glu на Asp и наоборот, так чтобы можно было сохранить отрицательный заряд; Ser на Thr, так чтобы можно было сохранить свободную группу -ОН; и Gln на Asn, так чтобы можно было сохранить свободную группу NH2.
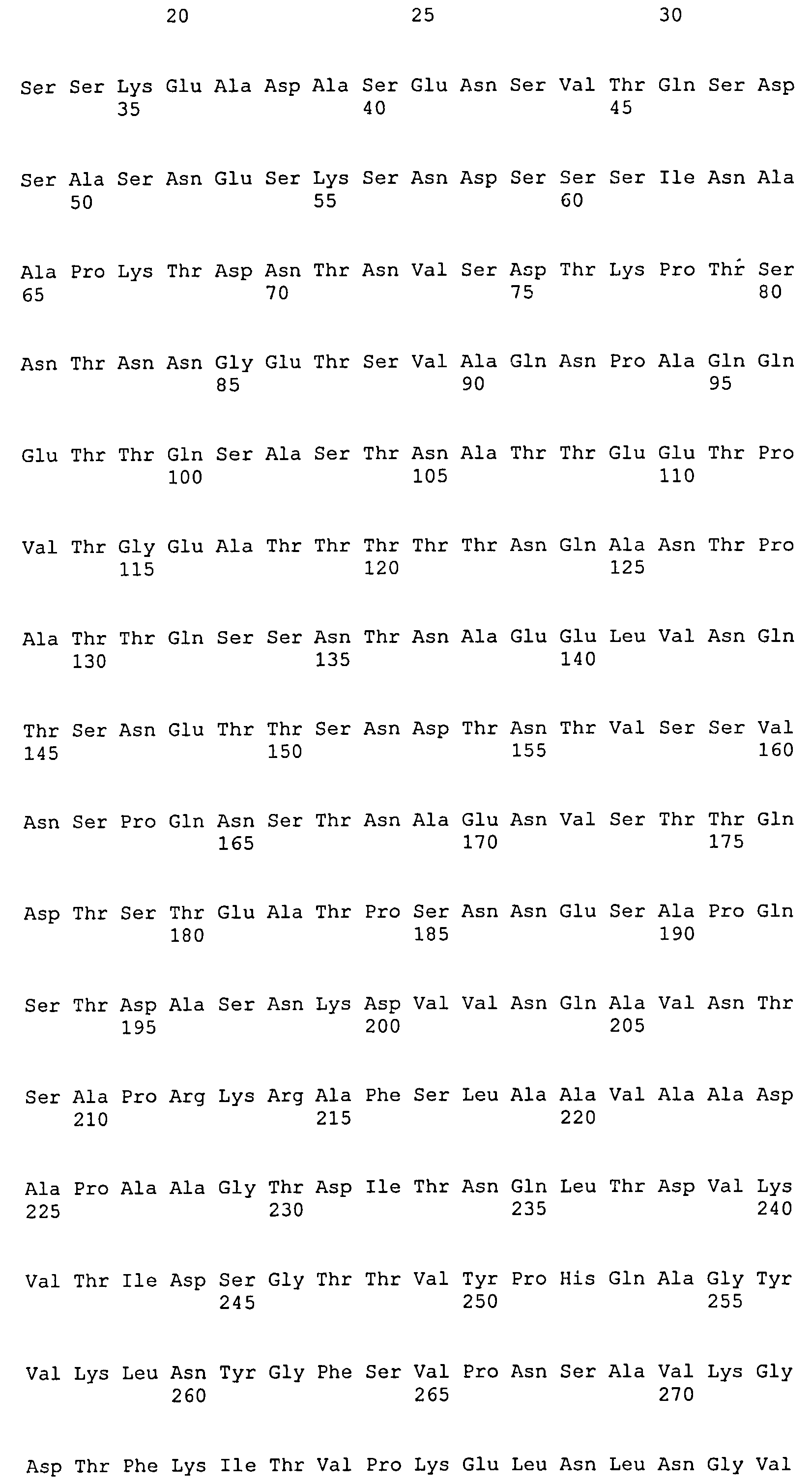
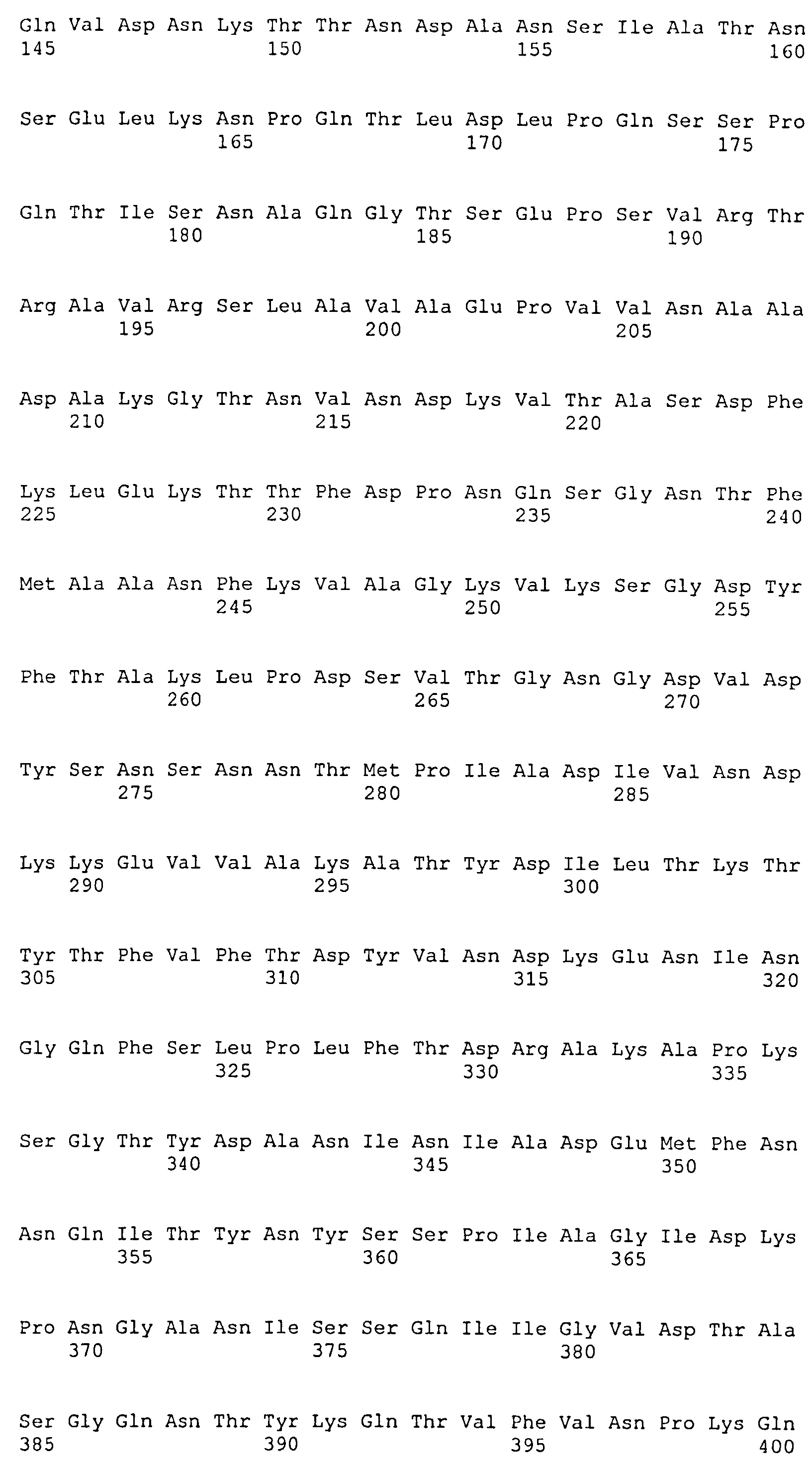
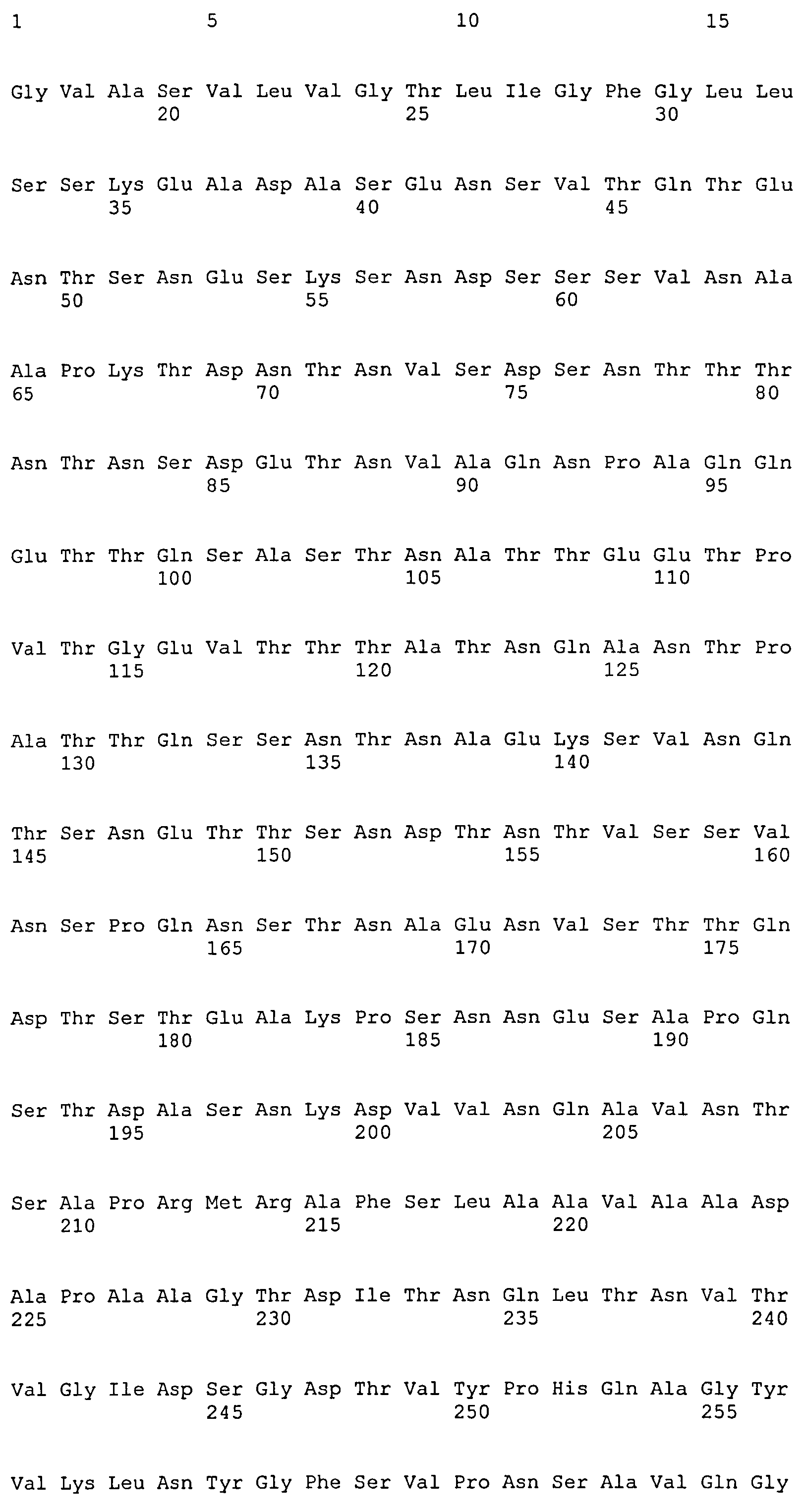
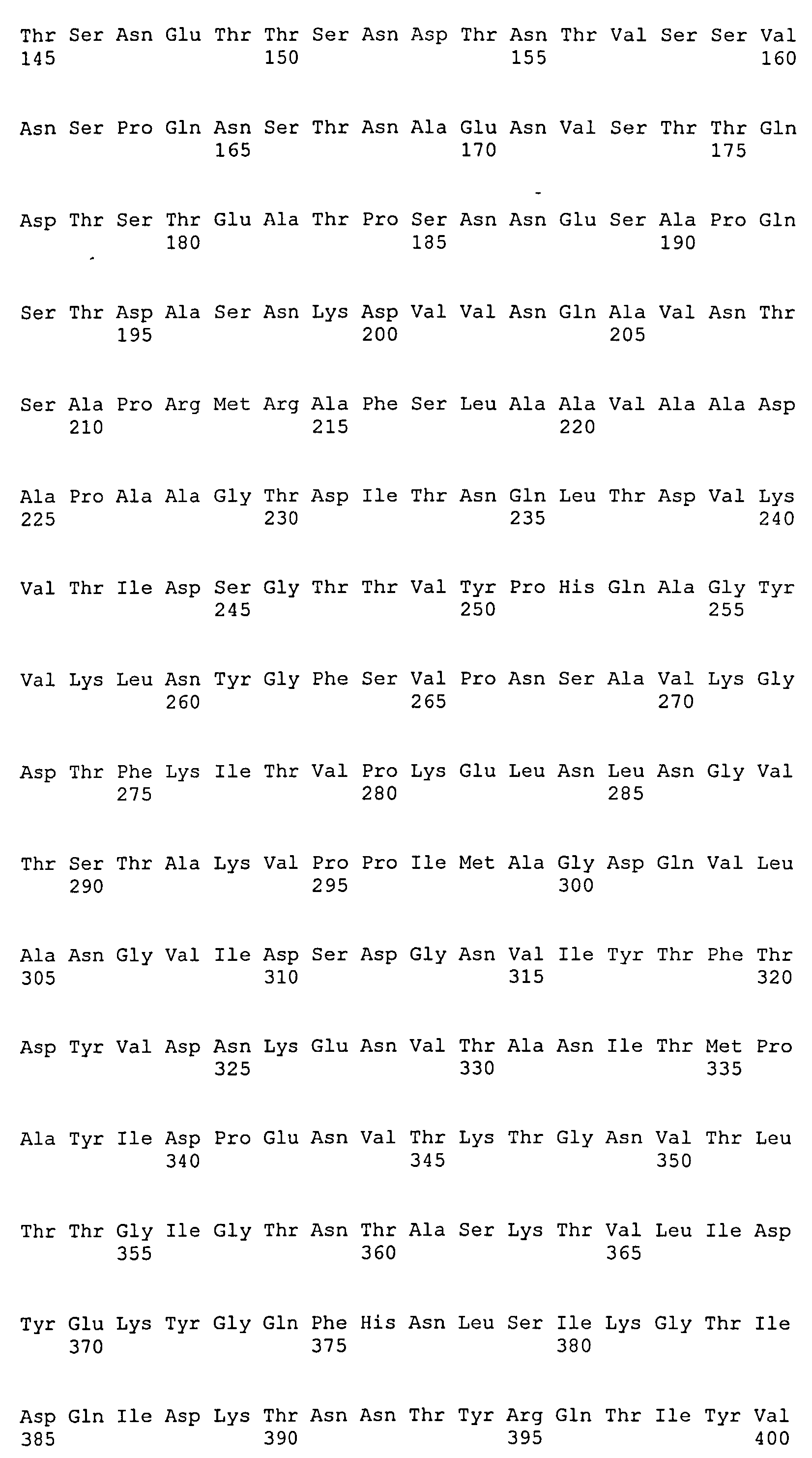
Термин «фрагмент» относится к белкам, в которых включены лишь отдельные домены более крупного белка. Например, каждый из белков ClfA и ClfB содержат вплоть до 8 доменов, если включены сигнальные последовательности. Каждый полипептид, соответствующий доменам N1N2N3, N2N3, N1N2, N1, N2 или N3, считается фрагментом ClfA или ClfB. Термин «фрагмент» также относится либо к белку, либо к полипептиду, содержащему аминокислотную последовательность из по меньшей мере 4 аминокислотных остатков (предпочтительно по меньшей мере 10 аминокислотных остатков, по меньшей мере 15 аминокислотных остатков, по меньшей мере 20 аминокислотных остатков, по меньшей мере 25 аминокислотных остатков, по меньшей мере 40 аминокислотных остатков, по меньшей мере 50 аминокислотных остатков, по меньшей мере 60 аминокислотных остатков, по меньшей мере 70 аминокислотных остатков, по меньшей мере 80 аминокислотных остатков, по меньшей мере 90 аминокислотных остатков, по меньшей мере 100 аминокислотных остатков, по меньшей мере 125 аминокислотных остатков или по меньшей мере 150 аминокислотных остатков) аминокислотной последовательности родительского белка или полипептида, или к нуклеиновой кислоте, содержащей нуклеотидную последовательность из по меньшей мере 10 пар оснований (предпочтительно по меньшей мере 20 пар оснований, по меньшей мере 30 пар оснований, по меньшей мере 40 пар оснований, по меньшей мере 50 пар оснований, по меньшей мере 50 пар оснований, по меньшей мере 100 пар оснований, по меньшей мере 200 пар оснований) нуклеотидной последовательности родительской нуклеиновой кислоты.
Термины «функциональная активность» антитела или «функциональное антитело» в том виде, как они здесь используются, относятся к антителу, которое, по меньшей мере, может специфично связываться с антигеном. В данной области известны дополнительные функции, и они могут включать дополнительные компоненты иммунной системы, которые осуществляют клиренс или умерщвление патогена, как, например, посредством опсонизации, ADCC (антитело-зависимая клеточная цитотоксичность) или цитотоксичности, опосредованной комплементом. После связывания антигена любые последующие функции антитела могут быть опосредованы областью Fc антитела. Анализ опсонофагоцитирующей активности антител (ОРА) представляет собой анализ in vitro, разработанный для измерения in vitro умерщвления бактерий эффекторными клетками (белыми клетками крови), выполняемого с помощью Ig комплемента, что, таким образом, имитирует биологический процесс. Связывание антитела также может непосредственно ингибировать биологическую функцию антигена, с которым оно связывается, например, антитела, которые связывают ClfA, могут нейтрализовать его ферментативную функцию. В некоторых воплощениях термин «функциональное антитело» относится к антителу, которое является функциональным по результатам измерений по умерщвлению бактерий в животной модели эффективности или тестом опсонофагоцитарного умерщвления, которое демонстрирует то, что антитела вызывают лизис бактерии.
Молекулярная масса капсульных полисахаридов S. aureus представляет собой фактор, который учитывают при применении в иммуногенных композициях. Например, капсульные полисахариды с высокой молекулярной массой могут быть способны индуцировать определенные иммунные ответы антител из-за более высокой валентности эпитопов, присутствующих на антигенной поверхности. Выделение «капсульных полисахаридов с высокой молекулярной массой» рассматривается для применения в композициях и способах по настоящему изобретению. Например, в одном воплощении изобретения рассматривается выделение полисахаридов типа 5 с высокой молекулярной массой, варьирующих по размеру от примерно 50 до примерно 800 кДа по молекулярной массе. В одном воплощении изобретения рассматривается выделение полисахаридов типа 5 с высокой молекулярной массой, варьирующих по размеру от примерно 20 до примерно 1000 кДа по молекулярной массе. В одном воплощении изобретения рассматривается выделение и очистка капсульных полисахаридов типа 5 с высокой молекулярной массой, варьирующих по размеру от примерно 50 до примерно 300 кДа по молекулярной массе. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 5 с высокой молекулярной массой, варьирующих по молекулярной массе от 70 кДа до 300 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 5 с высокой молекулярной массой, варьирующих по молекулярной массе от 90 кДа до 250 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 5 с высокой молекулярной массой, варьирующих по молекулярной массе от 90 кДа до 150 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 5 с высокой молекулярной массой, варьирующих по молекулярной массе от 90 кДа до 140 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 5 с высокой молекулярной массой, варьирующих по молекулярной массе от 80 кДа до 120 кДа. Другие интервалы капсульных полисахаридов серотипа 5 с высокой молекулярной массой, которые можно выделять и очищать способами по данному изобретению, включают интервалы размера от примерно 70 кДа до примерно 100 кДа по молекулярной массе; от 70 кДа до 110 кДа по молекулярной массе; от 70 кДа до 120 кДа по молекулярной массе; от 70 кДа до 130 кДа по молекулярной массе; от 70 кДа до 140 кДа по молекулярной массе; от 70 кДа до 150 кДа по молекулярной массе; от 70 кДа до 160 кДа по молекулярной массе; от 80 кДа до 110 кДа по молекулярной массе; от 80 кДа до 120 кДа по молекулярной массе; от 80 кДа до 130 кДа по молекулярной массе; от 80 кДа до 140 кДа по молекулярной массе; от 80 кДа до 150 кДа по молекулярной массе; от 80 кДа до 160 кДа по молекулярной массе; от 90 кДа до 110 кДа по молекулярной массе; от 90 кДа до 120 кДа по молекулярной массе; от 90 кДа до 130 кДа по молекулярной массе; от 90 кДа до 140 кДа по молекулярной массе; от 90 кДа до 150 кДа по молекулярной массе; от 90 кДа до 160 кДа по молекулярной массе; от 100 кДа до 120 кДа по молекулярной массе; от 100 кДа до 130 кДа по молекулярной массе; от 100 кДа до 140 кДа по молекулярной массе; от 100 кДа до 150 кДа по молекулярной массе; от 100 кДа до 160 кДа по молекулярной массе; и аналогичные желательные интервалы молекулярной массы.
Как обсуждалось выше, молекулярная масса капсульных полисахаридов S. aureus представляет собой фактор, который учитывают при применении в иммуногенных композициях. Например, капсульные полисахариды с высокой молекулярной массой могут быть способны индуцировать определенные иммунные ответы антител из-за более высокой валентности эпитопов, присутствующих на антигенной поверхности. В одном воплощении изобретения рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от примерно 20 кДа до примерно 1000 кДа. В одном воплощении изобретения рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от примерно 50 кДа до примерно 700 кДа. В одном воплощении изобретения рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от 50 кДа до 300 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от 70 кДа до 300 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от 90 кДа до 250 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от 90 кДа до 150 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от 90 кДа до 120 кДа. В одном воплощении рассматривается выделение и очистка капсульных полисахаридов типа 8 с высокой молекулярной массой, варьирующих по молекулярной массе от 80 кДа до 120 кДа. Другие интервалы капсульных полисахаридов серотипа 8 с высокой молекулярной массой, которые можно выделять и очищать способами по данному изобретению, включают интервалы размера от примерно 70 кДа до примерно 100 кДа по молекулярной массе; от 70 кДа до 110 кДа по молекулярной массе; от 70 кДа до 120 кДа по молекулярной массе; от 70 кДа до 130 кДа по молекулярной массе; от 70 кДа до 140 кДа по молекулярной массе; от 70 кДа до 150 кДа по молекулярной массе; от 70 кДа до 160 кДа по молекулярной массе; от 80 кДа до 110 кДа по молекулярной массе; от 80 кДа до 120 кДа по молекулярной массе; от 80 кДа до 130 кДа по молекулярной массе; от 80 кДа до 140 кДа по молекулярной массе; от 80 кДа до 150 кДа по молекулярной массе; от 80 кДа до 160 кДа по молекулярной массе; от 90 кДа до 110 кДа по молекулярной массе; от 90 кДа до 120 кДа по молекулярной массе; от 90 кДа до 130 кДа по молекулярной массе; от 90 кДа до 140 кДа по молекулярной массе; от 90 кДа до 150 кДа по молекулярной массе; от 90 кДа до 160 кДа по молекулярной массе; от 100 кДа до 120 кДа по молекулярной массе; от 100 кДа до 130 кДа по молекулярной массе; от 100 кДа до 140 кДа по молекулярной массе; от 100 кДа до 150 кДа по молекулярной массе; от 100 кДа до 160 кДа по молекулярной массе; и аналогичные желательные интервалы молекулярной массы.
«Иммунный ответ» на иммуногенную композицию представляет собой развитие у субъекта гуморального и/или клеточно-опосредованного иммунного ответа на молекулы, присутствующие в интересующей композиции (например, антиген, такой как белок или полисахарид). Для целей настоящего изобретения «гуморальный иммунный ответ» представляет собой иммунный ответ, опосредованный антителами, и включает генерирование антител с аффинностью в отношении антигенов, присутствующих в иммуногенных композициях по изобретению, тогда как «клеточно-опосредованный иммунный ответ» представляет собой иммунный ответ, опосредованный Т-лимфоцитами и/или другими белыми клетками крови. «Клеточно-опосредованный иммунный ответ» вызывает презентация антигенных эпитопов в ассоциации с молекулами класса I или класса II главного комплекса гистосовместимости (МНС). Это активирует клетки антигенспецифичных Т-хелперов CD4+ или клетки цитотоксических Т-лимфоцитов CD8+ ("CTL"). CTL имеют специфичность в отношении пептидных или липидных антигенов, которые презентированы в ассоциации с белками, кодируемыми главным комплексом гистосовместимости (МНС) или CD1, и экспрессированы на поверхностях клеток. CTL помогают индуцировать и стимулировать внутриклеточное разрушение внутриклеточных микробов или лизис клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антигенспецифичный ответ Т-клеток-хелперов. Т-клетки-хелперы действуют, помогая стимулировать функцию, и фокусируют активность неспецифичных эффекторных клеток против клеток, демонстрирующих пептидные антигены в ассоциации с классическими или неклассическими молекулами МНС на их поверхности. «Клеточно-опосредованный иммунный ответ» также относится к продукции цитокинов, хемокинов и других таких молекул, продуцируемых активированными Т-клетками и/или другими белыми клетками крови, включая клетки, происходящие от Т-клеток CD4+ и CD8+. Способность конкретного антигена или композиции стимулировать клеточно-опосредованный иммунологический ответ можно определять целым рядом анализов, таких как анализы лимфопролиферации (активации лимфоцитов), анализы цитотоксических клеток CTL, анализом Т-лимфоцитов, специфичных в отношении антигена, у сенсибилизированного субъекта, или измерением продукции цитокинов Т-клетками в ответ на повторную стимуляцию антигеном. Такие анализы хорошо известны в данной области. Смотрите, например, Erickson et al., J. Immunol. (1993) 151:4189-4199; Doe et al., Eur. J. Immunol. (1994) 24:2369-2376.
Термин «иммуногенный» относится к способности антигена или вакцины вызывать иммунный ответ, либо гуморальный, либо клеточно-опосредованный, либо оба.
Термины «иммуногенное количество», или «иммунологически эффективное количество», или «доза», каждый из которых используется здесь взаимозаменяемо, в общем, относятся к количеству антигена или иммуногенной композиции, достаточному для вызова иммунного ответа, либо клеточного (Т-клетка), либо гуморального (В-клетка или антитело) ответа, либо обоих при измерении стандартными анализами, известными специалисту в данной области.
Количество конкретного конъюгата в композиции обычно рассчитывают на основе общего полисахарида, конъюгированного и неконъюгированного, в отношении данного конъюгата. Например, конъюгат СР5 с 20% свободного полисахарида будет иметь примерно 80 мкг конъюгированного полисахарида СР5 и примерно 20 мкг неконъюгированного полисахарида СР5 в 100 мкг дозы полисахарида СР5. Вклад белка в конъюгат обычно не рассматривается при расчете дозы конъюгата. Количество конъюгата может варьировать в зависимости от серотипа стафилококка. Обычно каждая доза будет содержать от 0,01 до 100 мкг полисахарида, в частности от 0,1 до 10 мкг и более конкретно от 1 до 10 мкг. «Иммуногенное количество» разных полисахаридных компонентов в иммуногенной композиции может отличаться, и каждый может содержать 0,01 мкг, 0,1 мкг, 0,25 мкг, 0,5 мкг, 1 мкг, 2 мкг, 3 мкг, 4 мкг, 5 мкг, 6 мкг, 7 мкг, 8 мкг, 9 мкг, 10 мкг, 15 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг или примерно 100 мкг любого конкретного полисахаридного антигена.
В другом воплощении «иммуногенное количество» белковых компонентов в иммуногенной композиции может варьировать от примерно 10 мкг до примерно 300 мкг каждого белкового антигена. В конкретном воплощении «иммуногенное количество» белковых компонентов в иммуногенной композиции может варьировать от примерно 20 мкг до примерно 200 мкг каждого белкового антигена. «Иммуногенное количество» разных белковых компонентов в иммуногенной композиции может отклоняться, и каждый содержит 10 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг, 100 мкг, 125 мкг, 150 мкг, 175 мкг или примерно 200 мкг любого конкретного белкового антигена.
Эффективность антигена в качестве иммуногена можно измерять путем измерения уровней активности В-клеток посредством измерения уровней циркулирующих антител, специфичных в отношении антигена в сыворотке, с использованием иммуноанализов, анализов иммунопреципитации, функциональных анализов антител, таких как опсонический анализ in vitro, и многих других анализов, известных в данной области. Другой показатель эффективности антигена в качестве иммуногена Т-клеток можно измерять либо анализами пролиферации, либо цитолитическими анализами, такими как тесты с радиоактивным хромом для измерения способности Т-клетки лизировать ее специфическую клетку-мишень. Кроме того, в настоящем изобретении «иммуногенное количество» также можно определять измерением уровней антигенспецифичного антитела, индуцированного после введения антигена, в сыворотке или измерением способности антител, индуцированных таким способом, увеличивать опсонофагоцитирующую способность конкретных белых клеток крови, как здесь описано. Уровень защиты иммунного ответа можно измерять путем стимуляции иммунизированного хозяина антигеном, который был инъецирован. Например, если антиген, к которому желателен иммунный ответ, представляет собой бактерию, уровень защиты, индуцированный «иммуногенным количеством» антигена, может быть измерен путем определения процента выживаемости или процента смертности после заражения животных бактериальными клетками. В одном воплощении величину защиты можно оценивать путем измерения по меньшей мере одного симптома, ассоциированного с бактериальной инфекцией, например, лихорадки, ассоциированной с инфекцией. Количество каждого из антигенов в мультиантигенной или многокомпонентной вакцине, или иммуногенных композициях будет варьировать по отношению к каждому другому компоненту и может быть определено способами, известными специалисту. Такие способы будут включать, например, методики для измерения иммуногенности и/или эффективности in vivo.
Термин «иммуногенная композиция» относится к любой фармацевтической композиции, содержащей антиген, например, к микроорганизму или его компоненту, причем композицию можно использовать для вызова иммунного ответа у субъекта. Иммуногенные композиции по настоящему изобретению можно использовать для лечения человека, восприимчивого к инфекции S. aureus, посредством введения иммуногенных композиций через системный чрескожный путь или через слизистую. Такие введения могут включать инъекцию через внутримышечный (i.m.), внутрибрюшинный (i.p.), внутрикожный (i.d.) или подкожный пути; нанесение посредством пластыря или другого приспособления для чрескожной доставки; или посредством введения через слизистую в рот/пищеварительный тракт, респираторный или мочеполовой тракты. В одном воплощении для лечения или предупреждения носоглоточного носительства S. aureus используют интраназальное введение, таким образом, ослабляя инфекцию на ее самой ранней стадии. В одном воплощении иммуногенную композицию можно использовать в изготовлении вакцины или в индукции (elicitation) поликлональных или моноклональных антител, которые могут быть использованы для пассивной защиты или лечения животного.
Оптимальные количества компонентов для конкретной иммуногенной композиции могут быть установлены путем стандартных исследований, включающих наблюдение подходящих иммунных ответов у субъектов. После исходной вакцинации субъекты могут получать одну или несколько бустер-иммунизаций с адекватным интервалом во времени.
В одном воплощении настоящего изобретения иммуногенная композиция на основе S. aureus содержит фрагмент (N1N2N3 или их комбинации) рекомбинантного фактора слипания А S. aureus (ClfA), выделенные капсульные полисахариды типа 5, конъюгированные с CRMigy, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197. В другом воплощении иммуногенная композиция на основе S. aureus представляет собой стерильную композицию (жидкую, лиофилизированную, ДНК-вакцину, внутрикожный препарат) фрагмента (N1N2N3 или их комбинации) рекомбинантного фактора слипания S. aureus (ClfA), фрагмента (N1N2N3 или их комбинации) рекомбинантного фактора слипания В S. aureus (ClfB), выделенных капсульных полисахаридов типа 5, конъюгированных с CRM197, и выделенных капсульных полисахаридов типа 8, конъюгированных с CRM197. В одном воплощении настоящего изобретения иммуногенная композиция на основе S. aureus содержит фрагмент (N1N2N3 или их комбинации) рекомбинантного фактора слипания A S. aureus (ClfA), железосвязывающий белок MntC S. aureus, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197. В одном воплощении иммуногенная композиция на основе S. aureus представляет собой стерильную композицию (жидкую, лиофилизированную, ДНК-вакцину, внутрикожный препарат) фрагмента (N1N2N3 или их комбинации) рекомбинантного фактора слипания A S. aureus (ClfA), фрагмента (N1N2N3 или их комбинации) рекомбинантного фактора слипания В S. aureus (ClfB), железосвязывающего белка MntC S. aureus, выделенных капсульных полисахаридов типа 5, конъюгированных с CRM197, и выделенных капсульных полисахаридов типа 8, конъюгированных с CRM197. В одном воплощении настоящего изобретения иммуногенная композиция на основе S. aureus содержит фрагмент (N1N2N3 или их комбинации) рекомбинантного фактора слипания В S. aureus (ClfB), выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197. В одном воплощении настоящего изобретения иммуногенная композиция на основе S. aureus содержит фрагмент (N1N2N3 или их комбинации) рекомбинантного фактора слипания В S. aureus (ClfB), железосвязывающий белок MntC S. aureus, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197 и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197. В одном воплощении настоящего изобретения иммуногенная композиция на основе S. aureus содержит железосвязывающий белок MntC S. aureus, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197.
Иммуногенные композиции по настоящему изобретению могут дополнительно содержать один или более чем один дополнительный «иммуномодулятор», который представляет собой агент, который нарушает или изменяет иммунную систему, так, что наблюдается либо позитивная, либо негативная регуляция гуморального и/или клеточно-опосредованного иммунитета. В одном конкретном воплощении предпочтительной является позитивная регуляция гуморальной и/или клеточно-опосредованной ветвей иммунной системы. Примеры определенных иммуномодуляторов включают, например, адъювант или цитокин, или ISCOMATRIX (CSL Limited, Parkville, Австралия), описанный, среди прочих, в патенте США №5254339. Неограничивающие примеры адъювантов, которые можно использовать в вакцине по настоящему изобретению, включают адъювантную систему RIBI (Ribi Inc., Hamilton, Mont.), квасцы, минеральные гели, такие как гель гидроокиси алюминия, эмульсии типа «масло в воде», эмульсии типа «вода в масле», такие как, например, полный и неполный адъюванты Фрейнда, блок-сополимер (CytRx, Atlanta Ga.), QS-21 (Cambridge Biotech Inc., Cambridge Mass.), SAF-M (Chiron, Emeryville Calif.), адъювант AMPHIGEN®, сапонин, Quil А или другая фракция сапонина, монофосфориллипид А и липид-аминный адъювант Avridine. Неограничивающие примеры эмульсий типа «масло в воде», полезных в вакцине по изобретению, включают модифицированные SEAM62 и SEAM 1/2 композиции. Модифицированная SEAM62 представляет собой эмульсию типа «масло в воде», содержащую 5% (об./об.) сквалена (Sigma), 1% (об./об.) детергента SPAN® 85 (ICI Surfactants), 0,7% (об./об.) детергента полисорбат ® 80 (ICI Surfactants), 2,5% (об./об.) этанола, 200 мкг/мл Quil A, 100 мкг/мл холестерина и 0,5% (об./об.) лецитина. Модифицированная SEAM 1/2 представляет собой эмульсию типа «масло в воде», содержащую 5% (об./об.) сквалена, 1% (об./об.) детергента SPAN® 85, 0,7% (об./об.) детергента полисорбат 80, 2,5% (об./об.) этанола, 100 мкг/мл Quil А и 50 мкг/мл холестерина. Другие «иммуномодуляторы», которые могут быть включены в вакцину, включают, например, один или более чем один интерлейкин, интерферон или другой известный цитокин или хемокин. В одном воплощении адъювант может быть производным циклодекстрина или полианионным полимером, такими как производные циклодекстрина или полианионные полимеры, описанные в патентах США номер 6165995 и 6610310, соответственно. Следует понимать, что иммуномодулятор и/или адъювант, подлежащие применению, будут зависеть от субъекта, которому будут вводить вакцину или иммуногенную композицию, пути инъекции и числа инъекций, подлежащих введению.
«Инвазивное заболевание», вызванное S. aureus, представляет собой выделение бактерий из обычно стерильной области, когда имеются ассоциированные клинические признаки/симптомы заболевания. Обычно стерильные области тела включают кровь, CSF (цереброспинальная жидкость), плевральную жидкость, перикардиальную жидкость, перитонеальную жидкость, суставную/синовиальную жидкость, кость, внутренние области в организме (лимфатический узел, мозг, сердце, печень, селезенка, стекловидное тело, почка, поджелудочная железа, яичник) или другие обычно стерильные сайты. Клинические состояния, характеризующие инвазивные заболевания, включают бактериемию, пневмонию, целлюлит, остеомиелит, эндокардит, септический шок и другие.
Термин «выделенный» означает то, что вещество было изъято из его исходного окружения (например, природного окружения, если оно встречается в природе, или из его организма-хозяина, если оно представляет собой рекомбинантный объект, или взято из одного окружения и помещено в другое окружение). Например, выделенный капсульный полисахарид, белок или пептид по существу не содержит клеточного материала или других загрязняющих белков из клеточного или тканевого источника, из которого получен белок, или по существу не содержит химических предшественников или других химических веществ, если он синтезирован химически или присутствует иным образом в смеси как часть химической реакционной среды. В настоящем изобретении белки или полисахариды могут быть выделены из бактериальной клетки или из продуктов распада клетки так, что они получены в форме, полезной при изготовлении иммуногенной композиции. Термин «выделенный» или «выделение» может включать очистку или процедуру очистки, включая, например, способы очистки белков или капсульных полисахаридов, как здесь описано. Формулировка «по существу не содержит клеточного материала» включает препараты полипептида/белка, в которых полипептид/белок отделен от клеточных компонентов клеток, из которых он выделен или в которых он рекомбинантно продуцирован. Таким образом, капсульный полисахарид, белок или пептид, который по существу не содержит клеточного материала, включает препараты капсульного полисахарида, белка или пептида, имеющие меньше, чем примерно 30%, 20%, 10%, 5%, 2,5% или 1% (по сухой массе) загрязняющего белка или полисахарида, или другого клеточного материала. При рекомбинантной продукции полипептида/белка, он также предпочтительно по существу не содержит культуральную среду, т.е. культуральная среда представляет меньше, чем примерно 20%, 10% или 5% от объема препарата белка. Когда полипептид/белок или полисахарид продуцируют химическим синтезом, он предпочтительно по существу не содержит химических предшественников или других химических веществ, т.е. он отделен от химических предшественников или других химических веществ, которые участвуют в синтезе белка или полисахарида. Соответственно, такие препараты полипептида/белка или полисахарида имеют меньше, чем примерно 30%, 20%, 10%, 5% (по сухой массе) химических предшественников или соединений, отличных от интересующего полипептидного/белкового или полисахаридного фрагмента.
Фраза «неконсервативная аминокислотная замена» относится к замене одного или более чем одного аминокислотного остатка белка другими аминокислотными остатками, имеющими отличающиеся физические и/или химические свойства, используя характеристики, определенные выше.
Термин «фармацевтически приемлемый носитель» означает носитель, одобренный регулирующим органом федерального правительства, правительства штата или другим регулирующим органом, или перечислен в Фармакопее США или других общепризнанных фармакопеях для применения у животных, включая людей, а также млекопитающих, не являющихся человеком. Термин «носитель» относится к разбавителю, адъюванту, эксципиенту или наполнителю, с которыми вводят фармацевтическую композицию. Такие фармацевтические носители могут быть стерильными жидкостями, такими как вода и масла, включая жидкости нефтяного, животного, растительного или синтетического происхождения. Воду, солевые растворы и водные растворы декстрозы и глицерина можно применять в качестве жидких носителей, в частности для инъецируемых растворов. Подходящие фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и тому подобное. Композиция, если это желательно, также может содержать минорные количества увлажняющих, объемообразующих, эмульгирующих и забуферивающих агентов. Эти композиции могут принимать форму растворов, суспензий, эмульсии, препаратов замедленного высвобождения и тому подобного. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" E.W. Martin. Композиция должна соответствовать способу введения.
Термины «белок», «полипептид» и «пептид» относятся к полимеру из аминокислотных остатков и не ограничиваются минимальной длиной продукта. Таким образом, пептиды, олигопептиды, димеры, мультимеры и им подобные являются включенными в пределы данного определения. Определением охватываются как полноразмерные белки, так и их фрагменты. Данные термины также включают модификации, такие как делеции, вставки (additions) и замены (обычно консервативные по природе, но которые могут быть неконсервативными), по отношению к нативной последовательности, предпочтительно такие, что белок сохраняет способность вызывать иммунологический ответ у животного, которому вводится белок. Также включены постэкспрессионные модификации, например, гликозилирование, ацетилирование, липидирование, фосфорилирование и тому подобное.
Термин «защитный» иммунный ответ относится к способности иммуногенной композиции вызывать иммунный ответ, либо гуморальный, либо клеточно-опосредованный, что служит для защиты субъекта от инфекции. Предоставленная защита не обязательно должна быть абсолютной, т.е. инфекция не обязательно должна быть полностью предупрежденной или искорененной, если имеется статистически значимое улучшение по сравнению с контрольной популяцией субъектов, например, инфицированных животных, которым не вводили вакцину или иммуногенную композицию. Защита может быть ограничена уменьшением тяжести или скорости появления симптомов инфекции. В общем, «защитный иммунный ответ» будет включать индукцию увеличения уровней антител, специфичных в отношении конкретного антигена, по меньшей мере у 50% субъектов, включая некоторый уровень измеримых ответов функциональных антител на каждый антиген. В конкретных ситуациях «защитный иммунный ответ» может включать индукцию двухкратного увеличения уровней антител или четырехкратного увеличения уровней антител, специфичных в отношении конкретного антигена, по меньшей мере у 50% субъектов, включая некоторый уровень измеримых ответов функциональных антител на каждый антиген. В определенных воплощениях опсонизирующие антитела коррелируют с защитным иммунным ответом. Таким образом, защитный иммунный ответ можно анализировать путем измерения процентного снижения числа бактерий в анализе опсонофагоцитирующей активности, например анализах, описанных ниже. Предпочтительно наблюдается снижение числа бактерий по меньшей мере на 10%, 25%, 50%, 65%, 75%, 80%, 85%, 90%, 95% или более.
Термин «рекомбинантный» в том виде, как он здесь используется, просто относится к любому белку, полипептиду или клетке, экспрессирующей интересующий ген, которые получают способами генной инженерии. Термин «рекомбинантный» в том виде, как он используется по отношению к белку или полипептиду, означает полипептид, продуцируемый экспрессией рекомбинантного полинуклеотида. Белки, используемые в иммуногенных композициях по изобретению, могут быть выделены из природного источника или получены способами генной инженерии, как, например, рекомбинантный ClfA, рекомбинантный ClfB или рекомбинантный MntC. Термин «рекомбинантный» в том виде, как он здесь используется, дополнительно описывает молекулу нуклеиновой кислоты, которая, в силу ее происхождения или благодаря манипуляции, не ассоциирована со всем полинуклеотидом или частью полинуклеотида, с которым она ассоциирована в природе. Термин «рекомбинантный» в том виде, как он используется по отношению к клетке-хозяину, означает клетку-хозяина, в которую был введен рекомбинантный полинуклеотид.
Рекомбинантный ClfA (rClfA) и рекомбинантный ClfB (rClfB) в том виде, как они здесь используются, относятся к формам ClfA или ClfB для применения в иммуногенных композициях по изобретению. В одном воплощении rClfA представляет собой фрагмент ClfA, содержащий один или более чем один из N доменов, например, N1N2N3, N2N3, N2 или N3, и именуется здесь как «рекомбинантный ClfA» или «rClfA». В одном воплощении rClfB представляет собой фрагмент ClfB, содержащий один или более чем один из доменов N ClfB, например, N1N2N3, N2N3, N2 или N3, и именуется здесь как «рекомбинантный ClfB» или «rClfB».
Термин «субъект» относится к млекопитающему, птице, рыбе, рептилии или любому другому животному. Термин «субъект» также включает человека. Термин «субъект» также включает домашних животных. Неограничивающие примеры домашних животных включают собак, кошек, свиней, кроликов, крыс, мышей, песчанок, хомяков, морских свинок, хорьков, птиц, змей, ящериц, рыб, черепах и лягушек. Термин «субъект» также включает домашний скот. Неограничивающие примеры домашнего скота включают альпаку. бизона, верблюда, крупный рогатый скот, оленей, свиней, лошадей, лам, мулов, ослов, овец, коз, кроликов, северных оленей, яков, куриц, гусей и индеек.
Термин «лечение» в том виде, как он здесь используется (включая его вариации, например, «лечить» или «подвергающийся лечению»), относится к одному или более чем одному из следующего: (1) предупреждение инфекции или повторной инфекции, как в случае традиционной вакцины, (2) уменьшение тяжести или устранение симптомов и (3) значительное или полное устранение рассматриваемого патогена или расстройства. Следовательно, лечение может осуществляться профилактически (до инфекции) или терапевтически (после инфекции). В настоящем изобретении можно использовать профилактические или терапевтические лечения. Согласно конкретному воплощению настоящего изобретения предложены композиции и способы, которые лечат, включая профилактическую и/или терапевтическую иммунизацию, животного-хозяина от микробной инфекции (например, бактерии, такой как бактерия рода Staphylococcus). Способы по настоящему изобретению являются полезными для придания субъекту профилактического и/или терапевтического иммунитета. Способы по настоящему изобретению также можно практиковать на субъектах для биомедицинских исследовательских приложений.
Термины «вакцина» или «вакцинная композиция», которые используются взаимозаменяемо, относятся к фармацевтическим композициям, содержащим по меньшей мере одну иммуногенную композицию, которая индуцирует иммунный ответ у животного.
Общее описание
Настоящее изобретение относится к иммуногенным композициям, содержащим по меньшей мере три антигена из стафилококкового организма, например, S. aureus. Антигены могут быть выделены из организма с использованием биохимических методик выделения, или они могут быть получены синтетически или посредством рекомбинантных способов. Антигены могут быть полипептидами или полисахаридами, или их комбинацией. Эти иммуногенные композиции могут быть использованы в изготовлении вакцины для иммунизации субъектов против инфекций, вызванных стафилококковым организмом. Компоненты, подходящие для применения в данных композициях, более подробно описаны ниже.
Стафилококковые иммуногенные композиции
S. aureus является возбудителем широкого спектра человеческих заболеваний, варьирующих от поверхностных инфекций кожи до угрожающих жизни состояний, таких как пневмония, сепсис и эндокардит. Смотрите Lowy N. Eng. J. Med. 339:580-532(1998). В случаях инвазивного заболевания S. aureus может быть выделен из обычно стерильных областей организма, включая кровь, цереброспинальную жидкость (CSF), плевральную жидкость, перикардиальную жидкость, перитонеальную жидкость, суставную/синовиальную жидкость, кость, внутреннюю область в организме (лимфатический узел, мозг, сердце, печень, селезенка, стекловидное тело (vitreous fluid), почку, поджелудочную железу, яичник) или другие обычно стерильные области. Это может приводить к угрожающим жизни клиническим состояниям, таким как бактериемия, пневмония, целлюлит, остеомиелит, эндокардит и септический шок. Взрослые, пожилые пациенты и пациенты-дети наиболее подвержены риску инфекций S. aureus.
В воплощениях настоящего изобретения описаны избранные антигены в иммуногенных композициях, включающие выделенный полипептид фактора слипания А S. aureus (ClfA), выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем, выделенный фактор слипания В S. aureus (ClfB) и рекомбинантный белок MntC S. aureus. Затем антигены были охарактеризованы в иммуногенных композициях как серии комбинаций для демонстрации того, что специфичные комбинации обеспечивают иммунные ответы, которые могут превосходить иммунные ответы, полученные с использованием индивидуальных компонентов для иммуногенных композиций.
Соответственно, в одной комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания А S. aureus (ClfA), выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем. Во второй комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный фактор слипания В S. aureus (ClfB), выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем. В третьей комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем. В четвертой комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем. В пятой комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем. В шестой комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем. В седьмой комбинации предложена иммуногенная композиция, содержащая выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с белком-носителем. В восьмой комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный полипептид фактора слипания В S. aureus (ClfB) и выделенный белок MntC S. aureus. В некоторых воплощениях приведенные выше комбинации дополнительно содержат по меньшей мере один из следующих антигенов: EkeS, DsqA, KesK, KrkN, KrkN2, RkaS, RrkN, KnkA, SdrC, SdrD, SdrE, ОррЗа, DltD, HtsA, LtaS, IsdA, IsdB, IsdC, SdrF, SdrG, SdrH, SrtA, SpA, Sbi альфа-гемолизин (hla), бета-гемолизин, фибронектинсвязывающий белок A (fnbA), фибронектинсвязывающий белок В (fnbB), коагулаза, Fig, map, лейкоцидин Пантона-Валентина (pvl), альфа-токсин и его варианты, гамма-токсин (hlg) и варианты, ica, иммунодоминантный ABC транспортер, транспортер Mg2+, ABC транспортер Ni, RAP, автолизин, рецепторы ламинина, IsaA/PisA, IsaB/PisB, SPOIIIE, SsaA, EbpS, Sas A, SasF, SasH, EFB (FIB), SBI, Npase, ЕВР, сиалосвязывающий белок II кости, предшественник ауреолизина (AUR)/Sepp1, Cna и его фрагменты, такие как М55, TSST-1, mecA, экзополисахарид поли-N-ацетилглюкозамин (PNAG/dPNAG), GehD, EbhA, EbhB, SSP-1, SSP-2, HBP, витронектинсвязывающий белок, HarA, EsxA, EsxB, энтеротоксин А, энтеротоксин В, энтеротоксин С1 и новый автолизин.
Эпидемиологические исследования вспышек заболевания S. aureus указывают на то, что эволюция S. aureus является клональной по природе, когда один клон, который приобрел успешный генотип, быстро распространялся и вызвал многие из инфекций. Следовательно, эволюция считается клональной. Бактериальный геном состоит из более крупного, более стабильного основного (core) видового генома и более многообразного набора вспомогательных генов. Смотрите Feil et al., Nature Reviews: Microbiology 2:483-495 (2004). Основные гены повсеместно присутствуют во всех клонах вида, а вспомогательные гены не обязательно присутствуют в любом данном клоне. Рассматривая S. aureus в одном исследовании с использованием ДНК микрочипов, представляющих более чем 90% генома S. aureus, обнаружили, что 78% генов генома были общими для всех S. aureus, таким образом, представляя «видовую основу», и остальные 22% представляют собой «вспомогательные гены». Вспомогательные гены включают необязательный генетический материал, значительная часть которого кодирует факторы вирулентности, белки, опосредующие устойчивость к антибиотикам, и гены, кодирующие белки, специфичные для взаимодействия со специфической средой хозяина. Смотрите Fitzgerald et al., PNAS 98:8821-8826 (2001); Feil et al., Nature Reviews: Microbiology 2:483-495 (2004). В общем, основные гены эволюционируют медленнее, и вспомогательные гены являются полиморфными. Смотрите Kuhn et al., J. Bact. 188:169-178 (2006). Следовательно, подходящим образом выбранные основные гены дают лучшие антигены-мишени для применения в иммуногенных композициях для предупреждения инфекции.
Экспрессируемые на поверхности антигены из изолятов, вызывающих заболевание, или клональных типов S. aureus предоставляют источник антигенов, способных индуцировать иммунитет и функциональные антитела. На макромолекулярном уровне (либо аминокислотной последовательности, либо последовательности полисахарида) могут быть выбраны консервативные формы антигена, экспрессируемые разными изолятами, вызывающими заболевание, для обеспечения широкой перекрестной реактивности антител на те штаммы, которые могут обладать антигенными вариациями вакцины-мишени.
Одним важным соображением для включения антигена в описанные здесь мультиантигенные иммуногенные композиции является то, продемонстрировал ли антиген эффективность при введении в виде имуногенной композиции путем предоставления защиты в одной или более чем одной животной модели бактериальной инфекции. Существуют многочисленные животные модели для разных заболеваний, вызванных S. aureus. Каждая из этих моделей имеет преимущества и недостатки.
Клиренс бактериальных инфекций у человека может идти через опсоническое умерщвление, которое служит промежуточным звеном после фагоцитарного поглощения. Имеется множество убедительных примеров этого из исследований с использованием полисахаридных антигенов из грамположительных (бактерий), таких как капсульный полисахарид Streptococcus pneumoniae и капсульный полисахарид S. aureus. Смотрите Lee et al., Crit. Rev. Micro. 29:333-349 (2003). Существует меньше доказательств опсонической активности, индуцированной белковыми антигенами грамположительных (бактерий). Наблюдали поглощение фагоцитами, но прямое умерщвление было сложнее продемонстрировать. Было показано, что моноклональные антитела к белкам дают защиту против заражения S. aureus в животных моделях инфекции; и механизмы, отличные от опсонофагоцитарного умерщвления могут отвечать за наблюдаемую защиту.
Индукция антител, имеющих измеримую функциональную активность, такую как опсонофагоцитирующая активность (ОРА), является одним из индикаторов того, является ли конкретный антиген полезным для включения в иммуногенные композиции по настоящему изобретению. Другие индикаторы включают экспрессию антигена на поверхности клетки во время экспрессии in vivo при измерении с использованием антигенспецифичных антител или способность антител ингибировать/нейтрализовать функцию антигена, но не ограничиваются этим.
Виды/штаммы
Тип любого конкретного больничного или вызывающего заболевание штамма является полезным для определения происхождения, клонального родства и мониторинга эпидемиологии вспышек. Доступны многочисленные способы типирования штаммов S. aureus. Классическим практическим определением вида бактерий является группа штаммов, которые характеризуются более чем 70%-ной геномной гибридизацией (геномная гибридизация ДНК-ДНК DDH) и более чем 97%-ной идентичностью последовательности гена 16S рибосомной РНК. Смотрите Vandamme et al., Microbiol. Rev. 60:407-438 (1996). Бактериофаговое типирование (ВТ) представляет собой способ типирования штаммов S. aureus на основе их чувствительности к лизису определенными типами фагов. Смотрите Blair et al., Bull. W.H.O. 24:771-784 (1961). Этот более старый способ страдает от недостатка воспроизводимости между лабораториями и неспособности к типированию 15-20% изолятов.
Иммуногенные композиции с одним антигеном по сравнению с мультиантигенными иммуногенными композициями
Возникает вопрос относительно того, должна ли оптимальная иммуногенная композиция для защиты против инфекции превалирующими штаммами S. aureus содержать один компонент или много компонентов. Многочисленные исследования показали, что иммуногенные композиции на основе одного белкового или углеводного компонента могут давать некоторую защиту от заражения штаммом S. aureus, экспрессирующим этот компонент, в определенных животных моделях. Важно то, что также было продемонстрировано, что защита от одного антигена может зависеть от выбранного штамма.
Поверхностные белки, такие как адгезины, были исследованы в качестве однокомпонентных вакцин. Например, у мышей, иммунизированных ClfA S. aureus, развивался менее тяжелый артрит, чем у мышей, иммунизированных контрольным белком. Смотрите Josefsson et al., J. Infect. Dis. 184:1572-1580 (2001). Фрагменты коллагенсвязывающего адгезина (ела) давали защиту в мышиной модели сепсиса. Смотрите Nilsson, et al., J. Clin. Invest., 101:2640-2649 (1998). Иммунизация мышей доменом A ClfB могла уменьшать назальную колонизацию в мышиной модели. Смотрите Schaffer et al., Infect. Immun. 74:2145-2153(2006).
Один из четырнадцати белков секвестрирования железа S. aureus, известный как IsdB, исследуется в одновалентной иммуногенной композиции для защиты от инфекции S. aureus. Данный белок показал хороший защитный эффект у мышей и хорошую иммуногенность у приматов, не являющихся человеком. Смотрите Kuklin et al., Infect. Immun. 74:2215-2223 (2006).
Из-за огромного потенциала S. aureus к эволюционированию или замещению разных белков для выполнения тех же самых или аналогичных функций, оптимальная иммуногенная композиция для защиты большинства людей от большинства заболеваний, вызванных S. aureus, представляет собой мультиантигенную композицию, содержащую 2 или более чем 2 (например, 3, 4, 5 и т.д.) антигена, правильно отобранных и представленных в иммуногенной композиции. В определенных воплощениях иммуногенная композиция по изобретению содержит три или более чем три антигена, выбранных из выделенного полипептида фактора слипания A S. aureus (ClfA), выделенного полипептида фактора слипания В S. aureus (ClfB), выделенного капсульного полисахарида типа 5 (СР5) S. aureus, конъюгированного с белком-носителем, выделенного капсульного полисахарида типа 8 (СР8) S. aureus, конъюгированного с белком-носителем, и выделенного белка MntC S. aureus. В определенных воплощениях иммуногенная композиция по изобретению содержит четыре или более чем четыре антигена, выбранных из выделенного полипептида фактора слипания A S. aureus (ClfA), выделенного полипептида фактора слипания В S. aureus (ClfB), выделенного капсульного полисахарида типа 5 (СР5) S. aureus, конъюгированного с белком-носителем, выделенного капсульного полисахарида типа 8 (СР8) S. aureus, конъюгированного с белком-носителем, и выделенного белка MntC S. aureus. В определенных воплощениях иммуногенная композиция по изобретению содержит выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный капсульный полисахарид типа 5 (СР5) S. aureus, конъюгированный с белком-носителем, выделенный капсульный полисахарид типа 8 (СР8) S. aureus, конъюгированный с белком-носителем, и выделенный белок MntC S. aureus в качестве антигенов.
Адъюванты
Иммуногенные композиции, как здесь описано, в определенных воплощениях также содержат один или более чем один адъювант. Адъювант представляет собой вещество, которое усиливает иммунный ответ при введении совместно с иммуногеном или антигеном. Было показано, что ряд цитокинов или лимфокинов имеют иммуномодулирующую активность и, таким образом, являются полезными в качестве адъювантов, включая интерлейкины 1-α, 1-β, 2, 4, 5, 6, 7, 8, 10, 12 (смотрите, например, патент США №5723127), 13, 14, 15, 16, 17 и 18 (и его мутантными формами), интерфероны α, β и γ; гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (смотрите, например, патент США №5078996 и номер доступа АТСС 39900); макрофагальный колониестимулирующий фактор (M-CSF); гранулоцитарный колониестимулирующий фактор (G-CSF) и факторы некроза опухоли α и β, но не ограничиваясь ими. Кроме того, другие адъюванты, которые являются полезными с описанными здесь иммуногенными композициями, включают хемокины, включающие без ограничения, МСР-1, М1Р-1α, М1Р-1β и RANTES; молекулы адгезии, такие как селектин, например, L-селектин, Р-селектин и Е-селектин; муцинподобные молекулы, например, CD34, GlyCAM-1 и MadCAM-1; член семейства интегринов, такой как LFA-1, VLA-1, Мас-1 и р150.95; член надсемейства иммуноглобулинов, такой как РЕСАМ, ICAM, например, ICAM-1, ICAM-2 и ICAM-3, CD2 и LFA-3; костимулирующие молекулы, такие как В7-1, В7-2, CD40 и CD40L; факторы роста, включая сосудистый фактор роста, фактор роста нервов, фактор роста фибробластов, эпидермальный фактор роста, PDGF (тромбоцитарный фактор роста), BL-1 и фактор роста эндотелия сосудов; молекулы рецепторов, включая Fas, рецептор TNF (фактор некроза опухоли), Flt, Apo-1, p55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRA1L-R2, TRICK2, и DR6 и каспазу (ICE).
Подходящие адъюванты, используемые для усиления иммунного ответа, дополнительно включают, без ограничения, MPL™ (3-O-деацилированный монофосфориллипид A, Corixa, Hamilton, MT), который описан в патенте США №4912094. Также подходящими для применения в качестве адъювантов являются синтетические аналоги липида А или аминоалкилглюкозаминфосфатные соединения (AGP) или их производные, или аналоги, которые имеются в продаже у Corixa (Hamilton, MT) и которые описаны в патенте США №6113918. Одно такое AGP представляет собой 2-[(R)-3-тетрадеканоилокситетрадеканоил-амино]этил-2-дезокси-4-O-фосфоно-3-O-[(R)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоил-амино]-b-D-глюкопиранозид, который также известен как 529 (ранее известен как RC529). Этот адъювант 529 приготовлен в виде препарата в водной форме (AF) или в виде стабильной эмульсии (SE).
Кроме того, другие адъюванты включают мурамилпептиды, такие как N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (МТР-РЕ); эмульсии типа «масло в воде», такие как MF59 (патент США №6299884) (содержащая 5% сквалена, 0,5% полисорбата 80 и 0,5% Span 85 (возможно содержащая разные количества МТР-РЕ), приготовленный в виде препарата субмикронных частиц с использованием микрофлюидайзера (microfluidizer), такого как микрофлюидайзер Model HOY (Microfluidics, Newton, MA)), и SAF (содержащая 10% сквалена, 0,4% полисорбата 80, 5% плюроник-заблокированного полимера L121 и thr-MDP, либо микрофлюидизированных (microfluidized) в субмикронную эмульсию, либо перемешиваемых (vortexed) с генерированием эмульсии с большим размером частиц); неполный адъювант Фрейнда (IFA); соли алюминия (квасцы), такие как гидроокись алюминия, фосфат алюминия, сульфат алюминия; амфиген; авридин; L121/сквален; D-лактид-полилактид/гликозид; полиолы-плюроники; умерщвленные Bordetella; сапонины, такие как Stimulon™ QS-21 (Antigenics, Framingham, MA), описанный в патенте США №5057540, ISCOMATRIX (CSL Limited, Parkville, Австралия), описанный в патенте США №5254339, и иммуностимулирующие комплексы (ISCOMATRIX); Mycobacterium tuberculosis; бактериальные липополисахариды; синтетические полинуклеотиды, такие как олигонуклеотиды, содержащие мотив CpG (например, патент США №6207646); IC-31 (Intercell AG, Вена, Австрия), описанные в европейских патентах №1296713 и 1326634; коклюшный токсин (РТ) или его мутанты, холерный токсин или его мутанты (например, патенты США №7285281, 7332174, 7361355 и 7384640); или термолабильный токсин (LT) E. coli или его мутант, в частности LT-K63, LT-R72 (например, патенты США №6149919, 7115730 и 7291588).
Антигены-кандидаты:
ClfA: доменная организация
Фактор слипания А (ClfA) представляет собой поверхностный белок S. aureus, ассоциированный со связыванием с белками матрикса хозяина через сайт связывания фибриногена. ClfA является членом семейства белков, содержащих карбоксиконцевой мотив LPXTG (SEQ ID NO:125), который обеспечивает возможность ковалентного связывания белка с поверхностью клетки. ClfA также принадлежит к другому семейству белков (адгезивная молекула матрикса, распознающая компоненты микробной поверхности, или MSCRAMM), которые ассоциированы со связыванием белков хозяина, таких как фибриноген (связываемый ClfA), фибронектинсвязывающие белки (FnbA и FnbB), коллагенсвязывающий белок (Cna) и другие. Все эти белки имеют общую аминоконцевую сигнальную последовательность, которая опосредует транспорт к поверхности клетки. MSCRAMM также включают домен А, который представляет собой функциональную область, содержащую активный сайт для связывания лиганда (например, фибриногена, фибронектина, эластина, кератина). После домена А следует область, состоящая из серин-аспартатных повторов (SD повтор), которая, как полагают, пересекает пептидогликановый слой. После SD повтора следует пересекающая мембрану область, которая включает мотив LPXTG (SEQ ID NO:125) для ковалентного связывания белка с пептидогликаном. ClfA описан в патенте США №6008341.
Лигандсвязывающая область ClfA, содержащая N1N2N3 домена А (Фиг.1), охватывает аминокислоты 40-559. Домены N ClfA были определены следующим образом: N1 охватывает остатки 45-220; N2 охватывает остатки 229-369 и N3 охватывает остатки 370-559. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Для простоты ссылки домены N1N2N3 могут быть обозначены как N123, подобным образом N2N3 может быть обозначен как N23. Было обнаружено, что в препаратах рекомбинантного N1N2N3 домен N1 является протеазочувствительным и легко расщепляется или гидролизуется, оставляя N2N3 в виде стабильного лигандсвязывающего рекомбинантного фрагмента. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Кристаллическая структура фибриногенсвязывающего фрагмента N2N3 домена А ClfA выявила то, что как в N2, так и в N3 доминируют антипараллельные бета-тяжи. Помимо антипараллельных бета-тяжей домен N2 содержит один виток альфа-спирали и две 310 спирали, и домен N3 содержит три 310 спирали. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Выравнивание последовательности N2 и N3 выявляет лишь 13% идентичности последовательности и 36% сходства последовательности по их длине. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Топология доменов N2 и N3 является похожей на классическую укладку IgG, и было предположено, что она представляет собой новые варианты укладки IgG. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002).
Последовательность ClfA
Ген белка фактора слипания А, обозначенный ClfA, был клонирован, секвенирован и подробно проанализирован на молекулярном уровне (McDevitt et al., Mot. Microbiol. 11:237-248 (1994); McDevitt et al., Mol. Microbiol. 16:895-907 (1995)). Идентификаторы последовательности для аминокислотных последовательностей ClfA из 111 изолятов S. aureus, вызывающих заболевание, показаны в Таблице 10. Аминокислотная последовательность полноразмерного ClfA дикого типа (включая сигнальную последовательность) из штамма PFESA0237 S. aureus представлена в SEQ ID NO:130. Данная последовательность показывает тирозин в положении 338, который заменен на аланин в мутированной форме ClfA. Полноразмерный ген, кодирующий ClfA дикого типа из штамма PFESA0237 S. aureus, содержащий область N123, область повтора и якорную область, представлен в SEQ ID NO:131. Аминокислотная последовательность мутированных форм Y338A ClfA представлена в SEQ ID NO:123. Однако следует отметить, что замена тирозина на аланин, которая имеет место в ClfA дикого типа в положении 338 SEQ ID NO:130 и которая обозначена как Y338A, представлена в мутированной форме ClfA в SEQ ID NO:123 в положении 310. Кроме того, мутированная форма ClfA, представленная в аминокислотной последовательности SEQ ID NO:123, представляет собой зрелую форму ClfA без сигнальной последовательности, таким образом, отвечая за различие в положении этой мутации между SEQ ID NO:130 и SEQ ID NO:123.
ClfB: доменная организация
ClfB представляет собой белок S. aureus, имеющий фибриногенсвязывающую активность, и инициирует образование колоний (clumps) S. aureus в присутствии плазмы. ClfB представляет собой белок MSCRAMM и демонстрирует характерную доменную организацию MSCRAMM, включающую домен А, который представляет собой функциональную область, содержащую активный сайт для связывания лиганда (например, фибриноген, фибронектин, эластин, кератин). После домена А следует область, состоящая из серин-аспартатных повторов (SD повтор), которая, как полагают, пересекает пептидогликановый слой. После SD повтора следует пересекающая мембрану область, которая включает мотив LPXTG (SEQ ID NO:125) для ковалентного связывания белка с пептидогликаном. ClfB описан в WO 99/27109 и патенте США №6680195.
Внутренняя организация N-концевого домена А ClfB является очень сходной с организацией, обнаруженной в ClfA. Домен А состоит из трех субдоменов N1, N2 и N3. Лигандсвязывающая область ClfB, содержащая N1N2N3 домена А (Фиг.1) охватывает аминокислоты 44-585. Для простоты ссылки домены N1N2N3 могут быть обозначены как N123, подобным образом N2N3 может быть обозначен как N23. Домены N ClfB были обозначены следующим образом: N1 охватывает остатки 44-197; N2 охватывает остатки 198-375; и N3 охватывает остатки 375-585. Было обнаружено, что в ClfA кристаллическая структура домена А имеет уникальную версию иммуноглобулиновой укладки, и, по аналогии, можно предположить, что то же самое имеет место в случае ClfB. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Даже несмотря на то, что организация доменов А ClfB и ClfA является похожей, идентичность последовательности составляет лишь 26%. Смотрите Ni Eidhin et al., Mol. Microbiol. 30:245-257 (2002).
Последовательность ClfB
Ген, кодирующий ClfB, классифицируют как основной ген адгезии. Последовательности ClfB из 92 штаммов S. aureus, ассоциированные со многими болезненными состояниями, обобщены в Таблице 11. Дополнительные последовательности были получены из GenBank.
Другие MSCRAMMS
Для применения в иммуногенной композиции по настоящему изобретению могут быть рассмотрены другие MSCRAMMS. Например, белки с серин-аспартатными повторами (Sdr), SdrC, SdrD и SdrE, являются родственными по первичной последовательности и структурной организации белкам ClfA и ClfB и локализованы на поверхности клетки. Белки SdrC, SdrD и SdrE представляют собой белки, ассоциированные с клеточной стенкой, имеющие сигнальную последовательность на N-конце и мотив LPXTG (SEQ ID NO:125), гидрофобный домен и положительно заряженные остатки на С-конце. Каждый также имеет область R, содержащую SD повторы, достаточной длины для того, чтобы, наряду с мотивами В, делать возможной эффективную экспрессию области А лигандсвязывающего домена на поверхности клетки. Посредством области А белков SdrC, SdrD и SdrE, расположенных на поверхности клетки, данные белки могут взаимодействовать с белками в плазме, внеклеточном матриксе или с молекулами на поверхности клеток-хозяев. Белки Sdr имеют некоторое ограниченное сходство аминокислотной последовательности с ClfA и ClfB. Подобно ClfA и ClfB, SdrC, SdrD и SdrE также демонстрируют катионзависимое связывание лиганда белков внеклеточного матрикса.
Гены sdr тесно связаны и тандемно организованы. Белки Sdr (из SdrC, SdrD, SdrE, ClfA и ClfB) типично содержат область А, где существует высококонсервативная аминокислотная последовательность, которую можно использовать для получения консенсусного мотива TYTFTDYVD (SEQ ID NO:126). Данный мотив демонстрирует небольшую вариацию между разными белками. Эта вариация, наряду с консенсусной последовательностью мотива, описана в патенте США номер 6680195. В белках Clf-Sdr данный мотив является высококонсервативным. Мотив можно использовать в иммуногенных композициях для придания иммунитета широкого спектра к бактериальным инфекциям и также можно использовать в качестве антигена при получении моноклональных или поликлональных антител. Такое антитело можно использовать для придания пассивного иммунитета широкого спектра.
Белки Sdr отличаются от ClfA и ClfB наличием от двух до пяти дополнительных повторяющихся последовательностей из 110-113 остатков (В-мотивов), расположенных между областью А и R-областью. Каждый В-мотив содержит консенсусную Са2+-связывающую петлю EF-руки, обычно находящуюся в эукариотических белках. Структурная целостность рекомбинантного белка, содержащего пять В-повторов SdrD, как было показано флуоресцентным анализом bisANS, является Са2+-зависимой, вызывая предположение о том, что EF-руки являются функциональными. При удалении Ca2+ структура разрушалась в развернутую конформацию. Исходная структура восстанавливалась добавлением Са2+. C-концевые R-домены Sdr белков содержат 132-170 остатков SD. После них следуют консервативные, заякоренные в стенке области, характерные для многих поверхностных белков грамположительных бактерий.
В белках Sdr и Clf данный мотив В является высококонсервативным, тогда как в фибронектинсвязывающем MSCRAMMS, а также в коллагенсвязывающем белке Can имеет место вырожденная версия. Мотивы B в сочетании с областями R являются необходимыми для появления лигандсвязывающего домена на некотором расстоянии от поверхности клетки. Повторяющиеся мотивы В являются одним общим знаменателем описанной здесь подгруппы белков с SD повторами. Данные мотивы обнаруживаются в разных количествах в трех белках Sdr из штамма PFESA0237. Существуют явные отличия между индивидуальными мотивами В. Самыми консервативными элементами являются элементы, расположенные по соседству с областями R (B2 SdrC, B5 SdrD и В3 SdrE). Они отличаются от остальных по нескольким сайтам, особенно в C-концевой половине. Примечательной структурной деталью является то, что соседние повторы В всегда разделены остатком пролина, присутствующим в C-концевой области, но пролин никогда не встречается между последними повторами В и областью R. Вместо этого данный линкер характеризуется коротким кислотным отрезком. Данные различия являются доказательством того, что концевые элементы имеют отличающуюся структурную или функциональную роль по сравнению с другими мотивами В. N-концевые мотивы В SdrD и SdrE отдалились (drifted) от других, и имеются многочисленные изменения аминокислот, включающие маленькие вставки и делеции, тогда как остальные внутренние мотивы В являются более высококонсервативными. Заметьте, что каждый из трех белков Sdr имеет по меньшей мере один мотив В каждого вида.
C-концевые R-домены белков Sdr содержат 132-170 остатков SD. После них следуют консервативные заякоренные в стенке области, характерные для многих поверхностных белков грамположительных бактерий.
Другие молекулы SdrD-кандидаты для применения в иммуногенной композиции по изобретению могут происходить из разных видов организмов, некоторые из которых включают следующие SdrD из S. aureus: штамм USA300 FPR3757 (номер доступа белка SAUSA300 0547); штамм NCTC8325 (номер доступа белка SAOUHSC 00545); штамм MW2 (номер доступа белка MW0517); штамм MSSA476 (номер доступа белка SAS0520; и штамм Mu50 (номер доступа белка SAV0562).
Дополнительные MSCRAMMS, которые можно рассматривать для применения в иммуногенной композиции по настоящему изобретению, включают EkeS, DsqA, KesK, KrkN, KrkN2, RkaS, RrkN и KnkA. Данные MSCRAMMS описаны в WO 02/102829, которая тем самым включена посредством ссылки. Дополнительные MSCRAMMS, идентифицированные № доступа GenBank, включают NP_373261.1, NP_373371.1, NP_374246.1, NP_374248.1, NP_374841.1, NP_374866.1, NP_375140.1, NP_375614.1, NP_375615.1, NP_375707.1, NP_375765.1 и NP_375773.1.
Капсульные полисахариды типа 5 и типа 8
Стафилококковые микроорганизмы, способные вызывать инвазивное заболевание, обычно также способны продуцировать капсульный полисахарид (СР), который инкапсулирует бактерию и увеличивает ее устойчивость к клиренсу врожденной иммунной системой хозяина. СР служит для покрытия бактериальной клетки защитной капсулой, которая делает бактерию устойчивой к фагоцитозу и внутриклеточному умерщвлению. Бактерии, не имеющие капсулы, являются более чувствительными к фагоцитозу. Капсульные полисахариды часто являются важным фактором вирулентности для многих бактериальных патогенов, включая Haemophilus influenzae, Streptococcus pneumoniae и стрептококки группы В.
Капсульный полисахарид можно использовать для серотипирования конкретных видов бактерий. Типирование обычно проводят реакцией со специфичной антисывороткой или моноклональным антителом, генерированным к специфической структуре или уникальному эпитопу, характерному для капсульного полисахарида. Инкапсулированные бактерии имеют тенденцию к росту в гладких колониях, тогда как колонии бактерий, которые потеряли их капсулы, кажутся шероховатыми. Колонии, имеющие слизеподобный внешний вид, известны как сильно инкапсулированные. S. aureus типов 1 и 2 являются сильно инкапсулированными и редко ассоциированы с заболеванием.
Большинство клинических изолятов S. aureus являются инкапсулированными либо серотипом 5, либо серотипом 8. Капсульные полисахариды типа 5 (СР5) и типа 8 (СР8) имеют сходные трисахаридные повторяющиеся единицы, состоящие из N-ацетилманнозаминоуроновой кислоты, N-ацетил-L-фукозамина и N-ацетил-D-фукозамина. Смотрите Fournier, J.M. et al., Infect. Immun. 45:97-93 (1984) и Moreau, M., et al., Carbohydrate Res. 201:285-297 (1990). Два СР, которые имеют одинаковые сахара, но отличаются по связям сахаров и по сайтам O-ацетилирования, продуцируют серологически отличные картины иммунореактивности.
В некоторых воплощениях капсульные полисахариды серотипа 5 и/или 8 по изобретению являются O-ацетилированными. В некоторых воплощениях степень O-ацетилирования капсульного полисахарида типа 5 или олигосахарида составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%. 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В некоторых воплощениях степень O-ацетилирования капсульного полисахарида типа 8 или олигосахарида составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В некоторых воплощениях степень O-ацетилирования капсульных полисахаридов типа 5 и типа 8 или олигосахаридов составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%. 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%.
Степень O-ацетилирования полисахарида или олигосахарида можно определять любым способом, известным в данной области, например, протонным ЯМР (Lemercinier and Jones 1996, Carbohydrate Research 296; 83-96, Jones and Lemercinier 2002, J Pharmaceutical and Biomedical Analysis 30; 1233-1247, WO 05/033148 или WO 00/56357). Другой обычно используемый способ описан Hestrin (1949) J. Biol. Chem. 180; 249-261.
В некоторых воплощениях капсульные полисахариды серотипа 5 и/или 8 по изобретению используют для генерации антител, которые являются функциональными при измерении умерщвления бактерий в животной модели эффективности или в анализе опсонофагоцитарного умерщвления, который демонстрирует то, что антитела убивают бактерии. Такая функциональность может не наблюдаться при использовании анализа, который отслеживает генерирование одних антител, что не является признаком значимости O-ацетилирования для эффективности.
Эпидемиология капсулы
Ассоциация конкретных серотипов капсул с заболеванием возможна через мониторинг клинических изолятов. Из восьми разных идентифицированных серотипов S. aureus (Karakawa and Vann (1982) только серотипы 1 и 2 являются сильно инкапсулированными, и их редко выделяют. Смотрите Capsular Polysaccharides of Staphylococcus aureus, p.285-293, In J.B. Robbins, J.C. Hill and J.C. Sadoff (ed.), Seminars in infectious disease, vol. 4, Bacterial Vaccines. Thieme Stratton, Inc. New York). Исследования показали, что приблизительно 85-90% клинических изолятов S. aureus экспрессируют СР5 или СР8 (Arbeit RD, et al., Diagn. Microbiol. Infect. Dis. (1984) Apr;2(2):85-91; Karakawa WW, et al., J. Clin. Microbiol. (1985) Sep;22(3):445-7; Essawi T, et al., Trop. Med. Int. Health. (1998) Jul;3(7):576-83; Na'was T, et al., J. Clin. Microbiol. (1998) 36(2):414-20. Большинство нетипируемых штаммов СР5 и СР8 генетически представляют собой тип 5 или тип 8, содержащий мутации в локусе сар5/8 (Cocchiaro, Gomez et al. (2006), Mol. Microbiol. Feb. 59(3):948-960). Капсулирование для некоторых штаммов быстро теряется в пределах нескольких пассажей in vitro, что обусловлено репрессивным эффектом высокой концентрации фосфата в средах, используемых в клинической диагностике, на продукцию капсулы. Также сообщали, что неинкапсулированные изоляты восстанавливают экспрессию капсулы после прохождения через коров. Смотрите Opdebeck, J.P. et al., J. Med. Microbiol. 19:275-278 (1985). Некоторые нетипируемые штаммы становятся позитивными в отношении капсулы при подходящих ростовых условиях.
Структура СР5 и СР8
Повторяющаяся единица и СР5, и СР8 состоит из 2-ацетамидо-2-дезокси-D-маннуроновой кислоты, 2-ацетамидо-2-дезокси-L-фукозы и 2-ацетамидо-2-дезокси-D-фукозы. Смотрите С. Jones et al., Carbohydr. Res. 340:1097-1106 (2005). Несмотря на то, что СР5 и СР8 имеют одинаковый состав Сахаров, было показано, что они являются иммунологически различными. Они отличаются по гликозидным связям и сайту O-ацетилирования уроновой кислоты. Наблюдали зависимое от штамма неполное N-ацетилирование одного из FucNAc остатков. Смотрите Tzianabos et al., PNAS V98: 9365(2001).
Капсульный полисахарид S. aureus в иммуногенной композиции
Молекулярная масса капсульных полисахаридов S. aureus является важным фактором, который учитывают при применении в иммуногенных композициях. Капсульные полисахариды с высокой молекулярной массой способны индуцировать определенные иммунные ответы антител из-за большей валентности эпитопов, присутствующих на антигенной поверхности. Описанные здесь способы обеспечивают выделение и очистку капсульных полисахаридов типа 5 и типа 8 со значительно более высокой молекулярной массой, чем было доступно ранее.
MntC/SitC/связывающий белок слюны
MntC/SitC/связывающий белок слюны представляет собой белок АВС-транспортер и имеет гомологии у S. epidermidis и S. aureus. В настоящем изобретении он обозначен как MntC. Данный белок представляет собой 32 кДа липопротеин и локализован в бактериальной клеточной стенке. Смотрите Sellman et al. и Cockayne et al., Infect. Immun. 66: 3767(1998). У S. epidermidis он является компонентом оперона, регулируемого железом. Он демонстрирует значительную гомологию как с адгезинами, включая FimA S. parasanguis, так и с липопротеинами семейства АВС-транспортеров с доказанными или предполагаемыми функциями транспорта металлического железа. (Смотрите Таблицу 12 для штаммов S. aureus и последовательностей).
Белок MntC S. aureus
Гомолог MntC S. aureus известен как связывающий белок слюны, был раскрыт в патенте США №5801234 и может быть включен в иммуногенную композицию по изобретению. Последовательность белка гомолога MntC/SitC/ связывающего белка слюны S. aureus находится в GenBank под номером доступа NP_371155 для штамма Mu50. (Также известен как SAV0631). Идентификатор последовательности - SEQ ID NO:119. Номер доступа для нуклеотидной последовательности для полного генома штамма Mu50 - NC_002758.2 (координаты 704988-705917).
Белок SitC S. epidermidis
Гомолог MntC/SitC/связывающего белка слюны S. epidermidis известен как SitC и был раскрыт в Sellman et al. (Sellman et al., Infect. Immun. 2005 October; 73(10): 6591-6600). Последовательность белка гомолога MntC/SitC/ связывающего белка слюны S. epidermidis находится в GenBank под номером доступа YP_187886.1. (Также известен как SERP0290). Идентификатор последовательности - SEQ ID NO:121.
Номер доступа для нуклеотидной последовательности полного генома штамма RP62A - NCJ302976 (координаты 293030-293959). Другие молекулы SitC-кандидаты для применения в иммуногенной композиции по изобретению могут происходить из разных видов организмов, некоторые из которых перечислены в Таблице 1 ниже.
|
Железосвязывающие белки S. aureus
Другой потенциальный антиген-кандидат, подлежащий рассмотрению для применения в иммуногенных композициях по изобретению, включает поверхностный белок S. aureus поверхностную детерминанту железа В (IsdB). Этот MSCRAMM был описан Mazmanian et al. (Mazmanian, SK et al. Proc. Natl. Acad. Sci., USA 99:2293-2298 (2002)) и затем был протестирован, и было показано, что он является эффективным в качестве вакцины-кандидата в мышиной модели инфекции и исследовании иммуногенности на макаках-резусах, проведенном Kuklin, et al. (Kuklin, NA, et al. Infection and Immunity, Vol.74, No. 4, 2215-2223 (2006)). Эта молекула IsdB присутствует в разных штаммах S. aureus, включая штамм MRSA252 (номер доступа белка CAG40104.1); штамм Newman (номер доступа белка BAF67312.1); штамм MSSA476 (номер доступа белка CAG42837.1); штамм Mu3 (номер доступа белка BAF78003.1); штамм RF122 (номер доступа белка СА180681.1).
Антигены-кандидаты:
Иммуногенные композиции по настоящему изобретению также могут включать один или более чем один из следующих антигенов: Орр3а, DltD, HtsA, LtaS, IsdA, IsdC, SdrF, SdrG, SdrH, SrtA, SpA, альфа-гемолизин Sbi (hla), бета-гемолизин, фибронектинсвязывающий белок A (fnbA), фибронектинсвязывающий белок В (fnbB), коагулазу, Fig, map, лейкоцидин Пантона-Валентина (pvl), альфа-токсин и его варианты, гамма-токсин (hlg) и варианты, ica, иммунодоминантный ABC транспортер, транспортер Mg2+, ABC транспортер Ni, RAP, автолизин, рецепторы ламинина, IsaA/PisA, IsaB/PisB, SPOIIIE, SsaA, EbpS, Sas A, SasF, SasH, EFB (FIB), SBI, Npase, EBP, сиалосвязывающий белок II кости, предшественник ауреолизина (AUR)/Sepp1, Cna, и их фрагменты, такие как М55, TSST-1, mecA, экзополисахарид поли-N-ацетилглюкозамин (PNAG/dPNAG), GehD, EbhA, EbhB, SSP-1, SSP-2, HBP, витронектинсвязывающий белок, HarA, EsxA, EsxB, энтеротоксин А, энтеротоксин В, энтеротоксин С1 и новый автолизин. В определенных воплощениях изобретения, когда иммуногенная композиция содержит определенные формы СР5 и/или СР8, она может не содержать дополнительно PNAG.
Препараты иммуногенной композиции
В одном воплощении иммуногенные композиции по изобретению дополнительно содержат по меньшей мере одно из адъюванта, буфера, криопротектора, соли, двухвалентного катиона, неионного детергента, ингибитора окисления свободными радикалами, разбавителя или носителя.
Иммуногенные композиции по изобретению могут дополнительно содержать один или более чем один консерванта дополнение к множеству стафилококковых белковых антигенов и конъюгатов капсульный полисахарид-белок. FDA (Управление США по контролю за пищевыми продуктами и лекарственными средствами) требует, лишь с несколькими исключениями, чтобы биологические продукты в многодозовых (мультидозовых) сосудах содержали консервант. Вакцинные продукты, содержащие консерванты, включают вакцины, содержащие хлорид бензетония (сибирская язва), 2-феноксиэтанол (DTaP, HepA, болезнь Лайма, полиомиелит (Polio) (парентерально)), фенол (пневмония (Pneumo), тиф (Typhoid) (парентерально), оспа (Vaccinia)) и тимеросал (DTaP, DT, Td, HepB, Hib, грипп, JE, менингит (Mening), пневмония (Pneumo), бешенство (Rabies)). Консерванты, одобренные для применения в инъецируемых лекарственных средствах, включают, например, хлорбутанол, м-крезол, метилпарабен, пропилпарабен, 2-феноксиэтанол, хлорид бензетония, хлорид бензалкония, бензойную кислоту, бензиловый спирт, фенол, тимеросал и нитрат фенилртути.
Композиции по изобретению могут дополнительно включать одно или более чем одно из буфера, соли, двухвалентного катиона, неионного детергента, криопротектора, такого как сахар, и антиоксиданта, такого как акцептор свободных радикалов или хелатообразующий агент, или любую из их многих комбинаций. Выбор любого одного компонента, например, хелатообразующего агента, может определять то, является ли другой компонент (например, акцептор) желательным. Конечная композиция, приготовленная в виде препарата для введения, должна быть стерильной и/или свободной от пирогенов. Специалист может эмпирически определить, какие комбинации этих и других компонентов будут оптимальными для включения в иммуногенные композиции по изобретению, содержащие консервант, в зависимости от множества факторов, таких как конкретные требуемые условия хранения и введения.
В определенных воплощениях композиция по изобретению, которая совместима с парентеральным введением, содержит один или более чем один физиологически приемлемый буфер, выбранный из Tris(триметамин)-буфера, фосфатного, ацетатного, боратного, цитратного, глицинового, гистидинового и сукцинатного буфера, но не ограничиваясь ими. В определенных воплощениях композиция забуферена до значения в пределах интервала рН от примерно 6,0 до примерно 9,0, предпочтительно от примерно 6,4 до примерно 7,4.
В определенных воплощениях может быть желательным подведение рН иммуногенной композиции или препарата по изобретению. рН композиции по изобретению может быть подведен с использованием стандартных в данной области методик. рН композиции может быть подведен до значения от 3,0 до 8,0. В определенных воплощениях рН композиции может составлять или может быть подведен до значения от 3,0 до 6,0; от 4,0 до 6,0 или от 5,0 до 8,0. В других воплощениях рН композиции может составлять или может быть подведен примерно до 3,0; примерно 3,5; примерно 4,0; примерно 4,5; примерно 5,0; примерно 5,5; примерно 5,8; примерно 6,0; примерно 6,5; примерно 7,0; примерно 7,5 или примерно 8,0. В определенных воплощениях рН может составлять или может быть подведен до значения, находящегося в интервале от 4,5 до 7,5; или от 4,5 до 6,5; от 5,0 до 5,4; от 5,4 до 5,5; от 5,5 до 5,6; от 5,6 до 5,7; от 5,7 до 5,8; от 5,8 до 5,9; от 5,9 до 6,0; от 6,0 до 6,1; от 6,1 до 6,2; от 6,2 до 6,3; от 6,3 до 6,5; от 6,5 до 7,0; от 7,0 до 7,5 или от 7,5 до 8,0. В определенном воплощении рН композиции составляет примерно 5,8.
В определенных воплощениях композиция по изобретению, которая является совместимой с парентеральным введением, содержит один или более чем один двухвалентный катион, включая MgCl2, CaCl2 и MnCl2, но не ограничиваясь ими, в концентрации, варьирующей от примерно 0,1 мМ до примерно 10 мМ, причем концентрация вплоть до примерно 5 мМ является предпочтительной.
В определенных воплощениях композиция по изобретению, которая является совместимой с парентеральным введением, содержит одну или более чем одну соль, включая хлорид натрия, хлорид калия, сульфат натрия и сульфат калия, но не ограничиваясь ими, присутствующую при ионной силе, которая является физиологически приемлемой для субъекта при парентеральном введении, и включенную в конечной концентрации с получением выбранной ионной силы или осмолярности в конечной композиции. Конечная ионная сила или осмолярность композиции будет определяться множеством компонентов (например, ионов из буферного (ых) соединения (соединений) и других небуферных солей). Предпочтительная соль, NaCl, присутствует в интервале вплоть до примерно 250 мМ, причем концентрации соли выбирают для дополнения других-компонентов (например, сахаров) так, чтобы конечная общая осмолярность композиции была совместимой с парентеральным введением (например, внутримышечной или подкожной инъекцией), и будет способствовать долговременной стабильности иммуногенных компонентов препарата иммуногенной композиции в разных интервалах температуры. В композициях, не содержащих соль, будут допустимы увеличенные интервалы содержания одного или более чем одного выбранного криопротектора для поддержания желательных уровней конечной осмолярности.
В определенных воплощениях композиция по изобретению, которая является совместимой с парентеральным введением, содержит один или более чем один криопротектор, выбранный из дисахаридов (например, лактозы, мальтозы, сахарозы или трегалозы) и полигидроксиуглеводородов (например, дульцита, глицерина, маннита и сорбита), но не ограничиваясь ими.
В определенных воплощениях осмолярность композиции находится в интервале от примерно 200 мОсм/л до примерно 800 мОсм/л с предпочтительным интервалом от примерно 250 мОсм/л до примерно 500 мОсм/л или от примерно 300 мОсм/л до примерно 400 мОсм/л. Композиция, не содержащая соль, может содержать, например, от примерно 5% до примерно 25% сахарозы и предпочтительно от примерно 7% до примерно 15%, или от примерно 10% до примерно 12% сахарозы. В качестве альтернативы, композиция, не содержащая соль, может содержать, например, от примерно 3% до примерно 12% сорбита и предпочтительно от примерно 4% до 7% или от примерно 5% до примерно 6% сорбита. Если добавляют соль, такую как хлорид натрия, тогда эффективный интервал сахарозы или сорбита относительно снижается. Эти и другие такие осмолярность и соображения относительно осмолярности целиком находятся в пределах квалификации специалистов в данной области.
В определенных воплощениях композиция по изобретению, которая является совместимой с парентеральным введением, содержит один или более чем один из ингибиторов окисления свободными радикалами и/или хелатообразующих агентов. В данной области известен целый ряд акцепторов свободных радикалов и хелатообразующих агентов, и они применимы для описанных здесь композиций и способов применения. Примеры включают, но не ограничиваясь ими, этанол, EDTA (этилендиаминтетрауксусная кислота), комбинацию EDTA/этанол, триэтаноламин, маннит, гистидин, глицерин, цитрат натрия, инозитолгексафосфат, триполифосфат, аскорбиновую кислоту/аскорбат, янтарную кислоту/сукцинат, яблочную кислоту/малеат, десферал, EDDHA (этилендиаминдигидроксифенилуксусная кислота) и DTPA (диэтилентриаминпентауксусная кислота) и разные комбинации двух или более чем двух из приведенных выше. В определенных воплощениях может быть добавлен по меньшей мере один невосстанавливающий акцептор свободных радикалов в концентрации, которая эффективно увеличивает долговременную стабильность композиции. Также можно добавить один или более чем один ингибитор окисления свободными радикалами/хелатообразующий агент в разных комбинациях, такой как акцептор и двухвалентный катион. Выбор хелатообразующего агента будет определять, требуется или нет добавление акцептора.
В определенных воплощениях композиция по изобретению, которая совместима с парентеральным введением, содержит одно или более чем одно неионное поверхностно-активное вещество, включая, но не ограничиваясь ими, сложные эфиры полиоксиэтиленсорбитана и жирных кислот, полисорбат-80 (Tween 80), полисорбат-60 (Tween 60), полисорбат-40 (Tween 40) и полисорбат-20 (Tween 20), алкиловые эфиры полиоксиэтилена, включая, но не ограничиваясь ими, Brij 58, Brij 35, а также другие, такие как Triton X-100; Triton Х-114, NP40, Span85 и неионные поверхностно-активные вещества серии Pluronic (например, Pluronic 121), с предпочтительными компонентами - полисорбатом-80 в концентрации от примерно 0,001% до примерно 2% (с концентрацией вплоть до примерно 0,25% являющейся предпочтительной) или полисорбатом-40 в концентрации от примерно 0,001% до примерно 1% (с концентрацией вплоть до примерно 0,5% являющейся предпочтительной).
В определенных воплощениях композиция по изобретению содержит один или более чем один дополнительный стабилизатор, подходящий для парентерального введения, например, восстанавливающий агент, содержащий по меньшей мере одну тиольную (-SH) группу (например, цистеин, N-ацетилцистеин, восстановленный глутатион, тиогликолят натрия, тиосульфат, монотиоглицерин или их смеси). Альтернативно или возможно, препараты иммуногенной композиции по изобретению, содержащие консервант, могут быть дополнительно стабилизированы путем удаления кислорода из контейнеров для хранения, защитой препарата от света (например, посредством применения контейнеров из желтого стекла).
Препараты иммуногенной композиции по изобретению, содержащие консервант, могут содержать один или более чем один фармацевтически приемлемый носитель или эксципиент, который включает любой эксципиент, который сам по себе не индуцирует иммунный ответ. Подходящие эксципиенты включают макромолекулы, такие как белки, сахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, сахарозу (Paoletti et al., 2001, Vaccine, 19:2118), трегалозу, лактозу и липидные агрегаты (такие как капельки масла или липосомы), но не ограничиваются ими. Такие носители хорошо известны квалифицированному специалисту. Фармацевтически приемлемые эксципиенты обсуждаются, например, в Gennaro, 2000, Remington: The Science and Practice of Pharmacy, 20th edition, ISBN:0683306472.
Композиции по изобретению могут быть лиофилизированными или находиться в водной форме, т.е. в форме растворов или суспензий. Жидкие композиции преимущественно можно вводить непосредственно из их упакованной формы, и, таким образом, они являются идеальными для инъекции без необходимости растворения в жидкой среде, как, в других случаях, потребовалось бы для лиофилизированных композиций по изобретению.
Прямая доставка иммуногенных композиций по настоящему изобретению субъекту может осуществляться парентеральным введением (внутримышечно, внутрибрюшинно, внутрикожно, подкожно, внутривенно или в интерстициальное пространство ткани); или ректальным, пероральным, вагинальным, местным, чрескожным, интраназальным, глазным, ушным, легочным или другим введением на слизистую. В предпочтительном воплощении парентеральное введение осуществляется путем внутримышечной инъекции, например, в бедро или плечо субъекта. Инъекция может осуществляться через иглу (например, иглу для подкожных инъекций), но альтернативно можно использовать безыгольную инъекцию. Типичная внутримышечная доза составляет 0,5 мл. Композиции по изобретению можно приготовить в разных формах, например, для инъекции либо в виде жидких растворов, либо суспензий. В определенных воплощениях композицию можно приготовить в виде порошка или спрея для легочного введения, например, в ингаляторе. В других воплощениях композицию можно приготовить в виде суппозитория или пессария, или для назального, ушного или глазного введения, например, в виде спреев, капель, геля или порошка.
Оптимальные количества компонентов для конкретной иммуногенной композиции можно установить путем стандартных исследований, включающих наблюдение соответствующих иммунных ответов у субъектов. После исходной вакцинации субъекты могут получать одну или несколько бустер-иммунизаций с адекватным интервалом во времени.
Упаковка и лекарственные формы
Иммуногенные композиции по изобретению могут быть упакованы в форме единичной дозы или многодозовой форме (например, 2 дозы, 4 дозы или более). Для многодозовых форм флаконы типично, но не обязательно, являются предпочтительными по сравнению с предварительно заполненными шприцами. Подходящие многодозовые форматы включают 2-10 доз на контейнер по 0,1-2 мл на дозу, но не ограничиваются этим. В определенных воплощениях доза представляет собой дозу 0,5 мл. Смотрите, например, международную патентную заявку WO 2007/127668, которая включена сюда посредством ссылки.
Композиции могут быть представлены во флаконах или других подходящих контейнерах для хранения, или могут быть представлены в предварительно заполненных устройствах для доставки, например, однокомпонентных или многокомпонентных шприцах, которые могут поставляться с иглами или без игл. Шприц типично, но не обязательно, содержит одну дозу иммуногенной композиции по изобретению, содержащей консервант, хотя также рассматриваются многодозовые, предварительно заполненные шприцы. Подобным образом, флакон может включать одну дозу, но, альтернативно, может включать много доз.
Эффективные объемы дозировки можно устанавливать обычным способом, но типичная доза композиции для инъекции имеет объем 0,5 мл. В определенных воплощениях дозу готовят в виде препарата для введения субъекту-человеку. В определенных воплощениях дозу готовят в виде препарата для введения субъекту - взрослому человеку, тинэйджеру, подростку, ребенку, начинающему ходить, или младенцу (т.е. имеющему возраст не более года), и, в предпочтительных воплощениях, она может вводиться инъекцией.
Жидкие иммуногенные композиции по изобретению также подходят для растворения других иммуногенных композиций, которые представлены в лиофилизированной форме. Когда иммуногенная композиция предназначена для применения для такого немедленного растворения, согласно изобретению предложен набор с двумя или более чем двумя флаконами, двумя или более чем двумя готовыми к применению заполненными шприцами, или одним или более чем одним из каждого, причем содержимое шприца используется для растворения содержимого флакона до инъекции или наоборот.
В качестве альтернативы, иммуногенные композиции по настоящему изобретению могут быть лиофилизированными и растворенными, например, с использованием одного из многих способов лиофильной сушки, хорошо известных в данной области, с образованием сухих частиц правильной (например, сферической) формы, таких как микропеллеты или микросферы, имеющих характеристики частиц, такие как величины среднего диаметра, которые можно выбрать и контролировать путем варьирования точных способов, используемых для их получения. Иммуногенные композиции могут дополнительно содержать адъювант, который возможно может быть приготовлен с отдельными сухими частицами правильной (например, сферической) формы, таких как микрогранулы или микросферы или содержаться в них. В таких воплощениях согласно настоящему изобретению дополнительно предложен набор иммуногенной композиции, содержащий первый компонент, который включает стабилизированную, сухую иммуногенную композицию, возможно дополнительно содержащую один или более чем один консервант по изобретению, и второй компонент, содержащий стерильный водный раствор для растворения первого компонента. В определенных воплощениях водный раствор содержит один или более чем один консервант и возможно может содержать по меньшей мере один адъювант (смотрите, например, WO2009/109550 (включенный сюда посредством ссылки).
В еще одном другом воплощении контейнер многодозового формата выбран из одной или более чем одной группы, состоящей из, но не ограничиваясь, обычной лабораторной стеклянной посуды, флаконов, стаканов, мерных цилиндров, ферментеров, биореакторов, шлангов, трубок, пакетов, банок, сосудов, крышек сосудов (например, резиновых крышек, крышек с резьбой), ампул, шприцев, двух- или многокамерных шприцев, крышками шприцев, поршнями шприцев, резиновыми крышками, пластиковыми крышками, стеклянными крышками, картриджами и одноразовыми ручками и тому подобным. Контейнер по настоящему изобретению не ограничивается материалом, из которого он изготовлен, и включает такие материалы, как стекло, металлы (например, сталь, нержавеющую сталь, алюминий и т.д.) и полимеры (например, термопласты, эластомеры, термопласты-эластомеры). В конкретном воплощении контейнер данного формата представляет собой 5 мл стеклянный сосуд Шотта типа 1 (Schott Type 1) с бутиловой пробкой. Квалифицированный специалист поймет, что форматы, изложенные выше, никоим образом не являются исчерпывающим списком, но просто служат как руководство специалисту относительно множества форматов, доступных для настоящего изобретения. Дополнительные форматы, рассматриваемые для применения в настоящем изобретении, можно найти в опубликованных каталогах от поставщиков и производителей лабораторного оборудования, таких как United States Plastic Corp. (Lima, ОН), VWR.
Оценка иммуногенных композиций
В одном воплощении согласно настоящему изобретению предложены иммуногенные композиции, содержащие по меньшей мере три антигена из организма S. aureus.
Используются разные тесты in vitro для оценки иммуногенности иммуногенных композиций по изобретению. Например, опсонический анализ in vitro проводят путем совместного инкубирования смеси стафилококковых клеток, сыворотки, инактивированной нагреванием, содержащей специфичные антитела к рассматриваемым антигенам, и экзогенного источника комплемента. Опсонофагоцитоз идет на протяжении инкубации свежевыделенных полиморфоядерных клеток (PMN) или дифференцированных эффекторных клеток, таких как HL60, и смеси антитело/комплемент/стафилококковые клетки. Бактериальные клетки, которые покрыты антителом и комплементом, умерщвляются при опсонофагоцитозе. Колониеобразующие единицы (КОЕ) выживших бактерий, которые восстанавливаются после опсонофагоцитоза, определяют путем посева на чашки анализируемой смеси. Титры приводят как обратное значение от наиболее высокого разведения, которое дает 50%-ное умерщвление бактерий, определенное по сравнению с контролями анализа.
Для оценки иммуногенности in vitro и нахождения антигена на поверхности также используют анализ ELISA (твердофазный иммуноферментный анализ) целых клеток, при котором интересующим бактериальным штаммом (S. aureus) покрывают планшет, такой как 96-луночный планшет, и проводят реакцию тестируемой сыворотки из иммунизированного животного с бактериальными клетками. Если любое антитело, специфичное в отношении тестируемого антигена, реагирует с находящимся на поверхности эпитопом антигена, его можно детектировать стандартными способами, известными специалисту в данной области.
Любой антиген, демонстрирующий желаемую активность in vitro, затем тестируют в животной модели заражения in vivo. В определенных воплощениях в иммунизации животного (например, мыши) используют иммуногенные композиции способами и путями иммунизации, известными специалистам в данной области (например, интраназальным, парентеральным, пероральным, ректальным, вагинальным, чрескожным, внутрибрюшинным, внутривенным, подкожным и т.д.). После иммунизации животного конкретной иммуногенной композицией на основе Staphylococcus sp., животное заражают Staphylococcus sp.и анализируют на устойчивость к стафилококковой инфекции.
В одном воплощении мышей, не содержащих патоген, иммунизируют и заражают S. aureus. Например, мышей иммунизируют одной или более чем одной дозой желаемого антигена в иммуногенной композиции. Затем мышей заражают S. aureus и отслеживают выживание на протяжении периода времени после заражения.
Способы иммунизации
Также предложены способы иммунизации хозяина для предупреждения стафилококковой инфекции. В предпочтительном воплощении хозяином является человек. Таким образом, хозяину или субъекту вводят иммуногенное количество иммуногенной композиции, как здесь описано. Иммуногенное количество иммуногенной композиции можно определить путем осуществления исследования доза-ответ, в котором субъектов иммунизируют постепенно возрастающими количествами иммуногенной композиции, и анализируют иммунный ответ для определения оптимальной дозировки. Отправные точки для исследования можно вывести из данных по иммунизации в животных моделях. Величина дозировки может варьировать в зависимости от конкретных условий индивидуума. Количество можно определить в традиционных испытаниях способами, известными специалистам в данной области. В некоторых воплощениях способ иммунизации хозяина для предупреждения стафилококковой инфекции, заболевания или состояния включает лечение человека, ветеринарное лечение или лечение сельскохозяйственных животных. Согласно другому воплощению предложен способ иммунизации хозяина для предупреждения стафилококковой инфекции, заболевания или состояния, ассоциированного со Staphylococcus sp., у субъекта, включающий изготовление препарата поликлонального или моноклонального антитела из описанной здесь иммуногенной композиции и применение указанного препарата антитела для придания субъекту пассивного иммунитета.
Иммунологически эффективное количество иммуногенной композиции вводят субъекту в подходящем числе доз для вызова иммунного ответа. Обработанный индивидуум не должен демонстрировать более серьезных клинических проявлений стафилококковой инфекции. Размер дозировки может варьировать в зависимости от конкретных условий индивидуума, таких как возраст и масса тела. Данный размер можно определять в традиционных испытаниях способами, известными специалистам в данной области.
В одном воплощении пациенты, которым вводятся иммуногенные композиции по изобретению, демонстрируют снижение показателей носительства S. aureus. Такое снижение носительства или длительный интервал времени после введения иммуногенной композиции, который проводится в статусе неносителя, является значимым с точки зрения медицинской необходимости. Например, уменьшение общего носительства S. aureus у носителей можно оценивать после одной дозы мультиантигенной вакцины против S. aureus. Например, за 1 сутки до введения иммуногенной композиции группу взрослых в возрасте 18-50 лет можно подвергать скринингу на носительство посредством мазков из носа и горла с последующим культивированием для определения их состояния носительства. Затем группе можно вводить иммуногенную композицию по изобретению, имея группу, получающую контрольную обработку. Мазки из носа и горла берут еженедельно на протяжении 12-недельного периода и ежемесячно вплоть до 6 месяцев после введения иммуногенной композиции и сравнивают их с плацебо. Одним первичным этапом является сравнение показателей носительства у пациентов после введения иммуногенной композиции по сравнению с плацебо с 3-месячными интервалами после иммунизации.
Животные модели стафилококковой инфекции
Ниже описано несколько животных моделей для применения при оценке эффективности любой из описанных здесь иммуногенных композиций.
Мышиная модель сепсиса (пассивная или активная)
Модель пассивной иммунизации
Мышей пассивно иммунизировали внутрибрюшинно (i.p.) иммунным IgG или моноклональным антителом. Впоследствии, через 24 часа, мышей заражали летальной дозой S. aureus. Бактериальное заражение вводили внутривенно (i.v.) или i.p., обеспечивая то, что любое выживание могло быть приписано специфичному взаимодействию in vivo антитела с бактерией. Доза бактериального заражения определяется как доза, требуемая для достижения летального сепсиса примерно у 20% неиммунизированных контрольных мышей. Статистическую оценку исследований выживания можно проводить анализом Каплана-Мейера.
Модель активной иммунизации
В данной модели мышей (например, мышей Swiss Webster) активно иммунизируют интраперитонеально (i.p.) или подкожно (s.c.) антигеном-мишенью в 0, 3 и 6 недель (или согласно другой аналогичной схеме вакцинации с подходящими интервалами во времени) и затем заражают S. aureus на неделе 8 внутривенным путем. Дозу бактериального заражения калибруют для достижения приблизительно 20%-ного выживания в контрольной группе на протяжении 10-14-суточного периода. Статистическую оценку исследований выживания можно проводить анализом Каплана-Мейера.
Модель инфекционного эндокардита (пассивная или активная)
Модель пассивной иммунизации для инфекционного эндокардита (ИЭ), вызванного S. aureus, использовали ранее для того, чтобы показать, что ClfA может индуцировать защитный иммунитет. Смотрите Vernachio et al., Antmicro. Agents & Chemo. 50:511-518 (2006). В данной модели ИЭ кроликов или крыс используют для имитации клинических инфекций, которые включают центральный венозный катетер, бактериемию и гематогенный посев в дистальные органы. Катетеризированным кроликам или крысам со стерильными разрастаниями клапана аорты вводят одну или много внутривенных инъекций моноклонального или поликлонального антитела, специфичного в отношении антигена-мишени. Затем животных i.v. заражают штаммом S. aureus или S. epidermidis. Затем после заражения сердце, сердечные разрастания и дополнительные ткани, включая почки и кровь, собирают и культивируют. Затем измеряют частоту стафилококковой инфекции в сердечной ткани, почках и крови. В одном исследовании при заражении животных либо MRSE АТСС 35984, либо MRSA 67-0 были показаны значительные снижения уровня инфекции при использовании либо препарата поликлональных антител, либо моноклональных антител к ClfA. Смотрите Vernachio et al., Antmicro. Agents & Chemo. 50:511-518 (2006).
Модель инфекционного эндокардита также адаптировали для исследований активной иммунизации как у кроликов, так и у крыс. Кроликов или крыс иммунизировали внутримышечно или подкожно антигеном-мишенью и заражали S. aureus через две недели посредством внутривенного пути.
Модель пиелонефрита
В модели пиелонефрита мышей иммунизируют в недели 0, 3 и 6 (или согласно другой схеме иммунизации с подходящими интервалами во времени) антигенами-мишенями. Затем животных заражают i.p.или i.v. S. aureus PFESA0266. Через 48 ч отбирают почки и подсчитывают бактериальные КОЕ (колониеобразующая единица).
Антитела и композиции антител
Согласно изобретению дополнительно предложены антитела и композиции антител, которые специфично и селективно связываются с одним или более чем одним антигеном иммуногенной композиции по настоящему изобретению. В некоторых воплощениях антитела вырабатываются при введении субъекту иммуногенной композиции по настоящему изобретению. В некоторых воплощениях согласно изобретению предложены очищенные или выделенные антитела, направленные против одного или более чем одного антигена иммуногенной композиции по настоящему изобретению. В некоторых воплощениях антитела по настоящему изобретению являются функциональными при измерении по умерщвлению бактерий либо в животной модели эффективности, либо посредством анализа опсонофагоцитарного умерщвления. В некоторых воплощениях антитела по изобретению придают субъекту пассивный иммунитет. Согласно настоящему изобретению дополнительно предложены молекулы полинуклеотидов, кодирующие антитело или фрагмент антитела по изобретению, и клетка или клеточная линия (таких как гибридомные клетки или другие сконструированные клеточные линии для рекомбинантной продукции антител), и трансгенное животное, которое продуцирует антитело или композицию антител по изобретению, с использованием методик, хорошо известных специалистам в данной области.
Антитела или композиции антител по изобретению можно использовать в способе лечения или предупреждения стафилококковой инфекции, заболевания или состояния, ассоциированного со Staphylococcus sp., у субъекта, включающем получение препарата поликлональных или моноклональных антител и применение указанного антитела или композиции антител для придания субъекту пассивного иммунитета. Антитела по изобретению также могут быть полезными для диагностических способов, например, определения присутствия или количественного измерения уровней одного или более чем одного антигена иммуногенных композиций по настоящему изобретению.
ПРИМЕРЫ
Следующие примеры демонстрируют некоторые воплощения настоящего изобретения. Однако следует понимать, что данные примеры предназначены лишь для иллюстрации и не предназначены для того, чтобы полностью определить условия и объем данного изобретения. Следует понимать, что когда приведены типичные условия реакции (например, температура, время реакции и т.д.) также могут использоваться условия как выше, так и ниже определенных интервалов, хотя обычно с меньшим удобством. Все части и проценты, упоминаемые здесь, приведены на основе массы, и все температуры выражены в градусах Цельсия, если не указано иное.
Кроме того, следующие примеры осуществляли с использованием стандартных методик, которые хорошо известны и обычны для специалистов в данной области, за исключением тех случаев, где подробно описано иное. Как отмечалось выше, следующие примеры представлены для иллюстративной цели и никоим образом не должны быть истолкованы как ограничивающие объем данного изобретения.
Пример 1: получение антигенов ClfA и ClfB
Факторы слипания А (ClfA) и В (ClfB) представляют собой поверхностные белки S. aureus, ответственные за связывание с белками хозяина, включающими фибриноген (ClfA, ClfB) и цитокератин 10 (ClfB). ClfA и ClfB являются членами семейства белков, содержащих карбоксиконцевой мотив LPXTG (SEQ ID NO:125), который делает возможным ковалентное связывание белка с поверхностью клетки. И ClfA, и ClfB принадлежат к семейству белков (адгезивная молекула матрикса, распознающая компоненты микробной поверхности или MSCRAMM), которые распознают и связываются с белками экстраклеточного матрикса хозяина, такими как фибриноген (ClfA и ClfB), фибронектин (FnbA и FnbB), коллаген (Cna) и другие. Все эти белки имеют аминоконцевую сигнальную последовательность, которая опосредует транспорт к поверхности клетки. MSCRAMM также включают домен А, который представляет собой функциональную область, содержащую лигандсвязывающий сайт для фибриногена, фибронектина, эластина и кератина. После А-домена может следовать область, состоящая из серин-аспартатных повторов (SD-повтор), которая, как считают, пересекает пептидогликановый слой. После SD повтора следует пересекающая мембрану область, которая включает мотив LPXTG (SEQ ID NO:125) для ковалентного связывания белка с пептидогликаном.
Лигандсвязывающие области ClfA и ClfB, содержащие N1N2N3 А-домена, охватывают аминокислоты 40-559. N-домены ClfA/ClfB были определены следующим образом: N1 охватывает остатки 45-220; N2 охватывает остатки 229-369; и N3 охватывает остатки 370-559. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). В препаратах рекомбинантного N1N2N3 ClfA обнаружили, что домен N1 является протеазочувствительным и легко расщепляется или гидролизуется, оставляя N23 в виде стабильного лигандсвязывающего рекомбинантного фрагмента. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Аналогично, было продемонстрировано, что домен N1 ClfB также является протеазочувствительным и может легко расщепляться металлопротеазой S. aureus (McAleese, F. M. et al. J. Biol. Chem. 2001, 276, pp.29969-29978). Кристаллическая структура фибриногенсвязывающего фрагмента N23 А-домена ClfA выявила то, что как в N2, так и в N3 доминируют антипараллельные бета-тяжи. Помимо антипараллельных бета-тяжей домен N2 содержит один виток альфа-спирали и две 310 спирали, и домен N3 содержит три 310 спирали. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002).
Выравнивание последовательности N2 и N3 выявляет лишь 13% идентичности последовательности и 36% сходства последовательности по их длине. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Топология доменов N2 и N3 является аналогичной классической укладке IgG, и было предложено, что она представляет собой новые варианты укладки IgG. Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002).
Рекомбинантные формы ClfA, используемые в описанных здесь иммуногенных композициях, представляют собой фрагменты ClfA, содержащие один или более чем один домен N, например, N1N2N3, N2N3, и именуются здесь как «рекомбинантный ClfA» или «rClfA». Кроме того, любой rClfA должен представлять собой rClfA, который сохраняет нативную структуру отдельных доменов N и критических эпитопов, но не вмешивается в нормальные процессы у иммунизированного индивидуума после введения (т.е. не связывает фибриноген). Мутационные исследования показали, что мутирование Y338A (N2) полностью устраняло связывание фрагмента N23 с фибриногеном. (Данное положение Y338A относится к замене тирозина на аланин в положении 338 в незрелой форме полипептидной последовательности со все еще присоединенной лидерной последовательностью. Эту замену можно видеть в положении 310 в зрелой форме мутированного полипептида ClfA с SEQ ID NO: 123, который демонстрирует отсутствие связывания с фибриногеном). Смотрите Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Следовательно, мутацию Y338A принимали для всех фрагментов ClfA в следующих исследованиях.
Аналогично, рекомбинантные формы ClfB, используемые в описанных здесь иммуногенных композициях, представляют собой фрагменты ClfB, содержащие один или более чем один домен N, например, N1N2N3, N2N3, и именуются здесь как «рекомбинантный ClfB» или «rClfB». Кроме того, любой rClfB должен представлять собой rClfB, который сохраняет нативную структуру отдельных доменов N и критических эпитопов, но не вмешивается в нормальные процессы у иммунизированного индивидуума после введения (т.е. не связывает фибриноген). (Смотрите, например, Walsh, E.J. et al. Microbiology (2008), 154, 550-558).
ClfA и ClfB: обзор стратегии клонирования
Разные формы белка rClfA, используемые для получения доклинических данных по эффективности, включают HisClfA(N123); T7ClfA(N123); T7ClfA(N123); Y338A; ClfA(N23) и ClfA(N23)Y338A. Смотрите Фиг.1. Ген ClfA содержит область А, кодирующую последовательность из PFESA0237 S. aureus, соответствующую остаткам 40-559. Рамку считывания, клонированную из S. aureus, сливали с N-концевой His-меткой (HisTag) и линкерными последовательностями вектора (MRGSHHHHHHGS SEQ ID NO:127), наряду с тремя дополнительными кодирующими последовательностями (KLN), введенными на С-конце. (Смотрите ниже относительно подробной методики). Белок, экспрессированный с данного вектора, использовали для всех экспериментов, где он называется HisClfA(N123).
Разные формы rClfA имели происхождение из области А (остатки 40-559 ClfA, экспрессируемые PFESA0237 S. aureus (верхний ряд). HisClfA(N123) экспрессируется с использованием промотора Т5, содержащегося в pQE30, и все другие формы экспрессируются с использованием системы экспрессии рЕТ на основе Т7.
Две формы ClfB (T7ClfB N1N2N3 и ClfB N23) использовали для доклинических исследований на животных.
Методика клонирования ClfA
Клонировали кодирующую последовательность ClfA, соответствующую аминокислотным остаткам 40-559 из штамма PFESA0237 S. aureus, и вводили мутацию Y338A для устранения связывания фибриногена. Мутированный ген ClfA вводили в Т7 РНК-полимеразный экспрессионный вектор, рЕТ9а (Novagen) с получением плазмиды, pLP1179. Последовательность ДНК области, содержащей промотор Т7, и кодирующей области в pLP1179 представляет собой SEQ ID NO:124. Экспрессионный вектор трансформировали в BLR(DE3) Е. coli (Novagen) для продукции рекомбинантного ClfA.
Конструирование T7ClfA(N123)Y338A включало несколько стадий. Обобщение стадий клонирования, использованных для конструирования конечной экспрессионной плазмиды, pLP1179, показано на Фиг.2.
Последовательность ДНК clfA, присутствующая в pQECIf40, соответствует аминокислотным остаткам 40-559 ClfA, которые были первоначально клонированы в сайт клонирования BamHI/HindIII pQE30. Это создает слияние с His-меткой на N-конце ClfA и добавление трех остатков на С-конце. Кодирующую область ClfA, присутствующую в (AmpR) pQECIf40, субклонировали в вектор KanR pET 27b (Novagen) для создания pLP1137. Кроме того, последовательность ДНК clfA, соответствующая аминокислотным остаткам 221-559, клонировали в сайт клонирования NdeI-HindIII pET27b для создания pLP1134. N-концевую His-метку ClfA заменяли N-концевым Т7 путем субклонирования фрагмента ДНК BamHI-BlpI из pQECIf40 в рЕТ9а (Novagen) для создания pLP1153. Кодирующая последовательность T7ClfA(N123), присутствующая в pLP1153, содержит 11 N-концевых аминокислотных остатков из Т7 метки рЕТ9а, с последующими тремя аминокислотными остатками из линкерных последовательностей плюс три C-концевых остатка, происходящих из линкера, первоначально присутствующих в pQE30Clf40. Мутацию Y338A впервые вводили в кодирующую последовательность ClfA(N23) pLP1134 с созданием pLP1168. Позднее фрагмент ДНК PstI-SnaBI, содержащий мутацию Y338A из ClfA(N23) pLP1168, был перемещен в кодирующую последовательность PstI-SnaBI T7ClfA(N123) pLP1153 с созданием pLP1171. Внутренний сайт связывания рибосомы, присутствующий в кодирующей последовательности T7ClfA(N123)Y338A pLP1171, изменяли молчащими мутациями в положениях 339 и 342 ДНК ORF (открытая рамка считывания) Т7 rClfA Y338A, заменяя G на Т и G на А, соответственно. Образующуюся плазмиду, pLP1176, затем использовали для удаления трех посторонних остатков, первоначально происходящих из pQE30Clf40, между Т7-меткой и началом кодирующей области ClfA. В это время также удаляли три C-концевых остатка, происходящих из линкера.
rClfA, экспрессируемый образующейся плазмидой, pLP1179 (Фиг.2 и 3), содержит только 11 N-концевых аминокислот, слитых с остатками 40-559 ClfA(N123)Y338A. Последовательность ДНК области, содержащей промотор Т7 и кодирующую последовательность Т7 rClfA(N123)Y338A pLP1179 представляет собой SEQ ID NO 124.
Бактериальные штаммы и плазмиды
Плазмидную основу рЕТ9а (полученную от Novagen) использовали для конструирования pLP1179, которая экспрессирует T7ClfA(N123)Y338A с промотора Т7. Данная плазмида содержит ген устойчивости к канамицину (KanR) для позитивной селекции. Исходно использовали штамм хозяина-Е. coli BL21(DE3) [F- ompT hsdSB (rB -mB -) gal dcm (DE3)] (Novagen) для получения экспрессии T7ClfA(N123)Y338A. Обозначение DE3 означает лямбда лизоген, содержащий ген РНК-полимеразы Т7 под контролем промотора lacUV5 (индуцируемого IPTG (изопропилтиогалактозид)), который используется для индуцированной экспрессии РНК-полимеразы Т7 и последующей транскрипции с промотора Т7, проксимального по отношению к кодирующей последовательности ClfA(N123)Y338A, присутствующей в pLP1179. При получении информации о том, что лизогенный штамм-хозяин BL21(DE3) способен индуцировать литический фаг при ферментациях в большом масштабе, штамм-хозяин заменяли на штамм-хозяин recA BLR(DE3) [F- ompT hsdSB (rB -mB -) gal dcm Δ(sri-recA)306::Tn10(TcR) (DE3)] (Novagen).
Продукция и очистка ClfA
Для продукции ClfA Е. coli BLR(DE3)/pLP1179 выращивали в определенной среде в биореакторах согласно периодическому способу с подпиткой глюкозой (glucode fed-batch mode). При достижении культурой оптической плотности (ОП600) от 30 до 50 экспрессию ClfA индуцировали добавлением IPTG. Культуру собирали через 3-16 часов после индукции.
Клетки разрушали и собирали осветленную растворимую фракцию. После добавления сульфата аммония материал наносили на колонку, содержащую фенил-сефарозную смолу, и элюировали. Фракции, содержащие ClfA, идентифицировали, диализировали и наносили на анионообменную колонку (Q-Sepharose). После элюции солевым градиентом фракции, содержащие ClfA, идентифицировали, концентрировали ультрафильтрацией и наносили на колонку для гель-фильтрации (Superdex-75). Фракции, содержащие ClfA, идентифицировали и объединяли. Чистота ClfA в этот момент составляла примерно 98% при измерении SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия).
Клонирование и очистка N1N2N3 ClfB
Кодирующую последовательность ClfB, соответствующую аминокислотным остаткам 44-542, клонировали в экспрессионный вектор РНК-полимеразы Т7, рЕТ28а (Novagen), с получением плазмиды рРХ1189. Экспрессионный вектор трансформировали в Е. coli BLR(DE3) (Novagen) для продукции рекомбинантного ClfB. (Смотрите Walsh, et al., Microbiology 154:550-558 (2008).)
Для продукции ClfB Е. coli BLR(DE3)/pLP1179 выращивали в определенной среде в биореакторах согласно периодическому способу с подпиткой глюкозой. При достижении культурой оптической плотности (ОП600) от 30 до 50 экспрессию ClfB индуцировали добавлением IPTG. Культуру собирали через 3-16 часов после индукции.
Клетки разрушали и собирали осветленную растворимую фракцию. рН растворимой фракции доводили до рН примерно 3,2 и удаляли выпавшие в осадок примеси. рН растворимой фракции, содержащей ClfB, подводили до рН примерно 8,0 и диализировали для удаления солей. После добавления сульфата аммония материал наносили на колонку, содержащую фенил-сефарозную смолу, и элюировали. Фракции, содержащие ClfB, идентифицировали, диализировали и наносили на анионообменную колонку (Q-Sepharose). После элюции солевым градиентом фракции, содержащие ClfB, идентифицировали, концентрировали ультрафильтрацией и наносили на колонку для гель-фильтрации (Superdex-75). Фракции, содержащие ClfB, идентифицировали и объединяли. Чистота ClfB в этот момент составляла примерно 94% при измерении SDS-PAGE.
Пример 2: продукция антигенов: MntC Staph aureus
Клонирование липидированного MntC S. aureus
Рекомбинантный MntC первоначально клонировали из штамма Mu50 S. aureus. Кодирующую последовательность rMntC амплифицировали ПЦР (полимеразная цепная реакция) из геномной ДНК Mu50 S. aureus. Для амплификации использовали две пары гнездовых (nested) праймеров (Таблица 2). Первая пара праймеров, 5'SA926-MntC ups и 3'SA926-MntC down, выравниваются с последовательностью выше и ниже относительно открытой рамки считывания rMntC. Второй набор праймеров выравнивается с кодирующей последовательностью rMntC, позволяя амплифицировать последовательность, соответствующую аминокислотным остаткам 19-309. Сайты рестрикционных ферментов включали на 5'-концах данных праймеров для облегчения направленного клонирования. ПЦР проводили в Peltier Thermal Cycler (MJ Research Inc, Walthan, MA) с TaKaRa PrimeSTAR HS DNA Polymerase Premix (Takara Bio USA, Madison, WI). ПЦР-продукт очищали QIAEX II (Qiagen, Valencia, CA), расщепляли подходящими эндонуклеазами рестрикции (New England BioLabs, Ipswich, MA) и субклонировали в экспрессионный вектор pBAD18Cm, управляемый промотором araBAD. Данный вектор также содержит сигнальный пептид липопротеина Р4 из Н. influenza. ПЦР-продукт MntC субклонировали в рамку считывания ниже от сигнального пептида Р4 с созданием pLP1194. Последовательность ДНК кодирующей области MntC pLP1194 показана в SEQ ID NO:120. MntC, экспрессируемый из pLP1194, представляет собой липопротеин. Рекомбинантную плазмидную ДНК секвенировали ABI PRISM BigDye™ Terminator V.3.1 (Applied Biosystems, Foster City, CA) и рекомбинантный белок экспрессировали в Е. coli BLR (NOVAGEN) для продукции липидированного rMntC.
Продукция и очистка липидированного MntC
Для продукции липидированного MntC Е. coli BLR/pLP1194 выращивали в определенной среде в биореакторах согласно периодическому способу с подпиткой глюкозой. При достижении культурой оптической плотности (ОП600) примерно 60 экспрессию rMntC индуцировали переключением подпитки на смесь глюкозы и арабинозы. Культуру собирали примерно через 24 часа после индукции.
Клетки разрушали и собирали нерастворимую фракцию. Липидированный MntC обнаружили ассоциированным с клеточными мембранами из-за модификации липидов. MntC экстрагировали из мембранной фракции детергентом (Zwittergent ZW-312). После удаления нерастворимых обломков, липидированный MntC обнаружили в растворимой фракции. Растворимую фракцию наносили на колонку, содержащую смолу со смешанным принципом действия, и элюировали линейным градиентом соли и рН. Фракции, содержащие MntC, идентифицировали и объединяли. К объединенной фракции добавляли сульфат аммония, вещество наносили на колонку, содержащую бутилсефарозу, и элюировали. Фракции, содержащие MntC, идентифицировали, обессоливали и загружали на катионообменную колонку (SP-Sepharose). После элюции солевым градиентом фракции, содержащие MntC, идентифицировали и объединяли.
Клонирование нелипидированного MntC S. aureus
Последовательность ДНК, используемую для экспрессии нелипидированного rMntC, выделяли ПЦР-амплификацией из плазмиды pLP1194. Образующаяся последовательность соответствует аминокислотным остаткам 19-309 и не содержит сигнальную последовательность, которая управляет секрецией и липидированием. Последовательность ДНК кодирующей области rMntC pLP1215 находится в ДНК SEQ ID NO:120.
Для создания pLP1215 MntC амплифицировали ПЦР из pLP1194. Последовательность ДНК MntC, присутствующая в pLP1215, соответствует аминокислотным остаткам 19-309, и первый кодон для данной конструкции был введен в прямой праймер, используемый в амплификации гена. Праймеры, используемые для ПЦР, также содержат сайты рестрикционных ферментов на 5'-концах для облегчения направленного клонирования (Таблица 2). ПЦР и очистку амплифицированного гена проводили, как описано выше. Очищенный ПЦР-продукт расщепляли подходящими эндонуклеазами рестрикции (New England BioLabs, Ipswich, MA) и субклонировали в экспрессионный вектор рЕТ28а, управляемый промотором Т7 (Novagen, Madison, WI). ДНК рекомбинантной плазмиды pLP1215 секвенировали ABI PRISM BigDye™ Terminator V.3.1 (Applied Biosystems, Foster City, CA) и рекомбинантный белок экспрессировали в Е. coli BLR(DE3). Плазмидную ДНК для pLP1215 очищали и использовали для трансформации Е. coli HMS174(DE3) для оценки экспрессии белка.
|
Для генерирования конструкций rMntC использовали синтетические олигонуклеотиды. Сайты эндонуклеаз рестрикции подчеркнуты. Нуклеотиды, выделенные полужирным шрифтом, показывают первый кодон для конструкции нелипидированного rMntC.
Продукция и очистка нелипидированного rMntC
Для продукции нелипидированного rMntC Е. coli HMS174(DE3)/pLP1215 выращивали в определенной среде в биореакторах согласно периодическому способу с подпиткой глюкозой. При достижении культурой оптической плотности (ОП600) примерно от 60 до 80 экспрессию rMntC индуцировали добавлением IPTG. Культуру собирали примерно через 24 часа после индукции. Клетки разрушали и собирали осветленную растворимую фракцию. Лизат наносили на колонку, содержащую катионообменную смолу (SP-Sepharose) и элюировали линейным солевым градиентом. Идентифицировали фракции, содержащие MntC. После добавления сульфата аммония материал наносили на колонку, содержащую фенил-сефарозную смолу, и элюировали. После элюции фракции, содержащие rMntC, идентифицировали, объединяли и обессоливали. Чистота rMntC в этот момент составляла >95% при измерении SDS-PAGE.
Пример 3: продукция капсульных полисахаридов СР5 и СР8
В данном примере описано получение капсульных полисахаридов типа 5 и 8 S. aureus разных размеров. Структуры полисахаридов СР5 и СР8 показаны на Фиг.4. Описанные здесь способы являются эффективными при продукции СР5 и СР8 с молекулярными массами, варьирующими от примерно 50 кДа до 800 кДа. На основе ростовых характеристик и количества продуцированной капсулы был выбран штамм PFESA0266 для продукции СР5, тогда как штаммы PFESA0005 или PFESA0286 были использованы для продукции СР8. Было показано, что капсулы, выделенные из штаммов PFESA0005 и PFESA0286, являются идентичными.
Для продукции капсульных полисахаридов штаммы выращивали в комплексной среде, состоящей, прежде всего, из источника углерода (либо лактозы, либо сахарозы), гидролизованной соевой муки в качестве источника азота и следовых количеств металлов. Штаммы выращивали в биореакторах в течение 2-5 суток.
Очистку СР5 и СР8, используемых для получения конъюгатов, проводили двумя разными способами, которые основаны на повышенной температуре и низком рН для осуществления высвобождения капсулы от клетки и снижения молекулярной массы полисахарида. Полученная молекулярная масса зависит от времени, температуры и рН стадии гидролиза.
Определение характеристик СР5 и СР8 проводили с использованием методик, определенных в Таблице 3. Капсульные полисахариды, полученные этой методикой, представляют собой чистые полисахариды с низкими уровнями примесей белка, NA (нуклеиновых кислот), пептидогликана и ТА (тейхоевой кислоты). Смотрите Таблицы 4 и 5.
|
В первом способе после высвобождения капсулы от клетки и уменьшения молекулярной массы, препарат капсулы обрабатывают смесью ферментов (рибонуклеазы, дезоксирибонуклеазы, лизоцима и протеазы) для расщепления примесей. После инкубации остаточные примеси осаждают добавлением этанола (конечная концентрация примерно 25%). После удаления остаточного этанола, раствор, содержащий капсулу, загружали на анионообменную колонку (Q-Sepharose) и элюировали линейным солевым градиентом. Фракции, содержащие капсулы, объединяли и обрабатывали мета-перйодатом натрия. Эта обработка приводила к окислительному гидролизу остаточных примесей тейхоевой кислоты, но не влияла на СР5 или СР8. Реакцию гасили добавлением этиленгликоля. Вещество концентрировали и подвергали диафильтрации против дистиллированной H2O для удаления любых остаточных реактивов и побочных продуктов.
Второй способ, использованный для получения капсул, не включал применения ферментов для расщепления разных примесей, происходящих из клеток. В данном способе, после высвобождения капсулы от клетки и уменьшения молекулярной массы, гидролизованный ферментационный бульон осветляли микрофильтрацией с последующей ультрафильтрацией и диафильтрацией. Для удаления примесей раствор обрабатывали активированным углем. После обработки углем, вещество обрабатывали мета-перйодатом натрия для окисления остаточной тейхоевой кислоты с последующим гашением пропиленгликолем. Вещество концентрировали и подвергали диафильтрации против дистиллированной H2O для удаления любых остаточных реактивов и побочных продуктов.
Капсулы, полученные с использованием любого из двух способов, дают чистые полисахариды с низкими уровнями примесей белков, нуклеиновых кислот и тейхоевой кислоты. Описанные способы можно использовать для получения полисахаридов с конкретным желательным интервалом высоких молекулярных масс просто путем варьирования условий гидролиза. Имеющий особые преимущества диапазон полисахаридов с высокой молекулярной массой, варьирующей от 70 до 150 кДа, является полезным при получении иммуногенных композиций путем конъюгирования полисахарида с белком-носителем.
Примеры капсульных полисахаридов с высокой молекулярной массой, которые можно получать описанными здесь способами, показаны в Таблице 4 ниже. Партии очищенного СР5 с более высокой MW (молекулярная масса) также имели высокую чистоту, на что указывает отсутствие ТА (тейхоевой кислоты), пептидогликана и низкий уровень остаточного белка. Смотрите Таблицу 4. Интервал молекулярных масс в данных примерах охватывал от 132,7 кДа до 800 кДа, и очищенные полисахариды были сильно O-ацетилированными - в интервале 90-100%, и 100% - в отношении N-ацетилирования. Смотрите Таблицу 4.
Примеры капсульного полисахарида меньшей молекулярной массы, который можно получить описанными здесь способами, показаны в Таблице 5 ниже. Партии очищенного СР8 меньшей MW имели высокую чистоту, на что указывает отсутствие тейхоевой кислоты (ТА), пептидогликана и низкий уровень остаточного белка. Смотрите Таблицу 5. Интервал меньших молекулярных масс охватывал от 20,4 кДа до 65,1 кДа, и очищенные полисахариды были сильно O-ацетилированными - в интервале 75-96%. Уровни загрязнения нуклеиновыми кислотами были низкими, варьируя от 0,5% до 2,45%. Смотрите Таблицу 5.
|
|
Выбор молекулярной массы капсульных полисахаридов
Этот кинетический анализ демонстрирует то, что посредством описанных здесь способов можно генерировать широкий интервал молекулярных масс капсульных полисахаридов. Исходно бактериальные клетки продуцировали более крупные полисахариды, и впоследствии можно выбрать желательный интервал молекулярной массы и затем произвести очистку, манипулируя рН и условиями нагревания на стадиях нагревания и гидролиза.
Тепловая обработка ферментационного бульона S. aureus была стадией способа между ферментацией и выделением СР. На данной стадии способа используют нагревание для обработки бульона с откорректированным рН в течение определенного периода времени. Целью тепловой обработки при низком рН было умерщвление клеток, инактивация энтеротоксинов, высвобождение связанного с клеткой полисахарида и снижение молекулярной массы до желательного размера. Среди данных целей уменьшение молекулярной массы было самым медленным в показателях длительности обработки, требуемой на этой стадии. Следовательно, другие цели неизбежно были достигнуты в пределах рассматриваемого времени обработки.
Тепловая обработка
Были определены условия температуры и рН для выбора разных интервалов молекулярной массы капсульных полисахаридов. рН бульона корректировали концентрированной серной кислотой. Затем температуру бульона повышали до заданного значения. Время тепловой обработки начиналось, как только температура достигала заданной точки. Когда достигалось желаемое время обработки, бульон охлаждали до комнатной температуры. Образцы, находящиеся в процессе обработки, отбирали для определения концентрации и молекулярной массы полисахаридов посредством систем HPLC (высокоэффективная жидкостная хроматография) и SEC-MALLS, соответственно. Данные по MW использовали в кинетическом анализе. Профили MW определяли в течение периода времени при рН 4,0; 4,5 и 5,0 для СР5 и при рН 3,5; 4,0 и 5,0 для СР8. Смотрите Фиг.5А и 5Б.
Кинетику мягкого кислотного гидролиза полисахаридов определяли с использованием очищенных СР-5 и СР-8, полученных в данном способе. Раствор очищенного полисахарида доводили до желаемого для эксперимента рН серной кислотой. Образцы помещали в масляную баню, оснащенную системой точного контроля температуры. Каждый образец отбирали с заданным интервалом времени и гасили (реакцию) в емкости со льдом. В конце эксперимента в образец добавляли аликвоту 1 М Tris буфера (рН 7,5) и доводили рН обратно до значения примерно 7. Образцы анализировали системой SEC-MALLS. Данные по MW использовали в кинетическом анализе. Определяли влияние температуры на профили MW CP5 при рН 4,5 и СР8 при рН 3,5 в течение периода времени. Смотрите Фиг.6А и 6Б. Эту методику кислотного гидролиза можно осуществлять с использованием культуры в ферментере или на промежуточной стадии очистки, или, как здесь показано, используя очищенный полисахарид. Аналогичным образом, можно осуществлять другие этапы уменьшения молекулярной массы, такие как обработка ультразвуком или срезывающее усилие.
Результаты
Эффект рН на уменьшение MW при тепловой обработке показан на Фиг.5А и 5Б для СР-5 и СР-8, соответственно. Можно видеть, что меньший рН был более эффективным в снижении размера полисахарида. Данные также свидетельствуют о том, что СР-5 было сложнее гидролизовать, чем СР-8 при том же самом рН. Рассматривая профили СР8, интервалы молекулярных масс от 300 кДа до 600 кДа можно генерировать с использованием рН 5 при 95°С в течение периода времени от 15 минут до 120 минут. Подобным образом, выбор рН 4 при 95°С в течение периода времени от 15 минут до 120 минут может давать интервалы молекулярной массы полисахарида СР8 от 250 кДа до 450 кДа. Кроме того, выбор рН 3,5 при 95°С в течение периода времени от 15 минут до 120 минут может давать интервалы молекулярной массы полисахарида СР8 от 120 кДа до 450 кДа.
Влияние температуры на снижение MW исследовали с использованием очищенных полисахаридов, выделенных в результате процесса выделения. Результаты показаны на Фиг.6А и 6Б. Как показано, чем выше температура, тем быстрее скорость гидролиза и тем шире интервал молекулярных масс полисахаридов, образующихся со временем. Применение более низкой температуры, 55°С по сравнению с 95°С, при том же самом рН дает более узкий интервал молекулярных масс полисахаридов.
Кроме того, на Фиг.7 продемонстрирована корреляция между молекулярной массой очищенного CP5 и СР8 и временем обработки для мягкого кислотного гидролиза. Очищенный полисахарид представляет собой конечный продукт, полученный в результате процесса выделения, подробно описанного ранее. Как показано на Фиг.7, увеличение времени тепловой обработки штамма PFESA0266 S. aureus при рН 4,5 приводит к генерированию полисахаридов СР5 меньшей молекулярной массы, тогда как более короткое время тепловой обработки при рН 4,5 приводит к генерированию полисахаридов СР5 с большей молекулярной массой. Размер полисахаридов СР5 варьировал от примерно 90 кДа до примерно 220 кДа, в зависимости от продолжительности времени тепловой обработки при низком рН (4,5). Подобным образом, увеличение времени тепловой обработки штамма PFESA0005 S. aureus при рН 3,5 приводит к генерированию полисахаридов СР8 меньшей молекулярной массы, тогда как более короткое время тепловой обработки при рН 3,5 приводит к генерированию полисахаридов СР8 с большей молекулярной массой. Размер полисахаридов СР8 варьировал от примерно 80 кДа до примерно 220 кДа, в зависимости от продолжительности времени тепловой обработки при низком рН (3,5). Корреляция между временем тепловой обработки при низком рН и размером очищенных полисахаридов СР5 и СР8, как показано в данном исследовании, обеспечивает оценку времени обработки, требующегося для получения очищенного полисахарида с определенным интервалом молекулярной массы.
Важно отметить то, что, как продемонстрировано выше, может быть получен, высвобожден и очищен полный интервал молекулярных масс капсульных полисахаридов как для СР5, так и для СР8 от 20 кДа до более чем 800 кДа. Описанные способы можно использовать для получения конкретных интервалов желаемых капсульных полисахаридов с высокой молекулярной массой. На основе данных способов может быть получен особенно полезный интервал капсульных полисахаридов типа 5 и типа 8 с высокой молекулярной массой, имеющих молекулярные массы, варьирующие от 70 до 150 кДа. Смотрите Таблицу 6. Этот интервал молекулярных масс капсульного полисахарида является полезным при получении иммуногенных композиций путем конъюгирования полисахарида с белком-носителем. В качестве альтернативы, этот полезный интервал капсульных полисахаридов СР5 и СР8 с высокой молекулярной массой варьирует от 80 до 140 кДа. Смотрите Таблицу 6. Другой полезный диапазон капсульных полисахаридов СР5 и СР8 с высокой молекулярной массой составляет от 90 до 130 кДа или от 90 до 120 кДа для СР5 и СР8. Смотрите Таблицу 6. Условия, используемые для генерирования капсульного полисахарида СР5, имеющего интервал молекулярной массы от примерно 100 до 140 кДа, являются следующими: 95°С, рН 4,5 в течение 135 минут. Условия, используемые для генерирования капсульного полисахарида СР8, имеющего интервал молекулярной массы от примерно 80 до 120 кДа, являются следующими: 95°С, рН 3,5 в течение 300 минут.
|
Пример 4: конъюгирование капсульных полисахаридов СР5 и СР8 с CRM197
В данном примере описаны способы и характеризующие анализы, используемые в получении конъюгатов S. aureus CP5-CRM197 и S. aureus CP8-CRM197. Было оценено несколько химических способов конъюгирования для конъюгирования капсульных полисахаридов СР5 и СР8 S. aureus с белком-носителем. Конъюгирование с использованием PDPH (3-2-пиридилдитио)-пропионилгидразид) приводит к образованию ковалентной тиоэфирной связи, и CDI/CDT (1,1-карбоилдиимидазол/1,1-карбоил-ди-1,2,4-триазол) приводит к образованию одноуглеродного или безуглеродного линкера между СР и белком-носителем.
Конъюгирование СР с CRM197 посредством конъюгационной химии с PDPH
Конъюгационная химия PDPH представляет собой многоступенчатый способ, который включает активацию полисахарида, удаление тиольной защитной группы, очистку активированного полисахаридного промежуточного соединения, активацию и очистку белка CRM197 и конъюгирование активированных компонентов с последующей очисткой. После введения линкера, содержащего тиольную группу, в полисахарид и галогенацетильной группы в белок-носитель CRM197, полисахариды СР5 и СР8 S. aureus были связаны с белком-носителем через тиоэфирную связь. В белок CRM197 вводили бромацетильные группы реакцией аминных групп с N-гидроксисукцинимидным эфиром бромуксусной кислоты. Для генерирования тиолированного СР, карбоксилатные группы N-ацетилманнозаминоуроновой кислоты в СР, активированные карбодиимидом, подвергали сочетанию с гидразидной группой реагирующего с сульфгидрилом гидразидного гетеробифункционального линкера 3-(2-пиридилдитио)пропионилгидразида (PDPH). Тиолы PDPH-тиолированного СР, генерированного восстановлением с DTT (дитиотрейтол) и очищенного SEC на колонке Sephadex G25, подвергали реакции с бромацетильными группами активированного белка, что приводило к ковалентной тиоэфирной связи, образованной замещением брома между СР и белком. Непрореагировавшие бромацетильные группы «покрывали» гидрохлоридом цистеамина (гидрохлорид 2-аминоэтантиола). Реакционную смесь затем концентрировали и подвергали диафильтрации. Оставшиеся неконъюгированные бромацетильные группы покрывали гидрохлоридом цистеамина для обеспечения того, чтобы после конъюгирования не оставалось реакционноспособных бромацетильных групп. Это формировало ковалентную связь между тиольным концом цистеамина и ацетильной группой на остатке лизина после замещения брома.
Тиолирование капсульного полисахарида S. aureus PDPH
Полисахарид сначала активировали тиолированием с PDPH. Полисахарид смешивали со свежеприготовленным маточным раствором PDPH (250 мг/мл в DMSO (диметилсульфоксид)), маточным раствором EDAC (90 мг/мл в дистиллированной Н20) и маточным раствором MES (морфолиноэтансульфоновая кислота) буфера (0,5 М, рН 4,85) с получением конечного раствора 0,1 М MES и 2 и 4 мг СР/мл, поддерживая соотношение по массе CP:PDPH:EDAC 1:5:3 для СР5 и 1:0,6:1,25 для СР8. Данную смесь инкубировали в течение 1 часа при комнатной температуре и затем диализировали против 1000-кратного объема дистиллированной Н2О четыре раза с использованием устройства для диализа 3500 MWCO (номинальное отсечение по молекулярной массе 3500 Да) при 4-8°С для удаления непрореагировавшего PDPH. PDPH-связанный полисахарид обрабатывали 0,2 М DTT и инкубировали при комнатной температуре в течение 3 часов или в течение ночи при 4-8°С. Избыток DTT, а также побочные продукты реакции отделяли от активированного сахарида SEC с использованием смолы Sephadex G25 и дистиллированной воды в качестве подвижной фазы. Фракции анализировали посредством анализа с DTDP (дитиопиридин) на тиольные группы, и тиолпозитивные фракции, которые элюировались близко к "свободному объему" колонки, объединяли. Объединенные фракции анализировали РАНВАН (гидразид пара-гидроксибензойной кислоты) и анализами на O-ацетил для определения степени активации, которая выражается как молярный процент повторяющихся единиц, содержащих тиольную группу (молярная концентрация тиолов/молярная концентрация повторяющихся единиц). Активированный полисахарид лиофилизировали и хранили при -25°С, пока он не требовался для конъюгирования.
Активация белка-носителя
Отдельно белок-носитель активировали бромацетилированием. CRM197 разводили до 5 мг/мл 0,9%-ным NaCl, забуференным 10 мМ фосфатом, рН 7 (PBS (фосфатно-солевой буферный раствор)), и затем добавляли NaHCO3, рН 7, до концентрации 0,1 М, используя 1 М маточный раствор. Добавляли N-гидроксисукцинимидный эфир бромуксусной кислоты (BAANS) при соотношении CRM197:BAANS 1:0,25 (масс.:масс.), используя маточный раствор BAANS 20 мг/мл в DMSO. Данную реакционную смесь инкубировали при 4-8°С в течение 1 часа, затем очищали с использованием SEC на Sephadex G-25. Очищенный активированный CRM197 анализировали анализом по Лоури для определения концентрации белка и затем разбавляли PBS до 5 мг/мл. В качестве криопротектора добавляли сахарозу до 5% (масс./об.) и активированный белок замораживали и хранили при -25°С, пока он не требовался для конъюгирования.
Реакция сочетания
Как только были получены активированный капсульный полисахарид и активированный белок-носитель, их объединяли в реакционной смеси для конъюгирования. Лиофилизированный и тиолированный полисахарид растворяли в 0,16 М борате, рН 8,95, смешивали с размороженным бромацетилированным CRM197 и дистиллированной водой с получением конечного 0,1 М боратного раствора, с соотношением 1:1 масс./масс. CRM197:CP, и 1 мг/мл полисахарида для СР8 и 2 мг/мл полисахарида для СР5. Данную смесь инкубировали при комнатной температуре в течение 16-24 часов. Непрореагировавшие бромацетильные группы на белке покрывали добавлением гидрохлорида цистеамина при соотношении CRM197:цистеамин 1:2 (масс./масс.), используя маточный раствор цистеамина 135 мг/мл, растворенного в 0,1 М борате, рН 8,95, и инкубировали в течение 4 часов при комнатной температуре. Конъюгат капсульный полисахарид-CRM197 (конъюгат) очищали проведением 50-кратной диафильтрации против 0,9%-ного NaCl, используя 100К полиэфирсульфоновый ультрафильтр.
Результаты из исследований воспроизводимости тиолирования СР5 и СР8 с PDPH продемонстрировали то, что степень активации СР5 находилась в интервале от 11 до 19%, что соответствует приблизительно от одной молекулы линкера, присоединенной на десять повторяющихся единиц СР, до одной молекулы линкера на пять повторяющихся единиц. Активация СР8 находилась в интервале от 12 до 16%, что было очень сходным с активацией СР5.
Бромацетилирование лизиновых остатков CRM197 было весьма согласующимся, приводящим к активации 19-25 лизинов из доступных 39 лизинов. Реакция давала высокие выходы активированного белка.
Конъюгирование СР с CRM197 конъюгационной химией CDI/CDT
CDI и CDT обеспечивают одностадийный способ конъюгирования, когда полисахарид активируется в безводной среде (DMSO) с образованием имидазольных или триазольных карбаматных группировок с доступными гидроксилами и ацилимидазольных или ацилтриазольных группировок с карбоновыми кислотами. Добавление белкового носителя (в DMSO) приводит к нуклеофильному замещению имидазола или триазола лизином и образованию карбаматной связи (для активированных гидроксилов) и амидной связи (для активированных карбоновых кислот). Реакционный раствор разводят в 10 раз в водном растворе для удаления непрореагировавших активированных групп и затем очищают диафильтрованием.
Оба химических способа конъюгирования давали СР, ковалентно связанный с белком-носителем, на что указывало присутствие сахарида и белка во фракциях от гель-фильтрации и аминокислотный анализ конъюгата, "покрытого" гликольальдегидом или гидрохлоридом цистеамина.
Обобщение результатов из получения нескольких партий конъюгатов, полученных как химическим способом с PDPH, так и с CDI/CDT, для обоих капсульных серотипов с размерами полисахаридов в интервале от 20 до 40 кДа, показано в Таблице 7 ниже. Отсутствовали значимые различия в свободных капсульных полисахаридах, отношении СР:белок и выходах конъюгатов, генерированных этими двумя способами конъюгирования. Антигенность конъюгированного СР не была изменена конъюгированием, что отображается идентичностью линий преципитации между конъюгатами и нативным СР.
|
Как показано выше, описанные здесь способы можно использовать для получения конкретных интервалов желаемых капсульных полисахаридов с высокой молекулярной массой. Целью данного исследования было получение конъюгатов из предварительно выбранного интервала высоких молекулярных масс, которые могли бы быть отфильтрованными и очищенными СР для применения в иммуногенных композициях. В данном примере были выбраны восемь партий, где капсульный полисахарид СР5 варьировал по молекулярной массе от примерно 90 кДа до примерно 120 кДа, и было проведено конъюгирование с использованием активации с триазолом (CDT). Смотрите Таблицу 8. Молекулярные массы образующихся конъюгатов варьировали от 1533 кДа до 2656 кДа. Число конъюгированных лизинов на CRM197 варьировало от высокого - 22 до низкого - 15. Уровень свободного капсульного полисахарида варьировал от высокого - 18% до низкого - 11%. Смотрите Таблицу 8.
|
В Таблице 9 обобщен анализ конъюгатов СР8, где капсульный полисахарид СР8 варьировал по молекулярной массе от примерно 87 кДа до 113 кДа, и использовали имидазольную конъюгационную химию. Молекулярные массы образующихся конъюгатов варьировали от 595 кДа до 943 кДа. Число конъюгированных лизинов на CRM197 варьировало от высокого - 9 до низкого -3. Уровень свободного капсульного полисахарида варьировал от высокого - 6% до низкого - 2%. Смотрите Таблицу 9.
|
Оба химических способа конъюгирования давали СР, ковалентно связанный с белком-носителем. Не было значимых различий по свободному капсульному полисахариду, отношению СР:белок и выходу конъюгатов, генерированных этими двумя способами.
Пример 5: разнообразие последовательности полипептидных фрагментов N1, N2 и N3 ClfA
В данном примере оценивали гетерогенность белковой последовательности полипептидных фрагментов N1, N2 и N3 ClfA из изолятов, вызывающих заболевания, полученных из разных источников. Гены ClfA секвенировали из штаммов S. aureus, ассоциированных с многими болезненными состояниями. Информация о последовательностях из дополнительных штаммов была получена из GenBank для генерирования последовательностей из релевантных штаммов. В Таблице 10 перечислены разные последовательности ClfA.
Выравнивание последовательностей белков ClfA из разных штаммов S. aureus, вызывающих заболевание, показано на Фиг.8А-8Д. Белковые последовательности выравнивали с использованием MUSCLE. Смотрите Edgar, R.C. Nucleic Acids Research 32 (5):1792-1797 (2004). Выравнивания показывали с использованием SHOWALIGN. Смотрите Rice, P. et al., "EMBOSS: The European Molecular Biology Open Software Suite" Trends in Genetics, 16(6):276-277 (2000). Многие из последовательностей повторялись много раз без вариации. Для ясности каждую уникальную последовательность помещали в выравнивание только один раз. Смотрите Фиг.8А-8Д. Только уникальные последовательности были включены в перечень последовательностей (перечень последовательностей представлен в графической части). Например, белковая последовательность ClfA_001 была получена из многих разных штаммов без какой-либо вариации. Смотрите Фиг.8А-8Д. Номер в перечне последовательностей для любой последовательности также может быть получен из Таблицы 10: штаммы ClfA и перечни последовательностей. В Таблице 10 перечислен один типичный штамм, который содержал эту такую же белковую последовательность ClfA_001. Данная последовательность показана в первой строке выравнивания на Фиг.8А-8Д. Это выравнивание уникальных последовательностей антигена ClfA указывает на то, что полиморфизмы были распределены по всей области A (N1-N2-N3) ClfA. В некоторых случаях для любой данной уникальной белковой последовательности ClfA была открыта более чем одна нуклеотидная последовательность, кодирующая такой же белок. Только наиболее часто встречающиеся последовательности ДНК были включены в перечень последовательностей и в Таблицу 10. Для ClfA следующие последовательности раскрыты здесь и не обнаружены в GenBank: ClfA_003, ClfA_005, ClfA_008, ClfA_009, ClfA_013, ClfA_014, ClfA_015, ClfA_016, ClfA_017, ClfA_018, ClfA_019, ClfA_020, ClfA_021, ClfA_022, ClfA_023 и ClfA_024.
|
|
Исследовали филогению белковых последовательностей ClfA и строили филогенетическое древо. Последовательности выравнивали с использованием ClustalW. Смотрите Chenna R, Sugawara H, Koike Т, et al. Nucleic Acids Research. 31(13):3497-3500 (2003). Соединяющиеся по соседству ветви древа (neighbor-joining trees) загружали 1000 раз и демонстрировали посредством MEGA 4.0. Смотрите Tamura K, et al., Molecular Biology & Evolution. 24(8):1596-1599 (2007). Значения начальной загрузки (bootstrap values), указанные на ветвях, представляют собой число раз, когда ветвь воспроизводилась в 1000 испытаний. Значения меньше, чем 500 (50%-ная воспроизводимость) рассматриваются как слабо подтвержденные.
Последовательности ClfA образуют древо с 2 главными ветвями. Смотрите Фиг.9. Разделение этих двух групп очень хорошо подтверждается в филогении. Одна ветвь (верхняя) включает 9 последовательностей, которые являются довольно близкородственными друг другу (96-99%-ная идентичность), но имеют более отдаленное родство с последовательностью-кандидатом clfA_011, с которой они идентичны на 91-92%. Вторая группа, которая включает clfA_011, является более разнообразной, и филогения в данной группе также не подтверждается. Эти белковые последовательности являются на 93-99% идентичными друг другу.
Пример 6: разнообразие последовательностей полипептидных фрагментов N1, N2 и N3 ClfB
В данном примере оценивали гетерогенность белковых последовательностей полипептидных фрагментов N1, N2 и N3 ClfB из 92 изолятов, вызывающих заболевания, полученных из разных источников. Гены ClfB секвенировали из штаммов S. aureus, ассоциированных со многими болезненными состояниями. Смотрите Таблицу 11. Информацию от дополнительных штаммов получали из GenBank для генерирования дополнительных последовательностей.
Выравнивание последовательностей белков ClfB из разных штаммов S. aureus, вызывающих заболевание, показано на Фиг.10А-10Д. Белковые последовательности выравнивали с использованием MUSCLE. Смотрите Edgar, R.C. Nucleic Acids Research 32(5):1792-1797 (2004). Выравнивания представляли с использованием SHOWALIGN. Смотрите Rice, P. et al., "EMBOSS: The European Molecular Biology Open Software Suite" Trends in Genetics, 16(6):276-277 (2000). Смотрите выравнивание ClfB на Фиг.10А-10Д. Как и в случае с ClfA, многие из последовательностей повторялись много раз без вариации. Для ясности каждую уникальную последовательность помещали в выравнивание только один раз. Смотрите Фиг.10А-10Д. Только уникальные последовательности ClfB были включены в перечень последовательностей. Например, последовательность ClfB_006 была получена из многих разных штаммов без какой-либо вариации. Данная последовательность показана на первой строке выравнивания на Фиг.10А-10Д. Номер в перечне последовательностей для любой последовательности также может быть взят из Таблицы 11. Это выравнивание репрезентативных уникальных последовательностей антигена ClfB указывает на то, что полиморфизмы были распределены по всей области A (N1-N2-N3) ClfB. Аналогично ClfA, для любой данной уникальной белковой последовательности ClfB была открыта более чем одна нуклеотидная последовательность, кодирующая тот же самый белок. Только наиболее часто встречающиеся последовательности ДНК были включены в перечень последовательностей и в Таблицу 11. Для ClfB следующие последовательности раскрыты здесь и не обнаружены в GenBank: ClfB_001, ClfB_004, ClfB_005, ClfB_010, ClfB_011, ClfB_013, ClfB_014, ClfB_015, ClfB_016, ClfB_017, ClfB_018, ClfB_019, ClfB_020, ClfB_021, ClfB_022, ClfB_023 и ClfB_024. Филогенетическое древо показано на Фиг.11.
|
|
Пример 7: разнообразие последовательностей MntC в клонах S. aureus, вызывающих заболевания
В данном примере оценивали гетерогенность белковой последовательности генов MntC из 104 изолятов, вызывающих заболевания, полученных из разных источников. Гены MntC секвенировали из штаммов S. aureus, ассоциированных со многими болезненными состояниями. Смотрите Таблицу 12. Информацию от дополнительных штаммов получали из GenBank для генерирования последовательностей штаммов.
Выравнивание последовательностей белков MntC из разных штаммов S. aureus, вызывающих заболевание, показано на Фиг.12А-12Б. Белковые последовательности выравнивали с использованием MUSCLE. Смотрите Edgar, R.C. Nucleic Acids Research 32(5):1792-1797 (2004). Выравнивания представляли с использованием SHOWALIGN. Смотрите Rice, P. et al., "EMBOSS: The European Molecular Biology Open Software Suite" Trends in Genetics, 16(6):276-277 (2000). Смотрите Фиг.12. Как и в случае с ClfA, многие из последовательностей повторялись много раз без вариации. Для ясности каждую уникальную последовательность помещали в выравнивание только один раз. Смотрите Фиг.12. Только уникальные последовательности MntC были включены в перечень последовательностей. Например, последовательность MntC_001 была получена из разных штаммов без какой-либо вариации. Смотрите Фиг.12. Данная последовательность показана на первой строке выравнивания на Фиг.12. Номер в перечне последовательностей для любой последовательности также может быть получен из Таблицы 12. Только наиболее часто встречающаяся соответствующая последовательность ДНК была включена в перечень последовательностей. Для MntC следующие последовательности раскрыты здесь и не обнаружены в GenBank: MntC_002, MntC_006, MntC_007, MntC_008 и MntC_009.
|
Пример 8: экспрессия ClfA, CP5, СР8 и MntC на поверхности in vivo во время инфекции
S. aureus отвечает за вызов ряда разнообразных человеческих инфекций. Соответственно, бактерии должны адаптироваться к разным экологическим нишам путем дифференциальной экспрессии факторов вирулентности, требующихся для инфекции. Экспрессию антигенов-мишеней исследовали в трех анализах на грызунах in vivo для оценки их экспрессии во время инфекции: раневой модели для измерения экспрессии антигена в первичном сайте инфекции; модели бактериемии, в которой отслеживается экспрессия антигена в крови, и модели имплантированной (indwelling) камеры, в которой отслеживается экспрессия антигена в период условий с ограниченным (доступом) питательных веществ/кислорода. Для всех данных моделей грызунов заражали бактериями в месте исследования. После инфекции, бактерии собирали в разные моменты времени и экспрессию антигена (ClfA, СР5, СР8, MntC) оценивали с использованием иммунофлуоресцентной микроскопии (рана и бактериемия) или проточной цитометрии (камера).
МАТЕРИАЛЫ И МЕТОДЫ
Экспрессия в раневой модели
Эксперименты по инфекции ран состояли из 5 животных на группу и вплоть до 5 групп максимум с 25 животными на эксперимент. Самцы мышей C57BL/6 в возрасте от шести до восьми недель (нед.) подвергались хирургическому вмешательству для вставления петли шва в разрез бедренной мышцы. Это дает чужеродный субстрат для прикрепления бактерий и значительно уменьшает минимальную инфекционную дозу, необходимую для получения стафилококковой инфекции раны. В разрез под глубоким тканевым швом из шелка 4-0 вводили пять мкл S. aureus либо стерильного физиологического раствора. Кожу закрывали швами из пролена 4-0 или хирургическим адгезивным средством (например, цианоакрилатом). Животных подвергали эвтаназии в моменты времени от 30 мин до 10 суток после инфекции и бедренную мышцу вырезали, гомогенизировали и подсчитывали бактерий. В области видимой инфекции анализировали бактерий на экспрессию антигена посредством иммунофлуоресцентной (IF) конфокальной микроскопии.
Экспрессия в модели бактериемии
Группы из 10 четырехнедельных мышей CD-1 или Balb/C иммунизировали 1 мкг белка или конъюгата СР подкожной инъекцией в нед. 0, 3 и 6. У животных брали кровь в нед. 0 и 8, с последующим внутрибрюшинным заражением S. aureus, выращенным до поздней логарифмической фазы в TSB (триптиказо-соевый бульон). Через три часа после заражения животных подвергали эвтаназии и отбирали кровь для IF конфокальной микроскопии.
Экспрессия в модели имплантированной (indwelling) диализной трубки
Изоляты S. aureus выращивали в течение ночи на планшетах TSA при 37°С. Бактерии соскабливали с планшетов и ресуспендировали в стерильном PBS (фосфатно-солевой буферный раствор) и ОП600 доводили до 1, приблизительно 109 колониеобразующих единиц (КОЕ)/мл. Бактерии разводили до концентрации 103 КОЕ/мл и инокулировали в диализные трубки. Аликвоту суспензии высаживали на чашки для определения реального числа КОЕ. Диализные трубки с MWCO (порог отсечения молекулярной массы) 3,5 кДа готовили для имплантации путем стерилизации в 70%-ном этаноле в течение 30 минут с последующей обильной промывкой в стерильной воде и затем в стерильном физиологическом растворе. 2 мл аликвоту бактериальной суспензии переносили в диализную трубку, мешок закрывали узлом и затем обильно промывали стерильным физиологическим раствором. Самцов крыс Sprague Dawley (возраста 6 недель) анестезировали и делали 2-3 см разрез вдоль срединной линии спины. В месте разреза создавали карманы мягким отделением кожи от подлежащей ткани. Трубку имплантировали в карманы и кожу закрывали с использованием хирургических скоб. Через 24 часа крыс подвергали эвтаназии, удаляли трубку и выделяли бактерий для анализа проточной цитометрией.
Иммуннофлуоресцентная микроскопия (IF)
Кровь из 5 мышей объединяли в ледяном цитрате натрия, рН 7,0 (конечная концентрация 0,4%). Эукариотические клетки лизировали 1%-ным NP-40 (Pierce Biotechnology). Бактерии промывали PBS и инкубировали в течение ночи при 4°C с кроличьей иммунной или преиммунной сывороткой (1:100) и детектировали с антителом козы против кроличьего антитела, конъюгированным с ALEXA488 (1:250, Invitrogen). Меченые бактерии высушивали на предметном стекле микроскопа и монтировали покровное стекло со средой Vectashield HardSet (Vector Laboratories, Inc.). Изображения получали спектральным конфокальным микроскопом Leica TCS SL (Leica Microsystems).
Проточный цитометрический анализ
Изоляты S. aureus выращивали, как описано в методике для крысиной модели с диализной трубкой. Приблизительно 107 бактериальных клеток блокировали в окрашивающем буфере (сбалансированный солевой раствор Хэнкса с 10% сыворотки козы) в течение 1 часа на льду. Бактериальные клетки центрифугировали в течение 5 минут при 10000 об/мин, супернатант удаляли и клетки инкубировали с мышиным антителом или изотипическим контрольным антителом в течение 30 минут на льду. Затем клетки промывали и окрашивали антителом козы против IgG мыши, конъюгированным с FITC (флуоресцеинизотиоцианат) (Jackson ImmunoResearch) на льду в течение 30 минут. Бактерии промывали буфером для окрашивания, фиксировали 2%-ным параформальдегидом и данные получали и анализировали с использованием проточного цитометра FACS Caliber и программы Cell quest (Becton, Dickinson and Co.). Для каждого образца всего собирали 30000 событий.
|
|
|
Результаты
Комбинацию девятнадцати изолятов S. aureus тестировали на экспрессию ClfA, СР5, СР8 или MntC на поверхности клетки S. aureus во время инфекции (Таблицы 13а, 13б и 13в). Данные изоляты включали новые клинически релевантные штаммы и были разнообразными при мониторинге MLST (мультилокусное секвенирование-типирование). Экспрессия антигена зависела от штамма, момента времени и модели инфекции. Варьирование экспрессии антигена между изолятами в разных средах in vivo (кровоток по сравнению с раной) поддерживает применение мультиантигенной иммуногенной композиции для индуцирования широкого охвата стафилококковых изолятов при множестве разных инфекций. Антигены экспрессировались на поверхности в течение первых 24 часов инфекции и, таким образом, представляют собой подходящие компоненты для иммуногенной композиции против стафилококков. Белковые антигены ClfA и MntC были доступны для окрашивания в присутствии капсульной экспрессии, указывая на то, что присутствие капсулы не маскирует белки от антител, направленных против них.
Большинство тестированных изолятов типа 8 не экспрессировало СР в крови до поздних моментов времени после заражения (>4 ч) (Смотрите Таблицу 13а-в). Данные результаты демонстрируют то, что в S. aureus СР дифференциально регулируется, в зависимости от микроокружения in vivo, т.е. от сайта инфекции. Эти результаты могут объяснять несогласующиеся результаты по эффективности, доложенные для конъюгатов СР8 в животных моделях.
Результаты по экспрессии in vivo свидетельствуют о том, что ни одна иммуногенная композиция на основе одного антигена не будет давать широкого покрытия против большинства инфекций S. aureus. Существует слишком большое разнообразие экспрессионных фенотипов индивидуальных штаммов в пределах микроокружений in vivo. Следовательно, для предупреждения заболевания, вызванного S. aureus, требуется иммуногенная композиция, состоящая из более чем одного антигена.
Пример 9: иммуногенность мультиантигенных композиций, содержащих ClfA и конъюгаты СР5- и CP8-CRM197
В данном примере авторы изобретения оценивали иммуногенность комбинаций ClfA, CPS-CRM197 и CPS-CRM197.
А. Двухантигенный (CPS-CRM197/CP8-CRM197) препарат иммуногенной композиции - эффект дозы на ответы антител против капсулы у кроликов
В данном примере оценивали эффект дозы на иммуногенность объединенной иммуногенной композиции CPS-CRM197 и CPS-CRM197 У кроликов. Кроликов иммунизировали в неделю 0, 3 и 6 бивалентным конъюгатом плюс 125 мкг AlPO4, введенным подкожной инъекцией. Дозы, оцениваемые в данном исследовании, составляли 0,1 мкг, 1 мкг или 10 мкг каждого из CPS-CRM197 и CP8-CRM197 (конечные объединенные дозы CP-CRM197 0,2 мкг, 2 мкг и 20 мкг). Доза конъюгата отражает общий полисахаридный компонент конъюгата белок-полисахарид. У кроликов брали кровь в неделю 0, 3, 6 и 8. ELISA проводили на объединенных и индивидуальных сыворотках. Титры антител в конечной точке определяли как величину, обратную разведению при ОП405 0,1. Статистический анализ проводили по индивидуальным титрам в неделю 8. Результаты продемонстрировали то, что самые высокие титры специфичных антител против СР5 и СР8: 5×105 для СР5 и 1×106 для СР8 были индуцированы вакцинацией кроликов бивалентной иммуногенной композицией при дозе каждого компонента 1 мкг СР (данные не показаны).
Б. Трехантигенная композиция (CPS-CRM197 плюс CP8-CRM197 плюс rClfA). исследование по интервалу дозы rClfA с фиксированной дозой (1 мкг) каждого конъюгата у кроликов
Тестировали эффект комбинации rClfA и конъюгатов СР5 и СР8 на иммунный ответ на каждый компонент. Три группы иммунизировали бивалентными CPS-CRM197 плюс CP8-CRM197 S. aureus (доза каждого конъюгата 1 мкг), комбинированными с T7-ClfA (N1N2N3) в трех разных дозах 1, 10 и 100 мкг. Контрольную группу иммунизировали неконъюгированными СР5 и СР8 (по 50 мкг каждого), комбинированными со 100 мкг T7-ClfA (N1N2N3). Каждую иммуногенную композицию готовили в виде препарата с 500 мкг адъюванта AlPO4. Иммуногенные композиции вводили подкожной инъекцией в шею. У кроликов брали кровь в неделю 0, 6 и 8. ELISA проводили на объединенных и индивидуальных сыворотках и титры антител в конечной точке определяли как величину, обратную разведению при ОП405 0,1.
Результаты показали, что повышенное количество rClfA при комбинировании с бивалентным конъюгатом не влияло на ответы антител на капсульные полисахариды. Уровни антител к обоим капсульным серотипам находились в том же самом интервале, что и у кроликов, иммунизированных только бивалентным конъюгатом (данные не показаны). Уровни антител к СР5 и СР8 были в 2,5 раза ниже при дозе 10 (103 К) и 100 мкг (106 К) по сравнению с дозой 1 мкг rClfA (273 К). Существовал бустерный эффект после второй и третьей инъекции. Неконъюгированные бивалентные полисахаридные иммуногенные композиции (СР5+СР8, по 50 мкг каждого), комбинированные со 100 мкг rClfA, не индуцировали антитела, специфичные в отношении СР. Ответ антител, специфичных к rClfA, также не подвергался значительному влиянию дозы, где титры составляли от 1×105 до 1×106 после трех доз для доз 1, 10 и 100 мкг (данные не показаны). Также уровни ответа против ClfA, достигающиеся при введении с конъюгированными или неконъюгированными полисахаридами СР5 и СР8, были аналогичными.
Пример 10: трехантигенная композиция, иммуногенность у кроликов с высокими титрами Ab против СР5, СР8 и ClfA до иммунизации
Стафилококковая иммуногенная композиция направлена на популяции взрослых, которые имеют предсуществующие антитела к компонентам поверхности S. aureus. Для исследования эффекта предсуществующих антител к компонентам иммуногенной композиции на ответ на данную иммуногенную композицию авторы изобретения отобрали кроликов с высокими титрами полученных естественным путем антител против СР5, против СР8 и против ClfA. Две группы кроликов (n=6/7) иммунизировали в неделю 0, 3 и 6 трехантигенной иммуногенной композицией (CP5-CRM197 (1 мкг) и CP8-CRM197 (1 мкг) и T7-ClfA (N1N2N3)Y338A (10 мкг)). Одну группу иммунизировали иммуногенной композицией, приготовленной в виде препарата с 500 мкг AlPO4 в качестве адъюванта, и вторую группу иммунизировали иммуногенной композицией, не содержащей адъювант. Иммуногенные композиции вводили подкожной инъекцией. У кроликов брали кровь в нед. 0, 3, 6 и 8. Титры антител на СР5, СР8 и rClfA определяли ELISA как титры антител в конечной точке на объединенных и индивидуальных сыворотках (определенные как значение, обратное разведению при ОП405 0,1).
Результаты показали, что кролики с предсуществующими титрами антител, индуцированными природной инфекцией, отвечали на трехвалентную иммуногенную композицию увеличением уровней антител на все компоненты иммуногенной композиции - СР5, СР8 и rClfA. 5-10-кратное увеличение уровней Ab на каждый антиген было показано даже у животных с титрами антител 1×106. Присутствие адъюванта в иммуногенной композиции приводило к более высоким титрам антител по сравнению с группой, иммунизированной без адъюванта (данные не показаны).
Пример 11: эффект адъюванта на ответы на компоненты капсульных полисахаридов
А. Эффект двух разных доз AlPO4 на ответ на бивалентную иммуногенную композицию с конъюгатами CP5-CRM197/CP8-CRM197 у кроликов
Исследовали эффект дозы адъюванта AlPO4 на ответы против СР5 и СР8 у кроликов. Кроликов иммунизировали в неделю 0, 3 и 6 бивалентными CP5-CRM197 плюс CP8-CRM197 (доза каждого конъюгата 1 мкг) S. aureus. Одну группу (n=5/группу) иммунизировали иммуногенной композицией, приготовленной в виде препарата со 125 мкг, и вторую группу - с 500 мкг AlPO4 в качестве адъюванта. Иммуногенные композиции вводили подкожной инъекцией в шею. У кроликов брали кровь в неделю 0, 6 и 8, и антитела против капсулы определяли ELISA как титры антител в конечной точке, определенные как значение, обратное разведению, при ОП405 0,1. Результаты показали, что не было отличий в ответах специфичных антител против СР8 у кроликов, иммунизированных либо 125 мкг, либо 500 мкг AlPO4. Композиция со 125 мкг адъюванта давала более сильные ответы антител против СР5. Также все кролики в группе, иммунизированной 125 мкг, отвечали более сильными ответами антител против СР5, тогда как в группе, иммунизированной 500 мкг адъюванта, было два кролика со слабым ответом на композицию.
Б. Эффект AlPO4 на иммуногенность трехантигенной композиции
Кроликов (NZW, n=6/7 кроликов на группу) иммунизировали в неделю 0, 3 и 6 трехантигенной композицией, содержащей CP5-CRM197 (1 мкг), и CP8-CRM197 (1 мкг), и T7-ClfA (N1N2N3)Y338A (10 мкг). Одну группу кроликов иммунизировали иммуногенной композицией с 500 мкг AlPO4, вторую группу иммунизировали без адъюванта, третью группу иммунизировали в неделю 0 иммуногенной композицией с 500 мкг AlPO4, и в недели 3 и 6 - иммуногенной композицией без адъюванта. Иммуногенные композиции вводили подкожной инъекцией, у кроликов брали кровь в неделю 0, 3, 6 и 8 и сыворотку оценивали антигенспецифичной ELISA. Результаты показали, что присутствие адъюванта в иммуногенной композиции не оказывало эффекта на ответы против СР5 или против СР-8 у кроликов (данные не показаны). GMT (среднее геометрическое титра) титров антител на обе капсулы были сравнимыми. Однако имел место эффект адъюванта на ClfA-специфичный ответ антител, показанный в группах, иммунизированных с адъювантом, присутствующим во всех трех вакцинациях. Вторая и третья бустерная иммунизация (boost) иммуногенной композицией, не содержащей AlPO4, у кроликов, примированных иммуногенной композицией, содержащей адъювант, давали более сильные ответы на ClfA по сравнению с группой без адъюванта.
Примеры 12-29: доклиническая оценка ClfA, MntC, CPS-CRM197 и СР8-CRM197 S. aureus:
Ниже в Примерах 12-29 описаны результаты доклинической оценки конъюгатов СР5 и СР8, ClfA и MntC. Примеры демонстрируют эффективность данных антигенов в доклинических моделях на животных. Примеры также демонстрируют то, что антитела, генерированные конъюгатами СР, ClfA и MntC, имеют функциональную активность в анализах in vitro.
Для конъюгирования СР с CRM197 использовали два разных химических способа, но не наблюдали различий в эффективности для конъюгатов, полученных разными способами. Было показано, что O-ацетилирование капсульных полисахаридов влияет на индукцию функциональных антител. Оценка объединенной иммуногенной композиции, содержащей CP5-CRM197, CP8-CRM197 и ClfA, не показала мешающего воздействия на уровни специфичного антитела (Ab) на каждый компонент иммуногенной композиции.
Материалы и способы
ELISA
Планшеты ELISA для микротитрования Maxisorp (Nalge Nunk International, Rochester, NY) покрывали в течение 18 часов при 4°С или в течение 90 мин при 37°С 1 мкг/мл антигена ClfA в PBS, рН 7,5. Планшеты промывали пять раз в PBST (1X PBS, 0,1% полисорбат 20) и блокировали 1%-ным (масс./об.) обезжиренным молоком в PBS с 0,05% полисорбата 20 в течение 1 ч при комнатной температуре. Планшеты промывали PBST, последовательно разводили (3-кратно) и в отдельные недели 0, 3, 6 и 8 добавляли в планшеты кроличью антисыворотку и инкубировали либо в течение ночи при 4°С, либо в течение 2 ч при 37°С. Планшеты промывали и связавшиеся первичные антитела детектировали антителом козы против кроличьего IgG, конъюгированным с пероксидазой хрена (разведение 1:1000) в PBST. Планшеты инкубировали в течение 1 ч при 37°С, затем промывали и проявляли раствором пероксидазного субстрата ABTS (2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновая кислота)) (KPL, Inc., Gaithersburg, MD) при комнатной температуре приблизительно в течение 20 минут. Реакцию останавливали добавлением 1%-ного (об./об.) раствора SDS (додецилсульфат натрия). Поглощение измеряли при 405 нм в автоматическом планшет-ридере (Molecular Devices Corporation, Sunnyvale, CA). Титры антител выражали как значение, обратное наиболее высокому разведению сыворотки со значением поглощения 0,1. Для определения различий в титрах антител между разными группами использовали t-критерий Стьюдента с использованием программы JMP (SAS Institute, Cary, NC). Считали, что вероятность меньше, чем 0,05 показывает статистически значимое различие.
Мышиные модели сепсиса
Мышиная модель сепсиса имитирует заболевание, передающееся через кровь. Для пассивной иммунизации группы из 15 мышей Swiss-Webster интраперитонеально (i.p.) обрабатывали IgG. Через двадцать четыре часа мышей заражали S. aureus 659-018 посредством одной внутривенной (i.v.) инъекции (0,1 мл) через хвостовую вену. Всех животных наблюдали в течение 14-15 суток, момента времени, в который всех остающихся мышей умерщвляли.
Для активной иммунизации мышей иммунизировали антигеном в недели 0, 2 и 4 и заражали в неделю 6 S. aureus внутривенным путем.
Кроличья модель эндокардита с активной иммунизацией
Взрослых кроликов New Zealand White 4 раза внутримышечно иммунизировали 25 мкг антигена. Через одни сутки после хирургического вмешательства животных заражали i.v. болюсом S. aureus и определяли число колониеобразующих единиц (КОЕ) в сердечной ткани через 24 часа после заражения.
Мышиная бактериемия
Модель 3 ч бактериемии использовали для определения эффекта вакцинации на число бактерий на ранней стадии инфекции. Мышей иммунизировали в недели 0, 3 и 6 антигеном, с последующим i.p. заражением S. aureus в неделю 8. Животных обескровливали через 3 часа и последовательные разведения крови высевали на чашки Петри для подсчета бактерий.
Мышиная модель пиелонефрита
Мышиная модель пиелонефрита имитирует распространение S. aureus в результате бактериемии. Группы из 10 четырехнедельных самок мышей CD-1 иммунизировали антигеном в недели 0, 3 и 6. Мышей заражали i.p. инъекцией S. aureus. Через сорок восемь часов после заражения мышей умерщвляли и подсчитывали бактерий в почке и в крови.
Крысиная модель эндокардита
Крысиная модель эндокардита имитирует человеческий эндокардит, при котором колонизация происходит того, как инфекция, передающаяся через кровь, приводит к колонизации поврежденной сердечной ткани. Пять 5-недельных самцов крыс Sprague-Dawley (Charles River, Kingston, NY) иммунизировали в недели 0, 2 и 4 1 мкг конъюгата CPS-CRM197, приготовленного в виде препарата со 100 мкг AlPO4. У животных брали кровь до вакцинации в нед. 0 и в конце нед. 5. Через семьдесят два часа в левый желудочек сердца через сонную артерию хирургически устанавливали катетер (трубку РЕ-10). Установка катетера приводит к образованию стерильного разрастания, к которому при инфекции могут прикрепляться стафилококки. Для предупреждения инфекции, возникающей в результате хирургической процедуры, животных обрабатывали антибиотиком байтрилом (5 мг/кг) во время хирургического вмешательства и через 8 часов после хирургического вмешательства. Через сорок восемь часов после хирургического вмешательства крыс заражали PFESA0266 (приблизительно 4×108 КОЕ) или SA315 (приблизительно 1×109 КОЕ) интраперитонеальной инъекцией. Через сорок восемь часов после заражения крыс подвергали эвтаназии и сердце и почки удаляли и помещали в 3 мл забуференного фосфатом физиологического раствора (PBS). Данные органы затем гомогенизировали гомогенизатором тканей (Kinematica AG, Luzernerstrasse, Германия) и доводили объем до 10 мл PBS. Гомогенаты затем последовательно разводили и высевали на чашки Петри для подсчета бактерий.
Мониторинг функциональных антител с использованием анализов опсонофагоцитарного умерщвления
Для данного анализа можно использовать дифференцированные эффекторные клетки из клеточной линии (например, HL60s) или полиморфоядерные клетки (PMN), выделенные из донорской человеческой крови с использованием раствора LYMPHOLYTE®-poly (Cedarlane laboratories limited, Ontario, Канада) согласно протоколу изготовителя. Эффекторные клетки ресуспендировали в буфере для анализа (модифицированная среда Игла, содержащая 1% бычьего сывороточного альбумина) в концентрации приблизительно 2 Х 107 клеток/мл и помещали в инкубатор с температурой 37°С, пока они не были готовы для применения. Штамм PFESA0266 S. aureus выращивали в течение ночи на чашках с триптическим соевым агаром. Бактериальные клетки соскабливали, дважды промывали и ресуспендировали в буфере для анализа, содержащем 5% глицерина, до ОП600=1, что равно концентрации приблизительно 5×108 КОЕ/мл. 1 мл аликвоты бактериальной суспензии замораживали и хранили при -40°С до времени использования. Замороженную бактериальную суспензию размораживали и подводили концентрацию до 106 КОЕ/мл в буфере для анализа и помещали на лед. Анализ проводили с использованием стерильных 96-луночных полипропиленовых планшетов с глубокими 1 мл лунками. Получали двухкратные последовательные разведения образцов антител (50 мкл) с последующим добавлением 300 мкл буфера для анализа к смеси антител. Бактерии добавляли (50 мкл) в планшеты и помещали на ротационный шейкер на 30 минут при 4°С. После стадии опсонизации следовало добавление 50 мкл человеческого комплемента (конечная концентрация 1%). Наконец, в планшет добавляли 50 мкл эффекторных клеток (концентрация 107 клеток/мл) и суспензию хорошо перемешивали многократным пипетированием. 50 мкл аликвоту суспензии 10-кратно последовательно разводили в стерильном 1%-ном растворе сапонина, встряхивали для минимизации агрегации бактерий и высаживали на триптический соевый агар в двойной повторности. Планшет для анализа инкубировали при 37°С в течение 1 часа с непрерывным перемешиванием с использованием шейкера Rotisserie style. В конце инкубации 50 мкл аликвоту суспензии 10-кратно последовательно разводили в стерильном 1%-ном растворе сапонина, перемешивали посредством встряхивания для минимизации агрегации бактерий и высаживали на триптический соевый агар в двойной повторности. Процентную долю умерщвления рассчитывали определением отношения числа КОЕ выживших через 60 минут в лунках с бактериями, антителами, комплементом и эффекторными клетками к числу КОЕ выживших в пробирках, не содержащих антитела, но содержащих бактерии, комплемент и эффекторные клетки. Включали контроли, содержащие бактерии, комплемент и сыворотку, для корректировки любого снижения КОЕ, обусловленного агрегацией.
Адсорбция комплемента
В качестве источника комплемента в данном анализе можно использовать сыворотку от человеческих доноров, подвергнутую адсорбции против штаммов PFESA0266, PFESA0286 и PFESA0270 S. aureus. Штаммы S. aureus выращивали в течение ночи на планшетах TSA (триптический соевый агар) при 37°С. Клетки соскабливали с планшета и ресуспендировали в стерильном PBS. Бактериальные клетки центрифугировали при 10000 об/мин в течение 10 минут при 4°С и клеточный осадок ресуспендировали в человеческой сыворотке для адсорбции. Сыворотку инкубировали с бактериями на качалке (nutator) при 4°С в течение 30 минут. Клетки центрифугировали, сыворотку переносили в другую пробирку, содержащую бактерии, и стадию адсорбции вновь повторяли в течение 30 минут. Наконец, клетки центрифугировали и сыворотку пропускали через 0,2 микронный фильтр перед тем, как 0,5 мл аликвоты замораживали в жидком азоте.
Способ II. ОРА с использованием клеток HL-60
Клетки HL-60 были видоизменены (differentiated) согласно S. Romero-Steiner, et al., Clin Diagn Lab Immunol 4 (4) (1997), pp.415-422. Собранные клетки HL-60 ресуспендировали в буфере для анализа (модифицированная среда Игла, содержащая 1% бычьего сывороточного альбумина) в концентрации приблизительно 108 клеток/мл и помещали в инкубатор при 37°С до времени использования. S. aureus выращивали в течение ночи на чашках с триптическим соевым агаром. Бактериальные клетки соскабливали, дважды промывали и ресуспендировали в буфере для анализа, содержащем 5% глицерина, до ОП600=1, что равно приблизительно 5×108 КОЕ/мл. 1 мл аликвоты бактериальной суспензии замораживали и хранили при -40°С до времени использования. Замороженную бактериальную суспензию размораживали, доводили до концентрации 106 КОЕ/мл в буфере для анализа и помещали на лед. Анализ проводили с использованием стерильных 96-луночных полипропиленовых планшетов с глубокими 1 мл лунками. Получали двухкратные последовательные разведения образцов моноклональных антител (25 мкл) с последующим добавлением к суспензии антител 150 мкл буфера для анализа. Бактерии добавляли (25 мкл) в планшеты и помещали на ротационный шейкер на 30 минут при 4°С, с последующим добавлением 25 мкл человеческого комплемента (конечная концентрация 1%). Наконец, в планшет добавляли 25 мкл клеток HL-60 (107 клеток/мл) и суспензию хорошо перемешивали многократным пипетированием. 25 мкл аликвоту суспензии 10-кратно последовательно разводили в стерильном 1%-ном растворе сапонина, перемешивали встряхиванием для минимизации агрегации бактерий и высаживали на триптический соевый агар в двойной повторности. Планшет для анализа инкубировали при 37°С в течение 1 часа с непрерывным перемешиванием с использованием шейкера Rotisserie style. В конце инкубации 25 мкл аликвоту суспензии 10-кратно последовательно разводили в стерильном 1%-ном растворе сапонина, перемешивали посредством встряхивания и высаживали на триптический соевый агар в двойной повторности. Процентную долю умерщвления рассчитывали определением отношения числа КОЕ выживших через 60 минут в лунках с бактериями, антителами, комплементом и клетками HL-60 к числу КОЕ выживших в пробирках, не содержащих антитела, но содержащих бактерии, комплемент и клетки HL-60. Включали контроли, содержащие бактерии, комплемент и mAb, для корректировки любого снижения КОЕ, обусловленного агрегацией.
Пример 12: демонстрация защитного эффекта ClfA в животных моделях in vivo
Для оценки того, были ли способны поликлональные кроличьи антитела, индуцированные против ClfA, снижать число колоний S. aureus в мышиной модели сепсиса, использовали очищенные кроличьи поликлональные IgG против ClfA в двух дозировках (0,8 мг и 1,6 мг) в исследовании по пассивной иммунизации (Фиг.13). Заражающий штамм S. aureus представлял собой новый клинический изолят, 659-018. Обе дозировки антитела приводили к значительному снижению числа бактериальных колоний в мышиной модели сепсиса (р=0,0134 для дозы 1,8 мг и р=0,0013 для дозы 0,8 мг). Данный эксперимент повторяли с дополнительными изолятами S. aureus с похожими результатами (данные не показаны).
Пример 13: активная иммунизация ClfA уменьшала колонизацию сердца S. aureus
Активная иммунизация кроликов ClfA приводила к защите в кроличьей модели эндокардита. Авторы изобретения обнаружили 3-4 log-снижение КОЕ S. aureus, выделенного из сердечных разрастаний, для животных, иммунизированных ClfA, по сравнению с животными отрицательного контроля, иммунизированными PBS или AlPO4 (Фиг.14)
Пример 14: защитный эффект MntC в животных моделях in vivo
Активная иммунизация MntC показала стойкую защиту у мышей с ранних моментов времени после заражения S. aureus. Число бактерий в крови мышей, получающих i.p. заражение S. aureus, было значительно сниженным по сравнению с контролями, иммунизированными PBS (Фиг.15А и 15Б). Четыре из шести индивидуальных исследований показали значительное уменьшение КОЕ/мл крови у иммунизированных животных. Защита, опосредованная иммунизацией MntC, была продемонстрирована с использованием 2 разных заражающих штаммов S. aureus, PFESA0237 (Фиг.15А) и PFESA0266 (Фиг.15Б).
Пример 15: конъюгаты СР5 защищают в мышиной модели пиелонефрита
Конъюгаты СР5 оценивали на их способность защищать мышей в модели пиелонефрита с активной иммунизацией. На Фиг.16 показаны результаты из нескольких исследований. Количество бактерий в крови мышей, получающих i.p. заражение S. aureus, было значительно сниженным по сравнению с контролями, иммунизированными PBS (Фиг.16). Шесть из шести индивидуальных исследований показали значительное снижение КОЕ/мл почек у иммунизированных животных. Данные продемонстрировали стойкое уменьшение колонизации почки после активной иммунизации конъюгатом СР5.
Пример 16: конъюгаты СР5, полученные разными химическими способами конъюгирования, защищают мышей против экспериментальных инфекций
Исследования с активной иммунизацией в мышиной модели пиелонефрита проводили с использованием конъюгата СР5, полученного либо химическим способом с PDPH, либо с CDT. Способы конъюгирования СР5 или СР8 с CRM197 были описаны выше. Результаты показали, что оба конъюгата значительно снижают колонизацию у мышей по сравнению с животными с имитацией иммунизации (Таблица 14).
|
Пример 17: конъюгат СР5 защищает в крысиной модели эндокардита
Были проведены четыре исследования с конъюгатом CP5-CRM197 PDPH и неродственным конъюгатом (PP5-CRM197) в дозе 1 мкг. Конъюгаты СР5 значительно уменьшали колонизацию как в сердце, так и в почках в 2 из 3 экспериментов, в которых заражающим штаммом Типа 5 был PFESA0266 (Таблица 15). В третьем исследовании среднее геометрическое титра (GMT) титра антитела против СР5 было наименьшим из трех экспериментов, но оно было лишь немного ниже, чем титр в предыдущем эксперименте (51000 по сравнению с 67000).
|
Пример 18: конъюгаты CP5-CRM197 в модели пиелонефрита
Исходные исследования, в которых изучали эффективность конъюгатов, были проведены с СР5 с MW 25 кДа. Улучшения процесса ферментации приводили к продукции полисахарида с высокой MW, который был конъюгирован с белком-носителем и протестирован одновременно с 25 кДа конъюгатом СР5. Конъюгаты, содержащие СР с MW 25 кДа (низкая MW) и 300 кДа (высокая MW) получали с использованием конъюгационной химии с CDT и оценивали в мышиной модели пиелонефрита. Были протестированы три дозы (0,01; 0,1 и 1 мкг) конъюгатов HMW (с высокой молекулярной массой) и их сравнили с контрольным LMW (с низкой молекулярной массой) CP5-CRM197 и неродственным конъюгатом (PP5-CRM197) в дозе 1 мкг. Результаты показали значительное снижение КОЕ S. aureus PFESA0266, выделенного из почек, в дозе 1 мкг. Не было статистического различия между защитой от конъюгатов, полученных с СР5 разного размера, в дозе 1 мкг (Таблица 16). Более низкие дозы (0,01 мкг и 0,1 мкг) конъюгата не могли вызвать иммунный ответ, достаточный для значительного уменьшения инфекции. Эксперимент повторяли с использованием идентичной методики иммунизации и заражения. В повторном эксперименте только доза 1 мкг LMW CP5-CRM197 приводила к значительному уменьшению колонизации (р=0,01). Доза 1 мкг HMW CP5-CRM197 снижала КОЕ в почках, однако снижение не было статистически значимым (р=0,056).
|
Пример 19: O-ацетилирование полисахарида является важным для индукции защитного ответа антител на иммуногенную композицию конъюгата СР5
Для оценки важности O-ацетилирования СР5, нативный СР5 был де-O-ацетилирован (dOAc) и конъюгирован с CRM197 (dOAc-CRM197) с использованием конъюгационной химии с PDPH. Эффективность конъюгата dOAcCP-CRM197 сравнивали одновременно с CP5-CRM197 в мышиной модели пиелонефрита. Результаты показали, что конъюгат, не имеющий O-ацетильных групп (dOAc CP-CRM197), не является эффективным в данной модели, как показано по отсутствию значимого изменения в бактериальной колонизации в почках. Эти данные (Таблица 17) указывают на то, что O-ацетилирование было важным для индукции функциональных антител против СР5.
|
Пример 20: Иммунизация конъюгатом СР8 уменьшает смертность в модели сепсиса
Эффективность конъюгата CP8-CRM197 оценивали в мышиной модели сепсиса после заражения S. aureus PFESA0268 (Тип 8). Мышей Swiss Webster (n=30) активно иммунизировали подкожной инъекцией 1 мкг CPS-CRM197 и физиологическим раствором, которые оба приготавливали в виде препарата со 100 мкг AlPO4. Исследование показало существенное ослабление сепсиса (р=0,0308) по сравнению с мышами, иммунизированными только AlPO4. Смотрите Фиг.17.
Пример 21: оценка конъюгированного нативного и обработанного основанием СР8 в мышиной модели бактериемии
Для конъюгата СР8 была оценена важность O-ацетильных групп, присутствующих на нативном СР8 до конъюгирования, для индукции ответов функциональных антител. Полисахарид СР8 де-O-ацетилировали при мягких щелочных условиях, и как ЯМР, так и ионная хроматография (IC) подтвердили отсутствие O-ацетилирования в де-О-Ас (де-O-ацетилированный) CP8-CRM197.
Мышиную модель бактериемии использовали для оценки эффективности нативного СР8 по сравнению с обработанным основанием СР8, конъюгированными с CRM197. Группы самок мышей BALB/c (15/группу) иммунизировали в недели 0, 3 и 6 1 мкг де-О-Ас CP8-CRM197 или 1 мкг O-Ас CP8-CRM197. Иммуногенные композиции готовили в виде препарата с 22 мкг AlPO4. Животных заражали S. aureus PFESA0003. Через три часа после заражения мышей умерщвляли и подсчитывали бактерий в крови. Данные показали, что имелось статистически значимое (р=0,0362) снижение бактериальных КОЕ, выделенных из крови животных, иммунизированных необработанным конъюгатом нативного СР8, как определено по t-критерию Стьюдента (Таблица 18). У животных, которых иммунизировали конъюгатом СР8, обработанным основанием, бактериальные КОЕ, выделенные из крови, были аналогичными контрольной группе, которую иммунизировали физиологическим раствором.
|
Пример 22: подтверждение важности O-ацетилирования как функционального эпитопа СР5 посредством ОРА с использованием МАЬ с известными специфичностями
Моноклональные антитела против СР5 со специфичностями к СР5 ОАс+ (СР5-7-1), СР5 ОАс+/- (СР5-5-1) и СР5 ОАс- (СР5-6-1) оценивали на активность ОР (опсонического) умерщвления против штамма PFESA0266 типа 5 (Таблица 19). MAb СР8-3-1, специфичное к СР8 ОАс+, использовали в качестве отрицательного контроля. Результаты показали, что MAb СР5-7-1 (специфичное в отношении СР5 ОАс+) опосредует умерщвление обоих протестированных штаммов типа 5. Также mAb СР5-5-1, распознающее эпитопы, которые имеют и СР5 ОАс+, и СР5 ОАс-, опосредовало умерщвление штамма PFESA0266. mAb, специфичные в отношении эпитопов, присутствующих на полисахариде СР5 ОАс-, не опосредовали умерщвление штамма PFESA0266. Эти результаты указывают на то, что O-ацетильные эпитопы на СР5 вовлечены в функциональную активность антител, специфичных в отношении СР5.
|
Данные доложены как процент умерщвления и рассчитаны определением отношения числа КОЕ выживших через 60 минут в лунках с бактериями, антителами, комплементом и клетками HL-60 к числу КОЕ выживших в лунках, не содержащих антитела, но содержащих бактерии, комплемент и клетки HL-60.
Пример 23: опсоническая активность мышиных антител, индуцированных на конъюгаты СР5 с высокой и низкой MW
Сыворотку от мышей (n=5) с высокими титрами ELISA СР5 из групп, иммунизированных 1 мкг СР5 с высокой молекулярной массой и СР5 с низкой молекулярной массой из Примера 18, сравнивали по опсонической активности с использованием S. aureus PFESA0266. Результаты ОРА показали то, что оба конъюгата индуцировали опсонические антитела у мышей (Таблица 20). Имелась тенденция, наблюдаемая для конъюгатов с высокой Mw, индуцировать более высокий титр опсонических антител. Данные показаны как средний % умерщвления ± SEM для 5 индивидуальных мышиных сывороток. Антитела должны быть функциональными при измерении по умерщвлению бактерий либо в животной модели эффективности, либо посредством анализа опсонофагоцитарного умерщвления, который демонстрирует то, что антитела умерщвляют бактерии. Функциональное умерщвление может не быть продемонстрировано с использованием анализа, в котором просто отслеживается генерирование одних антител, что не указывает на важность конъюгатов с высокой молекулярной массой в эффективности.
|
Пример 24: опсоническая активность сыворотки от мышей, иммунизированных конъюгатами нативных и химически модифицированных СР8
Выбранные мышиные сыворотки (n=5) с высокими титрами СР8 из исследования в Примере 21 сравнивали по опсонической активности с использованием штамма PFESA0005. Результаты ОРА (Таблица 21) показывают, что только конъюгаты, полученные конъюгацией нативного СР8, индуцировали опсонические антитела у мышей. Примечательно, что конъюгат де-ОАс СР8 был иммуногенным у мышей, но индуцированные антитела не были опсоническими в данном анализе. Титры ОРА доложены как значения, обратные разведению, при котором наблюдали 40%-ное умерщвление. Антитела должны быть функциональными при измерении по умерщвлению бактерий либо в животной модели эффективности, либо посредством анализа опсонофагоцитарного умерщвления, который демонстрирует то, что антитела умерщвляют бактерии. Функциональное умерщвление может не быть продемонстрировано с использованием анализа, в котором просто отслеживается генерирование одних антител, что не указывает на важность O-ацетилирования в эффективности.
|
Пример 25: умерщвление штаммов типа 8 антисывороткой приматов, не являющихся человеком, на конъюгат СР8 ингибируется добавлением нативного СР8
Для подтверждения специфичности активности умерщвления в сыворотке приматов, не являющихся человеком, иммунизированных конъюгатом СР8, был проведен анализ в присутствии нативного СР8. Использовали способ II ОР со следующими модификациями. Получали двухкратные последовательные разведения проб антител (25 мкл), с последующим добавлением в суспензию антител либо 150 мкл (конкурент Pn 14), либо 125 мкл (конкурент СР8) буфера для анализа. Конкурент представлял собой очищенный полисахарид СР8 (СР8 poly), и неродственный пневмококковый полисахарид (Pn 14 poly) использовали в качестве контроля. Полисахариды добавляли (50 мкг) в суспензию антител и планшет инкубировали при 4°С в течение 30 минут с перемешиванием путем перемешивания с донышка на крышку (end over end mixing). После инкубации с полисахаридами в планшеты добавляли бактерии (25 мкл) и помещали планшеты на ротационный шейкер на 30 мин при 4°C с последующим добавлением 25 мкл человеческого комплемента (конечная концентрация 1%). Результаты (Таблица 22) показали то, что присутствие в реакционной смеси нативного СР8 ингибировало опсонофагоцитарное умерщвлении S. aureus типа 8. Данные результаты подтверждают то, что опсонофагоцитарное умерщвление иммунной сывороткой было опосредовано Ab, специфичными к капсуле.
|
|
Пример 26: приобретенные естественным путем антитела к ClfA опосредуют опсонофагоцитарное умерщвление S. aureus
Люди в популяции естественным образом подвергаются воздействию S. aureus и, таким образом, имеют предсуществующие антитела к данной бактерии в их системе кровообращения. Авторы данного изобретения провели аффинную очистку антитела против ClfA из человеческой сыворотки и оценили, могли ли антитела опосредовать опсоническое умерщвление. Было показано, что антитела к ClfA являются опсоническими в отношении капсульного полисахарида S. aureus (данные не показаны). Штамм PFESA0266 выращивали в течение ночи в питательной среде Columbia с 2% NaCl. Бактерии опсонизировали человеческим IgG, аффинно очищенными на ClfA, или человеческим IgG, аффинно очищенными на нерелевантном антигене (отрицательный контроль, стрептококковый белок SCP), и тестировали опсоническую активность. В анализе опсонофагоцитирующей активности использовали дифференцированные клетки HL-60 в соотношении эффектор/мишень 100:1. В качестве дополнительного контроля в эксперимент включали mAb против СР5 для демонстрации присутствия СР5 на поверхности. Результаты представляют собой среднее значение из двух независимых экспериментов. Антитела, специфичные в отношении ClfA и СР5, в самом деле опосредовали опсоническое умерщвление, и антитела, специфичные в отношении SCP (отрицательный контроль), не имели активности в данном анализе.
Пример 27: конъюгат CP5-CRM197 индуцирует опсонические антитела у приматов, не являющихся человеком (NHP)
Для сравнения функциональности конъюгатов CP5-CRM197 с высокой молекулярной массой по отношению к функциональности конъюгатов СР5-CRM197 с низкой молекулярной массой у NHP, группы из пяти обезьян иммунизировали дозами конъюгатов 2 и 20 мкг с адъювантом AlPO4 или без него. Обезьяны получали первую и вторую вакцинацию на сутки 0 и 28, соответственно. Пробы крови, взятые в сутки 0, 14, 28 и 42, тестировали на ОР активность. Результаты обобщали в Таблице 23. 20 мкг HMW конъюгата давали наиболее высокие титры ОР по сравнению с другими группами. Также частота ОР-позитивных обезьян была выше в группах, иммунизированных обеими дозами конъюгата с высокой MW, чем в соответствующих группах, иммунизированных конъюгатом с низкой MW. Данные результаты демонстрируют то, что для конъюгата HMW CPS-CRM197 существует тенденция индуцировать лучшие ответы ОР, чем в случае конъюгата LMW CP5 у NHP.
|
|
Пример 28: конъюгаты капсульных полисахаридов, содержащие полисахариды с высокой молекулярной массой, показывают повышенную иммуногенность по сравнению с конъюгатами, содержащими полисахариды с низкой молекулярной массой
Проводили исследования на приматах, не являющихся человеком (МНР), для оценки иммуногенности разных композиций капсульных конъюгатов. Тестировали две композиции при двух разных уровнях дозировок (2 и 20 мкг). Первая композиция состояла из полисахарида с высокой молекулярной массой (HMW) (приблизительно 130 кДа), конъюгированного с CRM197. Вторая композиция содержала полисахарид с низкой молекулярной массой (LMW) (приблизительно 25 кДа), конъюгированный с CRM197. Группы из пяти приматов вакцинировали одной дозой одной из вакцин и отслеживали иммунные титры до вакцинации и через две недели после вакцинации. Титры ОРА определяли как разведение сыворотки, требующееся для умерщвления 40% штамма PFESA0266 S. aureus в анализе ОРА. Титры антител также отслеживали ELISA. Повышенную активность наблюдали для вакцины HMW по сравнению с композицией LMW (Таблица 24), что следует из десятикратного увеличения титров антител для вакцины HMW по сравнению с вакциной LMW. Доля респондеров ОРА для МНР, которые получали вакцину HMW, также была выше (80% по сравнению с 40%).
|
Пример 29: двухантигенная (CP5-CRM197 и ClfA) композиция - ответы антител у приматов, не являющихся человеком
Для оценки иммунного ответа на одну дозу двухантигенных иммуногенных композиций (CP5-CRM197 и ClfA) у NHP группы из пяти обезьян иммунизировали разными дозами двух антигенов без добавления AlPO4. Пробы крови, взятые в сутки 0, 14 и 28, тестировали на опсонофагоцитирующую (ОР) активность, и титры ELISA и результаты обобщены в Таблице 24. Результаты показали, что ОР активность систематически наблюдалась у животных, иммунизированных СР5, по сравнению с группой с имитацией иммунизации СР5. В целом, группа, иммунизированная 100 мкг, имела наиболее высокие титры ELISA и ОР по сравнению с другими группами. Умерщвляющая ОР активность не наблюдалась с сывороткой от группы, иммунизированной одним ClfA. В группах, которым давали возрастающие дозы ClfA или СР5, не наблюдалось мешающего влияния. Смотрите Таблицу 25.
|
|
|
Животные модели демонстрируют потенциал антигенов на основе капсульных полисахаридов СР5 и СР8 S. aureus
Как CP5-CRM197, так и CP8-CRM197 конъюгаты индуцировали специфичные в отношении серотипа капсулы ответы антител у мышей, крыс, кроликов и приматов, не являющихся человеком (NHP). Антитела, индуцированные конъюгатами, были функциональными в функциональном анализе опсонофагоцитарного умерщвления in vitro. Были получены данные для демонстрации того, что O-ацетилирование является важным для индукции защитных антител в отношении как СР5, так и СР8 и что O-ацетильные группы являются частью эпитопа, распознаваемого ОРА+ mAb против СР5. MAb, которые распознают нативный СР5, который является O-ацетилированным, являются функциональными в ОРА и опосредуют умерщвление бактерий. Конъюгат СР8 индуцировал функциональные антитела как у мышей, так и у кроликов, которые опосредовали умерщвление штамма типа 8 в ОРА. Специфичность умерщвления поликлональными или моноклональными антителами была подтверждена устранением умерщвления после добавления в анализ гомологичного нативного полисахарида. Для демонстрации доклинической эффективности как СР5-, так и CP8-CRM197 конъюгатов использовали разные модели активной иммунизации. Конъюгат СР5 показывал систематическую эффективность в мышиной модели пиелонефрита и в крысиной модели эндокардита. Важность O-ацетилирования СР5 подтвердили в мышиной модели пиелонефрита, где де-O-ацетилированный СР5, конъюгированный с CRM197, не мог защитить животных от экспериментальной инфекции.
Комбинация конъюгатов в двухантигенной композиции индуцировала антитела к обеим капсулам - СР5 и СР8, и отсутствовало мешающее влияние на уровни индуцированных специфичных антител по сравнению с иммунизациями одним антигеном. Комбинация конъюгатов и ClfA в трехантигенной композиции индуцировала высокие уровни СР5, СР8 и ClfA, и отсутствовало мешающее влияние на ответы антител, индуцированные против любого антигена, присутствующего в комбинации. Трехантигенные иммуногенные композиции индуцировали ответы антител (Ab), допускающие бустерное усиление относительно всех трех компонентов у кроликов с высокими преиммунными титрами.
Данные результаты свидетельствуют о том, что СР5 и СР8, конъюгированные с CRM197, следует включать в качестве компонентов иммуногенной композиции защитной иммуногенной композиции против S. aureus.
Пример 30: необходимость разных антигенов для защиты от многочисленных возможных заболеваний, вызванных S. aureus
S. aureus вызывает широкий спектр инфекций, варьирующих от относительно мягких инфекций кожи до более серьезных и инвазивных инфекций, таких как эндокардит, некротизирующий фасцит, остеомиелит, септический артрит и пневмония. Каждый из этих сайтов in vivo является уникальным, и бактерии, по-видимому, отвечают на различия в стимулах среды изменением их профилей экспрессии антигенов на профили, наиболее подходящие для индивидуального штамма для колонизации, роста и, в конечном счете, вызова заболевания. Как проиллюстрировано в Примере 12, штаммы S. aureus демонстрируют разнообразие экспрессии антигенов in vivo. Многокомпонентная иммуногенная композиция, состоящая из разных антигенов, с большей вероятностью защитит против разнообразных болезненных проявлений, вызванных S. aureus.
Было показано, что ClfA защищает в моделях эндокардита и сепсиса у грызунов. Сообщали о том, что ClfB является важным при назальной колонизации S. aureus. MntC защищал мышей в мышиной модели бактериемии. Конъюгат СР5 защищал при пиелонефрите и эндокардите, и конъюгат СР8 защищал в моделях пиелонефрита и сепсиса у грызунов. Данные результаты демонстрируют то, что многокомпонентные вакцины, содержащие эти антигены, будут защищать против многих типов заболеваний, вызванных S. aureus.
Животные модели in vivo приблизительно соответствуют ходу реальной инфекции и помогают выяснить, какие антигены могут быть полезными при защите от конкретного заболевания. В Таблице 26 обобщены результаты из многочисленных экспериментов, проведенных на разных моделях in vivo. Результаты приведены в каждом блоке в виде четырех чисел, разделенных наклонной чертой, например, ClfA в модели сепсиса имеет числа 27/1/3/31. Первое число представляет собой число экспериментов, когда иммунизация ClfA давала статистически значимый положительный результат защиты. Второе число представляет собой число экспериментов, когда иммунизация ClfA давала положительный результат защиты, который демонстрировал тенденцию к значимости, но не был статистически значимым. Третье число представляет собой число экспериментов, когда иммунизация ClfA давала отрицательный результат, но он не был статистически значимым. Четвертое число представляет общее число проведенных экспериментов. Первые три числа при сложении должны давать четвертое число.
|
Пример 31: тестирование разных мультиантигенных иммуногенных композиций in vitro и in vivo
Разные мультиантигенные стафилококковые иммуногенные композиции, содержащие три, четыре или пять антигенов, выбранных из следующих полипептидов и/или полисахаридов: ClfA, ClfB, MntC, CP5- и СР8, тестировали на иммуногенность и эффективность в разных моделях in vivo. Иммуногенные композиции являются следующими:
(1) иммуногенная композиция, содержащая выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с CRM197, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с CRM197;
(2) во второй комбинации предложен фактор слипания A (ClfA), фактор слипания В (ClfB), выделенный MntC, выделенный стафилококковый капсульный полисахарид СР5, конъюгированный с CRM197, и выделенный стафилококковый капсульный полисахарид СР8, конъюгированный с CRM197;
(3) в третьей комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный полипептид фактора слипания В S. aureus (ClfB) или выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с CRM197, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с CRM197;
(4) в четвертой комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с CRM197, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с CRM197;
(5) в пятой комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания В S. aureus (ClfB), выделенный белок MntC S. aureus, выделенный капсульный полисахарид типа 5 S. aureus, конъюгированный с CRM197, и выделенный капсульный полисахарид типа 8 S. aureus, конъюгированный с CRM197; и
(6) в шестой комбинации предложена иммуногенная композиция, содержащая выделенный полипептид фактора слипания A S. aureus (ClfA), выделенный полипептид фактора слипания В S. aureus (ClfB) и выделенный белок MntC S. aureus.
rClfA и rClfB получают и очищают, как описано в Примере 1. MntC получают и очищают, как описано в Примере 2. Выделенные СР5 и СР8 получают и очищают, как описано в Примере 3, и конъюгируют с CRM197, как описано в Примере 4.
Более конкретно, методики, описанные в предыдущих примерах, приведенных выше, используют для измерения иммуногенности и эффективности. Исследования проводят для определения того, индуцирует ли каждый из трех, четырех или пяти компонентов иммунный ответ при доставке поодиночке или совместно. Такие же исследования используются для определения того, мешает ли присутствие любого одного из четырех или пяти компонентов способности любого из других трех или четырех компонентов индуцировать иммунный ответ. Кроме того, проводятся исследования для определения того, будут ли четыре или пять компонентов, протестированных поодиночке или протестированных совместно, давать защиту в любой одной или более чем одной животной модели, описанной выше. Четыре или пять компонентов вводят животному, например, мышам, крысам, кроликам или приматам, не являющимся человеком, в виде одной дозы или в виде многих доз, как отмечено в предыдущих примерах, приведенных выше. У животных берут кровь и сыворотку собирают и тестируют на присутствие антител к каждому из четырех или пяти компонентов. Присутствие антигенспецифичных антител измеряют любым иммуноанализом, известным специалистам в данной области, например, для оценки наличия или отсутствия антигенспецифичных антител используют ELISA (смотрите Примеры 11-29) или вестерн-блоттинг (смотрите Пример 1). Кроме того, для определения того, являются ли антигенспецифичные антитела эффективными при опосредовании умерщвления стафилококковых организмов клетками-фагоцитами, используют анализ опсонофагоцитирующей активности (смотрите Примеры 11-29).
Эффективность in vivo также оценивают с использованием любого одного или более чем одного исследования животных, описанного выше, такого как модель имплантированной трубки; мышиной моделью бактериемии; моделью инфекции раны; мышиной моделью пиелонефрита; крысиной моделью эндокардита и мышиной моделью сепсиса (смотрите примеры 11-30), но не ограничиваясь ими.
Пример 32: комбинации антигенов S. aureus генерируют антитела у приматов, не являющихся человеком, которые усиливают умерщвление штамма Pfe5-1 S. aureus
При использовании комбинаций антигенов наблюдали повышенную эффективность, как измерено с использованием анализа ОРА. Проводили исследование приматов, не являющихся человеком, где группы из 3-10 обезьян иммунизировали многокомпонентными вакцинами. Животные получали одиночную дозу вакцины, и титры ОРА отслеживали в сутки 0 и через две недели после вакцинации. Титры ОРА определяли как разведение сыворотки, требующееся для умерщвления 50% бактерий штамма Pfe5-1 S. aureus в анализе ОРА. Повышенную активность наблюдали для комбинации 4 антигенов по сравнению с 3-антигенной композицией вакцины (р=0,0272; Фиг.18).