Результат интеллектуальной деятельности: Амиды, сочетающие адамантановый и монотерпеновый фрагменты, используемые в качестве ингибиторов ортопоксвирусов
Вид РИД
Изобретение
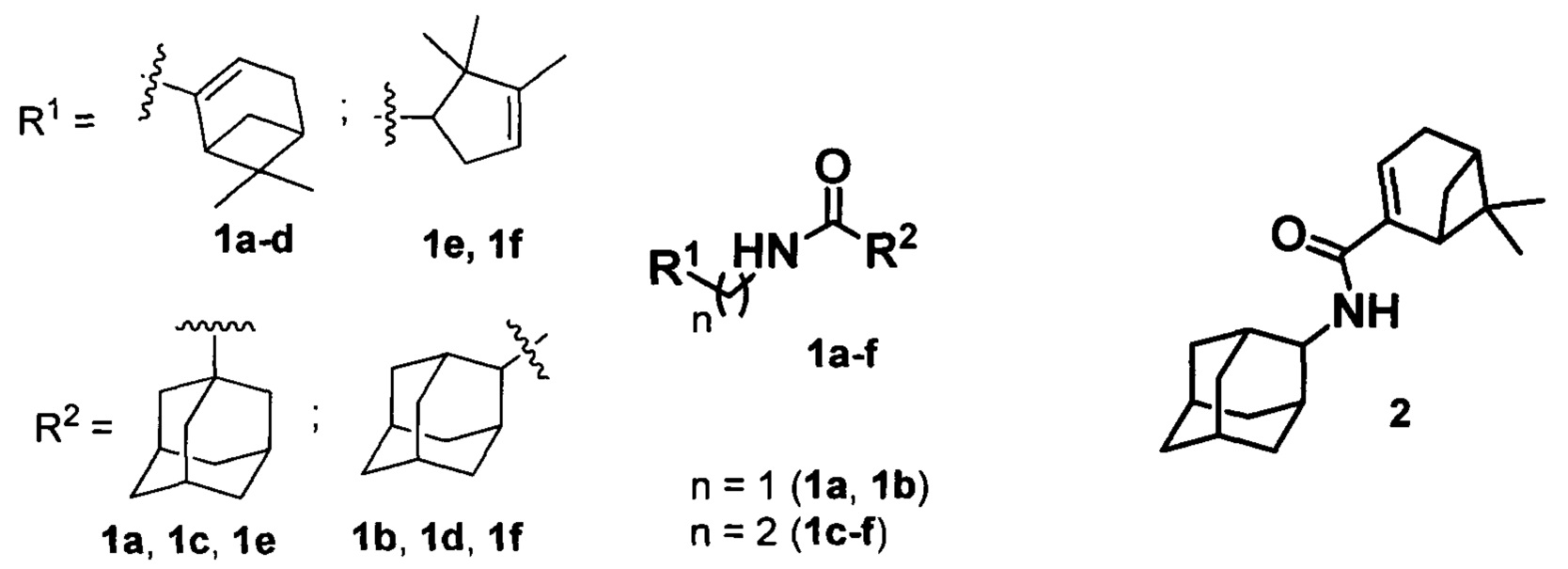
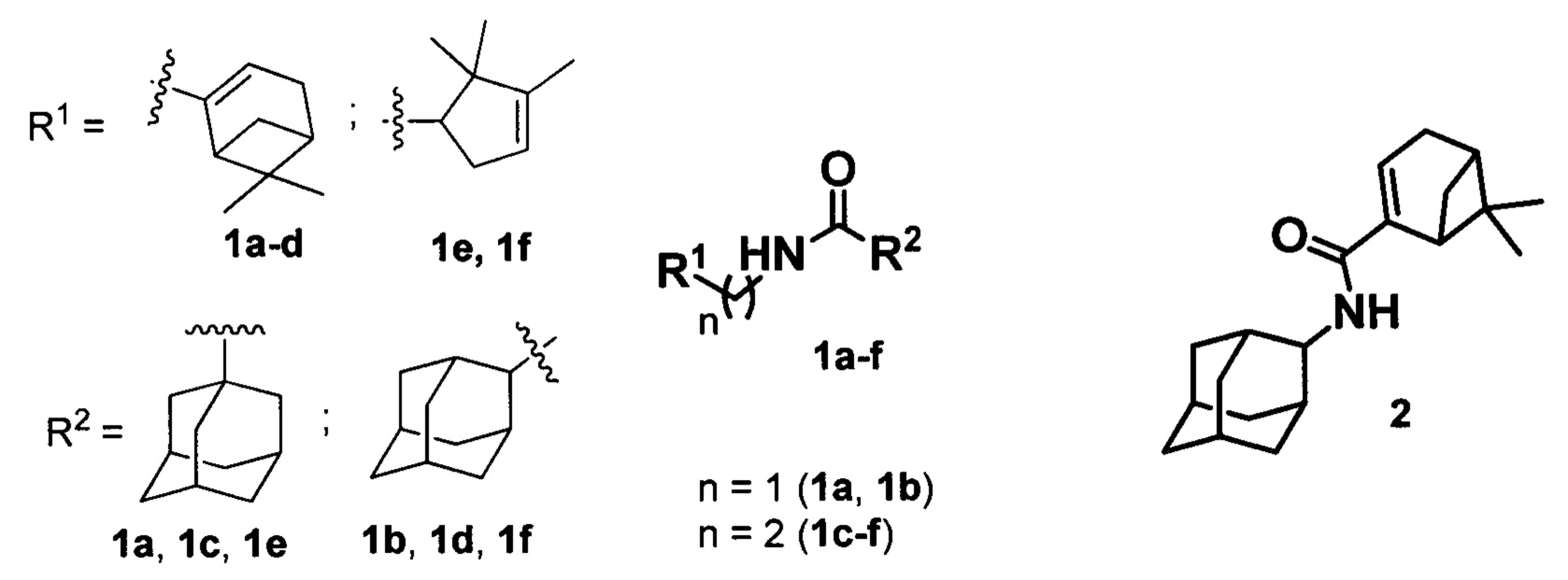
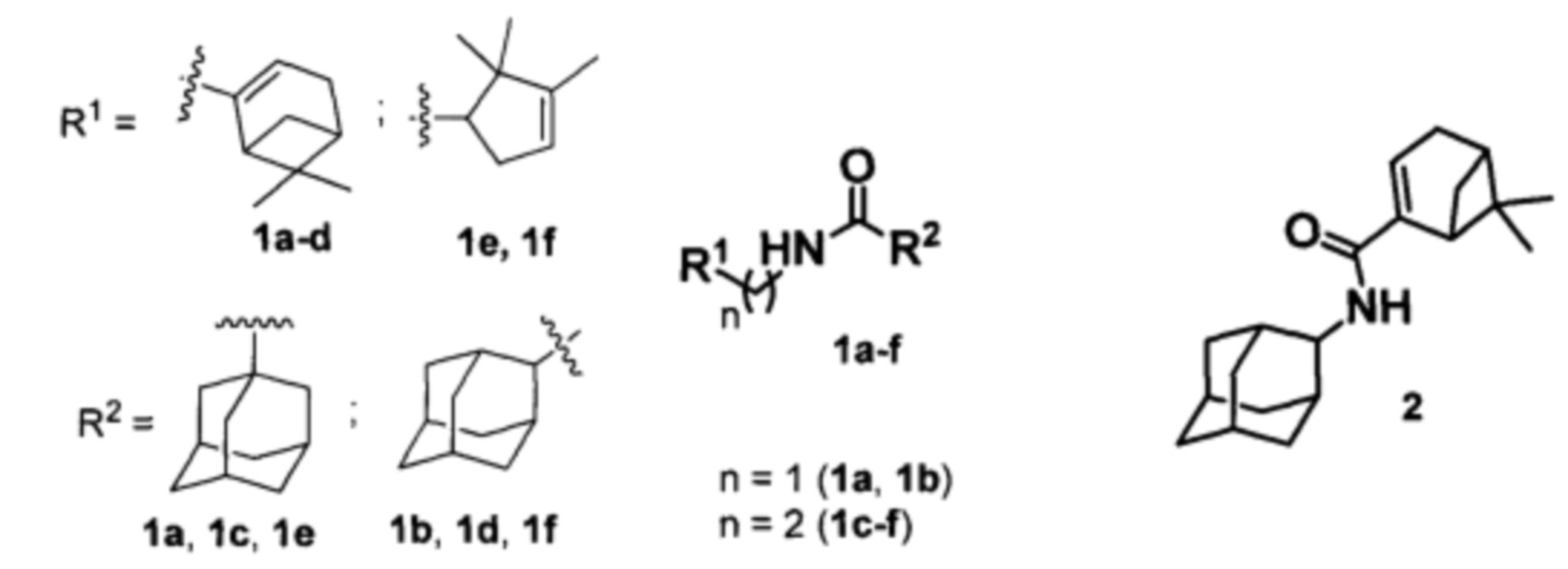
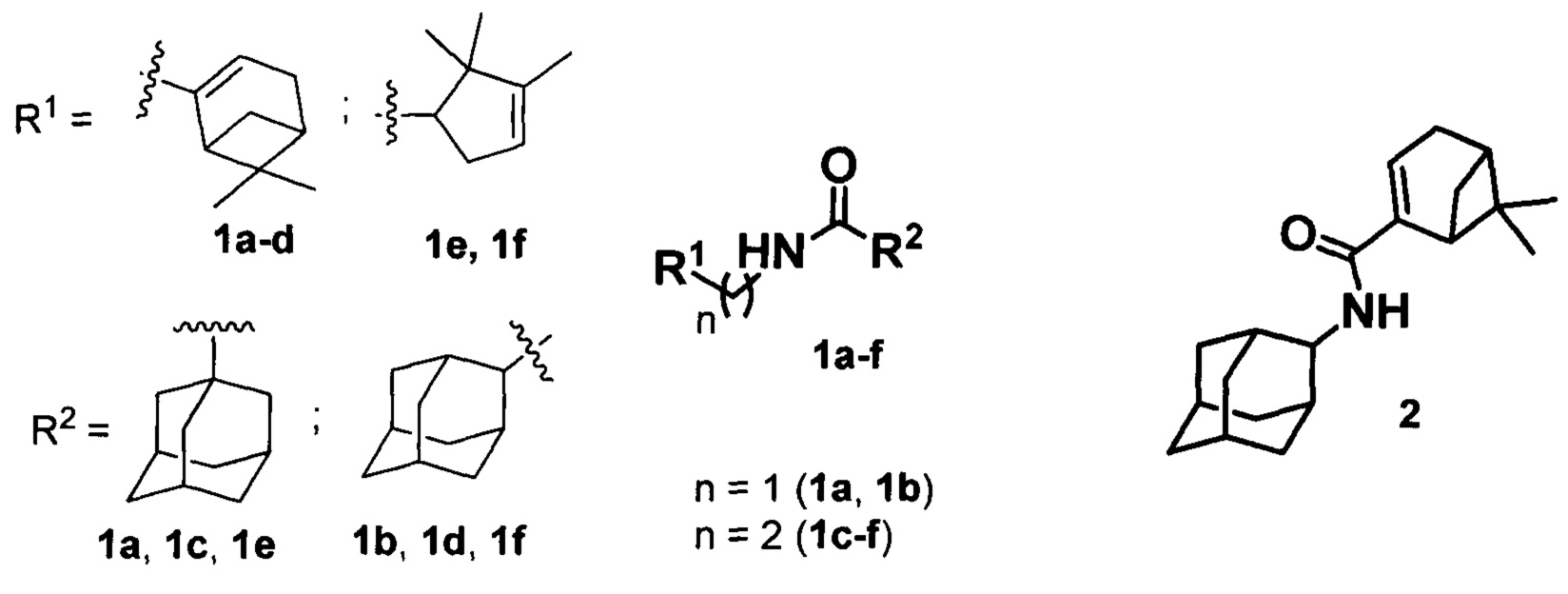
Изобретение относится к медицине, вирусологии и фармакологии, а именно к использованию соединений общей формулы 1a-g, где R1 фрагменты (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метила (1a, 1b), (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этила (1c, 1d), (2,2,3-триметилциклопент-3-ен-1-ил)метила (1e, 1f), R2 остаток 1- или 2-адамантана (1a-f), и 2 (включая их пространственные изомеры, в том числе стереоизомеры), в качестве ингибиторов репродукции ортопоксвирусов.
В 1980 г на Ассамблее Всемирной организации здравоохранения (ВОЗ) было объявлено об искоренении натуральной или черной оспы на планете, с этого же времени была прекращена вакцинация против вируса натуральной оспы (ВНО). Оспа стала первой болезнью в истории человечества, побежденной с помощью массовой вакцинации. В настоящее время, считается, что около 50% населения Земли не имеют иммунитета против ВНО. Вместе с тем, в отчете "Независимой консультативной группы по последствиям технологии синтетической биологии для общественного здравоохранения, связанных с оспой" для генерального директора ВОЗ было отмечено, что необходимо продолжение разработки новых низкомокулярных лекарственных средств [Идентификационный номер ВОЗ: WHO/HSE/PED/2015.1 (http://apps.who.int/iris/bitstream/10665/198357/l/WHO_HSE_PED_2015.1_eng.pdf?ua=1)]. Такой вывод связан с несколькими причинами. Во-первых, в настоящее время из-за климатических изменений существует угроза распространения ВНО из мерзлотных грунтов с останками умерших от оспы. Во-вторых, в связи с развитием и доступностью биотехнологий существует угроза воспроизведения ВНО или ему подобного вируса в террористических целях [Noyce R.S., Lederman S. & Evans D.H. PLoS One (2018) 13, 1-16]. Нельзя исключать также возможность нелегального хранения ВНО и преднамеренного использования против населения природных или рекомбинантных штаммов ВНО. Еще одним доводом в пользу разработки новых препаратов против ортопоксвирусов является то, что опасность для человека представляют и циркулирующие в популяциях животных другие ортопоксвирусы, например, вирусы оспы обезьян и оспы коров, которые эволюционируют, распространяются и периодически вызывают вспышки заболеваний среди людей. Например, последняя вспышка заболеваний у людей вирусом оспы обезьян была отмечена в Африке в 2016 г; стоит отметить, что смертность от этого заболевания может достигать 17% [Giulio D.B. Di & Eckburg Р.В. Lancet (2004) 4, 15-25; Mfinanga S. et al. Int. J. Infect. Dis. (2018) 78, 78-84].
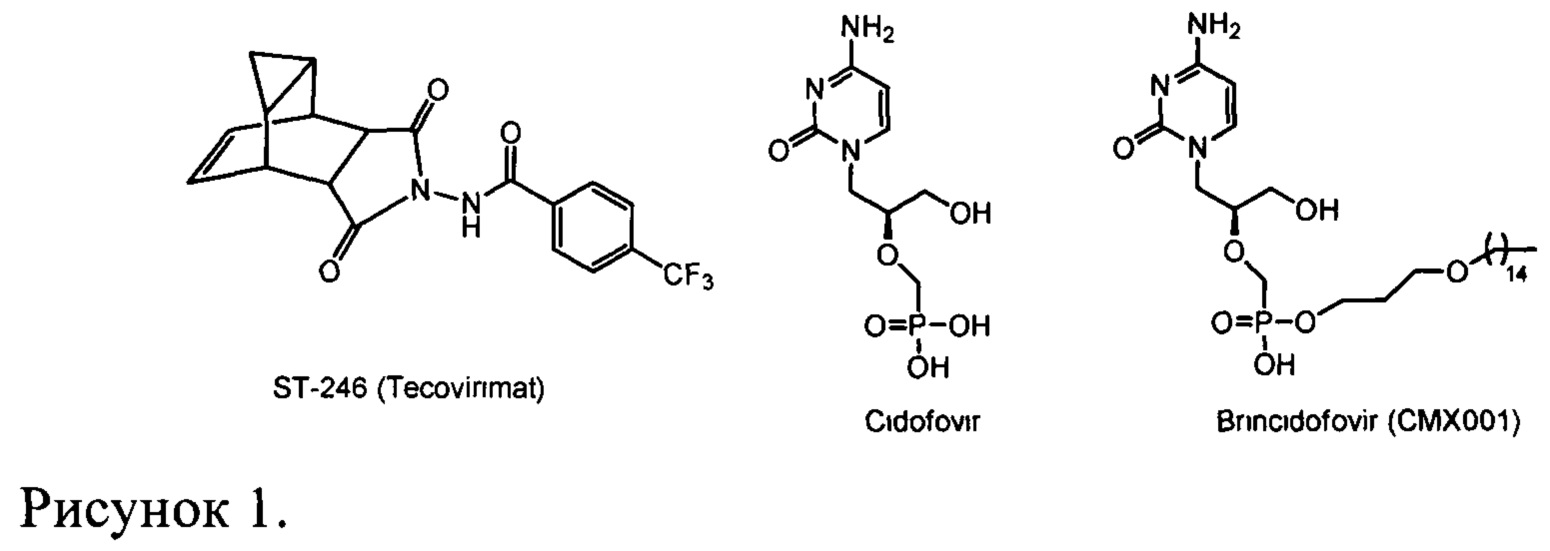
В настоящее время в Российской Федерации нет официально зарегистрированных химиопрепаратов для защиты людей от ВНО и других патогенных для человека ортопоксвирусов. Есть единственный препарат, разрешенный для лечении натуральной оспы и оспы обезьян на территории США, - ST-246 (Tecovirimat, ТРОХХ®, N-(6,8-диоксо-7-азатрицикло[3.3.2.02,4]дец-9-ен-7-ил)-4-(трифторметил)бензамидметил, Рис. 1) [FDA approves the first drug with an indication for treatment of smallpox. FDA News Release, https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm613496.htm, 13.07.2018]. Еще один противооспенный препарат находится на стадии клинических испытаний (СМХ001 (Brincidofovir, 3-(пентадецилокси)пропил((S)-1-(4-амино-2-оксопиримидин-1(2H)-ил)-3-гидроксипропан-2-илокси)метилфосфонат)) [Ноу S.M. Drugs (2018) 78 (13), 1377-1382]. Препарат СМХ001 (Brincidofovir) представляет собой липофильный нуклеотидный аналог Цидофовира (Cidofovir, CDV, Vistide®) (Рис. 1). CDV (Vistide®) является противовирусным препаратом, используемым для лечения цитомегаловирусного ретинита, при этом он проявляет активность в летальных моделях ортопоксвирусной инфекции на мышах и обезьянах [Идентификационный номер ВОЗ: WHO/HSE/GAR/BDP/2010.3/RUS (http://whqlibdoc.who.int/hq/2010/WHO_HSE_GAR_BDP_2010.3_rus.pdf?ua=1)]. Было показано, что Цидофовир имеет низкую пероральную биодоступность и может быть токсичным для почек, кроме того этот препарат оказался не эффективным при его использовании после проявления оспенных поражений у зараженных ВНО обезьян. В случае же СМХ001, на моделях с применением мелких грызунов было обнаружено, что он не обеспечивает достаточный уровень защиты от летальной инфекции мышей вирусом эктромелии [Parker S., Chen N.G., Foster S. et al. Antiviral Res. 2012. 94(1). 44-53]. ST-246 был разработан SIGA Technologies Inc. (США). Его механизм действия отличается от механизма CDV, который ингибирует репликацию вирусной ДНК. Мишенью ST-246 является высококонсервативный вирусный кодируемый белок р37, присутствующий во всех ортопоксвирусах.
В 2010 г. ВОЗ был опубликован отчет "Научный обзор исследований вируса натуральной оспы 1999-2010 г" [Идентификационный номер ВОЗ: WHO/HSE/GAR/BDP/2010.3/RUS (http://whqlibdoc.who.int/hq/2010/WHO_HSE_GAR_BDP_2010.3_rus.pdf?ua=1)] и замечания консультативной группы независимых экспертов ВОЗ по обзору программы исследования натуральной оспы (AGIES) по данному обзору [Идентификационный номер ВОЗ: WHO/HSE/GAR/BDP/2010.4 (http://whqlibdoc.who.int/hq/2010/WHO_HSE_GAR_BDP_2010.4_rus.pdf?ua=1)]. Эксперты AGIES в отношении СМХ001 и ST-246 отметили следующее: "Развитие резистентности было описано во время проведения экспериментов по пассированию in vitro с участием каждого из этих лекарств… AGIES полагает, что на продвинутых стадиях разработки было бы желательно продолжать исследования в направлении создания дополнительных обладающих активностью против ортопоксвирусов лекарств, механизмы действия которых отличаются от механизмов действия лекарств, находящихся на продвинутых стадиях разработки."
Некоторые производные адамантана обладают противовирусной активностью [Wanka L., Iqbal K. & Schreiner P.R. Chem. Rev. (2013) 113, 3516-604]. Среди них обнаружен ингибитор вируса осповакцины 1H-индол-2,3-дион-3-(N-2-адамантилтиосемикарбозон) (3) (рис. 2), который после трехчасовой экспозиции в культуре клеток в концентрации 2 мкг/мл привел к снижению репродукции вируса осповакцины на 42% [Kreutzberger А.,  Н.-Н. & Stratmann J. Arch. Pharm. (Weinheim). (1984) 317, 767-771]. Выраженным ингибирующим действием на вирус осповакцины обладают некоторые замещенные аминоацетил-адамантиламины (например, соединение 4, рис. 2), аминоалкоксиацетил-адамантиламины (например, соединение 5, рис. 2) и тромантадин 6 [May G., Peteri D. Arzneimittel Forschung (Drug research) (1973) 23(5), S.718]. В работе [Kreutzberger A. &
Н.-Н. & Stratmann J. Arch. Pharm. (Weinheim). (1984) 317, 767-771]. Выраженным ингибирующим действием на вирус осповакцины обладают некоторые замещенные аминоацетил-адамантиламины (например, соединение 4, рис. 2), аминоалкоксиацетил-адамантиламины (например, соединение 5, рис. 2) и тромантадин 6 [May G., Peteri D. Arzneimittel Forschung (Drug research) (1973) 23(5), S.718]. В работе [Kreutzberger A. &  H.-H. Arch. Pharm. (Weinheim). (1974) 307, 766-774] показано, что N-1-адамантил-2,2-дифенилацетамид (7) (рис. 2) в концентрации 2 мкг/мл снижает репродукцию вируса осповакцины в культуре клеток от 72 до 100%. Однако в этих работах отсутствуют данные по токсичности соединений, что не дает возможности оценить практический потенциал этих соединений. В то же время, ряд 1-адамантил-тиосемикарбазонов (соединения 8-9, рис. 2) и тиокарбогидразонов (соединения 10-13, рис. 2) не проявили активности против вируса осповакцины [Kolocouris A. et al. Bioorganic Med. Chem. Lett. (2002) 12, 723-727]. Отметим, что для представленных соединений их активность на других типах ортопоксвирусов не изучалась.
H.-H. Arch. Pharm. (Weinheim). (1974) 307, 766-774] показано, что N-1-адамантил-2,2-дифенилацетамид (7) (рис. 2) в концентрации 2 мкг/мл снижает репродукцию вируса осповакцины в культуре клеток от 72 до 100%. Однако в этих работах отсутствуют данные по токсичности соединений, что не дает возможности оценить практический потенциал этих соединений. В то же время, ряд 1-адамантил-тиосемикарбазонов (соединения 8-9, рис. 2) и тиокарбогидразонов (соединения 10-13, рис. 2) не проявили активности против вируса осповакцины [Kolocouris A. et al. Bioorganic Med. Chem. Lett. (2002) 12, 723-727]. Отметим, что для представленных соединений их активность на других типах ортопоксвирусов не изучалась.
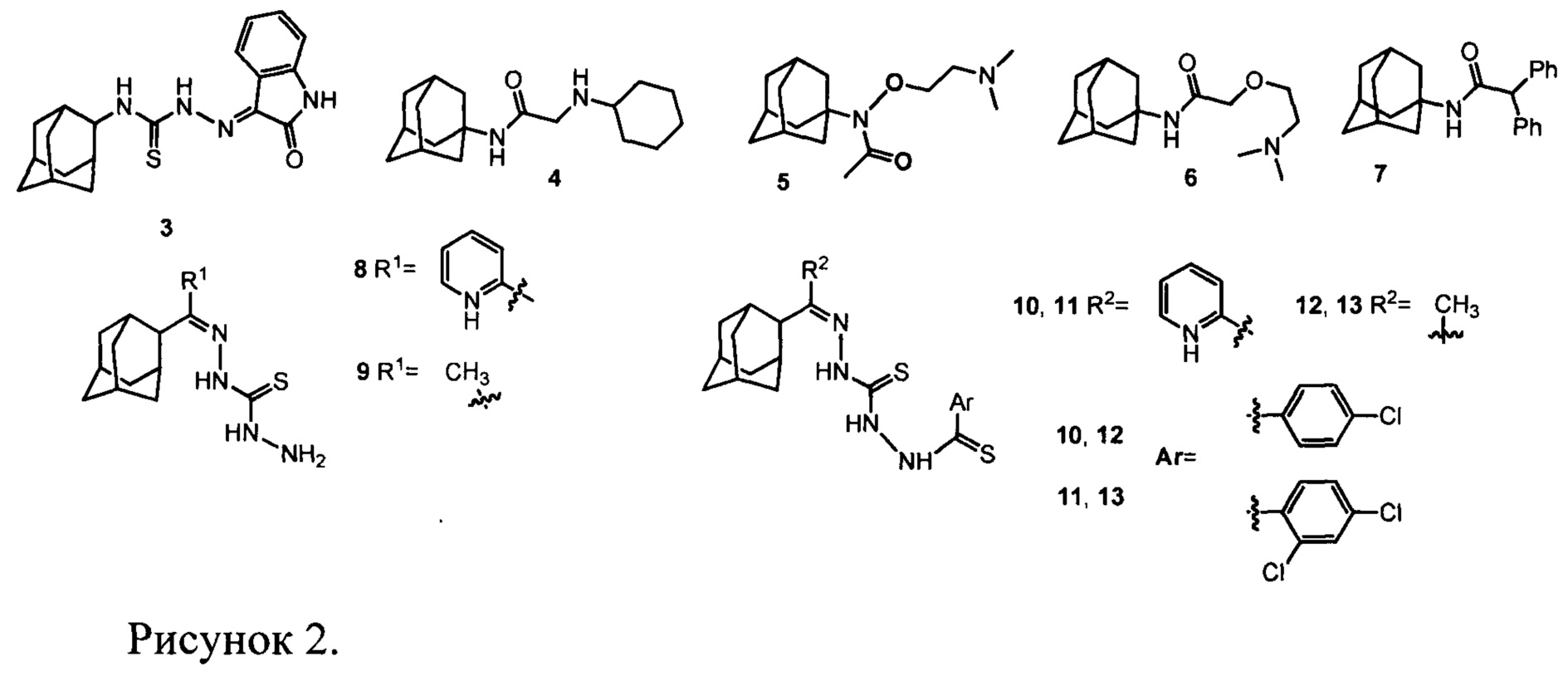
Наиболее близким к заявляемым соединениям 1 и 2 прототипом, являются соединения 4, 6, 7. Однако для этих соединений отсутствуют данные об их активности в отношении других вирусов из рода Orthopoxvirus, а также ничего не известно об их токсичности, что делает невозможным оценку их практической применимости.
Задачей изобретения является создание нового класса эффективных ингибиторов репродукции вирусов из рода Orthopoxvirus., обладающих высокой антивирусной активностью в сочетании с низкой токсичностью и, соответственно, высоким индексом селективности.
Технический результат: расширение ассортимента ингибиторов репродукции ортопоксвирусов.
Поставленная задача решается новыми соединениями общей формулы 1a-f, где R1 фрагменты (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метила (1а, 1b), (6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)этила (1c, 1d), (2,2,3-триметилциклопент-3-ен-1-ил)метила (1e, 1f), R2 остаток 1- или 2-адамантана (1a-f), и 2 (включая их пространственные изомеры, в том числе оптически активные формы):
Соединения общей формулы 1 и 2, после проведения углубленных фармакологических исследований, могут использоваться, как в чистом виде, так и в качестве компонентов новых низкотоксичных высокоэффективных препаратов против вирусов из рода Orthopoxvirus.
Синтез амидов 1a-f осуществлялся по схеме 1 взаимодействием соответствующих хлорангидридов кислот 16а, b с аминами 15а-с (Схема 1).
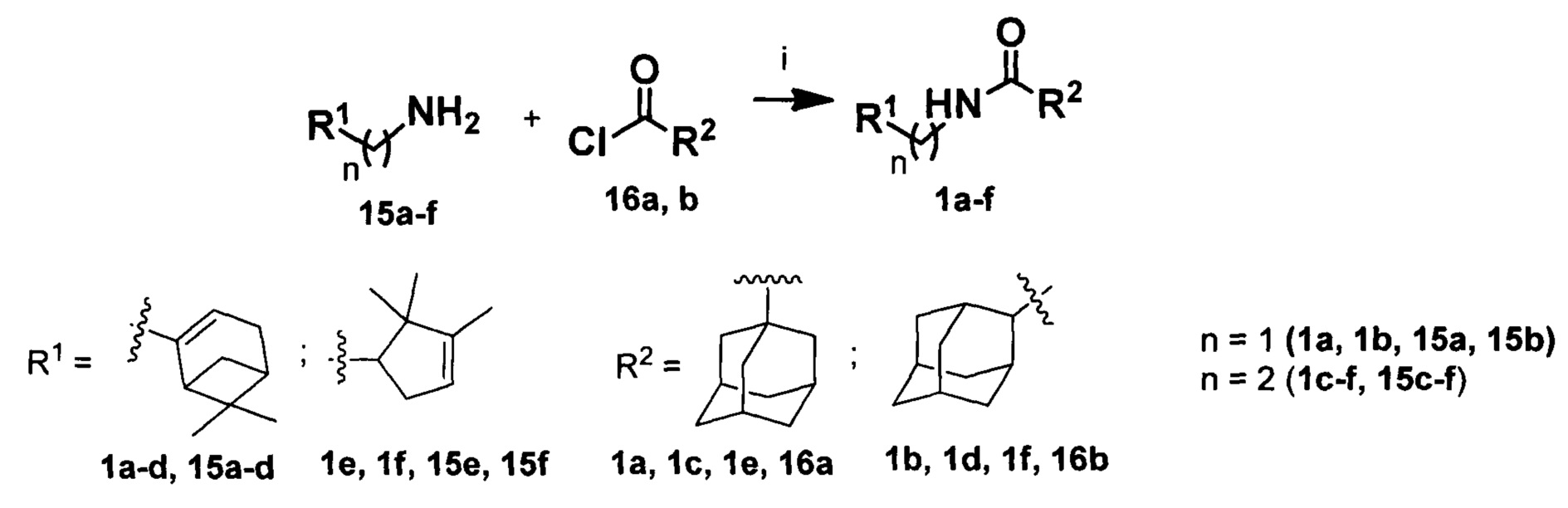
Схема 1. Реагенты и условия: (i) Et3N, толуол; 0°С.
Для получения амидов типа 1a-f, содержащих адамантановый фрагмент, первоначально были синтезированы некоторые монотерпеновые амины.
Эти соединения могут быть получены, например, из миртенола (19) и нопола (20) по следующей схеме: взаимодействием спиртов с PBr3 с последующим превращением полученных бромпроизводных по реакции Габриеля в соответствующие амины (15а) и (15b) (Схема 2). Синтез амина (15с) осуществлялся восстановлением LiAlH4 оксима полученного из камфаленового альдегида 21 (Схема 2). Амины (15а), (15b) и (15с) были описаны ранее в работах [Midland М.М., Kazubski A.J. Org. Chem. (1992) 57, 2953-2956; Sen S.E., Roach S.L. Synthesis. (1994) 1995, 756-758; Паплавская И.А., Горяев М.И., ЖОХ, (1963) 33(5), 1495-1496]. Соединения (15а), (15b) и (15с) использовались далее без предварительной очистки.
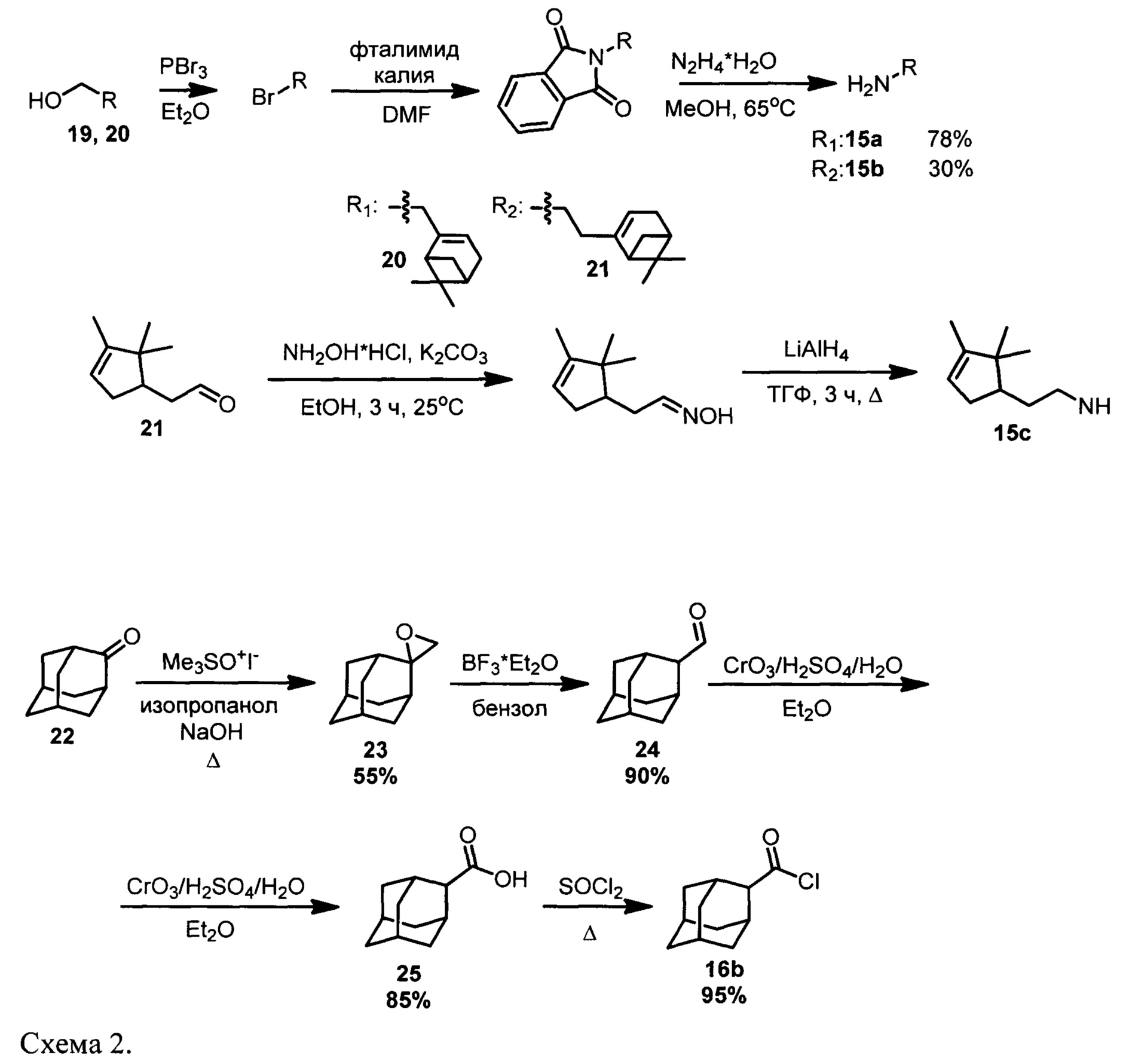
Хлорангидрид 1-адамантан карбоновой кислоты (16а) - коммерчески доступный реагент. Его изомер, хлорангидрид 2-адаманатан карбоновой кислоты (16b), был синтезирован исходя из адамантанона-2 (22). Методика синтеза хлорангидрида (16b) включала получение соответствующего оксирана 23 взаимодействием 22 с триметилсульфоксонием иодидом [Mukherjee A. et al. J. Org. Chem. (1994) 59(12), 3270-3274], раскрытие эпоксидной группы до альдегидной, окисление альдегида 24 до кислоты 25 реагентом Джонса [Madder A. et al. J. Chem. Soc., Perkin Trans. (1997) 2. 12, 2787-2784]. Выход 2-адамантан карбоновой кислоты 25, после очистки хроматографией на силикагеле, составил 85%. Хлорангидрид 2-адамантан карбоновой кислоты (16b) был получен по методике [Molle G. et al. J. Org. Chem., (1982) 47(21), 4120-4128] кипячением кислоты 25 в SOCl2 (Схема 2).
Амиды 1a-f были получены взаимодействием хлорангидридов 16а, 16b и аминов 15а-с с выходами от 31 до 55%.
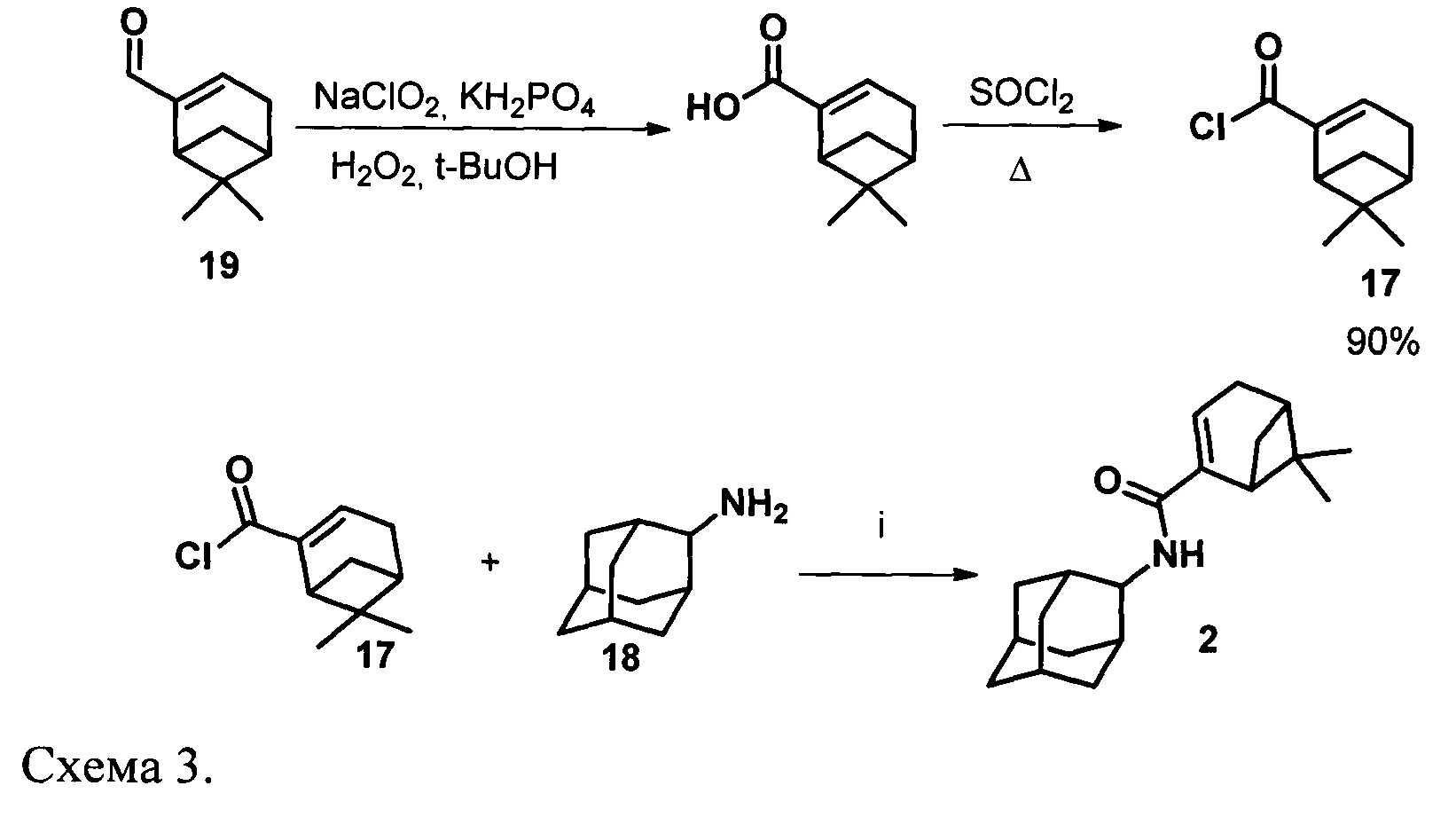
Синтез амида 2 осуществлялся по схеме 3 взаимодействием соответствующих хлорангидрида 17 с амином 18 (Схема 3).
Для синтеза амида типа 2 нами был получен хлорангидрид миртеновой кислоты (17) окислением миртеналя (19) хлоритом натрия в слабокислых условиях по методике [Pat. 6444687 US. Substituted imidazole neutopeptide Y Y5 Receptor antagonists / Stamford, A.A., Boyle, C.D.; Schering corporation (USA) - 03.09.02. - 26 pp. (Chem. Abstr. 2005:319778)] до соответствующей кислоты (Схема 3) и последующим кипячением с SOCl2. Взаимодействие (18) с 2-аминоадамантаном (18) привело к образованию соответствующего амида типа 2 (Схема 3).
Цитотоксичность и противовирусную активность синтезированных производных в отношении вирусов оспавакцины (штамм Копенгаген), оспы коров (Гришак) и оспы мышей (эктромелии, штамм К-1) оценивали с использованием адаптированного колориметрического метода в культуре клеток Vero [Селиванов Б.А., Тихонов А.Я., Беланов Е.Ф., Бормотов Н.И., и др. Химико-фармацевтический журнал. (2017) 51(6), 13-17]. В качестве положительного контроля использовался коммерчески доступный препарат Цидофовир (Heritage Consumer Products, LLC, США).
Изобретение иллюстрируется следующими примерами:
Спектральные исследования выполнены в Химическом исследовательском центре коллективного пользования СО РАН. Величины удельного вращения определяли на спектрометре PolAAr 3005. Удельное вращение выражено в (град⋅мл)⋅(г⋅дм)-1, концентрация раствора (г)⋅(100 мл)-1. Спектры ЯМР 1Н (δ, м.д., J/Гц) и 13С (δ, м.д.) регистрировали на спектрометре Bruker DRX-500 (1Н: 500.13 МГц, 13С: 125.76 МГц) для растворов веществ в CDCl3; в качестве внутреннего стандарта использовали остаточные сигналы хлороформа (δH 7.24, δC 76.90 м.д.). Строение полученных соединений установлено на основе анализа спектров ЯМР 1Н с привлечением спектров двойного резонанса 1Н - 1Н и двумерных спектров гомоядерной 1Н - 1Н корреляции (COSY), а также анализа спектров ЯМР 13С с привлечением двумерных спектров гетероядерной 13С - 1Н корреляции на прямых (COSY, 1JC,H 135 Гц) и дальних константах спин-спинового взаимодействия (COLOC, 2,3JC,H 10 Гц). Мультиплетность сигналов в спектрах ЯМР 13С определяли по спектрам, записанным в режиме J-модуляции (JMOD). Нумерация атомов в соединениях дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Масс-спектры высокого разрешения записывали на спектрометре DFS ThermoScientific в режиме полного сканирования в диапазоне m/z 0-500, ионизация электронным ударом 70 эВ при прямом вводе образца. Анализ фракций и наблюдения за ходом превращений осуществляли методом ГЖХ на приборе Agilent 7820А, кварцевая колонка НР-5 (сополимер 5%-дифенил-95%-диметоксисилоксан) длиной 30 м, внутренний диаметр 0.25 мм, толщина стационарной фазы 0.25 мкм, детектор пламенно-ионизационный, газ-носитель Не (скорость потока 2 мл/мин., деление потока 99:1), температурный режим 120-280°С, нагрев 20°С/мин.. Растворители перед использованием сушились и перегонялись.
Пример 1. N-(((1R,5S)-6,6-Диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)адаманатан-1-карбоксамид 1а.
К раствору монотерпенового амина (16а) (0.16 г, 1 ммоль, 1 экв) в толуоле (7 мл) при 0°С прикапывали раствор хлорангидрида 1- адамантан карбоновой кислоты (17а) (0.2 г, 1 ммоль, 1 экв) и триэтиламина (0.17 мл, 1.2 ммоль, 1.2 экв) в толуоле (3 мл). Реакционную смесь перемешивали 10 минут при комнатной температуре, растворитель отгоняли, остаток растворяли в EtOAc (25 мл), и промывали последовательно водными растворами 5% NaOH (20 мл), 5% HCl (20 мл) и насыщенным раствором NaCl (20 мл). Органическую фазу сушили над Na2SO4, упаривали. Амиды 1а выделили в чистом виде методом колоночной хроматографии с выходом 32%.
N-(((1R,5S)-6,6-Диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)адаманатан-1-карбоксамид 1а.
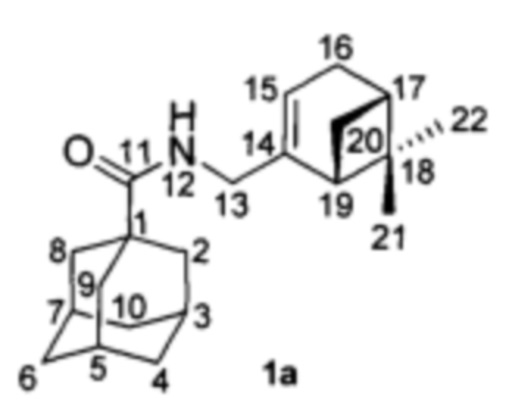
1Н-ЯМР (CDCl3): 0.81 (с, 3Н, Н-22); 1.12 (д, J(20анти, 20син)=8.6 Гц, 1Н, Нанти-20); 1.24 (с, 3Н, Н-21); 1.64-1.74 (м, 6Н, 2Н-4, 2Н-6, 2Н-10); 1.82 (д, 6Н, 3J=3.0 Гц, 2Н-2, 2Н-8, 2Н-9); 1.99 (ддд, 1Н, J(19, 17)=J(19, 20син)=5.6 Гц, J(19, 15)=1.5 Гц, Н-19); 1.99-2.03 (м, 3Н, Н-3, Н-5, Н-7); 2.05-2.09 (м, 1Н, Н-17); 2.18 (д.м, 1Н, 2J=17.7 Гц, Н-16); 2.25 (д.м, 1Н, 2J=17.7 Гц, Н'-16); 2.35 (ддд, 1Н, J(20син, 20анти)=8.6 Гц, J(20син, 17)=J(20син, 19)=5.6 Гц, Нсин-20); 3.69 (ддм, 1Н, 2J=15.6 Гц, J(13, NH)=5.4 Гц, Н-13); 3.78 (ддм, 1Н, 2J=15.2, J(13', NH)=6.0 Гц, Н'-13); 5.32-5.35 (м, 1Н, Н-15); 5.45-5.52 (ш.м 1Н, NH).
13С-ЯМР (CDCl3): 40.58 (с, C-1), 39.26 (т, С-2, С-8, С-9), 28.04 (д, С-3, С-5, С-7), 36.43 (т, С-4, С-6, С-10), 177.54 (с, С-11), 43.70 (т, С-13), 144.82 (с, С-14), 118.20 (д, С-15), 31.02 (т, С-16), 40.65 (д, С-17), 37.82 (с, С-18), 43.90 (д, С-19), 31.39 (т, С-20), 26.00 (к, С-21), 21.13 (к, С-22).
HR MS: 313.2396 (М+, C21H31O1N1+; вычислено 313.2400).
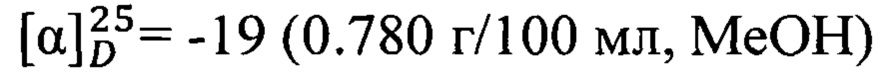
Пример 2. N-(((1R,5S)-6,6-Диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)адамантан-2-карбоксамид 1b.
Амиды 1b был получен по методике приведенной в примере 1 с выходом 46%.
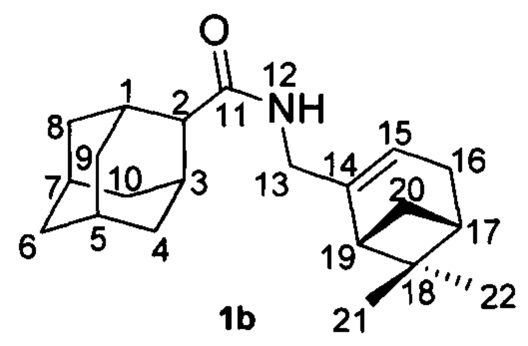
1Н-ЯМР (CDCl3): 0.80 (с, 3Н, Н-22); 1.13 (д, J(20анти, 20син)=8.7 Гц, 1H, Нанти-20); 1.24 (с, 3H, Н-21); 1.57-1.62 (м, 2Н, Н-4, Н-9); 1.69-1.77 (м, 4Н, 2Н-6, Н-8, Н-10); 1.80-1.84 (м, 1Н, Н-5 или Н-7); 1.84-1.95 (м, 5Н, Н'-4, Н-7 или Н-5, Н'-8, Н'-9, Н'-10); 2.04 (ддд, 1Н, J(19, 17)=J(19, 20син)=5.6 Гц, J(19, 15)=1.4 Гц, Н-19); 2.05-2.09 (м, 1Н, Н-17); 2.18 (дм, 1Н, 2J=17.7 Гц, Н-16); 2.20-2.28 (м, 3H, Н-1, Н-3, Н'-16); 2.35 (ддд, 1Н, J(20син, 20анти)=8.7 Гц, J(20син, 17)=J(20син, 19)=5.6 Гц, Нсин-20); 2.42-2.45 (м, 1Н, Н-2); 3.76 (ддм, 1Н, 2J=15.1 Гц, J(13, NH)=6.0 Гц, Н-13); 3.83 (ддм, 1Н, 2J=15.1 Гц, J(13', NH)=6.0 Гц, Н'-13); 5.34-5.37 (м, 1Н, Н-15); 5.45-5.56 (ш.м, 1Н, NH).
13С-ЯМР (CDCl3): 30.00 д и 29.81 д (С-1, С-3), 49.98 (д, С-2), 33.21 т и 33.28 т (С-4, С-9), 27.30 д и 27.39 д (С-5, С-7), 37.26 (т, С-6), 38.25 (т, С-8, С-10), 173.71 (с, С-11), 43.85 (т, С-13), 144.92 (с, С-14), 118.47 (д, С-15), 31.03 (т, С-16), 40.65 (д, С-17), 37.83 (с, С-18), 43.93 (д, С-19), 31.44 (т, С-20), 25.99 (к, С-21), 21.02 (к, С-22).
HR MS: 313.2402 (M+, C21H31O1N1+; вычислено 313.2400).
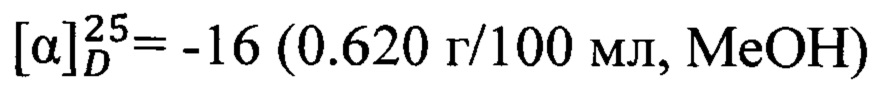
Пример 3. N-(2-((1R,5S)-6,6-Диметилбицикло[3.1.1]гепт-2-ен-2-ил)этил)адамантан-1-карбоксамид 1с.
Амиды 1с был получен по методике, приведенной в примере 1 с выходом 31%.
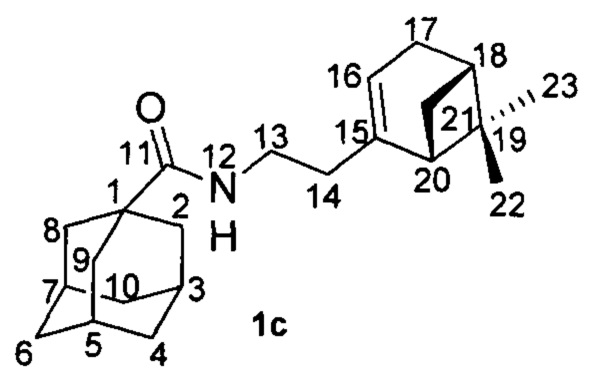
1Н-ЯМР (CDCl3): 0.81 (с, 3H, Н-23); 1.08 (д, 1Н, 2J=8.6 Гц, Нанти-21); 1.24 (с, 3H, Н-22); 1.62-1.73 (м, 6Н, 2Н-4, 2Н-6, 2Н-10); 1.79 (д, 6Н, 3J=3.0 Гц, 2Н-2, Н-8, 2Н-9); 1.97-2.04 (м, 4Н, Н-3, Н-5, Н-7, Н-20); 2.05-2.14 (м, 3H, 2Н-14, Н-18); 2.19 (дм, 1Н, 2J=17.7 Гц, Н-17); 2.25 (дм, 1Н, 2J=17.7 Гц, Н'-17); 2.36 (ддд, 1Н, 2J=8.6 Гц, J(21цис, 18)=J(21цис, 20)=5.6 Гц, Нцис-21); 3.14-3.29 (м, 2Н, 2Н-13); 5.25-5.28 (м, 1Н, Н-16); 5.59 (ш.с, 1Н, NH).
13С-ЯМР (CDCl3): 40.41 (с, С-1), 39.12 (т, С-2, С-8, С-9), 28.00 (д, С-3, С-5, С-7), 36.41 (т, С-4, С-6, С-10), 177.57 (с, С-11), 36.36 (т, С-13), 36.30 (т, С-14), 145.47 (с, С-15), 118.59 (д, С-16), 31.24 (т, С-17), 40.54 (д, С-18), 37.72 (с, С-19), 45.10 (д, С-20), 31.67 (т, С-21), 26.05 (к, С-22), 21.12 (к, С-23).
HR MS: 327.2552 (M+, C22H33O1N1+; вычислено 327.2557).
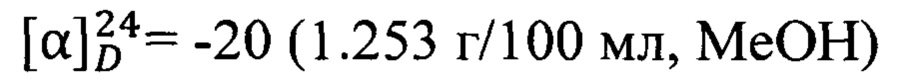
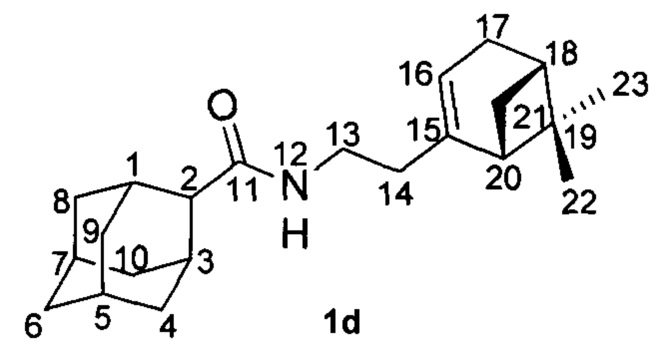
Пример 4. N-(2-((1R,5S)-6,6-Диметилбицикло[3.1.1]гепт-2-ен-2-ил)этил)адамантан-2-карбоксамид 1d.
Амиды 1d был получен по методике приведенной в примере 1 с выходом 31%.
1Н-ЯМР (CDCl3): 0.78 (с, 3H, Н-23); 1.06 (д, 1Н, 2J=8.7 Гц, Нанти-21); 1.22 (с, 3H, Н-22); 1.53-1.58 (ш.д, 2Н, 2J=12.8 Гц, Н-4, Н-9); 1.66-1.73 (м, 4Н, 2Н-6, Н-8, Н-10); 1.76-1.80 (м, 1Н, Н-5 или Н-7); 1.81-1.91 (м, 5Н, Н'-4, Н-7 или Н-5, Н'-8, Н'-9, Н'-10); 2.01 (ддд, 1Н, J(20, 18)=J(20, 21цис)=5.6 Гц, J(20, 16)=1.3 Гц, Н-20); 2.03-2.07 (дм, 1Н, Н-18); 2.09-2.24 (м, 6Н, Н-1, Н-3, 2Н-14, 2Н-17); 2.33 (ддд, 1Н, 2J=8.7 Гц, J(21цис, 18)=J(21цис, 20)=5.6 Гц, Нцис-21); 2.36-2.39 (м, 1Н, Н-2); 5.23-5.26 (м, 1Н, Н-16); 5.64-5.70 (ш.м, 1Н, NH).
13С-ЯМР (CDCl3): 29.75 д и 29.80 1 (С-1, С-3), 49.85 (д, С-2), 33.12 т и 33.13 (С-4, С-9), 27.23 д и 27.31 д (С-5, С-7), 37.19 (т, С-6), 38.19 (т, С-8, С-10), 173.63 (с, С-11), 36.49 (т, С-13, С-14), 145.38 (с, С-15), 118.35 (д, С-16), 31.17 (т, С-17), 40.52 (д, С-18), 37.69 (с, С-19), 45.14 (д, С-20), 31.55 (т, С-21), 26,02 (к, С-22); 20.95 (к, С-23).
HR MS: 327.2560 (M+, C22H33O1N1+; вычислено 327.2557).
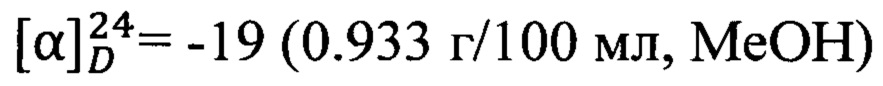
Пример 5. N-(2-((R)-2,2,3-Триметилциклопент-3-ен-1-ил)этил)адамантан-1-карбоксамид 1е.
Амиды 1е был получен по методике приведенной в примере 1 с выходом 55%.
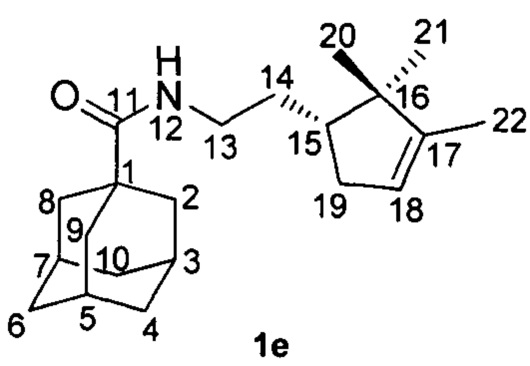
1Н-ЯМР (CDCl3): 0.71 (с, 3H, Н-21); 0.92 (с, 3H, Н-20); 1.35-1.43 (м, 1Н, Н-14); 1.55 (м, 3H, Н-22); 1.55-1.72 (м, 8Н, 2Н-4, 2Н-6, 2Н-10, Н'-14, Н-15); 1.80 (д, 6Н, 3J=3.0, 2Н-2, 2Н-8, 2Н-9); 1.80-1.85 (м, 1Н, Н-19); 1.97-2.01 (м, 3H, Н-3, Н-5, Н-7); 2.23-2.29 (м, 1Н, Н-19'); 3.13-3.20 (м, 1Н, Н-13); 3.23-3.30 (м, 1Н, Н'-13); 5.16-5.19 (м, 1Н, Н-18); 5.62 (ш.с, 1Н, NH).
13С-ЯМР (CDCl3): 40.36 (с, С-1), 39.14 (т, С-2, С-8, С-9), 27.99 (д, С-3, С-5, С-7), 36.38 (т, С-4, С-6, С-10), 177.62 (с, С-11), 38.68 (т, С-13), 29.92 (т, С-14), 47.93 (д, С-15), 46.66 (с, С-16), 148.35 (с, С-17), 121.42 (д, С-18), 35.37 (с, С-19), 25.56 (к, С-20), 19.51 (к, С-21), 12.41 (к, С-22).
HR MS: 315.2553 (M+, C21H33O1N1+; вычислено 315.2557).
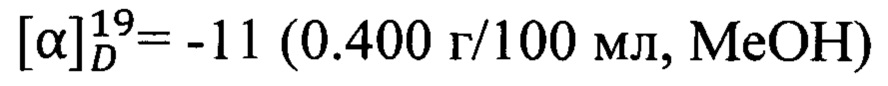
Пример 6. N-(2-((R)-2,2,3-Триметилциклопент-3-ен-1-ил)этил)адамантан-1-карбоксамид 1f.
Амиды 1f был получен по методике приведенной в примере 1 с выходом 55%.
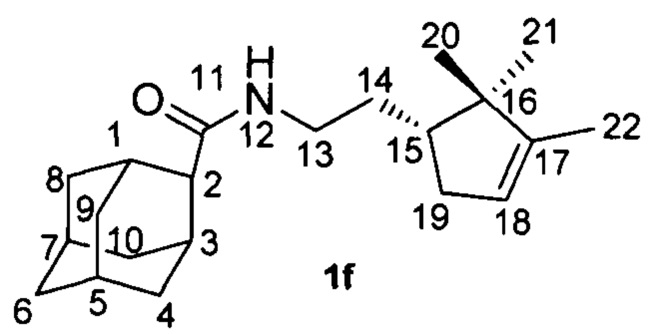
Выход 55%. 1Н-ЯМР (CDCl3): 0.74 (с, 3H, Н-21); 0.95 (с, 3H, Н-20); 1.39-1.47 (м, 1Н, Н-14); 1.58 (м, 3H, все J <3.0 Гц, Н-22); 1.58-1.67 (м, 3H, Н-4, Н-9, Н'-14); 1.70-1.77 (м, 5Н, 2Н-6, Н-8, Н-10, Н-15); 1.79-1.95 (м, 7Н, Н'-4, Н-5, Н-7, Н'-8, Н'-9, Н'-10, Н-19); 2.22-2.26 (м, 2Н, Н-1, Н-3); 2.30 (ддм, 1Н, 2J=15.3, J(19', 15)=7.8, другие J ≤ 3.0 Гц, Н'-19); 2.41 (ш.с, 1Н, Н-2); 3.20-3.28 (м, 1H, Н-13); 5.19-5.22 (м, 1H, Н-18); 5.64 (ш.с, 1Н, NH).
13С-ЯМР (CDCl3): 29.89 д и 29.94 д (С-1, С-3), 49.89 (д, С-2), 33.22 т (т, С-4, С-9), 27.29 д и 27.39 д (С-5, С-7), 37.27 (т, С-6); 38.27 (т, С-8, С-10); 173.90 (с, С-11), 38.73 (т, С-13), 30.11 (т, С-14), 47.90 (д, С-15), 46,72 (с, С-16), 148.44 (с, С-17), 121.46 (д, С-18), 35.36 (т, С-19), 25.64 (к, С-20), 19.59 (к, С-21), 12.47 (к, С-22).
HR MS: 315.2558 (M+, C21H33O1N1+; вычислено 315.2557).
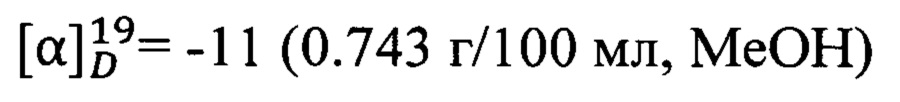
Пример 7. (1R,5S)-N-(Адамантан-2-ил)-6,6-диметилбицикло[3.1.1]гепт-2-ен-2-карбоксамид 1g.
К раствору 2-аминоадамантана (19) (0.15 г, 1 ммоль, 1 экв) в толуоле (7 мл) при 0°С прикапывали раствор хлорангидрида кислоты (18) (0.2 г, 1 ммоль, 1 экв) и триэтиламина (0.17 мл, 1.2 ммоль, 1.2 экв) в толуоле (3 мл). Реакционную смесь перемешивали 24 часа при комнатной температуре, растворитель отгоняли, остаток растворяли в EtOAc (25 мл), и промывали последовательно водными растворами 5% NaOH (20 мл), 5% HCl (20 мл) и насыщенным раствором NaCl (20 мл). Органическую фазу сушили над Na2SO4, упаривали. Полученный 1g амид выделяли колоночной хроматографией с выходом 30%.
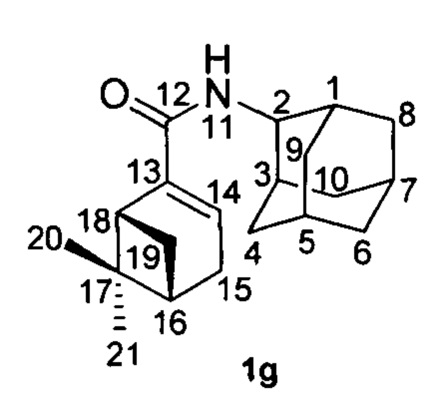
1Н-ЯМР (CDCl3): 0.80 (с, 3H, Н-21); 1.15 (д, J(19анти, 19син)=9.0 Гц, 1Н, Нанти-19); 1.31 (с, 3H, Н-20); 1.61-1.65 (м, 2Н, Н-4, Н-9); 1.71-1.76 (м, 4Н, Н'-4, 2Н-6, Н'-9); 1.79-1.86 (м, 6Н, Н-5, Н-7, 2Н-8, 2Н-10); 1.90-1.94 (м, 2Н, Н-1, Н-3); 2.09-2.13 (м, 1Н, Н-16); 2.33 (ддд, 1Н, 2J=19.0 Гц, J(15, 14)=J(15, 16)=3.0, Н-15); 2.39 (ддд, 1Н, 2J=19.0 Гц, J(15', 14)=J(15', 16)=3.0, Н'-15); 2.44 (ддд, 1Н, J(19син, 19анти)=9.0 Гц, J(19син, 16)=J(19син, 18)=5.7 Гц, Нсин-19); 2.60 (ддд, 1Н, J(18, 16)=J(18, 19син)=5.7 Гц, J(18, 14)=1.7 Гц, Н-18); 4.03-4.07 (м, 1Н, Н-2); 5.98 (ш.д, 1Н, J(11, 2)=8.0 Гц, NH); 6.30-6.33 (м, 1Н, Н-14).
13С-ЯМР (CDCl3): 31.77 д и 31.78 д (С-1, С-3), 52.85 (д, С-2), 31.96 т и 31.97 т (С-4, С-9), 27.00 д и 27.13 д (С-5, С-7), 37.42 (т, С-6); 36.98 (т, С-8, С-10); 166.21 (с, С-12), 144.27 (с, С-13), 127.93 (д, С-14), 31.52 (т, С-15), 40.37 (д, С-16), 37.69 (с, С-17), 42.01 (д, С-18), 31.32 (т, С-19), 25.90 (к, С-20), 20.85 (к, С-21).
HR MS: 299.2242 (М+, C20H29O1N1+; вычислено 299.2244).
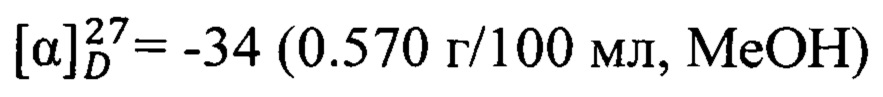
Пример 8. Определение цитотоксичности и противовирусного действия соединений 1 a-f и 2 в отношении вирусов осповакцины (штамм Копенгаген), оспы коров (Гришак) и оспы мышей (штамм К-1) в культуре клеток Vero
Цитотоксичность и противовирусную активность синтезированных производных в отношении вирусов оспавакцины, оспы коров и оспы мышей оценивали с использованием адаптированного колориметрического метода в культуре клеток Vero [Селиванов Б.А., Тихонов А.Я., Беланов Е.Ф., Бормотов Н.И., и др. Химико-фармацевтический журнал. (2017) 51(6), 13-17]. В качестве положительного контроля использовался коммерчески доступный препарат Cidofovir (HeritageConsumerProducts, LLC, США).
В работе были использованы типичные представители ортопоксвирусов - вирус осповакцины (штамм Копенгаген), оспы коров (Гришак) и эктромелии (оспы мышей, штамм К-1), полученные из Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ БВ «Вектор» Роспотребнадзора.
Вирусы нарабатывали в культуре клеток Vero. Концентрацию вирусов в культуральной жидкости определяли путем титрования методом бляшек в культуре клеток Vero, рассчитывали и выражали в десятичных логарифмах бляшко-образующих единиц в 1 мл (lg БОЕ/мл). Концентрация вирусов в использованных в работе образцах составляла от 5,6 до 6,1 lg БОЕ/мл. Наработанные и использованные в работе серии вирусов с указанным титром хранили при -70°С.
Оценку противовирусной эффективности препаратов проводили по адаптированной и модифицированной нами методике [Селиванов Б.А., Тихонов А.Я., Беланов Е.Ф., Бормотов Н.И., и др. Химико-фармацевтический журнал. (2017) 51(6), 13-17]. В качестве препарата сравнения использовали коммерчески доступный препарат Цидофовир (Cidofovir, Vistide) производства GileadSciencesInc. (США).
В лунки 96-луночных планшетов, содержащих монослой клеток Vero в 100 мкл среды DMEM с 2% эмбриональной сыворотки, сначала вносили по 50 мкл серийных разведений исследуемых соединений, а потом - по 50 мкл разведения ортопоксвируса в дозе 1000 БОЕ/лунку. Токсическая активность соединений определялась по гибели клеток под воздействием препарата в лунках планшета, в которые вирус не вносили. В качестве контролей использовали монослои клеток в лунках планшета, в которые вносили вирус без соединений (контроль вируса) и монослои клеток в лунках, в которые не вносили ни вирус, ни соединения (контроль культуры клеток). После инкубирования в течение 4 сут, монослой клеток окрашивали витальным красителем нейтральным красным в течение 1,5 ч. После удаления красителя и отмывки лунок от его несвязавшейся фракции добавляли лизирующий буфер. Количество красителя, адсорбированное живыми клетками монослоя, оценивали по оптической плотности (ОП), которая является показателем количества неразрушенных под влиянием вируса клеток в монослое. ОП измеряли на спектрофотометре Emax (MolecularDevices, США) при длине волны 490 нм. Учет результатов проводили с использованием планшетного спектрофотометра Emax и программы SoftMax 4.0 (MolecularDevices, США), которая автоматически рассчитывала 50% цитотоксическую концентрацию (ТС50 в мкг/мл) и 50% вирус ингибирующую (эффективную) концентрацию (IC50 в мкг/мл) препаратов. В таблице 1 приведены пересчитанные данные в мкмоль/л. По соотношению 50% цитотоксической и эффективной концентраций определяли индекс селективности (SI) препарата в отношении вируса: SI=TC50/IC50 (таблица 1).
Примечание: ТС50 - 50%-я цитотоксическая концентрация, при которой разрушаются 50% клеток в неинфицированном монослое; IC50 - 50%-я вирус ингибирующая концентрация, при которой сохраняется 50% клеток в инфицированном монослое; в виде M±Sm, где М - среднее, Sm - стандартное отклонение, n=3 - число измерений ТС50 и IC50; SI - индекс селективности препарата (TC50/IC50).
Наибольшую активность амиды типа 1a-f и 2 показали в отношении вируса осповакцины (штамм Копенгаген) и оспы мышей (штамм К-1). При этом стоит отметить, что при сравнении производных 1-адамантан карбоновой кислоты (соединения 1а, 1с, 1е) и 2-адамантан карбоновой кислоты (соединения 1b, 1d, 1f) первые оказываться более активными (Таблица 1). Данная тенденция наблюдается для всех типов изучаемых ортопоксвирусов: вирус осповакцины (штамм Копенгаген), вирусы оспы коров (штамм Гришак) и оспы мышей (эктромелии, штамм К-1). Все исследованные соединения 1 и 2 оказались на порядок более активными в отношении вируса осповакцины (ВОВ), чем препарат сравнения Цидофовир.
Практически все исследуемые соединения оказались менее цитотоксичными, чем препарат сравнения Цидофовир в два и более раз, только амиды 1d и 1f показали сравнимую с Цидофовир токсичность для клеток линии Vero (Таблица 1).
Благодаря сочетанию высокой активности и низкой цитотоксичности, разработанные соединения 1 и 2 обладают высоким индексом селективности, что делает перспективным их практическое применение.
Таким образом, нами обнаружен новый тип высокоэффективных низкотоксичных ингибиторов ортопоксвирусов.