Результат интеллектуальной деятельности: ПОЛИПЕПТИД ДЛЯ ИНГИБИРОВАНИЯ МИГРАЦИИ И ИНВАЗИИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Вид РИД
Изобретение
Изобретение относится к экспериментальной медицине и молекулярной биофармакологии и может быть использовано в качестве средства для ингибирования миграции и инвазии рака предстательной железы.
Описана анти-пролиферативная активность природного ингибитора ангиогенеза эндостатина в отношении рака предстательной железы, реализуемая посредством антагонистического воздействия на андрогеновые рецепторы опухолевых клеток [Lee J.H. et al. Endostatin: A novel inhibitor of androgen receptor function in prostate cancer. Proceedings of the National Academy of Sciences, T. 112, №5, C. 1392-1397 (2015)]. В случае андроген-независимого рака простаты показана возможность блокирования опухолевого роста с помощью эндостатина за счет подавления оксидативного стресса [Lee J.H. et al. Endostatin inhibits androgen-independent prostate cancer growth by suppressing nuclear receptor-mediated oxidative stress. The FASEB Journal, T. 31, №4, C. 1608-1619 (2017)]. Примечательно, что основную терапевтическую ценность полноразмерной молекулы эндостатина несет в себе фрагмент из 27 аминокислотных остатков, соответствующий N-концевой последовательности белка [Sjin R.M.T.T. et al. A 27-amino-acid synthetic peptide corresponding to the NH2-terminal zinc-binding domain of endostatin is responsible for its antitumor activity. Cancer Research, T. 65, №9, C. 3656-3663 (2005)]. Несмотря на сравнительную доклиническую активность эндостатина и его фрагментов, монотерапия на основе ингибиторов ангиогенеза показала весьма ограниченную эффективность на этапе клинических испытаний. При этом отмечено, что терапевтический эффект, реализуемый эндостатином и его полипептидными фрагментами, достигается преимущественно за счет воздействия на эндотелиальные клетки кровеносных сосудов и подавления кровоснабжения в опухолевом очаге.
В известных работах данных о прямом ингибирующем воздействии эндостатина на миграцию и инвазию клеток рака предстательной железы не обнаружено. Вместе с тем показана способность RGD-производного эндостатина оказывать анти-миграционный и анти-инвазивный эффекты в отношении гепатоцеллюлярной карциномы путем воздействия на αvβ3 интегриновый сигнальный путь [Li S. et al. RGD-modified endostatin peptide 30 derived from endostatin suppresses invasion and migration of HepG2 through the αvβ3 pathway. Cancer Biotherapy and Radiopharmaceuticals, T. 26, №5, C. 529-538 (2011)]. RGD трипептид представляет собой последовательность из аргинина, глицина и аспарагиновой кислоты, блокирующую связывание αv интегринов с компонентами внеклеточного матрикса и способную подавлять активацию интегрин-зависимых онкогенных сигнальных путей, обеспечивающих адгезию, миграцию и инвазию опухолевых клеток [Hatley R.J.D. et al. An alphav-RGD Integrin Inhibitor Toolbox: Drug Discovery Insight, Challenges and Opportunities. Angewandte Chemie, T. 57, C. 3298-3321 (2018)]. В частности, известен способ ингибирования роста опухолей головного мозга с помощью RGD-содержащих полипептидных антагонистов αv интегринов [патент RU 2255765, конвенционный приоритет 21.01.2000]. При раке предстательной железы описан способ подавления образования de novo, а также прогрессии костного метастазирования с помощью не пептидного антагониста αv интегриновых рецепторов GLPG0187 [van der Horst G. et al. Targeting of αv-Integrins in Stem/Progenitor Cells and Supportive Microenvironment Impairs Bone Metastasis in Human Prostate Cancer. Neoplasia, T. 13, №6, C. 516-525 (2011)]. Также показано использование моноклонального антитела против αv интегриновых рецепторов Абитузумаба (DI17E6, EMD 525797) с целью ингибирования прогрессии рака предстательной железы, в том числе за счет подавления миграции и инвазии опухолевых клеток [Jiang Y. et al. Abituzumab Targeting of αv-Class Integrins Inhibits Prostate Cancer Progression. Molecular Cancer Research, T. 15, №7, C. 875-883 (2017)].
Приведенные данные свидетельствуют о важности взаимодействия αv интегриновых рецепторов опухолевых клеток и внеклеточного матрикса в реализации инвазивного потенциала рака предстательной железы. Вместе с этим известно, что терапевтический эффект эндостатина связан с блокированием α5β1 интегринов эндотелиальных клеток кровеносных сосудов RGD-независимым образом [Wickstrom S.A. et al. Endostatin Associates with Integrin α5β1 and Caveolin-1, and Activates Src via a Tyrosyl Phosphatase-dependent Pathway in Human Endothelial Cells. Cancer Research, T. 62, C. 5580-5589 (2002)]. В имеющейся литературной базе работ по использованию RGD-производных полипептидных фрагментов эндостатина в качестве антагонистов αv интегриновых рецепторов, способных ингибировать миграцию и инвазию клеток рака предстательной железы, не обнаружено.
Наиболее близким аналогом изобретения является peptide 30, представляющий собой активный фрагмент N-концевой последовательности эндостатина, в котором аминокислотные остатки в положениях 25-30 заменены на RGDRGD гексапептид [Li S. et al. RGD-modified endostatin peptide 30 derived from endostatin suppresses invasion and migration of HepG2 through the αvβ3 pathway. Cancer Biotherapy and Radiopharmaceuticals, T. 26, №5, C. 529-538 (2011)]. При этом в экспериментах in vitro с гепатоцеллюлярной карциномой Li и соавторы (2011) доказали способность peptide 30 подавлять активность интегрин-зависимых матриксных металлопротеиназ (ММР) -2 и -9, отвечающих за миграцию и инвазию опухоли.
Задачей настоящего изобретения является получение средства для ингибирования миграции и инвазии рака предстательной железы.
Технический результат - получение анти-миграционной и анти-инвазивной активности полипептидного фрагмента эндостатина в отношении рака предстательной железы в результате слияния гексапептида RGDRGD с участком NH2-конца эндостатина (с 1 по 24 аминокислотные остатки).
Сущность изобретения: применение полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, в качестве средства для ингибирования адгезии, миграции и инвазии рака предстательной железы, подавления активности αv интегринов и фосфорилирования FAK, снижения экспрессии ММР-7 и ММР-9 в опухолевых клетках.
Известно применение полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, в качестве ингибитора ангиогенеза и подавления прогрессии клеток рака желудка и шейки матки [патент CN 104530199А от 22.04.2015]. Также имеются данные о прямом ингибирующем воздействии полипептида на миграцию и метастазирование колоректальной карциномы в результате антагонизма с αvβ3 интегринами опухолевых клеток [Yu S. et al. РЕР06 polypeptide 30 exerts antitumour effect in colorectal carcinoma via inhibiting epithelial mesenchymal transition. British journal of pharmacology, T. 175, №11, C. 3111-3130(2018)].
Однако до настоящего времени ни в одном исследовании не было предложено применение полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, в качестве средства для ингибирования миграции и инвазии рака предстательной железы.
Оценку адгезивных свойств клеток рака предстательной железы в результате применения полипептида с аминокислотной последовательностью, соответствующей SEQ ID NO: 1, проводили с использованием фибронектинового матрикса. Характер воздействия полипептида на миграцию и инвазию раковых клеток изучали в ходе эксперимента «заживления раны» и Transwell инвазии, соответственно. Экспрессию белков исследовали с помощью Вестерн блот анализа.
Краткое описание графических материалов
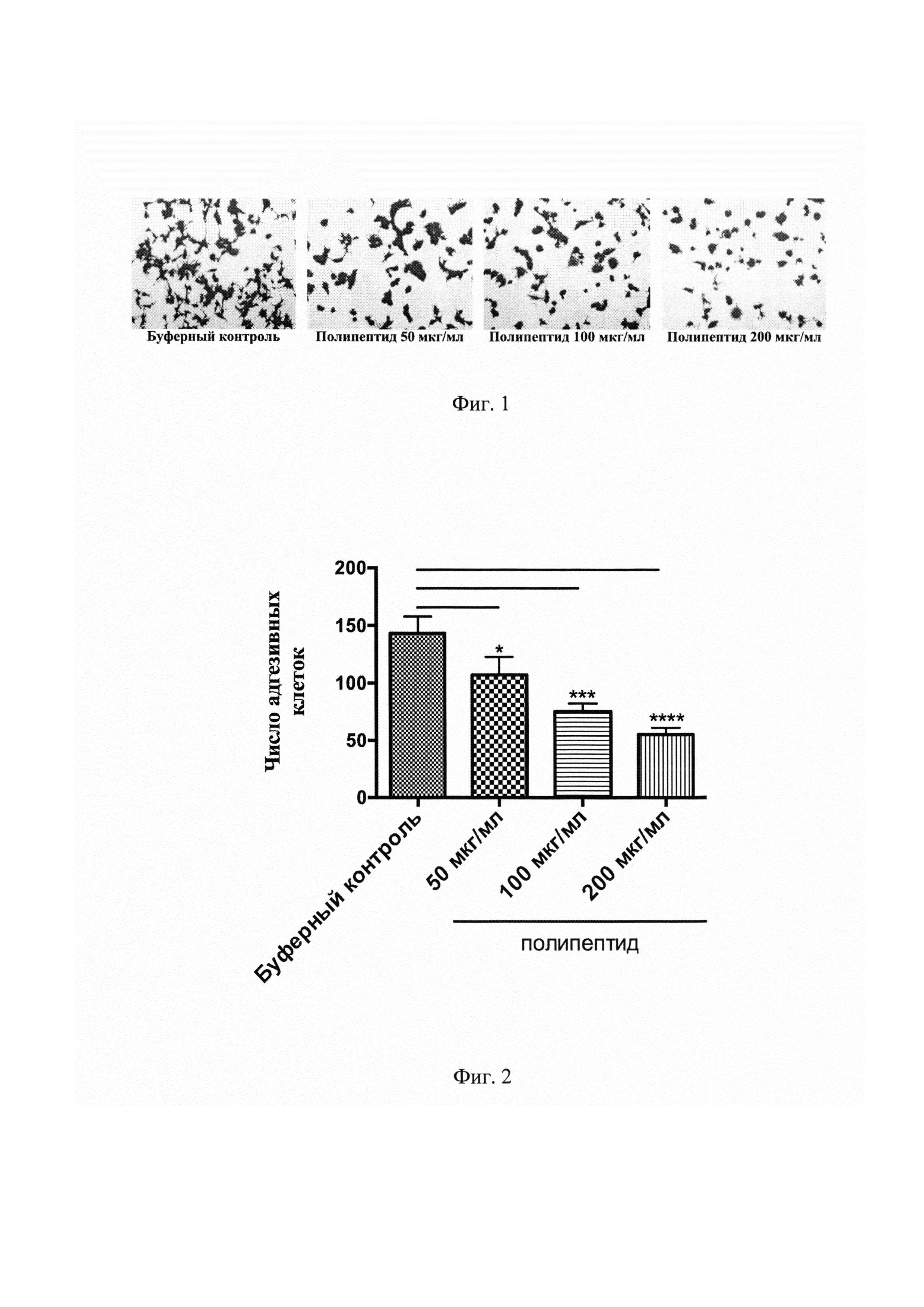
На Фиг. 1 представлены результаты фотомикроскопии адгезивных LNCaP клеток, инкубированных с указанными разведениями веществ на фибронектиновом матриксе в течение 24 часов. Адгезивные клетки окрашены раствором кристального фиолетового.
На Фиг. 2 представлен график, показывающий число адгезивных LNCaP клеток в каждой из указанных групп при 24-часовой инкубации на фибронектине. *Р<0,05, ***Р<0,001, ****P<0,0001 по сравнению с буферным контролем.
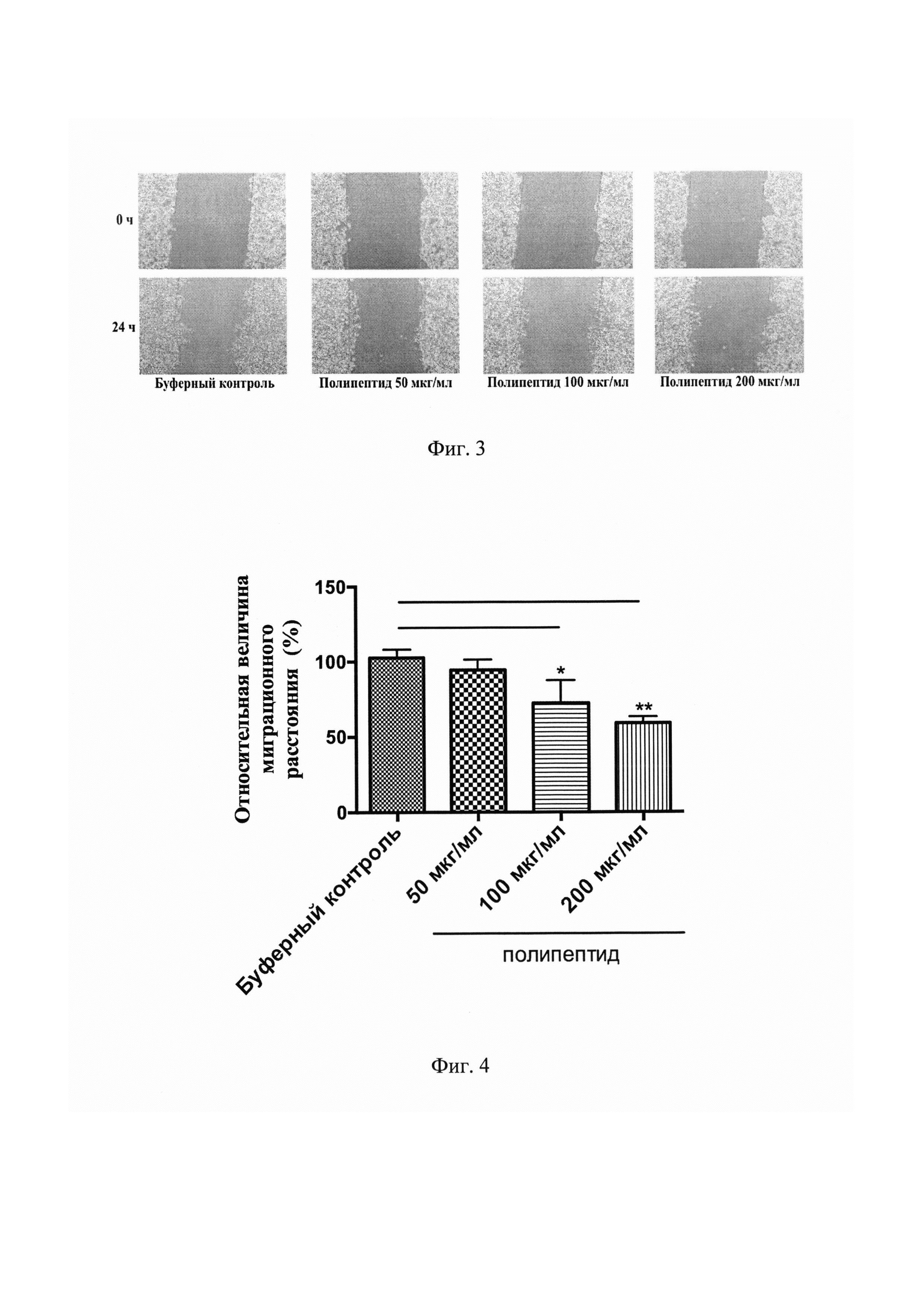
На Фиг. 3 представлены результаты нативной фотомикроскопии, демонстрирующие динамику «заживления» экспериментальных царапин-ран на монослое LNCaP культур за счет клеточной миграции в каждой из указанных групп в течение 24 часов.
На Фиг. 4 представлен график, демонстрирующий сокращение просвета «экспериментальной раны» (нм) за счет миграции LNCaP клеток из краев царапин в каждой группе за 24 часа. *Р<0,05, **P<0,01 по сравнению с буферным контролем.
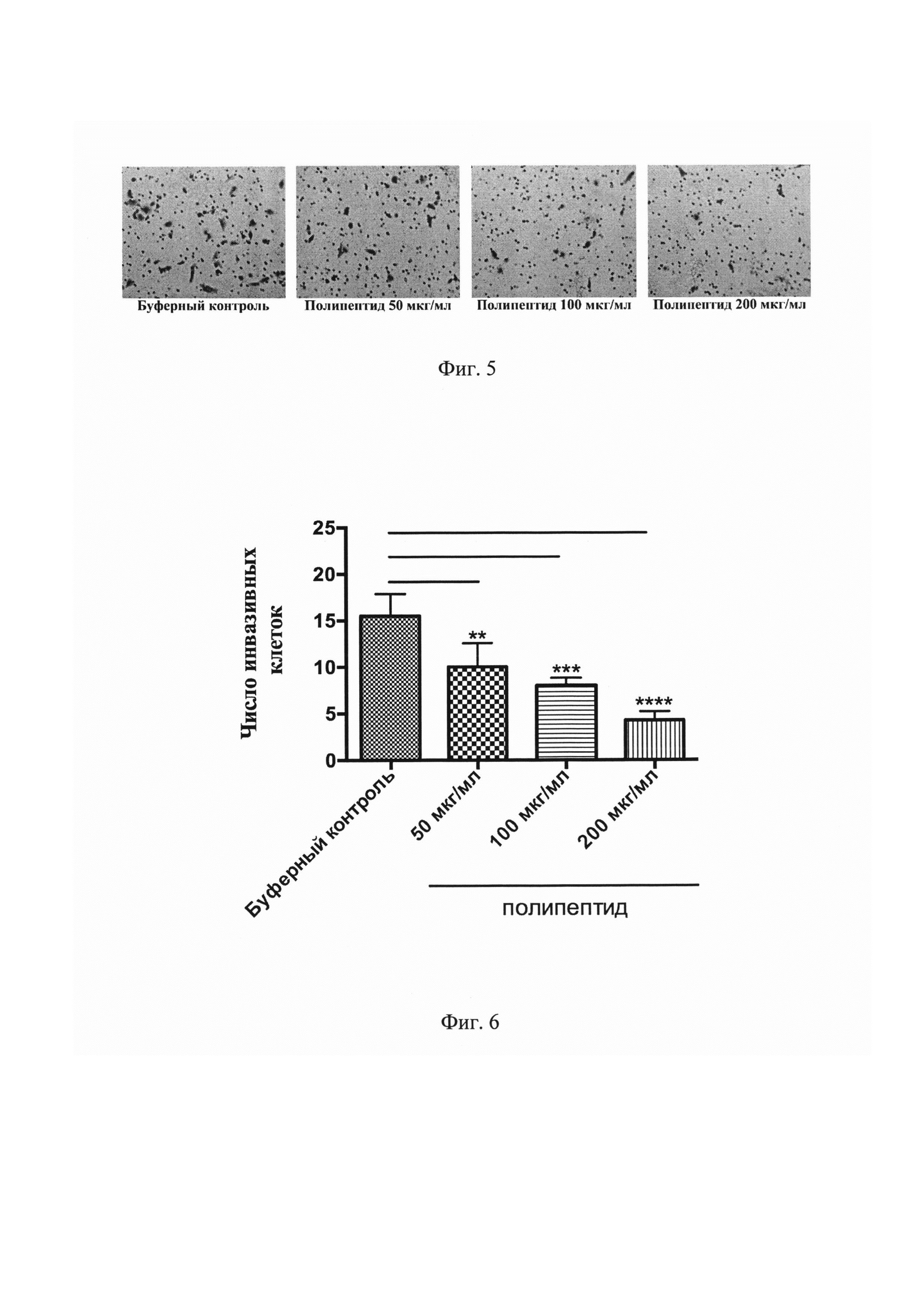
На Фиг. 5 представлены результаты фотомикроскопии мембран каждой из указанных групп в эксперименте Transwell инвазии. Инвазивные LNCaP клетки окрашены раствором кристального фиолетового.
На Фиг. 6 представлен график, демонстрирующий число инвазивных LNCaP клеток в каждой группе при 24-часовой инкубации в камерах Transwell с нанесенным матригелем. **Р<0,01, ***P<0,001, ****P<0,0001 по сравнению с буферным контролем.
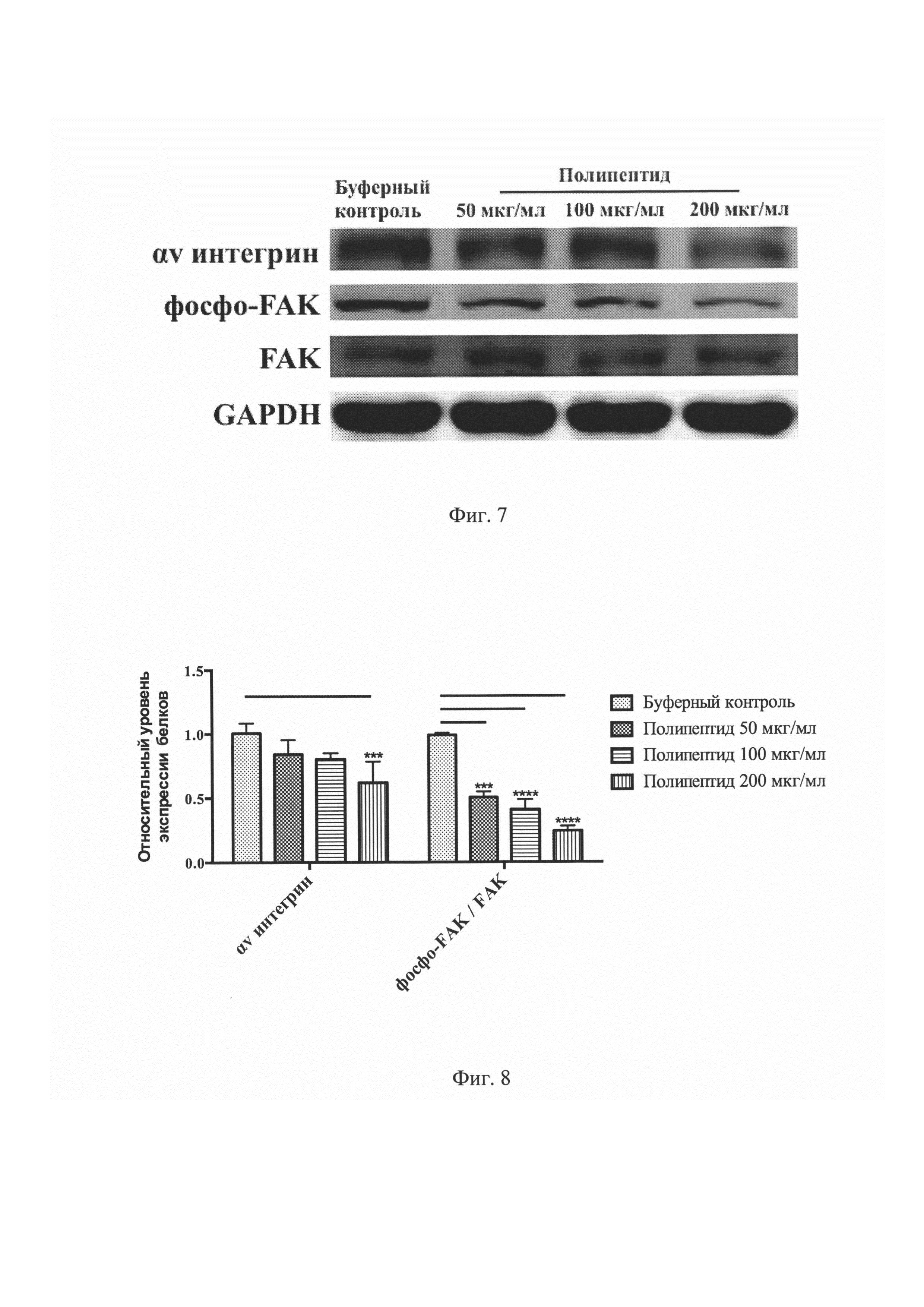
На Фиг. 7 представлен результат сканирования нитроцеллюлозной мембраны, инкубированной с первичными антителами против αv интегрина, фосфорилированного (Tyr 397) и тотального FAK, а также GAPDH в эксперименте Вестерн блот.
На Фиг. 8 представлен количественный анализ относительной денситометрии для αv интегрина, фосфорилированного (Tyr 397) и тотального FAK в эксперименте Вестерн блот. ***P<0,001, ****P<0,0001 по сравнению с буферным контролем.
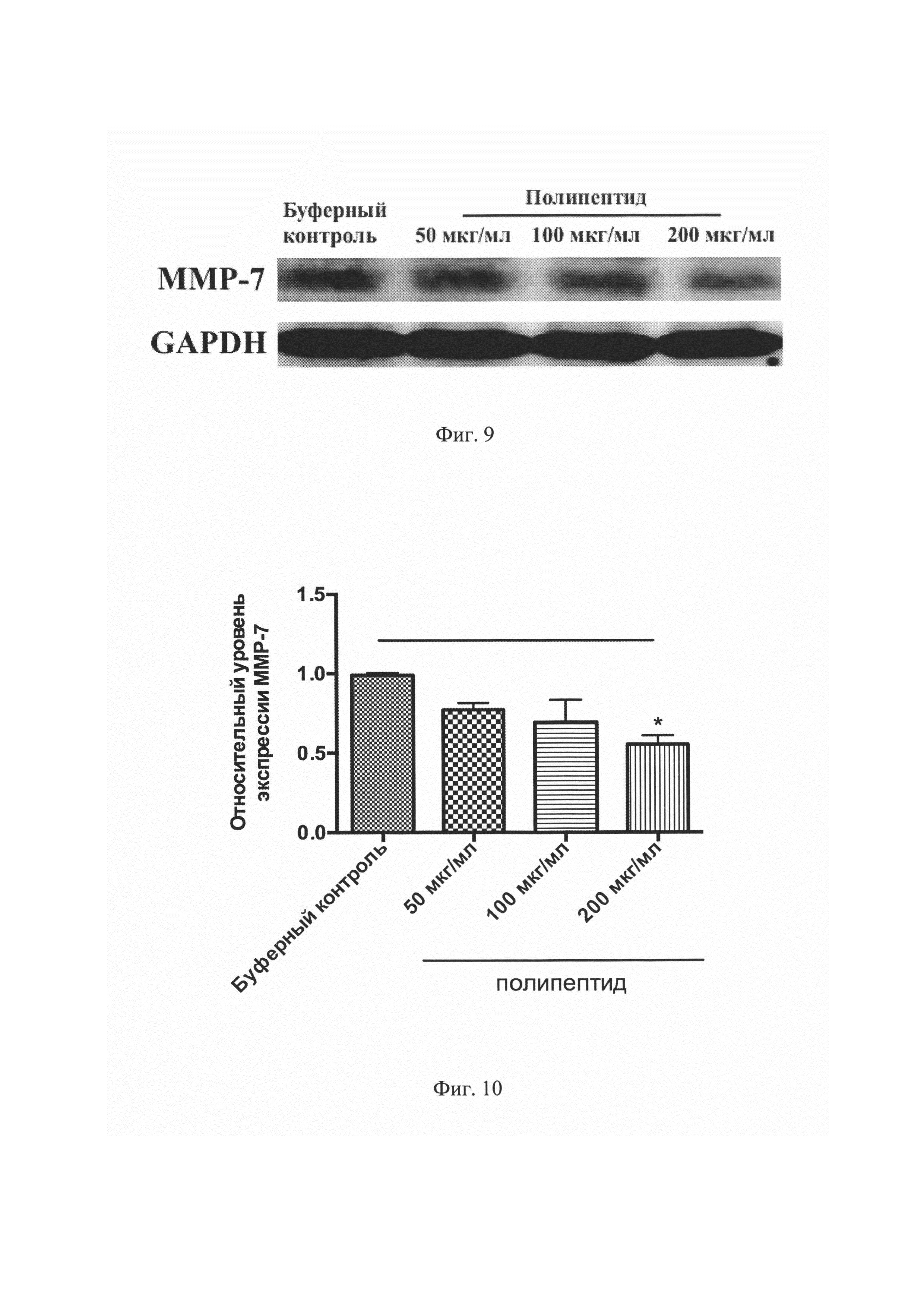
На Фиг. 9 изображен результат сканирования нитроцеллюлозной мембраны, инкубированной с первичными антителами против ММР-7 и GAPDH в эксперименте Вестерн блот.
На Фиг. 10 представлен количественный анализ относительной экспрессии ММР-7 в эксперименте Вестерн блот. *Р<0,05 по сравнению с буферным контролем.
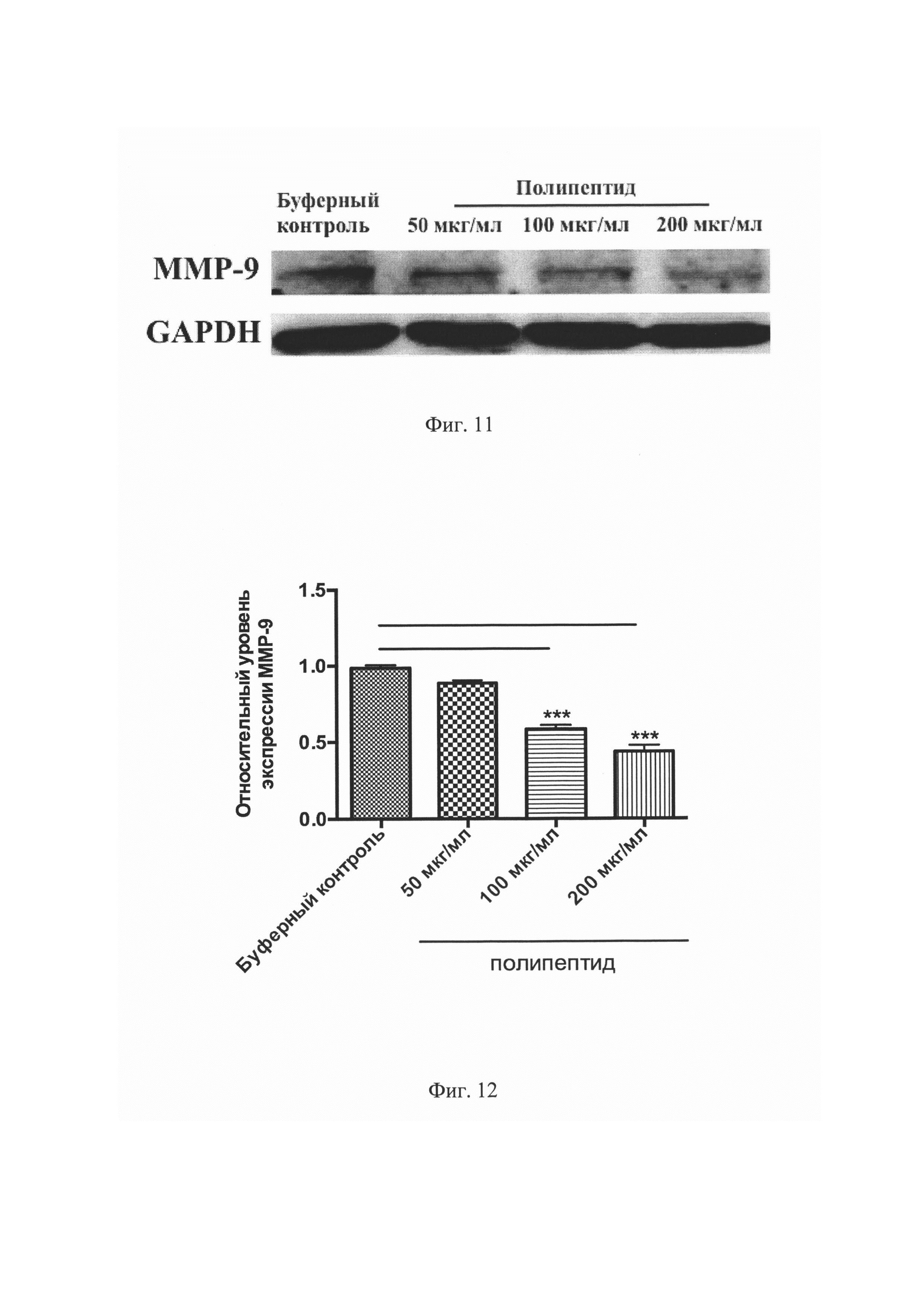
На Фиг. 11 представлен результат сканирования нитроцеллюлозной мембраны, инкубированной с первичными антителами против ММР-9 и GAPDH в эксперименте Вестерн блот.
На Фиг. 12 представлен количественный анализ относительной экспрессии ММР-9 в эксперименте Вестерн блот. ***P<0,001 по сравнению с буферным контролем.
Стоковый раствор полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, с концентрацией 10 мг/мл получали путем растворения 20 мг сухого вещества полипептида в 2 мл 5% раствора глюкозы для инъекций, после чего фильтровали с помощью 0,22 мкм-микропоровой мембраны (EMD Millipore). Отфильтрованный стоковый раствор хранили при -20°С в защищенном от света месте. Рабочие растворы низкой (50 мкг/мл), средней (100 мкг/мл) и высокой (200 мкг/мл) концентрации полипептида готовили по мере необходимости путем разведения стокового раствора питательной средой DMEM (GE Healthcare HyClone).
Экспериментальные исследования in vitro проводили с культурами клеточной линии рака предстательной железы LNCaP (АТСС® CRL-1740™).
Открепление адгезивных культур рака предстательной железы в результате воздействия полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, изучали на фибронектиновом матриксе. Для этого 96-луночный планшет предварительно покрывали 5 мкг/мл раствором фибронектина (Sigma-Aldrich) на 3 часа при комнатной температуре. После двукратного промывания лунок раствором фосфатно-солевого буфера в каждую лунку инокулировали LNCaP клетки в количестве 3×104 в объеме 100 мкл бессывороточной питательной среды DMEM и оставляли в инкубаторе на ночь, ожидая их прикрепления. На следующий день питательную среду заменяли на соответствующие разведения полипептида в бессывороточной питательной среде, в группе буферного контроля добавляли 5% раствор глюкозы. После 24-часовой инкубации неприкрепленные LNCaP клетки удаляли осторожным промыванием лунок раствором фосфатно-солевого буфера. Адгезивные клетки на фибронектиновом матриксе фиксировали 4% раствором параформальдегида и окрашивали раствором кристаллического фиолетового в течение 20 минут. В каждой группе осуществляли съемку в трех произвольных полях зрения под 100-кратным увеличением светового микроскопа. Количественный анализ полученных результатов производили с помощью программного обеспечения Image J (U.S. National Institutes of Health).
Характер воздействия полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, на миграцию рака предстательной железы in vitro изучали в ходе эксперимента «заживления раны». Во-первых, LNCaP клетки выращивали в 6-луночковом планшете, ожидая достижения ими 100% конфлюэнтности. Далее на клеточном монослое каждой группы проводили «царапину» с помощью наконечника 200 мкл пипетки, после чего питательную среду заменяли на разведения полипептида низкой (50 мкг/мл), средней (100 мкг/мл) и высокой (200 мкг/мл) концентрации и продолжали инкубацию в течение 24 часов. В группе буферного контроля использовали 5% раствор глюкозы. Фотосъемку границ «царапины-раны» осуществляли под 40-кратным увеличением микроскопа в соответствующие отрезки времени: 0 ч и 24 ч. Среднее значение ширины экспериментальной раны определяли при помощи программного обеспечения Image-Pro Plus 6.0 (Media Cybernetics). Показатели миграционного расстояния в каждой группе получали как разность значений средней ширины экспериментальной раны в 0 ч и 24 ч относительно группы буферного контроля.
Исследование влияния полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, на инвазию клеток рака предстательной железы изучали в эксперименте Transwell инвазии. Для этого LNCaP культуры (1×105 клеток в 400 мкл бессывороточной питательной среды) высеивали в BioCoat™ Invasion Chambers (Corning) с нанесенным Matrigel® в соответствующих разведениях полипептида на 24 часа. В группе буферного контроля был использован 5% раствор глюкозы. Нижние камеры заполняли 600 мкл 10% раствора сывороточной питательной среды в качестве хемоаттрактанта. По истечении 24 часов не инвазивные опухолевые клетки удаляли со дна камер при помощи ватного тампона. Визуализацию клеток, приникших через матригель и мигрировавших через поры в мембране, осуществляли путем окрашивания раствором кристаллического фиолетового с предварительной фиксацией 4% раствором параформальдегида. В каждой из камер осуществляли съемку мембран в трех произвольных полях зрения под 200-кратным увеличением светового микроскопа. Подсчет инвазивных клеток производили с помощью программного обеспечения Image J.
Анализ влияния полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, на экспрессию αv интегрина, тотального и фосфорилированного FAK, ММР-9 и ММР-7 исследовали с помощью Вестерн блоттинга. Для этого LNCaP клетки предварительно инкубировали с разведениями полипептида низкой (50 мкг/мл), средней (100 мкг/мл) и высокой (200 мкг/мл) концентраций в течение 24 часов. Выделение тотального белка из опухолевых клеток осуществляли с помощью RIPA буфера (Thermo Scientific), концентрацию полученного лизата определяли на спектрофотометре NanoDrop 2000 (Thermo Scientific). Протеиновые образцы каждой группы разделяли методом электрофореза, после чего осуществляли трансфер белковых фракций на нитроцеллюлозную мембрану. Для определения содержания искомых белков в образцах мембраны инкубировали при 4°С в течение 10-12 часов с первичными антителами против αv интегрина (Abeam), тотального FAK (Cell Signaling Technology), фосфорилированного FAK(Tyr397) (Cell Signaling Technology), MMP-7 (Abeam) и MMP-9 (Abeam). На следующий день мембраны промывали в фосфатно-солевом буфере с Твин-20 и проводили инкубацию с соответствующими вторичными антителами при комнатной температуре в течение 1 часа. После окончательного промывания в фосфатно-солевом буфере с Твин-20 проводили сканирование мембран с помощью аппарата Odyssey Imaging system (LI-COR Biosciences) с последующим денситометрическим анализом в программном обеспечении LI-COR Image Studio Software.
Статистический анализ результатов осуществляли с помощью программного обеспечения Graphpad Prism 6, используя однофакторный дисперсионный анализ One Way ANOVA. Значение Р<0,05 считали как статистически достоверное.
Анализ результатов эксперимента по изучению адгезивных свойств LNCaP культур выявил значительное открепление опухолевых клеток от фибронектинового матрикса при воздействии полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1 (Фигура №1). По истечении 24-часовой инкубации число адгезивных LNCaP клеток в группе буферного контроля составило 143,3±14,6, тогда как в группе полипептида с концентрацией 50 мкг/мл было 107,0±15,7 (Р<0,05), со 100 мкг/мл - 75,3±7,1 (Р<0,001), а в группе с максимальной концентрацией в 200 мкг/мл - 55,3±5,7 (Р<0,0001) (Фигура №2).
Изучение воздействия полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, в эксперименте «заживления раны» позволило установить значительное ингибирование миграции LNCaP клеток (Фигура №3). При этом статистически значимое сокращение миграционного расстояния было достигнуто в группах средней (Р<0,05) и максимальной (Р<0,01) концентраций полипептида (Фигура №4).
В ходе эксперимента Transwell инвазии было установлено, что инкубация культур LNCaP клеток с полипептидом, имеющим аминокислотную последовательность, соответствующую SEQ ID NO: 1, привела к значительной супрессии инвазивного потенциала рака предстательной железы in vitro (Фигура №5). Анализ полученных результатов показал статистически значимое уменьшение числа инвазивных клеток во всех группах с полипептидом (Фигура №6).
Сравнительный анализ результатов эксперимента Вестерн блоттинга с полипептидом, имеющим аминокислотную последовательность, соответствующую SEQ ID NO: 1, выявил подавление активности αv интегринов и FAK (Фигура №7). В группе с максимальной концентрацией полипептида зафиксировано статистически значимое снижение экспрессии αv интегрина до уровня 0,62±0,16 (Р<0,001) относительно значений буферного контроля (Фигура №8). При этом значительное подавление фосфорилирования FAK отмечалось во всех группах с полипептидом.
Кроме того, количественный анализ относительной денситометрии экспрессии ММР-7 показал статистически значимое (Р<0,05) уменьшение количества данного белка в группе с концентрацией полипептида 200 мкг/мл (Фигуры №9-10).
Как показали результаты Вестерн блот анализа, 24-часовая инкубация культур рака предстательной железы с полипептидом, имеющим аминокислотную последовательность, соответствующую SEQ ID NO: 1, привела к значительному ингибированию содержания ММР-9 в LNCaP клетках (Фигура №11). Так, в группе с концентрацией полипептида 100 мкг/мл зафиксирована экспрессия ММР-9 на уровне 0,58±0,03 (Р<0,001), а группе с максимальной концентрацией - 0,44±0,04 (Р<0,001) (Фигура №12).
В целом, результаты настоящего исследования свидетельствуют об ингибирующем действии полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, на миграцию и инвазию рака предстательной железы. Полученные данные об антагонизме полипептида настоящего исследования в отношении αv интегриновых рецепторов, а также его способность подавлять фосфорилирование FAK и снижать экспрессию ММР-7 и ММР-9 позволяют рассматривать данный полипептид в качестве потенциального противоопухолевого средства для терапии рака предстательной железы.
Применение полипептида, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 1, в качестве средства для ингибирования миграции и инвазии рака предстательной железы, подавления активности αv интегринов и фосфорилирования FAK, снижения экспрессии ММР-7 и ММР-9 в опухолевых клетках.