Результат интеллектуальной деятельности: ПРЕГНАНОВЫЕ СТЕРОИДЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Группа изобретений относится к медицинской и органической химии и медицине, в частности к производным 17-ацетата мепрегенола.
Предлагаемые соединения обладают цитотоксической активностью, что позволяет использовать их в противоопухолевой терапии.
Аналогами патентуемых соединений по структуре и биологической активности являются сложные эфиры 17-ацетата мепрегенола (далее АМП-17) [Зейналов О.А., Андрюшина В.А., Скрябин К.Г. Новые высокоактивные гестагены прегнанового ряда // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). - 2005. - Т. XLIX. - №1. - С. 118-124.], которые требуют увеличения целевой активности и селективности для противораковой терапии.
Прототипом предлагаемых соединений является 17α-ацетокси-3β-бутаноилокси-6-метилпрегна-4,6-диен-20-он (далее бутират АМП-17), обладающий высокой гестагенной и противоопухолевой активностями с возможностью перорального применения [Зейналов О.А., Андрюшина В.А., Скрябин К.Г. Новые высокоактивные гестагены прегнанового ряда // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). - 2005. - Т. XLIX. - №1. - С. 118-124].
Однако бутират АМП-17 требует улучшения параметров эффективной концентрации, расширения терапевтических показаний применения.
Известно несколько способов получения бутирата АМП-17 [RU 2099347 С1, Биореактор, 20.12.1997; RU 2091388 С1, Андрюшина и др., 27.09.1997; RU 2091019 С1, Андрюшина и др., 27.09.1997; RU 2292209 С2, Центр Химии Лекарственных Средств и др., 27.01.2007; RU 2653507 С1, ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, 10.05.2018 (прототип)].
Однако ранее известные методы синтеза, в том числе и способ-прототип, требуют применения спиртовых растворителей, кислой среды и охлаждения, что не позволяет считать известные технологические процессы соответствующими критериям «зеленой химии».
Техническая проблема состоит в получении новых модифицированных прегнановых гестагенов, содержащих пирролидиновый(ые) фрагмент(ы) и обладающих высокой цитотоксической активностью по отношению к злокачественным опухолевым клеточным линиям - клеткам рака шейки матки человека HeLa (нативным и эстрадиол-стимулированным); а также способы их получения.
Технический результат, достигаемый при осуществлении заявляемой группы изобретений, заключается в расширении арсенала средств, обладающих противоопухолевой (цитотоксической активностью), а также в обеспечении соответствия критериям «зеленой химии» технологии их получения за счет исключения применения спиртовых растворителей, кислой среды и охлаждения.
Сущность изобретения заключается в следующем.
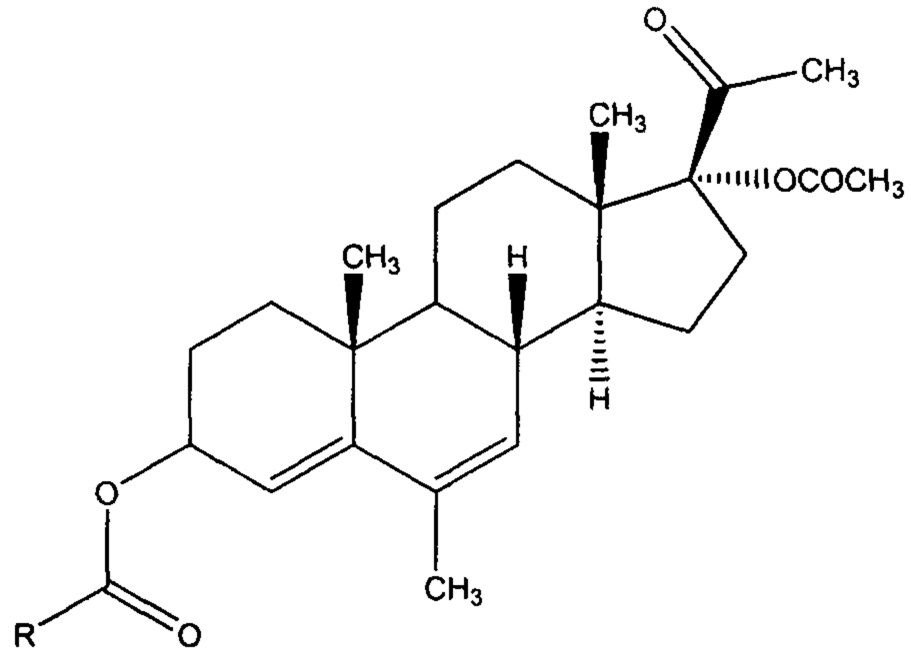
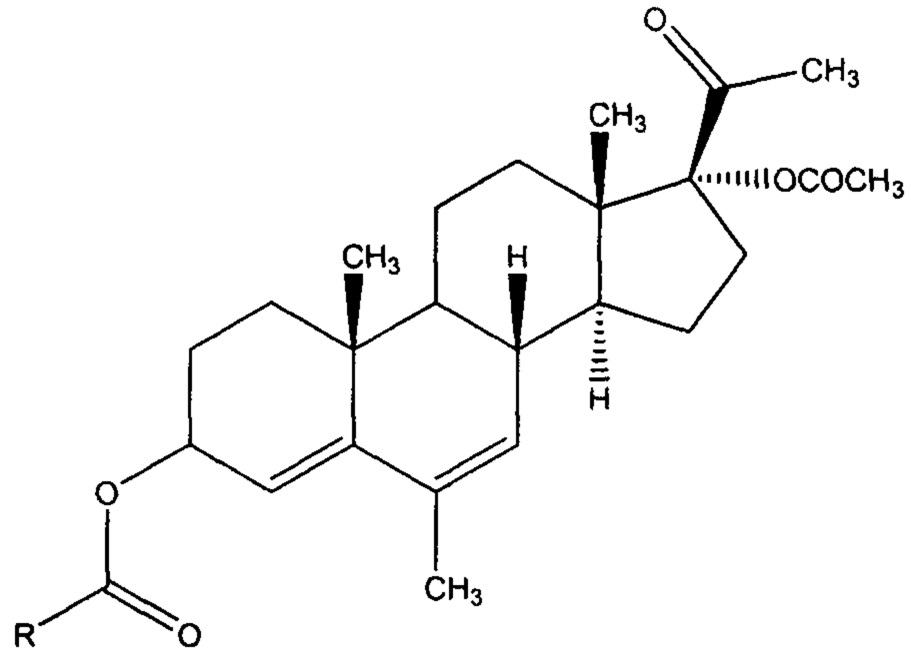
Предлагается средство, обладающее цитотоксической активностью, общей формулы:

где R выбран из следующей группы 1-бензилпирролидин-3-ил; 2-метоксикарбонил-5-фенилпирролидин-4-ил; 2-метоксикарбонил-5-(2-(трифторметил)фенил)пирролидин-4-ил; 2-метоксикарбонил-5-(2-бромфенил)пирролидин-4-ил; 1-акрилоил-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(1-акрилоил-5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил; винил.
Предлагается также способ получения указанного выше средства, где R соответствует винил; 1-акрилоил-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(1-акрилоил-5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил, в котором проводят ацилирование 17-ацетата мепрегенола, либо 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-5-фенилпирролидин-2,4-дикарбоксилата, либо 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-1-(5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-5-фенилпирролидин-2,4-дикарбоксилата акрилоилхлоридом в присутствии третичного амина.
При этом в качестве третичного амина может быть использован триэтиламин.
Предлагается также способ получения патентуемого средства, в котором 17-ацетат мепрегенола получают восстановлением ацетата мегестрола при комнатной температуре борогидридом натрия в тетрагидрофуране в нейтральной среде.
Предлагается способ получения патентуемого средства, где R соответствует 1-бензилпирролидин-3-ил, в котором проводят взаимодействие 17α-ацетокси-3β-акрилоилокси-6-метилпрегна-4,6-диен-20-она с N-метоксиметил-N-(триметилсилилметил)бензиламином в присутствии трифторуксусной кислоты.
Предлагается способ получения патентуемого средства, где R соответствует 2-метоксикарбонил-5-фенилпирролидин-4-ил; 2-метоксикарбонил-5-(2-(трифторметил)фенил)пирролидин-4-ил; 2-метоксикарбонил-5-(2-бромфенил)пирролидин-4-ил; 1-(5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил, в котором осуществляют взаимодействие 17α-ацетокси-3β-акрилоилокси-6-метилпрегна-4,6-диен-20-она либо 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-1-акрилоил-5-фенилпирролидин-2,4-дикарбоксилата с замещенными метил-2-(бензилиденамино)ацетатами в присутствии кислоты Льюиса и третичного амина.
При этом в качестве кислоты Льюиса может быть использован ацетат серебра(I), а в качестве третичного амина - триэтиламин.
Таким образом, разработан новый метод синтеза АМП-17, отличающийся тем, что восстановление ацетата мегестрола проводят при комнатной температуре борогидридом натрия в тетрагидрофуране в нейтральной среде.
Получены новые производные АМП-17, содержащие модифицированную гидроксильную группу в 3-ем положении прегнанового каркаса, общей формулы:
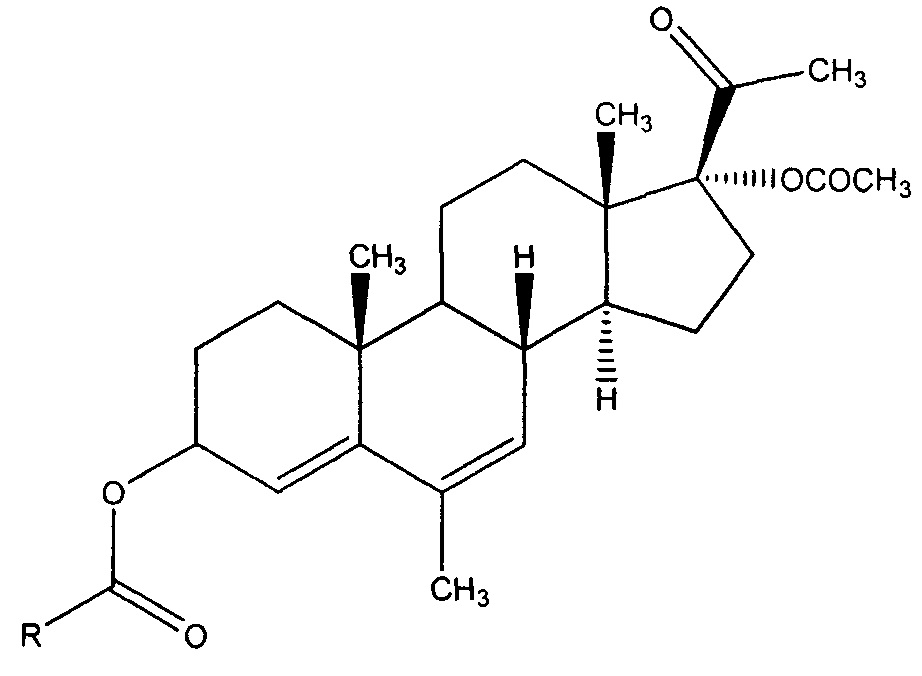
где R выбран из следующей группы 1-бензилпирролидин-3-ил; 2-метоксикарбонил-5-фенилпирролидин-4-ил; 2-метоксикарбонил-5-(2-(трифторметил)фенил)пирролидин-4-ил; 2-метоксикарбонил-5-(2-бромфенил)пирролидин-4-ил; 1-акрилоил-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(1-акрилоил-5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил; винил.
Соединения обладают цитотоксической активностью, что позволяет использовать их в противоопухолевой терапии.
Предлагаемое изобретение представлено химической структурой новых соединений класса прегнановых стероидов, содержащих модифицированную гидроксильную группу в 3-ем положении прегнанового каркаса, общей формулы:

где R выбран из следующей группы 1-бензилпирролидин-3-ил; 2-метоксикарбонил-5-фенилпирролидин-4-ил; 2-метоксикарбонил-5-(2-(трифторметил)фенил)пирролидин-4-ил; 2-метоксикарбонил-5-(2-бромфенил)пирролидин-4-ил; 1-акрилоил-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(1-акрилоил-5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил; винил, обладающих цитотоксической активностью.
Заявляемые соединения представляют собой бесцветные или слабоокрашенные кристаллические вещества, хорошо растворимые в хлористом метилене, хлороформе, тетрагидрофуране, спирте, диметилсульфоксиде. Структура и индивидуальность заявляемых соединений подтверждены элементным анализом, рентгеноструктурным анализом, данными ЯМР 1Н, ЯМР 13С, тонкослойной хроматографией.
Предложен также способ получения ранее неизвестных производных АМП-17, содержащих модифицированную фрагментом замещенной 3-пирролидинкарбоновой кислоты гидроксильную группу в 3-ем положении прегнанового каркаса, общей формулы:
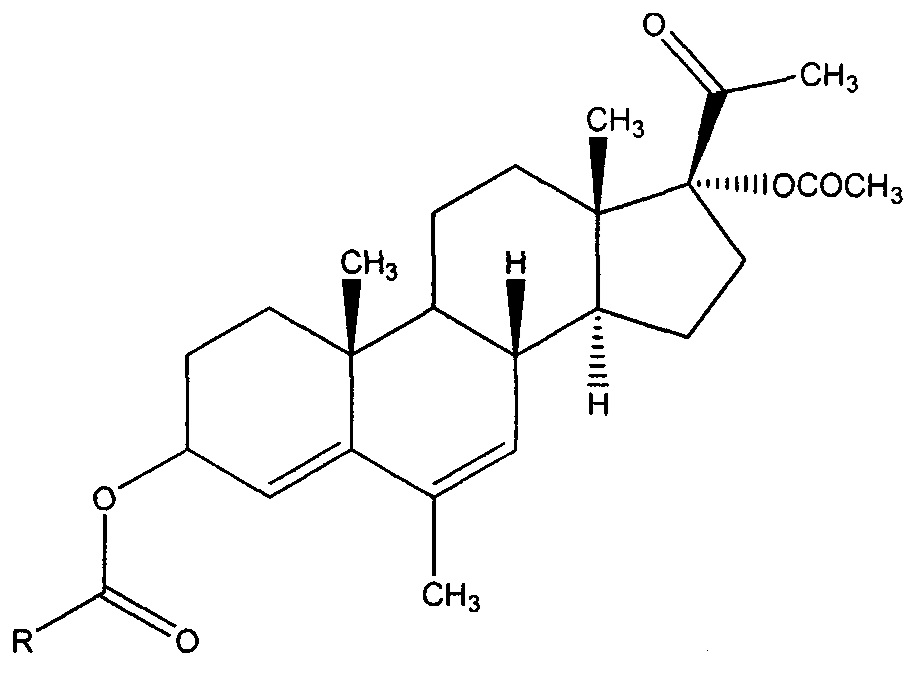
где R выбран из следующей группы 1-бензилпирролидин-3-ил; 2-метоксикарбонил-5-фенилпирролидин-4-ил; 2-метоксикарбонил-5-(2-(трифторметил)фенил)пирролидин-4-ил; 2-метоксикарбонил-5-(2-бромфенил)пирролидин-4-ил, при котором раствор полученного из АМП-17 17α-ацетокси-3β-акрилоилокси-6-метилпрегна-4,6-диен-20-она:

обрабатывают предшественником азометинового илида, последующая генерация которого приводит к целевым соединениям.
Предложен способ получения ранее неизвестных производных АМП-17, содержащих модифицированную гидроксильную группу в 3-ем положении прегнанового каркаса, общей формулы:
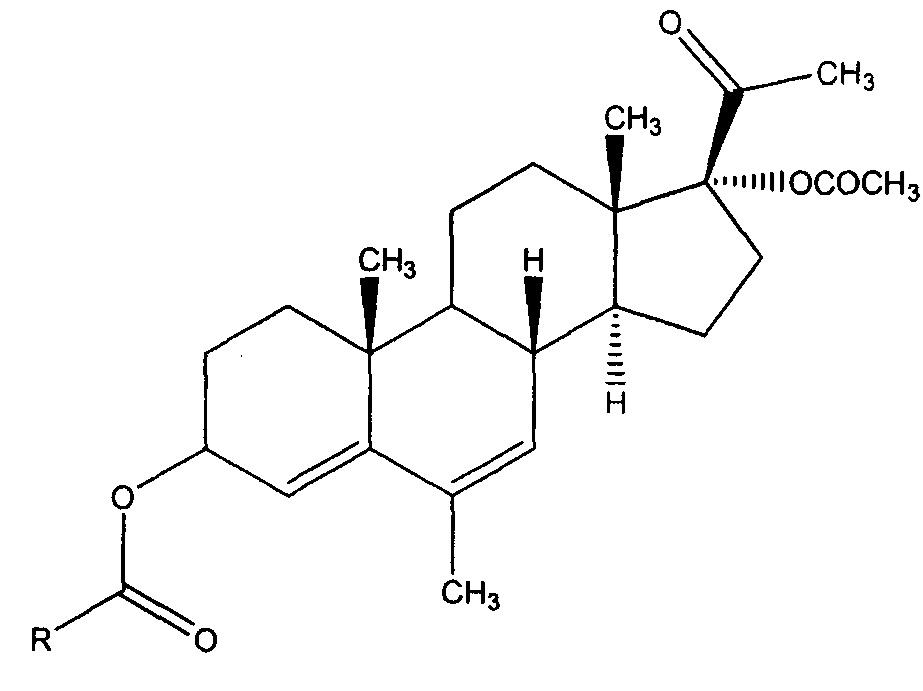
где R выбран из следующей группы винил; 1-акрилоил-2-метоксикарбонил-5-фенилпирролидин-4-ил; 1-(1-акрилоил-5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-2-метоксикарбонил-5-фенилпирролидин-4-ил, при котором 17-ацетат мепрегенола, либо 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-5-фенилпирролидин-2,4-дикарбоксилата, либо 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-1-(5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-5-фенилпирролидин-2,4-дикарбоксилата обрабатывают акрилоилхлоридом.
Пример 1. Получение 17-ацетата мепрегенола (I).
К раствору 1.000 г ацетата мегестрола в 50 мл тетрагидрофурана при перемешивании добавляют 0.100 г борогидрида натрия при комнатной температуре. Далее в реакционную смесь добавляют при перемешивании 5 мл дистиллированной воды. Через 2 ч добавляют 0.030 г борогидрида натрия. Через 1 ч при перемешивании добавляют 150 мл дистиллированной воды и перемешивают в течение 2 ч до формирования осадка. Осадок отфильтровывают, промывают дистиллированной водой и высушивают до постоянной массы. Получают 0.965 г (97%) АМП-17 в виде бесцветного твердого вещества, т.пл. 195°С. 1Н ЯМР (400 МГц; CDCl3): δ 5.55 (s, 1Н) 5.49 (s, 1H), 4.29 (br.s, 1H), 2.95 (dd, J 13.88, 11.31, 1H), 2.16-2.08 (m, 1H), 2.06 (s, 3H), 2.08-2.05 (m, 1H), 2.04 (s, 3H), 1.92 (dd, J 12.8, 4.1, 1H), 1.90-1.82 (m, 2H), 1.80 (s, 3H), 1.73 (s, 1H), 1.71-1.49 (m, 5H), 1.49-1.24 (m, 4H), 1.17-1.04 (m, 1H), 0.97 (s, 3H), 0.69 (s, 3Н). 13C ЯМР (100 МГц; CDCl3): δ 14.37, 18.08, 20.08, 20.31, 21.14, 23.29, 26.33, 28.67, 30.30, 31.24, 33.69, 35.01, 36.83, 47.55, 49.39, 51.06, 68.25, 96.60, 123.88, 128.32, 131.40, 145.16, 170.70, 204.20.
Пример 2. Получение (3S,8R,9S,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантренил-3-ил акрилата (II).
К охлажденному до минус 5°С 9.60 г 17-ацетата мепрегенола (I) в 150 мл хлористого метилена добавляют 3.50 мл триэтиламина. При перемешивании в атмосфере аргона добавляют порциями раствор 2.70 г акрилоилхлорида в 30 мл хлористого метилена, не допуская повышения температуры реакционной среды. Оставляют перемешиваться по окончании добавления акрилоилхлорида при комнатной температуре на 12 ч. Промывают водой, насыщенным раствором хлорида натрия. Органическую фазу сушат безводным сульфатом натрия, растворитель удаляют при пониженном давлении на ротационном испарителе. Твердый остаток очищают колоночной хроматографией на силикагеле, элюент петролейный эфир/этилацетат 5:1. Получают 7.50 г (73%) заявленного соединения в виде бесцветного твердого вещества, т.пл. 184-185°С. Вычислено, % С27Н36О5: С, 73.61; Н, 8.24. Найдено, %: С, 73.72; Н, 8.29. 1Н ЯМР (400 МГц; CDCl3): δ 6.41 (dd, J 17.3, 1.5, 1Н), 6.13 (dd, J 17.3, 10.4, 1H), 5.82 (dd, J 10.4, 1.5, 1H), 5.49 (s, 1H), 5.46 (d, J 3.1, 1H), 2.96 (dd, J 15.2, 1.3, 1H), 2.93 (dd, J 15.8, 2.4, 1H), 2.15-2.07 (m, 2H), 2.06 (s, 3H), 2.02 (s, 3H), 1.94 (td, J 12.7, 4.2, 1H), 1.90-1.79 (m, 3Н), 1.77 (dd, J 1.9, 1.3, 3H), 1.75-1.67 (m, 2H), 1.64-1.57 (m, 1H), 1.56-1.50 (m, 1H), 1.46-1.33 (m, 2H), 1.30 (ddd, J 16.5, 10.8, 3.7, 1H), 1.16-1.06 (m, 1H), 0.97 (s, 3H), 0.67 (s, 3Н). 13C ЯМР (100 МГц; CDCl3): δ 198.92, 165.51, 160.91, 141.72, 126.07, 125.40, 123.72, 123.63, 114.25, 66.04, 45.72, 44.19, 42.38, 31.65, 29.83, 28.25, 26.08, 25.15, 21.15, 19.16, 18.14, 15.99.
Пример 3. Получение (8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил-1-бензилпирролидин-3-карбоксилата (III).
К охлажденному до 0°С 1.000 г акрилата II, полученному из 17-ацетата мепрегенола (I), в 100 мл толуола, в атмосфере аргона при перемешивании добавляют последовательно 0.670 г N-метоксиметил-N-(триметилсилилметил)бензиламина, 0.1 мл 1 М раствора трифторуксусной кислоты в хлористом метилене. Через 30 мин снимают охлаждение и оставляют перемешиваться при комнатной температуре в течение 12 ч. Растворитель удаляют при пониженном давлении на ротационном испарителе. Остаток очищают колоночной хроматографией на силикагеле, элюент хлористый метилен/метанол от 100:1 до 50:1. Получают 1.140 г (88%) заявленного соединения в виде бесцветного маслообразного вещества. Вычислено, % C36H47NO5: С, 75.36; Н, 8.26; N, 2.44. Найдено, %: С, 75.48; Н, 8.29; N, 2.51. 1Н ЯМР (400 МГц; CDCl3): 7.41-7.17 (m, 5Н), 5.51 (s, 1Н), 5.41 (d, J 2.9, 1H), 3.64 (d, J 6.1, 1H), 3.13-2.85 (m, 3H), 2.67 (dd, J 14.1, 7.0, 1H), 2.56 (d, J 9.0, 1H), 2.06 (d, J 14.9, 8H), 2.22-2.01 (m, 4H), 1.96 (d, J 4.2, 1H), 1.92-1.63 (m, 10H), 1.57 (t, J 3.2, 1H), 1.54 (d, J 3.9, 1H), 1.50-1.22 (m, 4H), 1.12 (br. s, 1H), 0.98 (s, 3H), 0.69 (s, 3Н). 13C ЯМР (100 МГц; CDCl3): δ 204.14, 174.98, 170.71, 146.79, 131.26, 128.85, 128.69, 128.39, 128.22, 126.94, 119.52, 96.62, 71.18, 60.02, 56.78, 56.68, 53.80, 50.89, 49.38, 47.57, 47.41, 42.29, 36.83, 35.01, 33.43, 31.26, 30.34, 27.76, 27.59, 26.34, 24.32, 23.32, 21.18, 21.03, 20.27, 20.07, 17.93, 14.38.
Пример 4. Получение 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-5-фенилпирролидин-2,4-дикарбоксилата (IV).
К раствору 1.000 г акрилата II, полученному из 17-ацетата мепрегенола (I), в 100 мл толуола в атмосфере аргона при перемешивании добавляют последовательно 0.483 г метил-2-(бензилиденамино)ацетата, 0.568 г ацетата серебра(I), 0.344 г триэтиламина. Перемешивают в темноте 48 ч. Реакционную смесь фильтруют, фильтрат упаривают при пониженном давлении на ротационном испарителе. Остаток очищают колоночной хроматографией на силикагеле, элюент петролейный эфир/этилацетат от 3:1 до 1:1 до 0:1. Получают 1.200 г (88%) заявленного соединения в виде бесцветного твердого вещества, т.пл. 188°С. Вычислено, % C37H47NO7: С, 71.94; Н, 7.67; N, 2.27. Найдено, %: С, 72.12; Н, 7.59; N, 2.47. 1Н ЯМР (400 МГц; CDCl3): δ 7.21-7.40 (m, 5Н), 5.43 (s, 1Н), 5.27 (s, 1Н), 5.09 (s, 1Н), 4.92 (dt, J 32.1, 7.4, 1H), 4.52 (dd, J 7.4, 1.9, 1Н), 3.97 (t, J 8.1, 1H), 3.80 (s, 2H), 3.30 (dtd, J 19.3, 7.5, 5.9, 1H), 2.97-2.87 (m, 1H), 2.47-2.40 (m, 2H), 2.03 (s, 3H), 2.00 (s, 3H), 1.93-1.71 (m, 6H), 1.66 (ddd, J 21.9, 1.6, 1.2, 3H), 1.56-1.26 (m, 6H), 1.26-1.03 (m, 3H), 1.02-0.93 (m, 2H), 0.84 (d, J 8.0, 3H), 0.64 (s, 3H). 13C ЯМР (100 МГц; CDCl3): δ 204.10, 173.68, 172.62, 172.60, 170.68, 146.57, 138.97, 131.19, 128.75, 128.61, 128.22, 128.18, 127.63, 127.48, 127.07, 126.95, 119.33, 96.61, 71.02, 65.89, 59.90, 52.27, 50.77, 49.76, 49.66, 49.34, 47.52, 36.73, 34.82, 33.88, 33.72, 33.25, 31.21, 30.31, 26.31, 24.13, 23.30, 21.16, 20.20, 20.05, 17.80, 14.35.
Пример 5. Получение 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-5-(2-(трифторметил)фенил)пирролидин-2,4-дикарбоксилата (V).
К раствору 0.500 г акрилата II, полученному из 17-ацетата мепрегенола (I), в 100 мл толуола в атмосфере аргона при перемешивании добавляют последовательно 0.306 г метил-2-((2-(трифторметил)бензилиден)амино)ацетата, 0.284 г ацетата серебра(I), 0.172 г триэтиламина. Перемешивают в темноте 48 ч. Реакционную смесь фильтруют, фильтрат упаривают при пониженном давлении на ротационном испарителе. Остаток очищают колоночной хроматографией на силикагеле, элюент петролейный эфир/этилацетат от 3:1 до 1:1 до 0:1. Получают 0.550 г (71%) заявленного соединения в виде бесцветного твердого вещества, т.пл. 117°С. Вычислено, % C38H46F3NO7: С, 66.55; Н, 6.76; N, 2.04. Найдено, %: С, 66.42; Н, 6.59; N, 2.17. 1Н ЯМР (400 МГц; CDCl3): δ 7.81 (d, J 7.9, 1Н), 7.62 (t, J 7.4, 1H), 7.50 (td, J 7.5, 3.8, 1H), 7.35 (td, J 8.0, 2.3, 1H), 5.42 (d, J 4.3, 1H), 5.27 (s, 1H), 5.21 (d, J 1.9, 1H),4.87 (d, J 8.2, 1H), 4.73 (t, J 7.5, 1H), 4.22 (s, 1H), 3.99-3.92 (m, 1H), 3.80 (d, J 1.6, 2H), 3.31 (dtd, J 19.9, 7.7, 4.5, 1H), 2.98-2.85 (m, 1H), 2.63-2.53 (m, 1H), 2.43 (dtd, J 13.3, 8.4, 2.3, 1H), 2.03 (s, 3H), 2.00 (d, J 1.1, 3H), 1.97-1.71 (m, 5H), 1.70-1.57 (m, 3H), 1.57-1.30 (m, 4H), 1.28-0.84 (m, 5H), 0.81 (d, J 17.0, 3H), 0.64 (s, 3H). 13C ЯМР (100 МГц, CDCl3): δ 204.12, 173.48, 172.45, 170.65, 146.15, 131.87, 131.20, 128.75, 128.60, 128.55, 128.15, 127.65, 127.52, 119.18, 71.41, 71.05, 59.33, 52.23, 50.79, 49.35, 47.53, 36.74, 36.72, 34.77, 33.24, 33.03, 32.82, 31.21, 30.31, 26.32, 24.20, 23.29, 21.15, 20.17, 20.00, 17.78, 17.71, 14.35.
Пример 6. Получение 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-5-(2-бромфенил)пирролидин-2,4-дикарбоксилата (VI).
К раствору 0.500 г акрилата II, полученному из 17-ацетата мепрегенола (I), в 100 мл толуола в атмосфере аргона при перемешивании добавляют последовательно 0.321 г метил-2-((2-бромбензилиден)амино)ацетата, 0.284 г ацетата серебра(I), 0.172 г триэтиламина. Перемешивают в темноте 48 ч. Реакционную смесь фильтруют, фильтрат упаривают при пониженном давлении на ротационном испарителе. Остаток очищают колоночной хроматографией на силикагеле, элюент петролейный эфир/этилацетат от 3:1 до 1:1 до 0:1. Получают 0.702 г (89%) заявленного соединения в виде бесцветного твердого вещества, т.пл. 129°С. Вычислено, % C37H46BrNO7: С, 63.79; Н, 6.66; N, 2.01. Найдено, %: С, 63.92; Н, 6.69; N, 2.15. 1Н ЯМР (400 МГц; CDCl3): δ 7.57-7.51 (m, 2Н), 7.32-7.27 (m, 1Н), 7.15-7.10 (m, 1Н), 5.45 (s, 1Н), 5.22 (d, J 2.1, 1Н), 4.91 (t, J 7.1, 1Н), 4.80 (dd, J 12.0, 7.6, 1Н), 4.47 (d, J 1.6, 1Н), 4.01-3.94 (m, 1Н), 3.82 (s, 3Н), 3.64-3.51 (m, 1H), 2.98-2.88 (m, 1H), 2.50 (m, 2H), 2.05 (s, 3H), 2.02 (d, J 1.1, 3H), 1.95-1.84 (m, 2H), 1.84-1.05 (m, 14H), 1.04-0.92 (m, 1H), 0.86 (d, J 12.2, 3H), 0.66 (s, 3Н). 13C ЯМР (101 МГц, CDCl3): δ 203.73, 173.11, 172.34, 170.29, 146.11, 137.58, 132.08, 130.85, 128.34, 128.17, 127.61, 127.33, 123.78, 119.04, 70.63, 64.50, 58.81, 51.87, 50.36, 48.94, 47.14, 36.37, 34.41, 33.00, 32.84, 32.77, 30.82, 29.92, 25.94, 22.90, 20.77, 19.88, 19.81, 19.65, 17.44, 17.42, 14.86.
Пример 7. Получение 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-1-акрилоил-5-фенилпирролидин-2,4-дикарбоксилата (VII).
К охлажденному до минус 5°С раствору 1.160 г соединения IV в 100 мл хлористого метилена добавляют 0.285 г триэтиламина. При перемешивании в инертной атмосфере добавляют порциями раствор 0.205 г акрилоилхлорида в 20 мл хлористого метилена, не допуская повышения температуры реакционной среды. Оставляют перемешиваться по окончании добавления акрилоилхлорида при комнатной температуре на 12 ч. Промывают водой, насыщенным раствором хлорида натрия. Органическую фазу сушат безводным сульфатом натрия, растворитель удаляют при пониженном давлении на ротационном испарителе. Твердый остаток очищают колоночной хроматографией на силикагеле, элюент петролейный эфир/этилацетат 1:1. Получают 1.120 г (89%) заявленного соединения в виде бесцветного твердого вещества, т.пл. 145°С. Вычислено, % C40H49NO8: С, 71.51; Н, 7.35; N, 2.08. Найдено, %: С, 71.62; Н, 7.39; N, 2.19. 1Н ЯМР (400 МГц; CDCl3): δ 7.65 (d, J 7.3, 2Н), 7.37-7.24 (m, 3Н), 6.37-6.28 (m, 1H), 6.05 (ddd, J 16.7, 10.3, 1.7, 1H), 5.51 (ddd, J 10.4, 3.0, 1.9, 1H), 5.48 (d, J 13.6, 1H), 5.32 (d, J 8.6, 1H), 5.27 (s, 1H), 5.17 (s, 1H), 5.03 (t, J 8.3, 1H), 4.49 (ddd, J 11.3, 6.7, 1.8, 1Н), 3.84 (s, 1H), 3.58-3.44 (m, 1H), 2.97-2.89 (m, 1H), 2.56 (ddd, J 24.4, 12.9, 3.5, 1H), 2.39 (dtd, J 10.7, 6.5, 4.2, 1H), 2.12-2.05 (m, 1H), 2.04 (d, J 1.0, 3H), 2.01 (d, J 5.2, 3H), 1.96-1.15 (m, 16H), 1.05-0.97 (m, 1H), 0.90 (d, J 9.4, 3H), 0.65 (s, 3Н). 13C ЯМР (100 МГц, CDCl3) δ 204.08, 171.94, 170.67, 168.53, 165.44, 146.88, 138.23, 131.11, 129.43, 129.28, 129.03, 128.55, 128.53, 128.40, 128.36, 127.84, 127.75, 127.59, 118.90, 71.97, 63.13, 59.26, 52.44, 50.79, 49.32, 47.53, 36.77, 34.86, 33.24, 31.21, 30.32, 28.60, 26.34, 23.30, 21.16, 20.21, 20.16, 17.88, 17.83, 14.36.
Пример 8. Получение 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-1-(5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-5-фенилпирролидин-2,4-дикарбоксилата (VIII).
К раствору 0.660 г акриламида VII в 100 мл толуола в атмосфере аргона при перемешивании добавляют последовательно 0.209 г метил-2-(бензилиденамино)ацетата, 0.246 г ацетата серебра(I), 0.162 г триэтиламина. Перемешивают в темноте 48 ч. Реакционную смесь фильтруют, фильтрат упаривают при пониженном давлении на ротационном испарителе. Остаток очищают колоночной хроматографией на силикагеле, элюент петролейный эфир/этилацетат от 2:1 до 1:1 до 0:1. Получают 0.660 г (79%) заявленного соединения в виде бесцветного твердого вещества, т.пл. 213°С. Вычислено, % C50H60N2O10: С, 70.73; Н, 7.12; N, 3.30. Найдено, %: С, 70.52; Н, 7.19; N, 3.47. 1Н ЯМР (400 МГц; CDCl3): δ 7.50 (d, J 7.0, 2Н), 7.42 (d, J 4.3, 3Н), 7.37-7.21 (m, 5Н), 5.46 (d, J 10.2, 1H), 5.06 (d, J 2.3, 1H), 4.97-4.86 (m, 1H), 4.56 (dd, J 8.1, 1.6, 1H), 4.31 (d, J 7.3, 1H), 3.86-3.80 (m, 1H), 3.76 (s, 3H), 3.74 (s, 3H), 2.99-2.87 (m, 2H), 2.42-2.33 (m, 1H), 2.32-2.13 (m, 2H), 2.11-2.04 (m, 2H), 2.03 (s, 3H), 2.00 (s, 3H), 1.99-1.14 (m, 17H), 1.00 (t, J 10.7, 1H), 0.88 (d, J 5.4, 3H), 0.65 (s, 3Н). 13C ЯМР (100 МГц; CDCl3): δ 204.08, 173.33, 172.28, 171.96, 170.66, 168.48, 146.93, 146.69, 138.21, 137.74, 131.07, 130.98, 129.20, 128.97, 128.68, 128.49, 128.45, 128.37, 128.28, 128.23, 127.82, 127.69, 127.38, 118.93, 71.68, 67.14, 62.75, 60.14, 58.79, 52.28, 52.14, 50.76, 49.32, 47.66, 47.52, 36.74, 34.33, 33.26, 33.21, 31.20, 30.32, 28.17, 26.34, 23.30, 21.16, 20.19, 20.06, 17.91, 17.87, 14.36.
Пример 9. Получение 4-((8R,10R,13S,14S,17R)-17-ацетокси-17-ацетил-6,10,13-триметил-2,3,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-ил)-2-метил-1-(1-акрилоил-5-(метоксикарбонил)-2-фенилпирролидин-3-карбонил)-5-фенилпирролидин-2,4-дикарбоксилата (IX).
К охлажденному до минус 5°С раствору 0.510 г соединения VIII в 50 мл хлористого метилена добавляют 0.091 г триэтиламина. При перемешивании в инертной атмосфере добавляют порциями раствор 0.065 г акрилоилхлорида в 15 мл хлористого метилена, не допуская повышения температуры реакционной среды. Оставляют перемешиваться по окончании добавления акрилоилхлорида при комнатной температуре на 4 ч. Промывают водой, насыщенным раствором хлорида натрия. Органическую фазу сушат безводным сульфатом натрия, растворитель удаляют при пониженном давлении на ротационном испарителе. Твердый остаток очищают колоночной хроматографией на силикагеле, элюент петролейный эфир/этилацетат 1:1. Получают 0.470 г (87%) заявленного соединения в виде бесцветного твердого вещества, т.пл. 165°С. Вычислено, % C53H62N2O11: С, 70.49; Н, 6.92; N, 3.10. Найдено, %: С, 70.45; Н, 6.95; N, 3.19. 1Н ЯМР (400 МГц; CDCl3): δ 7.69 (d, J 7.3, 2Н), 7.51 (d, J 7.2, 2Н), 7.35 (m, 4Н), 7.26-7.21 (m, 2Н), 6.35 (d, J 17.0, 1H), 6.09 (dd, J 16.8, 10.4, 1H), 5.56 (d, J 10.3, 1H), 5.50 (d, J 11.1, 1H) 5.43 (d, J 8.4, 1H), 5.28 (s, J 5.7, 1H), 5.26 (s, 1H),4.26 (dd, J 10.3, 7.2, 1H), 3.88 (ddd, J 23.0, 13.0, 7.0, 1H), 3.77 (s, 3H), 3.71 (s, 3H), 3.67-3.01 (m, 3H), 2.94 (dd, J 15.3, 10.1, 1H), 2.65-2.41 (m, 1H), 2.34 (s, 3H), 2.05 (d, J 0.5, 3H), 2.02 (s, 3H), 1.99-1.16 (m, 16H), 1.03 (ddd, J 13.4, 10.2, 3.2, 1H), 0.91 (d, J 12.2, 3H), 0.66 (s, 3Н). 13C ЯМР (100 МГц; CDCl3): δ 14.33, 17.84, 17.90, 20.05, 20.17, 21.14, 23.27, 24.10, 26.32, 28.32, 29.30, 30.30, 31.18, 33.19, 33.26, 34.86, 34.89, 36.75, 47.51, 48.05, 49.29, 50.77, 52.34, 53.40, 59.00, 59.34, 62.44, 62.90, 96.54, 118.33, 118.64, 126.68, 127.46, 127.61, 127.68, 127.71, 128.16, 128.66, 128.84, 128.86, 128.89, 129.26, 129.59, 137.44, 138.34, 138.36, 165.38, 167.34, 168.27, 168.29, 170.64, 171.66, 204.06.
Пример 10. Определение цитотоксической активности на опухолевых клетках HeLa.
Культивирование клеток HeLa осуществлялось в стерильных условиях с использованием ламинарбокса Jouan (класс защиты II). Клетки культивировали на среде DMEM с глутамином («ПанЭко», Россия) с добавлением эмбриональной телячьей сыворотки (Invitrogen) в концентрации 10% и антибиотика-антимикотика пенициллина-стрептомицина-амфотерицина B в концентрации 100 мкг/мл (Sigma Aldrich) до получения конфлуэнтного монослоя. Инкубация осуществлялась при 37°С в условиях 5% продувки CO2. Культивировались параллельно 2 вида клеточной линии HeLa - с добавлением эстрадиола 10-8 и без добавления. Эстрадиол добавляли для создания модели гормонозависимого рака шейки матки. Клетки культивировались и пересевались с постоянной концентрацией эстрадиола за 4 недели до эксперимента.
Пересев клеток (каждые 3-4 дня) осуществлялся в стерильных условиях следующим образом:
1. Удаление культуральной среды из флакона.
2. Внесение 10 мл фосфатно-солевого буфера PBS (Sigma Aldrich) с последующей промывкой клеточного монослоя покачиванием флакона для вымывания ионов Са2+, дебриса и остатков сыворотки. Процедура повторялась 3 раза.
3. Внесение во флакон 1 мл концентрированного трипсина с последующим покачиванием флакона, и его быстрое удаление.
4. Контроль перехода клеток из монослоя в суспензию под инвертированным микроскопом с параллельным равномерным постукиванием стенок флакона.
5. Внесение 5-10 мл полной среды.
6. Из общего объема отобрать 1 мл клеточной суспензии перенести в новый стерильный флакон с полной средой для культивирования.
7. Для дальнейшего культивирования клеток в культуральный флакон вносили среду (DMEM) 7-10 мл и помещали в термостат (37°C при 5% содержании CO2 в воздухе).
Проведение МТТ-теста оценки жизнеспособности клеток.
Для оценки цитотоксического действия исследуемых соединений клетки высевали в 96-луночные планшеты в количестве 10 тыс.клеток на лунку. Соединения добавляли в диапазоне концентраций 10-9-10-2 М через 24 ч после высевания клеток, предварительно удалив среду инкубации и заменив ее средой без сыворотки для предотвращения лишней стимуляции факторами роста. На каждую концентрацию каждого соединения приходилось 4 лунки (4 повтора). Было проведено 3 независимых эксперимента. Через 72 ч с помощью реагента МТТ оценивалось количество жизнеспособных клеток спектрофотометрическим методом. Проводили оценку оптической плотности образцов на планшетном сканере Униплан-2000 версия 1.01 (Россия) при длине волны λ=530 нм. Отношение средней оптической плотности для данной концентрации вещества к средней оптической плотности в контроле принималось как доля выживших клеток.
Оптическую плотность контрольных образцов принимали за 100% выживаемость клеток. Среднюю ингибиторную концентрацию (IC50, концентрацию вещества, при которой доля жизнеспособных клеток составляла 50%) рассчитывали по формуле IC50=a+b*arctg(1+(d-1)/2c) после аппроксимации кривой Доза/Эффект логистической функцией y=c*(1-tg((x-a)/b))+d, где x - концентрация вещества, методом наименьших квадратов по коэффициентам a, b, c и d.
При обсчете результатов МТТ-теста достоверность отличия образцов от контроля оценивалась с помощью непараметрического критерия Манна-Уитни-Вилкоксона.
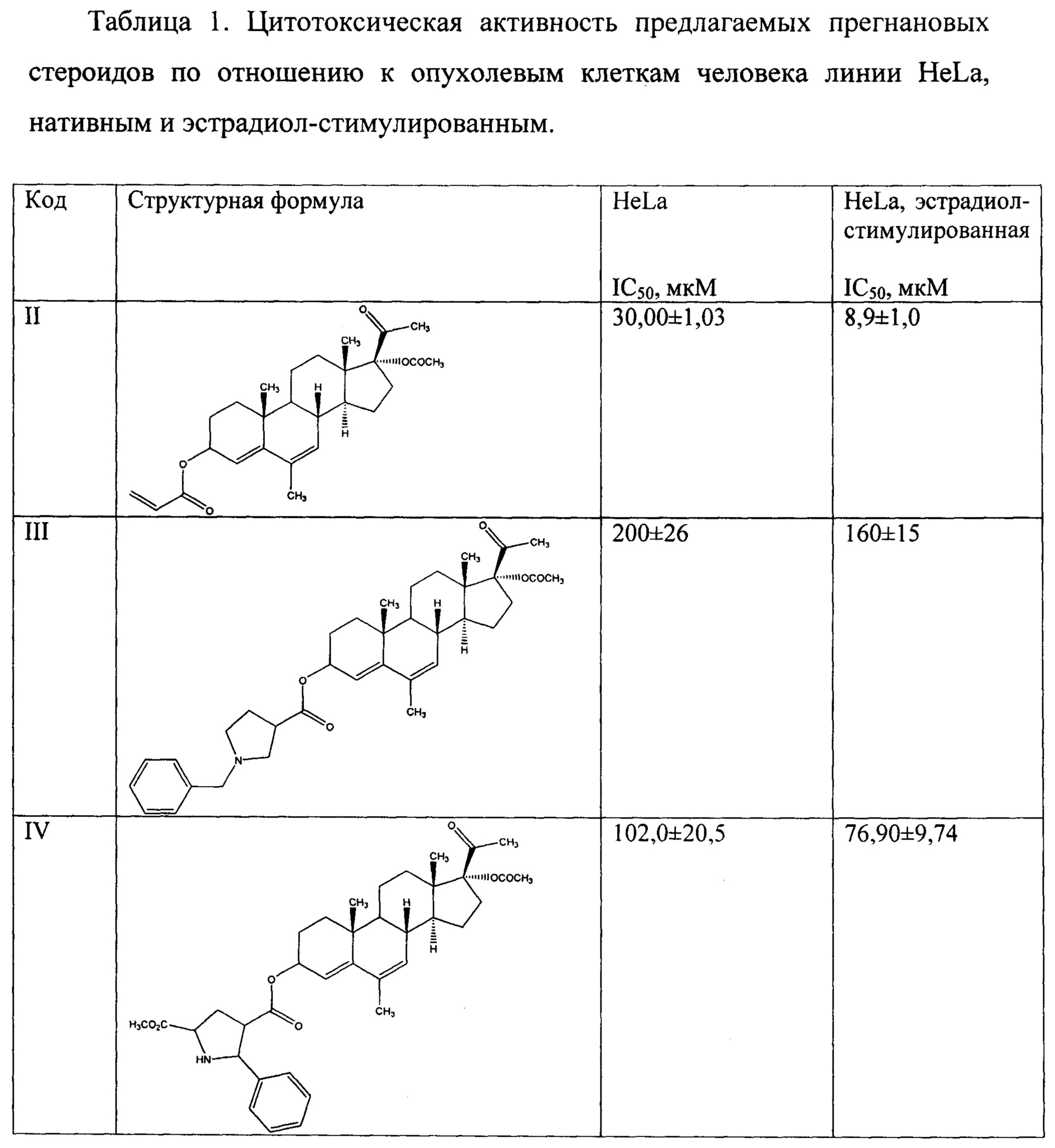
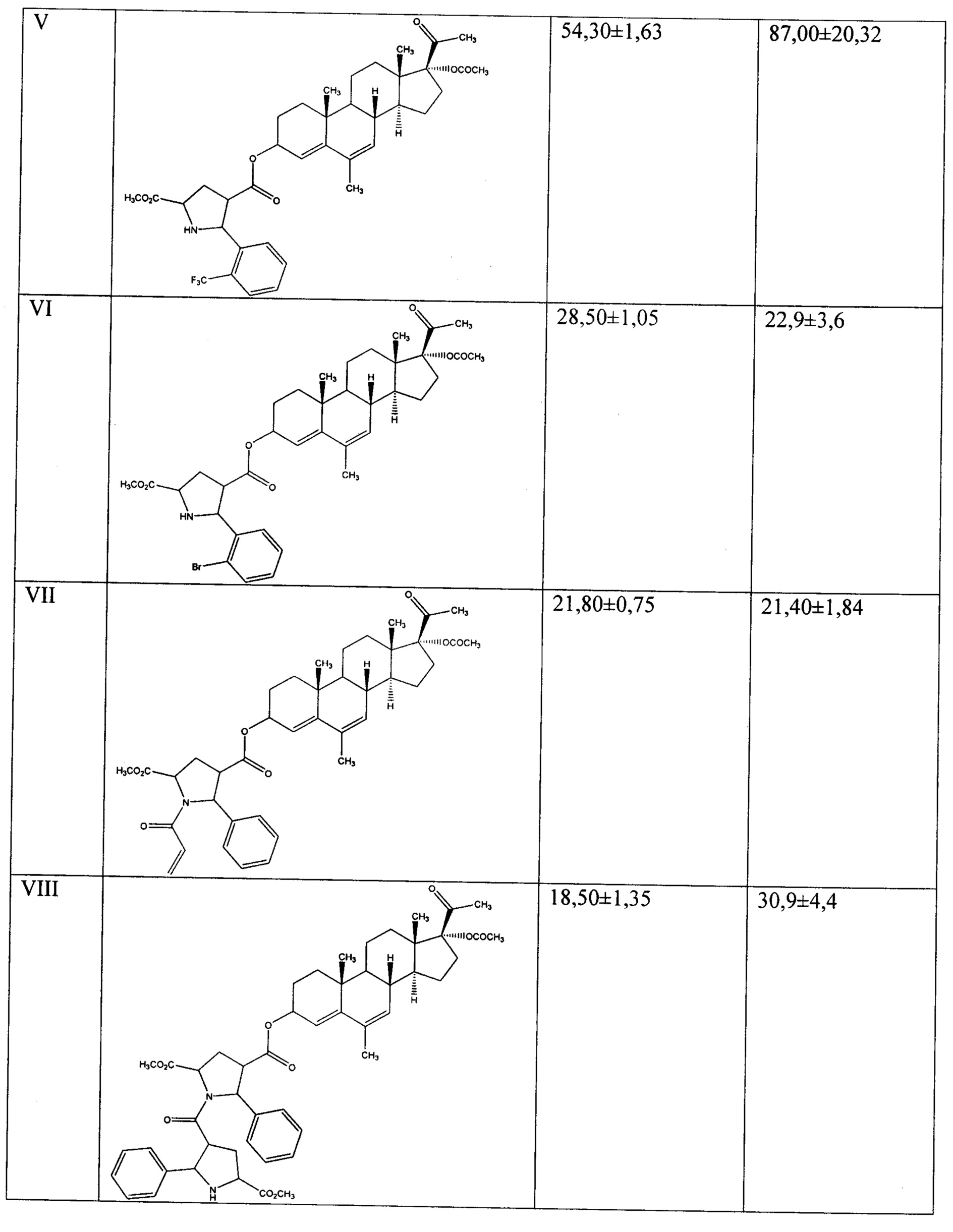
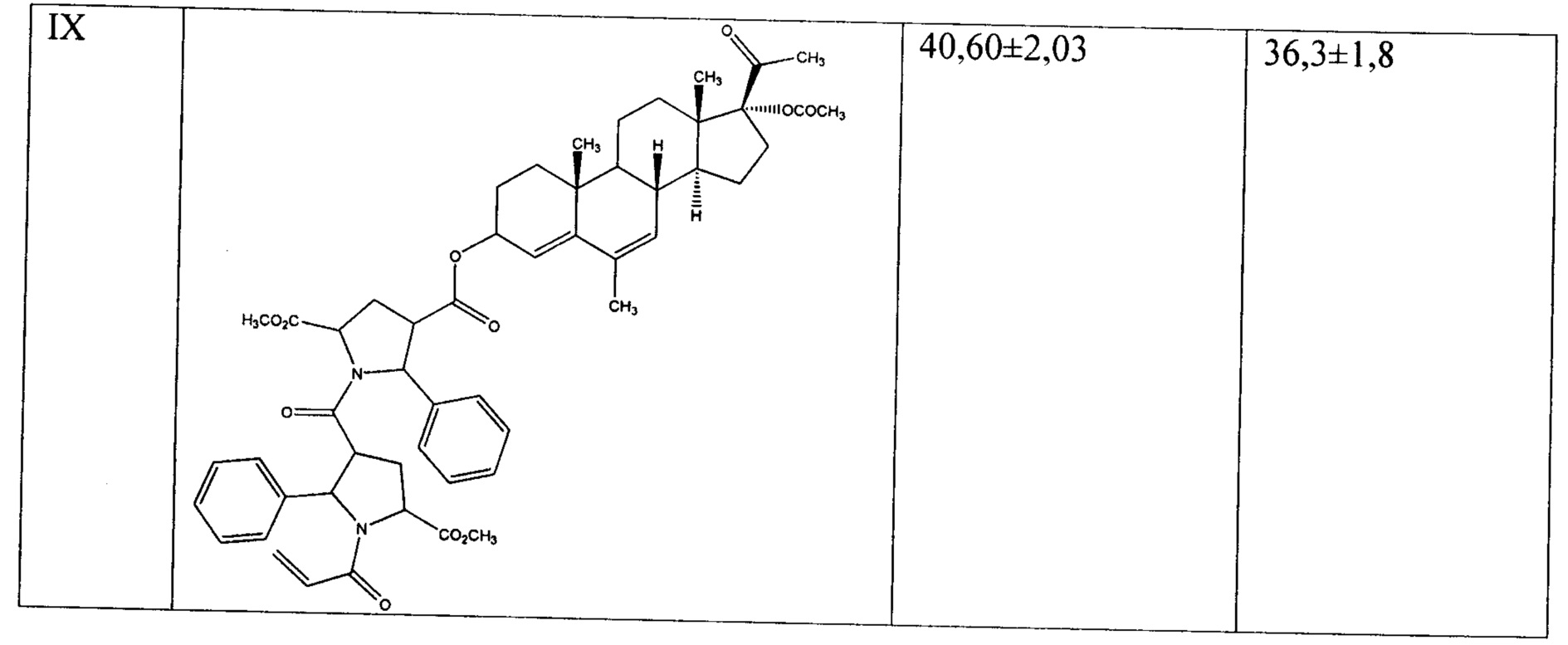
Результаты МТТ-тестов выявили цитотоксическую активность предлагаемых прегнановых стероидов по отношению к опухолевым клеткам человека линии Hela, нативным и эстрадиол-стимулированным. Значения IC50 представлены в Таблице 1