Результат интеллектуальной деятельности: НОВЫЕ КЛЕТКИ ПОЗВОНОЧНЫХ И СПОСОБЫ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ИНТЕРЕСУЮЩЕГО ПОЛИПЕПТИДА
Вид РИД
Изобретение
Область техники
[1] Настоящее изобретение относится к области технологий рекомбинантной экспрессии. Помимо прочего, оно относится к измененным клеткам позвоночных и их применению в способах рекомбинантной экспрессии. При рекомбинантной экспрессии в указанных измененных клетках интересующего полипептида, затем секретирующегося в среду для культивирования клеток, значительно снижают или даже полностью предотвращают клиппирование рекомбинантно экспрессирующегося интересующего полипептида в среде для культивирования клеток.
Уровень техники
[2] Рынок биофармацевтических средств продолжает расти с высокой скоростью, т.к. биофармацевтические средства становятся все более важными для современной медицины. В настоящее время все большее количество биофармацевтических средств получают в клетках позвоночных, например, в конкретных клетках млекопитающих. Биофармацевтические средства включают, в качестве неограничивающих примеров, антитела, фрагменты антител, ADC (конъюгат антитела и лекарственного средства), нанотела, Fc-слитые белки, факторы роста, гормоны, цитокины, ферменты и другие терапевтические полипептиды. В частности, экспрессия рекомбинантных неантительных терапевтических белков приобретает все большее значение. Кроме того, рекомбинантная экспрессия полипептидов в клетках млекопитающих также относится к другим областям применения, представляющим повышенный интерес. Учитывая производственные расходы на рекомбинантно экспрессирующиеся полипептиды, важно иметь высокоэкспрессирующие линии клеток млекопитающих. Интересующий полипептид экспрессируется и секретируется клетками млекопитающих в среду для культивирования клеток, из которой его затем собирают.
[3] Одной из основных проблем, возникающих при использовании клеток позвоночных, таких как клетки млекопитающих, в качестве клеток-хозяев для рекомбинантной экспрессии, является протеолитическая деградация экспрессирующегося и секретируемого интересующего полипептида в среде для культивирования клеток, также обозначаемая как "клиппирование". Протеазы, происходящие из клеток позвоночных, используемых для получения, являются активными в среде для культивирования клеток, протеолитическая активность которых может приводить к деградации интересующего рекомбинантно экспрессирующегося и секретируемого полипептида, таким образом, приводя к измененному, например, нефункциональному или менее функциональному интересующему полипептиду. Эта связанная с клеткой-хозяином протеолитическая деградация является одним из основных препятствий для рекомбинантной экспрессии полипептидов. Несмотря на то, что также могут быть затронуты антитела IgG, например, потому, что антитела IgG могут подвергаться клиппированию в вариабельных областях, протеолитическая деградация, т.е. клиппирование, с гораздо более высокой частотой происходит с не-IgG полипептидами. Такие не-IgG полипептиды, в частности, гликополипептиды, в результате их относительно экспонированной трехмерной структуры, могут быть очень чувствительными к протеолитической деградации. Клиппирование рекомбинантно экспрессирующихся не-IgG полипептидов может достигать значений до 100%. Клиппирование может приводить к получению неактивных и/или иммуногенных полипептидов, неприменимых для предполагаемой цели. Кроме того, даже если протеолитическая деградация происходит только с конкретной процентной долей, клиппированный полипептид нельзя использовать для предполагаемой цели, и, таким образом, снижается выход применимого интересующего рекомбинантного полипептида. Кроме того, для многих применений клиппированный полипептид необходимо удалять при очистке. Для этого может потребоваться специальная разработка способов очистки, делающих возможной отделение клиппированного от интактного полипептида, которые могут являться трудоемкими и дорогостоящими и иногда даже не являются успешными таким образом, что клиппированный белок остается в виде примеси. Таким образом, протеолитическая деградация интересующего экспрессирующегося полипептида в среде для культивирования клеток является основной проблемой при рекомбинантном получении интересующего полипептида в клетках позвоночных.
[4] В нескольких исследованиях изучали явление клиппирования для решения этой проблемы. Обнаруживали, что клиппирование зависит от времени и температуры, и его можно инактивировать посредством термической обработки. Однако, на настоящий момент немногое известно о протеазах, экспрессируемых клетками-хозяевами позвоночных, используемых для рекомбинантной экспрессии, и о протеазах, ответственных за клиппирование. Одной из основных проблем является количество протеаз, экспрессируемых клетками-хозяевами позвоночных. Например, известно более 700 протеаз, присутствующих в генах клеток грызунов, многие из которых могут участвовать в клиппировании.
[5] На современном уровне техники предложено несколько подходов для преодоления проблем клиппирования. Одним из подходов для избежания клиппирования является реконструкция затронутого белка для удаления аминокислотных мотивов, подверженных клиппированию. Однако этот подход занимает много времени, для него необходимо обширное тестирование того, является ли выбранный подход успешным, и он не гарантирует того, что реконструированный белок все еще является функциональным, не демонстрирует клиппирование в других участках и не является иммуногенным. Другим способом контроля активности протеазы в культуре клеток является добавление ингибиторов или замещающих субстратов в среду для культивирования. Однако при крупномасштабном производстве такие добавки являются дорогостоящими, и их необходимо удалять при очистке, что может потребовать специальной разработки способов очистки и чувствительных анализов для мониторинга отсутствия остатков добавок. Другие способы снижения протеолитической деградации интересующего экспрессируемого полипептида в среде для культивирования клеток включают расчет времени сбора (ранний сбор) для ограничения подвергания интересующих полипептидов воздействию протеаз в среде для культивирования клеток, снижение температуры культуры, оптимизацию условий pH или улучшение жизнеспособности клеток для снижения высвобождения внутриклеточных протеаз в среду для культивирования клеток. Кроме того, обнаруживали, что выбор линии клеток позвоночного, используемой в качестве клетки-хозяина для получения, может оказывать влияние на клиппирование в зависимости от протеаз, экспрессируемых соответствующей клеточной линией, и отдельного интересующего полипептида, подлежащего экспрессии. Таким образом, одним из вариантов является скрининг различных линий клеток для идентификации линии клеток, где клиппирование интересующего полипептида не происходит или происходит в меньшей степени, что, однако, занимает много времени, и в этом случае может потребоваться адаптация способа получения для выбранной линии клеток. Несмотря на то, что эти разные варианты могут снижать клиппирование, с помощью них редко будут полностью устранять протеолитическую деградацию. Кроме того, во многих случаях необходима адаптация экспрессии и способа получения для выбранного интересующего полипептида, подлежащего экспрессии, для разработки способа получения, с помощью которого избегают или, по меньшей мере, снижают проблему клиппирования и получают интактный интересующий полипептид с достаточным выходом и чистотой. Однако такая адаптация занимает много времени и является дорогостоящей. Таким образом, необходимы улучшенные способы для решения проблемы клиппирования.
[6] Таким образом, цель настоящего изобретения относится к улучшенному способу рекомбинантного получения интересующего полипептида в клетках позвоночных, где снижают или устраняют клиппирование экспрессирующего и секретируемого интересующего полипептида в среде для культивирования клеток. В частности, цель настоящего изобретения относится к новым клеткам позвоночных, в которых снижают или устраняют клиппирование интересующего полипептида, экспрессирующегося и секретируемого указанными клетками.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[7] Настоящее изобретение, помимо прочего, основано на неожиданном обнаружении того, что изменение клетки позвоночного для ухудшения эффекта эндогенной протеазы матриптазы, например посредством снижения или устранения функциональной экспрессии гена матриптазы, значимо снижает протеолитическую деградацию ("клиппирование") рекомбинантного интересующего полипептида, экспрессирующегося и секретируемого указанной клеткой в среде для культивирования клеток. Таким образом, ухудшение эффекта матриптазы в указанной клетке снижает клиппирование секретируемого рекомбинантного интересующего полипептида по сравнению с соответствующей клеткой позвоночного, в которой эффект матриптазы не ухудшается. С обнаружением матриптазы идентифицировали ключевую протеазу, ответственную за клиппирование рекомбинантно экспрессирующихся и секретируемых полипептидов. Изменение клетки позвоночного для ухудшения эффекта матриптазы делает возможным значительное улучшение рекомбинантного получения интересующего полипептида посредством снижения или устранения клиппирования рекомбинантно экспрессирующегося и секретируемого интересующего полипептида в среде для культивирования клеток. Таким образом, повышается выход интактного интересующего полипептида. Как показано в примерах, эти полезные эффекты не наблюдают при ухудшении функции других протеаз, что подтверждает, что матриптаза является основной протеазой, ответственной за клиппирование. Новые клетки позвоночных по настоящему изобретению устраняют потребность в реконструкции интересующего полипептида, подлежащего экспрессии, для удаления протеолитических участков или тщательной адаптации способа получения для снижения или предотвращения клиппирования или для конструирования конкретных способов очистки для удаления клиппированного белка. Предпочтительно, эти измененные клетки позвоночных, представленные в настоящем описании, можно использовать в качестве универсальных клеток-хозяев для экспрессии различных интересующих полипептидов, включая интересующие полипептиды, особенно подверженные клиппированию. Специальная адаптация полипептида, подлежащего экспрессии, или системы экспрессии устаревает, что экономит время и расходы. Кроме того, как показано в примерах, измененная клетка позвоночного по настоящему изобретению демонстрирует хорошие характеристики роста и экспрессии. Таким образом, при ухудшении эффекта матриптазы все равно получают клетки-хозяева с предпочтительными характеристиками экспрессии, важными для рекомбинантной экспрессии интересующего полипептида. Таким образом, настоящее изобретение вносит важный вклад в уровень техники.
[8] По первому аспекту настоящее изобретение относится к выделенной клетке позвоночного, подходящей для рекомбинантной экспрессии интересующего полипептида, где клетку позвоночного изменяют для ухудшения эффекта матриптазы, и она содержит по меньшей мере один гетерологичный полинуклеотид, кодирующий интересующий полипептид, где клетка позвоночного секретирует интересующий полипептид. Клетку позвоночного изменяют для ухудшения эффекта матриптазы, например, посредством снижения или устранения функциональной экспрессии гена матриптазы в указанной клетке позвоночного, например, посредством сайленсинга гена, делеции гена или мутагенеза гена матриптазы, таким образом, что экспрессируется нефункциональный или менее функциональный белок. Ухудшение эффекта матриптазы в клетке позвоночного снижает клиппирование интересующего секретируемого рекомбинантного полипептида по сравнению с соответствующей клеткой позвоночного, в которой эффект матриптазы не ухудшен. Как показано в примерах, помимо прочего, на основе экспериментов с контрольными образцами, в супернатанте среды для культивирования клеток, полученном при культивировании соответствующим образом измененных клеток позвоночных, в которых эффект матриптазы ухудшен, клиппирование интересующих рекомбинантных полипептидов неожиданно сильно снижается, несмотря на то, что другие протеазы все равно являются активными в супернатанте. Эти результаты подтверждали посредством экспрессии нескольких интересующих полипептидов в соответствующим образом измененных клетках, где эффект матриптазы ухудшен. Эти результаты подтверждают, что матриптаза является ключевой протеазой, отвечающей за клиппирование интересующего рекомбинантно экспрессирующегося и секретируемого полипептида. Таким образом, клетки позвоночных по первому аспекту являются особенно подходящими в качестве клеток-хозяев для технологий рекомбинантного получения, и их можно использовать для рекомбинантного получения интересующего полипептида, секретируемого клеткой позвоночного в среду для культивирования клеток, из которой его затем собирают.
[9] По второму аспекту настоящее изобретение относится к способу получения клетки позвоночного по первому аспекту, включающему изменение клетки позвоночного для ухудшения эффекта матриптазы и встраивание полинуклеотида, кодирующего интересующий полипептид, подлежащий экспрессии, где указанный интересующий полипептид секретируется клеткой позвоночного. Ухудшения эффекта можно достигать, например, посредством снижения или устранения функциональной экспрессии гена матриптазы в указанной клетке, например, посредством сайленсинга гена, делеции гена или мутагенеза гена матриптазы таким образом, что экспрессируется нефункциональный или менее функциональный белок.
[10] Третий аспект относится к способу рекомбинантного получения интересующего полипептида, включающему применение клетки позвоночного по первому аспекту в качестве клетки-хозяина для рекомбинантной экспрессии интересующего полипептида. Как описано выше, в результате достигаемого сниженного уровня клиппирования полипептида в среде для культивирования клеток, эти измененные клетки позвоночных являются особенно подходящими в качестве клеток-хозяев для рекомбинантного получения интересующего полипептида, в частности, полипептидов, подверженных клиппированию, таких как гликополипептиды. Предпочтительный вариант осуществления относится к способу рекомбинантного получения интересующего полипептида, включающему
(a) культивирование клеток-хозяев позвоночных по первому аспекту в условиях, делающих возможной экспрессию и секрецию интересующего полипептида в среду для культивирования клеток;
(b) выделение интересующего полипептида из среды для культивирования клеток; и
(c) необязательно, обработку выделенного интересующего полипептида.
[11] Четвертый аспект относится к способу рекомбинантного получения интересующего полипептида, включающему
(a) культивирование клеток-хозяев позвоночных, содержащих по меньшей мере один гетерологичный полинуклеотид, кодирующий интересующий полипептид в условиях, делающих возможной экспрессию и секрецию интересующего полипептида в среду для культивирования клеток, где среда для культивирования клеток содержит ингибитор протеазы, являющийся селективным в отношении матриптазы;
(b) выделение интересующего полипептида из среды для культивирования клеток; и
(c) необязательно, обработку выделенного интересующего полипептида.
[12] Пятый аспект относится к способу селекции клетки-хозяина, рекомбинантно экспрессирующей интересующий полипептид, включающему
(a) получение клеток позвоночных по первому аспекту в качестве клеток-хозяев; и
(b) селекцию одной или нескольких клеток-хозяев, экспрессирующих интересующий полипептид.
[13] По шестому аспекту настоящее изобретение относится к применению клетки позвоночного для рекомбинантного получения интересующего полипептида, секретируемого клеткой позвоночного, где используемую клетку изменяют для ухудшения эффекта эндогенной протеазы матриптазы. Соответствующим образом измененные клетки, например, можно трансфицировать с использованием полинуклеотида, кодирующего интересующий полипептид, предназначенный для экспрессии и секреции указанной клеткой. При использовании соответствующих клеток позвоночных, где эффект эндогенной протеазы матриптазы ухудшен, никакое или сниженное количество функциональной матриптазы является активным в среде для культивирования клеток. Это значимо снижает или даже устраняет протеолитическую деградацию интересующего рекомбинантного полипептида, секретируемого клетками в среде для культивирования клеток. Таким образом, предпочтительно использовать такую измененную клетку позвоночного для экспрессии рекомбинантного белка.
[14] По седьмому аспекту настоящее изобретение относится к способу селекции клетки позвоночного для рекомбинантного получения интересующего полипептида, включающему анализ того, является ли эндогенная протеаза матриптаза функционально экспрессирующейся в клетке позвоночного, и селекцию клетки позвоночного, в которой эффект такой эндогенной матриптазы ухудшен для рекомбинантного получения интересующего полипептида. Этот способ селекции делает возможной идентификацию клеток позвоночных, способных продуцировать рекомбинантный интересующий полипептид, где снижено клиппирование интересующего полипептида в среде для культивирования клеток. Соответствующие клетки позвоночных особенно подходят для получения рекомбинантного белка.
[15] Другие цели, признаки, преимущества и аспекты настоящего изобретения станут очевидными специалистам в этой области из следующего описания и формулы изобретения. Однако следует понимать, что следующее описание, формула изобретения и конкретные примеры, хотя и указывают на предпочтительные варианты осуществления изобретения, приведены исключительно в иллюстративных целях. По прочтении следующего ниже специалистам в этой области станут очевидны различные изменения и модификации без отклонения от сущности и объема описываемого изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
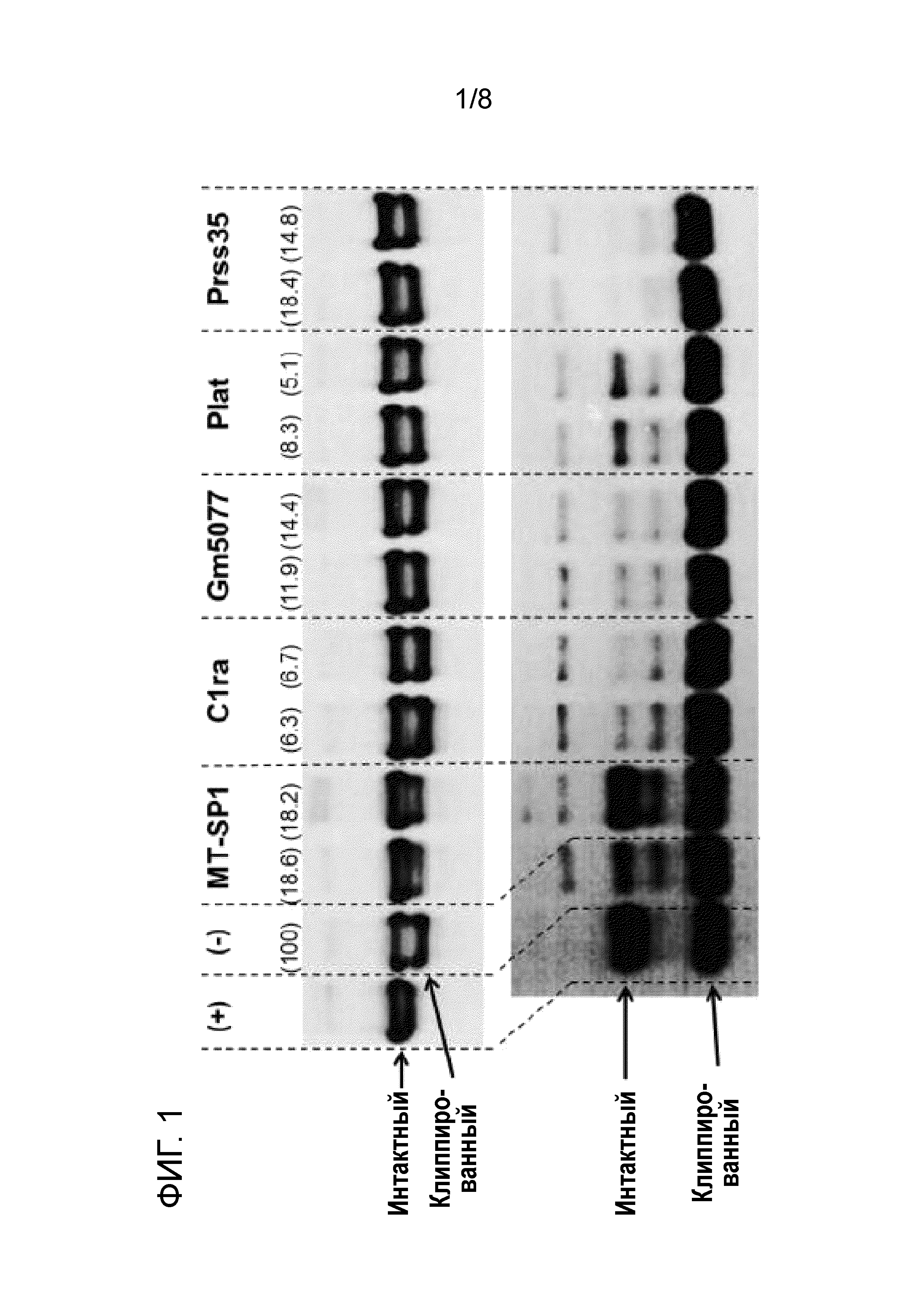
[16] На фиг. 1 показан вестерн-блоттинг двух терапевтических белков (верхняя панель: IgG (mAb), нижняя панель: Fc-слитый белок), инкубируемых в течение нескольких дней в кондиционированной среде, полученной посредством культивирования клеток CHO, трансфицированных с использованием миРНК, направленной против различных генов-мишеней протеаз (инкубация в течение 7 дней в случае mAb, инкубация в течение 3 дней в случае Fc-слитого белка). Первый контроль "(+)" представляет собой образец интересующего полипептида, инкубируемый в течение того же периода времени в химически определенной среде для культивирования, не приводимой в контакт с клетками. Химически определенная среда для культивирования, используемая в качестве контроля, являлась той же средой для культивирования, что и среда для культивирования, в которой клетки культивировали для получения кондиционированной среды. Второй контроль "(-)" представляет собой образец интересующего полипептида, инкубируемый в кондиционированной среде, полученной из клеток CHO, трансфицированных с использованием неэффективной миРНК (125 пмоль), служащей в качестве миРНК отрицательного контроля. Названия целевых трипсин-подобных сериновых протеаз и гомологов, экспрессию которых подвергали сайленсингу посредством трансфекции с использованием миРНК, приведены над верхней панелью (MT-SP1 (матриптаза, также обозначаемая в настоящем описании как St14), C1r (также обозначаемая как C1ra), C1s (также обозначаемая как Gm5077), Plat и Prss35). В случае каждой из комбинаций "интересующий полипептид/кондиционированная среда клеток с подвергнутой сайленсингу экспрессией протеазы" представлены результаты двух схем экспериментов с различными концентрациями миРНК. Кроме того, на фиг. 1 ниже определена и указана в скобках процентная доля остаточной экспрессии гена протеазы в отношении экспрессии гена протеазы в клетках с миРНК отрицательного контроля, принятой за 100%. Это означает, например, в отношении MT-SP1 (18,6%), что после сайленсинга наблюдали остаточную экспрессию гена 18,6%. MT-SP1: 125 пмоль (18,6%) и 150 пмоль (18,2%), C1r (C1ra): 125 пмоль (6,3%) и 150 пмоль (6,7%), C1s (Gm5077): 100 пмоль (11,9%) и 125 пмоль (14,4%), Plat: 125 пмоль (8,3%) и 150 пмоль (5,1%) и Prss35: 100 пмоль (18,4%) и 125 пмоль (14,8%). Результаты свидетельствуют о том, что если уровень мРНК MT-SP1 подвергается отрицательной регуляции посредством РНК-интерференции, в кондиционированной среде происходит значительно меньше клиппирования (определяемого для mAb и Fc-слитого белка). Если другие экспрессируемые трипсин-подобные сериновые протеазы подвергались отрицательной регуляции, клиппирование оставалось тем же. Таким образом, результаты свидетельствуют о том, что матриптаза является ключевой протеазой, ответственной за клиппирование.
[17] На фиг. 2 представлена последовательность экзона 2 гена матриптазы и фланкирующие интронные области в клетках, полученных из CHO-K1. Конструировали праймеры для секвенирования (показаны курсивом, полужирным шрифтом и подчеркнуты) для воздействия на фланкирующие интроны для подтверждения полученной из CHO-K1 последовательности экзона 2 MT-SP1 (закрашено серым). Участки связывания ДНК-связывающих доменов TALEN, используемых для получения нокаутных по матриптазе клеток, показаны полужирным шрифтом и подчеркнуты и область-мишень для нокаутной мутации показана полужирным шрифтом и подчеркнута двойной линией.
[18] На фиг. 3 показана столбиковая диаграмма, на которой представлена относительная экспрессия мРНК матриптазы, измеряемая в полученных из CHO-K1, нокаутных по матриптазе клонах клеток KO-1-KO-9, клоне Δ7/Δ15 и полученной из CHO-K1 линии клеток дикого типа (WT). Экспрессию мРНК матриптазы в полученной из CHO-K1 линии клеток дикого типа определяли как 100%. Как можно видеть, экспрессия мРНК матриптазы снижалась во всех нокаутных клонах и клоне Δ7/Δ15.
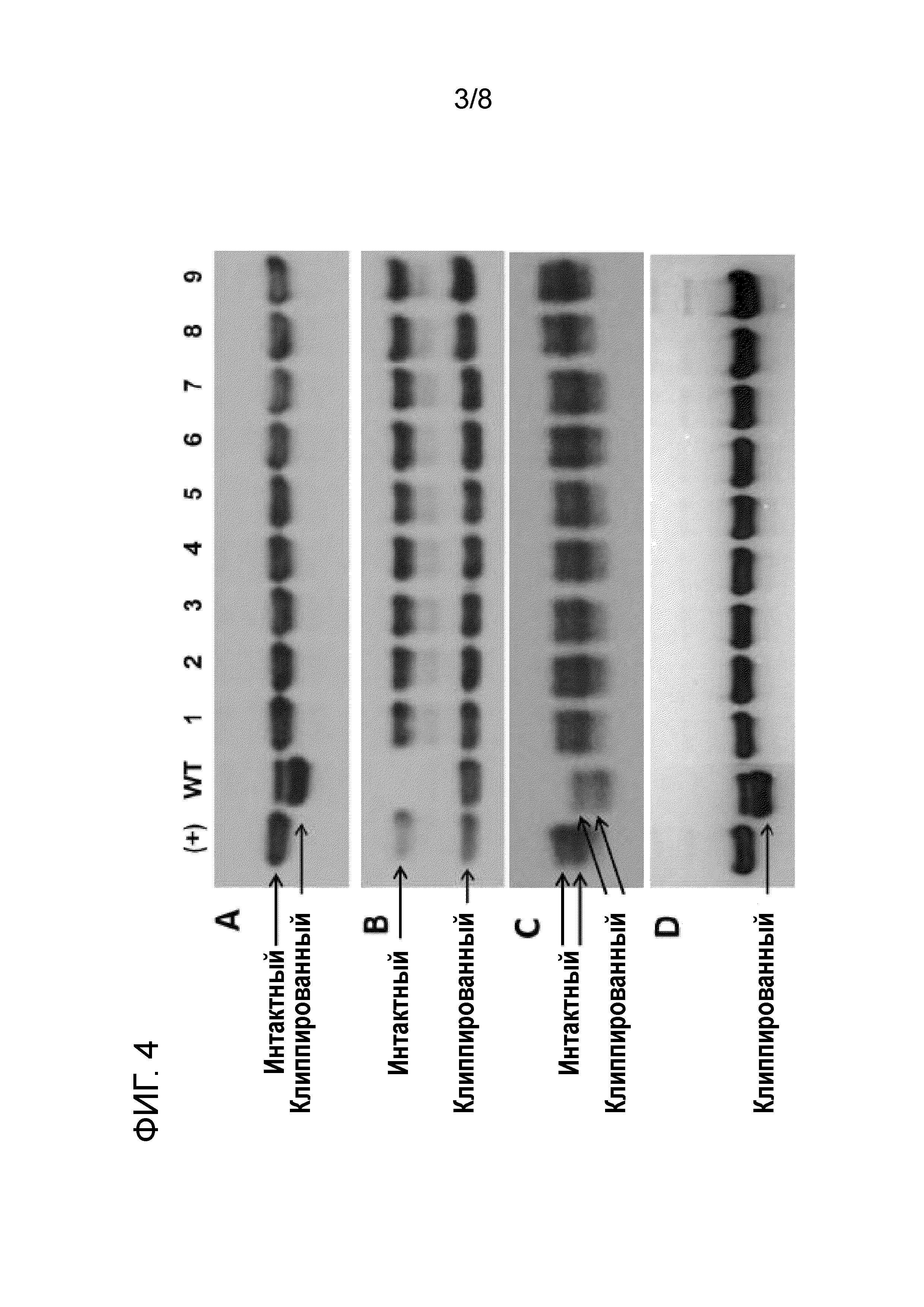
[19] На фиг. 4 показан вестерн-блоттинг трех разных интересующих полипептидов, подверженных клиппированию, инкубируемых в супернатанте среды для культивирования клеток CHO-K1 дикого типа (WT) и множества различных полученных из CHO-K1 клонах клеток, в которых матриптазу подвергали нокауту посредством различных мутаций (см. пример 2, в частности, таблицу 5). Интересующие полипептиды (концентрация каждого 0,7 мкМ) инкубировали в кондиционированной среде, полученной с помощью клеток CHO-K1 дикого типа (WT), нокаутных клонов KO-1-KO-9, представленных в таблице 5 (указаны на фиг. 4 под номерами 1-9, соответственно), или химически определенной среде, не приводимой в контакт с клетками (+). Интересующий полипептид на фиг. 4A является IgG (mAb), и время инкубации составляло 48 ч. Интересующий полипептид на фиг. 4B является Fc-слитым белком, время инкубации составляло 24 ч. Интересующий полипептид на фиг. 4C является дополнительным рекомбинантным белком с двумя гликовариантами, время инкубации составляло 1 ч. Оба гликоварианта подвергались клиппированию в кондиционированной среде, полученной из клеток CHO-K1 дикого типа (WT). Интактные и клиппированные белки указаны стрелками. На фиг. 4D представлен результат повторения эксперимента с mAb с использованием кондиционированной среды, полученной с помощью соответствующих клеток, культивируемых в течение трех месяцев. Условия инкубации были идентичны условиям на фиг. 4A. Результаты свидетельствуют об эффективном предотвращении клиппирования в кондиционированной среде, полученной с помощью нокаутных по матриптазе клонов клеток KO-1-KO-9, и что эти предпочтительные результаты сохраняются при длительном культивировании.
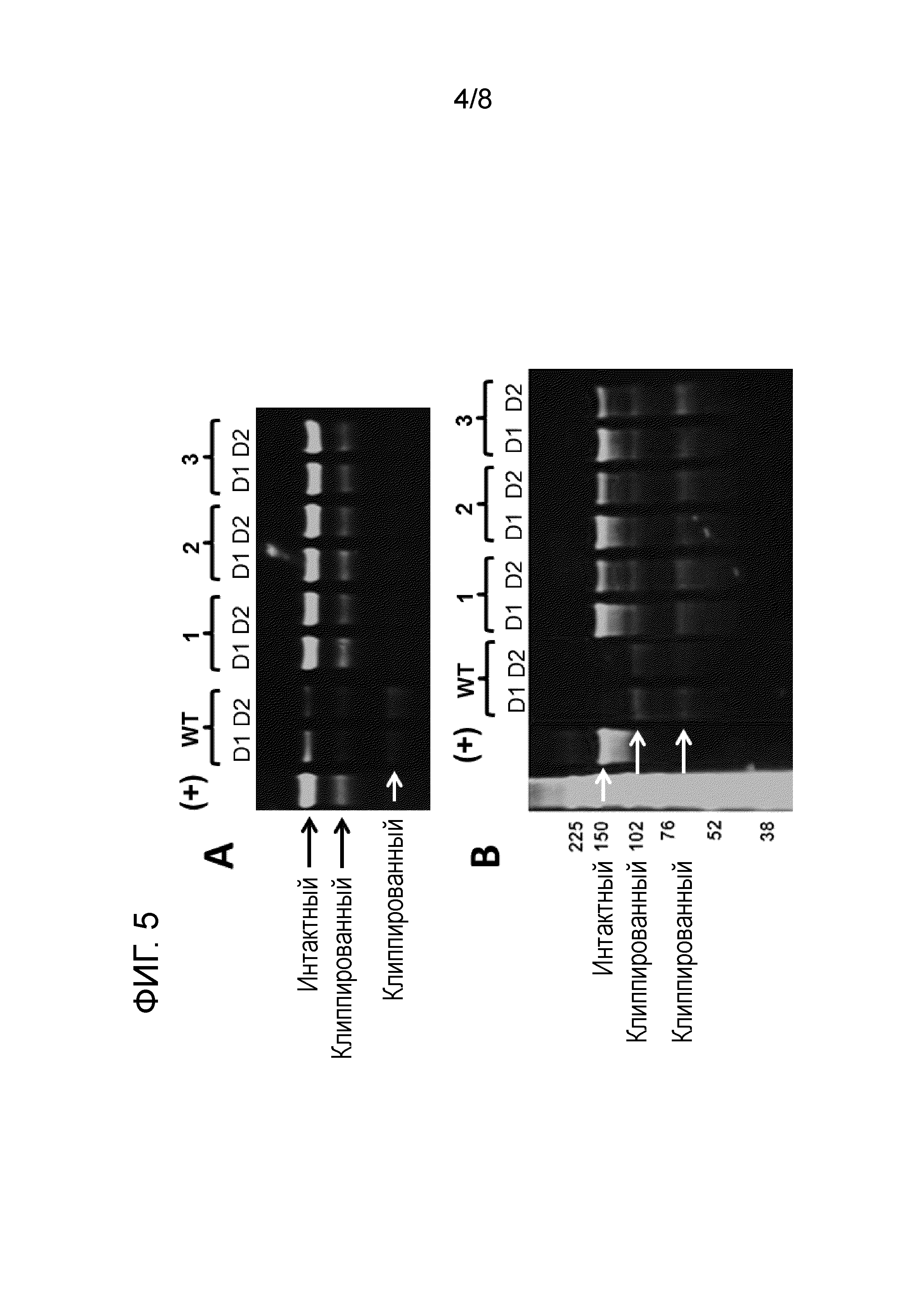
[20] На фиг. 5A и B представлены вестерн-блоттинги двух разных вирусных гликопротеинов (интересующих полипептидов), подверженных клиппированию. Интересующие полипептиды инкубировали в кондиционированной среде, полученной с помощью линии клеток, полученной из CHO-K1, экспрессирующих матриптазу (WT), и различных клонов клеток, в которых матриптазу подвергали нокауту (KO-1-KO-3). Интересующие полипептиды инкубировали в концентрации 0,7 мкМ в кондиционированной среде, полученной с помощью клеток дикого типа (WT), кондиционированной среде, полученной с помощью нокаутных клонов KO-1-KO-3, представленных в таблице 5 (указанных под номерами 1-3, соответственно), или химически определенной среде для культивирования, не приводимой в контакт с клетками (+). D1 указано время инкубации 24 ч., и D2 - время инкубации 48 ч. Интактные и клиппированные белки указаны стрелками (белыми и черными стрелками). Числа на левой стороне вестерн-блоттинга на фиг. 5B представляют собой определяемую молекулярную массу в кДа. Результаты свидетельствуют о том, что клиппирование значительно снижается в кондиционированной среде, полученной с помощью нокаутных по матриптазе клонов.
[21] На фиг. 6 показан вестерн-блоттинг Fc-слитого белка (фиг. 6A) и IgG (mAb) (фиг. 6B), инкубируемых в супернатанте среды для культивирования клеток, полученной с помощью клеток CHO, экспрессирующих матриптазу дикого типа ("WT1" и "WT2"), и клона CHO, в котором матриптазу подвергали мутагенезу ("Δ7/Δ15"), таким образом, что снижали функциональную экспрессию матриптазы. Соответствующая химически определенная среда для культивирования ("(+)"), не приводимая в контакт с клетками, служила в качестве положительного контроля. Fc-слитый белок и mAb (концентрация каждого 0,7 мкМ) инкубировали в течение 2 ч. и 24 ч., соответственно. Числа сбоку от вестерн-блоттинга представляют собой приблизительную молекулярную массу в кДа, как определяли по гелю. Результаты свидетельствуют о том, что клиппирование снижали в кондиционированной среде, полученной с помощью мутантного клона клеток, Δ7/Δ15 в котором функциональная экспрессия активной матриптазы снижена.
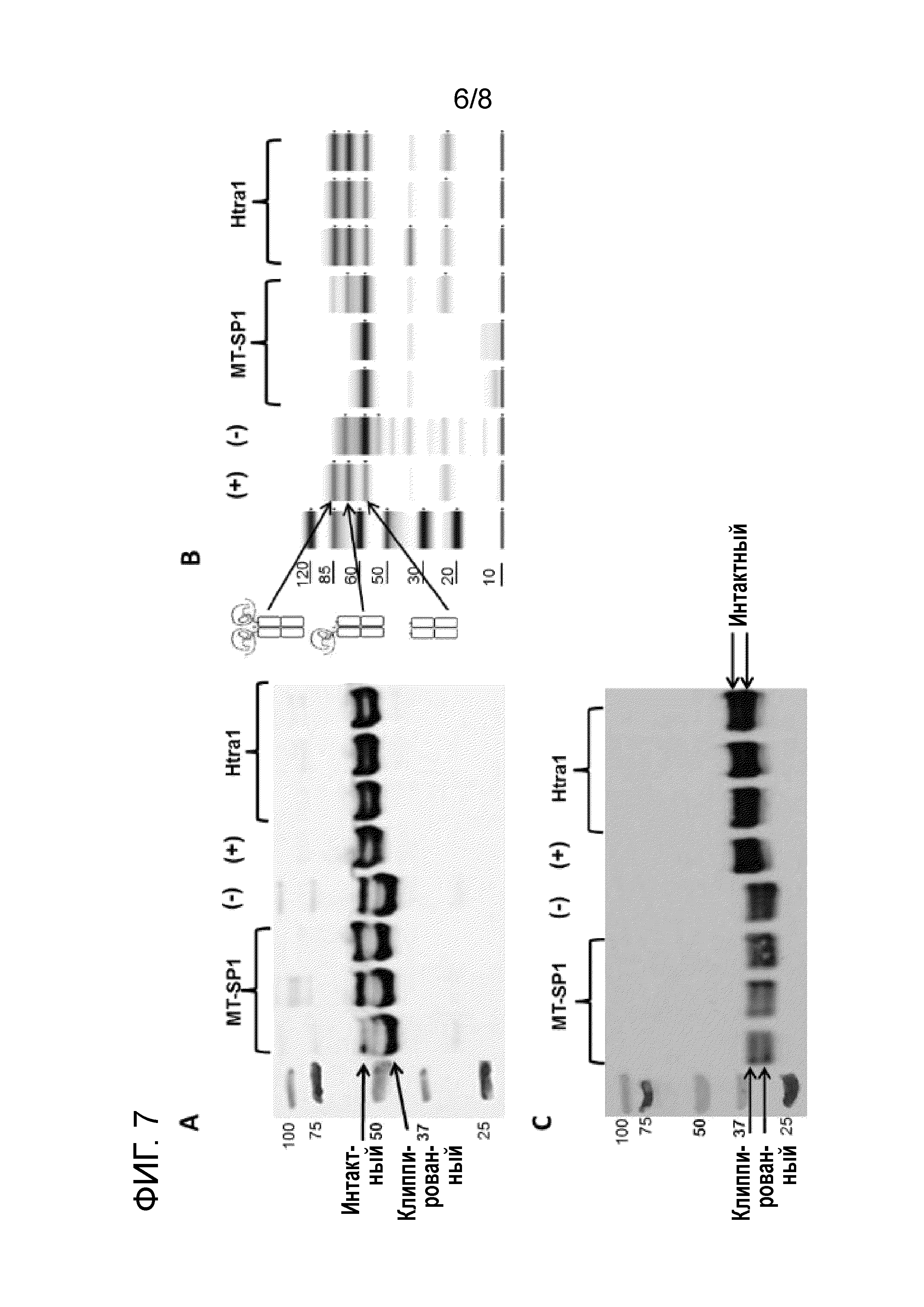
[22] На фиг. 7 показаны результаты совместной инкубации различных интересующих полипептидов с двумя различными трипсин-подобными протеазами, а именно матриптазой мыши (MT-SP1) и человека Htra1. На Фиг. 7A показан анализ вестерн-блоттинга mAb (время инкубации 24 ч.), на фиг. 7B - капиллярный электрофорез Fc-слитого белка в геле (Caliper LabChip®) (время инкубации 2 ч.), и на фиг. 7C - анализ вестерн-блоттинга дополнительного рекомбинантного белка (время инкубации 1 ч.). Концентрация интересующего полипептида составляла 0,7 мкМ во всех экспериментальных схемах. Каждый интересующий полипептид тестировали с использованием снижаемых количеств MT-SP1 и Htra1: молярные соотношения протеазы и интересующего полипептида слева направо составляют 1/10, 1/100 и 1/1000 для MT-SP1 и 1/3, 1/10 и 1/100 для Htra1. Интересующие полипептиды также инкубировали в течение того же периода времени в химически определенной среде для культивирования "(+)" и кондиционированной среде (супернатанте), полученной с помощью клеток дикого типа, полученных из CHO-K1, "(-)". Интактные белки (более крупные) и клиппированные белки (меньшие) указаны стрелками на фиг. 7A и 7C. На фиг. 7B представлены два типа клиппированных полипептидов помимо интактного полипептида (все показаны стрелками и указаны сбоку). На фиг. 7A-7C показано, что клиппирование происходит в присутствие матриптазы, таким образом, подтверждено, что матриптаза является ключевой протеазой, ответственной за клиппирование.
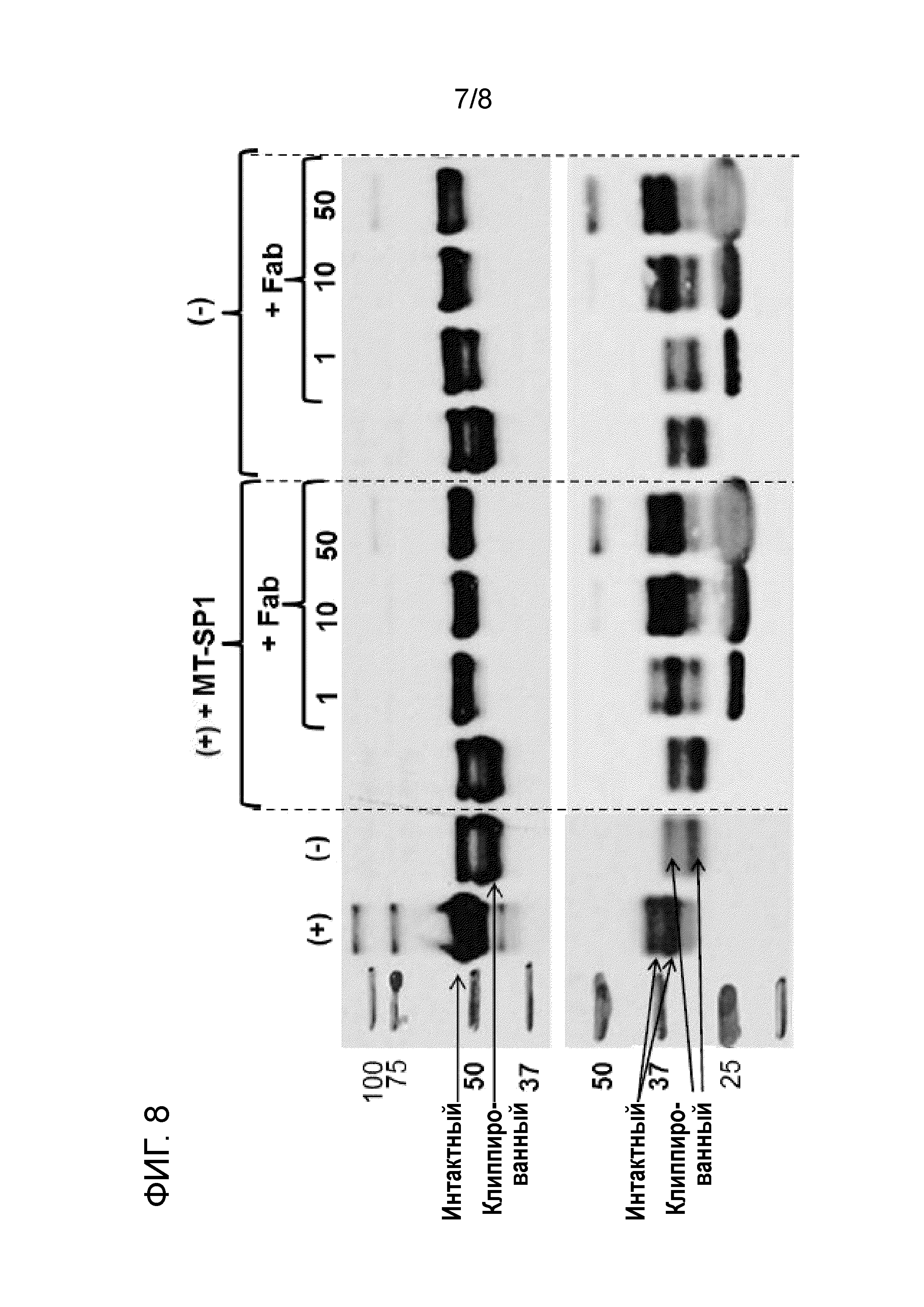
[23] На фиг. 8 показан анализ вестерн-блоттинга двух интересующих полипептидов, моноклонального антитела IgG (верхняя панель, время инкубации 24 ч.) и рекомбинантного белка (нижняя панель, время инкубации 1 ч.). Интересующие полипептиды (концентрация каждого 0,7 мкМ) инкубировали в химически определенной среде для культивирования "(+)", кондиционированной среде, полученной с помощью клеток дикого типа, полученных из CHO-K1, "(-)", или химически определенной среде для культивирования с рекомбинантной матриптазой, добавленной из Mus Musculus ((+)+MT-SP1). В несколько образцов добавляли ингибиторный Fab-фрагмент против MT-SP1, как указано ("+ Fab"). Концентрация Fab в образце указана над дорожкой (1 мкМ, 10 мкМ или 50 мкМ). Стрелками указаны белковые полосы, представляющие интактный или клиппированный белок. Белковая полоса, соответствующая 25 кДа, на дорожках, где добавляли Fab-фрагмент, соответствует Fab-фрагменту. Результаты свидетельствуют о том, что добавление Fab-фрагмента против MT-SP1 (являющегося селективным ингибитором матриптазы) в среду для культивирования клеток, в которых матриптаза является активной, снижает или даже полностью предотвращает клиппирование. Результаты дополнительно подтверждают то, что матриптаза является ключевой протеазой, ответственной за клиппирование.
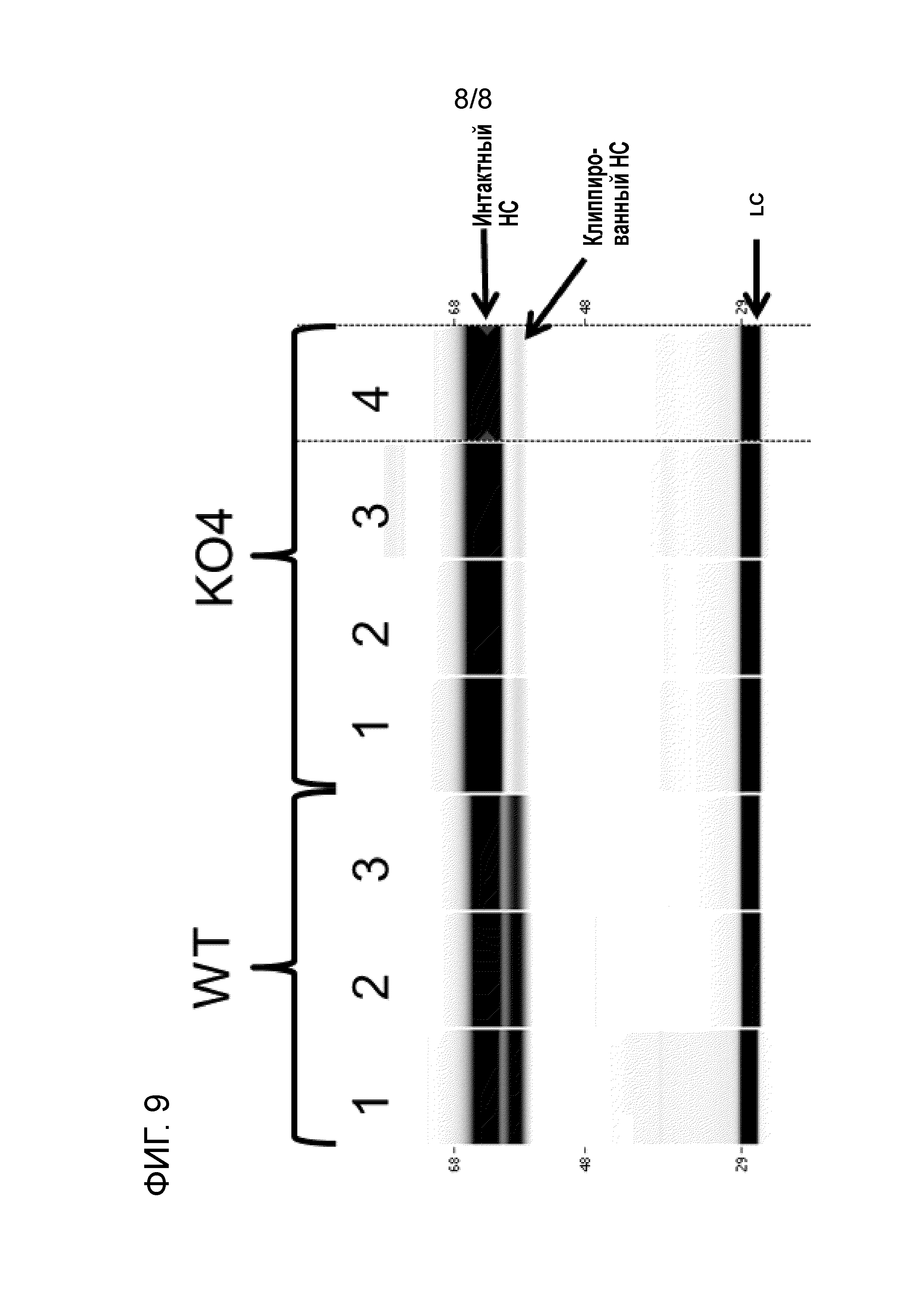
[24] На фиг. 9 показан результат капиллярного чип-электрофореза (Caliper LabChip®). Рекомбинантное mAb экспрессировали в полученных из CHO-K1 клетках дикого типа (WT) или нокаутных по матриптазе клетках (KO-4, также см. таблицу 5) и очищали с использованием аффинной хроматографии (с протеином A). Числа над дорожками представляют собой различные совокупности продуцирующих mAb клеток, полученных способами параллельной трансфекции и селекции. В каждой дорожке три белковые полосы являются видимыми, что указано стрелками. Верхняя белковая полоса соответствует интактной тяжелой цепи mAb, вторая полоса (непосредственно под первой) соответствует клиппированной тяжелой цепи антитела, и полоса внизу соответствует легкой цепи mAb. Результаты свидетельствуют о том, что клиппирование значительно снижается при экспрессии интересующего полипептида в нокаутных по матриптазе клетках.
ПОДРОБНОЕ ОПИСАНИЕ
[25] Настоящее изобретение, помимо прочего, основано на неожиданном обнаружении того, что измененная клетка позвоночного, в которой эффект эндогенной протеазы матриптазы ухудшен, например, посредством снижения или устранения функциональной экспрессии гена матриптазы, способна экспрессировать и секретировать интересующий рекомбинантный полипептид в среду для культивирования клеток, где, однако, клиппирование интересующего рекомбинантного полипептида в среде для культивирования клеток значительно снижено. Таким образом, среди сотен различных протеаз идентифицировали основную протеазу, ответственную за клиппирование рекомбинантно экспрессирующихся и секретируемых полипептидов. Также весьма удивительно было то, что направленное воздействие и ухудшение активности отдельной протеазы является достаточным для значительного снижения или даже устранения клиппирования в среде для культивирования клеток. Использование, например, соответствующим образом измененных клеток позвоночных по изобретению делает возможным значительное улучшение рекомбинантного получения интересующего полипептида посредством повышения выхода интересующего интактного полипептида, который можно получать из среды для культивирования клеток после экспрессии и секреции. Таким образом, при использовании измененной клетки позвоночного по изобретению для рекомбинантного получения интересующего полипептида для снижения протеолитической деградации и, таким образом, предотвращения клиппирования интересующего полипептида необязательно осуществлять дополнительные измерения. Таким образом, настоящее изобретение вносит важный вклад в уровень техники.
[26] Далее будут подробно описаны отдельные аспекты и подходящие и предпочтительные варианты осуществления настоящего изобретения.
A. Измененные клетки позвоночных
[27] По первому аспекту настоящее изобретение относится к выделенной клетке позвоночного, подходящей для рекомбинантной экспрессии интересующего полипептида, где клетку позвоночного изменяют для ухудшения эффекта матриптазы, и она содержит по меньшей мере один гетерологичный полинуклеотид, кодирующий интересующий полипептид, где клетка позвоночного секретирует интересующий полипептид. Ухудшение эффекта матриптазы в клетке позвоночного снижает клиппирование интересующего секретируемого рекомбинантного полипептида по сравнению с соответствующей клеткой позвоночного, в которой эффект матриптазы не ухудшен.
[28] Матриптазу впервые описали в 1993 году в качестве новой желатинолитической активности в культивируемых злокачественных клетках молочная железа. Матриптаза принадлежит к семейству трансмембранных сериновых протеаз типа II (TTSP). Ортологи матриптазы присутствуют у разных видов позвоночных, включая виды млекопитающих, и их идентифицировали, например, у человека, шимпанзе, собаки, мыши, крысы, курицы, данио-рерио, зеленого тетрадона и рыбы-собаки, что позволяет предполагать эволюционно консервативную функцию. Матриптаза указана в номенклатуре ферментов IUBMB как EC 3.4.21.109. Матриптаза также известна как сериновая протеаза мембранного типа 1 (MT-SP1) и супрессор канцерогенности-14 (ST14) (см. Chen et al, The Transmembrane Serine Protease Matriptase: Implications for Cellular Biology and Human Diseases J Med Sci 2012; 32 (3): 097-108). Она является интегральным мембранным белком с однопроходным трансмембранным доменом, близким к цитоплазматическому N-концу. Внеклеточная часть состоит из области стебля (включающей один домен SEA, 2 домена CUB и 4 домена LDLRA) и C-концевого домена сериновой протеазы, структурно очень схожего с другими TTSP и включающего консервативную каталитическую триаду гистидин/аспарагиновая кислота/серин (HDS), необходимую для каталитической активности (см., например, List et al, Matriptase: Potent Proteolysis on the cell Surface; MOL MED 12 (1-3) 1-7, JANUARY-MARCH 2006 и Chen et al, The Transmembrane Serine Protease Matriptase: Implications for Cellular Biology and Human Diseases J Med Sci 2012; 32 (3): 097-108). Описывают, что матриптаза экспрессируется в эпителии многих систем органов таких как кожа, молочная железа, легкие, эпидермис, роговица, слюнная железа, полости рта и носа, щитовидная железа, тимус, пищевод, трахея, бронхиолы, альвеолы, желудок, поджелудочная железа, желчный пузырь, двенадцатиперстная кишка, тонкий кишечник, толстый кишечник, прямая кишка, почка, надпочечники, мочевой пузырь, мочеточник, семенные пузырьки, придатки яичка, предстательная железа, яичники, матка и влагалище (см. List et al, 2006 и Chen et al, 2012). Матриптаза синтезируется в виде неактивного зимогена и превращается в свою активную форму в ходе сложного процесса. Подробности, относящиеся к процессу активации, включающему эндопротеолитическое расщепление, описаны для матриптазы человека в List et al 2006 и Chen et al 2012. Матриптаза связана с мембраной в виде трансмембранного белка типа II с каталитическим доменом, ориентированным во внеклеточное пространство. Кроме того, в литературе описано, что значительное отщепление матриптазы, соответственно, ее внеклеточной части, происходит in vivo (см. List et al, 2006 и Chen et al 2012). В литературе описано, что матриптаза отщепляется в форме комплекса, например, комплекса с ингибитором сериновой протеазы типа Куница HAI-1. В различных исследованиях предполагают, что в клетках человека специфичный ингибитор HAI-1 облегчает транспорт матриптазы к мембране клетки, т.к. показано, что удаление или даже отдельные точечные мутации в HAI-1 приводят к накоплению матриптазы в комплексе Гольджи. В литературе описано несколько разных эндогенных ингибиторов матриптазы помимо HAI-1, таких как HAI-2, антитромбин, альфа-1-антитрипсин и альфа-2-антиплазмин. Кроме того, также описаны другие ингибиторы матриптазы (см., например, Chen et al, 2012). В литературе описано, что матриптаза может играть множество ролей в нормальной физиологии, такой как барьерная функция кожи, целостность эпителия, развитие волосяного фолликула и гомеостаз тимуса, и в патологиях человека, таких как остеоартрит, атеросклероз и прогрессирование, инвазия и метастаз опухоли.
[29] На этом научном фоне, не касающемся рекомбинантного получения интересующего полипептида, неожиданным является настоящее открытие того, что матриптаза является ключевой протеазой, ответственной за клиппирование рекомбинантно получаемых интересующих полипептидов, секретируемых клетками-хозяевами в среду для культивирования клеток. Учитывая большое количество и разнообразие протеаз, экспрессирующихся в клетках позвоночных, таких как, в частности, клетки млекопитающих, даже более неожиданным является то, что ухудшение функции этой отдельной протеазы матриптазы является достаточным для значительного снижения или даже устранения клиппирования интересующего секретируемого полипептида в среде для культивирования клеток. Эти предпочтительные эффекты не наблюдают для других, даже близкородственных протеаз, что подтверждает важность открытия того, что матриптаза является ключевым фрагментом, ответственным за клиппирование секретируемых рекомбинантных полипептидов в среде для культивирования клеток. Как показано в примерах, при использовании измененных клеток позвоночных, где эффект эндогенной протеазы матриптазы ухудшен, клиппирование интересующего рекомбинантного полипептида, секретируемого клеткой в среду для культивирования клеток, значительно снижено. Например, ухудшение функции матриптазы посредством сайленсинга гена (например, РНКи, как показано в примере 1) или мутации эндогенного гена матриптазы (например, нокаута одного или обоих из двух аллелей матриптазы, как показано в примерах 2 и 5) приводит к значительному снижению или даже полному устранению клиппирования рекомбинантно экспрессирующегося и секретируемого интересующего полипептида в среде для культивирования клеток. Обнаруживали значительное снижение клиппирования для всех тестируемых полипептидов, подверженных клиппированию, таких как антитела IgG, Fc-слитые белки, гликозилированные вирусные белки и другие терапевтически активные белки. Таким образом, предпочтительным является использование дефектной по матриптазе линии клеток для получения интересующего полипептида посредством рекомбинантной экспрессии. Из примеров также очевидно, что матриптаза напрямую расщепляет интересующий полипептид, секретируемый в среду для культивирования клеток. Таким образом, любое ухудшение эффекта матриптазы снижает клиппирование рекомбинантно экспрессирующегося полипептида, секретируемого в среду для культивирования клеток. Кроме того, как показано в примерах, добавление селективного ингибитора матриптазы в среду для культивирования клеток также может снижать клиппирование.
[30] Т.к. эффект эндогенной протеазы матриптазы ухудшен в клетке позвоночного по первому аспекту настоящего изобретения, наблюдают отсутствие функционально активной матриптазы или менее функционально активную матриптазу в среде для культивирования клеток, в которой культивируют указанные клетки, например, потому что в таких клетках не присутствует или присутствует сниженное количество функциональной матриптазы на поверхности клеток и/или в среду для культивирования клеток не высвобождается (например, по причине отщепления) или высвобождается сниженное количество функциональной матриптазы. Таким образом, протеолитическая деградация интересующего рекомбинантного полипептида, секретируемого в среду для культивирования клеток, значительно снижается или даже устраняется, что является важным преимуществом при рекомбинантном получении интересующего полипептида. Т.к. клиппирование значительно снижено, выход интересующего интактного полипептида повышен. Образуется меньше или даже не образуется нефункциональный и потенциально иммуногенный клиппированный побочный продукт. Кроме того, обнаруживали, что эти новые клетки-хозяева позвоночных, как правило, демонстрируют хороший выход экспрессии и имеют хорошие характеристики роста, что делает их особенно подходящими в качестве производственных линий клеток. Дополнительные преимущества описывают ниже, и они также очевидны из примеров. Таким образом, эти предпочтительные клетки позвоночных делают возможным рекомбинантное получение интересующего полипептида с улучшенным качеством и выходом продукта. Кроме того, использование клеток позвоночных по изобретению, предпочтительно являющихся клетками млекопитающих, снижает время, необходимое для разработки производственной линии клеток для рекомбинантного получения интересующего полипептида. Для избежания или снижения клиппирования необходима меньшая оптимизация, или даже оптимизация интересующего полипептида, например, посредством изменения аминокислотной последовательности, не является необходимой. В частности, устаревает удаление участков клиппирования. Кроме того, можно избегать занимающих много времени способов очистки для удаления клиппированного белка при использовании этих клеток в качестве производственной линии клеток. Таким образом, эти клетки позвоночных обладают важными преимуществами при использовании в качестве линий клеток-хозяев для технологий рекомбинантного получения.
[31] В списке последовательностей представлены примеры аминокислотных последовательностей матриптазы различных видов позвоночных, таких как хомяк (SEQ ID NO: 1 - референсная последовательность NCBI: XP_003495890), человек (SEQ ID NO: 2 - референсная последовательность NCBI: NP_068813), мышь (SEQ ID NO: 3 - референсная последовательность NCBI: NP_035306), крыса (SEQ ID NO: 4 - референсная последовательность NCBI: NP_446087) и шимпанзе (SEQ ID NO: 5 - референсная последовательность NCBI: NP_001189434). Как видно из таблицы 1, матриптазу в настоящее время также обозначают как "белок-супрессор канцерогенности 14 " (например, в случае человека) и "гомолог белка-супрессора канцерогенности 14" (например, у мыши и китайского хомяка). Как применяют в настоящем описании, термин "матриптаза", в частности, включает любой белок, обладающий по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере,90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности по отношению к одному или нескольким белкам, представленным в SEQ ID NO: 1-5 как референсный белок матриптаза и имеющим ту же протеолитическую активность, что и указанный референсный белок матриптаза. Как применяют в настоящем описании, идентичность вычисляют по всей длине референсного белка. Матриптаза отличается от других протеаз. В литературе матриптазе приписывают различные названия, некоторые из которых представлены в таблице 1. Соответствующим генам, кодирующим фермент матриптазу, также приписывают различные названия, некоторые из которых представлены в таблице 1. В контексте изобретения протеазу для простоты обозначают как "матриптаза", "MT-SP1", "белок-супрессор канцерогенности 14" или "гомолог белка-супрессора канцерогенности 14". Однако, термин "матриптаза" также относится к любым альтернативным названиям указанного белка или соответствующего гена, например, используемым для характеризации соответствующего белка или гена у различных видов, и включает их. Гомологи и ортологи матриптазы, имеющие одинаковую функцию, включены в термин "матриптаза". В этом контексте следует отметить, что матриптаза-2 и матриптаза-3 относятся к протеазам, отличающимся от матриптазы (хотя и являющимся структурно родственными) и, таким образом, не охвачены используемым в настоящем описании термином "матриптаза".
Таблица 1: Примеры альтернативных названий гена матриптазы и/или кодируемого белкового продукта матриптазы, используемых в литературе (в алфавитном порядке)
|
[32] Ген, кодирующий белок матриптазу, в настоящем описании также обозначают как "ген матриптазы". Геномная последовательность гена различных видов млекопитающих известна, и ее описывают, например, для китайского хомяка (NCBI Gene-ID: 100755225); Homo sapiens (NCBI Gene-ID: 6768); Mus musculus (NCBI Gene-ID: 19143); Rattus norvegicus (NCBI Gene-ID: 114093); Pan Troglodytes (NCBI Gene-ID: 100188950) и др. Синонимы для гена матриптазы представлены в таблице 1, общеупотребительными являются "ST14" или "St14". Как применяют в настоящем описании, термин "ген матриптазы", в частности, включает любой эндогенный ген клетки позвоночного, кодирующий белок матриптазы, как представлено в SEQ ID NO: 1-5 или кодирующий белок матриптазу, обладающий по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности по отношению к одному или нескольким белкам матриптазы, представленным в SEQ ID NO: 1-5 в качестве референсного белка матриптазы и имеющим ту же протеолитическую активность, что и указанный референсный белок матриптаза. Как применяют в настоящем описании, идентичность вычисляют по всей длине референсного белка.
[33] Помимо прочего, настоящее изобретение относится к модифицированной клетке позвоночного, такой как, предпочтительно, клетка млекопитающего, где эффект эндогенной матриптазы, как правило, являющейся эндогенно экспрессируемой соответствующей немодифицированной клеткой позвоночного, ухудшается в указанной клетке. В результате этого изменения, ухудшающего эффект эндогенной протеазы матриптазы, измененная клетка позвоночного, представленная в настоящем описании, не презентирует или не высвобождает функциональную матриптазу или презентирует или высвобождает сниженные количества функциональной матриптазы в среде для культивирования клеток, при этом клиппирование секретируемого интересующего полипептида в среде для культивирования клеток снижают или даже полностью предотвращают. Как показано в примерах, это изменение, которое может являться транзиторным или постоянным, значительно снижает протеолитическую деградацию интересующего рекомбинантного полипептида, секретируемого указанной измененной клеткой в среде для культивирования клеток.
[34] Есть несколько возможностей для изменения и, таким образом, модификации клетки позвоночного для ухудшения эффекта эндогенной матриптазы в указанной клетке. Эффект матриптазы можно ухудшать, например, на уровне гена или белка. Эффект матриптазы можно ухудшать, например, посредством модификации структуры/последовательности матриптазы, транскрипции, трансляции и/или клеточного транспорта матриптазы. Неограничивающие варианты описаны далее.
[35] По одному из вариантов осуществления эффект матриптазы ухудшен, т.к. в указанной клетке снижена или устранена функциональная экспрессия гена матриптазы. Как показано в примерах, изменение экспрессии гена матриптазы посредством снижения или устранения функциональной экспрессии гена матриптазы, например, посредством сайленсинга гена или нокаута гена, является очень эффективной мерой обеспечения пригодности клетки позвоночного для экспрессии интересующего рекомбинантного полипептида, где, однако, снижают клиппирование интересующего секретируемого полипептида в среде для культивирования клеток или его даже полностью избегают. Обнаруживали, что, если функциональная экспрессия гена матриптазы снижена или устранена в клетке позвоночного, клиппирование интересующего секретируемого рекомбинантного полипептида в среде для культивирования клеток аналогично снижено. Эта корреляция является неожиданным открытием.
[36] Снижения или устранения функциональной экспрессии матриптазы можно достигать различными способами. Функциональную экспрессию можно снижать, например, снижая уровень экспрессии матриптазы, или снижая каталитическую активность матриптазы, или комбинируя то и другое. По одному из вариантов осуществления клетку изменяют таким образом, что функциональную экспрессию гена матриптазы снижают или устраняют посредством нокаута гена, мутации гена, делеции гена, сайленсинга гена или комбинации любых из указанного выше. По одному из вариантов осуществления геном клетки позвоночного изменяют для ухудшения эффекта матриптазы.
[37] По одному из вариантов осуществления функциональную экспрессию гена матриптазы снижают или устраняют в клетке посредством нокаута гена. Нокаут гена является генетическим способом, посредством которого ген делают недействующим с помощью нарушения его функции. Например, нуклеиновую кислоту можно встраивать в кодирующую последовательность, таким образом, нарушая функцию гена. Кроме того, полный ген матриптазы или его часть можно подвергать делеции, при этом функциональный белок не экспрессируется соответствующим образом измененной клеткой. Другим вариантом является встраивание одной или нескольких нокаутных мутаций в кодирующую последовательность, что приводит к нефункциональному или менее функциональному продукту экспрессии. Например, можно встраивать одну или несколько мутаций сдвига рамки считывания, приводящих к нефункциональному или менее функциональному белку. Альтернативно или дополнительно, в кодирующую последовательность можно встраивать один или несколько стоп-кодонов таким образом, что получают укороченный, нефункциональный или менее функциональный белок. Таким образом, по одному из вариантов осуществления ген матриптазы содержит одну или несколько мутаций, приводящих к нефункциональному или менее функциональному продукту экспрессии. По одному из вариантов осуществления указанные одна или несколько мутаций являются мутациями сдвига рамки считывания или мутациями с образованием стоп-кодонов. По одному из вариантов осуществления весь домен протеазы, локализованный на C-конце матриптазы, или его часть отсутствуют в результате одной или нескольких встроенных мутаций. Другие варианты включают, в качестве неограничивающих примеров, встраивание одной или нескольких мутаций в промотор, 5'-UTR, 3'-UTR и/или другие регуляторные элементы. По одному из вариантов осуществления нарушена функция промотора гена матриптазы, например, посредством делеции промотора или встраивания конструкции между промотором и точкой начала транскрипции. Способы достижения нокаута гена для супрессии или устранения функциональной экспрессии гена-мишени также хорошо известны специалисту в этой области и, таким образом, не требуется какое-либо их подробное описание в настоящем описании. Тем не менее, некоторые неограничивающие примеры описаны ниже.
[38] По одному из вариантов осуществления ген матриптазы подвергают функциональному нокауту посредством генетической инженерии. Неограничивающие примеры включают геномное редактирование, такое как геномное редактирование с использованием сконструированных нуклеаз (GEEN). Это является типом генетической инженерии, при котором ДНК встраивают, заменяют или удаляют из генома с использованием искусственно сконструированных нуклеаз, или "молекулярных ножниц". Нуклеазы создают специфичные двухцепочечные разрывы (DSB) в желаемых участках генома и используют эндогенные механизмы клетки для репарации вызванного разрыва с помощью природных процессов гомологичной рекомбинации (HR) и негомологичного соединения концов (NHEJ). Существует по меньшей мере четыре семейства сконструированных нуклеаз, которые можно использовать для этой цели: нуклеазы с цинковыми пальцами (ZFN), подобные активатору транскрипции эффекторные нуклеазы (TALEN), нуклеаза, распознающая кластерные регулярно расположенные короткие палиндромные повторы (CRISPR) и сконструированные мегануклеазы - реконструированные хоминг-эндонуклеазы. Технологию TALEN также использовали в примерах для получения измененных клеток млекопитающих, где ген матриптазы подвергают полному или частичному нокауту, таким образом, ухудшая эффект матриптазы в указанных клетках.
[39] По одному из вариантов осуществления одну или несколько копий гена матриптазы, присутствующего в геноме клетки позвоночного, изменяют, например, подвергают нокауту или делеции, для снижения или устранения и, таким образом, ухудшения эффекта матриптазы в клетке позвоночного. Таким образом, по одному из вариантов осуществления по меньшей мере одну копию гена матриптазы подвергают делеции или функционально инактивируют в геноме клетки позвоночного. По одному из вариантов осуществления клетка позвоночного содержит одну или несколько мутаций по меньшей мере в одной копии гена матриптазы для получения нефункционального или менее функционального продукта экспрессии. В основном, клетка позвоночного содержит две аллельные копии гена матриптазы. Одну или несколько мутаций можно встраивать в одну или обе копии гена матриптазы. Предпочтительно, одну или несколько мутаций встраивают в обе, соответственно, все копии гена матриптазы для получения нефункционального или менее функционального продукта экспрессии и, таким образом, ухудшения эффекта матриптазы в клетке позвоночного. Таким образом, в геноме все копии гена матриптазы, по существу, ухудшают или инактивируют. Как показано в примерах, различные мутации можно встраивать в различные аллели гена матриптазы для достижения ухудшения.
[40] По одному из вариантов осуществления указанные одна или несколько мутаций содержатся в кодирующей области гена матриптазы и приводят к нефункциональному или менее функциональному продукту экспрессии. Например, можно ухудшать функцию матриптазы, т.к. измененная клетка позвоночного содержит одну или несколько мутаций в области гена матриптазы, кодирующего аминокислотную последовательность, присутствующую в нескольких каталитически активных и, таким образом, функциональных вариантах сплайсинга матриптазы. Идентифицировано несколько вариантов сплайсинга матриптазы в различных видах. Несколько экзонов матриптазы обнаружено в большинстве или даже всех идентифицированных функциональных вариантах сплайсинга. Предпочтительно встраивать одну или несколько мутаций в область гена матриптазы, кодирующую экзон, присутствующий в нескольких, предпочтительно - в большинстве, или даже всех функциональных вариантах сплайсинга матриптазы соответствующей клетки позвоночного.
[41] По одному из вариантов осуществления одна или несколько мутаций содержатся в полинуклеотидной последовательности, кодирующей экзон 2 матриптазы. Выбор экзона 2 в качестве мишени для изменения для ухудшения функции эндогенной протеазы матриптазы в измененной клетке позвоночного обладает преимуществом, состоящим в том, что этот подход охватывает несколько разных функциональных вариантов сплайсинга. Экзоны, близкие к N-концу матриптазы, такие как, например, экзон 1, экзон 2 и экзон 3, являются предпочтительными мишенями для встраивания одной или нескольких мутаций, в частности, одной или нескольких мутаций со сдвигом рамки считывания. Мутация со сдвигом рамки считывания в одном из этих экзонов, наиболее вероятно, приводит к образованию преждевременного стоп-кодона в последовательности. Укороченный белок, кодируемый мутантным геном, наиболее вероятно, является коротким, и предполагают, что он локализуется внутриклеточно и/или является неактивным. Неактивный укороченный белок является предпочтительным, т.к. можно предположить, что его экспрессия нетоксична для клеток. Однако одну или несколько мутаций также можно встраивать в один из последующих экзонов, например, выбранных из экзонов 4-19.
[42] В примерах получали клетки CHO, содержащие различные мутации со сдвигом рамки считывания в экзоне 2. В примерах показано, что соответствующим образом измененные клетки поддерживали рост клетки. Таким образом, кодируемые укороченные версии матриптазы, тестируемые в примерах, очевидно, не являлись токсичными для клеток. Кроме того, обнаруживали, что общая экспрессия мРНК соответствующим образом подвергнутого мутагенезу гена матриптазы являлась более низкой, таким образом, что достигали более низких уровней укороченной версии (см. фиг. 3). Таким образом, в примерах показано, что соответствующее изменение является эффективным для ухудшения функции матриптазы в клетке позвоночного, такой как, предпочтительно, клетка млекопитающего, в то же время поддерживая другие характеристики, важные для рекомбинантного получения интересующего полипептида. Таким образом, по одному из вариантов осуществления выделенная клетка позвоночного содержит по меньшей мере одну мутацию со сдвигом рамки считывания в экзоне 2 гена матриптазы, приводящую к экспрессии нефункционального или менее функционального укороченного полипептида. По предпочтительному варианту осуществления клетка позвоночного является клеткой CHO, содержащей одну или несколько мутации со сдвигом рамки считывания в экзоне 2 одного или предпочтительно обоих аллелей гена матриптазы, при этом в указанной клетке CHO эффект матриптазы ухудшен.
[43] По одному из вариантов осуществления клетка позвоночного содержит одну или несколько мутаций в полинуклеотидной последовательности гена матриптазы, кодирующей, по меньшей мере, часть каталитического домена матриптазы, при этом получают нефункциональный или менее функциональный продукт экспрессии. Каталитический домен является областью фермента, взаимодействующей с ее субстратом, вызывая ферментативную реакцию. В этот домен можно встраивать одну или несколько мутаций таким образом, что снижают или устраняют каталитическую активность белка. Каталитический домен кодируется аминокислотами в экзонах 16, 17, 18 и 19. Таким образом, по одному из вариантов осуществления клетка позвоночного содержит одну или несколько мутаций в одном или нескольких экзонах, выбранных из экзона 16, экзона 17, экзона 18 и экзона 19. По одному из вариантов осуществления одна или несколько мутаций в каталитическом домене приводят к снижению или устранению каталитической активности матриптазы. Этого можно достигать, например, посредством мутации со сдвигом рамки считывания, специфичной точечной мутации, мутации с образованием стоп-кодона и/или делеции или инсерции в каталитическом домене. По одному из вариантов осуществления одну или несколько мутаций встраивают таким образом, что изменяют каталитическую триаду матриптазы, таким образом, получая нефункциональный или менее функциональный белок. Каталитически неактивные мутанты матриптазы, такие как, например, G827R-матриптаза или S805A-матриптаза, также описаны в литературе (см. Désilets et al, The Journal of Biological Chemistry Vol. 283, No. 16, pp. 10535-10542, 2008). Кроме того, известна кристаллическая структура каталитического домена рекомбинантной матриптазы. Из этих данных о структуре и последовательности специалист в этой области может получать дополнительные специфические мишени для мутаций для ухудшения каталитической функции матриптазы.
[44] Измененные клетки, где функциональная экспрессия матриптазы ухудшена, также можно получать с использованием подходов случайного мутагенеза или скрининга. На современном уровне техники известны соответствующие способы, и, таким образом, нет необходимости подробно их описывать. Измененные клетки, где функциональная экспрессия матриптазы ухудшена, затем можно идентифицировать, например, с использованием способа по седьмому аспекту.
[45] На функциональную экспрессию матриптазы также можно влиять, изменяя промотор и/или энхансер гена матриптазы таким образом, что продуцируется меньше транскрипта или транскрипт не продуцируется, или посредством технологий сайленсинга гена, таких как транскрипционный или посттранскрипционный сайленсинг гена. По одному из вариантов осуществления выделенная клетка позвоночного содержит одну или несколько мутаций в промоторной области гена матриптазы. Например, промоторную область можно изменять для получения менее функционального или нефункционального промотора, промотор можно полностью удалять. Альтернативно или дополнительно, можно добавлять полинуклеотидную последовательность, кодирующую полипептид, включая стоп-кодон между промотором и инициаторным кодоном гена матриптазы, что приводит к экспрессии другого полипептида вместо матриптазы. Полипептид, кодируемый полинуклеотидной последовательностью, встроенной между промотором и инициаторным кодоном, например, может являться репортерным полипептидом, таким как зеленый флуоресцентный белок (GFP). Сигнал репортера будет свидетельствовать о том, что вместо матриптазы экспрессируется гетерологичный полинуклеотид, кодирующий репортер, таким образом, делая возможной простую идентификацию клеток, где функциональная экспрессия матриптазы ухудшена.
[46] Снижение функциональной экспрессии гена может достигать уровня, на котором функциональную экспрессию даже устраняют.
[47] Посттранскрипционного сайленсинга гена можно достигать, например, с использованием антисмысловых молекул или молекул, опосредующих РНК-интерференцию. Неограничивающие примеры вкратце будут описаны далее.
[48] Можно конструировать антисмысловые полинуклеотиды для специфического связывания с РНК, что приводит к образованию гибридов РНК-ДНК или РНК-РНК с прекращением обратной транскрипции или трансляции матричной РНК. Разработано множество форм антисмысловых молекул, и их можно приблизительно классифицировать на фермент-зависимые антисмысловые молекулы или стерически блокирующие антисмысловые молекулы. Фермент-зависимые антисмысловые молекулы включают формы, зависящие от активности РНКазы H для деградации мРНК-мишени, включая одноцепочечную ДНК, РНК и фосфотиоатные антисмысловые. Антисмысловые полинуклеотиды, как правило, образуются в клетке посредством экспрессии из антисмысловых конструкций, содержащих антисмысловую цепь в качестве транскрибируемой цепи. Транс-расщепляющие каталитические РНК (рибозимы) являются молекулами РНК, обладающие эндорибонуклеазной активностью. Рибозимы можно специально конструировать для конкретной мишени и для сайт-специфического расщепления любых видов РНК в условиях клеточной РНК. Расщепление делает мРНК нестабильной и предотвращает экспрессию белка. Геном клетки позвоночного можно изменять таким образом, что соответствующая антисмысловая молекула, например, экспрессируется постоянно.
[49] Другой подходящий вариант для снижения функциональной экспрессии гена матриптазы на посттранскрипционном уровне основан на РНК-интерференции (РНКи). Как показано в примерах, основанных на экспериментах с контрольными образцами, снижение экспрессии матриптазы посредством РНКи является эффективным для снижения степени клиппирования интересующих рекомбинантных полипептидов, экспрессирующихся и секретируемых в среде для культивирования клеток соответствующим образом измененными клетками позвоночных. Значительно больше рекомбинантного полипептида остается интактным в супернатанте/среде для культивирования клеток после сайленсинга гена матриптазы посредством РНКи, и, таким образом, его можно собирать из нее. В отличие от этого, снижение уровней экспрессии других протеаз, даже близкородственных сериновых протеаз, не имеет или имеет небольшой эффект в отношение клиппирования. Это подчеркивает важность идентификации с помощью матриптазы основной протеазы, ответственной за клиппирование, при экспрессии рекомбинантного интересующего полипептида в клетке позвоночного, такой как, предпочтительно, клетка млекопитающего. Способы сайленсинга гена-мишени посредством РНКи хорошо известны специалисту в этой области, и, таким образом, нет необходимости в их подробном описании. Неограничивающие примеры индуцирующих РНКи соединений, которые можно использовать для сайленсинга экспрессии гена матриптазы и, таким образом, получения измененной клетки, в которой эффект матриптазы ухудшен, включают малые интерферирующие нуклеиновые кислоты (siNA), малые интерферирующие РНК (миРНК), микроРНК (мкРНК), короткие шпилечные РНК (shRNA), а также их предшественники, процессируемые в клетке до конкретного индуцирующего РНКи соединения. По одному из вариантов осуществления миРНК используют для сайленсинга. МиРНК можно получать в виде двухцепочечной молекулы, имеющей липкие 3'-концы на каждой цепи. Также можно использовать молекулы с тупыми концами. Указанная миРНК может содержать дезокси-, а также рибонуклеотиды и, кроме того, может содержать модифицированные нуклеотиды. Некоторые варианты осуществления и варианты соединений миРНК известны на современном уровне техники, и их можно использовать для снижения экспрессии матриптазы. Подходящие миРНК, направленные против выбранных/идентифицированных последовательностей-мишеней генов-мишеней на уровне РНК, можно идентифицировать с использованием соответствующих вычислительных способов, используя конкретные алгоритмы дизайна. Для получения миРНК против транскрипта-мишени клетку можно трансфицировать непосредственно с использованием двухцепочечной молекулы. Как показано в примерах, даже такие транзиторные способы, снижающие экспрессию матриптазы, являются эффективными в предотвращении клиппирования интересующего полипептида в кондиционированной среде, полученной с помощью таких клеток позвоночных. Альтернативно, миРНК может являться результатом процессинга посредством Dicer, фермента, превращающего длинную дцРНК или короткую шпилечную РНК (shRNA) в миРНК. Эти предшественники или конечные молекулы миРНК можно получать экзогенно (искусственно) и затем можно встраивать в клетки позвоночных различными способами трансфекции. По дополнительному варианту осуществления изобретения индуцирующее РНКи соединение экспрессируется с помощью вектора, с использованием которого трансфицировали клетку позвоночного. В случае миРНК это можно осуществлять, например, посредством встраивания петли между двумя цепями, таким образом, получая один транскрипт, который затем может процессироваться в функциональную миРНК в клетке позвоночного. В таких транскрипционных кассетах, как правило, используют промотор РНК-полимеразы III (например, U6 или H1), как правило, регулирующий транскрипцию малой ядерной РНК (например, для экспрессии shRNA). Предполагают, что получаемый транскрипт shRNA из вектора затем процессируется Dicer, таким образом, приводя к двухцепочечным молекулам миРНК, предпочтительно, имеющим характерные липкие 3'-концы. По одному из вариантов осуществления такой вектор, с помощью которого получают shRNA, стабильно встраивается в геном клетки позвоночного. Этот вариант осуществления является предпочтительным, т.к. отрицательная регуляция гена матриптазы является результатом постоянно продуцирующейся миРНК, стабильной, а не транзиторной. Например, клетки, содержащие соответствующий вектор, с помощью которого получают shRNA, затем можно трансфицировать с использованием экспрессирующего вектора, содержащего полинуклеотид, кодирующий интересующий полипептид, подлежащий экспрессии и секретируемый клеткой позвоночного. Кроме того, можно использовать стратегии котрансфекции, где вектор, с помощью которого получают shRNA, котрансфицируют с экспрессирующим вектором, содержащим полинуклеотид, кодирующий интересующий полипептид.
[50] Транскрипционный сайленсинг гена, например, может включать эпигенетические модификации. Кроме того, последовательность гена матриптазы можно изменять для снижения времени полужизни мРНК. С помощью этого также можно достигать снижения функциональной экспрессии матриптазы.
[51] По одному из вариантов осуществления экспрессию матриптазы снижают или устраняют посредством направленного воздействия на регуляторный элемент, участвующий в регуляции экспрессии гена матриптазы. Например, на фактор транскрипции, промотор (также см. выше), энхансер, UTR или другой регуляторный элемент можно направленно воздействовать, например, посредством нокаута, делеции, мутации, отрицательной регуляции или любого другого изменения, инактивирующего или снижающего активность указанного регуляторного элемента, таким образом, предотвращающего или снижающего функциональную экспрессию гена матриптазы и, таким образом, ухудшающего эффект матриптазы в указанных клетках.
[52] По одному из вариантов осуществления клетку позвоночного изменяют для ухудшения функции матриптазы посредством гетерологичной экспрессии мутантной матриптазы, являющейся нефункциональной или менее функциональной, чем эндогенная матриптаза. В этом варианте осуществления выделенная клетка позвоночного содержит, в дополнение к гетерологичному полинуклеотиду, кодирующему интересующий полипептид, дополнительный гетерологичный полинуклеотид, кодирующий мутантную матриптазу. Мутантная матриптаза имеет сниженную каталитическую активность или даже не имеет ее по сравнению с эндогенной матриптазой. При гиперэкспрессии соответствующей мутантной матриптазы возрастает вероятность того, что мутант, неактивная форма, встраивается в плазматическую мембрану вместо эндогенной матриптазы с образованием доминантного отрицательного фенотипа. Дополнительным вариантом для ухудшения и, таким образом, снижения эффекта матриптазы, в норме экспрессируемой клеткой, является гетерологичная экспрессия белка, такого как антитело или ингибитор матриптазы, нейтрализующие и/или ингибирующие матриптазу и, таким образом, ухудшающие эффект матриптазы.
[53] По одному из вариантов осуществления эффект матриптазы в клетке ухудшают посредством изменения функциональной экспрессии молекул, функционально взаимодействующих с матриптазой в клетке.
[54] По одному из вариантов осуществления функцию матриптазы в клетке ухудшают посредством ухудшения внутриклеточного транспорта матриптазы.
[55] По другому варианту осуществления функцию матриптазы ухудшают посредством ухудшения активации зимогена матриптазы. По одному из вариантов осуществления функцию матриптазы ухудшают посредством положительной регуляции одного или нескольких эндогенных клеточных ингибиторов матриптазы и/или посредством коэкспрессии ингибитора матриптазы. К настоящему времени описано несколько эндогенных ингибиторов матриптазы в различных клетках позвоночных, таких как HAI-1, HAI-2, альфа-1-антитрипсин, альфа-2-антиплазмин, антитромбин (см. обзор в Chen et al, 2012). Если экспрессия клеткой позвоночного подлежит изменению, положительная регуляция экспрессии этих ингибиторов и/или коэкспрессия этих ингибиторов также может ухудшать функцию эндогенной протеазы матриптазы, таким образом, снижая клиппирование интересующего секретируемого полипептида в среде для культивирования клеток.
[56] По одному из вариантов осуществления функциональная экспрессия матриптазы ухудшена посредством рекомбинантной экспрессии антагониста, такого как антитело или его связывающий домен. Например, соответствующий антагонист может гиперэкспрессироваться клеткой позвоночного.
[57] По одному из вариантов осуществления кодирующую последовательность матриптазы изменяют таким образом, что белок остается в ER. Например, белок матриптазу можно изменять так, чтобы он включал мотив KDEL, имеющий эффект, состоящий в том, что матриптаза остается в ER. Также можно использовать аналогичные подходы.
[58] Ухудшение эффекта эндогенной протеазы матриптазы приводит к получению измененной клетки, где клиппирование интересующего рекомбинантного полипептида, экспрессирующегося и секретируемого указанной измененной клеткой, снижается или даже отсутствует по сравнению с соответствующей клеткой позвоночного, в которой функция эндогенной протеазы матриптазы не ухудшена. Как представлено в настоящем описании, при использовании соответствующим образом измененных клеток, где эффект матриптазы ухудшен, в качестве клеток-хозяев для рекомбинантной экспрессии, нефункциональная или менее функциональная матриптаза является активной в среде для культивирования клеток, содержащей указанные клетки-хозяева и в которую секретируется интересующий полипептид.
[59] По одному из вариантов осуществления экспрессия гена матриптазы составляет 40% или менее, 35% или менее, 30% или менее, 25% или менее, 20% или менее, 15% или менее, 12,5% или менее, 10% или менее, 5% или менее, 2,5% или менее, 1,5% или менее, 1% или менее или 0,05% или менее по сравнению с экспрессией гена матриптазы в неизмененной соответствующей референсной клетке позвоночного, в которой эффект матриптазы не ухудшен (принят за 100%). По одному из вариантов осуществления в измененной клетке по первому аспекту экспрессия гена матриптазы составляет 0,1% или менее, или менее, 0,075% или менее, 0,05% или менее, 0,045% или менее, 0,04% или менее, 0,035% или менее, 0,03% или менее, 0,025% или менее, 0,02% или менее, 0,015% или менее, 0,01% или менее, 0,0075% или менее, 0,005% или менее, 0,0045% или менее, 0,004% или менее, 0,0035% или менее, 0,003% или менее, 0,0025% или менее, 0,002% или менее, 0,0015% или менее или 0,001% или менее по сравнению с экспрессией 18S РНК (принятой за 100%) в указанной клетке. По одному из вариантов осуществления экспрессия гена матриптазы составляет 0,00075% или менее, 0,0005% или менее или 0,0004% или менее по сравнению с экспрессией 18S РНК (принятой за 100%) в указанной клетке. Функциональную экспрессию гена матриптазы снижают или устраняют таким образом, что снижают клиппирование интересующего рекомбинантного полипептида, секретируемого указанной клеткой в среде для культивирования клеток, по сравнению с соответствующей референсной клеткой позвоночного (из которой получают измененную клетку), где функциональная экспрессия гена матриптазы не снижена или не ухудшена. Например, измененную клетку CHO, в которой функциональная экспрессия матриптазы снижена, сравнивают с клеткой CHO дикого типа в качестве референсной клетки позвоночного для анализа указанного признака. В качестве тестового полипептида используют полипептид, подверженный клиппированию при экспрессии референсной клеткой позвоночного. По одному из вариантов осуществления клиппирование снижают по меньшей мере в 2 раза, по меньшей мере 3 раза, по меньшей мере 5 раз, по меньшей мере 7,5 раз, по меньшей мере 8 раз или по меньшей мере 10 раз по сравнению с соответствующей референсной клеткой позвоночного, в которой функциональная экспрессия гена матриптазы не снижена или не устранена. Это можно тестировать с использованием, например, анализов, описываемых в примерах.
[60] Измененную клетку позвоночного получают из вида и типа клеток, эндогенно экспрессирующих матриптазу. Клетка позвоночного предпочтительно представляет собой клетку млекопитающего. Таким образом, все варианты осуществления, представленные в настоящем описании для клетки позвоночного, в основном, применимы и конкретно относятся к предпочтительному варианту осуществления, в котором используют клетку млекопитающего. Термин "выделенный" используют только для того, чтобы прояснить, что клетка позвоночного не содержится в живом организме, таком как животное или человек. Как представлено в настоящем описании, клетку позвоночного можно получать в форме культуры клеток, линии клеток, клона клеток и т.п. Примеры также описаны ниже. Как описано выше, указанную клетку позвоночного изменяют для ухудшения эффекта матриптазы по сравнению с соответствующей неизмененной клеткой позвоночного, эндогенно экспрессирующей матриптазу. Предпочтительно, ухудшения достигают посредством снижения или устранения функциональной экспрессии гена матриптазы. Варианты осуществления описаны выше. Для получения производственной линии клеток со стабильными, однородными и, таким образом, предсказуемыми характеристиками предпочтительно изменять геном клетки позвоночного для достижения ухудшения матриптазы. Подходящие варианты осуществления описаны выше. Соответствующим образом измененную клетку позвоночного затем можно трансфицировать с использованием экспрессирующего вектора, содержащего полинуклеотид, кодирующий интересующий полипептид, для получения клеток-хозяев по настоящему изобретению, содержащих гетерологичный полинуклеотид, кодирующий интересующий полипептид, и секретирующих интересующий полипептид в среде для культивирования клеток. Клетка позвоночного предпочтительно представляет собой клетку млекопитающего, и ее, например, можно выбирать из группы, состоящей из клеток грызуна, клеток человека и клеток обезьяны. Предпочтительными клетками позвоночных являются клетки грызунов, таких как, например, клетки, полученные из хомяка или мыши. Клетка грызуна может представлять собой линию клеток, выбранную из группы, состоящей из линии клеток китайского хомяка (такой как, например, линия клеток китайского хомяка (CHO)), линия клеток BHK, линия клеток NS0, линия клеток C127, линия фибробластов мыши 3T3 и линия клеток SP2/0. Особенно предпочтительной является клетка CHO, такая как полученная из CHO-K1 клетка CHO. Как показано в примерах, посредством снижения или устранения функциональной экспрессии матриптазы в клетке CHO получают кондиционированную среду для культивирования клеток, в которой клиппирование интересующего секретируемого полипептида значительно снижено или даже устранено. Матриптаза также экспрессируется в клетках человека. Таким образом, по одному из вариантов осуществления клетку позвоночного получают из клетки человека, которую, например, можно выбирать из группы, состоящей из клеток HEK293, клеток MCF-7, клеток PerC6, клеток CAP, гематопоэтических клеток и клеток HeLa. Другой альтернативой являются клетки обезьяны, которые, например, можно выбирать из группы, состоящей из клеток COS, COS-1, клеток COS-7 и клеток Vero. По одному из вариантов осуществления клетку позвоночного получают в виде клона клеток, линии клеток или культуры клеток.
[61] "Интересующий полипептид" является рекомбинантным полипептидом, как предполагают, подлежащим экспрессии и секреции клеткой позвоночного в больших количествах. Интересующий полипептид кодируется гетерологичным полинуклеотидом, содержащимся в указанной клетке. Указанная клетка-хозяин может содержать несколько гетерологичных полинуклеотидов, кодирующих интересующий полипептид. Интересующий полипептид секретируется клеткой позвоночного в среду для культивирования клеток, из которой его можно собирать, например, выделять и очищать.
[62] "Гетерологичный полинуклеотид" или "гетерологичная нуклеиновая кислота" и аналогичные выражения, используемые в настоящем описании, в частности, относятся к полинуклеотидной последовательности, встраиваемой в клетку позвоночного, например, рекомбинантными способами, такими как трансфекция. Термин "полинуклеотид", в частности, относится к полимеру нуклеотидов, как правило, соединенному от одной дезоксирибозы или рибозы к другой, и относится к ДНК, а также РНК, в зависимости от контекста. Термин "полинуклеотид" не включает какие-либо ограничения по размеру.
[63] Клетка позвоночного может содержать гетерологичный полинуклеотид, кодирующий селективный маркер, и/или гетерологичный полинуклеотид, кодирующий репортер, в дополнение по меньшей мере к одному гетерологичному полинуклеотиду, кодирующему интересующий полипептид. Это упрощает селекцию клеток-хозяев, успешно трансфицированных и, таким образом, экспрессирующих интересующий полипептид. Кроме того, клетка позвоночного может содержать несколько полинуклеотидов, кодирующих различные селективные маркеры и/или репортерные полипептиды.
[64] "Селективный маркер" в соответствующих селективных условиях культивирования делает возможной селекцию клеток-хозяев, экспрессирующих указанный селективный маркер. Селективный маркер представляет собой носитель указанного маркера в селективных условиях с преимуществом в отношении выживаемости и/или роста. Как правило, ген селективного маркера будет придавать устойчивость к селективному средству, такому как лекарственное средство, например, антибиотик или другое токсическое средство, или компенсировать метаболический или катаболический дефект в клетке-хозяине. Он может являться положительным или отрицательным селективным маркером. По одному из вариантов осуществления селективный маркер является маркером устойчивости к лекарственному средству, кодирующим белок, придающий устойчивость к условиям селекции, включающим указанное лекарственное средство. Описано множество генов селективных маркеров (см., например, WO 92/08796, WO 94/28143, WO2004/081167, WO2009/080759, WO2010/097240). Например, можно использовать по меньшей мере один селективный маркер, придающий устойчивость к одному или нескольким антибиотикам. По одному из вариантов осуществления селективный маркер может являться амплифицируемым селективным маркером. Амплифицируемый селективный маркер делает возможной селекцию вектора, содержащего клетки-хозяева, и может стимулировать амплификацию гена указанного вектора в клетках-хозяевах. Гены селективных маркеров, общеупотребительные с клетками позвоночных, включают гены аминогликозидфосфотрансферазы (APH), гигромицинфосфотрансферазы (hyg), дигидрофолатредуктазы (DHFR), тимидинкиназы (tk), глутаминсинтетазы, аспарагинсинтетазы и гены, кодирующие устойчивость к неомицину (G418), пуромицину, гигромицину, зеоцину, уабаину, бластицидину, гистидинолу D, блеомицину, флеомицину и микофеноловой кислоте. По одному из вариантов осуществления в качестве селективного маркера используют рецептор фолата в комбинации с новыми клетками позвоночных, представленными в настоящем описании (см., например, WO2009/080759), предпочтительно являющимися клетками млекопитающих. Рецептор фолата также можно использовать в комбинации с DHFR в качестве селективного маркера, как описано в WO 10/097240. "Репортерный полипептид" делает возможной идентификацию клетки, экспрессирующей указанный репортерный полипептид, на основе характеристик репортера (например, флуоресценции). С помощью репортерных генов, как правило, не получают клетки-хозяева с преимуществом в отношении выживаемости. Однако экспрессию репортерного полипептида можно использовать для дифференциации между клетками, экспрессирующими репортерный полипептид, и неэкспрессирующими клетками. Таким образом, репортерный ген также делает возможной селекцию успешно трансфицированных клеток-хозяев. Подходящие репортерные полипептиды включают, в качестве неограничивающих примеров, зеленый флуоресцентный белок (GFP), YFP, CFP и люциферазу. По одному из вариантов осуществления репортерный полипептид обладает характеристиками, делающими возможной селекцию посредством проточной цитометрии.
[65] По одному из вариантов осуществления по меньшей мере один гетерологичный полинуклеотид, кодирующий интересующий полипептид, встраивают в геном указанной клетки, и где, необязательно, по меньшей мере один гетерологичный полинуклеотид, кодирующий селективный маркер или репортерный полипептид, дополнительно встраивают в геном указанной клетки.
[66] Для встраивания гетерологичного полинуклеотида в клетку-хозяина можно использовать экспрессирующий вектор. Полинуклеотиды могут содержаться в экспрессирующей кассете. Полинуклеотиды, кодирующие интересующий полипептид, и полинуклеотиды, кодирующие селективный маркер или репортерный полипептид, могут локализоваться в одном или разных экспрессирующих векторах. Если они локализуются в разных экспрессирующих векторах, экспрессирующие векторы котрансфицируют в клетку-хозяина. Такие стратегии котрансфекции аналогично делают возможной селекцию, как хорошо известно на современном уровне техники. Встраивания в клетку позвоночного можно достигать, например, посредством трансфекции подходящего экспрессирующего вектора, содержащего полинуклеотид, кодирующий интересующий полипептид, в клетки-хозяева. Экспрессирующий вектор предпочтительно встраивается в геном клетки-хозяина (стабильная трансфекция). В случае если гетерологичная нуклеиновая кислота не встраивается в геном, гетерологичная нуклеиновая кислота может утрачиваться на более поздней стадии, например, когда клетки подвергаются митозу (транзиторная трансфекция). Стабильная трансфекция является предпочтительной для получения высокоэкспрессирующих клонов клеток для получения интересующего полипептида в промышленных масштабах. Это является особенно важным для интересующих терапевтически активных или диагностических полипептидов. На современном уровне техники известно несколько подходящих способов встраивания гетерологичной нуклеиновой кислоты, такой как экспрессирующий вектор, в клетки-хозяева позвоночных, предпочтительно являющиеся клетками-хозяевами млекопитающих, и таким образом, не требуется их подробное описание в настоящем описании. Соответствующие способы включают, в качестве неограничивающих примеров, трансфекцию с фосфатом кальция, электропорацию, липофекцию, биолистический и опосредованный полимерами перенос генов и т.п. Помимо общепринятых способов на основе случайного встраивания также можно использовать рекомбинационно-опосредованные подходы для переноса гетерологичного полинуклеотида в геном клетки-хозяина. Т.к. соответствующие способы хорошо известны на современном уровне техники, нет необходимости в их подробном описании. Неограничивающие варианты осуществления дизайна подходящего вектора также описаны далее, и они относятся к соответствующему изобретению.
[67] Экспрессирующие векторы, используемые для достижения экспрессии интересующего полипептида в клетке-хозяине, как правило, содержат элементы транскрипционного контроля, подходящие для регуляции транскрипции, такие как, например, промоторы, энхансеры, сигналы полиаденилирования, сигналы прерывания или терминации транскрипции, как правило, в виде элемента экспрессирующей кассеты. В вектор включают подходящие элементы трансляционного контроля, предпочтительно, такие как например, 5'-нетранслируемые области, приводящие к получению 5'-структур кэпа, подходящих для рекрутирования рибосом и стоп-кодонов для терминации процесса трансляции. Полученные транскрипты несут функциональные трансляционные элементы, облегчающие экспрессию белка (т.е. трансляцию) и правильную терминацию трансляции. Функциональную единицу экспрессии, способную правильно регулировать экспрессию встроенного полинуклеотида, также обозначают как "экспрессирующую кассету". Специалисту в этой области хорошо известно, как необходимо конструировать экспрессирующую кассету, чтобы сделать возможной экспрессию и секрецию интересующего полипептида в клетке позвоночного.
[68] Для достижения секреции интересующего рекомбинантного полипептида в среде для культивирования клеток интересующий полипептид снабжают соответствующим лидерным пептидом. Конструирование лидерных последовательностей и экспрессирующей кассеты для достижения секреции интересующего полипептида хорошо известны на современном уровне техники, и, таким образом, нет необходимости в его представлении в настоящем описании.
[69] Любой интересующий полипептид можно экспрессировать в клетке позвоночного по изобретению. Термин "полипептид" относится к молекуле, содержащей полимер аминокислот, соединенных посредством пептидных связей. Полипептиды включают полипептиды любой длины, включая белки (например, содержащие более 50 аминокислот) и пептиды (например, 2-49 аминокислот). Полипептиды включают белки и/или пептиды с любой активностью, функцией или размером и могут включать, например, ферменты (например, киназы, фосфатазы), рецепторы, транспортеры, бактерицидные и/или эндотоксин-связывающие белки, структурные полипептиды, мембраносвязанные полипептиды, гликополипептиды, глобулярные белки, иммунные полипептиды, токсины, антибиотики, гормоны, факторы роста, факторы крови, вакцины, вирусные гликополипептиды и т.п. Интересующий полипептид, экспрессирующийся согласно представленному в настоящем описании, также может являться субъединицей или доменом полипептида, таким как, например, тяжелая цепь или легкая цепь антитела или функциональный фрагмент или его производное. Термин "интересующий полипептид" может относится к такой отдельной субъединице, или домену, или конечному белку, состоящему из соответствующих субъединиц или доменов, в зависимости от контекста.
[70] По одному из вариантов осуществления интересующий полипептид выбран из терапевтического или диагностического полипептида. Терапевтические и, таким образом, терапевтически активные полипептиды являются особенно важными. Термин "терапевтические полипептиды" также включает профилактические полипептиды, например, используемые для вакцинации. Полипептид можно выбирать из группы, состоящей из пептидных гормонов, интерлейкинов, тканевых активаторов плазминогена, цитокинов, факторов роста, иммуноглобулинов, в частности, антител, или функциональных фрагментов антител, или вариантов, или их производных и Fc-слитых белков. В одном из вариантов осуществления интересующий полипептид является молекулой иммуноглобулина, такой как антитело. Как применяют в настоящем описании, термин "антитело", в частности, относится к белку, содержащему по меньшей мере две тяжелые цепи и две легкие цепи, соединенные дисульфидными связями. Термин "антитело" включает природные антитела, а также все рекомбинантные формы антител, например, гуманизированных антител, полностью человеческих антител и химерных антител. Каждая тяжелая цепь, как правило, состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи (CH). Каждая легкая цепь, как правило, состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи (CL). Однако, термин "антитело" также включает другие типы антител, такие как однодоменные антитела, тяжелая цепь антитела, т.е. антитела, состоящие лишь из одной или нескольких, в частности, двух тяжелых цепей, и нанотела, т.е. антитела, состоящие лишь из одного мономерного вариабельного домена. Нанотела также можно соединять для образования поливалентных структур. Как указано выше, полинуклеотид, кодирующий интересующий полипептид, также может кодировать одну или несколько субъединиц или доменов антител, например, тяжелую или легкую цепь или ее функциональный фрагмент или производное, в качестве интересующего полипептида. Указанные субъединицы или домены могут экспрессироваться с одной и той же или разных экспрессирующих кассет.
[71] Термин "функциональный фрагмент или производное" антитела, в частности, относится к полипептиду, получаемому из антитела и способному связываться с одним антигеном, в частности, с тем же эпитопом, что и антитело. Показано, что антигенсвязывающую функцию антитела могут выполнять фрагменты полноразмерного антитела или его производные. Примеры фрагментов или производных антител включают (i) Fab-фрагменты, моновалентные фрагменты, состоящие из вариабельной области и первого константного домена каждой тяжелой и легкой цепи; (ii) F(ab)2-фрагменты, бивалентные фрагменты, содержащие два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагменты, состоящие из вариабельной области и первого константного домена CH1 тяжелой цепи; (iv) Fv-фрагменты, состоящие из вариабельной области тяжелой цепи и легкой цепи одного плеча антитела; (v) scFv-фрагменты, Fv-фрагменты, состоящие из одной полипептидной цепи; (vi) (Fv)2-фрагменты, состоящие из двух ковалентно связанных Fv-фрагментов; (vii) вариабельный домен тяжелой цепи; и (viii) мультитела, состоящие из вариабельной области тяжелой цепи и вариабельной области легкой цепи, ковалентно связанных таким образом, что соединение вариабельных областей тяжелой цепи и легкой цепи может происходить только внутримолекулярно, но не межмолекулярно.
[72] По одному из вариантов осуществления интересующий полипептид, экспрессируемый измененной клеткой позвоночного, подвержен клиппированию протеазами. По одному из вариантов осуществления интересующий полипептид содержит по меньшей мере один участок клиппирования, распознаваемый матриптазой. Идентифицировано несколько подверженных клиппированию полипептидов, выбранных из группы, состоящей из гликопротеинов, антител, не-IgG белков, Fab-фрагментов, белковых комплексов, пептидаз, сигнальных пептидов, Fc-слитых белков, нанотел, факторов роста, гормонов, цитокинов, вирусных гликополипептидов, факторов крови и ферментов. Многие из этих полипептидов содержат несколько участков клиппирования и являются особенно чувствительными к клиппированию. Экспрессирующийся полипептид, подверженный клиппированию в качестве интересующего полипептида в измененной клетке позвоночного по настоящему изобретению, является предпочтительным, т.к. клиппирование интересующего секретируемого полипептида в среде для культивирования клеток значительно снижено или даже устранено, как показано в примерах.
[73] Клетка позвоночного может содержать или не содержать эндогенный полинуклеотид, соответствующий, соответственно являющийся идентичным, полинуклеотиду, кодирующему интересующий полипептид. По одному из вариантов осуществления клетка позвоночного не содержит эндогенный ген, соответствующий интересующему полипептиду.
[74] По одному из вариантов осуществления интересующий полипептид не является или не содержит матриптазу. По одному из вариантов осуществления интересующий полипептид не является или не содержит HAI-1.
[75] Экспрессирующий вектор или комбинация экспрессирующих векторов, содержащихся в клетке позвоночного, может дополнительно содержать дополнительные векторные элементы. Например, может содержаться по меньшей мере один дополнительный полинуклеотид, кодирующий дополнительный интересующий продукт. Как описано выше и как становится очевидным из описанных выше примеров полипептидов, которые можно экспрессировать по настоящему изобретению, конечный полипептид, подлежащий продукции и секреции клеткой-хозяином, также может являться белком, состоящим из нескольких отдельных субъединиц или доменов. Примером соответствующего белка является молекула иммуноглобулина, в частности, антитело, содержащее, например, тяжелые и легкие цепи. Существует несколько вариантов получения соответствующего белка, состоящего из разных отдельных субъединиц или доменов, и конструирование соответствующего вектора известно в этой области. По одному из вариантов осуществления две или более субъединицы или домена указанного белка экспрессируются из одной экспрессирующей кассеты. В этом варианте осуществления один длинный транскрипт получают из соответствующей экспрессирующей кассеты, содержащей кодирующие области отдельных субъединиц или доменов белка. По одному из вариантов осуществления по меньшей мере один элемент IRES (внутренний сайт связывания рибосомы) функционально локализуется между кодирующими областями отдельных субъединиц или доменов, и каждой кодирующей области предшествует секреторная лидерная последовательность. Таким образом, обеспечивают то, что отдельные продукты трансляции получают из указанного транскрипта, и что конечный белок может правильно собираться и секретироваться. На современном уровне техники известны соответствующие технологии, и, таким образом, не требуется их подробное описание в настоящем описании. В случае некоторых вариантов осуществления, таких как экспрессия антител, предпочтительной является экспрессия отдельных субъединиц или доменов с разных экспрессирующих кассет. По одному из вариантов осуществления экспрессирующая кассета, используемая для экспрессии интересующего продукта, является моноцистронной экспрессирующей кассетой. Все экспрессирующие кассеты, содержащиеся в экспрессирующем векторе или комбинации экспрессирующих векторов, могут являться моноцистронными. Таким образом, по одному из вариантов осуществления каждая экспрессирующая кассета, сконструированная для экспрессии интересующего продукта, содержит полинуклеотид, кодирующий одну субъединицу или домен белка, подлежащего экспрессии в качестве интересующего полипептида. Например, в случае антител одна экспрессирующая кассета может кодировать легкую цепь антитела, и другая экспрессирующая кассета может кодировать тяжелую цепь антитела. После экспрессии отдельных субъединиц или доменов с отдельных экспрессирующих кассет конечный белок, такой как антитело, собирается из указанных субъединиц или доменов и секретируется клеткой-хозяином. Этот вариант осуществления особенно подходит для экспрессии молекул иммуноглобулинов, таких как антитела.
[76] Как описано выше, полинуклеотиды, кодирующие интересующий полипептид, и полинуклеотиды, кодирующие селективные маркеры и/или репортерные полипептиды, предпочтительно содержатся в экспрессирующих кассетах. Подходящими являются несколько вариантов осуществления. Например, каждый из указанных полинуклеотидов может содержаться в отдельной экспрессирующей кассете. Это также обозначают как моноцистронную сборку. Однако в объем настоящего изобретения также входит то, что по меньшей мере два из соответствующих полинуклеотидов содержатся в одной экспрессирующей кассете. По одному из вариантов осуществления по меньшей мере один внутренний сайт связывания рибосомы (IRES) функционально локализуется между полинуклеотидами, экспрессирующимися с одной экспрессирующей кассеты. Соответствующие технологии экспрессии на основе IRES и другие би- и полицистронные системы хорошо известны, и, таким образом, нет необходимости в их дополнительном описании.
B. Способ получения клетки позвоночного по первому аспекту
[77] Второй аспект настоящего изобретения относится к способу получения клетки позвоночного по первому аспекту, включающему изменение клетки позвоночного для ухудшения эффекта матриптазы и встраивание полинуклеотида, кодирующего интересующий полипептид в указанной клетке, где указанный интересующий полипептид затем секретируется клеткой позвоночного.
[78] Подходящие и предпочтительные варианты осуществления для ухудшения функции эндогенной протеазы матриптазы описаны выше в комбинации с клетками позвоночных по первому аспекту и относятся к представленному выше описанию, которое также применимо здесь. Таким образом, способ может включать ухудшение эффекта матриптазы, как описано выше, в комбинации с измененными клетками позвоночных по первому аспекту. Неограничивающие варианты осуществления вкратце описаны далее.
[79] По одному из вариантов осуществления способ включает снижение или устранение функциональной экспрессии гена матриптазы и, таким образом, ухудшение эффекта матриптазы. Как описано выше, это ухудшение имеет эффект, состоящий в том, что функциональная матриптаза отсутствует или присутствует ее сниженное количество в активной форме в среде для культивирования клеток, содержащей измененные клетки, например, т.к. функциональная матриптаза отсутствует или ее сниженное количество присутствует на поверхности клеток и/или высвобождается, например, отщепляется, измененной клеткой. Таким образом, в среде для культивирования клеток, в которую секретируется интересующий рекомбинантный полипептид, отсутствует матриптаза или присутствует ее сниженное количество в протеолитически активной форме. Т.к. в настоящем описании показано, что матриптаза является ключевой протеазой, ответственной за клиппирование интересующего секретируемого полипептида, это изменение клетки предпочтительно снижает или даже устраняет клиппирование интересующего полипептида. Подходящие способы снижения или устранения функциональной экспрессии матриптазы описаны выше в комбинации с клетками позвоночных по первому аспекту и относятся к ним. По одному из вариантов осуществления геном клетки позвоночного изменяют для снижения или устранения функциональной экспрессии гена матриптазы. Например, нокаут гена можно осуществлять по отношению к гену матриптазы. По одному из вариантов осуществления такой нокаут гена осуществляют в отношении всех копий гена матриптазы. По одному из вариантов осуществления ген матриптазы подвергают делеции или нокауту посредством встраивания одной или нескольких мутаций, таких как, например, мутации со сдвигом рамки считывания и/или образованием стоп-кодона. Все копии гена матриптазы в геноме можно соответствующим образом изменять.
[80] По одному из вариантов осуществления указанная одна или несколько мутаций содержатся в кодирующей области гена матриптазы и приводят к нефункциональному или менее функциональному продукту экспрессии. Подробности описаны выше в комбинации с измененными клетками позвоночных по первому аспекту и относятся к соответствующему описанию, также применимому к ним. По одному из вариантов осуществления одну или несколько мутаций встраивают в область гена матриптазы, кодирующую аминокислотную последовательность, присутствующую в одном или нескольких каталитически активных вариантах сплайсинга матриптазы. В большинстве или даже всех идентифицированных каталитически активных вариантах сплайсинга обнаружено несколько экзонов матриптазы. Как описано выше и показано в примерах, полинуклеотидная последовательность гена матриптазы, кодирующая экзон 2 матриптазы, является подходящей мишенью для встраивания одной или нескольких мутаций, таких как, например, мутации со сдвигом рамки считывания, т.к. экзон 2 экспрессируется в большинстве вариантов сплайсинга матриптазы, и соответствующая мутация приводит к нефункциональному или менее функциональному продукту экспрессии. Кроме того, экзоны, близкие к N-концу матриптазы, такие как экзон 2, являются предпочтительными мишенями для встраивания одной или нескольких мутаций со сдвигом рамки считывания, приводящих к экспрессии нефункционального или менее функционального укороченного белка. Кроме того, одну или несколько мутаций можно встраивать в каталитический домен для ухудшения функции матриптазы.
[81] По одному из вариантов осуществления клетка позвоночного представляет собой клетку млекопитающего. По одному из вариантов осуществления клетка позвоночного является клеткой грызуна. Предпочтительно, клетка грызуна является клеткой хомяка, такой как клетка CHO. По одному из вариантов осуществления клетку CHO, предпочтительно, полученную из линии клеток K1, используют для получения измененной линии клеток позвоночного, где эффект эндогенной протеазы матриптазы ухудшен, предпочтительно, посредством снижения или устранения функциональной экспрессии гена матриптазы.
[82] Если геном клетки-хозяина изменяют для достижения ухудшения, предпочтительно сначала изменять клетку позвоночного для, по существу, постоянного ухудшения эффекта и, таким образом, функции эндогенной протеазы матриптазы, а затем встраивать гетерологичный полинуклеотид, кодирующий интересующий полипептид. В случае если изменение не является постоянным, как, например, в случае транзиторного сайленсинга гена матриптазы, например, посредством РНКи, можно сначала встраивать гетерологичный полинуклеотид, кодирующий интересующий полипептид, а затем изменять клетку позвоночного для ухудшения функции эндогенной протеазы матриптазы, например, посредством посттранскрипционного сайленсинга гена. Подходящие способы описаны выше и известны специалисту в этой области. Как описано выше, по предпочтительному варианту осуществления геном клетки позвоночного изменяют для достижения ухудшения. Способ по седьмому аспекту можно использовать для идентификации и селекции клетки-хозяина, где эффект матриптазы ухудшен.
[83] По одному из вариантов осуществления способ по второму аспекту дополнительно включает встраивание по меньшей мере одного полинуклеотида, кодирующего интересующий полипептид и, предпочтительно, по меньшей мере один полинуклеотид, кодирующий селективный маркер, в клетку позвоночного, измененную таким образом, что функциональную экспрессию гена матриптазы снижают или устраняют. По одному из вариантов осуществления полинуклеотид, кодирующий интересующий полипептид, и полинуклеотид, кодирующий селективный маркер, локализован в одном или разных экспрессирующих векторах. Подходящие и предпочтительные варианты осуществления описаны выше и относятся к соответствующему описанию, также применимому к ним. Встраивание можно осуществлять посредством трансфекции, где стабильная трансфекция является предпочтительной. Клетку-хозяина позвоночного, успешно экспрессирующую интересующий полипептид, можно подвергать селекции с использованием, например, способа по пятому аспекту. Он относится к последующему описанию.
C. Способы рекомбинантного получения интересующего полипептида
[84] Третий аспект настоящего изобретения относится к способу рекомбинантного получения интересующего полипептида, включающему использование клетки позвоночного по первому аспекту в качестве клетки-хозяина для рекомбинантной экспрессии интересующего полипептида. Как описано выше, в результате сниженного уровня протеолитической деградации интересующего полипептида в среде для культивирования клеток, достигаемого при использовании эти новых клеток позвоночных для рекомбинантной экспрессии, эти новые клетки позвоночных, предпочтительно являющиеся клетками млекопитающих, являются особенно подходящими в качестве клеток-хозяев для рекомбинантного получения интересующего полипептида. Подходящие и предпочтительные примеры клетки-хозяина позвоночного, которую изменяют для ухудшения эффекта матриптазы, предпочтительно, посредством снижения или устранения функциональной экспрессии гена матриптазы, а также подходящие и предпочтительные примеры интересующего полипептида подробно описаны выше и они относятся к представленному выше описанию, также применимому к ним.
[85] По одному из вариантов осуществления способ включает встраивание по меньшей мере одного полинуклеотида, кодирующего интересующий полипептид в клетку-хозяина позвоночного, измененную таким образом, что эффект эндогенной протеазы матриптазы ухудшен, и селекцию клетки-хозяина позвоночного, рекомбинантно экспрессирующей интересующий полипептид. Встраивание можно осуществлять посредством трансфекции, как хорошо известно, а также представлено в настоящем описании. Селекцию можно осуществлять способом по пятому аспекту настоящего изобретения. Предпочтительно, выбирают клетки-хозяева, где гетерологичный полинуклеотид, кодирующий интересующий полипептид, стабильно встроен в геном клетки-хозяина.
[86] По одному из вариантов осуществления способ включает
(a) культивирование клеток-хозяев позвоночных по первому аспекту в условиях, делающих возможной экспрессию и секрецию интересующего полипептида;
(b) выделение интересующего полипептида из среды для культивирования клеток; и
(c) необязательно, обработку выделенного интересующего полипептида.
Таким образом, предпочтительный вариант осуществления способа по третьему аспекту относится к способу рекомбинантного получения интересующего полипептида, включающему
(a) культивирование клеток-хозяев позвоночных по первому аспекту в условиях, делающих возможной экспрессию и секрецию интересующего полипептида в среде для культивирования клеток;
(b) выделение интересующего полипептида из среды для культивирования клеток; и
(c) необязательно, обработку выделенного интересующего полипептида.
[87] Указанные клетки-хозяева можно культивировать в бессывороточных условиях. Полипептид экспрессируется и секретируется в среде для культивирования, и его можно получать из нее. Для секреции используют соответствующий лидерный пептид таким образом, что секретируется интересующий полипептид. Дизайн лидерных последовательностей и экспрессирующей кассеты для достижения секреции хорошо известен на современном уровне техники, и, таким образом, нет необходимости в его представлении в настоящем описании.
[88] Как описано выше, при использовании измененных клеток позвоночных по первому аспекту для получения клеток-хозяев, функциональная матриптаза не является эффективной, или эффективным является ее сниженное количество в среде для культивирования клеток, содержащей указанные клетки, при этом значительно снижают или даже полностью устраняют протеолитическую деградацию интересующего рекомбинантного полипептида, секретирующегося в среду для культивирования клеток. Это связано с тем, что неожиданно обнаруживали, что среди сотен различных протеаз, экспрессируемых клетками позвоночных, матриптаза является ключевой протеазой, вызывающей клиппирование рекомбинантно экспрессирующихся полипептидов в среде для культивирования клеток. Таким образом, при использовании новых клеток-хозяев позвоночных по настоящему изобретению в качестве производственных клеток-хозяев, не является необходимым предпринимать дополнительные меры для снижения или во избежание протеолитической деградации и, таким образом, клиппирования интересующего полипептида в среде для культивирования клеток. Таким образом, по одному из вариантов осуществления в среду для культивирования клеток не добавляют ингибитор протеазы. По одному из вариантов осуществления температуру культуры не снижают для снижения протеолитической активности в среде для культивирования клеток. Настоящее изобретение включает способы, где интересующий полипептид реконструируют для удаления одного или нескольких мотивов, подверженных клиппированию протеазами. Однако по одному из вариантов осуществления интересующий полипептид не реконструируют для удаления одного или нескольких аминокислотных мотивов, подверженных клиппированию матриптазой, для снижения или предотвращения клиппирования. По этому варианту осуществления при желании можно осуществлять соответствующую реконструкцию для удаления одного или нескольких аминокислотных мотивов, подверженных клиппированию протеазой, отличающейся от матриптазы. Однако по одному из вариантов осуществления интересующий полипептид совсем не реконструируют для удаления одного или нескольких аминокислотных мотивов, подверженных клиппированию протеазой, для снижения или предотвращения клиппирования. Как показано в примерах, клиппирование эффективно снижают или даже полностью устраняют при использовании измененных клеток, представленных в настоящем описании, таким образом, что соответствующий подход реконструкции, в целом, устаревает.
[89] Примеры интересующих полипептидов, которые можно получать с использованием измененной клетки позвоночного, описаны выше в комбинации с первым аспектом изобретения и они относятся к соответствующему описанию, также применимому к ним. По одному из вариантов осуществления способ получения используют для получения интересующего полипептида, имеющего одну или несколько из следующих характеристик:
a) он является терапевтическим или диагностическим полипептидом;
b) он подвержен клиппированию протеазами;
c) он содержит по меньшей мере один участок клиппирования матриптазой;
d) он является гликополипептидом;
e) он выбран из группы, состоящей из гликопротеинов, антител, не-IgG белков, Fab-фрагментов, белковых комплексов, пептидаз, сигнальных пептидов, Fc-слитых белков, нанотел, факторов роста, гормонов, цитокинов, факторов крови и ферментов;
f) он не является или не содержит матриптазу; и/или
g) он не является или не содержит HAI-1.
[90] Получаемый интересующий полипептид выделяют из среды для культивирования клеток и, необязательно, дополнительно обрабатывают известными в этой области способами. Например, полипептид можно выделять из питательной среди общепринятыми способами, включая, в качестве неограничивающих примеров, центрифугирование, фильтрацию, ультрафильтрацию, экстракцию или осаждение. Дополнительные этапы обработки, такие как этапы очистки, можно осуществлять множеством способов, известных в этой области, включая, в качестве неограничивающих примеров, хроматографию (например, ионообменную, аффинную хроматографию, хроматографию с гидрофобными взаимодействиями, хроматофокусирование, хроматографию с протеином A или протеином G и эксклюзионную хроматографию), способы электрофореза (например, препаративное изоэлектрофокусирование), определение дифференциальной растворимости (например, осаждение сульфатом аммония) или экстракцию. Кроме того, выделенный и очищенный интересующий полипептид можно дополнительно обрабатывать, например, модифицировать и/или составлять в композиции, например, фармацевтической композиции.
[91] Четвертый аспект относится к способу получения интересующего рекомбинантного полипептида, включающему
(a) культивирование клеток-хозяев позвоночных, содержащих по меньшей мере один гетерологичный полинуклеотид, кодирующий интересующий полипептид, в условиях, делающих возможной экспрессию и секрецию интересующего полипептида в среде для культивирования клеток, где среда для культивирования клеток содержит ингибитор протеазы, являющийся селективным в отношении матриптазы;
(b) выделение интересующего полипептида из среды для культивирования клеток; и
(c) необязательно, обработку выделенного интересующего полипептида.
[92] Способ по четвертому аспекту также основан на важном открытии, представленном в настоящем описании, заключающемся в том, что матриптаза является ключевой протеазой, ответственной за протеолитическую деградацию интересующего секретируемого рекомбинантного полипептида в среде для культивирования клеток. В способе по четвертому аспекту протеолитической деградации интересующего полипептида в среде для культивирования клеток, также обозначаемой как "клиппирование" (см. выше), избегают посредством добавления ингибитора протеазы, селективного в отношении матриптазы, в среду для культивирования клеток. Ингибитор протеазы, селективный в отношении матриптазы, также обозначают в настоящем описании как селективный ингибитор матриптазы. Безусловно, также можно добавлять несколько селективных ингибиторов матриптазы. Как показано в примере 4, добавление селективного ингибитора матриптазы в среду для культивирования клеток делает возможным значительное снижение или даже прекращение клиппирования интересующего полипептида, даже при использовании клеток позвоночных, в норме экспрессирующих матриптазу. Таким образом, этот вариант осуществления делает возможным использование неизмененных клеток позвоночных, где, таким образом, эффект матриптазы не ухудшен, т.к. достигают ухудшения в среде для культивирования клеток.
[93] Селективный ингибитор матриптазы, присутствующий в среде для культивирования клеток, приводит к снижению или прекращению протеолитической активности матриптазы в среде для культивирования клеток. Ингибитор матриптазы, например, может являться конкурентным ингибитором, конкурирующим с субстратом за активный центр матриптазы, или аллостерическим ингибитором, модифицирующим структуру матриптазы для снижения ее активности. Ингибитор матриптазы считают селективным, если его ингибиторная активность в отношении матриптазы является более высокой, чем его ингибиторная активность в отношении других сериновых протеаз, в частности других трансмембранных сериновых протеаз типа II.
[94] Селективный ингибитор матриптазы может являться любым типом при условии, что он не демонстрирует неблагоприятные эффекты в отношении клетки-хозяина, используемой для получения интересующего рекомбинантного полипептида. Селективный ингибитор матриптазы можно выбирать из i) биологических ингибиторов матриптазы, включающих, в качестве неограничивающих примеров, селективные ингибиторы матриптазы на основе антитела или полученные из антитела, пептиды или белки, и ii) химических ингибиторов матриптазы, таких как низкомолекулярные соединения.
[95] По одному из вариантов осуществления селективный ингибитор матриптазы является по меньшей мере в 5 раз, по меньшей мере 10 раз, по меньшей мере 25 раз, по меньшей мере 50 раз, по меньшей мере 100 раз или по меньшей мере 250 раз более селективным и, таким образом, специфичным в отношении матриптазы, чем в отношении других протеаз. Однако, селективность также может являться, по существу, более высокой, такой как, например, по меньшей мере в 500 раз, по меньшей мере в 5000 раз, по меньшей мере в 10000 раз, по меньшей мере в 50000 раз, по меньшей мере в 500000 раз и по меньшей мере в 5000000 раз более высокой. Диапазоны включают, в качестве неограничивающих примеров, от 5 до 10000000 раз, от 10 раз до 5000000 раз, от 25 раз до 1000000 раз, от 50 раз до 5000000 раз. Более высокой селективности, например, по меньшей мере в 5000 раз или по меньшей мере в 10000 раз и выше, можно достигать, например, с использованием селективных биологических ингибиторов матриптазы, таких как, например, матриптаза-специфичные антитела или Fab-фрагменты.
[96] Селективность можно определять, например, с учетом значения ki, которое в случае селективного ингибитора матриптазы является более низким, чем для других тестируемых протеаз. По одному из вариантов осуществления ингибитор матриптазы селективно ингибирует матриптазу со значением ki 200 нМ или менее, 150 нМ или менее, 100 нМ или менее, 50 нМ или менее, 25 нМ или менее, 20 нМ или менее, 15 нМ или менее, 10 нМ или менее, 7,5 нМ или менее, 5 нМ или менее, 2,5 нм или менее, 1 нМ или менее или 0,75 нМ или менее.
[97] Как указано выше, на современном уровне техники описано несколько селективных ингибиторов матриптазы. Например, Faraday et al описывают различные селективные ингибиторы матриптазы на основе антител, а именно Fab-фрагмент (Farady et al., 2008 J.Mol.Biol. (2008) 380, 351-360) и два scFv-антительных ингибитора (J Mol Biol. 2007 June 15; 369 (4): 1041-1051). Ингибиторы на основе одноцепочечного вариабельного фрагмента (scFv) антитела E2 и S4 со значениями Ki 12 пМ и 160 пМ описывали в качестве особенных селективных. Селективный ингибитор матриптазы на основе антитела может являться активным в отношении матриптазы, полученной из разных видов. Как показано в примере 4, например, Fab-фрагмент против матриптазы человека также являлся эффективным против матриптазы, полученной из мыши и хомяка. Однако также можно получать соответствующие селективные ингибиторы матриптазы на основе антитела против конкретной матриптазы, экспрессируемой соответствующей клеткой-хозяином, для обеспечения максимального ингибиторного эффекта и возможности использования более низких концентраций селективного ингибитора матриптазы в среде для культивирования клеток. Кроме того, описаны антитела, специфичные для каталитического участка матриптазы (патентная заявка США № 2006/171884 A1). Пептидомиметические молекулы селективных ингибиторов матриптазы, таких как молекулы типа 3-амидинофенил-аланина CJ-730 и CJ-697, имеют значения ki для матриптазы 46 нМ и 26 нМ, соответственно (описаны в Förbs et al. International Journal of Oncology 27: 1061-1070 2005). Как описано в Förbs, добавления этих соединений в культуру клеток линий опухолевых клеток значительно снижает активность матриптазы без влияния на пролиферацию клеток. Селективные ингибиторы матриптазы также описывают в Steinmetzer et al, J. Med. Chem. 2006, 49, 4116-4126 и Goswami et al, ACS Med. Chem. Lett., 2013 4 (12) pp 1152-1157. Кроме того, в качестве соответствующего ингибиторов матриптазы идентифицированы структурные варианты эглина c, небольшого мономерного белка, являющегося ингибиторов сериновых протеаз (Desilets et al. FEBS Letters 580 (2006) 2227-2232). В этой статье при скрининге получали различные структурные варианты эглина c и тестировали на их специфичность для матриптазы. Замена одной аминокислоты (L45R) в петле реактивного центра делает эглин c матриптаза-специфичным (ki=18 нМ). Таким образом, известно множество селективных ингибиторов матриптазы, которые можно использовать в целях по настоящему изобретению для селективного ингибирования матриптазы в среде для культивирования клеток и, таким образом, снижения или предотвращения клиппирования интересующего полипептида, рекомбинантно экспрессирующегося и секретируемого в среде для культивирования клеток клеткой-хозяином позвоночного.
[98] Для ухудшения эффекта матриптазы в среде для культивирования клеток селективный ингибитор матриптазы можно добавлять в среду для культивирования клеток, в которой культивируют экспрессирующие клетки-хозяева. Посредством рутинного экспериментирования можно определять концентрацию отдельного селективного ингибитора матриптазы, необходимую для достижения достаточного ингибирования матриптазы в среде для культивирования клеток таким образом, что снижают протеолитическую деградацию интересующего полипептида. Селективный ингибитор матриптазы можно добавлять в среду для культивирования клеток до или после добавления клеток-хозяев. По одному из вариантов осуществления селективный ингибитор матриптазы добавляют вначале культивирования клеток. По одному из вариантов осуществления селективный ингибитор матриптазы добавляют в тот момент времени, когда клетки-хозяева начинают секретировать интересующий полипептид. Селективный ингибитор матриптазы также можно добавлять непрерывно. Например, при периодическом культивировании в подпитку можно включать селективный ингибитор матриптазы.
[99] Подробности в отношении интересующего полипептида, выделения интересующего полипептида из среды для культивирования клеток, а также последующей обработки описаны выше, например, в комбинации со способом по третьему аспекту и они относятся к представленному выше описанию, применимому к ним.
[100] Учитывая объем культуры клеток, необходимый для крупномасштабного получения, в среду для культивирования клеток необходимо добавлять большие количества (одного или нескольких) селективного ингибитора матриптазы, даже если для эффективного снижения или предотвращения клиппирования интересующего полипептида в среде для культивирования клеток используют ингибитор матриптазы с высокой селективностью. Это может быть дорогостоящим. Кроме того, в случае многих интересующих полипептидов, таких как биофармацевтические средства, добавленный селективный ингибитор матриптазы необходимо удалять при последующем выделении и очистке интересующего полипептида во избежание контаминации конечного интересующего полипептида ингибитором матриптазы. Такой этап удаления может включать любой известный этап очистки, такой как ионообменная, аффинная, эксклюзионная или обращенно-фазовая хроматография. Подходящий способ удаления зависит от типа используемого селективного ингибитора матриптазы. Т.к. такие этапы могут являться трудоемкими и могут повышать расходы, способ по третьему аспекту, включающий использование измененных клеток позвоночных по первому аспекту, является предпочтительным.
D. Способ селекции
[101] Пятый аспект настоящего изобретения относится к способу селекции клетки-хозяина, рекомбинантно экспрессирующей интересующий полипептид, включающему
(a) получение клеток позвоночных по первому аспекту по изобретению в качестве клеток-хозяев; и
(b) селекцию одной или нескольких клеток-хозяев, экспрессирующих интересующий полипептид.
[102] Клетки-хозяева позвоночных по первому аспекту, включая подходящие и предпочтительные варианты осуществления, а также их преимущества подробно описаны выше, и это относится к соответствующему описанию, также применимому к ним. Предпочтительно, клетка позвоночного представляет собой клетку млекопитающего. По одному из вариантов осуществления этап (a) способа селекции по пятому аспекту включает трансфекцию клеток позвоночных, измененных для ухудшения эффекта эндогенной протеазы матриптазы, с использованием по меньшей мере одного полинуклеотида, кодирующего интересующий полипептид, для получения клеток-хозяев позвоночных по первому аспекту. По одному из вариантов осуществления клетки не содержат гетерологичный полинуклеотид, кодирующий интересующий полипептид, перед трансфекцией полинуклеотида, кодирующего интересующий полипептид, подлежащий экспрессии и секреции клеткой-хозяином. Как описано, клетки млекопитающих предпочтительно используют в качестве клеток-хозяев позвоночных. Полинуклеотид, кодирующий интересующий продукт, может содержаться в экспрессирующем векторе, затем подвергнутом трансфекции в клетку позвоночного.
[103] По одному из вариантов осуществления указанные клетки-хозяева, полученные на этапе (a), дополнительно содержат по меньшей мере один гетерологичный полинуклеотид, кодирующий селективный маркер, и этап (b) включает культивирование указанного множества клеток-хозяев в условиях, селективных для селективного маркера. Этап селекции (b) может являться многоэтапным способом селекции, включающим несколько этапов селекции для селекции и, таким образом, идентификации клеток-хозяев, экспрессирующих интересующий полипептид. Таким образом, по одному из вариантов осуществления этап селекции (b) может включать несколько этапов селекции. Например, этап (b) может включать один или несколько этапов селекции для селекции успешно трансфицированных клеток, а также один или несколько последующих этапов селекции для селекции высокоэкспрессирующих клеток из совокупности успешно трансфицированных клеток. Соответствующая стратегия селекции зависит от дизайна экспрессирующего вектора, используемого для встраивания полинуклеотида, кодирующего интересующий полипептид, и, в частности, зависит от используемых селективных маркеров и/или репортеров. Неограничивающие варианты осуществления будут описаны далее.
[104] Как описано выше, клетки-хозяева позвоночных могут содержать по меньшей мере один гетерологичный полинуклеотид, кодирующий селективный маркер. Полинуклеотид, кодирующий селективный маркер, можно встраивать в клетку-хозяина вместе с полинуклеотидом, кодирующим интересующий полипептид, с использованием одного или разных котрансфицируемых экспрессирующих векторов. Затем этап (b) включает культивирование указанного множества клеток-хозяев в условиях, обеспечивающих давление отбора на клетки-хозяева для селекции успешно трансфицированных клеток-хозяев, например, с использованием подходящей селекционной среды. Как применяют в настоящем описании, "селекционная среда", в частности, относится к среде для культивирования клеток, применимой для селекции клеток-хозяев, экспрессирующих селективный маркер. Она может включать, например, средство селекции, такое как токсическое средство, делающее возможной селекцию успешно трансфицированных клеток-хозяев. Альтернативно, необходимое соединение может отсутствовать, или можно снижать его концентрацию в селекционной среде. По одному из вариантов осуществления клетки-хозяева, не являющиеся успешно трансфицированными и, таким образом, не экспрессирующие селективные маркеры, или в которых экспрессия является низкой, не могут пролиферировать или погибают в селективных условиях культивирования. В отличие от этого, клетки-хозяева, успешно трансфицированные с использованием экспрессирующих векторов и экспрессирующие селективные маркеры (и, таким образом, совместно встроенный интересующий полипептид) с достаточным выходом, являются устойчивыми или менее подвержены давлению отбора и, таким образом, могут пролиферировать, таким образом, опережают в росте клетки-хозяева, не являющиеся успешно трансфицированными, или в которых участок встраивания в геном клетки не является походящим. Селективный маркер можно выбирать из группы, состоящей из маркеров устойчивости к антибиотикам, маркеров устойчивости к лекарственным средствам и метаболических маркеров. Подходящие примеры селективных маркеров и принципов селекции описаны выше в комбинации с первым аспектом, и соответствующие условия селекции для отдельных селективных маркеров хорошо известны специалисту в этой области. Как описано выше, альтернативно или дополнительно, можно осуществлять селекцию на основе репортерного полипептида.
[105] По одному из вариантов осуществления клетки позвоночных, получаемые на этапе (a), являются клетками млекопитающих. По одному из вариантов осуществления клетки млекопитающих являются клетками грызуна, предпочтительно - клетками хомяка, такими как клетки CHO. Подходящие и предпочтительные варианты осуществления описаны выше в комбинации с первым аспектом и относятся к представленному выше описанию.
Дополнительные предпочтительные варианты осуществления, в частности, касающиеся клеток-хозяев позвоночных по первому аспекту, экспрессирующего вектора или комбинации экспрессирующих векторов, аналогично, описаны выше. Это относится к представленному выше описанию.
[106] Клетки, полученные способом селекции по пятому аспекту, можно выделять и культивировать как отдельные клетки. Однако в последующем способе также можно использовать обогащенную популяцию генетически разных клеток-хозяев, т.е. совокупность клеток. Полученные клетки-хозяева также можно подвергать дополнительному качественному или количественному анализу или их можно использовать, например, в разработке клональной линии клеток для получения белка. Клональную линию клеток можно получать из выбранной клетки-хозяина, стабильно экспрессирующей интересующий полипептид с высоким выходом.
[107] По одному из вариантов осуществления выбранные клетки культивируют для получения клонов клеток, в частности, в форме клональных культур клеток. Клональная культура клеток является культурой клеток, полученной из одной клетки-предка. В клональной культуре клеток все клетки являются клонами друг друга. Предпочтительно, все клетки в культуре клеток содержат одинаковую или, по существу, одинаковую генетическую информацию. В определенных вариантах осуществления для оценки продуктивности определяют количество или концентрацию интересующего полипептида в культуре клеток. Например, можно измерять титр посредством анализа супернатанта культуры. Кроме того, можно осуществлять исследование стабильности с использованием полученных клонов клеток.
E. Применение измененных клеток позвоночных для рекомбинантного получения
[108] Шестой аспект настоящего изобретения относится к применению выделенной клетки позвоночного для рекомбинантного получения интересующего полипептида, секретируемого клеткой позвоночного, где используемую клетку изменяют для ухудшения эффекта эндогенной протеазы матриптазы. По одному из вариантов осуществления шестого аспекта эффект матриптазы ухудшают, как подробно описано выше в комбинации с первым аспектом, предпочтительно, посредством снижения или устранения функциональной экспрессии гена матриптазы, как подробно описано выше. Клетка позвоночного, предпочтительно, является клеткой млекопитающего. Таким образом, по одному из вариантов осуществления эффект эндогенной протеазы матриптазы ухудшают, как описано выше в комбинации с измененными клетками позвоночных по первому аспекту. По одному из вариантов осуществления полинуклеотид, кодирующий интересующий полипептид, встраивают в указанную клетку. После встраивания получают клетку позвоночного, содержащую гетерологичный полинуклеотид, кодирующий интересующий полипептид, затем секретируемый клеткой позвоночного в среду для культивирования клеток. Таким образом, применение может включать встраивание гетерологичного полинуклеотида, кодирующего интересующий полипептид, в указанную клетку позвоночного, где указанный интересующий полипептид секретируется клеткой позвоночного. Подробности, касающиеся интересующего полипептида, аналогично подробно описаны выше и относятся к соответствующему описанию, также применимому к ним. Способы встраивания полинуклеотида в клетку позвоночного известны специалисту в этой области, а также в кратком изложении описаны выше.
[109] По одному из вариантов осуществления клетка позвоночного не содержит гетерологичный полипептид, кодирующий интересующий полипептид, перед встраиванием полинуклеотида, кодирующего интересующий полипептид, подлежащий экспрессии. По одному из вариантов осуществления указанная клетка дополнительно не содержит гетерологичный полинуклеотид, кодирующий селективный маркер, и/или гетерологичный полинуклеотид, кодирующий репортерный полипептид. По одному из вариантов осуществления клетка позвоночного не содержит какой-либо гетерологичный полинуклеотид перед встраиванием полинуклеотида, кодирующего интересующий полипептид. Соответствующую "пустую" клетку позвоночного, изменяемую для ухудшения эффекта эндогенной протеазы матриптазы, можно использовать, например, в качестве линии клеток для клонирования для технологий рекомбинантного получения. Соответствующую линию клеток можно трансфицировать с использованием гетерологичного полинуклеотида, кодирующего интересующий полипептид, например, с использованием соответствующего экспрессирующего вектора. Такие "пустые" клетки позвоночных, не экспрессирующие и не секретирующие рекомбинантный продукт, таким образом, можно трансфицировать с использованием различных экспрессирующих векторов в зависимости от желаемого интересующего полипептида, которые, как предполагают, получают рекомбинантно. Таким образом, такую линию клеток позвоночного можно использовать для различных проектов, т.е. для получения различных интересующих полипептидов. По одному из вариантов осуществления клетка позвоночного является клеткой позвоночного по первому аспекту. Подробности описаны выше, и это относится к представленному выше описанию.
F. Способ селекции клеток-хозяев позвоночных с ухудшенной функцией матриптазы
[110] По седьмому аспекту настоящее изобретение относится к способу селекции клетки позвоночного для рекомбинантного получения интересующего полипептида, включающему анализ того, является ли эндогенная протеаза матриптаза функционально экспрессирующейся в клетке позвоночного, и селекцию клетки позвоночного, в которой эффект такой эндогенной матриптазы ухудшен для рекомбинантного получения интересующего полипептида. Этот способ селекции делает возможной идентификацию клетки-хозяина, способной экспрессировать и секретировать интересующий рекомбинантный полипептид, где в среде для культивирования клеток снижают клиппирование интересующего секретируемого полипептида. Соответствующие клетки-хозяева особенно подходят для рекомбинантного получения.
[111] Этот аналитический способ предпочтительно можно использовать, например, в комбинации со способом по второму аспекту настоящего изобретения для идентификации того, получают ли клетку позвоночного, где ухудшен эффект гена матриптазы. По предпочтительному варианту осуществления способ включает анализ того, снижают ли или устраняют функциональную экспрессию гена матриптазы в указанных клетках. Неограничивающие варианты осуществления описаны далее. То, какой аналитический способ является подходящим, также зависит от того, как клетки изменяют для достижения снижения или устранения функциональной экспрессии матриптазы.
[112] Например, при осуществлении нокаута гена матриптазы для снижения или устранения функциональной экспрессии матриптазы можно амплифицировать соответствующий фрагмент ДНК и секвенировать амплифицированную ДНК для подтверждения того, что осуществляли нокаут гена матриптазы. Встраивание одной или нескольких мутаций можно определять, например, посредством секвенирования. Если функциональную экспрессию матриптазы снижают или устраняют посредством полной или частичной делеции указанного гена, можно определять делецию на уровне ДНК, например, с использованием подходящих способов определения на основе амплификации для детекции делеции (такие способы известны специалисту в этой области).
[113] Кроме того, способ можно использовать для селекции подходящей линии клеток, где от природы функциональную экспрессию матриптазы снижают или устраняют, например, т.к. снижают или устраняют общую экспрессию и/или снижают или устраняют активность экспрессирующейся матриптазы, например, в результате по меньшей мере одной мутации. Соответствующие клетки можно идентифицировать способом по седьмому аспекту, как представлено в настоящем описании. Например, экспрессию матриптазы можно анализировать способами на основе ПЦР, таких как RT-ПЦР и/или секвенирование. Альтернативно или дополнительно, активность матриптазы можно анализировать с использованием кондиционированной среды, полученной из клеток, подлежащих анализу.
[114] По одному из вариантов осуществления клетки без матриптазы или со сниженным количеством матриптазы на поверхности клеток подвергают селекции посредством проточной цитометрии. Например, для маркировки клеток, экспрессирующих матриптазу можно использовать антитело или другое средство детекции, связывающееся с матриптазой. Затем соответствующие клетки можно метить посредством добавления средства мечения, связывающегося с антителом или другим средством детекции, или антитело или другое средство детекции можно метить напрямую. По одному из вариантов осуществления метка является флуоресцентной меткой. Таким образом, клетки маркируют по их уровню экспрессии матриптазы, что затем позволяет идентифицировать и сортировать клетки, демонстрирующие сниженную экспрессию матриптазы или отсутствие экспрессии матриптазы, например, посредством активируемой флуоресценцией сортировки клеток (FACS).
[115] По одному из вариантов осуществления анализируют профиль экспрессии клеток позвоночных для определения того, снижают или устраняют ли функциональную экспрессию гена матриптазы. Например, анализ может включать осуществление качественной или количественной RT (обратная транскрипция) ПЦР для детекции наличия, отсутствия, количества или длины мРНК матриптазы. Дополнительно или альтернативно анализу функциональной экспрессии матриптазы в клетке способ селекции может включать этап тестирования того, есть ли активность матриптазы в кондиционированной среде, полученной из указанной клетки. Например, можно осуществлять эксперименты с контрольными образцами, как описано в примерах. Таким образом, можно собирать среду для культивирования клеток из множества потенциальных линий клеток для анализа того, есть ли активность матриптазы в соответствующим образом полученной кондиционированной среде. Например, кондиционированную среду можно тестировать на активность клиппирования в ней в отношении полипептида, подверженного клиппированию. Используя один или несколько полипептидов, которые, как известно, подвергаются клиппированию, в качестве стандарта для тестирования активности клиппирования, можно качественно или количественно оценивать активность клиппирования в потенциальных линиях клеток относительно друг друга или стандартной линии клеток.
[116] По одному из вариантов осуществления способ по седьмому аспекту предназначен для селекции клеток млекопитающих, в частности, клеток грызуна, таких как клетки хомяк, предпочтительно - клетки CHO.
[117] По одному из вариантов осуществления способ по седьмому аспекту включает селекцию по меньшей мере одной клетки, где функцию матриптазы ухудшают, предпочтительно - посредством снижения или устранения функциональной экспрессии гена матриптазы для рекомбинантной экспрессии интересующего полипептида. Клетки, имеющие соответствующие характеристики, особенно подходят для рекомбинантной экспрессии, как показано в примерах. Дополнительные варианты осуществления соответствующих клеток также подробно описаны выше, и это относится к соответствующему описанию.
[118] Числовые диапазоны, представленные в настоящем описании, включают числа, определяющие диапазон. Заголовки, представленные в настоящем описании, не ограничивают различные аспекты или варианты осуществления настоящего изобретения, которые можно толковать со ссылкой на описание в целом. По одному из вариантов осуществления объект, представленный в настоящем описании как содержащий конкретные элементы, также относится к объекту, состоящему из соответствующих элементов. В частности, полинуклеотиды, представленные в настоящем описании как содержащие конкретные последовательности, также могут состоять из соответствующих последовательностей. Предпочтительно осуществлять селекцию и комбинировать предпочтительные варианты осуществления, представленные в настоящем описании, и конкретный объект, возникающий в результате соответствующей комбинации предпочтительных вариантов осуществления, также принадлежит к настоящему изобретению. Все документы, процитированные в настоящем описании, включены в него в качестве ссылок.
ПРИМЕРЫ
[119] Следующие примеры служат для иллюстрирования настоящего изобретения без какого-либо ограничения его сущности. В частности, примеры относятся к предпочтительным вариантам осуществления настоящего изобретения.
I. Материалы и способы
1. Культура клеток
[120] Если в настоящем описании не представлено иначе, в качестве культуры клеток во встряхиваемых колбах в стандартной среде культивировали растущие в суспензии клетки CHO, полученные из CHO-K1, и способ культивирования клеток описывают, например, в WO 2011/134920. Клетки пересевали 2 раза в неделю в свежие среды и поддерживали их в логарифмической фазе роста на всем протяжении исследования.
Ту же среду для культивирования, которую использовали для культивирования клеток, использовали в примерах в качестве положительного контроля.
2. Эксперименты с контрольными образцами с использованием кондиционированной среды
[121] Клетки, не содержащие гетерологичный полинуклеотид, кодирующий интересующий полипептид, пересевали при плотности 2×105 жизнеспособных клеток/мл в стандартной среде (30 мл культуры) и выращивали при 37°C. На пике плотности жизнеспособных клеток (как правило, через 7 или 8 дней после пассажа; жизнеспособность выше 95%) клетки удаляли из среды. В этих условиях и на этой стадии роста клеток ожидают, что в среде для культивирования клеток активными будут максимальные количества секретируемых протеаз без высвобождения внутриклеточных протеаз в результате гибели клеток. Кроме того, в этих условиях ожидают максимального количества интересующего секретируемого полипептида, если клетки трансфицировали для экспрессии интересующего рекомбинантного полипептида. Для получения кондиционированной среды культуры клеток центрифугировали в течение 15 мин при 90×g (достаточно осторожно, чтобы клетки не высвобождали внутриклеточные протеазы в результате нагрузки при центрифугировании). После центрифугирования супернатант переносили и пропускали через фильтр 0,22 мкм для удаления оставшихся частиц клеток из кондиционированной среды.
[122] Интересующий полипептид добавляли в полученную таким образом кондиционированную среду с конечной концентрацией 0,7 мкМ и инкубировали при 37°C с непрерывным встряхиванием при 500 об./мин. Время инкубации для каждого интересующего полипептида определяли предварительно посредством периодического удаления аликвот в образце дикого типа и их анализа с использованием электрофореза в ПААГ в присутствие SDS и вестерн-блоттинга. Для каждого интересующего полипептида выбирали момент времени, в который наблюдали по меньшей мере 50% деградации в кондиционированной среде дикого типа. После инкубации все образцы интересующего полипептида анализировали посредством электрофореза в ПААГ в присутствие SDS, как правило, с последующим анализом вестерн-блоттинга для определения степени клиппирования. В примерах для анализа клиппирования в качестве интересующего полипептида использовали различные терапевтические полипептиды.
3. Электрофорез в ПААГ в присутствие SDS и вестерн-блоттинг
[123] Образцы белка разводили в буфере Pierce Lane Marker Reducing Sample Buffer (10 мМ DTT, кат. № 39000) и кипятили в течение 5 мин при 95°C. Приблизительно 0,1-0,6 мкг белка/дорожку нагружали на готовый гель 4-12% бис-Триса (Invitrogen, кат. № NP0322BOX). После электрофореза гели переносили на нитроцеллюлозную мембрану (Invitrogen, LC2001) с использованием системы электроблоттинга Bio-Rad. Интересующий полипептид определяли с использованием HRP-конъюгированного специфичного антитела и ECL (Pierce, кат. № 32109).
II. Пример 1: Клиппирование различных интересующих полипептидов при сайленсинге экспрессии различных протеаз посредством РНК-интерференции (РНКи)
[124] Сначала участки протеолитического расщепления различных рекомбинантных белков, подверженных клиппированию, анализировали различными способами, включая анализ CE-SDS, масс-спектрометрию и анализ in silico (данные не представлены). С помощью этого анализа в комбинации с дополнительными анализами с использованием различных ингибиторов протеаз выявляли, что большинство тестируемых белков, подверженных клиппированию, расщепляют трипсин-подобными протеазами, являющимися подсемейством сериновых протеаз. Эксперимент по РНКи в примере 1 проводили для демонстрации того, что матриптаза является ключевой протеазой, ответственной за клиппирование, и что сайленсинг гена матриптазы значительно снижает клиппирование, в то время как сайленсинг других генов, кодирующих различные протеазы, не снижает клиппирование интересующего полипептида. Конструировали миРНК против следующих мРНК-мишеней, экспрессирующихся в клетках CHO: 1. матриптаза (MT-SP1; также обозначаемая в настоящем описании как St14), 2. C1r (компонент комплемента активируемая C1r; также обозначаемая как Ctra), 3. C1s (компонент комплемента C1sB; также обозначаемый как Gm5077), 4. Plat (t-активатор плазминогена) и 5. Prss35 (протеаза, сериновая, 35). Эти гены-мишени кодируют трипсин-подобные протеазы, являющиеся секретируемыми или трансмембранными белками, и, таким образом, могут участвовать в клиппировании рекомбинантно экспрессирующихся белков, секретирующихся в среду для культивирования клеток. Ранее было подтверждено, что эти белки экспрессируются клетками CHO. В таблице 2 представлен обзор соответствующих генов-мишеней:
Таблица 2
|
[125] Смысловая и антисмысловая последовательность миРНК против матриптазы и других протеаз-мишеней приведены в таблице 3.
Таблица 3
|
Подробная схема эксперимента описана далее.
1.1. Трансфекция с использованием миРНК
[126] Трансфекцию с РНКи полученных из CHO-K1 клеток осуществляли с использованием реагента Lipofectamine® RNAiMAX (Life Technology, кат. № 13778), следуя "Протоколу обратной трансфекции" из руководства MAN0001182, масштабированному до 6-луночных планшетов. Для каждой мРНК-мишени использовали две наиболее эффективные концентрации дуплексных молекул РНКи из 100, 125 и 150 пмоль: 125 и 150 пмоль в случае MT-SP1 (St14), 125 и 150 пмоль в случае C1r (C1ra), 100 и 125 пмоль в случае C1s (Gm5077), 125 и 150 пмоль в случае Plat и 100 и 125 пмоль в случае Prss35. Дуплексные молекулы РНКи двух выбранных концентраций разводили в 1 мл Opti-MEM® (Gibco, кат. № 31985-062). В качестве отрицательного контроля РНКи (миРНК отрицательного контроля) использовали миРНК отрицательного контроля Silencer® № 1 (AM4611) (в концентрации 125 пмоль). В каждую лунку добавляли 5 мкл реагента Lipofectamine® RNAiMAX. Добавляли 2 мл клеточной суспензии с концентрацией 0,5×106 клеток/мл и планшеты инкубировали при 37°C и 10% CO2. Через три дня после трансфекции измеряли плотность клеток, экстрагировали тотальную РНК 3×106 жизнеспособных клеток с использованием набора RNeasy Plus Mini Kit (Qiagen, кат. № 74134) и собирали кондиционированную среду из каждой лунки. Для контроля эффекта сайленсинга в отношении генов-мишеней определяли экспрессию мРНК посредством RT-ПЦР в реальном времени.
Таблица 4: Последовательности праймеров и зондов для определения экспрессии мРНК протеазы
|
[127] Остаточная экспрессия гена протеазы относительно экспрессии гена протеазы в клетках отрицательного контроля миРНК, принимаемой за 100%, являлась следующей: MT-SP1: 125 пмоль (18,6%) и 150 пмоль (18,2%), C1r (C1ra): 125 пмоль (6,3%) и 150 пмоль (6,7%), C1s (Gm5077): 100 пмоль (11,9%) и 125 пмоль (14,4%), Plat: 125 пмоль (8,3%) и 150 пмоль (5,1%) и Prss35: 100 пмоль (18,4%) и 125 пмоль (14,8%).
1.2. Эксперименты с контрольными образцами в кондиционированной среде
[128] Для сбора кондиционированной среды 200 мкл среды для культивирования клеток из 6-луночных планшетов центрифугировали (300×g в течение 3 мин) и полученный супернатант использовали в качестве кондиционированной среды для экспериментов с контрольными образцами, как описано в "Материалах и способах" выше. Интересующий полипептид являлся моноклональным антителом IgG (mAb) или Fc-слитым белком. Как описано выше, временную точку, в которой наблюдали по меньшей мере 50% деградации в кондиционированной среде дикого типа, выбирали для каждого интересующего полипептида. Результаты приводили к времени инкубации 3 дня для Fc-слитого белка (где, однако, деградация составляла гораздо более 50%) и времени инкубации 7 дней для mAb. После инкубации образцы интересующего полипептида в кондиционированной среде анализировали посредством электрофореза в ПААГ в присутствие SDS и анализа вестерн-блоттинга для определения степени клиппирования, как описано в "Материалах и способах".
1.3. Клиппирование белка: Результаты экспериментов с контрольными образцами
[129] На фиг. 1 показан вестерн-блоттинг различных анализируемых интересующих полипептидов после инкубации, как определено выше, на верхней панели - mAb и на нижней панели - Fc-слитый белок.
[130] На первой дорожке вестерн-блоттинга на верхней панели показано mAb после инкубации в течение 7 дней в необработанной (химически определенной) среде (ту же среду также использовали для культивирования клеток), где, таким образом, не должно происходить клиппирование, т.к. среду для культивирования клеток не приводили в контакт с клетками, и,таким образом, клеточные протеазы присутствуют в указанной среде (положительный контроль (+)). MAb представлено в виде одной сильной белковой полосы (показано стрелкой), и клиппирование не происходило.
[131] На второй дорожке показан образец mAb после 7 дней инкубации в кондиционированной среде клеток отрицательного контроля ((-)), которые трансфицировали с использованием миРНК отрицательного контроля (отсутствие эффекта в отношении экспрессии гена). Т.к. миРНК отрицательного контроля не имеет эффекта в отношении экспрессии гена, кондиционированная среда, по существу, соответствует кондиционированной среде, получаемой после инкубации неизмененных клеток и, таким образом, клеток, демонстрирующих нормальную экспрессию гена-мишени, и где, таким образом, кодируемые протеазы нормально экспрессируются. Как можно видеть, в дополнение к белковой полосе интактного mAb появляется вторая сильная белковая полоса, соответствующая клиппированному mAb (показано стрелкой). Обе белковые полосы имеют одинаковую интенсивность, таким образом, можно предположить, что приблизительно 50% mAb подвергалось клиппированию. Тот же результат - значительное клиппирование - обнаруживали для mAb, инкубируемого в супернатанте клеток, в котором C1r (C1ra), C1s (Gm5077), Plat и Prss35 подвергали сайленсингу посредством РНКи (см. дорожки 5-12). То, что гены-мишени эффективно подвергали сайленсингу, подтверждали посредством RT-ПЦР. В случае C1r (C1ra) обнаруживали наибольшее снижение мРНК на 93,7% и 93,3%. Снижение, обнаруживаемое в случае Plat, составляло 91,7% и 94,9%, в случае C1s (Gm5077) - 88,1% и 85,6%, и в случае Prss35-81,6% и 85,2%. Таким образом, все эти гены-мишени успешно подвергали сайленсингу более чем на 80%. Несмотря на это, во всех этих случаях белковая полоса, соответствующая клиппированному mAb, имела, по меньшей мере, приблизительно ту же интенсивность сигнала, что и белковая полоса, соответствующая интактному mAb. Таким образом, как и в отрицательном контроле (-), по меньшей мере приблизительно 50% mAb подвергалось клиппированию. Таким образом, отрицательная регуляция этих генов протеаз не снижала клиппирование интересующего полипептида в кондиционированной среде.
[132] В отличие от этого, снижение экспрессии матриптазы (MT-SP1) в клетках посредством РНКи (см. дорожки 3 и 4) значительно снижало клиппирование mAb. В обоих схемах, в которых MT-SP1 подвергали супрессии на 81,4% и 81,8% по сравнению с отрицательным контролем (оставшаяся экспрессия MT-SP1-18,6% и 18,2%), белковая полоса, соответствующая клиппированному mAb, является значительно более слабой, чем белковая полоса, соответствующая интактному mAb. Это свидетельствует о том, что значительно меньше mAb подвергалось клиппированию, и что изменение клетки позвоночного для снижения функциональной экспрессии гена матриптазы, в данном случае - посредством РНКи, значительно снижает степень клиппирования интересующего полипептида в кондиционированной среде для культивирования клеток, полученной с помощью указанных клеток.
[133] Результаты для Fc-слитого белка, как дополнительного примера интересующего полипептида, представлены на нижней панели фиг. 1. В отличие от mAb, сравнительный образец "(+)" Fc-слитого белка содержит, в дополнение к белковой полосе, соответствующей интактному белку, вторую сильную полосу, соответствующую Fc-части в отдельности, также являющейся основным продуктом клиппирования (обе полосы показаны стрелками). Клиппированную Fc-часть также обнаруживают в положительном контроле, т.к. исходный материал (Fc-слитый белок, продуцируемый клетками CHO) даже после очистки содержит высокую процентную долю клиппированного Fc-слитого белка. В ходе очистки Fc-белка можно удалить не весь клиппированный материал. Таким образом, Fc-слитый белок, используемый в положительном контроле в качестве исходного материала, уже содержит значительные количества клиппированной Fc-части в качестве примеси. В кондиционированной среде клеток, где экспрессию C1r (C1ra), C1s (Gm5077), Plat или Prss35 подвергали сайленсингу, сигнал для интактного Fc-слитого белка находится в диапазоне от слабого (Plat) до очень слабого (Prss35). Таким образом, в этих случаях клиппирование Fc-слитого белка являлось очень высоким и достигало значений до 100% несмотря на то, что экспрессию этих протеаз подвергали супрессии. Таким образом, сайленсинг этих генов протеаз являлся неэффективным в снижении клиппирования. В отличие от этого, в кондиционированной среде, полученной с помощью клеток, в которых экспрессию матриптазы (MT-SP1) подвергали сайленсингу (использовали лишь одну концентрацию миРНК), обнаруживали приблизительно ту же интенсивность интактного белка, что и в положительном контроле (+). Таким образом, значительно снижали клиппирование. Дорожка, соответствующая миРНК отрицательного контроля (-), также содержит интактный белок. Однако этот результат представляет собой контаминацию дорожки миРНК отрицательного контроля положительным контролем, перетекающим при нанесении.
[134] В заключение, этот эксперимент с РНКи свидетельствует о том, что сайленсинг экспрессии матриптазы в клетках-хозяевах приводит к значительному снижению клиппирования различных примеров интересующих полипептидов в кондиционированной среде, полученной с помощью указанных клеток. В отличие от этого, сайленсинг экспрессии других трипсин-подобных протеаз, экспрессируемых клетками-хозяевами, не обладает каким-либо положительным эффектом в отношении клиппирования. Таким образом, в примере 1 подтверждена важность открытия того, что матриптаза является основной протеазой, ответственной за клиппирование интересующих рекомбинантно экспрессирующихся и секретируемых полипептидов. Кроме того, обнаруживали, что клетки, где матриптаза подвергалась отрицательной регуляции посредством РНКи, имели те же характеристики роста, что клетки с миРНК отрицательного контроля. Таким образом, отрицательная регуляция экспрессии матриптазы не влияет на рост клеток.
III. Пример 2: Нокаут гена матриптазы (KO) в клетках CHO приводит к снижению клиппирования
A. KO, осуществляемый с использованием технологии TALEN
[135] Девять клонов клеток с нокаутом матриптазы (MT-SP1) на основе клеток, полученных из CHO-K1, получали с использованием технологии TALEN (подобных активатору транскрипции эффекторных нуклеаз). Для нокаута на экзон 2 матриптазы направленно воздействовали в области, локализующейся перед кодирующей областью трансмембранного домена. Выбирали экзон 2, т.к. он охватывает различные альтернативные варианты сплайсинга. Добавление мутаций со сдвигом рамки считывания в экзоне 2 обладает преимуществом, состоящим в том, что укороченный белок будет коротким, будет локализоваться внутриклеточно и, кроме того, будет нестабильным и нетоксичным для клеток.
2.A.1. Дизайн/получение и использование TALEN, специфичных для экзона 2 матриптазы
[136] Экзон 2 матриптазы и фланкирующие интроны секвенировали в полученной из CHO-K1 родительской линии клеток (см. фиг. 2, SEQ ID NO: 31).
[137] Конструировали две укороченных TAL FokI против экзона 2 матриптазы. Каждая TALEN направлена и связывается с 19 нуклеотидами на 5' (прямой) или 3' (обратной) цепи ДНК, соответственно. Два участка связывания разделены шестнадцатью нуклеотидами участка расщепления. Каждую сконструированную TAL синтезировали и клонировали в исходный вектор Gateway® и субклонировали в конечный вектор pEXP3-DEST_A302. Описание продукта и способы доступны в Life Technology/GeneArt. Получали плазмиды, кодирующие распознающие 5' (слева) или 3' (справа) цепь TALEN (субклонированные в основной вектор pEXP3-DEST). pEXP3-DEST содержит промотор T7 выше кодирующей последовательности TALEN, что делает возможной транскрипцию in vitro (IVT) мРНК, кодирующей TAL-FokI.
2.A.2. Транскрипция векторов TALEN in vitro
[138] МРНК TALEN получали посредством транскрипции in vitro (IVT) векторов TALEN. Векторы TALEN предварительно линеаризовали с использованием фермента рестрикции HindIII (Roche, кат. № 10656321001) и очищали с использованием изопропанола с последующим осаждением 70% этанолом. МРНК получали способами, известными специалисту в этой области. Кэпированный продукт IVT очищали посредством осаждения NH4-Ac и полученную мРНК (содержащую поли-A-хвост и 5'-кэп) очищали с использованием набора Qiagen RNeasy Micro kit (кат. № 74004).
2.A.3. Трансфекция мРНК TALEN
[139] Для трансфекции использовали родительские клетки CHO-K1 в фазе экспоненциального роста с жизнеспособностью более 95%. Электропорацию (нуклеофекцию) осуществляли с использованием технологии Amaxa™, Nucleofector™ по инструкциям производителя (Lonza). Трансфицированные клетки выращивали в течение 4 дней после трансфекции и отдельные клетки разделяли в день 7 по 30 96-луночным планшетам. Моноклональность и конфлюентность контролировали с помощью Cloneselect™ Imager (Genetix).
2.A.4. Анализ Cel-I и стратегия скрининга
[140] Анализ Cel-I осуществляли по инструкциям SAFC Biosciences. Анализ Cel-I является стандартным анализом для определения эффективности расщепления. Вкратце, через 3 дня после трансфекции из клеток выделяли геномную ДНК и осуществляли ПЦР с использованием следующих праймеров:
Fwd: ttttttgcccagtcctggtt (SEQ ID NO: 32)
Rev: ccctttggtctgtcctctga (SEQ ID NO: 33)
[141] Продукт амплификация подвергали денатурации и позволяли ему ренатурироваться. Затем добавляли усилитель нуклеазы S и нуклеазу S и инкубировали. Анализировали расщепленный продукт. Присутствовали две меньшие полосы, свидетельствующие об активности TALEN в этой области генома и, таким образом, подтверждающие то, что клетки, где ген матриптазы изменен посредством мутации, присутствовали в анализируемых совокупностях клеток. Из наиболее положительных совокупностей клеток (более высокая интенсивность двух меньших полос) отдельные клетки подвергали сортировке в 96-луночные планшеты.
[142] Геномную ДНК (gDNA) экстрагировали из каждого клона в 96-луночных планшетах с использованием наборов Extract-N-Amp™ Blood PCR Kit (кат. № XNAB2R, Sigma). Экстракты gDNA использовали для скрининга на мутантные клоны в анализе "CutSite ПЦР" с использованием обратного праймера (Rev), представленного выше (SEQ ID NO: 33), в комбинации с праймером, связывающимся с участком расщепления (обозначаемым как праймер для анализа расщепления), имеющим следующую последовательность:
Праймер для анализа расщепления: GTGGAGTTTCTGCCTGTGAA (SEQ ID NO: 34)
Если в области участка разрезания возникала мутация в результате активности TALEN, праймер для анализа расщепления не будет связываться, что приводит к отсутствию продукта ПЦР. Клоны без продукта ПЦР анализировали посредством секвенирования для определения встроенной мутации. Альтернативно или дополнительно, осуществляли анализ Surveyor Mutation Detection (Transgenomics, кат. № 706025) с использованием прямого (Fwd) и обратного (Rev) праймеров, представленных выше. Клоны с мутациями переносили во встряхиваемые колбы емкостью 125 мл и секвенировали. В указанных скрининговых исследованиях идентифицировали клон Δ7/Δ15. Кроме того, после первого раунда трансфекции и скрининга с использованием анализа Cel-I получали один клон с генотипом wt/Δ4, имеющий мутацию со сдвигом рамки считывания в одном аллеле матриптазы.
[143] Для получения нокаутных клонов, содержащих мутации со сдвигом рамки считывания в обоих аллелях, осуществляли два раунда трансфекции мРНК TALEN и клонирования. Для получения нокаутных клонов с мутациями со сдвигом рамки считывания в обоих аллелях MT-SP1 клон с генотипом wt/Δ4 использовали во втором раунде трансфекции мРНК TALEN-клонирования, как описано выше, для получения мутаций со сдвигом рамки считывания также во втором аллеле. В целом, получали девять нокаутных по матриптазе клонов (KO-1-KO-9), содержащих мутации со сдвигом рамки считывания в обоих аллелях. Генотипы девяти клонов описаны в таблице 5. Последовательности экзона 2 MT-SP1, относящиеся к дикому типу, и эти мутации представлены в таблице 6. Частичные последовательности продукта MT-SP1, являющиеся результатом мутаций, представлены в таблице 7. Аминокислоты, кодируемые экзоном 2, выделенные полужирным шрифтом.
[144] В соответствии с таблицей 5, существует четыре клона, KO-1, KO-4 и KO-7 и KO-9, с генотипом Δ4/Δ4. Генотип матриптаза этих клонов является идентичным. KO-1, KO-4 и KO-7 получают из одной ретрансфицированной TALEN совокупности, KO-9 получают из другой. FISH-анализ клонов показал, что существует несколько отличий в кариотипе KO-1, KO-4 и KO-7. Таким образом, предполагают, что их получают не из одной и той же материнской клетки.
[145] Мутацию со сдвигом рамки считывания встраивают в оба аллеля гена матриптазы во все клоны KO-1-KO-9. Кроме того, получали мутантный клон Δ7/Δ15, имеющий генотип Δ7/Δ15 и имеющий мутацию со сдвигом рамки считывания только в одном аллеле (Δ7). Во втором аллеле мутация Δ15, делеция 15 пар оснований, приводит к делеции пяти аминокислот в коротком внутриклеточном домене матриптазы. Однако в результате делеции Δ15 не происходит сдвиг рамки считывания. Затронутый домен, по-видимому, не важен для каталитической функции, т.к. он остается прикрепленным к мембране, когда внеклеточная часть, содержащая каталитический домен протеазы, отщепляется. Таким образом, предполагают, что матриптаза, экспрессирующаяся с аллеля Δ15, все равно является каталитически активной. Таким образом, в клоне клетки Δ7/Δ15 снижают, но не устраняют, функциональную экспрессию матриптазы. Кроме того, предполагают, что приблизительно половина оставшейся мРНК, экспрессируемой указанным клоном, содержит мутацию со сдвигом рамки считывания.
Таблица 5: Мутации в экзоне 2 обоих аллелей гена матриптазы
|
Таблица 6: Последовательности гена матриптазы, кодирующие экзон 2 из клеток WT, полученных из CHO-K1, и различных KO клонов. С помощью "Δ" указана делеция. Числом после Δ указано то, сколько нуклеотидов подвергнуто делеции. В скобках полужирным шрифтом указаны делетированные нуклеотиды.
|
Таблица 7: Частичные аминокислотные последовательности матриптазы CHO WT и клонов KO, включающие экзоны 1, 2 и 3, при этом аминокислоты экзона 2 указаны полужирным шрифтом. Символом * в таблице 7 указан стоп-кодон.
|
2.A.5. Экспрессия мРНК матриптазы
[146] Для тестирования эффекта встроенных мутаций в отношении экспрессии матриптазы осуществляли количественную ПЦР с обратной транскрипцией в реальном времени (qRT-ПЦР). Экспрессию мРНК матриптазы, измеряемую в отдельных клонах посредством qRT-ПЦР, сравнивали с экспрессией мРНК в полученной из CHO-K1 клетке дикого типа. Результат этого эксперимента представлен на фиг. 3. В соответствии с фиг. 3 в клонах клеток с мутантной матриптазой мРНК экспрессировалась лишь в диапазоне от 5 до 40% по сравнению с диким типом. Этот результат позволяет предполагать, что экспрессия мутантной матриптазы снижена. Таким образом, клетки экспрессируют меньше (нефункционального) белка матриптазы. Кроме того, клон клетки Δ7/Δ15 демонстрировал лишь низкую экспрессию мРНК матриптазы в клетках.
2.A.6. Эксперименты с контрольными образцами с использованием супернатанта клеток из девяти нокаутных по матриптазе (MT-SP1) клонов
[147] Для оценки эффекта нокаута матриптазы осуществляли эксперименты с контрольными образцами с использованием пяти различных интересующих полипептидов, подверженных клиппированию. Кондиционированную среду культур клеток нокаутных клонов CHO получали по протоколу, описываемому в "Материалах и способах". Для экспериментов с контрольными образцами интересующий полипептид добавляли в кондиционированную среду с конечной концентрацией 0,7 мкМ и инкубировали при 37°C с непрерывным встряхиванием при 500 об./мин. Время инкубации зависело от типа тестируемого интересующего полипептида. После инкубации образцы интересующего полипептида в кондиционированной среде анализировали посредством электрофореза в ПААГ в присутствие SDS и анализа вестерн-блоттинга, как описано в "Материалах и способах".
[148] На фиг. 4A показан анализ вестерн-блоттинга в эксперименте с контрольными образцами с моноклональным антителом IgG (mAb) в качестве интересующего полипептида. В качестве референсного контроля на первой дорожке левого вестерн-блоттинга (указанной как "(+)") показано mAb после инкубации в химически определенной среде (ту же среду для культивирования также использовали для получения кондиционированной среды). Не определяли клиппирование продукта; интактный белок показан стрелкой. На второй дорожке (WT) показано моноклональное антитело после 48 ч. инкубации в кондиционированной среде, полученной из полученных из CHO-K1 клеток, в норме экспрессирующих матриптазу. Здесь определяли вторую сильную полосу, представляющую клиппированное антитело (показано стрелкой). Т.к. белковая полоса клиппированного антитела является более сильной, чем белковая полоса интактного белка, более 50% белка является клиппированными. В отличие от этого, после инкубации моноклонального антитела в кондиционированной среде, полученной из девяти нокаутных линий клеток KO-1-KO-9 (1-9 на фиг. 4), соответственно, не определяли клиппированный продукт. Таким образом, нокаут гена матриптазы в клетке-хозяине позвоночного представляет собой значительное улучшение, т.к. клиппирование mAb в среде для культивирования клеток можно эффективно предотвращать.
[149] Результаты соответствующего эксперимента с контрольными образцами с использованием Fc-слитого белка представлены на фиг. 4B. Время инкубации составляло 24 ч. В отличие от моноклонального антитела, даже положительный контроль в химически определенной среде (+) содержал большую часть клиппированного белка (показано стрелкой). Это является результатом того, что Fc-слитый белок, который добавляли в качестве интересующего полипептида, получали в клетках CHO, и он является в значительной степени клиппированным в среде для культивирования, из которой его собирали. Не весь клиппированный белок можно удалить при очистке, таким образом, исходный материал уже имеет некоторую контаминацию клиппированным белком. Хотя в экспериментах с нокаутными по матриптазе клонами (1- 9) количества интактного белка и клиппированного белка сравнимы с исходным материалом, инкубируемым в положительном контроле (+), инкубация в кондиционированной среде неизмененных полученных из CHO-K1 клеток дикого типа (WT) полностью устраняла интактный белок и, таким образом, приводила к его деградации. Таким образом, по существу, 100% клиппирования наблюдали в кондиционированной среде, полученной с помощью клеток, не измененных для ухудшения функции матриптазы.
[150] Сравнимый результат обнаруживают в случае дополнительного рекомбинантного терапевтического белка, который инкубировали в кондиционированных средах в течение 1 ч. (фиг. 4C). Присутствуют два гликоварианта белка. И снова, в кондиционированной среде клеток CHO-K1 дикого типа (WT) более 50% обоих гликовариантов белка являются клиппированными (показаны стрелками), в то время как инкубация в кондиционированных средах клеток KO-1-KO-9 (1-9), где функция эндогенной протеазы матриптазы ухудшена в результате нокаута гена, сохраняла состояние интактного белка, как наблюдали после инкубации в химически определенной среде (положительный контроль (+)).
[151] KO клоны также анализировали в течение месяцев для анализа того, является ли предотвращение, соответственно, снижение клиппирования стабильной характеристикой измененных клеток позвоночных, в которых ген матриптазы подвергали нокауту. Таким образом, эксперимент с контрольными образцами с использованием mAb повторяли с кондиционированной средой, полученной из нокаутных по матриптазе клонов клеток, которые культивировали в течение 3 месяцев. Результат эксперимента, снова сравниваемый с кондиционированной средой, полученной с помощью клеток CHO дикого типа, в качестве отрицательного контроля "(WT)" и химически определенной средой в качестве положительного контроля "(+)", показан на фиг. 4D. С помощью вестерн-блоттинга получали точно тот же профиль белковых полос, что и на фиг. 4A. Тот же результат также наблюдали после 3 месяцев для Fc-слитого белка (данные не представлены). Таким образом, подтверждали что в случае KO клонов не наблюдали клиппирование после нескольких месяцев. Кроме того, обнаруживали, что KO линии клеток хорошо росли, и рост клеток даже улучшался при культивировании в течение 3 месяцев.
[152] Результаты экспериментов с контрольными образцами с двумя гликозилированными вирусными белками с использованием кондиционированной среды, полученной с помощью нокаутных по матриптазе клонов KO-1-KO-3 (1-3) через 24 ч. (D1) и 48 ч. инкубации (D2), представлены на фиг. 5. На первой дорожке вестерн-блоттинга (фиг. 5A), соответствующей белку после инкубации в химически определенной среде (+), видны две белковые полосы. Верхняя полоса соответствует интактному белку, нижняя полоса - клиппированной версии белка, составляющей до приблизительно 5% общего белка в образце. В кондиционированной среде CHO-K1 дикого типа (дорожки WT) после 24 ч. (D1) инкубации присутствует сильно сниженное количество интактного белка. Через 48 ч. (D2) белковая полоса является почти невидимой, т.е. почти весь белок являлся клиппированным. Кроме того, белковая полоса, соответствующая клиппированному белку, полностью исчезала, что позволяет предполагать, что белок в дальнейшем подвергался деградации. В отличие от этого, не обнаруживали различий в профиле белковых полос для белков, инкубируемых в течение 24 ч. или 48 ч. в кондиционированных средах, полученных с помощью нокаутных по матриптазе клонов KO-1-KO-3 (см. 1-3). Таким образом, с использованием кондиционированной среды, полученной с помощью нокаутных по матриптазе линий клеток, определяли отсутствие или значительное снижение протеолитической деградации терапевтических белков. В случае второго вирусного белка наблюдают сравнимый результат (фиг. 5B). В этом случае интактный белок представлен одной белковой полосой, показанной на дорожке "(+)". Уже через 24 ч. инкубации в кондиционированной среде, полученной с помощью клеток дикого типа (WT, D1), полученных из CHO-K1, почти нельзя определить следы интактного белка. Вместо этого появляются две нижние белковые полосы, соответствующие клиппированным версиям белка. Эти белковые полосы также наблюдают в эксперименте со средой, полученной с помощью нокаутных по матриптазе клонов KO-1-KO-3. Однако, большую часть вирусного белка сохраняли при использовании всех тестируемых нокаутных клонов даже после 48 ч. инкубации.
[153] В подтверждение описанных выше экспериментов осуществляли эксперимент с контрольными образцами с пятью дополнительными Fc-слитыми белками, подверженными клиппированию, как описано выше. Несодержащий клетки супернатант подвергали захвату посредством аффинной жидкостной хроматографии с протеином A с использованием 1 мл HiTrap MabSelect Sure (GE Healthcare). Для уравновешивания, нагрузки и промывания использовали продолжительность обработки 2 минуты. Для элюции использовали продолжительность обработки 4 минуты. Элюат тировали до pH 5 с помощью 1 M Трис перед стерилизующей фильтрацией с использованием модуля шприцевого фильтра Millex-GV (0,22 мкм, PVDF, 13 мм; Millipore). Концентрацию белка определяли с использованием спектрофотометра NanoDrop 2000 (Thermo Scientific) при длине волны 280 нм. Все этапы осуществляли при комнатной температуре. В таблице 8 представлены данные масс-спектрометрического анализа. Как можно видеть, все тестируемые Fc-слитые белки являлись полностью или почти полностью клиппированными при экспрессии в родительских клетках. В отличие от этого, клиппирование значительно снижали при экспрессии в нокаутной линии клеток.
Таблица 8: Анализ клиппирования различных Fc-слитых белков
|
[154] В этих примерах показано, что измененные клетки позвоночных по настоящему изобретению, где функция эндогенной протеазы матриптазы ухудшена, не содержат, или не высвобождают, содержат или высвобождают сниженные количества функциональной матриптазы в среде для культивирования клеток. Таким образом, протеолитическая деградация интересующего рекомбинантного полипептида, присутствующего (в норме секретируемого) в среде для культивирования клеток, значительно снижается при использовании этих измененных клеток для получения интересующего полипептида.
2.A.7. Эксперименты с контрольными образцами с супернатантом клеток клона Δ7/Δ15 с мутантной матриптазой
[155] Для оценки эффекта сниженной функциональной экспрессии матриптазы эксперименты с контрольными образцами с Fc-слитым белком и моноклональным антителом IgG (mAb) повторяли с кондиционированной средой, полученной с помощью клона Δ7/Δ15. Кондиционированную среду культуры клеток получали по протоколу, описанному в "Материалах и способах". Для эксперимента с контрольными образцами интересующий полипептид добавляли в кондиционированную среду с конечной концентрацией 0,7 мкМ и инкубировали при 37°C с непрерывным встряхиванием при 500 об./мин. Fc-слитый белок инкубировали в течение 2 ч., mAb - в течение 24 ч. После инкубации образцы интересующих полипептидов в кондиционированной среде анализировали посредством электрофореза в присутствие SDS и анализа вестерн-блоттинга, как описано в "Материалах и способах".
[156] Результаты эксперимента с контрольными образцами с Fc-слитым белком представлены на фиг. 6A. В качестве референса на первой дорожке вестерн-блоттинга представлен Fc-слитый белок после инкубации в химически определенной среде (указан как "(+)"). На второй и третей дорожке ("WT1" и "WT2") представлен Fc-слитый белок после инкубации в кондиционированной среде, полученной с помощью двух разных линий клеток дикого типа, полученных из CHO-K1, в норме экспрессирующих немодифицированную функциональную матриптазу. Как указано выше, исходный материал содержал интактный Fc-слитый белок, а также клиппированный Fc-слитый белок в качестве примеси. В образцах белка, полученных при инкубации с кондиционированной средой, полученной с помощью клеток CHO с матриптазой дикого типа ("WT1" и "WT2"), по существу, не наблюдали интактный Fc-слитый белок. В отличие от этого, при инкубации в кондиционированной среде, полученной с помощью клона клеток Δ7/Δ15 ("Δ7/Δ15"), в которых функциональная экспрессия матриптазы значительно снижена (подробности, касающиеся клона, см. в примере 2.4), клиппирование значительно снижается, о чем может свидетельствовать сильная белковая полоса, соответствующая интактному Fc-слитому белку.
[157] На фиг. 6B представлен анализ вестерн-блоттинга для эксперимента с контрольными образцами с использованием IgG mAb в качестве интересующего полипептида. В качестве референса на первой дорожке вестерн-блоттинга (показанной как "(+)") показано mAb после инкубации в химически определенной среде. Одна сильная белковая полоса, соответствующая интактному антителу, являлась видимой. На второй и третьей дорожке ("WT1" и "WT2") показано моноклональное антитело после инкубации в кондиционированной среде, полученной с помощью двух разных полученных из CHO-K1 линий клеток дикого типа, экспрессирующих немодифицированную матриптазу. На этой второй и третей дорожке появилась дополнительная сильная белковая полоса, имеющая более низкую молекулярную массу, соответствующая клиппированному антителу. В соответствии с силой сигнала более 50% антитела, по-видимому, являются клиппированными. На четвертой дорожке ("Δ7/Δ15"), на которой показано mAb после инкубации в кондиционированной среде, полученной с помощью клона клеток Δ7/Δ15, интенсивности сигналов являются обратными. Таким образом, хотя клиппирование устранено не полностью, оно в значительной степени снижено по сравнению с клонами клеток с матриптазой дикого типа. Этот результат подтверждает, что снижение функциональной экспрессии матриптазы значительно снижает клиппирование интересующего полипептида в среде для культивирования клеток.
[158] Эти эксперименты свидетельствуют о том, что использование клона клеток, где только один аллель матриптазы подвергнут нокауту, и где снижена функциональная экспрессия матриптазы, также приводит к сниженному клиппированию интересующего полипептида в среде для культивирования клеток. Таким образом, можно заключить, что активность клиппирования пропорциональна степени экспрессии функциональной матриптазы.
B. KO, осуществляемый с использованием технологии ZFN
[159] Один ZFN-нокаутный (MT-SP1) клон клеток на основе родительских клеток CHO получали с использованием технологии ZFN (нуклеаз с цинковыми пальцами). Для нокаута на экзон 2 матриптазы направленно воздействовали в области, локализующейся перед кодирующей области трансмембранного домена (как описано в примере 2 A).
2.B.1. Дизайн/получение и использование TALEN, специфичных для экзона 2 матриптазы
[160] Конструировали пару ZFN против экзона 2 матриптазы. Одна ZFN воздействует и связывается с 12 нуклеотидами, другая воздействует на 18 нуклеотидов. Два участка связывания разделены пятью нуклеотидами участка расщепления.
2.B.2. Транскрипция in vitro векторов TALEN
[161] МРНК ZFN получали посредством транскрипции векторов ZFN in vitro (IVT). МРНК получали способами, известными специалисту в этой области. Кэпированный продукт IVT очищали посредством осаждения NH4-Ac и полученную мРНК (содержащую поли -A-хвост и 5'-кэп) очищали с использованием набора Qiagen RNeasy Micro kit (кат. № 74004).
2.B.3. Трансфекция мРНК ZFN
[162] Для трансфекции использовали родительские клетки CHO в фазе экспоненциального роста с жизнеспособностью более 95%. Осуществляли электропорацию (нуклеофекцию) с использованием технологии Amaxa™, Nucleofector™ по инструкциям производителя (Lonza).
2.B.4. Анализ Cel-I и стратегия скрининга
[163] Анализ Cel-I осуществляли по инструкциям SAFC Biosciences и осуществляли аналогичный скрининг, как описано в примере 2A.4.
[164] Для получения нокаутного клона, содержащего мутации со сдвигом рамки считывания в обоих аллелях, осуществляли два раунда трансфекции мРНК ZFN и клонирования. Получали один нокаутный по матриптазе клон (KO-10), содержащий мутации со сдвигом рамки считывания в обоих аллелях (Δ13/Δ13).
2.B.5. Эксперименты с контрольными образцами с использованием супернатанта клеток нокаутного по матриптазе (MT-SP1) клона
[165] Для оценки эффекта нокаута матриптазы осуществляли эксперименты с контрольными образцами с двумя разными интересующими полипептидами, подверженными клиппированию. Кондиционированную среду культур клеток, из которых получали нокаутные клоны CHO, получали по протоколу, описанному в "Материалах и способах". Для экспериментов с контрольными образцами интересующие полипептиды (один Fc-слитый белок и один рекомбинантный терапевтический белок) добавляли в кондиционированную среду с конечной концентрацией 0,7 мкМ и инкубировали при 37°C с непрерывным встряхиванием при 500 об./мин. Время инкубации зависело от типа тестируемого интересующего полипептида. После инкубации образцы интересующего полипептида в кондиционированной среде анализировали посредством электрофореза в ПААГ в присутствие SDS, как описано в "Материалах и способах".
[166] Результаты соответствуют экспериментам с контрольными образцами, осуществленным с использованием KO клонов, полученных с помощью технологии TALEN. Использовали Fc-слитый белок и рекомбинантный терапевтический белок, как описано в примере 2.A.6. Хотя в экспериментах с нокаутным по матриптазе клоном количества интактных белков и клиппированных белков сравнимы с исходным материалом, инкубируемым в положительном контроле (+), инкубация в кондиционированной среде неизмененных полученных с помощью CHO-K1 клеток дикого типа (WT) полностью устраняла интактные белки и, таким образом, приводила к их деградации.
[167] Клоны KO также анализировали в течение нескольких месяцев для анализа на предмет того, является ли профилактика и, соответственно, снижение клиппирования стабильной характеристикой измененных клеток позвоночных, в которых ген матриптазы подвергали нокауту. Таким образом, эксперимент с контрольными образцами с использованием Fc-слитого белка повторяли с кондиционированной средой, полученной из нокаутных по матриптазе клонов клеток, культивируемых в течение 6 месяцев. Результат эксперимента подтверждал, что при использовании KO клона не наблюдали клиппирование даже после нескольких месяцев. Кроме того, обнаруживали, что линия KO клеток хорошо росла, и рост клеток даже улучшался в течение времени культивирования.
IV. Пример 3: Рекомбинантные белки напрямую расщепляются матриптазой
[168] Для дополнительной демонстрации того, что матриптаза напрямую расщепляет рекомбинантно экспрессирующиеся и секретируемые белки (мишени клиппирования), использовали коммерчески доступные протеазы, а именно MT-SP1 мыши и Htra1 человека. Моноклональное антитело mAb IgG (фиг. 7A), Fc-слитый белок (фиг. 7B) и дополнительный рекомбинантный белок (фиг. 7C) инкубировали в течение 24 ч., 2 ч. и 1 ч., соответственно, с двумя трипсин-подобными протеазами MT-SP1 мыши и Htra1 человека, которые добавляли в химически определенную среду для культивирования. Совместную инкубацию осуществляли при 37°C с непрерывным встряхиванием при 500 об./мин. Интересующий полипептиды использовали в концентрации 0,7 мкМ каждый. Каждый интересующий полипептид тестировали с уменьшающимися количествами протеаз MT-SP1 и Htra1: молярные соотношения протеазы/интересующего полипептида слева направо составляют 1/10, 1/100, 1/1000 в случае MT-SP1 и 1/3, 1/10 и 1/100 в случае Htra1. В качестве контролей дополнительные образцы интересующего полипептида инкубируют с кондиционированной средой, полученной с помощью клеток дикого типа, полученных из CHO-K1, в качестве отрицательного контроля (дорожка "(-)"), и химически определенной средой, не приводимой в контакт с клетками в качестве положительного контроля (дорожка "(+)").
[169] Из вестерн-блоттингов на фиг. 7A-C очевидно, что рекомбинантная Htra1, которую добавляли в среду для культивирования клеток, не расщепляет ни один из тестируемых интересующих полипептидов. Даже при более высоких концентрациях Htra1 белковые полосы выглядят точно также, как и в положительном контроле ("(+)"). В отличие от этого, все интересующие рекомбинантные полипептиды в значительной степени подвергались клиппированию даже при наименьшей добавляемой концентрации MT-SP1. Белковая полоса напоминала полосу отрицательного контроля ("-") или была даже хуже. Таким образом, значительные степени клиппирования наблюдали во всех тестируемых условиях, когда добавляли MT-SP1.
[170] В эксперименте с Fc-слитым белком наблюдали зависящий от концентрации эффект протеазы MT-SP1 (фиг. 7B). Хотя при наименьшей концентрации матриптазы/MT-SP1 белковая полоса, соответствующая интактному Fc-слитому белку, соответствующая приблизительно 85 кДа, лишь немного уменьшена по сравнению с положительным контролем, при более высоких концентрациях MT-SP1 белковая полоса, соответствующая приблизительно 85 кДа, полностью исчезала. Таким образом, степень клиппирования Fc-слитого белка коррелирует с концентрацией матриптазы/MT-SP1 в среде для культивирования клеток.
[171] Для определения участка клиппирования, индуцируемого коммерческой MT-SP1 мыши, используемой в этом примере, образец антитела (mAb) с концентрацией MT-SP1 1/100 подвергали масс-спектрометрии. Идентифицированный участок клиппирования являлся тем же, что при получении mAb посредством линии клеток CHO дикого типа. Это свидетельствует о том, что участок клиппирования матриптазой мыши в mAb является тем же, что и участок клиппирования протеазой, ответственной за клиппирование при получении mAb в клетках CHO. Эти результаты дополнительно подтверждают, что матриптаза является клиппирующей протеазой.
V. Пример 4: Ингибирование клиппирования матриптазой посредством селективного ингибитора матриптазы
[172] Для дополнительного подтверждения того, что клиппирование интересующего рекомбинантного полипептида вызвано матриптазой как ключевой протеазой, ответственной за клиппирование, осуществляли эксперименты с контрольными образцами со специфичным Fab-фрагментом против MT-SP1, специфически ингибирующим матриптазу/MT-SP1 человека. Структура ингибиторного Fab и подробности связывания в отношении MT-SP1 человека опубликованы в Farady et al., 2008 J. Mol. Biol. (2008) 380, 351-360).
[173] В этом случае интересующими терапевтическими полипептидами в качестве мишеней для клиппирования являлись моноклональное антитело IgG (mAb) и рекомбинантный неантительный гликопротеин с двумя гликовариантами. В каждом случае интересующий полипептид добавляли в концентрации 0,7 мкМ. В таблице 9 описаны дополнительные подробности схемы эксперимента, соответствующие результатам вестерн-блоттинга, представленного на фиг. 8 для mAb (фиг. 8, верхняя панель) и рекомбинантного белка (фиг. 8, нижняя панель):
Таблица 9
|
[174] Кондиционированную среду получали, как описано в "Материалах и способах". Время инкубации составляло 24 ч. в случае моноклонального антитела IgG и 1 ч. в случае рекомбинантного неантительного белка.
[175] На фиг. 8 (см. верхнюю панель) показано, что сильная белковая полоса интактного mAb присутствует в положительном контроле (+) (см. дорожку 2). Не наблюдали клиппированное mAb. В отрицательном контроле (-) (см. дорожки 3 и 8) вторую белковую полосу с более высокой интенсивностью наблюдают немного ниже интактного белка, что свидетельствует о том, что моноклональное антитело является в значительной степени клиппированным в кондиционированной среде полученных из CHO-K1 клеток дикого типа. Интактное и клиппированное mAb указаны стрелками. Тот же профиль, что и в отрицательном контроле (-) наблюдают в химически определенной среде, в которую добавляли MT-SP1 мыши (см. дорожку 4). Что касается рекомбинантного неантительного белка (см. фиг. 8, нижняя панель) в положительном контроле (+) (см. дорожку 2) наблюдали сильную полосу для двух интактных гликовариантов белка, соответствующую приблизительно 37 кДа. Эти белковые полосы для интактных гликовариантов белка наблюдали в положительном контроле, но не в отрицательном контроле (-), и наблюдали новые белковые полосы для клиппированных гликовариантов белка (см. дорожки 3 и 8).
[176] Что касается образцов, которые инкубировали в присутствие Fab против MT-SP1, уже 1 мкМ Fab было достаточно для полного устранения деградации mAb MT-SP1 мыши (фиг. 8, верхняя панель, дорожка 5). 1 мкМ Fab против MT-SP1 также снижал, но не полностью предотвращал клиппирование mAb в кондиционированной среде (см. верхняя панель, дорожка 9). Клиппирование mAb устраняли в кондиционированной среде при концентрации Fab 10 мкМ и 50 мкМ (фиг. 8, верхняя панель, дорожки 10 и 11). В случае рекомбинантного белка, инкубируемого с рекомбинантной MT-SP1 мыши в химически определенной среде, клиппирование снижали уже при концентрации 1 мкМ Fab (см. фиг. 8, нижняя панель, дорожка 5). Дальнейшее снижение клиппирования наблюдали при 10 мкМ Fab и полное прекращение клиппирования наблюдали при 50 мкМ Fab в химически определенной среде с добавлением рекомбинантной MT-SP1 мыши, а также в кондиционированной среде (см. фиг. 8, нижняя панель, дорожки 6, 7 и 10 и 11). Таким образом, Fab, индуцированный против матриптазы человека, также эффективно ингибировал матриптазу мыши, а также хомяка. Однако более высокие концентрации были необходимы для наблюдения полного ингибирования матриптазы мыши и хомяка. Предполагают, что это связано с аминокислотными различиями между матриптазой человека, мыши и хомяка в эпитоп-связывающем участке таким образом, что ингибиторный Fab против матриптазы человека является менее активным в отношении матриптазы мыши и хомяка таким образом, что необходимы более высокие концентрации Fab для их ингибирования.
VI. Пример 5: Получение белка в нокаутных по матриптазе линиях клеток
[177] Для подтверждения результатов экспериментов с контрольными образцами несколько интересующих полипептидов экспрессировали в нокаутном по матриптазе клоне клеток в культуре с подпиткой и клиппирование интересующего экспрессирующегося и секретируемого полипептида анализировали и сравнивали с результатами, полученными с использованием соответствующей линии клеток CHO дикого типа, эндогенно экспрессирующих интактную матриптазу.
5.1. Трансфекция кодирующего mAb вектора
[178] Линию клеток CHO дикого типа, экспрессирующую матриптазу (полученную из CHO-K1), и нокаутный по матриптазе клон клеток CHO 4 (KO-4, см. таблицу 5) трансфицировали с использованием экспрессирующего вектора, содержащего полинуклеотид, кодирующий моноклональное антитело (mAb), и два гена селективных маркеров, а именно neo и DHFR. Для трансфекции клетки выращивали до экспоненциальной фазы и 5×106 клеток трансфицировали с использованием 3 мкг ДНК вектора. Пять повторений трансфекции осуществляли с использованием линии клеток дикого типа и четыре повторения трансфекции осуществляли с использованием линии клеток KO-4. Селекцию клеток, стабильно трансфицированных с использованием вектора, кодирующего интересующий белок, осуществляли с использованием G418 (концентрации G418 0,8 мг/мл) с двумя последующими этапами селекции MTX (500 нМ и 1 мкМ MTX). Условия селекции являлись идентичными для всех совокупностей и обеих линий клеток. В конце селекции (жизнеспособность клеток >95%) клетки замораживали. В течение селекции определяли титры экспрессируемого mAb в среде. Титр в супернатанте нокаутных по матриптазе клеток сравнивали с титром клеток CHO дикого типа. Результаты свидетельствуют о том, что нокаут матриптазы не обладает отрицательным эффектом в отношении производительности клеток, но имеет тенденцию к повышению титра.
5.2. Получение в культуре с подпиткой
[179] Для получения в культуре с подпиткой подвергали селекции все четыре совокупности нокаутных по матриптазе клонов KO-4 и три совокупности линий клеток CHO дикого типа с наибольшим титром антител. Замороженные клетки из семи совокупностей размораживали одновременно и однократно пересевали перед инокуляцией в отдельные реакторы с подпиткой.
[180] Клетки культивировали в шейкерах с подпиткой, содержащих химически определенную среду, обогащенную аминокислотами, витаминами и микроэлементами (подпитываемая среда). Культивирование с подпиткой осуществляли при температуре 37°C и встряхивании. В течение культивирования с подпиткой регулярно добавляли подпитку, содержащую глюкозу и аминокислоты. В течение культивирования с подпиткой образцы материала культуры с подпиткой регулярно собирали для определения плотности жизнеспособных клеток (vcd) с использованием анализатора жизнеспособности клеток Vi-Cell (Beckman Coulter) и для определения титров белка в среде для культивирования клеток. В конце культивирования с подпиткой (день 13 или 14) культивирование прекращали. Кондиционированную среду из встряхиваемой колбы (100 мл культуры) собирали и фильтровали с использованием фильтра 0,22 мкм Steriflip. Моноклональное антитело очищали из фильтрованной кондиционированной среды с использованием аффинной жидкостной хроматографии с протеином A (колонки Protein A Mini, Proteus, кат. № PUR008). Очистку осуществляли по инструкциям производителя. Концентрацию белка в образцах после очистки с помощью протеина A определяли с использованием системы NanoDrop™ (Thermo Scientific) по инструкциям производителя. Анализ культур с подпиткой показал, что в течение 14 дней периода культивирования титр экспрессирующегося mAb в среде для культивирования совокупностей KO-4 являлся схожим или даже более высоким, чем в среде для культивирования совокупностей клеток CHO дикого типа. Кроме того, жизнеспособность клеток являлась схожей или даже более высокой в случае совокупностей клеток KO-4. Клетки KO также росли при схожих или даже лучших плотностях клеток. Эти результаты свидетельствуют о том, что нокаут матриптазы не обладает отрицательным влиянием в отношении степени экспрессии белка и может даже повышать ее. Кроме того, не было отрицательного влияния на рост клеток, он даже мог улучшаться.
5.3. Анализ клиппирования
[181] Для анализа клиппирования использовали два параллельных подхода: чип-электрофорез (ME) в присутствие SDS и масс-спектрометрия.
Чип-электрофорез
[182] Для получения образца используют 5 мкл очищенного белка. В зависимости от концентрации образцов количество белка отличается. Для получения образца для восстановительного анализа с использованием микрочипа 5 мкл смешивают с 35 мкл восстанавливающего буфера для образцов. Затем смешанный раствор инкубируют в термоблоке в течение 15 мин при 70°C. После охлаждения 70 мкл воды MilliQ добавляли к конечному объему 110 мкл. В качестве системы использовали инструмент LabChip® GX II от PerkinElmer. Используемый протокол представляет собой пересмотренный вариант протокола поставщика. Основным различием является соотношение образца/восстанавливающего буфера для образцов, представляющее собой 1:7 в настоящем протоколе для лучшей денатурации вместо 1:3,5 в протоколе от поставщика.
[183] На фиг. 9 показан результат чип-электрофореза. Первые три дорожки слева (указанные как WT 1, 2 и 3) представляют композицию образца белка очищенной с помощью протеина A культуры клеток после трех повторений получения с использованием совокупностей клеток CHO дикого типа. В каждом образце наблюдают одинаковый профиль белковых полос. Наблюдали широкую белковую полосу, соответствующую интактной тяжелой цепи (HC) моноклонального антитела (размер при анализе Labchip является неточным и, как правило, завышенным). Непосредственно под этой белковой полосой наблюдают вторую, более тонкую белковую полосу, соответствующую клиппированной тяжелой цепи. Клиппированные молекулы HC мигрируют совместно с негликозилированной HC. Кроме того, третью белковую полосу, соответствующую легкой цепи, наблюдают в области приблизительно 29 кДа. В образцах белка моноклонального антитела, полученных в совокупностях нокаутных по матриптазе клеток (указанных как KO-4 1, 2, 3, и 4), белковые полосы интактной тяжелой цепи и легкой цепи, являются, по меньшей мере, сравнимыми, если не более сильными по сравнению с белковыми полосами, обнаруживаемыми в образцах, полученных с использованием линий клеток CHO дикого типа. Однако, полоса, соответствующая клиппированной тяжелой цепи, указанная второй стрелкой сверху на фиг. 9, еле видна во всех четырех образцах антител KO4-1, KO4-2, KO4-3 и KO4-4. Это свидетельствует о том, что клиппирование mAb почти устраняют при продуцировании в нокаутных по матриптазе линиях клеток.
[184] Для количественного анализа результата определяли интенсивность белковых полос клиппированной тяжелой цепи антитела и интактной тяжелой цепи антитела и из нее вычисляли процентную долю клиппирования. Результат этого анализа представлен в таблице 10. Там показано, что степень клиппирования моноклонального антитела значительно снижается при использовании нокаутного по матриптазе клона в качестве производственной линии клеток. В соответствии с анализом в среднем 16,1% тяжелой цепи моноклонального антитела, продуцируемого тремя совокупностями клеток CHO дикого типа, являлись клиппированными. В отличие от этого, в среднем происходил лишь 1% или менее клиппирования в случае HC mAb, продуцируемой в четырех нокаутных по матриптазе культурах с подпиткой. В результате совместной миграции негликозилированной HC с учетом анализа LabChip® нельзя определить точные значения.
Таблица 10: Анализ клиппирования на основе интенсивности белковых полос
|
Таким образом, с использованием чип-электрофореза в mAb определяют лишь 1% или менее клиппирования, экспрессирующемся клетками, KO по матриптазе, в то время как в клетках WT, экспрессирующих то же mAb, определяют от 12% до 20% клиппирования (клиппирование, определяемое в HC).
Масс-спектрометрический анализ
[185] Образцы дегликозилировали и восстанавливали перед масс-спектрометрическим анализом. Из каждого из семи очищенных с помощью протеина A образцов белка аликвоту с общим содержанием белка 50 мкг инкубировали в течение ночи при 37°C с 1,25 мкл ПНГазы F в концентрации 0,3 мг/мл в 50 мМ Трис/HCl, pH 7,5. Конечная концентрация образца составляла приблизительно 0,5 мг/мл. После дегликозилирования 88 мкл расщепленных с помощью ПНГазы F образцов восстанавливали посредством добавления 112 мкл восстанавливающего буфера (8M GuHCl, 10мкл 1M Трис/HCl, pH 7,5, и 2 мкл 1M DTT) и инкубации в течение одного часа при 37°C. Восстановление гасили добавлением 2 мкл 10% трифторуксусной кислоты.
[186] Затем полученные таким образом образцы с общим объемом 202 мкл и концентрацией приблизительно 0,22 мг/мл белка использовали для анализа посредством комбинации жидкостной хроматографии и масс-спектроскопии. Инструментом для LC/MS являлась система Waters Synapt G2, соединенная с UPLC (программное обеспечение: MassLynx 4.1). В способе LC использовали скорость потока 0,2 мл/мин и буферы MPA (0,1% TFA в воде) и MPB (0,09% TFA в ацетонитриле). УФ-детекцию осуществляли при 214 нм и 280 нм. Температура образца составляла ~5°C. 14мкл дегликозилированного и восстановленного образца (количество белка 3 мкг) нагружали на колонку BEH C4 1,7 мкМ, 2,1 × 100 мм (Waters). Температура колонки составляла 80°C. Перед нагрузкой образца колонку уравновешивали буфером MPA. Элюцию осуществляли с использованием буфера MPB.
[187] Затем элюированный белок дополнительно анализировали посредством масс-спектрометрии. Используя данные LC/MS, идентифицировали участки клиппирования и количественно анализировали процентную долю клиппированных молекул. В таблице 11 представлена процентная доля клиппированных тяжелых цепей антитела с учетом анализа LC/MS в каждом образце белка. Хотя в образцах дикого типа наблюдали клиппирование от 20 до 29%, лишь 2% или менее тяжелой цепи антитела являлись клиппированными при использовании нокаутных по матриптазе клеток для ее получения. Результаты, вычисленные с учетом данных для UV214 нм, являлись немного более высокими по сравнению с результатами, полученными при восстановительном анализе LabChip (см. таблицу 10). Однако снова подтверждали сильное снижение клиппирования, достигаемое при использовании руководства по настоящему изобретению. Результаты LC/MS свидетельствуют о 15-кратном снижении клиппирования mAb, полученных в нокаутных по матриптазе линиях клеток. Анализ участка клиппирования показал, что тяжелая цепь mAb, получаемая в нокаутных по матриптазе клетках, является клиппированной в том же положении, что и HC mAb, полученная в линиях клеток CHO дикого типа. При моделировании белка дополнительно выявляли, что участок клиппирования локализуется в очень гибкой области mAb, обращенной к среде для культивирования клеток. Таким образом, даже протеазы с низкой аффинностью для этого участка клиппирования легко могут получать доступ к нему и расщеплять его. С помощью этих результатов можно объяснить остаточное клиппирование в нокаутных по матриптазе штаммах.
Таблица 11: Анализ клиппирования на основе анализа LC/MS
|
5.4. Трансфекция WT и KO-4 с дополнительными гликопротеинами
[188] Дополнительные примеры осуществляли для демонстрации того, что осуществленный нокаут матриптазы не влияет отрицательно на уровень продукции и качество продукта рекомбинантных гликопротеинов. Экспрессировали два гликопротеина, отличающихся от антитела (Fc-слитый белок, а также один рекомбинантный терапевтический белок). Нокаутную по матриптазе линию клеток KO-4 и линию клеток CHO дикого типа, из которой получали клон KO-4, трансфицировали с использованием подходящих экспрессирующих векторов. После трансфекции и селекции осуществляли анализ титра и белка (например, как описано выше в главе 5.3).
[189] Титры белков, получаемые с использованием нокаутной по матриптазе линии клеток KO-4, находились в том же диапазоне или являлись более высокими, чем в соответствующей линии клеток WT, из которой получали клон KO-4 (также см. таблицу 12). Клиппирование снова являлось значительно сниженным в белках, таких как Fc-слитый белок, полученный из клеток KO, по сравнению с белками, такими как Fc-слитый белок, полученный из клеток WT (также см. таблицу 13). Это четко свидетельствует о том, что KO гена матриптазы снижал протеолитическую деградацию многих дополнительных полипептидов.
Таблица 12: Анализ экспрессии Fc-слитого белка и рекомбинантного терапевтического белка
|
Таблица 13: Анализ клиппирования Fc-слитого белка и рекомбинантного терапевтического белка
|
[190] В основном, в нокаутной по матриптазе линии клеток наблюдали схожие или даже улучшенные признаки в случае получения гликопротеинов. Таким образом, соответствующие линии клеток подходят для получения чувствительных к протеолитическому расщеплению полипептидов, а также для получения нечувствительных к протеолитическому расщеплению полипептидов. Таким образом, настоящее изобретение относится к универсальной линии клеток, с помощью которой упрощают получение различных интересующих полипептидов.
VII. Пример 6: Пригодность способа накопления и масштабирование биореактора
[191] Для демонстрации пригодности нокаутной по матриптазе линии клеток, подлежащей масштабированию для крупномасштабного получения терапевтического средства, 12 родительских клонов, полученных с помощью двух разных подходов KO матриптазы (технологии ZFN и TALEN) оценивали в трехстадийном скрининговом подходе. Линию клеток CHO дикого типа использовали для сравнения.
6.1. Оценка свойств родительского клона
6.1.1. Сравнение свойств родительского клона в течение выращивания клеток
[192] Для оценки свойств 12 нетрансфицированных KO клонов (семи субклонов ZFN (полученных посредством сортировки отдельных клеток клона KO ZFN, описываемого в примере 2b) и пяти полученных с помощью TALEN) и сравнительной линии клеток дикого типа в течение выращивания для крупномасштабного получения систему посевных ферментеров оценивали во встряхиваемых колбах с использованием двух сред для выращивания культур клеток, отличающихся по концентрации необходимого витамина. Таким образом, клоны инокулировали в обе среды для выращивания при определенной плотности жизнеспособных клеток и культивировали в течение четырех дней при 36,5°C. Клоны анализировали в отношении конечных плотностей жизнеспособных клеток, средних скоростей роста, как описано в таблице 14. Вместе с результатами оценки пригодности родительских клонов с использованием среды из этапа получения (глава 6.1.2) семь клонов с лучшими свойствами подвергали селекции для дальнейшего сравнения в отношении производительностей (см. главу 6.2).
Таблица 14: Результаты оценки свойств родительских клонов при выращивании клеток
|
6.1.2. Сравнение свойств родительского клона в условиях получения
[193] 12 родительских клонов и референсную линию клеток дикого типа дополнительно сравнивали в способе получения с подпиткой во встряхиваемых колбах. Клетки из исследования выращивания, описываемого в главе 6.1.1., культивировали при 36,5°C в течение 14 дней с использованием двух разных наборов условий культивирования (две разные химически определенные производственные среды, плотности инокулируемых клеток и схемы подпитки). Подпитку с использованием двух независимых растворов для подпитки осуществляли в течение всего процесса с заранее определенном профилем и использовали температурный сдвиг. Плотности, жизнеспособности клеток и ключевые метаболиты контролировали ежедневно и использовали для сравнения клонов KO с клонами WT в отношении пригодности для получения. Идентифицировали семь клонов, достигавших свойств роста, схожих или превосходящих линию клеток дикого типа, в то время как профили метаболитов являлись сравнимыми.
6.2. Скрининг трансфицированных совокупностей во встряхиваемых колбах
[194] 7 лучших родительских клонов, идентифицированных в главе 6.1, и CHO дикого типа трансфицировали в трех повторениях с использованием моноклонального антитела IgG в качестве интересующего полипептида, о котором известно, что оно является чувствительным к протеолитической деградации в условиях линии клеток дикого типа. Трансфицированные клетки оценивали с использованием культивирования во встряхиваемых колбах и двух разных наборов условий, как описано в главе 6.1.2. Рост клеток (плотности жизнеспособных клеток, жизнеспособности клеток) и образование продукта контролировали в течение культивирования. Клетки, полученные с помощью подхода TALEN-нокаута, демонстрировали схожий или повышенный рост клеток по сравнению с клетками CHO дикого типа, при этом совокупности, полученные с помощью ZFN, демонстрировали немного более низкий рост клеток в течение экспоненциальной фазы по сравнению с полученными с помощью TALEN совокупностями. Однако жизнеспособность клеток в конце культивирования являлась сравнимой для всех клонов. Волюметрическая производительность в конце культивирования составляла в среднем на 19% выше в случае TALEN и на 9% выше в случае совокупностей, полученных с помощью нуклеаз с цинковыми пальцами, по сравнению с производительностью совокупностей CHO дикого типа.
[195] В конце культивирования (день 14) моноклональное антитело IgG анализировали на целостность. Таким образом, супернатанты собирали посредством центрифугирования и стерилизации фильтрацией. Моноклональное антитело IgG захватывали из супернатантов и анализировали посредством CE-SDS (капиллярного электрофореза в присутствие додецилсульфата натрия) для протеолитической деградации и посредством CEC (катионообменной хроматографии) для оценки варианта распределения заряда. Все совокупности, полученные из нокаутных клонов, демонстрировали схожий низкий уровень приблизительно 1% клиппирования полипептида, в то время как продукт, полученный из CHO дикого типа, расщеплялся при приблизительно 21%.
6.3. Биореакторный скрининг родительских субклонов и трансфицированных совокупностей
[196] Четыре родительских клона с лучшими свойствами и трансфицированные совокупности, идентифицированные в главах 6.1. и 6.2., подвергали селекции для тщательной характеризации с использованием контролируемых условий культивирования в стеклянных биореакторах емкостью 7 л. Способ культивирования являлся, по существу, таким, как описано в главе 6.1.2., хотя использовали лишь предпочтительные условия культивирования, как описано в главе 6.2. В случае трансфицированных совокупностей наблюдали немного более низкий рост по сравнению с нетрансфицированными родительскими клонами, что является известным феноменом, приписываемым метаболическому бремени, вызываемому экспрессией полипептида. Однако не обнаруживали значительных различий в росте клеток по сравнению с линией клеток WT. Метаболиты, такие как лактат и аммоний, находились в пределах распространенных диапазонов и являлись схожими с линией клеток дикого типа.
[197] Качество продукта аналитически оценивали на чистоту с помощью SEC, CEC и CE-SDS и N-гликозилирования патентованным способом. Результаты свидетельствовали о том, что все клоны KO достигали сравнимого качества продукта в терминах продуктов агрегации и деградации, варианта распределения заряда и профиля гликозилирования. Сниженные результаты CE-SDS свидетельствовали о том, что клиппированные молекулы присутствуют в случае всех KO субклонов на низком уровне 0,7%. Все клоны KO не только демонстрировали схожие или предпочтительные характеристики роста по сравнению с референсной линией клеток дикого типа, но также продуцировали полипептид стабильно лучшего качества.