Результат интеллектуальной деятельности: МУТАНТНЫЕ АНТИГЕНЫ GAS57 И АНТИТЕЛА ПРОТИВ GAS57
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение относится к области иммунологии и вакцинологии. В частности, настоящее изобретение относится к антигенам, происходящим от Streptococcus pyogenes, и к их использованию в целях иммунизации.
Предшествующий уровень техники
Антиген GAS57 S. pyogenes (стрептококки группы A; GAS), экспрессируемый как рекомбинантный белок и выделенный из E.coli, индуцирует активность, направленную на защиту от летального инфицирования мышей бактерией S. pyogenes. Однако GAS57 представляет собой протеазу, которая расщепляет и инактивирует человеческие хемокины, такие как интерлейкин-8 (IL-8) (Edwards et al., J. Infectious Diseases 192, 783-90, 2005; Hidalgo-Grass et al., EMBO J. 25, 4628-37, 2006). Такое свойство GAS57 не дает возможность применять этот антиген в вакцинной композиции, поскольку он может вызывать побочные эффекты. Поэтому необходимо получить антигены GAS57, которые были бы не способны расщеплять человеческие хемокины, но при этом сохраняли бы способность обеспечивать защиту от инфекции, вызываемой S. pyogenes. Необходимо также получить антитела, которые обладали бы способностью специфически связываться с антигенами GAS57 и подавляли бы способность GAS57 расщеплять IL-8 и другие субстраты.
Краткое описание фигур
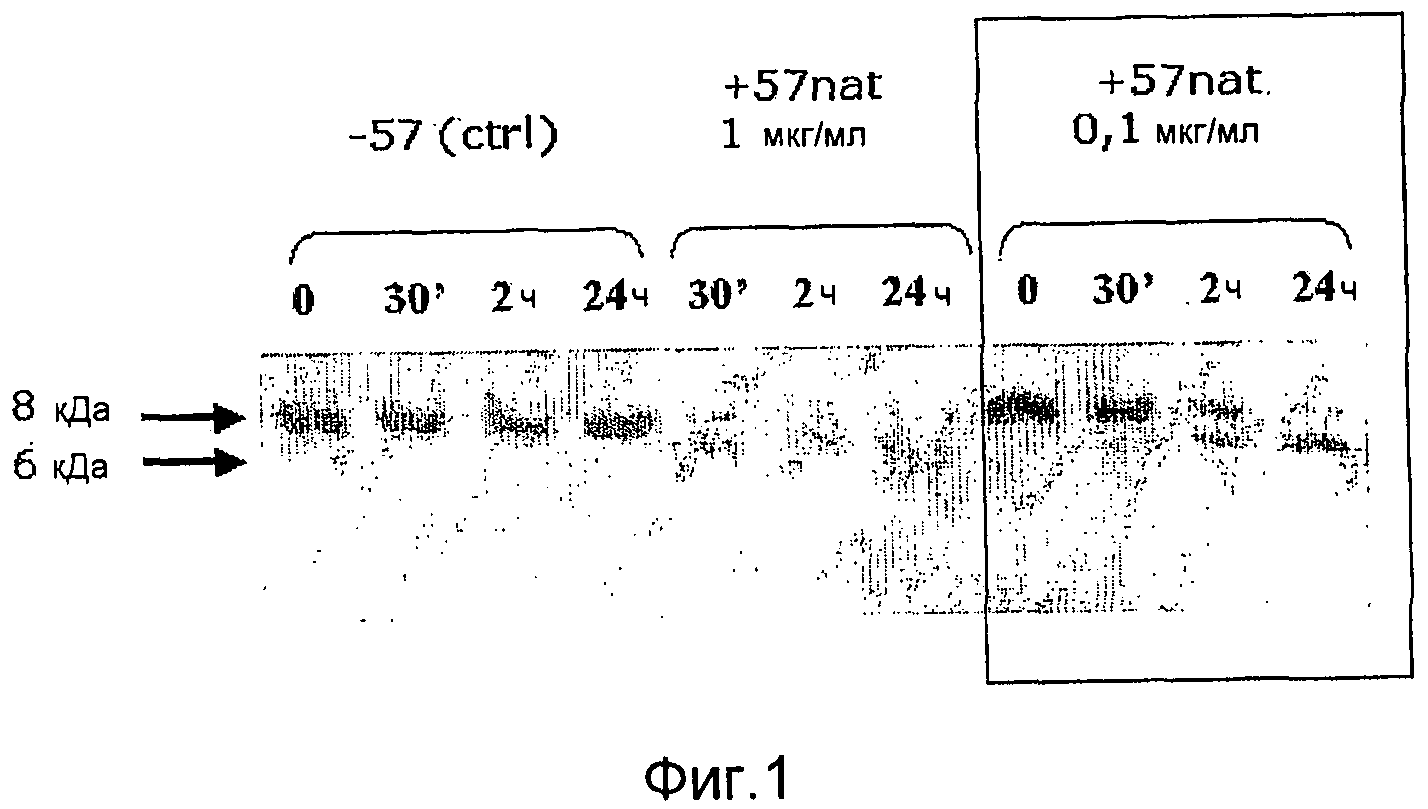
Фиг. 1. Микрофотография полиакриламидного геля с ДСН, иллюстрирующая расщепление IL-8 антигеном GAS57 дикого типа.
Фиг. 2. Сопоставление последовательностей GAS57 дикого типа (запрос, SEQ ID NO:1) с последовательностью сериновой протеазы, относящейся к классу пептидаз C5a, путем выравнивания этих последовательностей с помощью программы BLAST (Sbjct, SEQ ID NO:9).
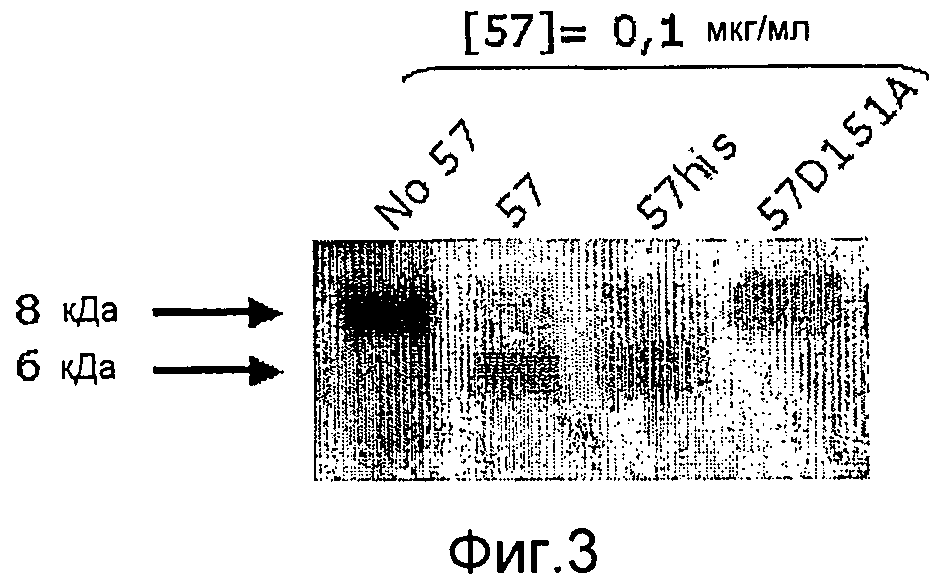
Фиг. 3. Микрофотография полиакриламидных гелей с ДСН, на которой показано, что точковый мутант GAS57 D151A не обладает способностью расщеплять IL-8.
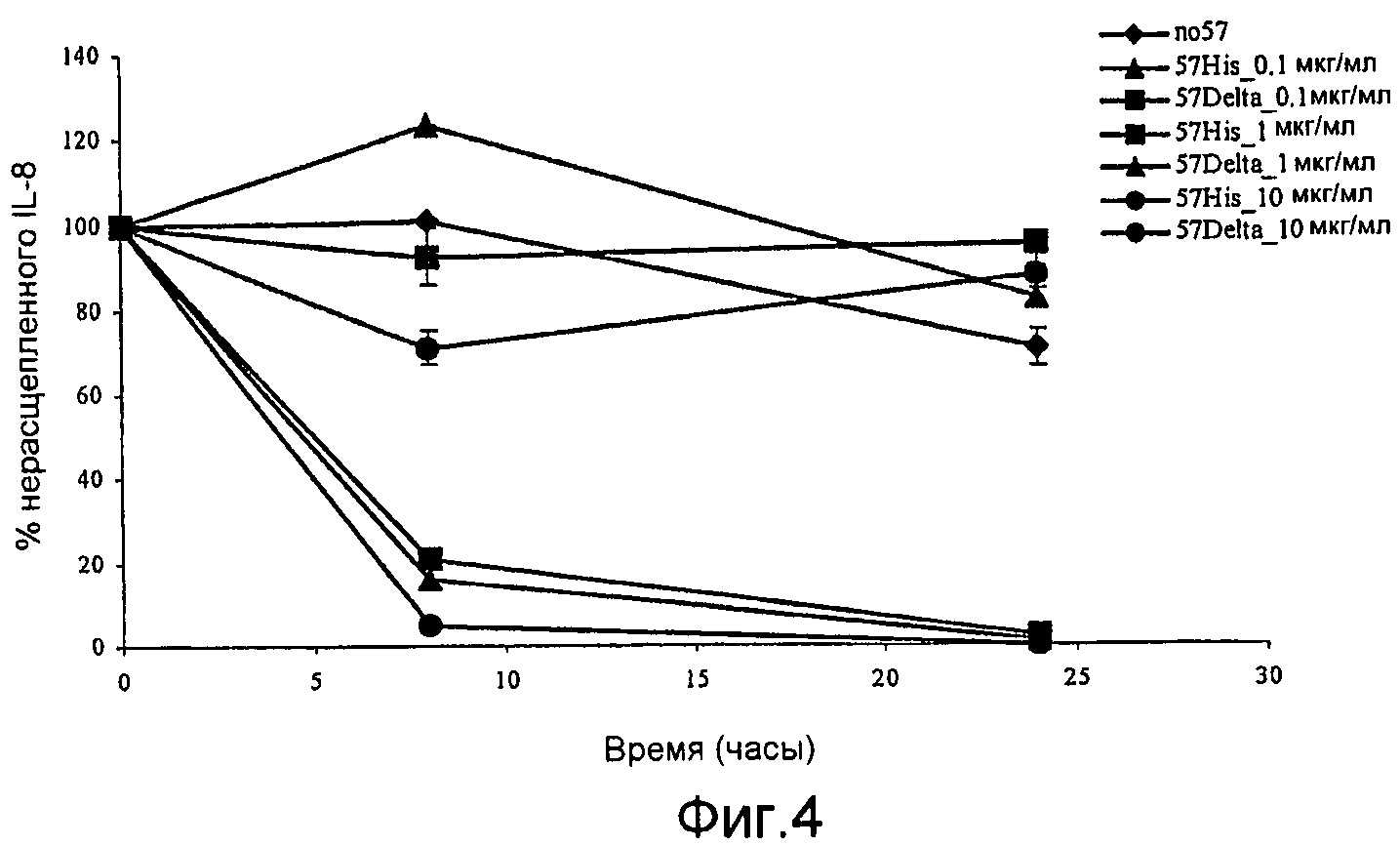
Фиг. 4. График, иллюстрирующий результаты ELISA-анализа, указывающего на то, что точковый мутант GAS57 D151A не обладает способностью расщеплять IL-8.
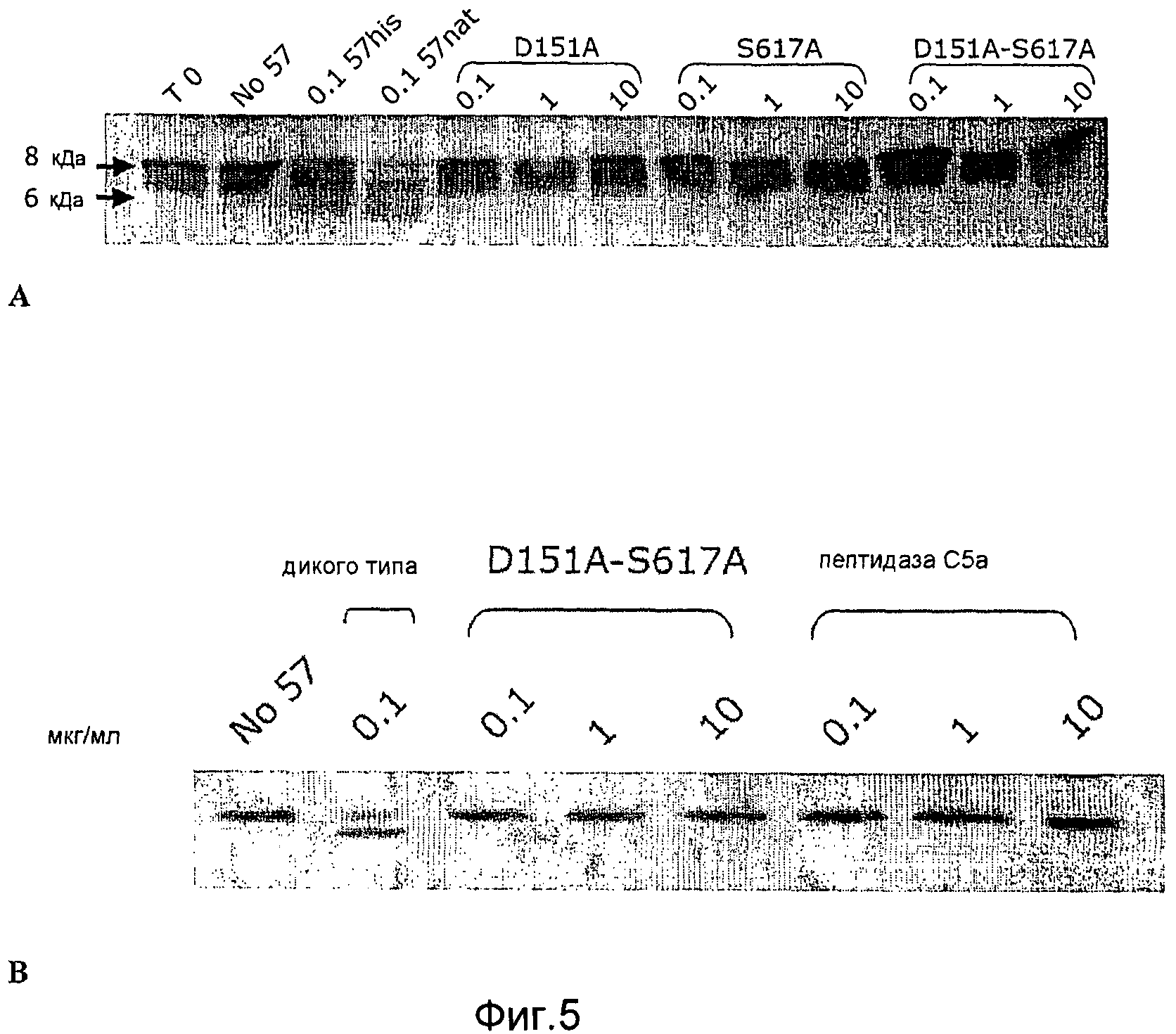
Фиг. 5A-B. Микрофотография полиакриламидных гелей с ДСН, на которой показано, что мутанты GAS57 с одной модификацией D151A и с одной модификацией S617A и мутант с двумя модификациями D151A+S617A не обладают протеолитической активностью GAS57.
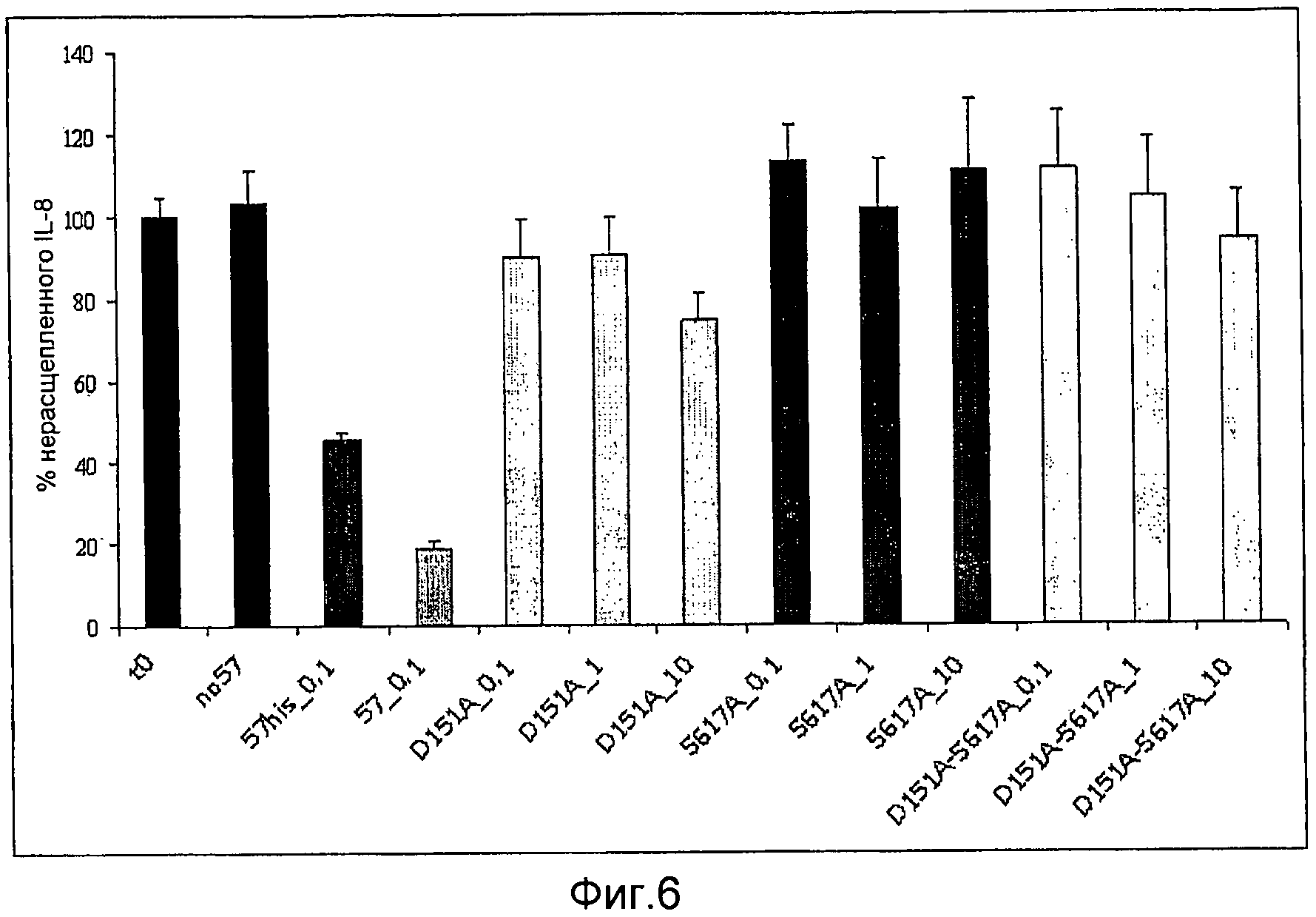
Фиг. 6. График, иллюстрирующий результаты ELISA-анализа, указывающего на то, что мутанты GAS57 с одной модификацией D151A и с одной модификацией S617A и мутант с двумя модификациями D151A+S617A не обладают протеолитической активностью GAS57.
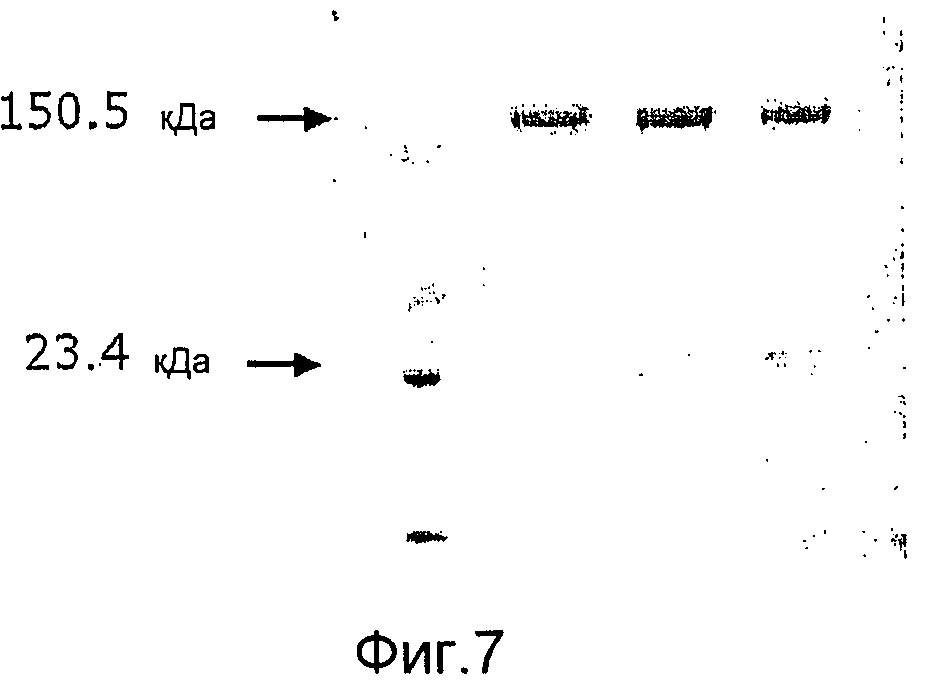
Фиг. 7. Микрофотография полиакриламидных гелей с ДСН, на которой показано, что GAS57 дикого типа посттрансляционно модифицируется в два полипептидных фрагмента размером в 150,5 кДа и 23,4 кДа.
Фиг. 8. Микрофотография полиакриламидных гелей с ДСН, на которой показано, что мутанты GAS57, а именно D151A, S617A и D151A+S617A, в отличие от антигена дикого типа, не подвергаются посттрансляционной модификации с образованием двух полипептидных фрагментов размером 150,5 кДа и 23,4 кДа (показано черными стрелками). Поэтому яркая полоса 174 кДа, соответствующая непроцессированному белку, присутствует на дорожках, соответствующих неактивным мутантным штаммам (показано серыми стрелками).
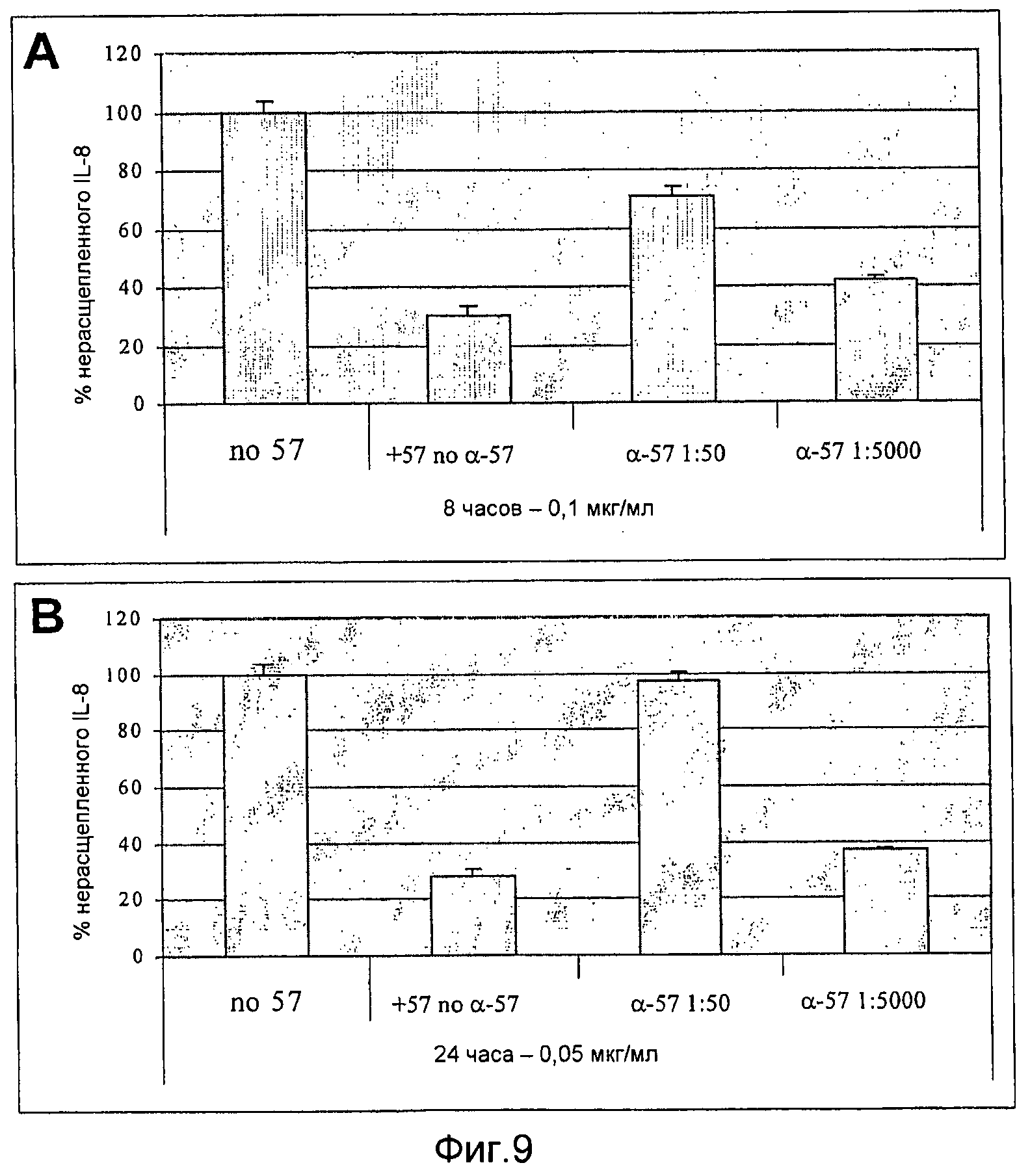
Фиг. 9A-B. Результаты ELISA-анализа продемонстрировали дозозависимое ингибирование GAS57-опосредуемого расщепления IL-8 под действием поликлональной антисыворотки против GAS57 в двух различных экспериментальных условиях. Фиг. 9A, 8-часовое инкубирование, 0,1 мкг/мл GAS57. Фиг. 9B, 24-часовое инкубирование, 0,05 мкг/мл GAS57.
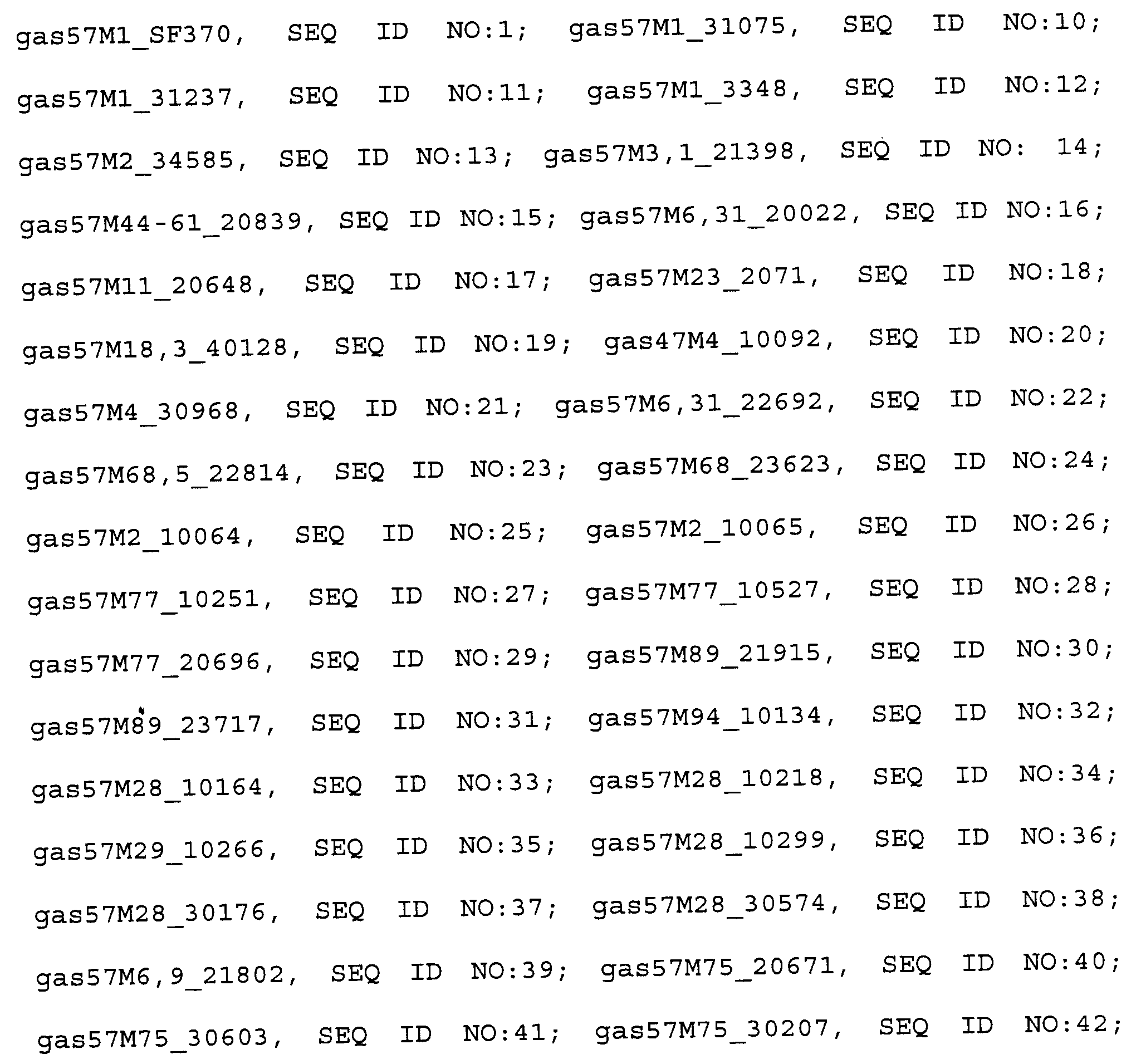
Фиг. 10A-GG. Сравнение антигенов GAS57, происходящих от различных штаммов/M-типов, путем выравнивания их последовательностей. Каталитическая триада (D, H, S) показана жирным шрифтом. Фиг. 10A, аминокислоты 1-50 (положения аминокислот, указанные наверху на каждой странице фиг. 10A-GG, относятся к аминокислотной последовательности gas57M1_SF370, SEQ ID NO:1); Фиг. 10B, аминокислоты 51-100; Фиг. 10C, аминокислоты 101-150; Фиг. 10D, аминокислоты 151-200; Фиг. 10E, аминокислоты 201-250; Фиг. 10F, аминокислоты 251-300; Фиг. 10G, аминокислоты 301-350; Фиг. 1H, аминокислоты 351-400, Фиг. 10I, аминокислоты 401-450; Фиг. 10J, аминокислоты 451-500; Фиг. 10K, аминокислоты 501-550; Фиг. 10L, аминокислоты 551-600; Фиг. 10M, аминокислоты 601-650; Фиг. 10N, аминокислоты 651-700; Фиг. 10O, аминокислоты 701-750; Фиг. 10P, аминокислоты 751-800; Фиг. 10Q, аминокислоты 801-850; Фиг. 10R, аминокислоты 851-900; Фиг. 10S, аминокислоты 901-950; Фиг. 10T, аминокислоты 951-1000; Фиг. 10U, аминокислоты 1001-1050; Фиг. 10V, аминокислоты 1051-1100; Фиг. 10W, аминокислоты 1101-1150; Фиг. 10X, аминокислоты 1151-1200; Фиг. 10Y, аминокислоты 1201-1250; Фиг. 10Z, аминокислоты 1251-1300; Фиг. 10AA, аминокислоты 1301-1350; Фиг. 10BB, аминокислоты 1351-1400; Фиг. 10CC, аминокислоты 1401-1450; Фиг. 10DD, аминокислоты 1451-1500; Фиг. 10EE, аминокислоты 1501-1550; Фиг. 10FF, аминокислоты 1551-1600; Фиг. 10GG, аминокислоты 1601-1650.

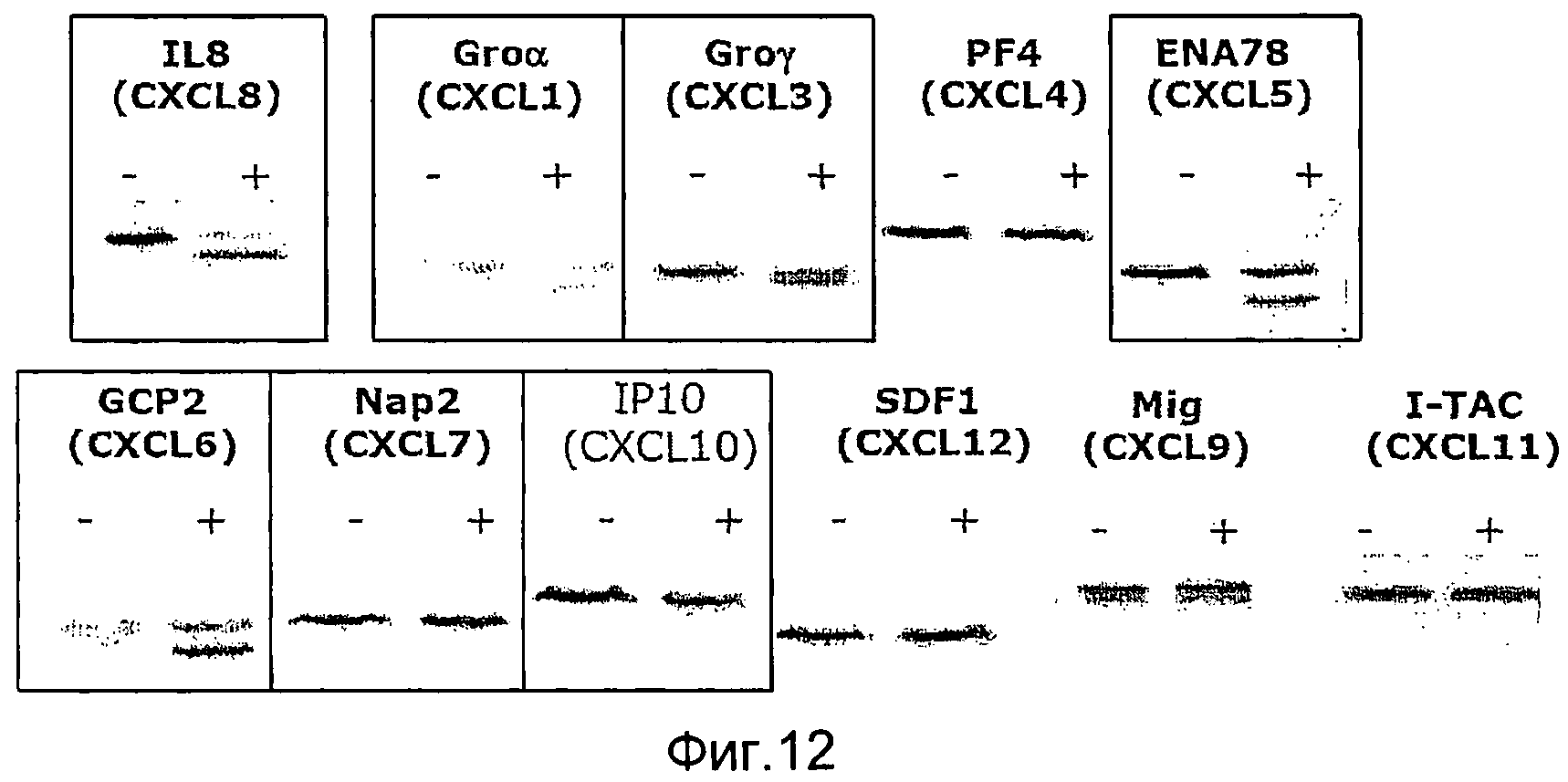
Фиг. 11. Выравнивание последовательностей человеческих хемокинов. GAS57 расщепляет CXCL8 (IL-8) (SEQ ID NO:81) между двумя аминокислотами, которые выделены жирным шрифтом и подчеркнуты. CXCL4, SEQ ID NO:57; CXCL7/NAP-2, SEQ ID NO:58; CXCL1/GROα, SEQ ID NO:59; CXCL2/GROβ, SEQ ID NO:60; CXCL3/GROγ, SEQ ID NO:61; CXCL6/GCP-2, SEQ ID NO:62; CXCL12/SDF-1α, SEQ ID NO:63; CXCL12/SDF-1γ, SEQ ID NO:64; CXCL12/SDF-1β, SEQ ID NO:65; CXCL9/MIG, SEQ ID NO:66; CXCL10/IP10, SEQ ID NO:67 и CXCL11, SEQ ID NO:68.
Фиг. 12. Микрофотография полиакриламидных гелей с ДСН, иллюстрирующая расщепление хемокинов CXC под действием GAS57.
Подробное описание изобретения
Настоящее изобретение относится к мутантам Spy0416 или GAS57 (называемым здесь «мутантными антигенами GAS57», «мутантами GAS57», «антигенами мутанта GAS57»), которые не способны расщеплять человеческие хемокины, такие как IL-8, но при этом сохраняют способность обеспечивать защиту от S. pyogenes. Мутанты GAS57 согласно изобретению могут быть использованы в вакцинных композициях для обеспечения защиты от S. pyogenes. Настоящее изобретение также относится к антителам, которые специфически связываются с GAS57 дикого типа и подавляют способность GAS57 расщеплять IL-8 и аналогичные субстраты. При этом следует отметить, что указанные антитела могут быть использованы в качестве терапевтических средств для предупреждения и/или лечения инфекционных заболеваний, вызываемых S. pyogenes.
Антигены мутантного GAS57
«GAS57» также обозначается «Spy0416» (M1), «SpyM3_0298» (M3), «SpyM18_0464» (M18) и «prtS». GAS57 был также идентифицирован как предполагаемая протеиназа клеточной оболочки. См. WO 02/34771 и US 2006/0258849. По данным специалистов Центра лечения и профилактики заболеваний США существует 49 последовательностей GAS57, происходящих от 17 различных M-типов (1, 2, 3, 4, 6, 11, 12, 18, 22, 23, 28, 44/61, 68, 75, 77, 89, 94), причем эти антигены 17 различных M-типов ответственны за 95% и более случаев заболеваемости фарингитом и примерно за 68% случаев образования инвазивных GAS-изолятов. Аминокислотные последовательности антигенов GAS57 дикого типа представлены в списке последовательностей как SEQ ID No: 1, 10-56 и 80. GAS57 дикого типа содержит два нековалентно связанных пептида (см. пример 5 и фиг.7).
Антигены мутантного GAS57 согласно изобретению обладают протеолитической активностью, направленной на расщепление интерлейкина 8 (IL-8), которая по меньшей мере на 50% (например, на 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100%) ниже активности GAS57 дикого типа, как было определено с помощью электрофореза в ДСН-ПААГ или ELISA-анализа (см. примеры 2 и 3), но при этом указанные антигены являются иммуногенными, например, они обеспечивают защиту от летального инфицирования антигеном GAS у мышей-моделей (пример 4). Предпочтительно, мутантный GAS57 согласно изобретению также не расщепляет другие человеческие цитокины, такие как CXCL1/GROα (например, SEQ ID NO:59), CXCL2/GROβ (например, SEQ ID NO:60), CXCL3/GROγ (например, SEQ ID NO:61), CXCL4 (например, SEQ ID NO:57), CXCL12/SDF-1α (например, SEQ ID NO:63), CXCL12/SDF-1β (например, SEQ ID NO:65), CXCL12/SDF-1γ (например, SEQ ID NO:64), CXCL5/ENA78 (например, SEQ ID NO:82), CXCL6/GCP-2 (например, SEQ ID NO:62), CXCL7/NAP-2 (например, SEQ ID NO:58), CXCL9/MIG (например, SEQ ID NO:66), CXCL10/IP10 (например, SEQ ID NO:67), CXCL11 (например, SEQ ID NO:68), CXCL13 (например, SEQ ID NO:83), CXCL14 (например, SEQ ID NO:84) и CXCL16 (например, SEQ ID NO:85). Неожиданно было обнаружено, что мутанты GAS57 согласно изобретению, в отличие от GAS57 дикого типа, представляют собой одиночные полипептиды, которые подвергаются посттрансляционному процессингу (созреванию) с образованием двух нековалентно связанных пептидов (примеры 5 и 6). Возможность получения таких антигенов в виде одиночного пептида облегчает продуцирование рекомбинантного белка, используемого для вакцинации.
Мутантами GAS57 согласно изобретению являются мутанты, имеющие аминокислотные модификации (то есть замену, делецию или инсерцию) в одном или нескольких положениях аминокислоты D151, H279 или S617, пронумерованных в соответствии с последовательностью GAS57 дикого типа, представленной в SEQ ID NO:1 (см. фиг. 10).
Мутантами GAS57 согласно изобретению являются мутанты, имеющие одну, две или три аминокислотных модификаций («мутанты с одной модификацией», «мутанты с двумя модификациями», «мутанты с тремя модификациями») в положениях D151, H279 и/или S617. Так, например, мутанты GAS57 могут иметь следующие замены:

Настоящее изобретение также включает эквиваленты мутантов GAS57, представляющие собой одиночные полипептиды, которые не расщепляют IL-8, как было определено с помощью электрофореза в ДСН-ПААГ или ELISA-анализа, но являются иммуногенными и обеспечивают защиту от летального инфицирования антигеном GAS у мышиной модели. Такими эквивалентами могут быть антигены мутантов GAS57 с аминокислотными делециями, инсерциями и/или заменами в положениях, не являющихся положениями D151, H279 или S617, включая делеции примерно до 40 аминокислот у N- или C-конца (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот). Такими эквивалентами также являются мутанты GAS57, имеющие делеции, инсерции и/или замены в положениях, кроме положений Dl51, H279 или S617, а также модификацию в одном или нескольких положениях аминокислот D151, H279 или S617 и S617, как описано выше.
Молекулы нуклеиновой кислоты
Настоящее изобретение включает молекулы нуклеиновой кислоты, кодирующие мутантные антигены GAS57. Настоящее изобретение также включает молекулы нуклеиновой кислоты, содержащие нуклеотидные последовательности, которые по меньшей мере на 50% идентичны последовательностям таких молекул. В зависимости от конкретной последовательности, степень идентичности последовательностей предпочтительно превышает 50% (например, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более). Идентичность нуклеотидных последовательностей предпочтительно определяют с помощью алгоритма поиска гомологии Смита-Уотермана, осуществляемого с применением программы MPSRCH (Oxford Molecular), где указанный поиск проводят с введением аффинных пробелов при следующих параметрах: штраф за пробел-пропуск = 12 и штраф за пробел-удлинение = 1.
Настоящее изобретение также относится к молекулам нуклеиновой кислоты, которые могут гибридизоваться с этими молекулами. Реакции гибридизации могут быть осуществлены в различных условиях «жесткости». Реакция гибридизации в условиях повышенной жесткости хорошо известна специалистам и описана в литературе. См., например, страницу 7.52 руководства Sambrook et al., Molecular Cloning: A Laboratory Manual, 1989. Примерами соответствующих условий являются (в порядке возрастания жесткости): температуры инкубирования 25°C, 37°C, 50°С, 55°C и 68°C; концентрации буферов 10X SSC, 6X SSC, 1X SSC и 0,1X SSC (где SSC означает 0,15 M NaCl и 15 мМ цитратный буфер) и эквивалентные условия с использованием других буферных систем; концентрации формамида 0%, 25%, 50% и 75%; время инкубирования от 5 минут до 24 часов; 1, 2 или более стадий промывки; время инкубирования промывок 1, 2 или 15 минут; и промывочные растворы 6X SSC, 1X SSC, 0,1X SSC или деионизованной воды. Методы гибридизации и их оптимизация хорошо известны специалистам. См., например, руководство Sambrook, 1989; Ausubel et al., eds., Short Protocols in Molecular Biology, 4th ed., 1999; патент США 5707829; Ausubel et al., eds., Current Protocols in Molecular Biology, Supplement 30, 1987.
В некоторых вариантах изобретения молекулы нуклеиновой кислоты согласно изобретению гибридизуются с мишенью в условиях низкой жесткости, в других вариантах изобретения молекулы нуклеиновой кислоты согласно изобретению гибридизуются в условиях умеренной жесткости, а в предпочтительных вариантах изобретения молекулы нуклеиновой кислоты согласно изобретению гибридизуются в условиях высокой жесткости. Примером гибридизации в условиях низкой жесткости является гибридизация при температуре 50°С и в 10X SSC. Примером гибридизации в условиях умеренной жесткости является гибридизация при температуре 55°C и в 1X SSC. Примером гибридизации в условиях высокой жесткости является гибридизация при температуре 68°C и в 0,1X SSC.
Продуцирование антигенов мутантов GAS57
Рекомбинантное продуцирование
Избыточность генетического кода хорошо известна специалистам. Так, например, любая молекула нуклеиновой кислоты (полинуклеотид), кодирующая белок GAS57 дикого типа, или мутантный белок GAS57 согласно изобретению, может быть использована для рекомбинантного продуцирования белка. Примеры нуклеотидных последовательностей, кодирующих GAS57 дикого типа, мутантный GAS57 D151A, мутантный GAS57 S617A и мутантный GAS D151A+S617A, представлены в SEQ ID NO:5, 6, 7 и 8 соответственно. Молекулы нуклеиновой кислоты, кодирующие GAS57 дикого типа, могут быть также выделены из соответствующей бактерии S. pyogenes стандартными методами очистки нуклеиновых кислот, либо они могут быть синтезированы методом амплификации, таким как полимеразная цепная реакция (ПЦР), или на автоматическом синтезаторе. См. Caruthers et al., Nucl. Acids Res. Symp. Ser. 215 223, 1980; Horn et al., Nucl. Acids Res. Symp. Ser. 225 232, 1980; Hunkapiller et al., Nature 310, 105-11, 1984; Grantham et al., Nucleic Acids Res. 9, r43-r74, 1981.
Молекулы кДНК могут быть получены стандартными методами молекулярной биологии с использованием мРНК в качестве матрицы. Затем молекулы кДНК могут быть реплицированы методами молекулярной биологии, хорошо известными специалистам. Метод амплификации, такой как ПЦР, может быть применен для получения дополнительных копий полинуклеотидов согласно изобретению с использованием геномной ДНК или кДНК в качестве матрицы.
При желании полинуклеотиды могут быть сконструированы методами, по существу известными специалистам, в целях модификации антиген-кодирующих последовательностей, включая, но не ограничиваясь ими, изменения, которые позволяют модифицировать клонирование, процессинг и/или экспрессию полипептида или мРНК-продукта. Для конструирования нуклеотидных последовательностей может быть осуществлена перестановка ДНК путем рандомизированной фрагментации и повторная сборка генных фрагментов и синтетических олигонуклеотидов, проводимая с помощью ПЦР. Так, например, сайт-направленный мутагенез может быть проведен для инсерции новых рестрикционных сайтов, изменения характера гликозилирования, изменения предпочтительности кодонов, продуцирования сплайсированных вариантов, введения мутаций и т.п.
Модификации последовательностей, такие как добавление последовательности метки для очистки или оптимизация кодонов, могут быть осуществлены в целях облегчения экспрессии. Так, например, N-концевая лидерная последовательность может быть заменена последовательностью, кодирующей белок-метку, такую как полигистидин («HIS») или глутатион-S-трансфераза («GST»). Такие белки-метки могут быть использованы для облегчения очистки и детектирования экспрессируемого белка, а также для повышения его стабильности. Кодоны, предпочитаемые конкретной прокариотической или эукариотической клеткой-хозяином, могут быть выбраны для повышения уровня экспрессии белка или для продуцирования РНК-транскрипта, обладающего нужными свойствами, такими как время полужизни, которое превышает время полужизни транскрипта, продуцируемого из природной последовательности. Такие методы хорошо известны специалистам и более подробно описаны в WO05/032582.
Экспрессионные векторы
Молекула нуклеиновой кислоты, кодирующая антиген мутанта GAS57, может быть встроена в экспрессионный вектор, содержащий элементы, необходимые для транскрипции и трансляции встроенной кодирующей последовательности. Для конструирования экспрессионных векторов, содержащих кодирующие последовательности и соответствующие элементы регуляции транскрипции и трансляции, могут быть применены методы, хорошо известные специалистам в данной области. Такими методами являются методы рекомбинантных ДНК in vitro, методы синтеза и методы генетической рекомбинации in vivo.
Клетки-хозяева
Клетки-хозяева для продуцирования мутантных антигенов GAS57 могут быть прокариотическими или эукариотическими. Предпочтительной клеткой-хозяином является E.coli, а другими подходящими хозяевами являются Lactococcus lactis, Lactococcus cremoris, Bacillus subtilis, Vibrio cholerae, Salmonella typhi, Salmonella typhimurium, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, M. tuberculosis), дрожжи, бакуловирусы, клетки млекопитающих и т.п.
Штамм клетки-хозяина может быть выбран по его способности модулировать экспрессию встроенных последовательностей или процессинг экспрессируемого полипептида нужным способом. Такими модификациями полипептидов являются, но не ограничиваются ими, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидизация и ацилирование. Для облегчения «правильного» встраивания, сборки и/или улучшения функций может быть также осуществлен посттрансляционный процессинг, который позволяет отщеплять «препро»-форму полипептида. Различные клетки-хозяева, обладающие специфическим клеточным механизмом и характерными механизмами посттрансляционной активности, имеются в Американской коллекции типовых культур (ATCC; 10801 University Boulevard, Manassas, VA 20110-2209) и могут быть выбраны для гарантии «правильной» модификации и «правильного» процессинга чужеродного белка. См. WO 01/98340.
Экспрессионные конструкции могут быть введены в клетку-хозяина хорошо известными методами, которыми являются, но не ограничиваются ими, перенос ДНК, опосредуемый трансферрином-поликатионами; трансфекция «оголенными» или инкапсулированными нуклеиновыми кислотами, слияние клеток, опосредуемое липосомами; внутриклеточный перенос ДНК, нанесенных на латексные сферы; слияние протопластов, инфицирование вирусом, электропорация, методы «выстреливания генов» и трансфекция, опосредуемая DEAE или фосфатом кальция.
Клетки-хозяева, трансформированные экспрессионными векторами, могут быть культивированы в условиях, подходящих для экспрессии и выделения белка из клеточной культуры. Белок, продуцированный трансформированной клеткой, может секретироваться или оставаться внутри клетки в зависимости от используемой нуклеотидной последовательности и/или от используемого экспрессионного вектора. Для специалиста в данной области очевидно, что экспрессионные векторы могут быть сконструированы так, чтобы они содержали сигнальные последовательности, которые направляют секрецию растворимых антигенов через мембрану прокариотических или эукариотических клеток.
Очистка
Сигнальные экспортные последовательности могут быть включены в рекомбинантно продуцируемый мутантный антиген GAS57 для облегчения его выделения из среды для культивирования клеток известными методами. Альтернативно рекомбинантно продуцированные мутантные антигены GAS57 согласно изобретению могут быть выделены из сконструированных клеток-хозяев и отделены от других клеточных компонентов, таких как белки, углеводы или липиды, методами, хорошо известными специалистам. Такими методами являются, но не ограничиваются ими, эксклюзионная хроматография, фракционирование сульфатом аммония, ионообменная хроматография, аффинная хроматография и электрофорез в препаративном геле. Препарат очищенных мутантных антигенов GAS57 имеет чистоту по меньшей мере 80%, а предпочтительно такие препараты имеют чистоту 90%, 95% или 99%. Чистота препаратов может быть оценена любыми методами, известными специалистам, такими как электрофорез в полиакриламидном геле с ДСН. При необходимости мутантные антигены GAS57 могут быть солюбилизированы, например, мочевиной.
Химический синтез
Мутантные антигены GAS57 могут быть синтезированы, например, методами твердофазного синтеза. См., например, Merrifield, J. Am. Chem. Soc. 85, 2149 54, 1963; Roberge et al., Science 269, 202 04, 1995. Синтез белка может быть осуществлен вручную или автоматически. Автоматизированный синтез может быть осуществлен, например, на синтезаторе пептидов Applied Biosystems 431A Peptide Synthesizer (Perkin Elmer). Фрагменты мутантного антигена GAS57 могут быть, но необязательно, отдельно синтезированы и объединены химическими методами с получением полноразмерной молекулы.
Антитела против GAS57
Настоящее изобретение также относится к антителам, которые специфически связываются с GAS57 дикого типа, и которые по существу ослабляют или подавляют способность GAS57 расщеплять IL-8. Некоторые антитела согласно изобретению также специфически связываются с мутантным GAS57, описанным выше. Предпочтительные антитела также ослабляют или подавляют способность GAS57 расщеплять другие субстраты, такие как гомологи IL-8 (например, CXL1/GROα, CXCL2/GROβ, CXCL3/GROγ, CXCL4, CXCL12/SDF-1α, CXCL12/SDF-1β, CXCL12/SDF-1γ, CXCL5/ENA78, CXCL6/GCP-2, CXCL7/NAP-2, CXCL9/MIG, CXCL10/IP10, CXCL11, CXCL13, CXCL14 и CXCL16). Считается, что антитело «специфически связывается» с GAS57 дикого типа или с мутантным GAS57, если в иммунохимическом анализе оно продуцирует детектируемый сигнал, который по меньшей мере в 5, 10 или 20 раз превышает детектируемый сигнал, передаваемый белками, не являющимися GAS57. Предпочтительно, если антитела, которые специфически связываются с GAS57 дикого типа или с мутантным GAS57 в иммунохимических анализах, не распознают белки, не являющиеся GAS57, и могут осаждать GAS57 дикого типа из раствора в виде иммунопреципитата. Антитела согласно изобретению могут снижать протеолитическую активность GAS57, направленную против интерлейкина-8 (IL-8), по меньшей мере на 50% (например, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99 или 100%) по сравнению с протеолитической активностью GAS57 дикого типа, как было обнаружено с помощью электрофореза в ДСН-ПААГ или ELISA.
В предпочтительных вариантах изобретения антитела согласно изобретению блокируют прогрессирование некротических поражений у животных, иммунизованных рекомбинантным антигеном GAS57 дикого типа или мутантного GAS57 и инфицированных GAS.
Используемый здесь термин «антитело» включает интактные молекулы иммуноглобулина, а также их фрагменты, которые специфически связываются с GAS57 дикого типа, а в некоторых случаях с мутантным антигеном GAS57. Такими антителами являются гибридные (химерные) молекулы антитела (например, Winter et al., Nature 349, 293-99, 1991; патент США 4816567); F(ab')2- и F(ab)-фрагменты и молекулы Fv; нековалентные гетеродимеры (например, Inbar et al., Proc. Natl. Acad. Sci. U.S.A. 69, 2659-62, 1972; Ehrlich et al., Biochem 19, 4091-96, 1980); одноцепочечные молекулы Fv (sFv) (например, Huston et al., Proc. Natl. Acad. Sci U.S.A. 85, 5897-83, 1988); конструкции из димерных и тримерных фрагментов антител; миниантитела (например, Pack et al., Biochem. 31, 1579-84, 1992; Cumber et al., J. Immunology 149B, 120-26, 1992); молекулы гуманизованного антитела (например, Riechmann et al., Nature 332, 323-27, 1988; Verhoeyan et al., Science 239, 1534-36, 1988; и патент Великобритании № GB 2276169, опубликованный 21 сентября 1994); и любые функциональные фрагменты, полученные из таких молекул, а также антитела, полученные нестандартными методами, такими как фаговое представление.
Получение антител против GAS57
Мутантный антиген GAS57 или антиген GAS57 дикого типа может быть использован для иммунизации млекопитающего, такого как мыши, крысы, кролики, морские свинки, обезьяны или человек, в целях вырабатывания у них поликлональных антител. При желании антиген GAS57 может быть конъюгирован с белком-носителем, таким как альбумин бычьей сыворотки, тироглобулин и гемоцианин лимфы улитки. В зависимости от вида хозяина для усиления иммунного ответа могут быть использованы различные адъюванты. Такими адъювантами являются, но не ограничиваются ими, адъювант Фрейнда, минеральные гели (например, гидроксид алюминия) и поверхностно-активные вещества (например, лизолецитин, полиолы плюроники, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол). Среди адъювантов, используемых для введения человеку, особенно подходящими являются BCG (бацилла Кальметта-Герена) и Corynebacterium parvum.
Моноклональные антитела, специфически связывающиеся с антигеном GAS57 дикого типа или мутантным антигеном GAS57, могут быть получены любым методом, который позволяет продуцировать молекулы антитела в непрерывной культуре клеточных линий. Такими методами являются, но не ограничиваются ими, гибридомный метод, метод с использованием человеческой В-клеточной гибридомы и метод с использованием EBV-гибридомы (Kohler et al., Nature 256, 495-97, 1985; Kozbor et al., J. Immunol. Methods 81, 31 42, 1985; Cote et al., Proc. Natl. Acad. Sci. 80, 2026-30, 1983; Cole et al., Mol. Cell Biol. 62, 109-20, 1984).
Кроме того, могут быть применены методы, разработанные в целях продуцирования «химерных антител» посредством сплайсинга генов мышиного антитела с их присоединением к генам человеческого антитела и образованием молекулы, обладающей соответствующей антигенной специфичностью и биологической активностью (Morrison et al., Proc. Natl. Acad. Sci. 81, 6851-55, 1984; Neuberger et al., Nature 312, 604-08, 1984; Takeda et al., Nature 314, 452-54, 1985). Моноклональные антитела и другие антитела могут быть также «гуманизованы» для предотвращения вырабатывания у пациента иммунного ответа против антитела, используемого в терапии. Последовательности таких антител могут иметь сходство с последовательностями человеческих антител, которое является достаточным для их прямого использования в терапии или для их использования в терапии после модификации нескольких ключевых остатков. Различие последовательностей антител грызунов и человека может быть минимизировано путем замены остатков, отличающихся от остатков человеческих последовательностей, которую проводят с помощью сайт-направленного мутагенеза отдельных остатков или посредством присоединения всех гипервариабельных областей.
Альтернативно гуманизованные антитела могут быть получены рекомбинантными методами, описанными ниже. Антитела, специфически связывающиеся с конкретным антигеном, могут содержать антиген-связывающие сайты, которые являются частично или полностью гуманизованными, как описано в патенте США 5565332. Человеческие моноклональные антитела могут быть получены in vitro, как описано в публикации Simmons et al., PLoS Medicine 4(5), 928-36, 2007.
Альтернативно описанные методы продуцирования одноцепочечных антител могут быть адаптированы известными методами в целях продуцирования одноцепочечных антител, специфически связывающихся с конкретным антигеном. Антитела, имеющие родственную специфичность, но отличающийся идиотипический состав, могут быть получены путем перестановки цепей из рандомизированных комбинаторных библиотек иммуноглобулинов (Burton, Proc. Natl. Acad. Sci. 88, 11120-23, 1991).
Одноцепочечные антитела могут быть также сконструированы методом амплификации ДНК, таким как ПЦР, с использованием гибридомной кДНК в качестве матрицы (Thirion et al., Eur. J. Cancer Prev. 5, 507-11, 1996). Одноцепочечные антитела могут быть моно- или биспецифическими и могут быть двухвалентными или четырехвалентными. Конструирование четырехвалентных биспецифических одноцепочечных антител описано, например, в публикации Coloma & Morrison, Nat. Biotechnol. 15, 159-63, 1997. Конструирование двухвалентных биспецифических одноцепочечных антител описано в публикации Mallender & Voss, J. Biol. Chem. 269, 199-206, 1994.
Нуклеотидная последовательность, кодирующая одноцепочечное антитело, может быть сконструирована методом ручного или автоматического нуклеотидного синтеза, клонирована в экспрессионную конструкцию стандартными методами рекомбинантных ДНК и введена в клетку для экспрессии кодирующей последовательности, как описано ниже. Альтернативно одноцепочечные антитела могут быть непосредственно продуцированы, например, с применением техники нитчатых фагов (Verhaar et al., Int. J. Cancer 61, 497-501, 1995; Nicholls et al., J. Immunol. Meth. 165, 81-91, 1993).
Антитела, которые специфически связываются с антигеном GAS57, могут быть также получены путем индуцирования их продуцирования in vivo популяцией лимфоцитов или путем скрининга библиотек иммуноглобулинов или панелей высокоспецифических связывающихся реагентов, описанных в литературе (Orlandi et al., Proc. Natl. Acad. Sci. 86, 3833 3837, 1989; Winter et al., Nature 349, 293 299, 1991).
Химерные антитела могут быть сконструированы, как описано в WO 93/03151. Могут быть также получены связывающие белки, которые происходят от иммуноглобулинов и которые являются поливалентными и мультиспецифическими, такими как «диантитела», описанные в WO 94/13804.
Антитела могут быть очищены методами, хорошо известными специалистам. Так, например, антитела могут быть аффинно очищены путем их пропускания через колонку, с которой связывается релевантный антиген. Затем связанные антитела элюируют с колонки с использованием буфера, имеющего высокую концентрацию соли.
Фармацевтические композиции
Настоящее изобретение также относится к композициям, используемым в качестве лекарственных препаратов (например, в качестве иммуногенных композиций или вакцин). Композиции согласно изобретению могут быть использованы в целях предупреждения и/или лечения заболевания, вызываемого инфицированием бактерией S. pyogenes, и содержат по меньшей мере один активный агент, которым может быть полипептид, молекула нуклеиновой кислоты или антитело. Указанными заболеваниями могут быть, например, бактериемия, менингит, послеродовой сепсис, скарлатина, рожа, фарингит, импетиго, некрозирующий фасцит, миозит или синдром токсического шока.
Фармацевтические композиции согласно изобретению могут быть использованы как в профилактических, так и терапевтических целях, но обычно они предназначены для применения в профилактических целях. В соответствии с этим, настоящее изобретение включает способ терапевтического или профилактического лечения заболевания, вызываемого инфицированием бактерией Streptococcus pyogenes. Предпочтительным животным является млекопитающее, а наиболее предпочтительно, человек. Указанные способы включают введение животному терапевтически или профилактически эффективного количества иммуногенных композиций согласно изобретению. Настоящее изобретение также относится к иммуногенным композициям согласно изобретению, используемым для терапевтического или профилактического лечения заболевания, вызываемого инфицированием бактерией Streptococcus pyogenes у животного.
Предпочтительными иммуногенными композициями, а более предпочтительно вакцинными композициями, являются композиции, содержащие мутантный антиген GAS57 или молекулу нуклеиновой кислоты, кодирующую мутантный антиген GAS57. pH таких композиций предпочтительно составляет от 6 до 8, более предпочтительно примерно 7. рН может поддерживаться с использованием буфера. Такая композиция может быть стерильной и/или апирогенной. Композиция может быть изотоничной с тканью человека (например, кровью).
Некоторые композиции согласно изобретению содержат один или несколько мутантных антигенов GAS57, описанных в настоящей заявке. Другие композиции согласно изобретению содержат одну или несколько молекул нуклеиновой кислоты, кодирующих мутантный(е) антиген(ы) GAS57, и, необязательно, другие антигены, которые могут быть включены в данную композицию (см. ниже). См., например, Robinson & Torres (1997) Seminars in Immunology 9:271-283; Donnelly et al. (1997) Ann. Rev Immunol 15:617-648; Scott-Taylor & Dalgleish (2000) Expert Opin Investig Drugs 9:471-480; Apostolopoulos & Plebanski (2000) Curr. Opin. Mol. Ther 2:441-447; Ilan (1999) Curr. Opin. Mol. Ther 1:116-120; Dubensky et al. (2000) Mol. Med. 6:723-732; Robinson & Pertmer (2000) Adv Virus Res 55:1-74; Donnelly et al. (2000) Am. J. Respir. Crit. Care Med. 162(4 Pt 2):S190-193; Davis (1999) Mt. Sinai J. Med. 66:84-90. Обычно молекулой нуклеиновой кислоты является молекула ДНК, например, в форме плазмиды.
Другие композиции согласно изобретению включают по меньшей мере одно антитело, которое специфически связывается с антигеном GAS57 дикого типа, описанным выше, или молекулу нуклеиновой кислоты, кодирующую такое антитело.
В некоторых вариантах изобретения композиции согласно изобретению могут включать активный агент более чем одного типа (например, полипептидный антиген и молекулу нуклеиновой кислоты; полипептидный антиген и антитело; молекулу нуклеиновой кислоты и антитело; полипептидный антиген, молекулу нуклеиновой кислоты и антитело).
В некоторых вариантах изобретения композиции согласно изобретению могут включать один или несколько дополнительных активных агентов. Такими агентами являются, но не ограничиваются ими: (a) другой антиген мутантного GAS57 согласно изобретению, (b) полипептидный антиген, который может быть использован в качестве вакцины для детей, (c) полипептидный антиген, который может быть использован в качестве вакцины для пожилых людей или индивидуумов с ослабленным иммунитетом, (d) молекула нуклеиновой кислоты, кодирующая антигены (a)-(c), и антитело, которое специфически связывается с антигенами (a)-(c).
Дополнительные антигены
Композиции согласно изобретению могут быть введены в комбинации с одним или несколькими антигенами, используемыми в способах терапии или профилактики согласно изобретению. Предпочтительными антигенами являются антигены, перечисленные ниже. Кроме того, композиции согласно изобретению могут быть использованы для лечения или предупреждения инфекционных заболеваний, вызываемых любыми перечисленными ниже патогенами. Композиции согласно изобретению, помимо комбинации с антигенами, описанными ниже, могут быть также объединены с адъювантом, описанным в настоящей заявке.
Антигенами, используемыми в настоящем изобретении, являются, но не ограничиваются ими, один или несколько нижеследующих антигенов или антигены, происходящие от одного или нескольких перечисленных ниже патогенов.
A. Бактериальные антигены
Бактериальными антигенами, подходящими для их использования в настоящем изобретении, являются белки, полисахариды, липополисахариды и другие мембранные везикулы, которые могут быть выделены и очищены из бактерий, либо они могут происходить от этих бактерий. Кроме того, бактериальными антигенами могут быть бактериальные лизаты и инактивированные бактериальные препараты. Бактериальные антигены могут быть продуцированы посредством рекомбинантной экспрессии. Бактериальными антигенами предпочтительно являются эпитопы, которые находятся на поверхности бактерий по меньшей мере в одной стадии их жизненного цикла. Бактериальные антигены предпочтительно являются консервативными для множества серотипов. Бактериальными антигенами являются антигены, происходящие от одной или нескольких бактерий, перечисленных ниже, а также специфические антигены, примеры которых идентифицированы ниже.
Neisseria meningitidis: Антигенами Meningitides могут быть белки (такие как белки, идентифицированные в работах 1-7), сахариды (включая полисахарид, олигосахарид или липополисахарид), или внешние мембранные везикулы (работы 8, 9, 10, 11), очищенные или выделенные из серогруппы N. meningitides, такой как A, C, W135, Y и/или B. Белковые антигены Meningitides могут быть выбраны из адгезивов, аутопереносчиков, токсинов, белков, образованных в результате присоединения Fe, и мембраносвязанных белков (предпочтительно интегрального внешнего мембранного белка).
Streptococcus pneumoniae: Антигенами Streptococcus pneumoniae могут быть сахарид (включая полисахарид или олигосахарид) и/или белок, происходящий от Streptococcus pneumoniae. Сахаридные антигены могут быть выбраны из антигенов серотипов 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F. Белковые антигены могут быть выбраны из белков, идентифицированных в WO 98/18931, WO 98/18930, в патенте США № 6699703, в патенте США № 6800744, WO 97/43303 и WO 97/37026. Белки Streptococcus pneumoniae могут быть выбраны из белков семейства полигистидиновых триад (PhtX), белков, принадлежащих к семейству холин-связывающих белков (CbpX), усеченных белков CbpX, белков семейства LytX, усеченных белков LytX, химерных белков «усеченная форма CbpX - усеченная форма LytX», пневмолизина (Ply), PspA, PsaA, Sp128, Sp101, Sp130, Sp125 или Sp133.
Streptococcus pyogenes (стрептококки группы А): Антигенами стрептококков группы А могут быть белок, идентифицированный в WO 02/34771 или WO 2005/032582 (включая GAS40), гибриды фрагментов белков GAS M (включая белки, описанные в WO 02/094851 и в работах Dale, Vaccine (1999) 17:193-200 и Dale, Vaccine 14(10): 944-948), белок, связывающийся с фибронектином (Sfb1), связанный с гемом белок стрептококков (Shp) и стрептолизин S (SagA). Другими антигенами стрептококков группы А являются, но не ограничиваются ими,
Moraxella catarrhalis: Антигенами Moraxella являются антигены, идентифицированные в WO 02/18595 и WO 99/58562, антигены внешнего мембранного белка (HMW-OMP), C-антиген и/или ЛПС.
Bordetella pertussis: Антигенами Pertussis являются антигены коклюшного холотоксина (PT) и нитчатый гемаглютинин (FHA) B. pertussis, присутствующие также, но необязательно, в комбинации с пертактином и/или антигеном аглютиногенов 2 и 3.
Staphylococcus aureus: Антигенами Staphylococcus aureus являются капсулярные полисахариды типа 5 и 8 S. aureus, необязательно конъюгированные с нетоксичным рекомбинантным экзотоксином А Pseudomonas aeruginosa, таким как Staph VAX™, или антигены, происходящие от поверхностных белков, инвазины (лейкоцидин, киназы, гиалуронидаза), поверхностные факторы, ингибирующие поглощение фагоцитов (капсулярный белок A), каротиноиды, белок, продуцирующий каталазу, белок А, коагулаза, фактор свертывания крови и/или разрушающие мембрану токсины (необязательно детоксифицированные), которые осуществляют лизис мембран эукариотических клеток (гемолизины, лейкотоксин, лейкоцидин).
Staphylococcus epidermis: Антигенами S. epidermidis являются антиген слизи (SAA).
Clostridium tetani (столбнячный токсин): Столбнячными антигенами являются столбнячный токсоид (TT), предпочтительно используемый в качестве белка-носителя в комбинации/в виде конъюгата с композициями согласно изобретению.
Cornynebacterium diphtheriae (дифтерийный токсин): Дифтерийными антигенами являются дифтерийный токсин, предпочтительно детоксифицированный, такой как CRM197. Кроме того, антигены, способные модулировать или ингибировать АДФ-рибозилирование или ассоциироваться с АДФ-рибозилированием, могут быть приготовлены в комбинации с композициями согласно изобретению/в виде препарата для совместного введения с композициями согласно изобретению/в виде конъюгата с композициями согласно изобретению. Дифтерийные токсоиды могут быть использованы в качестве белков-носителей.
Haemophilus influenzae B (Hib): Антигенами Hib являются сахаридный антиген Hib.
Pseudomonas aeruginosa: Антигенами Pseudomonas являются эндотоксин A, белок Wzz, ЛПС P. aeruginosa, а более конкретно, ЛПС, выделенный из PAO1 (серотипа O5), и/или внешние мембранные белки, включая внешние мембранные белки F (OprF) (Infect Immun. 2001 May; 69(5): 3510-3515).
Legionella pneumophila. Бактериальные антигены могут происходить от Legionella pneumophila.
Streptococcus agalactiae (стрептококки группы В): Антигенами стрептококков группы В являются белковый или сахаридный антиген, идентифицированный в WO 02/34771, WO 03/093306, WO 04/041157 или WO 2005/002619 (включая белки GBS 80, GBS 104, GBS 276 и GBS 322, и включая сахаридные антигены, происходящие от антигенов серотипов Ia, Ib, Ia/c, II, III, IV, V, VI, VII и VIII).
Neiserria gonorrhoeae: Антигенами Gonorrhoeae являются белок Por (или порин), такой как PorB (см. Zhu et al., Vaccine (2004) 22:660-669), белок, связывающийся с трансферрином, такой как TbpA и TbpB (См. Price et al., Infection and Immunity (2004) 71(1):277-283), белок, придающий непрозрачность (такой как Opa), белок, модифицируемый восстановлением (Rmp), и препараты на основе внешних мембранных везикул (OMV) (см. Plante et al., J Infectious Disease (2000) 182:848-855), см. также, например, WO99/24578, WO99/36544, WO99/57280, WO02/079243).
Chlamydia trachomatis: Антигенами Chlamydia trachomatis являются антигены, происходящие от серотипов A, B, Ba и C (агенты, вызывающие трахому, которая приводит к слепоте), серотипов L1, L2 и L3 (ассоциированных с Lymphogranuloma venereum), и серотипов D-K. Антигенами Chlamydia trachomas может быть также антиген, идентифицированный в WO 00/37494, WO 03/049762, WO 03/068811 или WO 05/002619, включая PepA (CT045), LcrE (CT089), ArtJ (CT381), DnaK (CT396), CT398, OmpH-подобный белок (CT242), L7/L12 (CT316), OmcA (CT444), AtosS (CT467), CT547, Eno (CT587), HrtA (CT823) и MurG (CT761).
Treponema pallidum (сифилис): Антигенами, вызывающими сифилис, является антиген TmpA.
Haemophilus ducreyi (бактерия, вызывающая мягкий шанкр): Антигенами Ducreyi является внешний мембранный белок (DsrA).
Enterococcus faecalis или Enterococcus faecium: Антигенами являются антигены с повторяющейся трисахаридной молекулой или другие антигены, происходящие от Enterococcus и описанные в патенте США № 6756361.
Helicobacter pylori: Антигенами H. pylori являются антигены Cag, Vac, Nap, HopX, HopY и/или уреазы.
Staphylococcus saprophyticus: Антигенами являются 160 кДа-гемаглютинин антигена S. saprophyticus.
Антигенами Yersinia enterocolitica являются ЛПС (Infect Immun. 2002 August; 70(8): 4414).
E. coli: Антигены E.coli могут происходить от энтеротоксигенной E.coli (ETEC), энтероагрегирующейся E.coli (EAggEC), диффузно-адгезивной E.coli (DAEC), энтеропатогенной E.coli (EPEC), и/или энтерогеморрагической E.coli (EHEC).
Bacillus anthracis (сибирская язва): Антигены B. anthracis являются, но необязательно, детоксифицированными и могут быть выбраны из A-компонентов (летального фактора (LF) и фактора отека (EF)), которые могут иметь общий B-компонент, известный как протективный антиген (PA).
Yersinia pestis (чума): Антигенами чумы являются капсулярный антиген F1 (Infect Immun. 2003 Jan; 71(1)): 374-383), ЛПС (Infect Immun. 1999 Oct; 67(10): 5395), V-антиген Yersinia pestis (Infect Immun. 1997 Nov; 65(11): 4476-4482).
Mycobacterium tuberculosis: Антигенами Tuberculosis являются липопротеины, ЛПС, антигены BCG (БЦЖ), гибридный белок, включающий антиген 85B (Ag85B) и/или ESAT-6, приготовленный, но необязательно, в виде везикул из катионного липида (Infect Immun. 2004 October; 72(10): 6148), антигены, ассоциированные с изоцитрат-дегидрогеназой Mycobacterium tuberculosis (Mtb) (Proc. Natl. Acad. Sci. USA. 2004 Aug 24; 101(34): 12652), и/или антигены MPT51 (Infect Immun. 2004 July; 72(7): 3829).
Rickettsia: Антигенами являются внешние мембранные белки, включая внешний мембранный белок A и/или B (OmpB) (Biochim Biophys Acta. 2004 Nov 1; 1702(2): 145), ЛПС, и поверхностный белковый антиген (SPA) (J Autoimmun. 1989 Jun 2; Suppl:81).
Listeria monocytogenes. Бактериальные антигены могут происходить от моноцитогенов Listeria.
Chlamydia pneumoniae: Антигенами являются антигены, идентифицированные в WO 02/02606.
Vibrio cholerae: Антигенами являются протеиназные антигены, ЛПС, в частности липополисахариды Vibrio cholerae II, O-специфические полисахариды O1 Inaba, антиген О139 V. cholera, антигены вакцины IEM108 (Infect Immun. 2003 Oct; 71(10):5498-504), и/или токсин Zonula occludens (Zot).
Salmonella typhi (сальмонеллез): Антигенами являются капсулярные полисахариды, предпочтительно конъюгаты (Vi, то есть vax-TyVi).
Borrelia burgdorferi (болезнь Лайма): Антигенами являются липопротеины (такие как OspA, OspB, OspC и OspD), другие поверхностные белки, такие как OspE-ассоциированные белки (Erps), белки, связывающиеся с декорином (такие как DbpA), и антигенно вариабельные белки VI, такие как антигены, ассоциированные с P39 и P13 (интегральный мембранный белок, Infect Immun. 2001 May; 69(5): 3323-3334), антигенно вариабельный белок VlsE (J. Clin. Microbiol. 1999 Dec; 37(12): 3997).
Porphyromonas gingivalis: Антигенами являются внешний мембранный белок P. gingivalis (OMP).
Klebsiella: Антигенами являются OMP, включая OMPA, или полисахарид, необязательно конъюгированный со столбнячным токсоидом.
Другими антигенами согласно изобретению могут быть капсулярные антигены, полисахаридные антигены и белковые антигены любой из вышеуказанных бактерий. Другими бактериальными антигенами согласно изобретению могут быть также препараты, полученные в виде внешних мембранных везикул (OMV). Кроме того, антигенами являются «живые», аттенюированные и/или очищенные варианты любой из вышеуказанных бактерий. Антигены согласно изобретению могут происходить от грамотрицательных или грамположительных бактерий. Антигены согласно изобретению могут происходить от аэробных или анаэробных бактерий.
Кроме того, любой из вышеупомянутых бактериальных сахаридов (полисахаридов, ЛПС, LOS или олигосахаридов) могут быть конъюгированы с другим агентом или антигеном, таким как белок-носитель (например, CRM197). Таким конъюгированием может быть прямое конъюгирование, осуществляемое путем восстановительного аминирования карбонильных групп на сахариде до аминогрупп на белке, как описано в патенте США № 5360897 и в публикации Can J. Biochem. Cell. Biol. 1984 May; 62(5):270-5. Альтернативно сахариды могут быть конъюгированы посредством линкера, такого как сукцинамид или другие связи, описанные в публикации Bioconjugate Techniques, 1996 and CRC, Chemistry of Protein Conjugation and Cross-Linking, 1993.
B. Вирусные антигены
Вирусными антигенами, подходящими для их использования в настоящем изобретении, являются инактивированный (или «убитый») вирус; аттенюированный вирус; препараты, полученные на основе расщепленного вируса; препараты, содержащие очищенные субъединицы; вирусные белки, которые могут быть выделены из вируса или очищены; или белки, которые могут происходить от вируса; и вирусоподобные частицы (VLP). Вирусные антигены могут происходить от вирусов, размноженных на клеточной культуре или на другом субстрате. Альтернативно вирусные антигены могут быть экспрессированы рекомбинантно. Вирусными антигенами предпочтительно являются эпитопы, которые находятся на поверхности вируса по меньшей мере в одной стадии его жизненного цикла. Вирусные антигены предпочтительно являются консервативными для множества серотипов или изолятов. Вирусными антигенами являются антигены, происходящие от одного или нескольких вирусов, перечисленных ниже, а также специфические антигены, примеры которых идентифицированы ниже.
Ортомиксовирус: Вирусные антигены могут происходить от ортомиксовируса, такого как вирус гриппа A, B и C. Антигеном ортомиксовируса может быть один или несколько антигенов, выбранных из вирусных белков, включая гемаглютинин (HA), нейраминидазу (NA), нуклеопротеин (NP), матриксный белок (M1), мембранный белок (M2), один или несколько транскриптазных компонентов (PB1, PB2 и PA). Предпочтительными антигенами являются HA и NA.
Антигены вируса гриппа могут происходить от штаммов вируса гриппа, вызывающих (ежегодные) пандемии, распространяющиеся по всему миру. Альтернативно антигены гриппа могут происходить от штаммов, которые могут вызывать вспышки пандемии (то есть штаммов гриппа с новой формой гемаглютинина, отличающейся от гемаглютинина, присутствующего в известных и широко распространенных штаммах, или штаммов вируса гриппа, которые являются патогенными у птиц и могут «горизонтально» передаваться человеку, или штаммов вируса гриппа, которые являются патогенными для человека).
Парамиксовирусы: Вирусные антигены могут происходить от парамиксовирусов, таких как пневмовирусы (RSV), парамиксовирусы (PIV) и морбилливирусы (корь).
Пневмовирус: Вирусные антигены могут происходить от пневмовируса, такого как респираторно-синцитиальный вирус (РСВ), коровий респираторно-синцитиальный вирус, вирус мышиной пневмонии и вирус ринотрахеита индеек. Предпочтительным пневмовирусом является РСВ. Антигенами пневмовируса могут быть один или несколько нижеследующих белков, выбранных из гибридного поверхностного белка (F), гликопротеина (G) и небольшого гидрофобного белка (SH), матриксных белков M и M2, нуклеокапсидных белков N, P и L и неструктурных белков NS1 и NS2. Предпочтительными пневмовирусными антигенами являются F, G и M. См., например, J. Gen. Virol. 2004 Nov; 85(Pt 11):3229). Пневмовирусные антигены могут быть также получены в виде препарата, содержащего химерные вирусы, либо они могут происходить от химерных вирусов. Так, например, химерные вирусы, такие как RSV/PIV, могут содержать компоненты RSV и PIV.
Парамиксовирус: Вирусные антигены могут происходить от парамиксовируса, такого как вирус парагриппа типа 1-4 (PIV), вирус паротита, вирусы Сендай, обезьяний вирус 5, вирус коровьего парагриппа и вирус ньюкаслской болезни. Предпочтительным парамиксовирусом является PIV или вирус паротита. Антигенами парамиксовируса могут быть один или несколько нижеследующих белков, выбранных из гемаглютинина-нейраминидазы (HN), гибридных белков F1 и F2, нуклеопротеина (NP), фосфопротеина (P), крупного белка (L) и матриксного белка (M). Предпочтительными белками парамиксовируса являются HN, F1 и F2. Антигены парамиксовируса могут быть также получены в виде химерных вирусов, либо они могут происходить от химерных вирусов. Так, например, химерные вирусы RSV/PIV могут содержать компоненты RSV и PIV. Коммерчески доступными вакцинами на основе вируса паротита являются «живой» аттенюированный вирус паротита, используемый либо в одновалентной форме, либо в комбинации с вакцинами на основе вируса кори и коревой краснухи (MMR).
Морбилливирус: Вирусные антигены могут происходить от морбилливируса, такого как вирус кори. Антигенами морбилливируса могут быть один или несколько нижеследующих белков, выбранных из гемаглютинина (H), гликопротеина (G), фактора слияния (F), крупного белка (L), нуклеопротеина (NP), фосфопротеина полимеразы (P) и матриксного белка (M). Коммерчески доступными вакцинами на основе вируса кори являются «живой» аттенюированный вирус кори, обычно в комбинации с вирусом паротита и коревой краснухи (MMR).
Пикорнавирус: Вирусные антигены могут происходить от пикорнавирусов, таких как энтеровирусы, риновирусы, гепарнавирусы, кардиовирусы и афтовирусы. Предпочтительными являются антигены, происходящие от энтеровирусов, таких как полиовирус.
Энтеровирус: Вирусные антигены могут происходить от энтеровируса, такого как полиовирус типа 1, 2 или 3, вирус Коксаки A типов 1-22 и 24, вируса Коксаки B типов 1-6, ECHO-вирус типов 1-9, 11-27 и 29-34 и энтеровирус 68-71. Предпочтительным энтеровирусом является полиовирус. Предпочтительными антигенами энтеровирусов могут быть один или несколько капсидных белков, выбранных из VP1, VP2, VP3 и VP4. Коммерчески доступными вакцинами на основе полиовирусов являются инактивированная полиовакцина (IPV) и полиовирусная вакцина для перорального введения (OPV).
Гепарнавирус: Вирусные антигены могут происходить от гепарнавируса, такого как вирус гепатита A (HAV). Коммерчески доступными вакцинами на основе HAV являются инактивированная HAV-вакцина.
Тогавирус: Вирусные антигены могут происходить от тогавируса, такого как рубивирус, альфа-вирус или артеривирус. Предпочтительными являются антигены, происходящие от рубивируса, такого как вирус коревой краснухи. Антигены тогавируса могут быть выбраны из E1, E2, E3, C, NSP-1, NSPO-2, NSP-3 или NSP-4. Антигены тогавируса предпочтительно выбирают из E1, E2 или E3. Коммерчески доступные вакцины на основе вируса коревой краснухи включают «живой», адаптированный к холоду вирус и обычно используются в комбинации с вакцинами на основе вируса паротита и кори (MMR).
Флавивирус: Вирусные антигены могут происходить от флавивируса, такого как вирус клещевого энцефалита (TBE), вирус денге (типов 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус энцефалита Западного Нила, вирус энцефалита Сент-Луис, вирус русского весенне-летнего энцефалита и вирус энцефалита Повассан. Антигены флавивирусов могут быть выбраны из PrM, M, C, E, NS-1, NS-2a, NS2b, NS3, NS4a, NS4b и NS5. Антигены флавивирусов предпочтительно выбирают из PrM, M и E. Коммерчески доступными вакцинами на основе TBE являются вакцины на основе инактивированного вируса.
Пестивирус: Вирусные антигены могут происходить от пестивируса, такого как вирус коровьей диареи (BVDV), вирус классической лихорадки свиней (CSFV) или вирус, вызывающий болезнь Бордера (BDV).
Гепаднавирус: Вирусные антигены могут происходить от гепаднавируса, такого как вирус гепатита В. Антигены гепаднавируса могут быть выбраны из поверхностных антигенов (L, M и S) и коровых антигенов (HBc, HBe). Коммерчески доступными вакцинами на основе HBV являются субъединичные вакцины, содержащие белок поверхностного антигена S.
Вирус гепатита C: Вирусные антигены могут происходить от вируса гепатита C (HCV). Антигенами HCV являются один или несколько антигенов, которые могут быть выбраны из E1, E2, E1/E2, полипротеина NS345, корового полипротеина NS345, корового пептида и/или пептидов, происходящих от неструктурных областей (Houghton et al., Hepatology (1991) 14:381).
Рабдовирус: Вирусные антигены могут происходить от рабдовируса, такого как лиссавирус (вирус бешенства) и везикуловирус (VSV). Антигены рабдовируса могут быть выбраны из гликопротеина (G), нуклеопротеина (N), крупного белка (L), неструктурных белков (NS). Коммерчески доступная вакцина на основе вируса бешенства содержит «убитый» вирус, выращенный на человеческих диплоидных клетках или клетках легких плода макак-резусов.
Калицивирус: Вирусные антигены могут происходить от калицивируса, такого как вирус Норфолк и вирусы, подобные вирусу Норфолк, такие как вирус Гавайи и вирус снежных гор.
Коронавирус: Вирусные антигены могут происходить от коронавируса, SARS, коронавируса дыхательных путей человека, вируса птичьего инфекционного бронхита (IBV), вируса мышиного гепатита (MHV) и вируса свиного трансмиссивного гастроэнтерита (TGEV). Антигены коронавируса могут быть выбраны из белка шипа (S), белка оболочки (E), матриксного белка (M), нуклеокапсида (N) и гликопротеина гемаглютинин-эстеразы (HE). Предпочтительный антиген коронавируса происходит от вируса SARS. Антигены вируса SARS описаны в WO 04/92360.
Ретровирус: Вирусные антигены могут происходить от ретровируса, такого как онковирус, лентивирус или спумавирус. Антигены онковирусов могут происходить от HTLV-1, HTLV-2 или HTLV-5. Антигены лентивирусов могут происходить от ВИЧ-1 или ВИЧ-2. Антигены ретровирусов могут быть выбраны из gag, pol, env, tax, tat, rex, rev, nef, vif, vpu и vpr. Антигены ВИЧ могут быть выбраны из gag (ρ24gag и p55gag), env (gp160 и gp41), pol, tat, nef, rev, vpu, минибелков (предпочтительно p55 gag и делетированного gp140v). Антигены ВИЧ могут происходить от одного или нескольких нижеследующих штаммов: HIVIIIb, HIVSF2, HIVLAV, HIVLAI, HIVMN, HIV-1CM235, HIV-1US4.
Реовирус: Вирусные антигены могут происходить от реовируса, такого как ортореовирус, ротавирус, орбивирус или колтивирус. Антигены реовирусов могут быть выбраны из структурных белков λ1, λ2, λ3, μ1, μ2, σ1, σ2 или σ3 или неструктурных белков σNS, μNS или σls. Предпочтительные антигены реовирусов могут происходить от ротавирусов. Ротавирусные антигены могут быть выбраны из VP1, VP2, VP3, VP4 (или расщепленного продукта VP5 и VP8), NSP1, VP6, NSP3, NSP2, VP7, NSP4 или NSP5. Предпочтительными ротавирусными антигенами являются VP4 (или расщепленный продукт VP5 и VP8) и VP7.
Парвовирус: Вирусные антигены могут происходить от парвовируса, такого как парвовирус B19. Антигены парвовирусов могут быть выбраны из VP-1, VP-2, VP-3, NS-1 и NS-2. Предпочтительным антигеном парвовируса является капсидный белок VP-2.
Вирус гепатита-дельта (HDV): Вирусные антигены могут происходить от HDV, в частности δ-антигена HDV (см., например, патент США № 5378814).
Вирус гепатита Е (HEV): Вирусные антигены могут происходить от HEV.
Вирус гепатита G (HGV): Вирусные антигены могут происходить от HGV.
Человеческий герпесвирус: Вирусные антигены могут происходить от человеческого герпесвируса, такого как вирус простого герпеса (HSV), вирус ветряной оспы (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (CMV), человеческий герпесвирус 6 (HHV6), человеческий герпесвирус 7 (HHV7) и человеческий герпесвирус 8 (HHV8). Антигены человеческого герпесвируса могут быть выбраны из предранних белков (α), ранних белков (β) и поздних белков (γ). Антигены HSV могут происходить от штаммов HSV-1 или HSV-2. Антигены HSV могут быть выбраны из гликопротеинов gB, gC, gD и gH, белка слияния (gB) или белков, ускользающих от «иммунного надзора» (gC, gE, или gI). Антигены VZV могут быть выбраны из белков сердцевины, нуклеокапсидных белков, белков тегумента или белков оболочки. Вакцины на основе живого аттенюированного вируса VZV являются коммерчески доступными. Антигены EBV могут быть выбраны из ранних антигенных белков (EA), антигена вирусного капсида (VCA) и гликопротеинов мембранного антигена (MA). Антигены CMV могут быть выбраны из капсидных белков, гликопротеинов оболочки (таких как gB и gH) и белков тегумента.
Паповавирусы: Антигены могут происходить от паповавирусов, таких как папиломавирусы и полиомавирусы. Папиломавирусами являются HPV серотипов 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 и 65. Предпочтительные антигены HPV происходят от серотипов 6, 11, 16 или 18. Антигены HPV могут быть выбраны из капсидных белков (L1) и (L2), или E1-E7, или их белков слияния. Антигены HPV предпочтительно получают в виде вирусоподобных частиц (VLP). Полиомавирусами являются вирус BK и вирус JK. Антигены полиомавируса могут быть выбраны из VP1, VP2 или VP3.
В настоящем изобретении также указываются антигены, композиции, способы и микроорганизмы, которые описаны в публикациях Vaccines, 4th Edition (Plotkin and Orenstein ed. 2004); Medical Microbiology 4th Edition (Murray et al. ed. 2002); Virology, 3rd Edition (W.K. Joklik ed. 1988); Fundamental Virology, 2nd Edition (B.N. Fields and D.M. Knipe, eds. 1991), и которые рассматриваются в комбинации с композициями согласно изобретению.
C. Антигены грибов
Антигены грибов, используемые в настоящем изобретении, могут происходить от одного или нескольких грибов, описанных ниже.


Способы продуцирования антигенов грибов хорошо известны специалистам (см. патент США № 6333164). В предпочтительном способе солюбилизированную фракцию экстрагируют и отделяют от нерастворимой фракции, получаемой из клеток грибов, стенки которых были в основном или по меньшей мере частично удалены, где указанный способ отличается тем, что он включает стадии: получения живых клеток грибов; получения клеток грибов, стенки которых были в основном или по меньшей мере частично удалены; резкой активации клеток грибов, стенки которых были в основном или по меньшей мере частично удалены; получения нерастворимой фракции и экстракции и отделения солюбилизированной фракции от нерастворимой фракции.
D. Антигены STD
Композиции согласно изобретению могут включать один или несколько антигенов, происходящих от патогенов, вызывающих заболевания, передающиеся половым путем (STD). Такие антигены могут быть использованы в целях профилактики или терапии STD, таких как хламидос, герпетическое поражение половых органов, гепатит (такой как HCV), остроконечная кондилома, гонорея, сифилис и/или мягкий шанкр (см., WO00/15255). Антигены могут происходить от одного или нескольких вирусных или бактериальных патогенов, вызывающих STD. Вирусные антигены STD, используемые в настоящем изобретении, могут происходить, например, от вируса ВИЧ, вируса простого герпеса (HSV-1 и HSV-2), человеческого папилломавируса (HPV) и гепатита (HCV). Бактериальные антигены STD, используемые в настоящем изобретении, могут быть выбраны, например, из антигенов Neiserria gonorrhoeae, Chlamydia trachomatis, Treponema pallidum, Haemophilus ducreyi, E. coli и Streptococcus agalactiae. Примеры специфических антигенов, происходящих от этих патогенов, описаны выше.
E. Антигены дыхательных путей
Композиции согласно изобретению могут включать один или несколько антигенов, происходящих от патогена, вызывающего респираторное заболевание. Так, например, антигены дыхательных путей могут происходить от вируса дыхательных путей, такого как ортомиксовирусы (вирус гриппа), пневмовирус (RSV), парамиксовирус (PIV), морбилливирус (вирус кори), тогавирус (вирус коревой краснухи), VZV и коронавирус (SARS). Антигены дыхательных путей могут происходить от бактерий, вызывающих респираторные заболевания, таких как Streptococcus pneumoniae, Pseudomonas aeruginosa, Bordetella pertussis, Mycobacterium tuberculosis, Mycoplasma pneumoniae, Chlamydia pneumoniae, Bacillus anthracis и Moraxella catarrhalis. Примеры специфических антигенов, происходящих от указанных патогенов, описаны выше.
F. Антигены вакцин для детей
Композиции согласно изобретению могут включать один или несколько антигенов, которые могут быть использованы в целях получения вакцин для детей. Эти вакцины могут быть введены детям в возрасте примерно менее 3 лет, или примерно менее 2 лет, или примерно менее 1 года. Эти антигены могут быть введены детям многократно в течение 6 месяцев, 1 года, 2 лет или 3 лет. Антигены вакцин для детей могут происходить от вируса, которым могут быть инфицированы дети, и/или от вируса, к инфицированию которым дети являются восприимчивыми. Вирусными антигенами вакцин для детей являются антигены, происходящие от одного или нескольких вирусов, таких как ортомиксовирус (вирус гриппа), пневмовирус (RSV), парамиксовирус (вирус парагриппа и вирус паротита), морбилливирус (вирус кори), тогавирус (вирус коревой краснухи), энтеровирус (полиовирус), HBV, коронавирус (SARS), вирус ветряной оспы (VZV) и вирус Эпштейна-Барра (EBV). Бактериальными антигенами вакцин для детей являются антигены, происходящие от одного или нескольких патогенов, таких как Streptococcus pneumoniae, Neisseria meningitides, Streptococcus pyogenes (стрептококки группы А), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Clostridium tetani (столбняк), Cornynebacterium diphtheriae (дифтерия), Haemophilus influenzae B (Hib), Pseudomonas aeruginosa, Streptococcus agalactiae (стрептококки группы В) и E. coli. Примеры специфических антигенов, происходящих от указанных патогенов, описаны выше.
G. Антигены, подходящие для использования в вакцинах для пожилых людей или людей с ослабленным иммунитетом
Композиции согласно изобретению могут включать один или несколько антигенов, подходящих для их использования в вакцинах для пожилых людей или людей с ослабленным иммунитетом. Такие индивидуумы нуждаются в более частой вакцинации с введением более высоких доз или с использованием адъювантных препаратов, вводимых в целях усиления иммунного ответа на доставляемые антигены. Антигенами, которые могут быть использованы в вакцинах для пожилых людей или людей с ослабленным иммунитетом, являются антигены, происходящие от одного или нескольких патогенов, таких как Neisseria meningitides, Streptococcus pneumoniae, Streptococcus pyogenes (стрептококки группы А), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Staphylococcus epidermis, Clostridium tetani (столбняк), Cornynebacterium diphtheriae (дифтерия), Haemophilus influenzae B (Hib), Pseudomonas aeruginosa, Legionella pneumophila, Streptococcus agalactiae (стрептококки группы В), Enterococcus faecalis, Helicobacter pylori, Clamydia pneumoniae, ортомиксовирус (вирус гриппа), пневмовирус (RSV), парамиксовирус (вирус парагриппа и вирус паротита), морбилливирус (вирус кори), тогавирус (вирус коревой краснухи), энтеровирус (полиовирус), HBV, коронавирус (SARS), вирус ветряной оспы (VZV), вирус Эпштейна-Барра (EBV) и цитомегаловирус (CMV). Примеры специфических антигенов, происходящих от указанных патогенов, описаны выше.
H. Антигены, подходящие для использования в вакцинах для подростков
Композиции согласно изобретению могут включать один или несколько антигенов, подходящих для их использования в вакцинах для подростков. Подросткам может оказаться необходимым введение бустер-дозы ранее вводимого антигена, используемого в вакцине для детей. Антигены, которые используются в вакцинах для детей и которые могут быть введены подросткам, описаны выше. Кроме того, подросткам могут быть введены антигены, происходящие от патогена, вызывающего STD, для гарантии вырабатывания у них протективного или терапевтического иммунного ответа до развития сексуальной активности. Антигены STD, которые могут быть использованы для введения подросткам, описаны выше.
I. Антигенные препараты
В других своих аспектах настоящее изобретение относится к способам продуцирования микрочастиц с адсорбированными на них антигенами. Такие способы включают: (a) получение эмульсий путем диспергирования смеси, содержащей (i) воду, (ii) детергент, (iii) органический растворитель и (iv) биологически разлагаемый полимер, выбранный из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира, полиангидрида и полицианоакрилата. Полимер обычно присутствует в смеси в концентрации примерно от 1% до 30% по отношению к органическому растворителю, а детергент обычно присутствует в смеси в массовом отношении «детергент-полимер», составляющем примерно от 0,00001:1 до 0,1:1 (обычно примерно от 0,0001:1 до 0,1:1, примерно от 0,001:1 до 0,1:1, или примерно от 0,005:1 до 0,1:1); (b) удаление органического растворителя из эмульсии; и (c) абсорбцию антигена на поверхности микрочастиц. В некоторых вариантах изобретения биологически разлагаемый полимер присутствует в концентрации примерно от 3% до 10% по отношению к органическому растворителю.
Используемые здесь микрочастицы могут быть получены из материалов, которые являются стерилизуемыми, нетоксичными и биологически разлагаемыми. Такими материалами являются, но не ограничиваются ими, поли(α-гидроксикислота), полигидроксимасляная кислота, поликапролактон, полиортоэфир, полиангидрид, PACA и полицианоакрилат. Микрочастицами, предпочтительными для использования в настоящем изобретении, являются частицы, происходящие от поли(α-гидроксикислоты), в частности от полилактида («PLA») или сополимера D,L-лактида и гликолида или гликолевой кислоты, такого как сополимер D,L-лактида и гликолида («PLG» или «PLGA») или сополимер D,L-лактида и капролактона. Микрочастицы могут происходить от любого из различных исходных полимерных веществ, имеющих различные молекулярные массы, а в случае сополимеров от таких сополимеров, как PLG, а также различные отношения лактид:гликолид, выбор которых зависит главным образом от типа совместно вводимой макромолекулы. Такие параметры более подробно обсуждаются ниже.
Другими антигенами могут быть также препараты на основе внешних мембранных везикул (OMV).
Другие методы получения препаратов и антигены (в частности, опухолевые антигены) описаны в патенте США рег. № 09/581772.
J. Работы, относящиеся к антигенам
В нижеследующих работах описаны антигены, которые могут быть использованы в комбинации с композициями согласно изобретению:
1. Международная патентная заявка WO99/24578.
2. Международная патентная заявка WO99/36544.
3. Международная патентная заявка WO99/57280.
4. Международная патентная заявка WO00/22430.
5. Tettelin et al. (2000) Science 287: 1809-1815.
6. Международная патентная заявка WO96/29412.
7. Pizza et al. (2000) Science 287:1816-1820.
8. Заявка PCT WO 01/52885.
9. Bjune et al. (1991) Lancet 338(8775).
10. Fuskasawa et al. (1999) Vaccine 17:2951-2958.
11. Rosenqist et al. (1998) Dev. Biol. Strand 92:323-333.
12. Constantino et al. (1992) Vaccine 10:691-698.
13. Constantino et al. (1999) Vaccine 17:1251-1263.
14. Watson (2000) Pediatr Infect Dis J 19:331-332.
15. Rubin (20000) Pediatr Clin North Am 47:269-285,v.
16. Jedrzejas (2001) Microbiol Mol. Biol Rev 65:187-207.
17. Международная патентная заявка, поданная 3 июля 2001, в которой испрашивается приоритет заявок GB 0016363.4; WO 02/02606; PCT IB/01/00166.
18. Kalman et al. (1999) Nature Genetics 21:385-389.
19. Read et al. (2000) Nucleic Acids Res 28:1397-406.
20. Shirai et al. (2000) J. Infect. Dis 181(Suppl 3):S524-S527.
21. Международная патентная заявка WO99/27105.
22. Международная патентная заявка WO00/27994.
23. Международная патентная заявка WO00/37494.
24. Международная патентная заявка WO99/28475.
25. Bell (2000) Pediatr Infect Dis J 19:1187-1188.
26. Iwarson (1995) APMIS 103:321-326.
27. Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
28. Hsu et al. (1999) Clin Liver Dis 3:901-915.
29. Gastofsson et al. (1996) N. Engl. J. Med. 334-:349-355.
30. Rappuoli et al. (1991) TIBTECH 9:232-238.
31. Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0.
32. Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70.
33. Международная патентная заявка WO93/018150.
34. Международная патентная заявка WO99/53310.
35. Международная патентная заявка WO98/04702.
36. Ross et al. (2001) Vaccine 19:135-142.
37. Sutter et al. (2000) Pediatr Clin North Am 47:287-308.
38. Zimmerman & Spann (1999) Am Fan Physician 59:113-118, 125-126.
39. Dreensen (1997) Vaccine 15 Suppl"S2-6.
40. MMWR Morb Mortal Wkly rep 1998 Jan 16:47(1):12, 9.
41. McMichael (2000) Vaccinel9 Suppl 1:S101-107.
42. Schuchat (1999) Lancer 353(9146):51-6.
43. Заявки на патент Великобритании 0026333.5, 0028727.6 и 0105640.7.
44. Dale (1999) Infect Disclin North Am 13:227-43, viii.
45. Ferretti et al. (2001) PNAS USA 98: 4658-4663.
46. Kuroda et al. (2001) Lancet 357(9264):1225-1240; см. также страницы 1218-1219.
47. Ramsay et al. (2001) Lancet 357(9251):195-196.
48. Lindberg (1999) Vaccine 17 Suppl 2:S28-36.
49. Buttery & Moxon (2000) J R Coil Physicians Long 34:163-168.
50. Ahmad & Chapnick (1999) Infect Dis Clin North Am 13:113-133, vii.
51. Goldblatt (1998) J. Med. Microbiol. 47:663-567.
52. Европатент 0477508.
53. Патент США № 5306492.
54. Международная патентная заявка WO98/42721.
55. Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, в частности, vol. 10:48-114.
56. Hermanson (1996) Bioconjugate Techniques ISBN: 012323368 & 012342335X.
57. Европейская патентная заявка 0372501.
58. Европейская патентная заявка 0378881.
59. Европейская патентная заявка 0427347.
60. Международная патентная заявка WO93/17712.
61. Международная патентная заявка WO98/58668.
62. Европейская патентная заявка 0471177.
63. Международная патентная заявка WO00/56360.
64. Международная патентная заявка WO00/67161.
Содержание всех цитируемых выше патентов, патентных заявок и журнальных статей во всей своей полноте вводится в настоящее описание посредством ссылки.
Если используется сахаридный или углеводный антиген, то такой антиген предпочтительно конъюгируют с белком-носителем для повышения иммуногенности. См. публикации Ramsay et al. (2001) Lancet 357(9251):195-196; Lindberg (1999) Vaccine 17 Suppl 2:S28-36; Buttery & Moxon (2000) J.R. Coll Physicians Lond 34:163-168; Ahmad & Chapnick (1999) Infect Dis. Clin. North Am 13:113-133, vii; Goldblatt (1998) J. Med. Microbiol. 47:563-567; Европейский патент 0477508; патент США № 5306492; WO98/42721; Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, в частности vol. 10:48-114; Hermanson (1996) Bioconjugate Techniques ISBN: 0123423368 или 012342335X. Предпочтительными белками-носителями являются бактериальные токсины или токсоиды, такие как дифтерийные или столбнячные токсоиды. Особенно предпочтительным является дифтерийный токсоид CRM197.
Другими полипептидами-носителями являются внешний мембранный белок N. meningitidis (EP-A-0372501), синтетические пептиды (EP-A-0378881 и EP-A 0427347), белки теплового шока (WO 93/17712 и WO 94/03208), белки коклюша (WO 98/58668 и EP A 0471177), белок D H. influenzae (WO 00/56360), цитокины (WO 91/01146), лимфокины, гормоны, факторы роста, токсин A или B от C. difficile (WO 00/61761), железосодержащие белки (WO 01/72337) и т.п. Если смесь содержит капсулярный сахарид обоих серотипов A и C, то предпочтительное отношение (масс./масс.) «сахарид MenA: сахарид MenC» может составлять более 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). Различные сахариды могут быть конъюгированы с белками-носителями одного и того же типа или различных типов. Для этих целей может быть проведена любая подходящая реакция конъюгирования с использованием, если это необходимо, любого подходящего линкера.
Если это необходимо, то токсичные белковые антигены могут быть детоксифицированы, например, посредством детоксификации коклюшного токсина химическим и/или генетическим методом.
Фармацевтически приемлемые носители
Композиции согласно изобретению, помимо вышеупомянутых компонентов, обычно содержат один или несколько «фармацевтически приемлемых носителей». Такими носителями является любой носитель, который сам не индуцирует вырабатывание антител, оказывающих негативное воздействие на индивидуума, которому вводят данную композицию. Подходящими носителями обычно являются крупные макромолекулы, медленно подвергающиеся метаболизму, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и липидные агрегаты (такие как масляные капельки или липосомы). Такие носители хорошо известны среднему специалисту в данной области. Композиция может также содержать разбавитель, такой как вода, физиологический раствор, глицерин и т.п. Кроме того, может присутствовать добавка, такая как смачивающий или эмульгирующий агент, рН-забуферивающее вещество и т.п. Подробное обсуждение фармацевтически приемлемых компонентов приводится в публикации Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th ed., ISBN: 0683306472.
Иммунорегуляторные средства
Адъюванты
Вакцины согласно изобретению могут быть введены в комбинации с другими иммунорегуляторными агентами. В частности, композиции обычно включают адъювант. Адъювантами, используемыми в настоящем изобретении, являются, но не ограничиваются ими, один или несколько из адъювантов, описанных ниже.
A. Композиции, содержащие минералы
Композициями, содержащими минералы и подходящими для их использования в качестве адъювантов в настоящем изобретении, являются минеральные соли, такие как соли алюминия и соли кальция. В настоящем изобретении рассматриваются минеральные соли, такие как гидроксиды (например, оксигидроксиды), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты и т.п. (см., например, главы 8 и 9 в публикации Vaccine Design... (1995) eds. Powell & Newman. ISBN: 030644867X. Plenum.), или смеси различных минеральных соединений (например, смесь фосфатного и гидроксидного адъюванта, необязательно с избыточным количеством фосфата) с соединениями в любой подходящей форме (например, в форме геля, кристаллического вещества, аморфного вещества и т.п.), а предпочтительно с соединениями, адсорбированными в соли(ях). Композиции, содержащие минералы, могут быть также приготовлены в виде частиц соли металла (WO00/23105).
Соли алюминия могут быть включены в вакцины согласно изобретению в дозе Al3+, составляющей от 0,2 до 1,0 мг на дозу.
В одном из вариантов изобретения адъювантом на основе алюминия, используемым в настоящем изобретении, являются квасцы (сульфат алюминия-калия (AlK(SO4)2)) или производные квасцов, полученные in situ путем смешивания антигена в фосфатном буфере с квасцами, с последующим их титрованием и осаждением основанием, таким как гидроксид аммония или гидроксид натрия.
Другими адъювантами на основе алюминия, используемыми в вакцинных препаратах согласно изобретению, являются адъювант на основе гидроксида алюминия (Al(OH)3) или кристаллический оксигидроксид алюминия (AlOOH), который является превосходным адсорбирующим веществом, площадь поверхности которого составляет приблизительно 500 м2/г. Альтернативно может быть использован адъювант на основе фосфата алюминия (AlPO4) или гидроксифосфат алюминия, которые вместо некоторых или всех гидроксильных групп адъюванта на основе гидроксида алюминия содержат фосфатные группы. Предпочтительные адъюванты на основе фосфата алюминия, описанные в настоящей заявке, представляют собой аморфные вещества и являются растворимыми в кислой, щелочной и нейтральной среде.
В другом варианте изобретения адъювант согласно изобретению содержит фосфат алюминия и гидроксид алюминия. В более конкретном варианте изобретения адъювант имеет большее количество фосфата алюминия, чем гидроксида алюминия, например, отношение фосфата алюминия к гидроксиду алюминия составляет 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или более чем 9:1 по массе. Более конкретно, соли алюминия в вакцине присутствуют в количестве от 0,4 до 1,0 мг на дозу вакцины, или от 0,4 до 0,8 мг на дозу вакцины, или от 0,5 до 0,7 мг на дозу вакцины, или примерно 0,6 мг на дозу вакцины.
В общих чертах, предпочтительный(е) адъювант(ы) на основе алюминия или отношение множества адъювантов на основе алюминия, такие как отношение «фосфат алюминия:гидроксид алюминия», выбирают путем оптимизации электростатического притяжения между молекулами, в результате чего данный антиген будет нести заряд, противоположный заряду адъюванта при нужном рН. Так, например, адъювант на основе фосфата алюминия (изоэлектрическая точка = 4) адсорбирует лизоцим, но не альбумин при pH 7,4. Если альбумин является мишенью, то должен быть выбран адъювант на основе гидроксида алюминия (изоэлектрическая точка = 11,4). Альтернативно, предварительная обработка гидроксида алюминия фосфатом приводит к снижению значения его изоэлектрической точки, что делает такой адъювант предпочтительным для более основных антигенов.
B. Масляные эмульсии
Композициями типа масляных эмульсий, используемыми в качестве адъювантов согласно изобретению, являются эмульсии «сквален-вода», такие как MF59 (5% сквален, 0,5% твин™ 80 и 0,5% Span 85, приготовленные в виде субмикронных частиц с использованием микрофлюидизатора). См. WO90/14837. См. также Podda, Vaccine (2001) 19: 2673-2680; Frey et al., Vaccine (2003) 21:4234-4237. MF59 используется в качестве адъюванта в трехвалентной субъединичной вакцине на основе вируса гриппа FLUAD™.
Особенно предпочтительными адъювантами, используемыми в указанных композициях, являются субмикронные эмульсии типа «масло в воде». Предпочтительными субмикронными эмульсиями типа «масло в воде», используемыми в настоящем изобретении, являются эмульсии «сквален/вода», содержащие, но необязательно, различные количества MTP-PE, такие как субмикронная эмульсия типа «масло в воде», содержащая 4-5% масс./об. сквалена, 0,25-1,0% масс./об. твина™ 80D (полиоксиэтиленсорбитанмоноолеат) и/или 0,25-1,0% SPAN 85™ (сорбитантриолеат) и, необязательно, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE), например, субмикронная эмульсия типа «масло в воде», известная как «MF59» (публикация международной заявки № WO90/14837; патенты США №№ 6299884 и 6451325, и Ott et al., Vaccine Design: The Subunit and Adjuvant Approach (Powell, M.F. and Newman, MJ. eds.) Plenum Press, New York, 1995, pp. 277-296). MF59 содержит 4-5% масс./об. сквалена (например, 4,3%), 0,25-0,5% масс./об. TWEEN™ 80, и 0,5% масс./об. SPAN 85™ и, необязательно, различные количества MTP-PE, приготовленные в виде субмикронных частиц с использованием микрофлюидизатора, такого как микрофлюидизатор модели 110Y (Microfluidics, Newton, MA). Так, например, MTP-PE может присутствовать в количестве примерно 0-500 мкг/дозу, более предпочтительно 0-250 мкг/дозу, а наиболее предпочтительно 0-100 мкг/дозу. Используемый здесь термин «MF59-0» означает вышеуказанную субмикронную эмульсию типа «масло в воде», не содержащую MTP-PE, а термин «MF59-MTP» означает препарат, содержащий MTP-PE. Так, например, «MF59-100» содержит 100 мкг MTP-PE на дозу и т.п. MF69, то есть другая субмикронная эмульсия типа «масло в воде», используемая в настоящем изобретении, содержит 4,3% масс./об. сквалена, 0,25% масс./об. твин™ 80 и 0,75% масс./об. SPAN 85™ и, необязательно, MTP-PE. Еще одной субмикронной эмульсией типа «масло в воде» является MF75, также известная как SAF, содержащая 10% сквален, 0,4% твин™ 80, 5% блокированный плюроником полимер L121 и thr-MDP, где указанная эмульсия была также получена с помощью микрофлюидизатора. MF75-MTP означает препарат MF75, который содержит MTP, такой как 100-400 мкг MTP-PE на дозу.
Субмикронные эмульсии типа «масло в воде», методы их получения и иммуностимулирующие агенты, такие как мурамиловые пептиды, используемые в данных композициях, подробно описаны в WO90/14837 и в патентах США №№ 6299884 и 6451325.
В настоящем изобретении в качестве адъювантов могут быть также использованы полный адъювант Фрейнда (ПАФ) и неполный адъювант Фрейнда (НАФ).
C. Сапонинсодержащие препараты
В настоящем изобретении в качестве адъювантов могут быть также использованы сапонинсодержащие препараты. Сапонины представляют собой гетерологичную группу гликозидов стирола и тритерпеноидных гликозидов, обнаруженных в коре, листьях, стеблях, корнях и даже в цветках растений широкого ряда. Сапонины, выделенные из коры мыльного дерева Quillaia saponaria, хорошо изучены и широко используются в качестве адъювантов. Сапонины могут быть также получены промышленным способом из Smilax ornata (сарсаприллы), Gypsophilla paniculata (качима метельчатого или перекати-поле) и Saponaria officianalis (корня мыльного дерева). Препараты, содержащие сапониновый адъювант, представляют собой очищенные препараты, такие как QS21, а также липидные препараты, такие как ISCOM.
Сапониновые композиции очищали с помощью высокоэффективной тонкослойной хроматографии (ВЭ-ТСХ) и обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ). Были идентифицированы конкретные очищенные фракции, полученные указанными методами, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительным сапонином является QS21. Метод получения QS21 описан в патенте США № 5057540. Сапониновые препараты могут также содержать стирол, такой как холестерин (см. WO96/33739).
Могут быть использованы комбинации сапонинов и холестеринов в форме уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM). ISCOM также обычно включают фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. В комплексах ISCOM может также содержаться любой известный сапонин. ISCOM предпочтительно включает один или несколько соединений, таких как Quil A, QHA и QHC. ISCOM также описаны в EP0109942, WO96/11711 и WO96/33739. Могут быть также получены, но необязательно, ISCOM, не содержащие дополнительного(ых) детергента(ов). См. WO00/07621.
Описание получения сапониновых адъювантов можно найти в публикации Barr et al., Advanced Drug Delivery Reviews (1998) 32:247-271. См. также Sjolander, et al., Advanced Drug Delivery Reviews (1998) 32:321-338.
D. Виросомы и вирусоподобные частицы (VLP)
В настоящем изобретении в качестве адъювантов могут быть также использованы виросомы и вирусоподобные частицы (VLP). Такие структуры обычно содержат один или несколько вирусных белков, необязательно объединенных с фосфолипидом или полученных в виде композиции с фосфолипидом. Обычно они являются непатогенными, нереплицирующимися и по существу не содержат какого-либо нативного вирусного генома. Вирусные белки могут быть рекомбинантно продуцированы или выделены из целых вирусов. Такими вирусными белками, подходящими для их использования в виросомах или VLP, являются белки, происходящие от вируса гриппа (такие как HA или NA), вируса гепатита B (такие как коровые или капсидные белки), вируса гепатита E, вируса кори, вируса Синдбис, ротавируса, вируса, вызывающего ящур, ретровируса, вируса Норфолк, вируса человеческой папилломы, ВИЧ, РНК-фагов, Qβ-фага (такие как белки оболочки), GA-фага, fr-фага, фага AP205 и Ty (такие как ретротранспозонный белок Ty p1). VLP подробно обсуждаются в заявках WO03/024480, WO03/024481 и в публикациях Niikura et al., Virology (2002) 293:273-280; Lenz et al., Journal of Immunology (2001) 5246-5355; Pinto, et al., Journal of Infectious Diseases (2003) 188:327-338; и Gerber et al., Journal of Virology (2001) 75(10):4752-4760. Виросомы подробно обсуждаются, например, в публикации Gluck et al., Vaccine (2002) 20:B10-B16. Иммунопотенцирующие виросомы на основе реконструированного вируса гриппа (IRIV), которые перед их использованием подвергают разведению, применяются в качестве системы для доставки субъединичного антигена, полученной в виде трехвалентного продукта INFLEXAL™ для интраназального введения (Mischler & Metcalfe (2002) Vaccine 20 Suppl 5:B17-23) и продукта INFLUVAC PLUS™.
E. Бактериальные или микробные производные
Адъювантами, подходящими для использования в настоящем изобретении, являются бактериальные и микробные производные, такие как:
(1) Нетоксичные производные энтеробактериального липополисахарида (ЛПС)
Такими производными являются монофосфориллипид A (MPL) и 3-O-деацилированный MPL (3dMPL). 3dMPL представляет собой смесь из 3 De-O-ацилированных монофосфориллипидов A с 4, 5 или 6 ацилированными цепями. Предпочтительная «небольшая частица», состоящая из 3 De-O-ацилированного монофосфориллипида A, описана в EP 0689454. Такие «небольшие частицы» из 3dMPL имеют небольшой размер, достаточный для их стерильной фильтрации через мембрану в 0,22 микрона (см. EP 0689454). Другими нетоксичными производными ЛПС являются имитаторы монофосфориллипида А, такие как фосфатные производные аминоалкилглюкозаминида, например, RC 529. См. Johnson et al. (1999) Bioorg Med Chem Lett 9:2273-2278.
(2) Производные липида А
Производными липида A являются производные липида А, происходящие от Escherichia coli, такие как OM-174. OM-174 описан, например, в публикации Meraldi et al., Vaccine (2003) 21:2485-2491; и Pajak, et al., Vaccine (2003) 21:836-842.
(3) Иммуностимулирующие олигонуклеотиды
Иммуностимулирующими олигонуклеотидами, подходящими для их использования в настоящем изобретении в качестве адъювантов, являются нуклеотидные последовательности, содержащие мотив CpG (последовательность, содержащую неметилированный цитозин, за которым следует гуанозин, и связанную фосфатной связью). Было также показано, что бактериальные двухцепочечные РНК или олигонуклеотиды, содержащие палиндромные или поли(dG)-последовательности, обладают иммуностимулирующим действием.
CpG могут включать нуклеотидные модификации/аналоги, такие как фосфортиоатные модификации, и могут быть двухцепочечными или одноцепочечными. Гуанозин может быть, но необязательно, заменен его аналогом, таким как 2'-дезокси-7-деазагуанозин. Примеры возможных аналогов с заменами можно найти в публикации Kandimalla, et al., Nucleic Acids Research (2003) 31(9): 2393-2400; WO02/26757 и WO99/62923. Адъювантное действие CpG-олигонуклеотидов подробно обсуждается в публикации Krieg, Nature Medicine (2003) 9(7): 831-835; McCluskie, et al., FEMS Immunology and Medical Microbiology (2002) 32:179-185; WO98/40100; в патенте США № 6207646; в патенте США № 6239116 и в патенте США № 6429199.
Действие последовательности CpG, такой как мотив GTCGTT или TTCGTT, может быть направлено на TLR9. См. Kandimalla, et al., Biochemical Society Transactions (2003) 31 (part 3): 654-658. Последовательность CpG, такая как CpG-A ODN, может специфически индуцировать иммунный Th1-ответ, а последовательность CpG-B ODN может обладать большей специфичностью в отношении индуцирования В-клеточного ответа. CpG-A и CpG-B ODN обсуждаются в публикации Blackwell, et al., J. Immunol. (2003) 170(8):4061-4068; Krieg, TRENDS in Immunology (2002) 23(2):64-65 и WO01/95935. Предпочтительным CpG является CpG-A ODN.
CpG-олигонуклеотид предпочтительно конструируют так, чтобы его 5'-конец был доступен для распознавания рецептора. Две CpG-олигонуклеотидных последовательности могут быть, но необязательно, присоединены по своим 3'-концам с образованием «иммуномеров». См., например, Kandimalla, et al., BBRC (2003) 306:948-953; Kandimalla, et al., Biochemical Society Transactions (2003) 31(part 3):664-658; Bhagat et al., BBRC (2003) 300:853-861 и WO03/035836.
(4) АДФ-рибозилирующие токсины и их детоксифицированные производные
В настоящем изобретении в качестве адъювантов могут быть использованы бактериальные АДФ-рибозилирующие токсины и их детоксифицированные производные. Предпочтительным белком является белок, происходящий от E.coli (то есть термолабильного энтеротоксина E.coli «LT»), холерного токсина («CT») или коклюшного токсина («PT»). Использование детоксифицированных АДФ-рибозилирующих токсинов в качестве адъювантов для введения в слизистую описано в WO95/17211, а в качестве адъювантов для парентерального введения - в WO98/42375. Предпочтительным адъювантом является детоксифицированный мутант LT, такой как LT-K63, LT-R72 и LTR192G. Применение АДФ-рибозилирующих токсинов и их детоксифицированных производных, в частности, LT-K63 и LT-R72, в качестве адъювантов, описано в нижеследующих работах: Beignon et al., Infection and Immunity (2002) 70(6):3012-3019; Pizza, et al., Vaccine (2001) 19:2534-2541; Pizza, et al., Int. J. Med. Microbiol (2000) 290(4-5):455-461; Scharton-Kersten et al., Infection and Immunity (2000) 68(9):5306-5313; Ryan et al., Infection and Immunity (1999) 67(12):6270-6280; Partidos et al., Immunol. Lett. (1999) 67(3):209-216; Peppoloni et al., Vaccines (2003) 2(2):285-293; and Pine et al., (2002) J. Control Release (2002) 85(1-3):263-270. Система нумерации аминокислотных замен была основана предпочтительно на выравнивании последовательностей субъединиц A и B АДФ-рибозилирующих токсинов, описанных в публикации Domenighini et al., Mol. Microbiol. (1995) 15(6):1165-1167.
F. Биоадгезивы и мукоадгезивы
В настоящем изобретении в качестве адъювантов могут быть также использованы биоадгезивы и мукоадгезивы. Подходящими биоадгезивами являются микросферы с этерифицированной гиалуроновой кислотой (Singh et al. (2001) J. Cont. Rele. 70:267-276) или мукоадгезивы, такие как перекрестно-связанные производные полиакриловой кислоты, поливинилового спирта, поливинилпирролидона, полисахаридов и карбоксиметилцеллюлозы. В настоящем изобретении в качестве адъювантов могут быть также использованы хитозан и его производные. См. WO99/27960.
G. Микрочастицы
В настоящем изобретении в качестве адъювантов могут быть также использованы микрочастицы. Микрочастицы (то есть частицы диаметром от ~100 нм до ~150 мкм, более предпочтительно от ~200 нм до ~30 мкм, а наиболее предпочтительно от ~500 нм до ~10 мкм), полученные из материалов, которые являются биологически разлагаемыми и нетоксичными (например, поли(α-гидроксикислоты), полигидроксимасляной кислоты, полиортоэфира, полиангидрида, поликапролактона и т.п.), предпочтительно из сополимера лактида и гликолида, могут быть, но необязательно, обработаны так, чтобы они имели отрицательно заряженную поверхность (например, додецилсульфатом натрия (ДСН)) или положительно заряженную поверхность (например, катионным детергентом, таким как CTAB).
H. Липосомы
Примеры липосомных препаратов, которые могут быть использованы в качестве адъювантов, описаны в патенте США № 6090406, в патенте США № 5916588 и EP 0626169.
I. Препараты, содержащие полиоксиэтиленэфир и сложный полиоксиэтиленэфир
Адъювантами, подходящими для их использования в настоящем изобретении, являются полиоксиэтиленэфиры и сложные полиоксиэтиленэфиры. См. WO99/52549. Такие препараты также включают поверхностно-активные вещества, а именно сложный эфир полиоксиэтиленсорбитана в комбинации с октоксинолом (WO01/21207), а также поверхностно-активные вещества, такие как полиоксиэтиленалкиловые эфиры или сложные эфиры в комбинации по меньшей мере с одним дополнительным неионогенным поверхностно-активным веществом, таким как октоксинол (WO01/21152).
Предпочтительные полиоксиэтиленэфиры выбраны из следующей группы: полиоксиэтилен-9-лаурилового эфира (лаурета 9), полиоксиэтилен-9-стеарилового эфира, полиоксиэтилен-8-стеарилового эфира, полиоксиэтилен-4-лаурилового эфира, полиоксиэтилен-35-лаурилового эфира и полиоксиэтилен-23-лаурилового эфира.
J. Полифосфазен (PCPP)
Препараты PCPP описаны, например, в публикации Andrianov et al., "Preparation of hydrogel microspheres by coacervation of aqueous polyphophazene solutions", Biomaterials (1998) 19(1-3): 109-115 и Payne et al., "Protein Release from Polyphosphazene Matrices", Adv. Drug. Delivery Review (1998) 31(3):185-196.
K. Мурамиловые пептиды
Примерами мурамиловых пептидов, подходящих для их использования в качестве адъювантов согласно изобретению, являются N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-l-аланил-d-изоглутамин (nor-MDP) и N-ацетилмурамил-l-аланил-d-изоглутаминил-l-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин, MTP-PE).
L. Имидазохинолиновые соединения
Примерами имидазохинолиновых соединений, подходящих для их использования в настоящем изобретении в качестве адъювантов, являются имихимод и его аналоги, подробно описанные в публикации Stanley, Clin. Exp. Dermatol. (2002) 27(7):571-577; Jones, Curr Opin Investig Drugs (2003) 4(2):214-218; и в патентах США 4689338, 5389640, 5268376, 4929624, 5266575, 5352784, 5494916, 5482936, 5346905, 5395937, 5238944 и 5525612.
M. Тиосемикарбазоновые соединения
Примеры тиосемикарбазоновых соединений, а также методы получения, приготовления и скрининга всех соединений, подходящих для их использования в настоящем изобретении в качестве адъювантов, описаны в WO04/60308. Тиосемикарбазоны являются особенно эффективными при стимуляции человеческих мононуклеарных клеток периферической крови для продуцирования цитокинов, таких как TNF-α.
N. Триптантриновые соединения
Примеры триптантриновых соединений, а также методы получения, приготовления и скрининга всех соединений, подходящих для их использования в настоящем изобретении в качестве адъювантов, описаны в WO04/64759. Триптантриновые соединения являются особенно эффективными при стимуляции человеческих мононуклеарных клеток периферической крови для продуцирования цитокинов, таких как TNF-α.
Настоящее изобретение может также включать комбинации аспектов, относящихся к одному или нескольким адъювантам, идентифицированным выше. Так, например, в настоящем изобретении могут быть использованы нижеследующие композиции адъювантов, такие как:
(1) сапонин и эмульсия типа «масло в воде» (WO99/11241);
(2) сапонин (например, QS21) + нетоксичное производное ЛПС (например, 3dMPL) (см. WO94/00153);
(3) сапонин (например, QS21) + нетоксичное производное ЛПС (например, 3dMPL) + холестерин;
(4) сапонин (например, QS21) + 3dMPL + IL12 (необязательно, + стирол) (WO98/57659);
(5) комбинации 3dMPL, например, с QS21 и/или эмульсиями типа «масло в воде» (см. Европейские патентные заявки 0835318, 0735898 и 0761231);
(6) SAF, содержащая 10% сквалан, 0,4% твин 80, 5% блокированный плюроником полимер L121 и thr-MDP, и либо приготовленная в виде субмикронной эмульсии с помощью микрофлюидизатора, либо тщательно перемешанная с образованием эмульсии из частиц более крупного размера;
(7) система адъювантов RIBI™ (RAS), (Ribi Immunochem), содержащая 2% сквален, 0,2% твин 80 и один или несколько бактериальных клеточных компонентов, выбранных из группы, состоящей из монофосфориллипида A (MPL), димиколята трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно, MPL+CWS (DETOX™); и
(8) одна или несколько минеральных солей (таких как соль алюминия) + нетоксичное производное ЛПС (такое как 3dPML).
(9) одна или несколько минеральных солей (таких как соль алюминия) + иммуностимулирующий олигонуклеотид (такой как нуклеотидная последовательность, включающая мотив CpG).
O. Человеческие иммуномодуляторы
Человеческими иммуномодуляторами, подходящими для использования в качестве адъювантов в настоящем изобретении, являются цитокины, такие как интерлейкины (например IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.п.), интерфероны (например, интерферон-γ), макрофагальный колониестимулирующий фактор и фактор некроза опухоли.
Предпочтительными адъювантами, используемыми в вакцинах на основе вируса гриппа, вводимых путем инъекции, являются соли алюминия и MF59. Предпочтительными адъювантами, используемыми в вакцинах, вводимых через слизистую, таких как вакцина для интраназального введения, являются бактериальные токсины и биоадгезивы.
Содержание всех цитируемых выше патентов, патентных заявок и журнальных статей во всей своей полноте вводятся в настоящее описание посредством ссылки.
Терапевтические методы
Настоящее изобретение относится к вышеописанным композициям, используемым в терапии. Настоящее изобретение относится к вышеописанным композициям, используемым для индуцирования или усиления иммунного ответа на S. pyogenes. Настоящее изобретение относится к способам индуцирования или усиления иммунного ответа на S. pyogenes, проводимым с использованием вышеописанных композиций. Иммунный ответ является предпочтительно протективным и может включать вырабатывание антител и/или вырабатывание клеточно-опосредуемого иммунного ответа (включая вырабатывание системного иммунитета и защитных свойств слизистых оболочек). Иммунные ответы включают вторичные иммунные ответы.
Подросткам и детям, включая младенцев и детей младшего возраста, может быть введена вакцина в целях профилактики; а подросткам или взрослым обычно вводят терапевтические вакцины. Вакцина, предназначенная для детей, может быть также введена взрослым для оценки ее безопасности и для определения дозы, иммуногенности и т.п.
Заболеваниями, вызываемыми Streptococcus pyogenes, которые могут быть предупреждены или подвергнуты лечению в соответствии с настоящим изобретением, являются, но не ограничиваются ими, фарингит (такой как заболевание горла, вызываемое стрептококками), скарлатина, импетиго, рожа, целлюлит, сепсис, синдром токсического шока, некрозирующий фасцит и их осложнения, такие как ревматическая лихорадка и острый гломерулонефрит. Эти композиции могут быть также эффективными против других стрептококковых бактерий, например GBS.
Тесты для определения эффективности иммунного ответа
Один из способов оценки эффективности терапевтического лечения включает мониторинг GAS-инфекции после введения композиции согласно изобретению. Один из способов оценки эффективности профилактического лечения включает мониторинг иммунных ответов на мутантные антигены GAS57, присутствующие в композициях согласно изобретению, после введения такой композиции.
Другим способом оценки иммуногенности белков-компонентов иммуногенных композиций согласно изобретению является рекомбинантное продуцирование антигенов мутантного GAS57 и скрининг сыворотки или секрета слизистой пациента с помощью иммуноблот-анализа. Положительная реакция между белком и сывороткой пациента указывает на то, что у данного пациента ранее вырабатывался иммунный ответ на рассматриваемый белок, то есть указанный белок является иммуногеном. Такой метод может быть также применен для идентификации иммунодоминантных белков и/или эпитопов.
Другой способ оценки эффективности терапевтического лечения включает мониторинг GAS-инфекции после введения композиции согласно изобретению. Один из способов оценки профилактического лечения включает мониторинг как системных иммунных ответов (такой как мониторинг уровня продуцирования IgG1 и IgG2a), так и защитной реакции слизистых оболочек (такой как мониторинг уровня продуцирования IgA) против GAS57 после введения данной композиции. Обычно сероспецифические гуморальные ответы определяют после иммунизации, но до антигенной стимуляции, а специфические гуморальные ответы слизистой определяют после иммунизации и после антигенной стимуляции.
Перед введением вакцинных композиций согласно изобретению хозяину, например человеку, эти композиции могут быть оценены in vitro и in vivo на моделях животных. Особенно ценными мышиными моделями являются модели, которые подвергают внутрибрюшинной иммунизации с последующим внутрибрюшинным или интраназальным заражением.
Эффективность иммуногенных композиций согласно изобретению может быть также определена in vivo путем инфицирования животных-моделей антигеном GAS, например, путем инфицирования морских свинок или мышей иммуногенными композициями. Иммуногенные композиции могут происходить, а могут и не происходить от тех же серотипов, которые используются для контрольного заражения.
Моделями для определения эффективности in vivo являются, но не ограничиваются ими: (i) мышиная модель, инфицированная человеческими серотипами GAS; (ii) мышиная модель заболевания, представляющая собой мышиную модель, инфицированную штаммом GAS, адаптированным для мышей, таким как штамм M23, который является особенно вирулентным у мышей, и (iii) модель-примат, инфицированная человеческими изолятами GAS.
Иммунным ответом может быть один из иммунных Th1- и Th2-ответов или оба этих ответа. Иммунным ответом может быть улучшенный, или усиленный, или измененный иммунный ответ. Иммунным ответом может быть один из системных иммунных ответов и иммунных реакций в слизистой или оба эти ответа. Предпочтительным иммунным ответом является усиленный системный ответ и/или ответ слизистой.
Усиленный системный ответ и/или ответ слизистой определяется как усиленный иммуный Th1- и/или Th2-ответ. Предпочтительным иммунным ответом является усиление продуцирования IgG1 и/или IgG2a и/или IgA.
Предпочтительным иммунным ответом слизистой является иммунный Th2-ответ. Предпочтительным иммунным ответом слизистой является усиление продуцирования IgA.
Активированные Th2-клетки усиливают продуцирование антител, а поэтому они играют важную роль в вырабатывании ответа на внеклеточные инфекции. Активированные Th2-клетки могут секретировать один или несколько IL-4, IL-5, IL-6 и IL-10. Иммунный Th2-ответ может приводить к продуцированию IgG1, IgE, IgA и В-клеток памяти с последующим обеспечением защиты.
Иммунный Th2-ответ может включать одно или несколько событий увеличения уровней одного или нескольких цитокинов, ассоциированных с иммунным Th2-ответом (таких как IL-4, IL-5, IL-6 и IL-10), или увеличения уровней продуцирования IgG1, IgE, IgA и В-клеток памяти. Предпочтительным усиленным иммунным Th2-ответом является увеличение уровня продуцирования IgG1.
Иммунный Th1-ответ может включать одно или несколько событий увеличения уровня ЦТЛ, увеличения уровней одного или нескольких цитокинов, ассоциированных с иммунным Th1-ответом (таких как IL-2, IFN-γ и TNFβ), увеличения уровня активированных макрофагов, увеличения активности клеток-киллеров (NK) или увеличения уровня продуцирования IgG2a. Предпочтительный усиленный иммунный Th1-ответ включает увеличение уровня продуцирования IgG2a.
Иммуногенные композиции согласно изобретению, в частности иммуногенная композиция, содержащая один или несколько мутантных антигенов GAS57 согласно изобретению, могут быть использованы отдельно или в комбинации с другими антигенами GAS, необязательно в присутствии иммунорегуляторного агента, обладающего способностью вырабатывать Th1- и/или Th2-ответ.
Настоящее изобретение также включает иммуногенную композицию, содержащую один или несколько иммунорегуляторных агентов, таких как минеральная соль, например соль алюминия, и олигонуклеотид, содержащий мотив CpG. Наиболее предпочтительно иммуногенная композиция включает соль алюминия и олигонуклеотид, содержащий мотив CpG. Альтернативно иммуногенная композиция включает АДФ-рибозилирующий токсин, такой как детоксифицированный АДФ-рибозилирующий токсин, и олигонуклеотид, содержащий мотив CpG. Предпочтительно один или несколько иммунорегуляторных агентов включают адъювант. Адъювант может быть выбран из одной или нескольких групп, состоящих из адъюванта Th1 и адъюванта Th2.
Композиции согласно изобретению предпочтительно вырабатывают клеточно-опосредуемый иммунный ответ, а также гуморальный иммунный ответ, необходимый для эффективной борьбы с GAS-инфекцией. Такой иммунный ответ предпочтительно индуцирует пролонгированное вырабатывание антител (например, нейтрализующих антител) и клеточно-опосредуемый иммунитет, который может быстро вырабатываться в ответ на обработку одним или несколькими антигенами GAS.
В одном из особенно предпочтительных вариантов изобретения иммуногенная композиция содержит один или несколько мутантных антигенов GAS57, которые вырабатывают ответ в виде нейтрализующих антител, и один или несколько мутантных антигенов GAS57, которые вырабатывают клеточно-опосредуемый иммунный ответ. Таким образом, ответ, вырабатываемый в виде нейтрализующих антител, обеспечивает предупреждение или ингибирование GAS-инфекции на ранней стадии, а клеточно-опосредуемый иммунный ответ, способный усиливать клеточный Th1-ответ, обеспечивает предупреждение последующего распространения GAS-инфекции.
Композиции согласно изобретению обычно вводят непосредственно пациенту. Композиции согласно изобретению могут быть введены отдельно или как часть композиции различными способами. Для некоторых композиций могут оказаться предпочтительными способы, которые приводят к вырабатыванию более эффективного иммунного ответа, а предпочтительно CMI-ответа, либо к снижению вероятности возникновения побочных эффектов или к облегчению введения.
Методами доставки являются парентеральная инъекция (например, подкожная, внутрибрюшинная, внутривенная, внутримышечная или интерстициальная инъекция), а также ректальное введение, пероральное введение (например, в виде таблетки, спрея), вагинальное введение, местное нанесение, трансдермальное введение (например, см. WO 99/27961), чрескожное введение (например, см. WO02/074244 и WO02/064162), интраназальное введение (например, см. WO03/028760), офтальмическое введение, внутриушное введение, введение в легкие или введение в другие слизистые оболочки.
Так, например, композиции согласно изобретению могут быть введены системно, через слизистую или трансдермально, либо они могут быть введены непосредственно в конкретную ткань. Используемый здесь термин «системное введение» включает, но не ограничивается ими, любые способы парентерального введения. В частности, парентеральное введение включает, но не ограничивается ими, подкожную, внутрибрюшинную, внутривенную, внутриартериальную, внутримышечную или интрастернальную инъекцию, а также внутривенное введение, внутриартериальное введение или вливание посредством почечного диализа. Предпочтительным системным, парентеральным введением является внутримышечная инъекция. Используемый здесь термин «введение в слизистую» включает, но не ограничивается ими, пероральное, интраназальное, интравагинальное, интраректальное, интратрахеальное, внутрикишечное и офтальмическое введение.
Лечение может быть проведено по схеме однократного приема лекарственного средства или по схеме введения многократных доз. Многократные дозы могут быть использованы в схеме первичной иммунизации и/или в схеме бустер-иммунизации. В схеме введения многократных доз различные дозы могут быть введены одинаковыми или различными способами, например, сначала парентерально, а затем в слизистую, или сначала в слизистую, а затем парентерально и т.п.
Композиции согласно изобретению могут быть получены в различных формах. Так, например, композиция может быть получена в виде препарата для инъекций, либо в виде жидкого раствора или суспензии. Композиция может быть также получена в твердой форме, подходящей для растворения или суспендирования в жидких носителях с последующей ее инъекцией (например, лиофилизованная композиция). Может быть получена композиция для перорального введения, например, в виде таблетки или капсулы, либо в виде спрея или сиропа (необязательно ароматизированного). Может быть получена композиция в виде тонкодисперсного порошка или спрея для внутрилегочного введения, например, с помощью ингалятора. Композиция может быть получена в виде суппозиториев или пессариев. Может быть получена композиция для интраназального, внутриушного или офтальмического введения, например, в виде капель. Композиция может поставляться в наборе, приготовленном так, чтобы комбинированная композиция могла быть разведена непосредственно перед ее введением пациенту. Такие наборы могут содержать один или несколько мутантных GAS57 или других антигенов в жидкой форме и один или несколько лиофилизованных антигенов.
Иммуногенные композиции, используемые в качестве вакцин, содержат иммунологически эффективное количество мутантного GAS57 или других антигенов (или молекул нуклеиновой кислоты, кодирующих такие антигены), а также любых других компонентов, если это необходимо, таких как антибиотики. Термин «иммунологически эффективное количество» означает количество, которое при его введении индивидууму в разовой дозе или в дробных дозах усиливает детектируемый иммунный ответ, либо предупреждает или ослабляет клинические симптомы.
Иммуногенные композиции согласно изобретению могут быть введены по схеме комбинированного лечения вместе с антибиотиками. В одном из вариантов изобретения антибиотик вводят до введения антигена согласно изобретению или композиции согласно изобретению, содержащей один или несколько мутантных антигенов GAS57.
В другом варианте изобретения антибиотик вводят после введения мутантного антигена GAS57 согласно изобретению. Примерами антибиотиков, подходящих для их применения в лечении заболевания, вызываемого GAS-инфекцией, являются, но не ограничиваются ими, пенициллин или его производное, или клиндамицин, цефалоспорины, гликопептиды (например, ванкомицин) и циклосерин.
Однако количество активного агента в композиции варьируется в зависимости от состояния здоровья и физического состояния индивидуума, подвергаемого лечению, возраста, таксономической группы индивидуума, подвергаемого лечению (например, примата, не являющегося человеком; примата и т.п.), способности иммунной системы индивидуума синтезировать антитела, степени требуемой защиты, состава вакцины, оценки лечащим врачом санитарного состояния и других релевантных факторов. Такое количество может варьироваться в относительно широких пределах и может быть определено путем проведения рутинных испытаний.
Наборы
Настоящее изобретение также относится к наборам, содержащим один или несколько контейнеров, включающих композиции согласно изобретению. Композиции могут быть приготовлены в жидкой форме, либо они могут быть лиофилизованными, в частности, как отдельные антигены. Подходящими контейнерами для композиций являются, например, бутыли, сосуды, шприцы и тест-пробирки. Такие контейнеры могут быть изготовлены из ряда материалов, включая стекло или пластик. Контейнер может иметь стерильное входное отверстие (например, таким контейнером может быть пакет с раствором для внутривенного введения или сосуд с крышкой, протыкаемой иглой для подкожных инъекций).
Такой набор может также содержать второй контейнер, включающий фармацевтически приемлемый буфер, такой как забуференный фосфатом физиологический раствор, раствор Рингера или раствор декстрозы. Набор может также содержать и другие вещества, полезные для потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы. Такой набор может также включать второй или третий контейнер с другим активным веществом, например, с антибиотиком.
Набор может также содержать вкладыш, вложенный в упаковку, на котором отпечатаны инструкции по способу вырабатывания иммунитета к S. pyogenes или по способу лечения инфекций, вызываемых S. pyogenes. Вкладыш, вложенный в упаковку, может представлять собой неутвержденный проект аннотации-вкладыша, либо он может быть одобрен Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) или другими Регуляторными органами.
Все патенты, патентные заявки и работы, цитируемые в настоящей заявке, во всей своей полноте вводятся в настоящее описание посредством ссылки. Выше приводится лишь общее описание настоящего изобретения. Более подробное описание изобретения представлено в нижеследующих конкретных примерах, которые приводятся лишь в целях иллюстрации и не должны рассматриваться как ограничение объема изобретения.
Пример 1
Очищенный рекомбинантный GAS57 дикого типа расщепляет IL-8 и другие цитокины CXC
GAS57 дикого типа был экспрессирован и выделен из E.coli в виде His-меченного или немеченного белка. Все варианты были экспрессированы без N-концевой лидерной последовательности и без C-концевого трансмембранного домена (см. SEQ ID NO:78 и 79). Более конкретно, ген gas57 был ПЦР-амплифицирован из генома M1_SF370 с использованием следующих праймеров:
57F, GTGCGT CATATG GCAGATGAGCTAAGCA (SEQ ID NO:69)
57R, GCGT CTCGAG GGCTTTTGCTGTTGCTGAGGT (SEQ ID NO:70)
57stopR, GCGT CTCGAG TTAGGCTTTTGCTGTTGCTGAGGT (SEQ ID NO:71).
Праймеры 57F и 57R были использованы для получения His-меченной формы, а праймеры 57F и 57stopR были использованы для получения немеченной формы. ПЦР-продукты гидролизовали ферментами NdeI-XhoI и лигировали с плазмидами pET21b+ и pet24b+, соответственно, расщепленными теми же самыми ферментами.
Электрокомпетентные клетки BL21(DE3) E.coli трансформировали путем проведения реакций лигирования. Резистентные к канамицину колонии, несущие плазмиду с «правильной» вставкой (pET21_57his и pET24_57), идентифицировали с помощью ПЦР колоний, и ген GAS57 секвенировали из одного из позитивных клонов.
Позитивный клон, экспрессирующий GAS57, культивировали в жидкой культуре при 25°C с перемешиванием, и рекомбинантные белки экспрессировали путем их добавления к культуре с 1 мМ IPTG. Очистку His-меченного белка GAS57 осуществляли с помощью аффинной хроматографии на ионах металлов (IMAC). Очистку немеченной формы GAS57 проводили за три стадии хроматографии: ионообменной хроматографии (на Q-сефарозе HP), хроматографии на гидроксиапатитах и гель-фильтрации. На фиг. 7 и 8 проиллюстрированы анализы очищенных белков дикого типа, проводимые с помощью электрофореза в ПААГ с ДСН.
Для анализа протеолитической активности GAS57, IL-8 инкубировали с двумя различными концентрациями GAS57 в течение длительного периода времени и проводили электрофорез в полиакриламидном геле с ДСН для подтверждения превращения исходного 8 кДа-белка IL-8 в расщепленный неактивный 6 кДа-белок. Результаты представлены на фиг. 1.
На фиг. 12 представлены результаты аналогичных экспериментов, в которых различные хемокины (10 мкг/мл) инкубировали в присутствии или в отсутствие GAS57 (1 мкг/мл) при 37°C в течение 24 часов. Затем образцы подвергали электрофорезу в 18% полиакриламидном геле с ДСН.
Пример 2
Получение мутантов GAS57
При сравнении с протеазой C5a (фиг. 2) были идентифицированы три аминокислоты в GAS57, которые, предположительно, составляли каталитический сайт протеазы: D151, H279 и S617. Для получения неактивной формы фермента, в GAS57-кодирующую последовательность путем сплайсинга, проводимого с помощью ПЦР с перекрывающимся удлинением (SOE-PCR), были введены нуклеотидные замены, приводящие к аминокислотным заменам D151A и/или S617A.
Замена D151A
Были проведены три ПЦР-реакции:

Затем ПЦР-продукт 3 гидролизовали ферментами Nde-Sal и вводили в плазмиду pET21_57his, гидролизованную теми же ферментами. Клоны, содержащие «правильные» замены с сохранением рамки считывания (pET21_57his_D151A), отбирали путем секвенирования ДНК.
Замена S617A
Были проведены три ПЦР-реакции:
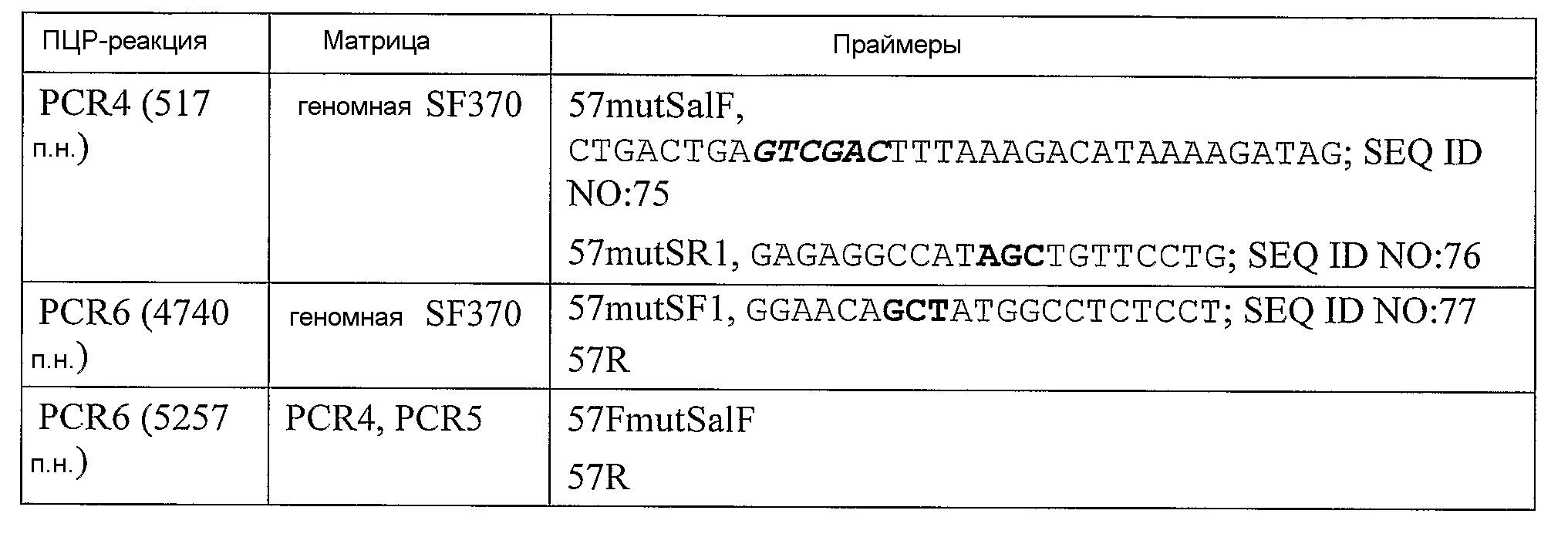
Затем ПЦР-продукт 6 гидролизовали ферментами Sal-Xho и вводили в плазмиду pET21_57his, гидролизованную теми же ферментами. Клоны, содержащие «правильные» замены с сохранением рамки считывания (pET21_57his_S617A), отбирали путем секвенирования ДНК.
Замена D151A+S617A
Затем ПЦР-продукт 6 гидролизовали ферментами Sal-Xho и вводили в плазмиду pET21_57his_D151A, гидролизованную теми же ферментами. Клоны, содержащие «правильные» замены с сохранением рамки считывания (pET21_57his_D151A+S617A), отбирали путем секвенирования ДНК.
Мутантные белки с одной и с двумя модификациями были экспрессированы и очищены, как описано выше для GAS57 дикого типа в примере 1.
Пример 3
Точковая мутация D151A приводит к инактивации протеолитической активности GAS57
D151A-мутантный GAS57 был экспрессирован как рекомбинантный His-меченный белок. Анализы двух типов показали, что этот мутант терял свою способность расщеплять IL-8.
Электрофорез в ДСН-ПААГ
IL-8 инкубировали с GAS57 дикого типа или с D151A-мутантным GAS57. Инкубационные смеси наносили на ДСН-ПААГ и проявляли путем окрашивания серебром. Результаты представлены на фиг. 3. GAS57 дикого типа (дорожки 2 и 3) давал две полосы: 8 кДа (активная форма) и 6 кДа (неактивный расщепленный IL-8). В противоположность этому D151A-мутантный GAS57 давал только одну полосу, которая соответствовала нерасщепленному IL-8, как в контрольной реакции (в отсутствие фермента).
ELISA
IL-8 инкубировали с GAS57 дикого типа или с D151A-мутантным GAS57 в трех различных концентрациях, и инкубационные смеси тестировали на присутствие нерасщепленного IL-8 с использованием антитела, которое является специфичным для цитокина, но не обладает способностью распознавать расщепленную неактивную форму. На фиг.4 представлены результаты, выраженные в процентах нерасщепленного IL-8 после проведения реакции в течение 0, 8 и 24 часов, и вычисленные по формуле:
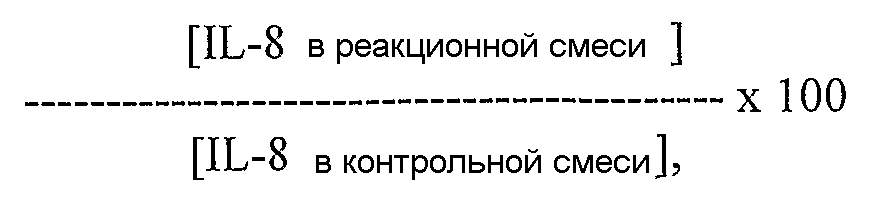
где «контрольная смесь» означает реакционную смесь, не содержащую фермента на время 0.
Как показано на фиг. 4, GAS57 дикого типа почти полностью инактивировал IL-8 через 8 часов даже при более низких концентрациях, но при этом какой-либо инактивации IL-8, обработанного мутантным ферментом, не наблюдалось.
Пример 4
S617A-мутантный GAS57 и GAS57 с двойной мутацией D151A+S617A не расщеплял IL-8
S617A-мутантный GAS57 и GAS57 с двойной мутацией D151A+S617A были экспрессированы в виде His-меченных белков и протестированы в экспериментах на инактивацию IL-8, как описано в примере 2.
Электрофорез в ДСН-ПААГ
IL-8 инкубировали с GAS57 дикого типа (с His-меченным или немеченным) или с каждым из мутантных GAS57 с заменами D151A, S617A и D151AS+S617A в течение 24 часов. Инкубационные смеси наносили на полиакриламидный гель с ДСН и проявляли путем окрашивания серебром. Результаты двух экспериментов представлены на фиг. 5А и 5В. Как S617A-мутантный GAS57, так и мутантный GAS57 с заменами D151+S617A не обладал способностью расщеплять IL-8 даже в концентрации, которая в 100 раз превышала концентрацию GAS57 дикого типа.
ELISA
Для проведения ELISA-анализа использовали те же самые образцы, и этот анализ подтвердил, что замены одной и двух аминокислот приводят к подавлению способности GAS57 расщеплять IL-8. Результаты, представленные на фиг. 6, продемонстрировали, что после 24-часового инкубирования, под действием этих мутантов высвобождается 100% нерасщепленного IL-8, а под действием GAS57 дикого типа высвобождается 20-40% нерасщепленного IL-8.
Пример 5
Протективная способность мутантов GAS57 аналогична способности GAS57 дикого типа
Мутантный GAS57 с заменой D151A и мутантный GAS57 с заменами D151A+S617A использовали для иммунизации мышей в целях определения способности этих мутантов обеспечивать защиту от летального инфицирования GAS по сравнению с GAS57 дикого типа. Результаты двух экспериментов (в каждом по 20 мышей) систематизированы ниже и выражены как средний % выживаемости.
|
Пример 6
Очищенные инактивированные мутанты, в отличие от GAS57 дикого типа, представлены как один пептид, который существует только в форме двух нековалентно связанных фрагментов белка.
GAS57 дикого типа получали, главным образом, в форме двух фрагментов, один из которых имел размер примерно 23 кДа, а другой - 150 кДа. Эти два фрагмента не разделялись с помощью аффинной очистки на колонке с Ni, образующим хелатный комплекс, или с помощью гель-фильтрации, но были детектированы как две различных полосы на ПААГ с ДСН (фиг. 7). N-концевое секвенирование подтвердило, что 23 кДа-фрагмент представляет собой N-концевую часть GAS57 (аминокислоты 34-244 SEQ ID NO:1), а 150 кДа-фрагмент представляет собой C-концевую область (аминокислоты 245-1603 SEQ ID NO:1).
В отличие от GAS57 дикого типа, мутанты GAS57 согласно изобретению были получены как белки с более высокой молекулярной массой (174 кДа), а 23 кДа-полоса отсутствовала (см. фиг. 8, где представлены результаты эксперимента, в котором частично очищенные GAS57 дикого типа и мутантные GAS57 загружали на полиакриламидные гели с ДСН).
Пример 7
Дозозависимое ингибирование GAS57-опосредуемого расщепления IL-8 под действием поликлональной антисыворотки
Мышиную антисыворотку, специфичную к GAS57 дикого типа и к неактивным мутантам, получали путем иммунизации мышей CD1 очищенными рекомбинантными белками.
IL-8 (10 мкг/мл) инкубировали с GAS57 дикого типа в присутствии или в отсутствие антисыворотки против GAS57 (1:50 и 1:5000) при двух различных условиях: (1) 8-часовое инкубирование, 0,1 мкг/мл GAS57 и (2) 24-часовое инкубирование, 0,05 мкг/мл GAS57. Затем инкубационные смеси тестировали с помощью ELISA на присутствие нерасщепленного IL-8. Результаты, представленные на фиг. 9A и 9B, продемонстрировали дозозависимое ингибирование GAS57-опосредуемого расщепления IL-8 под действием мышиной антисыворотки.