Результат интеллектуальной деятельности: Вакцина против рота-, коронавирусной инфекции и эшерихиоза крупного рогатого скота
Вид РИД
Изобретение
Предлагаемое изобретение относится к ветеринарной микробиологии и вирусологии.
Вакцина содержит активное вещество и целевые добавки.
В качестве активного вещества вакцина содержит смесь инактивированной суспензии штамма ротавируса РМ, семейства Reoviridae, рода Rotavirus (справка о депонировании №193/19 от 04.02.2004 г), инактивированной суспензии штамма коронавируса КЛ-2 семейства Coronaviridae, рода Coronavirus (справка о депонировании №3064/37 от 02.06.1989 г), с активностью каждого из вирусных штаммов 105,5 - 106,5 ТЦД50 в см3 вакцины и адгезивных антигенов бактерий Escherichia coli, взятых в равном соотношении с концентрацией 50-100 млдр. микробных клеток в 1 см3 вакцины.
Вакцину рекомендуется применять в хозяйствах, неблагополучных по таким кишечным заболеваниям вирусно-бактериальной этиологии, как рота-, коронавирусная и колибактериозная инфекция телят.
Колибактериоз (эшерихиоз) - широко распространенное во всем мире инфекционное заболевание новорожденных сельскохозяйственных животных, проявляющееся в виде диареи, сепсиса и сопровождающееся высокой заболеваемостью, смертностью и снижением привесов у переболевших животных.
С другой стороны, массовые энтериты и энтероколиты новорожденных телят, обусловленные рота-, коронавирусами имеют высокую инцидентность с E.coli. В этой связи, важное значение придается активной иммунизации коров-матерей с целью получения от них молозива и молока с высоким уровнем антител против рота-, коронавируса и колибактериоза для
выпаивания новорожденным телятам и создания у них пассивного иммунитета к данным инфекциям.
Адгезивность микроорганизмов один из основных факторов патогенности. 60% циркулирующих в хозяйствах штаммов E.coli - возбудителей колибактериоза обладают различными адгезивными антигенами и их сочетаниями. Наиболее часто у телят обнаруживают адгезины К99, F41, Att25. Активная защита от факторов адгезии микроорганизмов с помощью специфических препаратов может быть особенно эффективна при кишечных инфекциях животных, особенно вызываемых E.coli.
В нашей стране были предложены серии коммерческих сорбированных инактивированных противовирусных вакцин - против ротавирусного энтерита телят «РОТА-ВАК ВИЭВ», вакцина инактивированная гидроокисьалюминиевая против коронавирусного энтерита крупного рогатого скота «КОР-ВАК ВИЭВ», вакцина ассоциированная инактивированная против ротавирусного, коронавирусного энтеритов телят и вирусной диареи крупного рогатого скота, «РОДИКОР-ВАК ВИЭВ» (Гулюкин М.И., Мникова Л.А., Ишкова Т.А., Соколова Н.Л., Жидков С.А. Разработка и внедрение в практику эффективной системы диагностики и профилактики вирусных желудочно-кишечных болезней крупного рогатого скота // Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 2015. Т. 78. С. 179-186).
Разработан ряд вакцин на основе адгезивных антигенов. В частности, в ВИЭВ предложена вакцина против колибактериоза молодняка сельскохозяйственных животных на основе адгезивных антигенов К99, К88ав, К88ас, К88ад, F41, Атт25, 987Р, а также конъюгата термостабильного (ST) и термолабильного (LT) энтеротоксинов эшерихий (Соколова Н.А., Головко А.Н., Курашвили Т.К. и др. Способ получения вакцины против колибактериоза сельскохозяйственных животных, патент RU 2053792, С1, 10.02.1996).
Вакцины обладали высокими иммуногенными свойствами и широким
спектром действия на отдельных возбудителей колибактериоза молодняка сельскохозяйственных животных - телят, поросят и ягнят.
Известна поливалентная вакцина с адгезивными антигенами против колибактериоза (эшерихиоза) телят, которая включает 50% антигенной части E.coli А20 (Атт25), E.coli F41, E.coli К88 (F4) E.coli К99 (F5) и 50% адъюванта Montanide ISA-206 (Амосова Л.А., Ломако Ю.В., Новикова О.Н., Зубовская И.В., Карпович В.К., Пукшлис А.И. Экспериментальные исследования по разработке технологии изготовления и применения вакцины поливалентной с адгезивными антигенами против колибактериоза (эшерихиоза) телят / Эпизоотология, иммунобиология, фармакология, санитария. - 2015. - №1. - С. 3-7.).
Была сконструированна ассоциированная вакцина против коронавирусной и ротавирусной инфекции, колибактериоза и клостридиоза телят - которая содержит инактивированные рота и коронавирусы крупного рогатого скота, инактивированные адгезинпродуцирующие штаммы E.coli с антигенами К99 и F41, бета-токсоид Clostridium perfringens тип С (штамм ВТ).
Все имеющиеся коммерческие вакцины включают в свой состав неполный спектр возбудителей диареи новорожденных телят, либо не все специфические адгезивные антигены, характерные для возбудителей эшерихиозов. В указанных вакцинах в качестве бактериального компонента использована инактивированная клеточная суспензия, представляющая смесь антигенов клеточной стенки, не отвечающих за колонизирующую способность бактерий.
Известна также ассоциированная инактивированная гидроокисьалюминиевая вакцина против рота-, -корона, герпесвирусной и эшерихиозной диареи новорожденных телят (Гаффаров Х.З., Спиридонов Ч.Н., Иванов А.В. и др. патент RU 2137499, С1, 10.02.2000)
Ассоциированная вакцина имеет низкую антигенную и иммуногенную активность вакцинных штаммов, и как следствие отсутствие иммунитета у
животных к эшерихиозу, протекающему в форме колидиареи и колиэнтеротоксемии.
Наиболее близкой по технической сущности, выбранной в качестве прототипа, является вакцина инактивированная против вирусной диареи, рота-, короновирусной болезни и эшерихиоза крупного рогатого скота (Патент RU №2403063 C1; А61К 39/295, А61Р 31/00; 28.08.2009) (прототип).
Комбинированная вакцина имеет относительно невысокий титр иммуногенной активности входящих в ее состав вирусных суспензий, наличие клеток эшерихий и перегруженности антигенами ее состава.
Задачей исследований являлось - получение вакцины с высокими иммуногенными свойствами, расширенным профилактическим спектром действия на кишечные инфекции телят вирусно-бактериальной этиологии.
Нами предложена вакцина, ассоциированная инактивированная против ротавирусного, коронавирусного энтерита и эшерихиоза крупного рогатого скота.
Сравнительный анализ заявляемого способа получения вакцины и прототипа показывает, что предлагаемая вакцина отличается тем, что в ее составе объединены очищенные адгезивные антигены К99, F41, Атт25 с вирусным материалом, а сами адгезины получены при помощи, увеличенной до 1,5-3,0 М концентрации раствора фосфатно-мочевинного буфера.
Сущность изобретения заключается в следующем.
В состав вакцины входят ротавирус крупного рогатого скота штамм РМ, выращенный в перевиваемой культуре клеток МДВК или ЛЭК; коронавирус крупного рогатого скота, штамм КЛ-2, выращенный в тех же культурах и очищенные адгезины штаммов E.coli - К99, F41, Att25. Вакцина инактивирована формалином и сорбирована на гидроокиси алюминия.
Вакцина против рота-, коронавирусной инфекции и эшерихиоза крупного рогатого скота представляет собой жидкость светло-желтого цвета, при хранении образуется рыхлый белый осадок, легко разбивающийся в гомогенную взвесь при встряхивании.
Вакцина стабильна и сохраняет активность при температуре 2-8°C не менее 12 мес.
Вакцину вводят стельным животным двукратно за 40 и 20 дней до отела в объеме 5 мл подкожно в область средней трети шеи или в паховую складку.
Пример 1.
Технологический процесс состоит из нескольких стадий: стадии получения вирусного и эшерихиозного компонентов, добавление адъюванта, смешивание всех компонентов вакцины с последующей расфасовкой готовой продукции.
А. Стадия получения вирусного компонента вакцины.
Культивирование рота и коронавирусов проводят в культурах клеток ЛЭК или МДВК одномоментно или в несколько циклов с постепенным накоплением вирусного материала, хранят до изготовления вакцины при -10-20°C. Каждую партию рота-, коронавирусов проверяют на стерильность путем высева на питательные среды, и исследуют активность в ИФА (не ниже 1:16) для рота-, и в РГА (не ниже 1:512) для коронавируса. Суспензии, содержащие отдельно рота и коронавирус инактивируют формалином в конечной концентрации 0,05%.
После инактивации антигенная активность суспензии штамма ротавируса РМ должна составлять 105,5 - 106,5 ТЦД50 в см3 вакцины, суспензии штамма коронавируса КЛ-2 105,5 - 106,5 ТЦД50 в см3 вакцины.
Б. Стадия получения бактериального компонента вакцины.
Отбирают штаммы-продуценты адгезивных антигенов К99, F41, Att25 (референтные или полевые культуры E.coli), реагирующие в реакции агглютинации со стандартными моноспецифическими антиадгезивными сыворотками в титрах 1:320 - 1:1280 и выше, обладающие иммуногенными свойствами. Засевают в бульон Хоттингера или любую другую среду, способствующую экспрессии адгезивных антигенов. Культивирование проводят при 37-38°C в течение 6-8 ч при шюттулировании. Полученную
бульонную культуру центрифугируют при 3000-5000 об/мин в течение 30-40 мин при 4-10°C. Надосадочную жидкость удаляют, а осадок ресуспендируют в 1,5-3,0 М растворе фосфатно-мочевинного буфера до концентрации 50×109-100×109 микр. кл./мл. Полученную суспензию прогревают в водяной бане при 60-64°C в течение 20-25 мин при периодическом встряхивании (60 U/мин), после чего охлаждают и центрифугируют при 10000-15000 об/мин в течение 10-20 мин.
Супернатант сливают в стерильную посуду, инактивируют путем добавления 0,3-0,4% формалина и выдерживают при 37-38°C в течение суток, после чего проверяют на стерильность. Добавляют гидроокись алюминия до конечной концентрации 25%.
В. Стадия объединения вирусного и бактериального компонентов вакцины.
Для получения комплексного препарата, приготовленные указанным способом компоненты адгезинов и вирусов берут в равных соотношениях (1:1:1) и смешивают в стерильной посуде, т.е. в 1 см3 вакцины содержится 1 часть суспензии штамма ротавируса РМ, 1 часть штамма коронавируса КЛ-2 и 1 часть адгезивных антигенов бактерий Escherichia coli. В свою очередь адгезивные антигены бактерий Escherichia coli К99, F41, Атт25 тоже берутся в равном соотношении.
Приготовленную вакцину расфасовывают в стерильные стеклянные флаконы и герметично закрывают. Хранят 12 мес. при температуре +2-8°C.
Способы получения адгезивных антигенов для вакцины с апробацией на лабораторных мышах.
Вариант 1. Способ получения вакцины осуществляется, как описано выше, но для отделения от бактерий адгезивных антигенов используют 1,5 М концентрацию раствора фосфатно-мочевинного буфера.
Полученный препарат при однократном введении белым мышам стимулирует выработку антител к адгезинам в титрах 1:160-1:640 (в реакции агглютинации).
Вариант 2. Способ получения вакцины осуществляется, как описано выше, но для получения отдельных адгезивных антигенов используют 2,0 М концентрацию раствора фосфатно-мочевинного буфера.
Такой препарат при однократном введении белым мышам стимулирует выработку антител к адгезинам в титрах 1:640-1:1280 (в РА).
Вариант 3. Способ получения вакцины осуществляется, как описано выше, но для получения очищенных адгезивных антигенов используют 3,0 М концентрацию раствора фосфатно-мочевинного буфера.
Пример 2. Оценка антигенной активности вакцины на лабораторных животных.
Полученный препарат при однократной иммунизации белых мышей стимулирует выработку антител к адгезинам в титрах 1:320-1:1280 (в РА).
В опыте на крысах (Таб. 1) антигены входящие в вакцину вводили без адъювантов в трех вариантах ротавирус (РВ) и адгезивные антигены E.coli, коронавирус (KB) и адгезивные антигены E.coli, а также все антигены вместе подкожно в область спины по 3 мл дважды с интервалом 20 дней.
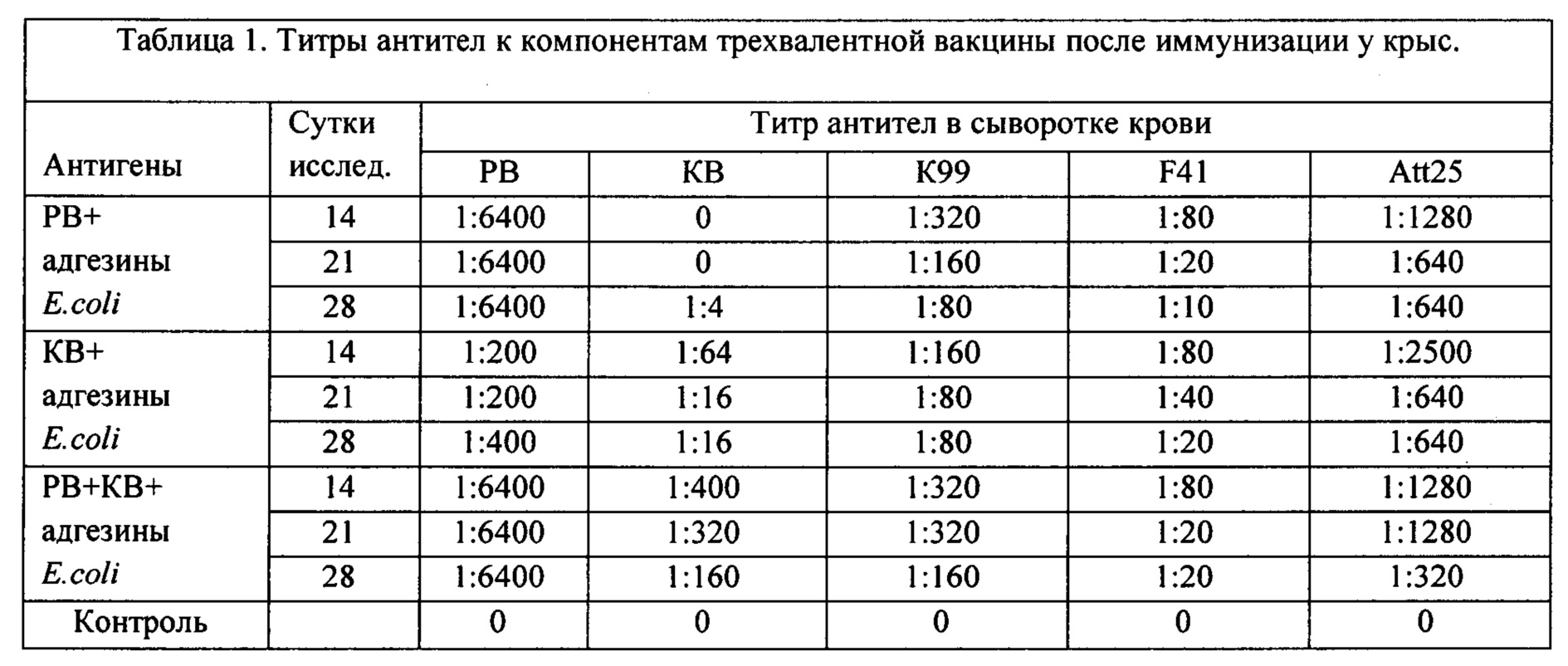
Кровь брали через 14, 21 и 28 дней после второй иммунизации и исследовали на наличие специфических антител методом ИФА для вирусов и РА для адгезивных антигенов. На всех сроках исследования отмечается повышение титров антител к антигенным компонентам вакцины. К вирусным
компонентам вакцины совместно с адгезивными антигенами E.coli, титры достигали величины 1:6400 к РВ и 1:400 к КР со снижением к 28-м суткам. Титры к адгезивным антигенам при совместном применении с вирусами были к К99 1:320, к F41 1:80 и Att25 1:1280, с постепенным снижением к 28-м суткам.
Морским свинкам и кроликам трехвалентную вакцину с адъювантом вводили внутримышечно двукратно с интервалом 7 дней. Через 14 дней после первой и второй иммунизации брали кровь для определения антител к компонентам вакцины.
Результаты по изучению антигенных свойств трехвалентной вакцины на морских свинках и кроликах показали, что введение вакцины животным стимулирует образование специфических антител против всех компонентов вакцины (Таб. 2). Установлено, что гидроокись алюминия является эффективным адъювантом при иммунизации лабораторных животных.
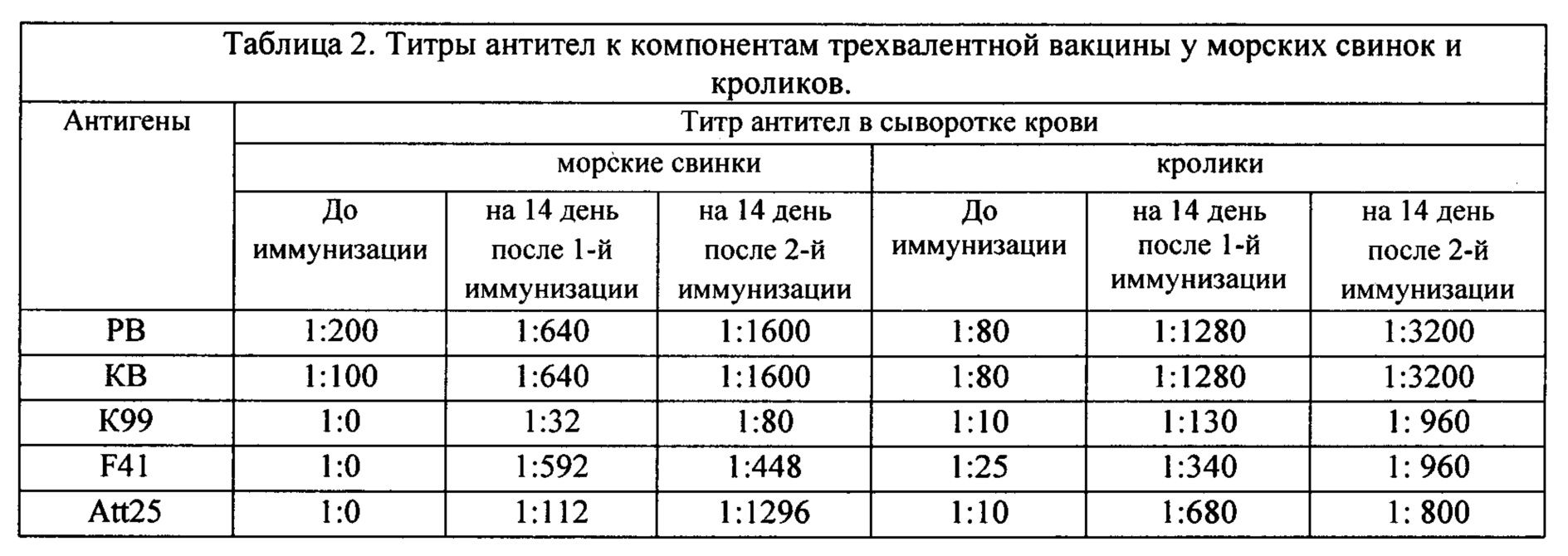
Так, при исследовании сыворотки крови морских свинок и кроликов, иммунизированных вакциной, методом иммуноферментного анализа установлено следующее: титры антител к рота,- и коронавирусам после двух вакцинаций выросли до значения 1:1600 - 1:3200 при начальных показаниях в среднем 1:200. Титры антител к адгезивным антигенам E.coli в РА на 14 день после второй иммунизации у морских свинок и кроликов достигали для К99 1:80 и 1:960, для F41 1:448 и 1:960, Att25 1:1296 и 1:800 соответственно. Полученные результаты свидетельствовали о том, что изготовленная
лабораторная серия вакцины характеризовалась выраженными антигенными свойствами.
Пример 3. Производственное испытание экспериментальных серий вакцины в опытах на коровах.
Иммуногенные свойства ассоциированной вакцины изучались на стельных коровах и телятах в хозяйствах Вологодской области в 2015-2017 гг. В период испытания ассоциированной вакциной было иммунизировано 76 стельных коров, контрольная группа состояла из 23 голов.
Вакцину вводили животным за 40 и 20 дней до отела в объеме 5 - 6 мл в область шеи. У животных до введения вакцины, за 40 и 20 дней до предполагаемого отела отбирали пробы сывороток крови, а после отела на 1, 2 и 3 день отбирали пробы молозива. Сыворотки крови и фекалии телят отбирали на 3 и 7 день для исследования на наличие антител к рота-, и коронавирусам КРС и бактериальным компонентам вакцины. Результаты приведены в (Таб. 3).
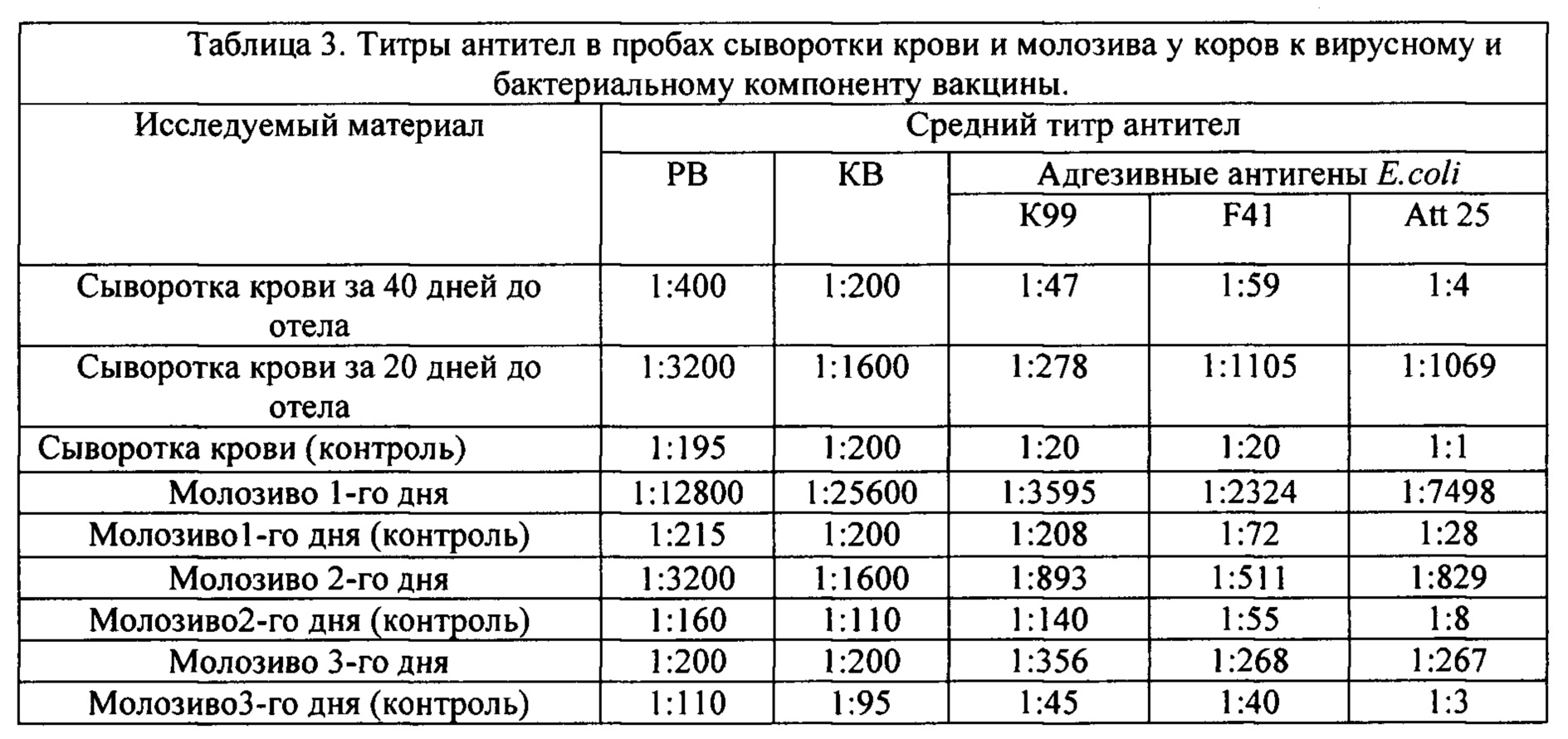
Установлено, что иммунизация стельных коров существенно влияет на накопление специфических антител в крови и молозиве животных и не оказывает отрицательного воздействия на физиологические показатели организма. Так, перед вакцинацией титр антител в пробах сыворотки крови
коров равнялся 1:400-1:800 для вирусов и 1:10-1:80 для адгезинов, за 20 дней перед отелом значение титров возросло до 1:1600-1:3200 для вирусов и до 1:278-1:1105 для адгезинов.
В молозиве первого дня отмечали наивысший титр специфических антител. Так, к рота- и коронавирусам титры антител достигали величины - 1:25600, к адгезивному антигену К99-1:3595, к F41-1:2324, к Att25-1:7498.
По сравнению с молозивом от контрольных животных титры антител к адгезинам выросли в 17-268 раз.
В молозиве 2 и 3-го дня антител содержалось значительно меньше, но их титры все равно превышали контрольные значения в 8-100 раз.
Пример 4. Производственное испытание экспериментальных серий вакцины в опытах на телятах.
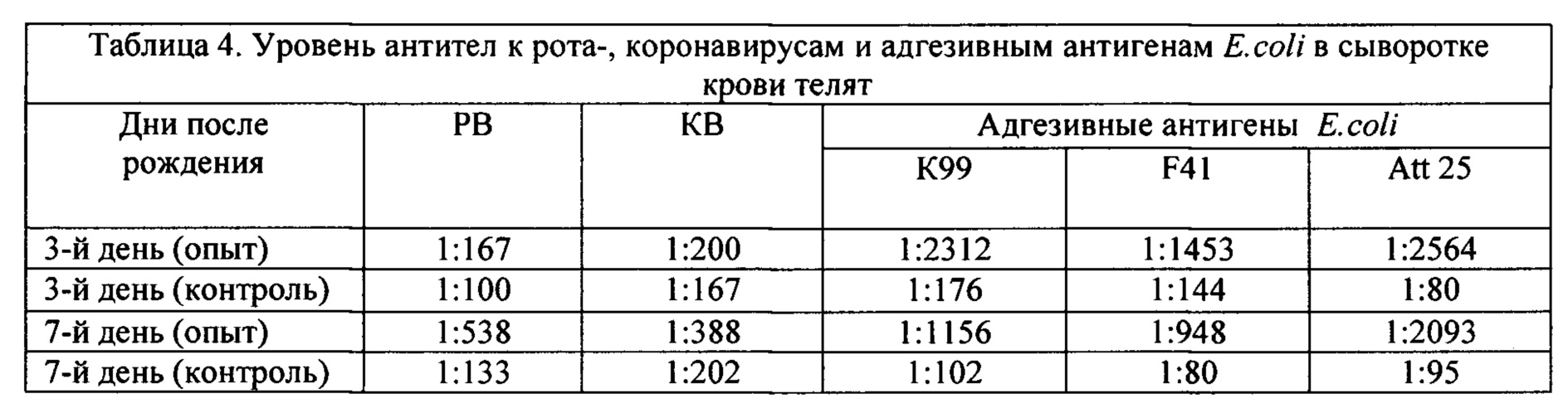
Иммуногенные свойства вакцины определяли также по степени заболеваемости новорожденных телят, полученных от вакцинированных и контрольных коров. Молозиво выпаивали телятам через 2-4 часа после рождения. За телятами вели наблюдение и ежедневно клинически обследовали. При этом учитывали количество специфических антител, получаемых животным с молозивом матери, частоту, продолжительность, тяжесть болезни телят. В результате проведенных исследований, установлена прямая коррелятивная связь между количеством антител в молозиве коров и наличием их в сыворотке крови и фекалиях телят, которым выпаивали иммунное молозиво. Так, в сыворотке крови 3 дневных телят от иммунизированных коров титры антител против адгезинов К99, F41, Att25 были соответственно в 13, 10 и 32 раза выше, чем у контрольных животных (Таб. 4). Фекалии телят, которым выпаивали молозиво от вакцинированных коров, содержали антитела в 65% случаев, а в фекалиях телят контрольной группы антитела выявляли лишь у одного теленка. Титры копроантител к адгезивным антигенам у телят от иммунизированных коров в 6-28 раз превышали титры у контрольных животных.
Около 20% телят от вакцинированных коров в течение первой недели
заболели с клиническим проявлением диареи, однако заболевание протекало в легкой форме, длилось не более 3-4 суток и заканчивалось выздоровлением.
У контрольных телят, полученных от неиммунизированных коров, заболевание протекало длительно, в острой форме, сопровождалось тяжелой диареей с большим количеством слизи, обезвоживанием, повышением температуры тела, истощением. Из всех заболевших пало 4 теленка (17,3%).
В результате проведенных исследований были изучены иммуногенные свойства трехвалентной вакцины против рота-коронавирусной инфекций и колиэнтеритов телят и даны характеристики защитных свойств молозива от коров вакцинированных трехвалентной вакциной и их влияние на резистентность телят.
На основании полученных результатов разработана и утверждена нормативно-техническая документация на трехвалентную ассоциированную вакцину против рота-, коронавирусной инфекций и колиэнтеритов телят, включающая инструкцию по изготовлению вакцины, инструкцию по ее применению, СТО (стандарт организации ФГБНУ ВИЭВ).
Таким образом, разработанная вакцина позволит правильно организовать мероприятия по профилактике и борьбе с желудочно-кишечными болезнями телят. Применение вакцины позволит значительно снизить заболеваемость и отход телят, облегчит течение болезни, уменьшит возможность инфицирования здоровых телят. Разработанная вакцина соответствует уровню, предъявляемого к препаратам данного
предназначения, поскольку в ее состав входят рота-, коронавирусные компоненты вирусов, проявляющих высокую инцидентность в ассоциации с адгезивными штаммами E.coli, а очищенные адгезины, обеспечивают значительно более высокий уровень антител по сравнению с использованием цельной бактериальной клетки или ее других компонентов.
Вакцина апробирована с положительным результатом на крупном рогатом скоте в неблагополучных хозяйствах. Это подтверждает безвредность препарата, повышенную иммуногенную активность компонентов вакцины в сравнении с другими препаратами, выраженную в индукции иммунного ответа у коров-матерей к разным вариантам антигенов возбудителей, циркулирующих в хозяйстве.
Результаты апробации свидетельствуют о том, что вакцина против рота-, коронавирусной инфекции и эшерихиоза крупного рогатого скота обладает высокими иммуногенными свойствами, обеспечивает создание напряженного колострального иммунитета и обладает протективными свойствами.
Учитывая широкое распространение желудочно-кишечных заболеваний в хозяйствах РФ и необходимость вакцинации большого количества животных, экономический эффект от применения разрабатываемой вакцины может быть существенным.
Список литературы
1. Гулюкин М.И., Мникова Л.А., Ишкова Т.А., Соколова Н.Л., Жидков С.А. Разработка и внедрение в практику эффективной системы диагностики и профилактики вирусных желудочно-кишечных болезней крупного рогатого скота // Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 2015. Т. 78. С. 179-186.
2. Сергеев В.А., Непоклонов Е.А., Алипер Т.И. и др. Вакцина инактивированная против вирусной диареи, рота-, короновирусной болезни и эшерихиоза крупного рогатого скота / патент RU №2403063 C1; А61К 39/295, А61Р 31/00, 28.08.2009. Прототип.
3. Соколова Н.А., Головко А.Н., Курашвили Т.К. и др. Способ получения вакцины против колибактериоза сельскохозяйственных животных / патент RU 2053792, С1, 10.02.1996.
4. Амосова Л.А., Ломако Ю.В., Новикова О.Н., Зубовская И.В., Карпович B.К., Пукшлис А.И. Экспериментальные исследования по разработке технологии изготовления и применения вакцины поливалентной с адгезивными антигенами против колибактериоза (эшерихиоза) телят / Эпизоотология, иммунобиология, фармакология, санитария. - 2015. - №1. - C. 3-7.
5. Гаффаров Х.З., Спиридонов Ч.Н., Иванов А.В. и др. Ассоциированная вакцина против рота-, корона-, герпесвирусной и эшерихиозной диареи новорожденных телят / патент RU 2137499, С1, 10.02.2000.

