Результат интеллектуальной деятельности: Способ модификации теста для in vitro диагностики туберкулезного плеврита
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к фтизиатрии и иммунологии и может быть использовано для диагностики плеврита туберкулезной этиологии.
Плевральный выпот является часто встречаемой патологией, которая осложняет течение различных заболеваний. Так, туберкулезный плеврит является распространенной внелегочной формой туберкулеза и частой причиной серозного выпота в регионах с высокой заболеваемостью туберкулезом [7]. В отдельных регионах РФ туберкулезный плеврит составляет до 8% случаев туберкулеза органов дыхания, а у лиц молодого возраста до 30%, в качестве самостоятельного заболевания; кроме того, до 15% случаев туберкулеза легких осложнено туберкулезным плевритом [2]. Приведенные данные свидетельствуют об актуальности своевременной и эффективной диагностики туберкулезного плеврита, в том числе с применением лабораторных методов.
Подтверждение диагноза туберкулеза плевры обычно достигается при помощи бактериологических или морфологических исследований. Посев серозного выпота с целью идентификации возбудителя бактериологическими методами рассматривается в качестве «золотого стандарта» в диагностике туберкулезных серозитов. Однако, некоторые недостатки, включая длительность исследования до двух-трех месяцев и недостаточную чувствительность (в пределах 25%) [1], уменьшают достоинства этого метода для рутинной практики. Морфологическое исследование биопсийного материала, направленное на обнаружение в диагностическом материале элементов туберкулезной гранулемы, позволяет установить диагноз туберкулеза в 60-70% случаев, одним из немаловажных недостатков этого метода является высокая травматичность процедуры получения диагностического материала.
Возможности верификации диагноза туберкулеза плевры расширяются при использовании молекулярно-биологических методов исследования. Они позволяют обнаружить в диагностическом материале ДНК возбудителя туберкулеза. Как показывает практика, чувствительность различных тест-систем на основе молекулярно-биологических методов при исследовании плевральной жидкости не превышает 31,6% [3].
В условиях недостаточной информативности основных лабораторных методов исследования in vitro многие годы хорошим дополнением в ряду диагностических мероприятий служат иммунологические методы. Иммунологические методы диагностики туберкулеза любой локализации направлены на выявление признаков сенсибилизации клеток иммунной системы антигенами М. tuberculosis. Доказано, что одним из признаков наличия туберкулезной инфекции является продукция интерферона-гамма (ИФНγ) лимфоцитами (преимущественно CD4+ Т-клетками) в ответ на их стимуляцию антигенами М. tuberculosis in vitro. Разработка коммерческих тест-систем, основанных на продукции интерферона-гамма клетками периферической крови в ответ на стимуляцию антигенами ESAT-6 и CFP-10, позволила унифицировать лабораторную диагностику туберкулеза иммунологическими методами и расширить область их применения.
Аналогом предлагаемого способа диагностики являются исследования образцов периферической крови с использованием диагностической тест-системы T-SPOT.ТВ (Oxford Immunotec, USPTO Applicaton №20070196878), которая предназначена производителем для исследования образцов периферической крови и выявляет лимфоциты, отвечающие на стимуляцию антигенами Mycobacterium tuberculosis выработкой ИФНγ, с целью диагностики туберкулезной инфекции. Согласно рекомендации производителя из образца периферической крови с помощью градиента плотности получают рабочую суспензию мононуклеарных клеток периферической крови (МКПК) в разведении 2,5×106 клеток/мл. Далее в четыре лунки микротитровального планшета последовательно помещают бессывороточную питательную среду (отрицательный контроль), антиген М. tuberculosis ESAT-6 (антиген А), антиген М. tuberculosis CFP10 (антиген В) и раствор фитогемагглютинина (положительный контроль). Затем во все четыре лунки вносят суспензию МКПК в количестве 250000 в лунку. Планшет помещают на 16-20 часов в инкубатор с влажной камерой при 37°С в атмосфере 5% С02, после чего проводят стандартные процедуры иммуноферментного анализа с целью визуализации клеток-продуцентов ИФНγ. На последнем этапе исследования подсчитывают количество отчетливо видных темно синих пятен на мембране каждой лунки. Каждое пятно образуется в месте, где располагалась клетка, продуцирующая ИФНγ. Подсчет пятен осуществляют с помощью USB-лупы с увеличением 500X или автоматизированного считывающего устройства для ELISpot. При оценке результатов количество пятен в лунке отрицательного контроля всегда вычитают из количества пятен в остальных лунках, при этом, если в нулевом контроле содержится от 6 до 10 пятен, то для определения количества пятен в лунках с антигенами необходимо вычесть из числа пятен в лунке с антигеном А и с антигеном В, двукратное число пятен в нулевом контроле. Результат теста интерпретируют как положительный, если итоговое количество пятен в лунках с антигеном А и/или антигеном В составляет шесть и более. Результат теста интерпретируют как отрицательный, если итоговое количество пятен в лунках с антигеном А и антигеном В составляет пять и менее. Нулевой контроль в котором наблюдают более 10 пятен рассматривают как «неопределенный». Положительный считают пройденным, если число отпечатков в нем составляет не менее 20 в лунке, в противном случае тест интерпретируют как «неопределенный». При этом производитель требует учитывать, что, если в нулевом контроле обнаружено более 10 пятен, результат должен быть оценен как «неопределенный». Подобный результат трудно интерпретировать и исследование рекомендуют повторить. В то же время, как показывает рутинная практика, в подавляющем большинстве случаев при повторном исследовании другого образца крови от пациента результат исследования остается неопределенным, составляя до 2% от общего числа исследований.
С целью повышения диагностической ценности тест-системы Т-SPOT®.ТВ у больных с плевральным выпотом туберкулезной этиологии, некоторые исследователи предприняли попытку использовать в качестве диагностического материала плевральную жидкость (ПЖ). Такой подход обусловлен тем фактом, что при туберкулезе плевры в плевральном выпоте происходит накопление М. tuberculosis-специфичных Т-клеток, что является результатом их избирательной миграции в очаг инфекции [6]. Исследования показали, что при анализе плевральной жидкости у больных с туберкулезным плевритом частота положительных результатов теста была выше, чем при исследовании периферической крови и составила от 71,0 до 96,3% [5]. Методика постановки теста в этих работах не отличалась от рекомендованной производителем тест-системы. В то же время, при исследовании плевральной жидкости исследователи столкнулись с необходимостью установления порогового значения положительного результата теста, поскольку, как и ожидалось, число ИФНγ-продуцирующих клеток в плевральной жидкости значительно превосходило таковое в крови. Пороговое значение положительного результата было различным в каждой из работ и варьировало от 54 до 100 пятен в одной из лунок с антигенами М. tuberculosis. Следует отметить, что использование подобных пороговых значений в рутинной практике возможно только при оснащении лаборатории автоматизированным считывающим устройством для ELISpot. При использовании USB-лупы точный подсчет пятен затруднителен, если их количество превышает 50 на одну лунку. Помимо этого, исследователи отмечают значительное число неопределенных результатов теста, которые в отдельных работах составили 28% [4]. Последнее связано с высоким содержанием в плевральной жидкости больных туберкулезным плевритом клеток, спонтанно продуцирующих ИФНγ in vitro. Вследствие этого, при проведении исследования число пятен в лунке отрицательного контроля часто превышает 10 и результат интерпретируется как неопределенный. Помимо этого, при определении диагностической чувствительности и специфичности теста, образцы с неопределенным результатом анализа, как правило, исключают из общего числа анализируемых образцов, что ведет к ошибочному завышению показателей диагностической информативности теста. Прототипом предложенного способа являются исследования плевральной жидкости у больных плевральным туберкулезом, проведенные с использованием тест-системы T-SPOT®.TB: Dheda K., Zyl-Smit R.N., Sechi L.A., et al. Utility of quantitative T-cell responses versus unstimulated interferon-γ for the diagnosis of pleural tuberculosis. // Eur. Respir. J. - 2009. - 34. - 1118-1126; Zhang L., Zhang Y., Shi X. et al. Utility of T-cell interferon-γ release assays for diagnosing tuberculous serositis: prospective study in Beijing, China // PloS One. - 2014. - 9(1). e85030. doi: 10.1371/journal.pone.0085030; Kang J.Y., Rhee C.K., Rfng N.H., et al. Clinical utility of two interferon-gamma release assays on pleural fluid for the diagnosis of tuberculous pleurisy. // Tuberc. Respir. Dis. - 2012. - 73. - 143-150. Недостатком перечисленных исследований является большое число неопределенных результатов, что снижает диагностическую информативность исследования.
Задачей, решаемой данным изобретением, является повышение диагностической информативности теста для in vitro диагностики туберкулеза при выявлении туберкулезной этиологии плеврита.
Технический результат изобретения состоит в снижении числа неопределенных результатов теста, что позволяет повысить его диагностическую информативность.
Решение задачи достигается тем, что для выявления эффекторных Т клеток, реагирующих на стимуляцию антигенами Mycobacterium tuberculosis, в тесте для in vitro диагностики туберкулеза в качестве исследуемого материала используется не периферическая кровь, как в аналоге T-SPOT®.TB Oxford Immunotec, USPTO Applicaton №20070196878), а плевральная жидкость, как в прототипе (Dheda K., et al., 2009; Zhang L., et al., 201; Kang J.Y., et al., 2012). В отличии от прототипа количество мононуклеарных клеток плевральной жидкости (МКПЖ), помещаемых в лунки микротитровального планшета составляет не 250000, а 65000 клеток в лунке, что существенно упрощает подсчет пятен, снижает частоту получения неопределенных результатов исследования и повышает диагностическую ценность тест-системы для распознавания туберкулезного плеврита.
Предлагаемый способ осуществляют следующим образом. Из образца плевральной жидкости (не менее 20 мл), стабилизированной гепарином выделяют МКПЖ. Для этого в пробирку для центрифугирования объемом 15 мл помещают 5 мл среды для выделения мононуклеарных клеток (Фиколл) и осторожно наслаивают плевральную жидкость. Центрифугируют при 1000g при температуре от 18 до 25°С в течение 22 мин. Затем с помощью пипетки отбирают белый мутный слой МКПЖ и переносят в конические центрифужные пробирки вместимостью 15 мл. Доводят объем с помощью питательной среды RPMI 1640 до 10 мл и центрифугируют при 600 g в течение 7 мин. Затем удаляют супернатант и ресуспендируют осадок 1 мл бессывороточной питательной среды AIM-V. Подсчитывают количество МКПЖ с помощью счетной камеры или автоматизированного гематологического анализатора. Путем разведения полученного образца бессывороточной питательной средой AIM-V готовят 500 мкл рабочей клеточной суспензии с концентрацией 6,5×105 клеток в мл. Далее в четыре лунки микротитровального планшета последовательно помещают бессывороточную питательную среду (отрицательный контроль), антиген М tuberculosis ESAT-6 (антиген А), антиген M. tuberculosis CFP10 (антиген В) и раствор фитогемагглютинина (положительный контроль). Затем во все четыре лунки вносят 100 мкл рабочей клеточной суспензии, таким образом, конечная концентрация МКПЖ в каждой лунке составляет 65000. Далее, все процедуры анализа проводят согласно инструкции производителя тест-системы. Планшет помещают на 16-20 часов в инкубатор с влажной камерой при 37°С в атмосфере 5% С02, после чего проводят стандартные процедуры иммуноферментного анализа с целью визуализации клеток-продуцентов интерферона-γ. На последнем этапе исследования подсчитывают количество отчетливо видных темно синих пятен на мембране каждой лунки. Подсчет пятен осуществляют с помощью USB-лупы с увеличением 500x. Для оценки результатов количество пятен в лунке отрицательного контроля всегда вычитают из количества пятен в остальных лунках, при этом, если в нулевом контроле содержится от 6 до 10 пятен, то для определения количества пятен в лунках с антигенами необходимо вычесть из числа пятен в лунке с антигеном А и с антигеном В, двукратное число пятен в нулевом контроле. Результат теста интерпретируют как положительный, если итоговое количество пятен в лунках с антигеном А и/или антигеном В составляет шесть и более. Результат теста интерпретируют как отрицательный, если итоговое количество пятен в лунках с антигеном А и антигеном В составляет пять и менее. Нулевой контроль в котором наблюдают более 10 пятен рассматривают как «неопределенный». Положительный считают пройденным, если число отпечатков в нем составляет не менее 20 в лунке, в противном случае тест интерпретируют как «неопределенный».
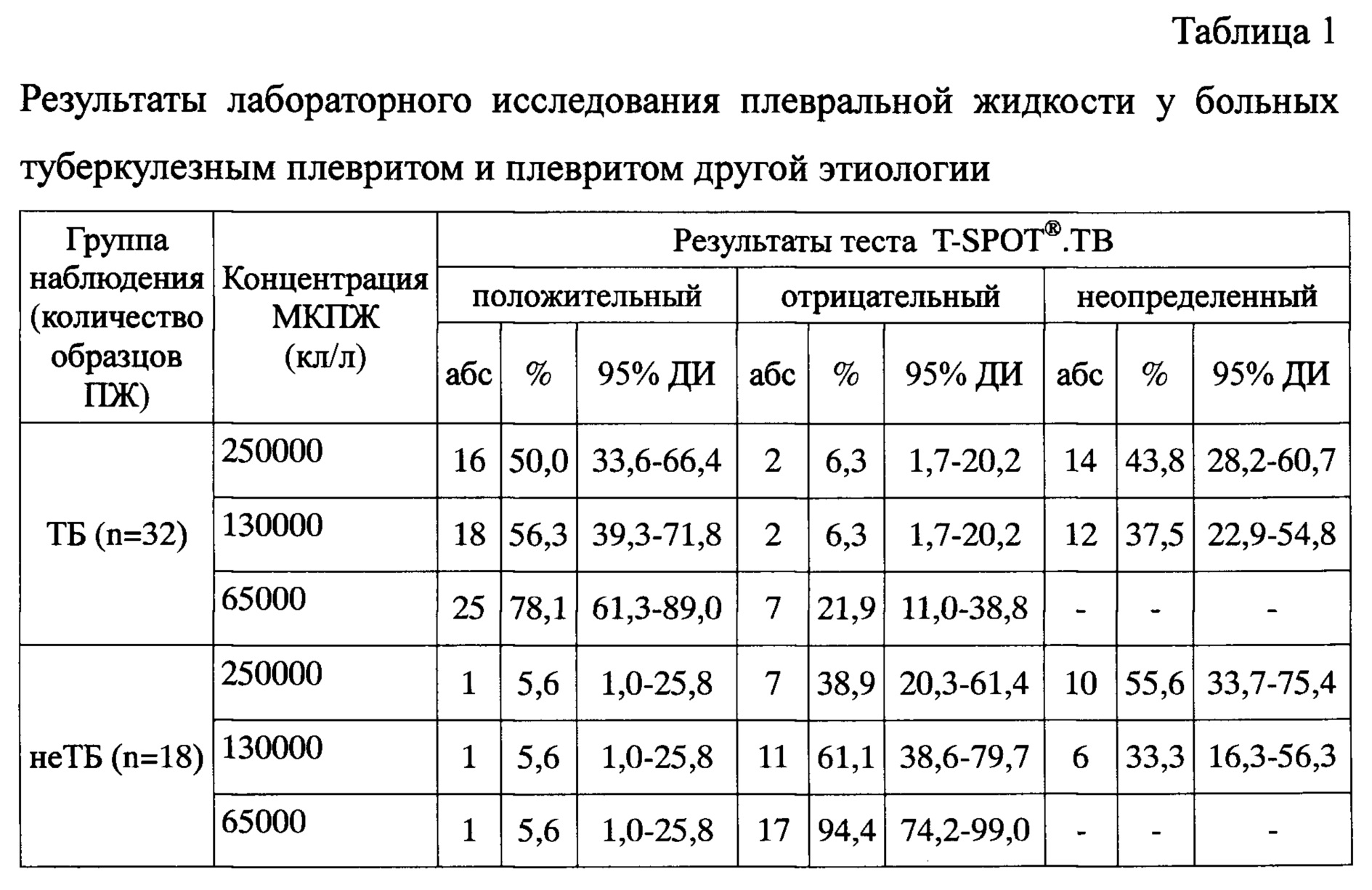
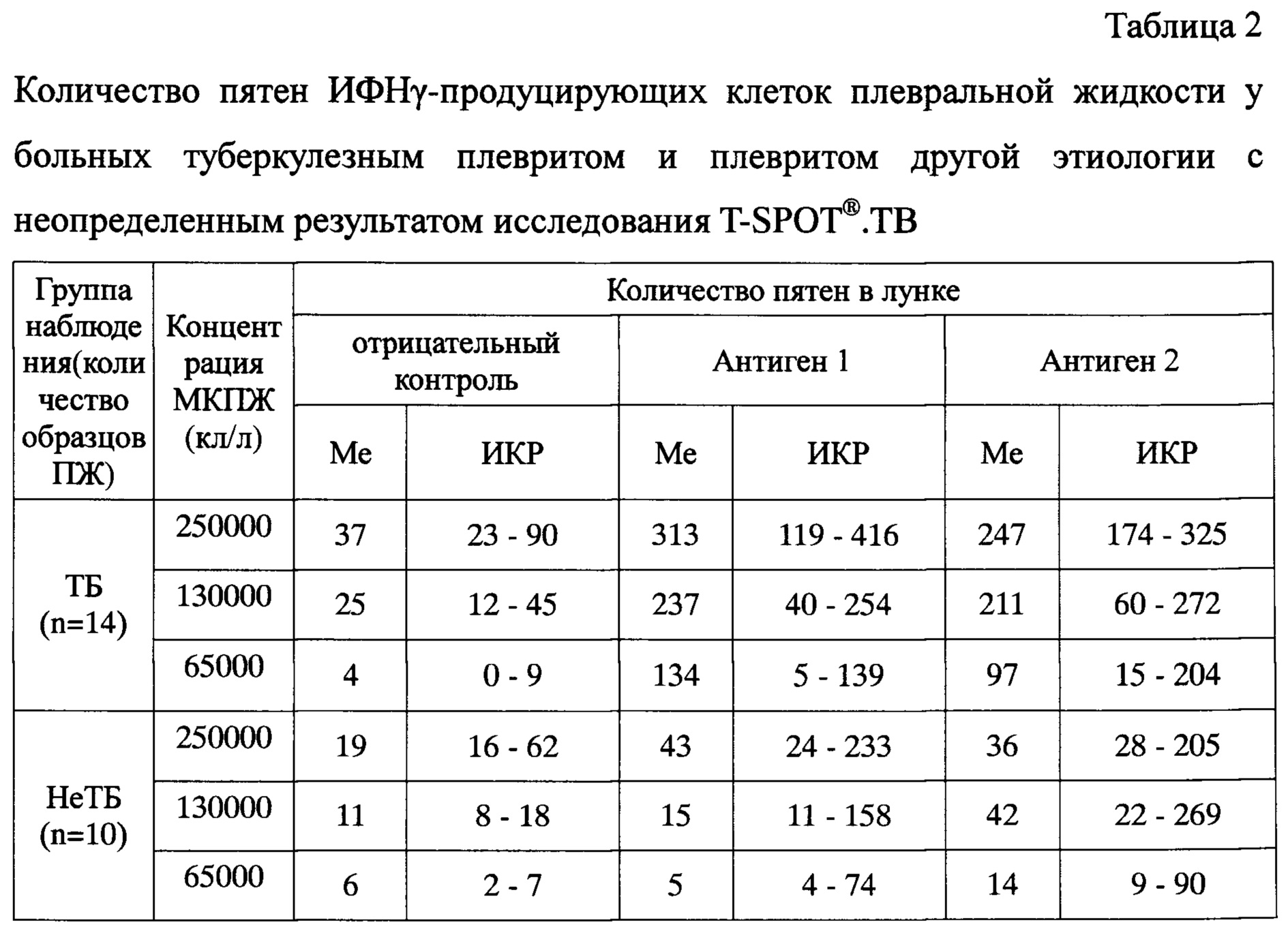
Предлагаемый способ модификации теста был использован при исследовании 32 образцов ПЖ от больных с плевральным выпотом туберкулезной этиологии и 18 образцов ПЖ от больных с плевритом другой этиологии. Из каждого образца плевральной жидкости было приготовлено три пробы клеточной суспензии с рабочим разведением клеток: проба 1 - 2,5×106/мл, проба 2 - 1,3×105/мл и проба 3 - 6,5×105/мл. Затем каждую из проб вносили в четыре лунки микротитровального планшета, в которые предварительно были внесены бессывороточная питательная среда (отрицательный контроль), антиген М tuberculosis ESAT-6 (антиген А), антиген М. tuberculosis CFP10 (антиген В) и раствор фитогемагглютинина (положительный контроль). Клеточная суспензия была внесена в лунки микротитровального планшета в объеме 100 мкл, таким образом, конечная концентрация мононуклеарных клеток в каждой из лунок составила для пробы 1 - 250000 клеток, пробы 2 - 130000 клеток, пробы 3 - 65000 клеток. По окончании инкубации были проведены стандартные процедуры иммуноферментного анализа согласно инструкции производителя тест-системы. Подсчет пятен осуществляли параллельно с помощью USB-лупы с увеличением 500x и автоматизированного считывающего устройства для ELISpot (AID EliSpot Reader System ELR04, Германия). Обобщенные результаты исследования приведены в таблицах 1 и 2.
Из приведенных данных видно, что при оценке полученных результатов согласно рекомендации производителя тест-системы, у больных туберкулезом частота положительных составила 50% (95% доверительный интервал (ДИ) 33,6-66,4%), частота отрицательных результатов у больных с плевритом другой этиологии составила 38,9% (95% ДИ 20,3-61,4%). Частота неопределенных результатов теста при исследовании ПЖ составила 43,8% (95% ДИ 28,2-60,7%) у больных туберкулезным плевритом и 55,6% (95% ДИ 33,7-75,4%) у больных плевритом другой этиологии. Это было связано с большим числом клеточных пятен в лунках отрицательного контроля как больных туберкулезным плевритом, так и плевритом другой этиологии (медиана (Me) 37 и 19, интерквартильный размах (ИКР) 23-90 и 16-62 пятна, соответственно; см. Табл. 2). При снижении концентрации клеток до 130000 в лунке было достигнуто снижение доли неопределенных результатов до 37,5% (95% ДИ 22,9-54,8%) для больных туберкулезным плевритом и 33,3% (95% ДИ 16,3-56,3%) для остальных больных, что стало возможным благодаря снижению числа проб с количеством клеточных пятен в отрицательном контроле более 10 на лунку. Снижение концентрации клеток до 65000 в лунке привело к уменьшению количества клеточных отпечатков до 10 и менее на лунку, что позволило полностью исключить получение неопределенных результатов теста во всех исследованных образцах плевральной жидкости.
Следует отметить, что образцы плевральной жидкости, которые при разведении клеток 250000 на лунку, были интерпретированы как положительные или отрицательные, при разведении клеток 65000 на лунку были интерпретированы аналогично.
Предложенный способ модификации теста T-SPOT®.TB в отличии от прототипа позволяет исключить получение неопределенного результата исследования при анализе плевральной жидкости, что ведет к увеличению доли однозначно-интерпретируемых результатов, вследствие чего повышает диагностическую информативность теста.
Список литературы
1. Стогова Н.А., Печерских А.И., Масленникова Т.И. и др. Дифференциальная диагностика туберкулезного и парапневмонического экссудативного плеврита. // Туберкулез и социально-значимые заболевания. - 2013. - №2. - С. 84-85.
2. Стогова Н.А., Тюхтин Н.С. Общие принципы выявления больных и верификации диагноза при туберкулезном плеврите // Проблемы туберкулеза и болезней легких. - 2007. - No 2. - С. 14-17.
3. Choi Н, ChonHR, Kim K, Kim S, Oh K-J, JeongSH, et al. Clinical and Laboratory Differences between Lymphocyte-and Neutrophil-Predominant PleuralTuberculosis. // PloSONE. - 2016. - 11(10): e0165428.doi:10.1371/journal.pone.0165428
4. Kang J.Y., Rhee C.K., Rfng N.H., et al. Clinical utility of two interferon-gamma release assays on pleural fluid for the diagnosis of tuberculous pleurisy. // Tuberc. Respir. Dis. - 2012. - 73. - P. 143-150.
5. Li Z.Z., Qin W.Z., Li L., et al. Accuracy of enzyme-linked immunospot assay for diagnosis of pleural tuberculosis: a meta-analysis. // Genetics and Molecular Research. - 2015. - 14(3). - 11672-11680.
6. Souza M.C., Penido C., Costa M.F., Heriques M.G. Mechanisms of T-lymphocyte accumulation during experimental pleural infection induced by Mycobacterium bovis BCG. // Infect Immunol. - 2008. - №76. - P. 5686-5693.
7. Valdes L., Alvarez D., Valle J.M. et all The etiology of pleural effusions in an area with high incidence of tuberculosis. // Chest - 1996. - №109. - C. 158-162.