Результат интеллектуальной деятельности: Применение радиофармацевтической композиции с использованием меченых аутологичных лейкоцитов для визуализации местных лучевых поражений методом однофотонной эмиссионной томографии
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к радиофармацевтической композиции с использованием меченых аутологичных лейкоцитов, и может применяться для визуализации местных лучевых поражений методом однофотонной эмиссионной томографии.
В настоящее время лучевая терапия применяется как метод радикального лечения, дополнения к хирургическому вмешательству либо химиотерапии и с паллиативными целями. Более 60% онкологических больных подвергаются лучевой терапии. Современные источники излучения высоких энергий (бетатрон, линейный ускоритель) меньше повреждают нормальные ткани, чем гамма- и рентгенотерапевтические аппараты, однако полностью избежать повреждающего действия соседних с опухолью тканей или расположенных над ней, а также отдаленных, особо чувствительных систем и органов (кроветворные области, богатые лимфоидными тканями, нервными рецепторами) невозможно. Отрицательное действие лучевой терапии на организм часто сказывается в виде лучевых реакций и лучевых повреждений окружающих опухоль здоровых тканей и органов, попавших в зону облучения. Под лучевыми реакциями понимают временные, обычно самостоятельно проходящие функциональные изменения, а под лучевыми повреждениями - уже стойкие функциональные и структурные изменения в окружающих опухоль здоровых тканях и органах, попавших в зону облучения. Лучевые повреждения делят на: ранние (возникающие в течение первых 3 мес.после облучения), когда страдают более радиочувствительные и хорошо регенерирующие структуры, и поздние (возникшие через 3-6 мес.), в этом случае страдают более радиорезистентные структуры. В основе таких лучевых повреждений - цитолиз и изменения на уровне мелких сосудов.
Местное лучевое поражение (МЛП) - специфическое радиационное поражение кожи, других подлежащих тканей и структур, включая внутренние органы, находящихся в проекции действия на тело пучка глубоко проникающего ионизирующего излучения. Трудности лучевой терапии обусловлены характерными для лучевых язв нарушениями обменных и пролиферативных процессов в тканях, изменениями в состоянии как тканевой, так и регионарной циркуляции в зоне повреждения.
Дифференциальная диагностика и оценка лучевых повреждений (особенно, затрагивающих внутренние ткани) крайне важны как для эффективного продолжения лучевой терапии (в рамках лечения основного заболевания), так и для сохранения здоровья и нормального качества жизни пациента.
Основными методами диагностики локальных лучевых поражений являются лабораторные исследования крови, термография, визуальный осмотр (помимо точного ведения всех сеансов облучения, включая детальное картирование и положение полюсов - высокая прогностическая значимость) [Iddins C.J., Christensen D.M. et al. Management of Ionizing Radiation Injuries and Illnesses, Part 5: Local Radiation Injury // The Journal of the American Osteopathic Association. 2014. Vol. 114. No. 11. pp. 840-848, International Atomic Energy Agency and the World Health Organization. Diagnosis and treatment of radiation injuries. Vienna: IAEA Press, 1998].
В настоящее время, среди всех лучевых диагностических технологий наиболее специфичными к воспалению являются методы ядерной медицины, позволяющие визуализировать очаги воспаления и оценивать патофизиологические изменения, протекающие в поврежденной ткани.
Это достигается за счет использования радиофармпрепаратов (РФП), способных накапливаться в области поражения. Благодаря достижениям молекулярной биологии и радиохимии удалось синтезировать такие РФП, как меченые антитела к гранулоцитам, неспецифический IgG, интерлейкины, антимикробные пептиды и многие другие. Однако далеко не все из них могут быть использованы в клинической практике из-за несоответствия основным требованиям, предъявляемым к РФП - низкая токсичность, отсутствие иммунологических реакций со стороны организма в ответ на введение индикатора.
Появление в середине 1980-х гг. РФП «Ceretec» (комплекс технеция-99 м с d,l-гексаметилпропиленаминоксимом, ГМ-ПАО; МНН - Экзаметазим), предложенного впервые фирмой Амершам (Великобритания), который был рекомендован как для исследования перфузии головного мозга, так и для мечения аутологичных лейкоцитов технецием-99 м.
С развитием технологий позитронно-эмиссионной томографии (ПЭТ) активно и успешно исследуют возможности новых РФП для визуализации воспаления, в первую очередь Фтордезоксиглюкозы - [18F]FDG, например [Bucerius J, Mani V, Moncrieff С, et al. Optimizing 18F-FDG PET/CT imaging of vessel wall inflammation: the impact of 18F-FDG circulation time, injected dose, uptake parameters, and fasting blood glucose levels // Eur J Nucl Med Mol Imaging. 2014 Feb; 41(2):369-83. doi: 10.1007/s00259-013-2569-6. Epub 2013 Nov 23, Gewirtz H, Dilsizian V. Defining Inflammatory Levels of Carotid Artery and Aortic 18FDG Uptake: Implications for Clinical Trial Design and Individual Patient Management // JACC Cardiovasc Imaging. 2016, Oct; 9 (10):1208-1210; doi: 10.1016/j.jcmg. 2016.05.014], а также 11С-метионина и других на основе ультракороткоживущих радионуклидов [O.L. Nielsen, Р. Afzelius, D. Bender, Н.С.  P.S. Leifsson, K.М. Nielsen, J.O. Larsen, S.B. Jensen, A.K.O. Alstrup.Comparison of autologous (111)In-leukocytes, (18)F-FDG, (11)C-methionine, (11)C-PK11195 and (68)Ga-citrate for diagnostic nuclear imaging in a juvenile porcine haematogenous staphylococcus aureus osteomyelitis model. // Am. J. Nucl. Med. Mol. Imaging, 2015. Vol. 5(2), p. 169].
P.S. Leifsson, K.М. Nielsen, J.O. Larsen, S.B. Jensen, A.K.O. Alstrup.Comparison of autologous (111)In-leukocytes, (18)F-FDG, (11)C-methionine, (11)C-PK11195 and (68)Ga-citrate for diagnostic nuclear imaging in a juvenile porcine haematogenous staphylococcus aureus osteomyelitis model. // Am. J. Nucl. Med. Mol. Imaging, 2015. Vol. 5(2), p. 169].
В некоторых работах показано применение радиофармацевтических препаратов для оценки локальных лучевых поражений. Например, в работе [ J.C. Medical and Surgical Management for Localized Radiation Injuries // International Journal Of Radiation Biology. 1990. Vol. 57. No. 4. pp. 783-795] показана возможность применения термографии совместно с ОФЭКТ после внутривенного введения натрия пертехнетата, 99mТс для оценки радиационных ожогов кожи, а в работе [Miot Е. et al. Quantitative magnetic resonance and isotopic imaging: Early evaluation of radiation injury to the brain // Int. J. Radiation Oncology Biol. Phys. 1995, Vol. 32. pp. 121-138] показано применение ОФЭКТ с 99mTc-HMPAO для оценки радиационного поражения мозга после облучения.
J.C. Medical and Surgical Management for Localized Radiation Injuries // International Journal Of Radiation Biology. 1990. Vol. 57. No. 4. pp. 783-795] показана возможность применения термографии совместно с ОФЭКТ после внутривенного введения натрия пертехнетата, 99mТс для оценки радиационных ожогов кожи, а в работе [Miot Е. et al. Quantitative magnetic resonance and isotopic imaging: Early evaluation of radiation injury to the brain // Int. J. Radiation Oncology Biol. Phys. 1995, Vol. 32. pp. 121-138] показано применение ОФЭКТ с 99mTc-HMPAO для оценки радиационного поражения мозга после облучения.
Развитие техники детектирования радиоактивности для клинических целей, появление томографических методов - ОФЭКТ vs. планарная сцинтиграфия - позволило в полной мере раскрыть диагностический потенциал меченых форменных элементов крови. Лимфоциты, в виду их высокой радиочувствительности [Kurt I. Altaian, John Т. Lett, editor. Relative Radiation Sensitivities of Human Organ Systems, reprinted ed. Elsevier, 2016, pp. 340], и значительно более низкого содержания в циркулирующей крови долгое время оставались малоизученными в плане применения в ядерной медицине. Однако работы в данной области велись постоянно в виду высокого диагностического потенциала меченых лейкоцитов для визуализации, в первую очередь, опухолей, инфарктных состояний и случаев отторжения аллотрансплантата [Kuyama J., McCormack A. et al. Indium-111 labelled lymphocytes: isotope distribution and cell division // Eur J Nucl Med. 1997. Vol. 24. pp. 488-496].
Co времени первых сообщений о возможности мечения лейкоцитов липофильным хелатным соединением 111In-трис-8-оксихинолином (111In-оксином) за счет пассивной диффузии [McAfee J., Thakur М. Survey of Radioactive Agents for in Vitro Labelling of Phagocytic Leukocytes // J Nucl Med: Radiopharm. 1976. Vol. 17. pp. 480-487; Thakur M.L., Segal A.W., Louis L. et al. Indium-111-labeled cellular blood components: mechanism of labeling and intracellular location in human neutrophils // J Nucl Med. 1977. Vol. 18. No. 10. pp. 1022-1026; Goodman D.A. et al. Comparative study of tumor and organ distribution of 111In-and 67Ga- labeled compounds in mice // J Nucl Med. 1971. Vol. 12. P. 434], мечение лейкоцитов было признано эффективным диагностическим приемом для обнаружения очагов воспаления различной этиологии и локализации [Thakur M.L., Lavender J.P., Arnot R.N. et al. Indium-111 labeled autologous leukocytes in man // J Nucl Med. 1977. Vol. 18. pp. 1012-1019., 6 Datz F.L. Infection imaging // Semin Nucl Med. 1994. Vol. 24. pp. 89-91].
Известен способ визуализации воспалений, включающий внутривенное введение изотопа галлия, пригодного для радионуклидной диагностики и выбранного из 68Ga и 67Ga в форме цитратного комплекса, и вещества, блокирующего металлсвязывающую способность трансферрина крови, представляющего собой физиологически приемлемое соединение трехвалентного железа, выбранного из цитрата железа, тартрата железа, лактата железа, маната железа и аскорбата железа, и последующую визуализацию очагов воспаления методами позитронно-эмиссионной томографии и однофотонной эмиссионной компьютерной томографии (RU 2571486 С1, 20.12.2015).
Ближайшим аналогом изобретения является применение препарата «Технефит, 99mТс» в качестве средства для проведения сцинтиграфии с мечеными аутологичными лейкоцитами при диагностике воспалительных процессов (RU 2290952 С1, 10.01.2007). Показано, что для эффективного связывания лейкоцитов необходимо выполнение следующих условий: использование одного флакона реагента не более чем для исследования одного пациента; использование препарата «Технефит, 99mТс» в дозе 740 МБк, инкубация лейкоцитов с радиофармацевтическим препаратом должна происходить при температуре 37°С в течение 45-90 мин. Таким образом, использование препарата «Технефит, 99mТс» в диагностической дозе 740 МБк является целесообразным и с точки зрения получения качественного сцинтиграфического изображения. Однако недостатком данного изобретения является высокий процент (50%) истинно отрицательных результатов, при этом средняя эффективность мечения лейкоцитов при указанной дозе 99mТс составляет 34,3%.
Кроме того, в связи с относительно короткими периодами полураспада 99mТс (Т1/2=6,01 ч) и тем более 18F (Т1/2=110 мин), 68Ga (Т1/2=68 мин) или 11С (Т1/2=20 мин) не могут быть применены при необходимости длительного (более нескольких часов) дву-, трехкратного исследования и/или при необходимости одновременной визуализации других органов и систем, например, скелета. Наиболее подходящим для таких целей радионуклидом оказался индий-111.
Поэтому задачей данного изобретения является получение радиофармацевтической композиции на основе радионуклида 111In для высокоэффективного способа визуализации местных лучевых поражений с использованием меченых аутологичных лейкоцитов методом однофотонной эмиссионной томографии, что позволит наилучшим образом определить тактику дальнейшего лечения пациента.
Поставленная задача решается тем, что в качестве препарата для получения меченых аутологичных лейкоцитов предлагается радиофармацевтическая композиция, содержащая в качестве активного компонента 111In с объемной активностью 35-40 МБк/мл, при следующем соотношении ингредиентов в 1 мл:
|
Техническим результатом заявленного изобретения является получение высокой эффективности мечения аутологичных лейкоцитов радиофармацевтической композицией, содержащей в качестве активного компонента 111In, с визуализацией до двух суток в очаге местного лучевого поражения, позволяющего проводить процедуры однофотонной эмиссионной компьютерной томографии (ОФЭКТ) на протяжении нескольких дней без дополнительного введения радиофармацевтического препарата.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ.
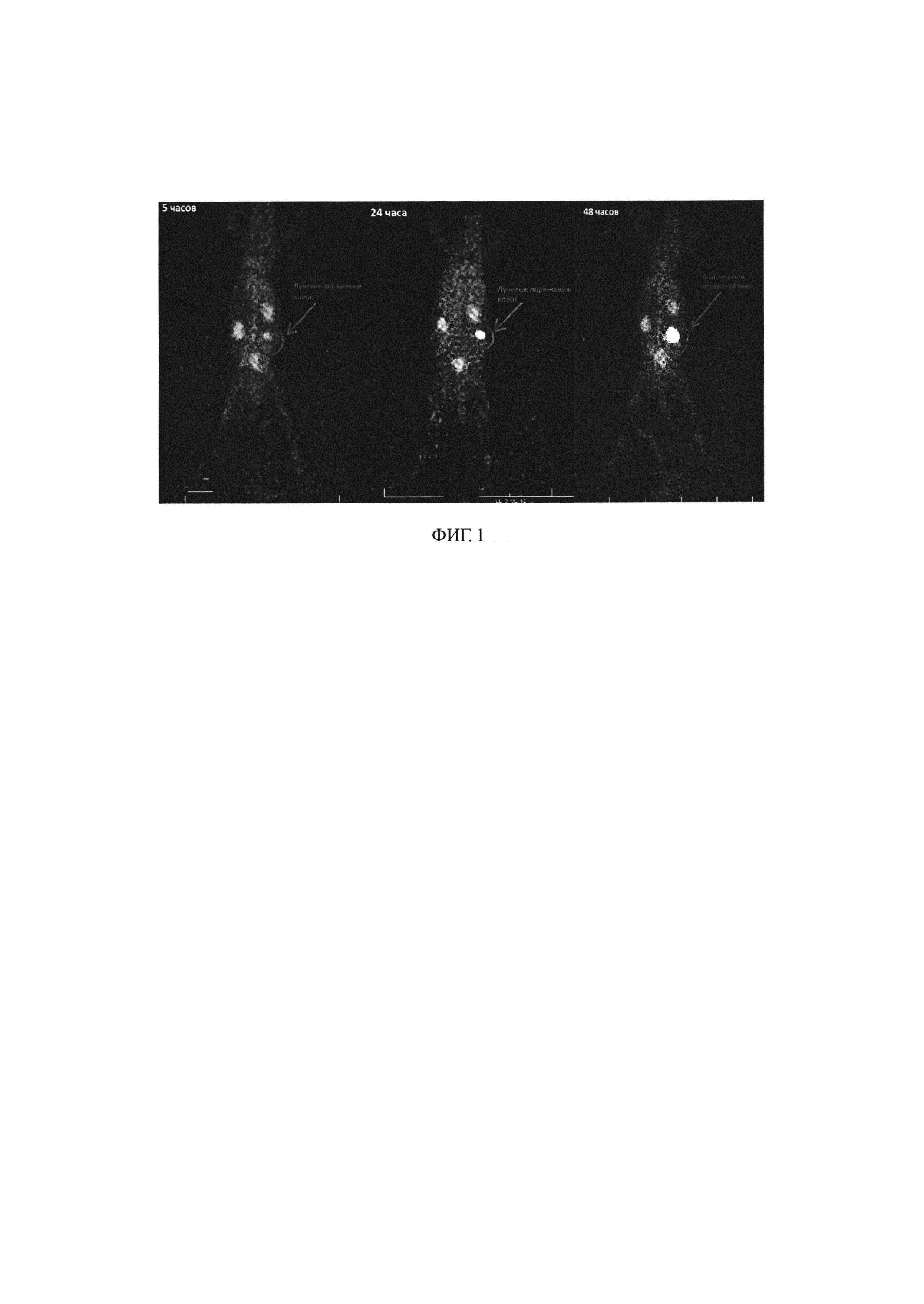
ФИГ 1. ОФЭКТ исследование через 5, 24, 48 ч у кролика с острым лучевым поражением кожи после введения аутологичных лейкоцитов, меченных радиофармацевтической композицией.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРИМЕР 1. Получение радиофармацевтической композиции на основе индия-111 для мечения лейкоцитов.
Радиофармацевтическая композиция представляет собой раствор комплекса 111In с 8 - гидроксихинолином, которая получается после растворения лиофилизата в солянокислом растворе 111In без носителя.
Индий - 111 можно получить облучением мишеней кадмия протонами по реакциям: 111Cd(p,n)111In и/или 112Cd(p,2n)111In (22 МэВ).
Индий хлорид, 111In представляет собой бесцветную прозрачную жидкость. Концентрация хлористоводородной кислоты составляет: от 0,049 до 0,051 моль/л. Период полураспада индия-111 равен 2,8 суток. Спектр гамма-излучения индия-111 имеет наиболее интенсивные гамма-линии с энергией 0,171 МэВ (90,2%) и 0,245 МэВ (94,0%). Относительное содержание примесей индия-114m не более 0,1%, индия-110 м не более 2,0% от активности индия-111 на дату и время изготовления. Радиохимическая чистота: не менее 95,0%.
Состав лиофилизата во флаконе:
|
Для приготовления радиофармацевтической композиции во флакон с лиофилизатом вводят 1,0 мл раствора индия-111 с объемной активностью 35-40 МБк/мл. Перемешивают содержимое флакона встряхиванием до полного растворения, выдерживают 10 мин при комнатной температуре. Радиофармацевтическая композиция готова для мечения лейкоцитов.
Характеристика радиофармацевтической композиции на основе индия-111:
|
Внешний вид - бесцветная прозрачная или слабо опалесцирующая жидкость
рН радиофармацевтической композиции от 6,3 до 9,0.
Радиохимическая чистота (РХЧ) - не менее 90%.
Радиофармацевтическая композиция стерильна.
Срок годности - 1 сутки со времени приготовления.
ПРИМЕР 2. Метод мечения лейкоцитов радиофармацевтической композицией на основе индия-111.
В пробирку, содержащую 1,0 мл взвеси лейкоцитов, вносили 0,1 мл радиофармацевтической композиции на основе индия-111 с объемной активностью 35-40 МБк/мл, затем инкубировали клетки в течение 10 мин при комнатной температуре. Путем центрифугирования осаждали лейкоциты. Удаляли супернатант, содержащий несвязавшиеся с клетками компоненты радиофармацевтической композиции на основе индия-111, не задевая осадок клеток. Оставшиеся клетки осторожно ресуспенизировали в 0,5 мл физиологического раствора.
Эффективность мечения лейкоцитов определяли методом прямой радиометрии взвеси клеток и супернатанта по формуле:

где
AL - активность взвеси лейкоцитов, имп;
AS - активность супернатанта, имп.
Эффективность мечения лейкоцитов составляет от 50% до 90%.
ПРИМЕР 3. Исследование накопления и распределения лейкоцитов, меченных радиофармацевтической композицией на основе индия-111, в организме лабораторных животных с модельной патологией лучевого ожога кожи.
Поскольку диагностические РФП на основе γ-излучателей не обладают терапевтической активностью, являясь лекарственным средством, объем фармакокинетических исследований ограничивают изучением распределения и выведения РФП из органов и тканей лабораторных животных (биораспределение). Распределение оценивают, измеряя содержание радионуклида в выделенных через определенные промежутки времени органах и тканях методом радиометрии. Для этого используют относительный метод измерения, заключающийся в сравнении скоростей счета от исследуемой пробы и эталона (эталон представляет собой равное или мерную долю количества РФП, введенного животным) при том, что условия измерения их одинаковы. Возможно также проведение ОФЭКТ исследований для подтверждения возможности контрастной визуализации очагов модельной патологии.
Исследования проведены на самках кроликов породы серый великан с массой тела 1600-2100 г. У данных животных возможно индивидуальное выделение достаточного количества лейкоцитов, поэтому генетическая идентичность не требовалась.
Острое очаговое лучевое поражение кожи в форме лучевых ожогов кожи 3-4 степени у лабораторных животных получено путем местного облучения поверхности кожи рентгеновским излучением (доза 110 Гр, время облучения поверхности кожи 380 с).
Для выделения лейкоцитарной массы из цельной крови использовали метод фракционированного осаждения без их разделения на субпопуляции с помощью центрифугирования. Все манипуляции по приготовлению растворов, отбору и разделению цельной крови на фракции, а также мечению лейкоцитарной массы выполнялись с соблюдением условий асептики.
В кратком изложении, методика выделения лейкоцитарной массы состоит в следующем. В предварительно подготовленные пробирки с антикоагулянтом (АК) отбирали 1,5 мл крови в следующих соотношениях 0,1 мл АК к 0,5 мл крови крыс и 0,25 мл АК к 1,5 мл крови кроликов. Осторожно смешивали кровь и АК, путем аккуратного переворачивания пробирки несколько раз. Затем аккуратно вливали в пробирки с осаждающим раствором (ОР) в соотношении 1:1, аккуратно перемешивали, избегая вспенивания, и оставляли при комнатной температуре на 45-60 мин до полного осаждения эритроцитов.
После осаждения эритроцитарной массы, надосадочную жидкость переносили в пластиковые центрифужные пробирки и центрифугировали при 150 g в течение 5-10 мин. Супернатант, представляющий собой плазму, обогащенную тромбоцитами осторожно удаляли. Лейкоцитарный осадок осторожно ресуспензировали в 1 мл физиологического раствора.
После внутривенного введения суспензии аутологичных лейкоцитов, меченных радиофармацевтической композицией на основе индия-111, методом прижизненной сцинтиграфии выполняли исследование динамики их распределения в организме. Планарная сцинтиграфия всего тела кроликов выполнена на ОФЭКТ/КТ томографе Philips Precedence 16 с настройкой фотопиков 171/245 кэВ для 111In. Исследования проведены через 5,24 и 48 часов после внутривенного введения меченых аутологичных лейкоцитов.
Результаты исследования накопления и распределения лейкоцитов, меченных радиофармацевтической композицией на основе индия-111, в организме лабораторных животных с модельной патологией лучевого ожога кожи отражены на фиг. 1.
На фиг. 1 отчетливо видно место лучевого поражения кожи в течение 5, 24, 48 часов, что доказывает тропность препарата на основе лейкоцитов, меченных радиофармацевтической композицией на основе индия-111, к очагу патологии. Область не физиологического накопления лейкоцитов увеличивалась от исследования к исследованию, что коррелирует с динамикой распределения меченых лейкоцитов в организме животных с воспалительными поражениями мягких тканей не лучевой природы, полученных методом радиометрии органов и тканей.
ПРИМЕР 4. Исследование динамики распределения меченых аутологичных лейкоцитов у крыс с ранним лучевым поражением кожи.
Эксперимент проведен на 30 половозрелых крысах-самцах с ранним лучевым поражением кожи. Лучевые поражения кожи были получены при действии относительно «мягкого» рентгеновского излучения на модифицированной установке РАП100-10 производства ООО «Диагностика-М» (Россия).
Животных облучали в течение 380 секунд до достижения дозы на поверхности кожи 110 Гр (мощность дозы - 17,5 Гр/мин) с алюминиевым фильтром 0,1 мм. Во время облучения животных фиксировали в специальном станке на животе. Локальное облучение в области спины проводилось после удаления шерсти, площадь облучения составляла 8,2-8,5 см2.
Взвесь меченых лейкоцитов с объемной активностью 36,8 МБк/мл была введена однократно в хвостовую вену в объеме 0,2 мл. Через 3 часа и через 1 и 2 сут после инъекции взвеси меченых лейкоцитов животные были умерщвлены частичной декапитацией. Для радиометрии были взяты следующие органы и ткани: кровь (~ 0,5 мл); мышца (~ 1,0 г); очаг лучевого поражения. Радиометрия проб проведена с использованием автоматического гамма-счетчика Wizard 2480 (PerkinElmer, USA).
Доли аккумуляции в органах (пробах) рассчитывали по формуле:

где:
Апробы - счет образца в импульсах;
Аэталон - счет эталона (или пересчет на 100% эталон счета его аликвоты) в импульсах;
Амв - счет от места введения в импульсах.
Также были рассчитаны коэффициенты дифференциального накопления (КДН), представляющие собой отношение накопленной активности (% от введенной активности на 1 г ткани) в зоне интереса (очаг лучевого поражения) к накопленной активности (% от введенной активности на 1 г ткани) в тканях или органах, являющихся фоновыми для зоны интереса. В данном исследовании фоновой является мышечная ткань.
Критерием прогноза четкой визуализации является значение КДН больше чем 1,5. Значения КДН рассчитаны по формуле:
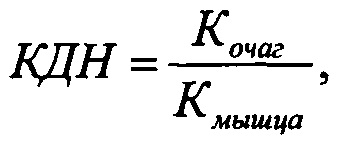
где:
Кочаг - аккумуляция меченых лейкоцитов на 1 г ткани очага лучевого поражения;
Кмышца - аккумуляция меченых лейкоцитов на 1 г поперечнополосатой мышечной ткани.
Полученные результаты представлены в таблице 1. Как видно из приведенных данных, меченые лейкоциты быстро покидают кровеносное русло, практически не накапливаясь в мышечной ткани. Накопление меченых лейкоцитов в очаге местного лучевого поражения имеет положительную динамику, что отражает сохранение их функциональных свойств. Значения КДН лучевой ожог/мышца, оцененные во все сроки наблюдения подтверждают возможность четкой ОФЭКТ визуализации очага данной патологии на фоне подлежащего мышечного слоя.
Таким образом, показана высокая эффективность мечения аутологичных лейкоцитов радиофармацевтической композицией, содержащей в качестве активного компонента 111In, с визуализацией до двух суток в очаге местного лучевого поражения, позволяющего проводить процедуры однофотонной эмиссионной компьютерной томографии (ОФЭКТ) на протяжении нескольких дней без дополнительного введения радиофармацевтической композиции.