Результат интеллектуальной деятельности: СОЛЬ ПРИСОЕДИНЕНИЯ КИСЛОТЫ СОЕДИНЕНИЯ, ИНГИБИРУЮЩЕГО Trk
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к соли присоединения кислоты 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевине, 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевине или 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевине, которая обладает ингибирующей Trk активностью и является пригодной в качестве профилактического и/или терапевтического средства от боли, злокачественной опухоли и т.п. (далее в настоящем описании в некоторых случаях сокращенно обозначаемой как "настоящее соединение"), и ее кристаллу и ее фармацевтической композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Семейство тропомиозин-рецепторных киназ (далее в настоящем описании сокращенно обозначаемых как "Trk") классифицируют как рецепторные тирозинкиназы, и оно включает TrkA, которая представляет собой высокоаффинный рецептор фактора роста нервов (далее в настоящем описании сокращенно обозначаемый как NGF), TrkB, которая является высокоаффинным рецептором нейротрофического фактора головного мозга (BDNF) и нейротрофина (далее в настоящем описании обозначаемого как NT)-4/5, и TrkC, которая является высокоаффинным рецептором NT-3. Все Trk-рецепторы экспрессируются в большом количестве в нервных тканях и участвуют в дифференцировке и поддержании функций нервных клеток (см. непатентный документ 1). При этом известно, что активация TrkA в периферических нервах NGF инициирует гипералгезию (см. непатентный документ 2), и на основании результатов клинических и доклинических испытаний с использованием антител против NGF или результатов доклинических испытаний с использованием низкомолекулярных ингибиторов Trk описано участие TrkA в ноцицептивной боли при остеоартрите, хронической боли в нижней части спины, ревматоидном артрите, переломе кости, интерстициальном цистите и хроническом панкреатите, нейропатической боли, а также боли при злокачественной опухоли, объединяющей оба описанных выше типа боли (см. непатентный документ 3-10). Кроме того, Trk-рецепторы экспрессируются злокачественными клетками, такими как нейробластома, рак щитовидной железы, рак легких, рак молочной железы, рак поджелудочной железы, рак толстого кишечника, рак предстательной железы и т.д., а также была описана возможность участия в пролиферации, миграции и метастазировании злокачественных клеток. В частности, слитые гены, являющиеся результатом слияния TrkA или TrkC с геном MPRIP, CD74, TPM3, TPR, TFG или ETV6, обнаруживают у части пациентов с раком щитовидной железы, раком легких, раком молочной железы, раком толстого кишечника или т.п. Описано, что в злокачественной опухоли, несущей такой слитый ген, Trk-киназа всегда является активированной, и соединение, обладающее ингибирующей Trk активностью, ингибирует пролиферацию злокачественных клеток. Кроме того, Trk-рецептор также экспрессируется воспалительными клетками, такими как тучные клетки, эозинофилы и т.д., иммунокомпетентными клетками, таким как T-клетки, B-клетки и т.д., и кератиноцитами и т.д., и описано, что он, вероятно, вовлечен в воспалительные заболевания, такие как язвенный колит, болезнь Крона и т.д., аллергические заболевания, такие как астма, ринит, атопический дерматит, и другие заболевания, такие как псориаз, (см. непатентный документ 11-15). Таким образом, соединения, обладающие ингибирующей Trk активностью, возможно, можно применять в терапии ноцицептивной боли, нейропатической боли и боли, объединяющей оба типа боли, злокачественной опухоли, воспалительных заболеваний, аллергических заболеваний, псориаза и т.д.
[0003] Принимая во внимание указанное выше, если предположить, что лекарственные средства, способные ингибировать Trk, созданы, ожидают, что ингибирующие Trk средства могут представлять собой новые типы профилактических и/или терапевтических средств против боли и т.п.
[0004] При этом в патентном документе 1 описан способ лечения или профилактики заболевания, регулируемых тирозинкиназой у человека или других млекопитающих, включающий введение человеку или другому млекопитающему, нуждающемуся в этом, соединения следующей ниже формулы (Ia), его соли, его изомера или его пролекарства.
[0005] Общая формула (Ia) является такой, как указано ниже:
[0006] 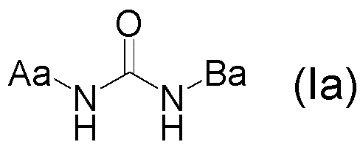
[0007] В формуле Aa выбран из группы, состоящей из следующих ниже (i)-(iii) и т.п.:
(i) фенила, который необязательно является замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из Ra1, ORa1, галогена и т.п.;
(ii) нафтила, который необязательно является замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из Ra1, ORa1, галогена и т.п., и
(iii) 5-6-членной моноциклической гетероарильной группы, содержащей от 1 до 3 гетероатомов, независимо выбранных из группы, состоящей из O, N, и S, которая необязательно является замещенной 1-3 заместителями, независимо выбранными из группы, состоящей из Ra1, ORa1, галогена и т.п.; и
Ba выбран из группы, состоящей из следующих ниже (i)-(iii) и т.п.:
(i) фенила, который необязательно является замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из -La-Ma, линейного или разветвленного C1-C5алкила, галогена и т.п.;
(ii) нафтила, который необязательно является замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из -La-Ma, линейного или разветвленного C1-C5алкила, галогена и т.п., и
(iii) 5-6-членной моноциклической гетероарильной группы, содержащей от 1 до 3 гетероатомов, независимо выбранных из группы, состоящей из O, N, и S, которая необязательно является замещенной 1-3 заместителями, независимо выбранными из группы, состоящей из -La-Ma, линейного или разветвленного C1-C5алкила, галогена и т.п.;
La выбран из группы, состоящей из -(CH2)ma-O-(CH2)la-, -(CH2)ma-C(O)-(CH2)la- и т.п., где переменные ma и la представляют собой целое число, независимо выбранное из 0-4;
Ma выбран из группы, состоящей из следующих ниже (i)-(iii) и т.п.:
(i) фенила, который необязательно является замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из Ra1, ORa1, галогена и т.п.;
(ii) нафтила, который необязательно является замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из Ra1, ORa1, галогена и т.п., и
(iii) 5-6-членной моноциклической гетероарильной группы, содержащей от 1 до 3 гетероатомов, независимо выбранных из группы, состоящей из O, N, и S, которая необязательно является замещенной 1-3 заместителями, независимо выбранными из группы, состоящей из Ra1, ORa1, галогена и т.п.;
где Ra1 независимо выбран из группы, состоящей из (a) водорода, (b) C1-C6алкила, (c) фенила, (d) 5-6-членного моноциклического гетероарила или 8-10-членного бициклического гетероарила, где каждый содержит от 1 до 4 гетероатомов, выбранных из группы, состоящей из O, N, и S, (e) C1-C3алкилфенила и (f) алкилгетероарила, содержащего от 1 до 4 гетероатомов, выбранных из группы, состоящей из O, N, и S; и если Ra1 не является водородом, то Ra1 необязательно является замещенным 1-3 заместителями, независимо выбранными из группы, состоящей из линейного, разветвленного или циклического C1-C5алкила, C1-C3алкокси, гидрокси, амино, C1-C3алкиламино, C2-C6диалкиламино, галогена, циано и нитро; и определения групп являются частично аннотированными.
[0008] В патентном документе 1 описано, что описываемое в нем соединение ингибирует KDR, и его используют для способа лечения заболеваний, опосредованных индуцируемыми VEGF путями передачи сигнала, у человека или других млекопитающих, в частности ретинопатии или ретинопатии недоношенных. Однако не раскрыто или не сделано предположение о том, что соединение, описываемое в указанном выше патентном документе, обладает ингибирующей Trk активностью, и в указанном выше патентном документе также конкретно не описано настоящее соединение.
[0009] Кроме того, в патентном документе 2 описано ингибирующее Trk соединение, представленное следующей ниже формулой (Ib), или его соль и лекарственное средство, содержащее такое соединение в качестве активного ингредиента.
[0010] Общая формула (Ib) является такой, как указано ниже:
[0011] 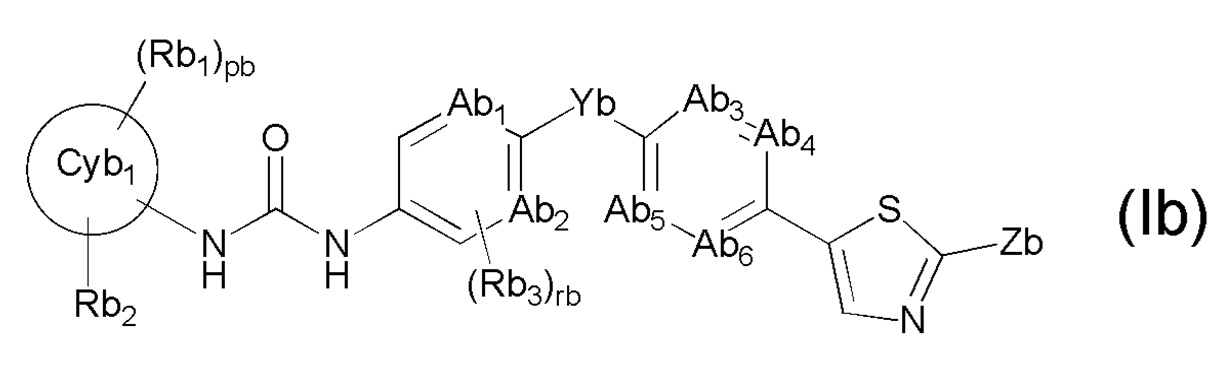
[0012] В формуле кольцо Cyb1 представляет собой C3-C10 моноциклическое углеродное кольцо или бициклическое углеродное кольцо, или 4-10-членное моноциклическое гетероциклическое кольцо или бициклическое гетероциклическое кольцо; Rb1 представляет собой галоген, C1-C6алкильную группу, которая может быть замещена галогеном или т.п.; Rb2 представляет собой (1) C1-C6алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из (i) галогена, (ii) гидроксильной группы и т.п., (2) атома водорода, (3) гидроксильной группы, (4) карбоксильной группы, (5) аминогруппы, (6)
[0013] 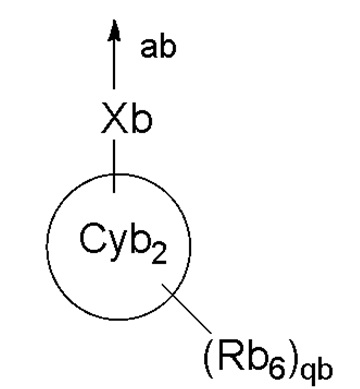
[0014] или т.п.; стрелка ab представляет собой связь с кольцом Cyb1; Xb представляет собой связь, атом кислорода, C=O, или NH; кольцо Cyb2 представляет собой C3-C10 моноциклическое углеродное кольцо или бициклическое углеродное кольцо, или 4-10-членное моноциклическое гетероциклическое кольцо или бициклическое гетероциклическое кольцо; Rb6 представляет собой (1) C1-C6алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из (i) галогена, (ii) гидроксильной группы и т.п., (2) галогена, (3) C1-C4алкоксигруппы или т.п.; каждый из Ab1 и Ab2 независимо представляет собой =CRb3-, =CH- или =N-; каждый из Ab3, Ab4, Ab5 и Ab6 независимо представляет собой =CRb4- или =N-; Rb3 представляет собой галоген или т.п.; Rb4 представляет собой галоген или т.п.; Yb представляет собой атом кислорода, атом серы, который может являться окисленным, метиленовую группу или C=O; Zb представляет собой
[0015] 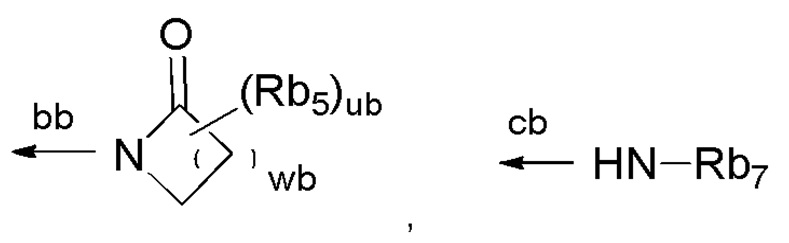
[0016] или т.п.; Rb5 представляет собой галоген, гидроксильную группу или C1-C4алкильную группу, которая может быть замещена гидроксильной группой; каждый Rb7s независимо представляет собой C1-C6алкильную группу, которая может быть замещена заместителем, выбранным из группы, состоящей из галогена, гидроксильной группы и т.п., атома водорода или т.п.; стрелки bb и cb и т.п. представляют собой связь с тиазольным кольцом; pb представляет собой целое число от 0 до 5; qb представляет собой целое число от 0 до 7; rb представляет собой целое число от 0 до 2; wb представляет собой целое число от 1 до 5; и ub представляет собой целое число от 0 до 2, при условии, что если каждый из pb, qb, rb, и ub представляет собой целое число 2 или более, то каждый из Rb1, Rb6, Rb3 и Rb5 независимо может представлять собой одно и тоже или являться отличным; и определения групп являются частично аннотированными.
[0017] В этом патентном документе 2 описано, что описываемое в нем соединение ингибирует Trk, таким образом, оно может стать профилактическим и/или терапевтическим средством от боли и т.п.
[0018] Настоящее изобретение относится к соли присоединения кислоты 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевине, 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевинк или 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевине, и в любой из приводимых ссылок не описано и не предположено, что указанная выше соль присоединения кислоты обладает селективным блокирующим Trk действием и устойчиво ингибирует повышенную проницаемость сосудов NGF, и не характеризуется взаимодействием лекарственных средств, и, кроме того, обладает превосходной растворимостью и всасываемостью по сравнению с такими свободными основаниями.
ЦИТИРУЕМЫЕ ССЫЛКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0019] Патентный документ 1: WO 2003/068228
Патентный документ 2: WO 2013/161919
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
Непатентный документ 1: Annual Review of Biochemistry, Vol. 72, pp.609-642, 2003.
Непатентный документ 2: Trends in Pharmacological Sciences, Vol. 27, pp.85-91, 2006.
Непатентный документ 3: New England Journal of Medicine, Vol. 363, pp. 1521-1531, 2010.
Непатентный документ 4: Pain, Vol. 152, pp.2248-2258, 2011.
Непатентный документ 5: Journal of Urology, Vol. 185, pp.1716-1721, 2011.
Непатентный документ 6: Pain, Vol. 116, pp.8-16, 2005.
Непатентный документ 7: Bone, Vol. 48, pp.389-398, 2011.
Непатентный документ 8: Molecular Pain, Vol. 6, p.87, 2010.
Непатентный документ 9: Journal of Pharmacological and Experimental Therapeutics, Vol. 322, pp. 282-287, 2007.
Непатентный документ 10: Gastroenterology, Vol. 141, pp. 370-377, 2011.
Непатентный документ 11: Expert Opinion Therapeutic Patents, Vol. 19, pp. 305-319, 2009.
Непатентный документ 12: Gut, Vol. 46, pp.670-679, 2000.
Непатентный документ 13: Current Opinion in Allergy and Clinical Immunology, Vol. 10, pp. 8-13, 2010.
Непатентный документ 14: Inflammation and Allergy Drug Targets, Vol. 9, pp. 173-180, 2010.
Непатентный документ 15: Journal of Investigative Dermatology, Vol. 126, pp. 1719-1727, 2006.
Непатентный документ 16: Nature Medicine, Vol. 19, pp.1469-1472, 2013.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ ПОСРЕДСТВОМ ИЗОБРЕТЕНИЯ
[0021] Для предоставления профилактического и/или терапевтического средства для связанных с Trk заболеваний задача настоящего изобретения заключается в получении соединения, которое обладает селективной ингибирующей Trk активностью и устойчиво ингибирует повышенную проницаемость сосудов NGF, и не характеризуется взаимодействием лекарственных средств и, кроме того, обладает превосходной растворимостью и всасываемостью по сравнению с такими свободными основаниями. Описано соединение, обладающее такими свойствами.
СРЕДСТВА РЕШЕНИЯ ЗАДАЧ
[0022] Для решения описанной выше задачи авторы настоящего изобретения провели обширные и тщательные исследования. В результате было выявлено, что настоящее соединение представляет собой соединение, которое обладает селективной ингибирующей Trk активностью и устойчиво ингибирует повышенную проницаемость сосудов NGF, и не характеризуется взаимодействием лекарственных средств, и, кроме того, обладает превосходной растворимостью и всасываемостью по сравнению с такими свободными основаниями, что привело к осуществлению настоящего изобретения.
[0023] В частности, настоящее изобретение относится к тому, что указано ниже:
[1] Соль присоединения кислоты соединения, представленная формулой(A):
[0024] 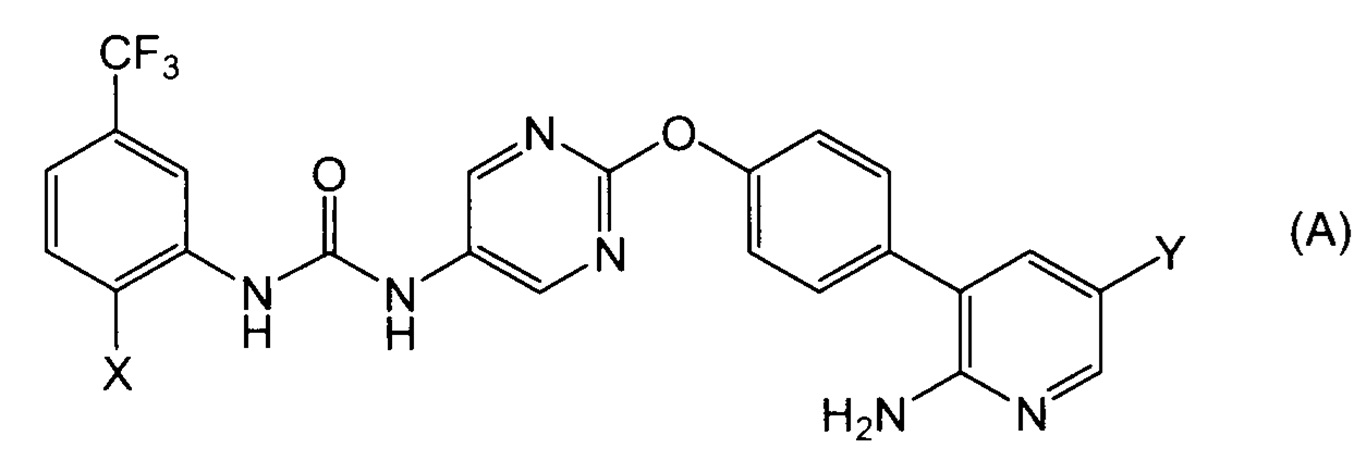
[0025] где X представляет собой метансульфонильную группу, 3-пиридильную группу или 1-пиразолильную группу; если X представляет собой метансульфонильную группу или 1-пиразолильную группу, то Y представляет собой атом хлора; и если X представляет собой 3-пиридильную группу, то Y представляет собой атом фтора.
[2] Соль, как указано выше в пункте [1], которая представляет собой соль присоединения кислоты 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевину.
[3] Соль, как указано выше в пункте [2], где соль присоединения кислоты представляет собой пара-толуолсульфонат, бензолсульфонат, метансульфонат, гидрохлорид или гидробромид.
[4] Пара-толуолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины.
[5] Соль, как указано выше в пункте [4], где соль представляет собой кристалл.
[6] Соль, как указано выше в пункте [5], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,35, 7,74, 9,98, 11,08, 11,42, 12,68, 13,22, 14,83, 15,42, 15,98, 16,89, 17,33, 17,86, 18,29, 19,00, 19,46, 20,56, 20,92, 21,47, 22,04, 23,82 и 24,49.
[7] Соль, как указано выше в пункте [5] или [6], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,35, 7,74, 9,98, 11,08, 11,42, 12,68, 13,22, 14,83, 15,42, 15,98, 16,89, 17,33, 17,86, 18,29, 19,00, 19,46, 20,56, 20,92, 21,47, 22,04, 23,82 и 24,49.
[8] Соль, как указано в любом из указанных выше пунктов [5]-[7], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 1.
[9] Бензолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины.
[10] Соль, как указано выше в пункте [9], где соль представляет собой кристалл.
[11] Соль, как указано выше в пункте [10], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,77, 7,78, 10,26, 11,20, 11,50, 13,54, 15,65, 16,02, 17,13, 18,01, 18,41, 18,70, 19,52, 20,25, 20,64, 21,65, 21,95, 22,66, 23,49 и 24,57.
[12] Соль, как указано выше в пункте [10] или [11], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,77, 7,78, 10,26, 11,20, 11,50, 13,54, 15,65, 16,02, 17,13, 18,01, 18,41, 18,70, 19,52, 20,25, 20,64, 21,65, 21,95, 22,66, 23,49 и 24,57.
[13] Соль, как указано в любом из указанных выше пунктов [10]-[12], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 2.
[14] Метансульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины.
[15] Соль, как указано выше в пункте [14], где соль представляет собой кристалл.
[16] Соль, как указано выше в пункте [15], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 4,63, 7,04, 9,33, 14,11, 18,74, 20,43, 21,35, 23,31 и 24,80.
[17] Соль, как указано выше в пункте [15] или [16], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 4,63, 7,04, 9,33, 14,11, 18,74, 20,43, 21,35, 23,31 и 24,80.
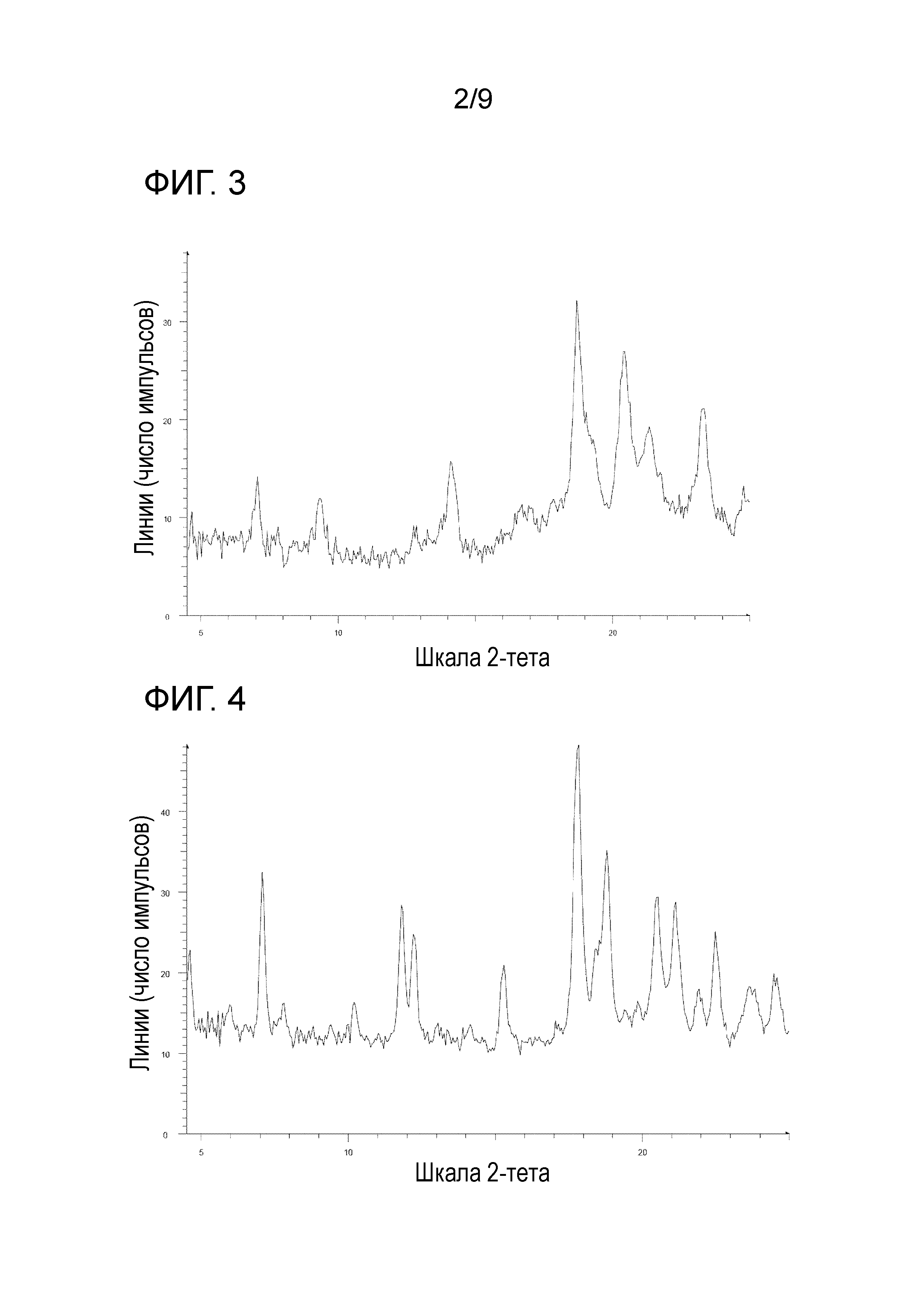
[18] Соль, как указано в любом из указанных выше пунктов [15]-[17], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 3.
[19] Гидрохлорид 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины.
[20] Соль, как указано выше в пункте [19], где соль представляет собой кристалл.
[21] Соль, как указано выше в пункте [20], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 4,60, 5,95, 7,06, 7,75, 9,38, 10,19, 11,82, 12,21, 13,01, 15,27, 17,81, 18,49, 18,79, 19,89, 20,52, 21,12, 21,96, 22,51, 23,67 и 24,54.
[22] Соль, как указано выше в пункте [20] или [21], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 4,60, 5,95, 7,06, 7,75, 9,38, 10,19, 11,82°, 12,21, 13,01, 15,27, 17,81, 18,49, 18,79, 19,89, 20,52, 21,12, 21,96, 22,51, 23,67 и 24,54.
[23] Соль, как указано в любом из указанных выше пунктов [20]-[22], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 4.
[24] Соль, как указано выше в пункте [1], которая представляет собой соль присоединения кислоты 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины.
[25] Соль, как указано выше в пункте [24], где соль присоединения кислоты представляет собой пара-толуолсульфонат, бензолсульфонат, метансульфонат, гидрохлорид или гидробромид.
[26] Ди(пара-толуолсульфонат) 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины.
[27] Соль, как указано выше в пункте [26], где соль представляет собой кристалл.
[28] Соль, как указано выше в пункте [27], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,11, 6,29, 7,76, 9,65, 10,18, 12,30, 12,57, 13,23, 13,59, 14,05, 14,85, 15,47, 16,94, 17,98, 18,52, 18,79, 19,32, 20,58, 21,25, 21,55, 22,11, 22,73, 23,20 и 24,36.
[29] Соль, как указано выше в пункте [27] или [28], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,11, 6,29, 7,76, 9,65, 10,18, 12,30, 12,57, 13,23, 13,59, 14,05, 14,85, 15,47, 16,94, 17,98, 18,52, 18,79, 19,32, 20,58, 21,25, 21,55, 22,11, 22,73, 23,20 и 24,36.
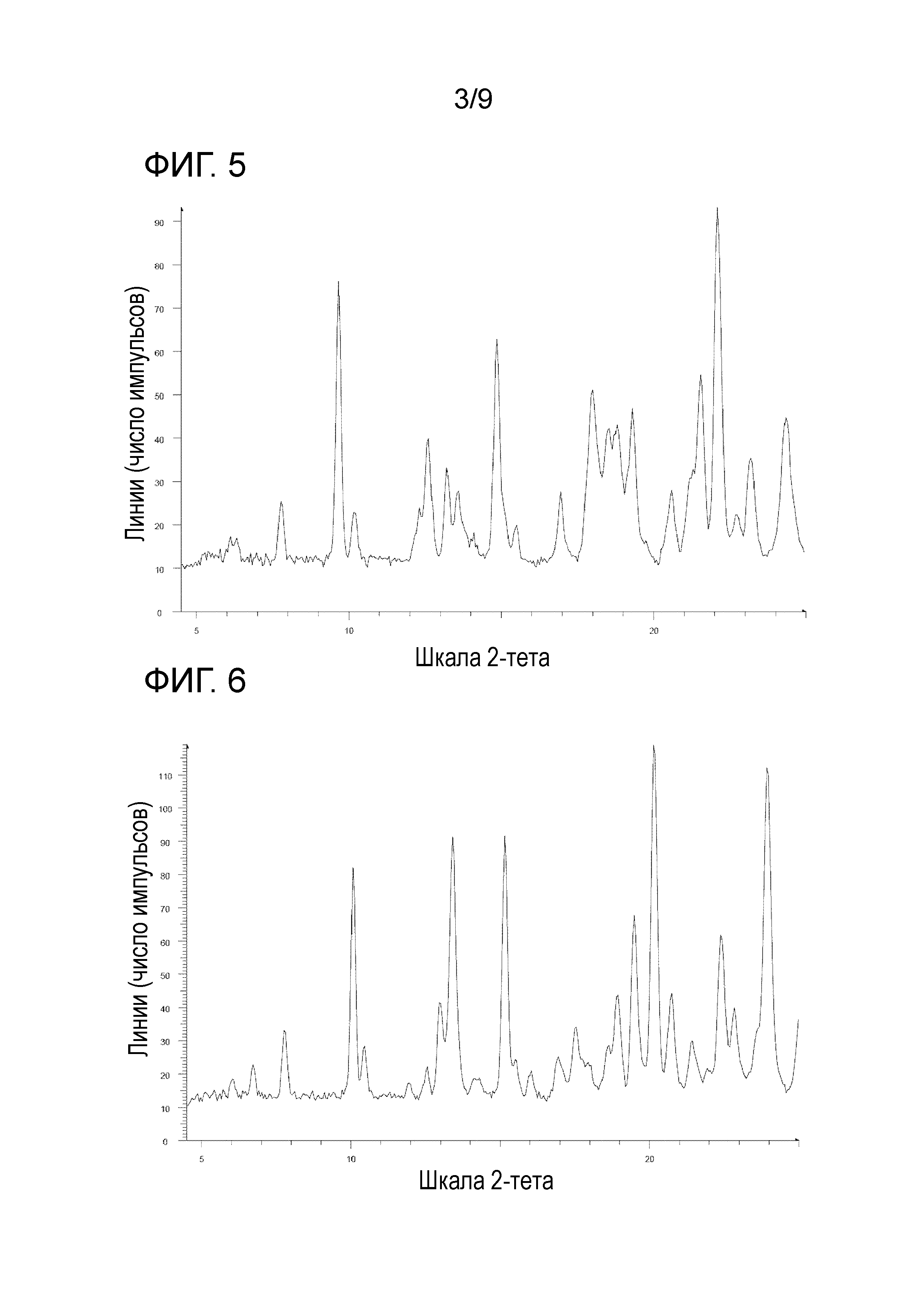
[30] Соль, как указано в любом из указанных выше пунктов [27]-[29], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 5.
[31] Дибензолсульфонат 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины.
[32] Соль, как указано выше в пункте [31], где соль представляет собой кристалл.
[33] Соль, как указано выше в пункте [32], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,99, 6,71, 7,78, 10,08, 10,42, 11,93, 12,53, 12,96, 13,41, 14,15, 15,16, 15,55, 16,03, 16,93, 17,52, 17,95, 18,63, 18,91, 19,50, 20,18, 20,73, 21,43, 22,43, 22,84, 23,60 и 23,97.
[34] Соль, как указано выше в пункте [32] или [33], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,99, 6,71, 7,78, 10,08, 10,42, 11,93, 12,53, 12,96, 13,41, 14,15, 15,16, 15,55, 16,03, 16,93, 17,52, 17,95, 18,63, 18,91, 19,50, 20,18, 20,73, 21,43, 22,43, 22,84, 23,60 и 23,97.
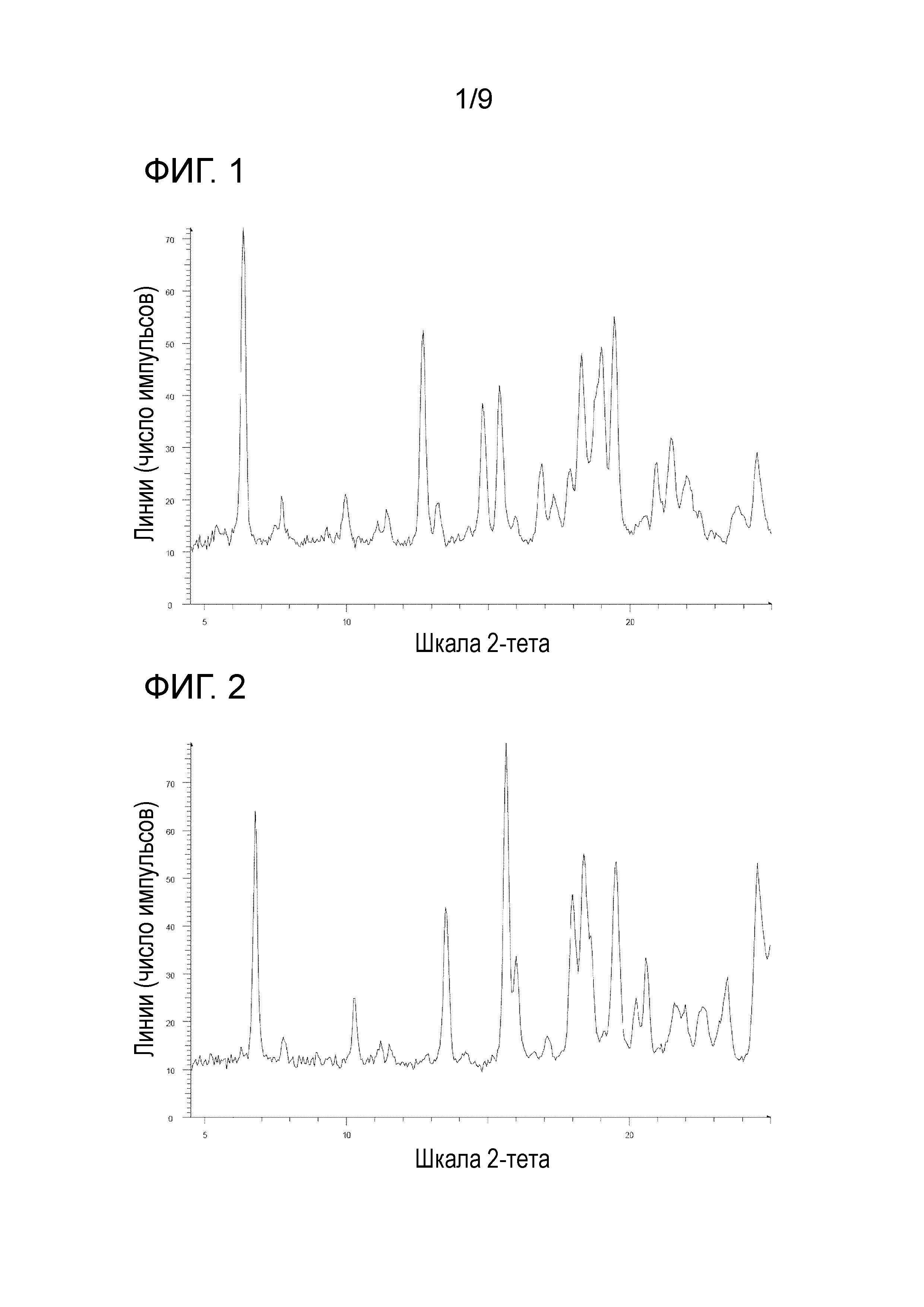
[35] Соль, как указано в любом из указанных выше пунктов [32]-[34], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 6.
[36] Диметансульфонат 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины.
[37] Соль, как указано выше в пункте [36], где соль представляет собой кристалл.
[38] Соль, как указано выше в пункте [37], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,30, 5,93, 8,91, 9,34, 9,64, 10,55, 11,77, 12,52, 12,92, 13,72, 14,25, 15,47, 15,91, 16,87°, 17,87, 18,77, 19,30, 19,62, 20,77, 21,23, 21,61, 22,47, 23,36, 23,78 и 24,51.
[39] Соль, как указано выше в пункте [37] или [38], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,30, 5,93, 8,91, 9,34, 9,64, 10,55, 11,77, 12,52, 12,92, 13,72, 14,25, 15,47, 15,91, 16,87, 17,87, 18,77, 19,30, 19,62, 20,77, 21,23, 21,61, 22,47, 23,36, 23,78 и 24,51.
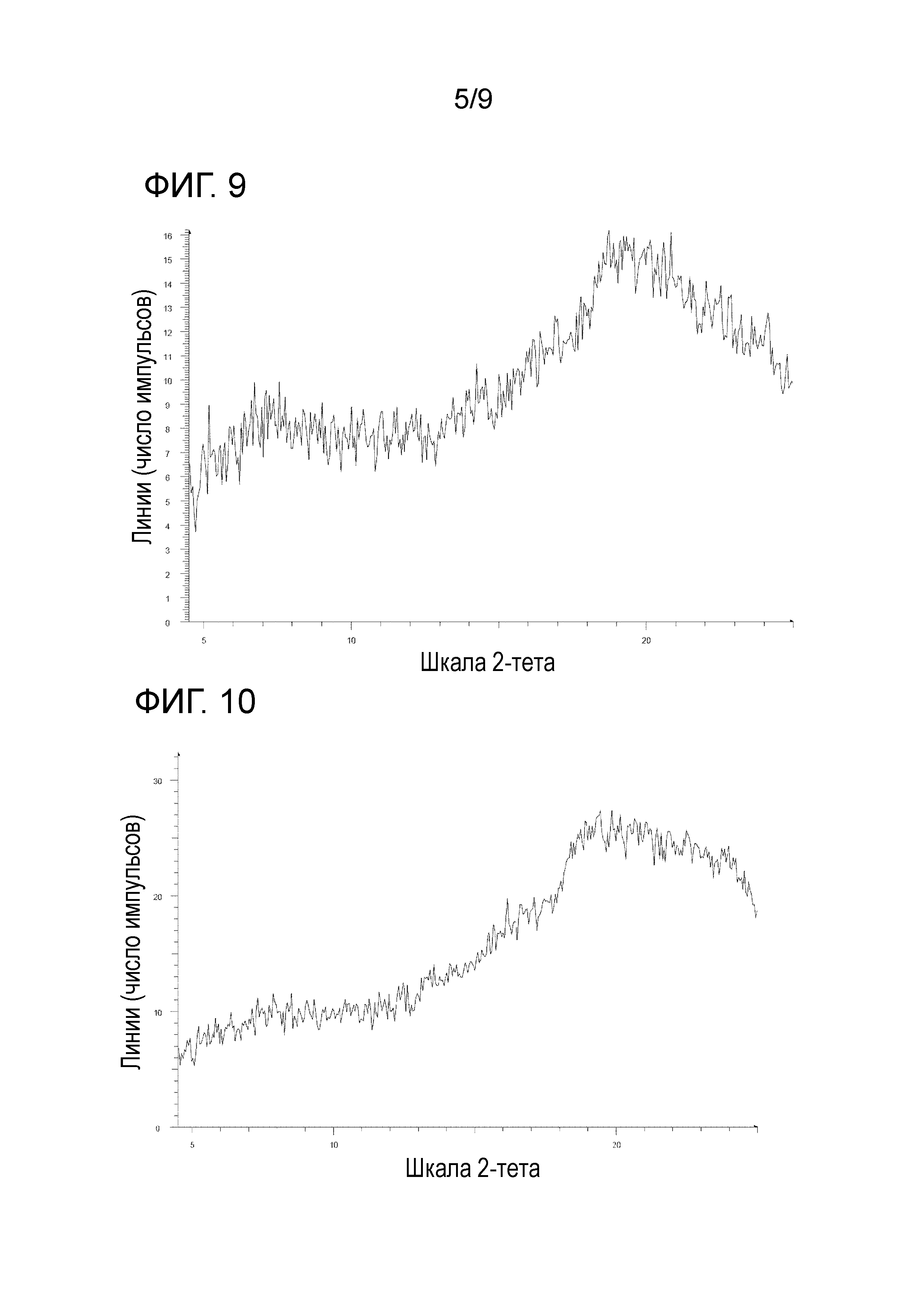
[40] Соль, как указано в любом из указанных выше пунктов [37]-[39], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 7.
[41] Дигидрохлорид 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины.
[42] Соль, как указано выше в пункте [41], где соль представляет собой кристалл.
[43] Соль, как указано выше в пункте [42], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,03, 6,84, 8,30, 9,87, 12,52, 13,70, 13,93, 14,90, 15,88, 18,31, 19,81, 20,94, 22,47, 22,89 и 24,08.
[44] Соль, как указано выше в пункте [42] или [43], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,03, 6,84, 8,30, 9,87, 12,52, 13,70, 13,93, 14,90, 15,88, 18,31, 19,81, 20,94, 22,47, 22,89 и 24,08.
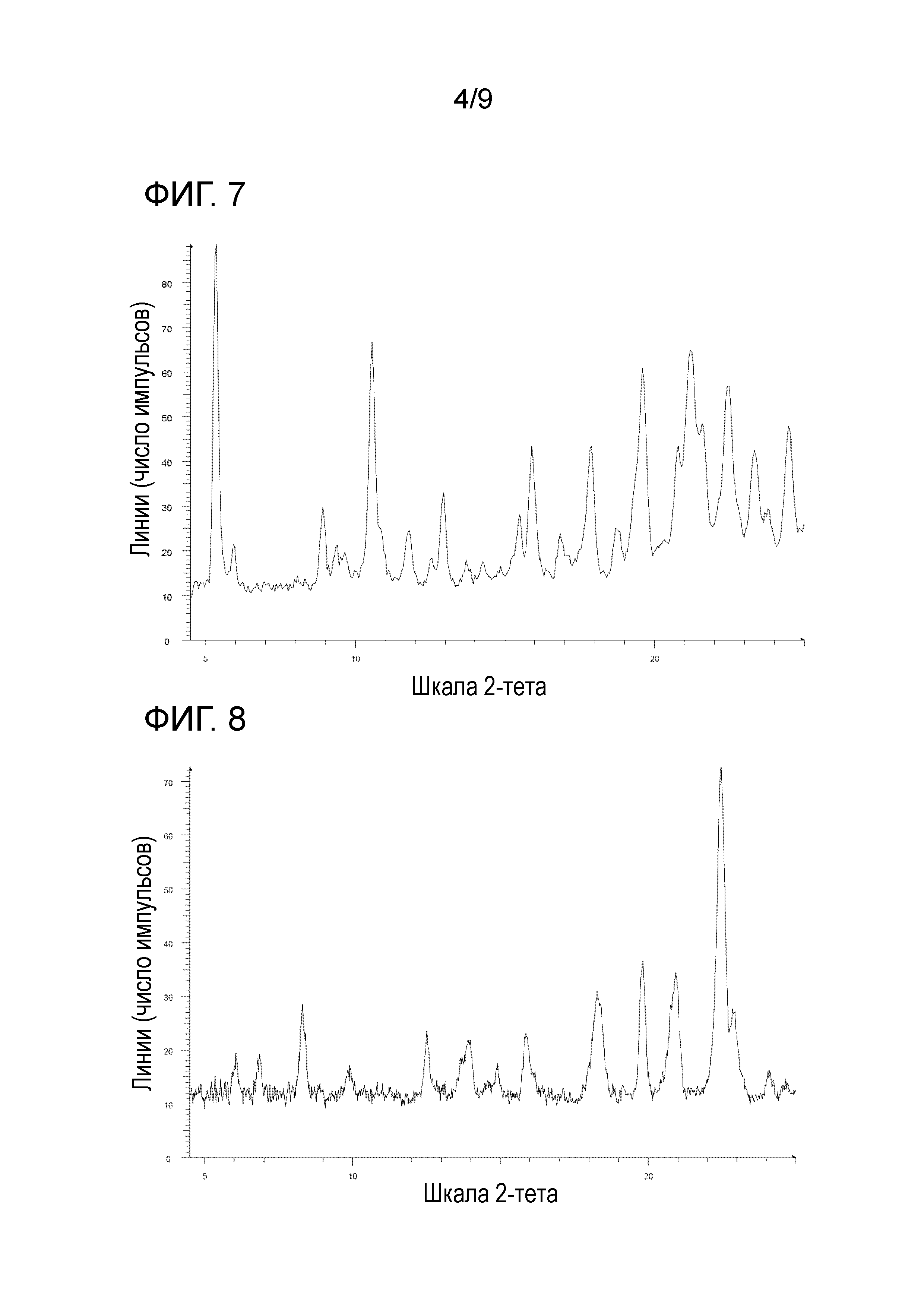
[45] Соль, как указано в любом из указанных выше пунктов [42]-[44], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 8.
[46] Соль, как указано выше в пункте [1], которая представляет собой соль присоединения кислоты 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины.
[47] Соль, как указано выше в пункте [46], где соль присоединения кислоты представляет собой пара-толуолсульфонат, бензолсульфонат, метансульфонат, гидрохлорид или гидробромид.
[48] Пара-толуолсульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины.
[49] Соль, как указано выше в пункте [48], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 9.
[50] Бензолсульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины.
[51] Соль, как указано выше в пункте [50], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 10.
[52] Метансульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины.
[53] Соль, как указано выше в пункте [52], где соль представляет собой кристалл.
[54] Соль, как указано выше в пункте [53], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,42, 8,64, 8,97, 9,64, 10,39, 11,85, 13,13, 16,02, 16,27, 16,89, 17,39, 18,19, 19,53, 20,49, 20,83, 21,89, 22,59 и 23,90.
[55] Соль, как указано выше в пункте [53] или [54], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,42, 8,64, 8,97, 9,64, 10,39, 11,85, 13,13, 16,02, 16,27, 16,89, 17,39, 18,19, 19,53, 20,49, 20,83, 21,89, 22,59 и 23,90.
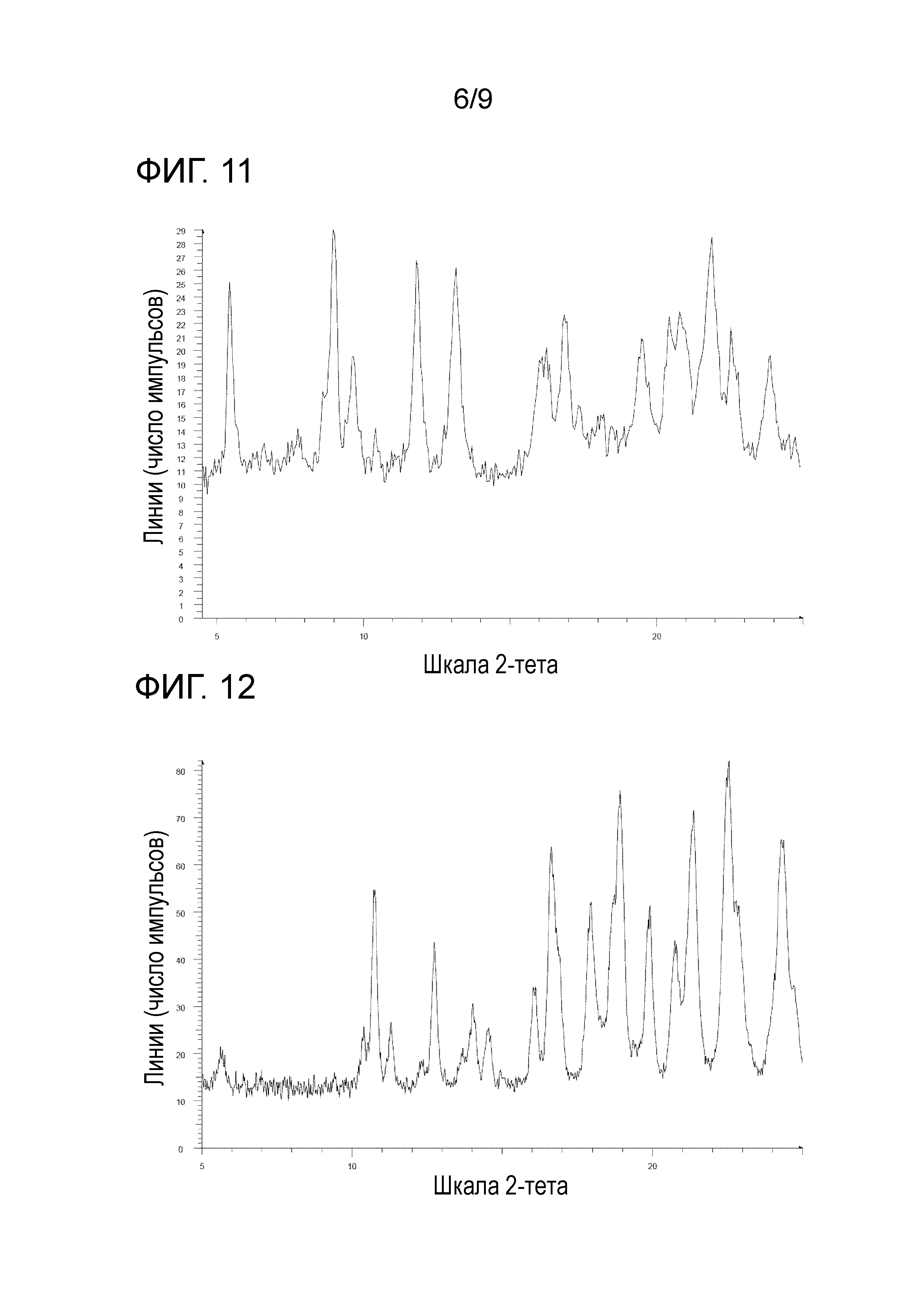
[56] Соль, как указано в любом из указанных выше пунктов [53]-[55], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 11.
[57] Гидрохлорид 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины.
[58] Соль, как указано выше в пункте [57], где соль представляет собой кристалл.
[59] Соль, как указано выше в пункте [58], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,63, 10,37, 10,73, 11,29, 12,30, 12,73, 13,68, 14,03, 14,53, 16,07, 16,64, 17,93, 18,66, 18,91, 19,89, 20,76, 21,35, 22,52, 22,84, 24,33 и 24,74.
[60] Соль, как указано выше в пункте [58] или [59], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,63, 10,37, 10,73, 11,29, 12,30, 12,73, 13,68, 14,03, 14,53, 16,07, 16,64, 17,93, 18,66, 18,91, 19,89, 20,76, 21,35, 22,52, 22,84, 24,33 и 24,74.
[61] Соль, как указано в любом из указанных выше пунктов [58]-[60], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 12.
[62] Фармацевтическая композиция, содержащая соль, как указано выше в пункте [1].
[63] Фармацевтическая композиция, содержащая соль присоединения кислоты 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины.
[64] Фармацевтическая композиция, содержащая соль присоединения кислоты 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины.
[65] Фармацевтическая композиция, содержащая соль присоединения кислоты 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины.
[66] Композиция, как указано в любом из указанных выше пунктов [62]-[65], которая является ингибитором Trk.
[67] Композиция как указано в любом из указанных выше пунктов [62]-[65], которая представляет собой профилактическое и/или терапевтическое средство для связанного с Trk заболевания.
[68] Композиция, как указано выше в пункте [67], где связанное с Trk заболевание представляет собой боль, зуд, расстройство нижних мочевыводящих путей, астму, аллергический ринит, воспалительное заболевание кишечника, болезнь Шагаса или злокачественную опухоль.
[69] Композиция, как указано выше в пункте [68], где боль представляет собой боль при остеоартрите, боль при злокачественной опухоли, хроническая боль в нижней части спины, боль в нижней части спины при остеопорозе, боль при переломе кости, боль при ревматоидном артрите, нейропатическую боль, постгерпетическую боль, боль при диабетической нейропатии, фибромиалгию, боль при панкреатите, боль при интерстициальном цистите, боль при эндометриозе, боль при синдроме раздраженного кишечника, мигрень, послеоперационную боль или боль при пульпите.
[70] Композиция, как указано выше в пункте [68], где злокачественная опухоль представляет собой рак молочной железы, рак толстого кишечника, рак легких, рак щитовидной железы, рак кожи, лейкоз, опухоли слюнной железы, нейроэндокринную опухоль, лимфому, опухоль головного мозга, нейробластому, рак яичника, рак поджелудочной железы, мезотелиому, карциному пищевода, саркому легких, медуллобластому, глиобластому, рак толстого кишечника, рак печени, ретинобластому, рак почки, рак мочевого пузыря, остеосаркому, рак желудка, рак матки, рак наружных половых органов, рак тонкого кишечника, рак предстательной железы, рак желчных протоков, грыжу мочеточника, карциному коры надпочечников или рак головы и шеи.
[71] Лекарственное средство, содержащее комбинацию соединения, как указано выше в пункте [1], [2], [24] или [46], по меньшей мере с одним, выбранным из ацетоминофена, нестероидного противовоспалительного лекарственного средства, опиоида, антидепрессанта, противоэпилептического средства, антагониста N-метил-D-аспартата, миорелаксанта an противоаритмического средства, стероида и бисфосфоната.
[72] Лекарственное средство, содержащее комбинацию соединения, как указано выше в пункте [1], [2], [24] или [46], по меньшей мере с одним, выбранным из алкилирующего средства, метаболического антагониста, противораковых антибиотиков, противоракового препарата на основе растительного сырья, гормонального лекарственного средство, соединения платины, ингибитора топоизомеразы, ингибитора киназы, антитела против CD20, антитела против HER2, антитела против EGFR, антитела против VEGF, антитела против PD-1 и антитела против PD-L1.
[73] Способ предотвращения и/или лечения связанного с Trk заболевания, включающий введение пациенту эффективного количества соединения, как указано выше в пункте [1], [2], [24] или [46].
[75] Использование соединения, как указано выше в пункте [1], [2], [24] или [46], для получения профилактического и/или терапевтического средства для связанного с Trk заболевания.
[76] Соль, как указано выше в пункте [5], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,16, 5,57, 7,01, 9,62, 9,97, 10,83, 11,15, 12,20, 13,47, 14,63, 15,81, 16,30, 17,63, 18,26, 19,28, 19,93, 20,72, 21,25, 21,73, 22,88, 23,51, 24,30 и 24,74.
[77] Соль, как указано выше в пункте [5] или [76], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 5,16, 5,57, 7,01, 9,62, 9,97, 10,83, 11,15, 12,20, 13,47, 14,63, 15,81, 16,30, 17,63, 18,26, 19,28, 19,93, 20,72, 21,25, 21,73, 22,88, 23,51, 24,30 и 24,74.
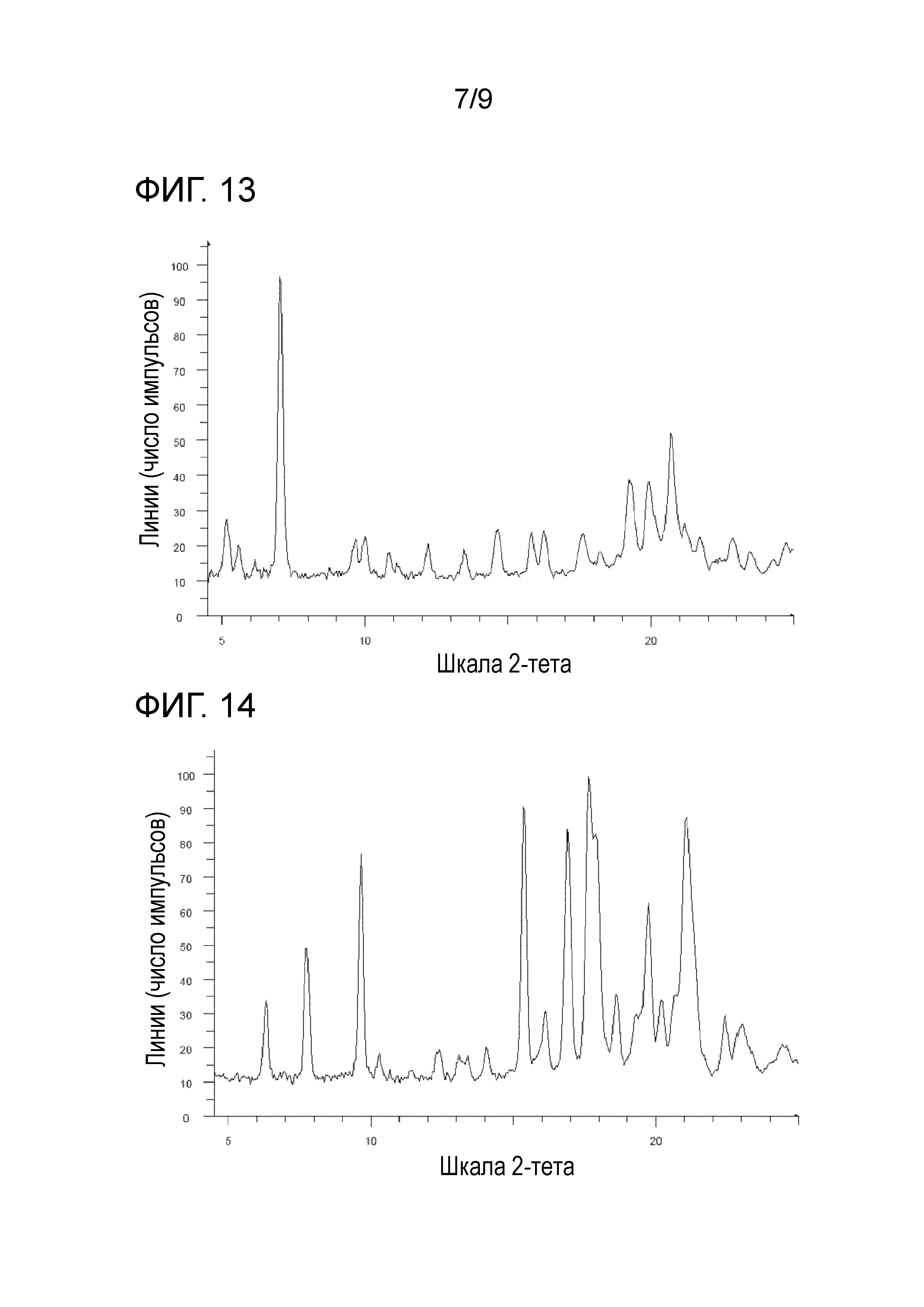
[78] Соль, как указано выше в пункте [5], [76] или [77], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 13.
[79] Соль, как указано выше в пункте [5], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,30, 7,72, 9,63, 10,27, 11,44, 12,39, 13,11, 13,36, 14,10, 15,40, 16,14, 16,94, 17,69, 17,90, 18,65, 19,33, 19,73, 20,23, 20,68, 21,09, 22,44, 23,02 и 24,51.
[80] Соль, как указано выше в пункте [5] или [79], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,30, 7,72, 9,63, 10,27, 11,44, 12,39, 13,11, 13,36, 14,10, 15,40, 16,14, 16,94, 17,69, 17,90, 18,65, 19,33, 19,73, 20,23, 20,68, 21,09, 22,44, 23,02 и 24,51.
[81] Соль, как указано выше в пункте [5], [79] или [80], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 14.
[82] Соль, как указано выше в пункте [10], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,96, 7,87, 8,69, 9,44, 10,02, 10,55, 12,51, 13,59, 15,02, 15,65, 16,42, 16,69, 17,00, 17,98, 18,91, 20,44, 20,74, 21,04, 21,44, 22,79, 24,22 и 24,37.
[83] Соль, как указано выше в пункте [10] или [82], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,96, 7,87, 8,69, 9,44, 10,02, 10,55, 12,51, 13,59, 15,02, 15,65, 16,42, 16,69, 17,00, 17,98, 18,91, 20,44, 20,74, 21,04, 21,44, 22,79, 24,22 и 24,37.
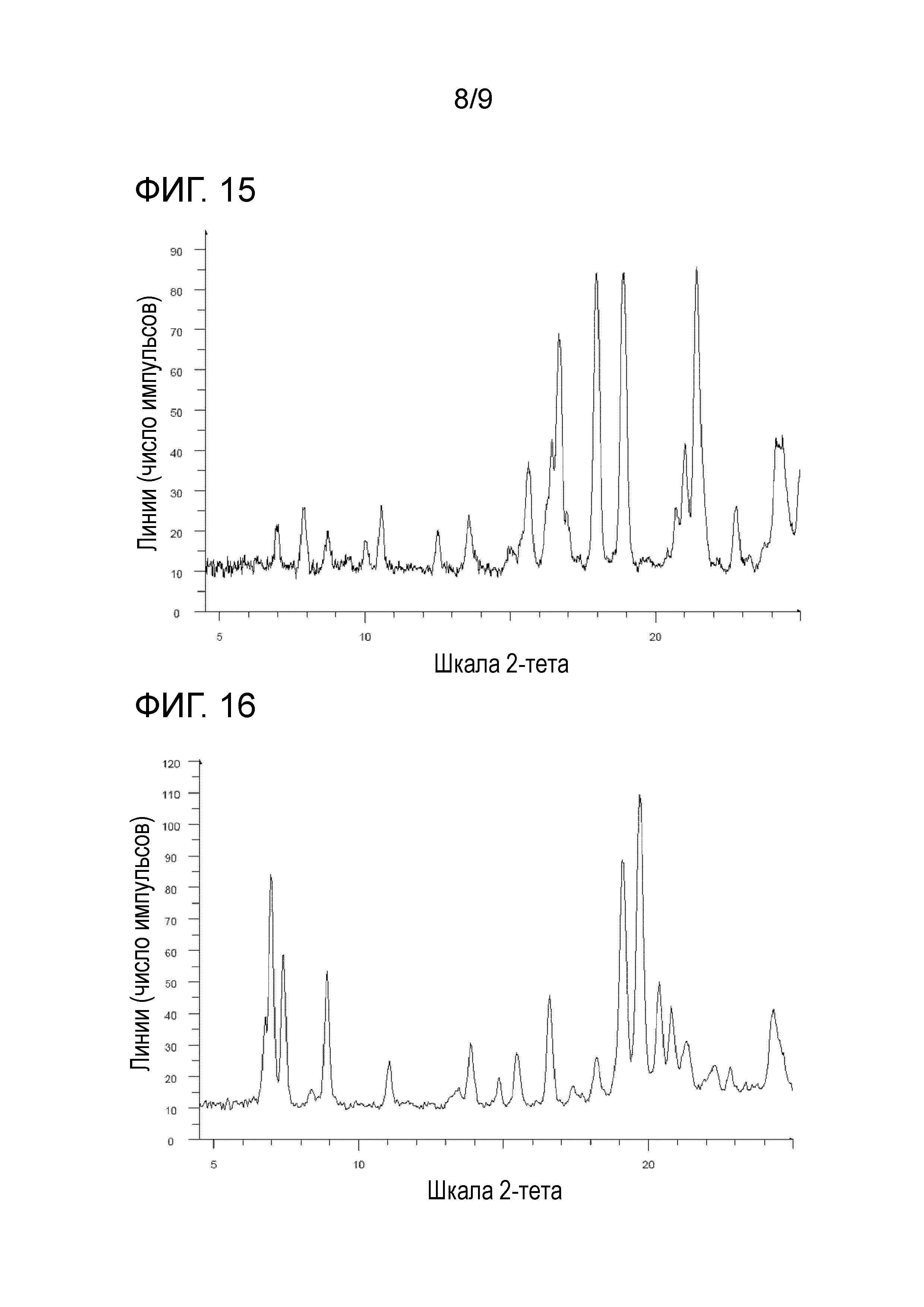
[84] Соль, как указано выше в пункте [10], [82] или [83], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 15.
[85] Соль, как указано выше в пункте [10], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,70, 6,97, 7,37, 8,36, 8,88, 11,04, 13,40, 13,88, 14,84, 15,48, 16,59, 17,40, 18,24, 19,12, 19,73, 20,38, 20,83, 21,32, 22,30, 22,85 и 24,33.
[86] Соль, как указано выше в пункте [10] или [85], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,70, 6,97, 7,37, 8,36, 8,88, 11,04, 13,40, 13,88, 14,84, 15,48, 16,59, 17,40, 18,24, 19,12, 19,73, 20,38, 20,83, 21,32, 22,30, 22,85 и 24,33.
[87] Соль, как указано выше в пункте [10], [85] или [86], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 16.
[88] Гидробромид 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины.
[89] Соль, как указано выше в пункте [88], где соль представляет собой кристалл.
[90] Соль, как указано выше в пункте [89], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,28, 12,53, 14,15, 15,51, 17,35, 18,80, 19,40, 21,48, 22,67, 23,44 и 24,15.
[91] Соль, как указано выше в пункте [89] или [90], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,28, 12,53°, 14,15°, 15,51°, 17,35°, 18,80°, 19,40°, 21,48°, 22,67°, 23,44° и 24,15°.
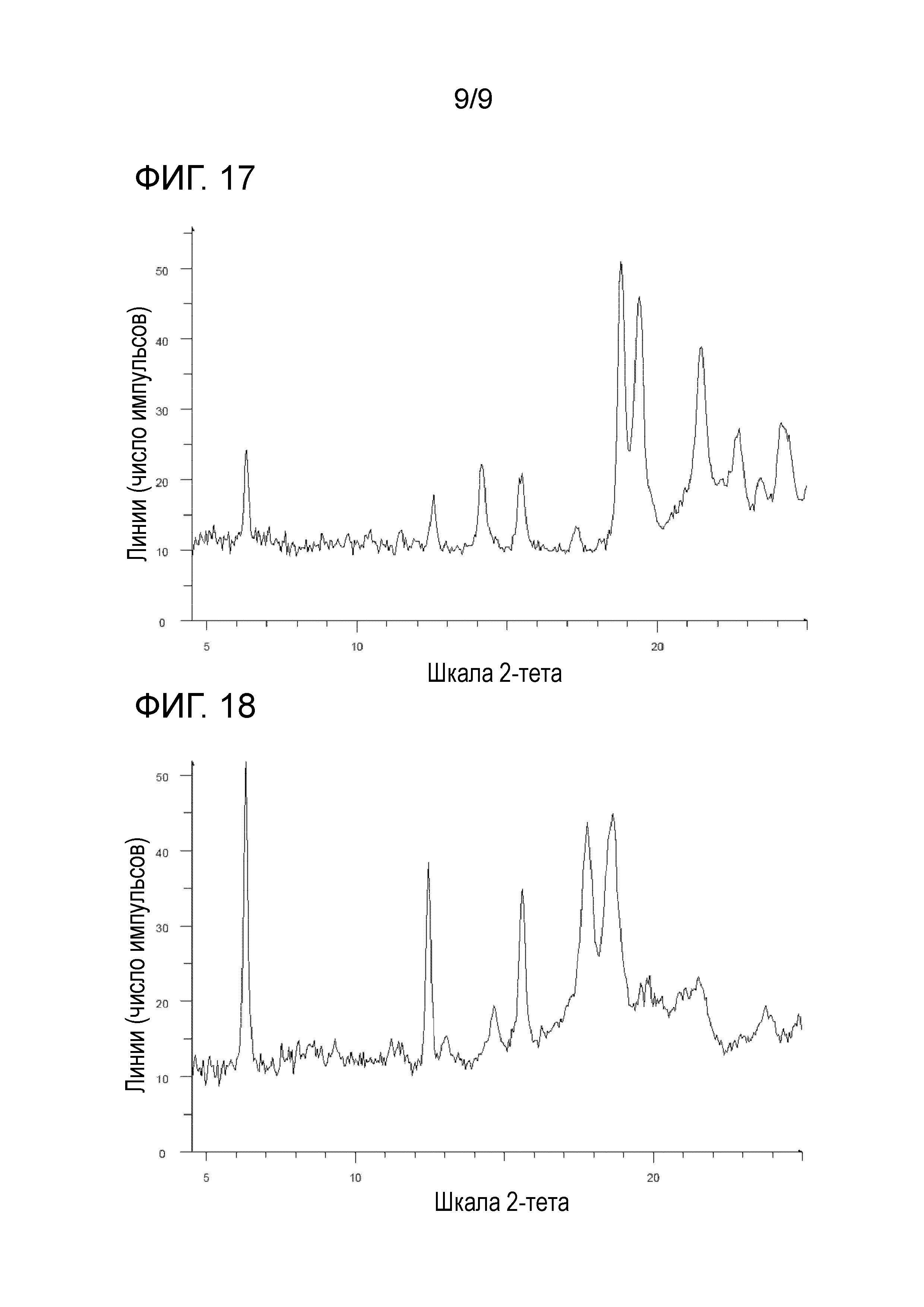
[92] Соль, как указано в любом из указанных выше пунктов [89]-[91], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 17.
[93] Соль, как указано выше в пункте [5], по меньшей мере с двумя или более пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,30, 12,44, 13,00, 14,68, 15,61, 17,79, 18,62, 21,54 и 23,82.
[94] Соль, как указано выше в пункте [5] или [93], с пиками при 2θ в порошковой рентгеновской дифрактограмме, выбранными из приблизительно 6,30, 12,44, 13,00, 14,68, 15,61, 17,79, 18,62, 21,54 и 23,82.
[95] Соль, как указано выше в пункте [5], [93] или [94], характеризующаяся диаграммой порошковой рентгеновской дифрактограммы, представленной на фиг. 18.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0026] Настоящее соединение обладает селективной ингибирующей Trk активностью и, таким образом, является пригодным в качестве профилактического и/или терапевтического средства для связанных с Trk заболеваний, таких как боль, зуд, расстройство нижних мочевыводящих путей, астма, аллергический ринит, воспалительное заболевание кишечника, болезнь Шагаса, злокачественная опухоль и т.д.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0027] На фиг. 1 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла (кристалла A) пара-толуолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 1 по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 2 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла (кристалла A) бензолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 2, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 3 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла метансульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 3, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 4 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла гидрохлорида 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевинв (на фиг. 4, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 5 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла ди(пара-толуолсульфоната)1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины (на фиг. 5, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 6 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла дибензолсульфоната 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины (на фиг. 6, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 7 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла диметансульфоната 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины (на фиг. 7, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 8 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла дигидрохлорида 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины (на фиг. 8, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 9 представлена диаграмма порошковой рентгеновской дифрактограммы аморфного вещества пара-толуолсульфоната 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины (на фиг. 9, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 10 представлена диаграмма порошковой рентгеновской дифрактограммы аморфного вещества бензолсульфоната 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины (на фиг. 10, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 11 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла метансульфоната 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины (на фиг. 11, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 12 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла гидрохлорида 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины (на фиг. 12, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 13 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла (кристалла B) пара-толуолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 13, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 14 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла (кристалла I) пара-толуолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 14, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 15 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла (кристалла B) бензолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 15, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 16 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла (кристалла F) бензолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 16, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 17 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла гидробромида 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 17, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
На фиг. 18 представлена диаграмма порошковой рентгеновской дифрактограммы кристалла (кристалла F) пара-толуолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (на фиг. 18, по оси ординат указана интенсивность (число импульсов), а по оси абсцисс указан 2θ (градус)).
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0028] Настоящее изобретение подробно описано ниже в настоящем описании.
[0029] В настоящем изобретении 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевина (далее в настоящем описании в некоторых случаях сокращенно обозначаемая как "соединение (I)") представляет собой
[0030] соединение, представленное следующей ниже структурной формулой:
[0031] 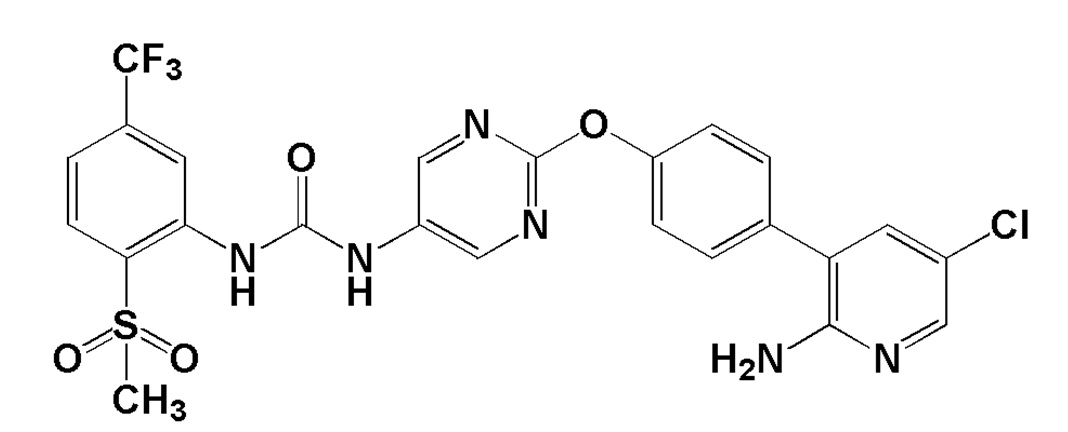
[0032] В настоящем изобретении 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевина (далее в настоящем описании в некоторых случаях сокращенно обозначаемая как "соединение (II)") представляет собой
[0033] соединение, представленное следующей ниже структурной формулой:
[0034] 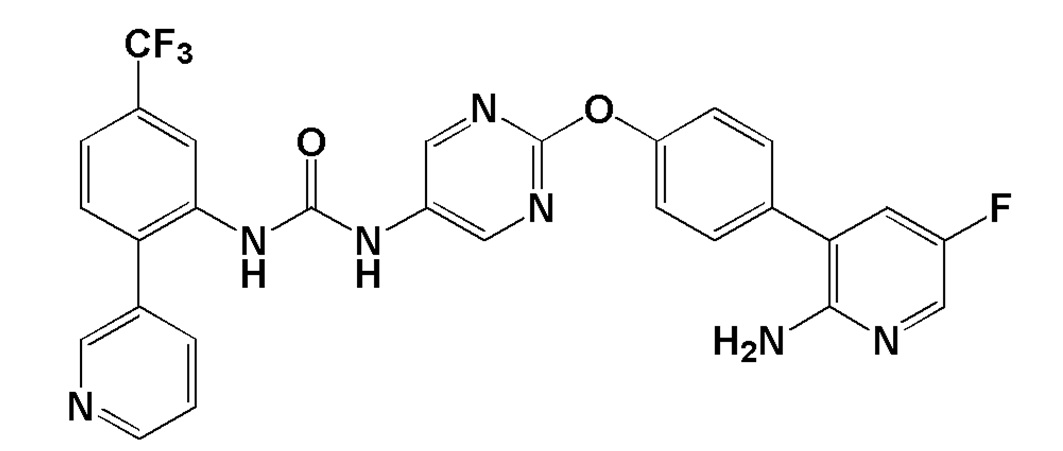
[0035] В настоящем изобретении 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевина (далее в настоящем описании в некоторых случаях сокращенно обозначаемая как "соединение (III)") представляет собой
[0036] соединение, представленное следующей ниже структурной формулой:
[0037] 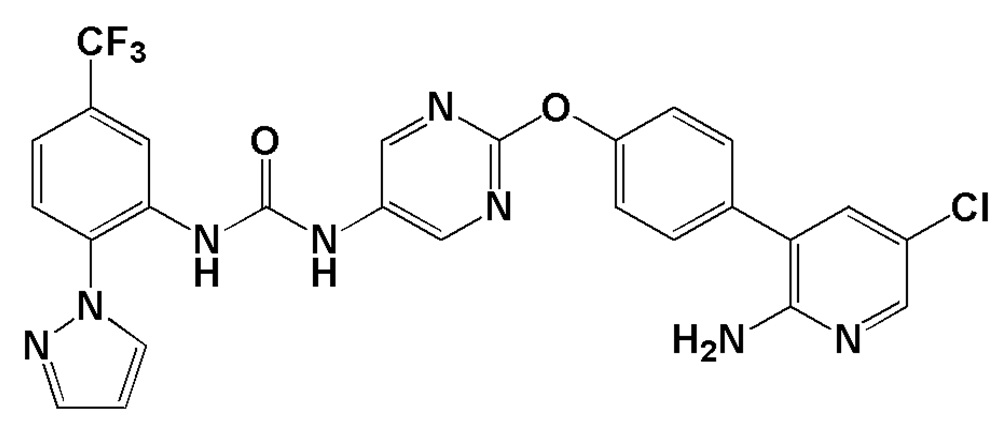
[0038] В настоящем изобретении примеры соли присоединения кислоты могут включать неорганические кислые соли, такие как гидрохлориды, гидробромиды, йодогидраты, сульфаты, фосфаты, нитраты и т.д., и органические кислые соли, такие как ацетаты, лактаты, тартраты, бензоаты, цитраты, трифторацетаты, глюкоронаты, глюконаты, малеаты, оксалаты, малеаты, алифатические сульфонаты, ароматические сульфонаты, алканолсульфонаты, сульфонаты камфоры и т.д. Примеры алифатического сульфоната могут включать метансульфонаты (соли MsOH), этансульфонаты, пропансульфонаты, бутансульфонаты, пентансульфонаты, гексансульфонаты, декансульфонаты, додекансульфонаты, 1,2-этандисульфонаты и т.п. Примеры ароматического сульфоната могут включать бензолсульфонаты (соли BsOH), орто-толуолсульфонаты (соли o-TsOH), мета-толуолсульфонаты (соли м-TsOH), пара-толуолсульфонаты (соли п-TsOH), 1-нафталинсульфонаты, 2-нафталинсульфонаты, oрто-фенолсульфонаты, мета-фенолсульфонаты, пара-фенолсульфонаты, нафтолсульфонаты, ксиленсульфонаты, нитробензолсульфонаты, фульфобензоаты, сульфосалицилаты, бензальдегидсульфонаты и т.п. Примеры алканолсульфоната могут включать изетионаты (2-гидроксиэтан-1-сульфонаты), 2-гидроксипропан-1-сульфонаты, 1-гидроксипропан-2-сульфонаты, 3-гидроксипропан-1-сульфонаты, 2-гидроксибутан-1-сульфонаты, 4-гидроксибутан-1-сульфонаты, 2-гидроксипентан-1-сульфонаты, 2-гидроксигексан-1-сульфонаты, 2-гидроксидекан-1-сульфонаты, 2-гидроксидодекан-1-сульфонаты и т.п. Предпочтительными являются гидрохлориды, гидробромиды, ацетаты, малеаты, оксалаты, малеаты, метансульфонаты, этансульфонаты, изетионаты, 1,2-этандисульфонаты, сульфонаты камфоры, бензолсульфонаты, пара-толуолсульфонаты и 2-нафталинсульфонаты. Наиболее предпочтительными являются гидрохлориды, гидробромиды, метансульфонаты, бензолсульфонаты и пара-толуолсульфонаты.
[0039] В настоящем изобретении настоящее соединение можно преобразовывать в сольват. Предпочтительно, чтобы сольват являлся нетоксичным и водорастворимым. Примеры сольвата, который является подходящим, могут включать сольваты с водным или спиртовым растворителем (например, этанол и т.д.).
[0040] Кроме того, атомы, из которых состоит настоящее соединение, при желании можно соответственно замещать их изотопами (например, 2H, 3H, 13C, 14C, 15N, 16N, 17O, 18O, 18F и т.д.).
[0041] В настоящем изобретении настоящее соединение не ограничено видом своей кристаллической формы и может представлять собой кристаллическое или аморфное вещество. Альтернативно, соединение также может представлять собой смесь кристаллического и аморфного вещества в оптимальном отношении. Более предпочтительным является кристалл. Какую кристаллическую форму имеет настоящее соединение можно определять известным способом анализа, принятым для кристаллографического анализа, например, способом на основе порошковой рентгеновской дифрактограммы, дифференциальной сканирующей калориметрией, способом на основе спектра поглощения в инфракрасном диапазоне, способом измерения температуры плавления или т.п., как по отдельности, так и в комбинации.
[0042] Все изомеры находятся в объеме настоящего изобретения, если конкретно не указано иное. Например, все изомеры вращения и их смеси в любых отношениях входят в настоящее изобретение. Кроме того, все изомеры вследствие таутомерии также входят в настоящее изобретение.
[0043] Кристалл ди(пара-толуолсульфоната) 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 6,11, 6,29, 7,76, 9,65, 10,18, 12,30, 12,57, 13,23, 13,59, 14,05, 14,85, 15,47, 16,94, 17,98, 18,52, 18,79, 19,32, 20,58, 21,25, 21,55, 22,11, 22,73, 23,20 и 24,36, предпочтительно пиками при 2θ приблизительно 9,65, 22,11 и 23,20, более предпочтительно пиками при 2θ приблизительно 6,11, 6,29, 7,76, 9,65, 10,18, 12,30, 12,57, 13,23, 13,59, 14,05, 14,85, 15,47, 16,94, 17,98, 18,52, 18,79, 19,32, 20,58, 21,25, 21,55, 22,11, 22,73, 23,20 и 24,36, еще более предпочтительно данными, описанными в таблице 1, относящейся к примеру 1, как описано ниже, и особенно данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 5.
[0044] Кристалл дибензолсульфоната 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьия или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 5,99, 6,71, 7,78, 10,08, 10,42, 11,93, 12,53, 12,96, 13,41, 14,15, 15,16, 15,55, 16,03, 16,93, 17,52, 17,95, 18,63, 18,91, 19,50, 20,18, 20,73, 21,43, 22,43, 22,84, 23,60 и 23,97, предпочтительно пиками при 2θ приблизительно 20,18 и 23,97, более предпочтительно пиками при 2θ приблизительно 5,99, 6,71, 7,78, 10,08, 10,42, 11,93, 12,53, 12,96, 13,41, 14,15, 15,16, 15,55, 16,03, 16,93, 17,52, 17,95, 18,63, 18,91, 19,50, 20,18, 20,73, 21,43, 22,43, 22,84, 23,60 и 23,97, еще более предпочтительно данными, описанными в таблице 2, относящейся к примеру 2, как описано ниже, и особенно данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 6.
[0045] Кристалл диметансульфоната 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 5,30, 5,93, 8,91, 9,34, 9,64, 10,55, 11,77, 12,52, 12,92, 13,72, 14,25, 15,47, 15,91, 16,87, 17,87, 18,77, 19,30, 19,62, 20,77, 21,23, 21,61, 22,47, 23,36, 23,78 и 24,51, предпочтительно пиками при 2θ приблизительно 10,55, 11,77 и 15,91, более предпочтительно пиками при 2θ приблизительно 5,30, 5,93, 8,91, 9,34, 9,64, 10,55, 11,77, 12,52, 12,92, 13,72, 14,25, 15,47, 15,91, 16,87, 17,87, 18,77, 19,30, 19,62, 20,77, 21,23, 21,61, 22,47, 23,36, 23,78 и 24,51, еще более предпочтительно данными, описанными в таблице 3, относящейся к примеру 3, как описано ниже, и особенно предпочтительно данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 7.
[0046] Кристалл дигидрохлорида 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 6,03, 6,84, 8,30, 9,87, 12,52, 13,70, 13,93, 14,90, 15,88, 18,31, 19,81, 20,94, 22,47, 22,89 и 24,08, предпочтительно пиками при 2θ приблизительно 8,30, 15,88 и 19,81, более предпочтительно пиками при 2θ приблизительно 6,03, 6,84, 8,30, 9,87, 12,52, 13,70, 13,93, 14,90, 15,88, 18,31, 19,81, 20,94, 22,47, 22,89 и 24,08, еще более предпочтительно данными, описанными в таблице 4, относящейся к примеру 4, как описано ниже, и особенно данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 8.
[0047] Пара-толуолсульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 9.
[0048] Бензолсульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 10.
[0049] Кристалл метансульфоната 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 5,42, 8,64, 8,97, 9,64, 10,39, 11,85, 13,13, 16,02, 16,27, 16,89, 17,39, 18,19, 19,53, 20,49, 20,83, 21,89, 22,59 и 23,90, предпочтительно пиками при 2θ приблизительно 5,42, 8,64, 8,97, 9,64, 10,39, 11,85, 13,13, 16,02°, 16,27, 16,89, 17,39, 18,19, 19,53, 20,49, 20,83, 21,89, 22,59 и 23,90, более предпочтительно данными, описанными в таблице 5, относящейся к примеру 7, как описано ниже, и еще более данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 11.
[0050] Кристалл гидрохлорида 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 5,63, 10,37, 10,73, 11,29, 12,30, 12,73, 13,68, 14,03, 14,53, 16,07, 16,64, 17,93, 18,66, 18,91, 19,89, 20,76, 21,35, 22,52, 22,84, 24,33 и 24,74, предпочтительно пиками при 2θ приблизительно 5,63, 10,37, 10,73, 11,29, 12,30, 12,73, 13,68, 14,03, 14,53, 16,07, 16,64, 17,93, 18,66, 18,91, 19,89, 20,76, 21,35, 22,52, 22,84, 24,33 и 24,74, более предпочтительно данными, описанными в таблице 6, относящейся к примеру 8, как описано ниже, и еще более данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 12.
[0051] Кристалл пара-толуолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 6,35, 7,74, 9,98, 11,08, 11,42, 12,68, 13,22, 14,83, 15,42, 15,98, 16,89, 17,33, 17,86, 18,29, 19,00, 19,46, 20,56, 20,92, 21,47, 22,04, 23,82 и 24,49, предпочтительно пиками при 2θ приблизительно 6,35, 7,74, 9,98, 11,08, 11,42, 12,68, 13,22, 14,83, 15,42, 15,98, 16,89, 17,33, 17,86, 18,29, 19,00, 19,46, 20,56, 20,92, 21,47, 22,04, 23,82 и 24,49, более предпочтительно данными, описанными в таблице 7, относящейся к примеру 9, как описано ниже, и еще более данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 1.
[0052] Кристалл бензолсульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 6,77, 7,78, 10,26, 11,20, 11,50, 13,54, 15,65, 16,02, 17,13, 18,01, 18,41, 18,70, 19,52, 20,25, 20,64, 21,65, 21,95, 22,66, 23,49 и 24,57, предпочтительно пиками при 2θ приблизительно 6,77, 7,78, 10,26, 11,20, 11,50, 13,54, 15,65, 16,02, 17,13, 18,01, 18,41, 18,70, 19,52, 20,25, 20,64, 21,65, 21,95, 22,66, 23,49 и 24,57, более предпочтительно данными, описанными в таблице 8, относящейся к примеру 10, как описано ниже, и еще более данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 2.
[0053] Кристалл метансульфоната 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ приблизительно 4,63, 7,04, 9,33, 14,11, 18,74, 20,43, 21,35, 23,31 и 24,80, предпочтительно пиками при 2θ, выбранными из приблизительно 4,63, 7,04, 9,33, 14,11, 18,74, 20,43, 21,35, 23,31 и 24,80, более предпочтительно данными, описанными в таблице 9, относящейся к примеру 11, как описано ниже, и еще более данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 3.
[0054] Кристалл гидрохлорида 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины характеризуется, например, в анализе способом на основе порошковой рентгеновской дифрактограммы по меньшей мере двумя или более (дополнительно тремя или более, еще дополнительно четырьмя или более и особенно пятью или более) пиками при 2θ, выбранными из приблизительно 4,60, 5,95, 7,06, 7,75, 9,38, 10,19, 11,82, 12,21, 13,01, 15,27, 17,81, 18,49, 18,79, 19,89, 20,52, 21,12, 21,96, 22,51, 23,67 и 24,54, предпочтительно пиками при 2θ приблизительно 4,60, 5,95, 7,06, 7,75, 9,38, 10,19, 11,82, 12,21, 13,01, 15,27, 17,81, 18,49, 18,79, 19,89, 20,52, 21,12, 21,96, 22,51, 23,67 и 24,54, более предпочтительно данными, описанными в таблице 10, относящейся к примеру 12, как описано ниже, и еще более данными по существу идентичными данным диаграммы порошковой рентгеновской дифрактограммы, представленного на фиг. 4.
[0055] Хотя кристаллическая форма настоящего соединения не определяется физико-химическими свойствами, описываемыми в настоящем описании, соответствующие данные могут незначительно отличаться с точки зрения их свойств, и не следует строго понимать кристаллическую форму.
[0056] Данные, получаемые, например, способ на основе порошковой рентгеновской дифрактограммы, например, относительная интенсивность могут отличаться с точки зрения их свойств на основании направления роста кристалла, размера зерна, условий измерения и т.д. Таким образом, при определении идентичности кристаллической формы, важным является дифракционный угол (2θ) или полная дифракционная картина. Кроме того, при определении идентичности кристаллической формы из графика порошковой рентгеновской дифрактограммы можно определять полуширину и использовать в сочетании с дифракционным углом (2θ) или полной дифракционной картиной, или относительной интенсивностью при желании.
[0057] Как правило, погрешность измерения дифракционного угла (2θ) в порошковой рентгеновской дифрактограмме возникает, например, вследствие типа устройства измерения, состояния соединения при отборе проб, которое необходимо измерять, и т.д.
[0058] Таким образом, все соединения, у которых полная дифракционная картина данных, получаемых способом на основе порошковой рентгеновской дифрактограммы, является аналогичной полной дифрактограмме кристаллической формы настоящего соединения, описываемого в настоящем описании, входят в настоящее изобретение.
[0059] Несмотря на то, что специалист в данной области может легко понимать в настоящем описании, графики порошковой рентгеновской дифрактограммы, описанные в чертежах, как описано ниже, представляют собой графики порошковой рентгеновской дифрактограммы, в которых дифракционный угол 2θ (градус) указан по оси абсцисс (шкала 2-тета), и интенсивность дифракции указана по оси ординат (линии (число импульсов)).
[0060] В настоящем описании рентгеновская порошковая дифрактограмма представляет собой рентгеновскую порошковую дифрактограмму, измеряемой с использованием излучения Cu-Kα.
Токсичность
Настоящее соединение обладает низкой токсичностью, и, таким образом, его можно безопасно использовать (например, оно не характеризуется взаимодействием лекарственных средств или т.п.) в качестве лекарственного средства.
Применение к лекарственным средствам
Настоящее соединение обладает ингибирующей Trk активностью и, таким образом, является пригодным в качестве профилактического и/или терапевтического средства для связанных с Trk заболеваний, например, боли, зуда, расстройства нижних мочевыводящих путей, астмы, аллергического ринита, воспалительного заболевания кишечника, болезни Шагаса, злокачественной опухоли и т.д.
Более конкретно, примеры боли могут включать боль при остеоартрите, боль при злокачественной опухоли, хроническую боль в нижней части спины, боль в нижней части спины при остеопорозе, боль при переломе кости, боль при ревматоидном артрите, нейропатическую боль, постгерпетическую боль, боль при диабетической нейропатии, фибромиалгию, боль при панкреатите, боль при интерстициальном цистите, боль при эндометриозе, боль при синдроме раздраженного кишечника, мигрень, послеоперационную боль, боль при пульпите и т.п. Примеры зуда могут включать системный кожный зуд, локализованный кожный зуд, старческий кожный зуд, зуд беременных, анальный зуд, зуд женских наружных половых органов и т.п. Примеры расстройства нижних мочевыводящих путей могут включать интерстициальный цистит, трудности мочеиспускания, обструкцию шейки мочевого пузыря, контрактуру шейки мочевого пузыря, уретральный синдром, детрузорно-сфинктерную диссинергию, нестабильный мочевой пузырь, хронический простатит, хронический цистит, психогенный цистит, вызванное лекарственными средствами расстройство мочеиспускания, синдром Хинмана, синдром Фаулера и т.п. Примеры воспалительного заболевания кишечника могут включать язвенный колит, болезнь Крона и т.п. Примеры злокачественной опухоли могут включать рак молочной железы, рак яичника, рак толстого кишечника (например, рак толстого кишечника и т.д.), рак легких (например, немелкоклеточный рак легких и т.д.), рак предстательной железы, рак головы и шеи (например, плоскоклеточную карциному полости рта, плоскоклеточную карциному головы и шеи, рак глотки, рак гортани, рак языка, рак щитовидной железы, неврому слухового нерва и т.д.), рак кожи (например, меланому (злокачественную меланому) и т.д.), лимфому (например, B-клеточную лимфому, T-клеточную лимфому и т.д.), опухоль головного мозга, глиому нерва, аденому гипофиз, увеальную злокачественную меланому, менингиому, тиому, мезотелиому, рак пищевода, рак желудка, рак печени (например, печеночноклеточную карциному и т.д.), холангиокарциному, рак желчного пузыря, рак поджелудочной железы, рак почки (например, почечноклеточную карциному, рак почечной лоханки, рак мочеточник и т.д.), рак мочевого пузыря, рак полового члена, рак яичка, рак матки, рак влагалища, рак женских наружных половых органов, злокачественную опухоль кости, саркому мягких тканей, хондросаркому, лейкоз, миелодиспластический синдром, множественную миелому, опухоль слюнных желез, нейроэндокринную опухоль, нейробластому, саркому легких, медуллобластому, глиобластому, ретинобластому, остеосаркому, рак тонкого кишечника, карциному коры надпочечников и т.п.
[0062] Настоящее соединение является особенно пригодным в качестве профилактического и/или терапевтического средства для боли или злокачественной опухоли.
[0063] Настоящее соединение можно вводить в качестве комбинации лекарственного средства с другим лекарственным средством с целью:
(1) комплемента и/или усиления профилактического и/или терапевтического эффект соединения;
(2) улучшения кинетики и всасывания и уменьшения дозы соединения, и/или
(3) облегчения побочного эффекта соединения.
[0064] Комбинированное лекарственное средство настоящего соединения и другого лекарственного средства можно вводить в форме одного состава, содержащего оба компонента, или можно вводить в виде отдельных составов. Введение отдельных составов включает одномоментное введение и последовательное введение. Кроме того, при последовательном введении настоящее соединение можно вводить сначала с последующим введением другого лекарственного средства или другое лекарственное средство можно вводить сначала с последующим введением настоящего соединения. Соответствующие способы введения могут являться аналогичными или отличатся друг от друга.
[0065] Лекарственное средство, для которого комбинированное лекарственное средство проявляет профилактический и/или терапевтический эффект, не является конкретно ограниченным и только должно лекарственным средством, которое дополняет и/или усиливает профилактический и/или терапевтический эффект настоящего соединения.
[0066] Примеры другого лекарственного средства для дополнения и/или усиления профилактического и/или терапевтического эффекта настоящего соединения в отношении к боли могу включать ацетоминофен, нестероидное противовоспалительное лекарственное средство, опиоид, антидепрессант, противоэпилептическое средство, антагонист N-метил-D-аспартата, миорелаксант, противоаритмическое средство, стероид, бисфосфонат и т.п.
[0067] Примеры нестероидного противовоспалительного лекарственного средства могут включать саспирин, салицилат натрия, аспирин, составы на основе аспирина, так как составы, содержащие диалюминат аспирина, и т.д., дифлунизал, индометацин, супрофен, уфенамат, диметилизопропилазулен, буфексамак, фелбинак, диклофенак, толметин натрия, клинорил, фенбуфен, набуметон, проглуметацин, индометацин фарнезил, ацеметацин, проглуметацина малеат, амфенак натрия, мофезолак, этодолак, ибупрофен, ибупрофен пиконол, напроксен, флурбипрофен, флурбипрофен аксетил, кетопрофен, фенопрофен кальция, тиапрофен, оксапрозин, пранопрофен, локсопрофен натрия, алминопрофен, залтопрофен, мефенамовая кислота, мефенамат алюминия, толфенамовая кислота, флоктафенин, кетофенилбутазон, оксифенбутазон, пироксикам, теноксикам, ампироксикам, мазь напагельн (Napageln), эпиризол, гидрохлорид тиарамида, гидрохлорид тиноридин, эморфазон, силпирин, мигренин, саридон, седес G, амипило-N, сорбон, средства от простуды на основе пилина, ацетоминофен, фенацетин, мезилат диметотиазина, мелоксикам, целекоксиб, рофекоксиб, валдекоксиб, содержащие симетрид составы, средства от простуды не на основе пилина и т.п.
[0068] Примеры опиоида могут включать кодеин, фентанил, гидроморфон, леворфанол, меперидин, метадон, морфин, оксикодон, оксиморфон, пропоксифен, гидрокодон, трамадол, бупренорфин, тапентадол, пентазоцин, буторфанол и т.п.
[0069] Примеры антидепрессанта могут включать трициклические антидепрессанты (например, гидрохлорид амитриптилина, гидрохлорид имипрамина, гидрохлорид кломипрамина, гидрохлорид досулепина, нортриптилин гидрохлорид, гидрохлорид лофепрамина, малеат тримипрамина и амоксапин), тетрациклические антидепрессанты (например, гидрохлорид мапротилина, гидрохлорид миансерина и малеат сетиптилина), ингибиторы моноаминоксидазы (MAO) (например, гидрохлорид сафразина), ингибиторы обратного захвата серотонина и норадреналина (SNRI) (например, гидрохлорид милнаципрана и гидрохлорид венлафаксина), селективные ингибиторы обратного захвата серотонина (SSRI) (например, малеат флувоксамина, гидрохлорид пароксетина, гидрохлорид флуоксетина и гидрохлорид циталопрама), ингибиторы обратного захвата серотонина (например, гидрохлорид тразодона) и т.п.
[0070] Примеры противоэпилептического средства могут включать фенобарбитал, пуридомин, фенитоин, этосуксимид, зонизамид, нитразаепам, клоназепам, карбамазепин, вальпроат натрия, ацетазоламид, сультиам и т.п.
[0071] Примеры антагониста N-метил-D-аспартата могут включать гидрохлорид кетамина, гидрохлорид амантадина, гидрохлорид мемантина, декстрометорфан, метадон и т.п.
[0072] Примеры миорелаксанта могут включать сукцинилхолин, суксаметоний, бромид векурония, бромид панкрония, дантролен натрия и т.п.
[0073] Примеры противоаритмического средства могут включать прокаинамид, дизопирамид, цибензолин, пирменол, лидокаин, мексилетин, априндин, пилсикаинид, флекаинид, пропафенон, пропранолол, атенолол, бисопролол, амиодарон, соталол, верапамил, дилтиазем, бепридил и т.п.
[0074] Примеры стероида могут включать как наружные лекарственные препараты, пропионат клобетазола, диацетат дифлоразона, флуцинонид, фуроат мометазона, дипропионат бетаметазона, пропионат бетаметазона бутирата, валерат бетаметазона, дифлупреднат, пудесонид, валерат дифлукортолона, амкинонид, галцинонид, дексаметазон, пропионат дексаметазона, валерат дексаметазона, ацетат дексаметазона, ацетат гидрокортизона, бутират гидрокортизона, пропионат гидрокортизона бутирата, пропионат депродона, ацетат преднизолона валерата, ацетонид флуоцинолона, пропионат пеклометазона, ацетонид триамцинолона, пивалат флуметазона, дипропионат алклометазона, бутират клобетазона, преднизолон, пропионат беклометазона, флудроксикортид и т.п.
[0075] В качестве лекарственных препаратов для внутреннего использования или для инъекции можно включить ацетат кортизона, гидрокортизон, фосфат натрия гидрокортизона, сукцинат натрия гидрокортизона, ацетат флудрокортизона, преднизолон, ацетат преднизолона, сукцинат натрия преднизолона, бутилацетат преднизолона, фосфат натрия преднизолона, ацетат галоперидола, метилпреднизолон, ацетат метилпреднизолона, сукцинат натрия метилпреднизолона, триамцинолон, ацетат триамцинолона, ацетонид триамцинолона, дексаметазон, ацетат дексаметазона, фосфат натрия дексаметазона, пальмитат дексаметазона, ацетат параметазона, бетаметазон и т.п.
[0076] В качестве лекарственных форм для ингаляции можно включать пропионат беклометазона, пропионат флутиказона, будезонид, флунизолид, триамцинолон, ST-126P, циклезонид, пальмитат дексаметазона, фуроат мометазона, сульфонат прастерона, дефлазакорт, метилпреднизолон сулептанат, сукцинат натрия метилпреднизолона и т.п.
[0077] Примеры бисфосфоната могут включать этидронат, памидронат, аледронат, ризедронат, золедронат, минодронат и т.п.
[0078] Примеры другого лекарственного средства для дополнения и/или усиления профилактического и/или терапевтического эффекта настоящего соединения в отношении злокачественной опухоли могут включать алкилирующее средство, метаболический антагонист, противораковые антибиотики, противораковый препарат на основе растительного сырья, гормональное лекарственное средство, соединение платины, ингибитор топоизомеразы, ингибитор киназы, антитело против CD20, антитело против HER2, антитело против EGFR, антитело против VEGF, ингибитор протеасомы, ингибитор HDAC, ингибитор иммунных контрольных точек (например, антитело против CTLA-4, антитело против PD-1, антитело против PD-L1 и т.д.), иммуномодулятор, другие противораковые лекарственные средства и т.п.
[0079] Примеры алкилирующего средства могут включать циклофосфамид, ифосфамид, дакарбазин, гидрохлорид нимустина, ранимустин, бендамустин, тиотепа, карбоквон и т.п.
[0080] Примеры метаболического антагониста могут включать метотрексат, пеметрексед, фторурацил, тегафур, тегафур урацил, тегафур гиместат отастат калия, доксифлуридин, капецитабин, цитарабин, гемцитабин гидрохлорид, флударабин, неларабин, кармофур, прокарбазин гидрохлорид и т.п.
[0081] Примеры противораковых антибиотиков могут включать митомицин C, гидрохлорид доксорубицина, гидрохлорид акларубицина, гидрохлорид пирарубицина, эпирубицин, хромомуцин A3, блеомицин, сульфат пепломицина, терарубицин и т.п.
[0082] Примеры противоракового препарата на основе растительного сырья могут включать иринотекан гидрохлорид, этопозид, сульфат винкристина, сульфат винбластина, сульфат виндезина, дитартрат винорелбина, гидрат доцетаксела, мезилат эрибулина, паклитаксел и т.п.
[0083] Примеры гормонального лекарственного средства могут включать фосфат натрий эстрамустина, флутамид, бакалутамид, ацетат гозерелина, ацетат лейпрорелина, цитрат тамоксифена, цитрат торемифена, анастрозол, летрозол, экземестан, мепитиостан, ацетат медроксипрогестерона, эпитиостанол, фосфестрол, гидрат гидрохлорида фадрозола, абиратерон, фулвестрант, аминоглутетимид и т.п.
[0084] Примеры соединения платины могут включать карбоплатин, цисплатин, недаплатин, оксалиплатин и т.п.
[0085] Примеры ингибитора топоизомеразы могут включать топотекан, собузоксан и т.п.
[0086] Примеры ингибитора киназы могут включать в качестве ингибитора EGFR, эрлотиниб, гефитиниб и афатиниб; в качестве ингибитора HER2 лапатиниб; в качестве ингибитора BCR-ABL иматиниб; в качестве ингибитора ALK кризотиниб; в качестве мультикиназного ингибитора регорафениб и дазатиниб и т.п.
[0087] Примеры антитела против CD20 могут включать ритуксимаб, ибритумомаб, ибритумомаб тиуксетан, окрелизумаб и т.п.
[0088] Примеры антитела против HER2 могут включать трастузумаб, трастузумаб эмтанзин, пертузумаб и т.п.
[0089] Примеры антитела против EGFR могут включать цетуксимаб, панитумумаб и т.п.
[0090] Примеры антитела против VEGF могут включать бевацизумаб и т.п.
[0091] Примеры ингибитора протеасом могут включать бортезомиб и т.п.
[0092] Примеры ингибитора HDAC могут включать вориностат и т.п.
[0093] Примеры антитела против CTLA-4 могут включать ипилимумаб и т.п.
[0094] Примеры антитела против PD-1 могут включать ниволумаб, пембролизумаб и т.п.
[0095] Примеры антитела против PD-L1 могут включать атезолизумаб, авелумаб и т.п.
[0096] Примеры иммунорегулятора включают талидомид, леналидомид, помалидомид и т.п.
[0097] Массовое отношение настоящего соединения к другим лекарственным средствам не является конкретно ограниченным.
[0098] Можно вводить любую комбинацию двух или более типов других лекарственных средств.
[0099] Кроме того, другие лекарственные средства для дополнения и/или усиления профилактического и/или терапевтического эффекта настоящего соединения могут включать не только лекарственные средства, которые идентифицированы в настоящее время, а также лекарственные средства, которые будут идентифицированы в будущем на основании указанного выше механизма.
[0100] Настоящее соединение или комбинированное лекарственное средство настоящего соединения и другое лекарственное средство, которое используют с описываемой выше целью, как правило, формулируют в виде подходящей фармацевтической композиции совместно с фармацевтически приемлемым носителем, а затем вводят системно или местно посредством перорального или парентерального введения.
[0101] Дозирование может изменяться в зависимости от возраста, массы, симптомов, терапевтического эффекта, способа введения, периода лечения и т.п., и может составлять от одного до нескольких пероральных введений в сутки в диапазоне от 1 мг до 1,000 мг в дозе на взрослого или от одного до нескольких парентеральных введений в сутки в диапазоне 0,1 мг до 100 мг в дозе или внутривенное непрерывное введение в течение 1-24 часов в сутки на взрослого.
[0102] Как и следовало ожидать, как описано выше, дозирование может изменяться в зависимости от различных состояний, и, таким образом, достаточное дозирование может составлять меньшее, чем описанное выше количество, или необходимым может являться количество большее, чем описанное выше количество.
[0103] Настоящее соединение или комбинированное лекарственное средство настоящего соединения и другие лекарственные средства можно вводить в виде пероральной твердой лекарственной формы для внутреннего применения, жидкого лекарственного средства для внутреннего ведения или инъекции, лекарственного средства для наружного применения, суппозитория, офтальмологического раствора, ингаляционной формы или т.п. для парентерального введения.
[0104] Примеры пероральной твердой лекарственной формы для внутреннего применения могут включать таблетку, пилюлю, капсулу, порошок, гранулу и т.п. Примеры капсулы могут включать твердую капсулу и мягкую капсулу. Кроме того, примеры таблетки могут включать сублингвальную таблетку, пластырь для слизистой оболочки полости рта, таблетку для рассасывания и т.п.
[0105] В твердой лекарственной форме для внутреннего применения одно или более активных веществ можно формулировать сами по себе или можно формулировать после их смешивания с эксципиентом (например, лактозой, маннитом, глюкозой, микрокристаллической целлюлозой, крахмалом и т.д.), связывающим средством (например, гидроксипропилцеллюлозой, поливинилпирролидоном, метасиликата алюмината магния и т.д.), дезинтегрантом (например, гликолятцеллюлозой кальция и т.д.), смазочным средством (например, стеаратом магния и т.д.), стабилизатором, адъювантным раствором (например, глутаминовой кислотой, аспарагиновой кислотой и т.д.) или т.п. общепринятыми способами. Кроме того, твердую лекарственную форма можно необязательно покрывать покрывающим средством (например, сахарозой, желатином, гидроксипропилцеллюлозой, фталатом гидроксипропилметилцеллюлозы и т.д.) и можно покрывать двумя или более слоями. Твердая лекарственная форма может дополнительно включать капсулу легко всасывающегося вещества, такого как желатин.
[0106] Примеры жидкого лекарственного средства для внутреннего применения могут включать фармацевтически приемлемую воду, суспензию, эмульсию, сироп, эликсир и т.п. В жидком лекарственном средстве одно или более активных веществ растворяют, суспендируют или эмульгируют в разбавителе общего назначения (например, очищенной воде, этаноле, их смешанном растворе и т.д.). Жидкое лекарственное средство может дополнительно содержать средство для смачивания, суспендирующее средство, эмульгатор, подсластитель, ароматизатор, душистое вещество, консервант, буферное средство и т.д.
[0107] Примеры лекарственной формы лекарственного препарата для наружного применения для парентерального введения могут включать мазь, гель, крем, горячий компресс, пластырь и самоприклеивающийся адгезив, линимент, мелкодисперсионное средство, лекарственную форму для ингаляций, спрей, аэрозоль, офтальмологический раствор, назальный раствор и т.п. Лекарственные формы содержат одно или более активных веществ, и их можно получать известным способом или с использованием состава общего назначения.
[0108] Мелкодисперсионное средство, лекарственная форм для ингаляций или спрей могут содержать в дополнение к разбавителю, который является общего пользования, стабилизатор, такой как гидросульфит натрия, и буферное средство, способное обеспечивать изотоничность, например, хлорид натрия, цитрат натрия, средство придания изотоничности, такое как лимонная кислота или т.п. Способ получения спрея является конкретным, описанным, например, в патентах США № 2868691 и 3095355.
[0109] Инъекция для парентерального введения может включать инъекции в форме раствора, суспензии, эмульсии или твердого вещества, которое необходимо растворять или суспендировать в растворителе при использовании. Инъекция можно использовать путем растворения, суспендирования или эмульгирования одного или более активных веществ в растворителе. В качестве растворителя можно упомянуть, например, дистиллированную воду, используемую для инъекции, физиологический раствор, растительное масло, пропиленгликоль, полиэтиленгликоль, спирт, такой как этанол, или их сочетания. Инъекция может дополнительно содержать стабилизатор, адъювантный раствор (например, глутаминовую кислоту, аспарагиновую кислоту, полисорбат 80 (зарегистрированный товарный знак) и т.д.), суспендирующее средство, эмульгатор, успокаивающее средство, буферное средство, консервант или т.п. Инъекцию можно получать стерилизацией на конечном этапе или путем асептической операции. Кроме того, асептическое твердое средство, например, лиофилизированный продукт можно получать и растворять в стерилизованной или асептической дистиллированной воде или другом растворителе для инъекции перед использованием.
[0110] Примеры другой композиции для парентерального введения могут включать суппозиторий для ректального введения и пессарий для вагинального введения, каждый из которых содержит одно или более активных веществ, и который формулируют общепринятым способом и т.п.
[0111] В настоящем изобретении "промышленное изделие" включает (1) фармацевтическую композицию, содержащую настоящее соединение, или фармацевтическую композицию в форме комбинированного лекарственного средства, содержащего настоящее соединение с сопутствующим лекарственным средством, отличным от настоящего соединения, (2) контейнер, содержащий описанную выше композицию, и (3) по меньшей мере одну из инструкции, описания, вкладыша в упаковку, и этикетку продукта (включая этикетки соответствующие этикетке или маркировке в Соединенных Штатах Америки), которые все свидетельствуют о том, что композицию можно использовать для профилактики и/или терапии связанного с Trk заболевания необязательно в комбинации с подходящим сопутствующим лекарственным средством (предпочтительно ацетоминофеном, нестероидным противовоспалительным лекарственным средством, опиоидом, антидепрессантом, противоэпилептическим средством, антагонистом N-метил-D-аспартата, миорелаксантом, противоаритмическим средством, стероидом и/или бисфосфонатом; или алкилирующим средством, метаболическим антагонистом, противораковыми антибиотиками, противоракового препарата на основе растительного сырья, гормональным лекарственным средством, соединением платины, ингибитором топоизомеразы, ингибитором киназы, антителом против CD20, антителом против HER2, антителом против EGFR, антителом против VEGF, ингибитором протеасомы, ингибитором HDAC, ингибитором иммунных контрольных точек и/или иммуномодулятором, или т.п.).
[0112] Вкладыш в упаковку, как указано в настоящем описании, означает официальный документ, прикладываемый к лекарственному средству, который обеспечивает необходимую информацию для подходящего использования лекарственного средства и соответствует "Tenpu Bunsho" (также обозначаемому как "Nou-gaki") в соответствии с законом о фармацевтической продукции в Японии, "Клинико-фармакологическая статья лекарственного средства (SPC или SmPC)" в соответствии с директивой EU, "вкладыш в упаковку US (USPI)" в соответствии с федеральным правилом в Соединенных Штатах Америки и эквивалентных документов где-либо еще.
[0113] Информация, предоставляемая этими документами, конкретно предписана статьями 52, 54 и 68(4) и т.п. в законе о фармацевтической продукции (см. в случае необходимости Уведомления № 606 и 607 Бюро по фармацевтическим продуктам от 25 апреля 1997 года и/или родственные уведомления, или т.п.) для "Tenpu Bunsho" в Японии, статьей 11 директивы 2001/83/EC и т.п. (см. в случае необходимости руководство по SmPC и/или родственные руководства) для Клинико-фармакологической статье лекарственного средства в EU и 21 CFR 201.100 и т.п. (см. в случае необходимости 21 CFR 201.57 и/или родственные федеральные правила) для вкладыша в упаковку US в Соединенных Штатах Америки и, как правило, включает информацию по показаниям, дозированию и введению, способу введения, предостережения и/или противопоказания.
[0114] В Соединенных Штатах Америки в подглаве B 21 CFR 201 указано требование, что в дополнение к вкладышу в упаковку US этикетка или маркировка должна содержать часть или полную информацию, предоставляемую на вкладыше в упаковку US. Этикетка в настоящем описании означает этикетку, непосредственно предоставляемую на контейнере и маркировка означает концепцию, включающую этикетку, печать на упаковках и печатный материал, прилагаемый к промышленному изделию.
[0115] В настоящем изобретении термин "контейнер" означает контейнер, который непосредственно содержит фармацевтическую композицию, содержащую настоящее соединение или фармацевтическую композицию в форме комбинированного лекарственного средства, содержащего настоящее соединение с сопутствующим лекарственным средством, отличным от настоящего соединения, и также может быть обозначено как "первичный контейнер", "первичная упаковка", "внутренний изолирующий слой" или т.п. Примеры контейнера могут включать банки/жестяные банки, бутылки, коробки, ампулы, флаконы, тубы, контейнеры стандартной дозы для глазных капель, бумагу, ткань, пластик, пластиковые пакеты, листы SP, листы PTP, пластиковые контейнеры и т.п.
[0116] Контейнер, содержащий фармацевтическую композицию, объединяют по меньшей мере с одной из инструкций, описания, вкладыша в упаковку и товарной этикетки (включая этикетку, соответствующую этикетке или маркировки в США), как описано выше, и, как правило, могут упаковывать во внешний контейнер или внешнюю упаковку и распространяют на рынке.
[0117] Кроме того, в настоящем изобретение также описан способ рекламы фармацевтической композиции, содержащей настоящее соединение, или фармацевтической композиции в форме комбинированного лекарственного средства, содержащего настоящее соединение с сопутствующим лекарственным средством, где способ включает побуждение целевого зрителя использовать композицию для профилактики и/или терапии связанного с Trk заболевания.
[0118] Описанный выше способ включает публичное распространение информации, которая описывает ценность, в частности польза для здоровья в результате использования, при профилактике и/или терапии связанного с Trk заболевания фармацевтической композиции, содержащей настоящее соединение, или фармацевтической композиции в форме комбинированного лекарственного средства, содержащего настоящее соединение с другим сопутствующим лекарственным средством. Такую информацию распространяют через подходящие средства рекламы в дополнение к устному сообщению. Соседства рекламы могут представлять собой любою из газеты, журналов, телевидения, радио, видео, брошюр, листовок, плакатов, систем социальных сетей, электронной почты, электронных вывесок, цифровой вывески, интернет-рекламы (домашние страницы/веб-сайты, баннерая реклама и т.п.), наружной рекламы (щиты наружной рекламы, неоновые вывески, дисплеи с большим экраном и т.п.), рекламные объявления в транспорте (рекламные объявления, передаваемые в поездах, автобусах, такси и т.п., рекламные объявления над окнами и дверями поездов, автобусов, такси и т.п., рекламные объявления на станциях), рекламные блоки в кинотеатрах (рекламные ролики в кинотеатрах), рекламные объявления, поднимающиеся со страницы (рекламные объявления при ходе в магазины и в магазинах), прямые рекламные объявления (прямые письма, вставки в газетах, листовки), специальные рекламные объявления (сувенирная продукция с рекламой, такая как календари, ручки и т.п.), другие рекламные объявления (прочерчивание рекламных знаков самолетом, реклама на скамейках и т.п.). Специалист в данной области может легко производить средства рекламы.
[0119] Если не определено иное, все технические и научные термины, и сокращенные обозначения, используемые в настоящем описании, имеют такие же значения как технические и научные термины, и сокращенные обозначения, как правило, понимаемые специалистом в данной области, к которой принадлежит настоящее изобретение.
[0120] Содержание всех патентных документы и непатентных документов или ссылок, явным образом цитируемых в настоящем описании, может полностью включено в настоящее описание как часть настоящего описания.
ПРИМЕРЫ
[0121] Настоящее изобретение подробно описано ниже в настоящем описании в качестве примеров, но не следует интерпретировать, что настоящее изобретение ограничено этими примерами.
[0122] Растворители, указанные в скобках, описанные в хроматографическом разделении и разделе TLC, означают используемые растворители для элюирования или растворители для проявления, и отношения выражают в объемном отношении.
[0123] Каждый из растворителей, указанный в скобках, описанный в разделе ЯМР, означает растворитель, используемый для измерения.
[1] LC-MS/ELSD:
Измерение проводили в следующих условиях:
{Колонка: Waters ACQUITY C18 (диаметр частиц: 1,7×10-6 м; длина колонки: 30×2,1 мм вн. диаметр); скорость потока: 1,0 мл/мин; температура колонки: 40°C; подвижная фаза (A): 0,1% водный раствор муравьиной кислоты; подвижная фаза (B): 0,1% раствор муравьиная кислота-ацетонитрил; градиент (описано отношение подвижной фазы (A) к подвижной фазе (B)): [0 мин] 95/5; [0,1 мин] 95/5; [1,2 мин] 5/95; [1,4 мин] 5/95; [1,41 мин] 95/5; [1,5 мин] 95/5; детектор: УФ(PDA), ELSD, MS}
[2] Спектр рентгеновской порошковой дифракции:
<Условия измерения>
Устройство: BRUKER D8 DISCOVER с GADDS, выпускаемый BRUKER axa
Мишень: Cu
Напряжение: 40 кВ
Ток: 40 мА
Время воздействия: 3 минуты
[Общий способ синтеза солей присоединения кислоты соединения (I), соединения (II) и соединения (III)]
С использованием соединения (I), соединения (II) и соединения (III) и различных кислот получали соли присоединения кислоты соли следующими ниже способами. В растворы соединения (I), соединения (II) и соединения (III), растворенных в различных растворителях, в случае соединения (I) и соединение (III), добавляли эквимолярный эквивалент кислоты и смешивали с ними, и в случае соединения (II) добавляли два молярных эквивалента кислоты и смешивали с ними. Выпавший в осадок кристалл собирали фильтрованием, а затем сушили. В случае, когда кристалл не выпадал в осадок, растворитель отгоняли при пониженном давлении и сушили остаток. Получаемый таким образом кристаллическое или аморфное вещество измеряли по отношению к данным физических свойств посредством рентгеновской порошковой дифрактограммы, TLC, LC-MS, ЯМР и т.д. Данные физических свойств подробно описаны в следующих ниже примерах.
[0124] Соединения, используемые в настоящем описании, получали с путем использования компьютерной программы, как правило, в соответствии с номенклатурной системой IUPAC, ACD/название (зарегистрированный товарный знак) или Chemdraw Ultra (версия 12.0, выпускаемая Cambridge Soft), или в соответствии с номенклатурной системой IUPAC.
[0125] Справочный пример 1
2,2,2-трихлорэтил(2-(пиридин-3-ил)-5-(трифторметил)фенил)карбамат
[0126] 
[0127] К этилацетату (5,7 мл) добавляли раствор 2-(пиридин-3-ил)-5-(трифторметил)бензоламина (574 мг), бикарбоната натрия (404 мг) и 2,2,2-трихлорэтилхлорформиата (398 мл) с последующим перемешиванием в течение 30 минут. К реакционной смеси добавляли воду и экстрагировали получаемое соединение этилацетатом. Получаемый органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, а затем концентрировали при пониженном давлении. Получаемый остаток очищали хроматографией на силикагеле (гексан/этилацетат=4/1), получая, таким образом, указанное в заголовке соединение (959 мг) со следующим ниже значением физических свойств.
Свойства: твердое белое вещество
TLC:этал. 0,62 (гексан/этилацетат=1/1)
1H-ЯМР (DMSO-d6): δ4,82 (с, 2H), 7,44-7,52 (м, 1H), 7,64 (д, 1H), 7,73 (д, 1H), 7,75-7,88 (м, 2H), 8,55-8,65 (м, 2H), 9,83 (ушир. с, 1H)
[0128] Справочный пример 2
5-нитро-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пиримидин
[0129] 
[0130] К тетрагидрофурана (далее в настоящем описании сокращенно обозначаемому как "THF") (8,2 мл) добавляли раствор 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенола (900 мг), триэтиламина (0,63 мл) и 2-хлор-5-нитропиримидина (684 мг). Реакционную смесь перемешивали при 0°C в течение одного часа. Реакционную смесь разбавляли этилацетатом и промывали получаемую реакционную смесь насыщенным водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Получаемый органический слой сушили над сульфатом натрия, а затем концентрировали при пониженном давлении, получая, таким образом, указанное в заголовке соединение (1,53 г) со следующим ниже значением физических свойств.
Свойства: твердое желтое вещество
TLC:этал. 0,45 (гексан/этилацетат=4/1)
1H-ЯМР (CDCl3): δ1,35 (с, 12H), 7,20 (д, 2H), 7,93 (д, 2H), 9,31 (с, 2H)
[0131] Справочный пример 3
2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)пиридин-5-амин
[0132] 
[0133] К смешанному раствору этанола (16,7 мл) и этилацетата (8,4 мл) соединения (1,52 г), получаемого в справочном примере 2, добавляли гидроксид палладия (20% масс., 139 мг). Реакционную смесь перемешивали в атмосфере водорода при 35°C в течение 4 часов. К получаемой реакционной смеси добавляли метанол (8 мл) и активированный уголь (29 мг) с последующим перемешиванием при комнатной температуре в течение 5 минут. Реакционную смесь фильтровали посредством целита (торговое наименование) и концентрировали фильтрат. К получаемому остатку добавляли смешанный растворитель трет-бутилметиловый эфир/гексан (1/1) и собирали выпадающее в осадок твердое вещество посредством фильтрования, получая, таким образом, указанное в заголовке соединение (1,14 г) со следующим ниже значением физических свойств.
Свойства: твердое белое вещество
TLC:этал. 0,29 (гексан/этилацетат=1/1)
1H-ЯМР (CDCl3): δ1,33 (с, 12H), 3,51 (ушир. с, 2H), 7,14 (д, 2H), 7,85 (д, 2H), 8,06 (с, 2H)
[0134] Справочный пример 4
2-(4-(2-амино-5-фторпиридин-3-ил)фенокси)пиримидин-5-амин
[0135] 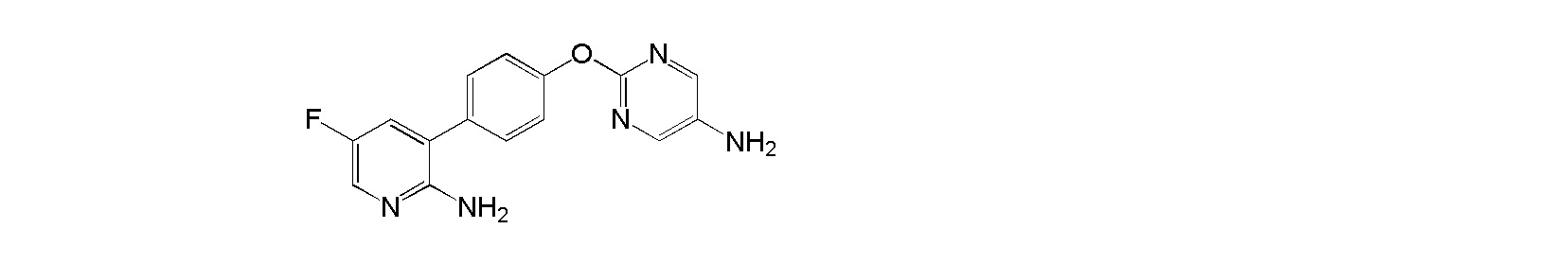
[0136] К раствору 1,4-диоксана (20 мл) соединения (1,1 г), получаемого в справочном примере 3, и 2-амино-3-бром-5-фторпиридина (738 мг) добавляли водный раствор фосфата калия (2 моль/л, 24 мл) и тетракис(трифенилфосфин)палладия (0) (203 мг) в атмосфере аргона. Реакционную смесь перемешивали при 100°C в течение ночи. К реакционной смеси добавляли воду и экстрагировали получаемое соединение этилацетатом. Получаемый органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, а затем концентрировали при пониженном давлении. Получаемый остаток промывали изопропиловым спиртом и собирали посредством фильтрования, получая, таким образом, указанное в заголовке соединение (737 мг) со следующим ниже значением физических свойств.
Свойства: твердое желтовато-коричневое вещество
TLC:этал. 0,41 (этилацетат)
1H-ЯМР (DMSO-d6): δ5,28 (с, 2H), 5,53 (с, 2H), 7,15 (д, 2H), 7,35 (дд, 1H), 7,48 (д, 2H), 7,93 (д, 1H), 7,99 (с, 2H)
[0137] Пример 1
Ди(пара-толуолсульфонат) 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины
[0138] 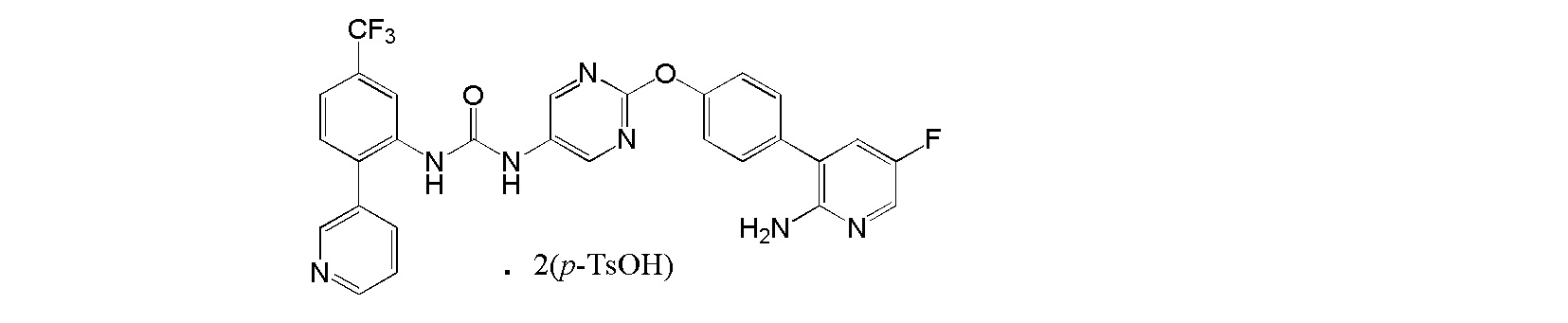
[0139] К раствору N,N-диметилацетамида (далее в настоящем описании сокращенно обозначаемого как "DMA") (5 мл), соединения (500 мг) получаемого в справочном примере 4, и соединения (765 мг), соединения получаемого в справочном примере 1, добавляли триэтиламин (0,067 мл). Реакционную смесь перемешивали в атмосфере аргона при 70°C в течение 1,5 часов. К реакционной смеси добавляли воду и экстрагировали реакционную смесь этилацетатом, а затем промывали насыщенным водным раствором хлорида натрия. Получаемый органический слой сушили над сульфатом натрия, фильтровали, а затем концентрировали при пониженном давлении. Получаемый остаток очищали колоночной хроматографией на силикагеле (этилацетат/этанол=19/1), получая, таким образом, 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевину (444 мг, соединение (II)). К этому соединению (II) (100 мг) добавляли 5 мл ацетона и 0,5 мл воды с последующим перемешиванием при 50°C. К этому раствору добавляли моногидрат пара-толуолсульфоновой кислоты (68 мг; p-TsOH×H2O). Реакционную смесь перемешивали при 50°C в течение 10 минут. Затем прекращали нагревание реакционной смеси и перемешивали получаемую реакционную смесь в течение ночи. В этом случае кристалл начинал выпадать в осадок при 40°C. Кристалл собирали при комнатной температуре посредством фильтрования, а затем сушили, таким образом, получая настоящее соединение (100 мг) со следующим ниже значением физических свойств.
Свойства: кристаллическое белое твердое вещество
LC-MS: 562 (M+H)+
1H-ЯМР (DMSO-d6): δ2,27 (с, 6H), 3,50-5,50 (ушир., 4H), 7,10 (дд, 4H), 7,29-7,36 (м, 2H), 7,41-7,49 (м, 4H), 7,50-7,57 (м, 2H), 7,58 (с, 2H), 7,88-8,00 (м, 2H), 8,16 (т, 1H), 8,30-8,39 (м, 2H), 8,47 (с, 1H), 8,65 (с, 2H), 8,84 (дд, 1H), 8,93 (д, 1H), 9,20 (с, 1H)
[0140] Рентгеновская порошковая дифрактограмма настоящего соединения (белого твердого кристаллического вещества) приведена на фиг. 5.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой, получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 1.
[0141]
|
[0142] Пример 2
Дибензолсульфонат 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины
Выполняли те же операции, как и в примере 1, за исключением того, что использовали бензолсульфоновую кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Другими словами, добавляли соединение (II) (100 мг) и растворяли в 2 мл ацетона. К этому раствору добавляли 56 мг бензолсульфоновой кислоты в 0,5 мл ацетона. Реакционную смесь концентрировали при пониженном давлении. К получаемому остатку добавляли изопропил ацетат с последующим перемешиванием при 85°C. Получаемое твердое вещество собирали посредством фильтрования, а затем сушили, получая, таким образом, настоящее соединение.
[0143] 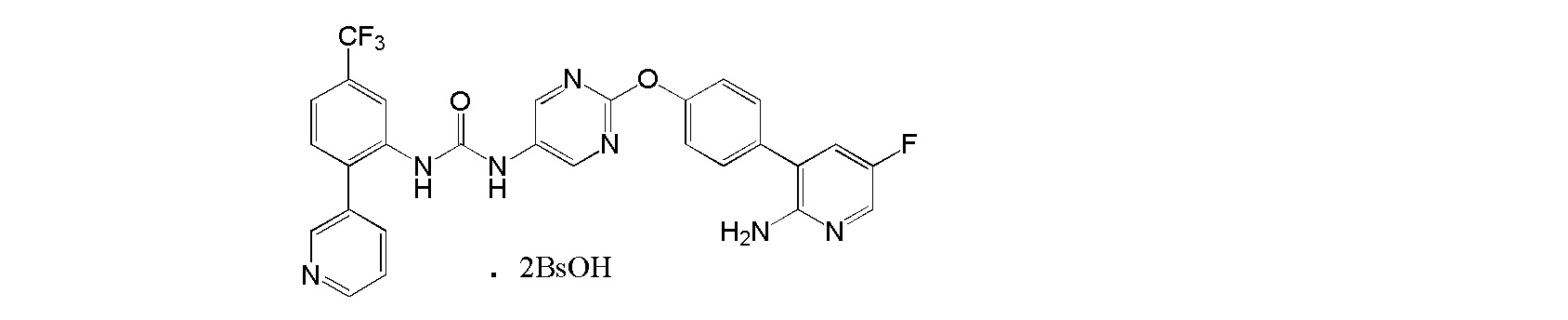
[0144] Свойства: твердое белое кристаллическое вещество
LC-MS: 562 (M+H)+
1H-ЯМР (DMSO-d6): δ3,50-6,00 (ушир., 4H), 7,27-7,41 (м, 8H), 7,51-7,68 (м, 8H), 7,95-8,05 (м, 2H), 8,20 (т, 1H), 8,34 (с, 1H), 8,40-8,47 (м, 1H), 8,52 (с, 1H), 8,66 (с, 2H), 8,88 (дд, 1H), 8,99 (д, 1H), 9,21 (с, 1H)
[0145] Рентгеновская порошковая дифрактограмма настоящего соединения (твердого белого кристаллического вещества) представлена на фиг. 6.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой, получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 2.
[0146]
|
[0147] Пример 3
Диметансульфонат 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины
Выполняли те же операции, как и в примере 1, за исключением того, что использовали метансульфоновую кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Другими словами, добавляли соединение (II) (100 мг) и растворяли в 10 мл этанола при 50-70°C. К этому раствору добавляли 0,024 мл метансульфоновой кислоты с последующим перемешиванием. Реакционную смесь перемешивали в течение одного часа, а затем собирали получаемый кристалл посредством фильтрования и сушили, таким образом, получая настоящее соединение.
[0148] 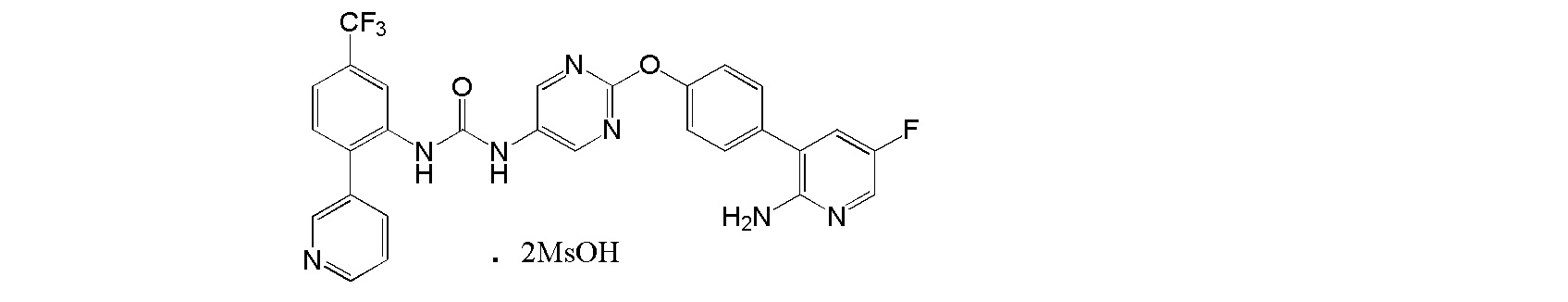
[0149] Свойства: твердое белое кристаллическое вещество
LC-MS: 562 (M+H)+
1H-ЯМР (DMSO-d6): δ2,34 (с, 6H), 3,50-5,50 (ушир., 4H), 7,33 (д, 2H), 7,52-7,62 (м, 4H), 7,88-7,97 (м, 2H), 8,14-8,19 (м, 1H), 8,29-8,37 (м, 2H), 8,50 (с, 1H), 8,67 (с, 2H), 8,85 (дд, 1H), 8,92 (д, 1H), 9,26 (с, 1H)
[0150] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 7.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой, получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 3.
[0151]
|
[0152] Пример 4
Дигидрохлорид 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины
Выполняли те же операции, как и в примере 1 за исключением того, что использовали соляную кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Другими словами, раствор DMSO соединения (II) добавляли к 1н. соляной кислоте с последующим перемешиванием. Выпадающий в осадок кристалл собирали посредством фильтрования, а затем сушили, таким образом, получая настоящее соединение.
[0153] 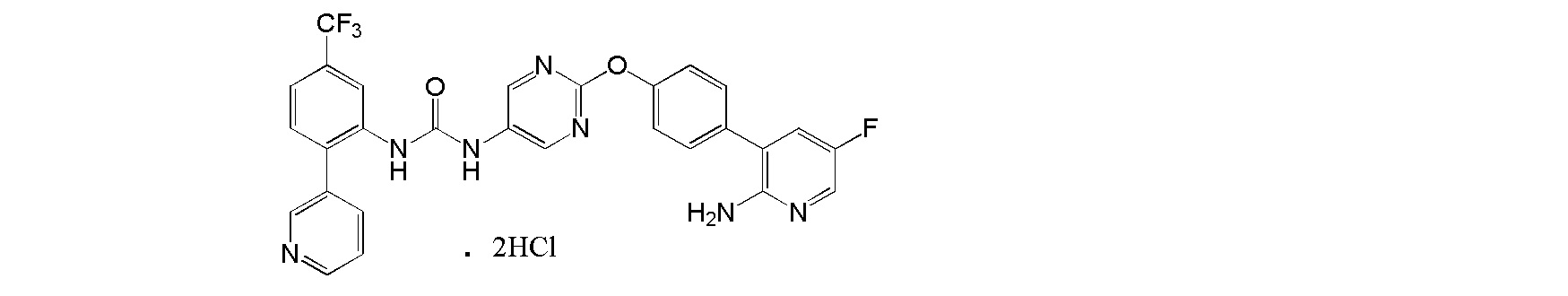
[0154] Свойства: твердое белое кристаллическое вещество
LC-MS: 562 (M+H)+
1H-ЯМР (DMSO-d6): δ4,00-5,50 (ушир., 4H), 7,34 (д, 2H), 7,52-7,62 (м, 4H), 7,90-8,01 (м, 2 H), 8,21 (т, 1H), 8,32-8,39 (м, 1H), 8,42 (с, 1H), 8,67 (с, 2H), 8,76 (с, 1H), 8,87 (дд, 1H), 8,93-9,00 (м, 1H), 9,84 (с, 1H)
[0155] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 8.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 4.
[0156]
|
[0157] Пример 5
Пара-толуолсульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины
Выполняли те же операции, как и операции в справочном примере 1 → справочный пример 2 → справочный пример 3 → справочный пример 4 → пример 1, за исключением того, что использовали соответствующий 2-(1H-пиразол-1-ил)-5-(трифторметил)анилин (CAS №: 883881-78-5) вместо 2-(пиридин-3-ил)-5-(трифторметил)бензоламина и 2-амино-3-бром-5-хлорпиридин вместо 2-амино-3-бром-5-фторпиридина, соответственно, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Свойства получаемого соединения являлись аморфными.
[0158] 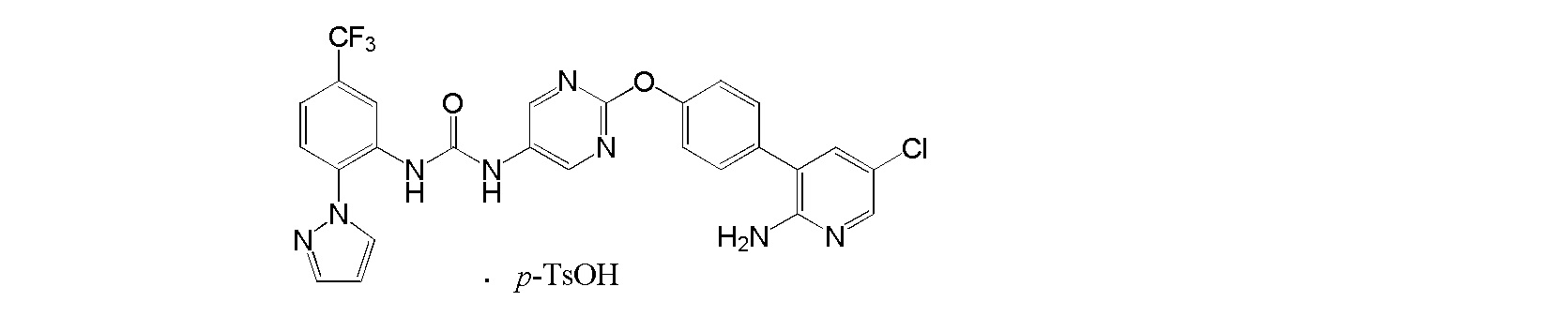
[0159] Свойства: Аморфное твердое белое вещество
LC-MS: 567 (M+H)+
1H-ЯМР (DMSO-d6): δ2,29 (с, 3H), 3,35-4,20 (ушир., 3H), 6,67-6,71 (м, 1H), 7,11 (д, 2H), 7,32 (д, 2H), 7,47 (д, 2H), 7,51-7,57 (м, 3H), 7,69-7,73 (м, 1H), 7,74-7,80 (м, 1H), 7,97 (д, 1H), 8,09 (д, 1H), 8,43 (д, 1H), 8,57-8,61 (м, 1H), 8,72 (с, 2H), 9,74 (с, 1H), 10,00 (с, 1H)
[0160] Рентгеновская порошковая дифрактограмма настоящего соединения (аморфное твердое белое вещество) представлена на фиг. 9.
[0161] Пример 6
Бензолсульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины
Выполняли те же операции, как и в примере 5, за исключением того, что использовали бензолсульфоновую кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Свойства получаемого соединения являлись аморфными.
[0162] 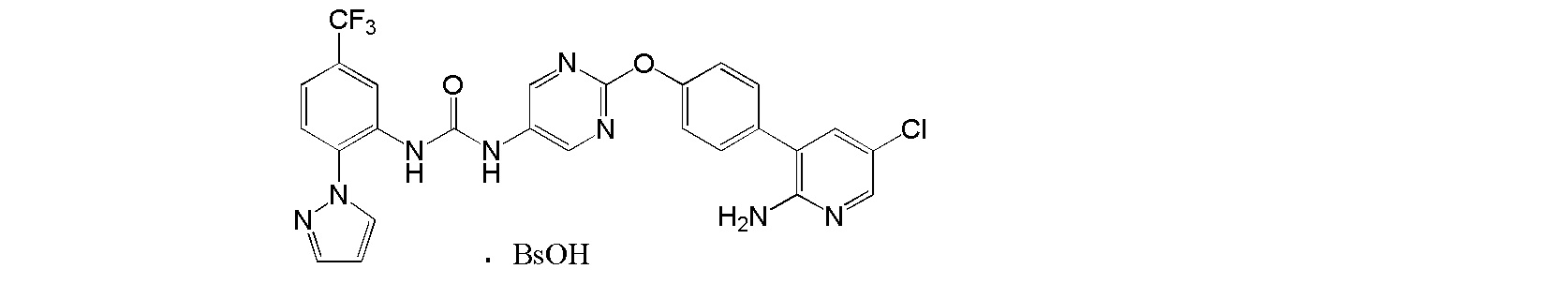
[0163] Свойства: аморфное твердое белое вещество
LC-MS: 567 (M+H)+
1H-ЯМР (DMSO-d6): δ3,20-3,90 (ушир., 3H), 6,65-6,74 (м, 1H), 7,26-7,39 (м, 5H), 7,50-7,64 (м, 5H), 7,72-7,83 (м, 2H), 7,95-8,01 (м, 1H), 8,10 (д, 1H), 8,40-8,47 (м, 1H), 8,57-8,64 (м, 1H), 8,72 (с, 2H), 9,74 (с, 1H), 10,00 (с, 1H)
[0164] Рентгеновская порошковая дифрактограмма настоящего соединения (аморфное твердое белое вещество) представлена на фиг. 10.
[0165] Пример 7
Метансульфонат 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины
Выполняли те же операции, как и в примере 5, за исключением того, что использовали метансульфоновую кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Другими словами, добавляли соединение (III) (100 мг) и растворяли в 1,0 мл этилацетата при 50-70°C. К этому раствору добавляли раствор этилацетата, содержащий метансульфоновую кислоту (0,011 мл). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, а затем перемешивали на ледяной бане в течение 15 минут. Получаемый кристалл собирали посредством фильтрования, а затем сушили, таким образом, получая настоящее соединение.
[0166] 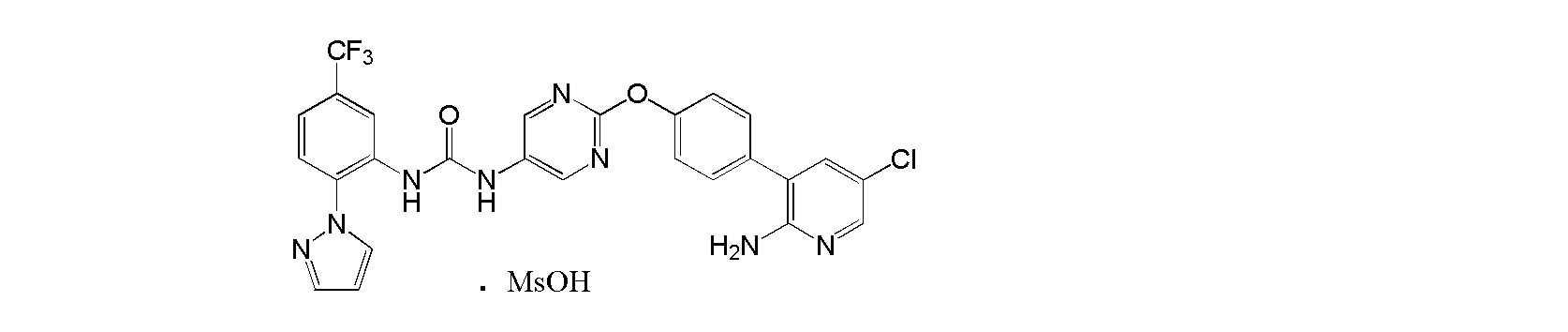
[0167] Свойства: твердое белое кристаллическое вещество
LC-MS: 567 (M+H)+
1H-ЯМР (DMSO-d6): δ2,31 (с, 3H), 3,35-3,85 (ушир., 3H), 6,69 (дд, 1 H), 7,32 (д, 2H), 7,50-7,58 (м, 3H), 7,72 (д, 1H), 7,77 (д, 1H), 7,97 (д, 1H), 8,09 (д, 1H), 8,43 (дд, 1H), 8,59 (д, 1H), 8,72 (с, 2H), 9,74 (с, 1H), 10,00 (с, 1H)
[0168] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 11.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 5.
[0169]
|
[0170] Пример 8
Гидрохлорид 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины
Выполняли те же операции, как и в примере 5, за исключением того, что использовали соляную кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Другими словами, добавляли соединение (III) (90 мг) и растворяли в 1,8 мл этилацетата и 1,8 мл этанола. К этому раствору добавляли 0,079 мл раствора 4н. соляной кислоты-этилацетата. Реакционную смесь перемешивали при комнатной температуре, а затем концентрировали при пониженном давлении. К получаемому остатку добавляли этилацетат с последующим перемешиванием. Получаемый кристалл собирали посредством фильтрования, а затем сушили, таким образом, получая настоящее соединение (97 мг).
[0171] 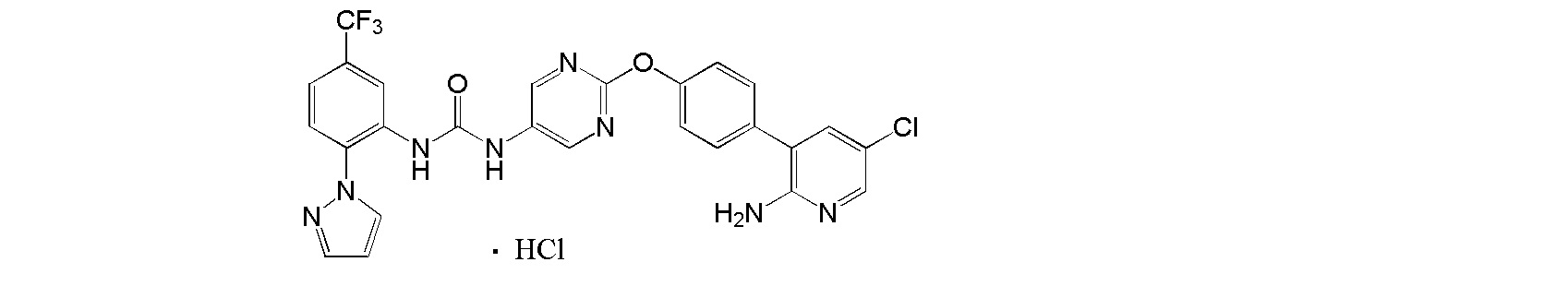
[0172] Свойства: твердое белое кристаллическое вещество
LC-MS: 567 (M+H)+
1H-ЯМР (DMSO-d6): δ3,70-5,20 (ушир., 3H), 6,69 (т, 1H), 7,30-7,35 (м, 2H), 7,52-7,57 (м, 3H), 7,75-7,80 (м, 2H), 7,97 (д, 1H), 8,16 (д, 1H), 8,43 (д, 1H), 8,59 (д, 1H), 8,73 (д, 2H), 9,75 (с, 1H), 10,06 (с, 1H)
[0173] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 12.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 6.
[0174]
|
[0175] Пример 9
Пара-толуолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (кристалл A)
[0176] 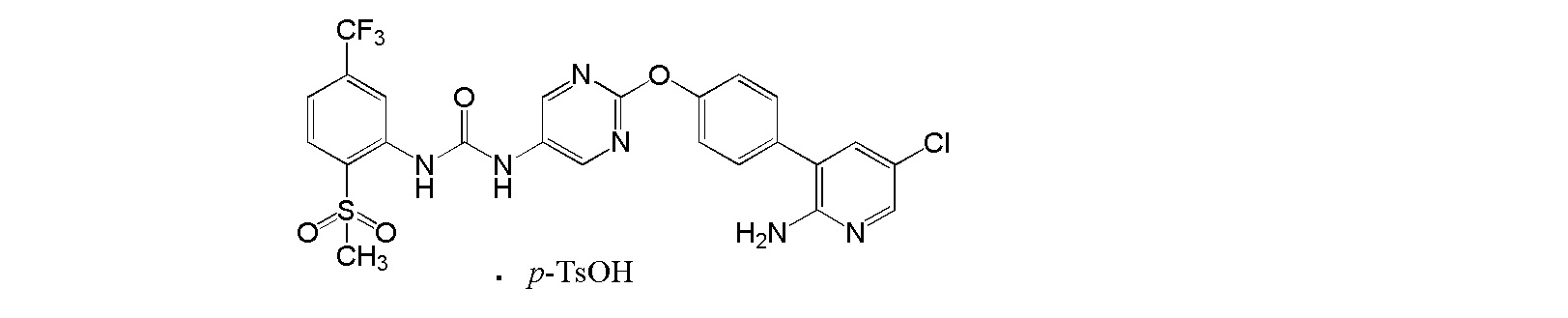
[0177] Выполняли те же операции, как и операции в справочном примере 1 → справочный пример 2 → справочный пример 3 → справочный пример 4 → пример 1, за исключением того, что использовали соответствующий 2-(метилсульфонил)-5-(трифторметил)анилин (CAS №: 402-19-7) вместо 2-(пиридин-3-ил)-5-(трифторметил)бензоламинв и 2-амино-3-бром-5-хлорпиридин вместо 2-амино-3-бром-5-фторпиридина, соответственно, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. В качестве растворителя для перекристаллизации из примера 1 использовали этанол вместо ацетона.
Свойства: твердое белое кристаллическое вещество (кристалл A)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ2,29 (с, 3H), 3,39 (с, 3H), 3,70-4,60 (ушир., 3H), 7,11 (д, 2H), 7,34 (д, 2H), 7,47 (д, 2H), 7,55 (д, 2H), 7,62-7,72 (м, 1H), 7,79 (д, 1H), 8,08 (д, 1H), 8,13 (д, 1H), 8,61-8,68 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,32 (с, 1H)
[0178] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 1.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 7.
[0179]
|
[0180] Пример 10
Бензолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (кристалл A)
Выполняли те же операции, как и в примере 9, за исключением того, что использовали бензолсульфоновую кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. В качестве растворителя для перекристаллизации из примера 1, который необходимо применять в примере 9, использовали ацетонитрил вместо ацетона.
[0181] 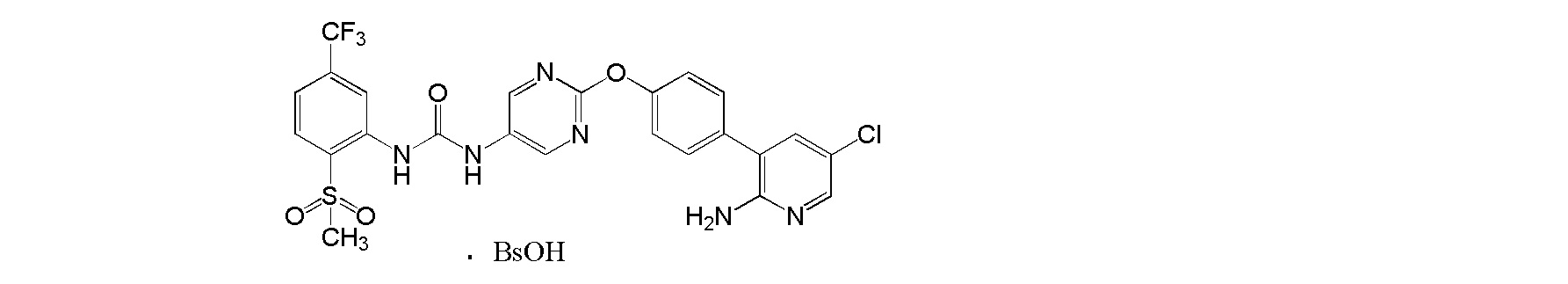
[0182] Свойства: твердое белое кристаллическое вещество (кристалл A)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ3,39 (с, 3H), 3,45-4,10 (ушир., 3H), 7,27-7,37 (м, 5H), 7,52-7,62 (м, 4H), 7,63-7,69 (м, 1H), 7,73 (д, 1H), 8,06-8,13 (м, 2H), 8,61-8,66 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,33 (с, 1H)
[0183] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 2.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 8.
[0184]
|
[0185] Пример 11
Метансульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины
Выполняли те же операции, как и в примере 9, за исключением того, что использовали метансульфоновую кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств. Другими словами, добавляли 120 мг соединения (I) и растворяли в 8,4 мл ацетонитрила при 50-70°C. К этому раствору добавляли раствор 0,22 мл 1 моль/л метансульфоновой кислоты-ацетонитрила. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, а затем перемешивали на ледяной бане в течение одного часа. Получаемый кристалл собирали посредством фильтрования, а затем сушили, таким образом, получая настоящее соединение.
[0186] 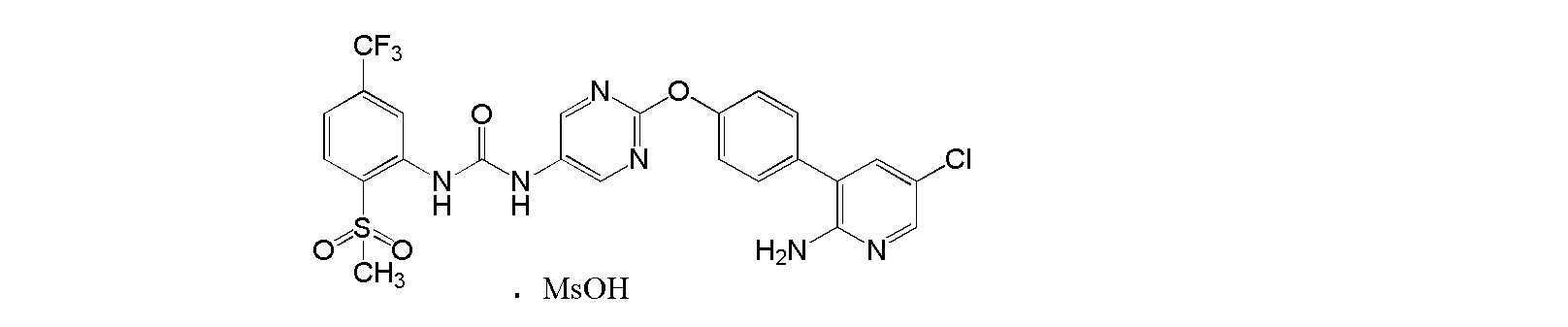
[0187] Свойства: твердое белое кристаллическое вещество
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ2,32 (с, 3H), 3,39 (с, 3H), 3,45-3,95 (ушир., 3H), 7,33 (д, 2H), 7,55 (д, 2H), 7,66 (д, 1 H), 7,72-7,77 (м, 1H), 8,06-8,12 (м, 2H), 8,62-8,67 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,33 (с, 1H)
[0188] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 3.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 9.
|
[0190] Пример 12
Гидрохлорид 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины
Выполняли те же операции, как и в примере 9, за исключением того, что использовали соляную кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств.
[0191] 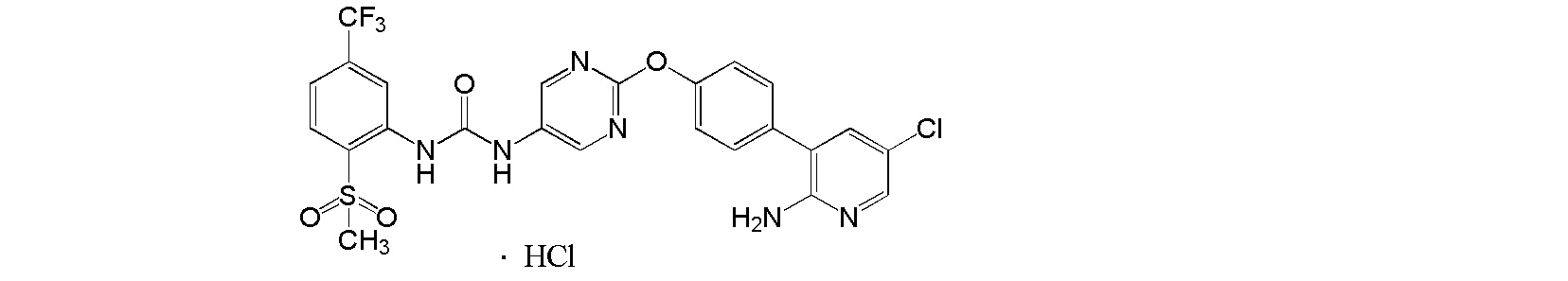
[0192] Свойства: твердое белое кристаллическое вещество
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ3,40 (с, 3H), 3,45-3,95 (ушир., 3H), 7,30-7,35 (м, 2H), 7,52-7,57 (м, 2H), 7,66 (дд, 1H), 7,70 (д, 1H), 8,07-8,11 (м, 2H), 8,62-8,65 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,36 (с, 1H)
[0193] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 4.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 10.
[0194]
|
[0195] Пример 13
Пара-толуолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (кристалл B)
Добавляли соединение (10 мг), получаемое в примере 9, и растворяли в 0,7 мл ацетонитрила при 60-80°C. Этот раствор перемешивали при комнатной температуре в течение ночи и сушили получаемый кристалл, таким образом, получая настоящее соединение со следующим ниже значением физических свойств.
Свойства: твердое белое кристаллическое вещество (кристалл B)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ2,29 (с, 3H), 3,39 (с, 3H), 3,70-4,60 (ушир., 3H), 7,11 (д, 2H), 7,34 (д, 2H), 7,47 (д, 2H), 7,55 (д, 2H), 7,62-7,72 (м, 1H), 7,79 (д, 1H), 8,08 (д, 1H), 8,13 (д, 1H), 8,61-8,68 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,32 (с, 1H)
[0196] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 13.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 11.
[0197]
|
[0198] Пример 14
Пара-толуолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (кристалл I)
Добавляли соединение (10 мг), получаемое в примере 9, и растворяли в 110 мкл 30% гидратированного этанола при 50-75°C. Этот раствор перемешивали при комнатной температуре в течение ночи и сушили получаемый кристалл, таким образом, получая настоящее соединение со следующим ниже значением физических свойств.
Свойства: твердое белое кристаллическое вещество (кристалл I)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ2,29 (с, 3H), 3,39 (с, 3H), 3,70-4,60 (ушир., 3H), 7,11 (д, 2H), 7,34 (д, 2H), 7,47 (д, 2H), 7,55 (д, 2H), 7,62-7,72 (м, 1H), 7,79 (д, 1H), 8,08 (д, 1H), 8,13 (д, 1H), 8,61-8,68 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,32 (с, 1H)
[0199] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 14.
(1) Рентгеновская порошковая дифрактограмма
Указанные выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 12.
[0200]
|
[0201] Пример 15
Бензолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (кристалл B)
Добавляли соединение (10 мг), получаемое в примере 10, и растворяли в 40 мкл 30% гидратированного этанола при 50-75°C. Этот раствор перемешивали при комнатной температуре в течение ночи, и сушили получаемый кристалл, таким образом, получая настоящее соединение со следующим ниже значением физических свойств.
Свойства: твердое белое кристаллическое вещество (кристалл B)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ3,39 (с, 3H), 3,45-4,10 (ушир., 3H), 7,27-7,37 (м, 5H), 7,52-7,62 (м, 4H), 7,63-7,69 (м, 1H), 7,73 (д, 1H), 8,06-8,13 (м, 2H), 8,61-8,66 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,33 (с, 1H)
[0202] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 15.
(1) Рентгеновская порошковая дифрактограмма
Указанные выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 13.
[0203]
|
[0203] Пример 16
Бензолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (кристалл F)
Добавляли соединение (10 мг), получаемое в примере 10, и растворяли в 200 мкл ацетона и 50 мкл уксусной кислоты при 40-60°C. Этот раствор перемешивали при комнатной температуре в течение ночи, и сушили получаемый кристалл, таким образом, получая настоящее соединение со следующим ниже значением физических свойств.
Свойства: твердое белое кристаллическое вещество (кристалл F)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ3,39 (с, 3H), 3,45-4,10 (ушир., 3H), 7,27-7,37 (м, 5H), 7,52-7,62 (м, 4H), 7,63-7,69 (м, 1H), 7,73 (д, 1H), 8,06-8,13 (м, 2H), 8,61-8,66 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,33 (с, 1H)
[0205] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 16.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 14.
[0206]
|
[0207] Пример 17
Гидробромид 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины
Выполняли те же операции, как и в примере 9, за исключением того, что использовали бромистоводородную кислоту вместо моногидрата пара-толуолсульфоновой кислоты, таким образом, получая настоящее соединение со следующим ниже значением физических свойств.
[0208] 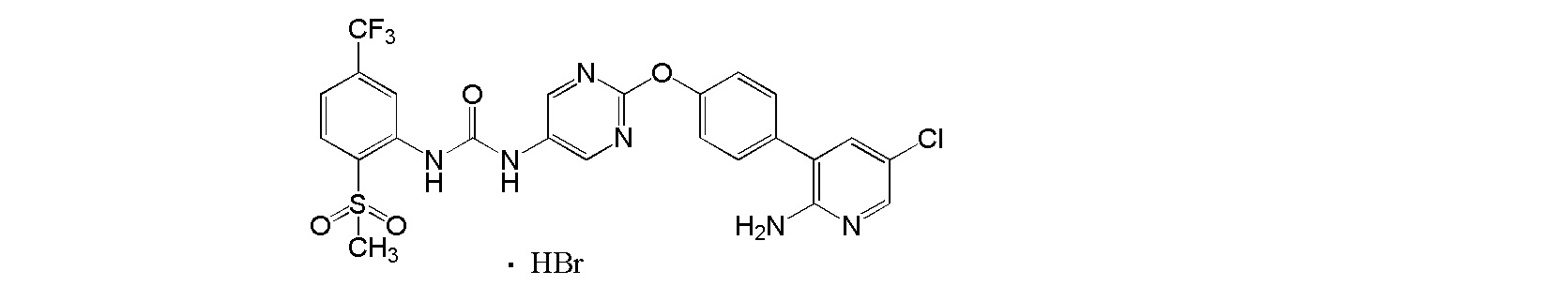
[0209] Свойства: твердое белое кристаллическое вещество (кристалл F)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ3,40 (с, 3H), 4,41-5,34 (ушир., 3H), 7,33 (д, 2H), 7,55 (д, 2H), 7,66 (дд, 1H), 7,74 (д, 1H), 8,05-8,14 (м, 2H), 8,61-8,66 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,32 (с, 1H)
[0210] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 17.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 15.
[0211]
|
[0212] Пример 18
Пара-толуолсульфонат 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (кристалл F)
Добавляли соединение (10 мг), получаемое в примере 9, и растворяли в 60 мкл 50% гидратированного диоксана при 60-80°C. Этот раствор перемешивали при комнатной температуре в течение ночи и собирали получаемое твердое вещество посредством фильтрования, а затем сушили, таким образом, получая настоящее соединение со следующим ниже значением физических свойств.
Свойства: твердое белое кристаллическое вещество (кристалл F)
LC-MS: 579 (M+H)+
1H-ЯМР (DMSO-d6): δ2,29 (с, 3H), 3,39 (с, 3H), 3,70-4,60 (ушир., 3H), 7,11 (д, 2H), 7,34 (д, 2H), 7,47 (д, 2H), 7,55 (д, 2H), 7,62-7,72 (м, 1H), 7,79 (д, 1H), 8,08 (д, 1H), 8,13 (д, 1H), 8,61-8,68 (м, 1H), 8,77 (с, 2H), 8,99 (с, 1H), 10,32 (с, 1H)
[0213] Рентгеновская порошковая дифрактограмма настоящего соединения (твердое белое кристаллическое вещество) представлена на фиг. 18.
(1) Рентгеновская порошковая дифрактограмма
Указанный выше кристалл характеризуется порошковой рентгеновской дифрактограммой получаемой с использованием Cu-Kα-облучения, данными дифракционного угла (2θ) и относительной интенсивности, представленными в следующей ниже таблице 16.
[0214]
|
[0215] Экспериментальные примеры характеристики соединения
Эксперимент 1 характеристики соединения: тестирование растворимости
В тестовой пробирке взвешивали приблизительно 5 мг настоящего соединения, в тестовую пробирку добавляли мешалку и 5 мл искусственного желудочно-кишечного сока (FaSSIF; ссылка 1: Pharmaceutical Research, Vol. 20, pp.1674-1680, 2003, и ссылка 2: Biological & Pharmaceutical Bulletin, Vol. 34, pp.401-407, 2011), а затем герметично запечатывали тестовую пробирку. Тестовую пробирку помещали в устройство тестирования растворимости (Gilson, Quad-Z 215) и проводили перемешивание при 37°C и 700 об./мин. Через 0,25, 0,5, 1, 3, 6 и 24 часов собирала часть жидкости в тестовой пробирке, соответственно. Собранную жидкость фильтровали на фильтре и 2-кратно разбавляли фильтрат ацетонитрилом. Разбавленную жидкость центрифугировали при 3000 об./мин. в течение 5 минут. Супернатант после центрифугирования использовали в качестве исследуемого раствора и рассчитывали растворимость посредством высокоэффективной жидкостной хроматографии.
[0216] <Условия измерения высокоэффективной жидкостной хроматографии>
Случай 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины (соединения (I)) и его солей присоединения кислоты:
(1)
Устройство: ВЭЖХ Agilent серия 1100
Колонка: Waters Xbridge C18 (4,6 мм во внутреннем диаметре×50 мм, 3,5 мкм)
Температура колонки: 40°C
Компоненты подвижной фазы: 20 мМ дигидрофосфат калия (pH 3,0)/ацетонитрил (0 мин: 55/45, 8 мин: 20/80)
УФ: 308 нм
Скорость потока: 1,0 мл/мин
Температура штатива для образца: 20°C
Количество впрыскиваемого образца: 40 мкл
Время измерения: 8 мин
Время удержания: 3,3 мин
[0217] (2)
Устройство: ВЭЖХ HITACHI La Chrom ELITE
Колонка: Waters Xbridge C18 (4,6 мм во внутреннем диаметре×50 мм, 3,5 мкм)
Температура колонки: 40°C
Компоненты подвижной фазы: 20 мМ дигидрофосфат калия (pH 3,0)/ацетонитрил (0 мин: 55/45, 8 мин: 20/80)
УФ: 308 нм
Скорость потока: 1,0 мл/мин
Температура штатива для образца: 20°C
Количество впрыскиваемого образца: 10 мкл
Время измерения: 8 мин
Время удержания: 4,3 мин
[0218] В результате, например, растворимость указанного выше соединения (I) и растворимость его солей присоединения кислоты через 0,25 часов представлена ниже. Например, растворимость в форме пара-толуолсульфоната составляла 96 мг/мл (соответствующая растворимости 74 мг/мл для соединения (I) в форме свободного основания), и растворимость в форме метансульфоната составляла 55 мг/мл (соответствующая растворимости 47 мг/мл для соединения (I) в форме свободного основания). В то же время, растворимость указанного выше соединения (I) составляла 7 мг/мл.
[0219] Случай 1-{2-[4-(2-амино-5-фторпиридин-3-ил)фенокси]пиримидин-5-ил}-3-[2-(пиридин-3-ил)-5-(трифторметил)фенил]мочевины (соединения (II)) и его солей присоединения кислоты:
(1)
Устройство: ВЭЖХ HITACHI La Chrom ELITE
Колонка: Waters Xbridge Shield RP-18 (4,6 мм во внутреннем диаметре×50 мм, 3,5 мм)
Температура колонки: 40°C
Компоненты подвижной фазы: 20 мМ дигидрофосфат калия (pH 3,0)/ацетонитрил (0 мин: 75/25, 10 мин: 20/80, 10,1 мин: 75/25, 15 мин: 75/25)
УФ: 312 нм
Скорость потока: 1,0 мл/мин
Температура штатива для образца: 25°C
Количество впрыскиваемого образца: 5 мл
Время измерения: 10 мин
Время удержания: 5,9 мин
[0220] (2)
Устройство: ВЭЖХ Agilent серия 1100
Колонка: Waters Xbridge Shield RP-18 (4,6 мм во внутреннем диаметре×50 мм, 3,5 мкм)
Температура колонки: 40°C
Компоненты подвижной фазы: 20 мМ дигидрофосфат калия (pH 3,0)/ацетонитрил (0 мин: 75/25, 10 мин: 20/80, 10,1 мин: 75/25, 15 мин: 75/25)
УФ: 312 нм
Скорость потока: 1,0 мл/мин
Температура штатива для образца: 20°C
Количество впрыскиваемого образца: 5 мкл
Время измерения: 10 мин
Время удержания: 5,6 мин
[0221] В результате, например, растворимость указанного выше соединения (II) и растворимость его солей присоединения кислоты через 0,25 часов приведены ниже. Например, растворимость в форме ди(пара-толуолсульфоната) составляла 99 мг/мл (соответствующая растворимости 61 мг/мл для соединения (II) в форме свободного основания), и растворимость в форме дибензолсульфоната составляла 81 мг/мл (соответствующая растворимости 52 мг/мл для соединение (II) в форме свободного основания). В тоже время, растворимость указанного выше соединения (II) составляла 4 мг/мл.
[0222] Случай 1-(2-(1H-пиразол-1-ил)-5-(трифторметил)фенил)-3-(2-(4-(2-амино-5-хлорпиридин-3-ил)фенокси)пиримидин-5-ил)мочевины (соединение (III)) и его солей присоединения кислоты:
Устройство: ВЭЖХ Agilent серия 1100
Колонка: Waters Xbridge Shield RP-18 (4,6 мм во внутреннем диаметре×50 мм, 3,5 мкм)
Температура колонки: 25°C
Компоненты подвижной фазы: 20 мМ дигидрофосфат калия (pH 3,0)/ацетонитрил (0 мин: 52/48, 10 мин: 20/80, 10,1 мин: 52/48, 15 мин: 52/48)
УФ: 304 нм
Скорость потока: 1,0 мл/мин
Температура штатива для образца: 25°C
Количество впрыскиваемого образца: 20 мкл
Время измерения: 10 мин
Время удержания: 4,5 мин
[0223] В результате, например, растворимость указанного выше соединения (III) и растворимость его солей присоединения кислоты через 0,25 часов приведены ниже. Например, растворимость в форме пара-толуолсульфоната составляла 55 мг/мл (соответствующая растворимости 42 мг/мл для соединения (III) в форме свободного основания), и растворимость в форме метансульфоната составляла 53 мг/мл (соответствующая растворимости 45 мг/мл для соединения (III) в форме свободного основания). В то же время, растворимость указанного выше соединения (II) составляла 26 мг/мл.
[0224] Эксперимент 2 характеристики соединение: эксперимент по фармакокинетике
Получали суспензию каждого из настоящих соединений и их свободных оснований (соединения (I), соединения (II) и соединения (III)). Суспензии получали с концентрацией 0,2 мг/мл с 0,5% водным раствором метилцеллюлозы. Настоящее соединение получали с концентрацией 0,2 мг/мл в преобразованном виде соответствующем свободному основанию. Каждую из суспензий вводили путем принудительного кормления через зонд в желудок обезьян (самцы макак-крабоеда), которые не получали корм предварительно за сутки до введения. Через 0,25, 0,5, 1, 2, 4, 6, 8 и 24 часа соответственно после введения суспензии (раствора лекарственного средства) шприцом с гепарином собирали 1 мл крови из подкожной латеральной вены. Собранную кровь центрифугировали при 12000 об./мин. в течение 3 минут, таким образом, фракционируя плазму.
Получение и анализ аналитического образца
К 10 мл плазмы добавляли 200 мл ацетонитрила/этанола (7/3, об./об.), содержащего вещество внутренний стандарт (дейтерированное тело свободного основания, соответствующего настоящему соединению) и перемешивали. Смесь центрифугировали при 15000 об./мин. при комнатной температуре в течение 2 минут. Супернатант разбавляли в 2 раза ультрачистой водой, а затем анализировали посредством LC/MC/MS.
[0225] Анализ посредством LC/MS/MS проводили в следующих условиях.
[Условия LC/MS/MS]
Аналитическое устройство: API-4000 (поставляемое Applied Biosystems)
Аналитическая колонка: CAPCELL PAK CR18 (2,0 мм вн. диаметр×50 мм, 5 мкм)
Скорость потока: 0,4 мл/мин
Компоненты подвижной фазы: 10 мМ ацетат аммония/ацетонитрил (0 мин: 55/45, 0,50 мин: 55/45, 1,01 мин: 10/90, 2,00 мин: 10/90, 2,01 мин: 55/45, 3,99 мин: 55/45)
Тип сканирования: MRM (мониторинг множественных реакций)
Полярность: Положительная
В результате настоящие соединения являлись лучше в отношении фармакокинетики по сравнению с соответствующими свободными основания, соответственно.
[0226] Эксперимент 3 характеристики соединение: эксперимент по взаимодействию лекарственного средства
Для получения реакционной смеси смешивали 319,92 мл ультрачистой воды, 30 мл 4/3 моль/л раствора фосфатного буфера (pH 7,4), 0,08 мл 500 ммоль/л EDTA×2Na (динатриевой соли этилендиаминтетрауксусной кислоты) и 2 мкл 20 мг/мл микросом печени человека. Реакционную смесь инкубировали в течение 5 минут на водяной бане при 37°C, а затем добавляли 4 мкл 1 ммоль/л препарата тестируемого вещества. Кроме того, реакционную смесь инкубировали при 37°C в течение 5 минут, а затем добавляли 40 мкл 20 ммоль/л NADPH (восстановленного никотинамидадениндинуклеотидфосфата) с последующим перемешиванием. Реакционную смесь инкубировали при 37°C в течение 30 минут, а затем добавляли 4 мл 15 ммоль/л препарата тестостерона с последующим перемешиванием. Реакционную смесь инкубировали при 37°C в течение 5 минут, а затем собирали 100 мкл реакционной смеси и добавляли к ацетонитрилу, содержащему вещество внутреннего стандарта (d7-6β-гидрокситестостерона) и перемешивали содержимое, таким образом, прекращая реакцию. Образец, получаемый этим способом, представляет собой тестируемое вещество-добавляемый образец. В то же время, образец, получаемый в условиях, в которых в описанном выше способе добавляли ацетонитрил/диметилсульфоксид (9/1, об./об.), который является средой для получения тестируемого вещества, вместо тестируемого вещества, представляет собой контрольный образец. Все соответствующие образцы отдельно центрифугировали при 1500 об./мин. в течение 5 минут с использованием планшета для фильтрования (MultiScreen (зарегистрированный товарный знак) планшеты для фильтрования Solvinert, 0,45 мкм гидрофильный PTFE с низким связыванием). Каждый из образцов после центрифугирования фильтровали через фильтр и разбавляли фильтрат в 2 раза ультрачистой водой, а затем предоставляли на анализ. Анализ посредством LC/MS/MS проводили в следующих условиях.
Условия LC/MS/MS
Аналитическое устройство: API-4000 (поставляемое Applied Biosystems)
Аналитическая колонка: Shim-pack XR-ODSII, 2,2 мкм, 150 мм×2 мм вн. диаметр
Температура колонки: 40°C
Подвижная фаза: 0,1% муравьиная кислота/ацетонитрил (50/50)
Скорость потока: 0,3 мл/мин
Тип сканирования: MRM (мониторинг множественных реакций)
Полярность: положительная
Способ анализа данных
С использованием отношения площади пика метаболит тестостерона (6β-гидрокситестостерона) {(площадь пика метаболита тестостерона)/(площадь пика вещества внутреннего стандарта)} в тестируемом веществе-добавляемом образце и отношения пика метаболита тестостерона (6β-гидрокситестостерона) {(площадь пика метаболита тестостерона)/(площадь пика вещества внутреннего стандарта)} в контрольном образце, рассчитывали коэффициент ингибирования (%) по следующему ниже уравнению 1.
[0227] Уравнение 1
Коэффициент ингибирования={(отношение площади пика метаболита тестостерона в тестируемом веществе-добавляемом образце)/(отношение площади пика метаболита тестостерона в контрольном образце)}×100 (%)
[0228] В результате даже когда концентрация настоящего соединения составляла 10 мМ, коэффициент ингибирования составлял приблизительно от 21 до 34%, и, таким образом, отмечали, что взаимодействие лекарственного средства настоящего соединения являлось очень слабым. С другой стороны, коэффициент ингибирования из примера 85-226, описанного в патентном документе 2, составлял 58% (10 мМ), и его 50% ингибирующая концентрация (IC50) составляла 10 мМ или менее, и, таким образом, соединение характеризовалось высоким взаимодействием с лекарственным средством.
Примеры фармакологических экспериментов
Пример 1 фармакологического эксперимента: измерение ингибирующей активности киназы TrkA с использованием экспрессирующих TrkA клеток человека
Ингибирующую активность киназы TrkA в клеточных системах измеряли с использованием клеток CHO-K1, экспрессирующих TrkA и NFAT-bla человека (клетки CellSenser™ TrkA-NFAT-bla CHO-K1, Invitrogen).
За сутки перед анализом клетки CellSenser™ TrkA-NFAT-bla CHO-K1 суспендировали в среде для анализа (среде со сниженным содержанием сыворотки Opti-MEM1 (Invitrogen), содержащей 0,5% диализированной эмбриональной телячьей сыворотки (Invitrogen), 0,1 мМ заменимых аминокислот (Invitrogen), 1 мМ пирувата натрия (Invitrogen) и антибиотики (100 Ед/мл пенициллина и 100 мг/мл стрептомицина (Invitrogen))) и высевали с плотностью 2,4×104 клеток/40 мкл/лунку 96-луночный планшет с прозрачным дном (Corning, каталожный №: 3882). Кроме того, в некоторые лунки добавляли только среду для анализа по 40 мкл/лунку (без клеток). На сутки анализа 10 мМ настоящего соединения (раствор DMSO) распределяли в 96-луночный планшет (Costar, каталожный №: 3363) и проводили серийное разведение DMSO, таким образом, подготавливая растворы серийного разведения со знаменателем геометрической прогрессии 3. Серийные разведения разбавляли средой для анализа в 100 раз, таким образом, подготавливая раствор настоящего соединения с 10-кратной концентрацией (концентрация DMSO: 1%). В планшет, куда высевали клетки, добавляли настоящее соединение по 5 мкл/лунку, и инкубировали планшет в инкубаторе CO2 с 5% CO2 и 95% воздуха при 37°C в течение 30 минут. Для контроля и слепой пробы добавляли среду для анализа, содержащую 1% DMSO, по 5 мкл/лунку вместо раствора настоящего соединения. Затем в планшет добавляли среду для анализа, содержащую NGF (Mouse 2,5s, Natural, Invitrogen) по 5 мкл/лунку (конечная концентрация NGF: 50 нг/мл) и инкубировали планшет в инкубаторе CO2 с 5% CO2 и 95% воздуха при 37°C в течение 5 часов. Для группы слепой пробы добавляли среду для анализа вместо NGF по 5 мкл/лунку. В планшет добавляли реагент для детекции для репортерного анализа по 10 мкл/лунку с последующей инкубацией в темноте при комнатной температуре в течение 120 минут. Реагент для детекции для репортерного анализа получали от LiveBLAzer™-FRET B/G Loading Набор (Invitrogen). С использованием Analyst GT (Molecular Devices Japan, K.K.) каждую лунку облучали излучением возбуждения при 405 нм и измеряли интенсивности флуоресценции при 460 нм и 530 нм. Рассчитывали отношение времяразрешенный флуоресцентный индуктивно-резонансный перенос энергии (TR-FRET) каждой из лунок по следующему ниже уравнению 2.
[0229] Уравнение 2
Отношение TR-FRET=(A460X-A460F)/(A530X-A530F)
[230] A460X: интенсивность флуоресценции при 460 нм настоящего соединения, контроль или слепой образец
A460F: интенсивность флуоресценции при 460 нм без содержания клеток
A530X: интенсивность флуоресценции при 530 нм настоящего соединения, контроль или слепой образец
A530F: интенсивность флуоресценции при 530 нм без содержания клеток
Коэффициент ингибирования TR-FRET (%) настоящего соединения рассчитывали по следующему ниже уравнению 3.
[0231] Уравнение 3
Коэффициент ингибирования (%)={1-(AX-AB)/(AC-AB)}×100
[0232] AX: отношение TR-FRET в момент времени добавления настоящего соединения
AB: отношение TR-FRET слепой пробы
AC: отношение TR-FRET контроля
Значение IC50 настоящего соединения рассчитывали из кривой ингибирования на основании коэффициента ингибирования настоящего соединения при соответствующих концентрациях.
[0233] В результате отмечали, что ингибирующая TrkA активность (значение IC50) настоящего соединения составляла менее 1 нМ и очень сильно ингибировала TrkA.
[0234] Пример 2 фармакологического эксперимента: тестирование ингибирующей фермент активности KDR
Настоящее соединение растворяли в диметилсульфоксиде, таким образом, подготавливая 100-кратную концентрация от тестируемой концентрации, 3 мМ. Раствор дополнительно разбавляли в 25 раз буфером для анализа (20 мМ HEPES, 0,01% Triton X-100, 2 мМ DTT, pH 7,5), таким образом, подготавливая раствор настоящего соединения. Аналогичным образом, получали раствор вещества положительного контроля с веществом положительного контроля.
[0235] Раствор с 4-кратной концентрацией (5 мл) настоящего соединения доводили буфером для анализа, 5 мкл раствора с 4-кратной концентрацией субстрата/АТФ/металла (Mg) и 10 мкл раствора с 2-кратной концентрацией киназы смешивали в лунке выполненного из полипропилена 384-луночного планшета и составляй взаимодействовать при комнатной температуре в течение одного часа. Реакцию останавливали, добавляя 60 мл буфера для терминация (QuickScout Screening Assist MSA; Carna Biosciences). Пептид субстрата и фосфорилированный пептид в реакционном растворе разделяли и количественно определяли. Реакцию киназы оценивали на основании отношения продуктов (P/(P+S)), рассчитываемого из высоты (S) пика пептида субстрата и высоты (P) пика фосфорилированного пептида. В следующей ниже таблице 17 указаны субстрат, концентрация субстрата, концентрация АТФ и вещество положительного контроля, используемого в тесте определения ингибирования ферментативной активности KDR.
[0236]
|
[0237] Коэффициент ингибирования рассчитывали из среднего сигнала тестируемых лунок настоящего соединения при этом, определяя средний сигнал каждой из контрольных лунок, содержащих все компоненты реакции как 0% ингибирования и определяя средний сигнал лунок фонового уровня (без добавления фермента) как 100% ингибирования, соответственно. В результате коэффициент ингибирования KDR настоящим соединением в концентрации 3 мМ составлял от 0 до 18%.
[0238] На основании этого результата отмечали, что настоящее соединение очень слабо ингибировало KDR и селективно сильно ингибировала TrkA.
[0239] Пример 3 фармакологического эксперимента: ингибирующий эффект индуцированной NGF повышенной проницаемости сосудов крысы
Ингибирующую TrkA активность настоящего соединения оценивали in vivo. Настоящее соединение, растворенное в среде, перорально вводили (вводимый объем: 5 мкл/кг) самцам крыс CD(SD)IGS (в возрасте 7-9-недель, Charles River Laboratories Japan, Inc.) с бритой спиной. Среду перорально вводили (вводимый объем: 5 мкл/кг) контрольной и нормальной группам. Через 12 или 14 часов после введения 3 мкг/мл NGF (Mouse 2.5s, Natural, Invitrogen) раствор, получаемый в содержащем 0,1% BSA (Sigma-Aldrich) физиологическом растворе, вводили внутрикожно (введенный объем; 50 мкл/участок) в 3 участка на спине животных под анестезией галотаном. Нормальной группе внутрикожно вводили содержащий 0,1% BSA физиологический раствор was (введенный объем; 50 мкл/участок) в 3 участка на спине. Непосредственно после внутрикожного введения вводили внутривенно 1% Evans Blue (Tokyo Chemical Industriy Co., Ltd.), растворенный в физиологическом растворе, в хвост (вводимый объем: 3 мкл/кг). Через 10 минут после введения животных умерщвляли путем обескровлевания вследствие разреза брюшной аорты. Вырезали участки внутрикожного введения на спине (3 участка) и образцы кожа соответственно переносили в лунки в 48-луночный планшет (Asahi Glass Co., Ltd.). В планшет добавляли формамид (0,8 мкл/лунку) и герметично закрывали планшет, и инкубировали в течение ночи при 60°C. Экстрагирующий раствор формамида (200 мкл) переносили в 96-луночный планшет и измеряли оптическую плотность (длина волны: 620 нм) Evans Blue, экстрагируемого в формамиде, на микропланшетном спектрофотометре для определения оптической плотности (SpectraMAX 190, Molecular Devices Japan, K.K.). Оптическую плотность образцов стандартов Evans Blue, растворенных в формамиде (0, 0,78, 1,56, 3,13, 6,25, 12,5, 25 и 50 мкг/мл), измеряли одновременно (длина волны: 620 нм), таким образом, получая калибровочную кривую. На основании калибровочной кривой и оптических плотностей соответствующих образцов рассчитывали концентрации Evans Blue в каждом образце. Концентрации Evans Blue для трех образцов кожи, собираемых от одного животного, усредняли с получением одного значения для животного. Коэффициент ингибирования индуцированной NGF повышенной проницаемости сосудов крысы настоящего соединения рассчитывали по следующему ниже уравнению 4.
[0240] Уравнение 4
Коэффициент ингибирования (%)={1-(AX-AN)/(AC-AN)}×100
[0241] AX: Концентрация Evans Blue настоящего соединения (среднее значение 3 образцов от одного животного)
AN: Концентрация Evans Blue нормальной группы (среднее значение 3 образцов от одного животного)
AC: Концентрация Evans Blue контрольной группы (среднее значение 3 образцов от одного животного)
В результате отмечали, что настоящее соединение (вводимое в количестве 1 мкг/кг как преобразованное в соответствующее свободное основание (соединение (I), соединение (II) или соединение (III)) значительно ингибировало индуцированную NGF повышенную проницаемость сосудов крысы даже через длительный период времени. Например, коэффициент ингибирования гидрохлорида соединения (I) составлял приблизительно 100% (за 14 часов до введения); коэффициент ингибирования ди(пара-толуолсульфоната) соединения (II) составлял приблизительно 78% (за 12 часов до введения), и коэффициент ингибирования метансульфоната соединения (III) составлял приблизительно 97% (за 14 часов до введением). С другой стороны, коэффициент ингибирования примера 85-90 и примера 85-146, описанных в патентном документе 2, индуцированной NGF повышенной проницаемости сосудов крысы составлял 54% (1 мкг/кг; за 12 часов до введения) и 26% (1 мкг/кг; за 14 часов до введения), соответственно.
[0242] Пример 4 фармакологического эксперимента: анальгетический эффект на модельных крысах, индуцированных монойодацетатом натрия
С использованием модельных крыс, индуцированных монойодацетатом натрия (далее в настоящем описании сокращенно обозначаемого как "MIA") (Sigma-Aldrich Japan), оценивали анальгетический эффект настоящего соединения.
[0243] (1) Получение индуцированных MIA модельных крыс
Под анестезией изофлураном крыс брили вокруг колена задних правых конечностей и вводили 25 мкл раствора 120 мкг/мл MIA в коленный сустав правой задней конечности с использованием шприца (BD Lo-Dose, Beckton Dickinson Japan) с иглой калибра 29G. Нормальной контрольной группе вводили 25 мл физиологического раствора.
[0244] (2) Организация группы и группирование
Включенные группы представляли собой нормальную контрольную группу, контрольную группу обработки, группу введения настоящего соединения и группу введения трамадола или группу введения морфина. Кроме нормальной контрольной группы крыс группировали так, чтобы отношение весовой нагрузки правой задней конечности (способ измерения будет описан ниже) модельных крыс через 14 суток после индукции MIA, получаемой способом, как описано выше (1), являлось эквивалентным между всеми группами.
[0245] (3) Введение настоящего соединения, трамадола или морфина
Настоящее соединение растворяли в Wellsolve (Celeste Corporation) с получением раствора 0,1, 0,3 или 1 мкг/мл (концентрация как преобразованного в соответствующие свободные основания, соединение (I), соединение (II), или соединение (III), соответственно). Получаемый 0,1, 0,3 или 1 мг/мл раствор разбавляли в 5 раз дистиллированной водой, таким образом, получая раствор 0,02, 0,06 или 0,2 мг/мл (конечная концентрация Wellsolve: 20%). Трамадол, который представляет собой лекарственное средство положительного контроля, растворяли в физиологическом растворе с получением 2 мг/мл раствора. Альтернативно, морфин, который представляет собой лекарственное средство положительного контроля, растворяли в физиологическом растворе с получением 0,6 мг/мл раствора. От суток 14 до суток 23 после индукции MIA раствор настоящего соединения (0,1, 0,3 или 1 мг/кг) (концентрация как преобразованного в соответствующие свободные основания, соединение (I), соединение (II) или соединение (III), соответственно) повторно вводили перорально в группе настоящего соединения дважды в сутки в течение 10 суток. На сутки 24 после индукции MIA раствор настоящего соединения дополнительно вводили перорально за 3 часа перед измерением отношения весовой нагрузки правой задней конечности и подкожно вводили физиологический раствор за один час до измерения. Группе трамадола или группе морфина повторно перорально вводили 20% Wellsolve дважды в сутки в течение 10 суток от суток 14 до суток 23 после индукции MIA. На сутки 24 после индукции MIA дополнительно перорально вводили 20% Wellsolve за 3 часа до измерения отношения весовой нагрузки правой задней конечности и вводили подкожно раствор трамадола (10 мг/кг) или раствора морфин (3 мг/кг) за один час до измерения. Кроме того, нормальной контрольной группе и контрольной группе заболевания повторно перорально вводили 20% Wellsolve дважды в сутки в течение 10 суток от суток 14 до суток 23 после индукции MIA. На сутки 24 после индукции MIA дополнительно перорально вводили 20% Wellsolve за 3 часа до измерения отношения весовой нагрузки правой задней конечности и вводили подкожно физиологический раствор за один час до измерения.
[0246] (4) Измерение отношения весовой нагрузки правой задней конечности
Нагрузку по массе на правую и левую задние конечности измеряли с использованием устройства Linton Incapacitance Tester (MJS Technology INC., UK). А именно, крысу переносили в замкнутую клетку на устройстве Linton Incapacitance Tester и позиционировали таким образом, чтобы правая и левая задник конечности помещались соответственно на каждой из двух пар гравиметрических датчиков. После подтверждения того, что крыса сохраняла равновесие в положении слева и справа, и вперед и назад, измеряли нагрузку по массе левой и правой задних конечностей, соответственно, в течение 3 секунд. Измерения нагрузки по массе повторяли 3 раза для одной крысы. Для получения стабильных измеряемых значений крыс предварительно подготавливали в замкнутой клетке в течение 20 минут или больше в сутки в течение 5 или более суток между сутками индукции MIA и сутками 14 после индукции. Кроме того, крыс также предварительно подготавливали в клетке непосредственно перед измерением нагрузки по массе приблизительно в течение 10 минут. Весовую нагрузку правой и левой задних конечностей измеряли перед группированием на сутки 14 после индукции MIA и на сутки 24 после индукции для нормальной контрольной группы, контрольной группы заболевания, группы введения настоящего соединения (3 часа после введения), группы введения трамадола (один час после введения) и группы введения морфина (один час после введения). На основании средних значений весовых нагрузок правой и левой задней конечности отношение весовой нагрузки правой задней конечности к весовой нагрузке обеих задних конечностей рассчитывали по следующему ниже уравнению 5. Измерение проводили в слепом режиме. Процент улучшения настоящего соединения рассчитывали на основании отношения весовой нагрузки правой задней конечности каждой группы на сутки 24 после индукции MIA по следующему ниже уравнению 6, таким образом, оценивая анальгетический эффект настоящего соединения.
[0247] Уравнение 5
Отношение весовой нагрузки правой задней конечности B (%)={AR/(AR+AL)×100}
[0248] AR: весовая нагрузка правой задней конечности (среднее значение трех измерений на крысу)
AL: Весовая нагрузка левой задней конечности (среднее значение трех измерений на крысу)
[0249] Уравнение 6
Процент улучшения настоящего соединения (%)={1-(BT-BC)/(BN-BC)}×100
[0250] BC: среднее значение нормальной контрольной группы
BN: среднее значение контрольной группы заболевания
BT: среднее значение группы настоящего соединения.
В результате процент улучшения настоящее соединение являлся ковалентным или большим, чем процент улучшения для трамадола (процент улучшения: 43%) и морфина (процент улучшения: 54%), каждый из которых широко используется в качестве анальгетического средства. Например, процент улучшения гидрохлорида соединения (I) составлял приблизительно 54% (лекарственное средство положительного контроля: морфин); процент улучшения ди(пара-толуолсульфоната) соединения (II) составлял приблизительно 53% (лекарственное средство положительного контроля: морфин), и процент улучшения метансульфоната соединения (III) составлял приблизительно 61% (лекарственное средство положительного контроля: трамадол). Таким образом, отмечали, что настоящее соединение обладает анальгетическим эффектом, эквивалентным или большим, чем анальгетический эффект трамадола и морфина.
[0251] Пример 5 фармакологического эксперимента: противоопухолевый эффект на линии клеток рака толстого кишечника человека KM12
Противоопухолевый эффект настоящего соединения оценивали с использованием KM12 (ATCC, Inc., каталожный № RBC0805), которая представляет собой линию клеток рака толстого кишечника человека. KM12 высевали в DMEM (Life Technologies Corporation, каталожный № 11965), содержащей 10% об. инактивированной эмбриональной телячьей сыворотки (FBS) и 1% об. жидкого пенициллина-стрептомицина (Life Technologies Corporation) и субкультивировали. За сутки перед обработкой настоящим соединением KM12 открепляли от подложки с использованием 0,25% Trysin-EDTA и собирали KM12 в центрифужную пробирку из чашки. KM12 центрифугировали при 180g при комнатной температуре в течение 3 минут, а затем суспендировали клеточный осадок в 10 мл среды DMEM. Часть суспензии KM12 собирали, подсчитывали число клеток в ней, а затем суспендировали KM12 с платностью клеток 5×104 клеток/мл в среде DMEM, таким образом, получая клеточную суспензию. В 96-луночный планшет для культивирования тканей (Asahi Glass Co., Ltd.) высевали суспензию KM12 100 мкл/лунку и планшет оставляли отстаиваться в течение 16 часов в условиях при 37°C в 5% CO2 и 95% воздуха. На сутки обработки настоящим соединением 10 ммоль/л настоящего соединения (раствор DMSO) серийно разводили DMSO, таким образом, получая растворы настоящего соединения с концентрацией 0,03, 0,1, 0,3, 1, 3, 10, 30 и 100 мкмоль/л, соответственно. Кроме того, эти растворы DMSO разбавляли в 100 раз средой, таким образом, получая среду, содержащую настоящее соединение с концентрацией 0,3, 1, 3, 10, 30, 100, 300 и 1000 нмоль/л, соответственно. Среду в 96-луночном планшете для культивирования тканей, в которой KM12 подвергали статическому культивированию в течение 16 часов, удаляли путем сцеживания. Затем в каждую из лунок добавляли среду DMEM и получаемую, как указано выше, среду, содержащую настоящее соединение в количестве 90 и 10 мкл/лунку, соответственно (конечная концентрация настоящего соединения становилась 0,03, 0,1, 0,3, 1, 3, 10, 30 и 100 нмоль/л). В дальнейшем планшет подвергали статическому культивированию в течение 72 часов в условиях при 37°C в 5% CO2 и 95% воздуха. После завершения статического культивирования с использованием набора CellTiter-Glo Luminescent Cell Viability Assay (Promega, G7571) измеряли люминесцентный сигнал (относительная единица люминесценции, RLU) каждой лунки посредством микропланшетного спектрофотометра. Рассчитывали среднее значение RLU трех лунок группы среды (группы, в которой обрабатывали раствор DMSO с концентрацией настоящего соединения ноль (0)) и рассчитывали коэффициент пролиферации KM12 в каждой лунке по следующему ниже уравнению 7.
[0252] Уравнение 7
Коэффициент пролиферация KM12 (%)=(RLU каждой лунки)÷(среднее значение RLU группы среды)×100
[0253] Затем для группы, которую обрабатывали настоящим соединением, рассчитывали коэффициент ингибирования пролиферации KM12 в каждой лунке по следующему ниже уравнению 8.
[0254] Уравнение 8
Коэффициент ингибирования пролиферации KM12 (%)=100-(скорость пролиферации KM12 (%))
[0255] В результате отмечали, что настоящее соединение значительно ингибирует пролиферацию KM12.
Примеры состава
Пример состава 1
Следующие ниже компоненты, согласно общепринятому способу, смешивали и прессовали таблетки, таким образом, получая 10000 таблеток, содержащих 10 мг активного ингредиента на таблетку.
Гидрохлорид 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинил}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины: 100 г
Карбоксиметилцеллюлоза кальция (дезинтегрирующее средство): 20 г
Стеарат магния (смазочное средство): 10 г
Микрокристаллическая целлюлоза: 870 г
Пример состава 2
Следующие ниже компоненты смешивали общепринятым способом, фильтровали через фильтр для улавливания пыли, распределяли в ампулы по 5 мл и термически стерилизовали в автоклаве, таким образом, получая 10000 ампул, содержащих 20 мг активного ингредиента на ампулу.
Гидрохлорид 1-{2-[4-(2-амино-5-хлор-3-пиридинил)фенокси]-5-пиримидинy)}-3-[2-(метилсульфонил)-5-(трифторметил)фенил]мочевины: 200 г
Маннит: 20 г
Дистиллированная вода: 50 л
ПРИМЕНИМОСТЬ В ПРОМЫШЛЕННОСТИ
[0256] Настоящее соединение обладает ингибирующей Trk активностью и, таким образом, является пригодным в качестве профилактического и/или терапевтического средства для связанных с Trk заболеваний, таких как боль, зуд, расстройство нижних мочевыводящих путей, астма, аллергический ринит, воспалительное заболевание кишечника, болезнь Шагаса, злокачественная опухоль и т.д.