Результат интеллектуальной деятельности: Микроорганизм, продуцирующий O-ацетилгомосерин, и способ получения O-ацетилгомосерина с использованием этого микроорганизма
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к белку, обладающему активностью по высвобождению О-ацетилгомосерина, и его новому модифицированному белку, микроорганизму, способному продуцировать О-ацетилгомосерин, с усиленной экспрессией этого белка и способу получения О-ацетилгомосерина с использованием этого микроорганизма.
Предшествующий уровень техники
Метионин, который может быть получен путем химического и биологического синтеза, используют в качестве исходного вещества для получения настоек и лекарственных средств, а также для получения пищевых продуктов и пищевых добавок. Недавно был раскрыт двухстадийный процесс получения L-метионина из предшественника L-метионина, получаемого путем ферментации, посредством реакции ферментативного превращения (публикация международной заявки WO 2008/013432). В публикации международной заявки WO 2008/013432 раскрыта возможность использования О-сукцинилгомосерина и О-ацетилгомосерина в качестве предшественника метионина в этом двухстадийном процессе, и для экономичного крупномасштабного производства метионина очень важно получать предшественники метионина с высоким выходом.
LeuE известен как белок экспорта лейцина. Как один из белков, принадлежащих семейству гомосерин/гомосерин-лактон-эффлюксного белка (RhtB), LeuE является белком, присутствующим во внутренней мембране, и известно, что он играет роль в экспорте лейцина и его аналогов как предполагаемый неохарактеризованный транспортный белок.
В предшествующем уровне техники в отношении LeuE известно, что пуриновый нуклеозид или пуриновый нуклеотид может быть получен путем улучшения аминокислотной последовательности гена leuE (yeaS) или его модифицированной аминокислотной последовательности, и уровень продуцирования аминокислоты может быть повышен. Кроме того, известен модифицированный leuE, обладающий активностью по высвобождению цистеина.
Раскрытие изобретения
Техническая задача
Авторы настоящего изобретения приложили много усилий для повышения продуцирования О-ацетилгомосерина, и в результате они обнаружили белок, который обладает активностью по высвобождению О-ацетилгомосерина и его модифицированный белок, тем самым осуществляя настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить полипептид, обладающий активностью по высвобождению О-ацетилгомосерина.
Другая задача настоящего изобретения заключается в том, чтобы предложить полинуклеотид, кодирующий этот полипептид.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Escherichia, продуцирующий О-ацетилгомосерин, в который включен полипетид, обладающий активностью по высвобождению О-ацетилгомосерина, или в котором он сверхэкспрессируется.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ получения О-ацетилгомосерина, включающий культивирование микроорганизма рода Escherichia, продуцирующего O-ацетилгомосерин, в среде и выделение О-ацетилгомосерина из культивированного микроорганизма или из культуральной среды.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ получения L-метионина, включающий культивирование микроорганизма рода Escherichia, продуцирующего О-ацетилгомосерин, в среде и превращение О-ацетилгомосерина в L-метионин путем обработки культивированного микроорганизма, или культуральной среды, или О-ацетилгомосерина, выделенного из культивированного микроорганизма или из культуральной среды, метилмеркаптаном и метионин-превращающим ферментом.
Полезные эффекты изобретения
Микроорганизм по настоящему изобретению, включающий модифицированный LeuE или LeuE, которые являются белками внутренней мембраны, обладает повышенной активностью по высвобождению О-ацетилгомосерина, и тем самым эффективность продуцирования О-ацетилгомосерина может быть повышена. Соответственно, микроорганизм по настоящему изобретению можно использовать для эффективного продуцирования О-ацетилгомосерина. Кроме того, О-ацетилгомосерин, полученный с высокой эффективностью, можно использовать для экономичного крупномасштабного производства L-метионина.
Наилучший способ осуществления изобретения
Для решения вышеизложенных задач в одном аспекте настоящего изобретения предложен полипептид, обладающий активностью по высвобождению О-ацетилгомосерина, в котором по меньшей мере одна аминокислота, выбранная из группы, состоящей из валина в положении 1, фениналанина в положении 30, лейцина в положении 95 и фенилаланина в положении 165 в аминокислотной последовательности SEQ ID NO: 1, заменена на другую аминокислоту.
Как его используют здесь, термин "О-ацетилгомосерин", который представляет собой специфическое промежуточное вещество в пути биосинтеза метионина у микроорганизмов, относится к ацетильному производному L-гомосерина. Известно, что О-ацетилгомосерин синтезируется при взаимодействии гомосерина и ацетил-СоА, катализируемой гомосерин-ацетилтрансферазой, и имеет формулу C6H11NO4.
Как его используют здесь, термин "пептид, обладающий активностью по высвобождению О-ацетилгомосерина" относится к полипептиду, имеющему функцию высвобождения О-ацетилгомосерина из клетки микроорганизма наружу клетки. Более конкретно, пептид может относиться к белку LeuE, обладающему активностью по высвобождению О-ацетилгомосерина, и его модифицированному белку, но пептид конкретно не ограничен этим, при условии что он обладает активностью по высвобождению О-ацетилгомосерина.
Как его используют здесь, в отношении транспортеров аминокислот термин "LeuE", который представляет собой белок, принадлежащий семейству гомосерин/гомосерин-лактон-эффлюксного белка (RhtB), относится к белку, присутствующему во внутренней мембране, но его функция точно не известна. В этом отношении, авторы настоящего изобретения впервые подтвердили, что LeuE специфически выводит О-ацетилгомосерин.
LeuE может представлять собой белок, имеющий происхождение из микроорганизма рода Escherichia, и в частности LeuE, имеющий происхождение из Е. coli, но любой LeuE, обладающий активностью по высвобождению О-ацетилгомосерина, может быть включен в объем настоящего изобретения без ограничения в отношении происхождения микроорганизма.
В частности, пептид, обладающий активностью по высвобождению О-ацетилгомосерина, может представлять собой белок, имеющий аминокислотную последовательность SEQ ID NO: 1. Дополнительно, пептид может представлять собой белок, который имеет аминокислотную последовательность, с активностью по высвобождению О-ацетилгомосерина, по существу такую же как аминокислотная последовательность SEQ ID NO: 1 или эквивалентную таковой, при этом имея гомологию с аминокислотной последовательностью SEQ ID NO: 1 по меньшей мере 70%, в частности по меньшей мере 80% и более конкретно по меньшей мере 90%. Альтернативно, пептид может представлять собой аминокислотную последовательность, обладающую такой гомологией, где присутствует делеция, модификация, замена или вставка в части аминокислотной последовательности, с активностью по высвобождению О-ацетилгомосерина, по существу такой же как аминокислотная последовательность SEQ ID NO: 1 или эквивалентной таковой, и очевидно, что этот пептид также входит в объем настоящего изобретения.
Как его используют здесь, термин "модифицированный полипептид" полипептида, обладающего активностью по высвобождению О-ацетилгомосерина, относится к полипептиду, обладающему повышенной активностью по высвобождению О-ацетилгомосерина по сравнению с таковой природного полипептида дикого типа или немодифицированного полипептида. В частности, модифицированный полипептид представляет собой пептид, обладающий повышенной активностью по высвобождению О-ацетилгомосерина по сравнению с таковой полипептида, который имеет аминокислотную последовательность SEQ ID NO: 1, вследствие модификации по меньшей мере одной аминокислоты в аминокислотной последовательности SEQ ID NO: 1.
Например, модифицированный полипептид может представлять собой полипептид, в котором по меньшей мере одна аминокислота, выбранная из группы, состоящей из валина в положении 1, фенилаланина в положении 30, лейцина в положении 95 и фенилаланина в положении 165 в аминокислотной последовательности SEQ ID NO: 1, заменена на другую аминокислоту. В частности, модифицированный полипептид может представлять собой полипептид, в котором валин в положении 1 аминокислотной последовательности SEQ ID NO: 1 заменен на метионин; фенилаланин в положении 30 аминокислотной последовательности SEQ ID NO: 1 заменен на любую аминокислоту, выбранную из группы, состоящей из аланина, триптофана, лейцина, валина, глицина, серина, аспарагина, аспарагиновой кислоты, гистидина, изолейцина, пролина, тирозина, глутамина, лизина, глутаминовой кислоты, цистеина, треонина и аргинина; лейцин в положении 95 аминокислотной последовательности SEQ ID NO: 1 заменен на любую аминокислоту, выбранную из группы, состоящей из валина, фенилаланина, аланина, глицина, треонина, аспарагина, аспарагиновой кислоты, гистидина, изолейцина, серина, пролина, тирозина, глутамина, лизина, глутаминовой кислоты, цистеина, триптофана и аргинина; или фенилаланин в положении 165 аминокислотной последовательности SEQ ID NO: 1 заменен на любую аминокислоту, выбранную из группы, состоящей из аланина, триптофана, лейцина, валина, глицина, серина, аспарагина, аспарагиновой кислоты, гистидина, изолейцина, пролина, тирозина, глутамина, лизина, глутаминовой кислоты, цистеина, треонина и аргинина. Более конкретно, модифицированный полипептид может представлять собой полипептид, в котором валин в положении 1 аминокислотной последовательности SEQ ID NO: 1 заменен на метионин; фенилаланин в положении 30 аминокислотной последовательности SEQ ID NO: 1 заменен на любую аминокислоту, выбранную из группы, состоящей из аланина, триптофана, лейцина, валина, глицина, серина, аспарагина, аспарагиновой кислоты и гистидина; лейцин в положении 95 аминокислотной последовательности SEQ ID NO: 1 заменен на любую аминокислоту, выбранную из группы, состоящей из валина, фенилаланина, аланина, глицина, треонина, аспарагина, аспарагиновой кислоты и гистидина; или фенилаланин в положении 165 аминокислотной последовательности SEQ ID NO: 1 заменен на любую аминокислоту, выбранную из группы, состоящей из аланина, триптофана, лейцина, валина, глицина, серина, аспарагина, аспарагиновой кислоты и гистидина. Еще более конкретно, модифицированный полипептид может представлять собой полипептид, в котором валин в положении 1 аминокислотной последовательности SEQ ID NO: 1 заменен на метионин; и фенилаланин в положении 30, лейцин в положении 95 и фенилаланин в положении 165 аминокислотной последовательности SEQ ID NO: 1 заменены на другую аминокислоту. Даже еще более конкретно, модифицированный полипептид может представлять собой полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 2, 133, 134, 137, 138, 141 или 142. В частности, модифицированный полипептид может представлять собой белок, имеющий аминокислотную последовательность, с повышенной активностью по высвобождению О-ацетилгомосерина, по существу такую же как аминокислотная последовательность модифицированного полипептида или эквивалентную таковой, при этом имея гомологию по меньшей мере 70%, в частности по меньшей мере 80% и более конкретно по меньшей мере 90% с вышеописанными аминокислотными последовательностями. Альтернативно, в аминокислотной последовательности, имеющей такую гомологию и обладающей повышенной активностью по высвобождению О-ацетилгомосерина, по существу такой же как аминокислотная последовательность модифицированного полипептида или эквивалентной таковой, аминокислотная последовательность может представлять собой такую, где имеется делеция, модификация, замена или вставка в части аминокислотной последовательности. Этот полипептид представляет собой пример модифицированного полипептида в контексте полипептида с повышенной активностью по высвобождению О-ацетилгомосерина по сравнению с таковой нативного полипептида дикого типа или немодифицированного полипептида, но полипептид не ограничен этим. Как его используют здесь, термин "природное нативное состояние или немодифицированное состояние" относится к состоянию, где введения соответствующего полипептида или введения модификации активности по настоящему изобретению не достигали.
Как его используют здесь, термин "гомология" относится к степени идентичности между нуклеотидами или аминокислотными остатками двух аминокислотных последовательностей или последовательностей нуклеиновой кислоты гена, кодирующего белок, определенной после их выравнивания с максимальной степенью соответствия друг другу по определенной области сравнения. Когда гомология является достаточно высокой, продукты экспрессии соответствующего гена могут обладать одинаковой или подобной активностью. Процент идентичности последовательностей можно определить с использованием известной программы сравнения последовательностей (например, BLAST (NCBI), CLC Main Workbench (CLC bio), MegAlign (DNASTAR Inc) и так далее).
В одном аспекте настоящего изобретения предложен полинуклеотид, кодирующий полипептид, обладающий активностью по высвобождению О-ацетилгомосерина. В настоящем изобретении полипептид, обладающий активностью по высвобождению О-ацетилгомосерина, является таким как объяснено выше.
Например, полинуклеотид может представлять собой полинуклеотид, в котором инициирующий кодон заменен на ATG, и может представлять собой нуклеотидную последовательность, представленную в SEQ ID NO: 4, 135, 136, 139, 140, 143 или 144, но нуклеотидная последовательность не ограничена этим. Дополнительно, в отношении полинуклеотида, нуклеотидная последовательность и ее модифицированные нуклеотидные последовательности, кодирующие одну и ту же аминокислотную последовательность, также включены в объем настоящего изобретения на основании вырожденности генетического кода. Например, нуклеотидная последовательность может быть модифицирована так, чтобы иметь оптимальный кодон в зависимости от используемого микроорганизма.
В частности, нуклеотидная последовательность может представлять собой нуклеотидную последовательность, которая кодирует аминокислотную последовательность, обладающую активностью по высвобождению О-ацетилгомосерина, по существу такую же как описанные выше нуклеотидные последовательности или эквивалентную им, при этом имея гомологию по меньшей мере 70%, в частности по меньшей мере 80% и более конкретно по меньшей мере 90% описанным выше аминокислотным последовательностям. Альтернативно, нуклеотидная последовательность может представлять собой последовательность, способную гибридизоваться с зондом, который может быть получен из известной последовательности гена (например, последовательности, комплементарной любым описанным выше нуклеотидным последовательностям или их части), в строгих условиях для кодирования белка, обладающего активностью по высвобождению О-ацетилгомосерина. Как его используют здесь, термин "строгие условия" относится к условиям, в которых образуется так называемый специфический гибрид, в то время как неспецифический гибрид не образуется. Например, строгие условия могут включать условия, в которых гены, имеющие высокую степень гомологии (например, 80% или больше, в частности 90% или больше, более конкретно 95% или больше, еще более конкретно 97% или больше и еще более конкретно 99% или больше), могут гибридизоваться между собой, в то время как гены, имеющие более низкую степень гомологии с ними не могут гибридизоваться друг с другом; или условия для традиционной саузерн-гибридизации (то есть, условия для однократной или, в частности, двукратной или трехкратной промывки при концентрации соли и температуре, соответствующим 60°C, 1×SSC (раствор хлорида и цитрата натрия) и 0,1% SDS (додецилсульфат натрия); в частности, при 60°C, 0,1×SSC и 0,1% SDS и более конкретно при 68°C, 0,1×SSC и 0,1% SDS) (Sambrook et al., Molecular Cloning: А Laboratory Manual, 3rd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001)). Зонд, используемый для гибридизации, возможно может представлять собой часть нуклеотидной последовательности, комплементарной описанным выше нуклеотидным последовательностям. Такой зонд может быть получен путем ПЦР с использованием олигонуклеотида, полученного на основе известной последовательности, в качестве праймера и фрагмента гена, содержащего такую нуклеотидную последовательность в качестве матрицы. Например, в качестве зонда можно использовать фрагмент гена размером примерно 300 п.н. Более конкретно, когда фрагмент гена размером примерно 300 п.н. используют в качестве зонда, условия 50°C, 2×SSC и 0,1% SDS составляют перечень условий промывки для гибридизации.
Гены, используемые в настоящем изобретении, белковые последовательности и промоторные последовательности, которые они кодируют, могут быть получены из известной базы данных (например GenBank от NCBI), но не ограничиваясь этим.
Один аспект настоящего изобретения относится к микроорганизму, в который включен полипептид, обладающий активностью по высвобождению О-ацетилгомосерина, или его модифицированный полипептид или в котором таковой сверхэкспрессируется. В частности, микроорганизм может представлять собой микроорганизм, продуцирующий О-ацетилгомосерин или его модифицированный полипептид, в который включен полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1, или в котором таковой сверхэкспрессируется.
Полипептид, обладающий активностью по высвобождению О-ацетилгомосерина, и его модифицированный полипептид являются такими как объяснено выше.
Как его используют здесь, термин "микроорганизм, продуцирующий О-ацетилгомосерин" относится к микроорганизму, способному продуцировать О-ацетилгомосерин в микроорганизме и высвобождать его в среду. Активность по продуцированию О-ацетилгомосерина может быть обеспечена или повышена посредством природных или искусственных мутаций или усовершенствования вида. В частности, такие микроорганизмы, которые продуцируют О-ацетилгомосерин, могут быть включены независимо от их микробного происхождения, при условии что они могут продуцировать О-ацетилгомосерин. В одном воплощении микроорганизм может представлять собой микроорганизм, принадлежащий роду Escherichia и более конкретно Escherichia coli.
При этом в настоящем изобретении микроорганизм, продуцирующий О-ацетилгомосерин, может представлять собой модифицированный микроорганизм, в который дополнительно введена известная модификация, затрагивающая родственные механизмы, такие как пути, относящиеся к биосинтезу гомосерина, и механизмы, относящиеся к высвобождению О-ацетилгомосерина, и так далее, для того чтобы повысить продуктивность по О-ацетилгомосерину помимо LeuE.
Другое конкретное воплощение настоящего изобретения может относиться к микроорганизму, продуцирующему О-ацетилгомосерин, у которого дополнительно активность цистатионин-синтазы инактивирована. В частности, микроорганизм может представлять собой микроорганизм, у которого ген, кодирующий цистатионин-синтазу (metB) делетирован или его экспрессия ослаблена по сравнению с таковой у немодифицированного микроорганизма, но не ограничиваясь этим. Аминокислотную последовательность гена metB можно взять из известной базы данных, и любая аминокислотная последовательность, обладающая активностью цистатионин-синтазы может быть включена без ограничения (например белок, имеющий аминокислотную последовательность SEQ ID NO: 5). Белок, имеющий аминокислотную последовательность SEQ ID NO: 5, может представлять собой белок, кодируемый нуклеотидной последовательностью SEQ ID NO: 6, но не ограничиваясь этим.
Дополнительно, еще одно конкретное воплощение настоящего изобретения может относиться к микроорганизму, продуцирующему О-ацетилгомосерин, у которого дополнительно активность гомосерин-киназы инактивирована. В частности, микроорганизм может представлять собой микроорганизм, у которого активность гомосерин-киназы понижена по сравнению с ее эндогенной активностью у немодифицированного микроорганизма или устранена. Например, микроорганизм может представлять собой микроорганизм, у которого ген (thrB), кодирующий гомосерин-киназу, связан с более слабым промотором по сравнению с нативным промотором, или модифицирован или делетирован с ослаблением активности, но промотор не ограничен этим. Аминокислотную последовательность гена thrB можно взять из известной базы данных, и любая аминокислотная последовательность, обладающая активностью гомосерин-киназы, может быть включена без ограничения (например белок, имеющий аминокислотную последовательность SEQ ID NO: 7). Белок, имеющий аминокислотную последовательность SEQ ID NO: 7, может представлять собой белок, кодируемый нуклеотидной последовательностью SEQ ID NO: 8, но не ограничиваясь этим.
Как его используют здесь, термин "инактивация" белка относится к случаю, когда активность белка у микроорганизма понижена по сравнению с активностью фермента, которой обладает микроорганизм, у нативного белка дикого типа или немодифицированного белка; случаю, когда белок совсем не экспрессируется; или случаю, когда белок экспрессируется, но не проявляет активность. Инактивация представляет собой понятие, включающее случай, когда активность самого фермента понижена или устранена по сравнению с активностью фермента, исходно присутствующего у микроорганизма, вследствие модификации и так далее гена, кодирующего фермент; случаю, когда общий уровень активности фермента в клетке понижен или устранен по сравнению с активностью фермента, исходно присутствующего у штамма микроорганизма дикого типа, вследствие ингибирования экспрессии или трансляции гена, кодирующего фермент; случаю, когда ген частично или полностью делетирован; и их комбинацию; но инактивация не ограничена этим.
Инактивация фермента может быть достигнута путем применения различных способов, хорошо известных в данной области техники. Примеры способов могут включать способ замены гена, кодирующего фермент, на хромосоме, на ген, модифицированный с понижением активности фермента, включая случай, когда активность фермента устранена; способ введения модификации в последовательность контроля экспрессии гена, кодирующего фермент, на хромосоме; способ замены последовательности контроля экспрессии гена, кодирующего фермент, на последовательность, имеющую слабую активность или не имеющую активности; способ делетирования, частично или полностью, гена, кодирующего фермент, на хромосоме; способ введения антисмыслового олигонуклеотида (например антисмысловой РНК), который комплементарно связывается с транскриптом гена на хромосоме, тем самым ингибируя трансляцию мРНК с образованием фермента; способ искусственного включения последовательности, комплементарной последовательности SD (последовательность Шайна-Дальгарно), в последовательность выше по ходу транскрипции от последовательности SD гена, кодирующего фермент, образующей вторичную структуру, тем самым делая невозможным присоединение ее к рибосоме; способ включения промотора на 3'-конце открытой рамки считывания (ORF) для индуцирования обратной транскрипции (технология обратной транскрипции (reverse transcription engineering, RTE)) и так далее, и также их комбинацию, но способы конкретно не ограничены этим.
Способ модификации последовательности контроля экспрессии может быть выполнен путем индуцирования модификации последовательности контроля экспрессии путем делеции, вставки, неконсервативной или консервативной замены или их комбинации в последовательности нуклеиновой кислоты последовательности контроля экспрессии, с тем чтобы дополнительно ослабить активность последовательности контроля экспрессии; или путем замены на нуклеиновую кислоту, обладающую более слабой активностью. Последовательность контроля экспрессии может включать промотор, операторную последовательность, последовательность, кодирующую участок связывания с рибосомой, и последовательности, контролирующие терминацию транскрипции и трансляции, но не ограничиваясь этим.
Более того, последовательность гена на хромосоме может быть модифицирована путем индуцирования модификации в последовательности посредством делеции, вставки, неконсервативной или консервативной замены или их комбинации в последовательности гена для дальнейшего ослабления ферментативной активности; или путем замены на последовательность гена, улучшенную так, чтобы иметь более слабую активность, или на последовательность гена, улучшенную так, чтобы не иметь активности, но способ не ограничен этим.
Дополнительно, способ делетирования, частично или полностью, гена, кодирующего фермент, может быть выполнен путем замены полинуклеотида, кодирующего эндогенный белок-мишень, на хромосоме на полинуклеотид или маркерный ген, имеющий частичную делецию в последовательности нуклеиновой кислоты, с использованием вектора для вставки в хромосому в бактериальном штамме. В примере воплощения способа делетирования, частично или полностью, гена можно применять способ делетирования гена путем гомологичной рекомбинации, но способ не ограничен этим.
Как его используют здесь, термин "часть" может варьировать в зависимости от типа полинуклеотидов, и в частности он может относиться к 1-300, более конкретно к 1-100 и еще более конкретно к 1-50, но специально не ограничиваясь этим.
Как его используют здесь, термин "гомологичная рекомбинация" относится к генетической рекомбинации, которая происходит путем кроссинговера по локусам генетической цепи, имеющих взаимную гомологию.
Кроме того, еще одно конкретное воплощение настоящего изобретения может относиться к микроорганизму, продуцирующему О-ацетилгомосерин, у которого дополнительно активность гомосерин-ацетилтрансферазы повышена по сравнению с таковой у немодифицированного микроорганизма. В частности, микроорганизм может представлять собой микроорганизм, у которого активность гомосерин-ацетилтрансферазы повышена по сравнению с таковой у немодифицированного микроорганизма, и в частности, может представлять собой микроорганизм, в который введен модифицированный ген metA, кодирующий гомосерин-ацетилтрансферазу с повышенной активностью. Модифицированный ген metA может представлять собой ген, кодирующий последовательность, в которой 111ая аминокислота гомосерин-ацетилтрансферазы заменена на глутаминовую кислоту и 112ая аминокислота гомосерин-ацетилтрансферазы заменена на гистидин, но не ограничиваясь этим. Модифицированный ген metA может включать без ограничения любую аминокислотную последовательность, обладающую повышенной активностью гомосерин-ацетилтрансферазы по сравнению с таковой у его дикого типа, и например, может представлять собой белок, имеющий аминокислотную последовательность SEQ ID NO: 10. Воплощения получения модифицированного гена metA и его использования, штамм, обладающий повышенной активностью гомосерин-ацетилтрансферазы, и так далее раскрыты в патенте Кореи No. 10-1335841, и описание этого патента включено в настоящее описание посредством ссылки во всей своей полноте.
Дополнительно, еще одно конкретное воплощение настоящего изобретения может относиться к микроорганизму, продуцирующему О-ацетилгомосерин, принадлежащему роду Escherichia, у которого дополнительно активность аспартат-полуальдегид-дегидрогеназы, трансгидрогеназы пиридиновых нуклеотидов или их комбинации повышена по сравнению с таковой у немодифицированного микроорганизма.
Дополнительно, еще одно конкретное воплощение настоящего изобретения может относиться к микроорганизму, продуцирующему О-ацетилгомосерин, у которого дополнительно активность фосфоенолпируваткарбоксилазы, аспартатаминотрансферазы или их комбинации повышена по сравнению с таковой у немодифицированного микроорганизма. Как его используют здесь, термин "повышение" относится к повышению уровня активности белка, которым обладает микроорганизм. Повышение активности белка не ограничено при условии, что оно может относиться к повышению активности каждого белка по сравнению с таковой нативного белка дикого типа или немодифицированного белка, как при повышении активности белка-мишени. Повышение может быть выполнено способом, выбранным из группы, состоящей из: 1) способа увеличения числа копий полинуклеотида, кодирующего каждый белок, 2) способа введения модификации в последовательность контроля экспрессии для повышения уровня экспрессии полинуклеотида, 3) способа модификации последовательности полинуклеотида на хромосоме для повышения активности каждого белка и 4) их комбинации. В частности, повышение может быть выполнено способом, выбранным из группы, состоящей из способа вставки полинуклеотида, включающего нуклеотидную последовательность, кодирующую каждый белок, в хромосому, способа введения полинуклеотида в микроорганизм после введения его в векторную систему, способа введения промотора с повышенной активностью в участок выше по ходу транскрипции от нуклеотидной последовательности, кодирующей каждый белок или введения модификации в промотор каждого белка, способа модифицирования нуклеотидной последовательности в участке 5'-UTR (5'-нетранслируемая область) и способа введения модифицированной нуклеотидной последовательности нуклеотидной последовательности, кодирующей каждый белок, но способы повышения не ограничиваются этими.
Еще один аспект настоящего изобретения относится к способу получения О-ацетилгомосерина, включающему культивирование микроорганизма рода Escherichia, продуцирующего О-ацетилгомосерин, в среде.
В частности, вышеупомянутый способ относится к способу получения О-ацетилгомосерина, включающего культивирование микроорганизма рода Escherichia, продуцирующего О-ацетилгомосерин, в среде и выделение О-ацетилгомосерина из культивированного микроорганизма или из культуральной среды.
Как его используют здесь, термин "культура" относится к выращиванию микроорганизма в подобранных подходящим образом условиях окружающей среды. В настоящем изобретении процесс культивирования может быть выполнен в подходящей среде и условиях культивирования, хорошо известных в данной области техники. Специалист средней квалификации в данной области техники может легко отрегулировать процесс культивирования в соответствии с выбранным штаммом. Культура может быть получена в периодическом процессе, при непрерывном культивировании, при культивировании с подпиткой и так далее, как известно в данной области техники, но специально не ограничиваясь этим. Среда и другие условия культивирования, используемые для культивирования микроорганизма по настоящему изобретению, могут быть специально не ограничены, но можно применять любую среду, традиционно используемую для культивирования микроорганизмов рода Escherichia. В частности, микроорганизм по настоящему изобретению можно культивировать в аэробных условиях в обычной среде, содержащей подходящие источники углерода, азота и фосфора, неорганические соединения, аминокислоты и/или витамины и так далее при подведении температуры, рН и так далее.
В настоящем изобретении источники углерода могут включать углеводы, такие как глюкоза, фруктоза, сахароза, мальтоза, маннит, сорбит и так далее; спирты, такие как сахарный спирт, глицерин и так далее; органические кислоты, такие как пировиноградная кислота, молочная кислота, лимонная кислота и так далее; аминокислоты, такие как глутаминовая кислота, метионин, лизин и так далее, но источники углерода не ограничены этим. Дополнительно можно использовать природные органические питательные вещества, такие как гидролизат крахмала, меласса, сырая меласса, рисовые отруби, маниока, тростниково-сахарная багасса, жидкий кукурузный экстракт и так далее. В частности, можно использовать углеводы, такие как глюкоза и стерилизованная предварительно обработанная меласса (то есть меласса, преобразованная в редуцирующий сахар) и так далее, и дополнительно можно использовать различные другие источники углерода в подходящем количестве без ограничения. Эти источники углерода можно использовать по отдельности или в комбинации по меньшей мере из двух типов.
Примеры источников азота могут включать неорганические источники азота (например аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония, нитрат аммония и так далее), аминокислоты (глутаминовую кислоту, метионин, глутамин и так далее) и органические источники азота (например пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыба или продукты ее переработки, обезжиренный соевый жмых или продукты его переработки и так далее). Эти источники азота можно использовать по отдельности или в комбинации по меньшей мере из двух типов, но не ограничиваясь этим.
Примеры источников фосфора могут включать однозамещенный фосфат калия, гидроортофосфат калия и соответствующие им натрийсодержащие соли. Примеры неорганических соединений для использования могут включать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и так далее. Дополнительно, могут быть включены аминокислоты, витамины и/или подходящие предшественники, но не ограничиваясь этим. Эти среды или предшественники могут быть добавлены в культуру в процессе периодического культивирования или в процессе непрерывного культивирования, но не ограничиваясь этим.
В настоящем изобретении во время периода культивирования рН в культуре можно подводить путем добавления в культуру такого соединения как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота, серная кислота и так далее подходящим образом. Дополнительно во время периода культивирования можно добавлять пеногаситель, такой как полигликолевый сложный эфир жирной кислоты, для ингибирования образования пены. Дополнительно, для поддержания аэробного состояния культуры в культуру можно вводить кислород или газ, содержащий кислород, в то время как для поддержания анаэробного или микроаэробного состояния культуры можно вводить азот, водород или углекислый газ без введения воздуха.
Температура культуры обычно может находиться в диапазоне от 27°C до 37°C, и более конкретно, от 30°C до 35°C, но температура культивирования не ограничена этим. Дополнительно, культивирование можно продолжать до тех пор, пока не будет(ут) получено(ы) желаемое(ые) вещество(а), и в частности от 10 часов до 100 часов, но не ограничиваясь этим.
Выделение О-ацетилгомосерина можно выполнять с использованием способа культивирования микроорганизма по настоящему изобретению. Например, целевой О-ацетилгомосерин может быть выделен из культуры с использованием подходящего способа, известного в данной области техники (например, при периодическом культивировании, непрерывном культивировании или периодическом культивировании с подпиткой и так далее). Например, можно использовать такие методы как центрифугирование, фильтрование, анионообменная хроматография, кристаллизация, ВЭЖХ и так далее, и дополнительно можно применять комбинированный метод из подходящих методов, известных в данной области техники.
Процесс выделения может включать процесс фракционирования и/или процесс очистки.
Один аспект настоящего изобретения относится к способу получения L-метионина, который включает культивирование микроорганизма рода Escherichia, продуцирующего О-ацетилгомосерин, в среде и превращение О-ацетилгомосерина в L-метионин путем обработки культивированного микроорганизма, или культуральной среды, или О-ацетилгомосерина, выделенного из культивированного микроорганизма или культуральной среды метилмеркаптаном и метионин-превращающим ферментом.
Например, метионин может быть получен из О-ацетилгомосерина, который выделен из культуры микроорганизма рода Escherichia, продуцирующего О-ацетилгомосерин в среду, путем двухстадийного процесса (патент Кореи No. 10-0905381).
Двухстадийный процесс включает процесс получения L-метионина и органической кислоты путем ферментативной реакции с использованием фермента, обладающего активностью по превращению О-ацетилгомосерина в метионин с использованием О-ацетилгомосерина и метилмеркаптана в качестве субстратов или штамма, содержащего этот фермент.
Метионин-превращающий фермент включает все ферменты, которые превращают О-ацетилгомосерин в метионин, и в частности О-ацетилгомосерин-сульфгидрилазу, но не ограничиваясь этим.
В частности, О-ацетилгомосерин-сульфгидрилаза для применения может представлять собой таковую, полученную из микробных штаммов, принадлежащих роду Leptospira, роду Chromobacterium и роду Hyphomonas, и более конкретно, таковую, полученную из микробных штаммов, принадлежащих видам Leptospira meyeri, Pseudomonas aurogenosa, Hyphomonas neptunium и Chromobacterium violaceum.
Вышеупомянутая реакция показана ниже:
CH3SH + О-ацетил-L-гомосерин <=> ацетат + метионин
Такой дополнительный процесс продуцирования метионина раскрыт в патенте Кореи No. 10-0905381, и описание этого патента может быть включено в настоящее описание во всей своей полноте посредством ссылки.
ПРИМЕРЫ
Здесь и далее настоящее изобретение будет раскрыто более подробно со ссылкой на соответствующие примеры воплощений. Однако раскрытые здесь примеры воплощений предназначены исключительно для иллюстративных целей и не предназначены никаким образом ограничивать объем настоящего изобретения.
Ссылочный пример 1: Получение штаммов, продуцирующих О-ацетилгомосерин
1-1. Делеция гена metB у Е. coli дикого типа
Для получения штаммов, продуцирующих О-ацетилгомосерин, использовали Е. coli, которая представляет собой репрезентативный микроорганизм из микроорганизмов рода Escherichia. Для этой цели Е. coli K12 W3110 (АТСС 27325), Е. coli дикого типа, получали из Американской коллекции типовых культур (АТСС) и использовали. Был получен штамм, который имеет дефекты в гене metB (SEQ ID NO: 6), кодирующем цистатионин-гамма-синтазу, и гене thrB (SEQ ID NO: 8), кодирующем гомосеринкиназу, у штамма Е. coli K12 W3110. Полученный таким образом штамм, продуцирующий О-ацетилгомосерин, получил название W3-BT. Одно воплощение, относящееся к делеции в штаммах с делецией генов metB и thrB, раскрыто в патенте Кореи No. 10-0905381 или публикации международной заявки WO 2008/013432 (см., в частности, Примеры 1-1 и 1-2 патента Кореи No. 10-0905381), и описание этого патента может быть включено в настоящее описание посредством ссылки во всей своей полноте.
1-2. Получение штамма с введенным модифицированным геном metA, обладающим активностью гомосерин-ацетилтрансферазы
Для повышения активности гомосерин-ацетилтрансферазы у штамма, полученного в ссылочном Примере 1-1, была предпринята попытка ввести в этот штамм модифицированный ген metA (SEQ ID NO: 10), кодирующий гомосерин-ацетилтрансферазу, обладающую повышенной активностью. Для получения такого штамма была получена плазмида pCL_Pcj1_metA (EH) способом, описанным в Примерах 1 и 3 патента Кореи No. 10-1335841.
Затем для получения "заменяющей кассеты" как средства для замены полученного выше модифицированного гена metA путем его введения в штамм, проводили ПЦР с использованием вектора pKD3 в качестве матрицы вместе с праймерами SEQ ID NO: 23 и SEQ ID NO: 24. В частности, ПЦР неоднократно выполняли в течение в общей сложности 30 циклов, в которых денатурацию проводили при 94°C в течение 30 секунд, отжиг при 55°C в течение 30 секунд и удлинение цепи при 72°C в течение 2 минут.
Для части metA (EH) "заменяющей кассеты" проводили ПЦР с использованием pCL-Pcj1-metA (EH) в качестве матрицы вместе с праймерами SEQ ID NO: 19 и SEQ ID NO: 20, в то время как для части metA дикого типа использовали праймеры SEQ ID NO: 21 и SEQ ID NO: 22, и таким образом были получены соответствующие ПЦР-продукты. На основе 3 ПЦР-продуктов с использованием праймеров SEQ ID NO: 19 и SEQ ID NO: 22 была получена "заменяющая кассета" metA (EH), содержащая хлорамфениколовый маркер, и ее путем электропорации вводили в штамм W3-BT, который трансформировали вектором pKD46, полученным в ссылочном Примере 1-1.
Штаммы, для которых было подтверждено, что они были трансформированы в описанном выше процессе, снова трансформировали вектором рСР20 и культивировали в среде LB. Штамм, у которого хлорамфениколовый маркер был удален и ген metA был заменен на metA (EH), получил название W3-BTA.
Одно воплощение, относящееся к штамму с повышенной активностью гомосерин-ацетилтрансферазы, и так далее, раскрыто в патенте Кореи No. 10-1335841 или публикации международной заявки WO 2012/087039, и описание этого патента может быть включено в настоящее описание посредством ссылки во всей своей полноте.
1-3. Получение штамма, включающего 2 копии генов рpс, aspC и asd
Для увеличения продуктивности по О-ацетилгомосерину штамма W3-BTA, полученного в ссылочном Примере 1-2, была введена известная стратегия усиления пути биосинтеза. Была поставлена задача получить штаммы, у которых гены, ассоциированные с фосфоенолпируваткарбоксилазой, вовлеченной в биосинтез оксалоацетата из фосфоенолпирувата, аспартатаминотрансферазой, вовлеченной в биосинтез аспартата из оксалоацетата, и аспартат-полуальдегид-дегидрогеназой, вовлеченной в биосинтез гомосерина из β-аспартилфосфата, были амплифицированы до 2 копий, то есть гены ррс, aspC и asd были амплифицированы до 2 копий.
Для получения этих штаммов плазмиды pSG-2ppc, pSG-2aspC и pSG-2asd получали способом, раскрытым в Примерах от 1-1 до 1-3 патента Кореи No. 10-1117012, вышеупомянутые плазмиды вводили в штамм W3-BTA, и штамм, у которого 3 различных гена были последовательно амплифицированы до 2 копий, получали способом, описанным в Примере 1-5 этого патента Кореи. Полученный таким образом штамм получил название W3-BTA2PCD (=WCJM).
Воплощение, относящееся к штамму с повышенной активностью фосфоенолпируваткарбоксилазы, аспартатаминотрансферазы и аспартат-полуальдегид-дегидрогеназы и так далее, раскрыто в патенте Кореи No. 10-0905381 или публикации международной заявки WO 2008/013432, и описание этого патента может быть включено в настоящее описание посредством ссылки во всей своей полноте.
1-4. Эксперимент с культурой в колбе
Чтобы протестировать уровень продуцирования О-ацетилгомосерина в штаммах, полученных в ссылочных Примерах 1-2 и 1-3, получали культуру в колбе Эрленмейера. Штаммы W3110, W3-BTA и WCJM высевали на среду LB и культивировали при 33°C в течение ночи. Отдельные колонии высевали в 3 мл среды LB и инкубировали при 33°C в течение 5 часов, разбавляли в 200 раз в колбе Эрленмейера емкостью 250 мл, содержащей 25 мл среды для продуцирования О-ацетилгомосерина, и снова инкубировали при 33°C при 200 об/мин в течение 30 часов, и уровень продуцирования О-ацетилгомосерина подтверждали анализом ВЭЖХ (высокоэффективная жидкостная хроматография). Состав применяемой среды приведен в Таблице 1 ниже.
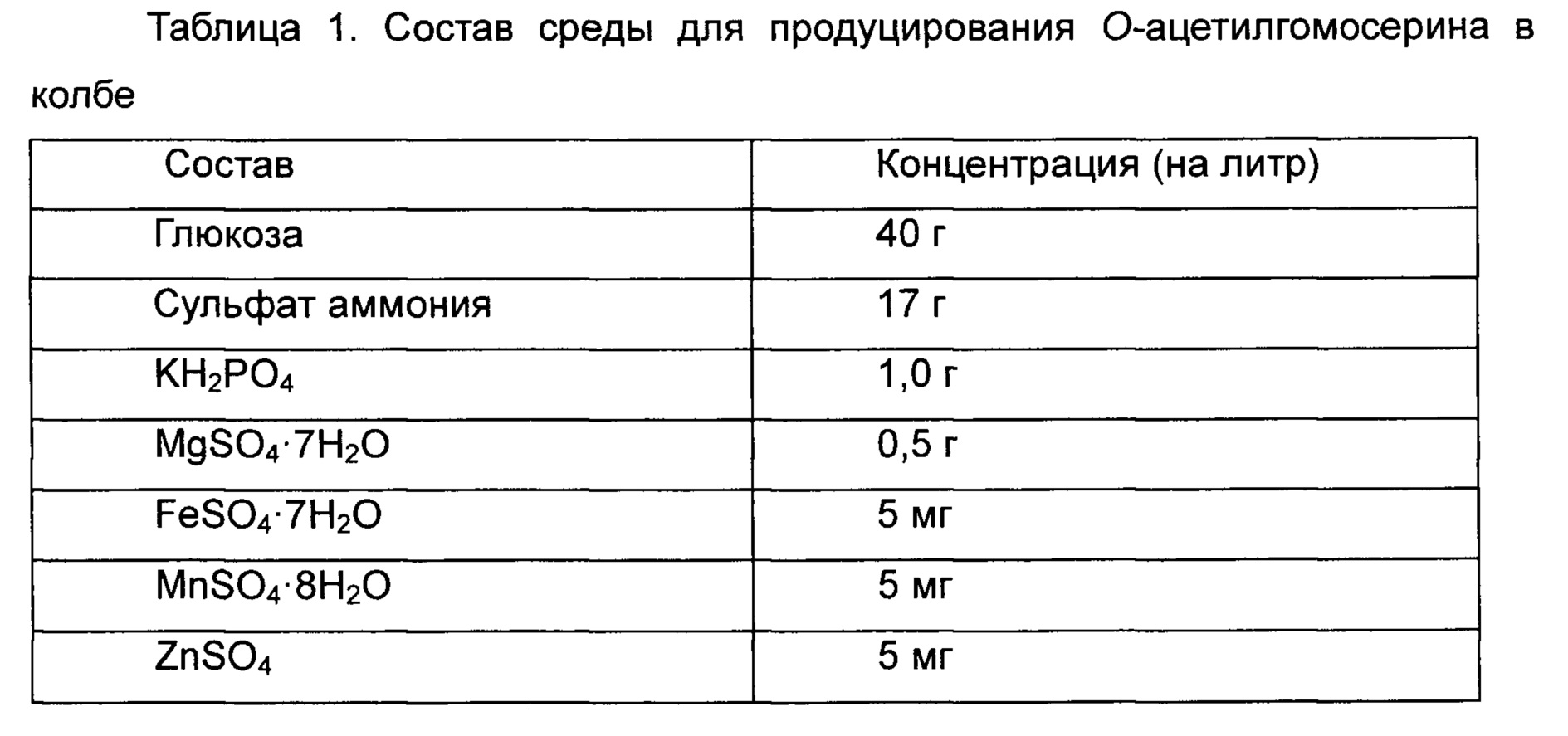

Уровень продуцирования О-ацетилгомосерина подтверждали анализом ВЭЖХ после культивирования в течение 30 часов с использованием вышеописанной среды, и результаты приведены в Таблице 2 ниже.
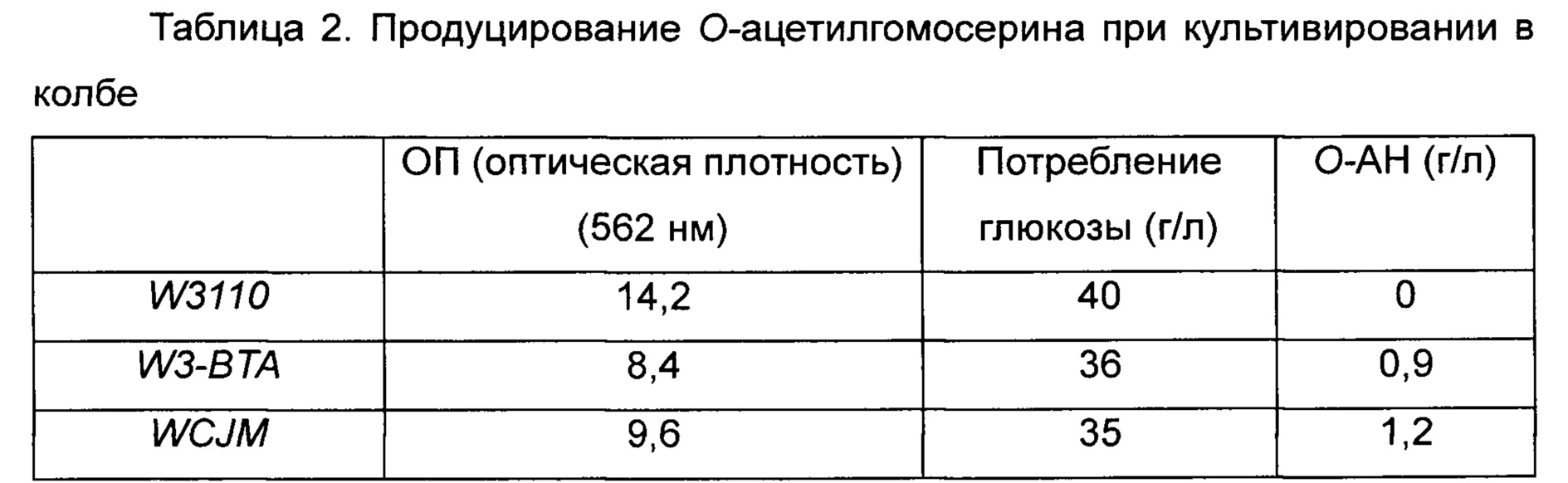
Как видно из Таблицы 2, представленной выше, штамм дикого типа W3110 вообще не продуцировал О-ацетилгомосерин, однако штамм W3-BTA продуцировал О-ацетилгомосерин (О-АН) в концентрации 0,9 г/л, а штамм WCJM с усиленным путем биосинтеза продуцировал О-ацетилгомосерин (О-АН) в концентрации 1,2 г/л.
Пример 1: Выбор мембранных белков, увеличивающих продуктивность по О-ацетилгомосерину
Авторы настоящего изобретения предприняли попытку использовать LeuE (SEQ ID NO: 1), имеющий происхождение из Escherichia coli, который был раскрыт как мембранный белок, но не был раскрыт в отношении связи его активности по высвобождению О-ацетилгомосерина и продуцированию О-ацетилгомосерина с продуцированием О-ацетилгомосерина.
Для усиления гена leuE у данного штамма ген leuE клонировали с использованием сайта рестрикции SmaI вектора pCL.
Во-первых, для получения гена leuE проводили ПЦР в течение в общей сложности 30 циклов с использованием праймеров SEQ ID NO: 11 и 12, в которых проводили денатурацию при 94°C в течение 30 секунд, отжиг при 55°C в течение 30 секунд и удлинение цепи при 68°C в течение 1 минуты. Полученный в результате ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и ДНК очищали из полосы, соответствующей 800 п.н. Очищенную ДНК обрабатывали ферментом рестрикции SmaI при 37°C в течение ночи и после дополнительной очистки ген leuE и вектор pCL клонировали с использованием лигазы Т4. После трансформации Е. coli DH5 с использованием клонированной плазмиды трансформированную Е. coli DH5 отбирали на чашке со средой LB, содержащей спектиномицин (50 мкг/мл) для получения плазмиды. Полученную таким образом плазмиду вводили в штаммы W3-BTA и WCJM, которые представляют собой штаммы, продуцирующие О-ацетилгомосерин. Они получили названия W3-BTA/pCL-leuE и WCJM/pCL-leuE, соответственно, и была выполнена их оценка в колбе на продуктивность по О-ацетилгомосерину.
Дополнительно, для получения контрольных групп пустой вектор pCL1920 вводили в штаммы W3-BTA и WCJM таким же способом, как описано выше, и они получили названия W3-BTA/pCL1920 и WCJM pCL1920, соответственно, и была выполнена их оценка в колбе на продуктивность по О-ацетилгомосерину.
В частности, каждый штамм высевали на твердую среду LB и культивировали в течение ночи в инкубаторе при 33°C. Отдельную колонию штамма, культивированного в течение ночи на чашке со средой LB, высевали в 3 мл среды LB и инкубировали при 33°C в течение 5 часов, разводили в 200 раз в колбе Эрленмейера емкостью 250 мл, содержащей 25 мл среды для продуцирования О-ацетилгомосерина, и снова инкубировали при 33°C при 200 об/мин в течение 30 часов, и уровень продуцирования О-ацетилгомосерина подтверждали путем анализа ВЭЖХ. Результаты приведены в Таблице 3 ниже.
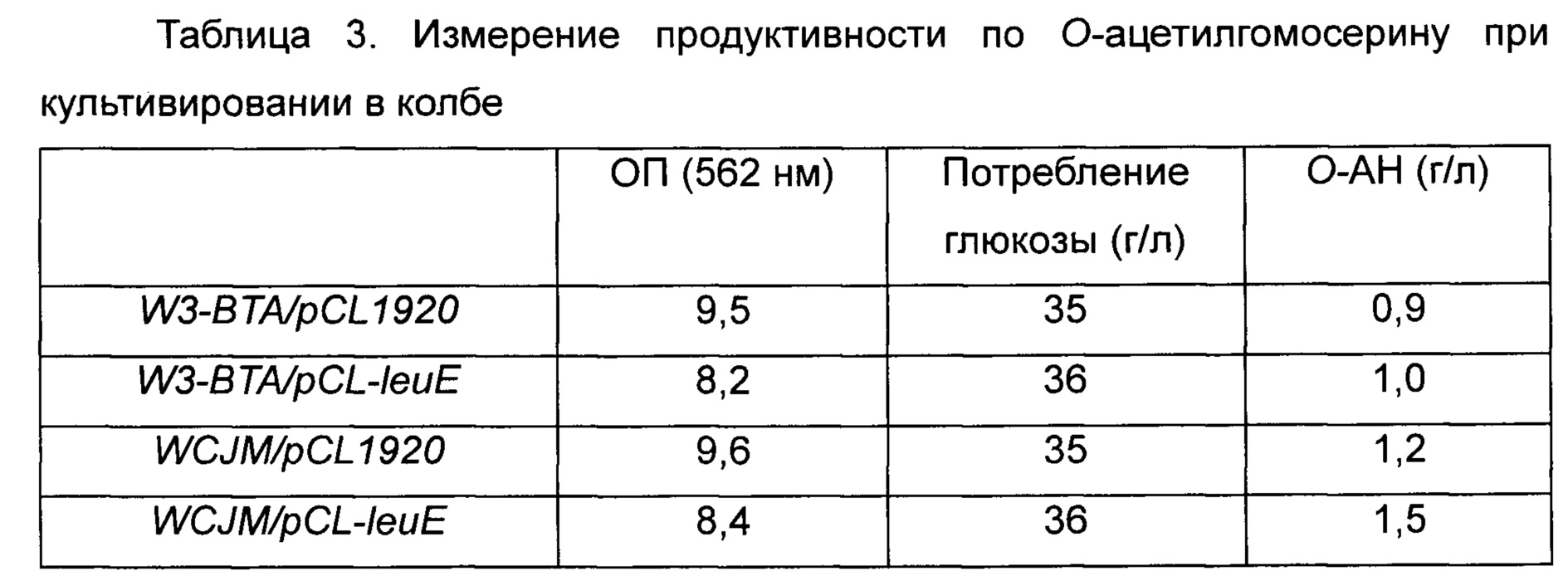
Как видно из Таблицы 3 выше, штамм WCJM с введенной плазмидой leuE демонстрировал более низкую ОП (оптическую плотность) по сравнению с таковой контрольного штамма с введенным пустым вектором, и также штамм WCJM демонстрировал более высокий уровень потребления глюкозы. Однако штамм WCJM продуцировал О-ацетилгомосерин в концентрации 1,5 г/л, и это не могло служить подтверждением того, что увеличение продуцирования О-ацетилгомосерина произошло вследствие введения leuE дикого типа. Тем не менее, результаты, демонстрирующие способность контролировать ОП и увеличение скорости потребления глюкозы, подтвердили потенциальную высвобождающую активность штамма. Соответственно, была предпринята попытка выбрать модифицированные штаммы, обладающие повышенной активностью по высвобождению О-ацетилгомосерина по сравнению с таковой у штамма дикого типа, путем структурного моделирования.
Пример 2: Получение плазмиды с модификацией стартового кодона leuE и оценка продуктивности по О-ацетилгомосерину
Известно, что стартовый кодон leuE дикого типа представляет собой gtg, который кодирует аминокислоту валин. Для подтверждения усиленного действия белка leuE при изменении стартового кодона на atg (то есть, метионин-кодирующий кодон), был проведен эксперимент по изменению стартового кодона на основе плазмиды, полученной в Примере 1. Более конкретно, первую аминокислоту аминокислотной последовательности SEQ ID NO: 1 заменяли на метионин для повышения активности по высвобождению О-ацетилгомосерина. Еще более конкретно, была получена модификация leuE(ATG). Для получения модификации leuE(ATG) использовали праймеры SEQ ID NO: 145 и SEQ ID NO: 146, и модифицированный ген leuE(ATG) получали путем сайт-специфического мутагенеза (набор для сайт-направленного мутагенеза, Stratagene, USA). Существующая плазмида дикого типа получила название WT, а плазмида с вариантом инициирующего кодона получила название WT_ATG, полученную таким образом плазмиду вводили в штамм WCJM и выполняли его оценку в колбе на продуктивность по О-ацетилгомосерину.
Более конкретно, каждый штамм высевали на твердую среду LB и культивировали в течение ночи в инкубаторе при 33°C. Штамм, культивированный в течение ночи на чашке со средой LB, высевали в 25 мл среды для титрования и инкубировали при 33°C при 200 об/мин в течение 40 часов. Результаты приведены в Таблице 4 ниже.

Как видно из Таблицы 4 выше, штамм с введенной плазмидой pCL-leuE WT(ATG), имеющей модификацию стартового кодона, демонстрировал более низкую ОП по сравнению с таковой у штамма дикого типа, но демонстрировал более быстрое потребление глюкозы. Штамм с введенной плазмидой pCL-leuE WT(ATG), имеющей модификацию стартового кодона, продуцировал О-ацетилгомосерин в концентрации 2,6 г/л, что представляет собой увеличение продуктивности на 173% по сравнению с таковой у штамма дикого типа.
Пример 3: Получение leuE-модифицированной плазмиды и оценка продуктивности по О-ацетилгомосерину
3-1. Получение leuЕ-модифицированной плазмиды
Были проведены эксперименты по получению каждого из трех модифицированных полипептидов, которые, как полагают, обладают более сильной высвобождающей активностью по сравнению с таковой leuE дикого типа, на основе двух типов плазмид, а именно плазмиды pCL-leuE WT и pCL-leuE WT(ATG), полученных в Примерах 1 и 2. В частности, положения модификации leuE были выбраны путем структурного моделирования для повышения активности по высвобождению О-ацетилгомосерина, и аминокислоты в положениях 30, 95 и 165 в аминокислотных последовательностях SEQ ID NO: 1 и 2 были заменены на другие аминокислоты, соответственно.
Более конкретно, были выполнены модификации L95V, F30A и F165A. Для получения модификации L95V использовали праймеры SEQ ID NO: 13 и 14; для модификации F30A использовали праймеры SEQ ID NO: 25 и 26; и для модификации F165A использовали праймеры SEQ ID NO: 27 и 28. Модифицированные гены leuE получали с использованием набора для сайт-направленного мутагенеза (Stratagene, USA) наряду с каждым из набора праймеров, описанных выше. На основе существующей плазмиды дикого типа WT, модифицированная плазмида L95V получила название WT_M3; модифицированная плазмида F30A получила название WT_M4 и модифицированная плазмида F165A получила название WT_M6, соответственно. Дополнительно, на основе плазмиды с модификацией стартового кодона (то есть, WT(ATG)) модифицированная плазмида L95V получила название WT(ATG)_M3, модифицированная плазмида F30A получила название WT(ATG)_M4 и модифицированная плазмида F165A получила название WT(ATG)_M6, соответственно. Полученные таким образом плазмиды вводили в штамм WCJM для оценки продуктивности по О-ацетилгомосерину в колбе.
Более конкретно, каждый штамм высевали на чашку со средой LB и культивировали в инкубаторе при 33°C в течение ночи. Штамм, культивированный в течение ночи на твердой среде LB, инокулировали в 25 мл среды для титрования и затем культивировали в инкубаторе при 33°C при 200 об/мин в течение 40 часов. Результаты показаны в Таблице 5 ниже.
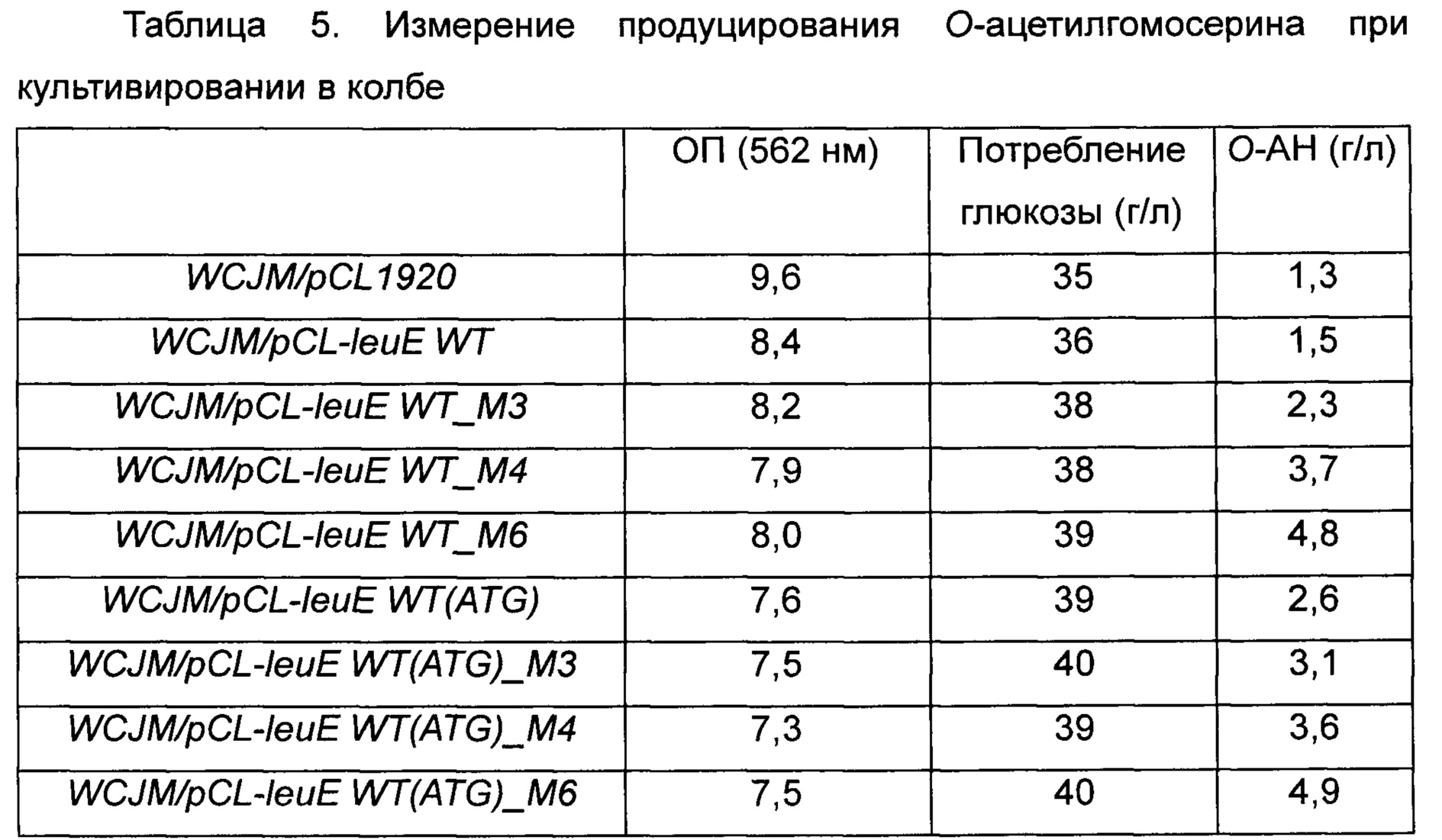
Как видно из Таблицы 5 выше, все 3 штамма с введенной leuE-модифицированной плазмидой демонстрировали снижение ОП по сравнению с таковой у дикого типа, но все 3 штамма демонстрировали более быстрое потребление глюкозы по сравнению с таковым у штамма дикого типа, и в частности, было показано, что штамм WT(ATG)_M6 продуцирует О-ацетилгомосерин в концентрации 4,9 г/л, тем самым демонстрируя самую высокую продуктивность по О-ацетилгомосерину. Соответственно, было подтверждено, что все 3 модифицированных штамма по настоящему изобретению проявляют повышенную продуктивность по О-ацетилгомосерину. Дополнительно, было подтверждено, что когда уровень экспрессии белка был повышен путем модификации стартового кодона leuE, продуктивность по О-ацетилгомосерину дополнительно увеличивалась.
3-2. Получение генов пути биосинтеза и модифицированных плазмид
Для максимального увеличения продуктивности по О-ацетилгомосерину была получена плазмида, способная усиливать путь биосинтеза гомосерина. Для клонирования аспартат-полуальдегид-дегидрогеназы, трансгидрогеназы пиридиновых нуклеотидов и LeuE дикого типа и модифицированного LeuE в векторе pCL сначала в вектор pCL вводили гены asd и pntAB.
Прежде всего при получении генов asd и pntAB проводили ПЦР в течение в общей сложности 30 циклов, в которых проводили денатурацию при 94°C в течение 30 секунд, отжиг при 55°C в течение 30 секунд и удлинение цепи при 68°C в течение 3 минут с использованием праймеров SEQ ID NO: 15 и 16 для гена asd и праймеров SEQ ID NO: 17 и 18 для гена pntAB. Полученные в результате ПЦР-продукты подвергали электрофорезу в 1,0% агарозном геле и очищали ДНК, полученную, соответственно, из полос, соответствующих размерам 1,4 т.н. (asd) и 3 т.н. (pntAB).
Два очищенных гена лигировали с использованием "сшивающей" ПЦР (методика, в которой перекрывающиеся части двух генов сначала лигируют без использования какого-либо праймера и затем амплифицируют с использованием праймеров на обоих концах). Условия для "сшивающей ПЦР" состояли в проведении ПЦР как описано выше в течение 10 циклов и затем в проведении ПЦР в течение 20 циклов после добавления праймеров SEQ ID NO: 15 и 18. В результате получили комбинированные фрагменты генов asd-pntAB, и их очищали путем электрофореза. Очищенные фрагменты и вектор pCL обрабатывали SmaI при 37°C в течение ночи, дополнительно очищали и плазмиду pCL-asd-pntAB получали с использованием лигазы T4.
Ген leuE клонировали в полученную таким образом плазмиду. При клонировании, в частности для получения гена leuE, проводили ПЦР в течение в общей сложности 30 циклов, в которых проводили денатурацию при 94°C в течение 30 секунд, отжиг при 55°C в течение 30 секунд и удлинение цепи при 68°C в течение 1 минуты с использованием праймеров SEQ ID NO: 29 и 30.
Полученный в результате ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и очищали ДНК, полученную из полосы, соответствующей 800 п.н. Очищенную ДНК и вектор pCL обрабатывали KpnI при 37°C в течение ночи, очищали дополнительно и ген leuE и вектор pCL-asd-pntAB клонировали. Клонированными плазмидами трансформировали Е. coli DH5α, и трансформированные Е. coli DH5α отбирали на чашке со средой LB, содержащей спектиномицин (50 мкг/мл), и из них выделяли плазмиды. Полученные таким образом плазмиды вводили в штамм WCJM, который представляет собой штамм, продуцирующий О-ацетилгомосерин, и выполняли его оценку в колбе на продуктивность по О-ацетилгомосерину. Всего таким образом было получено 4 типа плазмид, и использовали штамм дикого типа и 3 модифицированных штамма, полученных в Примере 2-1. Плазмиды 4 типов вводили в штамм WCJM путем электропорации и проводили оценку в колбе таким же образом как в Примере 3-1. Результаты показаны в Таблице 6-1 ниже.
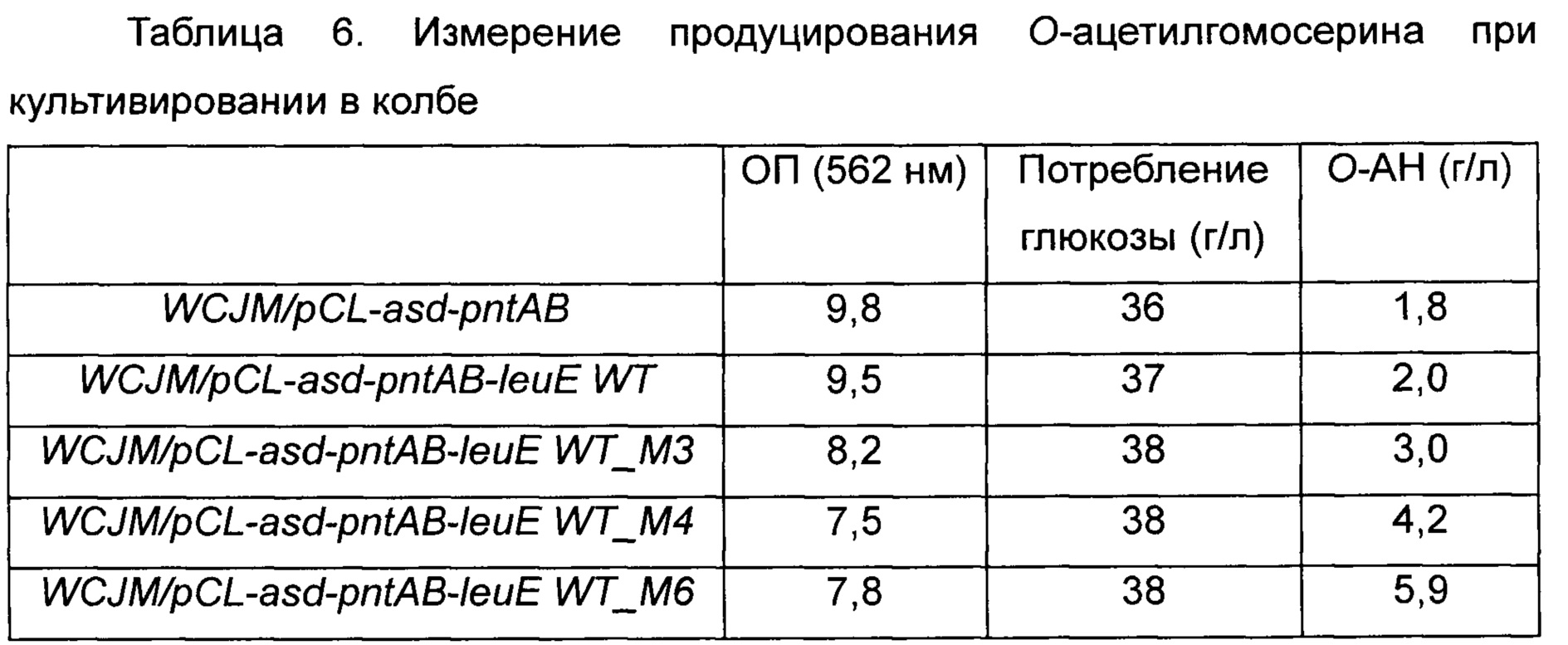
Как видно из Таблицы 6 выше, в результате одновременного усиления пути биосинтеза и модификации leuE продуктивность по О-ацетилгомосерину дополнительно повышалась. В частности, в случае штамма, которому была введена плазмида pCL-asd-pntAB-leuE WT_M6, ОП была понижена по сравнению с таковой у штамма дикого типа, но штамм демонстрировал более быстрое потребление глюкозы и продуцировал О-ацетилгомосерин в концентрации 5,9 г/л, самой высокой среди этих штаммов.
Пример 4: Получение модификации leuE путем насыщающего мутагенеза и оценка продуктивности по О-ацетилгомосерину
4-1. Получение штаммов с модификацией leuE путем насыщающего мутагенеза и их оценка
Были выполнены модификации путем насыщающего мутагенеза для получения различных типов аминокислотных замен 3 вариантов leuE, которые показали высокую продуктивность по О-ацетилгомосерину. Замены аминокислот были получены с использованием 17 типов мутаций М3, мутаций М4 и мутаций М6, соответственно, используя плазмиды, полученные в Примере 2, в качестве матрицы. Подробное описание представлено в Таблице 7 ниже.
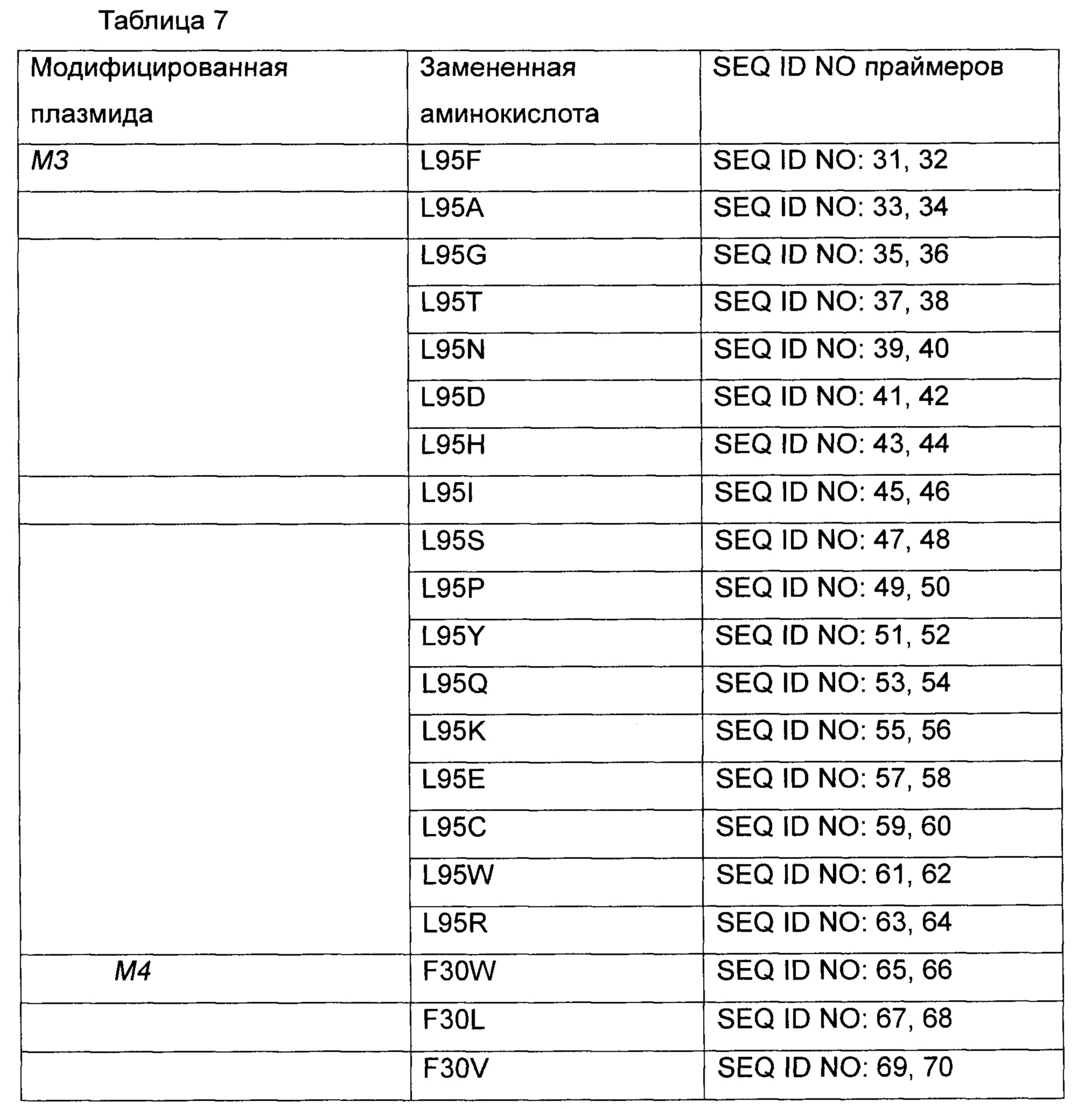
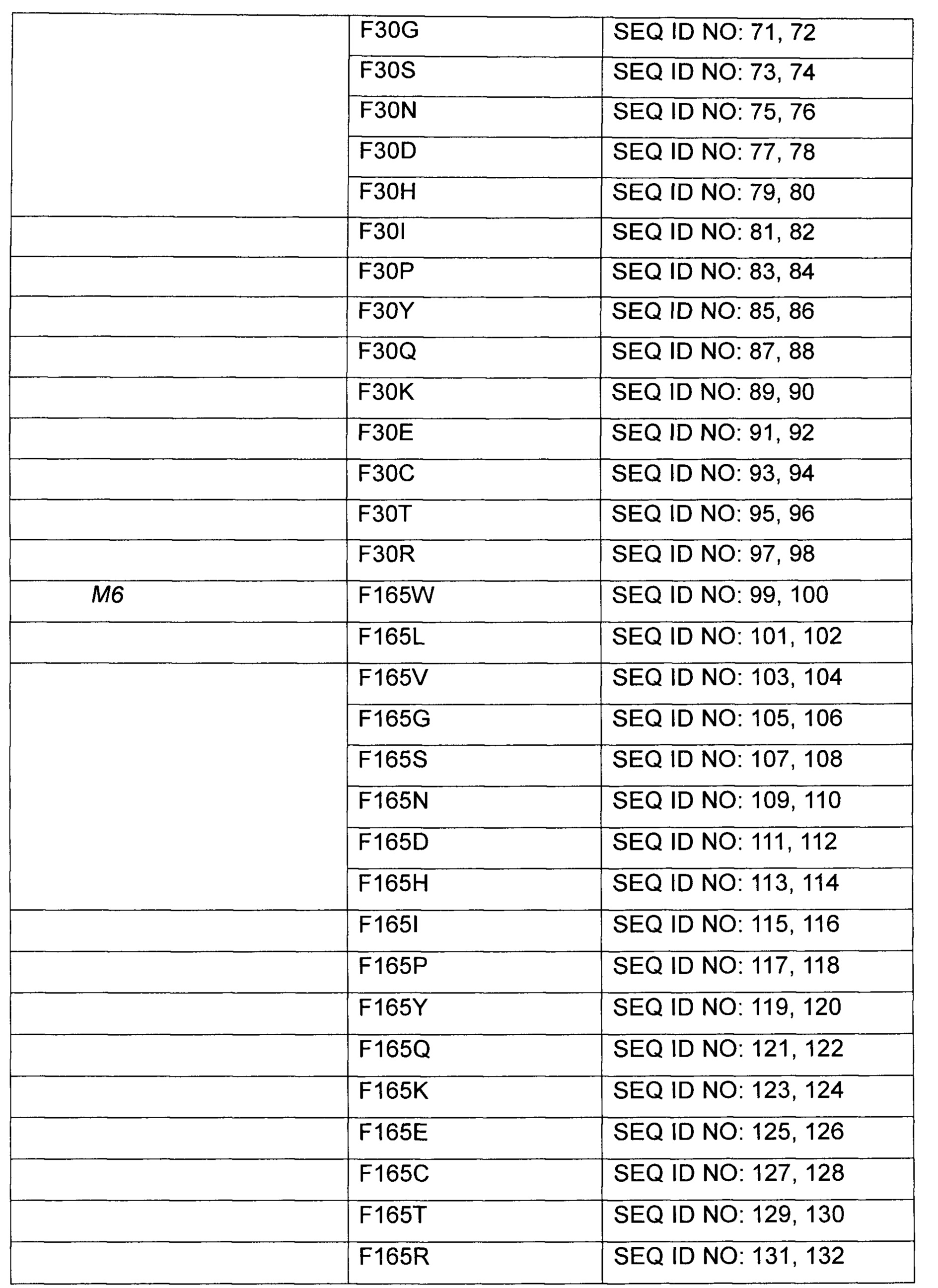
Более конкретно, leuE-модифицированные гены были получены путем использования набора для сайт-направленного мутагенеза (Stratagene, USA) с использованием праймеров, показанных в Таблице 7 выше. Плазмиду вводили в штамм WCJM и колбу подвергали оценке так же как в Примере 3-1. Результаты показаны в Таблице 8 ниже.
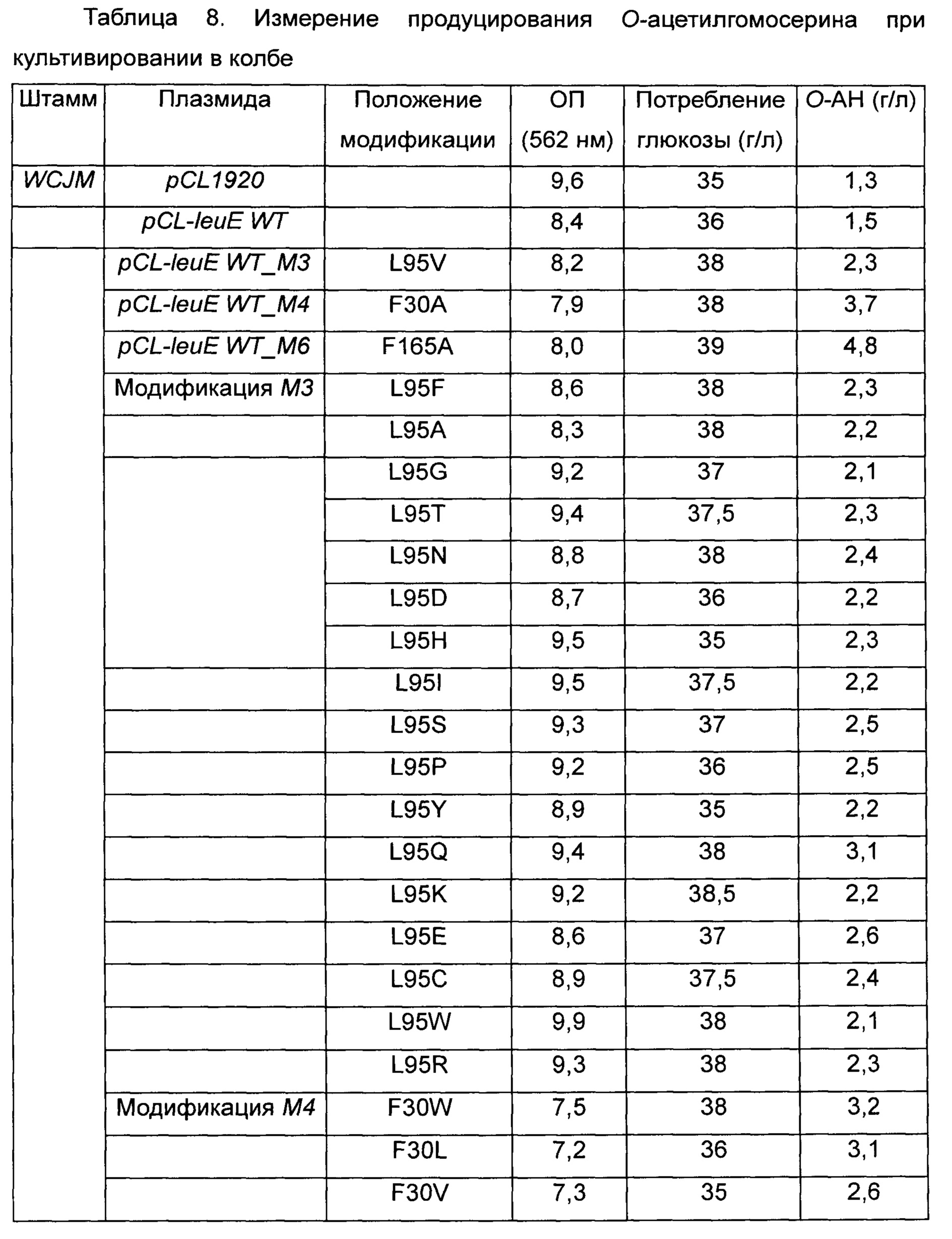
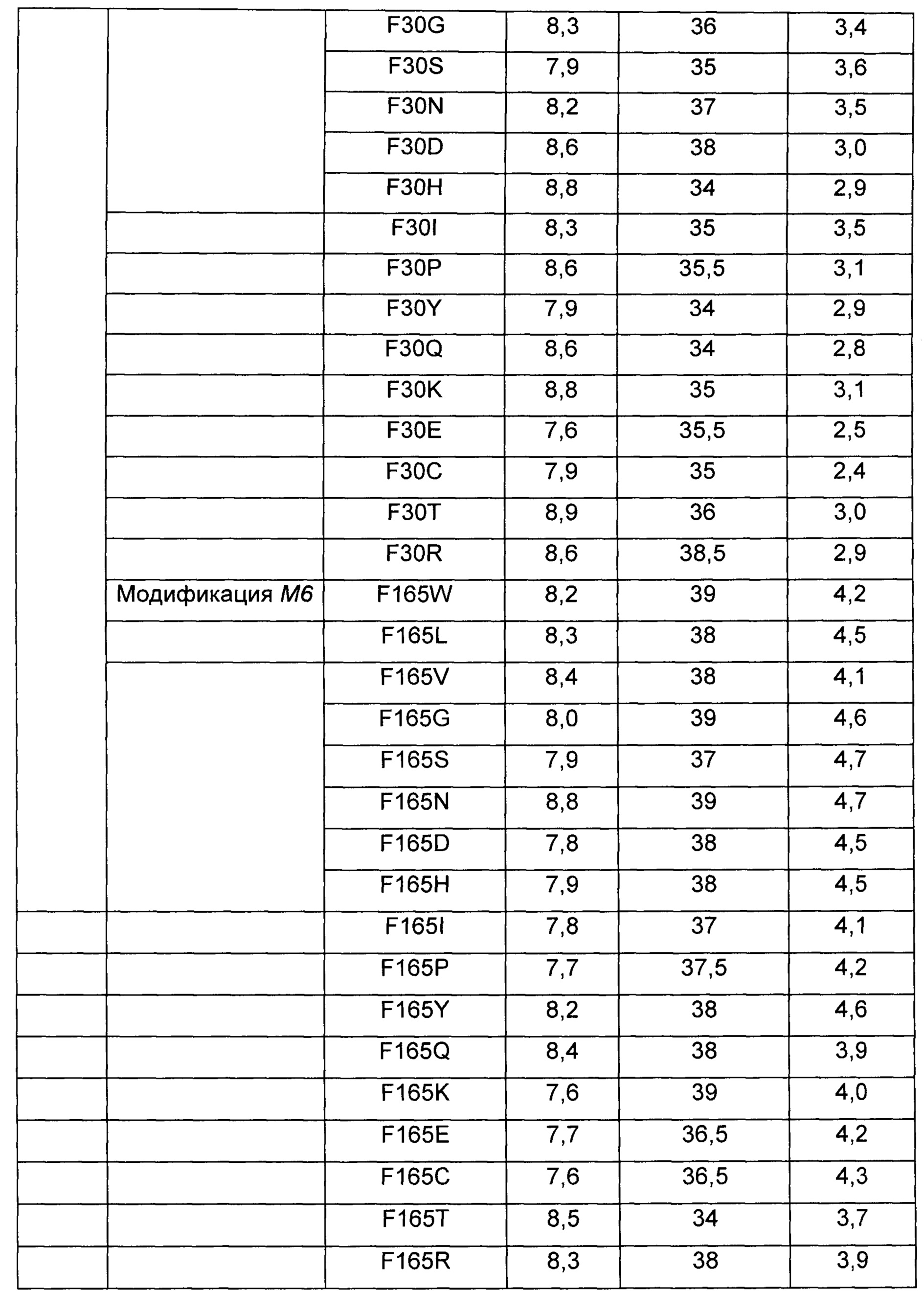
Как видно из Таблицы 8 выше, в результате оценки каждого из модифицированных штаммов наблюдалось небольшое различие в ОП и скорости потребления глюкозы. Однако было обнаружено, что все из вышеперечисленных модифицированных штаммов имеют повышенный уровень продуцирования О-ацетилгомосерина по сравнению со штаммами WCJM/pCL1920 и WCJM/pCL-leuE WT, используемыми в качестве контрольной группы.
4-2. Получение штамма с улучшенной модификацией leuE у штамма с высоким выходом О-ацетилгомосерина и оценка его продуктивности по О-ацетилгомосерину
Способ получения штамма, способного продуцировать О-ацетилгомосерин, путем использования штамма, способного продуцировать треонин благодаря мутации NTG, имеющего происхождение от W3110 дикого типа, раскрыт (публикация международной заявки No. WO 2012/087039). В частности, полученный таким образом штамм, продуцирующий О-ацетилгомосерин с высоким выходом, был депонирован в Корейском центре культур микроорганизмов (KССМ) с номером доступа KССМ11146Р.
Была предпринята попытка выяснить, можно ли дополнительно повысить продуктивность по О-ацетилгомосерину путем введения гена leuE и его модифицированных вариантов на основе вышеупомянутого штамма.
Более конкретно, ген leuE и 3 его модифицированных варианта вводили путем электропорации. Штаммы с введенным геном получили названия KCCM11146P/pCL1920, KCCM11146P/pCL-leuE WT, KCCM11146P/pCL-leuE M3, KCCM11146P/pCL-leuE M4 и KCCM11146P/pCL-leuE М6, соответственно. Для измерения продуктивности по О-ацетилгомосерину гена leuE и 3 его модифицированных вариантов была выполнена оценка культуры в колбе. Более конкретно, в среду LB вводили 4 типа вышеупомянутых штаммов и инкубировали в течение ночи при 33°C. Затем отдельные колонии вводили в 3 мл среды LB и снова культивировали при 33°C в течение 5 часов, разводили в 200 раз в колбе Эрленмейера емкостью 250 мл, содержащей 25 мл среды для продуцирования О-ацетилгомосерина, и снова инкубировали при 33°C при 200 об/мин в течение 30 часов и уровень продуцирования О-ацетилгомосерина подтверждали анализом ВЭЖХ. Результаты эксперимента приведены в Таблице 9 ниже.
Таблица 9. Измерение продуцирования О-ацетилгомосерина при культивировании в колбе
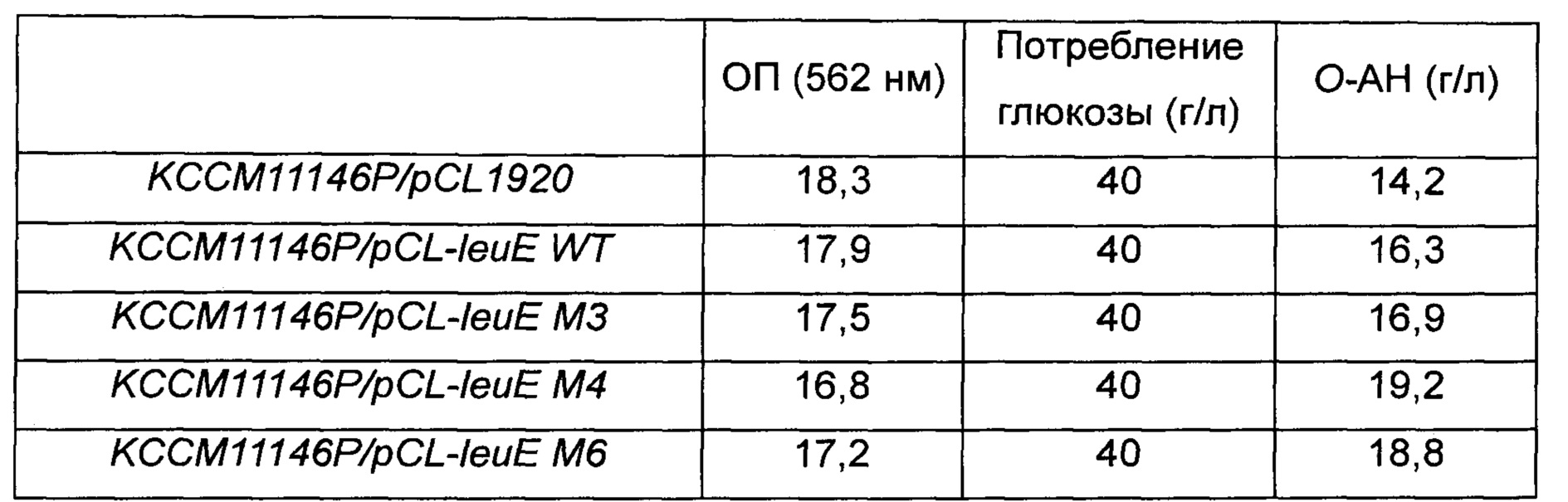
Как видно из Таблицы 9 выше, было подтверждено, что штамм, полученный путем введения только pCL1920 в штамм KССМ11146Р, продуцировал 14,2 г/л О-ацетилгомосерина, и штамм leuE WT также демонстрировал увеличение уровня продуцирования О-ацетилгомосерина по сравнению с исходным штаммом. Дополнительно, все три модифицированных штамма продемонстрировали снижение ОП, в то время как штамм М4 продемонстрировал самый высокий выход в продуцировании О-ацетилгомосерина (19,2 г/л). Штаммы М4 и М6 продемонстрировали повышение уровня продуцирования О-ацетилгомосерина.
Авторы настоящего изобретения подтвердили, что продуцирование О-ацетилгомосерина повышалось у "штаммов KCCM11146P/pCL-leuE М3, М4 и М6", которые представляют собой 3 lеuЕ-модифицированных штамма М3, М4 и М6 на основе штамма KССМ11146Р. В результате авторы изобретения дали штаммам названия "СА05-4009", "СА05-4010" и "СА05-4011", и они были депонированы в KССМ 15 декабря 2014 года с номерами доступа KССМ11645Р, KССМ11646Р и KССМ11647Р, соответственно.
Пример 5: Получение L-метионина с использованием полученного культурального раствора О-ацетилгомосерина и трансферазы
Был проведен эксперимент по получению L-метионина путем использования культурального раствора О-ацетилгомосерина, полученного в Примере 4, и О-ацетилгомосерин-сульфгидрилазы, которая представляет собой фермент, превращающий О-ацетилгомосерин в метионин.
О-ацетилгомосерин-сульфгидрилазу, превращающий фермент, получали способом, предложенном в Примере 1-2 патента Кореи No. 10-1250651, и измеряли количество L-метионина, продуцированного путем реакции превращения с использованием способа, предложенного в Примере 3 патента Кореи No. 10-1250651. Для О-ацетилгомосерина, используемого в качестве субстрата, использовали культуральный раствор KCCM11146P-pCL-leuE М4 (концентрация О-АН; 19,2 г/л), полученный в Примере 4 настоящего описания, и концентрация полученного из него L-метионина представлена в Таблице 10 ниже.
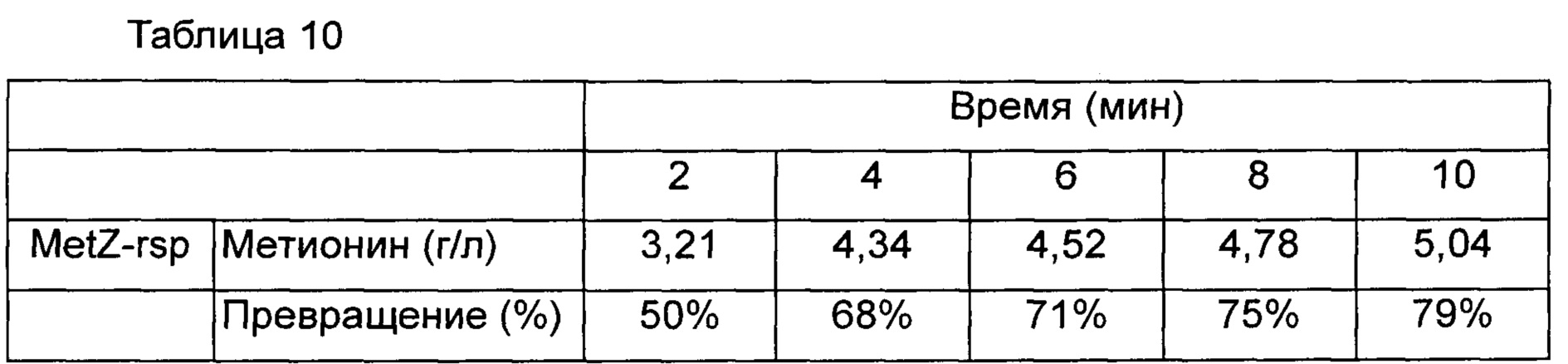
Как видно из Таблицы 10 выше, было подтверждено, что О-ацетилгомосерин, содержащийся в культуральном растворе штамма KCCM11146P-pCL-leuE М4, полученного в Примере 4, превращался в метионин со степенью превращения 79% за 10 минут. Эти результаты подтверждают, что метионин может быть успешно продуцирован с использованием штамма по настоящему изобретению.
На основании вышеизложенного специалист в области техники, к которой принадлежит данное изобретение, понимает, что настоящее изобретение может быть воплощено в других конкретных формах без отступления от технических идей или существенных признаков настоящего изобретения. В этом отношении примеры воплощений, раскрытые здесь, служат исключительно для иллюстративных целей и не предназначены ограничивать объем настоящего изобретения. С другой стороны, настоящее изобретение предназначено охватывать не только примеры воплощений, но также различные варианты, модификации, эквиваленты и другие воплощения, которые могут быть включены в идею и объем настоящего изобретения как определено в прилагаемой формуле изобретения.

