Результат интеллектуальной деятельности: Микроорганизм рода Escherichia, продуцирующий L-триптофан, и способ получения L-триптофана с его использованием
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к модифицированному микроорганизму рода Escherichia, продуцирующему L-триптофан, где активность фосфатазы инактивирована, и к способу получения L-триптофана с использованием микроорганизма рода Escherichia.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
L-триптофан, являющийся незаменимой аминокислотой, широко применяется в качестве кормовой добавки, основного вещества для лекарственных средств, таких как трансфузионные агенты и так далее, и в качестве основного вещества для функциональных пищевых продуктов для оздоровления (health functional foods) и так далее. Несмотря на то, что L-триптофан может быть получен химическим синтезом, ферментативной реакцией, ферментационными способами и так далее, в настоящее время L-триптофан получают преимущественно прямой ферментацией с использованием микроорганизмов. На ранних стадиях разработку штаммов, продуцирующих L-триптофан, проводили посредством мутационной селекции (публикация заявки на патент Кореи №1987-0001813). По мере развития генной инженерии разработку штаммов, продуцирующих триптофан, начали проводить способом, позволяющим преодолеть ингибирование ферментов биосинтетических путей триптофаном по механизму обратной связи посредством усиления ферментативного синтеза в метаболических процессах, как при усилении экспрессии ферментов биосинтеза триптофана. Тем не менее, все еще существует потребность в разработке штаммов, продуцирующих триптофан, которые обеспечивают высокоэффективное получение триптофана для использования в промышленности.
В частности, известно, что триптофансинтаза (ЕС 4.2.1.20), принимающая участие в последних реакционных стадиях при биосинтезе триптофана микроорганизмами, использует пиридоксальфосфат (PLP) в качестве кофермента. Кроме того, в случае серина, используемого в качестве субстрата триптофансинтазной реакции, фосфогидрокситреонинаминотрансфераза (ЕС 2.6.1.52), кодируемая геном serC, использует PLP в качестве кофермента, и поэтому PLP считают важным коферментом для биосинтеза триптофана.
Таким образом, ожидают, что поддержание подходящей концентрации PLP будет играть важную роль в эффективных реакциях для соответствующих ферментов и биосинтетических реакциях для получения требуемых продуктов. Тем не менее, коферменты участвуют в различных реакциях помимо синтеза триптофана, и по этой причине способ надлежащего поддержания уровня PLP пока не открыт.Кроме того, до сих пор не выяснено, может ли поддержание уровня PLP у микроорганизмов, продуцирующих триптофан, приводить к повышению продуктивности L-триптофана.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ Техническая проблема
Авторы настоящего изобретения приложили значительные усилия для разработки высокоэффективного способа получения L-триптофана. Они инактивировали активность белка, представленного аминокислотной последовательностью SEQ ID NO: 1, кодируемого геном yigL, функция которого на данный момент неясна, для повышения продуктивности триптофана посредством ингибирования распада PLP, являющегося коферментом, и поддержания надлежащей внутриклеточной концентрации PLP. В результате они подтвердили, что продуктивность L-триптофана была улучшена, тем самым завершив настоящее изобретение.
Техническое решение
Задачей настоящего изобретения является обеспечение микроорганизма рода Escherichia, продуцирующего L-триптофан.
Другой задачей настоящего изобретения является обеспечение способа получения L-триптофана с использованием микроорганизмов, продуцирующих L-триптофан.
Полезные эффекты
Согласно настоящему изобретению предложен модифицированный микроорганизм рода Escherichia, продуцирующий L-триптофан, где активность фосфатазы, представленной аминокислотной последовательностью SEQ ID NO: 1, инактивирована. Настоящее изобретение демонстрирует эффекты эффективного и экономичного получения L-триптофана, приводящие к более высокому выходу, с использованием микроорганизмов рода Escherichia. L-триптофан, полученный, как описано выше, может быть использован не только в кормах для животных или кормовых добавках, но также в различных продуктах, таких как продукты питания или пищевые добавки для человека, лекарственные средства и так далее.
НАИЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Для выполнения указанных выше задач в одном аспекте предложен модифицированный микроорганизм рода Escherichia, продуцирующий L-триптофан, где активность фосфатазы, представленной аминокислотной последовательностью SEQ ID NO: 1, инактивирована. Например, модифицированный микроорганизм рода Escherichia, продуцирующий L-триптофан, может представлять собой микроорганизм, продуктивность триптофана которого повышена, по сравнению с немодифицированными микроорганизмами рода Escherichia.
При использовании в настоящем описании термин «L-триптофан», относящийся к α-аминокислоте, представляет собой незаменимую аминокислоту, не синтезируемую in vivo и являющуюся L-аминокислотой с химической формулой C11H12N2O2. Для повышения продуктивности L-триптофана в микроорганизмах ранее применялись способы, включающие усиление экспрессии биосинтетических ферментов метаболических путей синтеза триптофана и блокаду путей метаболизма боковой цепи.
При использовании в настоящем описании термин «фосфатаза» может относиться к белку, катализирующему реакции удаления фосфатных групп из субстратов. В настоящем изобретении предполагают, что «фосфатаза, содержащая аминокислоты SEQ ID NO:1», представляющая собой белок, кодируемый геном yigL, катализирует реакции распада PLP, являющегося субстратом, до пиридоксаля и фосфорной кислоты. Поскольку в базе данных NCBI (http://www.ncbi.nlm.nih.gov) белок, кодируемый yigL, назван пиридоксальфосфатфосфатазой (идентификатор гена в NCBI: 12930615), а в базе данных ЕсоСус (http://www.ecocyc.org) он назван фосфатазой фосфосахаров, неизвестно, какая из этих функций является основной функцией данного белка. Согласно недавним исследованиям, сообщалось, что экспрессия yigL индуцируется тепловым шоком (J. Gen. Appl. Microbiol., (2005) V 51, pp. 93-103), и есть результаты исследований, согласно которым трансляцию yigL активирует sgrS, являющийся разновидностью sRNA, что приводит к распаду внутриклеточных фосфосахаров (J. Bacterid. (2013) V 195, pp. 4804-4815). Тем не менее, четкие функции все еще требуют уточнения.
Как таковые, ферменты представляют собой, помимо аминокислотной последовательности, представленной SEQ ID NO: 1, аминокислоты, на 70% или более, конкретно на 80% или более, конкретнее на 90% или более, еще конкретнее на 95% или более, еще конкретнее на 98% или более и еще конкретнее на 99% или более гомологичные указанным выше последовательностям, и ферменты могут быть включены, без ограничений, при условии, что они оказывают эффект, по существу идентичный или соответствующий эффекту указанных выше ферментов. Кроме того, в случае аминокислотных последовательностей, имеющих указанную выше гомологию и демонстрирующих эффект, соответствующий указанному ферменту, очевидно, что объем настоящего изобретения включает любой модифицированный фермент, имеющий аминокислотную последовательность с частичной(ым) делецией, модификацией, заменой или добавлением.
Гены, кодирующие фосфатазу, представленную SEQ ID NO: 1, могут быть включены, без ограничений, при условии, что они представляют собой последовательности, которые могут кодировать ферменты, и они могут быть обозначены как ген yigL. Конкретно, гены, кодирующие ферменты, представляют собой, помимо нуклеотидных последовательностей, представленных SEQ ID NO: 2, нуклеотидные последовательности, на 80% или более, конкретно на 90% или более, конкретнее на 95% или более, еще конкретнее на 98% или более и еще конкретнее на 99% или более гомологичные указанным выше последовательностям. Последовательности генов могут быть включены без ограничений при условии, что они кодируют ферменты, оказывающие эффект, по существу идентичный или соответствующий эффекту указанных выше ферментов. Кроме того, в случае нуклеотидных последовательностей, имеющих указанную выше гомологию, очевидно, что объем настоящего изобретения включает нуклеотидные последовательности с частичной(ым) делецией, модификацией, заменой или добавлением.
При использовании в настоящем описании термин «гомология» относится к проценту идентичности двух полинуклеотидных или полипептидных группировок. Гомология последовательностей одной группировки другой группировке может быть определена методикой, известной в данной области техники. Например, гомология может быть определена непосредственной систематизацией информации о последовательностях (то есть таких параметров, как балльная оценка, идентичность, сходство и так далее) двух полинуклеотидных молекул или двух полипептидных молекул с применением легкодоступной компьютерной программы (пример: BLAST 2.0), позволяющей систематизировать информацию о последовательностях. Кроме того, гомология полинуклеотидов может быть определена посредством гибридизации полинуклеотидов в условиях, при которых между гомологичными областями образуются стабильные двойные цепи, и разъединением нуклеазой, специфичной в отношении одиночных цепей, с последующим определением размера разъединенных фрагментов.
При использовании в настоящем описании термин «эндогенная активность» относится к активному состоянию фермента, присутствующего у микроорганизма, в естественном состоянии или до модификации.
Термин «инактивация» относится к случаю, когда ген, кодирующий фермент, не экспрессирован вовсе, по сравнению с штаммом в естественном состоянии или до модификации, и/или к случаю, когда активность фермента снижена или отсутствует, даже при экспрессии гена.
Таким образом, применительно к эндогенной активности инактивация относится к снижению или отсутствию активности, по сравнению с активностью фермента, исходно присутствующего у микроорганизма, в естественном состоянии или до модификации. Снижение является комплексным понятием, включающим: случай, когда активность самого фермента ниже активности этого фермента, исходно присутствующего у микроорганизма, за счет модификации гена, кодирующего ферменты, и так далее; случай, когда общий уровень внутриклеточной ферментативной активности ниже соответствующего уровня у штамма в естественном состоянии или до модификации за счет ингибирования экспрессии гена, кодирующего фермент, или ингибирования трансляции; и комбинацию таких случаев.
Способ модификации для инактивации ферментативной активности может быть осуществлен с применением различных способов, хорошо известных в данной области. Примеры таких способов могут включать, без ограничений: способ замены кодирующего фермент гена на хромосоме геном, мутированным с целью снижения ферментативной активности, включая случай, когда ферментативная активность устранена; способ удаления части или всего кодирующего фермент гена; способ замены последовательности контроля экспрессии кодирующего фермент гена последовательностью со слабой активностью или без активности; способ включения модификации в последовательность контроля экспрессии кодирующего фермент гена на хромосоме; способ удаления части или всего кодирующего фермент гена на хромосоме; способ включения антисмыслового олигонуклеотида (например, антисмысловой РНК), ингибирующего трансляцию фермента с мРНК посредством комплементарного связывания с транскриптом гена на хромосоме; способ искусственного включения последовательности, комплементарной последовательности SD (последовательности Шайна-Дальгарно), выше последовательности SD кодирующего фермент гена с образованием вторичной структуры и ингибированием посредством этого присоединение к рибосоме; способ обратно-транскрипционной инженерии (RTE) с включением промотора в 3'-конец открытой рамки считывания (ORF) соответствующей последовательности для обратной транскрипции; и их комбинации.
Конкретно, способ удаления части или всего кодирующего фермент гена может быть осуществлен путем замены полинуклеотида, кодирующего эндогенный белок-мишень, на хромосоме полинуклеотидом или маркерным геном, в котором удалена часть последовательности нуклеиновой кислоты, с использованием векторов для вставки в бактериальные хромосомы. В качестве способа удаления части или всего гена может быть применен способ удаления генов гомологичной рекомбинацией.
Как указано выше, термин «часть» может варьировать в зависимости от типов полинуклеотидов, но может составлять, без ограничений, конкретно от 1 до 300, конкретнее от 1 до 100 и еще конкретнее от 1 до 50.
Как указано выше, термин «гомологичная рекомбинация» относится к генетической рекомбинации, происходящей посредством кроссинговера в локусах гомологичных друг другу цепей генов.
Конкретно, способ модификации последовательностей контроля экспрессии может быть осуществлен путем внесения модификаций в нуклеотидные последовательности контроля экспрессии путем делеции, вставки, неконсервативной или консервативной замены или их комбинации, или заменой на существенно более слабые промоторы и так далее. Последовательности контроля экспрессии могут включать промоторы, операторные последовательности, последовательности, кодирующие области связывания рибосом, и последовательности, контролирующие терминацию транскрипции и трансляции.
Кроме того, способ модификации последовательности гена на хромосоме может быть осуществлен путем внесения модификации в последовательность путем делеции, вставки, неконсервативной или консервативной замены либо их комбинации для дополнительного снижения ферментативной активности или путем замены на последовательность гена, улучшенную для ослабления активности, или на последовательность гена, улучшенную для устранения активности.
В типичном воплощении настоящего изобретения было подтверждено, что у различных Escherichia coli, продуцирующих триптофан, с делецией гена yigL, кодирующего соответствующую фосфатазу, для инактивации эндогенной активности фосфатазы, представленной аминокислотной последовательностью SEQ ID NO: 1, продуктивность L-триптофана повышена по сравнению с исходными штаммами, без делеции yigL, посредством чего подтверждено, что микроорганизмы рода Escherichia, продуцирующие L-триптофан, модифицированные для инактивации эндогенной фосфатазной активности, могут эффективно продуцировать L-триптофан.
В настоящем изобретении микроорганизм рода Escherichia, продуцирующий L-триптофан, относится к микроорганизму, способному продуцировать L-триптофан из источников углерода, присутствующих в среде. Кроме того, микроорганизм, продуцирующий L-триптофан, может представлять собой рекомбинантный микроорганизм. Конкретных ограничений по типам нет, при условии наличия способности продуцировать L-триптофан, однако микроорганизм может принадлежать к роду Enterbacter, роду Escherichia, роду Erwinia, роду Serratia, роду Providencia, роду Corynebacterium, роду Brevibacterium и, конкретно, к роду Escherichia.
Более конкретно, микроорганизм рода Escherichia может представлять собой Escherichia coli, однако возможно включение, без ограничений, микроорганизма рода Escherichia, продуктивность L-триптофана у которого повышена, благодаря инактивации фосфатазной активности.
Конкретно, в настоящем изобретении нет конкретных ограничений относительно исходного штамма микроорганизма рода Escherichia, имеющего продуктивность L-триптофана за счет инактивации фосфатазной активности, при условии, что он представляет собой микроорганизм, продуцирующий триптофан. Например, микроорганизм, продуцирующий триптофан, может быть модифицирован для ослабления или инактивации активности гена в конкурирующих метаболических путях, активности регуляторов в метаболических путях, управляющих триптофановым опероном, активности импортера триптофана и активности гена транспорта и распада триптофана и/или для сверхэкспрессии активности триптофанового оперона. Способ ослабления или инактивации активности идентичен описанному выше и может включать, без ограничений, известные способы. Кроме того, включены, без ограничений, известные способы сверхэкспрессии активности триптофанового оперона, однако примеры могут включать, без ограничений: способ дополнительного включения частей или целых последовательностей генов оперона или полинуклеотидов, содержащих области контроля экспрессии, вводимые в хромосомы извне; способ увеличения числа копий за счет включения в векторную систему; замену областей контроля экспрессии, контролирующих экспрессию генов, другими контрольными последовательностями; модификацию частей или целых последовательностей генов в областях контроля экспрессии; и усиление активности оперона посредством включения модификаций в сам ген. Конкретно, он может представлять собой Escherichia coli с делецией частей или целых генов pheA, trpR, mtr и/или tnaAB и/или сверхэкспрессией триптофанового оперона.
В настоящем изобретении, помимо генов pheA, trpR, mtr и tnaAB, триптофановых оперонов и кодируемых ими белковых последовательностей, генные последовательности и белковые последовательности, используемые для настоящего изобретения, могут быть получены из известных баз данных (то есть GenBank NCBI и так далее), однако примеры не ограничены этими последовательностями. Кроме того, подробная информация о генах pheA, trpR, mtr и tnaAB и так далее может быть получена из патента Кореи №10-0792095 и публикации патента Кореи №10-2013-0082121, и настоящее изобретение может включать все их описание посредством ссылки.
Относительно типичного воплощения настоящего изобретения, в результате инактивации фосфатазной активности у различных исходных штаммов, в случае микроорганизма рода Escherichia, продуцирующего L-триптофан, было подтверждено, что при инактивации фосфатазной активности продуктивность L-триптофана была существенно улучшена независимо от типов исходных штаммов.
В другом аспекте настоящего изобретения предложен способ получения L-триптофана, включающий: культивирование модифицированного микроорганизма рода Escherichia, продуцирующего L-триптофан в среде, где активность фосфатазы, представленной аминокислотной последовательностью SEQ ID NO: 1, инактивирована; и выделение L-триптофана из культивированного микроорганизма и среды.
Для культивирования микроорганизма по настоящему изобретению могут быть использованы любые среды или условия культивирования, без ограничений, при условии, что они представляют собой типичные среды, используемые для культивирования микроорганизма рода Escherichia, однако, конкретно, микроорганизм по настоящему изобретению можно культивировать в типичных средах, содержащих подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины и так далее, в аэробных условиях с контролем температуры, рН и так далее.
В настоящем изобретении источники углерода могут включать углеводы, такие как глюкоза, фруктоза, сахароза, мальтоза, маннит, сорбит и так далее; спирты, такие как сахарные спирты, глицерин, пировиноградная кислота, молочная кислота, лимонная кислота и так далее; и аминокислоты, такие как органические кислоты, глутаминовой кислота, метионин, лизин и так далее. Кроме того, могут быть использованы природные органические источники питательных веществ, такие как гидролизаты кукурузного крахмала, мелассы, черная патока, рисовые отруби, маниока, остатки сахарного тростника и жидкий кукурузный экстракт, и, конкретно, могут быть использованы углеводы, такие как глюкоза, стерильные предварительно обработанные мелассы (то есть мелассы, преобразованные в восстанавливающие сахара, и так далее), и возможно широкое применение, без ограничений, подходящих количеств источников углерода, не включенных в приведенный выше список. Эти источники углерода могут быть использованы, без ограничений, по отдельности или в комбинации из по меньшей мере двух типов.
В качестве источников азота могут быть использованы неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония, нитрат аммония и так далее; аминокислоты, такие как глутаминовая кислота, метионин, глутамин и так далее; и органические источники азота, такие как пептон, NZ-амин, мясные экстракты, дрожжевые экстракты, солодовые экстракты, жидкий кукурузный экстракт, казеиновые гидролизаты, рыба или продукты ее разложения и соевый жмых и продукты его разложения. Эти источники азота могут быть использованы, без ограничений, по отдельности или в комбинации из по меньшей мере двух типов.
В качестве источников фосфора могут быть включены дигидрофосфат калия, гидрофосфат калия, соответствующие натрийсодержащие соли и так далее. В качестве неорганических соединений могут быть использованы хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и так далее, и, кроме того, могут быть включены аминокислоты, витамины, подходящие предшественники и так далее. Эти среды или предшественники могут быть добавлены в культуральные продукты в форме периодической культуры или непрерывной культуры.
В настоящем изобретении во время культивирования микроорганизмов в культуральные продукты могут подходящими способами быть добавлены такие соединения, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота, серная кислота и так далее, для регуляции рН культуральных продуктов. Кроме того, в процессе культивирования могут быть использованы пеногасители, такие как простой эфир полигликоля и жирных кислот, для подавления пенообразования. Кроме того, в культуральный продукт может вводиться кислород или кислородсодержащий газ для поддержания аэробных условий культуральных продуктов, или, для поддержания анаэробных и микроаэрофильных условий, можно вводить газообразные азот, водород и диоксид углерода, или не вводить газы.
Конкретная температура культуральных продуктов может составлять, без ограничений, от 27°С до 40°С, конкретнее от 30°С до 37°С. Культивирование можно продолжать до получения требуемого количества полезных продуктов и, конкретно, без ограничений, можно продолжать от 10 часов до 100 часов.
Указанная выше стадия выделения L-триптофана может обеспечивать выделение требуемого L-триптофана из культивированного микроорганизма и культуральной среды с использованием способов культивирования по настоящему изобретению, например, с использованием периодической культуры, непрерывной культуры, подпитываемой культуры и так далее, на основе подходящих способов, известных в данной области. Стадия выделения может включать процесс очистки. Процесс очистки может обеспечивать очистку выделенного L-триптофана с использованием подходящих способов, известных в данной области техники.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет подробно описано со ссылкой на следующие Примеры. Тем не менее, эти Примеры приведены лишь в иллюстративных целях, и объем настоящего изобретения не ограничен этими Примерами.
Пример 1: Получение фосфатазодефицитного штамма дикого типа
В данном примере из штамма, продуцирующего триптофан, получали штамм с инактивированной фосфатазной активностью.
У штамма W3110trpΔ2 (публикация заявки на патент Кореи №10-2013-0082121), полученного из штамма W3110, являющегося штаммом Escherichia coli дикого типа, типичного микроорганизма рода Escherichia, у которого удалены ген pheA (идентификатор гена в NCBI: 12934467), кодирующий хоризматмутазу/префенатдегидратазу (CM-PDT), ген tnaA (идентификатор гена в NCBI: 12933600), кодирующий триптофаназу, и ген tnaAB, являющиеся оперонными формами гена tnaB (идентификатор гена в NCBI: 12933602), кодирующего импортер триптофана, гомологичной рекомбинацией удаляли ген yigL, предположительно кодирующий фосфатазу, для повышения продуктивности триптофана.
Конкретно, для удаления гена yigL, содержащего генные последовательности SEQ ID NO: 2, применяли одностадийный способ инактивации, в который была вовлечена Red-рекомбиназа фага лямбда, разработанный Datsenko К.А. и соавт.(Proc Natl Acad Sci USA, (2000) V97, pp6640-6645). В качестве маркеров для подтверждения вставки в гены промоторы rmf лигировали с pUC19 (New England Biolabs (США)) и использовали хлорамфениколовые гены вектора pUCprmfmloxP, который получали лигированием мутантной кас сеты loxP-CmR-loxP, полученной с использованием pACYC184 (New England Biolab) (публикация патента Кореи №10-2009-0075549).
Сначала pUCprmfmloxP использовали в качестве матрицы с комбинацией праймеров с SEQ ID NO: 3 и 4, содержащей часть гена yigL и часть последовательностей гена резистентности к хлорамфениколу pUCprmfmloxP. Затем ΔyigL1st, представляющий собой продукт полимеразной цепной реакции (далее PCR) размером приблизительно 1,2 тысячи пар оснований (т.п.о.), получали путем первичной PCR с повторением 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты. После этого ΔyigL1st, PCR-продукт размером приблизительно 1,2 т.п.о., полученный путем PCR, подвергали электрофорезу в 0,8% агарозном геле, элюировали и использовали в качестве матрицы для вторичной PCR. Во время вторичной PCR с повторением 30 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 1 минуты с использованием комбинации праймеров с SEQ ID NO: 5 и 6 получали ΔyigL, представляющий собой PCR-продукт размером приблизительно 1,3 т.п.о., содержащий 20 пар оснований (п.о.) генных последовательностей 5'- и 3'-областей PCR-продуктов, полученных при первичной PCR, при использовании элюированных продуктов первичной PCR в качестве матрицы. Полученный таким образом PCR-продукт подвергали электрофорезу в 0,8% агарозном геле, элюировали и использовали для рекомбинации.
Escherichia coli W3110trpΔ2, трансформированные вектором pKD46, получали в компетентном состоянии в соответствии с одностадийным способом инактивации (Proc Natl Acad Sci USA., (2000) V97, pp.6640-6645), разработанным Datsenko К.А. и соавт., и затем трансформировали их фрагментами ΔyigL размером 1,3 т.п.о, полученными первичной и вторичной PCR. Затем их культивировали в средах LB, содержащих хлорамфеникол, и отбирали первичные трансфектанты, резистентные к хлорамфениколу.
После удаления pKD46 из полученных таким образом первичных рекомбинантных штаммов, резистентных к хлорамфениколу, из бактерий удаляли маркерные гены (Gene, (2000) V247, pp. 255-264) посредством включения векторов pJW168 (Gene, (2000) V247, рр255-264). PCR-продукты размером приблизительно 0,6 т.п.о., полученные из выделенных в итоге бактерий посредством PCR с использованием праймеров SEQ ID NO: 7 и 8, позволили подтвердить делецию гена yigL, и полученный штамм был назван W3110 trpΔ2 yigL.
Последовательности праймеров, использованных в данном Примере, показаны в Таблице 1 ниже.

Пример 2: Получение штаммов, продуцирующих триптофан с инактивированной фосфатазой
В этом примере ген yigL, предположительно кодирующий фосфатазу, удаляли путем гомологичной рекомбинации, как описано в способе согласно Примеру 1, имея в качестве родительского штамма КССМ11166Р (патент Кореи №10-1261147), являющийся еще одним типичным штаммом Escherichia coli, продуцирующим триптофан.
PCR-продукты размером приблизительно 0,6 т.п.о., полученные из выделенных в итоге бактерий посредством PCR с использованием праймеров с SEQ ID NO: 7 и 8, позволили подтвердить делецию гена yigL, и полученный штамм был назван СА04-2803.
Пример 3: Оценка продуктивности триптофана штаммами дикого типа,
дефицитных по гену yigL
В каждый штамм методами трансформации включали pCL-Dtrp_att-trpEDCBA и pBAC-Dtrp_att-trpDCBA для сравнения продуктивности триптофана W3110 trpΔ2 yigL, полученного в Примере 1, и W3110 trpΔ2, являющегося родительским штаммом. Включенные векторы представляли собой векторы с усиленной экспрессией триптофановых оперонов для сверхсинтеза триптофана посредством отключения контрольного механизма в контрольных областях триптофанового оперона (публикации патента Кореи №10-2013-0082121). Штаммы с включенными векторами культивировали в среде для оценки продукции триптофана, приготовленной в соответствии с составом, указанным в Таблице 2, и сравнивали их активность в отношении продукции L-триптофана.

Штаммы, культивированные в течение ночи в твердой среде LB в инкубаторе при 37°С, засевали в 25 мл тестовой среды согласно Таблице 2 одной платиновой петлей, соответственно, и культивировали в течение 48 часов в инкубаторе при 37°С и 200 об/мин. После этого сравнивали концентрации триптофана (Таблица 3).
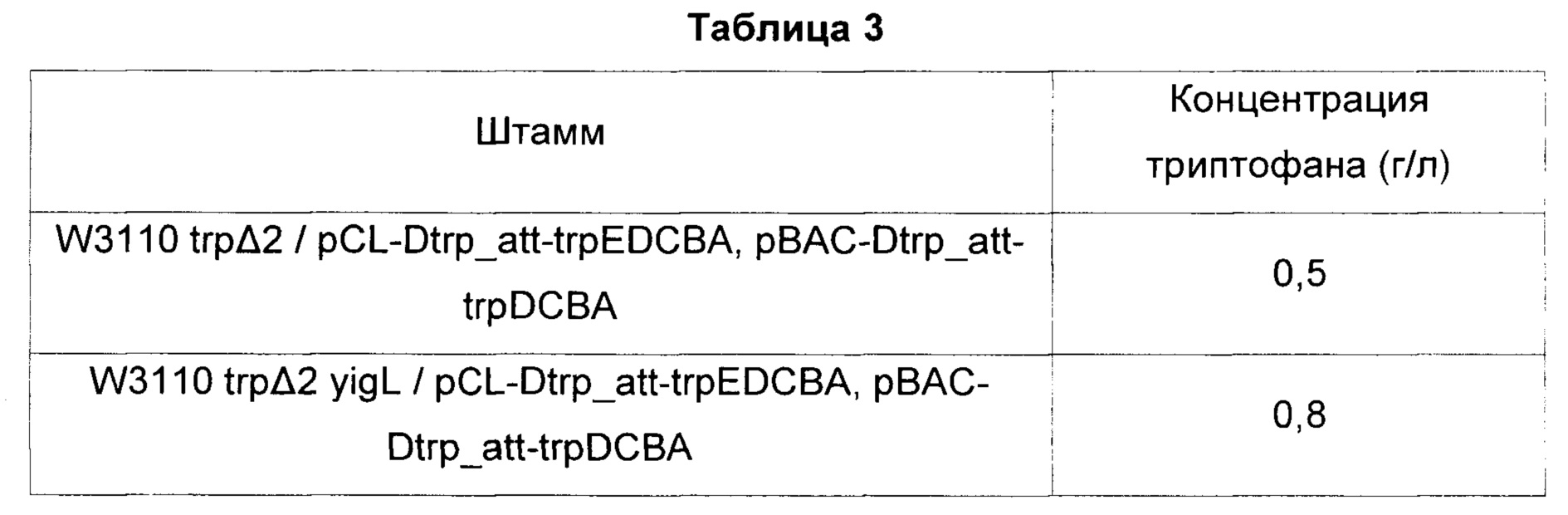
Результаты, представленные выше, демонстрируют, что у штамма, где активность фосфатазы, кодируемой геном yigL, была инактивирована, продуктивность триптофана была на 60% выше, чем у штамма, где активность фосфатазы не была инактивирована. Было подтверждено, что продуктивность триптофана может быть улучшена инактивацией фосфатазы, кодируемой yigL. Это можно трактовать как усиление биосинтеза триптофана посредством повышения концентрации PLP, играющего ключевую роль в качестве кофермента, важного для биосинтеза триптофана, вследствие инактивации фосфатазы, кодируемой yigL.
Пример 4: Оценка продуктивности триптофана штаммов, дефицитных по гену yigL
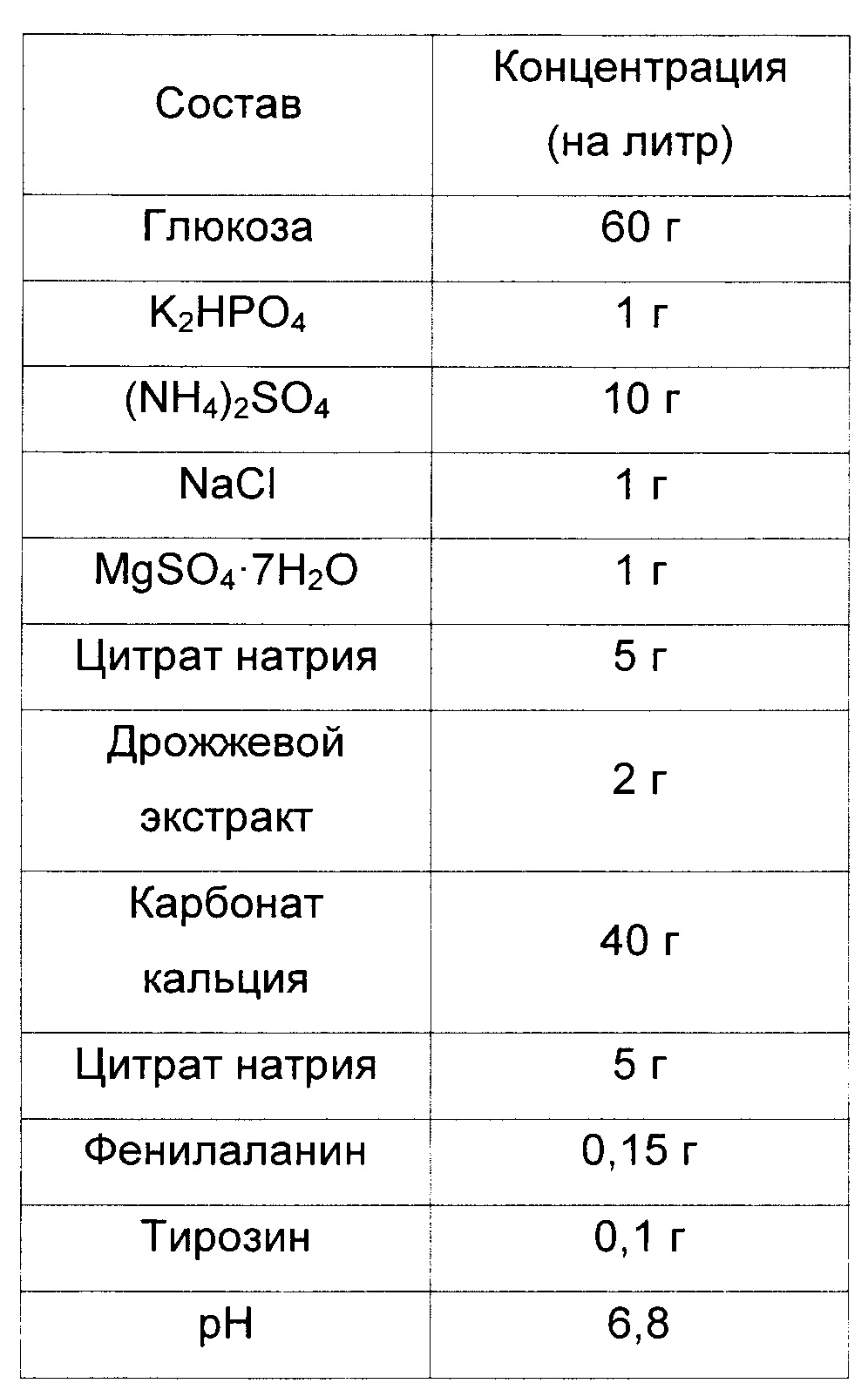
Для измерения титров триптофана у yigL-дефицитного штамма (СА04-2803), полученного в Примере 2, и КССМ11166Р, являющегося родительским штаммом, штаммы культивировали в среде для измерения титров триптофана, приготовленной в соответствии с составом, указанным в Таблице 4, представленной ниже. После этого было подтверждено повышение эффективности продукции L-триптофана.
Таблица 4
Состав среды для измерения титров триптофана
Штаммы Escherichia coli KCCM11166P и CA04-2803, культивированные в течение ночи в твердой среде LB в инкубаторе при 37°С, засевали в 25 мл среды для измерения титров согласно Таблице 4 одной платиновой петлей, соответственно, и культивировали в течение 48 часов в инкубаторе при 37°С и 200 об/мин. После этого сравнивали скорость потребления глюкозы и концентрации триптофана.
В результате, как показано в Таблице 5, представленной ниже, у СА04-2803, являющегося штаммом с инактивированной фосфатазой, кодируемой геном yigL, концентрация триптофана была приблизительно на 30% выше, чем у контрольного КССМ11166Р.
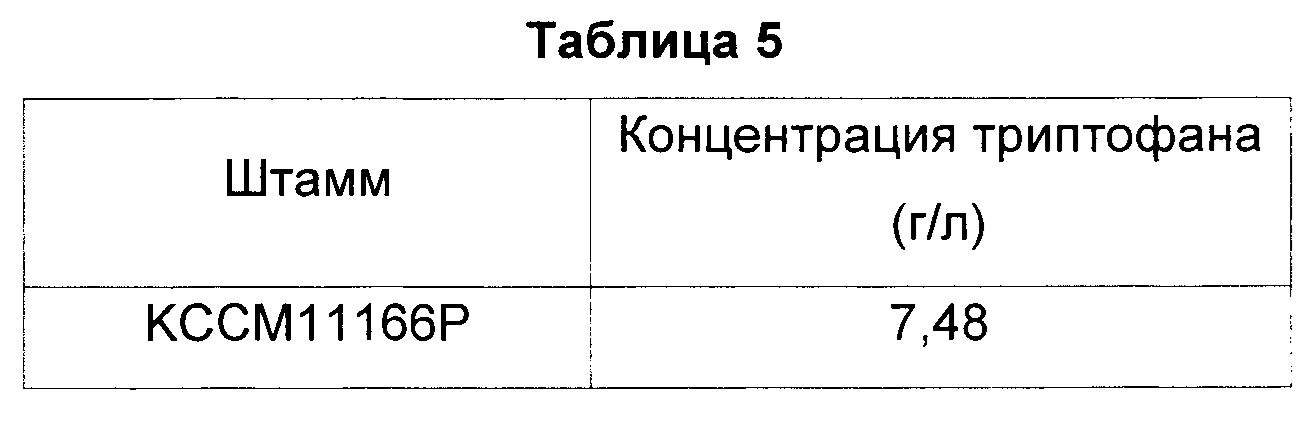

Авторы настоящего изобретения подтвердили повышение продуктивности триптофана у инактивированных штаммов на основе КССМ11166Р, дефицитных по гену yigL, кодирующему фосфатазу. Штаммы были названы «СА04-2803» или «СА04-2803 (KCCM11166P_ΔyigL)» и депонированы в Корейском центре культур микроорганизмов (Korean Culture Center of Microorganisms), являющемся признанным международным органом по депонированию согласно Будапештскому договору, 5 декабря 2014 г. под регистрационным номером КССМ11635Р.
Представленные выше результаты демонстрируют, что продуктивность L-триптофана в микроорганизме рода Escherichia, продуцирующем L-триптофан, увеличивалась больше у штамма с инактивированной фосфатазой, чем у штамма без инактивации фосфатазы. Кроме того, такие результаты в отношении увеличения продуктивности триптофана являются следствием инактивации фосфатазы, кодируемой геном yigL, и их рассматривают как следствие инактивации функции фосфатазы PLP, предположительно являющейся одной из функций фосфатазы, кодируемой указанным геном. Это весьма вероятно ввиду повышенной концентрации внутриклеточного PLP.
Исходя из изложенного выше, специалисту в области техники, к которой относится настоящее изобретение, будет ясно, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технической концепции или существенных характеристик настоящего изобретения. В этом отношении, типичные воплощения раскрыты здесь исключительно в целях наглядности, и их не следует толковать как ограничение объема настоящего изобретения. Наоборот, подразумевается, что настоящее изобретение охватывает не только типичные воплощения, но также различные альтернативы, модификации, эквиваленты и другие воплощения, которые могут быть включены в сущность и объем настоящего изобретения, как определено в приложенной формуле изобретения.

