Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ТЕРАПИИ ИММУННОГО ЗАБОЛЕВАНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к средству для профилактики и/или терапии иммунных заболеваний, в частности к средству для профилактики и/или терапии аллергических заболеваний или аутоиммунных заболеваний, содержащему в качестве активного ингредиента новое конденсированное пиримидиновое соединение или его соль, которое характеризуется ингибирующим эффектом в отношении тирозинкиназы Брутона (BTK).
Уровень техники
[0002]
Известно, что различные протеинкиназы существуют in vivo и вовлечены в регуляцию целого ряда функций. Протеинкиназа Брутона (BTK) представляет собой протеинкиназу, которая относится к семейству Tec-киназ, которое экспрессируется в миелоидных клетках, таких как В-клетки, моноциты/макрофаги, нейтрофилы, тучные клетки и остеокласты, и которое вовлечено в регуляцию функций указанных клеток (непатентные документы 1 и 2). BTK расположена ниже в цепи иммунорецепторных сигналов, таких как семейство рецепторов В-клеток (BCR) или Fc рецепторов, и вовлечена в пролиферацию, выживание, дифференцировку и активацию В-клеток, и в регуляцию экспрессии воспалительных цитокинов (например, фактора некроза опухоли-α или интерлейкина-1β) или химических медиаторов (например, гистамина или лейкотриена) в моноцитах/макрофагах или в тучных клетках (непатентный документ 3). Считается, что ингибитор, способный регулировать активность ВТК, применим в качестве терапевтического средства для заболеваний, ассоциированных с аномальной гиперактивностью сигнального пути BTK (например, злокачественных опухолей, аллергических заболеваний или аутоиммунных заболеваний).
[0003]
В последние годы считается, что в дополнение к В-клеткам, которые вовлечены в продукцию антител, различные клетки, такие как моноциты/макрофаги, нейтрофилы, тучные клетки и остеокласты, которые экспрессируют семейство Fc рецепторов (FcR) или их родственные молекулы, тесно ассоциированы с возникновением или прогрессированием аутоиммунных заболеваний, таких как ревматоидный артрит (непатентный документ 4). Поскольку ВТК сигналы ассоциированы с активацией указанных клеток или с аномальной активацией их функций (непатентные документы 2 и 3), ожидается, что соединение с ингибирующим эффектом в отношении ВТК, будет терапевтически эффективно в отношении аутоиммунных заболеваний. Кроме того, поскольку ВТК также вовлечена в активацию тучных клеток, ожидается, что соединение с ингибирующим эффектом в отношении ВТК, будет терапевтически эффективно в отношении аллергических заболеваний, с которыми ассоциированы В-клетки или тучные клетки.
[0004]
Известные на сегодняшний день ВТК ингибиторы включают в себя PCI-32765 (непатентный документ 5) и соединения, описанные в патентных документах 1 и 2 (патентные документы 1 и 2). Известно, что PCI-32765 ингибирует EGFR, а также ВТК, и представляет собой соединение, применимое в качестве средства для терапии иммунных заболеваний (таких как ревматоидный артрит) (непатентный документ 5).
[0005]
В то же время известно, что EGFR связывается, например, с эпидермальным фактором роста (EGF), который представляет собой лиганд, и участвует в пролиферации и выживании (например, ингибировании апоптоза) различных клеток (непатентный документ 6). Известно, что нацеленные на EGFR ингибиторы вызывают побочные эффекты, такие как кожные нарушения и одновременно дисфункцию желудочно-кишечного тракта, и широко распространено мнение, что такие побочные эффекты могут быть связаны с ингибированием сигнального пути EGFR дикого типа (непатентный документ 7), а потому в качестве средства для профилактики и/или терапии иммунных заболеваний требуется ингибитор, который характеризуется высокой BTK селективностью и высокой степенью применимости.
Перечень процитированных документов
Патентные документы
[0006]
Патентный документ 1: WO 2011/090760
Патентный документ 2: WO 2009/158571
Непатентные документы
[0007]
Непатентный документ 1: Schaeffer and Schwartzberg, Curr. Op. Imm., 2000, pp. 282-288
Непатентный документ 2: Schmidt U., et al., Int Arch Allergy Immunol, 134, 2004
Непатентный документ 3: Ellmeier W., et al., FEBS Journal., 278, 2011
Непатентный документ 4: Rommel C., et al., Nature reviews immunology, 7, 2007
Непатентный документ 5: Honigberg LA., et al., Proc. Natl. Acad. Sci. USA, 107, 2010
Непатентный документ 6: Lacouture ME., Nature Reviews Cancer, 6, 2006
Непатентный документ 7: Keefe DM and Bateman EH. Nature Reviews Clinical Oncology. 9, 2012
Краткое описание настоящего изобретения
Техническая задача
[0008]
Если ингибирующие эффекты в отношении BTK и EGFR отделены друг от друга, то можно ожидать снижения упомянутых выше побочных эффектов.
Другими словами, с точки зрения снижения побочных эффектов, требуется средство для профилактики и/или терапии иммунных заболеваний, которое характеризуется высокой ингибирующей активностью в отношении ВТК и низкими эффектами ингибирования других киназ, таких как EGFR, и которое в то же время обладает превосходной эффективностью.
Таким образом, целью настоящего изобретения является предоставление средства для профилактики и/или терапии иммунных заболеваний, характеризующееся лучшим эффектом в отношении иммунных заболеваний по сравнению с таковым у общепринятого ингибитора ВТК, со сниженными побочными эффектами, в частности, средство для профилактики и/или терапии аллергических заболеваний или аутоиммунных заболеваний.
Решение проблемы
[0009]
В результате широких исследований авторы настоящего изобретения обнаружили, что соединения, представленные следующей общей формулой (I), демонстрируют превосходную ингибирующую активность в отношении ВТК и превосходную селективность в отношении ВТК, и применимы в качестве лекарственного средства для лечения аутоиммунных заболеваний, таких как ревматоидный артрит или системная красная волчанка, или иммунных заболеваний, таких как аллергическое заболевание, например, атопический дерматит, оформив настоящее изобретение.
[0010]
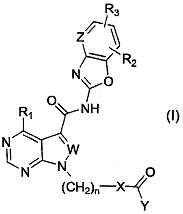
Более определенно, настоящее изобретение относится к средству для профилактики и/или терапии иммунных заболеваний, которое содержит в качестве активного ингредиента соединение, представленное следующей общей формулой (I), или его соль:
[0011]
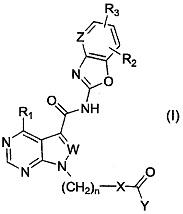
[0012]
где X представляет собой азотсодержащий C3-C10гетероциклоалкилен, который может содержать один или несколько заместителей;
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
каждый W и Z независимо представляет собой N или CH;
n представляет собой целое число от 0 до 2;
R1 представляет собой аминогруппу, которая может содержать один или несколько заместителей;
каждый R2 и R3, которые могут быть одинаковыми или разными, представляет собой атом водорода, атом галогена, C1-C6алкильную группу, которая может содержать один или несколько заместителей, C1-C6алкоксигруппу, которая может содержать один или несколько заместителей, C3-C7циклоалкильную группу, которая может содержать один или несколько заместителей, C6-C14ароматическую углеводородную группу, которая может содержать один или несколько заместителей, 4-10-членную моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую от 1 до 3 одинаковых или разных гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей, или цианогруппу; и
каждый R4, R5, R6 и R7, которые могут быть одинаковыми или разными, представляет собой атом водорода или C1-C6алкильную группу, которая может содержать один или несколько заместителей.
[0013]
Настоящее изобретение также относится к соединению, представленному приведенной выше общей формулой (I), или его соли для профилактики или терапии иммунных заболеваний.
Настоящее изобретение также относится к использованию соединения, представленного приведенной выше общей формулой (I), или его соли для получения средства для профилактики или терапии иммунных заболеваний.
Настоящее изобретение также относится к способу профилактики и/или лечения иммунных заболеваний, характеризующемуся введением соединения, представленного приведенной выше общей формулой (I), или его соли.
[0014]
Как упомянуто выше, PCI-32765 известен в качестве ингибитора ВТК и характеризуется наличием феноксифенильной группы; тем не менее, он значительно отличается от соединения согласно настоящему изобретению по причине отсутствия бензоксазольной группы или оксазолопиридиновой группы, которые представляют собой характерную черту соединения согласно настоящему изобретению. Кроме того, соединение согласно настоящему изобретению характеризуется наличием более высокой селективностью в отношении ВТК по сравнению с PCI-32765 (контрольное соединение 1), как описано ниже.
Кроме того, в соединениях, описанных в патентных документах 1 и 2, также отсутствует бензоксазольная группа или оксазолопиридиновая группа, которые представляют собой характерную черту соединения согласно настоящему изобретению, и их структуры значительно отличаются.
Кроме того, известно соединение, раскрытое в WO 2007/067781.
Однако соединения, раскрытые в указанном документе, представляют собой соединения, которые ингибируют Aurora-киназы, и не существует раскрытия какого-либо конкретного соединения, содержащего бензоксазольную группу или оксазолопиридиновую группу. Литература также умалчивает о наличии или отсутствии ингибирующей активности в отношении ВТК или применимости средства для профилактики и/или терапии иммунных заболеваний.
Полезные эффекты настоящего изобретения
[0015]
Согласно настоящему изобретению, предусмотрено средство для профилактики и/или терапии иммунных заболеваний, в частности, аллергических заболеваний или аутоиммунных заболеваний, которое содержит в качестве активного ингредиента новое соединение, представленное приведенной выше формулой (I), или его соль, применимое в качестве ингибитора ВТК.
Было выяснено, что соединение согласно настоящему изобретению или его соль обладает превосходной ингибирующей активностью в отношении ВТК и демонстрирует превосходную эффективность на модели иммунологического заболевания. Кроме того, поскольку соединение согласно настоящему изобретению или его соль ингибирует ВТК сильно и селективно по сравнению с EGFR, побочные эффекты могут быть снижены, и ожидается повышение безопасности. Поэтому, соединение согласно настоящему изобретению или его соль применимы в качестве средства для профилактики и/или терапии иммунных заболеваний, в частности, в качестве средства для профилактики и/или терапии аллергических заболеваний или аутоиммунных заболеваний.
Краткое описание чертежей
[0016]
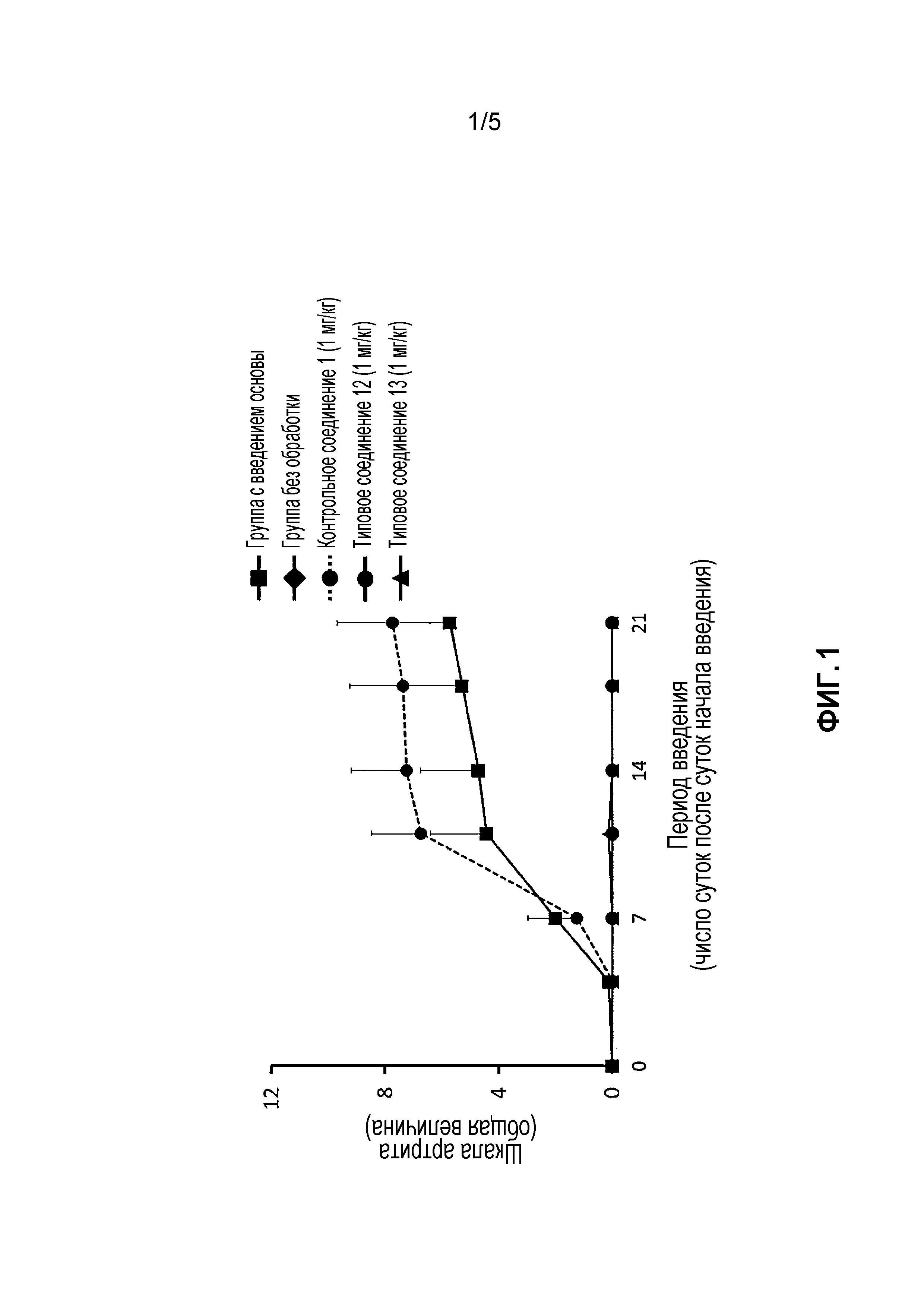
На фиг. 1 проиллюстрированы эффекты в модели индуцированного коллагеном артрита у мышей (профилактический эффект).
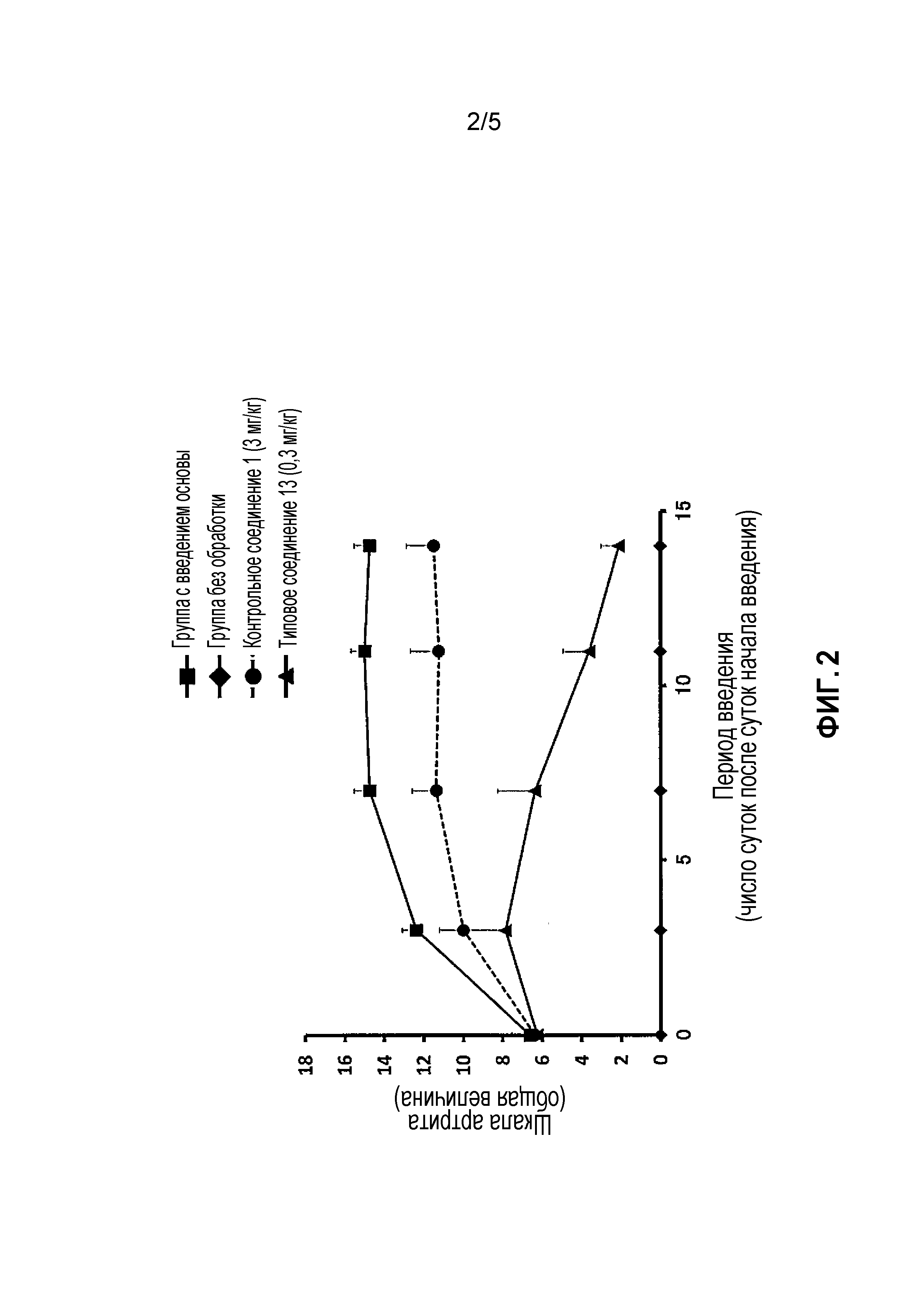
На фиг. 2 проиллюстрированы эффекты в модели индуцированного коллагеном артрита у мышей (терапевтический эффект).
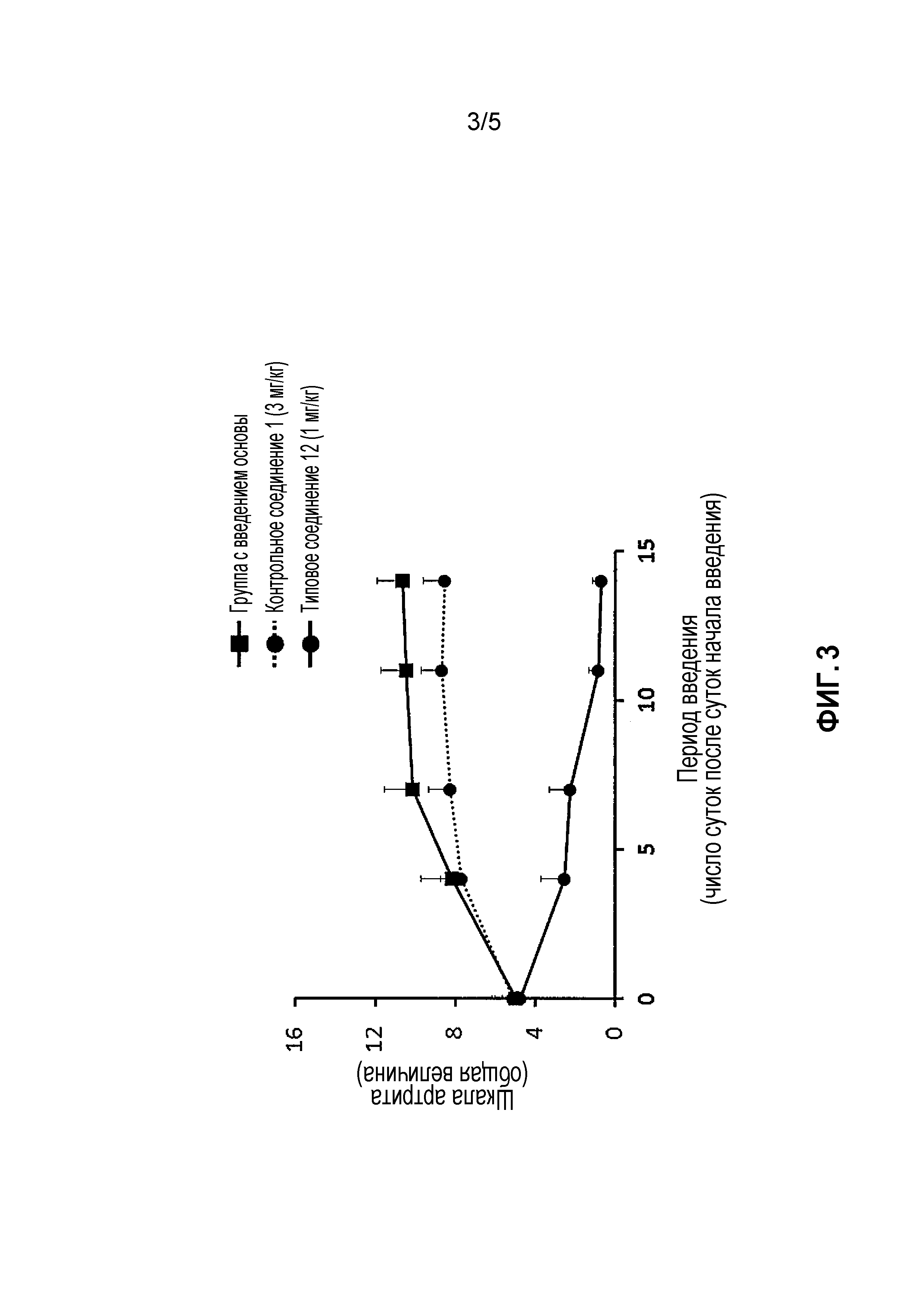
На фиг. 3 проиллюстрированы эффекты в модели индуцированного коллагеном артрита у мышей (терапевтический эффект).
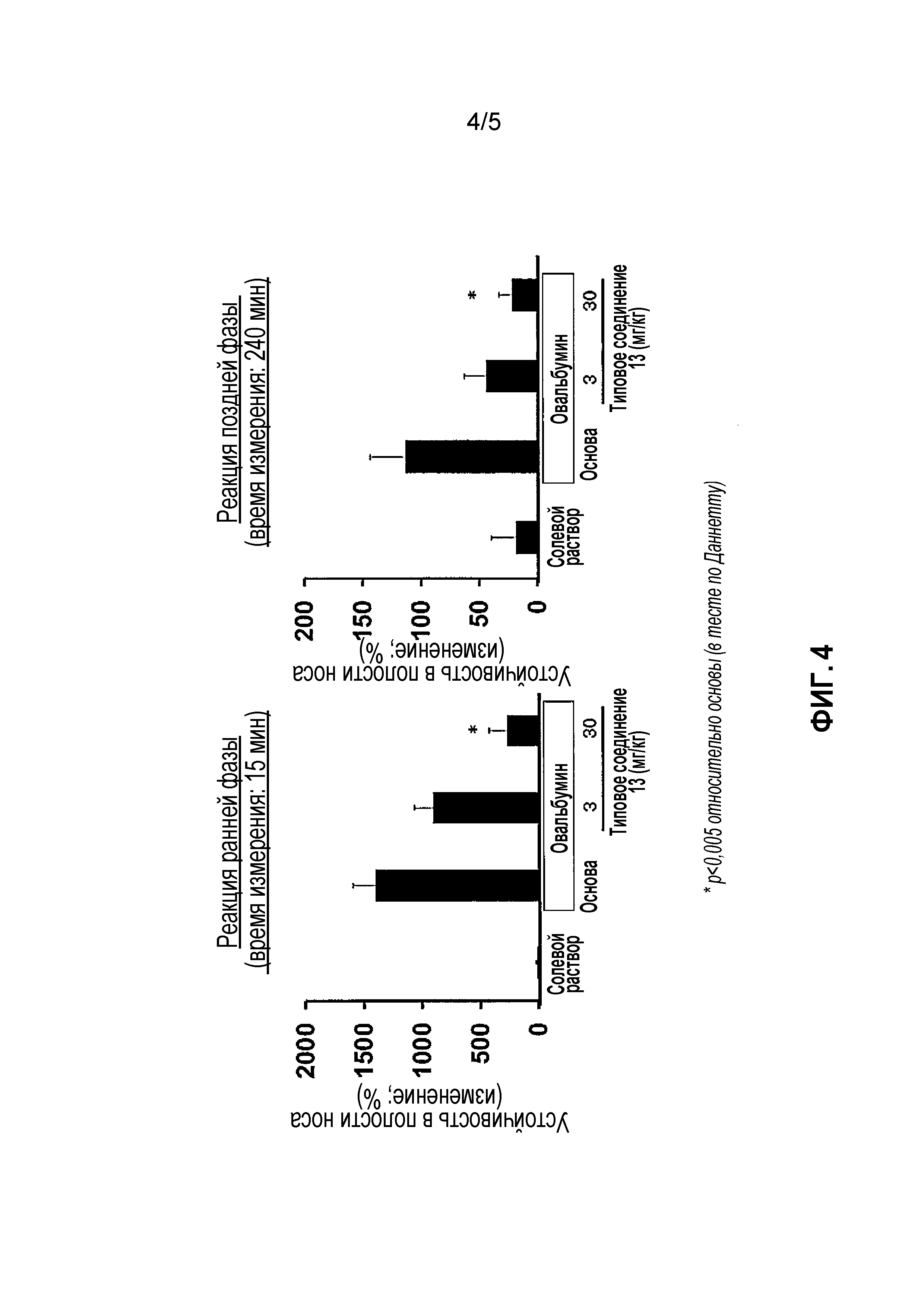
На фиг. 4 проиллюстрированы эффекты в модели антиген-индуцированного ринита у морских свинок.
На фиг. 5 проиллюстрированы эффекты на модели системной красной волчанки у мышей.
Описание варианта осуществления
[0017]
Соединение, представленное описанной выше формулой (I) согласно настоящему изобретению, представляет собой соединение, характеризующееся 1H-пиразоло[3,4-d]пиримидиновым остовом или 7H-пирроло[2,3-d]пиримидиновым остовом, который замещен бензоксазольной группой или оксазолопиридиновой группой в виде одного или нескольких заместителей, соединенных посредством амидной связи, и соединение представляет собой новое соединение, которое никогда не было описано в каких-либо известных из уровня техники источниках, упомянутых выше.
[0018]
В соответствии с настоящим описанием, примеры «заместителя(ей)» включают в себя атом галогена, гидроксильную группу, цианогруппу, нитрогруппу, алкильную группу, галогеналкильную группу, циклоалкильную группу, циклоалкилалкильную группу, аралкильную группу, алкенильную группу, алкинильную группу, алкоксигруппу, галогеналкоксигруппу, циклоалкоксигруппу, циклоалкилалкоксигруппу, аралкилоксигруппу, алкилтиогруппу, циклоалкилалкилтиогруппу, аминоруппу, моно- или диалкиламиногруппу, циклоалкилалкиламиногруппу, ацильную группу, ацилоксигруппу, оксогруппу, карбоксильную группу, алкоксикарбонильную группу, аралкилоксикарбонильную группу, карбамоильную группу, насыщенную или ненасыщенную гетероциклическую группу, ароматическую углеводородную группу и насыщенную гетероциклическую оксигруппу. В случае наличия упомянутых выше заместителей, число заместителей обычно составляет 1, 2 или 3.
[0019]
Примеры «атома галогена» в соответствии с настоящим описанием включают в себя атом фтора, атом хлора, атом брома и атом йода.
[0020]
«Алкильная группа» в соответствии с настоящим описанием может представлять собой любую неразветвленную группу или разветвленную группу, и ее примеры включают в себя C1-C6алкильные группы, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа и гексильная группа.
[0021]
«Галогеналькильная группа» в соответствии с настоящим описанием представляет собой неразветвленную или разветвленную алкильную группу, содержащую 1-6 атомов углерода и 1-13 атомов галогена (галоген-C1-C6алкильная группа), и ее примеры включают в себя галоген-C1-C6алкильные группы, такие как фторметильная группа, дифторметильная группа, трифторметильная группа, трихлорметильная группа, фторэтильная группа, 1,1,1-трифторэтильная группа, монофтор-н-пропильная группа, перфтор-н-пропильная группа и перфторизопропильная группа, тогда как предпочтительные примеры включают в себя галоген-C1-C4алкильные группы.
[0022]
Конкретные примеры «циклоалкильной группы» в соответствии с настоящим описанием включают в себя C3-C7циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. «Циклоалкилен» в соответствии с настоящим описанием представляет собой двухвалентный циклоалкил.
[0023]
Примеры «циклоалкилалкильной группы» в соответствии с настоящим описанием включают в себя C3-C7циклоалкил-замещенные C1-C4алкильные группы, такие как циклопропилметильная группа, циклобутилметильная группа, циклопентилметильная группа, циклогексилметильная группа и циклогептилметильная группа.
[0024]
Примеры «аралкильной группы» в соответствии с настоящим описанием включают в себя C7-C13аралкильные группы, такие как бензильная группа, фенэтильная группа, нафтилметильную группу и флуоренилметильная группа.
[0025]
«Алкенильная группа» в соответствии с настоящим описанием означает ненасыщенную углеводородную группу, которая может представлять собой любую неразветвленную группу, разветвленную группу или циклическую группу, и содержит, по меньшей мере, одну двойную связь. Ее примеры включают в себя C2-C6алкенильные группы, такие как винильная группа, аллильная группа, 1-пропенильная группа, 2-метил-2-пропенильная группа, изопропенильная группа, 1-, 2- или 3-бутенильная группа, 2-, 3- или 4-пентенильная группа, 2-метил-2-бутенильная группа, 3-метил-2-бутенильная группа, 5-гексенильная группа, 1-циклопентенильная группа, 1-циклогексенильная группа и 3-метил-3-бутенильная группа.
[0026]
«Алкинильная группа» в соответствии с настоящим описанием означает ненасыщенную углеводородную группу, которая может представлять собой любую неразветвленную группу, разветвленную группу или циклическую группу, и содержит, по меньшей мере, одну тройную связь. Ее примеры включают в себя C2-C6алкинильные группы, такие как этинильная группа, 1- или 2-пропинильная группа, 1-, 2- или 3-бутинильная группа и 1-метил-2-пропинильная группа.
[0027]
«Алкоксигруппа» в соответствии с настоящим описанием может представлять собой любую неразветвленную или разветвленную группу, и ее примеры включают в себя C1-C6алкоксигруппы, такие как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа и гексилоксигруппа.
[0028]
«Галогеналкоксигруппа» в соответствии с настоящим описанием представляет собой неразветвленную или разветвленную алкоксигруппу, содержащую 1-6 атомов углерода и 1-13 атомов галогена (галоген-C1-C6алкоксигруппу), и ее примеры включают в себя галоген-C1-C6алкоксигруппы, такие как фторметоксигруппа, дифторметоксигруппа, трифторметоксигруппа, трихлорметоксигруппа, фторэтоксигруппа, 1,1,1-трифторэтоксигруппа, монофтор-н-пропоксигруппа, перфтор-н-пропоксигруппа и перфтор-изопропоксигруппа, тогда как предпочтительные примеры включают в себя галоген-C1-C4алкоксигруппы.
[0029]
Конкретные примеры «циклоалкоксигруппы» в соответствии с настоящим описанием включают в себя C3-C7циклоалкоксигруппы, такие как циклопропоксигруппа, циклобутоксигруппа, циклопентилоксигруппа, циклогексилоксигруппа и циклогептилоксигруппа.
[0030]
Примеры «циклоалкилалкоксигруппы» в соответствии с настоящим описанием включают в себя C3-C7циклоалкил-замещенные C1-C4алкоксигруппы, такие как циклопропилметоксигруппа, циклобутилметоксигруппа, циклопентилметоксигруппа, циклогексилметоксигруппа и циклогептилметоксигруппа.
[0031]
Примеры «аралкилоксигруппы» в соответствии с настоящим описанием включают в себя C7-C13аралкилоксигруппы, такие как бензилоксигруппа, фенэтилоксигруппа, нафтилметилоксигруппа и флуоренилметилоксигруппа.
[0032]
«Алкилтиогруппа» в соответствии с настоящим описанием может представлять собой любую неразветвленную или разветвленную группу, и ее примеры включают в себя C1-C6алкилтиогруппы, такие как метилтиогруппа, этилтиогруппа, н-пропилтиогруппа, изопропилтиогруппа, н-бутилтиогруппа, изобутилтиогруппа, трет-бутилтиогруппа, н-пентилтиогруппа, изопентилтиогруппа и гексилтиогруппа.
[0033]
Примеры «циклоалкилалкилтиогруппы» в соответствии с настоящим описанием включают в себя C3-C7циклоалкил-замещенные C1-C4алкилтиогруппы, такие как циклопропилметилтиогруппа, циклобутилметилтиогруппа, циклопентилметилтиогруппа, циклогексилметилтиогруппа и циклогептилметилтиогруппа.
[0034]
Примеры «моноалкиламиногруппы» в соответствии с настоящим описанием включают в себя аминогруппы, которые монозамещены неразветвленными или разветвленными C1-C6алкильными группами, такие как метиламиногруппа, этиламиногруппа, н-пропиламиногруппа, изопропиламиногруппа, н-бутиламиногруппа, изобутиламиногруппа, трет-бутиламиногруппа, н-пентиламиногруппа, изопентиламиногруппа и гексиламиногруппа.
[0035]
Примеры «диалкиламиногруппы» в соответствии с настоящим описанием включают в себя аминогруппы, которые дизамещены неразветвленными или разветвленными C1-C6алкильными группами, такие как диметиламиногруппа, диэтиламиногруппа, ди(н-пропил)аминогруппа, диизопропиламиногруппа, ди(н-бутил)аминогруппа, диизобутиламиногруппа, ди(трет-бутил)аминогруппа, ди(н-пентил)аминогруппа, диизопентиламиногруппа и дигексиламиногруппа.
[0036]
Примеры «циклоалкилалкиламиногруппы» в соответствии с настоящим описанием включают в себя C3-C7циклоалкил-замещенные C1-C4алкиламиногруппы, такие как циклопропилметиламиногруппа, циклобутилметиламиногруппа, циклопентилметиламиногруппа, циклогексилметиламиногруппа и циклогептилметиламиногруппа.
[0037]
«Ацильная группа» в соответствии с настоящим описанием означает алкилкарбонильную группу или арилкарбонильную группу.
[0038]
Примеры «алкилкарбонильной группы» в соответствии с настоящим описанием включают в себя неразветвленные или разветвленные (C1-C6алкил)карбонильные группы, такие как метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, трет-бутилкарбонил, н-пентилкарбонил, изопентилкарбонил, и гексилкарбонил.
[0039]
Примеры «арилкарбонильной группы» в соответствии с настоящим описанием включают в себя (C6-C13арил)карбонильные группы, такие как фенилкарбонил, нафтилкарбонил, флуоренилкарбонил, антрилкарбонил, бифенилкарбонил, тетрагидронафтилкарбонил, хроманилкарбонил, 2,3-дигидро-1,4-диоксанафталенилкарбонил, инданилкарбонил и фенантрилкарбонил.
[0040]
«Ацилоксигруппа» в соответствии с настоящим описанием означает алкилкарбонилоксигруппу или арилкарбонилоксигруппу.
[0041]
Примеры «алкилкарбонилоксигруппы» в соответствии с настоящим описанием включают в себя неразветвленные или разветвленные (C1-C6алкил)карбонилоксигруппы, такие как метилкарбонилокси, этилкарбонилокси, н-пропилкарбонилокси, изопропилкарбонилокси, н-бутилкарбонилокси, изобутилкарбонилокси, трет-бутилкарбонилокси, н-пентилкарбонилокси, изопентилкарбонилокси и гексилкарбонилокси.
[0042]
Примеры «арилкарбонилоксигруппы» в соответствии с настоящим описанием включают в себя (C6-C13арил)карбонилоксигруппы, такие как фенилкарбонилокси, нафтилкарбонилокси, флуоренилкарбонилокси, антрилкарбонилокси, бифенилкарбонилокси, тетрагидронафтилкарбонилокси, хроманилкарбонилокси, 2,3-дигидро-1,4-диоксанафталенилкарбонилокси, инданилкарбонилокси и фенантрилкарбонилокси.
[0043]
«Алкоксикарбонильная группа» в соответствии с настоящим описанием может представлять собой любую неразветвленную или разветвленную группу, и ее примеры включают в себя (C1-C6алкокси)карбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутоксикарбонильная группа, трет-бутоксикарбонильная группа, пентилоксикарбонильная группа, изопентилоксикарбонильная группа и гексилоксикарбонильная группа.
[0044]
Примеры «аралкилоксикарбонильной группы» в соответствии с настоящим описанием включают в себя (C7-C13аралкил)оксикарбонильные группы, такие как бензилоксикарбонильная группа, фенэтилоксикарбонильная группа, нафтилметилоксикарбонильная группа и флуоренилметилоксикарбонильная группа.
[0045]
«Насыщенная гетероциклическая группа» в соответствии с настоящим описанием может представлять собой насыщенную гетероциклическую группу, содержащую гетероатомы, выбранные из группы, состоящей из атома азота, атома кислорода и атома серы, и ее конкретные примеры включают в себя морфолиногруппу, 1-пирролидинильную группу, пиперидиногруппу, пиперазинильную группу, 4-метил-1-пиперазинильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу, тетрагидротиофенильную группу и тиазолидинильную группу и оксазолидинильную группу.
[0046]
Согласно настоящему описанию, «ненасыщенная гетероциклическая группа» может включать в себя моноциклическую или полициклическую, полностью ненасыщенную или частично ненасыщенную гетероциклическую группу, содержащую гетероатомы, выбранные из группы, состоящей из атома азота, атома кислорода и атома серы, и ее конкретные примеры включают в себя имидазолильную группу, тиенильную группу, фурильную группу, пирролильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу, тиадиазолильную группу, пиразолильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиразильную группу, пиримидинильную группу, пиридазинильную группу, индолильную группу, изоиндолильную группу, индазолильную группу, триазолопиридильную группу, бензимидазолильную группу, бензоксазолильную группу, бензотиазолильную группу, бензотиенильную группу, бензофуранильную группу, пуринильную группу, хинолинильную группу, изохинолинильную группу, хиназолинильную группу, хиноксалинильную группу, метилендиоксифенильную группу, этилендиоксифенильную группу и дигидробензофуранильную группу.
[0047]
«Ароматическая углеводородная группа» в соответствии с настоящим описанием может включать в себя C6-C14ароматические углеводородные группы, такие как фенильная группа, толильная группа, ксилильная группа, нафтильная группа, антраценильная группа, фенантрильная группа, флуоренильная группа и тетрагидронафтильная группа.
[0048]
«Насыщенная гетероциклическая оксигруппа» в соответствии с настоящим описанием представляет собой оксигруппу, с которой связан насыщенный гетероцикл, причем гетероцикл содержит гетероатом, выбранный из группы, состоящей из атома азота, атома кислорода и атома серы. Конкретные примеры «насыщенной гетероциклической оксигруппы» включают в себя морфолинилоксигруппу, 1-пирролидинилоксигруппу, пиперидиноксигруппу, пиперазинилоксигруппу, 4-метил-1-пиперазинилоксигруппу, тетрагидрофуранилоксигруппу, тетрагидропиранилоксигруппу, тетрагидротиофенилоксигруппу, тиазолидинилоксигруппу и оксазолидинилоксигруппу.
[0049]
При этом выражение «CA-CB» в описании одного или нескольких заместителей согласно настоящему описанию указывает на то, что заместитель представляет собой один или несколько заместителей, число атомов углерода в которых составляет от A до B. Например, «C1-C6алкильная группа» указывает на алкильную группу, содержащую от 1 до 6 атомов углерода, и «C6-C14ароматическая углеводородоксигруппа» указывает на оксигруппу, с которой связана ароматическая углеводородная группа, содержащая от 6 до 14 атомов углерода. Выражение «A-B-членный» указывает на то, что число атомов, которые формируют кольцо (число кольцевых атомов) составляет от A до B. Например, «4-10-членная насыщенная гетероциклическая группа» означает насыщенную гетероциклическую группу, число кольцевых атомов в которой составляет от 4 до 10.
[0050]
В общей формуле (I), X представляет собой двухвалентный гетероциклоалкилен, содержащий от 3 до 10 атомов углерода, который может содержать один или несколько заместителей, содержит в кольце, по меньшей мере, один атом азота, и содержит в кольце от 0 до 2 гетероатомов одного вида или разных видов, выбранных из группы, состоящей из атома кислорода и атома серы (азотсодержащий C3-C10гетероциклоалкилен). Его конкретные примеры включают в себя азетидинилен, пирролидинилен, пиперидинилен, пиперазинилен, морфолинилен, октагидрохинолинилен и октагидроинлолинилен.
Предпочтительно, X представляет собой гетероциклоалкилен, содержащий от 3 до 5 атомов углерода, который может содержать один или несколько заместителей, и содержит в кольце один атом азота (азотсодержащий C3-C5гетероциклоалкилен), и X более предпочтительно представляет собой азетидинилен, пирролидинилен, или пиперидинилен, и еще более предпочтительно представляет собой 1,3-азетидинилен, 1,3-пирролидинилен или 1,3-пиперидинилен.
Применительно к заместителям указанных гетероциклоалкиленов, их примеры включают в себя заместители, такие как описанные выше; тем не менее, предпочтительно, если гетероциклоалкилены являются незамещенными.
[0051]
Предпочтительно, когда в общей формуле (I) атом азота азотсодержащей C3-C10гетероциклоалкиленовой группы, представленной X, связан с карбонильной группой -COY. Более того, предпочтительно, когда в общей формуле (I) атом азота азотсодержащей C3-C5гетероциклоалкиленовой группы, представленной X, связан с карбонильной группой -COY.
[0052]
В общей формуле (I), Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7.
[0053]
В общей формуле (I), каждый W и Z независимо представляет собой N или CH. Предпочтительно, если Z представляет собой N, то W представляет собой N, или если Z представляет собой CH, то W представляет собой N или CH.
[0054]
В общей формуле (I), n предпочтительно равен 0.
[0055]
В общей формуле (I), применительно к «заместителю(ям)» в «аминогруппе, которая может содержать один или несколько заместителей», представленной R1, их примеры включают в себя заместители, такие как описано выше; тем не менее, предпочтительно, если аминогруппа является незамещенной.
«Аминогруппа, которая может содержать один или несколько заместителей», представленная R1, предпочтительно представляет собой аминогруппу.
[0056]
В общей формуле (I), «атом галогена», представленный R2 или R3, предпочтительно представляет собой атом фтора, атом хлора или атом брома.
[0057]
В общей формуле (I), «C1-C6алкильная группа» в «C1-C6алкильной группе, которая может содержать один или несколько заместителей», представленной R2 или R3, предпочтительно представляет собой C1-C4алкильную группу, и C1-C6алкильная группа более предпочтительно представляет собой метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу или трет-бутильную группу, и еще более предпочтительно представляет собой метильную группу или этильную группу.
Применительно к «заместителю(ям)» в «C1-C6алкильной группе, которая может содержать один или несколько заместителей», представленной R2 или R3, предпочтительно, если C1-C6алкильная группа является незамещенной, или содержит один или несколько заместителей, таких как атом галогена или C1-C4алкоксигруппа. Более предпочтительно, если C1-C6алкильная группа является незамещенной или содержит один или несколько заместителей, таких как атом фтора или метоксигруппу. Если алкильная группа содержит один или несколько заместителей, то число заместителей конкретно не ограничено; тем не менее, если заместитель представляет собой атом галогена, число заместителей предпочтительно составляет от 1 до 3, тогда ка если один или несколько заместителей представляет собой C1-C4алкоксигруппу, то число заместителей предпочтительно составляет 1.
«C1-C6алкильная группа, которая может содержать один или несколько заместителей», представленная R2 или R3, предпочтительно представляет собой C1-C6алкильную группу, галоген-замещенную C1-C6алкильную группу или C1-C4алкокси-замещенную C1-C6алкильную группу; более предпочтительно C1-C4алкильную группу, галоген-замещенную C1-C4алкильную группу или C1-C4алкокси-замещенную C1-C4алкильную группу; еще более предпочтительно метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, трифторметильную группу, трихлорметильную группу, метоксиэтильную группу или этоксиэтильную группу; и еще более предпочтительно метильную группу, трифторметильную группу или метоксиэтильную группу.
[0058]
В общей формуле (I), «C1-C6алкоксигруппа» в «C1-C6алкоксигруппе, которая может содержать один или несколько заместителей», представленной R2 или R3 предпочтительно представляет собой «C1-C4алкоксигруппу», и «C1-C6алкоксигруппа» более предпочтительно представляет собой метоксигруппу, этоксигруппу, изопропоксигруппу или н-бутоксигруппу, и еще более предпочтительно метоксигруппу.
Применительно к «заместителю(ям)» в «C1-C6алкоксигруппе, которая может содержать один или несколько заместителей», представленной R2 или R3, их примеры включают в себя заместители, такие как описанные выше; тем не менее, предпочтительно если C1-C6алкоксигруппа является незамещенной.
«C1-C6алкоксигруппа, которая может содержать один или несколько заместителей», представленная R2 или R3, предпочтительно представляет собой C1-C6алкоксигруппу; более предпочтительно C1-C4алкоксигруппу; еще более предпочтительно метоксигруппу, этоксигруппу, изопропоксигруппу или н-бутоксигруппе; и еще более предпочтительно метоксигруппу.
[0059]
В общей формуле (I), «C3-C7циклоалкильная группа» в «C3-C7циклоалкильной группе, которая может содержать один или несколько заместителей», представленной R2 или R3, предпочтительно представляет собой C3-C6 циклоалкильную группу, и более предпочтительно циклопропильную группу, циклобутильную группу, циклопентильную группу или циклогексильную группу.
Применительно к «заместителю(ям)» в «C3-C7циклоалкильной группе, которая может содержать один или несколько заместителей», представленной R2 или R3, их примеры включают в себя заместители, такие как описанные выше; тем не менее, предпочтительно если C3-C7циклоалкильная группа является незамещенной.
«C3-C7циклоалкильная группа, которая может содержать один или несколько заместителей», представленная R2 или R3, предпочтительно представляет собой C3-C6циклоалкильную группу, и более предпочтительно циклопропильную группу, циклобутильную группу, циклопентильную группу или циклогексильную группу.
[0060]
В общей формуле (I), «C6-C14ароматическая углеводородная группа» в «C6-C14ароматической углеводородной группе, которая может содержать один или несколько заместителей», представленной R2 или R3, предпочтительно представляет собой фенильную группу или нафтильную группа, и более предпочтительно фенильную группу.
Применительно к «заместителю(ям)» в «C6-C14ароматической углеводородной группе, которая может содержать один или несколько заместителей», представленной R2 или R3, предпочтительно, если C6-C14ароматическая углеводородная группа является незамещенной или содержит атом галогена. Более предпочтительно, если C6-C14ароматическая углеводородная группа является незамещенной, или содержит атом хлора или атом фтора. Если C6-C14ароматическая углеводородная группа содержит один или несколько заместителей, то число заместителей конкретно не ограничено; тем не менее, число заместителей составляет предпочтительно от 1 до 3.
«C6-C14ароматическая углеводородная группа, которая может содержать один или несколько заместителей», представленная R2 или R3, предпочтительно представляет собой фенильную группу или нафтильную группу, которая является незамещенной или может содержать один или несколько заместителей-атомов галогена, и более предпочтительно представляет собой фенильную группу, хлорфенильную группу, фторфенильную группу, дихлорфенильную группу или трихлорфенильную группу; еще более предпочтительно фенильную группу или хлорфенильную группу; и особенно предпочтительно фенильную группу или 4-хлорфенильную группу.
[0061]
В общей формуле (I), «4-10-членная моноциклическая или полициклическая ненасыщенная гетероциклическая группа, содержащая от 1 до 3 одинаковых или разных гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы» в «4-10-членной моноциклической или полициклической ненасыщенной гетероциклической группе, содержащей от 1 до 3 одинаковых или разных гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей», представленной R2 или R3, предпочтительно представляет собой 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом азота, атом кислорода и атом серы; более предпочтительно 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом серы; еще более предпочтительно тиенильную группу; и еще более предпочтительно 2-тиенильную группу.
Применительно к «заместителю(ям)» в «4-10-членной моноциклической или полициклической ненасыщенной гетероциклической группе, содержащей от 1 до 3 одинаковых или разных гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей», представленной R2 или R3, их примеры включают в себя заместители, такие как описанные выше; тем не менее, предпочтительно если ненасыщенная гетероциклическая группа является незамещенной.
«4-10-членная моноциклическая или полициклическая ненасыщенная гетероциклическая группа, содержащая от 1 до 3 одинаковых или разных гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей», представленная R2 или R3, предпочтительно представляет собой 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом азота, атом кислорода и атом серы; более предпочтительно 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую один атом серы; еще более предпочтительно тиенильную группу; и еще более предпочтительно 2-тиенильную группу.
[0062]
В общей формуле (I), «C1-C6алкильная группа» в «C1-C6алкильной группе, которая может содержать один или несколько заместителей», представленной R4, R5 или R6, предпочтительно представляет собой C1-C4алкильную группу; более предпочтительно метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу или трет-бутильную группу; и еще более предпочтительно метильную группу.
Применительно к «заместителю(ям)» в «C1-C6алкильной группе, которая может содержать один или несколько заместителей», представленной R4, R5 или R6, предпочтительно если C1-C6алкильная группа является незамещенной, или содержит аминогруппу, замещенную двумя C1-C4алкильными группами (C1-C4алкильные группы также могут формировать вместе с атомом азота, к которому присоединены указанные алкильные группы, гетероциклоалкильную группу, содержащую 4-8-членное кольцо). Более предпочтительно, если C1-C6алкильная группа является незамещенной, или содержит диметиламиногруппу, метилэтиламиногруппу, диэтиламиногруппу, метилизопропиламиногруппу, 1-пиперидинильную группу или 1-пирролидинильную группу. Если «C1-C6алкильная группа, которая может содержать один или несколько заместителей» содержит один или несколько заместителей, то число заместителей конкретно не ограничено; тем не менее, число заместителей предпочтительно составляет 1.
«C1-C6алкильная группа, которая может содержать один или несколько заместителей», представленная R4, R5 или R6, предпочтительно представляет собой C1-C4алкильную группу или C1-C4алкильную группу, которая замещена аминогруппой, замещенной двумя C1-C4алкильными группами (C1-C4алкильные группы также могут формировать вместе с атомом азота, к которому присоединены указанные алкильные группы, гетероциклоалкильную группу, содержащую 4-8-членное кольцо). Более предпочтительные ее примеры включают в себя метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, диметиламинометильную группу, метилэтиламинометильную группу, диэтиламинометильную группу, метилизопропиламинометильную группу, диметиламиноэтильную группу, диэтиламиноэтильную группу, 1-пиперидинилметильную группу и 1-пирролидинилметильную группу.
[0063]
В общей формуле (I), «C1-C6алкильная группа» в «C1-C6алкильной группе, которая может содержать один или несколько заместителей», представленной R7, предпочтительно представляет собой C1-C4алкильную группу; более предпочтительно метильную группу, этильную группу, н-пропильную группу, изопропильную группу или н-бутильную группу; и еще более предпочтительно метильную группу.
Применительно к «заместителю(ям)» в «C1-C6алкильной группе, которая может содержать один или несколько заместителей», представленной R7, их примеры включают в себя заместители, такие как описанные выше; тем не менее, предпочтительно если C1-C6алкильная группа является незамещенной.
«C1-C6алкильная группа, которая может содержать один или несколько заместителей», представленная R7, предпочтительно представляет собой C1-C4алкильную группу; более предпочтительно метильную группу, этильную группу, н-пропильную группу, изопропильную группу или н-бутильную группу; и еще более предпочтительно метильную группу.
[0064]
В общей формуле (I), -C(R4)=C(R5)(R6) или -C≡C-R7, представленные Y, особенно предпочтительно представляет собой любой фрагмент, выбранный из группы, состоящей из:
[0065]
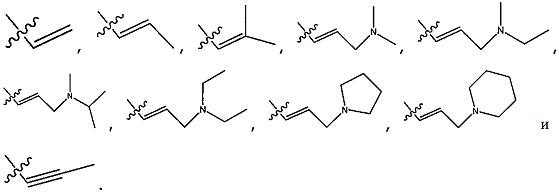
[0066]
[0067]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), предпочтительным является соединение или его соль, в котором:
X представляет собой азотсодержащий C3-C10гетероциклоалкилен;
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
каждый W и Z независимо представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
каждый R2 и R3, которые могут быть одинаковыми или разными, представляет собой атом водорода, атом галогена, C1-C6алкильную группу, которая может содержать один или несколько заместителей, C1-C6алкоксигруппу, которая может содержать один или несколько заместителей, C3-C7циклоалкильную группу, которая может содержать один или несколько заместителей, C6-C14ароматическую углеводородную группу, которая может содержать один или несколько заместителей, 4-10-членную моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую от 1 до 3 гетероатомов одного вида или разных видов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей, или цианогруппу; и
каждый R4, R5, R6 и R7, которые могут быть одинаковыми или разными, представляет собой атом водорода или C1-C6алкильную группу, которая может содержать один или несколько заместителей.
[0068]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), предпочтительным является соединение или его соль, в котором:
X представляет собой азотсодержащий C3-C10гетероциклоалкилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY);
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
каждый W и Z независимо представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
каждый R2 и R3, которые могут быть одинаковыми или разными, представляет собой атом водорода, атом галогена, C1-C6алкильную группу, которая может содержать один или несколько заместителей, C1-C6алкоксигруппу, которая может содержать один или несколько заместителей, C3-C7циклоалкильную группу, которая может содержать один или несколько заместителей, C6-C14ароматическую углеводородную группу, которая может содержать один или несколько заместителей, 4-10-членную моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую от 1 до 3 гетероатомов одного вида или разных видов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей, или цианогруппу; и
каждый R4, R5, R6 и R7, которые могут быть одинаковыми или разными, представляет собой атом водорода или C1-C6алкильную группу, которая может содержать один или несколько заместителей.
[0069]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой азетидинилен, пирролидинилен или пиперидинилен;
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
каждый W и Z независимо представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
каждый R2 и R3, которые могут быть одинаковыми или разными, представляет собой атом водорода, атом галогена, C1-C6алкильную группу, которая может содержать один или несколько заместителей, C1-C6алкоксигруппу, которая может содержать один или несколько заместителей, C3-C7циклоалкильную группу, которая может содержать один или несколько заместителей, C6-C14ароматическую углеводородную группу, которая может содержать один или несколько заместителей, 4-10-членную моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую от 1 до 3 гетероатомов одного вида или разных видов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей, или цианогруппу; и
каждый R4, R5, R6 и R7, которые могут быть одинаковыми или разными, представляет собой атом водорода или C1-C6алкильную группу, которая может содержать один или несколько заместителей.
[0070]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой азетидинилен, пирролидинилен или пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY);
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
каждый W и Z независимо представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
каждый R2 и R3, которые могут быть одинаковыми или разными, представляет собой атом водорода, атом галогена, C1-C6алкильную группу, которая может содержать один или несколько заместителей, C1-C6алкоксигруппу, которая может содержать один или несколько заместителей, C3-C7циклоалкильную группу, которая может содержать один или несколько заместителей, C6-C14ароматическую углеводородную группу, которая может содержать один или несколько заместителей, 4-10-членную моноциклическую или полициклическую ненасыщенную гетероциклическую группу, содержащую от 1 до 3 гетероатомов одного вида или разных видов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может содержать один или несколько заместителей, или цианогруппу; и
каждый R4, R5, R6 и R7, которые могут быть одинаковыми или разными, представляет собой атом водорода или C1-C6алкильную группу, которая может содержать один или несколько заместителей.
[0071]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой азетидинилен, пирролидинилен или пиперидинилен;
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
W и Z независимо представляют собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или C1-C6алкильную группу, а другой представляет собой атом водорода, атом галогена, C1-C6алкильную группу, галоген-замещенную C1-C6алкильную группу, C1-C4алкокси-замещенную C1-C6алкильную группу, C1-C6алкоксигруппу, фенильную группу, которая может быть замещена одним или несколькими атомами галогена, 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую атом серы, или цианогруппу; и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, C1-C6алкильную группу, или C1-C6алкильную группу, которая замещена аминогруппой, замещенной двумя C1-C6алкильными группами (C1-C6алкильные группы могут формировать вместе с атомом азота, к которому присоединены указанные алкильные группы, гетероциклоалкильную группу, содержащую 4-8-членное кольцо);
если Y представляет собой -C≡C-R7,
то R7 представляет собой атом водорода или C1-C6алкильную группу.
[0072]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой азетидинилен, пирролидинилен или пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY);
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
W и Z независимо представляют собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или C1-C6алкильную группу, а другой представляет собой атом водорода, атом галогена, C1-C6алкильную группу, галоген-замещенную C1-C6алкильную группу, C1-C4алкокси-замещенную C1-C6алкильную группу, C1-C6алкоксигруппу, фенильную группу, которая может быть замещена одним или несколькими атомами галогена, 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую атом серы, или цианогруппу; и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, C1-C6алкильную группу, или C1-C6алкильную группу, которая замещена аминогруппой, замещенной двумя C1-C6алкильными группами (C1-C6алкильные группы могут формировать вместе с атомом азота, к которому присоединены указанные алкильные группы, гетероциклоалкильную группу, содержащую 4-8-членное кольцо);
если Y представляет собой -C≡C-R7,
то R7 представляет собой атом водорода или C1-C6алкильную группу.
[0073]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-азетидинилен, 1,3-пирролидинилен или 1,3-пиперидинилен;
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
если Z представляет собой N, то W представляет собой N, и если Z представляет собой CH, то W представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или C1-C4алкильную группу, а другой представляет собой атом водорода, атом галогена, C1-C4алкильную группу, галоген-замещенную C1-C4алкильную группу, C1-C4алкокси-замещенную C1-C4алкильную группу, C1-C4алкоксигруппу, фенильную группу, которая может быть замещена одним или несколькими атомами галогена, 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую атом серы, или цианогруппу; и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, C1-C6алкильную группу, или C1-C6алкильную группу, которая замещена аминогруппой, замещенной двумя C1-C6алкильными группами (C1-C6алкильные группы могут формировать вместе с атомом азота, к которому присоединены указанные алкильные группы, гетероциклоалкильную группу, содержащую 4-8-членное кольцо);
если Y представляет собой -C≡C-R7,
то R7 представляет собой атом водорода или C1-C4алкильную группу.
[0074]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-азетидинилен, 1,3-пирролидинилен или 1,3-пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY);
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
если Z представляет собой N, то W представляет собой N, и если Z представляет собой CH, то W представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или C1-C4алкильную группу, а другой представляет собой атом водорода, атом галогена, C1-C4алкильную группу, галоген-замещенную C1-C4алкильную группу, C1-C4алкокси-замещенную C1-C4алкильную группу, C1-C4алкоксигруппу, фенильную группу, которая может быть замещена одним или несколькими атомами галогена, 4-6-членную моноциклическую ненасыщенную гетероциклическую группу, содержащую атом серы, или цианогруппу; и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, C1-C6алкильную группу, или C1-C6алкильную группу, которая замещена аминогруппой, замещенной двумя C1-C6алкильными группами (C1-C6алкильные группы могут формировать вместе с атомом азота, к которому присоединены указанные алкильные группы, гетероциклоалкильную группу, содержащую 4-8-членное кольцо);
если Y представляет собой -C≡C-R7,
то R7 представляет собой атом водорода или C1-C4алкильную группу.
[0075]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-азетидинилен, 1,3-пирролидинилен или 1,3-пиперидинилен;
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
если Z представляет собой N, то W представляет собой N, и если Z представляет собой CH, то W представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или метильную группу, а другой представляет собой атом водорода, атом галогена, метильную группу, трифторметильную группу, метоксиэтильную группу, метоксигруппу, фенильную группу, 4-хлорфенильную группу, 2-тиенильную группу или цианогруппу; и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, метильную группу, диметиламинометильную группу, метилэтиламинометильную группу, диэтиламинометильную группу, метилизопропиламинометильную группу, 1-пиперидинилметильную группу или 1-пирролидинилметильную группу;
если Y представляет собой -C≡C-R7,
то R7 представляет собой метильную группу.
[0076]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-азетидинилен, 1,3-пирролидинилен или 1,3-пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY);
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-R7;
если Z представляет собой N, то W представляет собой N, и если Z представляет собой CH, то W представляет собой N или CH;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или метильную группу, а другой представляет собой атом водорода, атом галогена, метильную группу, трифторметильную группу, метоксиэтильную группу, метоксигруппу, фенильную группу, 4-хлорфенильную группу, 2-тиенильную группу или цианогруппу; и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, метильную группу, диметиламинометильную группу, метилэтиламинометильную группу, диэтиламинометильную группу, метилизопропиламинометильную группу, 1-пиперидинилметильную группу или 1-пирролидинилметильную группу;
если Y представляет собой -C≡C-R7,
то R7 представляет собой метильную группу.
[0077]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
(1) если Z представляет собой N, и W представляет собой N,
то X представляет собой 1,3-пиперидинилен, и
Y представляет собой винильную группу;
(2) если Z представляет собой CH, и W представляет собой N,
то X представляет собой 1,3-пирролидинилен или 1,3-пиперидинилен,
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-(R7), и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, метильную группу, диметиламинометильную группу, метилэтиламинометильную группу, диэтиламинометильную группу, метилизопропиламинометильную группу, 1-пиперидинилметильную группу или 1-пирролидинилметильную группу,
если Y представляет собой -C≡C-(R7),
то R7 представляет собой метильную группу; и
(3) если Z представляет собой CH, и W представляет собой CH,
то X представляет собой 1,3-азетидинилен или 1,3-пирролидинилен,
Y представляет собой -C(R4)=C(R5)(R6), и
каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, диметиламинометильную группу, метилэтиламинометильную группу, диэтиламинометильную группу, метилизопропиламинометильную группу, 1-пиперидинилметильную группу или 1-пирролидинилметильную группу;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или метильную группу, а другой представляет собой атом водорода, атом галогена, трифторметильную группу, метоксиэтильную группу, фенильную группу, 2-тиенильную группу или цианогруппу.
[0078]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
(1) если Z представляет собой N, и W представляет собой N,
то X представляет собой 1,3-пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY), и
Y представляет собой винильную группу;
(2) если Z представляет собой CH, и W представляет собой N,
то X представляет собой 1,3-пирролидинилен или 1,3-пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY),
Y представляет собой -C(R4)=C(R5)(R6) или -C≡C-(R7), и
если Y представляет собой -C(R4)=C(R5)(R6),
то каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, метильную группу, диметиламинометильную группу, метилэтиламинометильную группу, диэтиламинометильную группу, метилизопропиламинометильную группу, 1-пиперидинилметильную группу или 1-пирролидинилметильную группу,
если Y представляет собой -C≡C-(R7),
то R7 представляет собой метильную группу; и
(3) если Z представляет собой CH, и W представляет собой CH,
то X представляет собой 1,3-азетидинилен или 1,3-пирролидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY),
Y представляет собой -C(R4)=C(R5)(R6), и
каждый R4, R5 и R6, которые могут быть одинаковыми или разными, представляет собой атом водорода, диметиламинометильную группу, метилэтиламинометильную группу, диэтиламинометильную группу, метилизопропиламинометильную группу, 1-пиперидинилметильную группу или 1-пирролидинилметильную группу;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода или метильную группу, а другой представляет собой атом водорода, атом галогена, трифторметильную группу, метоксиэтильную группу, фенильную группу, 2-тиенильную группу или цианогруппу.
[0079]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-пиперидинилен;
Y представляет собой винильную группу;
Z представляет собой CH;
W представляет собой N;
n равен 0;
R1 представляет собой аминогруппу;
любой из R2 и R3 представляет собой атом водорода, а другой представляет собой атом водорода, атом галогена или цианогруппу.
[0080]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), более предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY);
Y представляет собой винильную группу;
Z представляет собой CH;
W представляет собой N;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода, а другой представляет собой атом водорода, атом галогена или цианогруппу.
[0081]
Применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), особенно предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-пиперидинилен;
Y представляет собой винильную группу;
Z представляет собой CH;
W представляет собой N;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода, а другой представляет собой атом водорода или атом галогена.
[0082]
В этом случае, применительно к соединению согласно настоящему изобретению, представленному общей формулой (I), особенно предпочтительным является соединение или его соль, в котором:
X представляет собой 1,3-пиперидинилен (здесь, в общей формуле (I) атом азота связан с карбонильной группой -COY);
Y представляет собой винильную группу;
Z представляет собой CH;
W представляет собой N;
n равен 0;
R1 представляет собой аминогруппу;
один из R2 и R3 представляет собой атом водорода, а другой представляет собой атом водорода или атом галогена.
[0083]
Конкретные примеры соединения согласно настоящему изобретению включают в себя соединения, полученные в представленных ниже примерах; тем не менее, соединение согласно настоящему изобретению не ограничивается указанными соединениями.
Подходящие примеры соединения согласно настоящему изобретению включают в себя следующие соединения:
(1) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 1)
(2) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-бромбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 2)
(3) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-(тиофен-2-ил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 3)
(4) (R)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-метакрилоилпиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 4)
(5) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 5)
(6) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-цианобензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 6)
(7) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-метоксибензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 7)
(8) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-(2-метоксиэтил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 8)
(9) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(оксазоло[4,5-b]пиридин-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 9)
(10) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(4-метилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 10)
(11) (R)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1-(1-метакрилоилпиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 11)
(12) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 12)
(13) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 13)
(14) (R,E)-4-амино-N-(бензо[d]оксазол-2-ил)-1-(1-(бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 14)
(15) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 15)
(16) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(этил(метил)амино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 16)
(17) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диэтиламино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 17)
[0084]
(18) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(изопропил(метил)амино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 18)
(19) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пирролидин-1-ил)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 19)
(20) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пиперидин-1-ил)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 20)
(21) (R,E)-4-амино-N-(5-(тиофен-2-ил)бензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 21)
(22) (R)-4-амино-N-(бензо[d]оксазол-2-ил)-1-(1-(бут-2-иноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 22)
(23) (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5,6-диметилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 23)
(24) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 24)
(25) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 25)
(26) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(3-метилбут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 26)
(27) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 27)
(28) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(тиофен-2-ил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 28)
(29) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-метилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 29)
(30) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 30)
(31) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(4-хлорфенил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 31)
(32) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 32)
(33) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(этил(метил)амино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 33)
(34) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диэтиламино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 34)
(35) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(изопропил(метил)амино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 35)
(36) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пирролидин-1-ил)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 36)
(37) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пиперидин-1-ил)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 37)
(38) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-метоксибензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 38)
(39) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-цианобензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 39)
(40) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(2-метоксиэтил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 40)
[0085]
(41) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 41)
(42) (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 42)
(43) (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(трифторметил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 43)
(44) (R,E)-4-амино-N-(5-(трифторметил)бензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 44)
(45) 1-(1-акрилоилазетидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 45)
(46) 7-(1-акрилоилазетидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 46)
(47) (E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(диметиламино)бут-2-еноил)азетидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 47)
(48) (R)-7-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 48)
(49) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 49)
(50) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(этил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 50)
(51) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(диэтиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 51)
(52) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(изопропил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 52)
(53) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(пирролидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 53)
(54) (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(пиперидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 54)
(55) (R)-7-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 55)
(56) (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 56)
[0086]
(57) (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(этил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 57)
(58) (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(диэтиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 58)
(59) (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(изопропил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 59)
(60) (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(пирролидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 60)
(61) (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(пиперидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамид (типовое соединение 61)
[0087]
Далее, разъяснен способ получения соединения согласно настоящему изобретению.
Соединение (I) согласно настоящему изобретению может быть получено, например, посредством способа получения, описанного ниже, или посредством способа, описанного в разделе «Примеры». Тем не менее, предполагается, что способ получения соединения (I) согласно настоящему изобретению не ограничивается приведенными примерами реакций.
[0088]
Способ получения 1
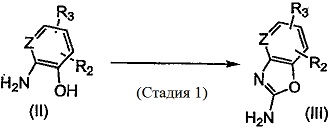
[0089]
где Z, R2 и R3 соответственно характеризуются теми же значениями, что и описанные выше.
[0090]
(Стадия 1) Данная стадия представляет собой методику синтеза бензоксазолового соединения, представленного общей формулой (III), из аминофенола, представленного общей формулой (II). Соединение, представленное общей формулой (II), может представлять собой коммерчески доступный продукт, или может быть получено в соответствии с известным способом.
Примеры используемого реагента включают в себя цианосоединения, такие как бромциан, хлорциан, йодциан, и 1,1-карбонимидоилбис-1H-имидазол. Реакцию проводят путем использования от 0,5 до 5 молей, и предпочтительно от 0,9 до 1,5 молей, цианосоединения относительно 1 моля соединения, представленного общей формулой (II). В то же время, что касается соответствующего цианосоединения, то может быть использован коммерчески доступный продукт, или цианосоединение может быть получено в соответствии с известным способом. Используемый в реакции растворитель может представлять собой любой растворитель при условии, что он не оказывает отрицательное влияние на реакцию, и используют, например, спирты (например, метанол и этанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлористый метилен, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду или их смеси. Продолжительность реакции может составлять от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции может составлять от 0°C до 120°C, и предпочтительно от 0°C до 90°C.
Соединение, представленное общей формулой (III), которое может быть получено в указанном виде, выделяют и очищают посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии, или может быть перенесено на следующую стадию без разделения и очистки.
[0091]
Способ получения 2
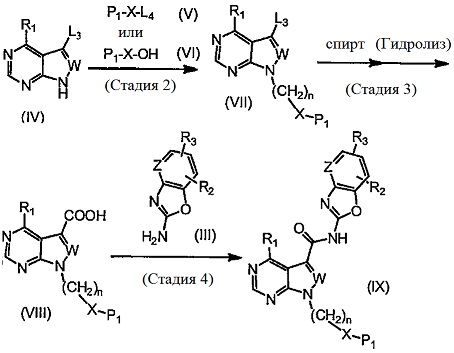
[0092]
где каждый L3 и L4 представляет собой уходящую группу; P1 представляет собой защитную группу аминогруппы в составе X; и W, X, Y, Z, R1, R2, R3 и n соответственно характеризуются теми же значениями, что и описанные выше.
[0093]
(Стадия 2) Данная стадия представляет собой методику получения соединения, представленного общей формулой (VII), путем использования соединения, представленного общей формулой (IV), и соединения, представленного общей формулой (V) или общей формулой (VI). Соединение, представленное общей формулой (IV), может представлять собой коммерчески доступный продукт, или может быть получено в соответствии с известным способом.
Если соединение, представленное общей формулой (V), используют в качестве алкилирующего реагента, то соединение, представленное общей формулой (VII), может быть получено в присутствии основания. В общей формуле (V), L4 представляет собой уходящую группу, например, атом хлора, атом брома, атом йода, сложный эфир метансульфоновой кислоты или сложный эфир пара-толуолсульфоновой кислоты, и может быть использован коммерчески доступный продукт, или соединение может быть получено в соответствии с известным способом. Соединение, представленное общей формулой (V), может быть использовано в количестве от 1 до 10 молей, и предпочтительно от 1 до 5 молей, относительно 1 моля соединения, представленного общей формулой (IV).
Примеры основания включают в себя неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид цезия, гидрид натрия и гидрид калия; и органические амины, такие как триметиламин, триэтиламин, трипропиламин, диизопропилэтиламин, N-метилморфолин, пиридин, 4-(N,N-диметиламино)пиридин, лутидин и коллидин. Применительно к количеству используемого основания, основание может быть использовано в количестве от 1 до 100 молей, и предпочтительно от 2 до 10 молей, относительно 1 моля соединения, представленного общей формулой (IV).
В качестве растворителей могут быть использованы, например, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, тетрагидрофуран, 1,4-диоксан, N-метилпирролидин-2-он и ацетонитрил, по отдельности или в виде смесей. Продолжительность реакции может составлять от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции может составлять от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
[0094]
Если соединение обшей формулы (VI) используют в качестве алкилирующего реагента, то соединение, представленное общей формулой (VII), может быть получено путем использования реакции Мицунобу. Обычно, эта реакция может проводиться в соответствии с известным способом (например, Chemical Reviews, Vol. 109, p. 2551, 2009), и, например, реакцию проводят в присутствии реагента Мицунобу и фосфинового реагента в растворителе, который не оказывает отрицательного влияния на реакцию. Данную реакцию обычно проводят путем использования соединения, представленного общей формулой (VI), в количестве от 1 до 10 молей, и предпочтительно от 1 до 5 молей, относительно 1 моля соединения, представленного общей формулой (IV).
Примеры реагента Мицунобу включают в себя диэтилазодикарбоксилат и диизопропилазодикарбоксилат. Применительно к используемому количеству реагента Мицунобу, то реакцию проводят путем использования реагента в количестве от 1 до 10 молей, и предпочтительно от 1 до 5 молей, относительно 1 моля соединения, представленного общей формулой (IV).
Примеры фосфинового реагента включают в себя трифенилфосфин и трибутилфосфин. Применительно к фосфиновому реагенту, реакцию проводят путем использования реагента в количестве от 1 до 10 молей, и предпочтительно от 1 до 5 молей, относительно 1 моля соединения, представленного общей формулой (IV).
Реакционный растворитель конкретно не ограничен при условии, что реакционный растворитель не прерывает реакцию; при этом подходящими являются, например, толуол, бензол, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид или смешанные из них растворители.
Температура реакции обычно может составлять от -78°C до 200°C, и предпочтительно от 0°C до 50°C. Продолжительность реакции обычно может составлять от 5 минут до 3 суток, и предпочтительно от 10 минут до 10 часов.
Соединение, представленное общей формулой (VII), которое может быть получено в указанном виде, выделяют и очищают посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии, или подвергают последующей реакции без разделения и очистки.
[0095]
(Стадия 3) Данная стадия представляет собой методику получения соединения, представленного общей формулой (VIII), путем осуществления взаимодействия соединения, представленного общей формулой (VII), например, с металлом переходной валентности и необязательно с основанием, в атмосфере монооксида углерода в присутствии спирта, в растворителе, который не оказывает отрицательного влияния на реакцию.
В общей формуле (VII), уходящая группа, представленная L3, представляет собой атом брома или атом йода, и применительно к соответствующему соединению, может использоваться коммерчески доступный продукт, или соединение может быть получено в соответствии с известным способом.
В данной реакции, давление монооксида углерода обычно может составлять от 1 до 10 атмосфер, и предпочтительно от 1 до 5 атмосфер. Применительно к используемому количеству спирта, соединение может быть использовано в количестве от 1 до 10 молей, и предпочтительно от 1 до 5 молей, относительно 1 моля соединения, представленного общей формулой (VII). Примеры спирта включают в себя метанол, этанол, пропанол, изопропиловый спирт, диэтиламиноэтанол, изобутанол, 4-(2-гидроксиэтил)морфолин, 3-морфолинопропанол и диэтиламинопроанол.
Катализатор на основе металла переходной валентности, который может быть использован в настоящей реакции, представляет собой, например, палладиевый катализатор (например, ацетат палладия, трис(дибензилиденацетон)дипалладий, дихлорид бис(трифенилфосфин)палладия(II) или комплекс дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана), и при необходимости к нему добавляют лиганд (например, трифенилфосфин, xantphos или три-трет-бутилфосфин). Используемое количество катализатора на основе металла переходной валентности может варьировать в зависимости от типа катализатора; тем не менее, используемое количество обычно может составлять 0,0001 до 1 моля, и предпочтительно от 0,001 до 0,5 моля, относительно 1 моля соединения, представленного общей формулой (VII). Используемое количество лиганда обычно может составлять 0,0001 до 4 молей, и предпочтительно от 0,01 до 2 молей, относительно 1 моля соединения, представленного общей формулой (VII).
[0096]
Кроме того, при необходимости, к реакционной смеси может быть добавлено основание. Примеры основания включают в себя органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, N-метилморфолин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Используемое количество основания обычно может составлять от 0,1 до 50 молей, и предпочтительно от 1 до 20 молей, относительно 1 моля соединения, представленного общей формулой (VII).
Реакционный растворитель конкретно не ограничен при условии, что реакционный растворитель не прерывает реакцию, и его примеры включают в себя углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду или их смеси. Продолжительность реакции может составлять от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции может составлять от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 150°C.
После этой реакции, по причине получения смеси карбоновой кислоты (VIII) и сложноэфирной формы, соответствующей используемому спирту, для преобразования смеси до соединения, представленного общей формулой (VIII), проводят реакцию гидролиза. Гидролиз проводят путем использования основания, и его примеры включают в себя органические основания, такие как диэтиламин, диизопропиламин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия и гидроксид натрия.
[0097]
Реакционный растворитель конкретно не ограничен при условии, что реакционный растворитель не прерывает реакцию, и его примеры включают в себя углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду или их смеси. Продолжительность реакции может составлять от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции может составлять от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 150°C.
Соединение, представленное общей формулой (VIII) которое может быть получено в указанном виде, выделяют и очищают посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии, или подвергают последующей реакции без разделения и очистки.
[0098]
(Стадия 4) Данная стадия представляет собой методику получения соединения, представленного общей формулой (IX), посредством проведения реакции амидирования путем использования соединений, представленных общей формулой (VIII) и общей формулой (III).
Реакция может проводиться путем использования соединения общей формулы (III) в количестве от 0,5 до 10 молей, и предпочтительно от 1 to 3 моль, относительно 1 моля соединения, представленного общей формулой (VIII), в присутствии соответствующего конденсирующего агента или активатора в качестве реагента амидирования.
Реакционный растворитель конкретно не ограничен при условии, что реакционный растворитель не прерывает реакцию, и подходящими являются, например, изопропанол, трет-бутиловый спирт, толуол, бензол, хлористый метилен, хлороформ, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид или их смеси. Температура реакции обычно может составлять от -78°C до 200°C, и предпочтительно от 0°C до 50°C. Продолжительность реакции обычно может составлять от 5 минут до 3 суток, и предпочтительно от 5 минут до 10 часов.
Примеры конденсирующего агента и активатора включают в себя азид дифенилфосфорной кислоты, N,N'-дициклогексилкарбодиимид, соль бензотриазол-1-илокси-трисдиметиламинофосфония, 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид, 1-этил-3-(3-диметиламинопропил)карбодиимид, сочетание 1-этил-3-(3-диметиламинопропил)карбодиимида и 1-гидроксибензотриазола, 2-хлор-1,3-диметилимидазолиния хлорид, O-(7-азабензотриазо-1-ил)-N,N,N',N'-тетраметилгексаурония гексафторфосфат, 1,1-карбонилдиимидазол и имид N-гидроксиянтарной кислоты.
[0099]
Кроме того, применительно к описанной выше реакции, при необходимости, может быть добавлено основание. Примеры основания включают в себя органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, диазабициклоундецен, диазабициклононен и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Его добавляемое количество может составлять от 1 до 100 молей, и предпочтительно от 1 до 10 молей, относительно 1 моля соединения, представленного общей формулой (VIII).
Соединение, представленное общей формулой (IX) которое может быть получено в указанном виде, выделяют и очищают посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии, или без разделения и очистки может быть использовано при получении соединения (I) согласно настоящему изобретению.
[0100]
Способ получения 3
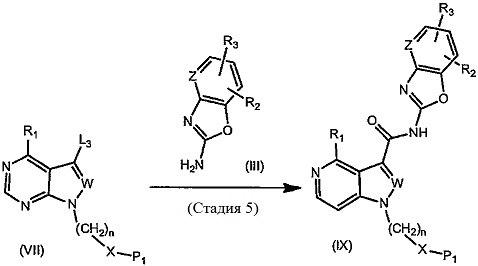
[0101]
где L3 представляет собой уходящую группу; и W, X, Y, Z, P1, R1, R2, R3 и n соответственно характеризуются теми же значениями, что и описанные выше.
[0102]
(Стадия 5) Данная стадия представляет собой методику получения соединения, представленного общей формулой (IX), путем осуществления взаимодействия соединения, представленного общей формулой (VII), например, с металлом переходной валентности и необязательно основанием в атмосфере монооксида углерода в присутствии соединения (III) в растворителе, который не оказывает отрицательного влияния на реакцию.
В общей формуле (VII), уходящая группа, представленная L3, представляет собой атом брома или атом йода, и может быть использован коммерчески доступный продукт, или соответствующее соединение может быть получено в соответствии с известным способом.
В данной реакции, давление монооксида углерода может составлять от 1 до 10 атмосфер, и предпочтительно от 1 до 5 атмосфер.
Катализатор на основе металла переходной валентности, который может быть использован в настоящей реакции, представляет собой, например, палладиевый катализатор (например, ацетат палладия, трис(дибензилиденацетон)дипалладий, дихлорид бис(трифенилфосфин)палладия(II) и комплекс дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана), и при необходимости к нему добавляют лиганд (например, трифенилфосфин, xantphos или три-трет-бутилфосфин). Используемое количество катализатора на основе металла переходной валентности может варьировать в зависимости от типа катализатора; тем не менее, используемое количество обычно может составлять 0,0001 до 1 моля, и предпочтительно от 0,001 до 0,5 моля, относительно 1 моля соединения, представленного общей формулой (IX). Используемое количество лиганда обычно может составлять 0,0001 до 4 молей, и предпочтительно от 0,01 до 2 молей, относительно 1 моля соединения, представленного общей формулой (VII).
Кроме того, применительно к описанной выше реакциям, при необходимости, может быть добавлено основание. Примеры основания включают в себя органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, N-метилморфолин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Используемое количество обычно составляет от 0,1 до 50 молей, и предпочтительно от 1 до 20 молей, относительно 1 моля соединения, представленного общей формулой (VII).
[0103]
Реакционный растворитель конкретно не ограничен при условии, что реакционный растворитель не прерывает реакцию, и его примеры включают в себя углеводороды (например, бензол, толуол и ксилол), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан, тетрагидрофуран и 1,4-диоксан), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид и гексаметилфосфорамид), воду или их смеси. Продолжительность реакции может составлять от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции может составлять от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 150°C.
Соединение, представленное общей формулой (IX), которое может быть получено в указанном виде, выделяют и очищают посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии, или без разделения и очистки может быть использовано при получении соединения (I) согласно настоящему изобретению.
[0104]
Способ получения 4
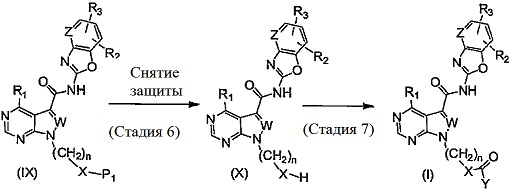
[0105]
где P1, W, X, Y, Z, R1, R2, R3 и n соответственно характеризуются теми же значениями, что и описанные выше.
[0106]
(Стадия 6) Данная стадия представляет собой методику получения соединения, представленного общей формулой (X), путем снятия защиты аминогруппы соединения, представленного общей формулой (IX). Способ снятия защиты может обычно может осуществляться известным способом, например, способом, описанным в Protective Groups in Organic Synthesis, T.W. Greene, John Wiley & sons (1981), или эквивалентным ему способом. Пример защитной группы представляет собой трет-бутилоксикарбонил. Если в качестве защитной группы используют трет-бутилоксикарбонильную группу, то предпочтительно снятие защиты в кислых условиях, и примеры кислоты включают в себя соляную кислоту, уксусную кислоту, трифторуксусную кислоту, серную кислоту, метансульфоновую кислоту и пара-толуолсульфоновую кислоту. В качестве альтернативы, также предпочтительно снятие защиты кислотой Льюиса, и ее примеры включают в себя триметилсилилйод и комплекс трифторида бора и диэтилового эфира. Используемое количество кислоты может составлять предпочтительно от 1 до 100 молей относительно 1 моля соединения (IX).
Используемый в реакции растворитель может представлять собой любой растворитель при условии, что он не оказывает отрицательное влияние на реакцию, и используют, например, спирты (например, метанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлористый метилен, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид), или их смеси. Продолжительность реакции может составлять от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции может составлять от 0°C до 120°C, и предпочтительно от 0°C до 90°C.
Соединение, представленное общей формулой (X) которое может быть получено в указанном виде, выделяют и очищают посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии, или без разделения и очистки может быть использовано в последующей реакции.
[0107]
(Стадия 7) Данная стадия представляет собой методику получения соединения согласно настоящему изобретению, представленного общей формулой (I), путем осуществления реакции амидирования между соединением, представленным общей формулой (X), и карбоновой кислотой, представленной формулой Y-COOH, или галогенангидридом, представленным формулой Y-C(=O)-L (где L представляет собой атом хлора или атом брома).
Если в качестве реагента амидирования используют карбоновую кислоту, представленную Y-COOH, то реакцию амидирования проводят путем использования от 0,5 до 10 молей, и предпочтительно от 1 до 3 молей, карбоновой кислоты относительно 1 моля соединения, представленного общей формулой (X), в присутствии соответствующего конденсирующего агента. Между тем, применительно к карбоновой кислоте, может использоваться коммерчески доступный продукт, или карбоновая кислота может быть получена в соответствии с известным способом.
Реакционный растворитель конкретно не ограничен при условии, что реакционный растворитель не прерывает реакцию, и подходящими являются, например, изопропанол, трет-бутиловый спирт, толуол, бензол, хлористый метилен, хлороформ, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, диметилсульфоксид, или их смеси. Температура реакции обычно составляет от -78°C до 200°C, и предпочтительно от 0°C до 50°C. Продолжительность реакции обычно составляет от 5 минут до 3 суток, и предпочтительно от 5 минут до 10 часов.
Примеры конденсирующего агента включают в себя азид дифенилфосфорной кислоты, N,N'-дициклогексилкарбодиимид, соль бензотриазол-1-илокситрисдиметиламинофосфония, 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид, 1-этил-3-(3-диметиламинопропил)карбодиимид, сочетание 1-этил-3-(3-диметиламинопропил)карбодиимида и 1-гидроксибензотриазола, 2-хлор-1,3-диметилимидазолиния хлорид и O-(7-азабензотриазо-1-ил)-N,N,N',N'-тетраметилгексаурония гексафторфосфат.
Кроме того, в зависимости от реакции, при необходимости к реакционной смеси может быть добавлено основание. Примеры основания включают в себя органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Его добавляемое количество может составлять от 1 до 100 молей, и предпочтительно от 1 до 10 молей, относительно 1 моля соединения, представленного общей формулой (X).
[0108]
Если в качестве реагента амидирования используют галогенангидрид, представленный формулой Y-C(=O)-L (where L представляет собой атом хлора или атом брома), то реакцию проводят путем использования от 0,5 до 5 молей, и предпочтительно от 0,9 до 1,1 моля, галогенангидрида относительно 1 моля соединения, представленного общей формулой (X). Между тем, применительно к соостветствующему галогенангидриду, может использоваться коммерчески доступный продукт, или галогенангидрид может быть получен в соответствии с известным способом.
Реакционный растворитель конкретно не ограничен при условии, что реакционный растворитель не прерывает реакцию, и подходящими являются, например, вода, толуол, бензол, хлористый метилен, хлороформ, тетрагидрофуран, ацетонитрил, 1,4-диоксан, диметилформамид, диметилацетамид, N-метилпирролидинон, или их смеси. Температура реакции обычно может составлять от -78°C до 200°C, и предпочтительно от -20°C до 50°C. Продолжительность реакции обычно может составлять от 5 минут до 3 суток, и предпочтительно от 5 минут до 10 часов.
Кроме того, в зависимости от реакции, при необходимости к реакционной смеси может быть добавлено основание. Примеры основания включают в себя органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, лутидин, коллидин, 4-диметиламинопиридин, трет-бутират калия, трет-бутират натрия, метоксид натрия, этоксид натрия, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия, и бутиллитий; и неорганические основания, такие как гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия и гидрид натрия. Применительно к добавляемому количеству, основание может быть использовано в количестве от 1 до 100 молей, и предпочтительно от 1 до 10 молей, относительно 1 моля соединения, представленного общей формулой (X).
Соединение, представленное общей формулой (I), которое может быть получено в указанном виде, выделяют и очищают посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии.
[0109]
Способ получения 5
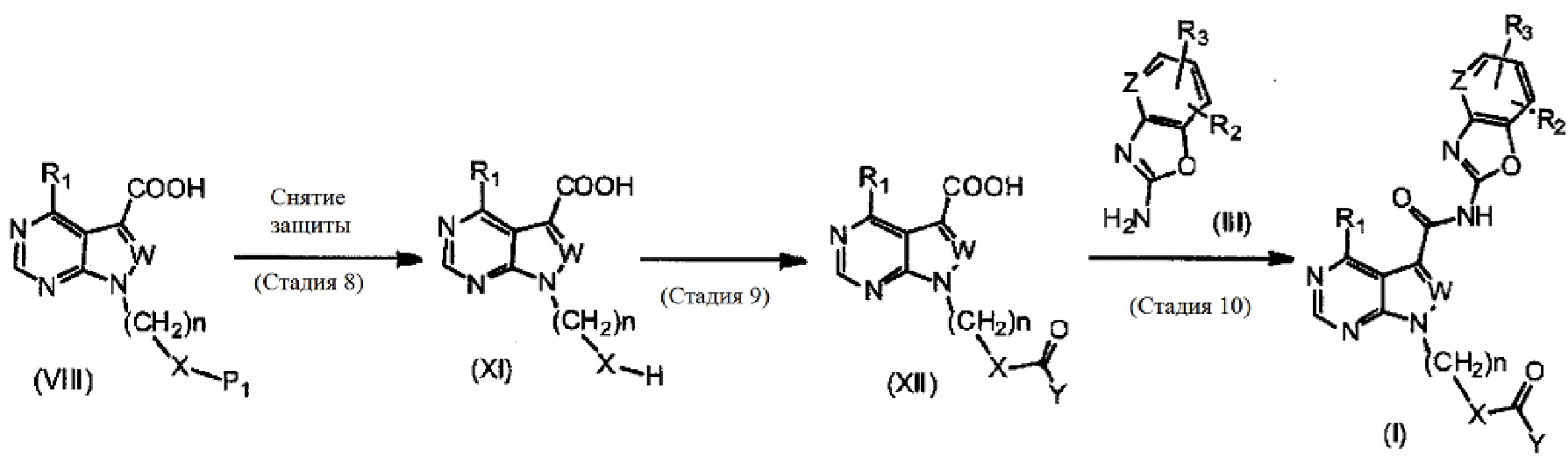
[0110]
где P1, W, X, Y, Z, R1, R2, R3 и n соответственно характеризуются теми же значениями, что и описанные выше.
[0111]
(Стадия 8 и Стадия 9)
Данные стадии представляют собой методики получения соединения, представленного общей формулой (XII), путем использования соединения, представленного общей формулой (VIII), в методиках, сходных с описанными в способе получения 4, стадии 6 и 7.
[0112]
(Стадия 10)
Данная стадия представляет собой методику получения соединения, представленного общей формулой (I), путем использования соединения, представленного общей формулой (XII), в методиках, сходных с описанными в способе получения 2, стадия 4.
Соединение, представленное общей формулой (I), которое может быть получено в указанном виде, может быть выделено и очищено посредством известных способов разделения и очистки, например, посредством концентрирования, концентрирования в условиях пониженного давления, кристаллизации, экстрагирования растворителем, переосаждения и хроматографии.
[0113]
Применительно к способам получения 1-5, для аминогруппы, иминогруппы, гидроксильной группы, карбоксильной группы, карбонильной группы, амидной группы и функциональной группы с активным протоном, такой как индол, в различных способах получения на соответствующих стадиях может использоваться защитный реагент, или в соответствии с общепринятым способом в соответствующую группу может быть введена защитная группа, а затем защитная группа может быть удалена.
Термин «защитная группа для аминогруппы или иминогруппы» конкретно не ограничен при условии, что группа сохраняет свою функциональность, и ее примеры включают в себя, например, аралкильные группы, такие как бензильная группа, пара-метоксибензильная группа, 3,4-диметоксибензильная группа, орто-нитробензильная группа, пара-нитробензильная группа, бензгидрильная группа, тритильная группа и кумильная группа; например, низшие алканоильные группы, такие как формильная группа, ацетильная группа, пропионильная группа, бутирильная группа, пивалоильная группа, трифтоацетильная группа и трихлорацетильная группа; например, бензоильную группу; например, арилалканоильные группы, такие как фенилацетильная группа и феноксиацетильная группа; например, низшие алкоксикарбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, пропилоксикарбонильная группа и трет-бутоксикарбонильная группа; например, аралкилоксикарбонильные группы, такие как пара-нитробензилоксикарбонильная группа и фенэтилоксикарбонильная группа; например, низшие алкилсилильные группы, такие как триметилсилильная группа и трет-бутилдиметилсилильная группа; например, тетрагидропиранильную группу; например, триметилсилилэтоксиметильную группу; например, низшие алкилсульфонильные группы, такие как метилсульфонильная группа, этилсульфонильная группа и трет-бутилсульфонильная группа; например, низшие алкилсульфинильные группы, такие как трет-бутилсульфинильная группа; например, арилсульфонильные группы, такие как бензолсульфонильная группа и толуолсульфонильная группа; и, например, имидные группы, такие как фталимидная группа. В частности, предпочтительными являются трифторацетильная группа, ацетильная группа, трет-бутоксикарбонильная группа, бензилоксикарбонильная группа, триметилсилилэтоксиметильная группа и кумильная группа.
Термин «защитная группа для гидроксильной группы» конкретно не ограничен при условии, что защитная группа сохраняет свою функциональность, и ее примеры включают в себя низшие алкильные группы, такие как метильная группа, этильная группа, пропильная группа, изопропильная группа и трет-бутильная группа; например, низшие алкилсилильные группы, такие как триметилсилильная группа и трет-бутилдиметилсилильная группа; например, низшие алкоксиметильные группы, такие как метоксиметильная группа и 2-метоксиэьлксиметильная группа; например, тетрагидропиранильную группу; например, триметилсилилэтоксиметильную группу; например, аралкильные группы, такие как бензильная группа, пара-метоксибензильная группа, 2,3-диметоксибензильная группа, орто-нитробензильная группа, пара-нитробензильная группа и тритильная группа; и, например, ацильные группы, такие как формильная группа, ацетильная группа и трифторацетильная группа. В частности, предпочтительными являются, например, метильная группа, метоксиметильная группа, тетрагидропиранильная группа, триметилсилилэтоксиметильная группа, трет-бутилдиметилсилильная группа и ацетильная группа.
Термин «защитная группа для карбоксильной группы» конкретно не ограничен при условии, что защитная группа сохраняет свою функциональность, и ее примеры включают в себя низшие алкильные группы, такие как метильная группа, этильная группа, пропильная группа, изопропильная группа и трет-бутильная группа; например, галогензамещенные низшие алкильные группы, такие как 2,2,2-трихлорэтильная группа; например, низшие алкенильные группы, такие как аллильная группа; например, триметилсилиэтоксиметильную группу; и, например, аралкильные группы, такие как бензильная группа, пара-метоксибензильная группа, пара-нитробензильная группа, бензгидрильная группа и тритильная группа. В частности, предпочтительными являются например, метильная группа, этильная группа, трет-бутильная группа, аллильная, бензильная группа, пара-метоксибензильная группа и триметилсилилэтоксиметильная группа.
Термин «защитная группа для карбонильной группы» конкретно не ограничен при условии, что защитная группа сохраняет свою функциональность, и ее примеры включают в себя кетали и ацетали, такие как этиленкеталь, триметиленкеталь, диметилкеталь, этиленацкталь, триметиленацеталь и диметилацеталь.
Термин «защитная группа для аминогруппы или функциональной группы с активным протоном, такой как индол» конкретно не ограничен при условии, что группа сохраняет свою функциональность, и ее примеры включают в себя низшие алкильные группы, такие как метильная группа, этильная группа, пропильная группа, изопропильная группа и трет-бутильная группа; например, низшие алкилсилильные группы, такие как триметилсилильная группа и трет-бутилдиметилсилильная группа; например, низшие алкоксиметильные группы, такие как метоксиметильная группа и 2-метоксиэтоксиметильная группа; например, тетрагидропиранильную группу; например, триметилсилилэтоксиметильную группу; например, аралкильные группы, такие как бензильная группа, пара-метоксибензильная группа, 2,3-диметоксибензильная группа, орто-нитробензильная группа, пара-нитробензильная группа и тритильная группа; и, например, ацильные группы, такие как формильная группа, ацетильная группа и трифторацетильная группа. В частности, предпочтительными являются метильная группа, метоксиметильная группа, тетрагидропиранильная группа, триметилсилилэтоксиметильная группа, трет-бутилдиметилсилильная группа и ацетильная группа.
[0114]
Способ удаления защитной группы может варьировать в зависимости от типа соответствующей защитной группы и устойчивости целевого соединения. При этом, например, удаление защитной группы проводят в соответствии со способами, описанными в литературе (см. Protective Groups in Organic Synthesis, 3rd Ed., written by T.W. Greene, John Wiley & Sons, 1999), или эквивалентными способами, например, посредством проведения сольволиза кислотой или основанием, то есть, например, путем переноса для взаимодействия 0,01 моль в большой избыток кислоты, предпочтительно трифторуксуной кислоты, муравьиной кислоты или соляной кислоты; или такое же количество молей в большой избыток основания, предпочтительно гидроксид калия или гидроксид кальция; или посредством химического восстановления, например, комплексом гидрида металла, или посредством каталитического восстановления, например, с палладированным углем или никелем Ренея.
[0115]
Соединение согласно настоящему изобретению может быть легко выделено и очищено традиционными способами разделения. Примеры таких способов включают в себя экстрагирование растворителем, перекристаллизацию, высокоэффективную жидкостную хроматографию с обращенной фазой для фракционирования, колоночную хроматографию и тонкослойную хроматографию для фракционирования.
[0116]
Если соединение согласно настоящему изобретению имеет изомеры, такие как оптические изомеры, стереоизомеры, региоизомеры и ротамеры, то в понятие соединения согласно настоящему изобретению включены все смеси любых изомеров. Например, если соединение согласно настоящему изобретению имеет оптические изомеры, то оптические изомеры, расщепленные из рацематов, также включены в понятие соединения согласно настоящему изобретению. Каждый из указанных изомеров может быть получен в виде отдельного соединения путем известной per se методики синтеза и методик разделения (например, концентрирование, экстрагирование растворителем, колоночная хроматография и перекристаллизация).
[0117]
Соединение согласно настоящему изобретению или его соль могут быть кристаллическими, и вне зависимости от того, является ли кристаллическая форма отдельной формой или полиморфной смесью, кристаллические соединения также включены в понятие соединения согласно настоящему изобретению или его соли. Кристаллическое вещество может быть получено посредством применения известного per se способа кристаллизации, и проведения кристаллизации. Соединение согласно настоящему изобретению или его соль могут представлять собой сольват (например, гидрат) или может не являться сольватом, и оба они включены в понятие соединения согласно настоящему изобретению или его соли. Соединения, меченые изотопами (например, 3H, 14C, 35S и 125I), также включены в понятие соединения согласно настоящему изобретению или его соли.
[0118]
Пролекарство соединения согласно настоящему изобретению или его соли относится к соединению, которое преобразуется до соединения согласно настоящему изобретению или его соли в результате реакции, обусловленной ферментом или желудочной кислотой, в живом организме в физиологических условиях, то есть к соединению, которое ферментативно индуцирует, например, окисление, восстановление или гидролиз, и преобразуется до соединения согласно настоящему изобретению или его соли, или к соединению, которое вызывает, например, гидролиз посредством желудочной кислоты, и преобразуется до соединения согласно настоящему изобретению или его соли. Кроме того, пролекарство соединения согласно настоящему изобретению или его соли также может представлять собой соединение, которое преобразуется до соединения согласно настоящему изобретению или его соли в физиологических условиях, описанных в Hirokawa Shoten Annual of 1990 "Iyakuhin no Kaihatsu (Development of Pharmaceutical Products)", Vol. 7, Molecule Design, pp. 163-198.
[0119]
Соль соединения согласно настоящему изобретения означает соль, которую традиционно используют в области органической химии, и ее примеры включают в себя соли, такие как основно-аддитивная соль, ассоциированная с карбоксильной группой, если соединение согласно настоящему изобретению содержит соответствующую карбоксильную группу; и кислотно-аддитивная соль, ассоциированная с аминогруппой или основной гетероциклической группой, если соединение согласно настоящему изобретению содержит соответствующую аминогруппу или основную гетероциклическую группу.
Примеры основно-аддитивной соли включают в себя, например, соли щелочных металлов, такие как соль натрия и соль калия; например, соли щелочноземельных металлов, такие как соль кальция и соль магния; например, соль аммония; и, например, соли органических аминов, такие как соль триметиламина, соль триэтиламина, соль дициклогексиламина, соль этаноламина, соль диэтаноламина, соль триэтаноламина, соль прокаина и соль N,N'-дибензилэтилендиамина.
Примеры кислотно-аддитивной соли включают в себя, например, соли неорганических кислот, такие как гидрохлорид, сульфат, нитрат, фосфат и перхлорат; например, соли органических кислот, такие как ацетат, формат, малеат, фумарат, тартрат, цитрат, аскорбат и трифторацетат; и, например, соли сульфоновой кислоты, такие как метансульфонат, изетионат, бензолсульфонат и паратолуолсульфонат.
[0120]
Соединение согласно настоящему изобретению или его соль характеризуется превосходной ингибирующей активностью в отношении ВТК и применимо в качестве средства для профилактики и/или терапии различных иммунных заболеваний, например, в качестве средства для профилактики и/или терапии аллергических заболеваний, аутоиммунных заболеваний или воспалительных заболеваний, в частности, в качестве средства для профилактики и/или терапии аллергических заболеваний или аутоиммунных заболеваний. Кроме того, соединение или его соль характеризуется превосходной селективностью в отношении ВТК и обладает преимуществом сниженных побочных эффектов, которые обусловлены дополнительным ингибированием других киназ (например, EGFR).
[0121]
Термин «ВТК» согласно настоящему описанию включает в себя ВТК человека или отличного от человека млекопитающего, и термин ВТК представляет собой предпочтительно BTK человека. Кроме того, термин «ВТК» включает в себя изоформы.
[0122]
Кроме того, по причине его превосходной ингибирующей активностью в отношении ВТК, соединение согласно настоящему изобретению или его соль применимы в качестве лекарственного средства для профилактики или лечения иммунных заболеваний, ассоциированных с ВТК, например, аллергических заболеваний, аутоиммунных заболеваний или воспалительных заболеваний, в частности аллергических заболеваний или аутоиммунных заболеваний.
Термин «заболевания, ассоциированные с ВТК» включает в себя заболевания, которые в результате делеции, супрессии и/или ингибирования функций ВТК характеризуются снижением коэффициента заболеваемости и ремиссией, облегчением и/или полным исчезновением симптомов.
Конкретные иммунные заболевания особо не ограничены при условии, что они представляют собой иммунные заболевания, вызванные аномальной экспрессией и/или активностью ВТК, и их примеры включают в себя, например, аллергические заболевания, аутоиммунные заболевания и воспалительные заболевания.
Общепринятые лекарственные средства для ревматоидного артрита (например, Тофацитиниб, который представляет собой ингибитор pan-JAK) снижают число NK клеток, что снижает иммунокомпетентность хозяина, и в этой связи отмечалась проблема высокого риска инфекции герпесвируса или канцерогенеза (ACR HOTILINE, 14 декабря 2012 г.).
Соединение согласно настоящему изобретению или его соль характеризуется низкой супрессирующей активностью в отношении NK клеток или т. п. по причине его высокой клеточной селективности, а потому оно характеризуется преимуществом высокой безопасности с низким риском супрессии иммунитета хозяина.
Кроме того, соединение согласно настоящему изобретению или его соль также применимы при патологическом состоянии, ассоциированном с остеокластами (например, остеопороз), поскольку оно супрессирует резорбцию кости в остеокластах мышей и восстанавливает плотность кости.
[0123]
Конкретные аллергические заболевания особо не ограничены, и их примеры включают в себя, например, бронхиальную астму, аллергический ринит, поллиноз, атопический дерматит, пищевую аллергию, анафилаксию, лекарственную аллергию, крапивницу и конъюнктивит. Предпочтительные примеры включают в себя бронхиальную астму, аллергический ринит, поллиноз и атопический дерматит, и особенно предпочтительные примеры включают в себя аллергический ринит, поллиноз и атопический дерматит.
[0124]
Конкретные аутоиммунные заболевания особо не ограничены, и их примеры включают в себя ревматоидный артрит, системную красную волчанку, дерматосклероз, полимиозит, синдром Шегрена и болезнь Бехчета. Предпочтительные примеры включают в себя ревматоидный артрит и системную красную волчанку, и особенно предпочтительные примеры включают в себя ревматоидный артрит.
[0125]
Конкретные воспалительные заболевания особо не ограничены, и их примеры включают в себя аппендицит, блефарит, бронхиолит, бронхит, бурсит, цервицит, холангит, холецистит, язвенный колит, болезнь Крона, синдром раздраженного кишечника, цистит, дакриоаденит, контактный дерматит, дерматомиозит, энцефалит, эндокардит, эндометрит, эпидидимит, фасцит, фиброзит, гастроэнтерит, гепатит, абсцесс потовых желез, ларингит, мастит, менингит, миелит, миокардит, нефрит, оофорит, орхит, панкреатит, паротит, перикардит, перитонит, фарингит, плеврит, флебит, пневмонию, проктит, простатит, пиелонефрит, сальпингит, назосинусит, стоматит, остеоартрит, синовит, тендинит, тонзиллит, увеит, вагинит, васкулит и вульвит. Предпочтительные примеры включают в себя язвенный колит, болезнь Крона, синдром раздраженного кишечника, контактный дерматит, цистит и остеоартрит. Особенно предпочтительные примеры включают в себя контактный дерматит, цистит и остеоартрит.
Применительно к конкретным иммунным заболеваниям, предпочтительные примеры включают в себя аллергические заболевания и аутоиммунные заболевания, причем более предпочтительные примеры включают в себя атопический дерматит, ревматоидный артрит, системную красную волчанку, аллергический ринит и поллиноз, и наиболее предпочтительные примеры включают в себя ревматоидный артрит.
[0126]
При использовании соединения согласно настоящему изобретению или его соли в качестве лекарственного средства, могут быть использованы различные лекарственные формы в соответствии с целью профилактики или терапии, посредством включения в состав фармацевтических носителей, если это необходимо. Лекарственная форма может представлять собой, например, любой пероральный препарат, инъекционный препарат, суппозиторий, мазь и пластырь. Указанные лекарственные формы могут быть, соответственно, получены посредством способов приготовления составов, которые традиционно используются и известны специалистам в данной области техники.
[0127]
Применительно к фармацевтическим носителям, используются различные органические или неорганические вещества носители, которые традиционно используются в качестве компонентов составов, и фармацевтические носители включают в состав в виде, например, наполнителя, связующего вещества, разрыхлителя, смазки и покровного вещества в твердых препаратах; и в виде растворителя, разбавителя, средства, способствующего суспендированию, изотонического средства, средства, регулирующего рН, буферного средства и анальгезирующего средства в жидких препаратах. Кроме того, при необходимости, в составе также могут быть использованы добавки, такие как антисептик, антиоксидант, краситель, вкусоароматизатор/отдушка и стабилизатор.
Примеры наполнителя включают в себя лактозу, сахарозу, D-маннит, крахмал, кристаллическую целлюлозу и силикат кальция.
Примеры связующего вещества включают в себя гидроксипропилцеллюлозу, метилцеллюлозу, поливинилпирролидон, сахарную пудру и гипромеллозу.
Примеры разрыхлителя включают в себя крахмалгликолят натрия, кармеллозу кальция, кроскармеллозу натрия, кросповидон, низкозамещенную гидроксипропилцеллюлозу и частично желатинизированный крахмал.
Примеры смазки включают в себя тальк, стеарат магния, сложные эфиры жирной кислоты сахарозы, стеариновую кислоту и стеарилфумарат натрия.
Примеры покровного вещества включают в себя этилцеллюлозу, аминоалкилметакрилата сополимер RS, гипромеллозу и сахарозу.
Примеры растворителя включают в себя воду, пропиленгликоль и физиологический солевой раствор.
Примеры разбавителя включают в себя полиэтиленгликоль, этанол, α-циклодекстрин, Макрогол 400 и Полисорбат 80.
Примеры средства, способствующего суспендированию, включают в себя каррагинан, кристаллическую целлюлозу, кармелозу натрия и гидрогенизированное полиоксиэтиленом касторовое масло.
Примеры изотонического средства включают в себя хлорид натрия, глицерин и хлорид калия.
Примеры средства, регулирующего рН, и буферного средства включают в себя цитрат натрия, соляную кислоту, молочную кислоту, фосфорную кислоту и дигидрофосфат натрия.
Примеры анальгезирующего средства включают в себя прокаина гидрохлорид и лидокаин.
Примеры антисептического средства включают в себя этилпараоксибензоат, крезол и бензалкония хлорид.
Примеры антиоксиданта включают в себя сульфит натрия, аскорбиновую кислоту и природный витамин Е.
Примеры красителя включают в себя оксид титана, полуторную окись железа, пищевой синий №1 и медный хлорофилл.
Примеры вкусоароматизатора/отдушки включают в себя аспартам, сахарин, сукралозу, 1-ментол и мятный вкусоароматизатор.
Примеры стабилизатора включают в себя пиросульфит натрия, эдетат натрия, эриторбовую кислоту, оксид магния и дибутилгидрокситолуол.
[0128]
В случае приготовления твердого перорального препарата к соединению согласно настоящему изобретению добавляют наполнитель, необязательно наполнитель, связующее вещество, разрыхлитель, смазку, краситель и вкусоароматизатор/отдушку, а затем посредством общепринятых способов может быть получена, например, таблетка, таблетка с покрытием, гранулярный препарат, порошкообразный препарат и капсульный препарат.
В случае приготовления инъекционного препарата к соединению согласно настоящему изобретению добавляют средство, регулирующее рН, буферное средство, стабилизатор, изотоническое средство и местный анестетик, и посредством общепринятых способов могут быть получены подкожные, внутримышечные и внутривенные инъекционные препараты.
[0129]
Количества соединения согласно настоящему изобретению, подлежащие включению в состав различных стандартных лекарственных форм, могут варьировать в зависимости от симптомов пациента, которому будут вводить соединение, или в зависимости от лекарственной формы; однако в целом стандартную лекарственную форму желательно адаптировать количество от 0,05 до 1000 мг для перорального препарата, от 0,01 до 500 мг для инъекционного препарата, и от 1 до 1000 мг для суппозитория.
[0130]
Кроме того, суточная доза лекарственного средства, содержащего описанную выше лекарственную форму, может варьировать в зависимости, например, от симптомов, массы тела, возраста и пола пациента, и не может быть определена произвольно. Однако доза может быть использована, как правило, в количестве от 0,05 до 5000 мг, и предпочтительно от 0,1 до 1000 мг в сутки для взрослого (масса тела: 50 кг), и предпочтительно вводить ее однократно в сутки или в виде отдельных порций приблизительно от 2 до 3 раз в сутки.
Примеры
[0131]
Далее в данном документе, настоящее изобретение будет описано более конкретно посредством примеров, но предполагается, что настоящее изобретение не ограничивается ими.
[0132]
Если иное не указано особо, то применительно к различным использованным в примерах реагентам, использовали коммерчески доступные продукты. Для колоночной хроматографии на силикагеле использовали PURIF-PACK (зарегистрированный товарный знак) SI производства Schott Moritex Corp., предварительно заполненную силикагелем колонку KP-Sil (зарегистрированный товарный знак) производства Biotage AB или предварительно заполненную силикагелем колонку HP-Sil (зарегистрированный товарный знак) производства Biotage AB. Для колоночной хроматографии на щелочном силикагеле использовали PURIF-PACK (зарегистрированный товарный знак) NH производства Moritex Corp. или предварительно заполненную колонку KP-NH (зарегистрированный товарный знак) производства Biotage AB. Для тонкослойной хроматографии с целью разделения на фракции использовали KIESELGEL TM60F254, Art. 5744 производства Merck KGaA или NH2-силикагель 60F254 производства Wako Pure Chemical Industries, Ltd. ЯМР-спектры измеряли на спектрометрах AL400 (400 МГц; JEOL, Ltd.) и MERCURY400 (400 Мгц; Agilent Technologies, Inc.), или на спектрометре INOVA400 (400 МГц; Agilent Technologies, Inc.), оснащенном датчиком OMNMR (Protasis Corp.), используя в качестве внутреннего стандарта тетраметилсилан, если дейтерированный растворитель содержал тетраметилсилан, а в других случаях используя в качестве внутреннего стандарта ЯМР-растворитель. Все значения δ выражали в м.д. Взаимодействия с микроволновой обработкой проводили с использованием реактора DISCOVER S-класса производства CEM Corp.
[0133]
Спектры LCMS измеряли с использованием системы ACQUITY SQD (квадруполь) производства Waters Corp. в условиях, описанных ниже.
Колонка: YMC-TRIART C18 производства YMC Co., Ltd., 2,0 × 50 мм, 1,9 мкм
MS-детекция: ESI (режим регистрации положительно заряженных ионов)
УФ-детекция: 254 нм и 210 нм
Скорость потока в колонке: 0,5 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиная кислота)
Вводимое количество: 1 мкл
Градиент (таблица 1)
[0134]
[Таблица 1]
|
[0135]
Кроме того, проводили очистку методом препаративной HPLC с обращенной фазой с использованием препаративной системы производства Waters Corp. в условиях, описанных ниже.
Колонка: Использовали колонку YMC-ACTUS TRIART C18 производства YMC Co., Ltd., 20×50 мм, 5 мкм, соединенную с колонкой YMC-ACTUS TRIART C18 производства YMC Co., Ltd. 20×10 мм, 5 мкм.
УФ-детекция: 254 нм
MS-детекция: ESI (режим регистрации положительно заряженных ионов)
Скорость потока в колонке: 25 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиная кислота)
Вводимое количество: от 0,1 до 0,5 мл
[0136]
Ниже представлены значения сокращений.
s: синглет
d: дублет
t: триплет
q: квартет
dd: двойной дублет
dt: двойной триплет
td: тройной дублет
tt: тройной триплет
ddd: двойной двойной дублет
ddt: двойной двойной триплет
dtd: двойной тройной дублет
tdd: тройной двойной дублет
m: мульфтиплет
br: уширенный
brs: уширенный синглет
CDI: карбонилдиимидазол
DMSO-d6: дейтерированный диметилсульфоксид
CDCl3: дейтерированный хлороформ
CD3OD: дейтерированный метанол
THF: тетрагидрофуран
DMF: N,N-диметилформамид
DMA: N,N-диметилацетамид
NMP: 1-Метил-2-пирролидинон
DMSO: диметилсульфоксид
TFA: трифторуксусная кислота
WSC: 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид
HOBt: 1-гидроксибензотразола моногидрат
HATU: (диметиламино)-N,N-диметил(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метаниминия гексафторфосфат
DIAD: диизопропилазодикарбоксилат
TBAF: тетрабутиламмония фторид
DIPEA: диизопропилэтиламин
Boc: трет-бутоксикарбонил
Boc2O: ди-трет-бутилдикаобонат
DMAP: диметиламинопиридин
[0137]
Пример синтеза 1
Синтез (R)-трет-бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
[0138]
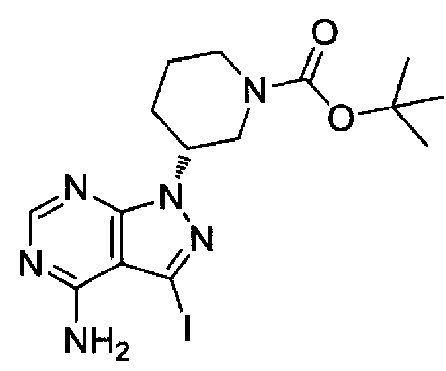
[0139]
(Стадия 1) Синтез (S)-трет-бутил-3-(метилсульфонилокси)пиперидин-1-карбоксилата
(S)-N-Boc-3-пиридинол (20 г) растворяли в 100 мл толуола, и добавляли к нему 21 мл триэтиламина и 9,2 мл метансульфонилхлорида при 0°C. Смесь перемешивали в течение 1 часа в условиях охлаждения на льду, затем добавляли к ней этилацетат и воду, и разделяли органический слой. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, насыщенным водным раствором хлорида аммония и водой, а затем сушили над безводным сульфатом натрия. Растворитель отгоняли в условиях пониженного давления, и получали тем самым 26,8 г указанного в заголовке соединения в виде бесцветного твердого вещества.
[0140]
(Стадия 2) Синтез (R)-трет-бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
Суспензионный раствор 14,6 г 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина, синтезированного согласно способу, описанному в WO 2007/126841, 25 г (S)-трет-бутил-3-(метилсульфонилокси)пиперидин-1-карбоксилата, полученного на стадии 1, и 69 г карбоната калия в 150 мл DMA нагревали до 100°C, и перемешивали в течение 10 часов. Суспензионный раствор охлаждали до комнатной температуры, а затем 300 мл воды добавляли к нему. Полученное тем самым твердое вещество собирали путем фильтрования и промывали водой, и сушили твердое вещество. Таким образом, получали 26,9 г указанного в заголовке соединения в виде желтого твердого вещества. Физические свойства: m/z [M+H]+ 446,2
[0141]
Пример синтеза 2
Синтез (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты
[0142]
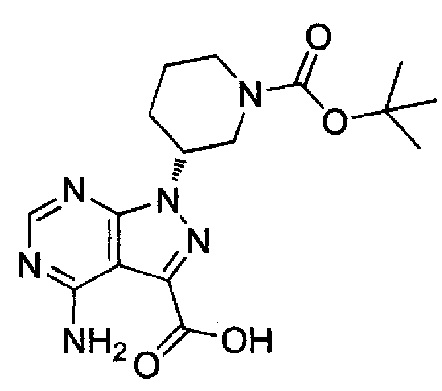
[0143]
(R)-трет-бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилат (2 г), полученный в примере синтеза 1, 3 мл 2-диэтиламиноэтанола и 158 мг Pd(PPh3)2Cl2 растворяли в 20 мл NMP. После продувки системы монооксидом углерода, раствор затем нагревали до 120°C. После перемешивания раствора в течение 1 часа, раствор охлаждали до комнатной температуры. К раствору добавляли 10 мл метанола, а затем добавляли 6 мл 5н водного раствора гидроксида натрия. Смесь перемешивали в течение 10 минут. К смеси добавляли воду, а затем промывали водный слой этилацетатом. Водный слой корректировали до pH 4 добавлением соляной кислоты, выпавшее в осадок твердое вещество собирали путем фильтрования, промывали водой, а затем сушили. Таким образом, получали 1,26 г указанного в заголовке соединения в виде бледно-желтого твердого вещества. Физические свойства: m/z [M+H]+ 363,1
[0144]
Пример синтеза 3
Синтез (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты
[0145]
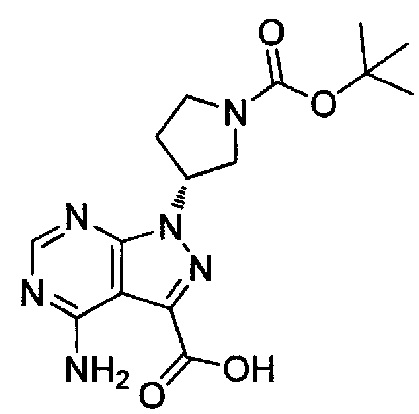
[0146]
(Стадия 1) Синтез (S)-трет-бутил-3-(метилсульфонилокси)пирролидин-1-карбоксилат
(S)-(-)-N-Boc-3-пирролидинол (935 мг) растворяли в 15 мл хлороформа, и добавляли к нему 1,04 мл триэтиламина и 467 мкл метансульфонилхлорида в условиях охлаждения на льду. Смесь перемешивали в течение 1,5 часов при комнатной температуре, затем добавляли к ней этилацетат и воду, и разделяли органический слой. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, насыщенным водным раствором хлорида аммония и водой, а затем сушили над безводным сульфатом натрия. Растворитель отгоняли в условиях пониженного давления, и получали тем самым 1,3 г указанного в заголовке соединения в виде бесцветного маслянистого вещества. Физические свойства: m/z [M+H]+ 266,1
[0147]
(Стадия 2) Синтез (R)-трет-бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата
Суспензию 20,0 г 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина, синтезированного согласно способу, описанному в WO 2007/126841, 23 г (S)-трет-бутил-3-(метилсульфонилокси)пирролидин-1-карбоксилата, полученного на стадии 1, и 32 г карбоната калия в 200 мл DMA нагревали до 85°C и перемешивали в течение 3 часов. Раствор охлаждали до комнатной температуры, а затем твердое вещество, полученное путем добавления к раствору 400 мл воды, собирали путем фильтрования, промывали водой, а затем сушили. Таким образом, получали 23,5 г указанного в заголовке соединения в виде бледно-желтого твердого вещества. Физические свойства: m/z [M+H]+ 431,0
[0148]
(Стадия 3) Синтез (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты
(R)-трет-бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилат (2,0 г), полученный на представленной выше стадии 2, 3,1 мл 2-диэтиламиноэтанола и 163 мг Pd(PPh3)2Cl2 растворяли в 20 мл NMP. Систему продували монооксидом углерода, а затем нагревали до 120°C. После перемешивания раствора в течение 1 часа, раствор охлаждали до комнатной температуры, и добавляли к нему 10 мл метанола. Затем, к раствору добавляли 6 мл 5н водного раствора гидроксида натрия, и перемешивали смесь в течение 10 минут. К смеси добавляли воду, затем водный слой промывали хлороформом, и корректировали водный слой до pH 4 добавлением соляной кислоты. Выпавшее в осадок твердое вещество собирали путем фильтрования, промывали водой, а затем сушили. Таким образом, получали 1,35 г указанного в заголовке соединения в виде бледно-желтого твердого вещества. Физические свойства: m/z [M+H]+ 349,1
[0149]
Пример синтеза 4
Синтез 5-цианобензо[d]оксазол-2-амина
[0150]
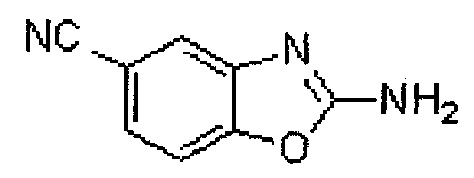
[0151]
3-Амино-4-гидроксибензонитрил (15,1 г) растворяли в смеси 75 мл этанола и 75 мл воды, и малыми порциями добавляли к раствору 14,7 г бромциана в условиях охлаждения на льду. Смесь перемешивали в течение 2 часов при комнатной температуре, и снова охлаждали на льду. К раствору добавляли 112 мл 2н водного раствора гидроксида натрия, и перемешивали смесь дополнительно в течение 30 минут. Большую часть этанола быстро удаляли на испарителе, и собирали остаток путем фильтрования. Осадок на фильтре промывали водой, и получали тем самым 12,12 г указанного в заголовке соединения.
Физические свойства: m/z [M+H]+ 161,1
[0152]
Пример 1
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 1)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
К суспензионному раствору 94 мг (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, в 4 мл THF добавляли 50 мг CDI, и перемешивали смесь в течение 3 часов при комнатной температуре. В условиях охлаждения на льду к смеси добавляли 66 мг 5-хлорбензо[d]оксазол-2-амина, и по каплям добавляли 1,0 M раствор гексаметилдисилазана лития в THF. Смесь перемешивали в течение 30 минут в условиях охлаждения на льду, добавляли к ней 1 мл воды, и удаляли растворитель (THF). Твердое вещество, полученное путем добавления к остатку 4 мл воды, отделяли путем фильтрования, и промывали 5 мл смеси гексан/этилацетат=1/1. Таким образом, получали 106 мг указанного в заголовке соединения в виде белого твердого вещества. Физические свойства: m/z [M+H]+ 513,2
[0153]
(Стадия 2) Синтез типового соединения 1
(R)-трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилат (5,6 г), полученный на стадии 1, смешивали с 1 мл смеси 4н соляная кислота/1,4-диоксан, смесь перемешивали в течение 1 часа, а затем удаляли растворитель на испарителе. К остатку добавляли 2 мл хлороформа и 7,6 мкл триэтиламина, смесь охлаждали на льду, а затем добавляли к ней 0,9 мкл акрилоилхлорида. После перемешивания смеси в течение 1,5 часов, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем очищали остаток, полученный после удаления растворителя, на колонке с силикагелем (элюент: этилацетат/метанол). Таким образом, получали 2,6 мг указанного в заголовке соединения в виде белого твердого вещества.
[0154]
Пример 2
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-бромбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 2)
Указанное в заголовке соединение получали в виде белого твердого вещества из полученной в примере синтеза 2 (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты и 5-бромбензо[d]оксазол-2-амина в соответствии с методикой, описанной в примере 1.
[0155]
Пример 3
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-(тиофен-2-ил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (типовое соединение 3)
(Стадия 1) Синтез 5-(тиофен-2-ил)бензо[d]оксазол-2-амин
5-Бромбензо[d]оксазол-2-амин (100 мг), 249 мг фосфата калия и 90 мг тиофен-2-илбороновой кислоты суспендировали в смеси 2,5 мл DME и 0,5 мл воды. К смеси добавляли 38 мг комплекса дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана, и обрабатывали смесь микроволнами при 140°C в течение 20 минут в микроволновом реакторе. Растворитель удаляли из реакционного раствора, очищали остаток методом хроматографии на аминосиликагеле (элюент: хлороформ/метанол), и получали тем самым 93 мг указанного в заголовке соединения в виде бледно-коричневого твердого вещества. Физические свойства: m/z [M+H]+ 216,8
[0156]
(Стадия 2) Синтез (R)-трет-бутил-3-(4-амино-3-((5-тиофен-2-ил)бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
К суспензионному раствору 19 мг (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, в 2 мл THF добавляли 10 мг CDI, и перемешивали смесь в течение 2 часов при комнатной температуре. В условиях охлаждения на льду к смеси добавляли 17 мг 5-(тиофен-2-ил)бензо[d]оксазол-2-амина, полученного на стадии 1, и по каплям добавляли 105 мкл 1,0 M раствора гексаметилдисилазана лития в THF. Смесь перемешивали в течение 30 минут в условиях охлаждения на льду, затем добавляли к ней 1 мл воды, и удаляли растворитель (THF). Твердое вещество, полученное путем добавления 4 мл воды к остатку, отделяли путем фильтрования и промывали 5 мл смеси гексан/этилацетат=1/1. Таким образом, получали 13 мг целевого вещества в виде бледно-коричневого твердого вещества. Физические свойства: m/z [M+H]+ 561,3
[0157]
(Стадия 3) Синтез типового соединения 3
К 9 мг (R)-трет-бутил-3-(4-амино-3-((5-(тиофен-2-ил)бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата, полученного на стадии 2, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, смесь перемешивали в течение 1 часа, а затем удаляли растворитель на испарителе. К остатку добавляли 2 мл хлороформа и 12 мкл триэтиламина, смесь охлаждали на льду, а затем добавляли к ней 1,3 мкл акрилоилхлорида. После перемешивания смеси в течение 1,5 часов, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем остаток, полученный после удаления растворителя, очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 2,1 мг указанного в заголовке соединения в виде белого твердого вещества.
[0158]
Пример 4
Синтез (R)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-метакрилоилпиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 4)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 1, путем использования метакрилоилхлорида вместо акрилоилхлорида.
[0159]
Пример 5
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 5)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 1, путем использования кронового хлорангидрида вместо акрилоилхлорида.
[0160]
Пример 6
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-цианобензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 6)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-3-((5-цианобензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
(R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновую кислоту (2,32 г), полученную в примере синтеза 2, растворяли в 25 мл DMA, добавляли к ней 2,01 г CDI, и перемешивали смесь в течение 1 часа при комнатной температуре. К реакционному раствору добавляли 1,12 г 5-цианобензо[d]оксазол-2-амина, и после этого добавляли 1,23 г трет-бутирата натрия. Смесь перемешивали в течение 2 часов при комнатной температуре, и добавляли к ней воду. Затем, значение pH корректировали добавлением 2н соляной кислоты, и из смеси выпадало в осадок твердое вещество. Твердое вещество собирали путем фильтрования и сушили. Таким образом, получали 2,66 г указанного в заголовке соединения в виде бледно-желтого твердого вещества. Физические свойства: m/z [M+H]+ 505,3
[0161]
(Стадия 2) Синтез типового соединения 6
(R)-трет-бутил-3-(4-амино-3-((5-цианобензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилат (2,1 г), полученный на стадии 1, суспендировали в 10 мл дихлорметана, и добавляли к нему при комнатной температуре10 мл TFA. Смесь перемешивали в течение 2 часов, а затем удаляли TFA на испарителе. Затем, остаток подвергали азеотропной перегонке с толуолом, остаток смешивали со смесью 20 мл NMP и 2 мл воды, и охлаждали смесь на льду. К смеси добавляли 2,88 г карбоната калия и 0,4 мл акрилоилхлорида, и перемешивали смесь в условиях охлаждения на льду. Спустя 2 часа, к смеси добавляли воду и 2н соляную кислоту для корректировки pH, и собирали полученное тем самым твердое вещество путем фильтрования. После этого, твердое вещество очищали методом хроматографии на силикагеле (хлороформ/метанол), и получали тем самым 0,7 г целевого вещества в виде белого твердого вещества.
[0162]
Пример 7
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-метоксибензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 7)
Указанное в заголовке соединение получали в виде бледно-коричневого твердого вещества в соответствии с методикой, описанной в примере 6, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, и 5-метоксибензо[d]оксазол-2-амина.
[0163]
Пример 8
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-(2-метоксиэтил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 8)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 6, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, и 5-(2-метоксиэтил)бензо[d]оксазол-2-амина.
[0164]
Пример 9
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(оксазоло[4,5-b]пиридин-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 9)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 6, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, и оксазоло[4,5-b]пиридин-2-амина.
[0165]
Пример 10
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(4-метилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 10)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 6, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, и 4-метилбензо[d]оксазол-2-амина.
[0166]
Пример 11
Синтез (R)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1-(1-метакрилоилпиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 11)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 6, путем использования (R)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1-(пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида, полученного в примере 12 (стадия 2), и путем использования метакрилоилхлорида вместо акрилоилхлорида.
[0167]
Пример 12
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 12)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-3-((5-фторбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
К раствору 1,0 г (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, в 10 мл DMA добавляли 895 мг CDI, и перемешивали смесь в течение 1 часа при комнатной температуре. К смеси добавляли 462 мг 5-фторбензо[d]оксазол-2-амина, и по каплям добавляли 9 мл 1,0 M раствора трет-бутирата натрия в THF. Смесь перемешивали в течение 30 минут при комнатной температуре, а затем добавляли к ней 10 мл 1н водного раствора гидроксида натрия, и удаляли растворитель (THF). После перемешивания смеси в течение 1 часа, к остатку для осаждения добавляли 2н соляную кислоту, и для полного осаждения добавляли смесь вода/метанол. Затем, полученное твердое вещество собирали путем фильтрования, и получали тем самым 1,14 г указанного в заголовке соединения в виде светло-желтого твердого вещества. Физические свойства: m/z [M+H]+ 497,2
[0168]
(Стадия 2) Синтез (R)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1-(пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида
(R)-трет-бутил-3-(4-амино-3-(5-фторбензо[d]оксазол-2-илкарбонил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилат (3,06 г), полученный на стадии 1, и 5,5 г йодида натрия суспендировали в 30 мл ацетонитрила, и при комнатной температуре добавляли к смеси 4,7 мл триметилсилилхлорида. Смесь перемешивали в течение 1 часа при комнатной температуре, добавляли к ней насыщенный водный раствор бикарбоната натрия, и в результате в осадок выпадало твердое вещество. После перемешивания системы в течение 10 минут, твердое вещество собирали путем фильтрования и сушили, получая тем самым 2,07 г указанного в заголовке соединения в виде светло-коричневого твердого вещества. Физические свойства: m/z [M+H]+ 398,0
[0169]
(Стадия 3) Синтез типового соединения 12
(R)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1-(пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамид (2 г), полученный на стадии 2, и 2,1 г карбоната калия растворяли в смеси 20 мл NMP и 2 мл воды, и перемешивали раствор в условиях охлаждения на льду. К смеси добавляли 0,4 мл акрилоилхлорида, и перемешивали смесь в течение 1 часа. К смеси добавляли воду, и корректировали pH добавлением соляной кислоты. Выпавшее в осадок из смеси твердое вещество собирали путем фильтрования. Твердое вещество, собранное путем фильтрования, очищали методом хроматографии на силикагеле (элюент: хлороформ/метанол), и получали 1,79 г указанного в заголовке соединения в виде белого твердого вещества.
[0170]
Пример 13
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 13)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-3-((бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
(R)-трет-бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилат (300 мг), полученный в примере синтеза 1, растворяли в 3 мл NMP. К нему добавляли 118 мг бензо[d]оксазол-2-амина, 20 мг xantphos и 0,15 мл N-метилморфолина, и проводили дегазирование смеси. После этого, к смеси добавляли 7,6 мг ацетата палладия, смесь нагревали в атмосфере монооксида углерода до 110°C и перемешивали в течение 2 часов. После охлаждения смеси, к ней добавляли 4,5 мл метанола и 0,45 мл 5н водного раствора гидроксида натрия, и перемешивали смесь в течение 30 минут при комнатной температуре. После этого, значение pH корректировали до 5,3 добавлением 2н соляной кислоты, и собирали полученное твердое вещество путем фильтрования. Неочищенный продукт очищали на колонке с силикагелем (хлороформ/метанол), и получали тем самым 257 мг указанного в заголовке соединения в виде белого твердого вещества. Физические свойства: m/z [M+H]+ 479,3
[0171]
(Стадия 2) Синтез типового соединения 13
(R)-трет-бутил-3-(4-амино-3-((бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилат (5 г), полученный на стадии 1, суспендировали в 50 мл ацетонитрила, и добавляли к нему 7,85 г йодида натрия. При комнатной температуре и при перемешивании по каплям добавляли 6,65 мл триметилсилилхлорида, и перемешивали смесь в течение 1 часа. К смеси добавляли 87,5 мл воды и 12,5 мл 5н водного раствора гидроксида натрия, а затем охлаждали систему на льду. К смеси по каплям добавляли 0,895 мл акрилоилхлорида, и перемешивали смесь в течение 1 часа в условиях охлаждения на льду. Твердое вещество, полученное путем добавления воды, собирали путем фильтрования, промывали водой и сушили. Таким образом, получали 4,13 г указанного в заголовке соединения в виде белого твердого вещества.
[0172]
Пример 14
Синтез (R,E)-4-амино-N-(бензо[d]оксазол-2-ил)-1-(1-(бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 14)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 13, путем использования кротонового хлорангидрида вместо акрилоилхлорида.
[0173]
Пример 15
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 15)
К 5 мг (R)-трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата, полученного на стадии 1 примера 1, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 10 минут. После этого, удаляли растворитель на испарителе, и подвергали систему азеотропной перегонке с толуолом. Остаток растворяли в 1 мл DMF, и добавляли к нему 8,5 мкл DIPEA, 2,4 мг гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты и 5,5 мг HATU. Смесь перемешивали в течение 1 часа при комнатной температуре, а затем концентрировали раствор в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 3,96 мг указанного в заголовке соединения в виде белого твердого вещества.
[0174]
Пример 16
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(этил(метил)амино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 16)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 15, путем использования гидрохлорида (E)-4-(этил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0175]
Пример 17
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диэтиламино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 17)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 15, путем использования гидрохлорида (E)-4-(диэтиламино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0176]
Пример 18
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(изопропил(метил)амино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 18)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 15, путем использования гидрохлорида (E)-4-(изопропил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0177]
Пример 19
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пирролидин-1-ил)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 19)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 15, путем использования гидрохлорида (E)-4-(пирролидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0178]
Пример 20
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пиперидин-1-ил)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 20)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 15, путем использования гидрохлорида (E)-4-(пиперидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0179]
Пример 21
Синтез (R,E)-4-амино-N-(5-(тиофен-2-ил)бензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 21)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 15, путем использования (R)-трет-бутил-3-(4-амино-3-((5-(тиофен-2-ил)бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата, полученного примере 3 (стадия 2).
[0180]
Пример 22
Синтез (R)-4-амино-N-(бензо[d]оксазол-2-ил)-1-(1-бут-2-иноил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 22)
Указанное в заголовке соединение получали в виде бледно-желтого твердого вещества в соответствии с методикой, описанной в примере 15, путем использования (R)-трет-бутил-3-(4-амино-3-((бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата, полученного в примере 13 (стадия 1), и бут-2-иновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0181]
Пример 23
Синтез (R)-1-(1-акрилоилпиперидин-3-ил)-4-амино-N-(5,6-диметилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 23)
(Стадия 1) Синтез (R)-1-(1-ацилоксипиперидин-3-ил)-4-амино-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты
К 1 г (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пиперидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 2, добавляли 15 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа при комнатной температуре. После этого, растворитель удаляли, и подвергали систему азеотропной перегонке путем добавления к ней толуола. К остатку добавляли 50 мл хлороформа and 3,8 мл триэтиламина. В процессе перемешивания смеси, к ней медленно добавляли 780 мкл акрилоилхлорида. После подтверждения завершения реакции, реакцию останавливали путем добавления 2-пропанола. Растворитель удаляли, и добавляли к остатку водный раствор муравьиной кислоты. После корректировки смеси до pH 3, в осадок выпадало твердое вещество. Полученное тем самым твердое вещество собирали путем фильтрования и сушили, и получали тем самым 840 мг указанного в заголовке соединения в виде желтого твердого вещества. Физические свойства: m/z [M+H]+ 318,1
[0182]
(Стадия 2) Синтез типового соединения 23
(R)-1-(1-ацилоксипиперидин-3-ил)-4-амино-1H-пиразоло[3,4-d]пиримидин-3-карбоновую кислоту (5 мг), полученную на представленной выше стадии 1, растворяли в 150 мкл DMF. К этому раствору добавляли 8,26 мкл диизопропилэтиламина, 3,85 мг 5,6-диметилбензо[d]оксазол-2-амина и 9 мг HATU. После перемешивания смеси в течение ночи, к ней добавляли 850 мкл DMSO, и очищали смесь методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 1,2 мг указанного в заголовке соединения в виде белого твердого вещества.
[0183]
Пример 24
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 24)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиридин-1-карбоксилата
К раствору 100 мг (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, в 5 мл DMF добавляли 56 мг CDI, и перемешивали смесь в течение 1 часа при комнатной температуре. В условиях охлаждения на льду к смеси добавляли 73 мг 5-хлорбензо[d]оксазол-2-амина, и добавляли 17 мг 60% гидрида натрия. После перемешивания смеси в условиях охлаждения на льду в течение 30 минут, к ней добавляли 1 мл воды для остановки реакции. Реакционный раствор концентрировали, и очищали методом колоночной хроматографии на силикагеле (элюент: хлороформ/метанол). Таким образом, получали 114 мг указанного в заголовке соединения в виде белого твердого вещества. Физические свойства: m/z [M+H]+ 499,1
[0184]
(Стадия 2) Синтез типового соединения 24
(R)-трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилат (15 мг), полученный на стадии 1, смешивали с 1,5 мл смеси 4н соляная кислота/1,4-диоксан, перемешивали смесь в течение 1 часа, а затем удаляли растворитель на испарителе. К остатку добавляли 2 мл хлороформа и 21 мкл триэтиламина, смесь охлаждали на льду, а затем добавляли к ней 2,4 мкл акрилоилхлорида. После перемешивания смеси в течение 3 часов, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем очищали остаток, полученный после удаления растворителя, на колонке с силикагелем (элюент: этилацетат/метанол). Таким образом, получали 6,8 мг указанного в заголовке соединения в виде белого твердого вещества.
[0185]
Пример 25
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 25)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 24, путем использования кротонового хлорангидрида вместо акрилоилхлорида.
[0186]
Пример 26
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(3-метилбут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 26)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 24, путем использования 3-метилбут-2-еноилхлорида вместо акрилоилхлорида.
[0187]
Пример 27
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 27)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 24, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и бензо[d]оксазол-2-амина.
[0188]
Пример 28
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(тиофен-2-ил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 28)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 24, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и 5-(тиофен-2-ил)бензо[d]оксазол-2-амина.
[0189]
Пример 29
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-метилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 29)
Указанное в заголовке соединение получали в виде бледно-желтого твердого вещества в соответствии с методикой, описанной в примере 24, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и 5-метилбензо[d]оксазол-2-амина.
[0190]
Пример 30
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-фторбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 30)
Указанное в заголовке соединение получали в виде бледно-желтого твердого вещества в соответствии с методикой, описанной в примере 24, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и 5-фторбензо[d]оксазол-2-амина.
[0191]
Пример 31
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(4-хлорфенил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 31)
(Стадия 1) Синтез 5-(4-хлорфенил)бензо[d]оксазол-2-амина
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной на стадии 1 примера 3, путем использования 4-хлорфенилбороновой кислоты вместо тиофен-2-илбороновой кислоты. Физические свойства: m/z [M+H]+ 245,1
[0192]
(Стадия 2) Синтез типового соединения 31
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 24, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и 5-(4-хлорфенил)бензо[d]оксазол-2-амина, полученного на представленной выше стадии 1.
[0193]
Пример 32
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 32)
К 15 мг (R)-трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата, полученного на стадии 1 примера 24, добавляли 1,5 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 10 минут. После этого, удаляли растворитель на испарителе, и подвергали систему азеотропной перегонке с толуолом. Остаток растворяли в 1 мл DMF, и добавляли к нему 13 мкл DIPEA, 3,7 мг гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты и 8,4 мг HATU. Смесь перемешивали в течение 1 часа при комнатной температуре, а затем концентрировали раствор в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 4,2 мг указанного в заголовке соединения в виде белого твердого вещества.
[0194]
Пример 33
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-этил(метил)амино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 33)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 32, путем использования гидрохлорида (E)-4-(этил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0195]
Пример 34
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(диэтиламино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 34)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 32, путем использования гидрохлорида (E)-4-(диэтиламино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0196]
Пример 35
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(изопропил(метил)амино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 35)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 32, путем использования гидрохлорида (E)-4-(изопропил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0197]
Пример 36
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пирролидин-1-ил)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 36)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 32, путем использования гидрохлорида (E)-4-(пирролидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0198]
Пример 37
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1-(1-(4-(пиперидин-1-ил)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 37)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 32, путем использования гидрохлорида (E)-4-(пиперидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0199]
Пример 38
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-метоксибензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 38)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 6, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и 5-метоксибензо[d]оксазол-2-амина.
[0200]
Пример 39
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-цианобензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 39)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 6, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и 5-цианобензо[d]оксазол-2-амина.
[0201]
Пример 40
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(2-метоксиэтил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 40)
Указанное соединение получали в виде бледно-желтого твердого вещества в соответствии с методикой, описанной в примере 6, из (R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты, полученной в примере синтеза 3, и 5-(2-метоксиэтил)бензо[d]оксазол-2-амина.
[0202]
Пример 41
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 41)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-3-((5-фенилбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата
(R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновую кислоту (20 мг), полученную в примере синтеза 3, суспендировали в 1 мл THF, и при комнатной температуре и при перемешивании добавляли к суспензии 12 мг CDI. Смесь перемешивали в течение ночи при комнатной температуре, добавляли к ней 24 мг 5-фенилбензо[d]оксазол-2-амин, а затем охлаждали смесь на льду. К смеси по каплям добавляли 172 мкл 1,0 M раствора гексаметилдисилазана лития в THF. После перемешивания смеси в течение 1 часа, реакцию останавливали путем добавления к смеси 30 мкл уксусной кислоты. После удаления растворителя, остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 12,8 мг указанного в заголовке соединения в виде белого твердого вещества. Физические свойства: m/z [M+H]+ 541,1
[0203]
(Стадия 2) Синтез типового соединения 41
К 12,8 мг (R)-трет-бутил-3-(4-амино-3-((5-фенилбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата, полученного на представленной выше стадии 1, добавляли 1,5 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа. После этого, растворитель удаляли, и подвергали систему азеотропной перегонке с 1 мл толуола. К остатку добавляли 1 мл хлороформа и 16 мкл триэтиламина, и перемешивали смесь в условиях охлаждения на льду. К раствору добавляли 1,9 мкл акрилоилхлорида, и перемешивали смесь в течение 1 часа. Затем, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем очищали остаток, полученный после удаления растворителя, методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 3,46 мг указанного в заголовке соединения в виде белого твердого вещества.
[0204]
Пример 42
Синтез (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 42)
К 5 мг (R)-трет-бутил-3-(4-амино-3-((5-фенилбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата, полученного на стадии 1 примера 41, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 30 минут. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. Остаток растворяли в 1 мл DMF, и добавляли к нему 7,9 мкл DIPEA, 2,2 мг гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты и 5,18 мг HATU. Смесь перемешивали в течение 1 часа при комнатной температуре, а затем концентрировали раствор в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 3,04 мг указанного в заголовке соединения в виде белого твердого вещества.
[0205]
Пример 43
Синтез (R)-1-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-(трифторметил)бензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 43)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-3-((5-(трифторметил)бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата
(R)-4-амино-1-(1-(трет-бутилоксикарбонил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновую кислоту (32 мг), полученную в примере синтеза 3, суспендировали в 2 мл THF, и при комнатной температуре и перемешивании добавляли к суспензии 55 мг CDI. Смесь перемешивали в течение ночи при комнатной температуре, и добавляли к ней 28 мг 5-(трифторметил)бензо[d]оксазол-2-амина. Затем, смесь охлаждали на льду, и по каплям добавляли к ней 183 мкл 1,0 M раствора гексаметилдисилазана лития в THF. После перемешивания смеси в течение 1 часа, путем фильтрования собирали твердое вещество, полученное путем добавления к смеси воды. Твердое вещество промывали смесью гексан/этилацетат, и получали тем самым 35 мг указанного в заголовке соединения в виде бледно-желтого твердого вещества. Физические свойства: m/z [M+H]+ 533,3
[0206]
(Стадия 2) Синтез типового соединения 43
К 8 мг (R)-трет-бутил-3-(4-амино-3-((5-(трифторметил)бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата полученного на представленной выше стадии 1, добавляли 500 мкл дихлорметана, и добавляли к ним 200 мкл трифторуксусной кислоты. Смесь перемешивали в течение 30 минут. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. К остатку добавляли 2 мл хлороформа и 11 мкл триэтиламина, и перемешивали смесь в условиях охлаждения на льду. К раствору добавляли 1,2 мкл акрилоилхлорида, и перемешивали смесь в течение 1 часа. Затем, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем очищали остаток, полученный после удаления растворителя, методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 1,58 мг указанного в заголовке соединения в виде белого твердого вещества.
[0207]
Пример 44
Синтез (R,E)-4-амино-N-(5-(трифторметил)бензо[d]оксазол-2-ил)-1-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 44)
К 5 мг (R)-трет-бутил-3-(4-амино-3-((5-(трифторметил)бензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пирролидин-1-карбоксилата, полученного на стадии 1, добавляли 500 мкл дихлорметана, а затем добавляли к ним 200 мкл трифторуксусной кислоты. Смесь перемешивали в течение 30 минут. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. Остаток растворяли в 1 мл DMF, и добавляли к нему 6,5 мкл DIPEA, 1,9 мг гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты и 4,3 мг HATU. Смесь перемешивали в течение 1 часа при комнатной температуре, а затем концентрировали раствор в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 2,88 мг указанного в заголовке соединения в виде белого твердого вещества.
[0208]
Пример 45
Синтез 1-(1-акрилоилазетидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоксамида (типовое соединение 45)
(Стадия 1) Синтез трет-бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
трет-Бутил-3-гидроксиазетидин-1-карбоксилат (240 мг) растворяли в 2 мл хлороформа, и при 0°C добавляли к нему 290 мкл триэтиламина и 130 мкл метансульфонилхлорида. После перемешивания смеси в течение 1 часа в условиях охлаждения на льду, к ней добавляли хлороформ и воду, и разделяли органический слой. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и водой, а затем сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. К остатку добавляли 300 мг 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина, синтезированного согласно способу, описанному в WO 2007/126841, 570 мг карбоната калия и 3 мл DMA, смесь нагревали до 100°C и перемешивали в течение 11 часов. Смесь охлаждали до комнатной температуры и экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом магния. Остаток очищали методом хроматографии на аминосиликагеле (гексан/этилацетат=1/1→0/1), и получали тем самым 232 мг указанного в заголовке соединения в виде бледно-желтого твердого вещества. Физические свойства: m/z [M+H]+ 417,1
[0209]
(Стадия 2) Синтез 4-амино-1-(1-(трет-бутилоксикарбонил)азетидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновой кислоты
трет-Бутил-3-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилат (262 мг), полученный на стадии 1, растворяли в 10 мл метанола и 1 мл триэтиламина. После замены атмосферы на монооксид углерода, к смеси добавляли 51 мг комплекса дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана, и нагревали смесь при 80°C в течение 14 часов. После охлаждения смеси, растворитель удаляли из раствора, к остатку добавляли 1 мл 1,4-диоксана, а затем добавляли 500 мкл 5н водного раствора гидроксида натрия. Смесь перемешивали в течение 3 часов при комнатной температуре, а затем корректировали смесь до pH 4 добавлением 2н соляной кислоты. Смесь охлаждали на льду, а твердое вещество, выпавшее в осадок после добавления к смеси воды, собирали путем фильтрования и сушили. Таким образом, получали 42 мг указанного в заголовке соединения в виде бледно-коричневого твердого вещества. Физические свойства: m/z [M+H]+ 335,2
[0210]
(Стадия 3) Синтез трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)азетидин-1-карбоксилата
4-Амино-1-(1-(трет-бутилоксикарбонил)азетидин-3-ил)-1H-пиразоло[3,4-d]пиримидин-3-карбоновую кислоту (42 мг), полученную на представленной выше стадии 2, растворяли в 3 мл DMF, добавляли к ней 24 мг CDI, и перемешивали смесь в течение ночи при комнатной температуре. Затем, к смеси добавляли 4 мг CDI, и перемешивали смесь в течение 30 минут. К раствору добавляли 42 мг 5-хлорбензо[d]оксазол-2-амина, смесь охлаждали на льду, и добавляли к ней 10 мг гидрида натрия (60%). После перемешивания смеси в течение 1 часа, реакцию останавливали водой, и растворитель удаляли. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 34 мг указанного в заголовке соединения в виде белого твердого вещества. Физические свойства: m/z [M+H]+ 485,2
[0211]
(Стадия 4) Синтез типового соединения 45
К 10 мг трет-бутил-3-(4-амино-3-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-1H-пиразоло[3,4-d]пиримидин-1-ил)азетидин-1-карбоксилата, полученного на представленной выше стадии 3, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. К остатку добавляли 1 мл хлороформа и 14 мкл триэтиламина, и перемешивали смесь в условиях охлаждения на льду. К раствору добавляли 1,7 мкл акрилоилхлорида, и перемешивали смесь в течение 1 часа. Затем, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем очищали остаток, полученный после удаления растворителя, методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 0,69 мг указанного в заголовке соединения в виде белого твердого вещества.
[0212]
Пример 46
Синтез 7-(1-акрилоилазетидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 46)
(Стадия 1) Синтез трет-бутил-3-(4-хлор-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)азетидин-1-карбоксилата
[0213]
[0214]
К раствору 2,00 г 4-хлор-5-йод-7H-пирроло[2,3-d]пиримидина, 1,86 г N-Boc-3-гидроксиазетидина и 3,75 г трифенилфосфина в 80 мл THF добавляли 2,3 мл DEAD, и перемешивали реакционную жидкость в течение 1 часа. Реакционную жидкость концентрировали и промывали этилацетатом, получая тем самым 2,55 г указанного в заголовке соединения в виде белого твердого вещества. Физические свойства: m/z [M+H]+ 435,0
[0215]
(Стадия 2) Синтез трет-бутил-3-(4-амино-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)азетидин-1-карбоксилата
[0216]
[0217]
К 1,5 г трет-бутил-3-(4-хлор-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)азетидин-1-карбоксилата, полученного на представленной выше стадии 1, добавляли 6 мл THF и 6 мл 28% водного аммиака, и перемешивали реакционную жидкость в течение 1,5 часов при 100°C в микроволновом реакторе. К смеси добавляли хлороформ и воду, и разделяли органический слой. Органический слой сушили над безводным сульфатом натрия, и отгоняли растворитель в условиях пониженного давления. Таким образом, получали 1,5 г указанного в заголовке соединения в виде белого твердого вещества. Физические свойства: m/z [M+H]+ 416,0
[0218]
(Стадия 3) Синтез трет-бутил-3-(4-амино-5-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)азетидин-1-карбоксилата
трет-Бутил-3-(4-амино-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)азетидин-1-карбоксилат (32 мг), полученный на представленной выше стадии 2, 20 мг 5-хлорбензо[d]оксазол-2-амина и 28 мкл диазабициклоундецена растворяли в 1 мл DMF, а затем добавляли 9 мг комплекса дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана. Смесь перемешивали в течение 1,5 часов при 80°C в атмосфере монооксида углерода. Смесь распределяли между хлороформом и водой, и сушили органический слой над безводным сульфатом натрия. Затем, очищали остаток, полученный после удаления растворителя, методом хроматографии на силикагеле (элюент: гексан/этилацетат=1/1 → этилацетат/метанол=10/1), и получали тем самым 20 мг указанного в заголовке соединения в виде бледно-коричневого твердого вещества. Физические свойства: m/z [M+H]+ 484,2
[0219]
(Стадия 4) Синтез типового соединения 46
К 5 мг трет-бутил-3-(4-амино-5-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)азетидин-1-карбоксилата, полученного на представленной выше стадии 3, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. К остатку добавляли 1 мл хлороформа и 14 мкл триэтиламина, и перемешивали смесь в условиях охлаждения на льду. К раствору добавляли 1,7 мкл акрилоилхлорида, и перемешивали смесь в течение 1 часа. Затем, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем очищали остаток, полученный после удаления растворителя, методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 2,21 мг указанного в заголовке соединения в виде белого твердого вещества.
[0220]
Пример 47
Синтез (E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(диметиламино)бут-2-еноил)азетидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 47)
К 5 мг трет-бутил-3-(4-амино-5-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)азетидин-1-карбоксилата, полученного на стадии 3 примера 46, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. Остаток растворяли в 1 мл DMF, и добавляли к нему 14,4 мкл DIPEA, 4,1 мг гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты и 9,4 мг HATU. После перемешивания смеси в течение 1 часа при комнатной температуре, раствор концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 4,67 мг указанного в заголовке соединения.
[0221]
Пример 48
Синтез (R)-7-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 48)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-хлор-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата
4-Хлор-5-йод-7H-пирроло[2,3-d]пиримидин (5,00 г), синтезированный согласно способу, описанному в WO 2005/042556, 19,1 г (S)-трет-бутил-3-(метилсульфонилокси)пирролидин-1-карбоксилата и 23,5 г карбоната цезия суспендировали в 25 мл ацетонитрила, и нагревали смесь в течение 3 часов при 60°C. После охлаждения суспензии, к ней добавляли воду и метанол, а полученное тем самым твердое вещество собирали путем фильтрования и сушили. Таким образом, получали 5,65 г указанного в заголовке соединения в виде бледно-коричневого твердого вещества.
[0222]
(Стадия 2) (R)-трет-бутил-3-(4-амино-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата
К 5 г (R)-трет-бутил-3-(4-хлор-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата, полученного на представленной выше стадии 1, добавляли 40 мл 28% водного аммиака, и перемешивали реакционную жидкость в течение 1,5 часов при 100°C в микроволновом реакторе. Смесь перемешивали в течение 1 часа в условиях охлаждения на льду, а полученное твердое вещество собирали путем фильтрования и промывали холодным метанолом. Таким образом, получали 3,91 г указанного в заголовке соединения в виде белого твердого вещества.
[0223]
(Стадия 3) Синтез (R)-трет-бутил-3-(4-амино-5-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата
трет-Бутил-3-(4-амино-5-йод-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилат (93 мг), полученный на представленной выше стадии 2, 110 мг 5-хлорбензо[d]оксазол-2-амина и 100 мкл диазабициклоундецена растворяли в 2 мл DMF, и добавляли к ним 35 мг комплекса дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) и дихлорметана. Смесь перемешивали в течение 2,5 часов при 80°C в атмосфере монооксида углерода. Смесь распределяли между хлороформом и водой, и сушили органический слой над безводным сульфатом натрия. Затем, очищали остаток, полученный после удаления растворителя, методом хроматографии на силикагеле (элюент: гексан/этилацетат=1/1 → этилацетат/метанол=10/1), и получали тем самым 106 мг указанного в заголовке соединения в виде бледно-коричневого твердого вещества. Физические свойства: m/z [M+H]+ 498,1
[0224]
(Стадия 4) Синтез типового соединения 48
К 20 мг (R)-трет-бутил-3-(4-амино-5-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата, полученного на представленной выше стадии 3, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. К остатку добавляли 2 мл хлороформа и 28 мкл триэтиламина, и перемешивали смесь в условиях охлаждения на льду. К раствору добавляли 3,2 мкл акрилоилхлорида, и перемешивали смесь в течение 1 часа. Затем, реакцию останавливали добавлением насыщенного водного раствора бикарбоната натрия, и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, а затем очищали остаток, полученный после удаления растворителя, методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)). Таким образом, получали 3,52 мг указанного в заголовке соединения в виде белого твердого вещества.
[0225]
Пример 49
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 49)
К 13 мг (R)-трет-бутил-3-(4-амино-5-((5-хлорбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата, полученного на стадии 3 примера 48, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. Остаток растворяли в 1 мл DMF, и добавляли к нему 14,4 мкл DIPEA, 4,1 мг гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты и 9,6 мг HATU. Смесь перемешивали в течение 1 часа при комнатной температуре, а затем концентрировали раствор в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 6,66 мг указанного в заголовке соединения.
[0226]
Пример 50
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(этил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 50)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 49, путем использования гидрохлорида (E)-4-(этил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0227]
Пример 51
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(диэтиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 51)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 49, путем использования гидрохлорида (E)-4-(диэтиламино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0228]
Пример 52
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(изопропил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 52)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 49, путем использования гидрохлорида (E)-4-(изопропил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0229]
Пример 53
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(пирролидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 53)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 49, путем использования гидрохлорида (E)-4-(пирролидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0230]
Пример 54
Синтез (R,E)-4-амино-N-(5-хлорбензо[d]оксазол-2-ил)-7-(1-(4-(пиперидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 54)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 49, путем использования гидрохлорида (E)-4-(пиперидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0231]
Пример 55
Синтез (R)-7-(1-акрилоилпирролидин-3-ил)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 55)
(Стадия 1) Синтез (R)-трет-бутил-3-(4-амино-5-((5-фенилбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата
Указанное в заголовке соединение получали в виде коричневого твердого вещества в соответствии с методикой, описанной на стадии 3 примера 48, путем использования 5-фенилбензо[d]оксазол-2-амина вместо 5-хлорбензо[d]оксазол-2-амина. Физические свойства: m/z [M+H]+ 540,3
[0232]
(Стадия 2) Синтез типового соединения 55
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной на стадии 4 примера 48, путем использования (R)-трет-бутил-3-(4-амино-5-((5-фенилбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата, полученного на представленной выше стадии 1.
[0233]
Пример 56
Синтез (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(диметиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 56)
К 13 мг (R)-трет-бутил-3-(4-амино-5-((5-фенилбензо[d]оксазол-2-ил)карбамоил)-7H-пирроло[2,3-d]пиримидин-7-ил)пирролидин-1-карбоксилата, полученного на стадии 1 примера 55, добавляли 1 мл смеси 4н соляная кислота/1,4-диоксан, и перемешивали смесь в течение 1 часа. После этого, растворитель удаляли, и подвергали остаток азеотропной перегонке с 1 мл толуола. Остаток растворяли в 1 мл DMF, и добавляли к нему 14,4 мкл DIPEA, 4,1 мг гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты и 9,6 мг HATU. После перемешивания смеси в течение 1 часа при комнатной температуре, раствор концентрировали в условиях пониженного давления. Остаток очищали методом препаративной HPLC с обращенной фазой (вода/ацетонитрил (0,1% муравьиная кислота)), и получали тем самым 6,66 мг указанного в заголовке соединения.
[0234]
Пример 57
Синтез (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(этил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 57)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 56, путем использования гидрохлорида (E)-4-(этил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0235]
Пример 58
Синтез (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(диэтиламино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 58)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 56, путем использования гидрохлорида (E)-4-(диэтиламино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0236]
Пример 59
Синтез (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(изопропил(метил)амино)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 59)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 56, путем использования гидрохлорида (E)-4-(изопропил(метил)амино)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0237]
Пример 60
Синтез (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(пирролидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 60)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 56, путем использования гидрохлорида (E)-4-(пирролидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0238]
Пример 61
Синтез (R,E)-4-амино-N-(5-фенилбензо[d]оксазол-2-ил)-7-(1-(4-(пиперидин-1-ил)бут-2-еноил)пирролидин-3-ил)-7H-пирроло[2,3-d]пиримидин-5-карбоксамида (типовое соединение 61)
Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной в примере 56, путем использования гидрохлорида (E)-4-(пиперидин-1-ил)бут-2-еновой кислоты вместо гидрохлорида (E)-4-(диметиламино)бут-2-еновой кислоты.
[0239]
Контрольный пример 1: Синтез (R)-1-(3-(4-амино-3-(4-феноксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-ил)проп-2-ен-1-он (контрольное соединение 1, PCI-32765)
Указанное в заголовке соединение получали в виде белого твердого вещества путем синтеза соединения в соответствии с методикой, описанной в способе согласно WO 2008/121742.
[0240]
Далее в данном документе, структурные формулы и физические свойства соединений примеров 1-61 и контрольного соединения 1 представлены в таблицах 2-14.
[0241]
[Таблица 2]
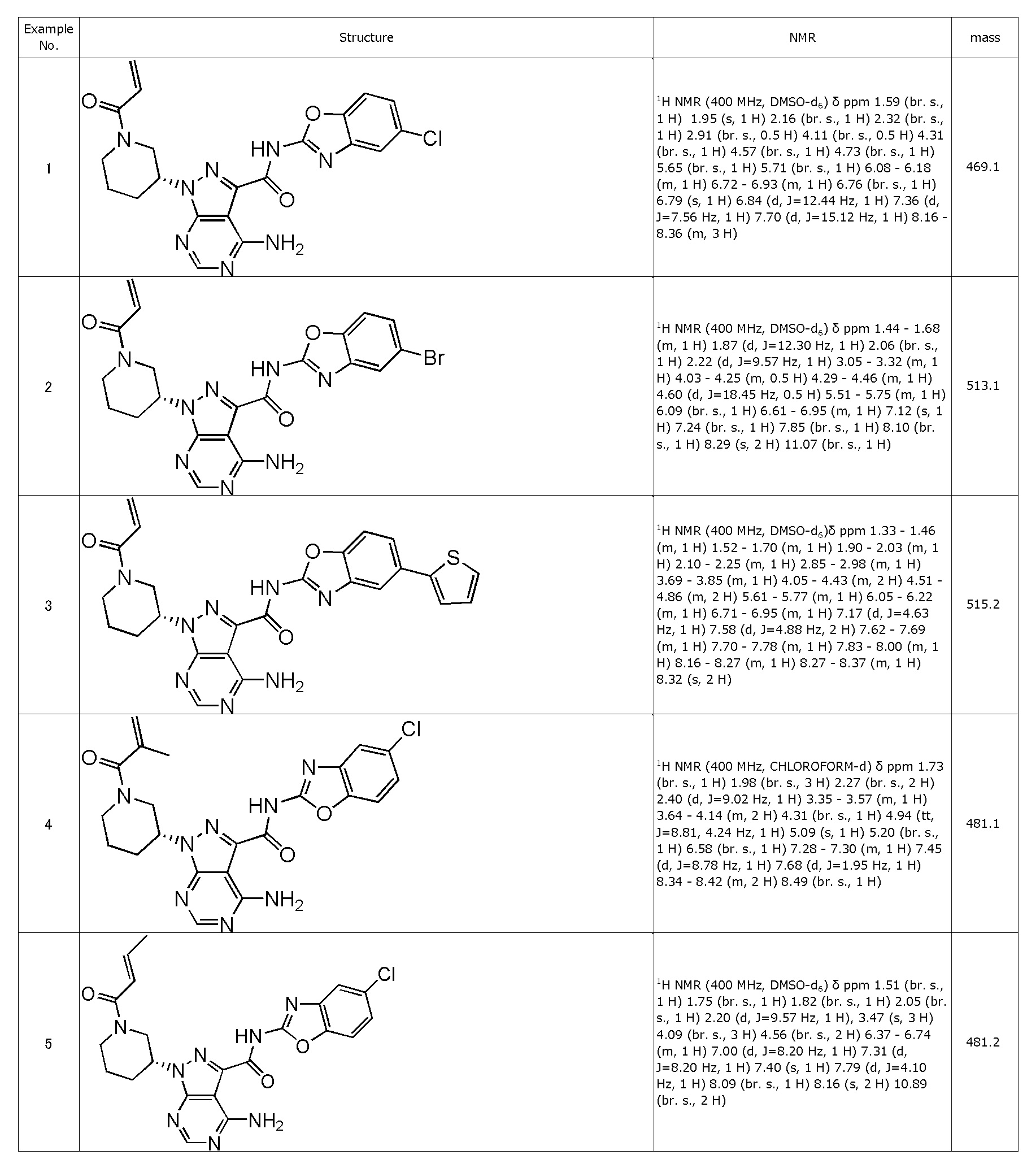
[0242]
[Таблица 3]
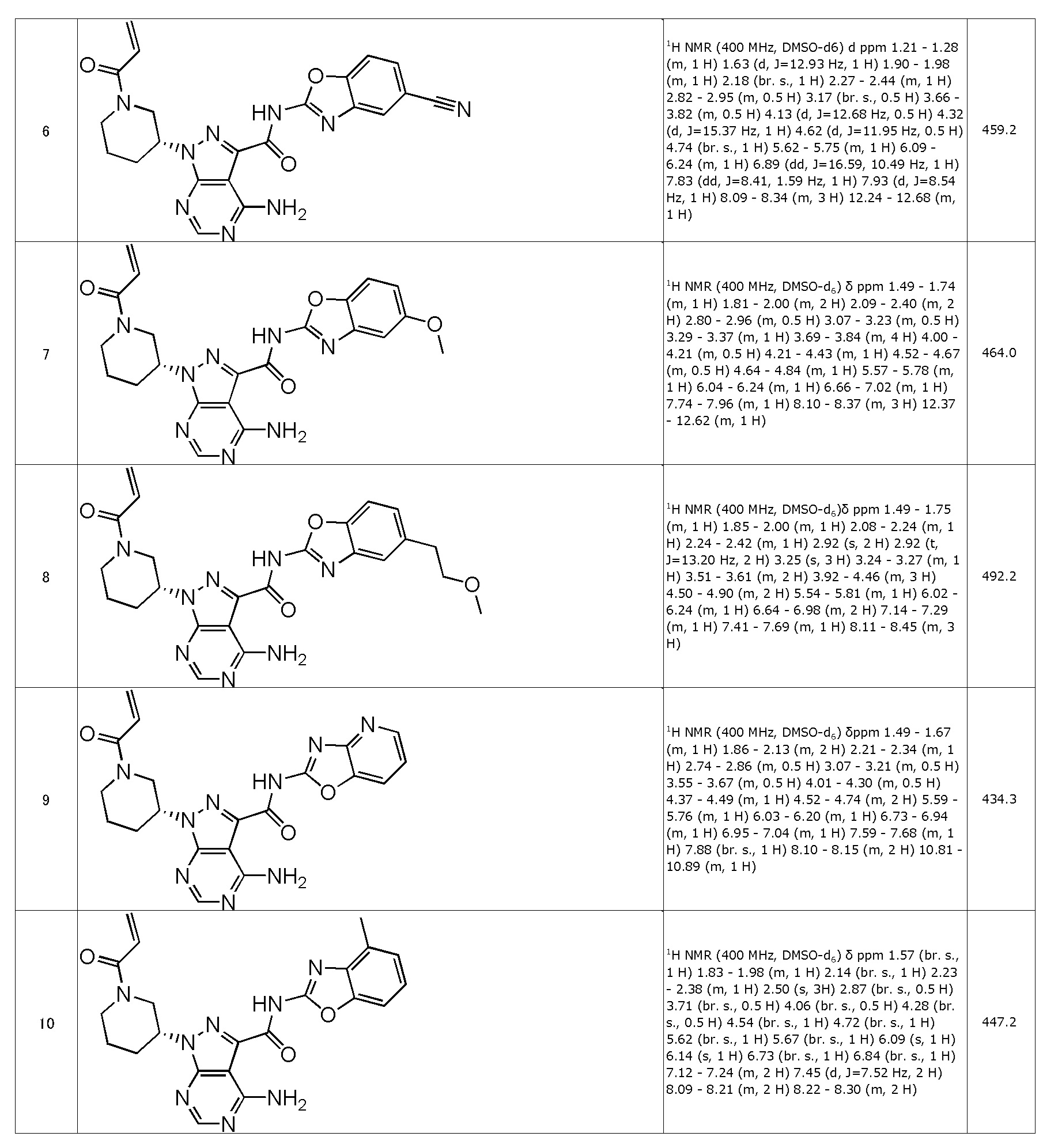
[0243]
[Таблица 4]
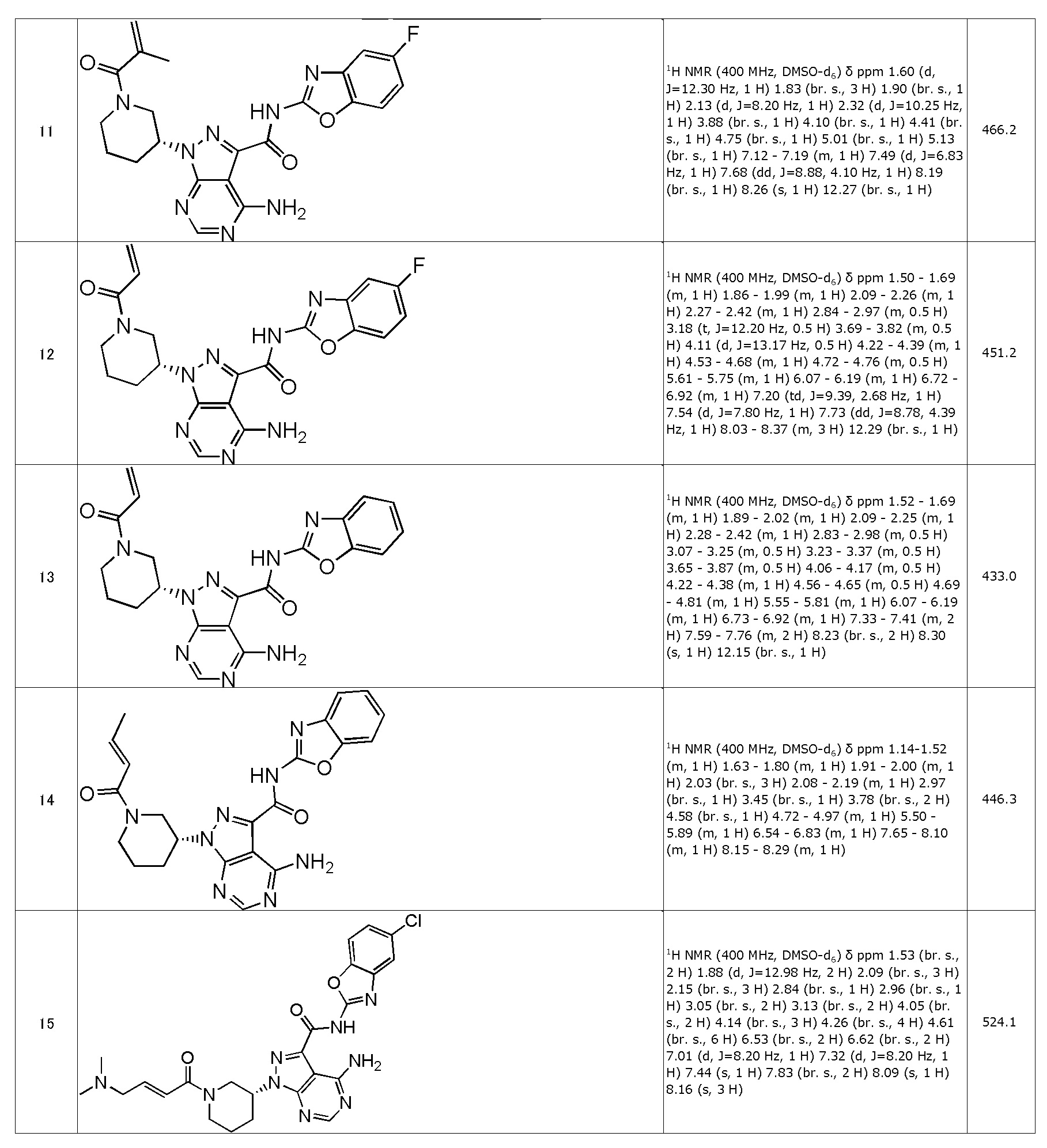
[0244]
[Таблица 5]
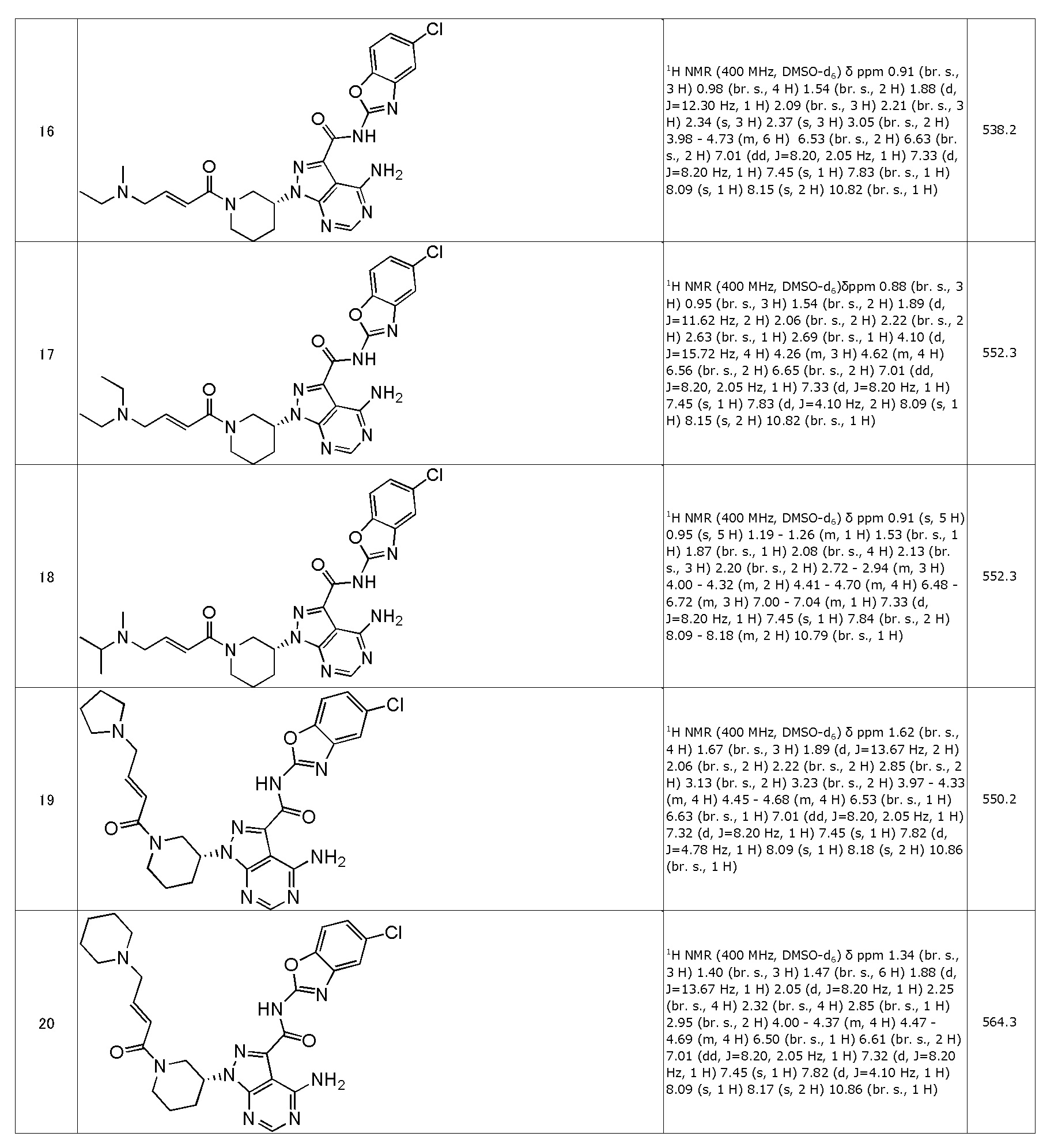
[0245]
[Таблица 6]
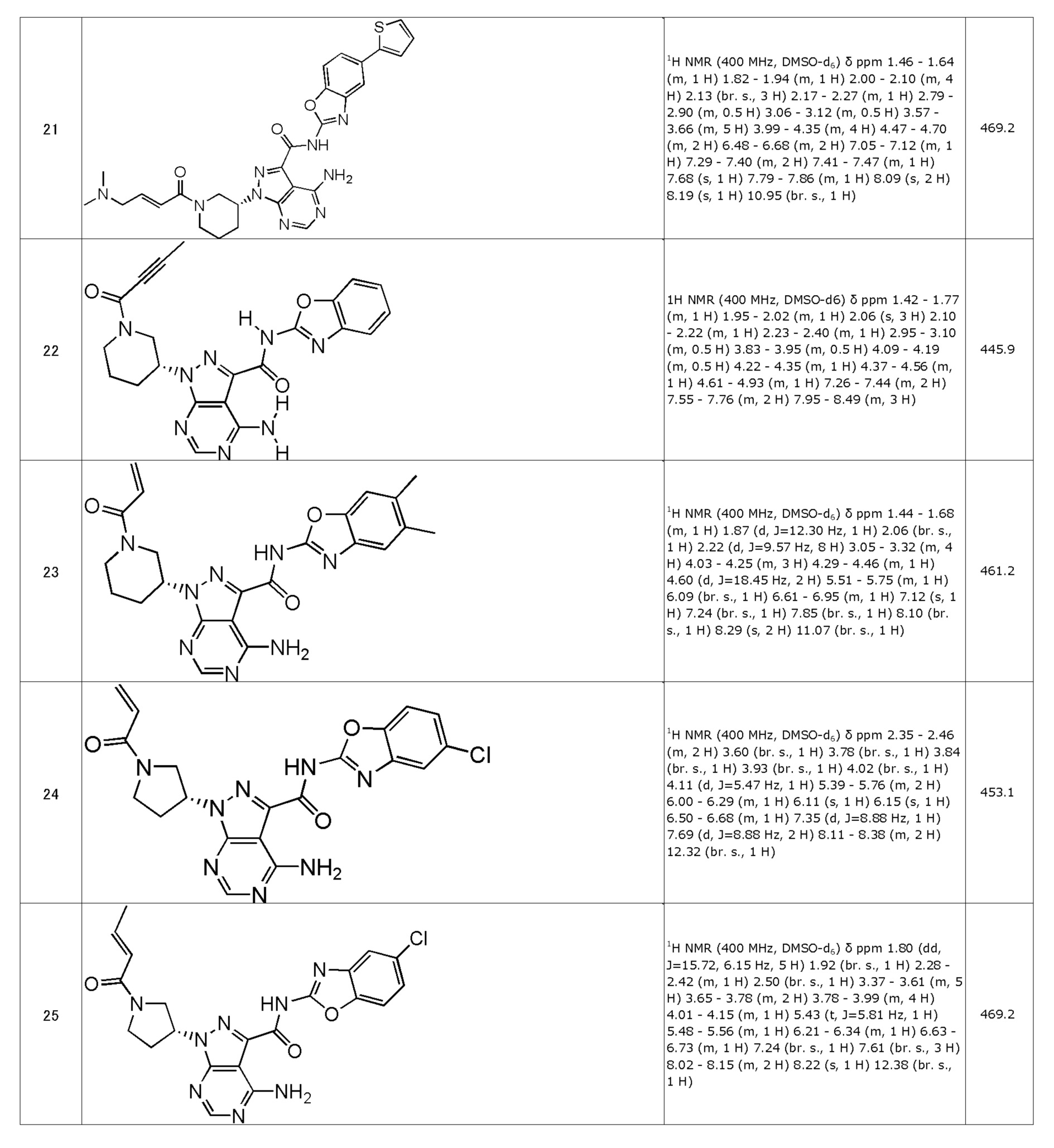
[0246]
[Таблица 7]
[0247]
[Таблица 8]
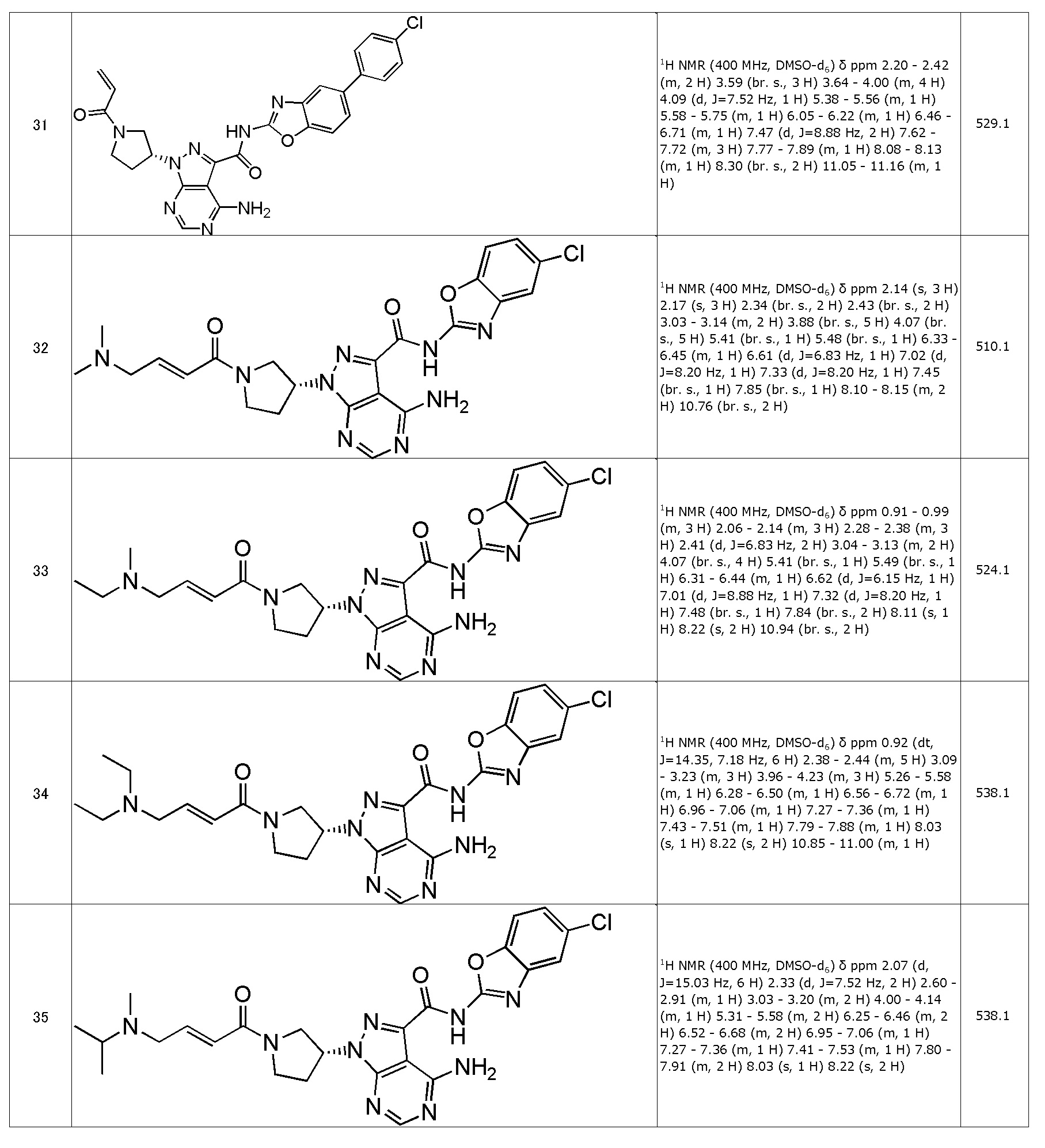
[0248]
[Таблица 9]
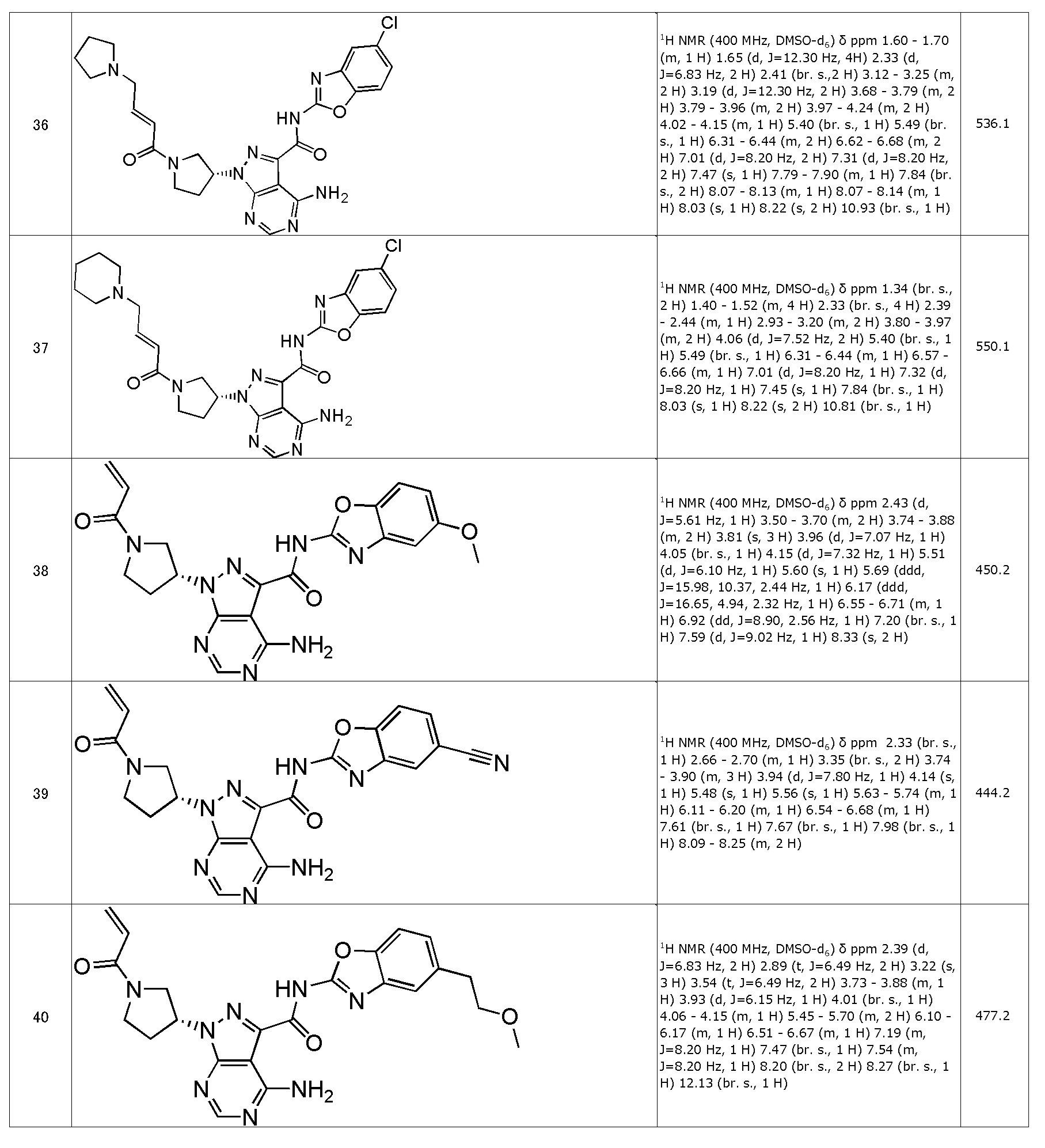
[0249]
[Таблица 10]

[0250]
[Таблица 11]

[0251]
[Таблица 12]
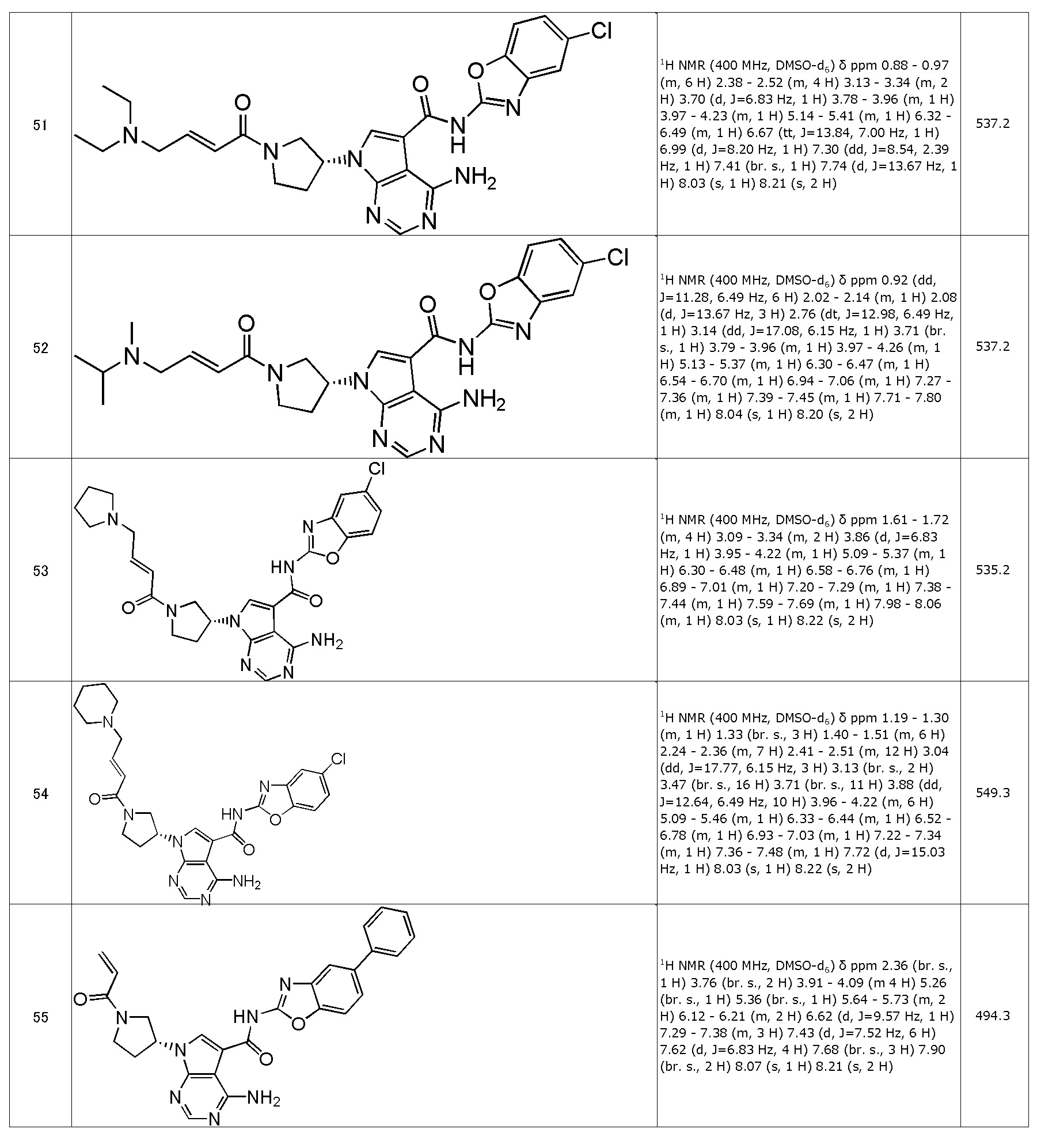
[0252]
[Таблица 13]
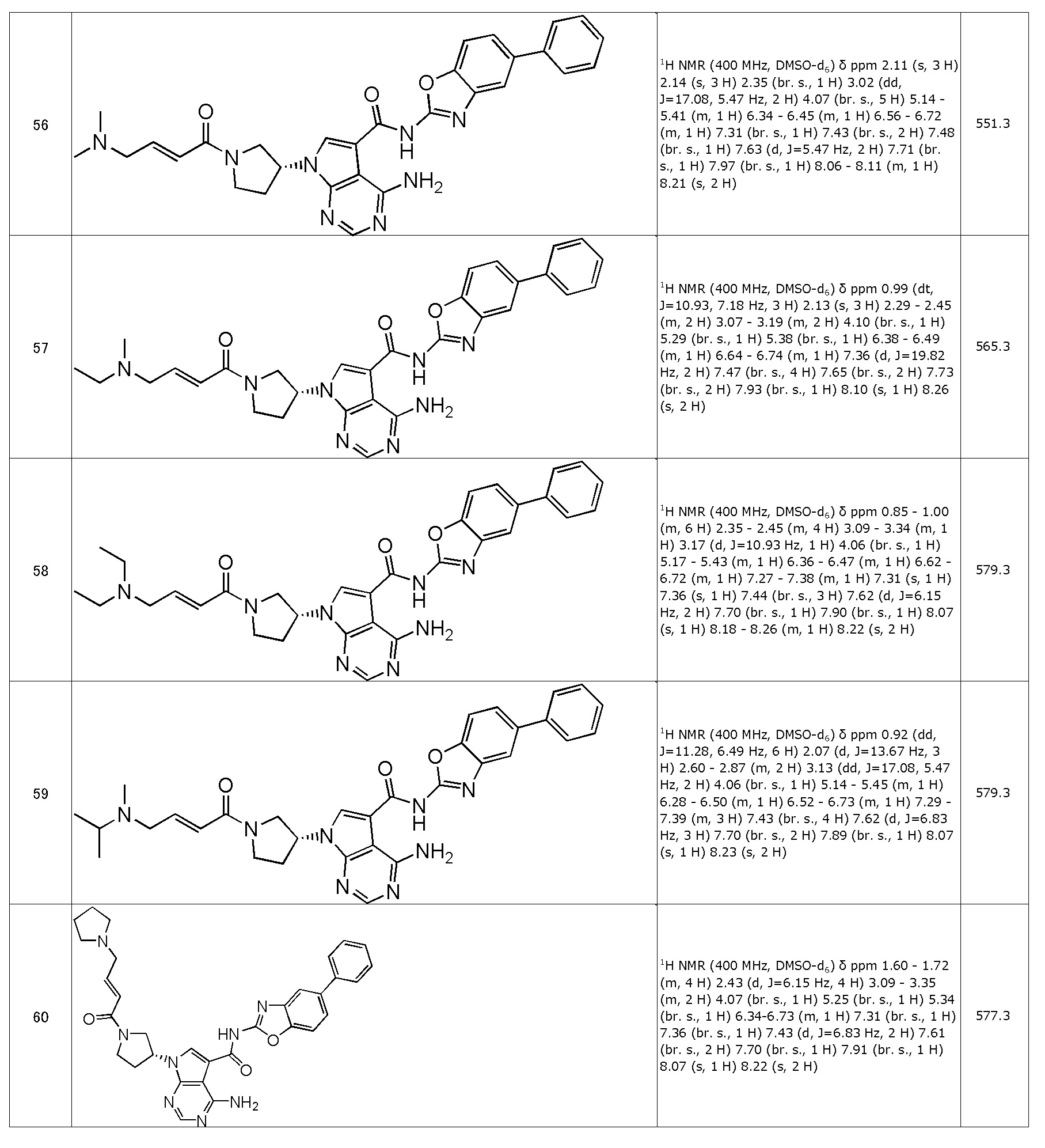
[0253]
[Таблица 14]
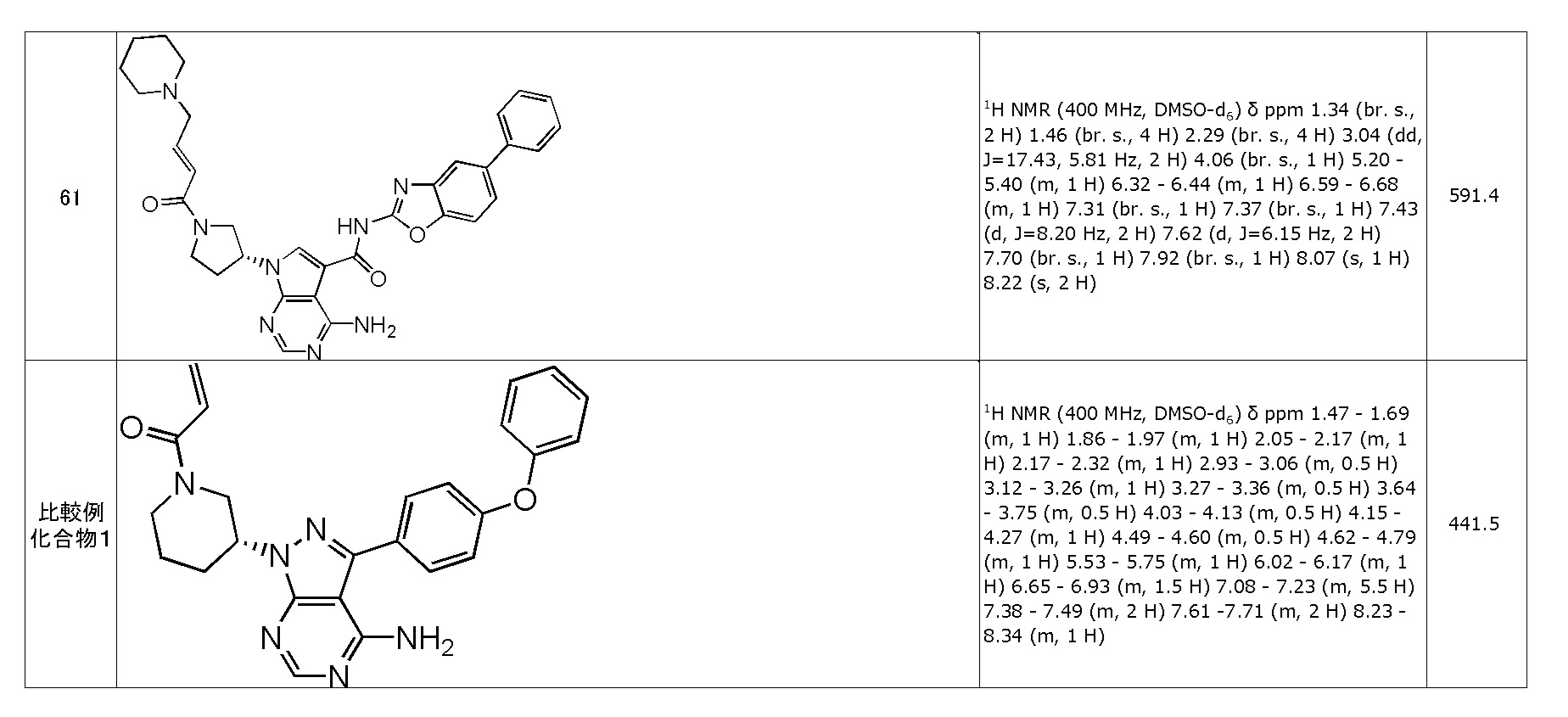
[0254]
Тестовый пример 1. Измерение ингибирующей активности в отношении ВТК (in vitro)
Применительно к параметрам условий для способа измерения ингибирующей активности соединения относительно ВТК киназной активности in vitro, в используемом каталоге цен поставок реагентов для LabChip (зарегистрированная торговая марка) серий PerkinElmer, Inc. описано, что FL-PEPTIDE 2 соответствует субстратному пептиду для измерения ВТК киназной активности. В этой связи, FL-PEPTIDE 2 использовали в качестве субстрата. Очищенный рекомбинантный белок ВТК человека, который использовали в тесте, приобретали в Carna Biosciences, Inc.
Применительно к измерению ингибирующей активности соединений, соединения согласно настоящему изобретению сначала поэтапно разбавляли DMSO. Затем, в буферный раствор для киназной реакции (20 мМ HEPES (pH 7,5), 2 мМ дитиотреитол, 0,01% Triton X-100) добавляли белок ВТК, субстратный пептид (конечная концентрация 1 мкМ), хлорид магния (конечная концентрация 1 мМ), АТФ (конечная концентрация 45 мкМ) и раствор соединений согласно настоящему изобретению в DMSO (конечная концентрация DMSO 5%), и после инкубации раствора в течение 40 минут при температуре 25°C проводили киназную реакцию. Реакцию завершали путем добавления в нее EDTA для получения конечной концентрации 30 мМ. В завершение, фосфорилированный субстратный пептид (S) и фосфорилированный пептид (P) разделяли и определяли посредством микроканального капиллярного электрофореза с помощью LabChip EZ Reader II (PerkinElmer, Inc.). Реакцию фосфорилирования количественно оценивали по соответствующим пиковым значениям S и P, и концентрация соединения, при которой реакция фосфорилирования могла быть супрессирована на 50%, определяли как значения IC50 (нМ). Результаты представлены ниже в таблицах с 15 по 17.
[0255]
[Таблица 15]
|
[0256]
[Таблица 16]
|
[0257]
[Таблица 17]
|
[0258]
Из этих результатов было обнаружено, что соединения согласно настоящему изобретению обладают ингибирующей активностью в отношении ВТК in vitro.
[0259]
Тестовый пример 2. Селективность ингибирования ВТК по сравнению с ингибирующей активностью в отношении EGFR киназы (in vitro)
1) Измерение ингибирующей активности в отношении ВТК
Ингибирующую активность в отношении ВТК измеряли тем же способом, что и описанный в Тестовом примере 1.
2) Измерение ингибирующей активности в отношении EGFR
Применительно к параметрам условий для способа измерения ингибирующей активности соединения в отношении киназной активности EGFR in vitro, в используемом каталоге цен поставок реагентов для LabChip (зарегистрированная торговая марка) серий PerkinElmer, Inc. описано, что FL-PEPTIDE 22 соответствует субстратному пептиду для измерения киназной активности EGFR. В этой связи, был получен биотнированный пептид (биотин-EEPLYWSFPAKKK), исходя их аминокислотной последовательности пептида. Очищенный рекомбинантный белок EGFR человека, использованный в тесте, приобретали в Carna Biosciences, Inc.
Применительно к измерениям ингибирующей активности соединений, соединения согласно настоящему изобретению сначала поэтапно разбавляли DMSO. Затем, в буферный раствор для киназной реакции (20 мМ HEPES (pH 7,5), 2 мМ дитиотреитол, 0,01% Triton X-100) добавляли белок EGFR, субстратный пептид (конечная концентрация 250 нM), хлорид магния (конечная концентрация 1 мМ), хлорид марганца (конечная концентрация 10 мМ), АТФ (конечная концентрация 1,5 мкМ) и раствор соединений согласно настоящему изобретению в DMSO (конечная концентрация DMSO 2,5%), и после инкубации раствора в течение 120 минут при температуре 25°C проводили киназную реакцию. Реакцию завершали путем добавления в нее EDTA с получением конечной концентрации 24 мМ. Затем к смеси добавляли детекторную жидкость, содержащую Eu-меченое антитело PT66 против фосфорилированного тирозина (PerkinElmer, Inc.) и SureLight APC-SA (PerkinElmer, Inc.), и оставляли систему отстаиваться в течение 2 часов или дольше при комнатной температуре. В завершение, после воздействия возбуждающим светом с длиной волны 337 нм измеряли интенсивность флуоресценции при двух длинах волн 620 нм и 665 нм с помощью PHERAstar FS (BMG Labtech GmbH). Реакцию фосфорилирования количественно оценивали из соотношения значений интенсивности флуоресценции при двух длинах волн, и концентрацию соединения, при которой реакция фосфорилирования могла быть супрессирована на 50%, определяли как значения IC50 (нМ).
3) Селективность ингибирования ВТК
На основании результатов, полученных в вышеприведенных пунктах 1) и 2), вычисляли величину «значение IC50 (нМ) ингибирующей активности в отношении EGFR/значение IC50 (нМ) ингибирующей активности в отношении ВТК», и определяли тем самым селективность ингибирования ВТК тестируемым соединением.
[0260]
[Таблица 18]
|
[0261]
[Таблица 19]
|
[0262]
Из результатов этого теста стало очевидно, что селективность ингибирования ВТК по сравнению с EGFR киназой in vitro соединением согласно настоящему изобретению была выше приблизительно в 7,5 раз или более в сравнении с таковой для контрольного соединения 1, и что соединения согласно настоящему изобретению характеризуются превосходной селективностью ингибирования ВТК. Эти результаты демонстрируют, что соединения согласно настоящему изобретению могут снижать побочные эффекты по сравнению с существующими ингибиторами ВТК.
[0263]
Тестовый пример 3. Тест на измерение ингибирования пролиферации линий клеток, экспрессирующих ВТК и EGFR (in vitro), и сравнение их селективности.
Клетки TMD8 из клеточной линии диффузной крупноклеточной В-клеточной лимфомы, экспрессирующей ВТК, суспендировали в среде RPMI1640 (Life Technologies Corp.), содержащей 10% фетальную бычью сыворотку. Клетки A431 из клеточной линии сильно активированной эпидермоидной карциномы человека, оверэкспрессирующей EGFR, суспендировали в среде DMEM с высоким содержанием глюкозы (Life Technologies Corp.), содержащей 10% фетальную бычью сыворотку. Клеточные суспензии инокулировали в каждую лунку 384-луночных плоскодонных микропланшетов, и культивировали клетки в течение одних суток при температуре 37°C в инкубаторе с содержанием 5% диоксида углерода. Соединения согласно настоящему изобретению и контрольное соединение 1 растворяли в DMSO, и разбавляли растворы DMSO до 500-кратной конечной концентрации тестируемого соединения. Раствор тестируемых соединений в DMSO разбавляли средой, используемой для суспензии каждых клеток, и добавляли его в каждую из лунок культуральных планшетов так, чтобы конечная концентрация DMSO составляла 0,2%. Клетки затем культивировали в течение трех суток при температуре 37°C в инкубаторе с содержанием 5% диоксида углерода. Подсчет числа клеток перед добавлением соединений и после культивирования в течение трех суток в присутствии соединений проводили с помощью CELLTITER GLO (Promega Corp.) на основании протокола, рекомендуемого Promega Corp. Коэффициент ингибирования пролиферации вычисляли по следующей формуле, и определяли концентрацию тестируемого соединения, ингибирующую на 50% (GI50 (нМ)).
[0264]
Коэффициент ингибирования пролиферации (%) =
= (C - T)/(C - C0) × 100
T: Интенсивность люминесценции в лунке, в которую было добавлено тестируемое соединения
C: Интенсивность люминесценции в лунке, в которую не было добавлено тестируемое соединение
C0: Интенсивность люминесценции в лунке, измеренная перед добавлением тестируемого соединения
[0265]
После проведения сравнения между эффектом ингибирования пролиферации клеток в отношении клеток A431, которая зависит от передачи EGFR сигнала пролиферации, и эффектом ингибирования пролиферации клеток в отношении клеток TMD8, которая зависит от передачи BTK сигнала пролиферации, можно оценить влияние соответствующих киназ на клеточном уровне. Другими словами, если вычислено соотношение «коэффициент ингибирования пролиферации клеток A431/коэффициент ингибирования пролиферации клеток TMD8», то считается, что чем больше значение этого соотношения, тем в клетках выше селективность в отношении ВТК по сравнению с EGFR. Значения соотношения «коэффициент ингибирования пролиферации клеток A431/коэффициент ингибирования пролиферации клеток TMD8» приведены в таблице 20 и таблице 21.
[0266]
[Таблица 20]
|
[0267]
[Таблица 21]
|
[0268]
Из результатов этого теста стало очевидно, что селективность ингибирования ВТК по сравнению с EGFR киназой, выраженная коэффициентом ингибирования пролиферации клеток (in vitro), соединениями согласно настоящему изобретению была выше приблизительно в 8,5 раз или более по сравнению с контрольным соединением 1, и что соединения согласно настоящему изобретению также обладают превосходной ингибирующей селективностью в отношении ВТК не только н уровне киназ, но также на клеточном уровне. Эти результаты демонстрируют, что соединения согласно настоящему изобретению могут снижать побочные эффекты по сравнению с существующими ингибиторами ВТК.
[0269]
Тестовый пример 4. Ингибирующий эффект в отношении активации В-клеток с использованием клеток Ramos
Клеточную линию Ramos, полученную из В-клеточной лимфомы человека, суспендировали в среде RPMI1640, а затем инокулировали клетки в культуральный планшет в концентрации 2,0 × 106 (клеток на лунку). Клетки культивировали в CO2 инкубаторе (Sanyo Electric Biomedical Co., Ltd.) при температуре 37°C в течение 12 часов. Каждое из контрольного соединения 1, тестируемого соединения 12 и тестируемого соединения 13 поэтапно разбавляли DMSO, добавляли разведение в инокулированный клетками планшет, и культивировали клетки в CO2 инкубаторе в течение 1 часа. Затем, осуществляли стимуляцию в течение 10 минут козьими F(ab')2 антителами к IgM UNLB человека (southern biotech Corp.). Затем, клетки собирали, и добавляли к клеточному осадку 50 мкл клеточного экстракта (NP-40; Invitrogen, Inc.), содержащего 1× ингибитор протеаз (Hoffmann-La Roche AG) и 1× коктейль ингибиторов фосфатаз (Sigma-Aldrich Co.)). Клеточные осадки оставляли отстаиваться в течение 10 минут на льду. Количество белка в собранном клеточном экстракте количественно анализировали посредством метода анализа белка DC (Bio-Rad Laboratories, Inc.), и 20 мкг белков наносили на трек Criterion TGXTM (Bio-Rad Laboratories, Inc.). После проведения электрофореза, проводили вестерн-блоттинг с помощью Trans-BlotTM TurboTM (Bio-Rad Laboratories, Inc.). Затем, фосфорилированный белок ВТК и белок ВТК определяли с помощью LAS4000 (GE Healthcare, Inc.) с люминофорным (pY223) анти-BTK антителом (EPITOMICS Inc.) и с анти-ВТК антителом (Abcam, plc.). Далее, из интенсивности люминесценции каждого из определяемых белков получали соотношение фосфорилированного белка ВТК к белку ВТК, и концентрация соединения, при которой фосфорилированный белок ВТК мог быть супрессирован на 50%, определяли как значение IC50 (нМ). В таблице 22 представлены концентрации ингибирования фосфорилированной BTK (IC50 (нМ)).
[0270]
По данным таблицы 22 видно, что контрольное соединение 1 характеризуется ингибированием фосфорилирования ВТК при 0,70 нМ, тогда как соединения согласно настоящему изобретению демонстрируют такое же или более высокое ингибирование фосфорилирования ВТК, и было обнаружено, что соединения согласно настоящему изобретению ингибируют активационный сигнал В-клеток посредством стимулирования В-клеточного рецептора.
Известно, что нацеленный на В-клетки ритуксан эффективен при аутоиммунных заболеваниях, индуцированных аутоантителами, включая ревматоидный артрит (непатентный документ: Rastetter et al., Annu Rev Med, 55, 2004).
Поскольку в тесте было подтверждено, что соединения согласно настоящему изобретению супрессируют активацию В-клеток посредством стимулирования В-клеточного рецептора, предполагалось, что соединения согласно настоящему изобретению продемонстрируют превосходную лекарственную эффективность в отношении аутоиммунных заболеваний, ассоциированных с В-клетками, вовлеченными в продукцию аутоантител.
[0271]
[Таблица 22]
|
[0272]
Тестовый пример 5. Ингибирующий эффект в отношении аллергической реакции с использованием RBL-2H3 клеток
Клетки базофильного лейкоза крыс RBL-2H3 суспендировали в среде MEM, содержащей 10% FBS, и затем инокулировали клетки в культуральный планшет и культивировали в CO2 инкубаторе (Sanyo Electric Biomedical Co., Ltd.) при температуре 37°C в течение 12 часов. После удаления культурального супернатанта и промывания клеток, к ним добавили раствор анти-DNP-мышиного IgE (Alpha Diagnostic Inc.), и культивировали клетки в CO2 инкубаторе в течение 1 часа. После удаления культурального супернатанта и промывания клеток, к ним добавили среду MEM. Каждое из контрольного соединения 1, тестируемого соединения 1, тестируемого соединения 12 и тестируемого соединения 13 поэтапно разбавляли DMSO, и добавляли разведение в инокулированный клетками планшет, и культивировали клетки в CO2 инкубаторе в течение 30 минут.
Далее, туда добавляли раствор DNP-BSA (LSL, Inc.), и культивировали клетки в CO2 инкубаторе в течение 15 минут. Культуральный супернатант собирали, инициировали реакцию с набором PGD2-MOX EIA (Cayman Chemical Inc.) на основании приложенного к нему протокола, и измеряли оптическую плотность с помощью SUNRISE RAINBOW THERMO (TECAM Inc.). Количество PGD2 в культуральном супернатанте вычисляли на основании измеренной оптической плотности, и концентрацию вещества, при которой количество продуцируемого PGD2 могло быть супрессировано на 50% по сравнению с контролем, определяли как значения IC50 (нМ). В таблице 23 представлены концентрации, при которых ингибировалась продукция PGD2 (IC50 (нМ)).
[0273]
По данным таблицы 23 видно, что контрольное соединение 1 демонстрирует ингибирование продукции PGD2 в концентрации приблизительно 350 нМ, тогда как соединения согласно настоящему изобретению демонстрируют способность ингибировать продукцию PGD2 намного сильнее, чем контрольное соединение 1.
Если антитела IgE связаны с рецепторами FCε тучных клеток, и эти антитела перекрестно связаны с антигеном, то тучные клетки активируются, и экскретируются и секретируются различные химические медиаторы (гистамин, PGD2 или лейкотриен). Известно, что такие медиаторы в значительной степени ассоциированы с возникновением аллергических заболеваний, например, бронхиальной астмы и аллергического ринита (непатентный документ: Ellmeier W., et al., FEBS Journal., 278, 2011).
Поскольку было подтверждено, что соединения согласно настоящему изобретению регулируют экскрецию или секрецию химических медиаторов тучных клеток в каскаде рецептора FCε, было сделано предположение, что соединения согласно настоящему изобретению продемонстрируют превосходную лекарственную эффективность в отношении аллергических заболеваний.
[0274]
[Таблица 23]
|
[0275]
Тестовый пример 6. Модель коллаген-индуцированного артрита у мышей (профилактический эффект)
Тест проводили в соответствии со способом, описанным в непатентном документе (Brand DD, et al., Nat Protoc. 2007; 2,1269-1275, Xu D. et al., JPET, 2012 Apr; 341(1): 90-103). Семинедельным самцам мышей DBA/1 (CHARLES RIVER LABORATORIES JAPAN, INC.) внутрикожно инъецировали в спину 100 мкл раствора (эмульсии) смешанного в равных количествах из 4 мг/мл раствора бычьего коллагена 2 типа (Collagen Research Center) и полного адъюванта Фрейнда (DIFCO Inc.) (начальная иммунизация). Спустя 21 сутки после этого, мышам внутрикожно в основание хвоста инъецировали 100 мкл раствора (эмульсии) смешанного в равных количествах из 4 мг/мл раствора бычьего коллагена 2 типа (Collagen Research Center) и полного адъюванта Фрейнда (DIFCO Inc.) для проведения дополнительной иммунизации. Один раз в сутки перорально вводили основу, тестируемое соединение 12, тестируемое соединение 13 или контрольное соединение 1 в течение 21 суток, включая сутки, в которые проводили дополнительную иммунизацию (заданы как 0 сутки). Симптомы артрита на 0 сутки, 4 сутки, 7 сутки, 10 сутки, 14 сутки, 17 сутки и 21 сутки оценивали невооруженным глазом (0: без изменений, 1: отек одного пальца, 2: отек двух пальцев или более, 3: отек плюсны, 4: отек всех пальцев помимо отека, распространяющегося на запястье/голеностоп) и получали суммарное значение для четырех конечностей в качестве характеристики индивидуума (максимально 16 пунктов) для сравнения эффекта в той же модели в каждой из групп введения. Результаты представлены на фигуре 1.
Исходя из данных фигуры 1, было подтверждено, что соединения согласно настоящему изобретению полностью супрессируют рост индекса по шкале артрита после дополнительной иммунизации по сравнению с контрольным соединением 1, и что соединения согласно настоящему изобретению обладают превосходным профилактическим эффектом применительно к заболеваемости ревматоидным артритом. Кроме того, в дозах, в которых использовались тестируемые соединения, не наблюдалось проявлений токсичности, например, существенного снижения массы тела или кожных нарушений, включая выпадение волос.
[0276]
Тестовый пример 7. Модель коллаген-индуцированного артрита у мышей (терапевтический эффект)
Тест проводили в соответствии со способом, описанным в непатентном документе (Brand DD, et al., Nat Protoc. 2007; 2,1269-1275, Xu D. et al., JPET, 2012 Apr; 341(1): 90-103). Семинедельным самцам мышей DBA/1 (CHARLES RIVER LABORATORIES JAPAN, INC.) внутрикожно инъецировали в спину 100 мкл раствора (эмульсии) смешанного в равных количествах из 4 мг/мл раствора бычьего коллагена 2 типа (Collagen Research Center) и полного адъюванта Фрейнда (DIFCO Inc.) (начальная иммунизация). Спустя 21 сутки после этого, мышам внутрикожно инъецировали в основание хвоста 100 мкл раствора (эмульсии) смешанного в равных количествах из 4 мг/мл раствора бычьего коллагена 2 типа (Collagen Research Center) и полного адъюванта Фрейнда (DIFCO Inc.) для проведения дополнительной иммунизации. Один раз в сутки перорально вводили основу, тестируемое соединение 13 или контрольное соединение 1 в течение 15 суток, начиная с шестых суток после дополнительной иммунизации в качестве суток начала введения (0 сутки). Симптомы артрита на 0 сутки, 4 сутки, 7 сутки, 11 сутки и 14 сутки, оценивали невооруженным глазом (0: без изменений, 1: отек одного пальца, 2: отек двух пальцев или более, 3: отек плюсны, 4: отек всех пальцев помимо отека, распространяющегося на запястье/голеностоп), и получали суммарное значение для четырех конечностей в качестве характеристики индивидуума (максимально 16 пунктов). Результаты представлены на фигуре 2.
[0277]
Исходя из данных фигуры 2, было подтверждено, что соединения согласно настоящему изобретению снижают индекс по шкале артрита, тогда как контрольное соединение 1 отсрочивает дальнейший рост повышенного индекса по шкале артрита, и что соединения согласно настоящему изобретению обладают превосходным терапевтическим эффектом в отношении ревматоидного артрита, который уже проявился. Кроме того, в дозах, в которых использовались тестируемые соединения, не наблюдалось проявлений токсичности, например, существенного снижения массы тела или кожных нарушений, включая выпадение волос.
[0278]
Тестовый пример 8. Модель коллаген-индуцированного артрита у мышей (терапевтический эффект)
Тест, аналогичный представленному в тестовом примере 7, проводили с использованием основы, тестируемого соединения 12 и контрольного соединения 1. Результаты представлены на фигуре 3.
[0279]
Исходя из данных фигуры 2, было подтверждено, что соединения согласно настоящему изобретению значительно снижают индекс по шкале артрита, тогда как контрольное соединение 1 отсрочивает дальнейший рост повышенного индекса по шкале артрита, и что соединения согласно настоящему изобретению обладают превосходным терапевтическим эффектом в отношении ревматоидного артрита, который уже проявился. Кроме того, в дозах, в которых использовались тестируемые соединения, не наблюдалось проявлений токсичности, например, существенного снижения массы тела или кожных нарушений, включая выпадение волос.
[0280]
Тестовый пример 9. Модель антиген-индуцированного дерматита у мышей
Модели аллергии I типа, сопровождающиеся кожными симптомами (модель дерматита), были получены на мышах TNP-IgE (CLEA Japan, Inc.). Мыши представляют собой генномодифицированных мышей BALB/c, которые постоянно продуцируют IgE, специфичный к гаптену TNP (тринитрофенол), который широко используется в качестве аллергена (антиген). Аллергическую реакцию у мышей можно индуцировать только путем введения аллергена без проведения иммунизации. Раствор 0,025% хлорида пикрила (NACALAI TESQUE, INC.) в ацетоне, который представляет собой аллерген, наносили на кожу уха обоих ушей мышей в количестве 10 мкл на ухо, и через 2 часа после нанесения антигена измеряли утолщение ушей с помощью индикаторного толщинометра (Ozaki Mfg., PEACOCK G-2M). Среднее значение величин утолщения обоих ушей получали в виде значения для отдельной особи (при условии, что предыдущее значение перед нанесением аллергена составляло 0 мм). Основу, контрольное соединение 1, тестируемое соединение 1, тестируемое соединение 6, тестируемое соединение 12 или тестируемое соединение 13 вводили перорально за 30 минут до нанесения аллергена.
Коэффициент усиления отека уха (%) вычисляли по следующей формуле. Результаты представлены в таблице 24.
[0281]
Коэффициент усиления отека уха (%)=(1-(Среднее значение утолщения уха в группе, получавшей соединение)/(Среднее значение утолщения уха в группе, получавшей основу)) × 100
[0282]
[Таблица 24]
|
[0283]
Исходя из данных таблицы 24, было подтверждено, что тестируемое соединение 1, тестируемое соединение 6, тестируемое соединение 12 и тестируемое соединение 13 в низкой дозе каждого соединения супрессируют отек уха, индуцированный нанесением аллергена, эквивалентно или сильнее по сравнению с контрольным соединением 1, и что соединения согласно настоящему изобретению демонстрируют превосходную лекарственную эффективность в отношении атопического дерматита.
[0284]
Тестовый пример 10. Модель антиген-индуцированного ринита у морских свинок
Модель аллергии I типа, сопровождающуюся закупоркой носового хода (модель ринита), получали с использованием морских свинок (Japan SLC, Inc.). Модельных животных сенсибилизировали путем подкожного введения 1 мл физиологического солевого раствора, содержащего 1 мг/мл овальбумина (OVA раствор), с использованием 1 мл шприца с иглой 23G, и сутки сенсибилизации принимали за 0 сутки. Аллергическую реакцию можно индуцировать путем введения каждой особи 20 мкл 10 мг/мл раствора OVA в обе назальные полости на 7 сутки, 14 сутки и 21 сутки. Однократное пероральное введение основы или тестируемого соединения 13 проводили за два часа до индукции антигеном на 21 сутки. На 20 сутки, в полостях носа особей по отдельности измеряли значения резистентности в качестве предварительного значения для особи, и на 21 сутки через 15 минут и через 240 минут после индукции антигеном в назальных полостях измеряли значения резистентности.
[0285]
Значения резистентности в назальных полостях (степень изменения (%)) вычисляли по следующей формуле. Результаты представлены на фигуре 4.
[0286]
Значение резистентности в назальной полости (степень изменения (%))=((Значения резистентности в назальной полости в группе, получавшей основу, или в группе, получавшей тестируемое соединение (15 минут или 240 минут; 21 сутки))/(Значение резистентности в назальной полости в группе, получавшей основу, или в группе, получавшей тестируемое соединение (предварительное значение; 20 сутки)) - 1) × 100
[0287]
По сравнению с группой, получавшей основу, в которой в связи с индукцией антигеном продемонстрировано увеличение резистентности в назальных полостях, тестируемое соединение 13 супрессировало увеличение резистентности в назальных полостях на ранней фазе и на поздней фазе в дозозависимой форме, в соответствии с данными на фигуре 4. Таким образом, было подтверждено, что соединения согласно настоящему изобретению демонстрируют превосходную эффективность в отношении аллергического ринита или поллиноза.
[0288]
Тестовый пример 11. Влияние повторного введения соединений согласно настоящему изобретению на массу тела крыс SD (in vivo)
Влияние на увеличение массы тела крыс SD посредством повторного введения контрольного соединения 1 и соединений согласно настоящему изобретению в течение двух недель, сравнивали с таковым в группе, получавшей основу. Крыс делил на группы, как указано далее, по четыре животных в каждой группе, посредством случайного распределения, так чтобы среднее значение массы тела в соответствующих группах было практически одинаковым (1 сутки).
Группа 1: Контрольное соединение 1 (280 мг/кг) вводили перорально однократно в сутки; Группа 2: Тестируемое соединение 12 (750 мг/кг) вводили перорально однократно в сутки; и Группа 3: Тестируемое соединение 13 (750 мг/кг) вводили перорально однократно в сутки.
Изменение массы тела (BWC) использовали в качестве индекса, указывающего на системную токсичность, обусловленную введением соединения. Значение BWC вычисляют по следующей формуле.
[0289]
BWC (%)=([(Масса тела крысы на 14 сутки после введения) -(Масса тела крысы на момент деления на группы)]/(Масса тела крысы на момент деления на группы)) × 100
[0290]
Относительную степень изменения массы тела в каждой группе, получавшей соединение, вычисляли по следующей формуле, принимая за 1 значение BWC в группе, получавшей основу, и результаты приведены в таблице 25.
[0291]
Относительная степень изменения массы тела (%)=(BWC в группе, получавшей соединение)/(BWC в группе, получавшей основу) × 100
[0292]
[Таблица 25]
|
[0293]
Согласно результатам, диапазон увеличения массы тела крысы в группе 1, которая представляет собой группу, получавшую контрольное соединение 1, был очень мал по сравнению с группой, получавшей основу. В свою очередь, в группах 2 и 3, которые представляют собой группы, получавшие соединения согласно настоящему изобретения, увеличение массы тела крысы было почти не изменено. Соединения согласно настоящему изобретению вводили в 2,5-кратном и более количестве по сравнению с контрольным соединением 1 (приблизительно в 5-кратном количестве относительно AUC0-24 (мкМ: ч)). Кроме того, в группе 1 было обнаружено, что особи страдают склонностью к поносу; однако в группах 2 и 3 таких особей обнаружено не было. Следовательно, соединения согласно настоящему изобретению обладают превосходным эффектом касательно того, что уровень побочных эффектов низок, несмотря на то, что используемое количество намного больше, чем используемое количество контрольного соединения 1.
[0294]
Как описано выше, стало очевидно, что по сравнению с контрольным соединением 1 соединения согласно настоящему изобретению представляют собой соединения, характеризующиеся высокими профилями со сниженной токсичностью.
[0295]
Тестовый пример 12. Модель системной красной волчанки у мышей
Для оценки лекарственную эффективность в этом тесте использовали мышей MRL/lpr (Japan SLC, Inc.), поскольку эти мыши широко используются в качестве мышиных моделей, в которых симптомы аутоиммунных заболеваний аналогичны спонтанному возникновению системной красной волчанки человека. Деление на группы проводили на основании отека нижнечелюстных и подмышечных лимфатических узлов в возрасте 14 недель, и введение один раз в сутки основы или суспензии тестируемого соединения 13 продолжали в течение 42 суток, начиная со дня деления на группы. Концентрацию азота мочевины и концентрацию анти-dsDNA антител измеряли в периферической крови на сутки последнего введения. Результаты представлены на фигуре 5.
[0296]
Исходя из данных фигуры 5 было подтверждено, что по сравнению с группой, получавшей основу, тестируемое соединение 13 супрессирует повышенный азот мочевины, который представляет собой маркер почечной функции, или повышенные анти-dsDNA антитела, которые представляют собой аутоантитела, и что соединения согласно настоящему изобретению демонстрируют превосходную эффективность в отношении системной красной волчанки, которая уже проявилась. Кроме того, при дозах, в которых использовались тестируемые соединения, существенного снижения массы тела не наблюдалось.