Результат интеллектуальной деятельности: СРЕДСТВО, УЛУЧШАЮЩЕЕ ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ОКСАЛИПЛАТИН, И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к средству для повышения противоопухолевого эффекта, содержащему липосомальное средство оксалиплатин. Настоящее изобретение также относится к противоопухолевому средству, содержащему липосомальное средство.
Предшествующий уровень техники
До настоящего времени были разработаны и применялись в медицине многие средства для лечения рака. Тегафур, например, представляет собой противоопухолевое средство, которое активируется in vivo и постепенно высвобождается в активной форме, т.е. в виде 5-фторурацила (далее «5-FU»), уменьшая, таким образом, токсичность или побочные эффекты, присутствующие у 5-FU. Комбинированное средство, содержащее три фармацевтических средства: тегафур, гимерацил и отерацил калия (торговое название: TS-1, молярное соотношение тегафур/гимерацил/отерацил калия=1:0,4:1, выпускается Taiho Pharmaceutical Co., Ltd., здесь это комбинированное средство называется TS-1), имеет более сильный противоопухолевый эффект, поскольку гимерацил ингибирует деградацию 5-FU. В этом средстве, поскольку отерацил калия специфически отдаляет наступление токсического действия на желудочно-кишечный тракт, которое, скорее всего, должно сопровождать потенцирование противоопухолевого эффекта, который достигается в результате действия двух противоопухолевых средств, т.е., тегафура и гимерацила, причем терапевтический эффект, таким образом, улучшается. Следовательно, TS-1 способствует лечению различных злокачественных опухолей (см. Патентный документ 1).
Однако сохраняется потребность в терапевтических средствах и способах, которые имеют более сильные терапевтические эффекты, достаточные для увеличения выживаемости больных раком. Предпринимаются попытки применения комбинированной химиотерапии различными средствами (комбинированной терапии), имеющими различный механизм противоопухолевого действия и/или различные побочные эффекты, для повышения терапевтического эффекта, и некоторые виды комбинированной терапии действительно способствуют улучшению результатов лечения рака (см., например, патентные документы 2, 3 и 4). Например, оксалиплатин демонстрирует низкую противоопухолевую активность, когда он применяется в отдельности, и поэтому он применяется в комбинации с другими фармацевтическими средствами. Комбинированная терапия с применением 5-фторурацила и фолината (здесь далее фолинат называется LV) (FOLFOX) широко используется во всем мире (см., например, Непатентные документы 1, 2 и 3). Тем не менее применение FOLFOX имеет осложнения, и пролонгированные периоды инфузий 5-FU снижают качество жизни пациентов вследствие физического ограничения подвижности, которым сопровождается длительная внутривенная инфузия, и, кроме того, высокой стоимости лечения. Следовательно, разработки по созданию более выигрышной комбинированной терапии с применением оксалиплатина ведутся во всем мире. В качестве примера, известно, что комбинированная терапия (XELOX) с применением оксалиплатина и капецитабина (торговое название: Кселода), который представляет собой фторированный пиримидин для перорального применения, обеспечивает противоопухолевый эффект, сопоставимый с FOLFOX (см., например, Непатентный документ 4). В качестве нового подхода было показано, что TS-1 и оксалиплатин обеспечивают заметный противоопухолевый эффект, поскольку в этом случае отмечается более высокая терапевтическая эффективность, чем в случае оксалиплатина в комбинации с капецитабином (Патентный документ 5). Однако все еще существует необходимость в более сильном терапевтическом эффекте.
Как упоминалось ранее, оксалиплатин демонстрирует низкую противоопухолевую активность, когда он применяется в отдельности, и одной из причин этого является низкое накопление средств в ткани опухоли. При введении противоопухолевого средства оно может быстро исчезать из крови или распределяться в здоровых органах; поэтому противоопухолевое средство неэффективно накапливается в ткани опухоли. Соответственно, многие противоопухолевые средства не всегда могут проявлять достаточную противоопухолевую активность, и они часто оказывают нежелательное действие на нормальные ткани (побочные эффекты), вызывая критическую токсичность. Улучшенная эффективность противоопухолевых средств представляет собой важную цель современной химиотерапии рака, и существует настоятельная потребность в разработке системы доставки лекарств (DDS), посредством которой лекарственные средства могут эффективно накапливаться в ткани опухоли.
Липосома представляет собой закрытый пузырек, состоящий в основном из фосфолипидов, полученных из биологических веществ. Таким образом, липосомы снижают токсичность и иммуногенность при введении в живой организм. Кроме того, некоторые работы показывают, что инкапсулирование средств в липосому дает возможность контролировать их стабильность в крови и биологическое распределение, что приводит к повышенной эффективности доставки доз средств в ткани-мишени (Патентные документы 6, 7 и 8 и Непатентный документ 5). Также известно, что пузырьки, такие как липосома, которые имеют размер частиц от 100 до 200 нм, эффективно накапливаются в опухоли, поскольку присутствующие в опухоли ангиогенные сосуды имеют относительно высокую проницаемость по сравнению с кровеносными сосудами в здоровых тканях (Непатентный документ 6).
Патентный документ 1: Патент Японии №2614164
Патентный документ 2: Патент Японии №2557303
Патентный документ 3: Неопубликованная японская патентная публикация №1996-169825
Патентный документ 4: Неопубликованная японская патентная публикация №2002-205945
Патентный документ 5: WO2005/120480
Патентный документ 6: WO95/24201
Патентный документ 7: Патент Японии №3415131
Патентный документ 8: Неопубликованная японская патентная публикация №2006-248978
Непатентный документ 1: Journal of Clinical Oncology, Vol.22, 2330, 2004
Непатентный документ 2: Journal of Clinical Oncology, Vol.21, 2059-2069, 2003
Непатентный документ 3: Journal of Clinical Oncology, Vol. 18, 2038, 2947, 2000
Непатентный Документ 4: Journal of Clinical Oncology, Vol. 22, 2084, 2091, 2004
Непатентный документ 5: Journal of Liposome Research, Vol.4, 667, 687, 1994
Непатентный документ 6: Drug Delivery System, Vol.14, 433, 447, 1999
Раскрытие изобретения
Проблемы, которые решаются изобретением
Важнейшей целью изобретения является повышение противоопухолевого эффекта комбинированного средства, содержащего тегафур, гимерацил и отерацил калия, без усиления его токсичности. Другой целью настоящего изобретения является предоставление противоопухолевого средства и набора, демонстрирующего более высокий противоопухолевый эффект, чем противоопухолевое средство, содержащее тегафур, гимерацил и отерацил калия, в комбинации с оксалиплатином.
Средства решения проблем
Принимая во внимание описанное выше состояние данной области науки в настоящее время, авторы данного изобретения проводили обширные исследования для разработки способа лечения рака, который значительно влияет на увеличение продолжительности жизни пациентов. В результате была разработана l-ОНР-содержащая липосома, которая представляет собой липосомальное средство, в которое стабильно инкапсулирован комплекс платины, т.е., цис-оксалат(1R,2R-диаминоциклогексан)платины(II) (международное название: оксалиплатин, торговое название: Элоксатин или Элплат, здесь далее называемый l-ОНР), и имеет удобный размер частиц. Противоопухолевые эффекты комбинированного средства, содержащего тегафур, гимерацил и отерацил калия, могут быть значительно повышены посредством сочетания с 1-ОНР-содержащими липосомами, без усиления побочных эффектов. Настоящее изобретение было завершено на основании этих новых открытий.
В частности, настоящее изобретение предоставляет средство, усиливающее противоопухолевый эффект, противоопухолевое средство, набор противоопухолевых средств, и т.д., как описано ниже.
Пункт 1. Противоопухолевое средство, сочетающее в своем составе липосомальное средство с инкапсулированным оксалиплатином и комбинированное средство, содержащее тегафур, гимерацил и отерацил калия.
Пункт 2. Противоопухолевое средство по пункту 1, в котором, по меньшей мере, один липидный компонент, который составляет липосому, представляет собой фосфолипид.
Пункт 3. Противоопухолевое средство по пункту 2, в котором поверхность мембраны липосомы модифицирована с применением полиэтиленгликоля, полиглицерина или катионогенного липида.
Пункт 4. Противоопухолевое средство по любому из пунктов с 1 по 3, в котором оксалиплатин применяется в соотношении от 0,1 моль до 5 моль на 1 моль тегафура.
Пункт 5. Противоопухолевое средство по пункту 1, в котором гимерацил применяется в соотношении от 0,1 до 5 моль на 1 моль тегафура и отерацил калия применяется в соотношении от 0,1 до 5 моль на 1 моль тегафура в комбинированном средстве, содержащем тегафур, гимерацил и отерацил калия.
Пункт 6. Противоопухолевое средство по пункту 1, в котором противоопухолевое средство сформировано как набор, который включает в себя липосомальное средство, содержащее оксалиплатин, и комбинированное средство, содержащее тегафур, гимерацил и отерацил калия.
Пункт 7. Противоопухолевое средство по пункту 1, в котором липосомальное средство вводится внутривенно, внутрибрюшинно, внутримышечно или подкожно, и комбинированное средство, содержащее тегафур, гимерацил и отерацил калия, вводится перорально.
Пункт 8. Средство, усиливающее противоопухолевый эффект, которое представляет собой липосомальное средство, содержащее в липосоме эффективное количество оксалиплатина для повышения противоопухолевой активности терапевтически эффективного количества комбинированного средства, содержащего тегафур, гимерацил и отерацил калия.
Пункт 9. Средство, усиливающее противоопухолевый эффект по п.8, в котором, по меньшей мере, один липидный компонент, который составляет липосому, представляет собой фосфолипид.
Пункт 10. Средство, усиливающее противоопухолевый эффект по п.9, в котором поверхность мембраны липосомы модифицирована с применением полиэтиленгликоля, полиглицерина или катионогенного липида.
Пункт 11. Средство, усиливающее противоопухолевый эффект по любому из пп. с 8 по 10, в котором оксалиплатин применяется в соотношении от 0,1 моль до 5 моль на 1 моль тегафура.
Пункт 12. Средство, усиливающее противоопухолевый эффект по п.8, в котором гимерацил применяется в соотношении от 0,1 до 5 моль на 1 моль тегафура и отерацил калия применяется в соотношении от 0,1 до 5 моль на 1 моль тегафура в комбинированном средстве, содержащем тегафур, гимерацил и отерацил калия.
Пункт 13. Применение липосомального средства, получаемого посредством инкапсулирования оксалиплатина в липосому, и комбинированного средства, содержащего тегафур, гимерацил и отерацил калия, для получения противоопухолевого средства.
Пункт 14. Применение липосомального средства, получаемого посредством инкапсулирования оксалиплатина в липосому, для получения средства, усиливающего противоопухолевый эффект.
Пункт 15. Терапевтический способ лечения рака, характеризующийся введением эффективного количества липосомального средства с инкапсулированным оксалиплатином и комбинированного средства, содержащего тегафур, гимерацил и отерацил калия, страдающему раком пациенту.
Эффект изобретения
Средство, усиливающее противоопухолевую активность, по настоящему изобретению, может повышать противоопухолевый эффект комбинированного средства, содержащего три фармацевтических средства: тегафур, гимерацил и отерацил калия, которое представляет собой известное противоопухолевое средство, без усиления токсичности по сравнению с ситуацией, когда в комбинации применяется 1-ОНР. Соответственно, противоопухолевое средство и набор противоопухолевых средств по настоящему изобретению достигают значительного эффекта в усилении противоопухолевой активности, который превышает противоопухолевый эффект от комбинированной терапии, в которой комбинированное средство содержит три фармацевтических средства: тегафур, гимерацил и отерацил калия, и применяется в сочетании с 1-ОНР, при этом не повышая степень токсичности. Ожидается, что настоящее изобретение может быть применено в терапевтическом способе для дополнительного увеличения продолжительности жизни пациентов, страдающих раком.
Краткое описание фигур чертежей
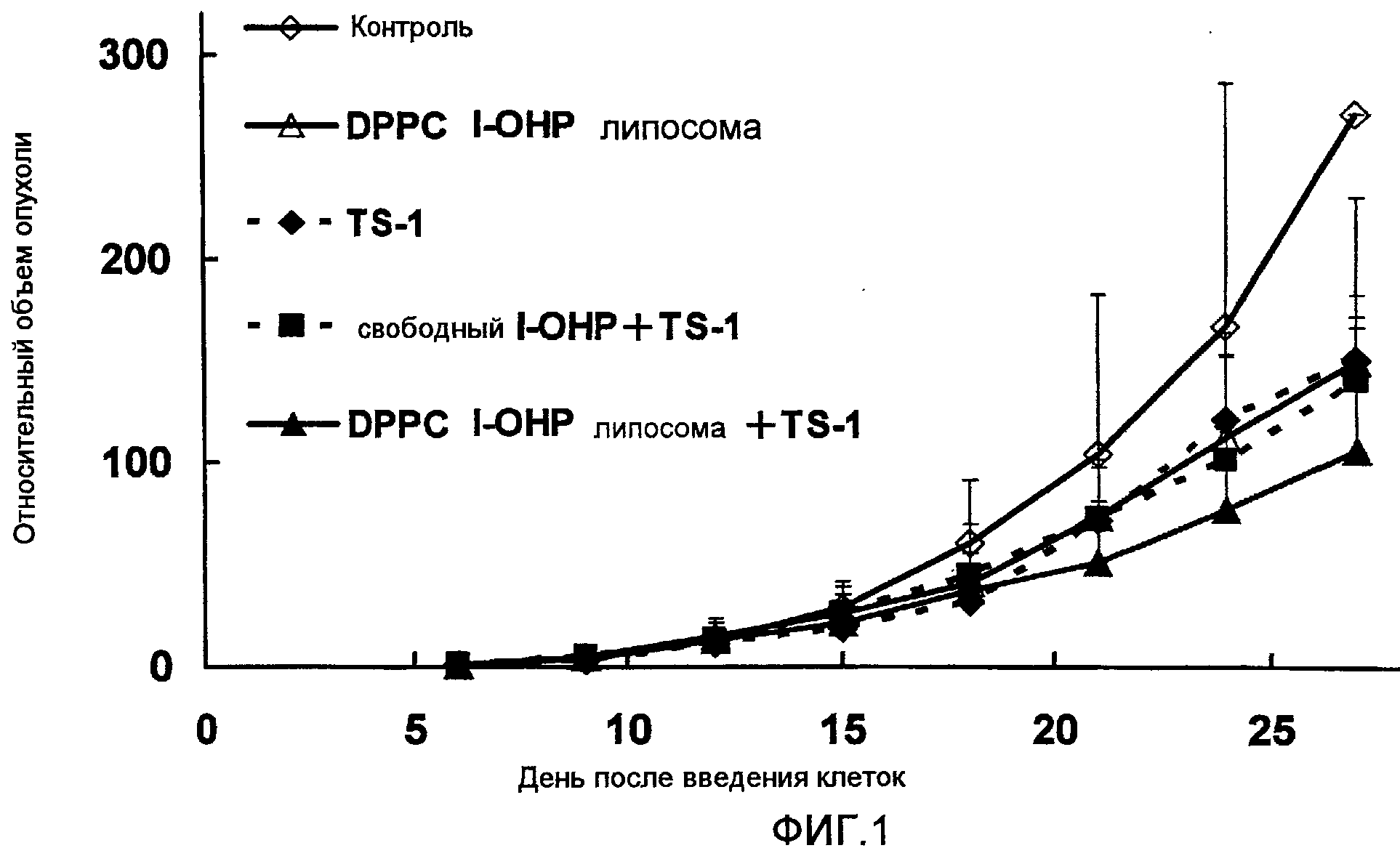
Фиг.1 представляет собой график, показывающий повышение относительных объемов опухоли в тестовом примере 1.
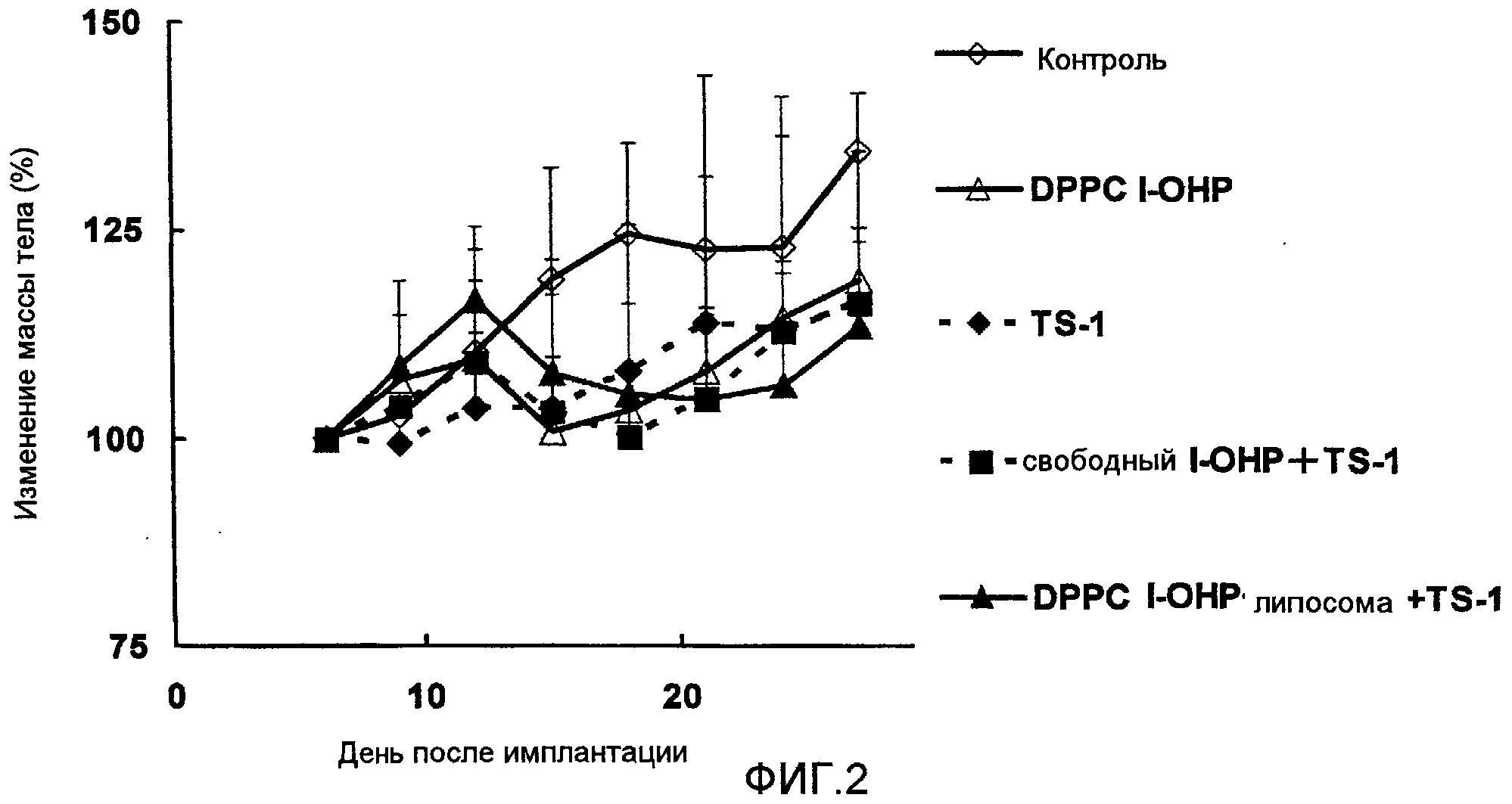
Фиг.2 представляет собой график, показывающий изменение веса тела подопытных мышей в тестовом примере 1.
Фиг.3 представляет собой график, показывающий повышение относительных объемов опухоли в тестовом примере 2.
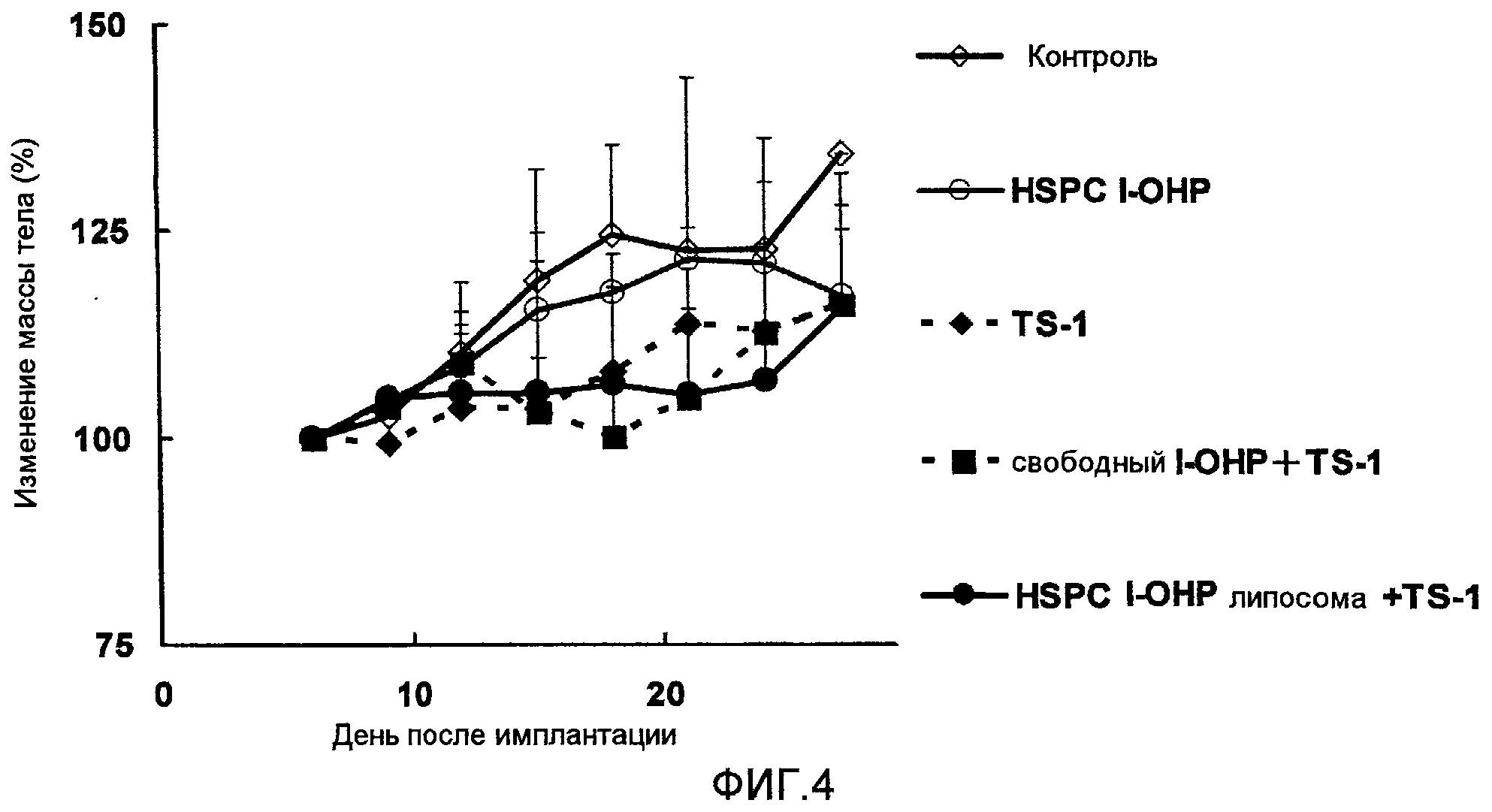
Фиг.4 представляет собой график, показывающий изменение веса тела подопытных мышей в тестовом примере 2.
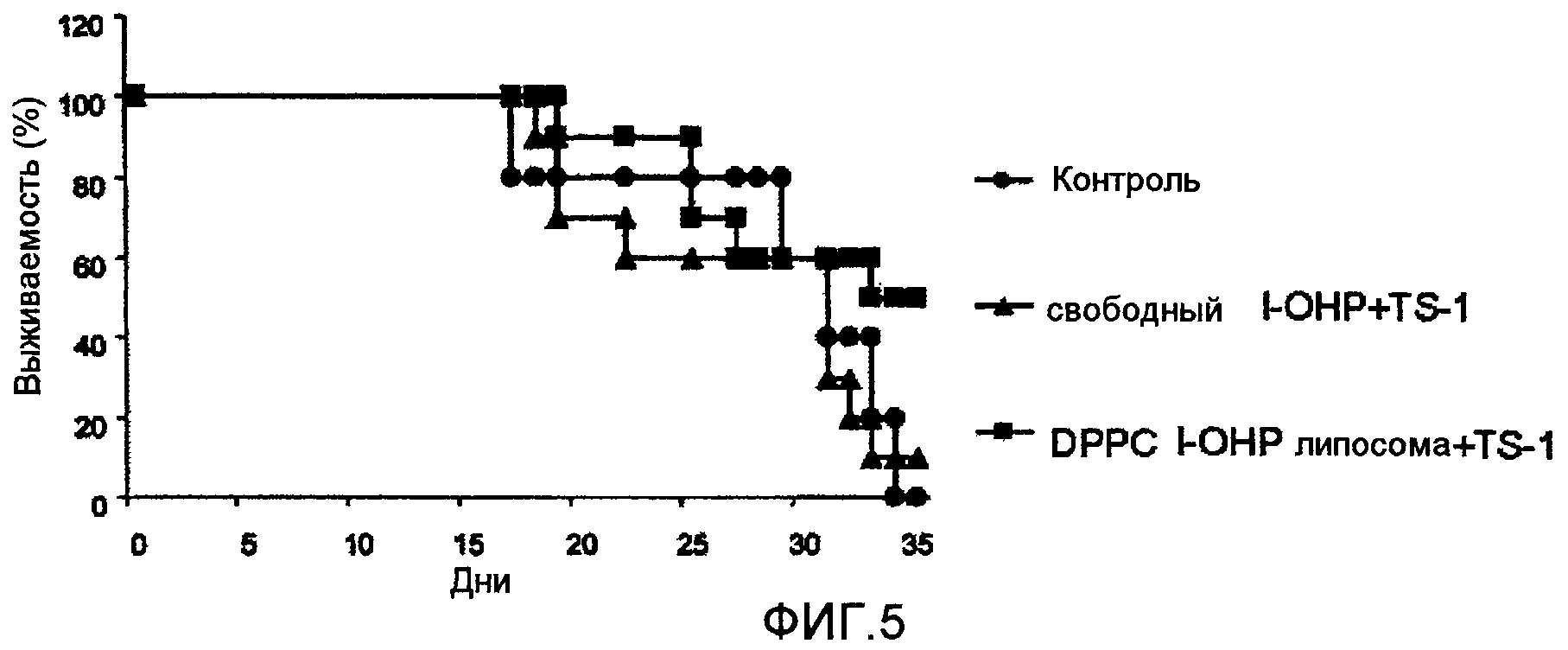
Фиг.5 представляет собой график, показывающий выживаемость мышей в днях после введения опухолевых клеток в тестовом примере 3.
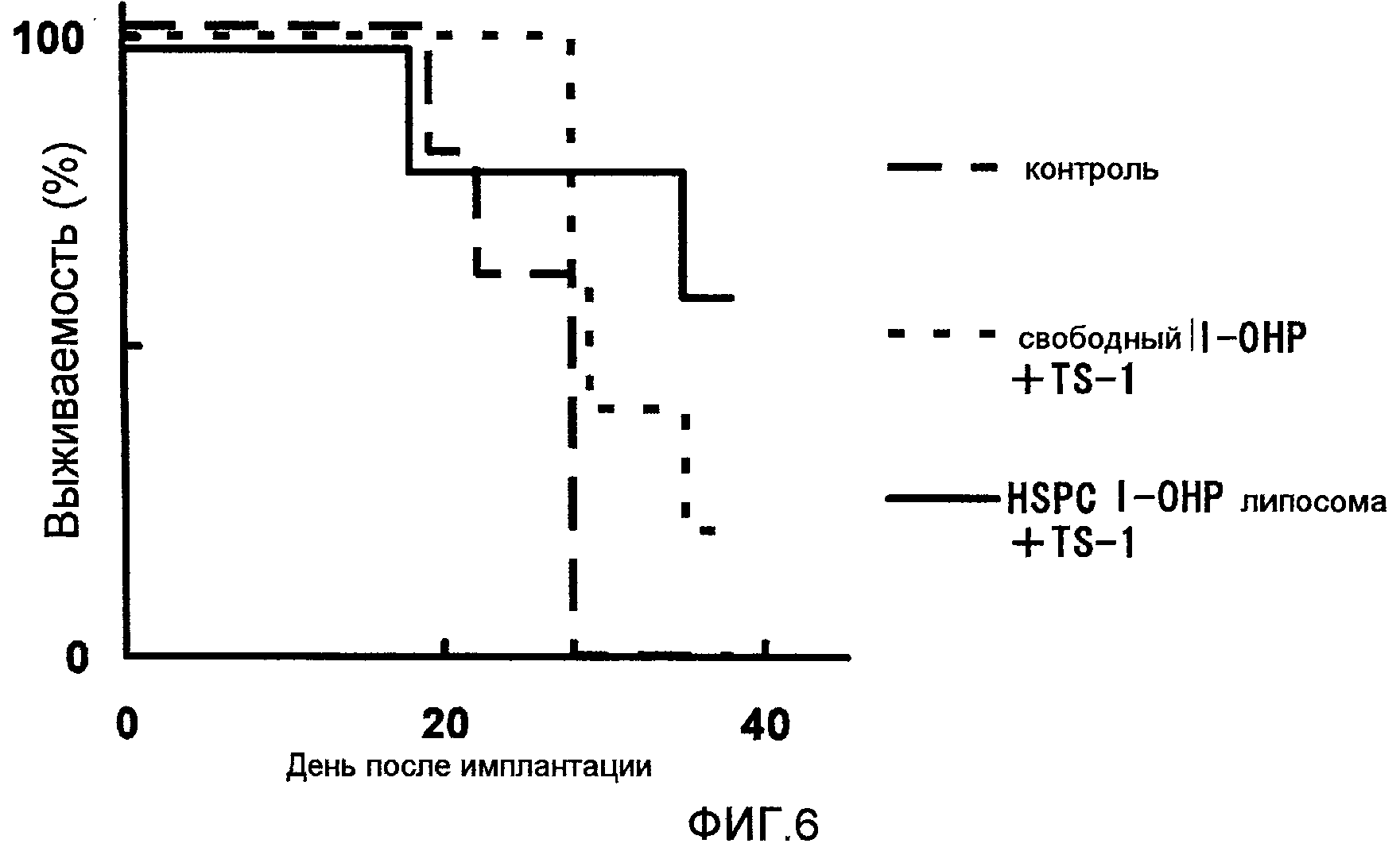
Фиг.6 представляет собой график, показывающий выживаемость мышей в днях после введения опухолевых клеток в тестовом примере 4.
Фиг.7 представляет собой график, показывающий повышение относительных объемов опухоли в тестовом примере 5.
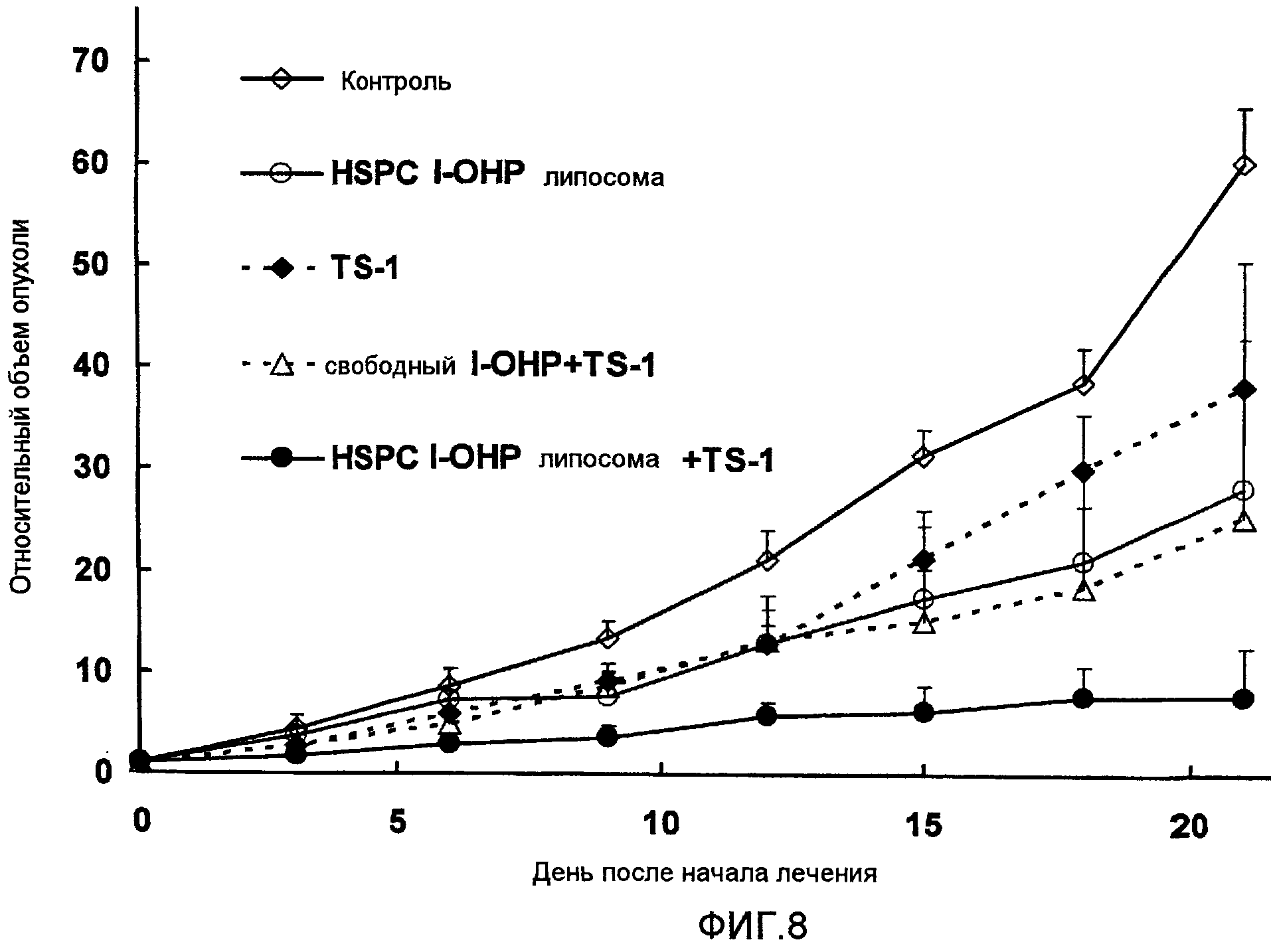
Фиг.8 представляет собой график, показывающий повышение относительных объемов опухоли в тестовом примере 6.
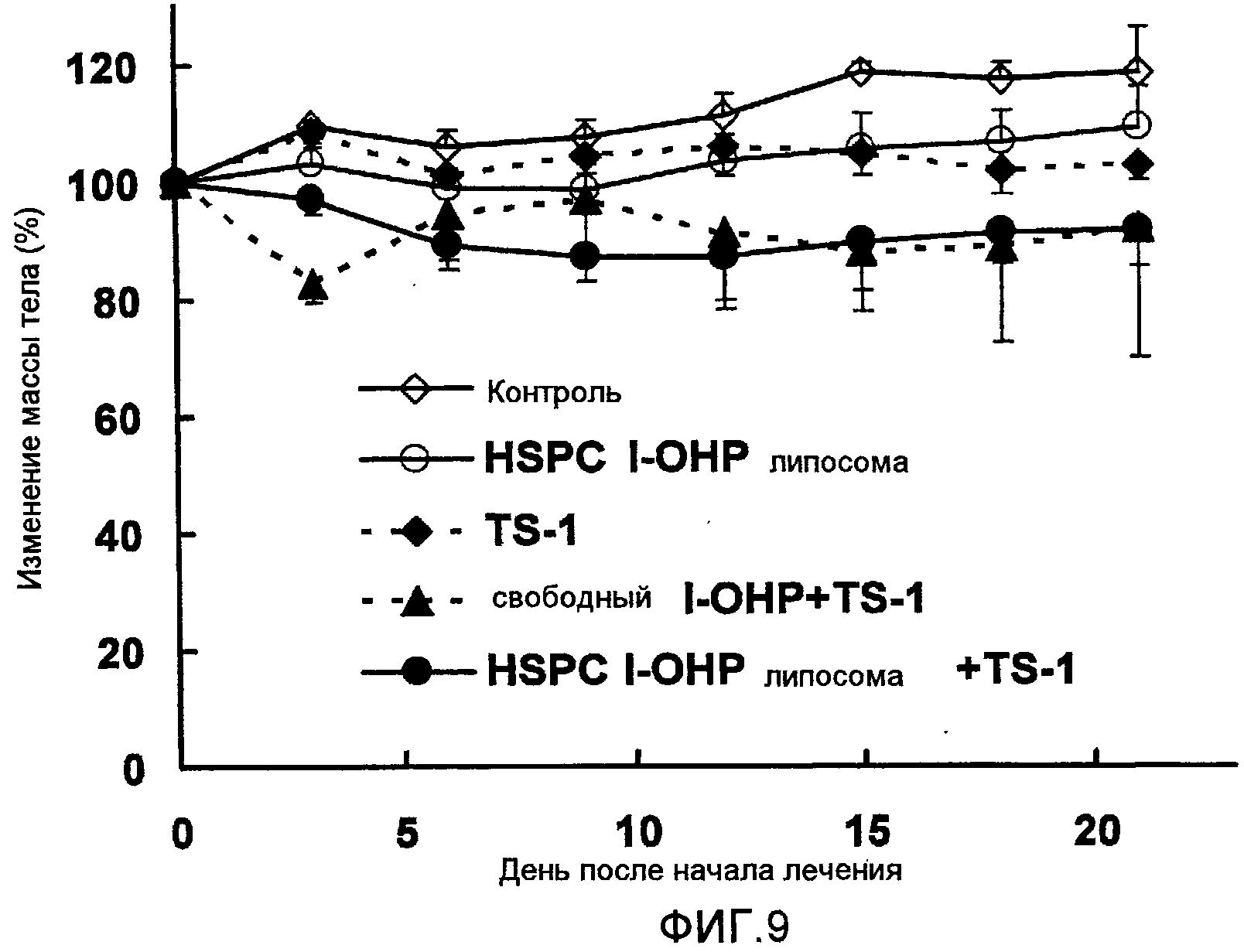
Фиг.9 представляет собой график, показывающий изменение веса тела подопытных мышей в тестовом примере 6.
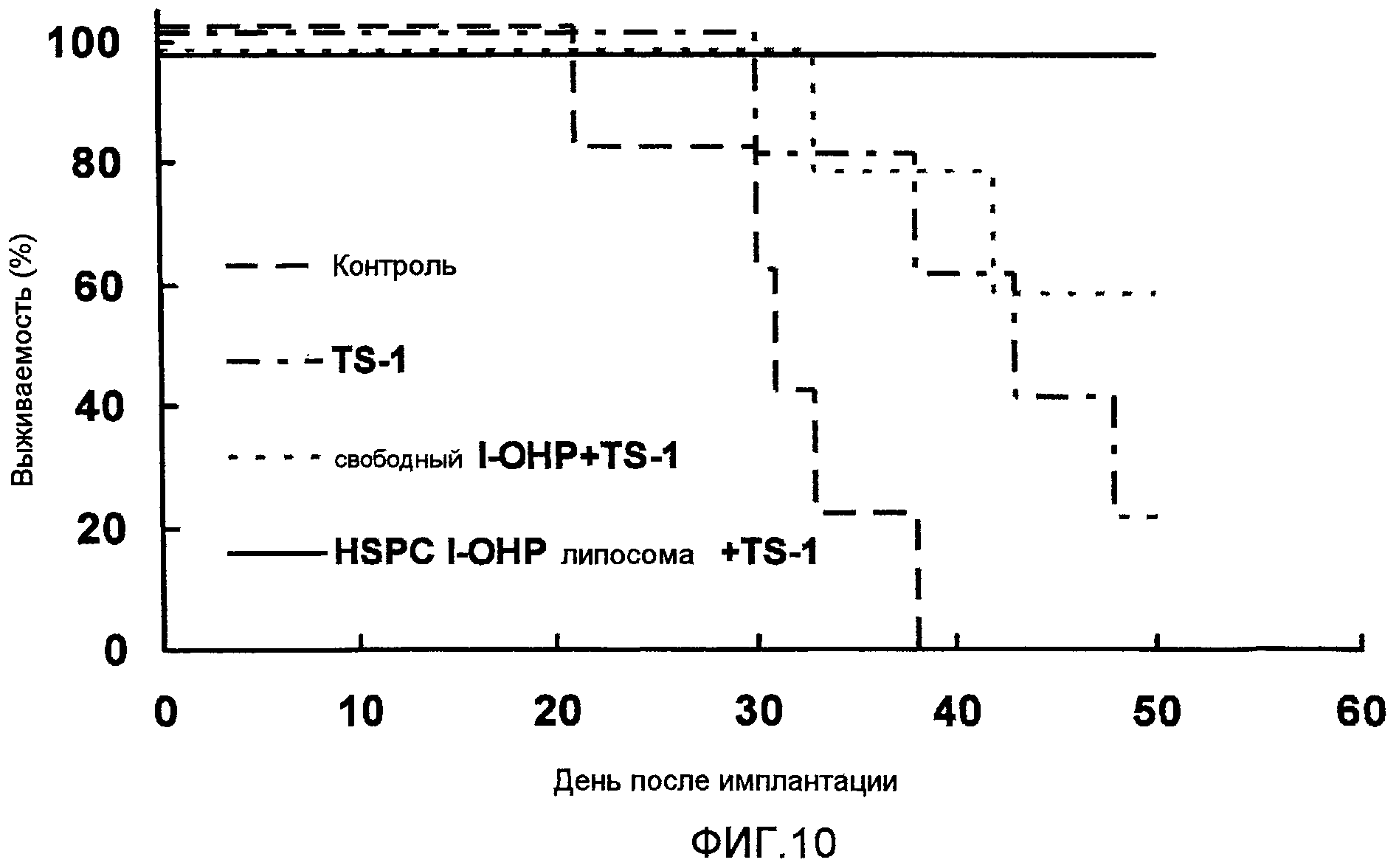
Фиг.10 представляет собой график, показывающий выживаемость мышей в днях после введения опухолевых клеток в тестовом примере 7.
Наилучший способ осуществления изобретения
(1) Средство, усиливающее противоопухолевый эффект
Настоящее изобретение предоставляет средство, усиливающее противоопухолевый эффект, для усиления противоопухолевой активности терапевтически эффективного количества комбинированного средства, содержащего терапевтически эффективное количество тегафура, гимерацила и отерацила калия. Средство, усиливающее противоопухолевый эффект, получают в виде липосомального средства, получаемого посредством инкапсулирования терапевтически эффективного количества оксалиплатина (1-ОНР) для повышения противоопухолевого эффекта в липосому, которая состоит из, по меньшей мере, одного липидного компонента.
(1-1) Липосомальное средство
l-OHP
l-OHP представляет собой известное соединение, содержащее комплекс платины. l-OHP связывается с ДНК в раковых клетках и затем индуцирует нарушение функции ДНК и разрыв цепи ДНК, приводя к тому, что это средство проявляет цитотоксичность по отношению к раковым клеткам. 1-ОНР может быть получен в соответствии с известными способами, например, способом, раскрытым в опубликованной японской патентной публикации №1985-41077.
Липосома
Липосома, применяемая в липосомальном средстве настоящего изобретения, представляет собой пузырек, который образован посредством диспергирования фосфолипидов, которые являются основным компонентом клеточной мембраны, в воде, и имеет внутреннюю водную фазу, окруженную липидными мембранами. Липосомы могут быть классифицированы на три категории в зависимости от размера частиц и количества липидных слоев, т.е., многослойный пузырек: MLV, большой однослойный пузырек: LUV и маленький однослойный пузырек: SUV. В настоящем изобретении могут быть применены липосомы любого типа. Липосома, применяемая в настоящем изобретении, должна иметь стабильную форму до и после введения в организм. Примеры фосфолипидов, которые формируют липосомы, включают гидрогенизированный очищенный фосфатидилхолин яичного желтка (температура фазового перехода 50°С, здесь далее называется HEPC), гидрогенизированный рафинированный фосфатидилхолин бобов сои (температура фазового перехода приблизительно 55°С, здесь далее называется HSPC) дипальмитоилфосфатидилхолин (температура фазового перехода приблизительно 41°С, здесь далее называется DPPC), дистеароилфосфатидилхолин (температура фазового перехода приблизительно 58°С, здесь далее называется DSPC) и 1-пальмитоил-2-олеоилфосфатидилхолин (температура фазового перехода -3°С). Среди фосфолипидов HEPC, HSPC, DPPS и DSPC являются предпочтительными.
В данном описании гидрогенизированный очищенный фосфатидилхолин яичного желтка подразумевает, что он получен посредством гидрогенизации фосфатидилхолина, извлеченного из яичного желтка. Один из примеров гидрогенизированного очищенного фосфатидилхолина яичного желтка, применяемого в предпочтительном варианте осуществления, включает в себя в качестве основного компонента фосфатидилхолин, в котором ацильная группа представляет собой ацильную группу С16-18, полученную из насыщенной жирной кислоты с неразветвленной цепью. В настоящем изобретении гидрогенизированный очищенный фосфатидилхолин яичного желтка получают посредством очистки гидрогенизированного фосфатидилхолина яичного желтка; и, например, применяются те из них, которые имеют чистоту не менее 80% и предпочтительно не менее 90%.
В этом описании гидрогенизированный фосфатидилхолин бобов сои обозначает, что он получен посредством гидрогенизации фосфатидилхолина, полученного из соевых бобов. Один из примеров гидрогенизированного очищенного фосфатидилхолина бобов сои, применяемого в предпочтительном варианте осуществления, включает в себя, в качестве основного компонента, фосфатидилхолин, в котором ацильная группа представляет собой ацильную группу С16-18, полученную из насыщенной жирной кислоты с неразветвленной цепью. В настоящем изобретении гидрогенизированный очищенный фосфатидилхолин бобов сои получают посредством очистки гидрогенизированного фосфатидилхолина бобов сои; и, например, применяются те из них, которые имеют чистоту не менее 80% и предпочтительно не менее 90%.
Эти фосфолипиды могут быть применены по-отдельности или в комбинации из двух или более видов. С применением фосфолипидов, имеющих различные температуры фазового перехода, можно изменить текучесть бимолекулярной липидной мембраны липосомы. Это делает возможным отбор фосфолипидов, наиболее пригодных с точки зрения скорости инкапсулирования, стабильности в составе фармацевтического средства, динамики in vivo после введения и тому подобного.
В дополнение к этим фосфолипидам, липосомы, применяемые в настоящем изобретении, предпочтительно смешиваются со стабилизатором, таким как холестерин, который, как сообщается, повышает стабильность липосом, или его производными. Кроме того, стабильность в крови, распределение в тканях, переход в ткань опухоли и тому подобные свойства липосомы могут быть дополнительно улучшены за счет модификации поверхности мембраны липосомы, при необходимости, с применением лиганда, выбранного из полиэтиленгликоля, полиглицерина или подобных гидрофильных высокомолекулярных полимерных веществ; липида, который имеет в своем составе аминогруппу, амидиновую группу, гуанидиновую группу или подобную основную функциональную группу (далее здесь называется катионизированный липид); или пептида, лектина, антитела, сахарида, гликопротеина, гликолипида или тому подобного.
В настоящем изобретении термин "полиэтиленгликоль" включает в себя не только незамещенные полиэтиленгликоли, но также производные, олеофильная (гидрофобная) боковая цепь которых связана ковалентной связью. Конкретные примеры олеофильных боковых цепей включают алкильные цепи, фосфолипиды и холестерин. Различные производные полиэтиленгликоля, которые, как правило, применяются для улучшения стабильности липосом, могут быть применены в настоящем изобретении. Кроме того, термин "полиглицерин" в настоящем изобретении включает в себя не только незамещенный полиглицерин, но также и производные, олеофильная (гидрофобная) боковая цепь которых связана ковалентной связью. Конкретные примеры олеофильных боковых цепей включают алкильные цепи, фосфолипиды и холестерин. Различные производные полиглицерина, которые, как правило, применяются для улучшения стабильности липосом, могут быть применены в настоящем изобретении. Кроме того, глицерин, глюкоза, хлорид натрия или тому подобные соединения могут быть добавлены в качестве обеспечивающих изотоничность средств. Кроме того, также могут добавляться парабены, хлоробутанол, бензиловый спирт, пропиленгликоль и подобные консерванты.
Липосомальное средство
Липосомальное средство по настоящему изобретению может быть получено известным способом. Примеры таких способов получения липосомальных средств включают способ обращенно-фазового выпаривания (Proc. Natl. Acad. Sci. USA, Vol.75, 4194, 1978, WO 97/48398), способ замораживания-оттаивания (Arch. Biochem. Biophys, Vol.212, 186, 1981), способ с применением градиента pH (Biochem. Biophys. Acta, Vol.816, 294, 1985, Неопубликованная японская патентная публикация No. 1995-165560) и тому подобное.
Среди этих способов, когда применяется способ обращенно-фазового выпаривания, липосомальное средство по настоящему изобретению получают с применением следующего процесса. Например, липидный компонент растворяют в хлороформе, простом эфире, этаноле или подобном растворителе, и полученный раствор помещают в грушевидную колбу. Растворитель удаляют посредством выпаривания при пониженном давлении, с получением тонкой липидной пленки. Затем смешанный липид, содержащий хлороформ и диэтиловый эфир в соотношении хлороформа к диэтиловому эфиру=1/2, добавляют для растворения тонкой пленки. Туда же добавляют водный раствор, содержащий активное вещество, и смесь обрабатывают ультразвуком при 25°С в течение 15 минут для получения эмульсии. Органическую фазу полученной эмульсии удаляют для переведения эмульсии «вода в масле» в эмульсию «масло в воде» посредством выпаривания в роторном испарителе в течение одного часа, с одновременным встряхиванием. Таким образом формируется липосома, и в нее инкапсулируют фармацевтическое средство. Процесс, описанный выше, делает возможным инкапсулирование фармацевтического средства в липосому.
Сообщалось, что размер частиц липосомы сильно влияет на биораспределение и накопление в опухолевой ткани их содержимого (Biol. Pharm. Bull., Vol.17, 935, 1994). В настоящем изобретении предпочтительно проводится распределение частиц по размеру для получения липосом требуемого и одинакового размера, содержащих в себе фармацевтическое средство. Например, при проведении ультразвуковой обработки с применением биодезинтегратора (выпускаемого Nippon Seiki Co., Ltd., и т.д.) или эмульгировании высоким давлением с применением Nanomizer (выпускаемого Yoshida Kikai Co., Ltd.), и т.д., размер частиц липосом может быть доведен до среднего диаметра частицы приблизительно от 100 до 200 нм. В качестве альтернативы, при воздействии на содержащий липосомы раствор давления азота для распределения по размеру с применением различных поликарбонатных мембранных фильтров (0,4 мкм, 0,2 мкм, 0,1 мкм и 0,08 мкм), размер частиц липосом может быть доведен до среднего диаметра частиц приблизительно от 100 до 300 нм.
В настоящем изобретении термин «средний диаметр частицы» обозначает средний диаметр частицы, измеренный при помощи способа светорассеяния с применением анализатора субмикронных частиц NICOMP 370 HPL (выпускаемого Particle Sizing System, Inc.).
Стабильность в крови, распределение в тканях и нахождение опухоли липосомой могут быть дополнительно улучшены посредством модификации поверхности мембраны липосомы при необходимости с применением полиэтиленгликоля, полиглицерина, катионизированного липида или лиганда, такого как пептид, лектин, антитело, сахарид, гликопротеин или гликопротеид.
Липосомальное средство по настоящему изобретению может также быть получено с применением способа по Патентному документу 7 (Патент Японии No. 3415131) или Патентному документу 8 (Неопубликованная японская патентная публикация No. 2006-248978), которые раскрывают липосомальные средства оксалиплатина (l-OHP).
В предпочтительном варианте осуществления липосомальное средство по настоящему изобретению получают с применением раствора, который получают растворением l-OHP в растворе глюкозы с концентрацией от 1 до 10%, таким образом, что концентрация l-ОНР в растворе составляет от 1 до 20 мг/мл.
Полученное таким образом содержащее l-ОНР липосомальное средство подвергают при необходимости ультрацентрифугированию, гель-фильтрации, ультрафильтрации и диализу. Эти обработки могут соответственно проводиться с использованием методов по-отдельности или в комбинации, и с помощью этого удаляются фармацевтические средства, которые не были инкапсулированы в липосому.
Полученное с помощью описанных выше способов содержащее l-OHP липосомальное средство может применяться непосредственно после приготовления. Однако с учетом времени хранения, условий хранения и т.д., содержащее l-ОНР липосомальное средство может быть высушено из замороженного состояния после добавления таких вспомогательных веществ, как маннит, трегалоза, лактоза, глицин. В качестве альтернативы, содержащее l-ОНР липосомальное средство может сохраняться в замороженном виде после добавления криоконсервантов, таких как глицерин.
В предпочтительном варианте осуществления липосомальное средство l-OHP содержит оксалиплатин в количестве от 1 до 50 мкг/мг липида, предпочтительно от 5 до 40 мкг/мг липида.
Содержащее l-OHP липосомальное средство по настоящему изобретению имеет средний диаметр частиц предпочтительно от 50 до 300 нм, более предпочтительно от 80 до 200 нм.
Содержащее l-OHP липосомальное средство, как правило, суспендировано или разведено в физиологически приемлемом водном растворе, и затем применено в виде средства для инъекций (вводимого внутривенно, внутрибрюшинно, внутримышечно или подкожно средства); однако содержащее l-OHP липосомальное средство может также применяться в виде средства для перорального приема, раствора для орошения носовой полости, ингалятора, суппозитория, средства для чрескожного всасывания, средства, всасывающегося через слизистые оболочки, и т.д. В этом случае содержащее l-OHP липосомальное средство формируется в виде композиции средств с применением соответствующих носителей, следуя обычному способу. Носители, пригодные для данного изобретения, представляют собой носители, наиболее часто применяемые в традиционных фармацевтических средствах. Конкретные примеры носителей включают вспомогательные средства, связующие вещества, дезинтеграторы, скользящие вещества, красители, усилители вкуса, усилители запаха, поверхностно-активные вещества и т.д.
Примеры комбинированного средства, содержащего тегафур, гимерацил и отерацил калия, противоопухолевый эффект которого может быть усилен средством, усиливающим противоопухолевый эффект, по настоящему изобретению описаны ниже.
(1-2) Комбинированное средство, содержащее тегафур, гимерацил и отерацил калия
Тегафур
Тегафур (международное название, химическое название: 5-фтор-1-(2-тетрагидрофурил)-2,4-(1H,3Н)-пиримидиндион) представляет собой известное соединение, которое активируется in vivo с высвобождением 5-FU, т.е., активной формы, имеющей противоопухолевую активность. Тегафур может быть получен в соответствии с известными способами, например, способом, раскрытым в опубликованной японской патентной публикации №1974-10510.
Гимерацил
Гимерацил (международное название, химическое название: 2,4-дигидрокси-5-хлорпиридин) также представляет собой известное соединение и сам по себе не проявляет никакой противоопухолевой активности. Однако он может ингибировать метаболическую инактивацию 5-FU in vivo, приводя к усилению противоопухолевого эффекта 5-FU.
Отерацил калия
Отерацил калия (международное название, химическое название: монокалия 1,2,3,4-тетрагидро-2,4-диоксо-1,3,5-триазин-6-карбоксилат) также представляет собой известное соединение. Несмотря на то что он не имеет какой-либо противоопухолевой активности сам по себе, он остается в основном в желудочно-кишечном тракте и ингибирует там активацию 5-FU, предотвращая тем самым нарушения желудочно-кишечного тракта, вызываемые 5-FU.
Что касается комбинированного средства, содержащего три ингредиента, а именно тегафур, гимерацил и отерацил калия, в качестве активных ингредиентов, доля каждого активного ингредиента может лежать в пределах, описанных применительно к известным фармацевтическим средствам, таким как, например, раскрытые в Патентной публикации No. 2614164. Соотношение обычно составляет приблизительно от 0,1 до 5 моль, предпочтительно приблизительно от 0,2 до 1,5 моль гимерацила на 1 моль тегафура, и приблизительно от 0,1 до 5 моль, предпочтительно приблизительно от 0,2 до 2 моль отерацила калия на 1 моль тегафура. Особенно предпочтительное соотношение трех ингредиентов составляет тегафур:гимерацил:отерацил калия=1:0,4:1 в молярном отношении.
Комбинированное средство, содержащее тегафур, гимерацил и отерацил калия в качестве активных ингредиентов, может быть получено в фармацевтической форме, содержащей два или более фармацевтических средств, каждое из которых содержит один из активных ингредиентов, или каждое из которых содержит активные ингредиенты в любом сочетании, или в виде фармацевтической формы, содержащей одно фармацевтическое средство, которое состоит из всех активных ингредиентов. В любом случае, такие комбинированные средства получают в виде фармацевтических композиций в соответствии с традиционными способами с применением пригодных фармацевтических носителей. Носители, пригодные в данном изобретении, представляют собой носители, наиболее часто используемые в традиционных фармацевтических средствах, например, вспомогательные средства, связующие вещества, дезинтеграторы, скользящие вещества, красители, усилители вкуса, усилители запаха, поверхностно-активные вещества и т.д.
При использовании комбинированного средства в фармацевтической форме, состоящей из двух или более фармацевтических средств, каждое фармацевтическое средство может вводиться одновременно с другими, или одно фармацевтическое средство может вводиться в любое время до или после введения другого фармацевтического средства (или средств). Предпочтительно, все фармацевтические средства вводят одновременно, или одно фармацевтическое средство вводиться в пределах 4 часов, более предпочтительно в пределах 2 часов до или после введения другого фармацевтического средства (или средств).
(1-3) Способ введения
Упомянутое выше средство, усиливающее противоопухолевый эффект, (т.е., содержащее l-OHP липосомальное средство), может быть введено отдельно или одновременно с комбинированным средством, которое содержит три ингредиента, т.е., тегафур, гимерацил и отерацил калия, в качестве активных ингредиентов, которое было получено в стандартной лекарственной форме. Более точно, средство, усиливающее противоопухолевый эффект, по настоящему изобретению может быть введено одновременно или в любое время до или после введения противоопухолевого средства, содержащего три ингредиента, т.е., тегафур, гимерацил и отерацил калия, в качестве активных ингредиентов. Предпочтительно, средство, усиливающее противоопухолевый эффект, вводится одновременно или в пределах 4 часов до или после введения противоопухолевого средства, и предпочтительно в пределах 2 часов до или после введения противоопухолевого средства. При постоянном введении следует выбирать удобную частоту и интервалы введения противоопухолевого средства и средства, усиливающего противоопухолевый эффект.
Когда содержащее l-OHP липосомальное средство вводится одновременно или отдельно от противоопухолевого средства, содержащего три активных ингредиента: тегафур, гимерацил и отерацил калия, средство, усиливающее противоопухолевый эффект, предпочтительно вводится в таком количестве, что количество l-ОНР на 1 моль тегафура составляет приблизительно от 0,1 до 5 моль, предпочтительно приблизительно от 0,1 до 3 моль и более предпочтительно приблизительно от 0,2 до 2 моль.
(2) Противоопухолевое средство
Настоящее изобретение предоставляет противоопухолевое средство, содержащее комбинированное средство, состоящее из трех активных ингредиентов: тегафура, гимерацила и отерацила калия, в сочетании со средством, усиливающим противоопухолевый эффект (содержащее l-ОНР липосомальное средство). Противоопухолевое средство может входить в состав фармацевтического средства, содержащего множество фармацевтических средств, каждое из которых содержит один из перечисленных выше четырех ингредиентов, т.е., три описанных выше ингредиента и содержащую l-ОНР липосому, или каждое из которых содержит такие ингредиенты в любой комбинации или в фармацевтической форме, содержащей одно фармацевтическое средство, содержащее все ингредиенты. Более точно, противоопухолевое средство по настоящему изобретению может быть сформировано в единую лекарственную форму, содержащую все вышеперечисленные четыре ингредиента, или сложную лекарственную форму, содержащую фармацевтическое средство, состоящее из от 1 до 3 ингредиентов, и одно или более фармацевтических средств, содержащих остальные ингредиенты. Особенно предпочтительный пример представляет собой средство из 2-х частей, в котором фармацевтическое средство, содержащее три ингредиента: тегафур, гимерацил и отерацил калия, в качестве активных ингредиентов, и фармацевтическое средство, содержащее l-ОНР, инкапсулированное в липосомальное средство, представлены в виде отдельных рецептур.
Что касается противоопухолевого средства, соотношение ингредиентов не ограничивается, независимо от того, составлены ли они в единое фармацевтическое средство или сложное фармацевтическое средство. Обычно на 1 моль тегафура гимерацил берется в соотношении приблизительно от 0,1 до 5, предпочтительно приблизительно от 0,2 до 1,5 моль; отерацил калия берется в соотношении приблизительно от 0,1 до 5 моль, предпочтительно приблизительно от 0,2 до 2 моль; и l-OHP берется в соотношении приблизительно от 0,1 до 5 моль, предпочтительно приблизительно от 0,1 до 3 моль и более предпочтительно от приблизительно 0,2 до приблизительно 2 моль. В частности, предпочтительное молярное соотношение каждого ингредиента, тегафур:гимерацил:отерацил калия:l-OHP=приблизительно 1:0,4:1:от 0,1 до 5, более предпочтительно приблизительно 1:0,4:1:от 0,1 до 3, и наиболее предпочтительно приблизительно 1:0,4:1:от 0,2 до 2. Когда противоопухолевое средство находится в виде 2 лекарственных форм, в которых фармацевтическое средство, содержащее три ингредиента: тегафур, гимерацил и отерацил калия, в качестве активных ингредиентов, и содержащая l-ОНР липосома представлены в виде отдельных рецептур, как описано выше, противоопухолевое средство предпочтительно содержит комбинированное средство, содержащее тегафур, гимерацил и отерацил калия в молярном отношении 1:0,4:1, и фармацевтическое средство, содержащее на 1 моль тегафура l-ОНР в соотношении приблизительно от 0,1 до 5 моль, предпочтительно приблизительно от 0,1 до 3 моль и более предпочтительно от приблизительно 0,2 до приблизительно 2 моль.
Эти активные ингредиенты могут быть получены в виде фармацевтических композиций в соответствии со стандартными способами, использующими пригодные фармацевтические носители. Носители, пригодные для настоящего изобретения, представляют собой носители, которые часто используются в традиционных фармацевтических средствах, например, вспомогательные средства, связующие вещества, дезинтеграторы, скользящие вещества, красители, усилители вкуса, усилители запаха, поверхностно-активные вещества и т.д.
При использовании противоопухолевого средства, которое имеет множественную лекарственную форму и содержит два или более фармацевтических средств, как описано выше, каждое фармацевтическое средство может вводиться одновременно с другими, или каждое фармацевтическое средство может вводиться в любое время до или после введения другого фармацевтического средства (или средств). Предпочтительно, все фармацевтические средства вводятся одновременно или одно фармацевтическое средство вводится в пределах 4 часов и, более предпочтительно, в пределах 2 часов до или после введения других фармацевтических средств.
(3) Набор
Настоящее изобретение предоставляет набор, включающий в себя содержащее l-OHP липосомальное средство с комбинированным средством, состоящим из тегафура, гимерацила и отерацила калия. Более точно, настоящее изобретение предоставляет набор для лечения рака у млекопитающих, включающий в себя:
(a) противоопухолевую композицию, которая содержит терапевтически эффективное количество тегафура, эффективное количество гимерацила для усиления противоопухолевого эффекта и эффективное количество отерацила калия для подавления побочных эффектов, а также
(b) липосомальное средство, в котором инкапсулировано эффективное количество l-OHP для усиления противоопухолевого эффекта.
Композиции, содержащиеся в таком наборе, могут представлять собой любую известную фармацевтическую форму. Композиции, как правило, помещают в применяемые обычно контейнеры в соответствии с их фармацевтической формой.
Набор применяется для лечения рака у млекопитающих и включает в себя:
(i) тегафур в терапевтически эффективном количестве,
(ii) гимерацил в количестве, эффективном для усиления противоопухолевого эффекта,
(iii) отерацил калия в количестве, эффективном для уменьшения побочных эффектов; причем все эти средства представляют собой части противоопухолевой композиции,
и
(iv) липосому, которая содержит l-OHP в количестве, эффективном для усиления противоопухолевого эффекта.
Набор включает в себя, по меньшей мере, 2 контейнера для этих ингредиентов, и тегафур и l-OHP упакованы в различные контейнеры. Вышеуказанные ингредиенты от (i) до (iv) предпочтительно находятся в фармацевтической форме, приготовленной в сочетании с фармацевтически приемлемыми носителями. Для указанного выше набора, поскольку ингредиенты (i) и (iv) хранятся в различных контейнерах, а ингредиенты (ii) и (iii) могут независимо храниться в контейнерах, которые отделены от тех контейнеров, в которых хранятся вышеуказанные два ингредиента, или ингредиенты (ii) и (iii) могут независимо смешиваться с ингредиентами (i) или (iv) для хранения в одном и том же контейнере. Набор, в котором фармацевтическое средство, содержащее ингредиенты с (i) по (iii), хранится в одном контейнере, и фармацевтическое средство, содержащее ингредиент (iv), хранится в другом контейнере, является предпочтительным.
Применяемые лекарственные формы противоопухолевого средства по настоящему изобретению для лечения млекопитающих, включая людей, страдающих злокачественными опухолями, не ограничены и могут быть выбраны надлежащим образом соответственно цели лечения. Конкретными примерами являются инъекционные формы, суппозитории, глазные капли, мази, аэрозоли и подобные парентеральные формы; таблетки, таблетки, покрытые оболочкой, порошки, гранулы, капсулы, жидкости, пилюли, суспензии, эмульсии и подобные формы для перорального применения. Противоопухолевое средство может быть получено в таких лекарственных формах в соответствии со способами, повсеместно известными в данной области.
Количества тегафура, гимерацила, отерацила калия и l-OHP, которые являются активными ингредиентами противоопухолевого средства по настоящему изобретению, изменяются в соответствии с лекарственной формой, путем введения, режимом дозирования и т.д., и не ограничены, и, следовательно, могут быть выбраны соответствующим образом. Обычно является предпочтительным, чтобы соотношение количеств активных ингредиентов составляло от приблизительно 1 до приблизительно 70% масс. всего фармацевтического средства.
Способы введения фармацевтического средства по настоящему изобретению не ограничены и могут быть определены в соответствии с его формой, возрастом, полом и состоянием пациента и другими факторами; и, следовательно, оно может вводиться энтерально, перорально, ректально, в ротовую полость, внутриартериально, внутривенно, чрескожно или аналогично этому. Например, таблетки, пилюли, растворы, суспензии, эмульсии, гранулы, капсулы и тому подобное вводят перорально; инъекционные формы вводят внутриартериально или внутривенно, суппозитории вводят ректально; и мази наносят на кожу, слизистую оболочку полости рта и т.д. Для фармацевтического средства по настоящему изобретению возможно пероральное введение фармацевтического средства, содержащего тегафур, гимерацил и отерацил калия, тогда как фармацевтическое средство l-OHP, инкапсулированное в липосому, вводится внутривенно.
Доза каждого активного ингредиента в настоящем изобретении может быть соответственно выбрана с зависимости от способа применения, возраста и пола пациента, степени тяжести заболевания и других факторов. Средство, усиливающее противоопухолевый эффект, и противоопухолевое средство по настоящему изобретению можно вводить в виде от 1 до 4 доз в день.
Для перорального приема фармацевтическое средство по настоящему изобретению предпочтительно дают в количестве, стандартом для которого является следующий диапазон: количество тегафура составляет приблизительно от 0,1 до 100 мг/кг/день, предпочтительно приблизительно от 0,2 до 40 мг/кг/день и более предпочтительно приблизительно от 0,5 до 20 мг/кг/день; количество гимерацила составляет приблизительно от 0,02 до 30 мг/кг/день, предпочтительно приблизительно от 0,05 до 12 мг/кг/день и более предпочтительно приблизительно от 0,1 до 6 мг/кг/день; количество отерацила калия составляет приблизительно от 0,1 до 100 мг/кг/день, предпочтительно приблизительно от 0,2 до 40 мг/кг/день и более предпочтительно приблизительно от 0,5 до 20 мг/кг/день; и количество l-OHP составляет приблизительно от 0,08 до 200 мг/кг/день, предпочтительно приблизительно от 0,15 до 80 мг/кг/день и более предпочтительно приблизительно от 0,4 до 40 мг/кг/день.
В случае инъекционных форм фармацевтическое средство, которое при необходимости может быть разведено водным раствором глюкозы, можно постепенно вводить взрослым пациентам в течение 5 минут или дольше, обычно в количестве, соответствующем приблизительно от 0,1 до 100 мг/кг/день тегафура и приблизительно от 0,08 до 200 мг/кг/день l-OHP.
При использовании суппозиториев, фармацевтическое средство по данному изобретению вводят взрослым один или два раза в день с интервалом от 6 до 12 часов, обычно в количестве, соответствующем приблизительно от 0,1 до 100 мг/кг/день тегафура и приблизительно от 0,08 до 200 мг/кг/день l-OHP посредством введения суппозитория в прямую кишку.
Типы злокачественных опухолей, которые можно лечить введением фармацевтического средства по настоящему изобретению, не ограничены, поскольку активная форма, т.е., 5-FU, действует во всех случаях; например, рак легких, рак желудка, рак толстой кишки, рак прямой кишки, рак пищевода, рак груди, рак головы и шеи, рак печени, рак желчного пузыря/желчных путей, рак поджелудочной железы, рак матки, рак шейки матки, рак яичников, рак почки, рак мочевого пузыря, рак простаты, рак горла, опухоль мозга, лейкемия, меланома, злокачественная лимфома и т.д. В частности, при использовании фармацевтического средства по настоящему изобретению можно ожидать выраженный эффект при раке толстой кишки, раке прямой кишки, раке желудка, раке пищевода, раке молочной железы и раке головы и шеи.
Кроме того, также можно ожидать значительный эффект при типичных резистентных к фармакотерапии опухолях и опухолях, в которых развивается устойчивость к медикаментозной терапии.
ПРИМЕРЫ
Примеры и тестовые примеры приведены ниже для более детальной иллюстрации изобретения, объем изобретения этими примерами и тестовыми примерами не ограничен.
Пример 1
DPPC (L-α-дипальмитоил фосфатидил холин, Coatsome MC-6060, выпускается NOF Corporation), холестерин (высокая степень чистоты, выпускаемый Wako Pure Chemical Industries, Ltd.) и mPEG2000-DSPE (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-n-[метокси(полиэтиленгликоль)-2000], Sunbright DSPE-020CN, выпускается NOF Corporation) растворяют в хлороформе для получения соответствующих концентраций 20 мМ, 50 мМ и 5 мМ. Затем 5 мл 20 мМ раствора DPPC, 0,5 мл 50 мМ раствора холестерина и 1 мл 5 мМ раствора mPEG2000-DSPE помещают в грушевидную колбу. При понижении давления с применением испарителя хлороформ удаляют для получения тонкой липидной пленки на дне грушевидной колбы. Тонкие липидные пленки затем растворяют в 6 мл хлороформа/диэтилового эфира (в объемном соотношении 1:2). l-OHP растворяют в 5%-ом растворе глюкозы так, чтобы концентрация l-OHP стала 8 мг/мл. Полученный таким образом раствор l-ОНР (2 мл) добавляют к липидному раствору и затем перемешивают. Полученную смесь обрабатывают ультразвуком при 25°С в течении 15 минут для получения эмульсии «вода в масле», и органическую фазу удаляют при пониженном давлении с применением испарителя с одновременным встряхиванием; таким образом l-ОНР инкапсулируется в липосому. Обработка ультразвуком для распределения частиц по размеру проводится с применением биодезинтегратора (Nippon Seiki Co., Ltd.), таким образом, чтобы средний диаметр частицы липосомы, содержащей внутри фармацевтическое средство, составил приблизительно менее 200 нм. Для удаления фармацевтического средства, которое не инкапсулировано в липосому, проводится диализ при 4°С в течение 2 часов с применением диализной кассеты (Slide-A-Lyzer Dialysis Cassettes, 10000 MWCO, произведенная Thermo Scientific Inc.), и 5%-ый раствор глюкозы в качестве внешнего раствора с перемешиванием в магнитной мешалке. После замены внешнего раствора проводится еще один диализ в течение двух часов с одновременным перемешиванием, с получением таким образом содержащего l-ОНР липосомального средства. Содержащее l-ОНР липосомальное средство, приготовленное таким образом, имеет средний диаметр частиц 185,2±14,9 нм (n=5).
В примерах настоящего изобретения средний диаметр частиц липосомального средства измеряют способом светорассеяния с применением анализатора субмикронных частиц NICOMP 370 HPL (выпускаемого Particle Sizing System, Inc.)
Пример 2
HSPC (гидрогенизированный фосфатидилхолин соевых бобов, Coatsome NC-21, выпускается NOF Corporation), холестерин (высокая степень чистоты, выпускаемый Wako Pure Chemical Industries, Ltd.) и mPEG2000-DSPE (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-n-[метокси(полиэтиленгликоль)-2000], Sunbright DSPE-020CN, выпускается NOF Corporation) растворяют в хлороформе для получения соответствующих концентраций 20 мМ, 50 мМ и 5 мМ. Затем 5 мл 20 мМ раствора HSPC, 0,5 мл 50 мМ раствора холестерина и 1 мл 5 мМ раствора mPEG2000-DSPE помещают в грушевидную колбу. При понижении давления с применением испарителя хлороформ удаляют для получения тонкой липидной пленки на дне грушевидной колбы. Тонкие липидные пленки затем растворяют в 6 мл хлороформа/диэтилового эфира (в объемном соотношении 1:2). l-OHP разбавляют в 5%-ом растворе глюкозы так, чтобы концентрация l-OHP стала 8 мг/мл. Полученный таким образом раствор l-ОНР (2 мл) добавляют к липидному раствору и затем перемешивают. Полученную смесь обрабатывают ультразвуком при 25°С в течении 15 минут для получения эмульсии «вода в масле», и органическую фазу удаляют при пониженном давлении с применением испарителя в течение примерно часа с одновременным встряхиванием; таким образом l-ОНР инкапсулируется в липосому. Затем происходит контроль размера частиц, и неинкапсулированное фармацевтическое средство удаляют таким же образом, как в примере 1, получая липосомальное средство l-ОНР. Содержащее l-ОНР липосомальное средство, полученное таким образом, имеет средний диаметр частиц 197,9±22,0 нм (n=5).
Пример 3
Содержащее l-ОНР липосомальное средство получают таким же образом, как в примере 1, за исключением того, что PG-DSPE (Sunbright DSPE-PG10G, производится NOF Corporation) применяется вместо mPEG2000-DSPE. Содержащее l-OHP липосомальное средство имеет средний диаметр частиц 130,4±48,3 нм (n=3).
Пример 4
HSPC (гидрогенизированный фосфатидилхолин сои, Coatsome NC, выпускается NOF Corporation), холестерин (высокая степень чистоты, выпускаемый Wako Pure Chemical Industries, Ltd.) и DC-6-14 (катионогенный липид, O,O'-дитетрадеканоил-N-(альфа-триметил аммонио ацетил) диэтаноламин хлорид, выпускаемый Sogo Pharmaceutical Co., Ltd.) и mPEG2000-DSPE (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-n-[метокси(полиэтиленгликоль)-2000], Sunbright DSPE-020CN, выпускается NOF Corporation) растворяют в хлороформе для получения соответствующих концентраций 20 мМ, 50 мМ и 5 мМ. Затем 5 мл 20 мМ раствора HSPC в хлороформе, 1 мл 50 мМ раствора холестерина и по 2 мл 5 мМ раствора в хлороформе DC-6-14 и 5 мМ mPEG2000-DSPE помещают в грушевидную колбу. При понижении давления с применением испарителя хлороформ удаляют для получения тонкой липидной пленки на дне грушевидной колбы. Тонкие липидные пленки затем растворяют в 6 мл хлороформа/диэтилового эфира (в объемном соотношении 1:2). l-OHP разбавляют в 5%-ом растворе глюкозы так, чтобы концентрация l-OHP стала 8 мг/мл. Полученный таким образом раствор l-ОНР (2 мл) добавляют к липидному раствору и затем перемешивают. Полученную смесь обрабатывают ультразвуком при 35°С в течении 15 минут, и органический растворитель удаляют при пониженном давлении с применением испарителя с одновременным встряхиванием; таким образом l-ОНР инкапсулируется в липосому. Затем происходит контроль размера частиц, и неинкапсулированное фармацевтическое средство удаляют таким же образом, как в примере 1, получая липосомальное средство l-ОНР. Содержащее l-ОНР липосомальное средство, полученное таким образом, имеет средний диаметр частиц 202,4±14,7 нм (n=5).
Тестовый пример 1
Рецептура фармацевтического средства
Применяется содержащее l-OHP липосомальное средство, полученное в примере 1 (здесь далее называемое DPPS l-ОНР липосома).
Средство l-ОНР (здесь далее называемое свободный l-ОНР) получают посредством растворения l-ОНР в 5%-ом растворе глюкозы.
Средство TS-1 (здесь называемое TS-1) получают растворением содержимого капсулы TS-1 в воде.
Противоопухолевый эффект и побочные эффекты фармацевтического средства
Активно метастазирующие клетки рака легкого, например, карциномы легких Льюиса (LLC) культивируют в присутствии 5% CO2 при температуре 37°С в 10%-ом FBS-DMEM. 0,1 мл клеток LLC, содержащий 5×106 клеток/мл, подкожно вводят в спину самцу мыши линии C57BL/6 (возраст 5 недель, масса тела 20 г) для получения мыши-носителя солидной опухоли. О возникновении опухоли свидетельствует то, что объем опухоли, рассчитанный по следующей ниже формуле, превышает 50 мм3 через 6 дней после инфузии клеток LLC.
DPPC l-OHP липосома или свободный l-OHP вводят внутривенно в дозе 4,2 мг/кг по l-ОНР. TS-1 вводят перорально в дозе 6,9 мг/кг по тегафуру. DPPC l-ОНР липосома и свободный l-ОНР вводятся на 13 и 20 день после введения клеток, а TS-1 вводят каждый день с 6 дня после введения клеток до конца эксперимента.
Объем опухоли рассчитывают с помощью следующей формулы через 6 дней после введения клеток. Противоопухолевый эффект оценивают с использованием относительного объема опухоли в качестве индекса.
Объем опухоли=1/2 × a × b2
(а: большая ось опухоли, b: малая ось опухоли)
Изменение массы тела мышей наблюдается в качестве индикатора побочных эффектов.
Как ясно видно из результатов, показанных на Фиг.1, комбинированная терапия DPPC l-ОНР липосомами и TS-1 показывают более высокий противоопухолевый эффект, чем сочетание свободного l-OHP и TS-1. Однако результаты, показанные на Фиг.2, указывают на то, что достоверного различия в изменении массы тела между сочетанием TS-1 с DPPC l-ОНР липосомой и со свободным l-ОНР нет. Значительного повышения токсичности не наблюдалось.
Тестовый пример 2
Противоопухолевый эффект и побочные эффекты оценивают таким же образом, как в тестовом примере 1, за исключением того, что используется содержащее l-OHP липосомальное средство, полученное в примере 2 (здесь далее называемое HSPC l-OHP липосома).
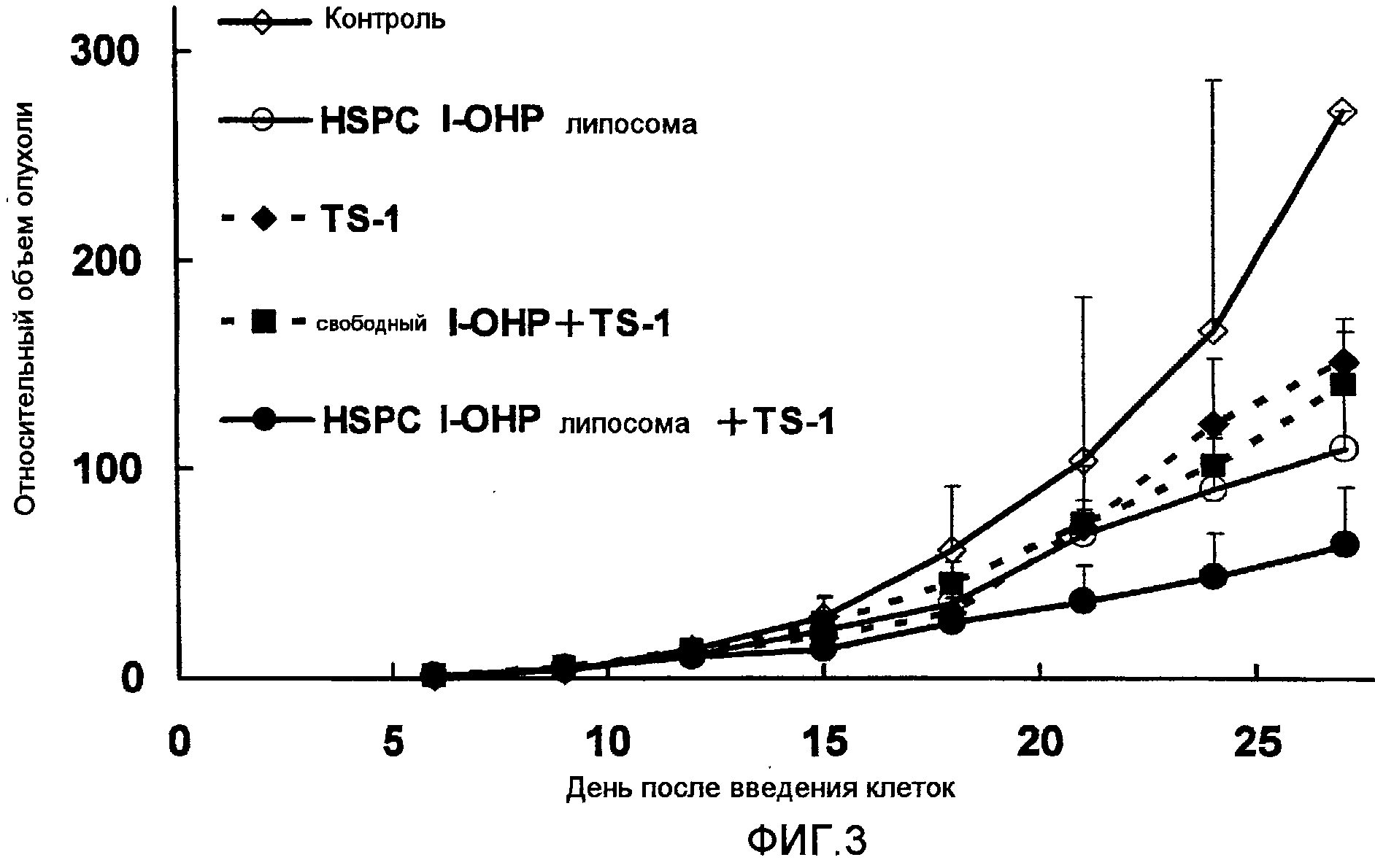
Как ясно из результатов, показанных на Фиг.3, комбинированная терапия HSPC l-OHP липосомами и TS-1 показывает более высокий противоопухолевый эффект, чем комбинация свободного l-ОНР и TS-1. Однако результаты, показанные на Фиг.4 ясно указывают на то, что не отмечается достоверного различия в изменении массы тела в случаях применения комбинации TS-1 и HSPC l-ОНР липосомы и TS-1 и свободного l-ОНР. Значительного повышения токсичности не наблюдалось.
Тестовый пример 3
Фармацевтическое средство составляют аналогично тестовому примеру 1. Полученное фармацевтическое средство вводят мыши-носителю опухоли и прослеживают продолжительность выживаемости мышей в днях.
Как видно из результатов, показанных на Фиг.5, когда TS-1 вводят в комбинации с DPPC l-OHP липосомой, длительность выживаемости больше, чем в случае комбинации со свободным l-OHP.
Тестовый пример 4
Фармацевтическое средство получают таким же образом, как в тестовом примере 2. Полученное фармацевтическое средство вводят мыши-носителю опухоли и оценивают продолжительность выживаемости мышей в днях.
Как ясно из результатов, показанных на Фиг.6, когда TS-1 вводят в комбинации с HSPC l-OHP липосомой, длительность выживаемости больше, чем в случае комбинации со свободным l-OHP.
Тестовый пример 5
Противоопухолевый эффект оценивают аналогично тестовому примеру 1, за исключением того, что применяют содержащее l-OHP липосомальное средство, полученное в примере 3 (далее называемое PG10 l-OHP липосома).
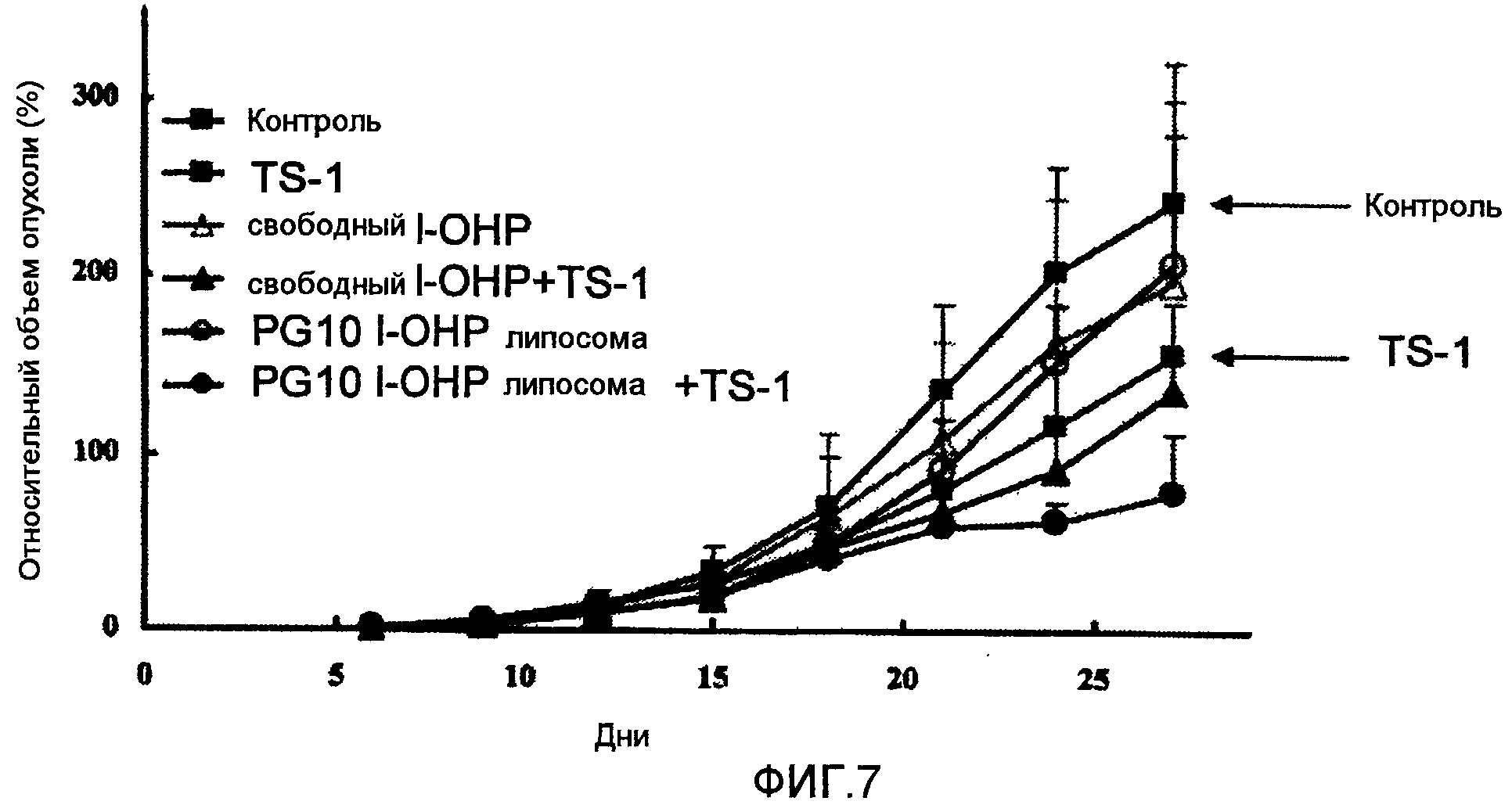
Как ясно из результатов, показанных на Фиг.7, комбинированная терапия PG10 l-OHP липосомой в сочетании с TS-1 показывает более высокий противоопухолевый эффект, чем сочетание свободного l-OHP и TS-1.
Тестовый пример 6
Рецептура фармацевтического средства
Фармацевтическое средство составляют так же, как в тестовом примере 2.
Противоопухолевый эффект и побочные эффекты фармацевтического средства
Клетки рака толстой кишки мыши, а именно Colon 26, культивируют в присутствии 5% CO2 при 37°С в 10%-ом FBS-DMEM. 0,1 мл клеток линии Colon 26, содержащий 2×107 клеток/мл подкожно вводят в спинку самца мыши линии BALB/с (возраст 5 недель, масса 20 г) для получения мыши-носителя солидной опухоли. Это подтверждают тем, что объем опухоли, рассчитанный по следующей формуле, превышает 50 мм3 через 7 дней после введения клеток Colon 26.
HSPC l-OHP липосома или свободный l-OHP внутривенно вводят в дозе 4,2 мг/кг в качестве l-OHP. TS-1 вводят перорально в дозе 6,9 мг/кг в качестве тегафура. HSPC l-OHP липосома и свободный l-OHP вводят на 14 и 21 день после введения клеток опухоли, и TS-1 вводят каждый день с 7 дня после введения клеток до конца эксперимента.
Противоопухолевые и побочные эффекты оценивают таким же образом, как в тестовом примере 2.
Как видно из результатов, показанных на Фиг.8, противоопухолевый эффект комбинированной терапии HSPC l-OHP липосомы и TS-1 более сильный, чем у комбинации свободного l-OHP и TS-1. Однако результаты, показанные на Фиг.9, ясно указывают на то, что нет достоверных различий в изменении массы тела между обработкой TS-1 в комбинации с HSPC l-OHP липосомой и со свободным l-OHP. Другими словами, значительного повышения токсичности не наблюдается.
Тестовый пример 7
Фармацевтическое средство составляют таким же образом, как в тестовом примере 6. Полученное фармацевтическое средство вводят мыши-носителю опухоли и контролируют выживаемость мыши в днях.
Как видно из результатов, показанных на Фиг.10, HSPC l-OHP липосомы в сочетании с TS-1 демонстрируют пролонгированную выживаемость по сравнению с комбинацией свободного l-OHP и TS-1.
Приведенные выше результаты подтверждают, что посредством инкапсулирования l-OHP в липосому, т.е., содержащего l-ОНР липосомального средства, противоопухолевый эффект и показатели выживаемости для содержащего l-ОНР липосомального средства могут быть значительно улучшены посредством комбинирования с TS-1, тогда как уровень токсичности практически такой же, как в случае, когда l-ОНР вводится в сочетании с TS-1. Повышение противоопухолевой активности, возможно, объясняется улучшенным биораспределением и повышенным накоплением l-ОНР в опухолевой ткани в результате его оптимального инкапсулирования в липосомы.
Настоящее изобретение показывает, что посредством инкапсулирования l-OHP в липосомальное средство противоопухолевая активность комбинированной терапии l-ОНР и комбинированным средством, содержащим тегафур, гимерацил и отерацил калия, может быть повышена, и токсичности, связанной с включением l-ОНР в липосомы, не обнаруживается. Это показывает, что, как предполагается, комбинированная терапия с применением липосомального средства l-ОНР с комбинированным средством, содержащим тегафур, гимерацил и отерацил калия, должна быть эффективной для лечения рака.