Результат интеллектуальной деятельности: Комбинация дегидроксиметилэпоксихиномицина (DHMEQ) и цитостатиков для лечения рака яичника
Вид РИД
Изобретение
Область техники
Изобретение относится к области медицины и фармакологии и касается разработки и получения эффективной лекарственной комбинации, включающей DHMEQ, которая может быть использованы для лечения и/или предотвращения рецидива рака яичника у субъекта, характеризующегося злокачественной опухолью или метастазами злокачественной опухоли.
Уровень техники
Рак яичника (РЯ) является самой частой причиной смерти женщин среди всех онкогинекологических патологий. Ежегодно около 140 000 женщин в мире погибает от РЯ [1]. Одной из особенностей данной опухоли является поздняя диагностика, когда уже имеется поражение брюшины, асцит, реже гематогенные метастазы и опухолевый плеврит. В первый год с момента постановки летальность диагноза составляет более 35% [1, 2]. На момент установки диагноза у большинства больных наблюдается канцероматоз брюшной полости. Стандартом лечения больных с поздними стадиями РЯ является хирургическая циторедукция с последующей внутривенной химиотерапией соединениями платины и таксанов [3]. Хотя частичный и полный ответ наблюдаются в 80% и 40-60% случаев, соответственно, у большинства пациентов развивается рецидив, а медиана продолжительности жизни составляет 18 месяцев [4]. За последние десятилетия 5-ти летняя выживаемость несколько увеличилась с использованием более эффективных хирургических методов и эмпирически подобранных комбинаций цитостатиков, однако она все равно остается на крайне низком уровне и составляет не более 30% [2]. Такие низкие результаты стандартного лечения требуют поиска новых подходов к лекарственной терапии больных с различными стадиями рака яичника. Одним из альтернативных вариантов системной терапии РЯ является внутрибрюшинное введение противоопухолевых препаратов или интраперитонеальная химиотерапия [5]. Анализ результатов внутрибрюшинной химиотерапии РЯ показал увеличение эффективности лечения пациенток по сравнению с системной внутривенной [6]. Одним из преимуществ такой терапии является накопление лекарственного вещества непосредственно в брюшной полости, куда зачастую с током внутрибрюшинной жидкости метастазирует данная локализация, что наряду с большим проникновением препаратов в опухолевую ткань, существенно увеличивает фармакологический эффект. Однако, несмотря на ряд преимуществ, данный вид терапии не находит широкого применения в клинической практике [8], что связано с развитием ряда осложнений при проведении процедур, таких как спаечные процессы, развитием резистентности к препаратам и их низкой эффективностью, сопряженной с высокой токсичностью [7]. Лишь ограниченное количество существующих на рынке препаратов подходит для интраперитонеальной химиотерапии. Поэтому, наряду с поиском новых методов лечения, существует необходимость в новых препаратах, обладающих более выраженным противоопухолевым действием и менее выраженной токсичностью для применения их посредством внутрибрюшинного введения для лечения РЯ. Помимо этого, оптимальными для внутрибрюшинной терапии являлись бы препараты, сочетающие низкий молекулярный вес, способность проникать в опухолевые клетки и выраженное контактное действие [6].
Раскрытие изобретения
Задачей данного изобретения является разработка и получение новой нетоксичной эффективной лекарственной комбинации на основе DHEMQ, для лечения и/или предотвращения рецидива рака яичника у субъекта, характеризующегося злокачественной опухолью или метастазами злокачественной опухоли.
Техническим результатом данного изобретения является разработка и создание новой эффективной нетоксичной лекарственной комбинации, включающей DHMEQ и, по меньшей мере, один цитостатик, для лечения и/или предотвращения рецидива рака яичника у субъекта, характеризующегося злокачественной опухолью или метастазами злокачественной опухоли, которая обладает достаточной стабильностью и высокой биодоступностью. Комбинация по изобретению характеризуется тем, что действие одного компонента комбинации потенцирует действие другого и, как результат, проявляется синергетический эффект. Комбинации по изобретению также эффективно снижают рост и объем опухоли яичника по сравнению с режимом монотерапии.
Указанный технический результат достигается посредством разработки и создания комбинации для внутрибрюшинного введения, предназначенной для лечения и/или предотвращения рецидива рака яичника у субъекта, характеризующегося злокачественной опухолью или метастазами злокачественной опухоли, включающая терапевтически эффективное количество DHMEQ или его фармацевтически приемлемой соли и терапевтически эффективное количество, по меньшей мере, одного цитостатика или его фармацевтически приемлемой соли.
В частных вариантах воплощения изобретения терапевтически эффективное количество DHMEQ представляет собой суточную дозу 1-15 мг/кг.
В некоторых частных вариантах воплощения изобретения терапевтически эффективное количество DHMEQ представляет собой суточную дозу 7-15 мг/кг.
В некоторых частных вариантах воплощения изобретения терапевтически эффективное количество DHMEQ представляет собой суточную дозу 10-12 мг/кг.
В некоторых частных вариантах воплощения изобретения терапевтически эффективное количество DHMEQ представляет собой суточную дозу 14.2 мг/кг.
В частных вариантах воплощения изобретения цитостатик представляет цисплатин и/или паклитаксел.
В частных вариантах воплощения изобретения субъект представляет собой человека.
В частных вариантах воплощения изобретения DHMEQ или его фармацевтическая соль и цитостатик или его фармацевтически приемлемая соль вводятся субъекту одновременно, последовательно или раздельно.
Технический результат также достигается посредством разработки и создания фармацевтической композиции для внутрибрюшинного введения, предназначенной для лечения и/или предотвращения рецидива рака яичника у субъекта, характеризующегося злокачественной опухолью или метастазами злокачественной опухоли, включающей комбинацию по изобретению и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
В частных вариантах воплощения изобретения фармацевтически приемлемое вспомогательное вещество представляет собой носитель, наполнитель и/или растворитель.
Технический результат также достигается посредством осуществления способа лечения рака яичника, характеризующегося внутрибрюшинным введением комбинации по изобретению.
В частных вариантах воплощения изобретения суточная доза DHMEQ в комбинации составляет 1-15 мг/кг.
В частных вариантах воплощения изобретения суточная доза DHMEQ в комбинации составляет 7-15 мг/кг.
В частных вариантах воплощения изобретения суточная доза DHMEQ в комбинации составляет 10-12 мг/кг.
В частных вариантах воплощения изобретения компоненты комбинации вводятся субъекту одновременно, последовательно или раздельно.
В частных вариантах воплощения изобретения субъект представляет собой человека.
Определение и термины
В/б – внутрибрюшинный;
ДМСО – диметилсульфоксид;
МПД – максимально переносимая доза;
ОЯ – опухоль яичника;
РЯ – рак яичника;
СПЖ – средняя продолжительность жизни;
УПЖ – увеличение продолжительности жизни;
ЦП – цисплатин;
Т/С% = (СПЖопыта/СПЖконтроля)×100;
Т/С – Treatment (лечение)/Control (контроль) - показывает на сколько процентов изменилась средняя продолжительность жизни в группах относительно контрольных групп;
ТРО – торможение роста опухоли;
DHMEQ – дегидроксиметилэпоксихиномицин, cпецифичный низкомолекулярный ингибитор NF-kB, характеризующийся следующей структурной формулой:
 .
.
Для лучшего понимания настоящего изобретения ниже приведены некоторые термины, используемые в настоящем описании изобретения.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термины «лечение», «терапия» охватывают лечение патологических состояний у субъекта, предпочтительно у человека, и включают: а) блокирование (приостановку) течения заболевания, б) облегчение тяжести заболевания, т.е. индукцию регрессии заболевания.
Термин «субъект» охватывает все виды млекопитающих, предпочтительно человека.
Под термином «цитостатик» в данном документе понимается производные платины (в частности, Цисплатин, Карбоплатин, Оксалиплатин) и таксаны (в частности, Доцетаксел, Паклитаксел). Интервалы эффективных дозировок цитостатиков могут, в частности, составлять 30-150 мг/м2 для цислплатина и 135–175 мг/м2 для паклитаксела.
Термин «профилактика», «предотвращение» охватывает устранение факторов риска, а также профилактическое лечение субклинических стадий заболевания у субъекта, предпочтительно у человека, направленное на уменьшение вероятности возникновения клинических стадий заболевания. Субъекты для профилактической терапии отбираются на основе факторов, которые, на основании известных данных, влекут увеличение риска возникновения клинических стадий заболевания по сравнению с общим населением. К профилактической терапии относится, а) первичная профилактика и б) вторичная профилактика. Первичная профилактика определяется как профилактическое лечение у пациентов (субъектов), клиническая стадия заболевания у которых ещё не наступила. Вторичная профилактика - это предотвращение повторного наступления того же или близкого клинического состояния заболевания.
Термин «уменьшение риска» охватывает терапию, которая снижает частоту возникновения клинической стадии заболевания. Примерами уменьшения риска заболевания является первичная и вторичная профилактика заболевания.
Термин "профилактика асцитного состояния" обозначает, что после соответствующего профилактического лечения по настоящему изобретению образование асцитной жидкости полностью ликвидировано или снижено, или, в другом варианте, что тем не менее образовавшаяся асцитная жидкость исчезает или степень ее образования снижена.
Термин "лечение асцитного состояния" обозначает, что после соответствующего лечения по настоящему изобретению присутствующая у пациента асцитная жидкость не образуется или степень ее образования снижена.
Используемый здесь термин «фармацевтически приемлемая соль» относится к таким солям, которые, в рамках проведенного медицинского заключения, пригодны для использования в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и т.д., и отвечают разумному соотношению пользы и риска. Примерами могут служить фармацевтически приемлемые соли и/или алкоголята щелочных металлов (например, калиевые, натриевые, литиевые соли).
Изобретение также относится к фармацевтическим композициям, которые содержат комбинации по изобретению и один или несколько фармацевтически приемлемых носителей, растворителей и/или наполнителей, таких, которые могут быть введены в организм субъекта совместно с комбинацией, составляющей суть данного изобретения, и которые не разрушают фармакологической активности компонентов комбинации по изобретению, и являются нетоксичными при введении в дозах, достаточных для доставки терапевтического количества компонентов комбинации.
Фармацевтические композиции, заявляемые в данном изобретении, содержат комбинации по изобретению совместно с фармацевтически приемлемыми носителями, которые могут включать в себя любые растворители, разбавители, дисперсии или суспензии, поверхностно-активные вещества, изотонические агенты, загустители и эмульгаторы, консерванты, смазочные материалы и т.д., подходящие для конкретной формы дозирования. Материалы, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничиваются, моно- и олигосахариды, а также их производные; желатин; тальк; эксципиенты; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; и фосфатные буферные растворы. Также в составе композиции могут быть другие нетоксичные совместимые смазочные вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, разделительные жидкости, консерванты и антиоксиданты.
В данном документе «терапевтически эффективным количеством» называется такое количество соединения, которое необходимо для детектируемого уничтожения раковых клеток или ингибирования их роста или скорости распространения по организму, размера или количества опухолей, или других характеристик ракового заболевания. Точное требуемое количество может меняться от субъекта к субъекту в зависимости от вида, возраста и общего состояния пациента, тяжести заболевания, особенностей противоракового агента и т.п.
Под термином «доза» в данном документе понимается количество действующего (активного) вещества, который вводят пациенту, нуждающегося в соответствующем лечении для получения терапевтического эффекта.
Комбинации для лечения и/или предотвращения рецидива рака яичника у субъекта, характеризующегося злокачественной опухолью или метастазами злокачественной опухоли по изобретению предназначены для одновременного, раздельного введения или введения через определенный период времени. Термин "одновременный" или "одновременно", если он относится к терапевтическому применению, обозначает, что при лечении вводят два или более активных ингредиентов одним и тем же способом и в одно и то же время, то есть совместно. Совместное введение подразумевает, в частности, совместную доставку, например, в одной лекарственной форме, в частности в одной инъекции.
Термин "раздельно" или "раздельный", если он относится к терапевтическому применению, обозначает, что при лечении вводят два или более активных ингредиентов приблизительно в одно и то же время по крайней мере двумя различными способами. Введение "через определенный период времени" обозначает, что два или более ингредиентов вводят в различное время, и прежде всего, когда введение одного активного ингредиента полностью завершается перед введением другого или других активных ингредиентов. Таким образом, можно вводить один из активных ингредиентов в течение нескольких месяцев до введения другого активного ингредиента или ингредиентов. В этом случае, исключено одновременное введение. Введение "через определенный период времени" также включает случаи, когда ингредиенты вводят через различные периоды времени (например, когда один ингредиент вводят один раз в сутки, а другой ингредиент вводят один раз в неделю).
Под «раком (опухолью) яичника» в данном документе понимаются любые злокачественные новообразования яичников, таких как, например, серозные, эндометриодные, муцинозные, светло-клеточные, серозно-муцинозные, недифференцированные или смешанные эпителиальные карциномы, но не ограничиваясь ими.
Краткое описание чертежей
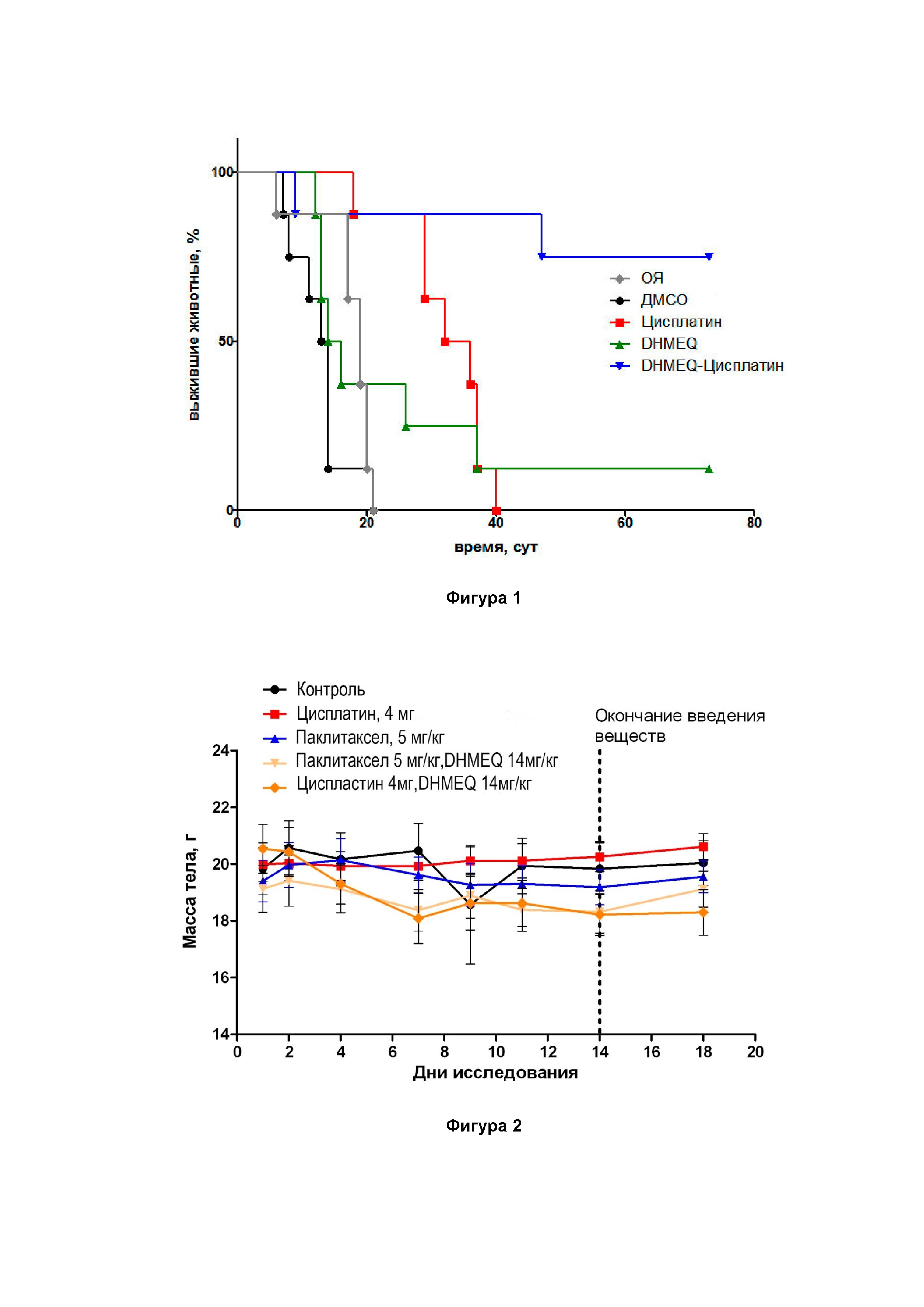
Фигура 1. Кривые выживаемости крыс с опухолью яичника в контрольных группах и группах с комбинациями по изобретению, где DHMEQ в дозе 14,2 мг/кг.
Фигура 2. Влияние исследуемых веществ и комбинаций по изобретению на изменение массы тела животных.
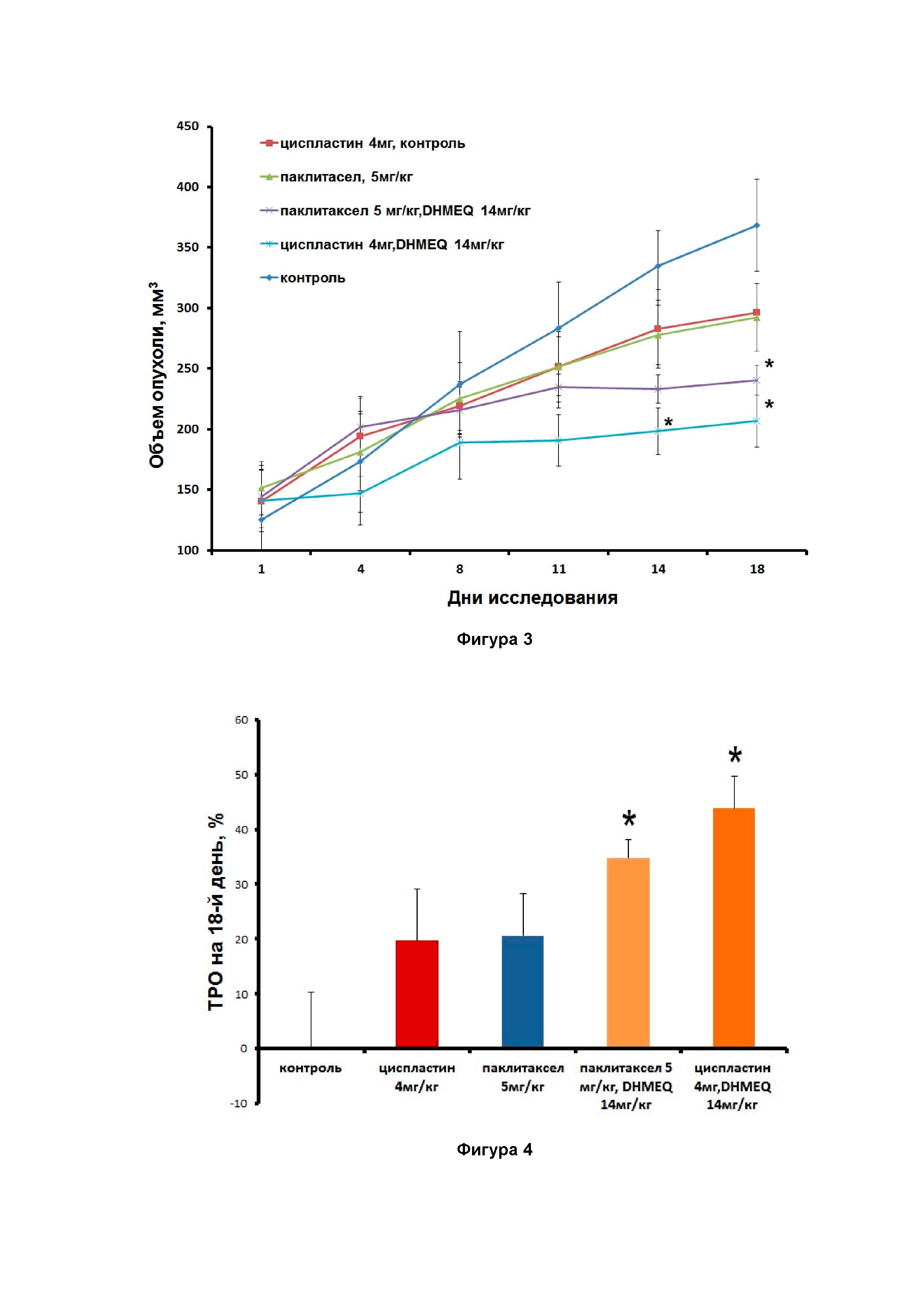
Фигура 3. Влияние исследуемых веществ и комбинаций по изобретению на рост опухоли клеточной линии SKOV-3 в модели ксенографтов (* - p<0,05 по сравнению с группой «Контроль»).
Фигура 4. Торможение роста опухоли (ТРО) на 18-й день исследования роста опухолевых клеток линии SKOV-3 в модели ксенографтов (* - p<0,05 по сравнению с группой «Контроль»).
Подробное раскрытие изобретения
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера. Следует понимать, что эти и все приведенные в материалах заявки примеры не являются ограничивающими и приведены только для иллюстрации настоящего изобретения.
В результате проведенных экспериментов неожиданно были получены данные, демонстрирующие потенциирующий противоопухолевый эффект (эффект комбинации больше суммарного эффекта комбинантов) DHMEQ в комбинации с цитостатиками, в частности, с цисплатином и/или паклитакселом. Данные in vivo показывают, что препарат DHMEQ, который является ингибитором NF-kB, в комбинации с цитостатиком, в частности, с цисплатином или паклитакселом, проявляет высокую эффективность на нескольких моделях рака яичников in vivo, эффект становится неожиданно более сильным и продолжительным, чем сумма эффектов отдельных лекарственных средств, что свидетельствует о том, что комбинации характеризуются существенно улучшенными показателями эффективности для лечения рака яичника. Таким образом, комбинации по изобретению, а именно DHMEQ в комбинации с цитостатиками, в частности, с цисплатином и/или паклитакселом, перспективны для использования в качестве эффективного лекарственного средства для лечения и/или предотвращения рецидива рака яичника у субъекта, характеризующегося злокачественной опухолью или метастазами злокачественной опухоли, в том числе асцитного состояния, связанного с раком яичников.
Характеристика биологической активности комбинации по изобретению
Исследование противоопухолевой активности препарата DHMEQ при монотерапии и комбинации по изобретению на перевиваемой опухоли яичника у самок крыс
Для оценки противоопухолевой активности DHMEQ при монотерапии и комбинации по изобретению, в частности комбинации, включающей DHMEQ и цисплатин, были использованы 300 крыс-самок Вистар массой тела 160–200 г, которым перевивался штамм опухоли яичника (ОЯ), который был получен из РОНЦ им. Н.Н. Блохина РАМН. Несмотря на то, что ксенографтные модели не являются идеальными, они широко используются для оценки потенциальной эффективности лекарственных препаратов против РЯ в доклинических исследованиях. В данном исследовании использована экспериментальная модель диссеминированного РЯ у крыс [2], получаемая в/б перевивкой асцитной ОЯ, которая является воспроизводимой и адекватной для изучения эффективности и безопасности препаратов при в/б введении. Использованная в данном эксперименте ОЯ является низкодифференцированным эпителиальным РЯ. Опухоль прививалась в 100% случаев. По своей морфологии и течению (характер метастазирования, накопление асцита) ОЯ весьма близка соответствующим опухолям человека. Для данной опухоли характерно метастазирование в паратрахеальные лимфоузлы, образование многочисленных опухолевых узлов в брюшной полости, обильного асцита и отсутствие крупной солидной опухоли. По литературным сведениям известно, что ОЯ является более агрессивной по сравнению с ксенографтными моделями, средняя продолжительность животных после перевивки составляет 14±2 суток.
Для оценки комбинированного действия с DHMEQ и как препарат сравнения в данном исследовании использовался цисплатин, который убивает клетки на разных стадиях клеточного цикла, образует сшивки ДНК-белок и ДНК-ДНК, а также взаимодействует с их нуклеофильными группами. Низкая молекулярная масса цисплатина по сравнению с другими цитостатиками способствует его более быстрому проникновению в опухолевую ткань, что увеличивает его эффективность при внутрибрюшинном введении. AUC цисплатина значительно ниже паклитаксела, однако последний обладает более высокой молекулярной массой и показывал несколько меньшую эффективность в других исследованиях на выбранной модели РЯ, однако более высокую активность в комбинации с DHMEQ, чем в монотерапии паклитаксела (фиг. 4).
В результате проведенных исследований продолжительности жизни животных после введения комбинации по изобретению получены данные, представленные в таблице 1.
Таблица 1. Результаты исследования продолжительности жизни животных при введении Цисплатина, DHMEQ, комбинации DHMEQ с Цисплатином по изобретению.
|
Как следует из представленных данных, значительное увеличение продолжительности жизни было получено при использовании комбинации DHMEQ (14,2 мг/кг) с Цисплатином (4 мг/кг) и составило 387% (p=0,005, log-rank test) по сравнению с контрольной группой (фиг.1). Комбинация DHMEQ/Цисплатин также увеличивала продолжительность жизни крыс на 91% по сравнению с группой животных, которым был введен просто Цисплатин (p=0,003, log-rank test). Комбинация DHMEQ и Цисплатина неожиданно показала потенциирующий (синергетический) эффект на эффективность терапии рака яичников (16 крыс в каждой группе).
Более 50% животных в группе комбинации DHMEQ + Цисплатин оставались живыми на 73 сутки эксперимента. При этом в группе с Цисплатином не осталось ни одного животного, а в группе с DHMEQ в живых оставалось лишь одна крыса. Результаты в группе комбинации были бы выше, если не принудительная остановка эксперимента. Поэтому в клинической фармакологии часто используется также показатель "медиана продолжительности жизни", либо "медиана выживаемости", которая идентифицирует продолжительность жизни 50% участников исследования. В ходе исследования у группы с комбинацией DHMEQ+Цисплатин она максимальна и составляет 73 суток и характеризует потенциирующий эффект комбинации.
Комбинация DHMEQ/Цисплатин так же статистически достоверно снижала образование опухолевого плеврита по сравнению с контрольными группами.
Таким образом, перспективным является применение комбинации DHMEQ с цитостатиком, в частности, в виде фармацевтических композиций при инъекционной терапии внутрибрюшинно диссеминированного рака яичников в области онкологии.
Изучение противоопухолевой активности препарата DHMEQ при монотерапии и в комбинации с препаратами Циспластин и Паклитаксел в модели ксенографтов рака яичников линии SKOV-3.
Для оценки противоопухолевой активности комбинаций по изобретению, в частности комбинаций DHMEQ/цисплатин и DHMEQ/паклитаксел на основе размера опухоли, а не продолжительности жизни, использовали модели ксенографтов рака яичников человека линии SKOV-3.
DHMEQ растворяли в 100% ДМСО. Стоковые растворы DHMEQ в 100% ДМСО хранили не более 2 недель при +4°C в темном месте вне пределов попадания прямых солнечных лучей.
При введении препаратов цисплатина и паклитаксела объем введения составлял 8 мл/кг. Все препараты вводили внутрибрюшинно.
Среда для культивирования RPMI-1640 (ПанЭко; С330п) содержит 10 % FBS (HyClone; SV30160.03), 2 mM глутамин натрия (ПанЭко; Ф032), 1xПируват натрия (ПанЭко; Ф023), 1хЗаменимые аминокислоты (ПанЭко; Ф115/50), 1xПенициллин-стрептомицин (ПанЭко; А065).
Клетки рака яичника человека линии SKOV-3 размораживали в среде и культивировали в Т175 флаконах для прикрепленных культур. По мере достижения 100% конфлюентности, клетки пересеивали: в среднем раз в 3-4 дня. При откреплении удаляли культуральную жидкость, промывали в фосфатно-солевом буфере и добавляли раствор трипсина-ЭДТА 0,25% с солями Хенкса (ПанЭко; П041). Инкубировали 5 минут при 37°С, добавляли среду и откручивали. Далее рассеивали в Т175 флаконы.
В день имплантации мышам клетки SKOV-3 промывали в среде α-МЕМ (ПанЭко; С180п) без сыворотки, считали, откручивали на скорости 900 rpm (R ротора 20,4 см). Повторно откручивали на скорости 900 rpm и ресуспендировали в среде α-МЕМ температурой меньше 10°С до плотности клеток в конечной суспензии 50 млн/мл. Предварительно охлажденной пипеткой добавляли объем Матригеля, равный объему суспензии клеток и плавно перемешивали их. Таким образом, конечная концентрация клеток составляла 25 млн/мл.
Суспензию клеток вводили мышам подкожно вдоль позвоночника (в районе правой лопатки) в объеме 0.2 мл (5 млн клеток) на мышь. Перед имплантацией клеток соответствующий участок кожи мышей выбривали и обрабатывали дезинфицирующим раствором АХД-2000.
Таблица 2. Группы животных в эксперименте.
|
Измерение подкожно имплантированных опухолей проводили 2 раза в неделю. Объем опухоли определяли по формуле:
π/6 x L x W2=mm3,
где L- соответствует наибольшему диаметру опухоли, W – наименьшему. Измерения проводили с помощью штангенциркуля.
Противоопухолевую активность исследуемых препаратов, а также комбинаций по изобретению определяли по замедлению роста опухоли относительно опухолей в контрольной группе, получающей растворитель. Для этого рассчитывали значения торможения роста опухоли:
ТРО=(С-Т) х100/С, %
где С – средний размер опухоли в контрольной группе, получавшей растворитель,
Т – размер опухоли в экспериментальной группе.
ТРО определяли на 14-й день исследования (после последнего введения исследуемого препарата и комбинаций по изобретению) и через 4 дня после этого.
Также следили за здоровьем и поведением животных, фиксировали число летальных исходов. Осмотр животных проводили в момент введения соединений, и далее дважды в день (утром и вечером) для регистрации смертности и общего состояния.
Измерение веса животных проводили 2 раза в неделю.
Средние размеры опухолей в конце исследования были использованы для статистического сравнения ингибирования роста опухолей. Для межгруппового статистического сравнения использован двусторонний тест Манна-Уитни (GraphPadPrizm). Различия определяли при уровне статистической значимости ≤ 0.05.
Проведенное исследование показало, что введение исследуемых веществ не влияет на изменение массы тела животных (фиг. 2).
Результаты исследования влияния испытуемых веществ и комбинаций по изобретению на рост опухоли приведены на фигуре 3.
Эти результаты показывают, что у животных в группе «Контроль» размер опухоли равномерно и постоянно увеличивался. Опухоли животных, получавших однократно Паклитаксел в дозе 5 мг/кг, а также однократно Циспластин в дозе 4 мг/кг также увеличивались со временем. Увеличение не отличается от группы «Контроль». Комбинации DHMEQ и Паклитаксела в дозах 14 мг/кг и 5 мг/кг, а также DHMEQ и Циспластина в дозах 14 мг/кг и 4 мг/кг значительно замедляли рост опухолей. Эффект сохранялся и через четыре дня после завершения приема препарата.
При исследовании размеров опухолей и торможения роста опухоли (ТРО) на 14-й день исследования и на 18-й день, в частности, показано, что ежедневное введение DHMEQ в дозе 14 мг/кг после однократных введений препарата Циспластина в дозе 4 мг/кг и Паклитаксела в дозе 5 мг/кг приводит к достоверному уменьшению размеров опухолей и увеличению ТРО (фиг. 4). На 18-й день исследования (четвертый день после прекращения введения препаратов) результаты такие же, как и на 14-й день.
Таким образом, впервые показано, что ежедневное внутрибрюшинное введение комбинации по изобретению, в частности комбинации, включающей DHMEQ в дозе 14 мг/кг после однократного внутрибрюшинного введения препаратов циспластина и/или паклитаксела приводит к снижению темпов роста опухоли клеточной линии SKOV-3 в модели ксенографтов.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
Список литературы, которая включена в настоящее описание изобретения в качестве ссылок:
[1] Siegel R., Ma J., Zou Z., Jemal A.. Cancer statistics, 2014 // CA: A Cancer Journal for Clinicians. - V. 64. – P. 9–29.
[2] Bast R.C. Jr, Hennessy B., Mills G.B. The biology of ovarian cancer: new opportunities for translation // Nat Rev Cancer. - 2009. – V. 9(6). - P. 415-28
[3] Marcus C.S., Maxwell G.L., Darcy K.M. et al. Current approaches and challenges in managing and monitoring treatment response in ovarian cancer // J. Cancer. – 2014. – Vol. 5. – P. 25–30.
[4] Hennessy BT, Coleman RL, Markman M. Ovarian cancer. Lancet. - 2009. – V.374. - P 1371-82.
[5] Chua, T.C. Intraoperative hyperthermic intraperitoneal chemotherapy after cytoreductive surgery in ovarian cancer peritoneal carcinomatosis: systematic review of current results / T.C. Chua, G. Robertson, W. Liauw et al. // J. Cancer Res. Clin. Oncol. – 2009. – Vol. 135. – P. 1637–1645.
[6] Eskander R.N., Cripe J., Bristow R.E. Intraperitoneal chemotherapy from Armstrong to HIPEC: challenges and promise // Curr. Treat. Options Oncol. – 2014. – Vol. 15. – P. 27–40.
[7] Eskander R.N., Cripe J., Bristow R.E. Intraperitoneal chemotherapy from Armstrong to HIPEC: challenges and promise // Curr. Treat. Options Oncol. – 2014. – Vol. 15. – P. 27–40.
[8] Bowles E.J., Wernli K.J., Gray H.J. et al. Diffusion of intraperitoneal chemotherapy in women with advanced ovarian cancer in community settings 2003–2008: the effect of the NCI clinical recommendation // Front. Oncol. – 2014. – V. 10. - P 4-43.