СОСТАВ ГЕЛЯ ДЛЯ ЛУЧЕВОЙ ТЕРАПИИ ПОД ВИЗУАЛЬНЫМ КОНТРОЛЕМ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к улучшенному составу для лучевой терапии под визуальным контролем.
Уровень техники
Каждый год у почти 12 миллионов человек по всему миру диагностируют рак, и каждый год от рака умирает 7,5 миллионов человек. Ожидается, что это число будет возрастать из-за роста населения и образа жизни в западном мире. Радиотерапия - важная часть современных методов лечения рака, и более 50% всех пациентов с раковым диагнозом получали минимум один сеанс радиотерапии. В настоящее время радиотерапия базируется на современном высокоточном планировании, современном лечебном оборудовании и методах визуализации опухоли, таких как компьютерная томография (КТ), позитрон-эмиссионная томография (ПЭТ) и магнитно-резонансная визуализация (МРВ), предназначенных для доставки точных доз радиации к четко определенной мишени в облучаемых пациентах.
Одна из основных сложностей дистанционной радиотерапии состоит в том, что во время сеанса облучения как сама опухоль, так и близлежащие ткани, весьма существенно перемещаются и притом непредсказуемым образом. Движения эти происходят как в течение одного сеанса, так и в течение всего курса облучения, который обычно продолжается 5-7 недель. Притом смещения могут быть весьма существенными (например, на несколько сантиметров в течение нескольких секунд) и могут быть вызваны различными факторами, такими как дыхание пациента, наполнение мочевого пузыря и кишок, прохождение воздуха по толстой кишке, сокращение опухоли и изменение положения самого пациента. Один из путей минимизации этой проблемы состоит в имплантации в опухоль или рядом с нею маркеров, позволяющих многократную прицельную визуализацию и соответствующую адаптацию лечебного процесса. На настоящий момент маркеры вводятся с помощью длинной и толстой иглы - сложная процедура со значительным риском осложнений, которые ограничивают практическую пользу от использования маркеров в лучевой терапии.
В идеале, биологический маркер должен позволять отслеживать перемещения опухоли, оставаясь видимым несколькими методами визуализации в течение продолжительного периода времени (скажем, не менее 4 недель), быть нетоксичным и просто вводиться в организм.
Был предпринят целый ряд попыток улучшить ситуацию с биологическими маркерами в области лучевой терапии. В европейском патенте EP 1006935 описывается состав для контролируемого выделения вещества. В патенте WO 9403155 описывается состав гидрогеля, приготовленного из молекулярного остова, связанного с перекрестносшивающим агентом. Такой гидрогель может вводиться с терапевтическими препаратами и диагностическими метками, включая вещества для рентгеноконтрастной визуализации, используемые для диагностирования и лечения заболеваний. В патенте US20120065614 описывается гибридная система для биологической визуализации. Золото там связывается с матрицей, состоящей из гидрогеля или полимера, или аналогичного состава. В патенте US 20100296007 описывается существенно двояковогнутая наночастица, которая состоит из водяного ядра и гидрофильной оболочки, состоящей из амфифильного полимера.
Кроме того, в патенте US 2009110644 описывается наночастица, состоящая из полимера, который представляет собой хелатообразующий металл, покрытый оксидом магнитного металла, причем, по крайней мере, один из этих активных агентов ковалентно связан с полимером. В документах US 20100290995 и US 2005036946 описываются рентгеноконтрастные биоразлагаемые составы, полученные изменением концевых групп у синтетических и природных биоразлагаемых полимеров, таких как полилактоны с йодированными функциональными группами; а в шведском патенте SE 403255 описан контрастный агент, который состоит их полимера, включающего гидрокси- и/или аминогруппы, и содержащего также йодозамещенные ароматические группы, обеспечивающие рентгеноконтрастные свойства. Далее, в документе WO 9519184 представлены инкапсулирующие воздух микрочастицы, образованные ионотропно образующими гель синтетическими полиэлектролитами, такими как поли(карбоксилато-фенокси)фосфазен, поли(акриловая кислота), поли(метакриловая кислота) и сополимерами метакриловой кислоты (эудрагит), при контакте с многовалентными ионами, такими как ионы кальция.
У сегодняшней клинической практики использования твердых маркеров и методов, описанных в перечисленных выше документах, имеется целый ряд недостатков. Имплантация твердых маркеров носит инвазивный характер из-за больших размеров твердого импланта, который может вызвать серьезные осложнения, ограничивающие положительный эффект лучевой терапии. Объединяя гелеобразующие растворы малой вязкости с твердыми частицами и/или органическими с рентгеноконтрастными веществами (или веществами для других способов визуализации) можно получить инъецируемые гели с плавно варьируемыми свойствами, которые можно менять, изменяя параметры и гелеобразующего раствора и используемых контрастных веществ. Помимо вклада в общий контраст системы твердые частицы могут нести и лекарственные вещества и производить их высвобождение регулируемым образом.
Цель настоящего изобретения состоит в том, чтобы представить новые составы, состоящие из гелеобразующих систем низкой вязкости, которые легко вводятся парентерально, и при этом настоящее изобретение обеспечивает хорошую визуализацию одним или несколькими методами, включая рентгеноскопию.
Краткое изложение сущности изобретения
Рентгеноконтрастный состав для местного применения, который проявляет контрастные свойства и, по меньшей мере, 60% введенного количества упомянутого рентгеноконтрастного состава остается в течение более чем 24 часов в пределах 10 см от точки инъекции этого рентгеноконтрастного состава в тело человека или животного.
Подробное описание изобретения
Указанный состав приготовляется преимущественно в форме, предназначенной для парентерального введения, и должен преимущественно состоять из фармацевтически приемлемых компонентов. Состав, который как таковой имеет сравнительно низкую вязкость, предназначен для инъекций в тело человека или животных, где он становится более вязким, например, через превращение из золя в гель (жидкости в гель), или образует аморфную стекловидную матрицу из-за наличия гелеобразующей системы. Предпочтительно, чтобы, после введения в тело человека или животного, вязкость состава возрастала не менее чем на 50%, например, не менее чем на 80%, например, не менее чем на 100%, или не менее чем на 150%, или не менее чем на 200%, или не менее чем на 300%, или не менее чем на 500%, или не менее чем на 750%, или не менее чем на 1000%, или не менее чем на 10000%, или чтобы состав стал по сути твердым (не вязким).
Состав предпочтительно адаптируется для введения через иглы, используемые для инъекций в тело человека, или иглы для родственных хирургических операций, такие как иглы для биопсии, но не ограничиваясь только такими иглами. До инъекции гидрогель или гелеобразующий состав может иметь любую подходящую вязкость, а именно, такую, чтобы состав можно было ввести пациенту парентерально.
Типичные составы включают, но не ограничиваются, такие, которые имеют вязкость (до введения или инъекции) ниже 10000 сантипуаз (сП), например, ниже 2000 сП, например, от 10 до 2000 сП, например, от 20 до 1000 сП, например, от 10 до 2000 сП, например, от 150 до 350 сП, например, от 400 до 600 сП, например, от 600 до 1200 сП, или от 1000 до 2000 сП, или от 10 до 600 сП, или от 20 до 350 сП, при 20°C.
По альтернативному варианту, такие составы включают, но не ограничиваются, такие, которые имеют вязкость (до введения или инъекции) ниже чем 10000 сантипуаз (сП), например, ниже 2000 сП, например, от 10 до 2000 сП, например, от 20 до 1000 сП, например, от 10 до 2000 сП, например, от 150 до 350 сП, например, от 400 до 600 сП, например, от 600 до 1200 сП, или от 1000 до 2000 сП, или от 10 до 600 сП, или от 20 до 350 сП, при 5°C.
Для рассматриваемого объекта (динамическая) вязкость при заданной температуре измеряется по методике, описанной в стандарте ASTM D7483 Американского общества по испытанию материалов.
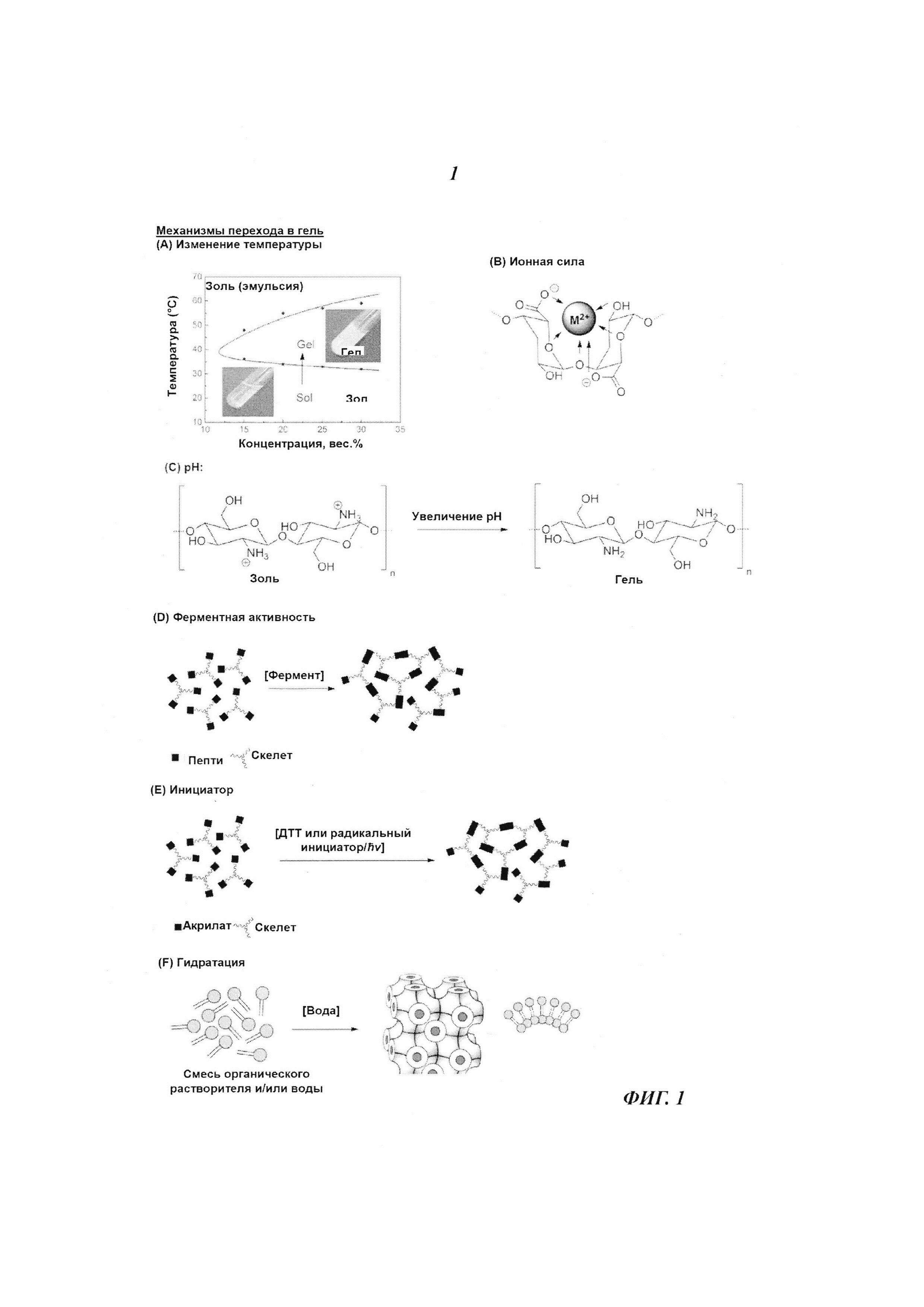
Гидрогели, гели или аморфные стекловидные матрицы могут быть возникнуть благодаря образованию ковалентных связей или вследствие ионных или гидрофобных взаимодействий. Физические (нековалентные) поперечные связи могут возникнуть в результате комплексообразования, гидратации, образования водородных связей, десольватации, ван-дер-ваальсовского взаимодействия, образования ионных связей, комбинации вышеописанных связей и тому подобного, и могут быть инициированы смешением двух исходных реагентов, которые были физически разделены до момента соединения на месте смешивания, или же вследствие воздействия преобладающих условий данного физического окружения, включая температуру, pH, ионную силу, и комбинации этих параметров, и т.п. Химические (ковалентные) связи могут быть созданы по любому механизму, включая свободнорадикальную полимеризацию, конденсационную полимеризацию, анионную или катионную полимеризацию, ступенчатую полимеризацию, электрофильно-нуклеофильные реакции, комбинацию вышеперечисленных реакций и т.п. На рисунках 1-6 представлены примеры гидрогель- и/или гелеобразующих и/или аморфных стеклянных матричных систем, которые могут быть использованы в настоящем изобретении.
Составы, образующие гидрогель, гель или аморфную стеклянную матрицу, могут быть нагружены органическими рентгеноконтрастными веществами, такими как йодированные полимеры или сахара и наночастицы, или субмикронные частицы, либо до, либо во время образования геля, скажем, когда состав находится в состоянии коллоидного раствора или во время перехода в гель, и это можно сделать, например, с помощью диффузии в состав гидрогеля. Эти рентгеноконтрастные вещества или частицы могут быть захвачены в матрицу геля без образования химических поперечных связей, или же они могут быть связаны ковалентно или нековалентно со скелетом или перекрестносшивающим агентом гидрогеля, геля или аморфной стеклянной матрицей. Органические рентгеноконтрастные вещества могут быть одним компонентом геля, а частицы - другим компонентом, причем частицы будут или контрастным агентом для визуализации с помощью методов рентгеновского анализа, МРТ, ПЭТ, гамма-томографии, флуоресцентного анализа или ультразвукового исследования, и/или содержать фармацевтические вещества. Такими фармацевтическими веществами могут быть радиосенсибилизирующие средства, средства для химиотерапии или гормоны, но не только. Одним из компонентов в гелеобразующих системах могут быть вещества для проведения МРТ, такие как гадолиний. Более того, фармацевтические вещества могут быть связаны ковалентно или нековалентно с гидрогелем, гелем или аморфной стекловидной матрицей, в которую они погружены
После инъекции состав обычно обеспечивает хорошо определенную совокупность рентгеноконтрастных агентов, которые обеспечивают контраст, например, при рентгеновской визуализации, и которые могут служить в качестве маркеров, позволяя с их помощью отслеживать перемещения опухоли, например, во время сеансов радиотерапии или хирургических операций.
В американском патенте US 2001/0142936 описаны ковалентно связанные частицы гидрогеля в микрометровом диапазоне размеров (10-500 мкм) с непрозрачными для ионизирующей радиации агентами или без них, предназначенные для конформного заполнения хирургических ран с выборочной визуализацией для того, чтобы гарантировать точную установку имплантов. Настоящее изобретение обладает рядом преимуществ, поскольку оно использует органические рентгеноконтрастные агенты, которые могут применяться в комбинации с наночастицами, объединенными с гелеобразующей жидкостью для инъекции. У наночастиц низкая или нулевая скорость осаждения из-за эффектов броуновского движения, которое проблематично для частиц микронного размера. Кроме того, разделение частиц и гелеобразующего раствора на две составляющих позволяет регулировать диффузию частиц, их высвобождение внутри геля и т.п., что дает определенные преимущества для регулирования общих свойств состава. Патент US 2001/0142936 построен на изобретении использующем тот факт, что набухание геля увеличивает расстояние между здоровыми тканями и опухолью путем инъекции в ятрогенное (медицинским путем созданное) пространство. Настоящее изобретение стремится проникнуть в ткань при минимальном воздействии на форму и положение служащей мишенью ткани, которой обычно является раковая опухоль. Кроме того, цель настоящего изобретения состоит в инфильтрации тканей с минимальными изменениями для их размера и положения, поэтому разбухание было бы недостатком для настоящего изобретения. В этом его отличие от описанного в патенте US 2001/0142936.
В контексте настоящего изобретения термин «маркер» или «биологический маркер» означат обнаруживаемое тем или иным способом вещество или состав, который не двигается или остается по существу в одном положении в течение нескольких дней или недель, после того как он был введен или имплантирован в конкретное место или ткань в теле млекопитающего. Биологический маркер может, например, содержать один или более рентгеноконтрастных агентов, радиоактивных веществ, парамагнитных соединений, флуоресцентных веществ, или других обнаруживаемых агентов.
В контексте настоящего изобретения термин «гель» определяется как матричный носитель, в котором распределен и/или растворен определяемый агент (контрастное вещество). Под термином «гель» подразумеваются такие системы как гидрогели, гели или аморфные стекловидные матрицы, которые после введения в тело человека или животного увеличивают свою вязкость вод воздействием химического и/или физического стимула.
Понятие «визуализируемый тканевый маркер» или «визуализируемый маркер» включает обнаруживаемый агент в форме и/или в достаточном количестве, позволяющем внешнему способу визуализации обнаруживать этот тканевый маркер, введенный или имплантированный в тело млекопитающего.
Примеры дистанционных методов визуализации включают, но не ограничиваются этим перечнем, рентгеновскую визуализацию, КТ визуализацию, МРТ, ПЭТ, однофотонную эмиссионную компьютерную томографию (SPECT), ядерную сцинтиграфию, ультразвуковую эхографию, ультразвуковую визуализацию, визуализацию в ближней инфракрасной области спектра и/или флуоресцентную визуализацию. Есть примеры фирменных названий и типов разных методов визуализации, например, ЕхасТгас® (фирма BrainLAB), ConeBeam (например, от фирмы «Вариан») и OBI (например, On-Board Imager® от фирмы «Вариан»). Контрастные вещества
Рентгеновский контраст может быть создан с помощью рентгеноконтрастных веществ, таких как йодированные соединения, которые могут быть объединены с хелатирующими веществами агентов МРТ, таких как гадолиний, и/или объединены с хелатирующими веществами визуализирующих агентов ПЭТ, таких как медь-64, которые могут быть далее соединены с твердыми неорганическими частицами. Хелатирующими группами могут быть DOTA (тетраазациклододекантерауксусная кислота), EDTA (этилендиаминтетрауксусная кислота) или DTPA (диэтилентриаминпентауксусная кислота), и хелаторы будут нековалентно погружены в или ковалентно связаны с гелеобразующими компонентами. Объединенные рентгеноконтрастные вещества должны быть видимы для, как минимум, систем КТ. Предпочтительными рентгеноконтрастными веществами являются йодированные соединения, такие как полимеры или молекулы Сахаров, таких как производные глюкозы или сахарозы или других олигосахаридов. Твердые частицы могут включать в свой состав или состоять из одного или более рентгеноконтрастных веществ, т.е. веществ, которые способны блокировать (не пропускать) или ослаблять рентгеновское излучение. Такие вещества включают переходные металлы, редкоземельные металлы, щелочные металлы, щелочноземельные металлы, и другие металлы согласно определению металлов в периодической таблице. Металлы или щелочные металлы могут быть в неокисленной форме или любом из существующих окисленных состояний этих металлов. Окисленные состояния включают одновалентные катионы, двухвалентные катионы, трехвалентные катионы, четырехвалентные катионы, пятивалентные катионы, шестивалентные катионы и семивалентные катионы.
В одном варианте исполнения один или более рентгеноконтрастных агентов выбираются из йода (I), золота (Au), висмута (Bi), гадолиния (Gd), железа (Fe), бария (Ba), кальция (Ca), и магния (Mg). В одном конкретном исполнении визуализируемое соединение включает одно или более соединений, выбранных из группы золота (Au) и висмута (Bi). Одно или более рентгеноконтрастных веществ обычно присутствуют в форме металлов, сплавов, оксидов или солей.
Следует понимать, что помимо йодированных соединений, которые обеспечивают нужный контраст для рентгеновской визуализации, в состав комплекса могут также входить твердые частицы, которые видны при рентгеновской визуализации или при использовании других методов, отличных от рентгеновской визуализации. В одном исполнении твердые частицы видимы также методами MP и/или ПЭТ визуализации, или другими методами визуализации.
В одном конкретном исполнении гелеобразующий состав может также содержать радиоактивное или парамагнитное соединение для одного или более методов визуализации, таких как МРТ, ПЭТ, однофотонная эмиссионная компьютерная томография (SPECT), ядерная сцинтиграфия, ультразвуковая эхография, ультразвуковая визуализация, визуализация в ближней инфракрасной области спектра и/или флуоресцентная визуализация.
В некоторых интересных исполнениях состав по одному из предшествующих пунктов содержит твердые частицы, которые включают одну или более радиоактивных, парамагнитных или ферромагнитных частиц. Кроме того, отдельные частицы могут содержать два или более видов соединений, которые видимы различными методами визуализации.
Указанные радиоактивные соединения могут содержать изотопы меди (61Cu, 64Cu и 67Cu), индия (111In), технеция (99mTc), рения (186Re, 188Re), галлия (67Ga, 68Ga), стронция (89Sr), самария (153Sm), иттербия (169Yb), таллия (201Тl), астата (211At), лютеция (177Lu), актиния (225Ас), иттрия (90Y), сурьмы (119Sb), олова (117Sn, 113Sn), диспрозия (159Dy), кобальта (56Со), железа (59Fe) рутения (97Ru, 103Ru), палладия (103Ра), кадмия (115Cd), теллура (118Те), бария (131Ва, 140Ва), гадолиния (149Ga), тербия (160Tb). золота (198Au, 199Au), лантана (140La), циркония (89Zr), и радия (223Ra, 224Ra), причем указанный изотоп металлического радионуклида может появиться в любом из существующих окисленных состояний этого металла. Эти окисленные состояния включают одновалентные катионы, двухвалентные катионы, трехвалентные катионы, четырехвалентные катионы, пятивалентные катионы, шестивалентные катионы и семивалентные катионы.
Указанные парамагнитные или ферромагнитных соединения могут быть выбраны из следующего перечня: скандий (Sc), иттрий (Y), лантан (La), титан (Ti), цирконий (Zr), гафний (Hf), ванадий (V), ниобий (Nb), тантал (Та), хром (Cr), молибден (Мо), вольфрам (W), марганец (Mn), технеций (Тс), рений (Re), железо (Fe), рутений (Ru), осмий (Os), кобальт (Co), родий (Rh), иридий (Ir), никель (Ni), палладий (Pd), платина (Pt), медь (Cu), серебро (Ag), золото (Au), цинк (Zn), кадмий (Cd), ртуть (Hg), лантаниды, такие как лантан (La), церий (Се), празеодим (Pr), неодим (Nd), прометий (Pm), самарий (Sm), европий (Eu), гадолиний (Gd), тербий (Tb), диспрозий (Dy), гольмий (Но), эрбий (Er). тулий (Tm), иттербий (Yt), лютеций (Lu), и актиниды, такие как актиний (Ас), торий (Th), протактиний (Ра), уран (U), нептуний (Np), плутоний (Pu), америций (Am), кюрий (Cm), берклий (Bk), калифорний (Cf), эйнштейний (Es), фермий (Fm), менделевий (Md), нобелий (No) и лоуренсий (Lr), причем указанные парамагнитные или ферромагнитные соединения могут присутствовать в любом из существующих окисленных состояний для конкретного металла. Эти окисленные состояния включают одновалентные катионы, двухвалентные катионы, трехвалентные катионы, четырехвалентные катионы, пятивалентные катионы, шестивалентные катионы и семивалентные катионы.
Указанное одно или более радиоактивных, парамагнитных или ферромагнитных соединений может быть ковалентно связано гелеобразующими компонентами или наночастицами, или нековалентно связано с гелеобразующими компонентами или наночастицами.
В одном из вариантов осуществления изобретения гелеобразующие компоненты или наночастицы содержат одно или более флуоресцентных соединений для получения люминесцентных изображений в ближней инфракрасной области спектра. Указанные соединения могут содержать флуоресцентные белки, пептиды или молекулы флуоресцирующих красителей. Обычные классы флуоресцентных красителей включают ксантены, такие как родамины, родолы и флуоресцеины и их производные; биманы; кумарины и их производные, такие как умбеллиферон и аминометилкумарины; ароматические амины, такие как данзил; скваратные красители; бензофураны; флуоресцентные цианины; карбазолы; дицианометиленпираны, полиметин, оксабензантран, ксантен, пирилий, карбостил, перилен, акридон, куинакридон, ребрен, антрецен, коронен, фенантрецен, пирен, бутадиен, стильбен, хелатные комплексы с металлами лантановой группы, хелатные комплексы с редкоземельными металлами, и производные таких красителей. Типичные флуоресцирующие красители содержат 5-карбоксифлуоресцеин, флуоресцеин-5-изотиоцианат и 6-карбоксифлуоресцеин; примеры других флуоресцеиновых красителей можно найти, например, в патентах US 6,008,379, US 5,750,409, US 5,066,580 и US 4,439,356. Эти комплексы могут быть включать родаминовые красители, такие как, например, тетраметилродамин-6-изотиоцианат, 5-карбокситетраметилродамин, производные 5-карбоксироданола, тетраметил- и тетраэтил-родамин, дифенилдиметил- и дифенилдиэтил-родамин, динафтилродамин, родамин 101 сульфонилхлорид (в твердой форме под фирменным названием TEXAS RED, «техасский красный»), и другие родаминовые красители. Эти комплексы могут в качестве альтернативы включать цианиновый краситель, такой как, например, Cy3, Cy3B, Cy3.5, Cy5, Cy5.5, Cy, или IRDye 800CW, IRDye 680LT, нанокристалл Qdot 800, нанокристалл Qdot705 или соединения порфиразина.
В другом исполнении наночастицы также содержат или состоят из одного или более газов инкапсулированных в липидные, полимерные или неорганические частицы для ультразвуковой биолокации. Указанные газы могут состоять из воздуха, галогенидов серы, таких как гексафторид серы или пиросерный декафторид; фторуглеродов, таких как перфторуглероды; фторированных (например, перфторированных) кетонов, таких как перфторацетон; и фторированных (например перфорированных) эфиров, таких как перфтордиэтиловый эфир. Представители перфторуглеродов, которые могут, например, содержать до 7 атомов углерода, включают перфторалканы, такие как перфторметан, перфторэтан, перфторпропаны, перфторбутаны (например перфтор-н-бутан, опционально в смеси в другими изомерами, такими как перфтор-изобутан), перфторпентаны, перфторгексаны и перфторгептаны; перфторалкены, такие как перфторпропен, перфторбутены, например перфторбут-2-ене) и перфторбутадиен; перфторалкины, такие как перфторбут-2-ин; перфторциклоалканы, такие как перфторциклобутан. перфторметилциклобутан, перфтордиметилциклобутаны, перфтортриметилциклобутаны, перфторциклопентан, перфтормептилцикелопентан, перфтордимептилцикелопентаны, паерфторциклогексан, перфторметилциклогексан и перфторциклогептан; и смеси любых из вышеперечисленных соединений, включая смеси с газами, такими как азот, диоксид углерода, кислород и т.п., но не ограничиваясь перечисленными газами.
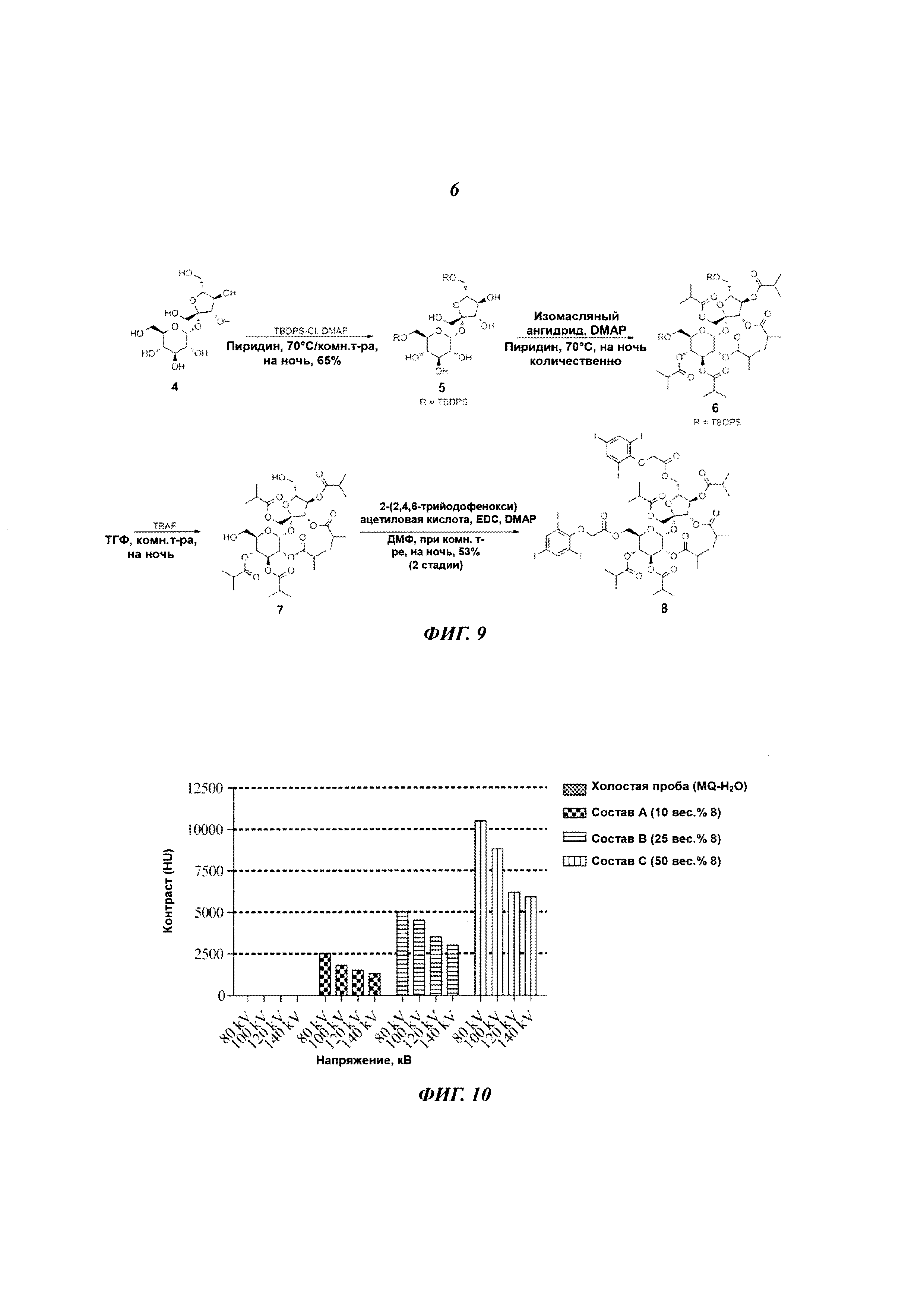
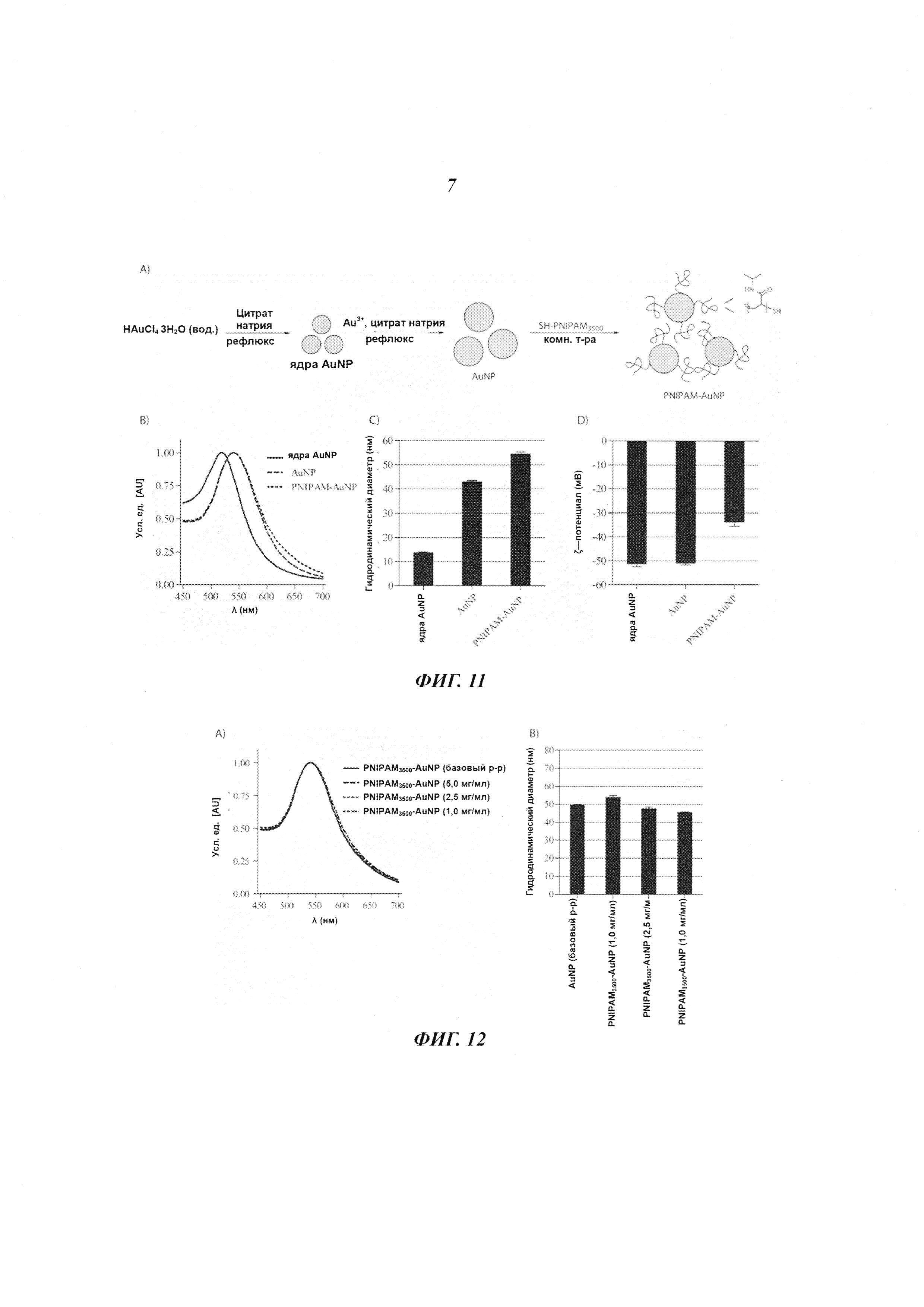
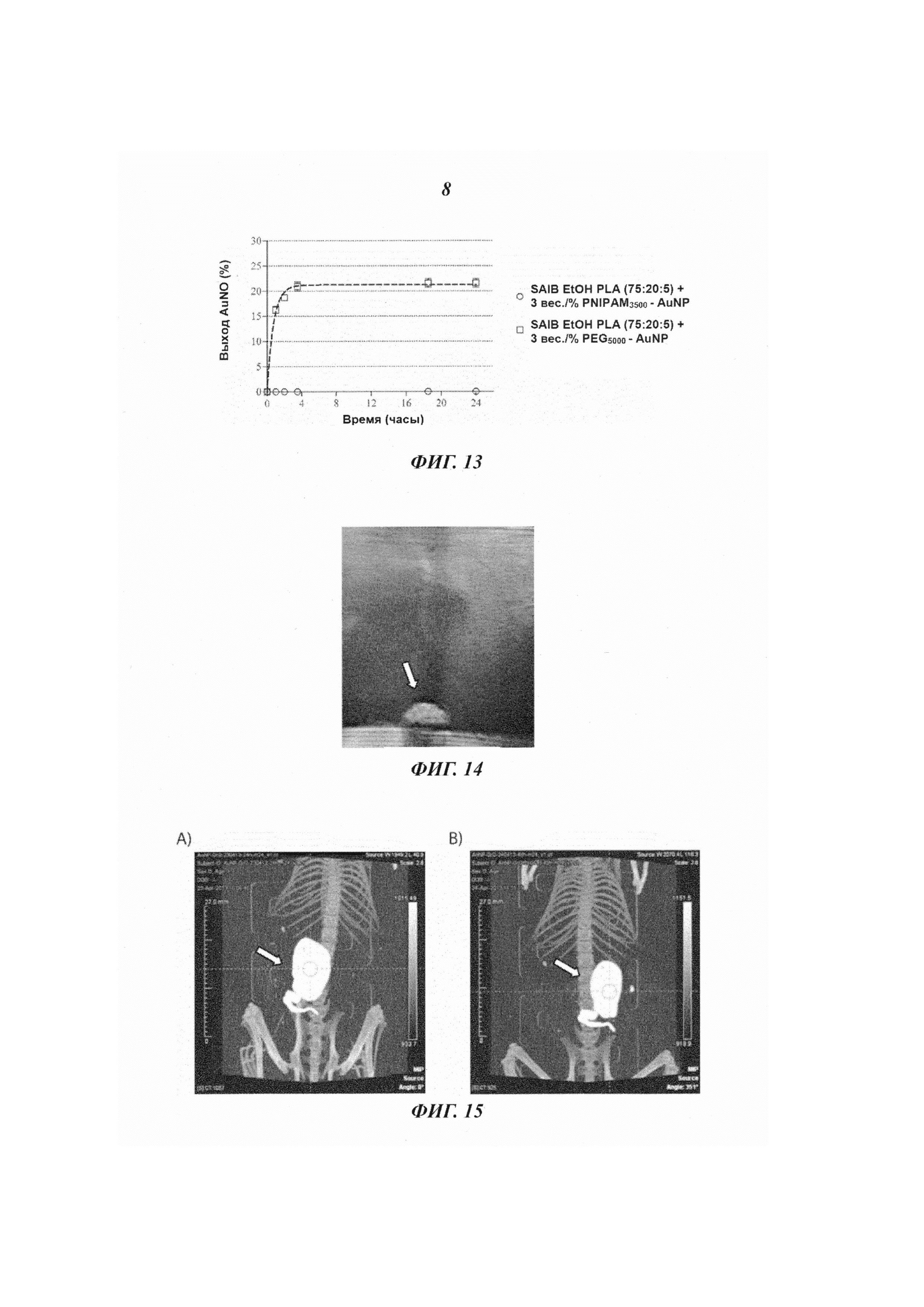
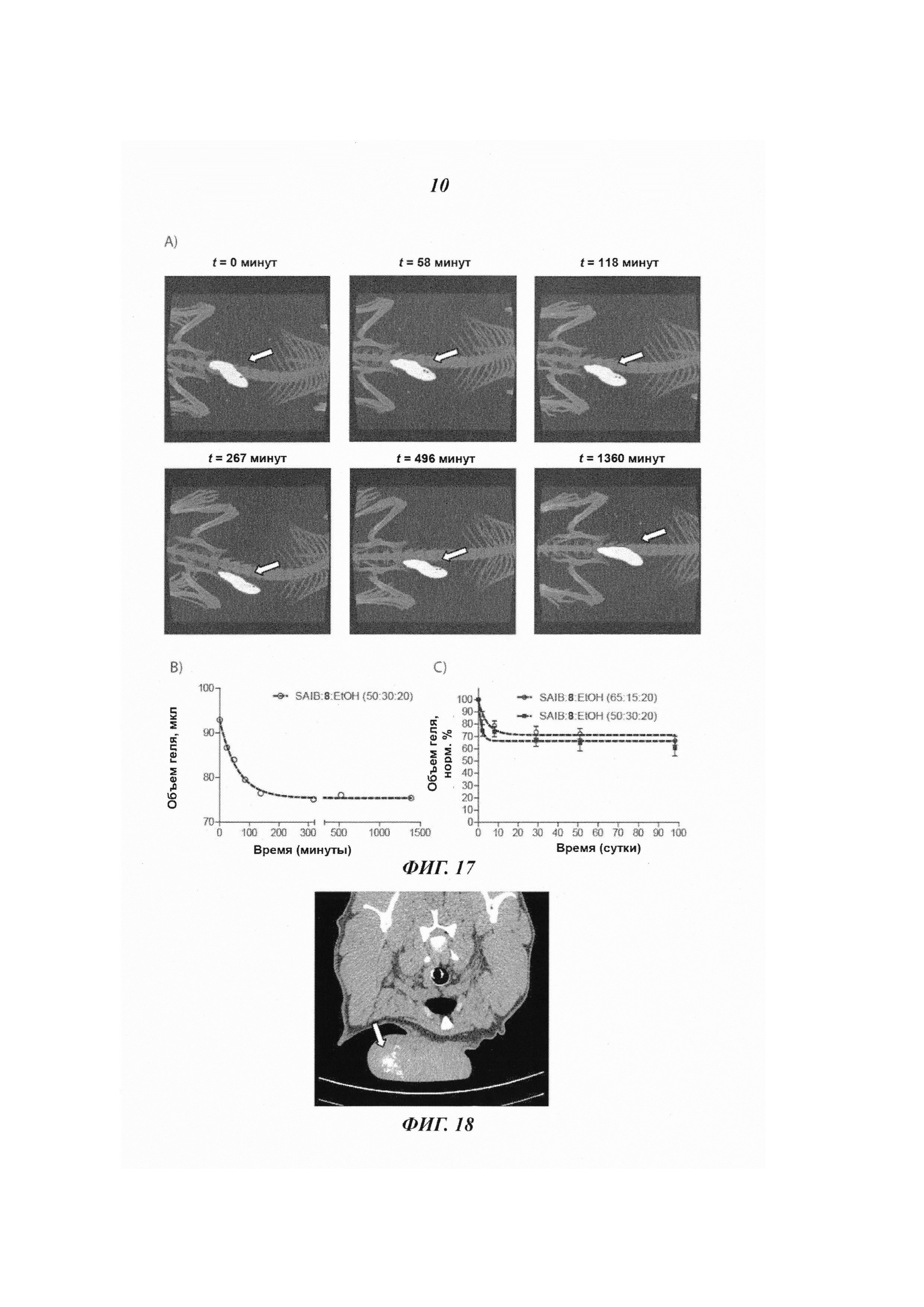
В другом варианте исполнения контраст в визуализации достигается применением небольших йодсодержащих органических соединений. Указанные небольшие йодсодержащие органические соединения включают серийно выпускаемые йодированные контрастные вещества, такие как диатризоат (продающийся, в частности, под фирменным названием «гастрографен» (Gastrografen™), ионные димеры, такие как йоксаглат (продающийся, в частности, под фирменным названием «гексабрикс» (Gexabrix™), неионные мономеры, такие как йогоксол (продающийся под фирменным названием «омнипак» (Omnipaque™), йопамидол (продающийся, в частности, под фирменным названием «изовуе» (Isovue™), йомептрол (продающийся, в частности, под фирменным названием «иомерон» (lomeron™), и неионный димер йодиксанол (продающийся под фирменным названием «визипак» (Visipaque™). Дополнительные примеры небольших йодсодержащих органических соединений включают те, что представлены в документах WO 2009/071605, ЕР 1186305, ЕР 686046, ЕР 108638, EP 0049745, ЕР 0023992, WO 20033080554, WO 2000026179, WO 1997000240, WO 09208691, US 3804892, US 4239747, US 3763226, US 3763227 и US 3678152, но не ограничиваясь этим перечнем. В другом интересном исполнении, упомянутые небольшие йодсодержащие органические соединения включают йодированные производные изобутирата ацетата сахарозы (SAIB). В отличие от того, что описано, например, в документе ЕР1006935, где представлен состав для регулируемого высвобождения вещества, причем этот состав содержит SAIB, данное конкретное осуществление настоящего изобретения стремится создать стабильное контрастное вещество, погруженное в гель изобутирата ацетата сахарозы (SAIB). Примеры таких йодированных производных изобутирата ацетата сахарозы приведены на Рис. 7, но это не ограничивает список таких производных. Такие соединения могут быть использованы индивидуально или в комбинации с твердыми частицами для получения инъецируемого геля, который, как минимум, будет виден при КТ визуализации. В одном из конкретных осуществлений настоящего изобретения гелеобразующим компонентом, чувствительным к гидратации, является изобутират ацетата сахарозы (SAIB), а гидрофобная составляющая состоит из сахарозы (скелет), которая была ацилирована изобутиратом и ацетатом. Предпочтительными скелетными структурами для данного изобретения являются моносахариды, дисахариды и трисахариды. Особенно предпочтительным дисахаридным скелетом являются сахароза, однако спиртсодержащий остов может быть получен из полигидроксиспирта, имеющего от 2 до 20 гидроксигрупп, и могут быть образованы эстерификацией от 1 до 20 молекул полиола. Подходящие спиртовые группы включают те, которые получаются удалением одного или более атомов водорода из: монофункциональных спиртов размером C1-C20, дифункциональных спиртов размером C1-C20, трифункциональных спиртов, гидроксил-содержащих карбоновых кислот, гидрокси-содержащих аминокислот, фосфатсодержащих спиртов, тетрафункциональных спиртов, сахароспиртов, моносахаридов и дисахаридов, сахарокислот, и полиэфирных полиолов. В частности, спиртовые части могут включать одну или более из следующих молекул: додеканол, гександиол, в частности 1,6-гександиол. глицерол, гликолевую кислоту, молочную кислоту, гидромасляную кислоту, гидровалериановую кислоту, гидрогексановую кислоту, серии, АТФ, пентаэритритол, маннитол, сорбитол, глюкозу, галактозу, фруктозу, мальтозу, лактозу, глюкуроновую кислоту, эфиры полиглицерола, содержащие от 1 до 20 единиц глицерола, полиэтиленгликоли, содержащие от 1 до 20 единиц этиленгликоля. Кроме того, в качестве скелета в молекулах данного изобретения может быть использован любой олигосахарид, содержащий от 3 до 6 моносахаридов. В целом, эфиры скелета по данному изобретению могут быть получены реакцией одного или более спиртов, в частности одного или более полиолов, которые образуют спиртовую группу получающегося эфира, с одной или более карбоновых кислот, лактонов, карбонатов, или ангидридов карбоновых кислот, которые образуют кислотную группу получающихся эфиров. Реакция эстерификации может быть проведена просто нагреванием, хотя в некоторых случаях может быть использовано добавление сильной кислоты или сильного основания как катализатора эстерификации. По альтернативному варианту в качестве катализатора эстерификации могут быть использованы 2-этилгексаноат двухвалентного олова или активационные реагенты, такие как N-(3-диметиламминопропил)-N'-этилкарбодиамид (EDC), N,N'-дициклогексилкарбодиимид (DCC), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) и тому подобные соединения.
Ацильными группами, образующими ацилоксилирующие заместители по данному изобретению, могут быть любые группы, полученные из карбоновой кислоты. В частности, ацильные группы указанных составов могут быть вида RCO-, где R будет, по выбору, оксизамещенный алкил длиной в 2-10 атомов углерода, который может быть линейным или разветвленным углеводородом с одной или более функциональными группами в цепи. Использование карбоновых кислот или полиолов с различной длиной цепи и использование карбоновых кислот, имеющих окизамещение, позволяет регулировать степень гидрофильности и растворимости получающегося эфира. Такие материалы обладают существенным устойчивостью к растворению в живом организме и способны образовывать стабильные гидрофобные гели, которые могут инкапсулировать указанные контрастные вещества по данному изобретению. Эти гели могут также содержать фармацевтический агент в комбинации с контрастным веществом.
Покрытие твердых частиц
Твердые частицы могут также содержать целый рад других компонентов. Пригодными твердыми частицами могут быть покрытые или непокрытые металлические частицы, покрытые или непокрытые твердые металлические частицы, а также липосомы, полимерсомы, дедримеры, водорастворимые поперечно-сшитые полимеры и мицеллы, заключающие в себя такие твердые частицы. В данном изобретении «покрытые» твердые частицы имеют оболочку или поверхностное покрытие вокруг твердого материала ядра. Оболочка или поверхностное покрытие может быть прикреплено к материалу ядра ковалентно, нековалентно или смесью ковалентных и нековалентных связей. Примеры оболочек или поверхностных покрытий описаны ниже. В одной реализации твердая частица включает полимерное поверхностное покрытие, нековалентно или ковалентно прикрепленное к поверхности сердечника частицы. Полимером может быть гомополимер, сополимер, блочный сополимер, или привитой сополимер, или синтезированный или природный сополимер типа дендримера, и другие соединения. Обычно в полимерное покрытие входит полиэтиленгликоль (PEG), чаще всего с молекулярным весом от 2000 до 70 тысяч дальтон (атомных единиц), например 5000 дальтон; декстраны, обычно с молекулярным весом от 2 тысяч до 1 миллиона дальтон. Эти полимеры обычно комбинируются как блок-сополимеры таким образом, что общая полимерная структура оказывается отрицательно заряженной, позволяя вступать в электростатическое взаимодействие с положительно заряженной поверхностью наночастицы, чтобы обеспечить эффективное покрытие. В одном частном варианте исполнения твердые частицы содержат сопряженные молекулы PEG1000, PEG2000, PEG3000, PEG5000, или PEG10000, то есть, препараты PEG, имеющие средний молекулярный вес приблизительно равный 1000, 2000, 3000, 5000 и 10000 атомных единиц, соответственно, но не только такие соединения. В дополнительном исполнении твердые частицы содержали сопряженные молекулы PNIPAM1000, PNIPAM2000, PNIPAM3000, PNIPAM5000, или PNIPAM10000, то есть, препараты PNIPAM, имеющие средний молекулярный вес, приблизительно равный 1000, 2000, 3000, 5000 и 10000 дальтон, соответственно, но не только такие соединения. В одном варианте исполнения твердые частицы содержат оболочку или поверхностное покрытие, содержащее липидный слой, например липидный монослой и/или один или более липидных двойных слоев, и ядро, состоящее из неорганической частицы. Липиды поверхностного покрытия по данному изобретению включают, например, жирные кислоты, нейтральные жиры, фосфатиды, гликолипиды, церамиды, сфингоглипиды, алифатические спирты и стероиды. Конкретными, но не ограничивающими список, примерами твердых частиц могут быть золотые наночастицы, синтезированные с полиэтиленгликольным (PEG) покрытием или PEG-илированные золотые наностержни, как стержни, описанные в документе WO 2007/129791 и в статье 2007 года Kim at al. [Invest. Radiol., 2007, 42, 797-806], покрытые полимером наночастицы висмута, описанные в публикации 2006 года Rabin [Nat. Mater., 2006, 5, 188-122], нанокомпозиты ядро-оболочка из липосомы фосфата кальция, дендримеры РАМАМа с захваченными наночастицами золота для КТ визуализации, как описано в статье 2007 года Haba et al. [Langmuir, 2007, 23, 5243-5246] и статье 2010 года Kojima et al. [Bioconjugate Chem. 2010, 21, 1559-1564], и другие твердые частицы, содержащие рентгеноконтрастные вещества, известные в этой области. В одной конкретной реализации настоящего изобретения оболочка наночастицы включает 1,2-дистеароил-sn-глицеро-3-фосфахолин (DSPC) - «А», холестерин - «В», и 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси (полиэтиленгликоль)-2000] (DSPE-PEG-2000) «С», и 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси (полиэтиленгликоль)-2000]-ТАТЕ (DSPE-PEG-200-RGD) - «D» с мольным отношением A:B:C:D, где A выбирается в интервале 45-65, В выбирается в интервале 35-45, C выбирается в интервале 5-13, и D выбирается в интервале от 0 до 3, причем так, чтобы в сумме A+B+C+D=100.
Покрытие твердых частиц может быть использовано для придания коллоидным частицам желаемых химических и/или физических свойств. Такие свойства как гидрофобность/гидрофильность, заряд частицы, гидродинамический диаметр и стабильность в различных средах, таких как среды с высокой/низкой концентрацией солей, органические растворители, восстанавливающие среды, тепло и другие параметры могут контролироваться выбором правильного материала покрытия. Эти свойства, вводимые в твердые частицы с поверхностным покрытием, являются важными факторами управления, необходимыми для точной регулировки общих характеристик описываемого здесь рентгеноконтрастного состава.
Количество контрастного вещества, содержащегося в гелеобразующем составе, включающем погруженные в него наночастицы в соответствии с настоящим изобретением, может быть охарактеризовано по весовому процентному содержанию контрастного вещества по отношению к общему весу гелеобразующей системы с учетом погруженной в нее наночастицы, за исключением любой воды, содержащейся в наночастице, по весовому процентному содержанию контрастного вещества по отношению к весу оболочки наночастицы, или же по размеру контрастного вещества в подготовленных наночастицах. Последняя характеристика может быть измерена с помощью обычных методов, используемых для этих целей, таких как криотрансмиссионная электронная микроскопия или динамическое рассеяние света.
Форма и размер
Наночастицы по данному изобретению могут быть квазисферическими, сферическими или несферическими, такими как стержни. Подходящие наночастицы включают частицы размером до 50 мкм, предпочтительнее - до 5 мкм. Предпочтительный размер наночастиц по настоящему изобретению должен быть в диапазоне от 1 до 1000 нм, например, от 2 до 10 нм, например, от 10 до 100 нм, например, от 10 до 80 нм, например, от 10 до 50 нм, например, от 10 до 20 нм, например, от 10 до 15 нм, или, например, от 15 до 20 нм, или, например, от 20 до 50 нм, или, например, от 50 до 80 нм, или, например, от 80 до 110 нм, или, например, от 110 до 140 нм, или, например, от 140 до 170 нм, или, например, от 170 до 200 нм, или, например, от 200 до 220 нм, или, например, от 220 до 250 нм, или, например, от 250 до 280 нм, или, например, от 280 до 310 нм, или, например, от 310 до 340 нм, или, например, от 340 до 370 нм, или, например, от 370 до 400 нм, или, например, от 400 до 420 нм, или, например, от 420 до 450 нм, или, например, от 450 до 480 нм, или, например, от 480 до 500 нм, или, например, от 500 до 1000 нм. В соответствии с настоящим изобретением размер может быть измерен по диаметру, длине или ширине, включая среднечисловой диаметр, длину или ширину. В предпочтительной реализации наночастицы в составе по настоящему изобретению имеют средний диаметр в диапазоне от 10 нм до 150 нм, например, от 10 до 100 нм, например, от 10 до 80 нм, например, от 10 до 50 нм, например, от 10 до 30 нм, например, от 10 до 20 нм, или, например, от 30 до 40 нм, или, например, от 40 до 50 нм, или, например, от 50 до 60 нм, или, например, от 60 до 70 нм, или, например, от 70 до 80 нм, или, например, от 90 до 100 нм, или, например, от 100 до 110 нм, или, например, от 110 до 120 нм, или, например, от 120 до 130 нм, или, например, от 130 до 140 нм, или, например, от 140 до 150 нм. Контролируя форму и размер наночастиц можно существенно повлиять на стабильность наноразмерных коллоидных эмульсий, а также на изменение этих частиц в организме. В одном из предпочтительных исполнений наночастицы в составе по настоящему изобретению имеют среднечисловой диаметр в диапазоне от 120 нм до 100 нм. Такие наночастицы отличаются низкой или нулевой скоростью осаждения из-за эффектов броуновского движения. В другой предпочтительной реализации наночастицы в составе по настоящему изобретению имеют среднечисловой диаметр менее 10 нм. Такие наночастицы после деградации гидрогеля могут быть очищены, например, путем почечной фильтрации с последующим выведением в мочу, что может предотвратить продолжительное пребывание в ткани и/или таким образом снизить риск отравления.
Органическая гелеобразующая система
Подходящие гелеобразующие компоненты включают, но не ограничиваются только нижеперечисленными, соединения, состоящие из органических составляющих, таких как производные сахаридов, таких как эстерифицированные сахариды, производные полиолов, такие как эстерифицированные полиолы, полимеры, липиды, пептиды, протеины, гелеобразующие соединения низкого молекулярного веса и нерастворимые в воде жидкие носители с высокой вязкостью, а также их комбинации.
Гелеобразующими системами на основе сахаридов и полиолов может быть изобутират ацетата сахарозы (SAIB), который представляет собой гидрофобный компонент, состоящий из сахарозы (остов), ацилированной изобутиратом и ацетатом. Предпочтительный материал для остовов соединений по данному изобретению - это моносахариды, дисахариды или трисахариды. Особенно предпочтительным дисахаридным остовом является сахароза, однако спиртсодержащий остов может быть получен из полигидроксиспирта, содержащего от 2 до 20 гидроксильных групп и может быть создан эстерификацией от 1 до 20 молекул полиола. Подходящие спиртовые группы включают группы, полученные удалением одного или более атомов водорода из: монофункциональных спиртов размером С1-С20, дифункциональных спиртов размером С1-С20, трифункциональных спиртов, гидроксил-содержащих карбоновых кислот, гидроксил-содержащих аминокислот, фосфатсодержащих спиртов, тетрафункциональных спиртов, сахароспиртов, моносахаридов и дисахаридов, сахарокислот, и полиэфирных полиолов. В частности, спиртовые части могут включать одну или более из следующих молекул: додеканол, гександиол, в частности, 1,6-гександиол, глицерол, гликолевую кислоту, молочную кислоту, гидромасляную кислоту, гидровалериановую кислоту, гидрогексановую кислоту, серии, АТФ, пентаэритритол, маннитол. сорбитол, глюкозу, галактозу, фруктозу, мальтозу, лактозу, глюкуроновую кислоту, эфиры полиглицерола, содержащие от 1 до 20 единиц глицерола, полиэтиленгликоли, содержащие от 1 до 20 единиц этиленгликоля. Кроме того, в качестве скелета в молекулах по данному изобретению может быть использован любой олигосахарид, содержащий от 3 до 6 моносахаридов. В целом, эфиры скелета по данному изобретению могут быть получены реакцией одного или более спиртов, в частности одного или более полиолов, которые образуют спиртовую группу получающегося эфира, с одной или более карбоновых кислот, лактонов, карбонатов, или ангидридов карбоновых кислот, которые образуют кислотную группу получающихся эфиров. Такие системы известны тем, что после гидратации образуют биоразлагающиеся, аморфные, углеводные, стеклянные матрицы вследствие индуцированного растворителем разделения фаз.
Соответствующим полимером может быть гомополимер, сополимер, блочный сополимер, или привитой сополимер, или синтезированный или природный сополимер типа дендримера. Конкретные примеры подходящих мономеров включают: лактид, гликолид, N-винилпирролидон, винилпиридин, акриламид, метакриламид, N-метилакриламид, гидроксиэтилметакрилат, гидроксиэтилакрилат, гидроксиметилметакрилат, гидроксиметилакрилат, метакриловая кислота и акриловая кислота, содержащая кислотную группу, и соли этих кислот, винилсульфокислота, стиролсульфокислота и т.п. и производные, содержащие основную группу, такие как N,N-диметиламиноэтил-метакрилат, N,N-диэтиламиноэтил-метакрилат, N,N-диметиламино-пропилакриламид, соли этих производных и т.п. Другие мономеры могут включать: производные акрилата и производные метакрилата, такие как этилакрилат, метил-метакрилат и глицидилметакрилат; производные N-замещенного алкилметакриламида, такие как N-n-бутилметакриламид, винилхлорид. акрилонитрил, стирол, винилацетат, лактоны, такие как ε-капролактон, лактамы, такие как ε-капролактам, и тому подобные соединения. Дополнительные примеры подходящих мономеров включают оксиды алкенов, такие как пропиленоксид, этиленоксид и тому подобные соединения, но не только.
С другой стороны, конкретными примерами полимерных блоков, объединяемых (или соединяемых связью) с вышеупомянутыми мономерами могут быть: метилцеллюлоза, декстран, полиэтиленоксид, полипропиленоксид, поливиниловый спирт, поли-N-винилпирролидон, поливинилпиридин, полиакриламид, полиметакриламид, поли-N-метилакриламид, полиридроксиметилакрилат, полиакриловая кислота, полиметакриловая кислота, поливинилсульфокислота, полистиролсульфокислота, и соли этих кислот; поли-N,N-диметиламиноэтил-метакрилат, поли-N,N-диэтиламиноэтил-метакрилат, поли-N,N-диметиламинопропил-акриламид и соли этих соединений, полимолочная согликолевая кислота, поликапролактон и комбинация этих соединений, но не только. Соответствующим липидом может быть любой фосфолипид, включая один или более стеролов, таких как холестерол и холестанол, жирная кислота, содержащая насыщенную или ненасыщенную ацильную группу длиной от 8 до 22 атомов углерода, и антиоксидант, такой как альфа-токоферол. Примеры фосфолипидов включают фосфатидилэтаноламины, фосфатидилхолины, фосфатидилсерины, фосфатидилинозитолы, фосфатидилглицеролы, кардиолипины, сфингомиелины, церамид-фосфорилэтаноламины, церамид-фосфорилглицеролы, церамид-фосфорилглицеролфосфаты, 1,2-димиристоил-1,2-деоксифосфотатидилхолины, плазмалогены, фосфатидные кислоты и т.п., и эти соединения могут быть использованы по одному или в комбинации по два или более однородных соединений. Остатки жирных кислот этих фосфолипидов не имеют особых ограничений, и их примеры включают остатки насыщенных или ненасыщенных жирных кислот размером от 12 до 20 атомов углерода. Конкретные примеры включают ацильную группу, полученную из таких жирных кислот как лауриновая кислота, миристиновая кислота, стеариновая кислота, масляная кислота и линолевая кислота. Далее могут быть использованы фосфолипиды, полученные из таких природных продуктов как лецитин яичного желтка и лецитин соевых бобов. Подходят также, например, ди- и триглицириды, 1,2-бис (олеоилокси)-3-(триметиламмонио) пропан (DOTAP), 1-N,N-диметиламинодиолеоил пропан (DODAP), 1-олеоил-2-гидрокси-3-ТбТ-диметиламинопропан, 1,2-диацил-3-N,N-диметиламинопропан, 1,2-дидеканоил-1-N,N-диметиламинопропан, 3-бета-[n-[(N',N'-диметиламино)этан]-карбамоил]-холестерол (DC-Chol), бромид 1,2-димиристолоксипропил-3-диметилгидроксиэтиламмония (DMRIE), бромид 1,2-диолеоил-оксипропил-3-диметилгидроксиэтиламмония (DORI) и тому подобные соединения, но не только.
Понятие «пептид» или полипептид» в данном контексте относится к цепи из, по меньшей мере, двух α-аминокислотных остатков, соединенных химическими связями (например, амидными связями). В зависимости от контекста, термин «пептид» может относиться к отдельному пептиду или к группе пептидов имеющих одну и ту же или различные последовательности, каждая из которых может содержать только природные альфа-аминокислотные остатки, альфа-аминокислотные остатки неприродного происхождения, или как те, так и другие. Пептид может проявлять самоорганизующиеся свойства, например, пептидные амфифилы и пептиды с бета-складчатым слоем или образующими альфа-спираль последовательностями. Пептиды могут включать D-аминокислоты, L-аминокислоты, или их комбинации. Подходящие, природные гидрофобные аминокислотные остатки, которые могут быть в самоорганизующихся пептидах, включают следующие: Ala, Val, Ile, Met, Phe, Tyr, Trp, Ser, Thr и Gly. Гидрофобные аминокислотные остатки могут быть основными аминокислотами (например, Lys, Arg, His, Orm); кислые аминокислоты (например, Glu, Asp); или аминокислоты, которые образуют водородные связи (например, Asn, Gln). В результате распада L-аминокислот появляются аминокислоты, которые могут быть повторно использованы питающей тканью. L-сконфигурированные аминокислотные остатки возникают в теле естественным образом, отличая пептиды, образованные из этого класса соединений, от многочисленных прочих биологически совместимых веществ. L-сконфигурированные аминокислоты содержат биологически активные последовательности, такие как последовательности адгезии RGD. Аминокислотные остатки в самоорганизующихся пептидах могут быть аминокислотными остатками, возникшими естественным или искусственным образом. Аминокислоты, возникающие естественным путем, могут включать аминокислотные остатки со стандартным генетическим кодом, аминокислоты, которые могут быть образованы в результате изменений стандартных аминокислот (например, пирролизина или селеноцистеина), а также нестандартные аминокислоты (например, аминокислоты, имеющие D-конфигурацию а не L-конфигурацию). Хотя искусственно возникающие аминокислоты в природе не найдены, они могут быть включены в пептидную цепочку. Такими аминокислотами могут быть, например, D-аллоизолейцин(2R,3S)-2-амино-3-метилпентановая кислота, L-циклопентилглицин (S)-2-амино-2-циклопентиловая кислота. Самоорганизующиеся пептиды, используемые в соответствии с описанием предмета изобретения, могут варьироваться по длине, пока они сохраняют способность, например, самособираться до размеров полезных для выполнения одной или более описанных здесь задач. Подходящими могут оказаться пептиды содержащие минимум два альфа-аминокислотных остатка или максимум приблизительно 50 остатков. В реализациях могут быть использованы аналоги альфа-аминокислот. В частности, могут быть использованы альфа-аминокислотные остатки D-конффигурации. Пригодные пептиды могут также быть разветвленными. Один или более аминокислотных остатков в самособирающемся пептиде могут быть функционализированы добавлением такой химической структурной единицы как ацильная группа, карбогидратная группа, фосфатная группа, фарнесильная группа, изофарнесильная группа, жирнокислотная группа или сшивающий агент для сопряжения. Эта функциональная группа может обеспечить образование межпептидных связей, или связей между пептидом и гидрогелем или предшественником гидрогеля. Например, гидрофобная часть амфифильного пептида может быть функционализована с помощью ацетиленовых групп. По альтернативному варианту может быть изменен один либо оба конца данного пептида. Например, могут быть защищены или не защищены карбоксил и/или аминогруппы карбокил- или амино-концевых остатков, соответственно. Примеры самоорганизующихся пептидов включают пептиды описанные в статьях Nagai et al. [J. Controlled Release, 2006, 115, 18-25], Schneider et al. (PloS ONE, 2008, 1, 1-8], и Hartgerink et al. (PNAS, 2002, 99, 5133-5138].
По протеину нет особых ограничений, и он может иметь молекулярный вес от 5 до 500 килодальтон, например, 20-200 кДа. Это может быть природный протеин или продукт генной инженерии, описанный в доступных для биологического представления системах, таких как дрожжи, млекопитающие, и в бактериальных системах описания. Предпочтительнее если у него будет легко реагирующая область, такая как альфа-спирально закрученный клубок или лейциновый домен типа застежки молнии, но не только такие структуры, которые после внешнего или внутреннего стимулирующего воздействия образует гидрогель, который структурно реагирует на изменения, например, в уровне pH, температуры и ионной силы. Примерами таких протеинов могут быть протеины, описанные в статье Banta et al. [Annu. Rev. Biomed. Eng., 2010, 12, 167-186].
Гелеобразующие вещества с низким молекулярным весом включают любую молекулу с молекулярным весом от 100-400 дальтон, например 250-1000 дальтон, имеющую амфифильную структуру, способную образовывать гидрогель. Конкретные, но не ограничивающие список низкомолекулярных гелеобразующих структур, примеры приведены в WO 2008/102127 А2; Chem Rev., 2004, 104, 1201-1217, и в Eur. J Org. Chem., 2005, 3615-3631.
Нерастворимые в воде жидкие материалы-носители высокой вязкости включают, но не ограничиваются этим перечнем, изобутират ацетата сахарозы, эфиры стеарата, такие как эфиры пропиленгликоля, глицерила, диэтиламиноэтила и гликоля, амиды стеарата и другие амиды длинноцепочечных жирных кислот, такие как N,N'-этилендистеарамид, стеарамид МЕА и DEA, этиленбистеарамид, оксид кокоамина, длинноцепочечные жирные спирты, такие как цетиловый спирт и стеариловый спирт, длинноцепочечные эфиры, такие как миристал миристат, бегениерукат, фосфаты глицерила, дистеарат ацетилированной сахарозы (Codesta А-IO), и тому подобные соединения.
Гель по настоящему изобретению обладает способностью разлагаться биологическим путем и совершать фазовый переход золь-гель в зависимости от уровня pH, температуры, концентрации ионов, ферментной активности, напряженности электрического поля или гидратации.
Состав растворителя (диспергирующей среды) не должен быть специально ограничен, и примеры включают, например, буферные растворы, такие как фосфатный буфер, цитратный буфер, и физиологический раствор содержащий фосфатный буфер, физиологический солевой раствор, среду для клеточной культуры и биологически совместимые органические растворители, такие как этанол, этиллактат, карбонат пропилена, гликофурол, N-метилпирролидон. 2-пирролидон, пропиленгликоль, ацетон, метилацетат, этилацетат. метилэтилкетон, бензиловый спирт, триацетин, диметилформамид, диметилсульфоксан, тетрагидрофуран, капролактам, децилметилсульфоксид, масляная кислота, 1-додецилазациклогептан-2-он и тому подобные соединения. Хотя данный состав может быть стабильно растворен в перечисленных растворителях (диспергирующих средах), в эти растворители могут быть добавлены сахариды (в виде водного раствора), например, моносахариды, такие как глюкоза, галактоза, манноза, фруктоза, инозитол, рибоза и ксилоза; дисахариды, такие как лактоза, сахароза, целлобиоза. тригалоза и мальтоза; трисахариды, такие как раффиноза и мелезитоза, и полисахариды, такие как альфа-, бета- или гамма-циклодекстрин; сахарные спирты, такие как эритриол, ксилитол, сорбитол, маннитол и мальтитол, или многоатомные спирты (в виде водного раствора), такие как глицерин, диглицерин, полиглицерин, пропиленгликоль, полипропиленгликоль, этиленгликоль, диэтиленгликоль, триэтиленгликоль, полиэтиленгликоль, моноалкиловый эфир этиленгликоля, моноалкиловый эфир диэтиленгликоля, и 1,3-бутиленгликоль. Добавки могут быть также выбраны из группы, состоящей из биологически усваиваемых материалов, таких как амилорид, прокаинамид, ацетил-бета-метилхолин, спермин, спермидин, лизоцим, фиброн, альбумин, коллаген, трансформирующий фактор роста бета (TGF-beta), костные морфогенетические белки (BMP), фактор роста фибробластов (bFGF), дексаметазон, фактор роста эндотелия сосудов (VEGF), фибронектин, фибриноген, тромбин, протеины, декстразоксан, лейковорин, рецинолевая кислота, фофсолипид, подслизистая оболочка тонкой кишки, витамин E, полиглицериновый эфир жирной кислоты, Лабрафил, Labrafil M1944CS, лимонная кислота, глютаминовая кислота, гидроксипропил, изопропилмиристат, Эудрагит, тегобетаин, димиристоифосфатидилхолин, склероглюкан, и т.п.; органические растворители, такие как кремофор EL, этанол, диметилсульфоксид и т.п.; консерванты, такие как метилпарабен и т.п.; сахара, такие как крахмал и его производные, сахаро-содержащие полиолы, такие как сахароза-маннитол, глюкоза-маннитол и т.п.; аминокислоты, такие как аланин, аргинин, глицин и т.п.; полимерсодержащие полиолы, такие как трегалоза-PEG, сахароза-PEG, сахароза-декстран и т.п.; сахаросодержащие аминокислоты, такие как сорбитол-глицин, сахароза-глицин, и т.п.; поверхностноактивные вещества, такие как полоксамеры разного молекулярного веса, Твин 20, Твин 80, Тритон Х-100, додецилсульфат натрия (SDS), полиоксиэтиленовые эфиры и т.п.; сахаросодержащие ионы, такие как трегалоза-ZnSO4, мальтоза- ZnSO4 и т.п.; и биологически приемлемые соли, такие как силикат, NaCl, KCl, NaBr, Nal, LiCl, n-Bu4NBr, n-Pr4NBr, Et4NBr, Mg(OH)2, Ca(OH)2, ZnCO3, Са3(PO4)2/ZnCl2, (C2H3O2)2Zn, ZnCO3, CdCl2, HgCl2, CalCl2, (CaNO3)2, BaCl2, MgCl2, PbCl2, AlCl2, FeCl2, FeCl3, NiCl2, AgCl2, AuCl, CuCl2, тетрадецилсульфат натрия, бромид додецилтриметиламмония, хлорид додецилтриметиламмония, бромид тетрадецилтриметиламмония, и тому подобные соединения, но не только.
В одной из реализаций настоящего изобретения содержание добавок находится в диапазоне от 1×10-6 до 30 вес. %, предпочтительно от 1×10-3 до 10 вес. %, на основе общего веса гелеобразующего компонента или компонентов.
Предпочтительно чтобы инъецируемая медицинская гелеобразующая система могла обладать одной или более, а желательно всеми, перечисленными ниже характеристиками:
(1) Для готовности к инъекции система перед введением должна быть в состоянии золя. Золь должен быть в состоянии с достаточно низкой вязкостью - обычно ниже 10000 сП, предпочтительно ниже 2000 сП при 20°C (или, по альтернативному варианту, - ниже чем 10000 сП, а предпочтительно - 2000 сП при 5°C), чтобы можно было использовать тонкую иглу для снижения дискомфорта пациенту и упрощения процедуры инъекции.
(2) Гелеобразование путем образования химических поперечных связей, физической ассоциации или гидратации начинается или завершается после инъекции.
(3) Гели должны быть биологически разлагаемыми или постепенно растворяемыми в течение регулируемого периода времени, а продукты разложения должны быть очищены и секретированы через обычные пути.
(4) Сам полимер и продукты разложения должны быть биологически совместимыми. Аналогично, если вводятся добавки, например, перекрестносшивающие агенты, инициаторы и т.п., то эти добавки также должны быть биологически совместимыми.
(5) Гель потенциально может обладать свойствами адгезии к клеткам и ткани.
(6) Гель не должен вызывать отрицательных последствий, таких как иммунная реакция, например, в виде раздражения.
Следует понимать, что гелеобразующая система должна предпочтительно быть биологически совместимой, то есть, не должна вызывать сильной, длительной или обостряющейся биологической реакции на введение состава в тело млекопитающего, в частности, человека. Для содействия биотрансформации скелетной структуры геля, в него могут быть введены разлагаемые связи путем использования строительных блоков на основе таких соединений как полилактид, полигликолид, поли(лактид-ко-гликолид), полифосфазин, полифосфат, поликарбонат, полиаминокислота, полиангидрид, и полиортоэфир в числе прочих. Также, в качестве строительных блоков могут быть использованы низкомолекулярные поперечносшивающие агенты, содержащие аналогичные гидролизуемые группы как и полимеры, такие как карбонаты, эфиры, уретаны, ортоэфиры, амиды, имиды, имидоксигидразиды, тиокарбазиды и фосфаты. Кроме того, в качестве разлагаемых строительных блоков могут быть использованы диакрилат полигликолида, диакрилат полиортоэфира и акрилатсодержащий полифосфазин, акрилатзамещнная полиаминокислота или и акрилатсодержащие полифосфатные полимеры. Вместо акрилатных групп в вышеприведенных примерах могут быть использованы метакрилатные или акриламидные группы. Аналогичным образом могут быть использованы небольшие молекулы, содержащие гидролизуемый сегмент и два или более акрилата, метакрилата или акриламида. Такие разлагаемые полимеры и небольшие молекулярные строительные блоки могут быть функционализированы такими группами как акрилат, метакрилат, акриламид, или аналогичными группами с помощью известных в данной области методов.
Для того чтобы стать инъецируемым составом данная система перед введением должна быть в состоянии золя. Этот золь должен иметь достаточно малую вязкость, чтобы для его введения можно было использовать тонкую иглу, снижающую дискомфорт для пациента и упрощающую процедуру инъекции.
Гелеобразование через образование химических поперечных связей или физическую ассоциацию начинается или завершается после инъекции.
Предпочтительные свойства гелеобразующей системы включают одну или более из перечисленных ниже характеристик:
Гелеобразующая система может быть в форме гидрогеля. Гидрогели состоят из поперечносшитых полимерных сетей, которые содержат большое число гидрофильных групп или доменов. Эти сетчатые структуры обладают высоким сродством к воде, но не растворяются из-за химических или физических связей между полимерными цепями. Вода проникает в эти сети, вызывая разбухание и придавая гидрогелю его форму. Полностью набухшие гидрогели обладают некоторыми физическими свойствами, общими для живых тканей, включая мягкую и резиновую консистенцию и низкое поверхностное натяжение на границе раздела фаз с водой или биологическими жидкостями. Эластичная природа полностью набухших или гидратированных гидрогелей способна снизить раздражение окружающих тканей после имплантации до минимума. Низкое поверхностное натяжение на границе раздела фаз между поверхностью гидрогеля и жидкостью тела минимизирует абсорбцию протеина и клеточную адгезию, что, в свою очередь, снижает риск патологической иммунной реакции. Многие полимеры, используемые в гидрогелевых препаратах (например, полиакриловая кислота (РАА), PHEMA, PEG, и PVA) обладают мукоадгезивными и биоадгезивными характеристиками, которые увеличивают время удержания лекарства. Эти адгезионные свойства, возникающие благодаря образованию межцепочечных мостиков между функциональными группами полимеров гидрогеля и гликопротеинов слизи, могут помочь улучшить специфическое связывание ткани.
Желательно, чтобы до введения в тело, гелеобразующая система по данному изобретению находилась в текучем состоянии. Поэтому органический рентгено-контрастный агент, такой как йодированные производные SAIB, показанные на Рис. 7, или другие йодированные полимеры и твердые органические частицы, могут, например, быть добавлены в гелеобразующую систему просто подмешиванием перед инъекцией. После инъекции гелеобразующая система в физиологических условиях быстро превращается в гель. Таким образом, впрыскиваемая матрица может быть имплантирована в тело человека с помощью минимально инвазивной хирургической процедуры. После превращения в гель на месте введения эта матрица может служить контрольным маркером для визуализации и прицельной лучевой терапии под визуальным контролем.
Для запуска этого перехода в гель после инъекции может быть использован целый ряд активирующих факторов или условий, которые или применяются снаружи, или возникают внутри в ответ на микросреду ткани. Примерами этого являются гелеобразование в ответ на pH, температуру, концентрацию ионов, ферментную активность, электрическое поле и гидратацию (Рис. 1). В связи сданным изобретением вполне уместным будет регулирование механической стабильности в ткани, чтобы можно было производить одиночные инъекции.
Системы образующие гель в ответ на изменение температуры
В одном из вариантов воплощения гелеобразующая система переходит в гель в ответ на температуру в диапазоне 10°C-65°C, предпочтительно в диапазоне 35-40°C.
Предпочтительный термочувствительный материал должен будет проявлять свойство совершать обратный переход из золя в гель. Термин «обратный» здесь означает, что превращение в гель происходит под воздействием нагрева, а не охлаждения. Примеры биологически разлагаемых или поглощаемых термогелирующих полимеров показаны на Рис. 2. По происхождению материала термогелирующие полимеры модно разделить на природные (или полуприродные) полимерные системы и синтетические полимерные системы. Полимеры из первой группы включают целлюлозу, хитозан, ксилоглюкан, желатин и т.п. и их производные. К полимерам из второго класса относятся некоторые полиэфиры, блочные сополимеры полиэфиров и биологически разлагающихся полиэфиров, синтетические полипептиды и другие полимеры (Рис. 2).
Другие примеры таких гелеобразующих систем описаны в следующих журналах, патентах и книгах: (I) Eur. J. Pharm. Biopharm., 2004, 57, 53-64; (II) Chem. Soc. Rev., 2008, 37, 1473-1481; (III) Adv. Drug Deliv. Rev., 2010, 62, 83-99; (IV) Macromol. Biosci. 2010, 10, 563-579 (V) J. Controlled Release, 2005, 103, 609-924; (VI) Expert Opin. Ther. Patents, 2007, 17, 965-977, (VII) Appl. Microbiol. Microtechnol., 2011, 427-443, (VIII) Science, 1998, 281, 389-392; (IX) Eur. J. Pharm Biopharm. 2008, 68, 34-45; (X) Biomacromolecules, 2002, 4, 865-968; (XI) Colloids and Surfaces B: Biointerfaces, 2011, 82, 196-202, (XII) Biomacromolecules, 2010, 1, 1082-1088; (XIII) Adv. Eng. Mater., 2008, 10, 515-527; (XIV) Eur. J. Pharm Biopharm., 2004, 58, 409-426; (XV) Adv. Drug Deliv. Rev., 2002, 54, 37-51; (XVI) Biomater., 2004, 25, 3005-3012; (XVII) J. Biomed. Mater. Res., 2000, 50, 171-177; (XVIII) (XIX) WO 2007/064252; (XX) WO 2009/150651; (XXI) WO 2007/064152; (XXII) WO 99/07416; (XXIII) Park K., Shallaby W.S.S., Park K., Shallaby W.S.S., Park H., Biodegradable Hydrogels for Drug Delivery. Basel: Technomic Publishing Co., Inc., 1993, ISBN 1-56676-004-6, Print; (XXIV) Biomedical Polymers and Polymers Therapeutics, Ed. by Chiellini E,. Sunamoto J., Migliaresi C., Ottenbrite R.M., Cohn D., New York, Kluwer Academic Publishers, 2002, ISBN 0-30646472-1-1, Print - и ссылочные материалы, приведенные в этом сборнике, но не ограничиваясь этим перечнем.
В одной из интересных реализаций в качестве термочувствительного полимера выступает поли(этиленгликоль)-b-поли(пропиленгликоль)-b-поли(этиленгликоль) (PEG-PPG-PEG, плюроник (Pluronic®) или полоксамер) или его производные. Контролируя композицию ПЭГ/ППГ, молекулярный вес и концентрацию, можно получить обратимое гелеобразование при физиологических температурах и pH.
В другом интересном воплощении термочувствительным полимером является хитозан. Хитозан может быть термочувствительной, зависимой от уровня pH гелеобразующей системой при добавлении солей полиола (например бета-глицерофосфата, GP). Такие смеси имеют нейтральный pH, остаются жидкими при комнатной температуре или ниже, и образуют монолитные гели при температуре тела. Стабильность золя при комнатной температуре и время образования геля увеличиваются с уменьшением степени деацетилирования хитозана [Int. J. Pharm., 2000, 203, 89-98]. Переход в гель систем на основе хитозана происходит вследствие объединенного воздействия нейтрализации заряда, ионных и водородных связей и, как основной движущей силы, - факторов гидрофобного взаимодействия. Кроме того, такие системы обладают высокой совместимостью с биологическими соединениями и могут быть использованы для инъекций в организм биологически активных факторов роста и клеток [Biomater., 2000, 21, 2155-2161].
В одном очень интересном варианте воплощения термочувствительным полимером является поли(капролактон-b-этиленгликоль-b-капролактон) (PCL-PEG-PCL) поли(этиленгликоль-b-капролактон-этиленгликоль) (PEG-PCL-PEG) или поли(этиленгликоль-b-капролактон) (PEG-PCL). Это семейство блоковых сополимеров может быть настроено таким образом, чтобы при комнатной температуре быть свободнотекучим раствором и стать хорошо биоразлагаемым гелем при температуре тела. Такие полимеры обладают высокой биологической совместимостью, и притом они оказались очень низкотоксичными при максимально переносимой дозе в 25 г/кг веса тела при подкожном введении [J. Pharm. Sci., 2009, 98, 4684-4694] и оставались устойчивыми в теле в течение более чем 4 недель [Tissue Eng., 2006, 12, 2863-2873].
В другом интересном варианте воплощения термочувствительным полимером являются трехблочные сополимеры поли(этиленгликоль-b-[DL-молочная кислота - когликолевая кислота]-b-этиленгликоль) (PEG-PLGA-PEG). Полимер PEG-PLGA-PEG (33 вес. %) представляет собой свободнотекучий золь при комнатной температуре. Этот гель показал хорошую механическую прочность и целостность гелей, сохранявшихся больше 1 месяца [J. Biomed. Mater. Res., 2000, 50, 171-177]. Дополнительные примеры включают сополимер поли(N-изопропилакриламид)-g-метилцеллюлозы в качестве гидрогеля обратимо и быстро совершающего золь-гель переход под воздействием температуры. Подбором содержания метилцеллюлозы можно регулировать температуру гелеобразования, время набухания и механическую прочность геля [Biomater., 2004, 25, 3005-3012].
Системы образующие гель в ответ на изменение ионной силы
По еще одному из вариантов воплощения гелеобразующая система переходит в гель в ответ на изменение ионной силы в диапазоне 1 мкМ-500 мМ, предпочтительнее в диапазоне 1-50 мМ, или 50-200 мМ.
Не ограничивающие список примеры таких гелеобразующих систем включают системы, показанные на Рис. 3 и системы, описанные в следующих публикациях: (I) Int. J. Pharm., 189, 57, 163-168; (II) J. Controlled Release, 1997, 44, 201-208; (III) J. Am. Chem. Soc, 2001, 123, 9463-9464; (IV) J. Controlled Release, 2003, 86, 253-265; (V) Biomater., 2001, 22, 511-521; (XI) Park К., Shallaby W.S.S., Park H., Biodegradable Hydrogels for Drug Delivery. Basel: Technomic Publishing Co., Inc., 1993, ISBN 1-56676-004-6, Print; (XII) Biomedical Polymers and Polymers Therapeutics, Ed. by Chiellini E,. Sunamoto J., Migliaresi C, Ottenbrite R.M., and Cohn D., New York, Kluwer Academic Publishers, 2002, ISBN 0-30646472-1-1, Print; и ссылочные материалы, приведенные в этих источниках.
Одним вызывающим интерес примером такой гелеобразующей системы является альгинат. Альгиновая кислота представляет собой неразветвленный бинарный сополимер 1-4 гликозидно-связанной L-гулуроновой кислоты (G) и ее С-5 эпимера - D-маннуроновой кислоты (М). Соотношение, а также распределение этих двух мономеров, определяет в большой степени физико-химические свойства альгината.
В одной из реализаций, гелеобразующая система базируется на водном растворе альгината. Альгинаты - это семейство линейных полисахаридов, которые в водных растворах могут превращаться в гель после прибавления многовалентных катионов. Использования альгината в качестве препарата для анестезии в большинстве приложений основано на его способности формировать устойчивые к нагреву прочные гели, которые могут развиваться и устанавливаться при комнатных температурах. Именно образование альгинатом геля под воздействием ионов кальция представляет интерес для большинства приложений.
Однако альгинат образует гели с большинством двух- и многовалентных катионов. Одновалентные катионы и ионы Mg2+ не индуцируют переход в гель, тогда как ионы Ва2+ и Sr2+ стимулируют образование даже более прочных гелей альгината, чем Са2+. Прочность геля зависит от содержания гулурона (G), а также от среднего числа единиц гулурона в G-блоках. Образование альгинатом геля происходит, когда в межцепочечном связывании между блоками гулурона принимают участие двухвалентные катионы, в результате чего получается трехмерная сеть в форме геля (Рис. 1). Гель альгината как иммобилизационная матрица чувствителен к присутствию хелатирующих соединений, таких как фосфат, лактат и цитрат, и к присутствию препятствующих гелеобразованию катионов, таких как ионы Na+ или Mg2+. Чтобы избежать этого бусинки геля можно держать в среде, содержащей несколько миллимолей свободных ионов кальция и поддерживать соотношение Na+/Са2+ ниже 25:1 для альгинатов с высоким содержанием гулурона и 3:1 для альгинатов с низким содержанием гулурона. Альтернативный способ состоит также в том, чтобы заменить ионы Са2+ другими двухвалентными катионами с более высоким сродством к альгинату. Также была найдена корреляция между механической прочностью геля и сродством к катионам. Было обнаружено, что прочность геля может снижаться в следующем порядке: Pb2+>Cu2+=Ва2+>Sr2+>Cd2+>Са2+>Zn2+>Со2+>Ni2+. Однако в приложениях, включающих иммобилизацию живых клеток, лимитирующим фактором при использовании большинства ионов является токсичность, и для этих целей нетоксичными считаются только ионы Sr2+, Ва2+ и Са2+. Было найдено, что гели альгината стабильны в целом ряде органических растворителей.
Поскольку перед инъекцией в состав добавляется индуцирующий образования геля фактор, требуется, чтобы гель не образовывался быстро, чтобы избежать закупорки шприца. Эту задачу можно решить медленным высвобождением ионов кальция, например, из порошка CaSO4, после того как этот порошок добавляется в водный раствор альгината натрия [J. Biomater. Sci. Polym. Ed., 1998, 9, 475-478]. В другом интересном воплощении в результате совместной инъекции вызывающего гелеобразование фактора и водного раствора альгината из двойного шприца достигается быстрое образование геля в ткани инъекции и таким образом удается избежать закупорки шприца. Другим интересным воплощением представляется геллановая камедь (Gelrite®, Рис. 3) - высокомолекулярный полисахарид (500 кДа) продуцируемый микробом Sphingomonas eladea. Геллановая камедь состоит из четырех моносахаридов, включая одну молекулу рамнозы, одну молекулу глюкуроновой кислоты и две молекулы глюкозы. Она образует гели при добавлении позитивно заряженных ионов (т.е. катионов). Таким образом, свойства этого геля можно контролировать, изменяя концентрации солей натрия, магния, кальция и/или калия.
В другом интересном воплощении гелеобразующая система, чувствительная к ионной силе, представляет собой пептид, такой как H-(FEFEFKFK)2-OH (FEK16), известный своей способностью к самосборке в В-складчатые структуры зависимым от ионной силы образом [J. Am. Chem. Soc, 2001, 123, 9463-94-64]. Было найдено, что FEK16 хорошо растворяется в чистой воде, но образует самособирающиеся гидрогели при концентрациях выше 10 мг/мл в присутствии миллимольных концентраций NaCl, KCl и CaCl2.
Системы образующие гель в ответ на изменение pH
Еще в одном из вариантов воплощения гелеобразующая система переходит в гель в ответ на изменение уровня pH. Избирательно гелеобразующая система переходит в состояние геля в ответ на совместное изменение уровня pH и температуры, такие как pH в диапазоне 6-8 и температура в диапазоне от 35 до 40°C.
Не ограничивающие список примеры таких гелеобразующих систем показаны на Рис. 4 и включают системы, описанные в следующих публикациях: (I) Macromol. Biosci., 2010, 10, 563-579; (II) J. Controlled Release, 2001, 73, 205-211; (III) Topics in tissue engineering - Smart Polymers, Vol.3, 2007, Chapter 6; (IV) Adv. Drug Delivery Rev., 2010, 62, 83-99; (V) J. Controlled Release, 2003, 86, 2530265; (VI) Park K., Shallaby W.S.S., Park H., Biodegradable Hydrogels for Drug Delivery. Basel: Technomic Publishing Co., Inc., 1993, ISBN 1-56676-004-6, Print; (VII) Biomedical Polymers and Polymers Therapeutics, Ed. by Chiellini E,. Sunamoto J., Migliaresi C., Ottenbrite R.M., and Cohn D., New York, Kluwer Academic Publishers, 2002, ISBN 0-30646472-1-1, Print, и ссылочные материалы, приведенные в этих источниках.
У этого состава pH (до инъекции) предпочтительно должен находиться в диапазоне pH=2-10, а избирательно - в одном из следующих диапазонов 4-6, 6-8 или 8-9.
Характеристики гидрогелей, реагирующих на уровень pH, сильно зависят от рКа ионизуемой группы, наличия гидрофобных групп в полимерном скелете, их количества и распределения. Когда ионизуемые группы становятся нейтральными (неионизованными) и внутри полимерной сети исчезают силы электростатического отталкивания, начинают доминировать гидрофобные взаимодействия. Введение более гидрофобной группы может создать более компактную конформацию в незаряженном состоянии и обеспечить более четкий фазовый переход. Гидрофобность этих полимеров можно регулировать с помощью сополимеризации гидрофобных ионизируемых мономеров с более гидрофобными мономерами, содержащими или не содержащими чувствительных к уровню pH групп, таких как 2-гидроксиэтилметакрилат, метилметакрилат и малеиновый ангидрид. После введения в тело эти полимерные растворы оказываются в окружении с иным уровнем pH и образуют гели. Одним из примеров является мукоадгезивный чувствительный к уровню pH хитозан/глицерилмоноолеат (C/GMO), образующий на месте гелевую систему, которая состоит из 3% (вес. %/объем) хитозана и 3% (вес. %/объем) GMO в 0.33-мольной лимонной кислоте. Хитозан обычно нерастворим в средах с нейтральным или щелочным pH. Однако в разбавленных кислотах (с pH≤5,0) он становится растворимым вследствие протонирования свободных аминогрупп в цепях хитозана (RNH3+). Растворимость хитозана к кислых средах также зависит от его молекулярного веса. Кислые растворы хитозана при попадании в среду со щелочным pH или с биологическим pH тела теряют этот заряд и образуют вязкие гели. Как хитозан, так и глицерилмоноолеат обладают мукоадгезивными свойствам, которые используются в системе доставки лекарственного вещества. Позитивные заряды в главной цепи хитозана могут вызвать сильное электростатическое взаимодействие с мукусом или негативно заряженной слизистой поверхностью.
Системы образующие гель в ответ на ферментативную активность
Еще в одном из вариантов воплощения гелеобразующая система переходит в гель в ответ на ферментативную активность.
Не ограничивающие список примеры таких гелеобразующих систем показаны на Рис.5 и включают системы, описанные в следующих публикациях: (I) Tissue Eng., 2006, 12, 1151-1168, (II) Biomater. 2001, 22, 453-462; (III) Biomater., 2002, 23, 2703-2710; (IV) Colloids Sufr. B, 2020, 79, 142-148; (V) Biomacromolecules, 2011, 12, 82-87, (VI) Macromolecules, 1997, 30, 5255-5264; (VII) Park K., Shallaby W.S.S., Park H., Biodegradable Hydrogels for Drug Delivery. Basel: Technomic Publishing Co., Inc., 1993, ISBN 1-56676-004-6, Print; (VIII) Biomedical Polymers and Polymers Therapeutics, Ed. by Chiellini E,. Sunamoto J., Migliaresi C., Ottenbrite R.M., and Cohn D., New York, Kluwer Academic Publishers, 2002, ISBN 0-30646472-1-1, Print, и ссылочные материалы, приведенные в этих источниках.
Как на ферменты, так и на их происхождение особых ограничений не накладывается. Фермент может быть добавлен до или после инъекции гелеобразующей системы, действуя, таким образом, как молекула активизирующая образование геля. Фермент может быть инкапсулирован, например, в липосомы и тому подобные соединения, которые освобождают фермент при контакте с внутренним или внешним стимулом. Кроме того, фермент может присутствовать в ткани инъекции либо как естественный компонент ткани, либо как активируемый фермент из-за патофизиологических условий на месте инъекции.
В одной из реализаций активируемая ферментом гелеобразующая система базируется на казеинах - группе фосфопротеинов с молекулярным весом в диапазоне от 20 кДа до 30 кДа. Такая система может быть превращена в гидрогель добавлением микробной трансглютаминазы (MTG-азы), природного тканевого фермента, при физиологических температуре и pH [Colloids Surf., В, 2010, 79, 142-148].
Другой интересный пример гелеобразующей системы, использующей ферментную активацию, базируется на образовании шиффового основания обогащенными лизином пептидами вследствие активации либо лизилоксидазой, либо амилоксидазой плазмы [Biomacromolecules, 2011, 12, 82087]. Окисление ε-аминогрупп лизина лизиноксидазой или аминоксидазой плазмы приводит к образованию альдегида, который легко образует шиффово основание с дополнительной ε-аминогруппой лизина, что приводит к образованию гидрогеля.
Системы образующие гель в ответ на воздействие инициатора
Еще в одном из вариантов воплощения гелеобразующая система переходит в гель в ответ на контакт с инициатором, например, в виде молекулы или облучения, который приводит к образованию геля вследствие поперечного связывания гелеобразующей системы ковалентными химическими связями.
Не ограничивающие список примеры таких гелеобразующих систем описаны в следующих публикациях: (I) US 5410016; (II) Controlled Release, 2005, 102, 619-627; (III) Macromol Res., 2011, 19, 294-299; (IV) Polym. Bull., 2009, 62, 699-711; (V) J. Biomater. Sci., Polym. Ed., 2004, 15, 895-904, и в ссылочных материалах, приведенных в этих публикациях.
В одном из примеров воплощения гелеобразующая система связывается поперечными связями под воздействием создающего свободные радикалы фотоинициирования, которое предпочтительно проводить, облучая видимым светом или длинноволновым ультрафиолетом. Предпочтительные области полимеризации включают акрилаты, диакрилаты, олигоакрилаты, метакрилаты, диметиакрилаты, олигометакрилаты, или другие биологически приемлемые группы, полимеризующиеся под воздействием света. Эффективными фотоинициаторами для вышеуказанной системы являются такие, которые могут быть использованы для активации свободнорадикальной полимеризации макромеров, протекающей без цитотоксичности и за короткой промежуток времени, а именно, за минуты, а, более предпочтительно, - за секунды. Красители, предпочтительно используемые как популярные инициаторы для инициации видимым светом включают этилэозин, 2,2-диметокси-2-фенилацетофенон, другие производные ацетофенона и камфорохинон. Во всех случаях поперечные связи макромеров инициируются активируемыми светом инициаторами свободнорадикальной полимеризации, такими как, например, 2,2-диметокси-2-фенилацетофенон или комбинация этилэозина и триэтаноламина.
В другом примере реализации гелеобразующая система поперечно связывается гетеро- или гомо-бифункциональными связывающими агентами, такими как, например, дитиотреитол, глутаральдегид, дифетилметанбисмалеимид, дисукцинимидилсуберат.бис(сульфосукцинимидил)суберат, диметиладипин и тому подобные соединения, но не только. Примером такой гелеобразующей системы является мультиакрилат полимеров на основе PEG, которые, как сообщается, образуют гидрогель после добавления инициатора DTT [J. Controlled Release, 2005, 102, 619-627]. Свойства этого геля могут быть точно настроены регулированием размера полимера и количества добавляемого инициатора, причем гель может образовываться при физиологических температуре и уровне pH. Дополнительным примером такой системы служит образование гидрогеля путем поперечного сшивания производного гиалуроновой кислоты с гидразидной группой и других производных гиалуроновой кислоты с альдегидом для образования гидролизуемой связи гидразона [Eur. J. Pharm. Biopharm., 2008, 68, 58-66]. У этого способа имеется то преимущество, что он позволяет проводить поперечное сшивание на месте, без использования инициаторов, поперечносшивающих химических агентов, или дополнительного оборудования для образования перекрестных связей, такого как источник света.
Системы образующие гель в ответ на гидратацию
Еще в одном из вариантов воплощения гелеобразующая система переходит в гель в ответ на гидратацию. Не ограничивающие список примеры таких гелеобразующих систем описаны в следующих публикациях: (I) WO 2006/075123; (II) Adv. Drug Delivery Res., 2001, 47, 229-250; (III) US 2007/0092560, и в ссылочных материалах, приведенных в этих публикациях, но не только.
Составы состоящие из нейтральных диациллипидов и/или токоферолов и/или фосфолипидов, растворенных в биологически совместимом, кислородсодержащем, органическом, маловязком растворителе, могут образовывать жидкокристаллическую структуру после гидратации, например в контакте с водосодержащей жидкостью, такой как экстраваскулярная жидкость, внеклеточная жидкость, межклеточная жидкость или плазма, но не только. Другие системы включают нерастворимые в воде высоковязкие жидкие материалы-носители, такие как изобутират ацетата сахарозы (SAIB). Такая система может быть смешана с твердыми частицами, описанными в настоящем изобретении, с последующей парентеральной инъекцией, и, таким образом, действовать как впрыскиваемый контрастный агент, который может быть визуализован одним из многочисленных способов визуализации, включая рентгеновскую.
Гелеобразующие системы с группами, образующими поперечные связи
Еще в одном примере реализации любая из вышеупомянутых гелеобразущих систем далее функционализируется введением одной или более поперечносшиваемых групп, таких как акрилат, метилакрилат, акриламид, метакриламид, сложный виниловый эфир, стирил, эпоксид, производные малеиновой кислоты, диен, замещенный диен, тиол, спирт, амин, гидроксиамен, карбоновая кислота, ангидрид карбоновой кислоты, галид карбоновой кислоты, альдегид, алкоксисилан, алкин, азид, 2'-пиридилдитиол, фенилдиоксал, йодомалеимид, имидоэфир, дибромопропионат, и галоацетаты, такие как бромацетат, но не только.
Гелеобразующие системы с хелатообразующими группами
В дополнительном примере реализации гелеобразующая система составлена из хелатообразующего агента, который, как известно, хелатирует ионы. Любой известный на данный момент или обнаруженный позже хелатирующий ионы агент может быть использован в статьях настоящего изобретения. Примеры агентов хелатирующих ионы металла (например, Gd3+ или Cu2+) включают, но не ограничиваются перечисленными, протяженные порфирины и порфириноподобные производные, DOTA, DTPA, AngioMARKTM (хелатный комплекс DTPA с функционализированной основной цепью), DTPA-BMA (нейтральное бисметиламидное производное DTPA), и HP-D03A (DOTA-подобные макроциклическое соединение в котором одна хелатная ветвь заменена на гидроксилпропильную группу). Дополнительные хелаты включают, но не ограничиваются, DPDP (TeslaScan™) и дефероксамин (например, Fe3+ и Zr4+).
Другие компоненты состава
Далее состав может включать другие составляющие, такие как альфа-, бета- и/или гамма-циклодекстрины и любые их производные. Такие составляющие могут образовывать комплексы типа «гость-хозяин» с гелеобразующей системой и наночастицами, таким образом, способствуя образованию геля и, возможно, изменяя параметры высвобождения содержащейся частицы [Adv. Drug Delivery Rev., 2008, 60, 1000-1017]. В одном очень интересном примере реализации гелеобразующая система базируется на трехблоковых (PEG-PHB-PEG) сополимерах, альфа-циклодекстрине и твердых покрытых PEG наночастицах. В таком составе альфа-циклодекстрин может образовывать комплексы включения как с блоками PEG трехблочного образования PEG-PHB-PEG, так и с покрытыми PEG наночастицами, что вместе с гидрофобными взаимодействиями между срединными блоками РНВ образует прочный гидрогель с повышенной способностью удерживать твердые наночастицы из-за взаимодействий альфа-циклодекстрина, которые, таким образом, изменяют характеристики высвобождения частицы.
В одном примере реализации обсуждаемый состав содержит еще и йодсодержащий полимер, например, поливинилпирролидон-йод (PVP-I), или соединение, подобранное из одного из следующих источников (I) Polym Chem., 2010, 1, 1467-1474; (II) US 3852341; (III) US 4406878; (IV) US 519836; (V) Biomedical Polymers and Polymers Therapeutics, Ed. by Chiellini E,. Sunamoto J., Migliaresi C., Ottenbrite R.M., and Cohn D., New York, Kluwer Academic Publishers, 2002, ISBN 0-30646472-1-1, Print, и ссылочных материалах, приведенных в этих источниках. Такие полимеры могут быть добавлены к гелеобразующим компонентам до перевода системы в гель и действовать в теле как контрастный агент. Такие полимеры могут дополнительно или альтернативно быть ковалентно связанными с одной или более гелеобразующей компонентой или могут быть приклеены к частицам по данному изобретению.
В одном конкретном примере реализации создаваемый состав состоит из SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH. Указанная комбинация позволяет создавать стабильные вводимые составы с очень высоким содержанием йода, который может быть использован для обеспечения хорошей визуализации одним или несколькими методами визуализации, включая и рентгенографию. Высокое содержание йода (высокий контраст в единицах Хаунсфилда, HU) особенно важно для менее чувствительных методов визуализации, таких, например, как флюороскопия, в числе прочих. Концентрация йода в указанном составе, состоящем из SAIB/6,6'-(2,4,6-трийодофенокси)ацетокси-изомасляной сахарозы (8)/EtOH может быть плавно настроена изменением весового процентного содержания (вес. %), определяемого как умноженное на 100 отношение веса создающего рентгеноконтрастный эффект атома (молекулы), такого как йод, к общему весу материала состава 6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8), добавленной в матрицу. Процентный химический состав 6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8) следующий: C, 34,96; Н, 3,61; I, 42,62; О, 18,81. На основе этого состава можно рассчитать общее содержание йода (вес. %) в разных составах, а именно: для SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH с процентным содержанием (75:5:20) оно равно 2,13 вес. % и 2,67 вес. % йода до и после инъекции соответственно (диффузия этилового спирта из состава после инъекции создает увеличение процентного содержания йода); для SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH (70:10:20) оно равно 4,26 вес. % и 5,33 вес. % йода до и после инъекции соответственно; для SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH (60:20:20) оно равно 8,52 вес. % и 10,66 вес. % йода до и после инъекции соответственно; для SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH (55:25:20) оно равно 10,65 вес. % и 13,32 вес. % йода до и после инъекции соответственно; для SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH (45:35:20) оно равно 14,92 вес. % и 18,65 вес. % йода до и после инъекции соответственно; для SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH (30:50:20) оно равно 21,30 вес. % и 26,64 вес. % йода до и после инъекции соответственно;
Рост концентрации йода в составе может напрямую соотноситься с наблюдаемым контрастом в единицах Хоунсфилда. Ниже приведены значения контраста, которые наблюдались на разных энергиях: 80 кВ, 100 кВ, 120 кВ, и 140 кВ, все 200 мАс, 2 мм (кол. 40×0,6 мм) для следующих составов: (а) SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH(70:10:20) (4,26 вес. % и 5,33 вес. % йода до и после инъекции) 2500 HU (80 кВ), 1800 HU (100 кВ), 1500 HU (120 кВ), и 1300 HU (140 кВ); b) SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH (55:25:20) (10,65 вес. % и 13,32 вес. % йода до и после инъекции) 5000 HU (80 кВ), 4500 HU (100 кВ), 3500 HU (120 кВ), и 3000 HU (140 кВ); с) SAIB/6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)/EtOH(30:50:20) (21,30 вес. % и 26,64 вес. % йода до и после инъекции) 10500 HU (80 кВ), 8800 HU (100 кВ), 6200 HU (120 кВ), и 5900 HU (140 кВ).
Гелеобразующий состав может также содержать фармацевтические вещества, включая пролекарства (коротко «лекарства»; в широком смысле интерпретируются как агенты, которые способны модулировать соответствующие биологические процессы в млекопитающих). Примерами фармацевтически активных веществ могут быть микродозы лекарств, плазмоидная ДНК (например, для генной терапии), информационная ДНК (mDNA), малые интерферирующие ДНК (siDNA), углеводороды, пептиды и протеины. Конкретные примеры фармацевтических веществ включают: (а) химиотерапевтические вещества, такие как доксорубицин, митомицин, паклитаксел, азотистый иприт, этопозид, камптотецин, 5-фтороурацил, и т.п.; (b) радиосенсибилизирующие вещества, такие как гемцитабин и доранидазол, порфирины для фотодинамической терапии (например, визудин) или кластеры 10В или 157Gd для нейтронозахватной терапии; (с) пептиды или протеины, которые моделируют апоптоз, клеточный цикл, или другие ключевые сигнальные каскады; (d) противовоспалительные средства, такие как метилпреднизолон гемисукцинат, бета-метазон; (е) успокоительные препараты как мускульные релаксанты, такие как диклофенак, придинол; (f) местные анестетики, такие как лидокаин, бупивакаин, дибукаин, тетракаин, прокаин; (g) анальгетики, такие как опиоиды, нестероидные противовоспалительные препараты (NSAID); (h) антимикробные препараты, такие как пентамидин, азалиды; (i) нейролептические средства, такие как хлорпромазин, перфеназин; (j) противопаркинсонические средства, такие как будипин, продипин. бензтропинмезилат, тригексифенидил, L-DOPA, допамин; (k) противопротозойные средства, такие как хинакрин, хлорохин, амодиахин, хлорогуанид, примахин, мефлохин, хинин; (I) антигистаминные препараты, такие как дифенгидрамин, прометазин; (m) антидепрессанты, такие как серотонин, имипрамин. амитриптилин, доксепин, дезипрамин; (n) антианафилактические вещества, такие как эпинефрин; (о) антихолинергические средства, такие как атропин, децикломин, метиксен, пропантелин, физостигмин; (р) противоаритмические вещества, такие как хинидин, пропранолол, тимолол, пиндолол; (q) простаноиды, такие как простагландины, тромоксан, простациклин, но не ограничиваясь этим перечнем. Эти лекарства могут быть составлены как одно вещество или как комбинация двух или более вышеперечисленных веществ в их активной форме или в виде пролекарств.
Дополнительные примеры противоопухолевых препаратов включают производные камптотецина, такие как иринотекангидрохлорид, ногитекангидрохлорид, экситекан, RFS-2000, лурдотекан, BNP-1350, Вау-383441, PNU-166148, IDEC-132, BN-80914, DB-38, DB-81, DB-90, DB-91, CKD-620, Т-0128, Т-0128, ST-1481, DRF-1042 и DE-310, производные таксана, такие как доцетакселгидрат, IND-5109, BMS-184476, BMS-188797, Т-3782, ТАХ-1011, SB-RA-31012, SBT-1514 и DJ-927, ифосфамид, нимустингидрохлорид, карбоквон, циклофосфамид, дакарбазин, тиотепа, бисульфан, мелфалан, ранимустин, эстрамустинфосфат натрия, 6-меркаптопуринрибозид, эноцитабин. гемцитабингидрохлорид, кармофур, цитарабин, цитарабинокфосфат, тегафур, доксифлуридин, гидроксикарбамид, фторурацил, метотрексат, меркаптопурин, флударабинфосфат, актиномицин D, акларубицингидрохлорид, идарубицингидрохлорид, эпирубицингидрохлорид, даунорубицингидрохлорид, пирарубицингидрохлорид, блеомицингидрохлорид, циностатинстималамер, неокарциностатин, митомицин С, блеомицинсульфат, винорелбинтартрат, винкристинсульфат, виндестин сульфат, винбластин сульфат, амрубицингидрохлорид, гефитиниб, эксеместан, капецитабин, TNP-470, ТАК-165, KW-2401, KW-2170, KW-2871, КТ-5555, КТ-8391, TZT-1027, S-3304, CS-682, YM-511, YM598, ТАТ-59, TAS-101, TAS-102, ТА-106, FK-228, FK-317, Е7070, Е7389, KRN-700, KRN-5500, J-107088, HMN-214, SM-11355, ZD0473, и т.п.
Дополнительные примеры радиосенсибилизирующих веществ включают магний 5,10,15,20-тетракис(4-сульфофенил)-порфин додекагидрат, протеин PYROA (Emericella nidulans), протозан III, ломефлоксацин, циамемазин, тиапрофеновая кислота и тому подобные вещества, но не только.
Лекарства вводятся в состав в количествах достаточных для создания желаемого эффекта. Количество лекарства или биологически активного вещества, включенного в состав, зависит от желаемого временного профиля его высвобождения, концентрации лекарства, необходимой для создания биологического эффекта и желаемого периода высвобождения этого лекарства. Биологически активные вещества обычно присутствуют в составе в количествах от приблизительно 0,5% до 20% по весу по отношению к общему весу состава, а более типично - в количестве от приблизительно 1% до приблизительно 15% по весу. Другой предпочтительный диапазон - от приблизительно 2% до приблизительно 10% по весу. Для очень активных веществ, таких как факторы роста, предпочтительны количества менее 1% по весу и менее 0,0001%.
Вязкость состава
Вязкость состава до инъекции предпочтительно должна быть ниже 10000 сантипуаз, в частности - ниже 2000 сП при 20°C. По альтернативному варианту измерения, вязкость состава до инъекции обычно бывает ниже 2000 сП при 5°C.
Органическая гелеобразующая система состава предпочтительно должна быть такой, чтобы после инъекции или в условиях, имитирующих условия человеческого тела, она при 37°C образовывала гель с вязкостью в диапазоне от 2000 до 50000000 сП. Более конкретно, вязкость гидрогеля может быть около 2000 сП, ок. 5000 сП, ок. 10000 сП, ок. 20000 сП, ок. 30000 сП, ок. 50000 сП, ок. 75000 сП, ок. 100000 сП, ок. 125000 сП, ок. 150000 сП, ок. 200000 сП, ок. 300000 сП, ок. 800000 сП, ок. 1000000 сП, ок. 2000000 сП, ок. 5000000 сП, ок. 10000000 сП, ок. 20000000 сП, ок. 30000000 сП, ок. 40000000 сП, ок. 50000000 сП, или в диапазонах указанных значений. Вязкость гидрогеля после инъекции (то есть, когда он доставлен в нужное место) должна предпочтительно быть выше 20000 сП, например, в находиться в диапазоне от 20000 сП до 1000000 сП. В частности, после инъекции предпочтительно, чтобы состав стал практически твердым.
Использование состава
Настоящее изобретение также предлагает такой состав, как описано выше, для использования в качестве маркера конкретной ткани при рентгеновской визуализации, такой как при компьютерной томографии (КТ) тела млекопитающего.
В одном из интересных вариантов реализации изобретения, состав вводится парентерально в предварительно определенное место в теле человека или животного, и при этом регистрируется рентгеновское изображение, по крайней мере, части тела человека или животного, включающей и это предварительно определенное положение.
Комплект включающий в себя состав
Настоящее изобретение далее включает в себя комплект инструментов, состоящий из шприца, иглы, используемой для инъекций в тело или родственных хирургических процедур, таких как биопсия, но не только, и подогнанной для одевания на открытый конец указанного шприца, и вводимого состава в соответствии с тем, как определено выше. В одном из вариантов реализации, этот состав содержится внутри сосуда или в указанном шприце.
Гелеобразующая система может быть представлена в виде лиофилизированного порошка, суспензии или раствора. Разные компоненты могут быть представлены в одной или более ампул, или предварительно смешаны внутри сосуда или в указанном шприце. Примеры различных компонентов включают, но не ограничиваются этим перечнем, гелеобразующую систему и твердые частицы, и состав, и один или более инициаторов гелеобразования.
Шприц может иметь исполнение в виде одноцилиндрового шприца или многоцилиндрового шприца (как, например, шприцы фирмы Medmix Systems AG), или двухкамерного шприца (как, например, шприцы фирмы Debiotech S.A.) и тому подобные конструкции, но не только. Многоцилидровые шприцы, двухкамерные шприцы и тому подобные исполнения могут быть удобны, например, для двухкомпонентных составов, где один компонент является смесью гелеобразующей системы и одного или нескольких контрастных агентов, а другой компонент - это инициатор или взвесь солей, например, Са2+ в том случае, когда гелеобразующая система создана на основе альгината.
В некоторых вариантах исполнения, игла для этого шприца может быть такой, которая подходит для выполнения тонкоигольной пункционной биопсии. Не ограничивающие общности примеры шприцов и игл для таких реализаций описаны в патенте США №7,871,383, в публикации патента США №20040162505 и в ссылочных материалах, приведенных в этих патентах. Такие шприцы и иглы могут с успехом быть использованы в процедурах, где забор ткани на биопсию выполняется совместно с визуализацией этой ткани при использовании состава по данному изобретению.
Комплект предпочтительно хранится не менее 6 месяцев, например, минимум 12 месяцев, если хранение происходит, например, при комнатной температуре (обычно 18-25°C) или при низких температурах, таких как, например, 2°C-10°C, или около 5°C. Срок хранения может быть, например, определен как период, в течение которого комплект может храниться при 25°C, относительной влажности воздуха 80% и атмосферном давлении в 1 атмосферу, и где вязкость состава сохраняется в пределах ±5% от исходной вязкости.
Метод регистрации рентгеновского изображения тела животного или человека
Настоящее изобретение также предусматривает способ регистрации рентгеновского изображения тела млекопитающего, заключающийся в том что:
(a) предусматривается состав, состоящий из органической гелеобразующей системы, которая является однородной жидкостью до инъекции и включает органический рентгеноконтрастный агент, например йодированное соединение, обнаруживаемое при рентгеновской визуализации.
(b) состав вводится в тело субъекта исследования, и
(c) регистрируются рентгеновские изображения, такие как изображения компьютерной томографии (КТ) или двухмерные рентгеновские изображения.
В одном примере осуществления этот метод предназначается для совместной лучевой терапии и рентгеновской визуализации ткани-мишени объекта, где изображения по этапу (с) обеспечивают определение ткани-мишени, и далее содержит этап
(d) используется определение ткани-мишени, полученное на этапе (с) для направления внешнего луча радиотерапии на ткань-мишень.
Ткань-мишень - это обычно ткань, которая содержит нежелательно растущие клетки. В одном варианте воплощения нежелательно растущие клетки являются клетками опухоли, например клетками злокачественного новообразования, и объект терапии страдает от ракового заболевания или подвержен риску ракового заболевания. В одном частном примере осуществления этот нежелательный рост клеток связан с раком легких, раком простаты, раком шейки матки или раком яичников. Другие типы условий или заболеваний, связанные с нежелательным ростом клеток, включают внематочную (эктопическую) беременность, доброкачественные опухоли мозга, такие как доброкачественные опухоли, расположенные близко к оптическому нерву, железы со сверхсинтезом гормона, такие как, например, гипоталамус, кость и хрящ в связи со сдавливанием нерва, клетки крови, которые могут быть убиты перед трансплантацией, условия, связанные с большими гландами, такие как острый тонзиллит или аденоиды, обструктивное апноэ, обструкция дыхательных путей носоглотки, храп, или перитонзиллярный абсцесс или гиперплазированные или ангиогенные заболевания глаз.
В тех примерах реализации, где гелеобразующая система переходит в состояние геля после добавления инициатора, этап введения (а) или (b) может также включать смешивание с инициатором гелеобразования.
Состав, созданный согласно данному изобретению, может быть введен парентерально, например, внутривенно, внутримышечно, интраспинально, чрезкожно, интраартериально, интракардиально, внутрикостно, внутрикожно, интрацистарнально, интратекально, внутрицеребрально, трансдермально, трансмукозально, ингаляционно, эпидурально, сублингвально, в стекловидное тело, интраназально, интраректально, интравагинально или интраперитонеально. Парентеральный ввод может быть выполнен, например, инфузионно или инъекционно.
Обычно состав вводится в предварительно определенное место или радом с ним, например, в ткань-мишень, в некоторых случаях в связи с биопсией этой ткани.
Объем состава, который вводится млекопитающему или человеку на этапе (с), может быть установлен имеющим опыт в этой области специалистом, принимая во внимание природу исследования и размер визуализируемой области. Обычно назначается объем в 100 микролитров. В разных конкретных примерах осуществления этот метод включает введение состава в объеме от 100 мкл до 20 мл, например от 200 мкл до 10 мл, например от 200 мкл до 2 мл.
На этапе (с) обычно регистрируется рентгеновское изображение, по крайней мере, части тела млекопитающего, включающей и предварительно определенное положение. В некоторых вариантах реализации, этапы (с) и (d) могут выполняться одновременно, так что визуализация и лучевая терапия объединяются и выполняются последовательно или одновременно.
Использование состава в качестве уплотнителя тканей
По данному изобретению также предусматривается использование определенного выше состава в качестве уплотнителя тканей, например для перекрытия созданных иглой каналов при биопсии, которая проводится в связке с визуализацией по данному изобретению.
Такой уплотнитель тканей может включать эффективное количество кровоостанавливающего средства, например, средства, выбранного из факторов свертывания крови, инициаторов коагуляции, инициаторов тромбоцитов, сосудосуживающих факторов и ингибиторов фибринолиза, например, эпинептрина, адренохрома, коллагенов, тромбина, фибрина, фибриногена, окисленной целлюлозы и хитозана.
Конкретные реализации изобретения
Как указывалось выше, настоящее изобретение в одном из своих осуществлений представляет собой рентгеноконтрастный состав для местного применения, который проявляет контрастные свойства и, по меньшей мере, 60% введенного количества упомянутого рентгеноконтрастного состава остается в течение более чем 24 часов в пределах 10 см от точки инъекции этого рентгеноконтрастного состава в тело человека или животного. Существуют разные формы введения и возможные пути введения состава, такие как, но не только, подкожные инъекции, введение с помощью бронхоскопа, гастроскопа или любого другой гибкой проводной системы, используемой для продвижения внутри тела, распыление или просто добавление в открытую рану, прикрепление к другой такой системе, внутричерепной инъекцией, в наполненные воздухом и жидкостью органы или полости (например, селезенку, желудок), или в естественные или медицинским способом созданные полости.
Кроме того, существуют различные формы дозировки, такие как, но не только, быстрые инъекции (шарика) с возвратом назад за иглой при инъекции, медленная инъекция на месте (например, менее чем за 5 секунд, 60 с, 120 с, 5 минут, 10 минут или менее 20 минут), инъекция толчками, вводя иглу и нагнетая под постоянным давлением в течение определенного периода. Более того, существуют различные устройства, которые можно для этого использовать, такие как, но не только, игла с 1 или более отверстиями на конце иглы, образующими многочисленные мелкие объекты, гибкие многокамерные системы. В одной из реализаций, настоящее изобретение обладает гелеобразующими свойствами и представляет собой жидкость до введения и обладает способностью переходить в гель после введения. В одном конкретном примере осуществления настоящее изобретение имеет гелеобразующие свойства и представляет собой однородную жидкость до введения и обладает способностью переходить в гель после введения. Кроме того, в одном примере осуществления настоящее изобретение представляет собой неколлоидное рентгеноконтрастное вещество как часть однородного жидкого рентгеноконтрастного состава, который переходит в гель после введение в тело человека или животного. Еще в одном конкретном примере осуществления, рентгеноконтрастный состав является жидкостью до введение в тело человека или животного и вязкость этой жидкости возрастает на более чем 100 сантипуаз (СП), например на более чем 1000 сП, более чем 2000 сП, или более чем на 5000 сП после введения в тело человека или животного. По еще одному конкретному примеру осуществления настоящего изобретения рентгеноконтрастный состав до введения в тело человека или животного является жидкостью, вязкость которой возрастает на более чем 10000 сантипуаз (сП) после введения в тело человека или животного. В другой конкретной реализации настоящее изобретение имеет вязкость менее 10000 сантипуаз (сП) при 20°C.
Кроме того, с позиций настоящего изобретения, рентгеноконтрастный состав содержит рентгеноконтрастный агент, являющийся частью рентгеноконтрастного состава, причем упомянутый рентгеноконтрастный агент является органическим веществом. По одному конкретному примеру воплощения это органическое вещество является контрастным «агентом» и этот рентгеноконтрастный состав включает альгинат и хитозан. В другом конкретном примере осуществления рентгеноконтрастный состав включает один или более природных полимеров, синтетических полимеров, олигомеров, липидов, сахаридов, дисахаридов, полисахаридов, пептидов или любую их комбинацию и, как отмечено ранее, они могут быть контрастным «агентом». В еще одном конкретном варианте осуществления настоящего изобретения этот рентгеноконтрастный агент включает один или более йодированных полимеров, олигомеров, липидов, сахаридов, дисахаридов, полисахаридов, пептидов или их производное или их комбинацию. Кроме того, в одном варианте реализации этот рентгеноконтрастный агент является неорганической кислотой или солью, такой как золотохлористоводородная кислота.
Настоящее изобретение в одном осуществлении может включать в себя частицы для достижения различных целей. Одной целью может быть дополнительный контрастный эффект; другой целью может быть усиление эффекта, а третьей целью может быть использование в качестве носителя, например, лекарства или других веществ. В одном конкретном варианте осуществления настоящего изобретения этот рентгеноконтрастный агент включает в себя наночастицы, включающие золото (Au). В еще одном варианте осуществления этот рентгеноконтрастный состав включает также частицы размером от 1 нм до 1000 нм, например частицы размером от 2 до 500 нм, и в одном конкретном осуществлении эти наночастицы включают золото (Au), как предпочтительный элемент ослабления рентгеновского излучения. В еще одном осуществлении рентгеноконтрастный состав содержит наночастицу, которая может быть контрастным агентом визуализации в МРТ, ПЭТ, ультразвуковой визуализации, флуоресцентных исследованиях, исследованиях на радиочастоте и в видимом свете. Кроме того, еще в одной конкретной реализации наночастица является контрастным агентом визуализации в МРТ или ПЭТ или в комбинации вышеупомянутых методов визуализации.
Настоящее изобретения может в одной реализации содержать твердые частицы, покрытые составом SH-PNIPAM (MW 350). Выбрав PNIPAM в качестве материала покрытия можно придать частицам различные интересные свойства. PNIPAM обладает более выраженными гидрофобными свойствами по сравнению, скажем, с PEG, но все еще остается водорастворимым, что позволяет эффективно и достаточно просто покрывать частицы в водном растворе без предварительного извлечения в органических растворителях. Кроме того, PNIPAM в качестве материала покрытия создает нанокомпозит, который может быть сублимирован в порошок без необходимости стимулировать агрегирование частиц и т.п., что невозможно сделать с другими полимерами, например с PEG. Наличие твердых частиц в форме порошка дает массу самых разных преимуществ в смысле повышенной стабильности, облегчения хранения и упрощения процедур приготовления состава. Более того, присутствие PNIPAMa в качестве единственного полимера на твердых частицах позволяет законсервировать эти частицы в виде суспензии в органических растворителях, таких как, например, этиловый спирт, на длительное время без агрегирования благодаря повышенной гидрофобности покрытых частиц, которую сообщает полимер PNIPAMa. Наличие PNIPAMa прикрепленного к твердым частицам в качестве единственного полимера в составе повышает гидрофобные взаимодействия с гелеобразующим раствором в виде, например, изобутирата ацетата сахарозы (SAIB), создавая в результате систему для введения в организм с очень высокой способностью удерживания частиц. Выбор более гидрофобного материала для покрытия частиц может спровоцировать выход твердых частиц из гелиевой матрицы, и это может стать как преимуществом, так и недостатком, в зависимости от желаемых свойств приготовляемого состава.
Как упомянуто выше, настоящее изобретение может иметь гелеобразующие свойства, и образование геля может быть инициировано различными факторами, такими так, но не только, температура, гидратация, ферментативная активация, ионная концентрация и/или pH. В одной реализации гелеобразование рентгеноконтрастного состава начинается в ответ на температуру от 35 до 40°C. В другой реализации гелеобразование рентгеноконтрастного состава начинается в ответ на гидратацию. В еще одном воплощении гелеобразование рентгеноконтрастного состава начинается под воздействием ионов в концентрации от 1 микромоля до 500 миллимолей, например в диапазоне от 1 мМ до 200 мМ. В одной реализации эти ионы являются двухвалентными ионами, такими как ионы кальция. В одной реализации гелеобразование рентгено-контрастного состава начинается в ответ на уровень pH от 6 до 8. В еще одной реализации гелеобразование рентгеноконтрастного состава начинается в ответ на контакт с инициатором гелеобразования, и здесь инициаторы могут быть разные, такие как, но не только, ионы, или химически активные соединения, которые производят поперечную сшивку других молекул.
В одной реализации рентгеноконтрастный состав по данному изобретению может содержать радиоактивные соединения, парамагнитные соединения, флуоресцентные соединения или ферромагнитные соединения, или любую смесь из вышеуказанных соединений.
Как отмечено выше, рентгеноконтрастный состав может также действовать как переносчик веществ, таких как лекарственные вещества, но не только. Эти вещества могут быть включены в состав или в наночастицы, или в покрытие наночастиц, или связаны с наночастицами. Эти вещества могут представлять собой также другие типы добавок. Примерами таких веществ могут быть, но без ограничения приведенного ниже перечня, препараты для химиотерапии, гемцитабин, цисплатин, доксорубицин, доранидазол, гормоны или антитела. В одной из реализаций рентгеноконтрастный состав содержит минимум одно фармацевтическое вещество. В одной конкретной реализации рентгеноконтрастный состав содержит частицы размером от 1 нм до 1000 нм, например, наночастицы размером от 2 до 500 нм, и где частица содержит, по меньшей мере, одно фармацевтическое вещество.
В одном примере осуществления изобретения полимер может быть использован, чтобы действовать как стабилизатор в системе между гелем и биологическим окружением, и поэтому рентгеноконтрастный состав может также содержать молекулу, которая повышает стабильность геля в теле человека или животного. Это могут быть молекулы, активные на поверхности раздела, такие как амфифильные молекулы, например эмульсификаторы. Поэтому в одной из реализаций рентгеноконтрастный состав содержит поли(этиленгликоль-b-капролактон) (PEG-PCL), изобутират ацетата сахарозы (SAIB), поли(D,L-молочную кислоту) (PLA), или поли(молочную-ко-гликолевую кислоту) (PLA), или комбинацию этих молекул.
В одном примере осуществления настоящего изобретения поли(D,L-молочную кислоту) (PLA) добавляют в гель изобутирата ацетата сахарозы (SAIB), обеспечивая этим снижение залпового высвобождения указанного инкапсулированного содержания, например, частиц лекарства и т.п. Еще в одной реализации рентгеноконтрастный состав содержит изобутират ацетата сахарозы (SAIB) или его производную, и в одном конкретном примере осуществления настоящего изобретения рентгеноконтрастный состав содержит йодированное производное изобутирата ацетата сахарозы (SAIB). Кроме того, в другом конкретном примере осуществления настоящего изобретения рентгеноконтрастный состав содержит йодированное производное изобутирата ацетата сахарозы (SAIB), подмешанное в изобутират ацетата сахарозы (SAIB). Эта композиция была исследована на стабильность, и относительное количество этого йодированного производного-SAIB/SAIB, которое может быть подмешано в SAIB, составляет, по меньшей мере, 50% по весу.
Это йодзамещенное производное SAIB обеспечивает высокий рентгенографический контраст. Этот йодированный SAIB полимер плохо растворяется в этаноле и представляет собой белый твердое вещество, тогда как нейодированный SAIB хорошо растворяется в этаноле и представляет собой вязкое маслообразное вещество. Однако смесь этанола и SAIB может сделать йодзамещенное производное SAIB достаточно хорошо растворимым. Это означает, что SAIB повышает растворимость йодзамещенного производного SAIB, что является очень интересной особенностью и обеспечивает пригодный для инъекции раствор, который после введения (через тонкую иглу, - тоньше чем номер 20G) образует биологически разлагаемую, аморфную, углеводородную, стеклянную матрицу, которая может использоваться как высококонтрастный рентгеновский маркер. После введения в мышь эта смесь йод-SAIB/SAIB обеспечивает высокий контраст и необходимые свойства стабильности геля. Кроме того, образуемый этой смесью гель однороден. В одной реализации настоящего изобретения рентгеноконтрастный состав включает йодированную производную изобутирата ацетата сахарозы (SAIB), растворенную в смеси этанола и изобутирата ацетата сахарозы (SAIB).
Одним из вариантов содержания и хранения этого состава может быть помещение его в шприц. Это означает возможный срок хранения не менее 6 месяцев. Одной из реализаций настоящего изобретения является комплект, состоящий из шприца, приспособленной для установки на его открытый конец иглы для инъекций в тело или для проведения хирургических процедур, таких как биопсия, но не только, и состава по настоящему изобретению.
В одном из осуществлений настоящего изобретения рентгеноконтрастный состав содержит йодированную производную изобутирата ацетата сахарозы (SAIB) и лекарственное вещество. В другом осуществлении рентгеноконтрастный состав содержит йодированную производную изобутирата ацетата сахарозы (SAIB) и частицу, которая содержит лекарственное вещество. Еще в одном осуществлении рентгеноконтрастный состав содержит йодированную производную изобутирата ацетата сахарозы (SAIB), растворенную в смеси этанола и изобутирата ацетата сахарозы (SAIB), и частицу, которая содержит фармацевтическое вещество. Еще в одном осуществлении настоящего изобретения рентгеноконтрастный состав содержит йодированную производную изобутирата ацетата сахарозы (SAIB), растворенную в смеси этанола и изобутирата ацетата сахарозы (SAIB), и лекарственное вещество. Кроме того, в одном конкретном осуществлении настоящего изобретения рентгеноконтрастный состав содержит йодированную производную изобутирата ацетата сахарозы (SAIB), растворенную в смеси этанола и изобутирата ацетата сахарозы (SAIB), и частицу, которая содержит лекарственное вещество.
Настоящее изобретение предполагается использовать для радиотерапии или лучевой терапии под визуальным контролем, но не только; возможны и другие способы использования, такие как, но не только, двухмерные рентгеновские снимки для анализа, диагностики, лечения и/или оценки качества лучевой терапии. Настоящее изобретение может быть использовано как биологический маркер и/или в качестве состава с контролируемой выдачей лекарства.
В одном из осуществлений рентгеноконтрастный состав по настоящему изобретению предназначен для введения в количествах 0,01-5,0 мл, а в одном конкретном осуществлении этот рентгеноконтрастный состав предназначен для введения в объеме 0,1-1,0 мл. В еще одной реализации состав по настоящему изобретению может быть использован как герметизирующий материал для биологических тканей.
В одном из осуществлений настоящего изобретения рентгеноконтрастный состав парентерально вводится в предварительно определенное положение в теле млекопитающего, и при этом регистрируется рентгеновское изображение, по меньшей мере, части тела млекопитающего, включающей это предварительно определенное положение. Далее, одна реализация настоящего изобретения может содержать способ регистрации рентгеновского изображения тела млекопитающего, заключающийся в том что:
a. приготовляют рентгеноконтрастный состав, содержащий органический рентгеноконтрастный агент в гелеобразующей системе;
b. вводят рентгеноконтрастный состав в определенное место в теле млекопитающего;
c. регистрируют полученные с помощью рентгеновских лучей изображения, по крайней мере, части тела, которая включает данное предварительно определенное место.
В другой реализации данное изобретение представляет способ совместной радиотерапии и рентгеновской визуализации ткани-мишени млекопитающего, заключающийся в том, что:
а. приготовляют рентгеноконтрастный состав, содержащий органический рентгеноконтрастный агент в гелеобразующей системе;
b. вводят рентгеноконтрастный состав в определенную ткань-мишень в теле млекопитающего;
c. регистрируют полученные с помощью рентгеновских лучей изображения, по крайней мере, части тела, которая включает данную ткань-мишень, обеспечивая таким образом определение этой ткани-мишени; и
d. используют определения ткани-мишени, полученные на стадии (с), для направления луча дистанционной радиотерапии на эту мишень.
Теоретически, этапы (с) и (d) могут выполняться одновременно.
В другой реализации изобретение представляет способ направления местного введения активных лекарственных веществ в ткань-мишень млекопитающего, заключающийся в том, что:
a. приготовляют рентгеноконтрастный состав, содержащий органический рентгеноконтрастный агент в гелеобразующей системе;
b. вводят рентгеноконтрастный состав в определенную ткань-мишень в теле млекопитающего;
c. регистрируют полученные с помощью рентгеновских лучей изображения, по крайней мере, части тела, которая включает ткань-мишень, обеспечивая таким образом определение этой ткани-мишени; и
d. используют рентгеноконтрастный состав из стадии (b) для добавления активного лекарственного вещества с целью его доставки к предварительно определенной ткани-мишени млекопитающего.
Теоретически, этапы (с) и (d) могут выполняться одновременно.
В одном конкретном осуществлении настоящего изобретения ткань-мишень содержит нежелательно растущие клетки, а в другом конкретном осуществлении изобретения ткань-мишень содержит клетки опухоли.
Подписи под рисунками
Рисунок 1. Показаны различные механизмы образования геля, включая системы образующие гель в ответ на воздействия температуры, ионов, pH, ферментов и гидратации.
Рисунок 2. Показаны различные системы, образующие гель в ответ на воздействие температуры, причем они обеспечивают обратный переход золя в гель, т.е. переход, происходящий при повышении температуры.
Рисунок 3. Показаны различные ионочувствительные гелеобразующие системы, которые образуют гели при высокой концентрации солей.
Рисунок 4. Показаны различные гелеобразующие системы, чувствительные к уровню pH, причем образующие гидрогели в конкретных интервалах pH.
Рисунок 5. Показаны различные ферментно-чувствительные системы, которые образуют гидрогели в присутствии определенных ферментов.
Рисунок 6. Показано использование изобутирата ацетата сахарозы (SAIB) как гелеобразующей системы чувствительной к гидратации. Раствор SAIB в органическом растворителе, таком как этанол, имеет низкую вязкость и поэтому подходит для инъекции через тонкие иглы. После гидратации этанол уходит из матрицы, и в результате создается очень вязкий гидрофобный гель, пригодный для инкапсулирования контрастных веществ.
Рисунок 7. Показаны различные йодозамещенные производные SAIB, которые могут быть использованы для ослабления рентгеновского излучения.
Рисунок 8. Представлена схема синтеза 2-(2,4,6-трийодофенокси)уксусной кислоты (3)
Рисунок 9. Представлена схема синтеза, 6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы (8)
Рисунок 10. Показан КТ-контраст (в единицах Хоунсфилда, HU) йодированных гелей с 10, 25 или 50 вес. % (8) (весовые проценты показывают умноженный на 100 вес атома или молекулы (в данном случае йода), деленный на общий вес материала) и отрицательный результат для контрольного холостого образца, содержащего MQ-H2O. Результаты получены на клиническом КТ сканере при различных энергиях: 80, 100, 120 и 140 кВ, все 200 мАс, 2 мм (кол. 40×0.6 мм).
Рисунок 11. Показан синтез AuNP и соответствующие характеристики. (А) Схема синтеза для получения покрытых PNIPAM ядер AuNP по технологии затравочных ядер. (В) Определение характеристик AuNP с помощью спектров поглощения в УФ и видимой области; (С) Определение характеристик AuNP методом динамического рассеяния света (DLS); (D) Описание характеристик AuNP с помощью ζ-потенциала.
Рисунок 12. Показана увеличенная стабильность ядер AuNP покрытых PNIPAM. (А) Спектры поглощения покрытых PNIPAM ядер AuNP в УФ и видимой области: до (базовый р-р) и после лиофилизации и повторного перевода в суспензию в безводном этиловом спирте (концентрация AuNP в диапазоне 1,0-5,0 мг Au/мл); (В) методом динамического рассеяния света (DLS) покрытых PNIPAM ядер AuNP: до (базовый р-р) и после лиофилизации и повторного перевода в суспензию в абсолютном этиловом спирте (концентрация AuNP в диапазоне 1,0-5,0 мг Au/мл).
Рисунок 13. Показан кумулятивный выход ядер AuNP покрытых PNIPAM3500 и PEG5000 из гелей, состоящих из SAIB/EtOH/PLA (75:20:5)+3,0 вес. % ядер AuNP покрытых PNIPAM3500 или PEG5000.
Рисунок 14. Ультразвуковая эхография состава B (SAIB/8/EtOH (55:25:20)) (250 мкл), исследованного в лабораторных условиях. Гель находился под водой на дне стеклянного лабораторного стакана.
Рисунок 15. Полученные компьютерной микротомографией снимки состава B (SAIB/8/EtOH (55:25:20)) (250 мкл), введенного подкожной инъекцией в здоровую мышь, исследованную на ЯМР томографе. (А) КТ снимок, сделанный через 24 часа после инъекции; (В) КТ снимок, сделанный через 48 часов после инъекции.
Рисунок 16. (А) Микротомографический снимок состава SAIB/8/EtOH (65:15:20), введенного подкожной инъекцией в иммунокомпетентную мышь. (В) Микротомографический снимок состава SAIB/8/EtOH (50:30:20), введенного подкожной инъекцией в иммунокомпетентную мышь; (С) Наблюдение извлеченного из тела мыши через 14 недель после инъекции состава SAIB/8/EtOH (50:30:20), находящегося в подкожном отделе. (D) Гелиевые импланты, состоящие из SAIB/8/EtOH (50:30:20), через 14 недель после имплантации в иммунокомпетентную мышь.
Рисунок 17. (А) Серия микротомографических снимков состава SAIB/8/EtOH (50:30:20), введенного в мышь подкожной инъекцией. Микросканы получены через короткие временные интервалы, чтобы отследить кинетику перехода йодсодержащего состава в гель. (В) Кинетика перехода в гель состава SAIB/8/EtOH (50:30:20) (50 мкл), введенного подкожной инъекцией в иммунокомпетентную мышь. (С) Кривые разложения в течение 100 дней (14 недель) йодсодержащих гелей состава SAIB/8/EtOH (65:15:20) или SAIB/8/EtOH (50:30:20), введенных подкожно в объеме 50 мкл.
Рисунок 18. КТ снимок состава (В) SAIB/8/EtOH (55:25:20), введенного в опухоль собаки компаньона (американский стаффордширский терьер, возраст - 9 лет вес - 34 кг) с опухолью мастоцита между передними ногами.
ПРИМЕРЫ
Пример 1 - Образование йодсодержащего SAIB геля и КТ контраст в пробирке
Материалы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному. 2-(2,4,6-трийодофенокси)-уксусная кислота (3) и 6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляная сахароза (8) были синтезированы в две и четыре стадии, соответственно, как показано на Рис. 7 и Рис. 8.
Синтез
2-(2,4,6-трийодофенокси)-уксусная кислота (3). 2,4,6-трийодофенол (1) (10,00 г.21,2 миллимоля) растворяли в осушенном диметилформамиде (ДМФ) (75 мл) в атмосфере азота. К этому раствору приливали трет-бутилбромоацетат (4,20 мл, 28, 46 мМ) и K2CO3 (8,79 г, 63,6 мМ) и перемешивали всю ночь при комнатной температуре. Растворитель удаляли под вакуумом, и оставшееся желтое масло повторно растворяли в EtOAc (150 мл) и промывали с MQ-H2O (3×150 мл). Органическую фазу высушивали с MgSO4, фильтровали и концентрировали под вакуумом, чтобы получить 2-(2,4,6-трийодофенокси)ацетат (2) в виде легкого желтого масла, которое использовали на следующей стадии синтеза без дальнейшей очистки. Соединение 2 растворяли в CH2Cl2 (60 мл) и приливали трифторуксусную кислоту (30 мл). Смесь перемешивали в течение часа при комнатной температуре, после чего растворитель отгоняли под вакуумом и получали в остатке белое твердое вещество. Этот неочищенный продукт подвергали рекристаллизации из этилового спирта и получали 2-(2,4,6-трийодофенокси)-уксусную кислоту (3) в виде тонких белых игл (9,58 г, 85% (2 стадии)). Химические сдвиги протонного ЯМР спектра раствора (3) в дейтерированном метиловом спирте (MeOD), снятого на приборе с частотой 300 МГц, следующие: δ 6,58 (s, синглет, 2Н), 2,95 (s, синглет, 2Н). Данные времяпролетной MALDI-TOF масс-спектрометрии с матрично-активированной лазерной десорбцией / ионизацией (2,5-дигидроксибензойная кислота(DHB) + Na+): химический состав: C8H5I3NaO3, расчетная масса - 552,83; найденная - 553,08 (M+Na+).
6,6'-TBDPS-сахароза (5). Сахарозу (4) (3,00 г, 8,76 мМ) растворяли в сухом пиридине (54,0 мл) в атмосфере азота. К этому раствору добавляли трет-бутилдифенилхлорсилан (TBDPS-CI) (2,51 мл, 9,64 мМ) и каталитическое количество диметиламинопиридина (DMAP) (107,5 мг, 0,88 мМ) и раствор нагревали при 70°C в течение 3 часов. После охлаждения до комнатной температуры прибавляли TBDPS-CI (2,51 мл, 9,64 мМ) и смесь перемешивали всю ночь при комнатной температуре. Растворитель отгоняли под вакуумом, а неочищенный продукт очищали с помощью флэш-хроматографии, используя ступенчатый градиент и, элюируя с (I) EtOAc, (II) EtOAc/ацетон/H2O (100:100:1) и (III) EtOAc/ацетон/H2O (10:10:1), в результате получили 6,5'-TBDPS-сахарозу (5) в виде белого твердого вещества (4,66 г.65%). Фактор ретенции Rf=0,40 (EtOAc/ацетон/H2O (100:100:1). Данные времяпролетной МАЛДИ масс-спектрометрии (DHB+Na+): химический состав C44H57NaO11Si2, расчетная масса 841,08; найденная 841,81 (M+Na+).
6,6'-TBDPS-изомасляная сахароза (6). 6,6'-TBDPS-сахарозу (5) (3,00 г, 3,66 мМ) растворяли в сухом пиридине (45,0 мл) в атмосфере азота. К этому раствору добавляли изомасляный ангидрид (15,00 мл, 90,4 мМ) и смесь перемешивалась всю ночь при комнатной температуре. К этой смеси добавляли дополнительное количество изомасляного ангидрида (5,0 мл, 15,06 мМ)и каталитическое количество 4-диметил-аминопиридина (DMAP) (50 мг, 0,41 мМ) и смесь нагревали при 70°C в течение 6 часов. Растворитель отгоняли под вакуумом, а неочищенный продукт очищали с помощью флэш-хроматографии, используя смесь гексана с EtOAc (5:1) в качестве элюента, и получили 6,6'-TBDPS-изомасляную сахарозу (6) в виде чистого бесцветного масла (4,54 г, количественно). Фактор ретенции Rf=0,48 (гексан/EtOAc (5:1). Данные времяпролетной МАЛДИ масс-спектрометрии (DHB+Na+): химический состав: C68H94NaO17Si2, расчетная масса 1262,62; найденная 1262,22 (M+Na+).
6,6'-ОН-изомасляная сахароза (7). 6,6'-TBDPS-изомасляную сахарозу (6) (217,2 г, 0,175 мМ) растворяли в ТГФ (940 мл) и перемешивали при комнатной температуре. В колбу прибавляли безводную уксусную кислоту (42,1 г, 0,701 мМ) и после этого добавляли фторид тригидраттетрабутиламмония (TBAF⋅3H2O) (221,1 г, 0,701 М) в ТГФ (592 мл). Раствор перемешивали при комнатной температуре в течение 15 часов, после чего добавляли гептан (2085 мл) и фосфатный буфер (0.5 М, 2111 мл), H2KPO4 (177,2 г) и HK2PO4 (343,3 г) в MQ-H2O (6544 мл)) при pH 7,0. Органическую фазу собирали и промывали в двух дополнительных порциях фосфатного буфера (0,5 М, 2111 мл). Неочищенный продукт очищали с помощью флэш-хроматографии, используя градиентное элюирование, начинающееся со смеси гексана с EtOAc (7:3), а потом - смеси гексана с EtOAc (6:4), в качестве элюента, и получили на выходе 6,6'-ОН-изомасляную сахарозу. (7) в виде прозрачного вязкого масла (106,1 г, 79%). Фактор ретенции Rf=0,21 (гексан/EtOAc (3:1)). Химические сдвиги (δ) и константы расщепления (J) протонного ЯМР (ПМР) спектра раствора (7) в дейтерированном диметилсульфоксане (DMSO-d6), снятого на приборе с частотой 300 МГц, δ 5,75 (d, дублет, J=6,1 Гц, 1Н), 5,50 (d, дублет, J=3,6 Гц, 1Н), 5,40 (d, дублет, J=7,7 Гц, 1Н), 5,31 (t, триплет, J=7,4 Гц, 1Н), 5,18 (t, триплет, J=9,8 Гц, 1Н), 4,87 (t, триплет, J=5,5 Гц, 1Н), 4,70 (d,d, дублет дублетов, J=10,4, 3,7 Гц, 1Н), 4,29 (d, дублет, J=11,9 Гц, 1Н), (d,d, дублет дублетов, J=12,0, 5,5 Гц, 1Н), 3,69-3,44 (m, мультиплет, 4Н). 2,64-2,49 (m, мультиплет, 6Н), 1,13-0,96 (m, мультиплет, 36 Н). Данные времяпролетной МАЛДИ масс-спектрометрии (DHB+Na+): химический состав: C36H58NaO17, расчетная масса 785,83; найденная 785,82 (M+Na+).
6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляная сахароза (8). 6,6'-ОН-изомасляную сахарозу (7) (800 мг, 1,05 мМ) растворяли в сухом ДМФ (10,0 мл) в атмосфере азота. К этому прстаору прибавляли предварительно подготовленную смесь 2-(2,4,6-трийодофенокси)-уксусной кислоты (3) (167 г.315 мМ), EDC-HCI (622 мг.3,15 мМ) и диметиламинопиридина (DMAP) (769 мг, 629 мМ) в сухом ДМФ (10,0 мл) и реакция продолжается при комнатной температуре и перемешивании всю ночь. Растворитель удаляли под вакуумом и оставшееся желтое масло повторно растворяли в CH2CI2 (40 мл) и промывали с MQ-H2O (3×40 мл). Органическую фазу высушивали с MgSO4, фильтровали и концентрировали под вакуумом и получали светло-желтое масло. Окончательную фильтрацию проводили с помощью флэш-хроматографии, используя смесь гексана с EtOAc (5:1) в качестве элюента, и получили на выходе 6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляную сахарозу (8) в виде белого вспененного твердого вещества (1,56 г, 83%). Химические сдвиги и константы расщепления ПМР спектра соединения (8) в дейтерированном метиловом спирте (MeOD), снятого на приборе с частотой 300 МГц, δ 8,05 (синглет, 2Н), 8,04 (синглет, 2Н), 5,68 (d, дублет, J=3,7 Гц, 1Н), 5,56 (d, J=7,3 Гц, 1Н), 5,54-5,48 (m, мультиплет, 1Н), 5,43 (t, триплет, J=7,2 Гц, 1Н), 5,37 (t, триплет, J=9,8 Гц, 1Н), 5,03 (d,d, дублет дублетов, J=10,2, 3,7 Гц, 1Н), 4,70-4,06 (m, мультиплет, 12Н). 2,73-2,45 (m, мультиплет, 6Н), 1,36-1,04 (m, мультиплет, 36 Н). Данные времяпролетной МАЛДИ масс-спектрометрии (DHB+Na+): химический состав: C52H64I6NaO21, расчетная масса - 1809,47; определенная масса -1809,59 (M+Na+).
Приготовление геля
Готовили три состава на основе изобутирата ацетата сахарозы (по 600 мг каждый) с возрастающим количеством 6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляной сахарозы в соответствии с тем, как описано в следующей таблице.

Раствор SAIB в этаноле (90% в весовом отношении) взвешивали и смешивали с соединением 8 и абсолютным этиловым спиртом (см. таблицу выше). Смеси гомогенизировались в шаровой мельнице-мешалке для гомогенизации с течение 60 минут (на скорости 30 об/с) и центрифугировались в течение 20 с на скорости 5000 об/мин для удаления из составов воздушных пузырьков. Все составы были однородными прозрачными растворами с вязкостью, возрастающей как функция концентрации соединения 8 - все составы пригодны для инъекции через гиподермальные иглы №25G.
Йодированные гели (500 мкл) готовились из составов А-С впрыскиванием в пластиковые флаконы, содержащие MQ-H2O при 37°C. Водные растворы заменяли три раза и гели выдерживались в течение 12 дней при 37°C прежде чем на клиническом компьютерном томографе была проведена КТ визуализация и выполнены измерения контраста по шкале Хоунсфилда.
Измерение КТ контраста йодированных гелей в пробирке
Три йодированных геля, созданных с 10, 25 и 50 вес. % соединения 8, а также холостая проба, содержащая MQ-H2O, были визуально исследованы на клиническом компьютерном томографе на разных энергиях: 80, 100, 120 и 140 кВ, все 200 мАс 2 мм (кол. 40×0,6 мм). Полученные значения контраста в единицах Хоунсфилда (HU) показаны на Рис. 10 как функция энергии, и приведены в таблице ниже. Наблюдался прекрасный контраст в диапазоне 1300-10500 HU, менявшийся в зависимости от процентного содержания соединения 8 и приложенной энергии.

Как можно понять из изложенного выше, в соответствии с конкретной реализацией настоящего изобретения рентгеноконтрастный состав является жидкостью до введения в тело человека или животного и имеет концентрацию йода более 1,5 вес. % до инъекции, например 2-30 вес. %, например 3-25 вес. %, например 4-25 вес. %,
Пример 2. Синтез и улучшенные свойства покрытых PNIPAM ядер AuNP
Материалы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному. HAuCl4×3H2O приобретен у фирмы Wako Chemicals GmbH (г. Неусс, Германия), a SH-PNIPAM (мол. вес 3500, PDI=1,24) приобретен у фирмы Polymer Source (г. Дорвал. Канада).
Синтез AuNP. покрытие PNIPAM и определение характеристик частиц
Вся стеклянная посуда промывалась царской водкой. Тринатриевый цитрат быстро впрыскивался в кипящий раствор HAuCl4⋅3H2O (10 мл, 38,8 мМ) при энергичном перемешивании. Наблюдали незамедлительное изменение цвета со светло-желтого на винно-красный и продолжали нагрев в колбе с обратным холодильником в течение 15 минут, после чего раствор охлаждали до комнатной температуры. Полученные ядра AuNP (20 мл) добавляли в кипящий раствор HAuCl4⋅3H2O (2500 мл. 0,296 мМ) при энергичном перемешивании. После этого добавляли тринатриевый цитрат (11,2 мл, 38,8 мМ) и смесь дефлегмировали 30 минут, в результате чего наблюдали четкое изменение цвета с вино-красного на пурпуровый. Дополнительную порцию тринатриевого цитрата (100 мл, 38,8 мМ) добавляли в качестве стабилизатора и смесь нагревали еще один час. Раствор AuNP охлаждали до комнатной температуры и добавляли SH-PNIPAM3500 (40 мг, 11,4 мкМ) (6 молекул на квадратный нанометр поверхности AuNP), растворенный в этиловом спирте (5,0 мл). Реакционные смеси перемешивали всю ночь при комнатной температуре (Рис. 11А). Покрытые PNIPAM семена AuNP промывали MQ-H2O и концентрировали до объема приблизительно 2,3 мл (теоретически 65 мг AuNP/мл) центрифугированием (4500 об/мин, 45 мин/цикл). Все ядра AuNP, стабилизированные цитратом ядра AuNP и очищенные концентрированные и покрытые PNIPAM ядра AuNP были охарактеризованы спектрами поглощения в УФ и видимой области (Рис. 11B), методом динамического рассеяния света (DLS) (Рис. 11С); и с помощью ζ-потенциала (Рис. 11D). Концентрация Au концентрированных покрытых PNIPAM ядер AuNP определялась с помощью масс-спектрометрии с индукционной плазмой, использующей в качестве стандарта Au3+ (1000 мг/мл) в 5% HCI, вкалываемой вместе с 0,5 триллионными долями иридия (Ir) в качестве внутреннего стандарта. Концентрированные, покрытые PNIPAM ядра AuNP растворяли в царской водке и разбавляли 5% HCl до теоретических 666 триллионных долей (т.д.) Au3+. Концентрация покрытых PNIPAM ядер AuNP была определена на уровне 64 мг Au/мл. Покрытые PNIPAM ядра AuNP хранили при 5°C до дальнейшего использования.
Лиофилизация покрытых PNIPAM ядер AuNP и стабильность в органическом растворителе
Покрытые PNIPAM ядра AuNP (см. синтез выше) разбавляли MQ-H2O до 1,0, 2,5 или 5,0 мг Au/мл (500 мкМ каждого) и быстро замораживали, погружая в жидкий азот на 2 минуты. Образцы оставляли на ночь для сублимационной сушки (p<6,0×10-2 мбар) до образования блестящего порошка темного цвета. Лиофилизованные покрытые PNIPAM ядра AuNP растворялись в EtOH (0,50 мл) и несколько секунд перемешивались на вортексе. Эти частицы повторно полностью распределялись по объему в течение нескольких секунд, создавая темные окрашенные растворы. Морфология частицы исследовалась с помощью спектров поглощения в УФ и видимой части спектра (Рис. 12А) и метода динамического рассеяния света (DLS) (Рис. 12В). Для покрытых PNIPAM ядер AuNP не наблюдалось никаких признаков агрегирования или нестабильности ни во время лиофилизации, ни при солюбилизации в ЕtOН. Высушенный в вакууме порошок может легко храниться и развешиваться после хранения.
Пример 3. Контроль удерживания частиц в геле SAIB, использующем гидрофобность частицы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному. HAuCl4×3H2O приобретался у Wako Chemicals GmbH (г. Неусс, Германия), SH-PNIPAM (мол. вес 3500, PDI=1,24) приобретен у фирмы Polymer Source (г. Дорвал, Канада), a MeO-PEG5000-SH приобретался у фирмы Rapp Polymere GmbH (г. Тюбинген, Германия).
Синтез AuNP, покрытие полимером PEG5000 и определение характеристик частиц
Покрытые полимером PEG ядра AuNP (PEG5000) приготовлялись по схеме, описанной выше для покрытых PNIPAM ядер AuNP в Примере 2, только на этот раз с использованием покрывающего частицу полимера SH- PEG5000. Покрытые PEG частицы были охарактеризованы спектрами поглощения в УФ и видимом свете (λ=539) и величиной гидродинамического диаметра частиц по DLS (59,7±0.9 нм), а концентрация определялась с помощью масс-спектрометрии с индукционной плазмой (82,6 мг Au/мл).
Выход частиц AuNP из гелей SAIB/EtOH/PLA в искусственных условиях
Составы (по 1000 мг каждого), состоявшие из SAIB/EtOH/PLA (75:20:5)+3,0 вес. % покрытых PNIPAM3500 или PEG5000 частиц AuNP готовили как описано в таблице ниже.
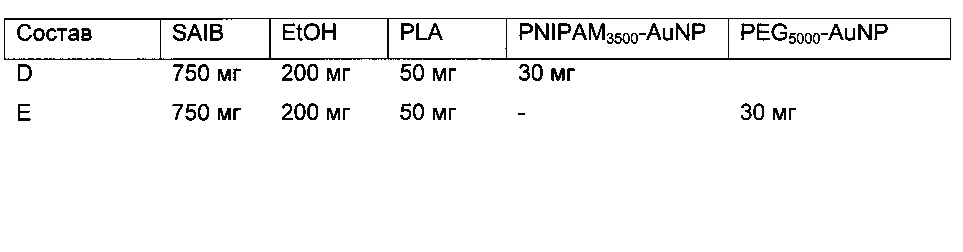
Компоненты геля смешивали и гомогенизировали в шаровой мельнице-мешалке (45 минут, 30 об/с) до получения прозрачного однородного раствора. Частицы AuNP (PNIPAM3500 или PEG5000) переносили в абсолютный этиловый спирт с раствором геля и перемешивали на вортексе. Исследование выхода частиц в искусственных условиях проводили впрыскиванием составов (3×200 мкл каждого) в содержащую MQ-H2O (10,0 мл для PNIPAM3500-AuNP) или PBS (для PEG5000-AuNP) стеклянную колбу при 37°C. Небольшие аликвоты (1,0 мл) отбирались по прошествии времени и заменялись свежими водными растворами. Количество вышедших частиц AuNP измерялось по корреляции со стандартной кривой поглощения в УФ и видимом свете, полученной для соответствующих частиц (Рис. 13). Для инкапсулированных гидрофильных покрытых PEG частиц наблюдался залповый выход (20%) в течение первых нескольких часов, тогда как более гидрофобные покрытые PNIPAM частицы AuNP оставались инкапсулированными в аморфной стеклянной матрице SAIB благодаря более сильным гидрофобным взаимодействиям с матрицей геля.
Пример 4, Образование йодсодержащего SAIB-геля с покрытыми PNIPAM частицами AuNP в пробирке
Материалы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному. HAuCl4×3H2O приобретался у Wako Chemicals GmbH (г. Неусс, Германия), SH-PNIPAM (мол. вес 3500, PDI=1,24) приобретался у фирмы Polymer Source (г. Дорвал, Канада), а 6,6'-(2,4,6-трийодофенокси) ацетокси-изомаслянаую сахарозу (8) получали синтезом по схеме, описанной в Примере 1.
Синтез AUNP, покрытие PNIPAM и определение характеристик полученных частиц
Покрытые PNIPAM частицы AuNP приготовляли по схеме, описанной в Примере 2.
Приготовление геля
Состав, состоявший из SAIB/8/EtOH (55:25:20) + 3,0 вес. % PNIPAM-AuNP, готовили как описано в таблице ниже.
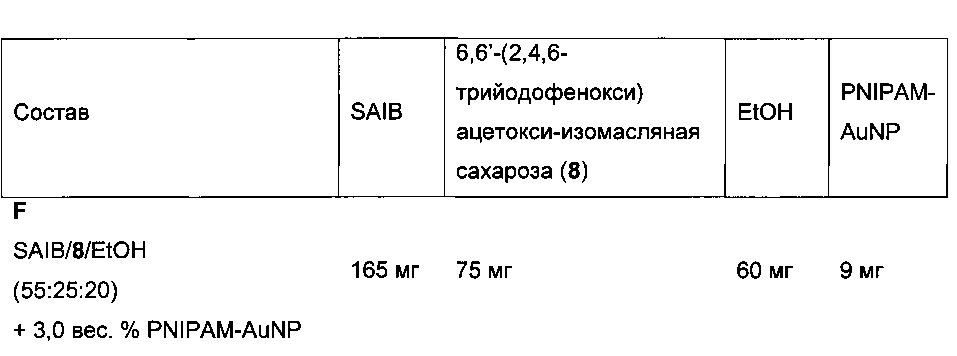
Раствор SAIB (90% по весу в EtOH) отвешивали и смешивали с соединением 8 (см. таблицу выше). Смесь гомогенизировали в шаровой мельнице-мешалке в течение 60 минут на скорости 30 об/с и центрифугировали 20 секунд на скорости 5000 об/мин для удаления пузырьков воздуха из составов. Покрытые PNIPAM частицы AuNP (14 мкл, 64 мг AuNP/мл) разбавляли MQ-H2O (1659 мкл) и лиофилизировали до получения блестящего порошка. Лиофилизированные покрытые PNIPAM частицы AuNP повторно распределяли в абсолютном этиловом спирте (52,8 мкл) и смешивали с другими компонентами геля.
Выход частиц AuNP в MQ-H2O
Йодированный гель (20 мкл) с 3,0 вес. % покрытых PNIPAM частиц AuNP (состав F) готовили впрыскиванием состава в содержащую MQ-H2O (10,0 мл) стеклянную колбу при 37°C. Небольшие аликвоты (1,0 мл) отбирались как функция времени и заменялись свежими MQ-H2O. Количество вышедших частиц AuNP измерялось по корреляции со стандартной кривой поглощения в УФ и видимом свете, полученной для покрытых PNIPAM частиц AuNP. На протяжении всего эксперимента не наблюдалась никакого выхода покрытых PNIPAM частиц AuNP. Состав F оставался однородным темноокрашенным раствором, пригодным для инъекции через гиподермические иглы №25.
Пример 5. Визуализация йодсодержащих SAIB гелей ультразвуковой эхографией в пробирке
Материалы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному, а 6,6'-(2,4,6-трийодофенокси)ацетокси-изомасляную сахарозу (8) получали синтезом по схеме, описанной в Примере 1.
Приготовление геля
Состав, состоявший из SAIB/8/EtOH (55:25:20) (350 мг), готовили как описано в Примере 1 (состав В). Йодированный SAIB гель (250 мкл) готовили впрыскиванием состава в содержащий MQ-H2O (500 мл) стеклянный стакан и гелю давали отстояться в течение 5 дней перед проведением ультрасонографического исследования. Ультразвуковое зондирование йодированного SAIB геля проводилась на ультразвуковом сканере (ВК Medical, г. Херлев, Дания) на следующих режимах Res/Hz 2/21 Гц, В Gain 83%, динамический диапазон 80 дб, подавление шума - 10, отсечка шума - 32. Йодированный SAIB гель был четко различим при ультрасонографической визуализации, как показано на Рис. 14.
Пример 6. Йодсодержащие SAIB гели как контрастные вещества КТ, вводимые в живой организм, - визуализация на иммунокомпетентных мышах
Материалы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному, а 6,6'-(2,4,6-трийодофенокси)ацетокси-изомасляную сахарозу (8) получали синтезом по схеме, описанной в Примере 1. Живые женские особи мышей стандарта NMRI (Морского медицинского НИИ, США) закупались у фирмы Taconic (г. Боруп. Дания).
Приготовление геля
Состав, состоявший из SAIB/8/EtOH (55:25:20) (900 мг), готовили как описано в Примере 1 (состав В).
Постановка эксперимента на животных
Состав B (SAIB/8/EtOH (55:25:20)) вводился здоровым мышам (женские особи стандарта NMRI, n=3) подкожной инъекцией (200 мкл каждой) под анестезией.
Микро-КТ визуализация введенных йодсодержащих SAIB гелей
Йодированные гели проходили визуальное исследование в динамике по времени с помощью компьютерной томографии (КТ). КТ снимки получали на приборе MicroCAT® II (фирмы Siemens Medical Solutions, г. Малверн, США). Прекрасный КТ контраст наблюдался на составе B (SAIB/8/EtOH (55:25:20)), как показано на Рис. 15А-В (КТ съемку производили 24 часа после инъекции и 48 часов после инъекции).
Пример 7. Йодсодержащие SAIB гели как контрастные вещества КТ, вводимые в живой организм, - долговременная стабильность и визуализация на иммунокомпетентных мышах
Материалы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному, а 6,6'-(2,4,6-трийодофенокси)ацетокси-изомасляную сахарозу (8) получали синтезом по схеме, описанной в Примере 1. Живые женские особи мышей стандарта NMRI (Морского медицинского НИИ, США) закупались у фирмы Taconic (г. Боруп. Дания).
Приготовление геля
Составы, состоявшие из (а) SAIB/8/EtOH (65:15:20) (750 мг) и (b) SAIB/8/EtOH (50:30:20) (750 мг), готовили как описано в Примере 1.
Постановка эксперимента на животных
Оба состава (а) SAIB/8/EtOH (65:15:20) и (о) SAIB/8/EtOH (50:30:20) вводились здоровым мышам (женские особи стандарта NMRI, n=2×8 мышей) подкожной инъекцией (50 мкл каждой) под анестезией.
Микро-КТ визуализация введенных йодсодержащих SAIB гелей визуализация после инъекции
Йодированные гели проходили визуальное исследование в динамике по времени с помощью компьютерной томографии (КТ). КТ снимки получали на приборе MicroCAT® II (фирмы Siemens Medical Solutions, г. Малверн, США). Прекрасный КТ контраст наблюдался на обоих составах: (а) SAIB/8/EtOH (65:15:20) и (b) SAIB/8/EtOH (50:30:20), как показано на Рис. 16А-В. Полученный в результате КТ-контраст соответствовал относительному содержанию йодсодержащего SAIB соединения (8) в исследуемом составе. Спустя 14 недель (100 дней) после имплантации животные были умерщвлены и соответствующие гели были извлечены из подкожного отдела (Рис. 16C-D). Йодированные гели имели хорошо выраженные формы, и их можно было легко удалять и переносить без риска разрушения. Кроме того, они были достаточно мягкими и легко деформировались с помощью скальпеля.
Кинетика гелеобразования у вводимых йодсодержащих SAIB составов
Кинетика гелеобразования йодсодержащих гелей состоящих из SAIB/8/EtOH (50:30:20) отслеживалась с помощью многократных экспериментов на микро-КТ сканере в течение первых нескольких часов после инъекции (Рис. 17А). На основе этих КТ снимков был рассчитан общий объем йодсодержащего геля как функция времени (Рис. 17В). Желирование йодсодержащего геля происходит в результате оттока EtOH из матрицы геля, который происходит в первые два часа после инъекции, обеспечивая, таким образом, быстрый рост вязкости йодсодержащего геля и увеличение КТ-контраста приблизительно на 35% вследствие сокращения объема геля.
Динамика разрушения введенных йодсодержащих SAIB гелей в течение 14 недель
Динамика деградации йодированных гелей, состоявших из (а) SAIB/8/EtOH (65:15:20) и (b) SAIB/8/EtOH (50:30:20) отслеживалась с помощью многократных экспериментов на микро-КТ сканере, проводившихся в течение 14 недель. На основе этих КТ снимков был рассчитан общий объем йодсодержащих гелей как функция времени (Рис. 17С). Между двумя исследованными составами не наблюдалось никакой разницы в динамике деградации, и для обоих составов наблюдался установившийся режим деградации. После начальной фазы оттока EtOH для обоих составов наблюдалась (с доверительным интервалом 95%) потеря объема со скоростью 0,0917 мкл/сутки.
Пример 8. Йодсодержащие SAIB гели как контрастные вещества КТ, вводимые в живой организм, - визуализация на собаке со спонтанной опухолью
Материалы
Химические материалы приобретались у фирмы Sigma-Aldrich Inc. (г. Брондбю, Дания), если не указано по-иному, а 6,6'-(2,4,6-трийодофенокси) ацетокси-изомасляную сахарозу (8) получали синтезом по схеме, описанной в Примере 1.
Приготовление геля
Состав, состоявший из SAIB/8/EtOH (55:25:20) (350 мг), готовили как описано в Примере 1 (состав В).
Постановка эксперимента на животных
Состав B (SAIB/8/EtOH (55:25:20)) был введен собаке компаньону (американский стаффордширский терьер, возраст - 9 лет вес - 34 кг) с опухолью мастоцита между передними ногами. Йодсодержащий SAIB гель был введен интраопухолевой инъекцией (500 мкл) с помощью иглы №25G.
КТ визуализация йодсодержащих SAIB гелей введенных собаке
Йодсодержащий SAIB гель визуально исследовался с помощью компьютерной томографии. КТ снимки получали на компьютерном томографе с послойным сканированием (фирмы Siemens Medical Solutions, г. Малверн, США). На составе B (SAIB/8/EtOH (55:25:20)), наблюдался прекрасный КТ контраст, показанный на Рис. 18 (КТ съемка производилась через 24 часа после инъекции).