Результат интеллектуальной деятельности: Штамм дрожжей Pichia pastoris - продуцент ксиланазы
Вид РИД
Изобретение
Изобретение относится к микробиологии и биотехнологии и касается получения рекомбинантного штамма дрожжей Pichia pastoris, способного продуцировать ксиланазу.
Ксилан является основным структурным полисахаридом растительных клеткок и вторым после целлюлозы наиболее распространенным полисахаридом в природе [Biotech. Genet. Eng. Rev. 1995, 13, 100-131]. Это комплексный полисахарид, основная цепь которого состоит из β-(1-4) связанного ксилозного скелета с небольшим количеством β- (1-3) ответвлений [Macromol Rapid Commun., 2000, 21(9), 542-556. doi: 10.1002/1521-3927(20000601)21:9<542::AID-MARC542>3.0.СО;2-7].
Основную роль в разрушении ксилана играет эндо-ксиланаза (эндо-1,4-β-ксиланаза, ЕС 3.2.1.8), которая катализирует случайный гидролиз ксилана до ксилололигосахаридов.
Ксиланазы широко используют в различных отраслях промышленности.
Так при кормопроизводстве введение ксиланаз уменьшает содержание некрахмальных полисахаридов, тем самым снижая вязкость корма в кишечнике животных и улучшая усвояемость и питательную ценность плохо разлагаемых кормов. [J. Anim. Sci, 2002, 80, 2773-2779; Br. Poult. Sci., 2003, 44, 60 - 66; Br. Poult. Sci., 2003, 44, 291-298]
Природными источниками ксиланаз являются различные микроорганизмы: бактерии, грибы, дрожжи и актиномицеты [FEMS Microbiology Reviews, 2005, 29 (1), 3-23].
Традиционно ферментные препараты, в состав которых входят ксиланазы, получают на основе нерекомбинантных или рекомбинантных штаммов грибов рода Trichoderma, Aspergillus или Penicillium. Однако грибные штаммы, помимо ксиланазы, продуцируют ряд других ферментов, относящихся к карбогидразам, а именно: целлюлазу, глюканазу, пектиназу и маннаназу, что не позволяет использовать их при производстве моноферментных препаратов.
Наиболее перспективным является создание продуцентов ферментов на основе рекомбинантных штаммов метилотрофных дрожжей Pichia pastoris, которые при использовании несбраживаемых источников углерода (глицерина, метанола и т.п.) способны к росту с образованием биомассы высокой плотности, что позволяет получать значительные количества гетерологичного белка [Appl. Microbiol Biotechnol, 2000, 54(6), 741-750]. При этом процесс культивирования метилотрофных дрожжей достаточно прост, поскольку их рост не блокируется продуктами метаболизма [FEMS Microbiol.Rev., 2000, 24:45-66, doi: 10.1111/j.1574-6976.2000.tb00532.x].
Известны рекомбинантные штаммы Pichia pastoris, продуцирующие ксиланазу из Streptomyces sp.FA1 [CN107142225А] и ксиланазу из Neocallimastix frontalis [CN104130951А] ксиланазу А из Bacillus licheniformis [Protein Expression and Purification 57 (2008), 101-107]
При этом, показано [Биотехнология, 2018, 34(4), 26-36], что гены ксиланаз различного происхождения экспрессируются в дрожжах Pichia pastoris с различной эффективностью
Известно также, что на уровень продукции гереторологических белков в клетках Pichia pastoris оказывают влияние мутации, присутствующие в составе хромосомы этих дрожжей.
Показано [Microb Cell Fact. 2012 Feb 13;11:22. doi: 10.1186/1475-2859-11-22], что штамм с делецией гена АОХ1 в хромосоме превосходит первоначальный штамм как в производительности, так и в эффективности экспрессии рекомбинантного белка пероксидазы хрена С1А.
Показано также [Molecular biology, 2000, V.16, 23-52], что деления гена АОХ1 в хромосоме дрожжей Pichia pastoris приводит к увеличению уровня продукции рекомбинантного белка. При этом уменьшается потребление метанола, что упрощает процесс ферментации и снижает себестоимость целевого белка [Gerd Gellissen, Production of Recombinant Proteins: Novel Microbial and Eukaryotic Expression Systems, 2005, John Wiley & Sons, p.150].
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих ксиланазу.
Задача решена путем конструирования штамма дрожжей Pichia pastoris Xy1-756 ВКПМ Y-4394 - продуцента ксиланазы, в составе хромосомы которого содержится ген xy1, кодирующий эндо-1,4-β-ксиланазу из Paenibacillus brasilensis, и инактивирован ген АОХ1.
Заявляемый штамм Pichia pastoris Xy1-756 получен путем интеграции экспрессионной кассеты, содержащей ген xy1 из Paenibacillus brasilensis, в состав хромосомы штамма Pichia pastoris ВКПМ Y-4392 и инактивации гена АОХ1
Штамм является продуцентом эндо-1,4-β-ксиланазы и депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика как Pichia pastoris Xy1-756 ВКПМ Y-4394.
Культурально-морфологические характеристики заявляемого штамма:
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %), клетки имеют овальную форму, 3 -4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее Истинного мицелия не образуют.
Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 1.0, ацетат натрия - 0.5, глюкоза - 1.0, агар - 2.0, вода - остальное. Аски имеют тетраэдрическую форму, включают 4 аскоспора.
На агаризованной среде YP с добавлением глюкозы (2 мас. %) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией.
При росте в жидкой среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода -остальное) с добавлением глюкозы (2 мас. %), при 28°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки:
Штамм способен к росту как в аэробных, так и в анаэробных условиях.
В качестве единственного источника углерода способен использовать метанол, этанол, глюкозу, глицерин, лактат, сукцинат, не способен ассимилировать мальтозу, сахарозу, ацетат, крахмал, лактозу.
При культивировании в присутствии метанола штамм способен синтезировать ксиланазу.
Штамм не способен к росту на минимальной среде с добавлением 4% метанола.
Изобретение проиллюстрировано следующими фигурами.
Фиг. 1 Экспрессионная кассета 1
Фиг.2 Кассета для инактивации гена А0Х1
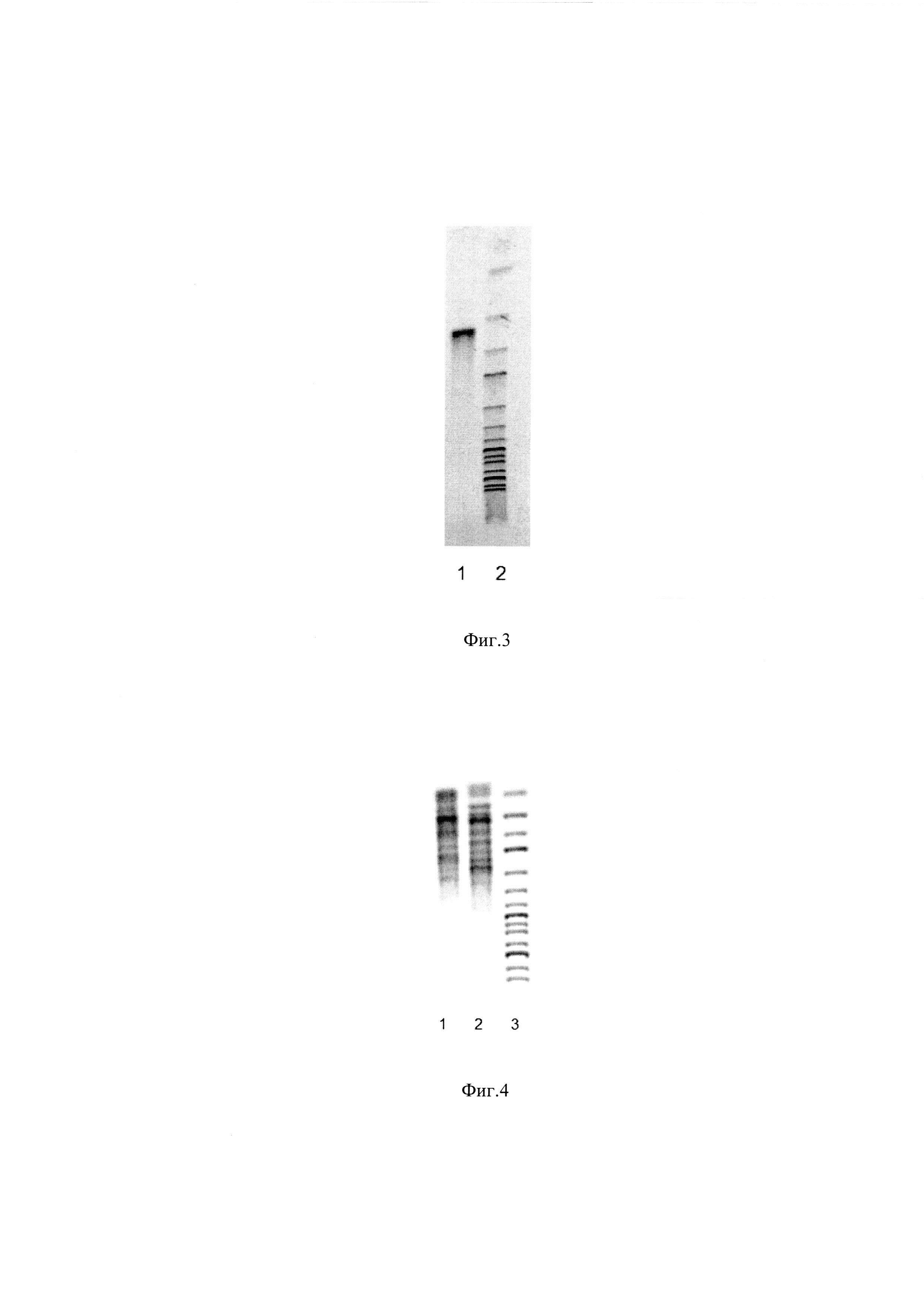
Фиг. 3 Электрофорез гена xy1 Paenibacillus brasilensis.
Фиг. 4 Фингерпринт штамма Pichia pastoris Xy1-756 ВКПМ Y-4394
Изобретение подтверждено следующими примерами.
Пример 1. Конструирование заявляемого штамма.
Конструирование штамма осуществляют в 2 этапа.
Этап 1. Получение штамма дрожжей Pichia pastoris содержащего ген xyl кодирующий ксиланазу из Paenibacillus brasilensis
Используя метод "фьюжн-пцр" [Gene., 1989, 15, 77(1), 61-68] конструируют интегративную экспрессионную кассету 1 (фиг.1), содержащую следующие генетические элементы:
1. Ген xyl Paenibacillus brasilensis, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактороа, под контролем АОХ1 промотора;
2. Терминатор транскрипции ТТАОХ1;
3. Дрожжевой селективный маркер kan, фланкированный сайтами 1ох 66 и 1ох 71, под контролем дрожжевого TEF промотора и обуславливающий у дрожжей Pichia pastoris устойчивость к антибиотику генетицину (G418) [Nature Biotechnology. - 1994. - Т. 12. -№. 2. - С.181];
4. Область интеграции - нуклеотидная последовательность гена АОХ2.
Указанную интегративную экспрессионную кассету методом электропорации [http://tools.thermofisher.com/content/sfs/manuals/pich_man.pdf] трансформируют в штамм Pichia pastoris ВКПМ Y-4392, полученный на основе штамма Pichia pastoris DSMZ 70877 интеграцией в хромосому кассеты Pcup-cre, состоящей из гена cre, кодирующего рекомбиназу бактериофага Р1 под контролем Рcup промотора из Saccharomyces cerevisiae.
Селекцию трансформантов ведут на агаризованной среде YP с добавлением глюкозы (2 мас. %) в течение 5 суток при температуре 30°С. В качестве селективного агента добавляют антибиотик G418 в количестве 500 мкг/мл.
Для отбора наиболее продуктивных трансформантов проводят их культивирование в жидкой ферментационной питательной среде YP с добавлением метанола (3 мас. %) в при 30°С в течение 72 ч на качалке (250 об/мин). В качестве контроля используют штамм Pichia pastoris Y-4392.
Определение активности ксиланазы в культуральной жидкости проводят с использованием ДНС метода [Anal. Chem., 1959, 31 (3), 426-428].
По результатам ферментации отбирают наиболее продуктивный трансформант №378, который при культивировании синтезирует наибольшее количество ксиланазы.
Для выщепления маркерного гена kanМХ из экспрессионной кассеты, интегрированной в хромосому трансформанта №378, проводят индукцию гена cre, кодирующего рекомбиназу бактериофага Р1 встроенного в хромосому штамма Pichia pastoris ВКПМ Y-4392 (Mut+, INS Pcup-cre) и находящегося под контролем промотора Рcup. Индукция происходит в присутствии ионов меди. Для этого клетки трансформанта №378 выращивают в жидкой питательной среде YP с добавлением глюкозы (2 мас. %), до концентрации 1×108 клеток на 1 мл, после чего добавляют раствор сульфата меди до концентрации 0,3 М, инкубируют в течении 3 часов, после чего клетки высевают на агаризованную питательную среду YP с добавлением глюкозы (2 мас. %). Отбирают колонии, не способные к росту в присутствии антибиотика G418.
В результате отобран трансформант Pichia pastoris 378 с выщепленным маркерным геном kanМХ, способный к синтезу фермента эндо-1,4-β-ксиланазы Paenibacillus brasilensis.
Этап 2 Инактивация гена АОХ1
Конструируют кассету для инактивации гена АОХ1 (фиг.2) содержащую следующие генетические элементы:
1. Дрожжевой селективный маркер kan, фланкированный сайтами lох 66 и 1ох 71, под контролем дрожжевого TEF промотора и обуславливающий у дрожжей Pichia pastoris устойчивость к антибиотику генетицину (G418);
2. Область интеграции - нуклеотидная последовательность гена АОХ1.
Указанную кассету трансформируют в штамм Pichia pastoris 378 с использованием метода электропорации
Селекцию трансформантов ведут на агаризованной среде YPD с добавлением глюкозы (2 мас. %) в течение 5 суток при температуре 30°С. В качестве селективного агента добавляют антибиотик G418 в количестве 500 мкг/мл.
Для отбора клонов с инактивированным геном АОХ1 используют агаризованную среду YNB (https://www.dia-m.ru/reactive.php?productid=253884) с добавлением метанола (4 мас. %). В качестве контроля используют трансформант Pichia pastoris 378.
Отбирают трансформант №756, не способный к росту на среде YNB в присутствии 4% метанола.
В отобранном трансформанте проводят выщепление маркерного гена kanМХ.
Отбирают колонии, не способные к росту в присутствии антибиотика G418.
Заявляемый штамм представляющий собой трансформант Pichia pastoris Xy1-756 с инактивированным геном АОХ1 способный к синтезу фермента эндо-1,4-β-ксиланазы Paenibacillus brasilensis, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика как Pichia pastoris Ху1-756_ВКПМ Y-4394.
Наличие в хромосоме заявляемого штамма вставки гена xy1 Paenibacillus brasilensis подтверждают методом полимеразной цепной реакции (ПЦР), для чего используют хромосомальную ДНК, выделенную из клеток заявляемого штамма и специфические праймеры Xy1P-f и Ху1Р-r


Режим реакции ПЦР:
95°С - 3 мин - 1 цикл
30 циклов:
95°С - 30 сек.
60°С - 30 сек.
72°С - 60 сек.
72°С - 5 мин. - 1 цикл
Для контроля величины амплифицированного фрагмента ДНК при электрофорезе использован молекулярный маркер GeneRuler 1 kb DNA Ladder (Fermentas) (линия 2, фиг. 3, размер фрагментов снизу вверх 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п. н.). Наработка фрагмента ДНК размером 552 п. н. (линия 1 фиг. 3) свидетельствует о присутствии в хромосоме заявляемого штамма вставки гена xyl Paenibacillus brasilensis
Результаты ПЦР-фингерпринта [Applied and Environmental Microbiology, Oct, 1999, 4351-4356] штамма Pichia pastoris Хуl-756_ВКПМ Y-4394 представлены на фиг 4.
Фингерпринт проведен с использованием полимеразной цепной реакции (PCR) с использованием неспецифических праймеров М13 (линия 1 фиг. 4) и 1254 (линия 2 фиг. 4).
Праймер М13 
режим реакции:
1 цикл
95°С -3 мин.
39 циклов
95°С -30 сек.
45°С -30 сек.
72°С- 2 мин.
1 цикл
72°С - 5 мин
Праймер 1254 
режим реакции:
1 цикл
95°С - 3мин.
39 циклов
95°С - 30 сек.
48°С - 30 сек.
72°С - 1 мин.
1 цикл
72°С - 5 мин
Для контроля величины фрагментов ДНК при электрофорезе использован молекулярный маркер 1kb DNA GeneRuler (Fermentas) (линия 3, фиг. 4 размер фрагментов снизу вверх 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п. н.).
Пример 2. Продукция ксиланазы заявляемым штаммом.
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке с 250 об/мин. Посев ферментационной среды осуществляют в соотношении 1/10.
Ферментацию проводят при 30°С на качалке (250 об/мин) в питательной среде состава (мас. %): дрожжевой экстракт - 0,5, пептон - 1, вода - остальное с добавлением глюкозы (1 мас. %) в пробирках (50 мл) с рабочим объемом 5 мл. Через 18 часов добавляют метанол (1 мас. %) Ферментацию продолжают в течение 72 часов, добавляя метанол (1 мас. %) через каждые 24 часа. После окончания ферментации определяют количество фермента ксиланазы в культуральной жидкости с использованием ДНС метода [Anal. Chem., 1959, 31 (3), 426-428].
Через 72 часа ферментации количество фермента составило 1728 ед/мл культуральной жидкости.
Штамм дрожжей Pichia pastoris ВКПМ Y-4394 с инактивированным геном АОХ1 и содержащий ген xyl, кодирующий эндо-1,4-β-ксиланазу Paenibacillus brasilensis - продуцент ксиланазы.