Результат интеллектуальной деятельности: Способ модификации поверхности биоразлагаемых полимерных материалов
Вид РИД
Изобретение
Изобретение относится к области химии полимеров и медицины, а именно к способу модификации поверхности биоразлагаемых полимерных материалов, для придания им заданных свойств (гемосовместимости, тромборезистентности, ускоренной эндотелизации, антибактериальных или противовирусных свойства и др.) для применение в медицинской промышленности для создания, например, протезов кровеносных сосудов, сосудистых заплат для артериальной реконструкции или создания лекарственных форм препаратов с пролонгированным сроком действия.
В современной медицине широко используются различные биоразлагаемые полимерные материалы. В частности, биоразлагаемые полимеры используются для реконструкции кровеносных сосудов. Наноразмерные частицы из биоразлагаемых материалов широко используются при создании средств направленной доставки лекарственных препаратов. Использование полимеров в системе кровообращения выдвигает к ним ряд требований, основное из которых -гемосовместимость. В тоже время к полимерам могут предъявляться и другие требования в зависимости от конкретных решаемых задач.
В настоящее время для придания полимерным материалам, контактирующих с кровью, заданных свойств, используются различные подходы. Так, например, для придания полимеру, из которого изготовлен сосудистый протез, антибактериальных свойств, изделие погружают в насыщенный раствор спирторастворимого антибиотика на 24-72 ч, перед использованием извлекают и помещают в 1%-ный раствор клея «Сульфакрилат» (патент RU 2141280 С1, опубл. 20.11.1999).
Близкий по смыслу подход введения биологически активных веществ в сосудистый протез, изготавливаемый методом электроспининга, предложен в патентной заявке US 2014/0309726 А1, опубл. 16.10.2014. Представленный сосудистый трансплантат содержит внутренний слой, выполненный из биоразлагаемого полиэфирного соединения - полиглицеролсебаката, и наружную оболочку, выполненную из поликапролактона и/или полимеров или сополимеров гликоевой и молочной кислоты. Для снижения тромбогенных свойств импланта и повышения его биосовместимости, внутреннюю поверхность обрабатывают раствором гепарина, а наружную оболочку пропитывают любыми биологически активными компонентами, способствующими регенерации тканей (например, фактором роста стволовых клеток (SCF), сосудистым эндотелиальным фактором роста (VEGF) и др.).
Недостатком известного способа является не контролируемое высвобождение адсорбированных компонентов. Кроме того, прямая адсорбция гепарина на полимерах не обеспечивает достаточной тромборезистентности, поскольку, с одной стороны, взаимодействие "гидрофобная поверхность полимера - гидрофильная молекула гепарина" является слабым, а, с другой стороны, гепарин имеет большое сродство к ряду составляющих крови, что приводит к его быстрому удалению с полимерной поверхности.
Для замедления высвобождения лекарственного средства из состава полимерного материала предложен способ получения микроволокнистого сосудистого протеза методом электроспининга, где лекарственное средство в растворе диметилсульфоксида (паклитаксел, сиролимус или диклофенак) непосредственно вводят в исходный раствор полимера (патент RU 2669344 С1, опубл. 10.10.2018).
Однако применение диметилсульфоксида может приводить к изменению физических характеристик полимера, что может иметь критическое значение при создание сосудистых протезов или иных изделий для артериальной реконструкции.
В ряде работ предложен способ ковалентного присоединения факторов клеточной адгезии - пептидов, содержащих RGD-фрагмент, к биоразлагаемым поверхностям тканеинженерных сосудистых графтов на основе поликапролактона (Gabriel М, et. al. Biomater. Direct grafting of RGD-motif-containing peptide on the surface of polycaprolactone films. // Journal of Biomaterials Science. Polymer Edition, 2006, Vol. 17, No. 5, pp. 567-577). Способ включает двухэтапную модификацию поверхности, где на первом этапе полимер обрабатывают 40% водным раствором этилендиамина, а на втором этапе выполняют модификацию поверхности пептидом, содержащим RGD фрагмент (Gly-Arg-Gly-Asp-Ser), используя в качестве кросс-сшивающего агента глутаровый альдегид.
Недостатком способа является использование глутарового альдегида, приводящего к образованию цитотоксичных продуктов (Hass, V. et. al. Collagen cross-linkers on dentin bonding: Stability of the adhesive interfaces, degree of conversion of the adhesive, cytotoxicity and in situ MMP inhibition. // Dent Mater 32, 732, 2016), а также способствующего кальцификации (Fahrenholtz, M.M. et.al., Development of a heart valve model surface for optimization of surface modifications. Acta Biomater, 2015, V. 26, P. 64) и развитию воспалительных процессов (Delgado, L.M. et. al., To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. // Tissue Eng Part В Rev, 2015, V. 21, P. 298).
Известно, что ключевым моментом, влияющим на процесс свертывания крови в сосудистых протезах и заплатах является адсорбция на поверхности полимеров белков (Смурова Е.В., Доброва Н.Б. Создание полимерных материалов с тромборезистентными свойствами, Химия и технология высокомолекулярных соединений, Москва, ВИНИТИ, 1976, т. 10, с. 30-60), которая бывает благоприятной и неблагоприятной. Так, адсорбция человеческого сывороточного альбумина (ЧСА) несколько ингибирует дальнейшие этапы свертывания крови на полимерной поверхности, а адсорбция фибриногена, напротив, ускоряет процесс свертывания крови.
Наиболее близким к заявляемому способу - прототипом, является способ получения тромборезистентных полимерных материалов, контактирующих с кровью путем их последовательной обработки поверхностно-активным веществом (ПАВ), затем гепарином, затем глутаровым альбумином, при этом в качестве ПАВ используют 1-2% раствор альбумина человека или 0,5% раствор фибриногена, а обработку ими проводят при 30-40°С в течение 1,5-2,5 часа, отмывают материал водой, с последующей сорбцией гепарина на альбуминизированной поверхности и «сшивки» гепраин-альбумин путем обработки глутаровым альдегидом. Обработку гепарином производят из водного раствора с концентрацией 40-5000 ед/мл при 30-40°С в течение 1-1,5 часа, а глутаровым альдегидом при 50-60°С в течение 15-30 минут (SU 1097336 А1, опубл. 15.06.1984). Данный способ позволяет избежать сорбции на поверхности полимеров нежелательных белков, ускоряющих свертывание крови.
Недостатком способа является использование токсичного реагента (глутарового альдегида) и применение высокой температуры (50-60°С). Кроме того, сорбция альбумина в значительной степени зависит от типа используемого полимера и в случае использования биоразлагаемых полимеров на основе полигидроксибутирата/валерата (PHBV) и поликапролактона (PCL) эффективность сорбции в физиологических условиях может оказаться недостаточной для существования модифицированного слоя в течении продолжительного времени.
Задачей изобретения является разработка способа, обеспечивающего возможность получения стабильной в физиологических условиях альбуминизированной поверхности, обладающей заданными биологическими свойствами.
Технический результат: повышение эффективности сорбции альбумина и повышение стабильности модифицированных поверхностей полимерных материалов.
Поставленная задача достигается последовательной обработкой поверхности биоразлагаемых полимеров сначала алифатическими аминогруппами, затем активированным эфиром полиненасыщенной жирной кислоты, далее альбумином, с присоединенным по SH группе цистина 34 ЧСА малеимидным производным, необходимым для придания заданных свойств полимеру.
Предлагаемый способ заключается в следующем. На первой стадии поверхность полимера обрабатывают раствором алифатического диамина в 60% водном растворе изопропилового спирта при температуре 24°С - 30°С в течение 30-60 мин. После чего поверхность тщательно последовательно промывают 50% водным раствором изопропилового спирта, далее деионизированной водой, 0,3% раствором не ионного детергента Tween-20 в деионизированной воде. В качестве алифатического диамина может быть взят гексаметилендиамин, 4,7,10-trioxa-1,13-тридекандиамин и т.п.
На второй стадии, поверхность полимера, содержащую алифатические аминогруппы, обрабатывают 10 мМ раствором гидроксисукцинимидного эфира линолевой (9,12-уноктадиеновой) кислоты в абсолютным изопропиловом спирте, содержащем 0,1% триэтиламина при температуре 37-40°С в течении 60 минут. Модифицированную поверхность полимера тщательно последовательно промывают изопропиловым спиртом, 50% водным раствором изопропилового спирта, 0,3% раствором Tween-20 в деионизированной воде, деионизированной водой.
Предварительно, выполняют модификацию человеческого сывороточного альбумина (ЧСА) требуемым малеимидным производным биологически активного соединения (БАВ) известным способом (Popova T.V., et. al, Bioorg. Med. Chem. Lett. - 2018. - V. 28. - P. 260-264). В качестве биологически активного соединения могут быть взяты антибиотик, RGD-пептид, гепарин и т.п.
Для этого, к 0,001 М раствору ЧСА в фосфатном буфере (PBS) с рН 7.4 добавляют 0,01 М раствор малеимидного производного БАВ в воде или 0,03 М раствор в диметилсульфоксиде, смесь инкубируют при 37°С в течение 18 часов, низкомолекулярные компоненты реакционной смеси отделяют с помощью концентратора «Centricon» при 9000 g. Полученный коньюгат ЧСА с соответствующим малеимидным производным (коньюгат ЧСА) используют на следующей стадии.
Поверхность полимера, содержащую остатки линолевой кислоты, обрабатывают водным раствором конъюгата ЧСА в течении 15-30 минут, затем модифицированную поверхность полимера промывают водой, три раза 0,9% раствором хлорида натрия, далее опять водой.
Предложенный способ отличается простотой и отсутствием токсичных реагентов, конкретнее, отсутствует обработка поверхности полимера глутаровым альдегидом, приводящая к нарушению нативной структуры белка и образованию токсичных продуктов. Введение на поверхность полимера полиненасыщенной жирной кислоты значительно увеличивает эффективность связывания ЧСА за счет наличия у ЧСА специфического центра связывания, а предварительная модификация ЧСА различными биологически активными соединениями позволяет вводить на поверхность полимера различные требуемые компоненты (один или несколько) используя общую процедуру.
Определяющими существенными признаками заявляемого способа, по сравнению с прототипом, являются:
1) Поверхность полимера последовательно обрабатывают сначала 10% раствором диамина (преимущественно гексаметилендиамином или 4,7,10-trioxa-1,13-тридекандиамином) в 60% водном растворе изопропилового спирта при 24-30°С в течение 30-60 мин, а затем 10 мМ раствором N-гидроксисукцинимидного эфира линолевой (9,12-уноктадиеновой) кислоты в изопропиловом спирте, что позволяет существенно повысить прочность связывания ЧСА с поверхностью полимера за счет введения на поверхность через линкерную группу полиненасыщенных жирных кислот.
2) Поверхность полимера, содержащую остатки линолевой кислоты, обрабатывают водным раствором предварительно модифицированного ЧСА в течении 15-30 минут, что позволяет использовать широкий набор коммерчески доступных или легко получаемых биологически активных соединений (RGD-пептиды, антибиотики, антикоогулянты, красители и т.п.).
В связи с тем, что поиск по источникам патентной и научно-технической информации не выявил аналогичного технического решения, можно сделать вывод, что заявляемый способ модификации поверхности биоразлагаемых полимерных материалов для придания им заданных свойств, отвечает критериям патентоспособности, а именно обладает «новизной» и «изобретательским уровнем».
Изобретение иллюстрируется следующими фигурами:
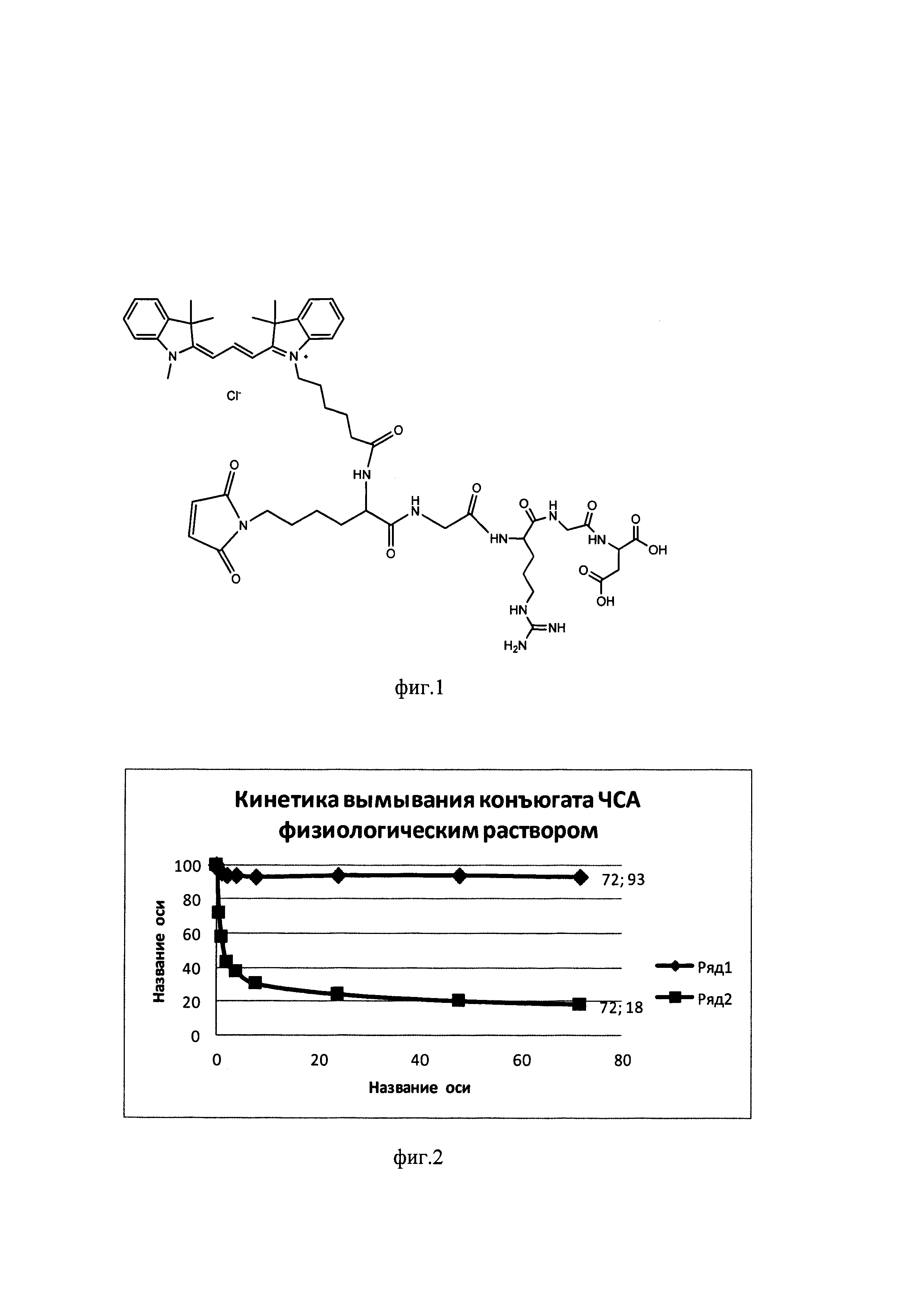
Фигура 1. Структура RGD-пептида, содержащего малеимидный фрагмент и флюоресцентный краситель.
Фигура 2. Кинетика вымывания конъюгата ЧСА с поверхности, модифицированной остатками линолевой кислоты (ряд 1) и немодифицированной поверхности (ряд 2).
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1.
А). Полимерную пластину на основе полигидроксибутирата/валерата (PHBV) и поликапролактона (PCL) (1:1) площадью 10 см2 обрабатывали 10% раствором 4,7,10-trioxa-1,13-тридекандиамина в 60% водном растворе изопропилового спирта при 24°С в течение 60 мин. После чего поверхность тщательно последовательно промывали от избытка исходных реагентов 50% водным раствором изопропилового спирта (3×50 мл), далее деионизированной водой (2×50 мл), 0,3% раствором Tween-20 в деионизированной воде. Количественное определение аминогрупп проводили с помощью нингидринового теста. От модифицированной поверхности отрезали фрагмент площадью 1 см2, помещали в пробирки на 1,5 мл и обрабатывали 1 мл 1% раствором нингидрина в этаноле в присутствии 20 мкл 0,05% аскорбиновой кислоты. Реакцию проводили при 80°С в течение 30 минут, образцы тщательно промывали этанолом, высушивали, растворяли в 0,5 мл хлороформа. К полученному раствору добавляли 0,5 мл изопропанола и измеряли оптическую плотность (L=1 см) при длине волны 568 нм. Количество аминогрупп на 1 см2 составляло 8,4±0.2×10-9 М/см2.
Б). Обработанную аминогруппами полимерную пластину высушивали, промывали абсолютным изопропиловым спиртом (3×20 мл) и помещали в 10 мМ раствор N-гидроксисукцинимидного эфира линолевой (9,12-уноктадиеновой) кислоты в абсолютном изопропиловом спирте, содержащем 0,1% триэтиламина. Обработку проводили в шейкере при 40°С в течении 60 минут. Обработанный образец последовательно промывали изопропиловым спиртом (3×50 мл), 50% водным раствором изопропилового спирта, 0,3% раствором Tween-20 в деионизированной воде (50 мл), деионизированной водой (30×50 мл).
Количество не прореагировавших аминогрупп на 1 см2 не превышает 0,4±0.1×10-9 М/см2.
В) Модификация ЧСА. К 1 мл 0,001 М раствора ЧСА (66.4 мг) в фосфатном буфере (PBS) с рН 7.4 добавляли 7 мг малеимидного производного RGD-пептида, содержащего в структуре флюоресцентный краситель Су3 (фиг. 1), в 50 мкл диметилсульфоксида (ДМСО). Реакционную смесь инкубировали при 37°С в течение 18 ч. После инкубации реакционную смесь очищали от низкомолекулярных веществ с помощью концентратора «Centricon» (Amicon Centriprep YM30, Millipore, Bedford) при 9000 g. Для этого раствор белка концентрировали до минимально возможного объема (~0,2 мл), добавляли буфер PBS (0,4 мл×4), а затем воду (0,4 мл×6), после добавления каждой порции буфера или воды раствор концентрировали. Объем полученного на заключительном этапе раствора конъюгата ЧСА с малеимидным производным RGD-пептида доводили водой до 20 мл и использовали на следующей стадии.
Г) Обработанный образец полимерного материала, полученный на стадии Б, помещали в раствор конъюгата ЧСА с малеимидным производным RGD пептида, полученным на стадии В (концентрация альбумина 3,3 г/л). Образец выдерживали на шейкере при 37°С в течение 15 минут, пластину промывали водой (2×50 мл), 0,9% раствором хлорида натрия (3×50 мл), водой (50 мл).
Для определения количества сорбированного белка образец модифицированного полимерного материала (1 см2) растворяли в гексафторизопропиловом спирте и измеряли оптическую плотность (L=1 см) при длине волны 550 нм. Количество сорбированного белка составляло 3,1±0,2 мкг/см2.
Пример 2.
А). Полимерную пластину на основе полигидроксибутирата/валерата (PHBV) и поликапролактона (PCL) (1:1) площадью 10 см2 обрабатывали 10% раствором гексаметилендиамина в 60% водном растворе изопропилового спирта при 30°С в течение 30 мин. После чего поверхность тщательно последовательно промывали 50% водным раствором изопропилового спирта (3×50 мл), далее деионизированной водой (2×50 мл), 0,3%) раствором Tween-20 в деионизированной воде. Количественное определение аминогрупп проводили с помощью нингидринового теста как описано в примере 1. Количество аминогрупп на 1 см2 составляло 7,5±0.2×10-9 М/см2.
Б). Обработанную аминогруппами полимерную пластину обрабатывали 10 мМ раствором N-гидроксисукцинимидного эфира линолевой кислоты при температуре 37 в течении 60 минут, как описано в примере 1.
Количество не прореагировавших аминогрупп на 1 см2 не превышает 0,6±0.1×10-9 М/см2
В) Модификацию ЧСА проводили, как описано в примере 1.
Г) Обработанный образец полимерного материала, полученный на стадии Б, помещали в раствор конъюгата ЧСА с малеимидным производным RGD пептида, полученным на стадии В (концентрация альбумина 3,3 г/л). Образец выдерживали на шейкере при 37°С в течение 15 минут, пластину промывали водой (2×50 мл), 0,9% раствором хлорида натрия (3×50 мл), водой (50 мл).
Для определения количества сорбированного белка образец модифицированного материала (1 см2) растворяли в гексафторизопропиловом спирте и измеряли оптическую плотность (L=1 см) при длине волны 550 нм. Количество сорбированного белка составляло 2,9±0,2 мкг/см2.
Пример 3 Сравнительный анализ эффективности связывания конъюгата ЧСА с модифицированной, согласно заявляемому способу, и не модифицированной поверхностью.
Полимерные пластины на основе полигидроксибутирата/валерата (PHBV) и поликапролактона (PCL) площадью 10 см2 с немодифицированной поверхностью, и поверхностью, модифицированной линолевой кислотой, как описано в примере 1 (стадии А и Б), обрабатывали конъюгатом ЧСА с RGD-пептидом, содержащим в структуре флюоресцентный краситель Су3 (стадия В, пример 1) как описано в примере 1 (стадия Г), без промывки раствором хлорида натрия.
Образцы модифицированного полимера помещали в 0,9% раствор хлорида натрия (физиологический раствор) при 37°С и выдерживали в шейкере. Через 0,5, 1, 2, 4, 8, 24, 48 и 72 часа измеряли оптическую плотность раствора при длине волны 550 нм. За 100% принята величина сорбированного белка, определенная как описано в пункте Г, пример 2. Полученный результат представлен на фиг. 2.
Как видно из фиг. 2, в отличии от немодифицированной поверхности, модификация поверхности полимера, в соответствии с заявляемым способом, обеспечивает прочное связывание конъюгатов альбумина с поверхностью полимера. После первоночальной промывки физиологическим раствором количество связанного альбумина уменьшается на 6% и в дальнейшем практически не изменяется.
Таким образом, использование предлагаемого способа позволяет получать модифицированные поверхности полимеров с заданными биологическими свойствами, которые отличаются повышенной стабильностью в физиологических условиях, а также обладают за счет наличия конъюгатов альбумина высокой био- и гемосовместимостью для использования в медицинской практике. Процедура модификации полимера отличается простотой, воспроизводимостью и технологичностью.