Результат интеллектуальной деятельности: Способ получения олигонуклеотидного комплекса для доставки в клетки млекопитающих
Вид РИД
Изобретение
Изобретение относится к области химии, биологии и молекулярной медицины и может быть использовано для быстрой и специфичной доставки любых олигонуклеотидов в эукариотические клетки, что способно значительно повысить эффективность ген-направленных воздействий.
Применение ген-направленных олигонуклеотидных препаратов для исследовательских целей, а также коррекции аномальной экспрессии генов, приводящей к патологии, считается перспективным направлением биомедицины (Dygalo N.N., Kalinina T.S., Shishkina G.T. //Ann N Y Acad Sci. 2008. V. 1148. P. 409-414; Shishkina G.T., Kalinina T.S., Popova N.K., Dygalo N.N. // Behav Neurosci. 2004. V. 118. P. 1285-1292). Использование этого подхода сдерживается нерешенной проблемой доставки олигонуклеотидов, комплементарных последовательностям мРНК гена-мишени, в клетку. Для увеличения поступления, олигонуклеотиды подвергают разнообразным химическим модификациям, а также создают на их основе различные мультимолекулярные комплексы (Schoch К.М., Miller Т.М. // Neuron. 2017. V. 94. P. 1056-1070; Juliano R.L. // Nucleic Acids Res. 2016. V. 19. P. 6518-6548).
Известен способ получения композиции носителя для доставки нуклеиновой кислоты (коротких интерферирующих РНК) и собственно носителя, на основе диацилфосфатидилхолина, и, по меньшей мере, одного компонента, выбранного из группы, состоящей из холестерина и катионного липида с холестериновым каркасом, и алифатического первичного амина. Заявленная композиция способна эффективно доставлять нуклеиновую кислоту в клетки, а также имеет низкую токсичность и высокую безопасность (патент RU 2476229 С2, оп. 27.02.2013). Этот способ аналогичен созданию липосом и, кроме того, данный способ доставки требует обязательной стерилизации полученных смесей, что усложняет технологическую процедуру.
Известен способ доставки нуклеозидтрифосфатов в эукариотические клетки в виде комплекса нуклеозидтрифосфата с катионными наногелями, представляющими собой сополимер полиэтиленимина и полиэтиленгликоля (Vinogradov S.V., Expert Opin. Drug. Deliv. 2007, v. 4(1), p.5-17; Vinogradov S.V., Curr. Pharm. Des. 2006, v. 12, p. 36). Предварительно полученный наногель диспергируют в воде при рН 10 для депротонирования аминогрупп, затем титруют его полученным раствором нуклеозидтрифосфата до рН 7.5, концентрируют в вакууме, пропускают через колонку NAP-20 и лиофилизуют.Недостатками данного способа являются длительность процедуры и низкое качество целевого продукта, вследствие недостаточно прочной связи нуклеозидтрифосфата с носителем.
Известен способ доставки ДНК в эукариотические клетки, заключающийся в том, что доставку ДНК осуществляют в биосовместимых и биодеградируемых микрокапсулах, состоящих из мультислойных полимерных оболочек DEAE-декстран/к-каррагинан, которые предохраняют ДНК от расщепления нуклеазами в процессе ее доставки в клетки организма. Сорбируют плазмидную ДНК пористыми частицами СаСО3 методом соосаждения. Получают мультислойные оболочки путем поочередного наслоения DEAE-декстран и к-каррагинан на пористые частицы СаСО3. Помещают микрокапсулы в раствор 0,1М ЭДТА. Интенсивно перемешивают до полного растворения внутреннего ядра, состоящего из СаСО3. Трижды промывают водой полученные микрокапсулы. Вводят в клетки животных путем инъекции (патент RU 2409384С1, оп. 20.01.2011).
Способ увеличивает количество сорбированной ДНК до 96,0-99,1% и увеличивает прочность оболочки микрокапсулы, но требует технически сложных многостадийных процедур создания мультислойных оболочек.
Наиболее близким к заявляемому способу - прототипом, является способ получения олигонуклеотидного комплекса, содержащего поликатионный амфифил в качестве компонента, связывающего и упаковывающего нуклеиновую кислоту, нейтральный фосфолипид в качестве структурообразующего и промотирующего компонента при следующем содержании компонентов, мол. %: поликатионный амфифил -30-75; нейтральный фосфолипид - 70-25. В качестве поликатионного амфифила используют одно из соединений (1-3), выраженное общей формулой, представленной на фиг. 1, где n=3 для амфифилов 1 и 2, n=5 для амфифила 3; Х=>С=O (карбонильная группа) для 1, X=-NH-CO-(карбаматная группа) для амфифилов 2 и 3. Олигонуклеотидный комплекс получают следующим образом. Раствор поликатионного амфифила (1-3) и нейтрального фосфолипида DOPE, взятые в определенном соотношении в подходящем органическом растворителе (например, этиловый спирт, хлороформ) упаривают в вакууме до образования липидной пленки. Полученную липидную пленку гидратируют в необходимом количестве воды, а затем озвучивают на ультразвуковой бане до получения однородной смеси. Озвучивание можно заменить экструзией через поликарбонатную мембрану с размером пор от 50 до 200 нм. (патент RU 2423147С1, оп. 10.07.2011).
Недостатками прототипа являются трудоемкость и длительность, поскольку предлагаемый способ предусматривает предварительное получение с помощью органического синтеза 9 соединений, что существенно увеличивает длительность процесса.
Задачей изобретения является разработка простого и быстрого способа эффективной доставки олигонуклеотидов внутрь клеток млекопитающих в составе комплексов, не обладающих токсичностью.
Технический результат: упрощение и уменьшение длительности способа.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Водный раствор необходимых олигонуклеотидов (ОН) с длиной от 18 до 501 п. о. с концентрацией 2,0-25 мкг/мл смешивают с водным раствором декстрана с мол. весом 65-70 кДа с концентрацией 2,0-2,5 мг/мл в соотношении ОН:декстран, равном около 1:2000 - 1:1500, соответственно. Полученную смесь перемешивают и подвергают облучению пучками электронов высокой энергии в дозе 2,5 - 10 кГр. В результате образуется олигонуклеотидный комплекс. Индуцированные пучками электронов высокой энергии сшивки декстрана с олигонуклеотидами могут иметь либо химическую природу, в виде ковалентных связей, либо физическую природу в виде координационных, электростатических, гидрофобных, диполь-дипольных взаимодействий или цепных зацеплений между сегментами сети. Эффективность сшивки может быть подтверждена замедлением электрофоретической подвижности ОН, облученных в смеси с декстраном, по сравнению с облучением водных растворов ОН без декстрана.
Образование комплекса ОН:декстран происходит в результате однократной радиационной сшивки, что не требует затратной и трудоемкой очистки получаемого комплекса от продуктов химических реакций, а также обеспечивает требуемый уровень стерильности вводимого препарата, необходимый для работы с живыми биологическими объектами.
Полученные комплексы ОН:декстран используются для непосредственного введения в клетки млекопитающих. Доставка полученных комплексов ОН:декстран в клетки значительно эффективнее введения ОН без комплекса с декстраном.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1.
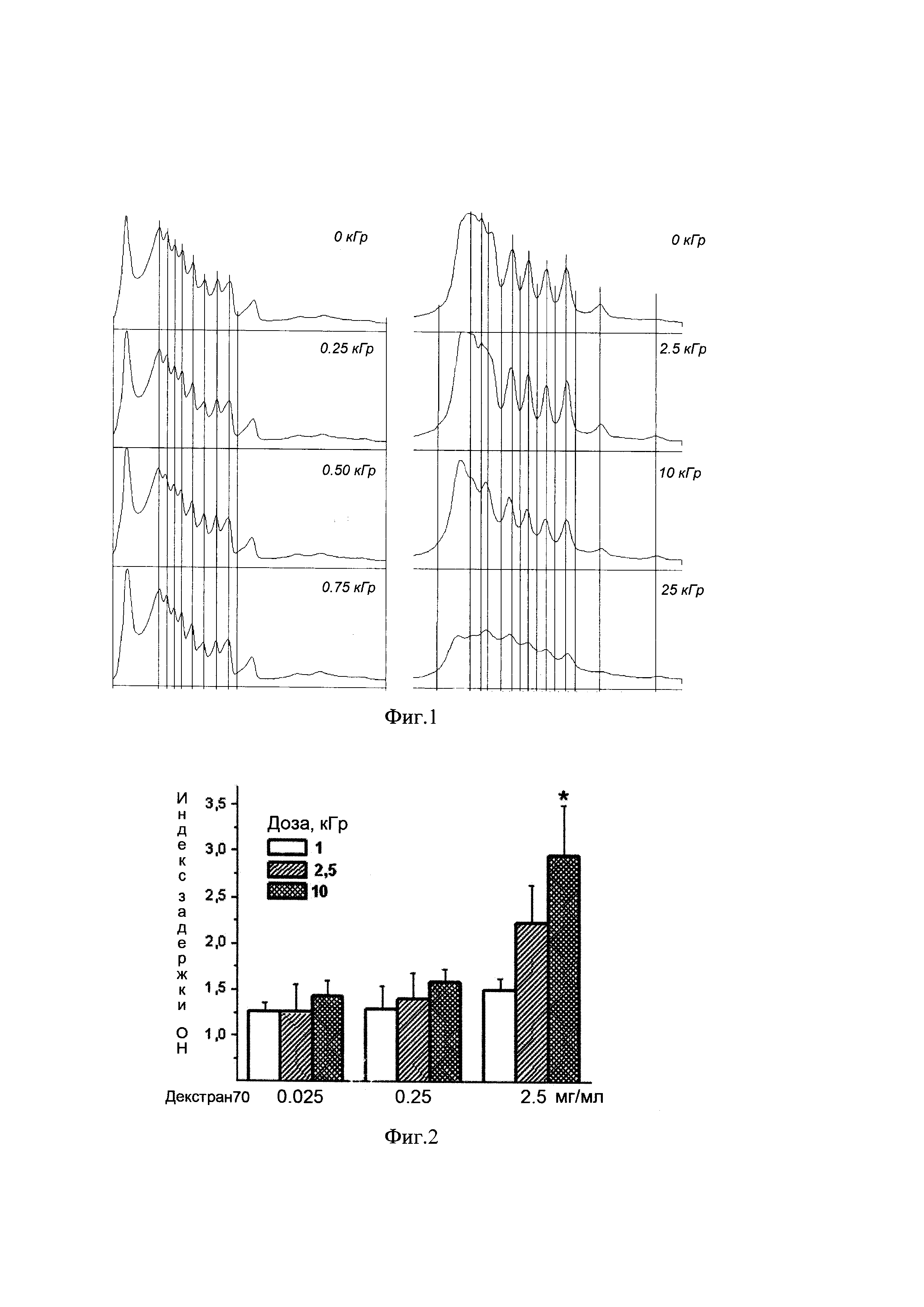
Смесь ОН с длиной от 26 до 501 п. о. в концентрации 0,02 мг/мл смешивают с водным раствором декстрана с мол. весом 70 кДа (декстран70) в концентрации 2,5 мг/мл в объеме 20 мкл. Заявленные смеси готовят в количестве не менее 3 для каждой дозы облучения. Смеси перемешивают и подвергают облучению пучками электронов высокой энергии (2.5 МэВ) мощностью 0; 0,25; 0,50; 0,75; 2,5; 10 и 25 кГр на ускорителе ИЛУ-10 (ИЯФ СО РАН). После процедуры облучения комплексы ОН:декстран наносят на гель, окрашенный бромистым этидием. После электрофоретического разделения проводят денситометрию с применением любой пригодной для этих целей программы, преимущественно ScionImage. Контролем являются смеси ОН с декстраном70, не облученные на ускорителе ИЛУ-10, а также ОН без декстрана (нативные).
На Фиг. 1 представлены результаты денситометрии комплексов ОН:декстран, облученных пучками электронов разной мощности. Видно, что облучение низкими дозами электронных пучков, менее 1 кГр, не приводит к выраженным отклонениям в подвижности фрагментов ОН (левый график). Выраженное снижение электрофоретической подвижности (ассиметрия пиков, выделенных вертикальными линиями относительно максимума и минимума пиков в контрольном образце) происходит при облучении 2,5 и 10 кГр, а применение высокой дозы облучения в 25 кГр вызывает деструкцию нуклеинового материала (правый график), что исключает применение этой дозы в дальнейшем. Таким образом, эффективная доза облучения комплекса ОН:декстран составляет 2,5-10кГр.
Пример 2.
Водный раствор ОН с длиной 100 п. о. смешивают с декстраном70 в концентрации 0,025; 0,25 и 2,5 мг/мл в объеме 20 мкл. Смеси готовят в количестве не менее 3-х для каждой дозы декстрана. Смеси перемешивают и подвергают облучению пучками электронов высокой энергии (2.5 МэВ) мощностью 1; 2,5 и 10 кГр на ускорителе ИЛУ-10 (ИЯФ СО РАН). После процедуры облучения комплексы ОН:декстран наносят на гель, окрашенный бромистым этидием. После электрофоретического разделения проводят денситометрию с применением любой пригодной для этих целей программы, в нашем случае мы использовали программу ScionImage.
На Фиг. 2 видно, что наибольшее снижение электрофоретической подвижности происходит при образовании комплекса ОН с декстраном в дозе 2,5 мг/мл.
Пример 3.
Водный раствор смеси ОН с длинами от 26 до 501 п. о. в концентрации 0,02 мг/мл смешивают с водным раствором декстрана70 в концентрации 2,5 мг/мл в объеме 20 мкл. Смеси готовят в количестве не менее 3 для каждой дозы облучения. Смеси перемешивают и подвергают облучению пучками электронов высокой энергии (2.5 МэВ) мощностью 0; 2,5 и 10 кГр на ускорителе ИЛУ-10 (ИЯФ СО РАН). После процедуры облучения комплексы ОН:декстран наносят на гель, окрашенный бромистым этидием. После электрофоретического разделения проводят денситометрию с применением программы ScionImage. Контролем являются смеси ОН с декстраном70, не облученные на ускорителе ИЛУ-10, а также ОН без декстрана (нативные).
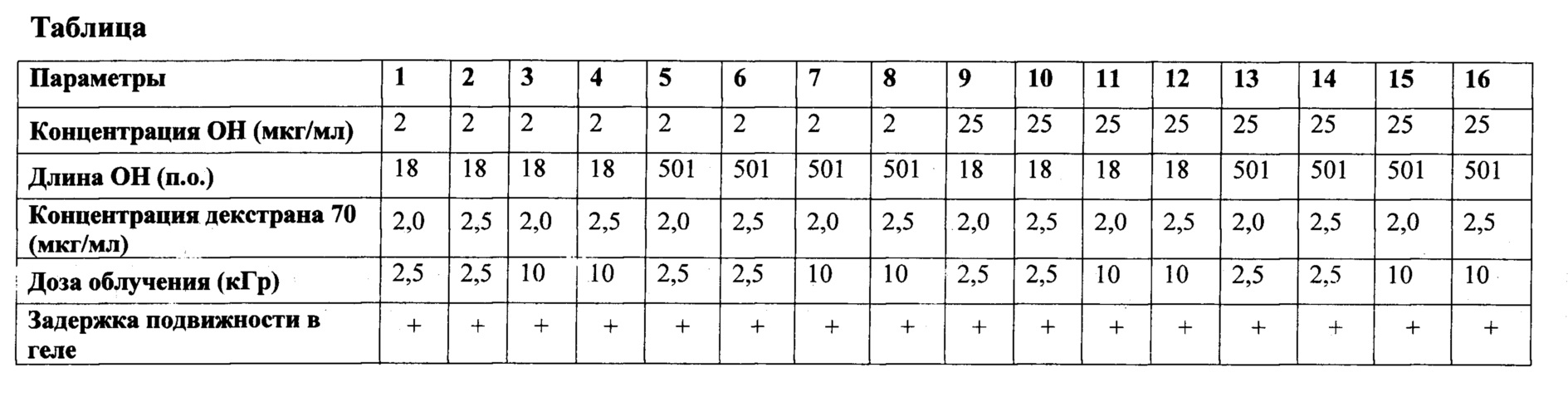
На Фиг. 3 представлены результаты денситометрии комплексов ОН:декстран при использовании ОН разного размера. Видно, что выраженное снижение электрофоретической подвижности (ассиметрия пиков, выделенных вертикальными линиями относительно максимума и минимума пиков в контрольном образце) наблюдается как для ОН условно малого размера (26-110 п. о.), так и для ОН условно большого размера (330-501 п. о.).
С учетом установленных оптимальных параметров дозы облучения и дозы декстрана70 снижение электрической подвижности в геле было зафиксировано для комплексов ОН:декстран в диапазоне пограничных значений для разной концентрации ОН, разного размера ОН, концентрации декстрана70 и дозы облучения (Таблица).
Пример 4.
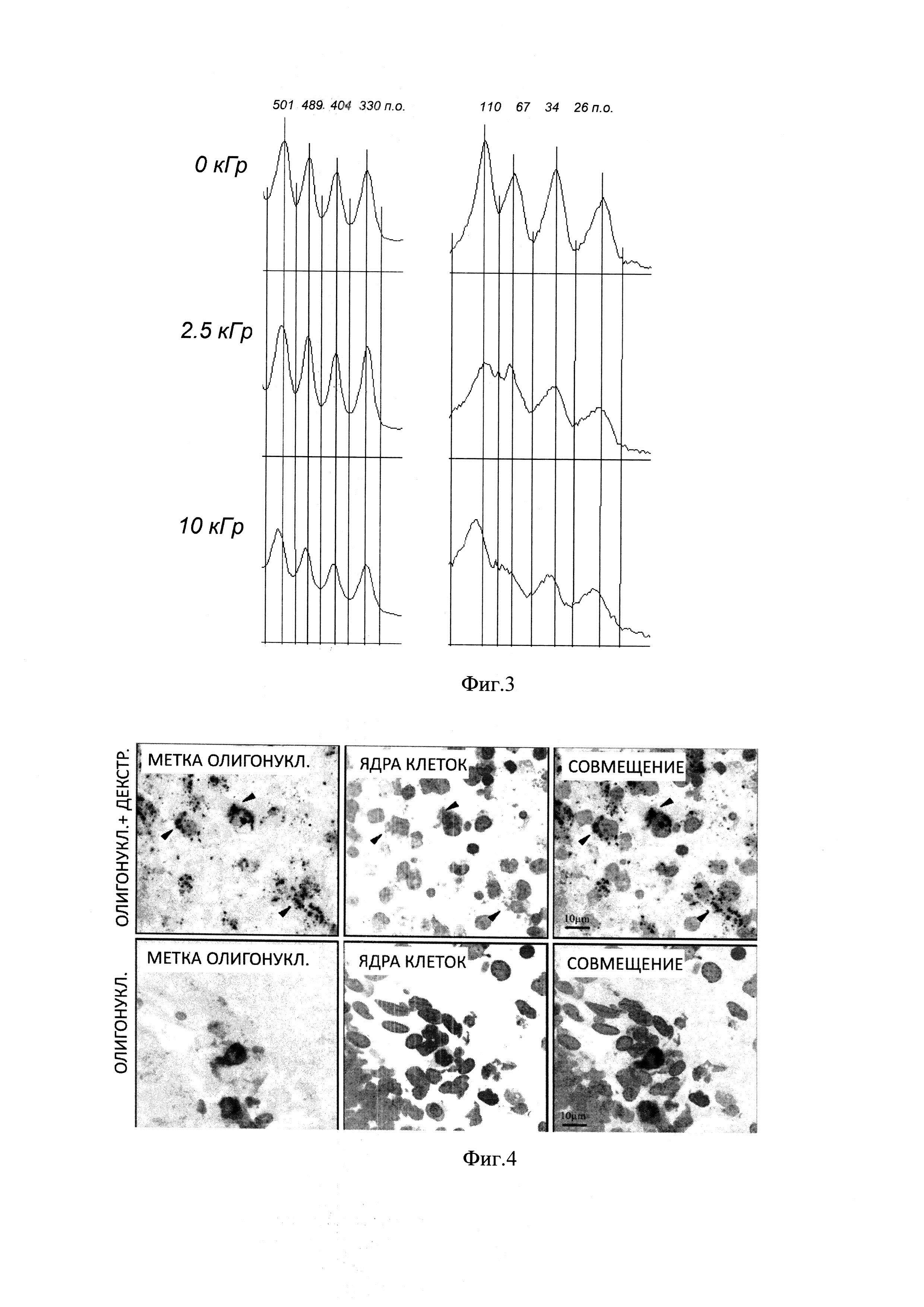
Эксперимент проведен на крысятах линии Вистар 3-4-суточного возраста. Водный раствор ОН (18 п.о.) с концентрацией 15 мкг/мл, был смешан с водным раствором декстрана70 с концентрацией 2,5 мг/мл и облучен на ускорителе ИЛУ-10 пучками электронов высокой энергии в дозе 10 кГр. Для последующей визуализации на срезах мозга использованный ОН был флуоресцентно мечен бис-имидазолом. ОН такого размера используются в качестве антисмысловых и при создании коротких интерферирующих РНК для подавления экспрессии гена-мишени. Комплекс ОН:декстран был стереотаксически точно введен в дозе 0.06 мкг/5 мкл в головной мозг (стволовую часть) неонатальных крысят под Холодовым наркозом, описанным ранее способом [Shishkina G.T., Kalinina T.S., Dygalo N.N. // Neuroscience. 2007. V. 150. P. 404-412]. Контрольные животные получали внутримозговую инъекцию ОН без декстрана либо водную смесь ОН:декстран без облучения на ускорителе ИЛУ-10. Через 24 часа после введения препаратов, животных в состоянии глубокой холодовой анестезии транскардиально перфузировали сначала физиологическим раствором и затем раствором параформальдегида, после чего головной мозг извлекали для последующего микроскопического анализа локализации флуоресцентно меченных олигонуклеотидов в клетки [Lanshakov D.A., Sukhareva E.V., Kalinina T.S., Dygalo N.N. // Neurobiol Dis. 2016. V. 91. P. 1-9].
На Фиг. 4 представлена картина локализации комплексов ОН:декстран, несущих флуоресцентную метку (верхний ряд фотографий), а также свободных флуоресцентно меченных ОН (нижний ряд фотографий) в клетках головного мозга неонатальных животных. Стрелками отмечены наиболее организованные скопления ОН в клетках. Линейка - 10 мкм.
На Фиг. 4 видно, что ОН значительно лучше поступают в клетки мозга в комплексах с декстраном, чем такие же меченные флуоресцентной меткой олигонуклеотиды, но не включенные в комплексы с декстраном. В комплексах с декстраном, ОН обнаруживались в значительной части клеток мозга, и лишь небольшое их количество оставалось в межклеточном пространстве. В отличие от комплексов, свободные ОН проникали в существенно меньшее число клеток, и их пропорция [(в клетке)/(в межклеточном пространстве)] была в 3 раза ниже, чем для комплексов. Статистическая обработка выявила достоверно значимое увеличение проникновения в клетки мозга комплексов ОН:декстран - (F(2,3)=10,10; р<0,01).
Предлагаемый способ получения олигонуклеотидного комплекса для доставки в клетки млекопитающих имеет ряд очевидных преимуществ перед применяемыми для этих целей разнообразными химическими модификациями, а также формированием физико-химическим путем на их основе всевозможных мультимолекулярньгх комплексов. Получаемые обоими последними, как правило, многостадийными способами препараты нуждаются в затратной и трудоемкой очистке от зачастую весьма токсичных компонентов, используемых в этих технологиях. Кроме того, для применения in vivo препараты необходимо стерилизовать, что также добавляет еще одну технологическую процедуру. При радиационной сшивке полимеров вся процедура получения комплексного препарата сводится к приготовлению смеси олигонуклеотидов с олигосахаридом (декстраном) и одностадийному ее облучению пучком электронов высокой энергии, что одновременно стерилизует препарат, исходно свободный от токсичных примесей. Предлагаемый способ свидетельствует о неоспоримых преимуществах радиационной сшивки олигонуклеотидов с олигосахаридами для повышения эффективности доставки ген-нацеленных олигонуклеотидных препаратов в клетки млекопитающих.