Результат интеллектуальной деятельности: Вакцина ассоциированная против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота инактивированная эмульсионная
Вид РИД
Изобретение
Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности к производству и применению биологического препарата против парагриппа-3, инфекционного ринотрахеита, вирусной диареи-болезни слизистых оболочек, рота-, коронавирусных инфекций молодняка крупного рогатого скота, протекающих с признаками поражения респираторно-кишечного тракта.
Респираторно-кишечные болезни молодняка крупного рогатого скота остаются одной из наиболее сложных проблем инфекционной патологии животных во многих странах мира, в том числе и России. В развитии этих форм патологии у телят доминирующими признаны герпесвирус типа 1, вирус вирусной диареи - болезни слизистых оболочек (ВД-БС), вирус парагриппа-3 (ПГ-3), респираторно-синцитиальный (PC) вирус, рота-, коронавирусы. Эти болезни протекают преимущественно в виде смешанной инфекции и потери молодняка от них в современных крупных молочных комплексах достигают 35-50%.
Несмотря на то, что во многих хозяйствах для повышения общей резистентности организма новорожденных телят применяют иммуностимулирующие препараты - миксоферон, фоспренил, гамовит и полиспецифическую гипериммунную сыворотку против пастереллеза, сальмонеллеза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота, а также проводят вакцинацию глубокостельных коров и нетелей против вирусных инфекций ассоциированной вакциной «Комбовак», против эшерихиоза - вакциной «Коливак», заболеваемость новорожденных телят респираторно-кишечными болезнями остается довольно высокой. В отдельных хозяйствах она достигает до 70% [Ветеринарная энциклопедия Webvet.ru].
Желудочно-кишечные заболевания с клиникой диареи и общей интоксикации проявляются уже на 1-2 день жизни. У заболевших телят наблюдается лихорадка, угнетение, снижение аппетита, диарея. Кал жидкий, с примесью слизи, сгустков молока и пузырьков газа, беловато-серого цвета, с гнилостным или кислым запахом. Заболевшие животные быстро худеют, кожа вследствие обезвоживания организма становится сухой, шерсть теряет блеск. К концу заболевания температура тела падает ниже нормы, глаза западают. Животные гибнут в течение 2-7 дней заболевания. В 15-20-дневном возрасте переболевшие диареей, ослабленные телята заболевают респираторными вирусными болезнями, которые часто осложняются бактериальной микрофлорой. Заболевание протекает в острой и хронической формах. Переболевшие телята отстают в росте и развитии. Важно отметить, что часто телята рождаются с признаками болезни: у них наблюдается опухание суставов, отмечаются гиперемия и отек слизистой оболочки носовых ходов и раковин.
Для специфической профилактики смешанных респираторно-кишечных инфекций молодняка крупного рогатого скота в РФ применяют различные ассоциированные инактивированные и живые вакцины отечественного и зарубежного производства.
Известна живая вакцина «Тривак (ВИЭВ)» для профилактики инфекционного ринотрахеита, парагриппа-3 и вирусной диареи-болезни слизистых оболочек крупного рогатого скота, содержащая антигены из аттенуированных штаммов вируса инфекционного ринотрахеита (штамм «ТК-А (ВИЭВ)-В2»), вируса ВД-БС (штамм «ВК-1), парагриппа-3 (штамм «ПТК-45/86») и защитную среду на основе желатина и сахарозы. Вакцину вводят внутримышечно, двукратно, телятам по 1,0 см3, взрослым животным по 2,0 см3 (Патент RU №2111011, А61К 39/295, опуб. 20.06.1998 г.).
Недостатком данной инфекции является низкая защита поголовья КРС от пневмогастроэнтеритов вследствие неполноценности антигенного состава входящих компонентов и сложных взаимодействий вирусов, из которых она изготовлена.
Для профилактики инфекционного ринотрахеита, вирусной диареи, парагриппа-3, респираторно-сентициальной инфекции и лептоспироза крупного рогатого скота в РФ применяется импортная вакцина «Бови-шилд Голд FPS L5» (организация-производитель «Pfizer Animal Health», США). Вакцина состоит из двух компонентов, содержащих живые аттенуированные возбудители инфекционного ринотрахеита крупного рогатого скота (IBR), вирусной диареи (BVD тип 1 и 2), парагриппа-3 (PI3), респираторно-сентициальной инфекции (BRSV), а также инактивированные лептоспиры 5 серогрупп.
Недостатком данной вакцины является то, что она содержит живые аттенуированные штаммы вирусов ИРТ, ПГ-3 и РСИ и ее применение на слабом иммунодефицитом поголовье может способствовать реверсии штаммов и вызвать инфекционную патологию.
Известна комбинированная вакцина против вирусных пневмогастроэнтеритов крупного рогатого скота и телят, содержащая адъювант и инактивированные суспензии вирусов инфекционного ринотрахеита вирусной диареи, ротавирусной и коронавирсуной инфекции в титре 107,5-108,5 ТЦД 50/см3, инактивированные суспензии вирусов парагриппа-3 и респираторно-синцитиальной инфекции - в титре 106,5-107,5 ТЦД 50/см3, взятые в вакцине в объемном соотношении 1:1:1:1:0,5:0,5 соответственно (Патент RU №2261111, А61К 39/295, опуб. 27.09.2005 г.).
Недостатком данной вакцины является то, что входящие в ее состав штаммы вирусов не обеспечивают формирование иммунитета по отношению к разным подтипам и основным антигенным вариантам эпизоотических штаммов возбудителей, циркулирующих в хозяйствах и как следствие, эта вакцина недостаточно эффективна. Кроме того вакцина не достигает высокого уровня антител в крови коров и в молозиве.
Наиболее близким аналогом является «Вакцина инактивированная комбинированная против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синцитиальной, рота- и коронавирусной болезней телят «Комбовак»», содержащая производственные инактивированные штаммы 6 вирусов: инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно- синцитиальной, рота- и коронавирусной болезней крупного рогатого скота, инактивированных формалином и сорбированных на 6%-ом геле гидроокиси алюминия и сапонине (Наставление по применению вакцины инактивированной против инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синцитиальной, рота-, коронавирусной болезни телят Комбовак, №13-3-04/0703 от 20.03.2003 г., утвержденное Департаментом ветеринарии МСХ РФ 20.03.2003 г.).
К недостаткам ближайшего аналога относится относительно невысокий титр инфекционной активности, входящих в ее состав вирусных суспензий, из-за того, что вакцина изготовлена из нативных вирусных суспензий без концентрирования, в связи с чем применение вакцины в дозе, указанной в инструкции, не обеспечивает поступление необходимого количества протективных антигенов против указанных болезней. Поэтому рекомендуемые дозы вакцины недостаточны для создания напряженного иммунитета у телят и стельных коров.
Кроме того, применение вакцины с содержанием антигена вируса респираторно-синцитиальной инфекции не оправдано в тех хозяйствах, где эта инфекция не наблюдается. Антиген вируса респираторно-синцитиальной инфекции в таких случаях создает лишь антигенную перегрузку организма, оказывая иммунодепрессивное действие и снижая при этом выработку иммунитета достаточной напряженности к другим компонентам вакцины, а -гидроокись алюминия - это относительно слабый адъювант, не способный обеспечить длительное освобождение антигена из места введения вакцины.
Использованный нами масляный адъювант дает эмульсию типа «вода-масло», которая освобождает антигены в течение более длительного времени, чем гидроокись алюминия и аналогичные адсорбенты, это создает более выраженную иммунную стимуляцию уже после первой иммунизации животных эмульсионными вакцинами.
В связи с этим проблема создания вакцины ассоциированной, эмульсионной против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций, обладающей высокой антигенной и иммуногенной активностью, продолжает оставаться актуальной и является основным направлением исследований по ее совершенствованию.
Технический результат, на достижение которого направлено изобретение, заключается в получении вакцины, обладающей повышенной стабильностью антигенной и иммуногенной активностью против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота, а также в усилении напряженности иммунитета у привитых животных и родившихся телят, т.е. повышает сохранность животных.
Для достижения названного технического результата в предлагаемой вакцине, содержащей активное вещество, инактивированное формалином, и адъювант, в качестве активного вещества она содержит смесь очищенного инактивированного концентрированного антигена штамма «ПТК-45/86», вируса парагриппа-3 крупного рогатого скота (КРС) на фосфатном буфере рН 7,2-7,4 с активностью не менее 8,5 Lg ТЦД 50/см3; очищенного, инактивированного концентрированного антигена штамма «ТК-А (ВИЭВ)-В2» вируса инфекционного ринотрахеита КРС на фосфатно-солевом буфере рН 7,2-4,4 с активностью не менее 8,5 Lg ТЦД 50/см3; очищенного инактивированного, концентрированного антигена штамма «ВК-1» вируса вирусной диареи - болезни слизистых оболочек КРС на фосфатно-солевом буфере рН 7,2-7,4 с активностью не менее 8,0 Lg ТЦД 50/см3; очищенного инактивированного, концентрированного антигена штамма «РМ» ротовируса КРС на фосфатно-буферном растворе рН 7,2-7,4 с активностью не менее 8,2 Lg ТЦД 50/см3; очищенного инактивированного, концентрированного антигена штамма 2- «КЛ-2» коронавируса КРС на фосфатно-буферном растворе рН 7,2-7,4 с активностью не менее 8,2 Lg ТЦД 50/см3, взятую в объемном соотношении 1:1:1:1:1, а в качестве адъюванта содержит смесь синтетического масла ПЭС-3М и ланолина безводного в соотношении 85:15.
Сущность изобретения заключается в следующем: «Вакцина ассоциированная против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота инактивированная эмульсионная» содержит очищенные, инактивированные, концентрированные антигены вирусов парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусов крупного рогатого скота в объемном соотношении 1:1:1:1:1, эмульгированные в масляном адъюванте:
- концентрированный антиген штамма «ПТК-45/86» вируса парагриппа-3 на фосфатно-солевом буфере рН 7,2-7,4, полученный на перевиваемой культуре клеток трахеи эмбриона коровы TR с инфекционным титром не ниже 8,5 lg 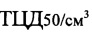 и гемагглютинирующей активностью не ниже 1:32;
и гемагглютинирующей активностью не ниже 1:32;
- концентрированный антиген штамма «ТК-А (ВИЭВ)-В2» вируса инфекционного ринотрахеита на фосфатно-солевом буфере рН 7,2-7,4, полученный на перевиваемой культуре клеток эмбриона коровы MDBK с инфекционным титром не ниже 8,5 lg 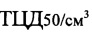 ;
;
- концентрированный антиген штамма «ВК-1» вируса вирусной диареи - болезни слизистых оболочек крупного рогатого скота на фосфатно-солевом буфере рН 7,2-7,4, полученный на перевиваемой культуре клеток эмбриона коровы MDBK с инфекционным титром не ниже 8,0 lg 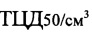 ;
;
- концентрированный антиген штамма «РМ» ротавируса на фосфатно-солевом буфере рН 7,2-7,4, выращенная на перевиваемой культуре клеток эмбриона коровы MDBK с инфекционным титром не ниже 8,2 lg 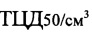 ;
;
- концентрированный антиген штамма 2-«КЛ-2» коронавируса крупного рогатого скота на фосфатно-солевом буфере рН 7,2-7,4, полученный на перевиваемой культуре клеток эмбриона коровы MDBK с инфекционным титром не ниже 8,2 lg 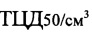 и гемагглютинизирующей активностью не ниже 1:128;
и гемагглютинизирующей активностью не ниже 1:128;
- адъювант - смесь синтетического масла ПЭС-3М (кремнеорганическая жидкость ГОСТ 13004-77) и ланолин безводный ФС 42-2520-99.
Штаммы вирусов, используемых в качестве производственных, характеризуются следующими признаками и свойствами:
- штамм «ПТК-45/86» вируса парагриппа-3 - РНК-содержащий вирус из семейства Paramyxoviridae полиморфный, размеры варьируют от 150 до 300 нм, внутренняя структура вириона представлена рибонуклеопротеидом. Вирус высокочувствителен к действию УФ-лучей. Эфир повышает гемагглютинационный титр и способствует потере инфекционности вируса. Вирус термолабилен, прогревание при 56°С в течение 30 мин инактивирует его. В щелочной среде вирус сохраняется лучше, чем в кислой. Вирус обладает гемадсорбирующими свойствами, агглютинирует эритроциты морской свинки, кролика, свиньи, коровы, мыши, овцы, козы и голубя. Инфекционный титр штамма вируса составляет не ниже 6,0 lg 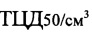 ;
;
- штамм «ТК-А (ВИЭВ)-В2» вируса инфекционного ринотрахеита - герпесвирус типа 1 относится к семейству Herpesviridae, ДНК- содержащий, вирионы заключены в липидосодержащую оболочку, диаметром 150-250 нм. Вирус обладает относительно слабой устойчивостью к физико-химическим воздействиям: при 100°С погибает моментально; при 56°С - в течение 20 мин; при 22°С - в течение 50 дней. Ацетон, эфир, хлороформ и этиловый спирт инактивируют вирус моментально. Инфекционный титр герпесвируса типа 1 составляет не ниже 6,0 lg 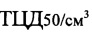 . При заражении вирус индуцирует у животных образование вируснейтрализующих, комплементсвязывающих и преципитирующих антител;
. При заражении вирус индуцирует у животных образование вируснейтрализующих, комплементсвязывающих и преципитирующих антител;
- штамм «ВК-1» вируса вирусной диареи - болезни слизистых (ВД-БС) - РНК-содержащий вирус. Является представителем рода Pestivirus семейства Flaviviridae, относятся к 1-ой подгруппе цитопатогенных штаммов. Величина вирионов колеблется от 30 до 50 нм. Вирус чувствителен к эфиру, хлороформу, трипсину и дезоксихолату. Быстро инактивируется при рН 3,0. Продуктивно репродуцируется в перевиваемых линиях культуры клеток MDBK, ЛЭК, TR и ВНК-21. При этом инфекционный титр составляет не ниже 5,5 lg 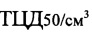 ;
;
- штамм «РМ» ротавируса крупного рогатого скота является производственным, получен из ВИЭВ в 2009 году. Репродуцируется в перевиваемых линиях клеток MDBK, ЛЭК на среде Игла MEM с 10% фетальной сыворотки телят. Не патогенен для новорожденных телят, безвреден для морских свинок и кроликов. Инфекционная активность вируса составляет 5,2 lg 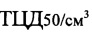 ;
;
- штамм 2-«КЛ-2» коронавируса крупного рогатого скота является производственным, получен из ВИЭВ в 2009 году. Репродуцируется в перевиваемых линиях клеток MDBK, Т-1, ЛЭК на среде Игла MEM с 10% фетальной сыворотки телят. Непатогенен для новорожденных телят, безвреден для белых мышей, морских свинок и кроликов. Инфекционная активность вируса составляет 5,2 lg 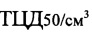 , гемагглютинизирующая активность - 1:64.
, гемагглютинизирующая активность - 1:64.
Производственные штаммы вирусов хранят в лиофилизированном состоянии. Для лиофилизации используют защитную среду, состоящую из 30% желатина, 2% пептона и 10% сахарозы. Лиофилизированные вирусы хранят при температуре не выше минус 20°С.
Пример 1. Получение культуральных вирусных суспензий производственных штаммов.
Вирус парагриппа - 3 (штамм «ПТК-45/86») культивируют в перевиваемой культуре клеток трахеи эмбриона коровы TR, выращенной в роллерных бутылях на комбинированной среде, состоящей из среды Игла MEM - 40% ГЛА - 40%, среды 199 - 10% и сыворотки крупного рогатого скота - 10%. Монослой формируется на 2-3 сут при посевной концентрации 130-150 тыс. клеток на 1 см3 среды. Перед заражением ростовую среду сливают и монослой перевиваемой культуры клеток промывают раствором Хенкса. Затем вносят для культивирования вируса поддерживающую средув количестве 300-350 см3 следующего состава: среда Игла MEM - 99% и 3%-ный раствор глутамина - 1%, в которую предварительно вносят вирус в дозе 0,1-1,0 ТЦД 50/см3 клетка и антибиотики пенициллин и стрептомицин. Бутыли инкубируют в роллерной установке при 37°С в течение 3-4 суток. Сбор культуральной вируссодержащей жидкости производят в период выраженного цитопатического эффекта. Освобождение вирусов из клеток осуществляют путем трехкратного замораживания и оттаивания.
Вирус инфекционного ринотрахеита крупного рогатого скота (штамм «ТК-А (ВИЭВ)-В2») культивируют в перевиваемой культуре клеток почки эмбриона коровы (линия MDBK), выращенной в роллерных бутылях на комбинированной среде, состоящей из среды Игла MEM - 89%; 3%-ный раствор глутамина - 1% и сыворотки крупного рогатого скота - 10%. Монослой формируется на 2-3 сут при посевной концентрации 120-140 тыс. клеток на 1 см3 среды. Перед заражением ростовую среду сливают и монослой промывают раствором Хенкса. Затем вносят для культивирования вируса герпесвируса типа 1 поддерживающую среду в количестве 300-350 см3 следующего состава: среда Игла MEM - 99% и 3%-ный раствор глутамина - 1%, в которую предварительно вносят вирус в дозе 0,1-1,0 ТЦД 50/клетка и антибиотики пенициллин и стрептомицин. Бутыли инкубируют в роллерной установке при 37°С в течение 2-3 суток. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Освобождение вирусов из клеток осуществляют путем трехкратного замораживания и оттаивания.
Вирус вирусной диареи (штамм «ВК-1») культивируют в перевиваемой культуре клеток почки эмбриона коровы (линия MDBK), выращенной в роллерных бутылях на комбинированной среде, состоящей из среды Игла MEM - 89%; 3%-ного раствора глутамина - 1% и сыворотки крупного рогатого скота - 10%. Монослой формируется на 2-3 сут при посевной концентрации 120-140 тыс. клеток на 1 см3 среды. Перед заражением ростовую среду сливают и монослой промывают раствором Хенкса. Затем вносят для культивирования вируса поддерживающую среду в количестве 300-350 см3 следующего состава: среда Игла MEM - 99% и 3%-ный раствор глутамина - 1%, в которую предварительно вносят вирус в дозе 0,1-1,0 ТЦД 50/клетка и антибиотики пенициллин и стрептомицин. Бутыли инкубируют в роллерной установке при 37°С в течение 2-3 суток. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Освобождение вирусов из клеток осуществляют путем трехкратного замораживания и оттаивания.
Ротавирус крупного рогатого скота (штамм «РМ») культивируют в перевиваемой культуре клеток почки эмбриона коровы (линия MDBK), выращенной в роллерных бутылях на комбинированной среде, состоящей из среды Игла MEM - 89%; 3%-ного раствора глутамина - 1% и сыворотки крупного рогатого скота - 10%. Монослой формируется на 2-3 сут при посевной концентрации 120-140 тыс. клеток на 1 см3 среды. Перед заражением ростовую среду сливают и монослой промывают раствором Хенкса. Затем вносят для культивирования ротавируса поддерживающую среду в количестве 300-350 см3 следующего состава: среда Игла MEM - 97%, 2%-ный раствор трипсина - 1% и 3%-ный раствор глутамина - 1%, в которую предварительно вносят вирус в дозе 0,1-1,0 ТЦД 50/клетка и антибиотики пенициллин и стрептомицин. Бутыли инкубируют в роллерной установке при 37°С в течение 2-3 суток. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Освобождение вирусов из клеток осуществляют путем трехкратного замораживания и оттаивания.
Коронавирус крупного рогатого скота (штамм 2-«КЛ-2») культивируют в перевиваемой культуре клеток почки эмбриона коровы (линия MDBK), выращенной в роллерных бутылях на комбинированной среде, состоящей из среды Игла MEM - 89%; 3%-ного раствора глутамина - 1% и сыворотки крупного рогатого скота - 10%. Монослой формируется на 2-3 сут при посевной концентрации 120-140 тыс. клеток на 1 см3 среды. Перед заражением ростовую среду сливают и монослой промывают растворомХенкса. Затем вносят для культивирования коронавируса поддерживающую среду в количестве 300-350 см3 следующего состава: среда Игла MEM - 98%, 2%-ный раствор трипсина - 1% и 3%-ный раствор глутамина - 1%, в которую предварительно вносят вирус в дозе 0,1-1,0 ТЦД 50/клетка и антибиотики пенициллин и стрептомицин. Бутыли инкубируют в роллерной установке при 37°С в течение 2-3 суток. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Освобождение вирусов из клеток осуществляют путем трехкратного замораживания и оттаивания.
Пример 2. Осветление, концентрирование, объединение вирусных суспензий в серию и приготовление антигена.
Культуральные вирусные суспензии осветляют путем центрифугирования при 3000-3500 об/мин.
Получение, концентрирование антигенов вирусов парагриппа -3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусов производят путем осаждения на ПЭГ - 6000 в концентрации 7-8%, а также добавлением хлористого натрия до 3%. После полного растворения осадка вирусные материалы помещают в холодильную камеру при +4-8°С на 14-16 часов. Далее центрифугируют при 5000-8000 об/мин в течение 45 мин, осадок ресуспензируют в фосфатно-солевом буфере рН 7,2-7,4.
Концентрированные антигены вирусов проверяют на инфекционную активность путем титрования их на культурах МДВК и TR. Дополнительно проверяют гемагглютинирующую активность биомассы вируса ПГ-3 с 0,5-1%-ыми суспензиями эритроцитов морской свинки и коронавируса КРС с 0,5-0,8%-ыми суспензиями эритроцитов белых мышей.
Для приготовления вакцины используют смесь концентрированной биомассы вирусов ПГ-3, ИРТ, ВД-БС, рота- и коронавируса в объемном соотношении 1:1:1:1:1 с инфекционной активностью не ниже 8,5 Lg ТЦД 50/см3 и гемагглютинирующей активностью антигена вируса ПГ-3 не ниже 1:32 и коронавируса - 1:128.
Перед использованием концентрированные вирусные суспензии проверяют на стерильность в отношении бактерий и грибков путем высева их на питательные среды: МПБ, МПА, МППБ под вазелиновым маслом и среду Сабуро. Суспензии должны быть стерильны, в посевах не должно быть роста бактерий и грибков.
Пример 3. Инактивация концентрированных вирусных суспензий.
Инактивацию вирусов проводят 10%-ным раствором формальдегида в конечной концентрации 0,2% при температуре 37°С в течение 48 часов.
Расчет необходимого количества формалина для получения 0,2% раствора формальдегида производят по формуле: Х=А:Б×100, где Х - количество формалина в см3, которую нужно разбавить до 100 см3; А - необходимый процент формальдегида; Б - содержание формальдегида в неразведенном формалине.
Полноту инактивации вирусов оценивают в трех последовательных пассажах на культурах клеток MDBK и TR с интервалом 5 суток.
Пример 4. Приготовление масляного адъюванта.
Масляный адъювант для изготовления предлагаемой вакцины готовят из синтетического масла ПЭС-3М (кремнеорганическая жидкость ГОСТ 13004-77) и ланолина безводного, взятых в соотношении 85:15 объемных частей. Смесь масла и ланолина смешивают, автоклавируют при 1,0 атм. в течение 40 минут. Готовый адъювант охлаждают, проверяют на стерильность по общепринятой методике.
Пример 5. Составление производственной серии ассоциированной эмульсионной вакцины.
Для приготовления серии ассоциированной вакцины масляный адъювант смешивают в соотношении 1:1 со стандартизированной смесью концентрированных инактивированных вирусных антигенов и эмульгируют на аппарате «IKA Ultra-Turrax Т 50 basik» при 5 тыс. об/мин. в течение 3 минут. Полученную эмульсию переливают в емкость для расфасовки.
Пример 6. Контроль вакцины на стерильность, безвредность и антигенную активность.
Для проверки на стерильность из 6 флаконов вакцины каждой серии делают посевы по 0,2 см3 на МПБ, МПА, кровяной МПА, МППБ под вазелиновым маслом и агар Сабуро по 2 пробирки на каждый флакон. Посевы со всеми средами выдерживают в термостате при 37°С, а с агаром Сабуро - при 20-22°С в течение 15 суток. Питательные среды должны оставаться стерильными.
Безвредность каждой серии вакцины определяют на белых мышах. С этой целью вакцину тщательно взбалтывают и прогревают в термостате при температуре 37-38°С и вводят внутрибрюшинно 10 белым мышам в дозе 0,5 см3. Безвредность каждой 5-ой серии вакцины проверяют на 3-х телятах 1-2 месячного возраста. Препарат вводят в объеме 2,0 см3 внутримышечно в область верхней трети шеи. Наблюдение за животными ведут в течение 10 суток. Вакцину считают безвредной, если в течение срока наблюдения животные не заболеют и не погибают.
Антигенную активность вакцины контролируют на 3-х кроликах массой 2-2,5 кг, которым подкожно в области спины в дозе 1,0 см3 двукратно с интервалом 14 дней вводят биопрепарат. На 21 сут после ревакцинации у кроликов берут кровь и сыворотку исследуют в РТГА с коронавирусным и парагриппозным антигеном типа 3, в РВН с вирусом вирусной диареи, в ИФА, с вирусом инфекционного ринотрахеита и ротавирусным антигеном, используя соответствующие наборы диагностикумов согласно наставлениям по их применению.
Вакцину считают антигенно активной, если в сыворотке крови двукратно вакцинированных кроликов выявляются специфические антитела к вирусу парагриппа-3 в титрах 1:160-1:320 в РТГА, к вирусам вирусной диареи 1:16-1:32 в РВН, и вирусу инфекционного ринотрахеита к ротавирусу - 1:512-1024 в ИФА, коронавирусу - 1:128-256 в РТГА.
Пример 7. Эффективность вакцины оценивали по сохранности телят до и после применения вакцины в неблагополучных по респираторно-кишечным заболеваниям КРС хозяйствах.
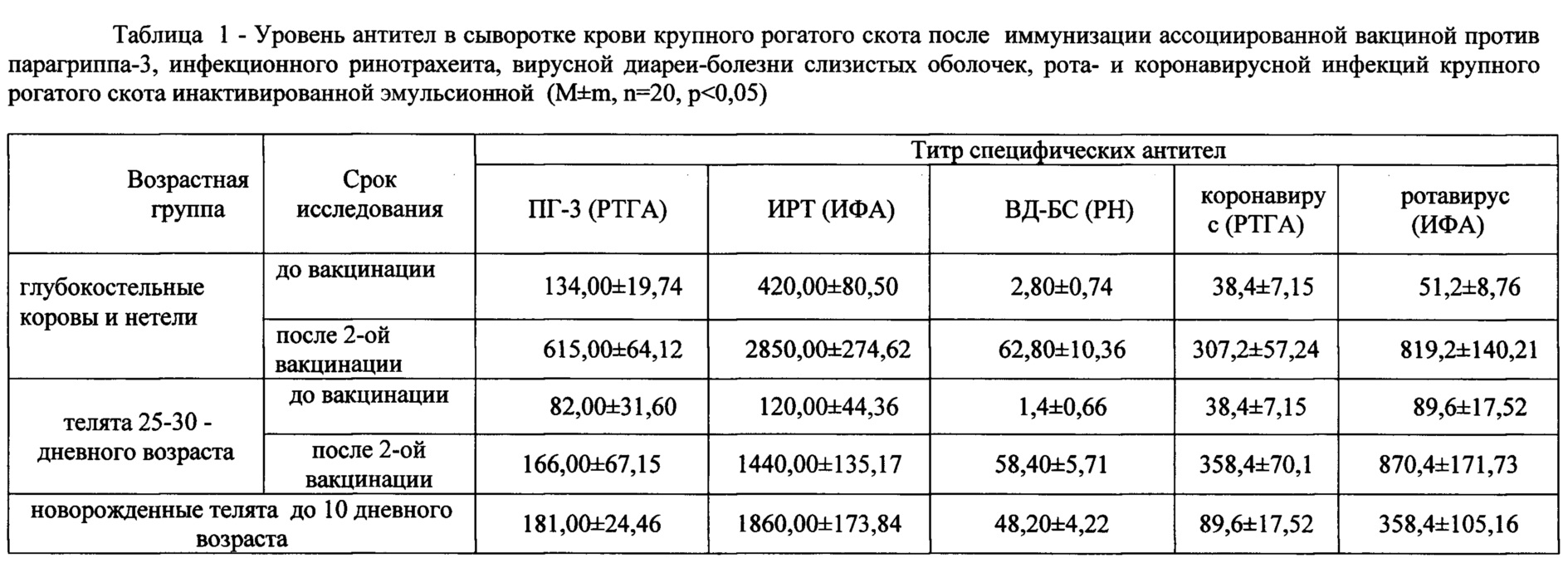
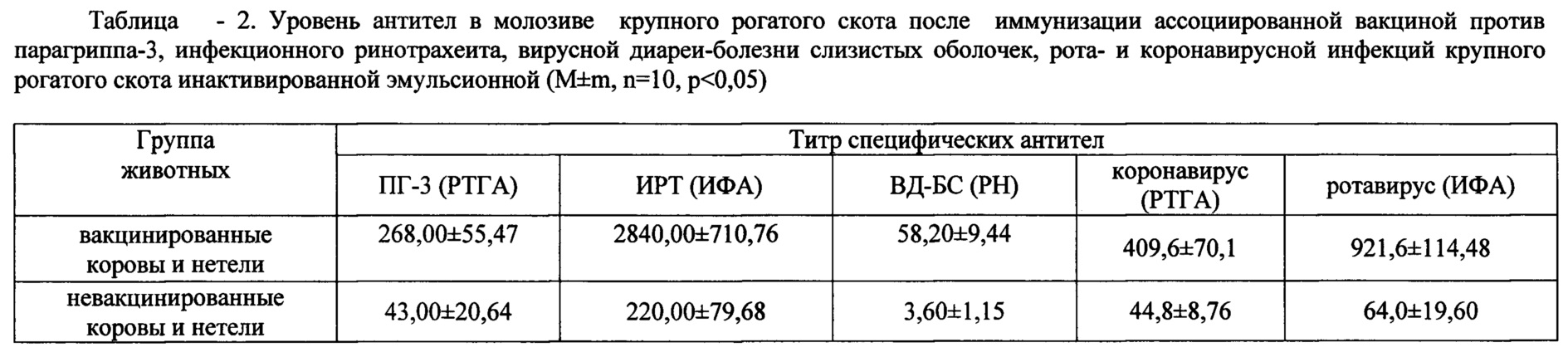
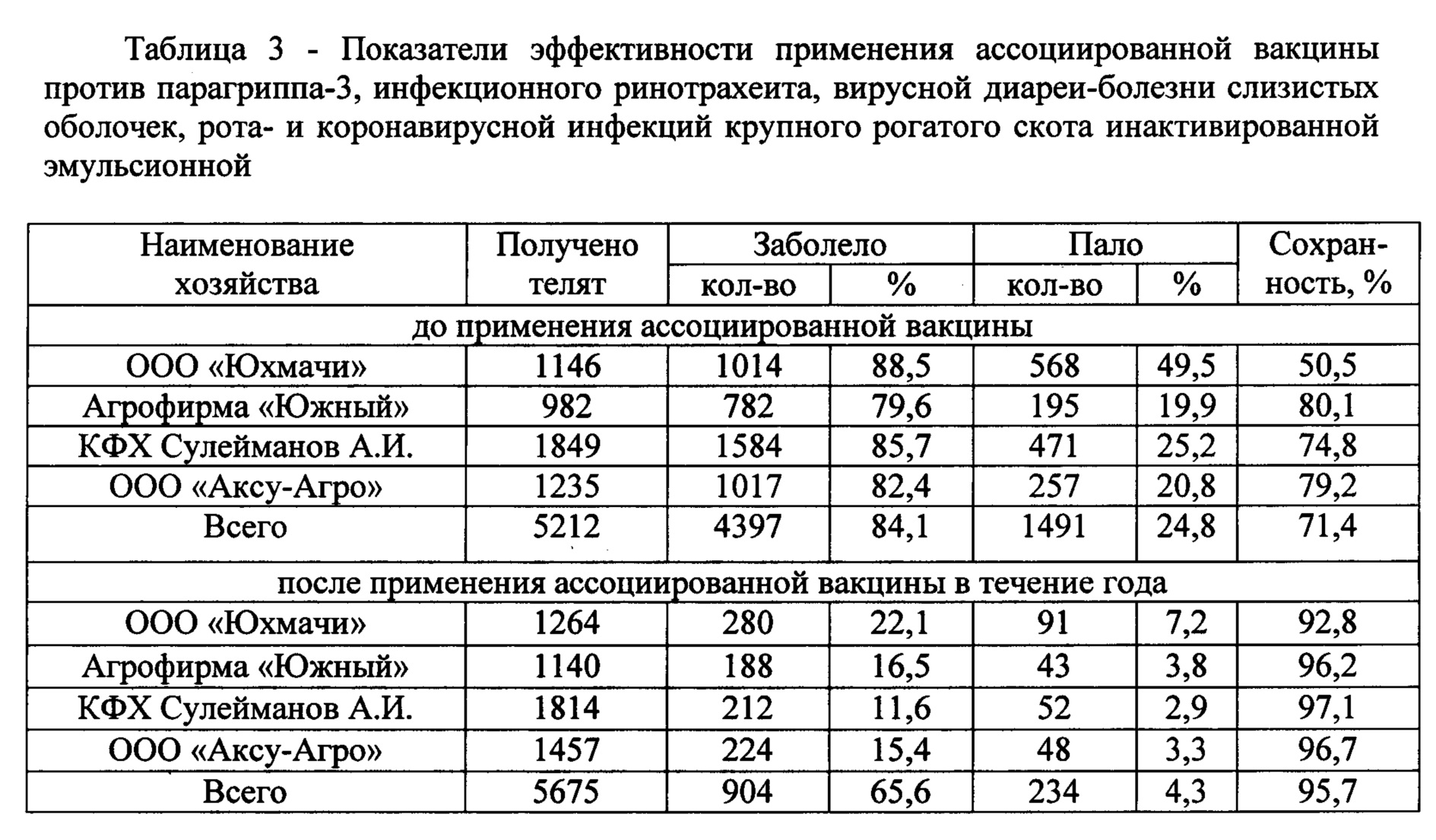
Производственные испытания экспериментальных серий вакцины проводили в ООО «Аксу-Агро» Аксубаевского, ООО «АФ Южный» и КФХ «Сулейманов А.И.» Нурлатского и ООО «Юхмачи» Алькеевского районов Республики Татарстан. Стельным коровам вакцину вводили внутримышечно за 1,5-2 мес до отела двукратно в дозах по 2 см3. Телят, полученных от вакцинированных коров, вакцинировали в 10-12 дневном возрасте двукратно в дозах по 1 см3. Коров и телок случного возраста вакцинировали однократно за 1,5-2 мес до осеменения в дозе 2 см3. Результаты испытания вакцины в неблагополучных хозяйствах представлены в таблице 1-3. Данные таблиц свидетельствуют о том, что «Вакцина ассоциированная против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота инактивированная эмульсионная» обладает высокой стабильностью антигенной (табл. 1 и 2) и иммуногенной активностями (табл. 3) и повышает сохранность животных до 95,7%.
Пример 8. Общие сведения, биологические свойства, порядок применения «Вакцины ассоциированной против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота инактивированной эмульсионной».
Общие сведения.
Вакцина изготовлена из концентрированных антигенов вирусов парагриппа-3 (штамм «ПТК-45/86»), инфекционного ринотрахеита (штамм «ТК-А (ВИЭВ)-В2»), вирусной диареи (штамм «ВК-1»), ротавируса крупного рогатого скота (штамм «РМ»), и коронавируса крупного рогатого скота (штамм 2-«КЛ-2» инактивированных формалином (0,2% к объему), эмульгированных в равном соотношении с масляным адъювантом (15% ланолина, 85% ПЭС-3).
По внешнему виду вакцина представляет собой эмульсию розовато-белого цвета. При длительном хранении допускается незначительное расслоение эмульсии, восстанавливающийся при взбалтывании.
Вакцина расфасована по 50,0 и 100,0 см3 в стеклянные флаконы соответствующей вместимости, укупоренные резиновыми пробками, укрепленными алюминиевыми колпачками.
Флаконы с вакциной упакованы в картонные коробки с разделительными перегородками, обеспечивающими их целостность. В каждую коробку вложена инструкция по применению вакцины.
Срок годности вакцины 12 мес с даты выпуска при соблюдении условий хранения и транспортирования.
Запрещено использовать вакцину по истечении срока годности.
Вакцину хранят и транспортируют в сухом темном месте при температуре от 2 до 8°С.
Вакцину следует хранить в местах, недоступных для детей.
Вакцину во флаконах без этикеток, с истекшим сроком годности, с нарушением целостностью и/или герметичности укупорки, с измененным цветом и/или консистенцией содержимого, с наличием посторонних примесей, а также остатки вакцины, не использованные в течение 4 ч после вскрытия флаконов, бракуют, обеззараживают путем кипячения в течение 30 мин или обрабатывают 2% раствором щелочи или 5% раствором хлорамина (1:1) в течение 30 мин и утилизируют.
Утилизация обеззараженной вакцины не требует соблюдения специальных мер предосторожности.
Биологические свойства
Вакцина вызывает формирование иммунного ответа у крупного рогатого скота к парагриппу-3, инфекционному ринотрахеиту, вирусной диареи, рота- и коронавирусной инфекциям через 14 сут после двукратного введения продолжительностью 12 месяцев.
Вакцина безвредна, лечебными свойствами не обладает.
Порядок применения вакцины.
Вакцина предназначена для профилактики парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота в угрожаемых и стационарно неблагополучных хозяйствах.
Запрещено вакцинировать клинически больных и/или ослабленных животных.
Вакцинации подлежит крупный рогатый скот с 10-12 дневного возраста и старше. Вакцину вводят внутримышечно в среднюю треть шеи двукратно с интервалом 14-15 дней в дозах: телятам от 10 дней до 6 мес по 1,0 см3, молодняку в возрасте старше 6 мес и взрослым животным по 2,0 см3.
Ревакцинацию телят проводят через 6 мес однократно в дозе 2,0 см3.
Стельных коров и нетелей вакцинируют за 2 мес до отела.
Коров и телок случного возраста вакцинируют однократно за 1,5-2 мес до осеменения в дозе 2,0 см3.
Перед применением вакцину подогревают на водяной бане до температуры 37-38°С, в процессе применения флаконы с вакциной периодически взбалтывают.
Вакцину вводят с соблюдением правил асептики и антисептики, для введения используют стерильные материалы и инструменты. Для каждого животного используют отдельную иглу или одноразовые стерильные шприцы. Место инъекции обрабатывают 70° спиртом.
Симптомов проявления парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота-, коронавирусной инфекций или других патологических признаков при передозировке вакцины не установлено.
Следует избегать нарушений схемы проведения вакцинации, поскольку это может привести к снижению эффективности иммунопрофилактики парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота-, коронавирусной инфекций крупного рогатого скота. В случае пропуска очередного введения вакцины необходимо провести иммунизацию как можно скорее.
При применении вакцины в соответствии с настоящей инструкцией побочных явлений, как правило, не отмечается. У отдельных животных через сутки после вакцинации возможно незначительное повышение температуры и формирование припухлости в месте инъекции, самопроизвольно исчезающей через 10-15 суток.
Запрещается применение вакцины ассоциированной против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота совместно с другими иммунобиологическими препаратами, а также с антигельминтиками и инсектоакарицидами в течение 14 сут до и после очередной иммунизации.
Молоко и продукты от вакцинированных животных реализуют без ограничений независимо от сроков вакцинации.
Меры личной профилактики.
При работе с вакциной следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными средствами ветеринарного назначения.
Все лица, участвующие в проведении вакцинации, должны быть одеты в спецодежду (резиновые сапоги, халат, брюки, головной убор, резиновые перчатки) и обеспечены очками закрытого типа. В местах работы должна быть аптечка первой доврачебной помощи.
В случае попадания вакцины на кожу и/или слизистые оболочки их рекомендуется немедленно промыть большим количеством чистой воды с мылом. При случайном введении вакцины человеку, необходимо место укола обработать 70°-ным раствором этилового спирта и обратиться в медицинское учреждение и сообщить об этом врачу.
Источники информации
1. Гаффаров, Х.З. Этиологическая структура и клинико-эпизоотические особенности смешанных форм диареи новорожденных телят / Х.З. Гаффаров, Г.Н. Спиридонов, Ф.В. Елисеева и др. // Матер, науч.-произв. конф. по проблемам ветеринарии и животноводства, Казань. - 1995. - С. 67.
2. Гумеров, В.Г. Специфическая профилактика парагриппа-3, инфекционного ринотрахеита и хламидиоза крупного рогатого скота / В.Г. Гумеров, Р.Х. Хамадеев, B.C. Угрюмова, Ф.М. Хусаинов и др. // Тезисы докладов междунар. начн.-практ.конф. - Витебск. - 1996. - С. 95.
3. Закутский, Н.И. Опыт профилактики и борьбы с инфекционным ринотрахеитом (ИРТ) и парагриппом-3 (ПГ-3) крупного рогатого скота / Н.И. Закутский, В.И. Жестерев, Л.Д. Конакова и др. // Диагностика, профилактика и меры борьбы с особо опасными, экзотич. и зооантропоноз. болезнями животных. - Сб. статей междунар. науч.-практ.конф. - Покров. - 2000. - С. 60-62.
4. Инструкция по применению набора для диагностики коронавирусного энтерита крупного рогатого скота методом гемагглютинации. Утв. Россельхознадзором 12.06.2008 г. Рег. №ПВР-1-4.7/02081.
5. Коромыслов, Г.Ф. Этиологическая роль рота-, коронавирусов в возникновении диареи телят /Г.Ф. Коромыслов, B.C. Авилов, М.М. Гоголев и др. // Профилактика болезней молодняка с. -х. животных Сибири и Дальнего Востока. Новосибирск, 1982. - С. 6-13.
6. Крюков, Н.Н. Инфекционный ринотрахеит - пустулезный вульвовагинит крупного рогатого скота / Н.Н. Крюков // Итоги науки и техники. Животноводство и ветеринарии. - М. - 1980. - Т. 13. - С. 32-38.
7. Лисицын, В.В. Вакцинопрофилактика диареи новорожденных телят рота-, коронавирусной этиологии / В.В. Лисицын, Т.Б. Никитина, В.В. Думова и др. // Российский ветеринарный журнал. - 2006. - №3. - С. 1618.
8. Мищенко, В.А. Особенности респираторных инфекций телят / В.А. Мищенко, А.А. Гусев, Н.А. Яременко и др. // Ветеринария. - 2000. - №9. - С. 5-6.
9. Соколова Н.Л. Перспективы диагностики и специфической профилактики желудочно-кишечных болезней новорожденных животных / Н.Л. Соколова // Труды ВИЭВ. - Т. 75. - М.: ВИЭВ, 2010. - С. 112-114.
10. Спиридонов Г.Н. Желудочно-кишечные заболевания новорожденных телят в условиях промышленных комплексов и разработка лечебно-профилактических мероприятий / Г.Н. Спиридонов. - Ветеринарный врач. - 2007. - С. 26-29.
Вакцина ассоциированная против парагриппа-3, инфекционного ринотрахеита, вирусной диареи, рота- и коронавирусной инфекций крупного рогатого скота инактивированная эмульсионная, содержащая активное вещество, инактивированное формалином, и адъювант, отличающаяся тем, что в качестве активного вещества она содержит смесь очищенного инактивированного, концентрированного антигена штамма «ПТК-45/86» вируса парагриппа-3 крупного рогатого скота на фосфатном буфере рН 7,2-7,4 с активностью не менее 8,5 Lg ТЦД 50/см; очищенного инактивированного, концентрированного антигена штамма «ТК-А (ВИЭВ)-В2» вируса инфекционного ринотрахеита крупного рогатого скота на фосфатно-солевом растворе рН 7,2-7,4 с активностью не менее 8,5 Lg ТЦД 50/см; очищенного инактивированного, концентрированного антигена штамма «ВК-1» вируса вирусной диареи - болезни слизистых оболочек крупного рогатого скота на фосфатно-солевом буфере рН 7,2-7,4 с активностью не менее 8,0 Lg ТЦД 50/см; очищенного инактивированного, концентрированного антигена штамма «РМ» ротавируса крупного рогатого скота на фосфатно-буферном растворе рН 7,2-7,4 с активностью не менее 8,2 Lg ТЦД 50/см; очищенного инактивированного, концентрированного антигена штамма 2-«КЛ-2» коронавируса крупного рогатого скота на фосфатно-буферном растворе рН 7,2-7,4 с активностью не менее 8,2 Lg ТЦД 50/см, взятую в объемном соотношении 1:1:1:1:1, а в качестве адъюванта содержит смесь синтетического масла ПЭС-3М и ланолина безводного, взятого в объемном соотношении 85:15, при этом для приготовления серии ассоциированной вакцины масляный адъювант смешивают в объемном соотношении 1:1 со смесью концентрированных вирусных антигенов.
