Результат интеллектуальной деятельности: СПОСОБ ПРОИЗВОДСТВА ФАКТОРА VIII, ИМЕЮЩЕГО УЛУЧШЕННОЕ СООТНОШЕНИЕ FVIII:C/FVIII:Ag
Вид РИД
Изобретение
Данное изобретение относится к способу производства продукта Фактора VIII, имеющего улучшенное соотношение FVIII:C/FVIII:Ag в продукте Фактор VIII с помощью хроматографии, и медикаменту, содержащему продукт, который может быть получен с помощью способа по данному изобретению, с содержанием мономера ≥ 98%.
Уровень техники в области изобретения
Нативная молекула Фактора VIII при нормальных условиях циркулирует [в крови] в виде комплекса, имеющего легкую (для обоих вариантов FVIII - полноразмерного, происходящего из плазмы, и с делецией B-домена - весом в 80 кДа) и тяжелую цепь (в случае происходящего от плазматического или рекомбинантого полноразмерного Фактора VIII весом 200 кДа, а для рекомбинантного с делецией B-домена Фактора VIII - весом в 90 кДа). Точные условия ассоциации тяжелой и легкой цепей детально неизвестны, однако в опубликованных статьях предполагается вовлечение металлоионного мостика, который вместе с гидрофобными взаимодействиями формирует комплекс и удерживает его вместе. Предполагается, что во взаимодействии участвуют ионы различных металлов, включая в себя кальций, медь, цинк, марганец и т.д. (1) Для недавно разработанного рекомбинантного продукта Фактора VIII с делецией B-домена установлено, что молекула содержит три иона металлов - кальция, меди и цинка. (2) Без металлического мостика легкая и тяжелая цепи молекулы Фактор VIII, по отдельности, не имеют биологической активности, однако обладают антигенной активностью. В нескольких публикациях сообщено (3, 4), что in vivo существует риск формирования ингибитора, особенно, что касается легкой цепи Фактора VIII. Таким образом, в продукте Фактора VIII, инъецируемом пациентам, в котором должны присутствовать минимальные количества одиночных легких и тяжелых цепей, соотношение активности FVIII:C/FVIII:Ag должно быть близко к 1,0 (единице)(5), особенно в отношении легкой цепи Фактора VIII.
В целом, агрегация белков является фактором риска в способе очистки не только вследствие потерь желаемого продукта, но также вследствие потенциального формирования ингибитора (6). При определенных биохимических условиях рекомбинантный Фактор VIII может агрегировать (7, 8), что приводит к существенному уменьшению его биологической активности. Продукт Фактора VIII с агрегированным Фактором VIII, таким образом, будет содержать неактивные формы Фактора VIII с содержанием мономера <100%. Содержание мономера продукта фармацевтического белка должно быть близко к 100% с минимально возможным количеством неактивных форм Фактора VIII (агрегаты, фрагменты и т.д.).
Было описано множество процессов очистки Фактора VIII из плазмы или культур, которые рекомбинантно продуцируют Фактор VIII (rFVIII). В качестве примера [патентная заявка] WO 2009/156430 описывает серию хроматографических стадий очистки Фактора VIII, включая в себя стадию, основанную на аффинном [связывании] Fab не животного происхождения, в которой лиганд весом 13 килодальтон (кДа) связывается с легкой цепью Фактора VIII. Другая хроматографическая стадия, упомянутая в заявке, включает в себя комбинированную анионно-катионную смолу, катионный обмен, анионный обмен и гель фильтрацию. Информация, касающаяся удаления неактивных форм или содержания агрегатов Фактора VIII, в данной патентной заявке не представлена. В статье «Purification and characterization of a new recombinant factor VIII»(9) описаны четыре стадии хроматографического способа очистки Фактора VIII, включая в себя аффинную стадию с моноклональным антителом в качестве лиганда, который связывается с тяжелой цепью Фактора VIII. Три другие стадии - это комбинированная хроматографическая смола, анионообменная смола и стадия гель-фильтрации, информация об устранении неактивных форма или содержания агрегата Фактора VIII в данной статье не представлена. В статье «Development and validation of an affinity chromatography step using a peptide ligand for cGMP production of Factor VIII» (10), описан пятистадийный хроматографический способ, включающий в себя аффинную стадию, основанную на пептиде, в которой лиганд 2,7 кДа связывается с легкой цепью Фактора VIII. Описано, что избыток легкой цепи Фактора VIII, полученный в способе культивирования, удаляли в ходе отмывки смолы, аффинной к пептиду. Другие четыре хроматографических стадии представляют собой катионообменную смолу, анионообменную смолу, смолу гидрофобных взаимодействий и стадию гель-фильтрации. Установлено, что две хроматографические стадии, следующие за смолой, аффинной к пептиду, устраняют избыток легкой цепи Фактора VIII, но точно не определено, на какой стадии. Информации, касающейся удаления неактивных форм иных, чем легкая цепь Фактора VIII, или содержания агрегата Фактора VIII в этой статье не представлено. В статье (11) описано применение нового аффинного адсорбента для захвата и очистки соединений рекомбинантного Фактора VIII аффинной смолой с лигандом [весом] 13 кДа, основанным на Fab, для очистки Фактора VIII, информация об удалении неактивных форм или содержании агрегата Фактора VIII в данной статье не предоставлено.
Как описано в статьях (5), (12), коммерчески доступные на рынке продукты рекомбинантного Фактора VIII содержат неактивные формы Фактора VIII, как показывают измерения соотношения биологически активного Фактора VIII (Фактор VIII:C), отнесенного к общему количеству Фактора VIII (Фактор VIII:Ag), что имеет потенциально негативные эффекты для пациентов в отношении иммунологических реакций.
Биологически активный Фактор VIII определяется как Фактор VIII, имеющий активность Фактора VIII, которая при нормальных условиях in vivo может быть активирована до Фактора VIIIa через ферментативные реакции, которые представляют собой существенную часть каскада свертывания [крови], цель которого - остановка кровотечений. Биологически активный Фактор VIII может быть измерен двумя разными аналитическими способами in vitro (FVIII:C), например, хромогенным анализом FVIII и/или одностадийным анализом свертывания. (13) Хромогенный анализ представляет собой двухстадийный фотометрический способ, который измеряет биологическую активность фактора VIII как кофактора. Фактор VIII активирует фактор X до фактора Xa, который, в свою очередь, ферментативно расщепляется в продукт, который может быть количественно определен спектрофотометрически. Одностадийный анализ свертывания основан на способности образца, содержащего фактор VIII, корректировать время свертывания плазмы, дефицитной по фактору VIII в присутствии фосфолипида, контактного активатора и ионов кальция. Время появления фибринового сгустка измеряется в одну стадию.
WO-A-2008/134310 описывает способ стабилизации основного объема раствора рекомбинантного белка для хранения в замороженном состоянии, который содержит предоставление частично очищенного раствора рекомбинантного белка, который имеет концентрацию одновалентной соли, по меньшей мере, 100 мМ, и добавление углевода к упомянутому раствору в количестве, достаточном, чтобы при замораживании раствор имел температуру стеклования -56°C или выше.
WO 2010/115866A1 описывает молекулы и полипептиды, содержащие, по меньшей мере, одну аминокислотную последовательность, имеющую существенную идентичность (гомологию) с Фактором VIII человека или его биологически активным участком (участками), связанные с этим молекулы (такие как нуклеиновые кислоты, кодирующие такие полипептиды), композиции (такие как фармацевтические формы), содержащие такие полипептиды, и способы изготовления и использования таких полипептидов.
WO 97/33178A1 описывает способ тестирования пригодности фракции белка, содержащей фактор VIII, дальнейшая обработка которой вовлекает стадию пастеризации, и вовлекает тестирование исходного материала для фрагментов в диапазоне 20 - 50 кДа. Фрагменты Фактора VIII в этом диапазоне очевидно порождают формы ингибитора у пациента, ранее получавшего лечение фактором VIII. Даже партии, загрязненные такими фрагментами, могут быть использованы в производстве очень чистого безвирусного фактора VIII путем применения эксклюзионной хроматографии на гидрофильных материалах.
[Патент] США 4,675,385 A описывает быстрый и простой крупномасштабный способ очистки прокоагулянтного белка Фактор VIII человека, коров и свиней с использованием последовательной эксклюзионной хроматографии высокого разрешения в условиях, во-первых, низкой концентрации соли и, во-вторых, в условиях высокой концентрации соли в повторно растворенном коммерческом концентрате Фактора VIII:C (комплексный Фактор VIII). Хроматографическое разделение выполняли на эксклюзионной хроматографической колонке высокого разрешения, заполненной пористыми шариками, имеющими размер частиц от около 13 до около 35 микрон, диаметр пор от около 500 до около 2000 ангстрем, а объем пор от около 1,0 до около 1,8 мл на грамм. Первое хроматографическое разделение проводили в буферном водном растворе, используя буферный водный раствор как элюент. Низкомолекулярные составляющие (загрязнения) отделялись от Фактора VIII и высокомолекулярных составляющих (загрязнений). Второе хроматографическое разделение может быть выполнено после того, как Фактор VIII диссоциирует в буферном растворе, имеющем концентрацию от около 0,25 до около 0,45M ионов кальция. Вторая хроматографическая колонка заполнена тем же* материалом, что и первая колонка, и элюировалась буферным водным раствором, содержащим 0,25 - 0,45M ионов кальция. В колонке 2,5 × 60 см, 4 грамма коммерческого концентрата Фактора VIII могут быть очищены менее, чем за два часа. Способ пригоден к расширению его масштаба.
В EP 0 412 466 A2 описано раскрытие способа приготовления пастеризованного концентрата фактора VIII с высокой специфической активностью и стабильностью, который содержит загрязнения, абсорбируемые из раствора, содержащего фактор VIII, по меньшей мере, в ходе двух адсорбций с помощью Al(OH)3, анионообменника или Ca3(PO4)2, предпочтительно с использованием двух разных адсорбентов из этой группы.
FR 2 650 393 A1 раскрывает получение концентрата фактора VIII, имеющего специфическую активность и высокий выход, каковой концентрат свободен от постороннего белка не человеческого происхождения. Фактор VIII, полученный каким-либо способом, осаждается на колонке, содержащей анионообменный гель, предварительно уравновешенный первым буфером. После загрузки фактора VIII на колонку, гель отмывали вторым буфером пока не достигалась оптическая плотность менее, чем 0,1. Очищенный фактор VIII затем выделяли из геля 3-м буфером. После хроматографии специфическая активность составляла 30/1600 IU (международных единиц)/мг.
Cheng, Elisabeth et al. описывают в Biotechnology Letters, v. 32, n. 9, p. 1207-1214, 2010, что FVIII человека был очищен непосредственно из плазмы с помощью анионообменной хроматографии, за которой следовала гель-фильтрация. Протестированы три смолы Q-Sepharose, приводящие к 40% восстановлению активности FVIII с помощью смолы Q-Sepharose XL, около 80% - с помощью Q-Sepharose Fast Flow и 70% - с помощью Q-Sepharose Big Beads. Витамин K-зависимые факторы свертывания совместно элюировались с помощью FVIII с анионообменных колонок. На второй стадии очистки, когда использовалась Sepharose 6FF, 70% активности FVIII восстановлено с витамин К-зависимыми факторами.
Краткое описание изобретения
Задача данного изобретения состоит в предоставлении способа уменьшения количества одиночных легкой и тяжелой цепей в способе производства Фактора VIII и предоставления продукта с высоким содержанием мономера, в особенности для рекомбинантно продуцированного Фактора VIII. Другая задача данного изобретения состоит в предоставлении композиции, в которой одиночные легкая и тяжелая цепи (фрагменты) и агрегированные формы Фактора VIII могут быть устранены, и образовавшийся в основном мономерный раствор Фактора VIII может храниться в замороженном и/или лиофилизированном состоянии в течение нескольких лет, поддерживая в нем высокое содержание мономерного Фактора VIII.
Удивительно, но было обнаружено авторами данного изобретения, что способ производства продукта Фактор VIII, имеющего соотношение FVIII:C/FVIII:Ag, по меньшей мере, 0,7 и высокое содержание мономера в продукте Фактора VIII путем использования хроматографии, способен решить задачу, лежащую в основе данного изобретения. Способ по данному изобретению содержит действия, в которых, по меньшей мере, одна хроматографическая стадия выполняется путем использования аффинной хроматографической смолы, имеющей аффинность к специфическому связыванию Фактора VIII, на которую влияет лиганд аффинности, который иммобилизован на аффинной хроматографической смоле, упомянутый лиганд аффинности представляет собой происходящий из дрожжей фрагмент Fab весом 13 кДа против молекулы Фактора VIII.
Упомянутый лиганд аффинности связывается с частью молекулы FVIII - легкой цепью. Удивительно, в растворе, содержащем смесь, содержащую нативный Фактор VIII, образованный легкой и тяжелой цепью Фактора VIII в комплексе, и одиночную легкую цепь FVIII, не имеющую какой-либо биологической активности FVIII, легкая цепь FVIII без какой-либо биологической свертывающей активности может быть удалена из смеси путем обработки упомянутой аффинной смолой с помощью специфических условий отмывки. Специалисты в данной области техники должны ожидать, что будет удалено также существенное количество нативных молекул Фактора VIII, т.е. комплекса тяжелой и легкой цепей.
Упомянутый лиганд, в частности, иммобилизован на аффинной хроматографической смоле через гидрофильную спейсерную ножку, каковая смола представляет собой поперечно сшитый агарозный основной матрикс**, упомянутый лиганд аффинности представляет собой происходящий из дрожжей фрагмент Fab весом 13 кДа против молекулы Фактора VIII, и коммерчески доступный на фирме GE Healthcare под торговым наименованием VIIISelect.
В качестве альтернативы цель [данного изобретения] достигается с помощью процесса, предоставляющего соотношение FVIII:C/FVIII:Ag, по меньшей мере, 0,7 и дающего высокое содержание мономера Фактора VIII, в котором, по меньшей мере одна хроматографическая стадия выполняется путем использования, по меньшей мере, одной хроматографической стадии на анионообменной хроматографической смоле.
В качестве другой альтернативы данного изобретения описан способ предоставления соотношения FVIII:C/FVIII:Ag, по меньшей мере, 0,7 и высокого содержания мономера Фактора VIII, в котором, меньшей мере, одна хроматографическая стадия выполнена путем использования стадии эксклюзионной хроматографии при специфических условиях хроматографии и композиции буфера.
Согласно другой альтернативе данному изобретению, использующей те же хроматографические стадии, что и для удаления FVIII:C/FVIII:Ag, содержание мономера в продукте Фактор VIII составляет ≥ 98%.
В дополнительной альтернативе данному изобретению, получающееся высокое соотношение FVIII:C/FVIII:Ag и высокое содержание мономера FVIII: из предыдущей хроматографической стадии может сохраняться, меньшей мере, 12 месяцев, предпочтительно, по меньшей мере, 24 месяца, а наиболее предпочтительно, по меньшей мере, 36 месяцев в замороженном или лиофилизированном состоянии при неизменности свойств FVIII:C/FVIII:Ag и/или высоком содержании мономера Фактора VIII до использования пациентом.
Если два способа из трех способов по данному изобретению скомбинированы, становится возможным достичь соотношения FVIII:C/FVIII:Ag, по меньшей мере, 0,8, а если скомбинированы все три, тогда становится возможным соотношение, по меньшей мере, 0,9.
Например, способ по данному изобретению представлен способом производства продукта Фактор VIII, имеющего соотношение FVIII:C/FVIII:Ag, по меньшей мере, 0,7 и дающего высокое содержание мономера Фактора VIII мономер ≥ 98% и существенно не агрегированный продукт Фактор VIII путем использования хроматографии,
и в котором
стадия (a) - по меньшей мере, одна хроматографическая стадия выполняется путем использования аффинной хроматографической смолы, имеющей аффинность к специфическому связыванию Фактора VIII, на которую влияет лиганд аффинности, который иммобилизован на аффинной хроматографической смоле, упомянутый лиганд аффинности в способе по данному изобретению представляет собой происходящий из дрожжей фрагмент Fab весом 13 кДа, против молекулы Фактора VIII, и
в котором
стадия (b) - по меньшей мере, одна хроматографическая стадия выполняется на анионообменной хроматографической смоле. Порядок стадий может быть (b) после (a) или (a) после (b).
В соответствии с данным изобретением также возможно выполнять следующий способ производства продукта Фактор VIII, имеющего соотношение FVIII:C/FVIII:Ag, по меньшей мере, 0,7 и дающего высокое содержание мономера Фактора VIII ≥ 98% и существенно не агрегирующий продукт Фактор VIII путем использования хроматографии,
в которой
стадия (a) - по меньшей мере, одна хроматографическая стадия выполняется путем использования аффинной хроматографической смолы, имеющей аффинность к специфическому связыванию Фактора VIII, на которое влияет лиганд аффинности, который иммобилизован на аффинной хроматографической смоле, упомянутый лиганд аффинности в способе по данному изобретению представляет собой происходящий из дрожжей фрагмент Fab весом 13 кДа против молекулы Фактора VIII, и
в котором
стадия (c) - по меньшей мере, одна хроматографическая стадия выполняется путем использования стадии эксклюзионной хроматографии. Порядок стадий может быть (c) после (a) или (a) после (c).
По данному изобретению также возможно выполнение следующего способа производства продукта Фактор VIII, имеющего соотношение FVIII:C/FVIII:Ag, по меньшей мере, 0,7 и дающего высокое содержание мономера Фактора VIII ≥ 98% и существенно не агрегировавшего продукта Фактор VIII с помощью хроматографии,
в которой
стадия (b) - по меньшей мере, одна хроматографическая стадия проводится на анионообменной хроматографической смоле и
в которой
стадия (c) - по меньшей мере, одна хроматографическая стадия выполняется путем использования стадии эксклюзионной хроматографии. Порядок стадий может быть (c) после (b) или (b) после (c).
Еще один вариант осуществления состоит в комбинации трех процессов по данному изобретению. Например, способ по данному изобретению далее представлен способом производства продукта Фактор VIII, имеющим соотношение FVIII:C/FVIII:Ag, по меньшей мере, 0,9 и дающим высокое содержание мономера Фактора VIII ≥ 99% и существенно не агрегирующий продукт Фактор VIII с помощью хроматографии,
в которой
стадия (a) - по меньшей мере, одна хроматографическая стадия выполняется путем использования аффинной хроматографической смолы, имеющей аффинность к специфическому связыванию Фактора VIII, на которое влияет лиганд аффинности, который иммобилизован на аффинной хроматографической смоле, упомянутый лиганд в способе по данному изобретению аффинности представляет собой происходящий из дрожжей фрагмент Fab весом 13 кДа против молекулы Фактора VIII, и
в котором
стадия (b) - по меньшей мере, одна хроматографическая стадия выполняется на анионообменной хроматографической смоле, и
в котором
стадия (c) - по меньшей мере, одна хроматографическая стадия выполняется путем использования стадии эксклюзионной хроматографии. Порядок стадий может быть [таким]: (a), (b), (c); (a), (c), (b); (c), (b), (a); (c), (a), (b); (b), (c), (a); (b), (a), (c).
По данному изобретению молекула Фактора VIII, использованная в способах по данному изобретению, представляет собой комплекс легкой цепи и тяжелой цепи, а улучшенное соотношение of FVIII:C/FVIII:Ag возникает вследствие истощения легкой цепи Фактора VIII, тяжелой цепи Фактора VIII и/или диссоциации легкой цепи Фактора VIII/тяжелой цепи Фактора VIII из комплекса. Диссоциированные цепи Фактора VIII могут присутствовать вследствие способа производства культуры в результате мутаций, протеолитической/физической дегенерации и т.д., или вследствие ферментативной/физической дегенерации в ходе способа очистки. Диссоциированные легкая цепь FVIII и/или тяжелая цепь FVIII могут формировать или фрагменты Фактора VIII фрагменты и/или агрегаты Фактора VIII в зависимости от окружающей среды, например, буфера, концентрации белка и т.д. Таким образом, выгоднее удалить все формы Фактора VIII, которые не являются мономерными и/или обладают потенциалом образования агрегатов легче, чем нативная форма Фактора VIII.
По другому объекту данного изобретения молекула Фактора VIII, использованная в способе, могла быть нековалентно и/или ковалентно связана с другими веществами, например, фрагментами антител vWF, PEG, HES и/или FC и т.д. для продления времени полужизни продукта Фактора VIII, внесенными в тот же раствор по данному изобретению с высоким соотношением биологической активности и высоким содержанием финального продукта.
В конкретном варианте осуществления данного изобретения стадия аффинной хроматографии выполнялась в условиях, дающих возможность связывания Фактора VIII с аффинной смолой и удаления диссоциированной легкой цепи путем отмывки, прежде чем Фактор VIII элюируется. Связывание Фактора VIII с аффинной хроматографической смолой имеет место в условиях низкой солености, эквивалентной концентрации около 0,1 - около 0,5 моль/кг хлористого натрия. Затем выполнялась отмывка аффинной хроматографической смолы при повышенной концентрации соли, эквивалентной диапазону около 0,3 - около 4 моль/кг хлористого натрия для удаления легкой цепи, а затем, если требовалось, выполнялась стадия элюции и сбора для получения Фактора VIII в отдельной фракции путем использования концентрации соли, эквивалентной диапазону около 0,5 - около 4 моль/кг хлористого натрия и/или MgCl2 в комбинации с около 40 - около 60% спирта, предпочтительно этиленгликоля или пропиленгликоля или их смеси.
Аффинная смола создана таким образом, чтобы связывать легкую цепь, а не другие части молекулы Фактора VIII. Это стало возможным благодаря использованию лиганда аффинности определенного размера. Известно, что лиганды аффинности, которые слишком малы, например, химически синтезированные молекулы, вследствие стерических затруднений имеют трудности в связывании белка-мишени. Поэтому размер лиганда аффинности, требующегося по данному изобретению, находится в диапазоне ≥ 10 килодальтон. Поскольку ожидалась высокая аффинность к фрагменту молекулы Fab такого размера (14) и поскольку лиганд фактически направлен против легкой цепи FVIII, постольку было удивительно, что легкая цепь FVIII могла быть отмыта перед элюцией нативного комплекса, содержащего тяжелую цепь FVIII вместе с легкой цепью FVIII. В частности, аффинная смола основана на поперечно-сшитом агарозном матриксе со средним размером частиц около 74 мкм, и фрагмент лиганда аффинности антитела Fab, происходящий от дрожжей, [весом] около 13 кДа связан с матриксом через гидрофильную спейсерную ножку, чтобы сделать лиганд более доступным для связывания с молекулой Фактора VIII. Лиганд аффинности связывается с легкой цепью Фактора VIII биологически активной молекулы Фактора VIII.
В еще одном варианте осуществления способа по данному изобретению условия аффинной хроматографии содержат, по меньшей мере, два следующих условия;
- загрузка смолы биологически активным Фактором VIII, по меньшей мере, 5000 IU/мл смолы, предпочтительно, по меньшей мере, 10000 IU/мл смолы, а наиболее предпочтительно - более чем 20000 IU/мл смолы.
- Буферные условия при загрузке Фактора VIII: около 0,1- около 0,5 моль/кг NaCl, около 0,01- около 0,05 моль/кг CaCl2, около 0,01- около 0,05 моль/кг L-гистидина, около 0,005- около 0,05% (вес/вес) Polysorbate 80, около 0,5- около 2% Triton X-100, около 0,1- около 1% TNBP при рН 6,2 - 6,8.
- Буферные условия при отмывке: около 0,5 - около 4 моль/кг NaCl, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг L-гистидина, около 0,005 - около 0,05% (вес/вес) Polysorbate 80 при pH 6,2 - 6,8.
- Буферные условия при элюции Фактора VIII: около 0,5 - около 4 моль/кг NaCl, около 40 - около 60% этиленгликоля, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг L-гистидина, около 0,005 - около 0,05% (вес/вес) Polysorbate 80 при pH 6,2 - 6,8.
В еще одном конкретном варианте осуществления способа по данному изобретению анионообменная хроматография выполнялась в условиях, обеспечивающих связывание Фактора VIII с анионообменной хроматографической смолой, и биологически неактивные формы удалялись с анионообменной хроматографической смолы либо перед, либо после элюции биологически активного Фактора VIII. Содержание мономера фактора VIII во фракции элюции составляет ≥ 98%. В соответствии с способом по данному изобретению Фактор VIII нагружали в условиях низкого уровня солености, эквивалентного концентрации 0,01 - 0,15 моль/кг хлористого натрия для связывания Фактора VIII и удаления неактивных форм Фактора VIII, анионообменную хроматографическую смолу отмывали в условиях средней солености, эквивалентной концентрации 0,15 - 0,3 моль/кг хлористого натрия, для удаления неактивных форм Фактора VIII, а Фактор VIII элюировали из анионообменной хроматографической смолы и собирали в отдельную фракцию путем использования условий высокой солености, эквивалентных концентрации 0,3 - 1 моль/кг хлористого натрия.
Другие неактивные формы Фактора VIII элюировали с анионообменной хроматографической смолы и собирали в отдельную фракцию путем использования условий высокой солености, эквивалентных концентрации 1 - 2 моль/кг хлористого натрия.
В конкретном варианте осуществления анионообменного способа по данному изобретению биологически неактивный Фактор VIII удаляли путем анионообменной хроматографической стадии, приводящей к тому, что содержание мономера составляет ≥ 98% во фракции элюированного продукта, соблюдалось, по меньшей мере, два из следующих хроматографических условий:
- загрузка смолы биологически активным Фактором VIII, по меньшей мере, 10000 IU/мл смолы, предпочтительно - по меньшей мере, 15000 IU/мл смолы, а наиболее предпочтительно - более, чем 20000 IU/мл смолы;
- буферные условия в ходе загрузки Фактора VIII: около 0,05 - около 0,15 моль/кг NaCl, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг L-гистидина, около 0,005 - около 0,05% (вес/вес) Polysorbate 80 при рН 6,0 - 7,5;
- буферные условия в ходе отмывки: около 0,15 - около 0,3 моль/кг NaCl, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг L-гистидина, около 0,005 - около 0,05% (вес/вес) Polysorbate 80 при рН 6,0 - 7,5;
- буферные условия в ходе элюции Фактора VIII: около 0,3 - около 0,5 моль/кг NaCl, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг L-гистидина, около 0,005 - около 0,05% (вес/вес) Polysorbate 80 при рН 6,0 - 7,5.
В еще одном варианте осуществления анионообменного хроматографического способа по данному изобретению, анионообменная смола представляет собой сильный анионообменник с четвертичным ионом аммония в качестве лиганда, связанного с поперечно-сшитым 6% агарозным матриксом со сферическим диаметром около 45 - около 165 мкм, с общей способностью связывания ионов около 0,18 - около 0,25 моль/мл.
В еще одном конкретном варианте осуществления способа по данному изобретению эксклюзионная хроматография содержит, по меньшей мере, два следующих хроматографических условия:
- загрузка образца около 4- около 8% объема колонки,
- высота колонки около 60 - около 90 см,
- концентрация биологически активного Фактора VIII в загруженном образце составляет, по меньшей мере, 10000 IU/мл, предпочтительно - по меньшей мере, 15000 IU/мл, а наиболее предпочтительно - более чем 20000 IU/мл,
- буфер уравновешивания колонки для агрегации неактивных форм Фактора VIII: около 0,2 - около 0,7 моль/кг NaCl, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг цитрата натрия, около 0,5 - около 2% (вес/вес) сахарозы, около 0,5 - около 2% (вес/вес) L-аргинина, около 0,1 - около 1% (вес/вес) Poloxamer 188 при рН 6,0 -7,5,
в котором биологически активный Фактор VIII собирали в мономерной форме, тогда как неактивный Фактор VIII обнаруживался или во фракции, содержащей агрегированные неактивные формы (возможно - и агрегированные фрагменты (неактивные) и агрегированный мономерный Фактор VIII (активный в мономерном виде, но частично неактивный в агрегированном виде)) со стадии эксклюзионной хроматографии и/или во фракции, содержащей фрагментированные формы Фактора VIII на стадии эксклюзионной хроматографии, и
- сбор мономера Фактора VIII начинался, когда регистрировался пик поглощения около 30 - около 40 mAU на выходе колонки, и останавливался, когда пик поглощения возвращался снова к около 1- около 40 mAU, что соответствовало 2 - 3 кратному количеству относительно нанесенного образца.
В конкретном варианте осуществления эксклюзионной хроматографии по данному изобретению эксклюзионная смола представляет собой сферические [частицы] поперечно сшитой агарозно-декстрановой среды со средним диаметром около 34 мкм и оптимальным диапазоном разделения между 10000 - 600000 дальтон.
Другой конкретный вариант осуществления способа по данному изобретению, [в котором] элюат эксклюзионной хроматографии стабилен в течение, по меньшей мере, 12 месяцев, в частности - 36 месяцев, содержит, по меньшей мере, два из следующих условий:
- композиция буфера содержит: около 0,2 - около 0,7 моль/кг NaCl, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг цитрата натрия, около 0,5 - около 2% (вес/вес) сахарозы, около 0,5 - около 2% (вес/вес) L-аргинина, около 0,1 - около 1% (вес/вес) Poloxamer 188 при рН 6,0 - 7,5,
- замороженный раствор хранится при ≤ -60°C,
- замораживание раствора от комнатной температуры до ≤ -40°C занимает ≤ 90 минут,
- замороженный раствор, хранившийся при ≤ -60°С оттаивает до 18 - 25°С за ≤ 90 минут,
- оттаявший раствор используется для способа лиофилизации после установления концентрации Фактора VIII с помощью вышеупомянутого буфера и заполнения стеклянных флаконов по 250 IU, 500 IU, 1000 IU, 2000 IU, 3000 IU, 4000 IU или 5000 IU Фактора VIII на флакон.
- Лиофилизированный продукт по вышеизложенному, в котором содержание мономера фактора VIII составляет ≥ 99%.
- Лиофилизированный продукт согласно вышеизложенному, который может храниться, по меньшей мере, 12 месяцев, предпочтительно - 24 месяца, а наиболее предпочтительно - 36 месяцев, без существенного изменения мономера Фактора VIII после растворения и использования пациентом.
- Растворение продукта, представленного выше, который имеет композицию буфера: около 0,2 - около 0,7 моль/кг NaCl, около 0,01 - около 0,05 моль/кг CaCl2, около 0,01 - около 0,05 моль/кг цитрата натрия, около 0,5 - около 2% (вес/вес) сахарозы, около 0,5 - около 2% (вес/вес) L-аргинина, около 0,1 - около 1% (вес/вес) Poloxamer 188 при рН 6,0 - 7,5.
Объект данного изобретения также представляет собой продукт Фактор VIII, который может быть получен по способу по данному изобретению для лечения гемофилии и устранения формирования ингибиторов, в котором продукт стабилен в замороженном и/или лиофилизированном состоянии в течении, по меньшей мере, 6 месяцев, предпочтительно - по меньшей мере, 12 месяцев, более предпочтительно - по меньшей мере, 24 месяцев, а наиболее предпочтительно - до 36 месяцев. Такой Фактор VIII может быть получен путем особого способа прохождения вышеописанных трех стадий очистки: 1. аффинной стадии, 2. анионообменной стадии, 3. стадии эксклюзионной хроматографии в таком порядке.
Полученное путем использования такого порядка схемы очистки качество продукта FVIII в отношении высокого соотношения FVIII C/Ag и высокого содержания мономера (что означает низкое содержание агрегатов и фрагментов) сравнили с рекомбинантными продуктами FVIII, полученными с помощью различных схем очистки (22) и присутствующими на рынке. Продукт Фактор VIII по данному изобретению продемонстрировал превосходные результаты в отношении высокого соотношения Фактор VIII C/Ag и высокого содержания мономера при низком содержании фрагментов, как можно видеть из Таблицы 1. При дальнейшем сравнении in vivo между продуктом по данному изобретению и одним из рекомбинантных коммерчески доступных продуктов, можно было отметить уменьшенное количество случаев проблем с ингибитором у пациентов, ранее не получавших лечения от гемофилии А, как можно видеть из Табл. 2. Продукт rFVIII, для очистки которого был использован способ A (22) в Табл. 2 не имел такой же высокой способности повысить соотношение FVIII C/Ag и получить продукт с высоким содержанием мономера и низким содержанием фрагментов, как по способу очистки по данному изобретению, который очевидным образом влияет на количество иммунологических проблем у пациентов, ранее не получавших лечения от гемофилии А.
|
|
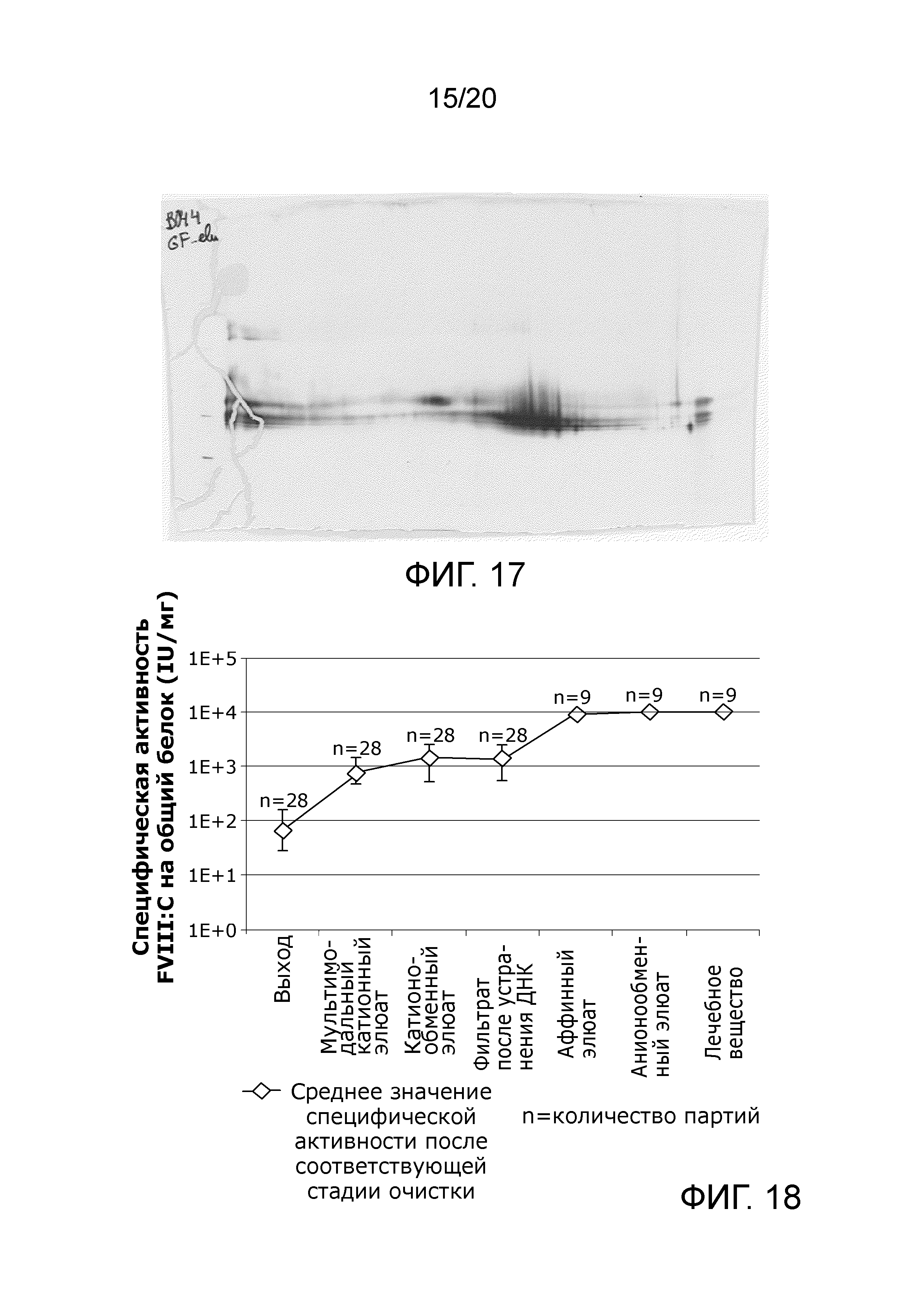
Еще один объект данного изобретения представляет собой улучшенную активность продукта по данному изобретению по сравнению с EP2537862A1. Это конкретно достигается особым способом прохождения через описанные выше три стадии очистки, 1. аффинная стадия, 2. анионообменная стадия, 3. стадия эксклюзионной хроматографии в таком порядке. В дополнение к этому содержатся специфические условия способа стадии эксклюзионной [хроматографии] по данному изобретению, которые обеспечивают требующееся высокое (>0,9) соотношение Фактор VIII C/Ag и содержание мономера (>99%) у пациентов. Это достигается также после хранения при -70°C в течение 12 месяцев, когда Фактор VIII хранится с использованием специфических буферных условий по данному изобретению, которые обеспечены последней стадией обмена эксклюзионного буфера и лиофилизацией продукта. Это, вероятно, минимизирует неблагоприятное соотношение Фактор VIII C/Ag и уменьшает содержание мономера в период хранения, что обеспечивает то, что продукт, даваемый пациентам, имеет уменьшенный риск нежелательных иммунологических реакций от агрегатов/фрагментов в растворе, который инъецируется пациентам (после растворения хранившегося лиофилизированного продукта). Кроме того, специфическая активность, измеренная как концентрация FVIII:C/белок с помощью аналитического способа Брэдфорда статистически достоверно более высока (10000 IU/мг, n=9) по сравнению со значением, описанным в EP2537862A1 (8061 IU/мг, n=1). Специфическая активность является индикатором чистоты продукта FVIII (способ измерения различных белков известен, дающий разные результаты, таким образом, требуется такой же способ для белков для получения сравнимых значений), который показывает превосходную активность продукта по данному изобретению по сравнению с EP2537862A1, поскольку белковые загрязнения являются одним из факторов риска проблем с ингибитором у пациентов. В дополнение анализ методом пептидных карт по изоэлектрической фокусировке, как изложено в EP2537862A1 и может быть обнаружено на Фиг. 17 данного изобретения, показывает различие свойств продуктов у соответствующих продуктов.
В конкретном варианте осуществления по данному изобретению Фактор VIII характеризуется тем, что соотношение биологически активного Фактора VIII (FVIII:C) относительно общего количества Фактора VIII (FVIII:Ag) составляет ≥ 0,7, предпочтительно ≥ 0,8, более предпочтительно ≥ 0,9, а наиболее предпочтительно 1, и содержание мономера фактора VIII составляет ≥ 98%, предпочтительно ≥ 99%, а наиболее предпочтительно 100% после последней стадии и что существенного количества агрегированного Фактора VIII невозможно было обнаружить.
В еще одном варианте осуществления по данному изобретению Фактор VIII сохраняет свою биологическую активность, высокое содержание мономерного Фактора VIII и низкое содержание агрегированного/фрагментированного Фактора VIII.
В еще одном варианте осуществления Фактор VIII по данному изобретению характеризуется тем, что он происходит из плазмы, имеет рекомбинантное происхождение и/или является дериватом делетированной или укороченной форм Фактора VIII, сохраняющим биологическую активность, в частности, FVIII с делецией B-домена, такой, как описан в 20, включенный по ссылке.
В еще одном варианте осуществления по данному изобретению Фактор VIII характеризуется тем, что в случае [фактора] рекомбинантного происхождения и/или деривата делеции он продуцируется в клетках человека.
В конкретном варианте осуществления по данному изобретению Фактор VIII характеризуется тем, что количество ингибиторов у ранее леченных или нелеченных от гемофилии A пациентов, получавших данный продукт, составляет < 25%, предпочтительно < 20%, более предпочтительно < 10%, а наиболее предпочтительно 0%.
Объектом данного изобретения также является продукт Фактор VIII, который может быть получен по способу по данному изобретению для лечения гемофилии и устранения формирования ингибиторов.
В частности, продукт по данному изобретению показывает количество ингибиторов у ранее леченных или нелеченных от гемофилии А пациентов после лечения продуктом по данному изобретению < около 25%, предпочтительно < около 20%, более предпочтительно < около 10%, а наиболее предпочтительно около 0%.
Крио-/лиопротекторы рекомендуются для защиты белка в способе лиофилизации и в ходе хранения, путем образования аморфного матрикса, окружающего белок.
Наполнитель может быть добавлен, чтобы он действовал как объемообразующий препарат для обеспечения механической поддержки в ходе лиофилизации и для увеличения сухого веса лечебного продукта. Наполнитель, таким образом, вносит вклад в униформность качества и внешний вид лиофилизированного продукта.
Кроме того, буферный агент может быть добавлен для поддержания значения рН, пригодного для белка и терапевтического использования продукта. Подходящие ингредиенты для лиофилизированных белков, например, описанные в WO2010/026186 A, включены по ссылке.
Краткое описание чертежей
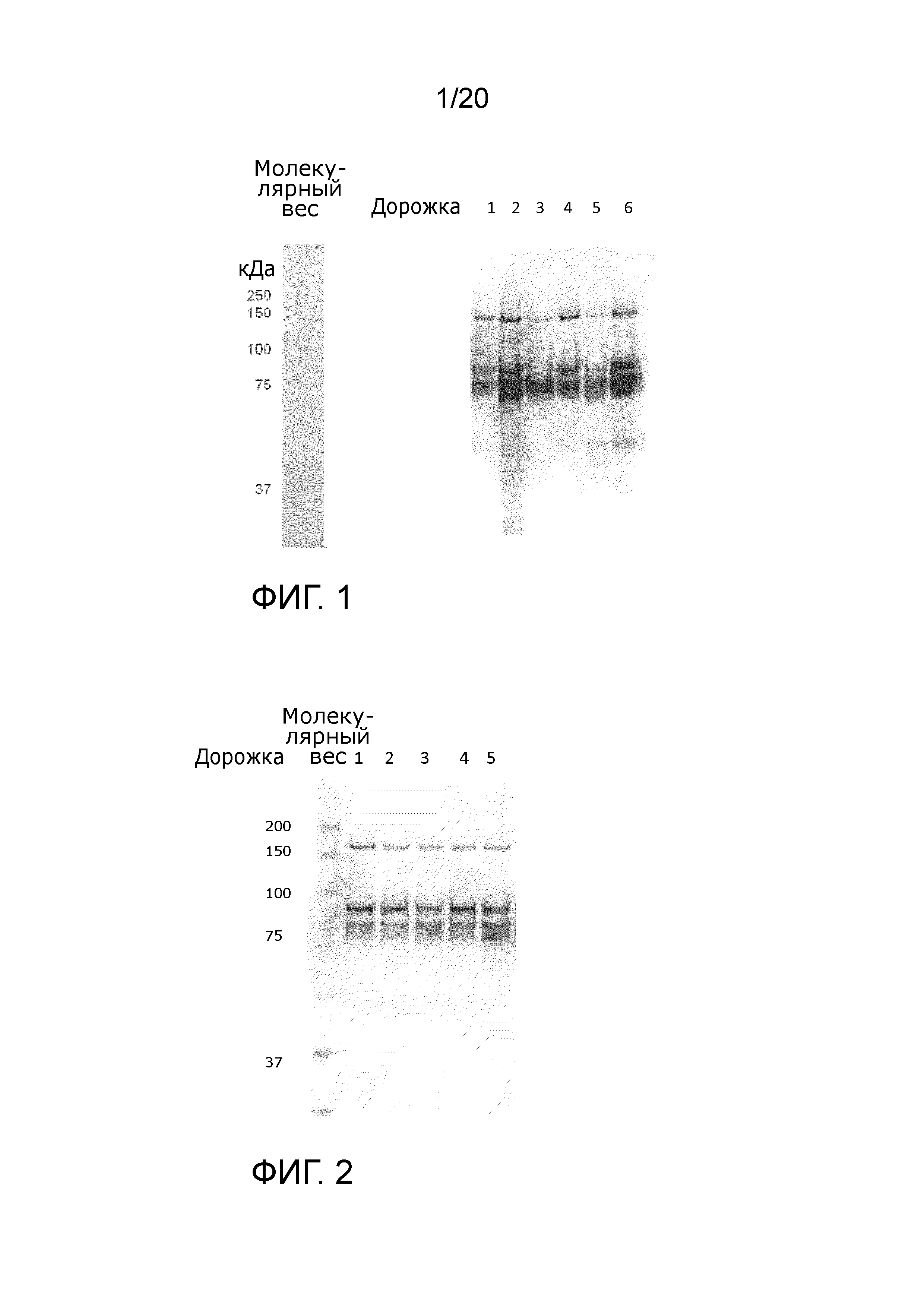
Фиг. 1: Вестерн-блоттинг с антителами к FVIII. Слева - стандарты молекулярного веса, Дорожка 1; Исходный материал аффинной стадии, FVIII:Ag 5,0 IU/мл, Дорожка 2; проток на аффинной стадии, FVIII:Ag 132 IU/мл, Дорожка 3; фракция отмывки на аффинной стадии, FVIII:Ag 26 IU/мл, Дорожка 4; элюат аффинной стадии (исходный материал Q), FVIII:Ag 5,8 IU/мл, Дорожка 5; анионообменный проток + eq., FVIII:Ag 1,7 IU/мл, Дорожка 6; отмывка анионообменника, FVIII:Ag 5,0 IU/мл. Фиг. 1 показывает устранение неактивного FVIII:C в проточной и отмывочной фракциях аффинной стадии и стадии анионообменника. Отмывочная фракция аффинной стадии содержит почти только легкую цепь FVIII.
Фиг. 2: Вестерн-блоттинг с антителами к FVIII. Слева - стандарты молекулярных весов, Дорожка 1; контроль FVIII, FVIII:C 5,0 IU/мл, Дорожка 2; элюат аффинной стадии, FVIII:C 5 IU/мл, Дорожка 3; разбавленный элюат аффинной стадии, FVIII:C 5 IU/мл, Дорожка 4; элюат анионообменной стадии, FVIII:C 5 IU/мл, Дорожка 5; Элюат эксклюзионной стадии, FVIII:C 5 IU/мл. Фиг. 2 показывает паттерн вестерн-блоттинга FVIII при равной концентрации FVIII:C после аффинной стадии, после анионообменной стадии и после эксклюзионной стадии, все показывают такой же паттерн, как контроль FVIII.
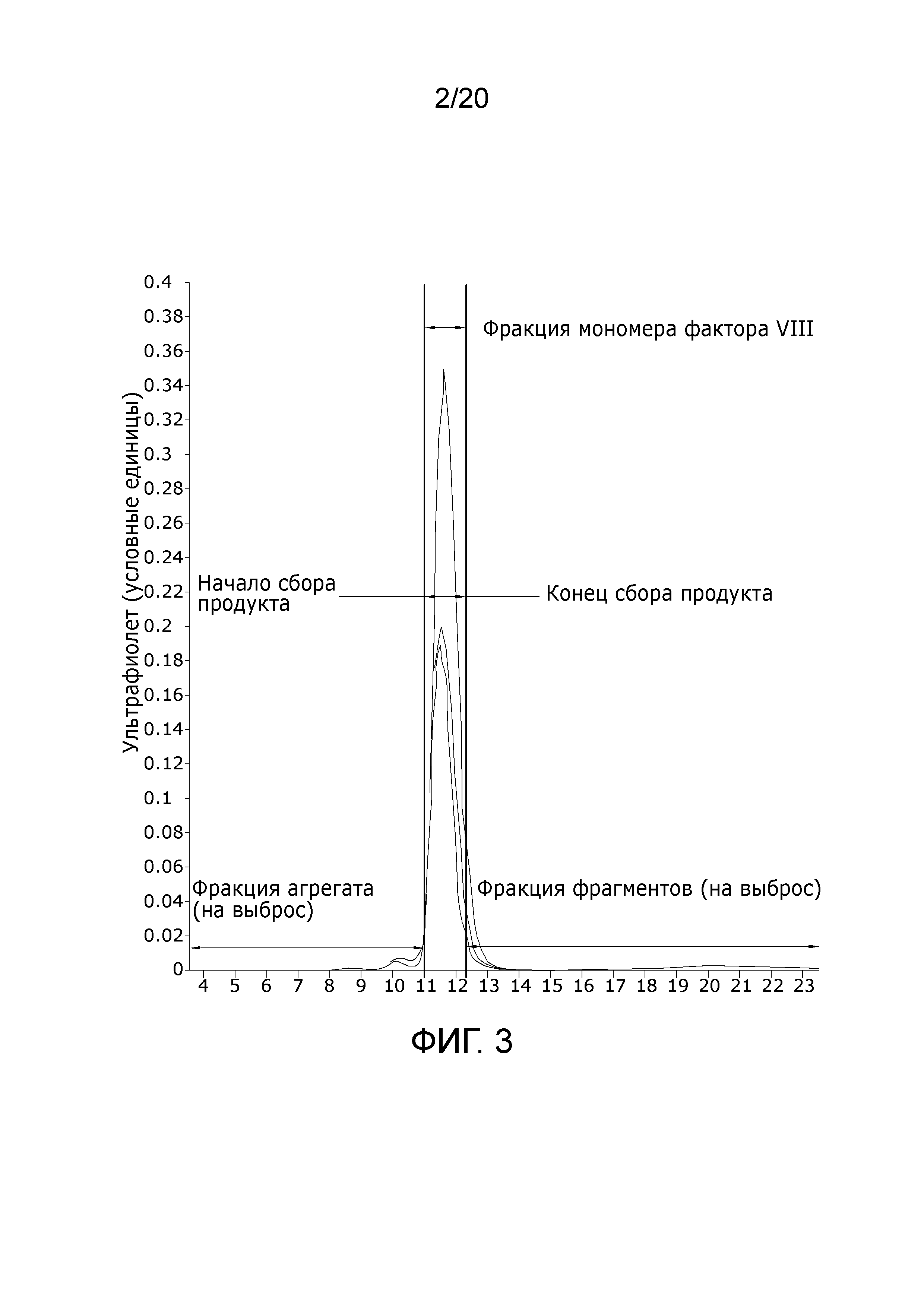
Фиг. 3: Хроматограмма, полученная на препаративной эксклюзионной хроматографической колонке в соответствии с Примером 3, показывающая разделение агрегатов и фрагментов мономера Фактор VIII в 3 разных экспериментах с использованием разной загрузки смолы и концентрации Фактора VIII. Уравновешивание буферной системы и хроматографические условия в соответствии с Примером 3 облегчают агрегацию и, таким образом, устранение агрегатов из мономерного*** Фактора VIII (элюция). Хроматографический пик отражает белки, измеренные при поглощении на [длине волны] 280 нм.
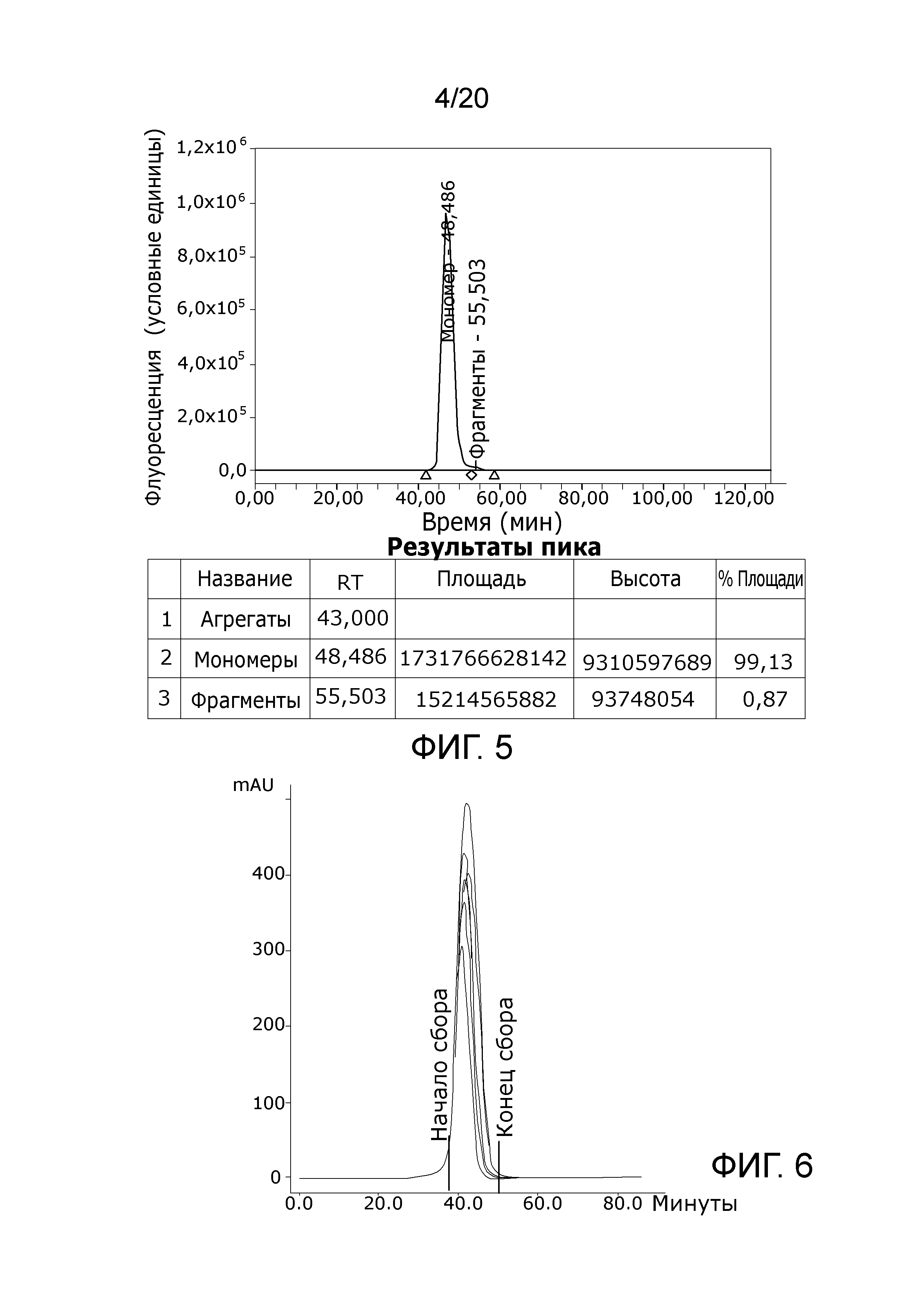
Фиг. 4: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца (элюция), приготовленного в соответствии с Примером 2, и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в этом образце составляет > 98% при < 0,5% агрегатов и < 1,5% фрагментов.
Фиг. 5: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца (элюция), приготовленного в соответствии с Примером 2, и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в этом образце обычное > 99% без видимых количеств агрегатов и < 1% фрагментов.
Фиг. 6: Хроматограмма препаративной эксклюзионной хроматографической колонки в соответствии с примером 4, показывает разделение агрегатов и фрагментов мономера Фактора VIII в 5 различных экспериментах с использованием разных загрузок смолы и концентраций Фактора VIII. Уравновешивающая буферная система и хроматографические условия в соответствии с Примером 4 облегчают агрегацию и, таким образом, устранение агрегатов из мономера Фактора VIII (элюция). Хроматографические пики отражают белки, измеренные при поглощении на [длине волны] 280 нм.
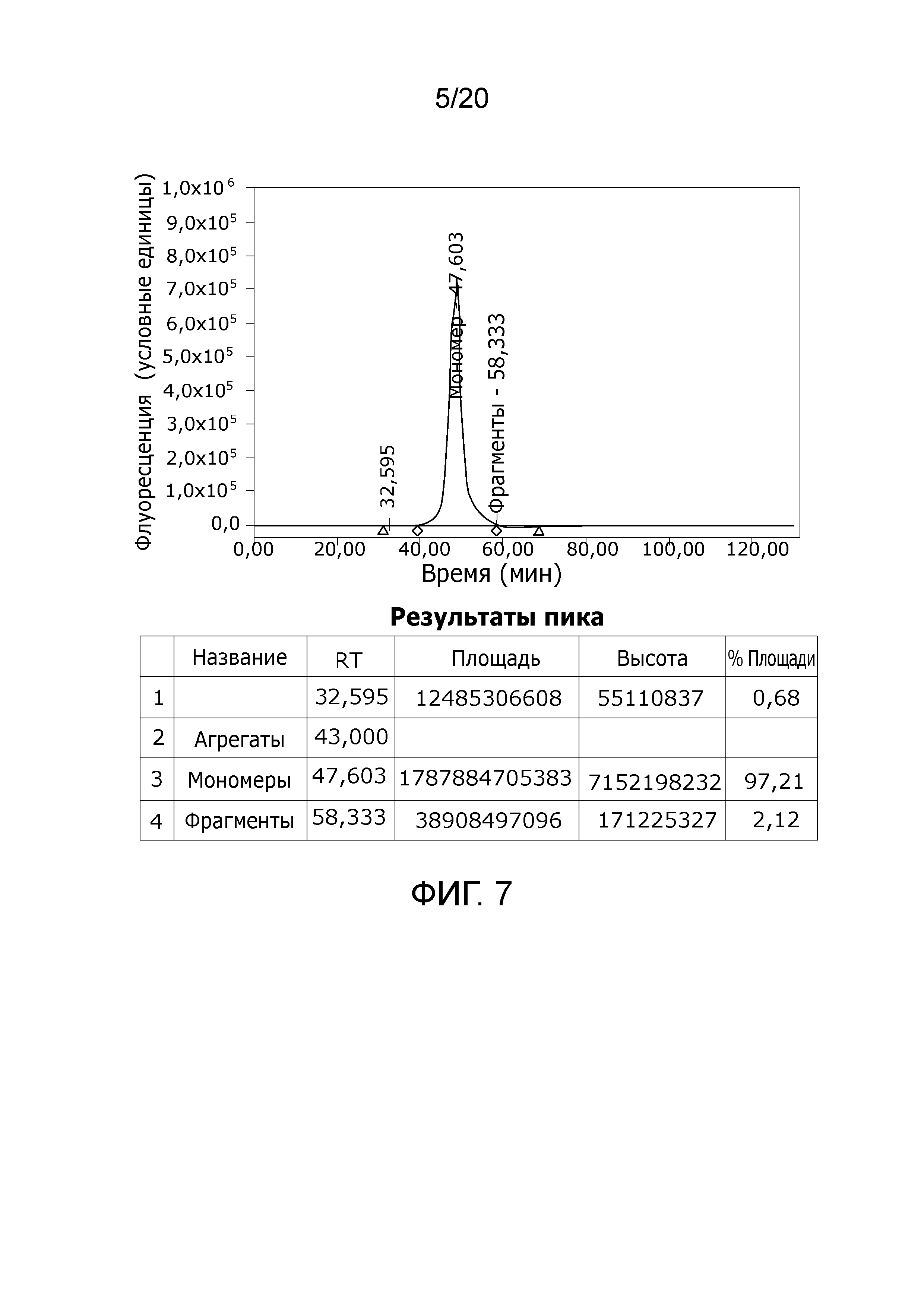
Фиг. 7: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (анионообменный элюат), и соответственное содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 97% при < 0,7% агрегатов и < 2,5% фрагментов.
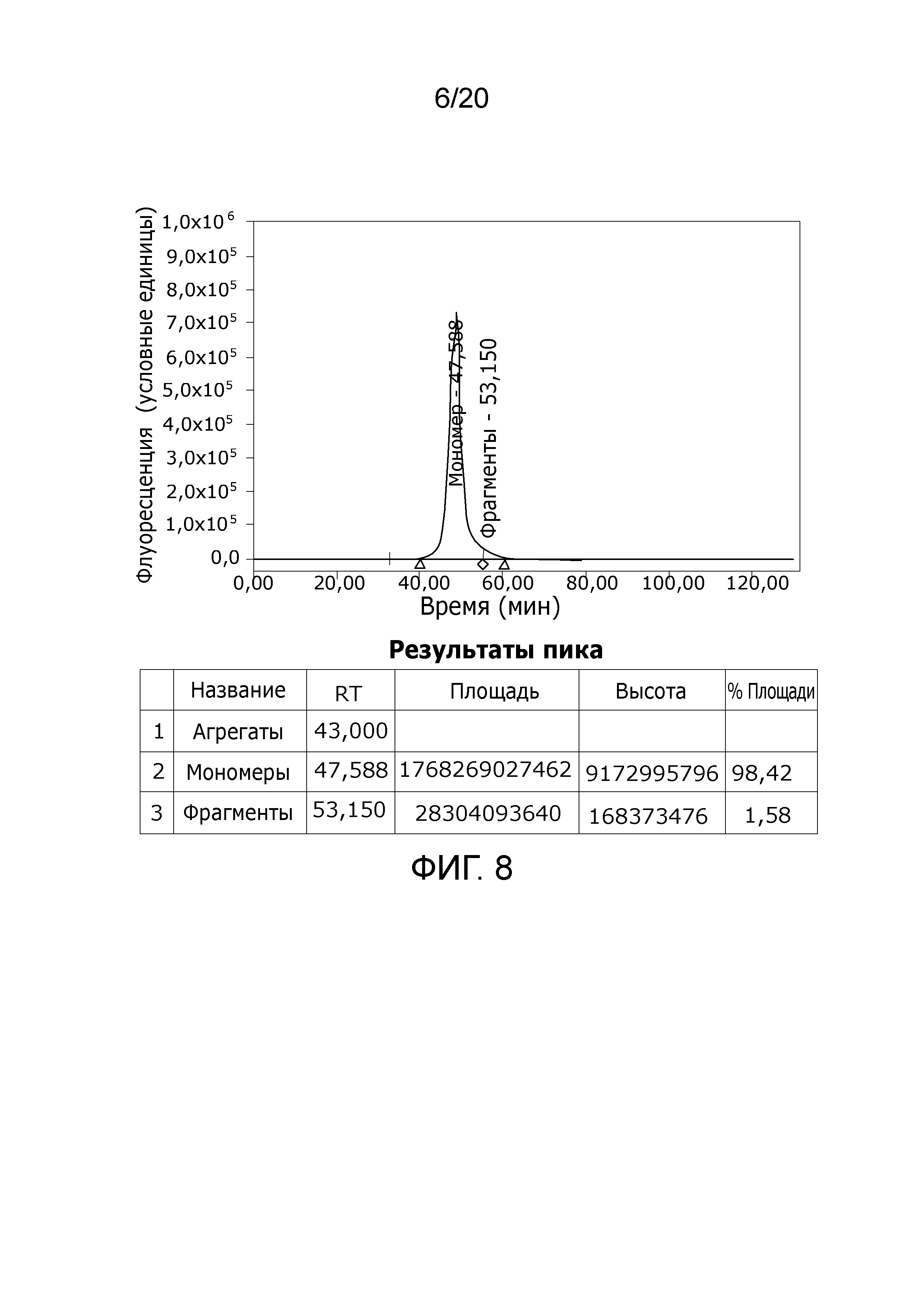
Фиг. 8: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (эксклюзионный элюат), и соответственное содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 98% при отсутствии видимых признаков агрегатов и < 2% фрагментов.
Фиг. 9: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (анионообменный элюат), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 98% при отсутствии видимых признаков агрегатов и < 2% фрагментов.
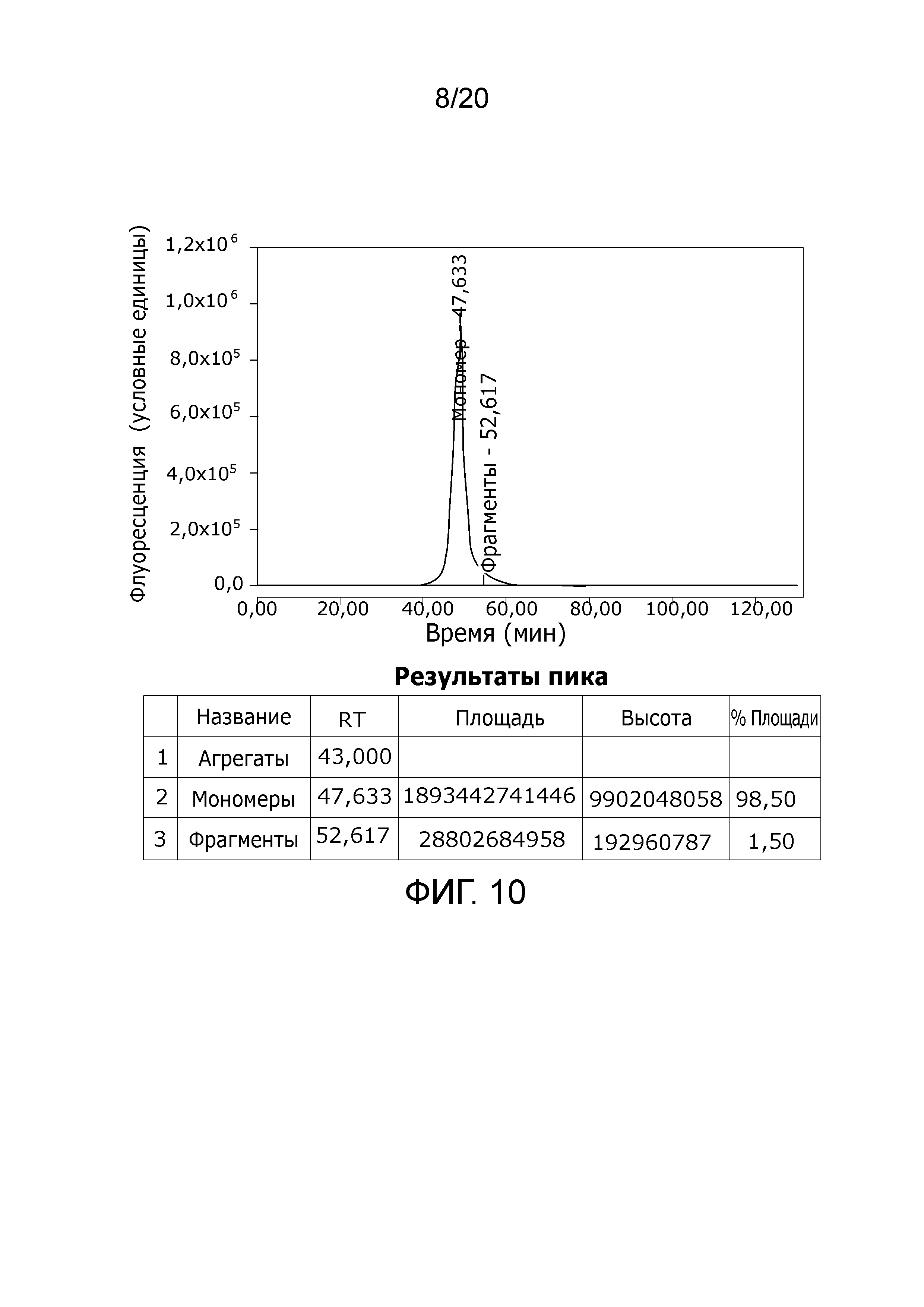
Фиг. 10: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (эксклюзионный элюат), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 98% при отсутствии видимых признаков агрегатов и <2% фрагментов.
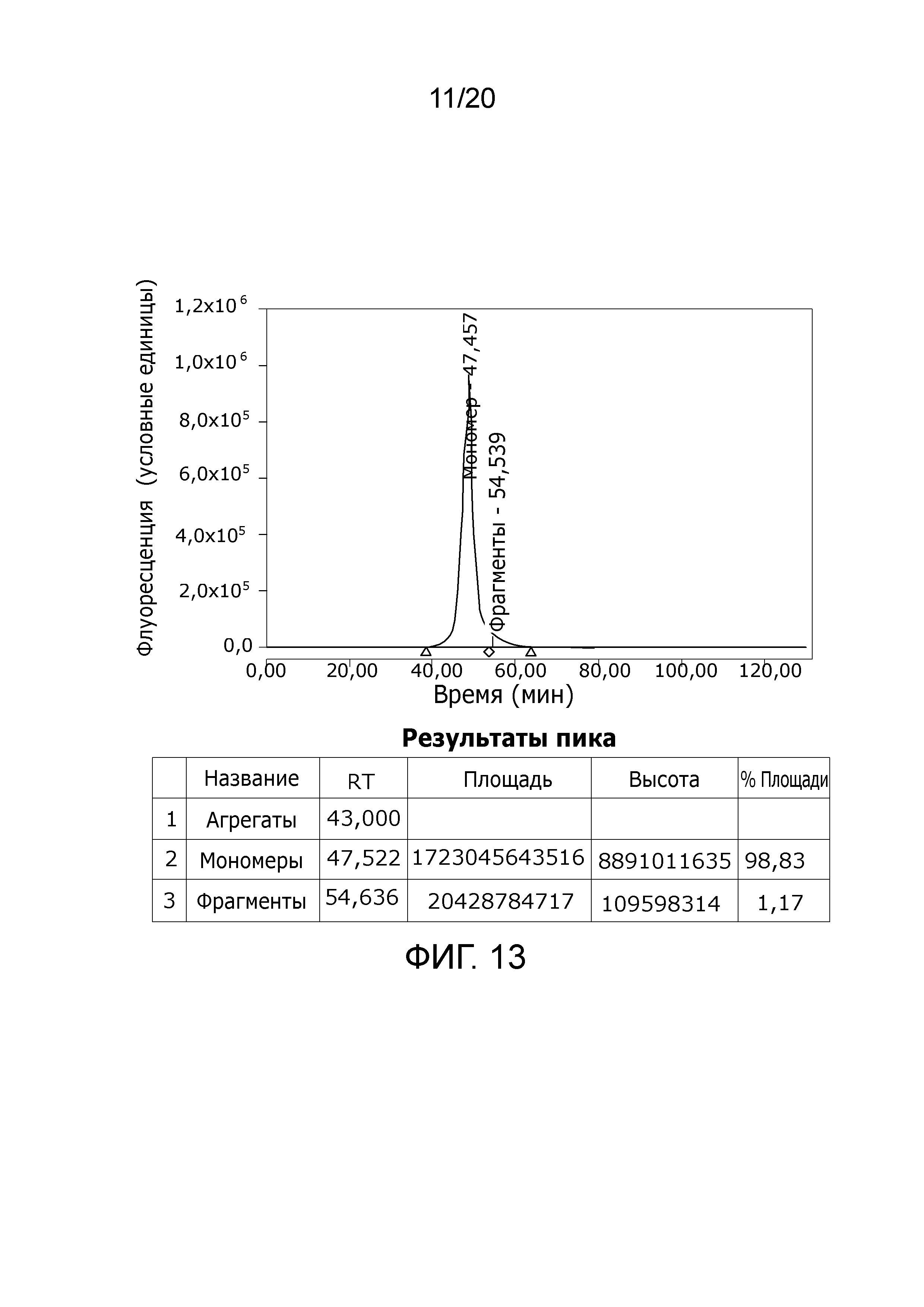
Фиг. 11: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (анионообменная элюция), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 98% при отсутствии видимых признаков агрегатов и < 1,5% фрагментов.
Фиг. 12: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (эксклюзионный элюат), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 98% при отсутствии видимых признаков агрегатов и < 1,5% фрагментов.
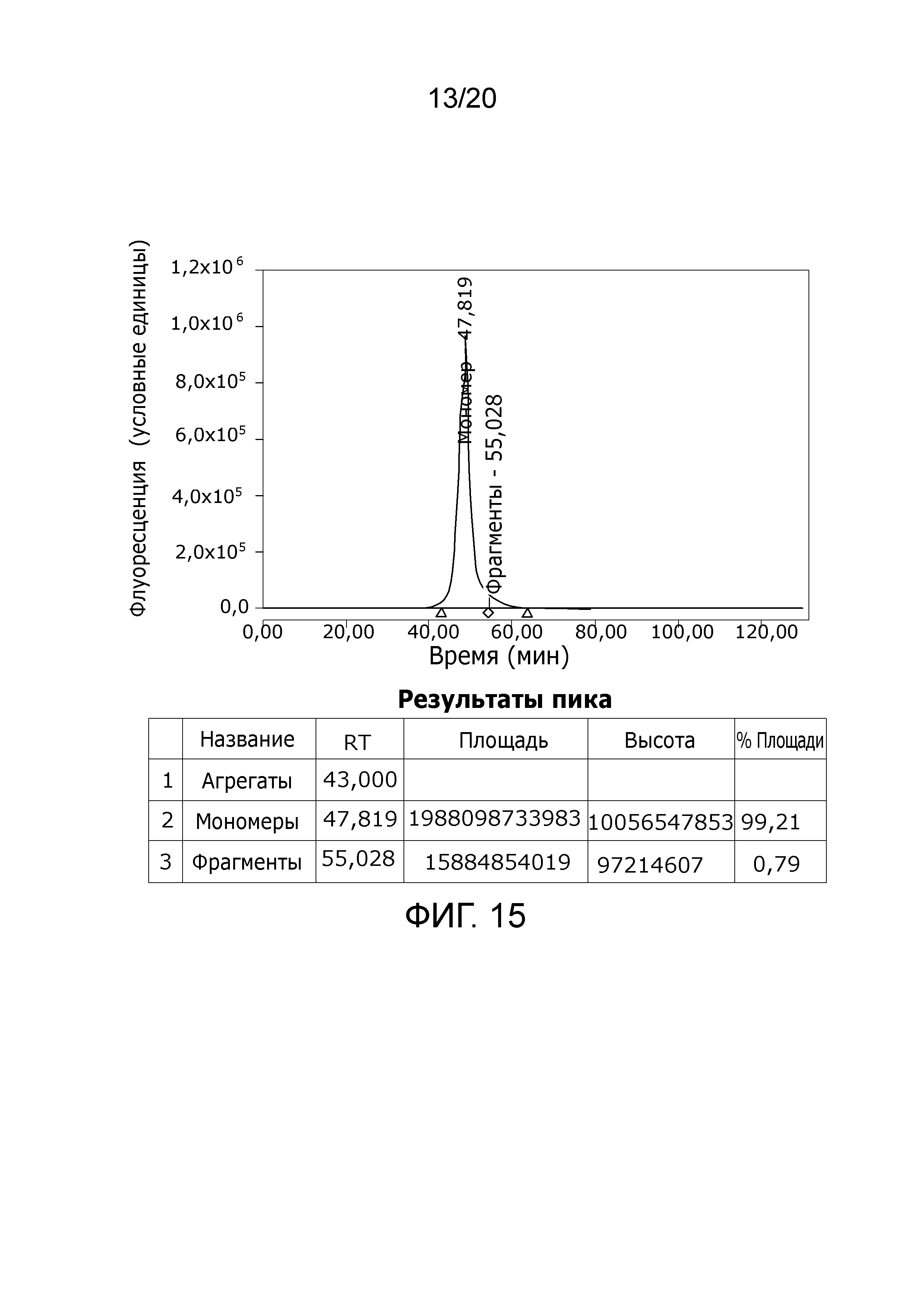
Фиг. 13: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (анионообменный элюат), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 99% при отсутствии видимых признаков агрегатов и < 1,5% фрагментов.
Фиг. 14: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (эксклюзионный элюат), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 98% при отсутствии видимых признаков агрегатов и < 1,5% фрагментов.
Фиг. 15: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (анионообменный элюат), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 99% при отсутствии видимых признаков агрегатов и < 1% фрагментов.
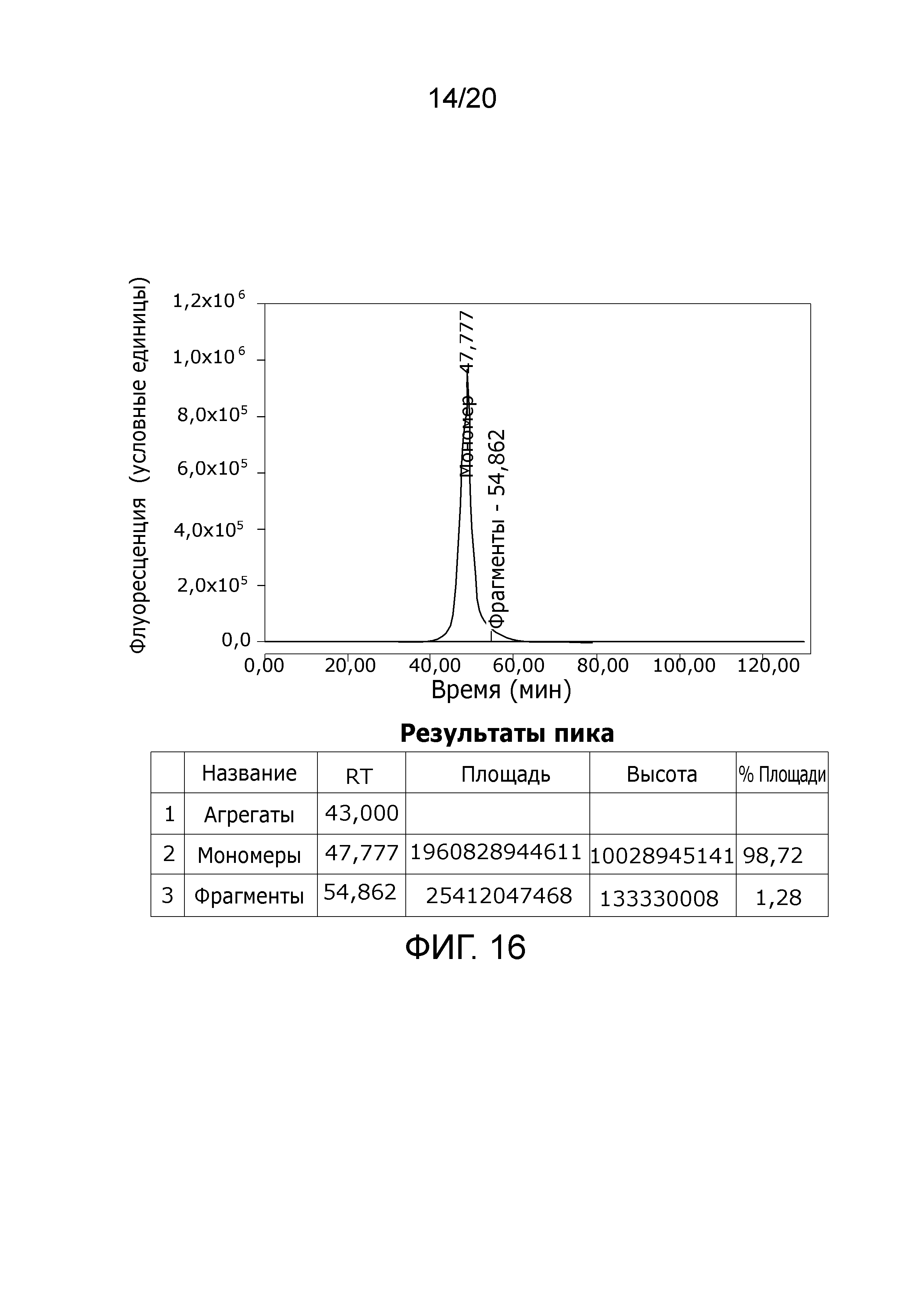
Фиг. 16: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC1), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 4 (эксклюзионный элюат), и соответствующее содержание агрегатов, мономера и фрагментов в процентах. Содержание мономера в данном образце составляет > 98% при отсутствии видимых признаков агрегатов и < 1,5% фрагментов.
Фиг. 17: Аналитический двумерный электрофорез (2D-PAGE) фингерпринта профиля заряда и размера образца, обработанного по Примеру 4 данного изобретения, образец после эксклюзионной хроматографии.
Фиг. 18: Повышение чистоты Фактора VIII в ходе способа очистки по данному изобретению.
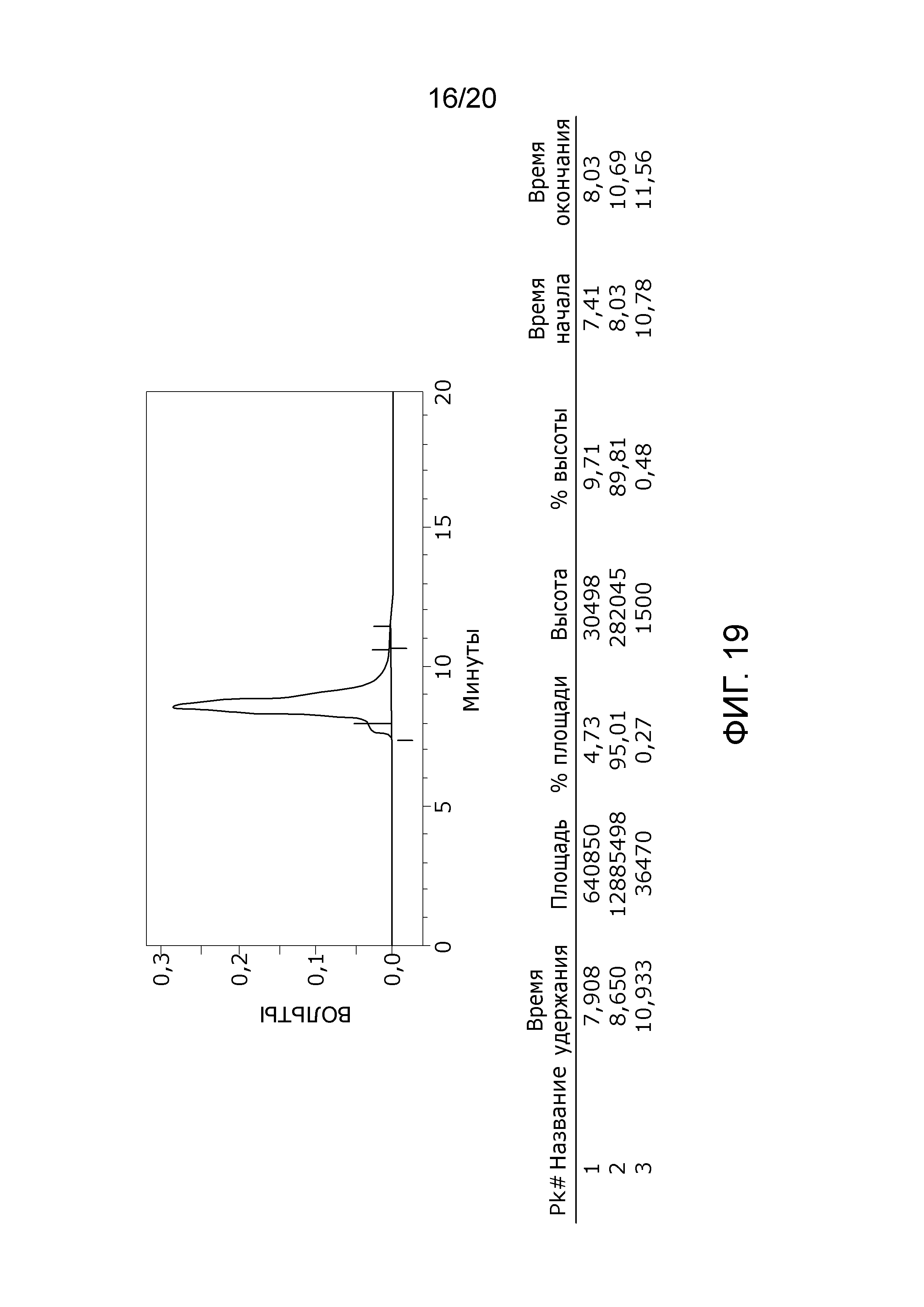
Фиг. 19: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC2), показывающая хроматографический профиль образца, приготовленного в соответствии с примером 7 (очищенного и лиофилизированного по данному изобретению), и соответствующее содержание агрегатов, мономера и фрагментов в процентах после растворения лиофилизированного продукта (1000 IU флакон). Содержание мономера в данном образце составляет, в принципе 100% (небольшой изгиб слева на пике мономера, основываясь на стандартной кривой удержания молекулярных весов (Фиг. 23) должен быть включен в пик мономера FVIII), и элюируется на приблизительно 7-10 минутах хроматограммы SEC-HPLC2 без видимых признаков агрегатов и фрагментов.
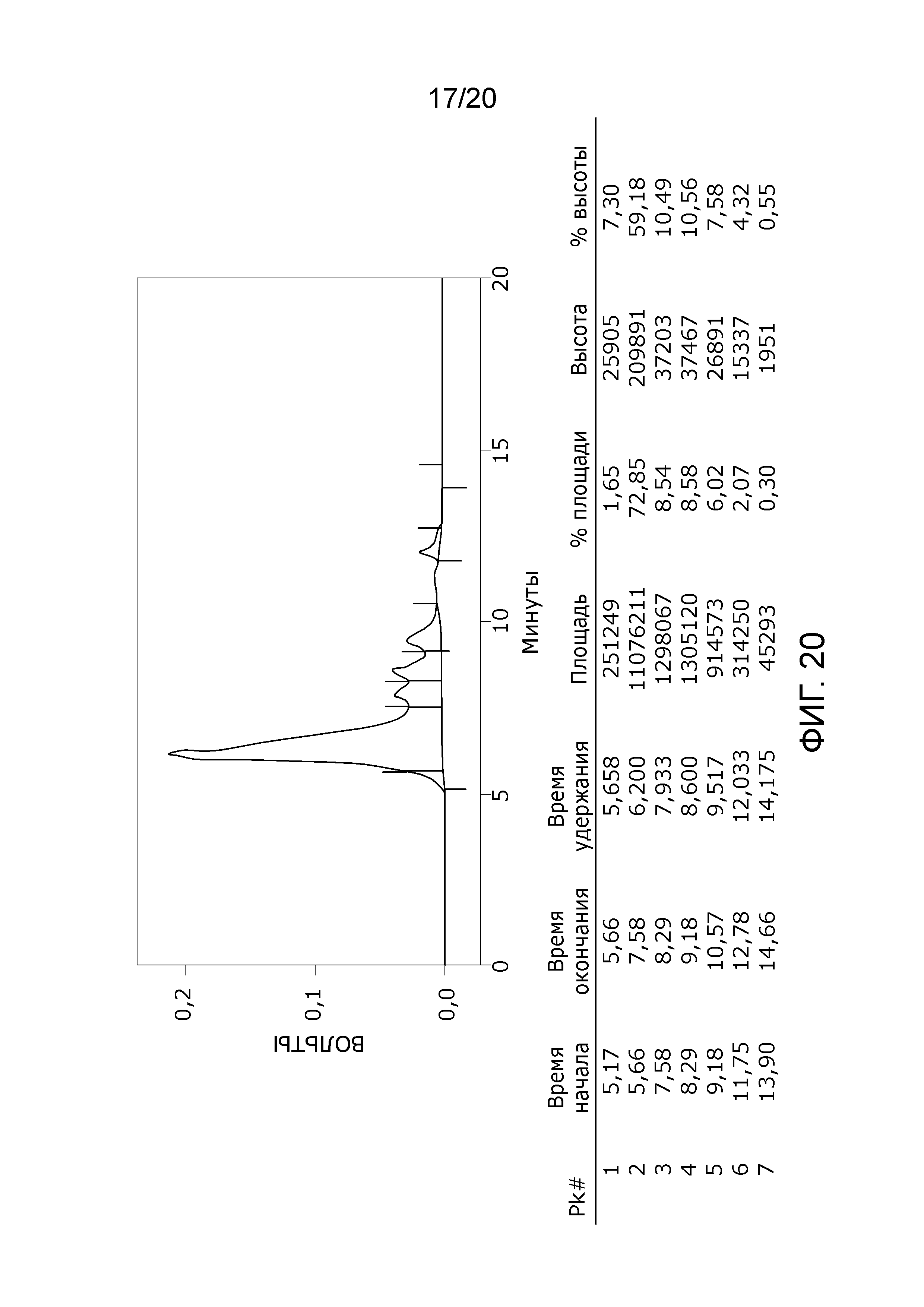
Фиг. 20: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC2), показывающая хроматографический профиль образца, приготовленного по способу очистки A22 и лиофилизированного, и содержание агрегатов, мономера и фрагментов в процентах после растворения лиофилизированного продукта (1000 IU флакон). Содержание мономера в данном образце составляет приблизительно 76% без видимых признаков агрегатов и приблизительно 24% фрагментов. Продукт rFVIII представляет собой полноразмерный продукт FVIII с интактным B-доменом с молекулярным весом приблизительно 300 кДа, что дает элюцию мономера FVIII на хроматограмме SEC-HPLC2 приблизительно на 5-8 минутах. Рассчитано, что пик фрагментов начинается сразу после пика мономера приблизительно на 8-13 минутах.
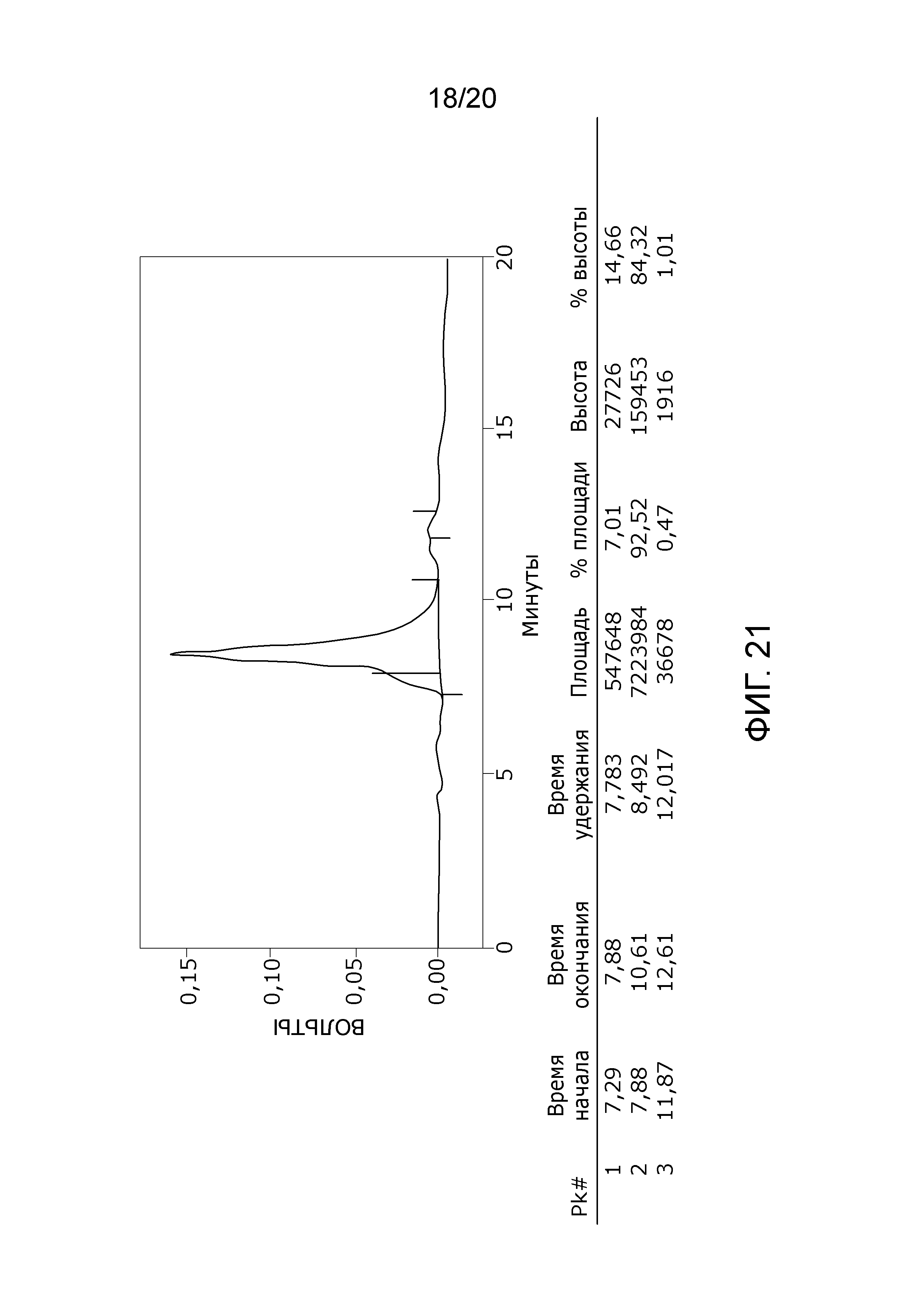
Фиг. 21: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC2), показывающая хроматографический профиль образца, приготовленного по способу очистки B22 и лиофилизированного, и соответствующее содержание агрегата, мономера и фрагментов в процентах после растворения лиофилизированного продукта (1000 IU флакон). Содержание мономера в данном образце составляет приблизительно 99% (небольшой изгиб слева на пике мономера, основываясь на стандартной кривой удержания молекулярных весов (Фиг. 23) должен быть включен в пик мономера FVIII) без видимых признаков агрегатов и приблизительно 1% фрагментов. Продукт rFVIII представляет собой продукт FVIII с делецией B-домена и приблизительным молекулярным весом 170 кДа, который дает элюцию мономера FVIII на хроматограмме SEC-HPLC2 приблизительно на 7-10,5 минутах. Рассчитано, что пик фрагментов начинается непосредственно после пика мономера приблизительно на 10,5-13 минутах.
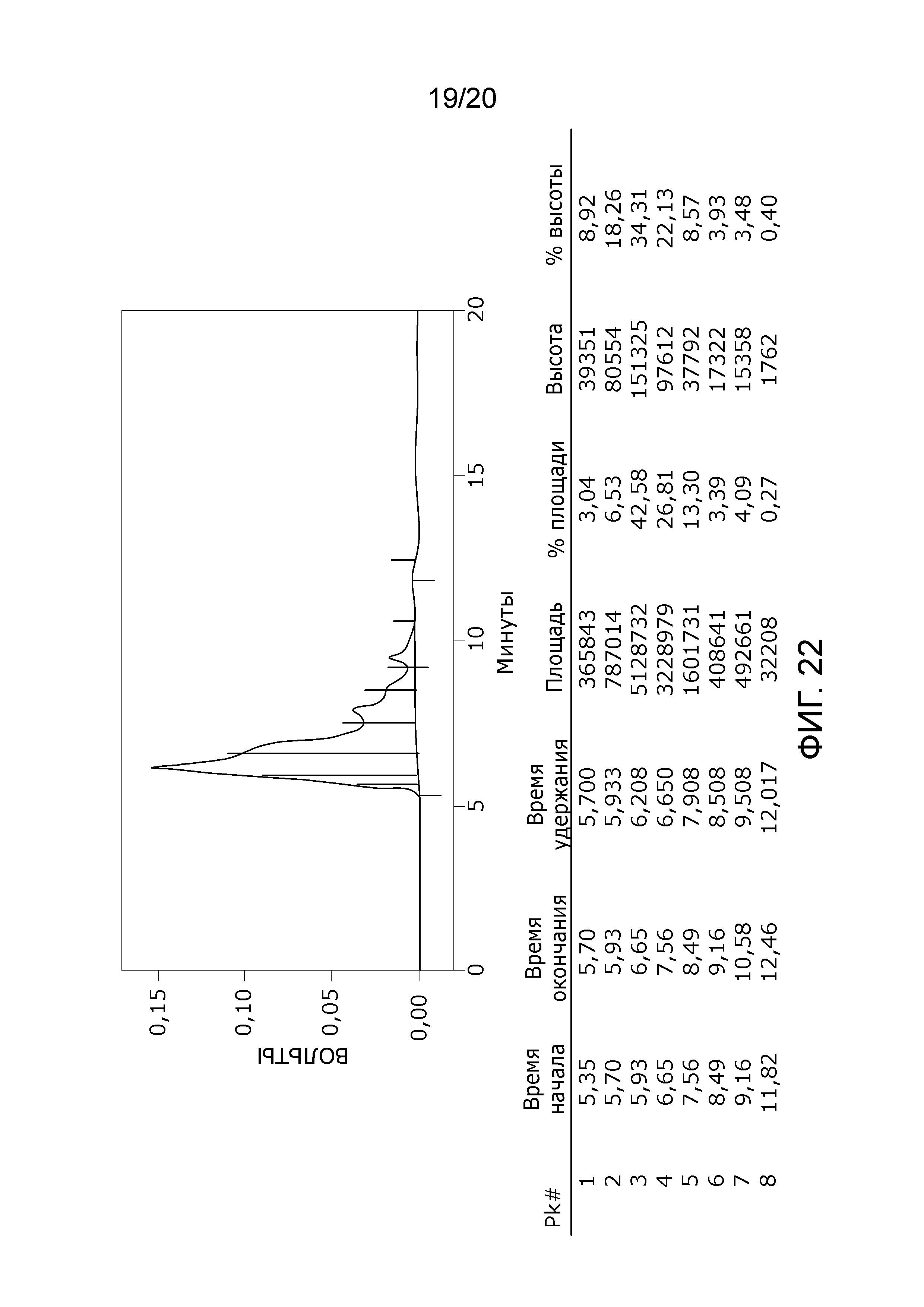
Фиг. 22: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC2), показывающая хроматографический профиль образца, приготовленного по способу очистки C22, и лиофилизированного, и соответствующее содержание агрегатов, мономера и фрагментов в процентах после растворения лиофилизированного продукта (1000 IU флакон). Содержание мономера в данном образце составляет приблизительно 80% при отсутствии видимых признаков агрегатов и приблизительно 20% фрагментов. Продукт rFVIII представляет собой полноразмерный продукт FVIII с интактным B-доменом с приблизительным молекулярным весом 300 кДа, что дает элюцию мономера FVIII на хроматограмме SEC-HPLC2 приблизительно на 5-8 минутах. Пик Рассчитано, что пик фрагментов начинается непосредственно после пика мономера приблизительно на 8-13 минутах.
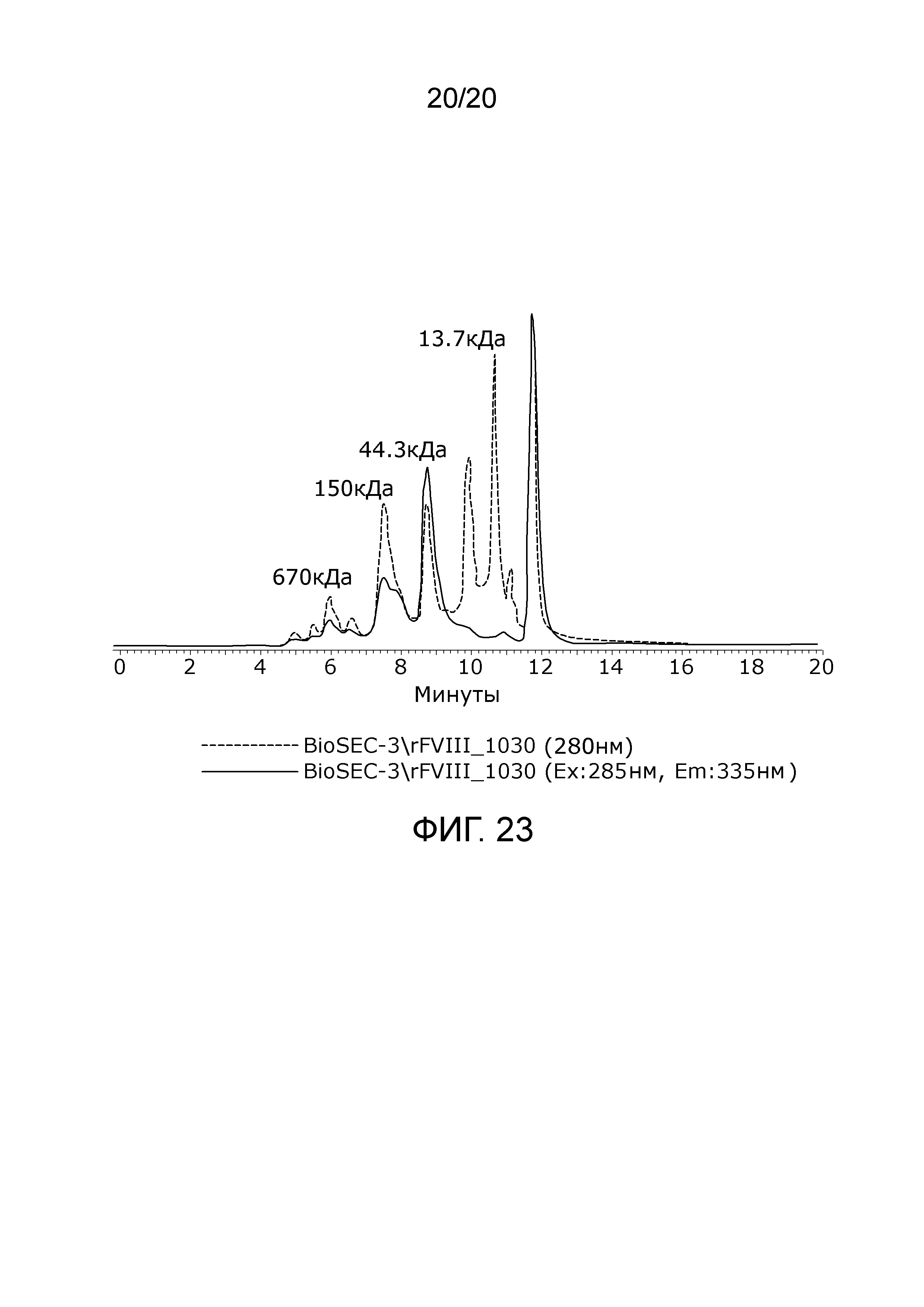
Фиг. 23: Хроматограмма с аналитической эксклюзионной хроматографической колонки (SEC-HPLC2), показывающая хроматографический профиль образца стандарта молекулярного веса (15-600 кДа, 69385, фирма Sigma-Aldrich Chemie GmbH).
Термин «биологически неактивная форма Фактора VIII» по данному изобретению означает форму Фактора VIII, которая утратила свою биологическую активность вследствие химической, биохимической или ферментативной причин. Биологически неактивной [формой] Фактора VIII может быть, например, одиночная легкая или тяжелая цепь Фактора VIII, укороченная форма Фактора VIII или активированная форма (однако, нестабильная, что определяется по активации в цикле свертывания [крови]) Фактора VIII (такая как FVIIIa) и/или агрегированная или иные формы фрагментированного Фактора VIII.
Определение моль/кг, использованное в заявке, представляет собой количество моль, добавленное к 1000 г воды, определение «молярный» означает количество моль, добавленное к 1000 мл воды.
Общее количество биологически активного и неактивного Фактора VIII в образце измеряли с помощью основанного на антигене аналитического способа иммуноферментного анализа (ELISA) (FVIII:Ag). Соотношение между биологически активным Фактором VIII (FVIII:C) и антигенным содержанием Фактора VIII (FVIII:Ag) в образце с полной биологической активностью (как in vivo) должно быть равно 1,0. Если соотношение меньше, чем 1, это показывает, что в образце присутствуют неактивные формы Фактора VIII. Неактивные формы могут представлять собой либо агрегаты Фактора VIII и/или молекулы Фактора VIII, которые диссоциировали на отдельные легкую и тяжелую цепи Фактора VIII.
Легкая цепь FVIII (A3, C1 и C2 домены Фактора VIII с молекулярным весом приблизительно 80 кДа) представляет собой биологически активную молекулу Фактора VIII, металлогидрофобный комплекс с тяжелой цепью FVIII (A1 и A2 домены Фактора VIII с молекулярным весом 90-210 кДа). Этот комплекс представляет собой нативную молекулу Фактора VIII in vivo, которая при нормальных условиях циркулирует в связанном виде с Фактором фон Виллебранда (vWF), который защищает его от дегенерации. Когда система свертывания активируется, нативная молекула Фактора VIII отделяется от vWF и связывается с активированными тромбоцитами (кровяными пластинками) и протеолитически преобразуется в FVIIIa (активированный Фактор VIII), который является активной формой нативной молекулы FVIII, важной части системы свертывания [крови]. Молекула FVIIIa быстро расходуется в каскаде свертывания, а затем ферментативно инактивируется различными протеазными ингибиторами♣. (15) Если комплекс диссоциирует (16), то легкая цепь или тяжелая цепь не имеют биологической активности или имеют малую [биологическую активность], а соотношение FVIII:C/FVIII:Ag близко к нулю. Если нативный комплекс протеолитически инактивирован, молекулярный вес и легкой, и тяжелой цепей уменьшается, продукты деградации Фактора VIII первоначально сохраняют биологическую активность (например, FVIIIa), но они нестабильны и сравнительно быстро инактивируются in vivo.(1) Продукты деградации Фактора VIII (и деградировавшие протеолитически, и диссоциированные непротеолитически) могут быть обнаружены аналитическим способом вестерн-блоттинга Фактора VIII, который специфически демонстрирует биологически активные и неактивные молекулы Фактора VIII, основываясь на [их] размере. Нативная молекулы Фактора VIII имеет молекулярный вес приблизительно 170 кДа или 290 кДа в зависимости от наличия или отсутствия делеции B-домена. B-домен не имеет биологически активной функции в молекуле Фактора VIII, таким образом, биологически активная молекула Фактора VIII может иметь или не иметь B-домен (или часть его).
Мономерный продукт Фактор VIII определен в данном документе как биологически активная молекула Фактора VIII, имеющая такую же величину молекулярного веса, определенного способом аналитической эксклюзионной HPLC хроматографии, выполненным при нативных буферных условиях. Фрагментированные формы Фактора VIII в основном неактивны, тогда как агрегированные формы Фактора VIII имеют уменьшенную биологическую активность. Обе формы проявляют теоретически повышенный риск формирования ингибиторов in vivo и [их количество] должно быть снижено, насколько возможно в продукте Фактор VIII, предназначенном для лечении гемофилии А. [Уровень] мономерного продукта Фактор VIII должен быть высок, насколько возможно, в конце способа очистки, а также быть стабильным перед (в замороженном состоянии) фармацевтической‡ обработкой продукта Фактор VIII и в ходе фармацевтической‡ обработки (лиофилизация или разливка раствора во флаконы) до растворения и потребления пациентами. Этот период времени может часто составлять от нескольких месяцев до 1-3 лет. Один из примеров стабильности замороженного раствора Фактора VIII представлен в Патенте США 8,187,799 B2, в котором заявлены специфические композиции буфера, однако, содержание агрегата/мономера Фактора в данной ссылке не обсуждалось.
Рекомбинантный Фактор VIII по данному изобретению представляет собой, в частности, производное делеции с частично или полностью отсутствующим B-доменом, таким образом предоставляя специфическую активность, которая может значительно превосходить 5000 IU/мг в заключительном очищенном продукте. Примеры таких производных делеции с частично или полностью отсутствующими B-доменами описаны и изготовлены в EP-A-1136553 и EP-A-1739179 на клеточных линиях человека. Следует понимать, что изобретенные ныне композиции так, как они описаны в последующем разделе, особенно хорошо подходят для применения таких дериватов делеций Фактора VIII или других продуктов Фактора VIII сходной чистоты.
Подробное описание данного изобретения
Подробное описание стадии аффинной хроматографии Фактора VIII
Фактор VIII связывается с аффинной хроматографической колонкой Фактора VIII (VIIISelect) в условиях уравновешивающего буфера (0,3 моль/кг NaCl, 0,02 мол/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate80, pH 6,4-6,6, проводимость 30-36 мСм (миллисименс)/см) с или без химических веществ типа растворитель-детергент (1% Triton X-100 + 0,3% tri-n-бутилфосфат), которые могут быть применены в растворе Фактора VIII перед аффинной стадией для целей инактивации вирусов (в липидной оболочке). Также другие химические вещества, связанные с предшествующей очистков Фактора VIII, могут присутствовать в загружаемом растворе Фактора VIII, такие как 0,2 моль/кг сорбитола и 0,045 моль/кг аргинина, которые могут быть добавлены в целях стабилизации Фактора VIII. Обычно загрузка Фактора VIII составляет около 5000 - около 25000 IU/мл аффинной смолы и в принципе любая чистота (1-15000 IU Фактора VIII/мг белка) раствора Фактора VIII могла быть использована на аффинной колонке. Способ выполняли при температуре окружающей среды, например, при комнатной температуре.
После того, как содержащий Фактор VIII раствор проходил колонку, колонку споласкивали 15 объемами колонки уравновешивающего буфера (0,3 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, рН 6,4-6,6, проводимость 30-36 мСм/см) для устранения загрязнений (связанных и с продуктом, и с способом). За этим следует отмывка 5 объемами колонки с повышенной концентрацией соли (1 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH 6,4-6,6, проводимость 83 - 89 мСм/см) для специфического устранения отдельных легких цепей FVIII. Биологически активный Фактор VIII затем элюируется с колонки буфером - 4 объемами колонки - с повышенной концентрацией соли и этиленгликоля (1,5 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 50% (вес/вес) этиленгликоля, 0,02% (вес/вес) Polysorbate 80, pH 6,4-6,6, проводимость 36-42 мСм/см).
Оставшиеся белки, связанные с аффинной смолой, затем устраняются кислотной отмывкой (pH 2), и после смолы, и после уравновешивания готовы для нового цикла очистки.
Подробное описание стадии анионообменной хроматографии
Фактор VIII связывается с сильной анионообменной колонкой (Q Sepharose FF) в условиях уравновешивающего буфера (0,1 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, рН 7,4-7,6, проводимость 12-16 мСм/см). Также другие химические вещества, [оставшиеся] от предшествующих стадий очистки Фактора VIII могут присутствовать в растворе загрузки Фактора VIII, такие как 5% этиленгликоля. Обычная загрузка Фактора VIII составляла 10000 - 100 000 IU/мл аффинной смолы, а чистота исходного материала составляла > 5000 IU Фактора VIII/мг белка. Способ проводили при температуре окружающей среды, например - комнатной температуре.
После того, как раствор, содержащий Фактор VIII, обрабатывается на колонке, колонку споласкивали 15 объемами колонки уравновешивающего буфера (0,1 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, рН 7,4-7,6, проводимость 12-16 мСм/см) для устранения загрязнений (связанных и с продуктом, и с способом). За этим следовала отмывка 5 объемами колонки при повышенной концентрации соли (0,30 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH 7,4-7,6, проводимость 30-35 мСм/см), чтобы удалить неактивны формы Фактора VIII. Биологически активный мономерный Фактор VIII затем элюировали с колонки с помощью буфера с повышенной концентрацией соли (один объем колонки) (0,39 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH 5,9-6,1, проводимость 38-42 мСм/см).
Какие-либо остающиеся белки, связанные с анионообменной смолой ионными взаимодействиями, затем устранялись путем повышения концентрации соли до 2 моль/кг NaCl, после чего смолу дезинфицировали с помощью высокого pH (14), и после уравновешивания колонка была готова к следующему циклу очистки.
Подробное описание стадии эксклюзионной хроматографии
Фактор VIII загружается в количестве 4-8% от объема колонки в колонку для эксклюзионной хроматографии (Superdex 200 p.g.) с высотой слоя 70 см и уравновешенную 30,7 г/кг NaCl, 0,5 г/кг CaCl2, 2,0 г/кг Na-цитрата, 9,2 г/кг L-аргинин гидрохлорида, 9,2 г/кг сахарозы, 2,0 г/кг Poloxamer 188, pH 6,9-7,1, проводимость 47-51 мСм/см. Обычно концентрация Фактора VIII в исходном материале составляет > 10 000 IU/мл, а композиция буфера: 0,4 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH 6,0-6,5, проводимость 35-42 мСм/см. Чистота исходного материала составляет > 8000 IU Фактора VIII/мг белка. Способ проводили при комнатной температуре 18-25°С.
После того, как раствор, содержащий Фактор VIII, наносили на эксклюзионную колонку, колонку обрабатывали уравновешивающим буфером, пока на выходе колонки поглощение, измеренное [на длине волны] 280 нм повышалось до 40 mAU, биологически активный мономер продукта Фактор VIII собирали пока поглощение не возвращалось к исходному уровню (40-1 mAU). Биологически неактивный агрегированный Фактор VIII устраняли перед (< 40 mAU), а неактивные фрагменты Фактора VIII фрагмент устраняли после (< 40 mAU) пика мономерного биологически активного Фактора VIII. Мономерный биологически активный раствор Фактора VIII после эксклюзионной стадии обычно составлял 2-3 объема к исходному материалу.
Все ссылки, процитированные в данном документе, включены по ссылке в полном объеме, включение которого не противоречит положениям, изложенным в данном документе. Все ссылки, включающие в себя публикации, патентные заявки и патенты, процитированные в данном документе, таким образом включены по ссылке во всей их полноте и в том же объеме, как если бы каждая ссылка была отдельно и специфически показана как включенная по ссылке и раскрыта во всей полноте в данном документе (до максимума, разрешенного законом), независимо от отдельно сделанных включений конкретных документов, сделанных где-либо в данном документе.
Термины (артикли) «a», и «an» и «the» и сходные слова в контексте описываемого данного изобретения используются, чтобы охватить и единственное, и множественное число, если иное не обозначено в данном документе или ясно не противоречит контексту. Если не указано иное, все конкретные значения, приведенные в данном документе, представляют собой соответствующие приблизительные значения (например, все конкретные приводимые в качестве примера значения, приведенные в отношении конкретного фактора или измерения, могут рассматриваться также, как приблизительное измерение с поправкой «около» там, где это пригодно).
Описание в данном документе какого-либо объекта или варианта осуществления по данному изобретению, использующее термины, такие как «содержащий (comprising)», «имеющий», «включающий в себя» или «содержащий (containing)" по отношению к элементу или элементам направлено на сходные аспекты или варианты осуществления по данному изобретению, которые «состоят из», «в основном состоят из» или «в основном содержат» такой элемент или такие элементы, если иное не обозначено или прямо не противоречит контексту (например, композицию, описанную в данном документе, как содержащую конкретный элемент, следует понимать также как описывающую композицию, состоящую из этого элемента, если не обозначено иное или ясно не противоречит по контексту).
Все заголовки и подзаголовки, как они используются в данном документе, даются только для удобства и не должны истолковываться как ограничивающие данное изобретение каким-либо образом. Использование каких-либо или всех примеров, или типовых выражений (например, «такой как»), приведенных в данном документе, направлено только на лучшее освещение данного изобретения и не представляет собой ограничения сферы данного изобретения, если не заявлено иное. Никакие выражения в спецификации не должны истолковываться как указывающие на незаявленные элементы, существенные для использования данного изобретения.
Цитаты и включение патентных документов в данный документ сделаны только для удобства и не отражают каких-либо воззрений на обоснованность, патентоспособность и/или законную силу таких патентных документов. Данное изобретение включает в себя все модификации и эквиваленты объектов изобретения, приведенных в формуле изобретения, и/или объектов, включенных в данный документ, насколько это допустимо соответствующим законом.
Данное изобретение далее описано, но не ограничено следующими примерами.
Пример 1:
Очистка лиганда аффинности Фактор VIII дрожжевого происхождения, связанного со смолой.
Нижеследующий способ иллюстрирует уcтранение форм Фактора VIII, не имеющих активности Фактора VIII:C на стадии хроматографии с помощью аффинности дрожжевого происхождения (VIIISelect).
Колонка и смола
Колонку BPG140 заполняли смолой VIIISelect до высоты слоя одиннадцать см, что дает объем колонки 1,7 литра. Смола VIIISelect была получена на фирме GE Healthcare (каталожный № 17-5450).
Исходный материал:
Материал, содержащий Фактор VIII с чистотой 1614 IU Фактора VIII/мг белка, 0,34 моль/кг NaCl, 0,035 моль/кг CaCl2, 0,01 моль/кг L-гистидина, 0,045 моль/кг L-аргинина, 0,2 моль/кг сорбитола, 0,02% (вес/вес) Polysorbat 80, 1% (вес/вес) Triton X-100, 0,3% tri-n-бутилфосфата (TNBP, вес/вес), pH 6,5 использовали как исходный материал. Исходный материал получали, как далее описано в WO2009156430A1, включенной по ссылке. Загрузка FVIII:C на смолу составляла 15529 IU/мл смолы.
Композиции буферов:
Уравновешивающий буфер (с Triton X-100 и TNBP)
0,3 моль/кг NaCl, 0,02 моль/кг CaCl2 (2 × H2O), 0,02 моль/кг L-гистидина, 1% вес/вес Triton X-100, 0,3% вес/вес TNBP, pH: 6,5 ± 0,1, проводимость: 31± 3 мСм/см при +25°C.
Отмывочный буфер 1 (Уравновешивающий буфер без Triton X-100 и TNBP)
0,3 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 6,5 ± 0.1, проводимость: 31 ± 3 мСм/см при +25°C
Отмывочный буфер 2
1,0 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 6,5 ± 0,1, проводимость: 85 ± 3 мСм/см при +25°C.
Буфер элюции
1,5 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, 50% (вес/вес) этиленгликоля (EG), pH: 6,5 ± 0,1, проводимость: 39 ± 3 мСм/см при +25°C.
Буферы уравновешивания, отмывки и элюции не ограничены указанными pH, концентрациями и типом буфера, солей или детергентов.
Колонку уравновешивали уравновешивающим буфером, после чего загружали исходный материал. Смолу затем обрабатывали отмывочным буфером 1 и отмывочным буфером 2, после чего - буфером элюции, как описано в Табл. 1. Образцы брали из соответствующих фракций (проток в ходе загрузки исходного материала + отмывка 1, отмывка 2 и элюция) и анализировали на FVIII:C, FVIII:Ag и FVIII с помощью вестерн-блоттинга.
|
Табл. 3 иллюстрирует устранение неактивных форм Фактора VIII из исходного материала. Соотношение биологически активного Фактора VIII, измеренного как FVIII:C в сравнении с общим количеством доступного Фактора VIII, измеренного через FVIII:Ag, составляет в исходном материале 0,61. Соотношение C/Ag, которое также измеряли в протоке и отмывочных фракциях, было очень низким (<0,05). Во фракции элюата соотношение C/Ag повышалось с 0,61 в исходном материале до 0,87. Это ясно показывает устранение неактивных форм Фактора VIII в ходе аффинной стадии на VIIISelect. Это далее подтверждается анализом вестерн-блоттинга Фактора VIII на Фиг. 1, дорожки 1 - 4. Дорожка 1 показывает «исходный материал» перед аффинной колонкой. Дорожка 2 показывает множество полос, относящихся к Фактору VIII, что показывает, что продукты дегенерации Фактора VIII устранены из фракции «проток + отмывка 1». Дорожка 3 показывает, что во фракции «отмывка 2» присутствует одна основная полоса Фактора VIII, которая имеет тот же молекулярный вес, что отдельная (диссоциированная) легкая цепь Фактора VIII (80 кДа). Эта фракция Фактора VIII показывает отсутствие или очень низкую активность Фактора VIII:C (как показано в Табл. 3). Дорожка 4 показывает фракцию элюции аффинной стадии, включая в себя легкую цепь Фактора VIII (80 кДа), тяжелую цепь Фактора VIII (90 кДа) и нерасщепленную молекулу фактора VIII (170 кДа).
Вывод по Примеру 1
Стадия VIIISelect устраняет молекулы Фактора VIII с уменьшенной и/или отсутствующей активностью FVIII:C во фракциях протока и отмывки, как можно видеть из Табл. 3 и Фиг. 1 (дорожки 1 - 4).
Пример 2, Стадия анионообменной хроматографии (Q-Sepharose FF)
Следующий способ иллюстрирует устранение форм Фактора VIII, не имеющих активности Фактора VIII:C, на анионообменной смоле (Q Sepharose FF), приводящий к получению продукта Фактор VIII с высоким содержанием мономера.
Колонка и смола
Колонку BPG140 заполняли смолой Q Sepharose FF с высотой слоя восемь см, что давало объем колонки в 1,23 литра. Смолу Q Sepharose FF получали на фирме GE Healthcare (каталожный номер 17-0510).
Исходный материал
Материал, содержащий Фактор VIII с чистотой 9470 IU Фактора VIII/мг белка, 0,1 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbat 80, pH 6,5, использовали как исходный материал. Исходный материал получали, как далее описано в Примере 1 (продукт фракции элюции). Загрузка FVIII:C на смолу составляла 15 383 IU/мл смолы.
Композиции буферов:
Буфер уравновешивания
0,1 моль/кг NaCl, 0,02 моль/кг CaCl2 (2 × H2O), 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 7,5 ± 0,1, проводимость: 15 ± 1 мСм/см при +25°C
Отмывочный буфер
0,32 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 7,5 ± 0,1, проводимость: 32,5 ± 2,5 мСм/см при +25°С
Буфер элюции
0,39 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 6,0 ± 0,1, проводимость: 40 ± 2 мСм/см при +25°C.
Буферы уравновешивания, отмывки и элюции не ограничены указанными pH, концентрациями и типами буфера, соли или детергента.
Колонку уравновешивали буфером уравновешивания, после чего загружали исходный материал. Затем на смолу снова наносили уравновешивающий буфер, чтобы позволить Фактору VIII связаться, а затем наносили отмывочный буфер, после которого наносили буфер элюции, как описано в Табл. 3. Образцы брали из соответствующих фракций (проток при загрузке исходного материала + отмывка 1, отмывка 2 и элюция) и анализировали на FVIII:C, FVIII:Ag, SEC-HPLC1, с помощью вестерн-блоттинга FVIII, картирования фингерпринта N-гликана и картирования фингерпринта пептида трипсина.
|
Табл. 4 иллюстрирует устранение неактивных форм Фактора VIII из исходного материала анионообменной стадии. Соотношение биологически активного Фактора VIII, измеренного как FVIII:C по отношению к общему количеству доступного Фактора VIII, определенного через FVIII:Ag, составляло в исходном материале 0,78. Соотношение C/Ag также измеренное в протоке и фракциях отмывки, было существенно ниже (<0,35). Во фракции элюата соотношение C/Ag повышалось с 0,78 в исходном материале до 0,91. Это ясно показывает устранение неактивных форм Фактора VIII на анионообменной стадии. Это также подтверждается на Фиг. 1, дорожки 5 - 6, которые обе показывают, что дегенерированные продукты Фактора VIII устранены из протока + фракция уравновешивания и в отмывочной фракции. Фиг. 2, дорожка 4, показывает профиль вестерн-блоттинга FVIII основной фракции Фактора VIII (элюате) без видимых продуктов дегенерации FVIII. Высокое (>98%) содержание мономера в элюате показано на Фиг. 4, как вытекает из анализа SEC-HPLC1.
Вывод по Примеру 2
Анионообменная стадия устраняет молекулы Фактора VIII с уменьшенной и/или отсутствующей активностью FVIII:C в проточной и отмывочных фракциях, как можно видеть из Табл. 4 и Фиг. 1 (дорожки 5 - 6). Биологически активный продукт фракции (элюция) содержит в высокой степени мономерный Фактор VIII, как видно из Фиг. 4.
Пример 3, Эксклюзионная хроматография
Следующий способ иллюстрирует устранение форм Фактора VIII без активности Фактора VIII:C на эксклюзионной хроматографической колонке (Superdex 200 p.g.).
Колонка и смола
Колонка BPG100 заполнялась смолой Superdex 200 p.g. до высоты слоя 69 см, что дает объем колонки 5,4 литра. Смолу Superdex 200 p.g. получали на фирме GE Healthcare (каталожный № 17-1043).
Исходный материал
Материал, содержащий Фактор VIII с чистотой 10 200 IU Фактора VIII/мг белка, 0,4 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbat 80, pH 6.2 использовали как исходный материал. Исходный материал получали, как описано в Примере 2 (продукт фракции элюции). Образец, загруженный на смолу, составлял 5,5% объема колонки.
Композиция буфера:
Буфер уравновешивания
30,7 г/кг NaCl, 0,5 г/кг CaCl2, 2,0 г/кг цитрата натрия, 9,2 г/кг аргинина, 9,2 г/кг сахарозы, 0,02% (вес/вес) Polysorbate 80, pH: 7,0 ± 0,1, проводимость: 49 ± 2 мСм/см при +25°С
Уравновешивание не ограничивается указанным pH, концентрациями и типом буфера, солей или детергентов.
Колонку уравновешивали буфером уравновешивания, после чего загружали исходный материал. На смолу затем снова наносили буфер уравновешивания, чтобы позволить раствору Фактора VIII отделиться на эксклюзионной колонке. Когда поглощение на [длине волны] 280 нм превосходит 0,035 условных единиц (AU) на выходе из колонки начинали сбор элюата, а когда поглощение снижалось до 0,05, сбор элюата прекращали. Образцы брали из загрузки и из элюата и анализировали вестерн-блоттинги FVIII:C, FVIII:Ag, SEC-HPLC1 и FVIII.
|
Табл. 5 иллюстрирует устранение неактивных форм Фактора VIII из исходного материала на стадии эксклюзионной [хроматографии]. Соотношение биологически активного Фактора VIII, измеренное как FVIII:C по сравнению с общим количеством доступного Фактора VII, измеренного как FVIII:Ag, составляло 0,83 в исходном материале и 0,94 во фракции элюата. Это показывает устранение неактивных форм Фактора VIII на эксклюзионной колонке вследствие агрегации и/или фрагментации. Фиг. 2, дорожка 5 показывает одинаковый паттерн полос Фактора VIII для фракции элюции по сравнению с контролем. Фиг. 5 показывает высокое содержание (>99%) мономера Фактора VIII и низкое содержание (<1%) агрегатов в элюате с помощью анализа SEC-HPLC1 при нативных условиях. Фиг. 3 иллюстрирует истинное устранение агрегатов и фрагментов из мономерного продукта Фактора VIII, как представляется из эксклюзионной хроматограммы.
Вывод из Примера 3
Стадия эксклюзионной хроматографии устраняет молекулы Фактора VIII с уменьшенной и/или отсутствующей активностью FVIII:C в результате разделения молекул различного размера. Среда хроматографии и параметры способа облегчают агрегацию и устранение [агрегатов] в ходе процедуры, что приводит к высокому уровню мономерного продукта (>99%) Фактора VIII с высокой биологической активностью (C/Ag > 0,9), как может быть видно из Фиг. 5 и Табл. 5.
Пример 4. Последовательное использование аффинной, анионообменной и эксклюзионной хроматографии
Следующий способ иллюстрирует устранение форм Фактора VIII, не имеющих активности Фактора VIII:C, путем последовательности очистки, состоящей из трех различных технологий хроматографии, выполненных последовательно:
Аффинная хроматография (VIIISelect)
Анионообменная хроматография (Q Sepharose FF)
Эксклюзионная хроматография (Superdex 200 p.g.)
Колонки и смолы
Аффинная хроматография (VIIISelect)
Колонку BPG140 заполняли смолой VIIISelect до высоты слоя в десять см, что дает объем колонки в 1,5 литра. Смола VIIISelect была получена на фирме GE Healthcare (каталожный № 17-5450).
Анионообменная хроматография (Q Sepharose FF)
Колонка BPG100 была заполнена смолой Q Sepharose FF до высоты слоя в семь см, что дает объем колонки 0,55 литра. Смола Q Sepharose FF была получена на фирме GE Healthcare (каталожный 17-0510).
Эксклюзионная хроматография (Superdex 200 p.g.)
Колонку BPG100 заполняли смолой Superdex 200 p.g. до высоты слоя 69 см, что дает объем колонки 5,4 литра. Смолу Superdex 200 p.g. получали на фирме GE Healthcare (каталожный № 17-1043).
Исходный материал, композиция буфера аффинной стадии:
0,34 моль/кг NaCl, 0,035 моль/кг CaCl2, 0,01 моль/кг L-гистидина, 0,045 моль/кг L-аргинина, 0,2 моль/кг сорбитола, 0,02% (вес/вес) Polysorbat 80, 1% (вес/вес) Triton X-100, 0,3% tri-n-бутилфосфата (TNBP, вес/вес), pH 6,5 использовались как исходный материал. Исходный материал получали, как описано также в WO 2009/156430 A1, включенной по ссылке.
Исходный материал, композиция буфера на стадии анионообменной [хроматографии]:
0,15 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbat 80, pH 7,5 были использованы как исходный материал.
Исходный материал, композиция буфера стадии эксклюзионной [хроматографии]:
0,39 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbat 80, pH 6,2 были использованы как исходный материал.
Композиции буферов для аффинной хроматографии:
Буфер уравновешивания (с Triton X-100 и TNBP)
0,3 моль/кг NaCl, 0,02 моль/кг CaCl2 (2 × H2O), 0,02 моль/кг L-гистидина, 1% вес/вес Triton X-100, 0,3% вес/вес TNBP, pH: 6,5 ± 0,1, проводимость: 31 ± 3 мСм/см при +25°C.
Отмывочный буфер 1 (Буфер уравновешивания без Triton X-100 и TNBP)
0,3 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 6,5 ± 0,1, проводимость: 31 ± 3 мСм/см при +25°C.
Отмывочный буфер 2
1,0 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 6,5 ± 0,1, проводимость: 85 ± 3 мСм/см при +25°C.
Буфер элюции
1.5 моль/кг NaCl, 0.02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0.02% (вес/вес) Polysorbate 80, 50% (вес/вес) этиленгликоль (EG), pH: 6,5 ± 0,1, проводимость: 39 ± 3 мСм/см at +25°C.
Буферы уравновешивания, отмывки и элюции не ограничиваются обозначенными pH, концентрациями, а также типами буфера, солей или детергентов.
Композиции буферов для анионообменной хроматографии:
Буфер уравновешивания
0,1 моль/кг NaCl, 0,02 моль/кг CaCl2 (2 × H2O), 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 7,5 ± 0,1, проводимость: 15 ± 1 мСм/см при +25°C.
Отмывочный буфер
0,32 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 7,5 ± 0,1, проводимость: 32,5 ± 2,5 мСм/см при +25°C.
Буфер элюции
0,39 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbate 80, pH: 6,0 ± 0,1, проводимость: 40 ± 2 мСм/см при +25°C.
Буферы уравновешивания, отмывки и элюции не ограничены установленным pH, концентрациями и типом буфера, солей или детергента.
Композиции буферов эксклюзионная хроматографии:
Буфер уравновешивания
30,7 г/кг NaCl, 0,5 г/кг CaCl2, 2,0 г/кг цитрата натрия, 9.2 г/кг аргинина, 9,2 г/кг сахарозы, 0,02% (вес/вес) Polysorbate 80, pH: 7.0 ± 0.1, проводимость: 49 ± 2 мСм/см при +25°C.
Уравновешивание не ограничено указанным pH, концентрациями и типом буфера, солями или детергентами.
Соответствующая колонка (для аффинной, анионообменной, эксклюзионной хроматографии) уравновешивалась буфером уравновешивания, как определено выше.
Смола для аффинной хроматографии обрабатывалась первой путем загрузки исходного материала, как определено выше и в Табл. 6, после чего следовала отмывка колонки отмывочным буфером 1 и отмывочным буфером 2, как определено выше. Далее, биологически активный продукт Фактор VIII элюировался буфером элюции. Элюат после отбора образцов (FVIII:C, FVIII:Ag) становился исходным материалом для последующей стадии анионообменной хроматографии.
Элюат стадии аффинной хроматографии разбавляли в 10 раз, чтобы получить условия исходного материала, определенные выше. Разбавленный исходный материал наносили на анионообменную колонку, за чем следовали отмывка 1 и отмывка 2, как определено выше. Затем биологически активный продукт Фактор VIII элюировался с помощью буфера элюции. Элюат после отбора проб (FVIII:C, FVIII:Ag) становился исходным материалом для последующей стадии эксклюзионной хроматографии.
Элюат стадии анионообменной [хроматографии] размораживали, если он был заморожен, в противном случае использовался непосредственно на стадии эксклюзионной хроматографии, как определено выше и в Табл. 6. После нанесения на колонку продукта на колонку наносили буфер уравновешивания до тех пор, пока элюировалась фракция мономера Фактора VIII. Фракция мономера Фактора VIII начиналась, когда поглощение, измеренное на [длине волны] 280 нм, возрастало выше 0,04 AU. Сбор фракции мономера Фактора VIII прекращали, когда поглощение, измеренное на [длине волны] 280 нм, возвращалось к 0,01 AU. Из элюата отбирали образцы и анализировали на вестерн-блоттинге FVIII:C, FVIII:Ag, FVIII, SEC_HPLC и аминокислотную композицию.
Вышеописанная процедура повторялась для 5 различных партий материала при указанных условиях (Табл. 6), чтобы изучить повторяемость, ее результаты можно видеть в Табл. 7.
|
|
Табл. 7 иллюстрирует устранение неактивных форм Фактора VIII из исходного материала в пяти различных партиях после первой стадии способа очистки (аффинная хроматография), за которой следовала вторая стадия способа очистки (анионообменная хроматография) и, наконец, заключительная стадия способа очистки (эксклюзионная хроматография).
Фиг. 6 показывает наложение хроматограмм 5 партий продукта (согласно Табл. 6 - 7) выполненное на стадии эксклюзионной хроматографии. Начало и конец сбора фракции элюата эксклюзионной [хроматографии] показаны на чертеже.
Соотношение биологической активности Фактора VIII, измеренное по FVIII:C в сравнении с общим количеством доступного Фактора VIII, измеренного через FVIII:Ag, составляло 0,70 как среднее значение для исходного материала перед аффинной стадией. Соотношение FVIII C/Ag увеличивается затем до 0,80 как среднего значения после аффинной стадии, а затем увеличивается до 0,85 как среднего значения после анионообменной стадии. Наконец, после заключительной эксклюзионной стадии очистки [соотношение] увеличивается до 0,95, что близко к оптимальному соотношению FVIII C/Ag 1,0. это может быть далее изучено по Табл. 7, показывающей все концентрации FVIII:C и FVIII:Ag и соотношения FVIII:C/FVIII:Ag для соответствующих стадий во всех 5 партиях, на которых это было выполнено.
Фиг. 7, 9, 11, 13 и 15 показывают результаты после SEC-HPLC1 анализа элюата анионообменной [хроматографии] партий 1 - 5, как это определено в Табл. 6 - 7. Результаты SEC-HPLC1 для всех образцов анионообменных элюатов показывают отсутствие (4 партии) или очень малое (< 1%) количество агрегатов (среднее значение для 5 партий 0,1%), содержание мономера FVIII > 97% (среднее значение для 5 партий 98,5%) и содержание фрагментов < 2% (среднее значение для 5 партий 1,4%). Анионообменный элюат после выполнения аффинной стадии, за которой следовала анионообменная стадия, демонстрирует высокое содержание мономера Фактора VIII и низкое содержание потенциально иммуногенных агрегатов/фрагментов частей FVIII.
Фиг. 8, 10, 12, 14 и 16 показывают результаты после SEC-HPLC1 анализа элюата эксклюзионной [хроматографии] для партий 1 - 5, как определено в Табл. 6 - 7. Результаты SEC-HPLC1 для всех образцов эксклюзионного элюата показывают отсутствие видимых или обнаружимых количеств агрегатов, содержание мономера FVIII составляет > 98% (среднее значение для 5 партий 98,6%), а содержание фрагментов составляет < 2% (среднее значение для 5 партий 1,4%). Эксклюзионный элюат после выполнения аффинной стадии, за которой следовала анионообменная стадия и эксклюзионная стадия, демонстрирует высокое содержание мономера Фактора VIII, отсутствие обнаружимых или видимых признаков агрегатов и низкое содержание фрагментов FVIII.
Вывод по Примеру 4
Все три хроматографические стадии, выполненные в последовательности 1 - 3 в соответствии с Примером 4, вносят вклад в устранение неактивных молекул Фактора VIII по данному изобретению. Это показывает, что неактивные молекулы Фактора VIII, устраненные на разных стадиях, различаются по своим биофизическим свойствам, и выполнение стадий в последовательной связке между собой, чтобы предоставить финальный очищенный продукт Фактор VIII с минимальной степенью содержания неактивного Фактора VIII и максимальной степенью содержания мономера фактора VIII дает минимальный риск иммуногенных реакций у пациентов.
Пример 5. Параметры эксклюзионной хроматографии (высота колонки, концентрация FVIII:C, загрузка)
Нижеследующий пример иллюстрирует важность параметров эксклюзионной [хроматографии] (концентрация FVIII:C и загрузка колонки) для биологической активности (FVIII:C/Ag).
Колонка и смола
Колонка BPG200 заполнялась смолой Superdex 200 p.g. до толщины слоя 62 см, дающей объем колонки в 19,5 литра. Смолу Superdex 200 p.g. получали на фирме GE Healthcare (каталожный № 17-1043).
Исходный материал
Материал, содержащий Фактор VIII со следующей композицией: 0,4 моль/кг NaCl, 0,02 моль/кг CaCl2, 0,02 моль/кг L-гистидина, 0,02% (вес/вес) Polysorbat 80, pH 6,2, использовали как исходный материал. Исходный материал получали, как описано в Примере 2 (продукт фракции элюции).
Композиция буфера:
Буфер уравновешивания
30,7 г/кг NaCl, 0,5 г/кг CaCl2, 2,0 г/кг цитрата натрия, 9,2 г/кг аргинина, 9,2 г/кг сахарозы, 0,02% (вес/вес) Polysorbate 80, pH: 7,0 ± 0,1, проводимость: 49 ± 2 мСм/см при +25°C.
Уравновешивание не ограничено указанным pH, концентрациями и типом буфера, солями или детергентом.
Семь различных партий (A-G) были обработаны согласно Табл. 8 ниже. Колонку уравновешивали буфером уравновешивания, после чего следовала оговоренная загрузка исходного материала. Затем смолу обрабатывали буфером уравновешивания, чтобы позволить раствору Фактора VIII разделиться на эксклюзионной колонке. Когда поглощение [на длине волны] 280 нм повышалось до 0,035 AU на выходе из колонки, начинали сбор элюата, а когда поглощение снижалось до 0,005 AU, сбор элюата прекращали. Образцы брали из исходного материала и элюата и анализировали на FVIII:C, FVIII:Ag и SEC-HPLC1.
|
Табл. 8 иллюстрирует то, что устранение неактивных форм Фактора VIII из исходного материала на стадии эксклюзионной [хроматографии] зависит от разных параметров. Сравнительно низкая концентрация Фактора VIII:C в комбинации с сравнительно низкой загрузкой колонки, как в партии E (15925 IU/мл, 4,3%), F (14844 IU/мл, 1,9%) и G (9149 IU/мл, 3,9%), вероятно, имеют негативное влияние на биологическую активность, измеренную как соотношение FVIII:C/FVIII:Ag в соответствующих элюатах (E - 0,81, F - 0,79, G - 0,82), по сравнению с партиями A - D (A - 0,90, B - 0,81, C - 0,99 и D - 1,01)
Вывод по Примеру 5
Концентрация FVIII:C в комбинации с загрузкой колонки представляет собой важный параметр выхода стадии эксклюзионной [хроматографии] по биологической активности. Основываясь на данных, описанных в Примере 3 и Примере 4, в которых в обоих случаях использовалась высота слоя 69 см, возможно, что результаты, описанные в Примере 5 с немного меньшей толщиной слоя (62 см), вероятно в комбинации с двумя другими факторами, имеющими значение, (концентрация FVIII:C и загрузка колонки) также влияют на выход стадии эксклюзионной [хроматографии]. Показано, что стадия эксклюзионной [хроматографии] более эффективна при высокой концентрации Фактора VIII:C, большой высоте слоя в колонке и загрузке колонки ≥ 4%.
Пример 6. Стабильность биологически активного мономерного Фактора VIII в замороженном состоянии.
Нижеследующий пример иллюстрирует стабильность раствора биологически активного мономерного Фактора VIII, обработанного по Примеру 4, в замороженном состоянии.
Исходный материал: Раствор Фактора VIII, полученный по Примеру 4, с содержанием мономера фактора VIII > 99%, содержанием агрегатов < 1% и количеством неактивного Фактора VIII > 0,9, измеренный по соотношению биологически активного Фактора VIII относительно общего количества Фактора VIII (FVIII:C/FVIII:Ag).
Среда буфера Фактора VIII:
30,7 г/кг NaCl, 0,5 г/кг CaCl2, 2,0 г/кг цитрата натрия, 9,2 г/кг аргинина, 9,2 г/кг сахарозы, 0,02% (вес/вес) Polysorbate 80, pH: 7,0 ± 0,1, проводимость: 49 ± 2 мСм/см при +25°C.
Условия замораживания и хранения:
Раствором Фактора VIII заполняли пластиковый контейнер из полиэтилена низкого плотности и замораживали до -40°C путем способа быстрого замораживания в течение максимум 60 минут. Замороженный раствор затем хранили при температуре между -60°С и -80°С в течение 36 месяцев. Образцы отбирали после 0, 6, 9, 12, 18, 24 и 36 месяцев хранения и анализировали на биологическую активность и содержание мономера, агрегатов и фрагментов.
|
Как можно видеть из Табл. 9, раствор Фактора VIII полностью стабилен в течение, по меньшей мере, 36 месяцев хранения при температуре между -60°С и -80°С в отношении биологической активности и содержания мономерного Фактора VIII (формирование агрегатов и фрагментов).
Пример 7. Стабильность биологически активного мономерного Фактора VIII в лиофилизированном продукте.
Нижеследующий пример иллюстрирует стабильность раствора биологически активного мономерного Фактора VIII, обработанного по Примеру 4 и Примеру 6, а затем лиофилизированного.
Исходный материал: Замороженный раствор Фактора VIII, полученный по Примеру 4 и Примеру 6 с содержанием мономера фактора VIII > 99%, содержанием агрегатов < 1% и количеством неактивного Фактора VIII > 0,9, измеренного как соотношение биологически активного Фактора VIII относительно общего количества Фактора VIII (FVIII:C/FVIII:Ag).
Содержание одного флакона Фактора VIII после лиофилизации:
|
Процедура лиофилизации:
2,5 мл исходного материала Фактора VIII заливали во стеклянный флакон на 8 мл (тип I) до общего количества 250 IU Фактора VIII. Флакон подвергали способу лиофилизации, как описано в Табл. 10.
|
После способа лиофилизации флаконы закрывали с помощью бромбутиловых пробок и уплотняли алюминиевыми обжимными кольцами. Флаконы хранили при +5°С в течение 24 месяцев. Образцы отбирали после 0, 6, 9, 12, 18 и 24 месяцев хранения путем растворения лиофилизированного продукта в 2,5 мл воды для инъекций, а затем анализировали на биологическую активность и содержание мономера, агрегатов и фрагментов, см. Табл. 11.
|
Как можно видеть из Табл. 11, лиофилизированный продукт Фактор VIII полностью стабилен в течение, по меньшей мере, 24 месяцев хранения при температуре +5°С в отношении биологической активности и содержания мономерного Фактора VIII (формирование агрегатов и фрагментов).
Пример 8. Определение соотношения FVIII C/Ag, а также агрегатов, мономера и фрагментов в финальном лиофилизированном продукте по данному изобретению и сравнение их с рекомбинантными продуктами с помощью различных способов.
Нижеследующие примеры иллюстрируют превосходные свойства продукта по данному изобретению и сравнение их с другими коммерчески доступными рекомбинантными продуктами с помощью различных способов очистки.
Исходный материал: Лиофилизированный продукт Фактор VIII, изготовленный согласно Примеру 7 по данному изобретению, растворяли и сравнивали с 3 различными конкурентными rFVIII продуктами, очищенными 3 различными способами очистки (A-C) и стабилизированными разными формами буферов. По меньшей мере, 1 флакон с активным веществом (250 IU, 1000 IU или 3000 IU) анализировали на сравнение между разными формами композиций стабилизатор/FVIII. Все образцы анализировали на [соотношение] FVIII C/Ag и [содержание] агрегатов, мономер и фрагментов по аналитическому способу SEC-HPLC2 при нативных условиях.
|
Вывод по Примеру 8:
Табл. 1 показывает превосходное качество очищенного и лиофилизированного рекомбинантного продукта FVIII, полученного по данному изобретению, в отношении 100% содержания мономера и соотношения FVIII C/Ag > 0,9. Это подразумевает отсутствие или очень малое количество биологически неактивного Фактора VIII в финальном продукте по сравнению с конкурирующими продуктами, очищенными и стабилизированными в различных условиях.
Пример 9. Сравнение образования ингибитора продукта rFVIII, очищенного, изготовленного в виде формы, лиофилизированного и сохраняемого по данному изобретению, у ранее нелеченных от гемофилии А пациентов по сравнению с опубликованными данными для одного из конкурирующих рекомбинантных продуктов FVIII21. Также сравниваются соотношение FVIII C/Ag и [содержание] агрегатов, мономера и фрагментов между двумя продуктами.
Нижеследующий пример иллюстрирует превосходные качества продукта по данному изобретению и сравнение его с одним из коммерчески доступных на рынке рекомбинантных продуктов FVIII.
Исходный материал: Лиофилизированный продукт Фактор VIII, произведенный по Примеру 7 по данному изобретению, сравнивали с одним из конкурирующих продуктов rFVIII, коммерчески доступных на рынке, очищенным по способу A, описанному в Примере 8. Два продукта давали пациентам и отслеживали развитие формирования ингибитора, в соответствии со стандартными клиническими протоколами21 для пациентов, ранее не леченных от гемофилии A. Количество пациентов, у которых развивается ингибитор к соответствующим продуктам, а также соотношение Фактора VIII C/Ag и профиль агрегат/мономер/фрагмент можно видеть в Табл. 12.
|
Вывод по примеру 9:
Таблица показывает существенно меньшее количество ингибитора, обнаруживаемого у ранее не леченных от гемофилии А пациентов, использующих продукт по данному изобретению, по сравнению с одним из коммерчески доступных на рынке продуктов rFVIII. Кроме того, Табл. 10 показывает соотношение C/Ag Фактора VIII и профиль агрегат/мономер/фрагмент образцов соответствующих продуктов для 2 (250 IU и 1000 IU) и соответственно 3 (250 IU, 1000 IU и 3000 IU) разных содержаний активного вещества во флаконе. Можно предположить, что меньшее количество биологически неактивного FVIII в продукте должно уменьшать количество ингибитора, образующегося у пациентов. Таким образом, подчеркивается важность очистки, стабилизации, лиофилизации и хранения рекомбинантных продуктов FVIII для минимизации риска иммунологических реакций для пациентов.
Пример 10. Специфическая активность (чистота) рекомбинантного продукта FVIII, очищенного по данному изобретению.
Нижеследующий пример иллюстрирует превосходную чистоту рекомбинантного продукта FVIII, очищенного по данному изобретению.
Исходный материал: Замороженный раствор Фактора VIII, полученного по Примеру 4 и Примеру 6, с содержанием мономера фактора VIII > 99%, содержанием агрегатов < 1% и количеством неактивного Фактора VIII > 0,9, измеренного по соотношению биологически активного Фактора VIII относительно общего количества о Фактора VIII (FVIII:C/FVIII:Ag) анализировали по FVIII:C и общему содержанию белка по Брэдфорд.
Вывод по Примеру 10:
Фиг. 18 показывает увеличение чистоты, измеренной как FVIII:C/мг белка (измеренная по Брэдфорд) на 9 партиях, очищенных по данному изобретению (3 последние стадии: элюат аффинной стадии, элюат анионообменной стадии и лекарственный препарат (= элюат эксклюзионной хроматографии)) в промышленном масштабе, достигающий чистоты в диапазоне 10 000 IU/мг белка, что означает практически чистый rFVIII.
Описание анализа
Биологическую активность Фактора VIII (FVIII:C) измеряли хромогенным анализом (набор COATEST SP FVIII, 82 4086 63, фирма Chromogenix/Instrumentation Laoboratory (US)), основанным на двухстадийном фотометрическом способе, который измеряет биологическую активность фактора VIII как кофактора. (17)
Количественное антигенное содержание Фактора VIII (FVIII:Ag) измеряли с помощью набора для иммуноферментного анализа (ELISA) (ASSERACHROM® VIII:Ag, набор для иммуноферментного анализа на Фактор VIII, фирма Diagnostica Stago (Франция), как описано далее (18) с заменой буфера, предоставляемого в наборе, буфером Tris-NaCl + 1% бычьего сывороточного альбумина для разбавления образцов.
Мономеры, агрегаты и фрагменты Фактора VIII измеряли с помощью двух разных аналитических колонок для эксклюзионной хроматографии (SEC-HPLC) (SEC-HPLC 1, Superdex 200, 10/300 GL, фирма GE Healthcare и SEC-HPLC2, BioSEC-3, фирма Agilent Technologies)
Способ SEC-HPLC1 (Superdex 200) проводили при нативных буферных условиях (25 мМ HEPES, 0,5M NaCl, 0,3M аргинина, 50 мМ CaCl2, 0,02% Polysorbate 80, pH 7,5). Загруженный образец составлял приблизительно 1% эксклюзионной колонки, а концентрация Фактора VIII:C составляла приблизительно 1000 IU/мл. Мономер определялся как главный пик хроматограммы FVIII, агрегаты - как пик элюирующийся перед, а фрагменты - как хроматографический пик, элюирующийся после пика мономера FVIII.
Способ SEC-HPLC2 (BiSEC-3). Рекомбинантно экспрессированные образцы FVIII анализировались относительно их композиции по агрегатам, мономеру и фрагментам FVIII с помощью эксклюзионной хроматографии (BioSEC-3, 30 × 4,6 мм колонка SEC фирмы Agilent Technologies) при неденатурирующих буферных условиях (25 мМ Tris-HCl, 50 мМ CaCl2, 500 мМ NaCl; pH 7,0) при скорости протока 0,4 мл/мин в системе жидкостной хроматографии высокого разрешения Shimadzu HPLC system. Загрузка образца составляла приблизительно 0,2 - 0,4 мкг в соответствии с определенными значениями активности FVIII (FVIII:C). Мономер определяли как основной пик хроматограммы FVIII, агрегаты - как пик, элюирующийся перед, а фрагменты - как пик хроматограммы, элюирующийся после пика мономера FVIII. Время выхода пика анализируемых образцов rFVIII также сравнивали с временем выхода пиков образцов молекулярных весов (15 - 600 кДа, 69385, фирма Sigma-Aldrich Chemie GmbH)
Продукты разложения Фактора VIII, основываясь на размерах, измеряли с помощью вестерн-блоттинга FVIII. Распределение молекулярных масс FVIII белков и пептидов в препаратах фактора VIII разделяли в соответствии с молекулярными массами по гель-электрофорезу в полиакриламидном геле (PAGE) с додецилсульфатом натрия (SDS) при восстанавливающих условиях. Затем белки электрофоретически переносились с геля на нитроцеллюлозную мембрану, которую затем инкубировали с блокирующим агентом. Добавляли коммерчески доступные поликлональные антитела овцы к полной молекуле фактора VIII человека, после чего вносили вторые помеченные ферментом антитела в качестве зонда. В качестве третьей стадии добавляли хемилюминесцентный субстрат и, когда он комбинировался с ферментом, образовывалось излучение как побочный продукт. Появление излучения захватывалось как изображение в реальном времени с помощью охлаждаемой телекамеры на приборах с зарядовой связью. Интенсивность сигнала коррелирует с избытком антигена (FVIII) на мембране блоттинга.
Двумерный электрофорез с серебряным окрашиванием проводили, чтобы изучить паттерн электрофоретических полос белковой цепи Фактора VIII.
Анализ аминокислотной композиции проводили путем композиционного аминокислотного анализа, за которым следовал кислотный гидролиз белка. Белки гидролизовали в 6M HCl при 110°С в течение 24 ч, а затем аминокислоты отделялись катионообменной хроматографией на сульфонированной полистирольной смоле и непрерывно детектировались в элюенте. Детектирование основывается на послеколоночной нингидриновой дериватизации с использованием двойного фотометра для одновременного измерения на [длине волны] 440 нм пролина и на [длине волны] 570 нм - остальных аминокислот. Данные относительно цистеина и триптофана не могли быть получены, поскольку данный способ не в состоянии измерять эти остатки правильно. Значения для лизина и аргинина также опущены из-за наложения лизина и аргинина, присутствующих в форме буфера.
Фингерпринтинг N-гликанов выполняли с помощью анионообменной хроматографии высокого разрешения с импульсным амперометрическим детектированием (HPAEC-PAD) для определения N-связанных гликанов. (19) N-связанные гликановые цепи отделялись от белков путем ферментативного расщепления (N-Glycanase Plus, продукт No GKE-5010B, фирма Prozyme), а затем связывали с анионообменной хроматографической колонкой при высоких pH (pH 13), за чем следовал градиент с повышенной ионной силой и пониженным pH. Разделение различных гликановых цепей в хроматографической системе достигалось благодаря разнице в заряде, размере и структуре. Анионообменной колонкой являлась хроматографическая колонка CarboPac™ PA 200 (250 мм x 3 мм ID, размер частиц 5,5 мкм, продукт No 062896) фирмы Dionex и предколонка CarboPac™ PA 200 (50 x 3 мм ID, продукт No 062895) фирмы Dionex. Система детектирования представляла собой электрохимический детектор ICS-3000 CD с 3 мм золотой мембраной (ICS-3000 Au Working Electrode, 3 мм, продукт No 063723), управляемый программным обеспечением Chromeleon.
Образцы, соответствующие различным хроматографическим пикам, собирали во фракции, причем каждая фракция соответствует времени удерживания 1 мин. Гликаны обессоливали на пористой колонке с графитовым углеродом, а затем каждую фракцию концентрировали. Хроматографическое разделение выполняли на капиллярной системе LC с помощью колонки PGC, а гликаны подвергались электрораспылению в реальном масштабе времени до времяпролетной масс-спектрометрии. База данных Functional Glycomics [www.functionalglycomics.org] была использована путем внесения [величин] массы и поиска возможных совпадений. Вследствие точности больших масс (около 30 ppm) идентификация соответствующих гликанов была определена точно.
Картирование фингерпринта трипсинизированных пептидов выполняли с включением двух основных стадий. На первой стадии трипсин использовали для переваривания белка, чтобы анализировать в виде полипептидов, который на второй стадии разделяются и регистрируются с помощью технологии жидкостной хроматографии высокого разрешения (HPLC). Таким образом генерируется специфический паттерн («фингерпринт»). Пептиды детектируются по их выходу флуоресценции (в основном - триптофана), которая дает более простую карту по сравнению с ультрафиолетовым детектированием. Зарегистрированный флуоресцентный паттерн во времени представляет пептидную карту анализируемого образца.
Концентрацию белка определяли анализом Брэдфорд23.
VIIISelect представляет собой среду для аффинной хроматографии (смолу), разработанную для очистки рекомбинантного фактора VIII, лишенного B-домена.
В соответствии с данными 28-9662-37 AB, фирмы GE healthcare ключевые характеристики VIIISelect включают в себя:
Эффективность очистки рекомбинантного фактора VIII, лишенного B-домена, с высоким выходом и сохранением специфической активности
Высокая селективность
Превосходная масштабность производства
Производство без использования животных
Эффективность процессов очистки рекомбинантных факторов свертывания крови необходима для лечения пациентов, страдающих гемофилией. VIIISelect представляет собой среду для аффинной хроматографии, разработанную для очистки рекомбинантного фактора VIII, лишенного B-домена, ключевого рекомбинантного фактора крови, используемого в лечении гемофилии A. Вследствие чувствительной природы молекулы фактора VIII, важно ограничить число стадий процессов последующей обработки. Высокие селективность и выход, полученные с помощью VIIISelect, делают возможным надежный и эффективный способ очистки с превосходной чистотой, получаемой в одну стадию. Производство без использования животных и низкая утечка лиганда представляют собой дополнительные свойства, которые делают эту среду в высокой степени пригодной для производства в промышленном масштабе рекомбинантного фактора VIII, лишенного B-домена. VIIISelect представляет собой часть программы фирмы GE Healthcare по разработке сред по заказу (Custom Designed Media program).
Характеристики среды
VIIISelect основывается на основном агарозном матриксе с высокой степенью с поперечной сшивки, который делает возможным быструю обработку больших объемов образца. Лиганд, [который представляет собой] рекомбинантный белок 13 кДа, присоединен к пористому основному матриксу через гидрофильную спейсерную ножку, что делает легко доступным связывание с рекомбинантным фактором VIII, лишенным В-домена (Фиг. 1). Табл. 1 суммирует основные характеристики VIIISelect.
Функциональные принципы
Аффинная хроматография использует иммобилизованный лиганд, который адсорбирует специфическую молекулу или группу молекул при подходящих условиях связывания и отделяется от них при подходящих условиях элюции. Эти условия зависят от молекулы-мишени, композиции исходного материала и хроматографической среды и должны быть изучены вместе с другими хроматографическими параметрами (например, загрузкой образца, скоростью потока, толщиной слоя, регенерацией и безразборной отмывкой), чтобы установить условия, которые приводят к связыванию молекулы-мишени с наибольшим выходом продукта.
Частичная структура VIIISelect.
Рекомбинантный фактор VIII может быть нанесен на колонку VIIISelect непосредственно из очищенных клеточных лизатов или супернатантов.
|
Буферы всегда должны содержать ионы Ca2+, чтобы запускать формирование активной конформации фактора VIII. Присутствие поверхностно-активных веществ необходимо, чтобы ингибировать индуцированную поверхностью денатурацию /адсорбцию. Нейтральный рН буферов и гистидина должен всегда использоваться для связывания, отмывки и элюции для поддержания специфической активности фактора VIII. В зависимости от природы материала, нанесенного на VIIISelect, регенерация обычно требуется после каждого цикла, за которой следует повторное уравновешивание с помощью уравновешивающего/загрузочного буфера.
Стабильность
Лиганд связан с основным матриксом с высокой степенью поперечной сшивки через стабильную амидную связь. Фиг. 2 показывает исследование, в котором VIIISelect хранили при комнатной температуре при разных значениях рН в течение одной недели. Чертеж показывает, что стабильность является высокой при рН между при pH 3 и 10. GE рекомендует длительное хранением между pH 3 и 10, а краткосрочное хранение при pH 2 и 12.
Хранение
Рекомендуемые условия хранения: 20% этанол при 4°С - 8°С. VIIISelect предоставлялся предварительно набухшим в 20% растворе этанола.
Безразборная отмывка
Протокол очистки VIIISelect может содержать 0,1M лимонной кислоты или 0,5M фосфорной кислоты. Однако, продолжительное воздействие pH < 2 должно быть устранено из-за разрушения основного агарозного матрикса. Гидрат окиси натрия (0,01 M) может быть использован сам по себе или в комбинации с сульфатом/хлоридом натрия в качестве стабилизатора.
Ссылки
1. Wang et al., Coagulation Factor VIII; structure and stability, International Journal of pharmaceutics 259 (2003) 1-15.
2. Svensson et al., Evaluation of the metal binding site in a recombinant coagulation Factor VIII identifies two sites with unique metal binding sites, Biological Chemistry, DOI:10.1515/hsz-2012-0298.
3. Peerlinck et al., Factor VIII inhibitors in previous treated Haemophilia A patients with a double virus inactivated plasma derived Factor VIII concentrate, Thrombosis and Haemostasis 77 (1) 80-86 (1997).
4. Fang et al., The protein structure and effect of Factor VIII, Thrombosis Research (2007) 119, 1-13.
5. Lin et al., Relationship between Factor VIII:Ag and Factor VIII in recombinant and plasma derived Factor VIII concentrate, Haemophilia (2004), 10, 459-469.
6. Mire-Sluis et al., Analysis and immunogenic potential of aggregates and particles, Bioprocess International 9(11) December 2011 38-43.
7. Grillo et al., Conformational origin of the aggregation of recombinant human Factor VIII, Biochemistry 2001, 40, 586-595.
8. Wang et al., Correlation with rFVIII inactivation with aggregation in solution, Pharmaceutical Research, Vol. 20, No. 4, April 2003.
9. Thim et al., Purification and characterization of new recombinant Factor VIII (N8), Haemophilia (2010), 16, 349-359.
10. Kelley et al., Development and validation of ab affinity chromatography step using a peptide ligand for cGMP production of Factor VIII, Biotechnology and Bioengineering, Vol. 87, No. 3, August 5, 2004.
11. McCue et al., Application of a novel affinity adsorbent for the capture and purification of recombinant Factor VIII compounds, Journal of Chromatography A, 1216 (2009) 7824-7830.
12. Kusch et al., Factor VIII assay mimicking in vivo coagulation conditions, Haemophilia (2013), 1-7.
13. Sommer et al., Comparative field study evaluating activity of recombinant FVIII Fc fusion protein in plasma samples at clinical haemostatis laboratories, Heamophilia (2013) 1-7.
14. Muyldermans, Single domain camel antibodies: current status, Reviews in Moleculer Biotechnology 74, (2001), 277-302.
15. Fay, Factor VIII: Function and structure, International Journal of Hematology 83 (2006) 103-108.
16. Metal ion-independent association of Factor VIII subunits and the roles of calcium and copper ions for cofactor activity and inter-sub-unit affinity, Biochemistry 2001, 40, 10293- 10300.
17. Rosen, Assay of Factor VIII:C with a chromogenic substrate, Scand J Haemetol-Suppl 40, Vol. 33, 1984, 139-145.
18. Girma et al., Assay of Factor VIII antigen (FVIII:CAg) in 294 Haemophilia A patients by a new commercial ELISA using monoclonal antibodies, (Haemophilia 1998), 4, 98-103.
19. Cataldi et al., Carbohydrate analysis by high performance anion-exchange chromatography with pulsed amperometric detection: the potential is still growing, Fresenius J Anal Chem 2000; 368:739-58.
20. Casademunt et al., The first recombinant human coagulation Factor VIII of human origin: human cell line and manufacturing characteristics. Eur J Haematol. 2012; 89(2):165-76.
21. Collins et al., Factor VIII brand and the incidence of Factor VIII inhibitors in previously untreated UK children with severe haemophilia A, 2000-2011, Bloodjournal.org, DO1 10.1182/blood-2014-07-580498.
22. Boedeker, Production processes of licensed recombinant Factor VIII preparations, Seminars in thrombosis and hemostasis volume 27, number 4, 2001.
23. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976; 72:248-54.