Результат интеллектуальной деятельности: СПОСОБЫ ИЗБИРАТЕЛЬНОГО ЛЕЧЕНИЯ АСТМЫ С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ IL-13
Вид РИД
Изобретение
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит Список последовательностей, который подан в электронной форме в формате ASCII, и полное содержание которого, таким образом, включено в качестве ссылки. Указанная копия ASCII, созданная 19 марта 2015 г., названа PAT056217-WO-PCT_SL.txt и имеет размер 40804 байтов.
ОБЛАСТЬ ТЕХНИКИ
Описание относится к прогностическим способам, способам персонализированной терапии, к пригодным для передачи формам информации и к способам лечения пациентов, страдающих астмой.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ДЛЯ ОПИСАНИЯ
Астма представляет собой ведущую нагрузку на всемирное здравоохранение. Несмотря на существующие виды терапии, еще существуют значительные медицинские нужды относительно астмы, с оценкой 300 миллионов пораженных человек по всему миру. Всемирная организация здравоохранения оценивает, что 15 миллионов утраченных лет жизни с поправкой на длительность инвалидизации ежегодно теряются из-за астмы, представляя 1% общей всемирной нагрузки. Ежегодное количество смертей по всему миру оценивают как 250000. Неконтролируемая астма обладает распространенностью более 6 миллионов пациентов по всему миру.
Интерлейкин 13 (IL-13) представляет собой цитокин, продуцируемый T-клетками-помощниками типа 2 (Th2), тучными клетками, эозинофилами и базофилами (Kelly-Welch A, (2005), Sci STKE; 293:pcm 8), который стимулирует продукцию воспалительных цитокинов, осуществляет повышающую регуляцию MHC класса II и экспрессии CD23 на моноцитах, индуцирует зависимое от антител против CD40 переключение класса IgE, и индуцирует синтез IgG и IgM в B-клетках (Joshi BH, (2006), Vitam Horm; 74:479-504). Показано, что IL-13 играет главную роль в нескольких биологических процессах, включая гиперчувствительность дыхательных путей, аллергическое воспаление, эозинофилию тканей, уничтожение паразитов, гиперплазию тучных клеток, синтез антител IgE, метаплазию бокаловидных клеток, ремоделирование тканей и фиброз (Belperio JA, (2002) Am J Respir Cell Mol Biol; 27(4): 419-427; Brombacher F (2000) Bioessays; 22: 646-656; Wynn TA, (2004), Immunol Rev; 201:156-67; Kolodsick JE, (2004), J Immunol; 172: 4068-4076). В частности, показано, что IL-13 является центральным медиатором аллергической астмы в модели на животных (Wills-Karp M, (1998), Science; 282: 2258-2261). Это наблюдение дополнено данными, показывающими, что Ab против IL-13 ингибирует прогрессирование астмы у мышей (Yang G, (2005), J Pharmacol Exp Ther; 313(1): 8-15). IL-13 привлекает два родственных рецептора на отвечающих клетках, IL-13Rα1 и IL-13Rα2 (Wills-Karp M, (2008), Sci Signal; 1(51) pe55). IL-13Rα1 формирует комплекс с субъединицей рецептора IL-4Rα, который передает сигналы посредством пути JAK/STAT для фосфорилирования STAT6, который действует как фактор транскрипции, стимулирующий экспрессию эотаксина и других продуктов, вовлеченных в зависимое от Th2 воспаление. Второй рецептор IL-13Rα2 связывает также IL-13, но, по-видимому, не производит сигналов, вовлеченных в аллергию. Таким образом, комплекс рецепторов IL-13Rα1/IL-4Rα обеспечивает ключевую общую точку в обоих путях передачи сигналов IL-13 и IL-4. См. также Ingram and Kraft (2012) J Allergy Clin Immunol 130(4): 829-842.
WO05007699, WO07036745, WO12049278, и WO08106116 относятся к антителам против IL-13 и/или антагонистам IL-13 для лечения астмы.
Продолжается поиск биомаркеров, определяющие различные фенотипы астмы (Wenzel SE (2012), Nat Med; 18(5): 716-725). WO12083132 относится к способу идентификации пациента с астмой или пациента с респираторным нарушением, который, вероятно, может отвечать на лечение ингибитором пути TH2, включающему в себя использование диагностического анализа эозинофильного воспаления.
Slager RE, (2012), J Allergy Clin Immunol; 130(2): 516-22, относятся к сериям однонуклеотидных полиморфизмов (SNP) в рецепторе IL-4Rα, ассоциированных с уменьшенным риском обострений астмы у пациентов, подвергнутых лечению ингибитором IL-4. WO11156000 относится к применению способов и наборов для определения главного аллеля в конкретных SNP в рецепторе IL-4Rα в качестве показателя вероятного ответа на лечение антагонистом IL-4/IL13 (IL-4 и IL-13), таким как лечение с помощью мутантного белка Il-4 человека.
КРАТКОЕ ИЗЛОЖЕНИЕ РАСКРЫТИЯ
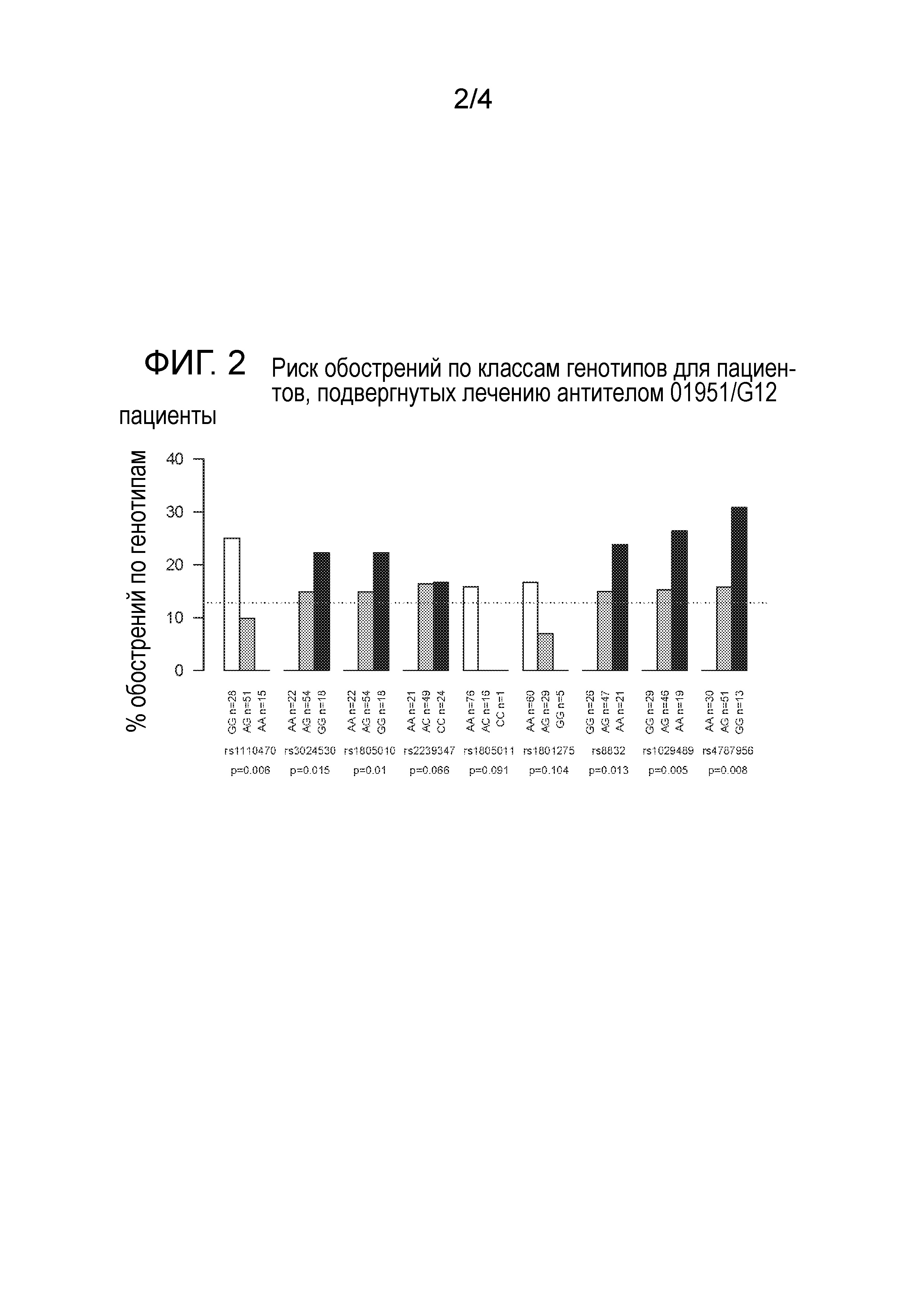
Существует необходимость в идентификации однонуклеотидных полиморфизмов (SNP) как являющихся прогностическими для того, будет ли пациент, страдающий астмой, отвечать на лечение антагонистом IL-13, в качестве способа с использованием фармакогеномного биомаркера для диагностики и лечения астмы. В настоящем документе представлены прогностические способы и виды персонализированной терапии для пациентов, страдающих астмой, которые максимизируют преимущество и минимизируют риск антагонизма IL-13 в этих популяциях посредством идентификации пациентов с вероятностью благоприятного ответа, перед лечением с помощью антагониста IL-13. Способы по изобретению, описанные в настоящем документе, относятся к открытию, что пациенты с конкретными отвечающими генотипами, обладали значительным снижением обострений астмы после лечения антителом 01951/G12 (SEQ ID No. 14 и 16), человеческим моноклональным антителом IgG1/κ против Il-13, дополнительно описанным в WO2007/045477. Отвечающие генотипы у пациентов представляют собой специфические отвечающие аллели SNP в гене рецептора IL-4Rα и представлены в таблице 1.
Таблица 1
|
В таблице 1 указаны нуклеотидные последовательности SNP для рецептора IL-4Rα, как обозначено по соответствующему номеру rs. Последовательности SNP представлены также в базе данных dbSNP, как более подробно указано в ссылках ниже. Альтернативные аллели показаны в скобках. Отвечающий аллель по изобретению показан в таблице 1 жирным шрифтом, и соответственно, обозначен как маркер ответа на анти-Il-13 («маркер AIR» далее в настоящем документе). Соответственно, обозначение маркер AIR является ссылкой только на отвечающий аллель и исключает неотвечающий аллель. В отношении этого, далее принимают, что пациент может являться гомозиготным или гетерозиготным в отношении конкретного маркера AIR. Таким образом, например, пациент, которого определяют как гомозиготного по маркеру AIR 3, обладает генотипом AA по SNP rs1805010, в то время как пациент, который является гетерозиготным по маркеру AIR 3, обладает генотипом AG по этому SNP. В оригинальных способах по изобретению, пациент является положительным по конкретному маркеру AIR, и таким образом, по отвечающему аллелю, когда пациент является гомозиготным или гетерозиготным по отвечающему аллелю. Пациент, который является отрицательным по конкретному маркеру AIR, является гомозиготным по неотвечающему аллелю. Например, пациент, который является отрицательным по маркеру AIR 3, обладает GG для SNP rs1805010.
Изобретение относится к способу избирательного лечения пациента, страдающего астмой, включающему идентификацию пациента, обладающего по меньшей мере одним маркером AIR, выбранным из группы, состоящей из маркера AIR-1, 2, 3, 4, 5, 6, 7, 8 и 9, и затем введение терапевтически эффективного количества антагониста IL-13 пациенту.
В одном варианте осуществления, идентификация включает в себя анализ биологического образца от пациента на присутствие по меньшей мере одного маркера AIR, выбранного из указанной группы.
В другом варианте осуществления, изобретение относится к способу избирательного лечения пациента, страдающего астмой, включающему:
i) анализ биологического образца от пациента на присутствие или отсутствие по меньшей мере одного маркера AIR, выбранного из указанной группы, состоящей из маркеров AIR-1, 2, 3, 4, 5, 6, 7, 8 и 9;
ii) детекцию присутствия по меньшей мере одного маркера AIR, выбранного из указанной группы, в указанном образце, и таким образом определения, что пациент является положительным по указанному маркеру AIR, и
iii) избирательное введение терапевтически эффективного количества антагониста IL-13 пациенту, который является положительным.
В другом варианте осуществления, способы по изобретению дополнительно включают в себя определение того, присутствует ли указанный маркер AIR в гомозиготной или гетерозиготной форме, где присутствие по меньшей мере одного маркера AIR в гомозиготной форме является определяющим для того, что пациент является положительным по указанному маркеру AIR.
В другом варианте осуществления маркер AIR выбран из группы, состоящей из маркера Air 3 и маркера Air 10.
В другом варианте осуществления, способы избирательного лечения по изобретению дополнительно включают в себя определение того, является ли пациент гомозиготным или гетерозиготным по указанному маркеру AIR, и избирательное введение терапевтически эффективного количества антагониста IL-13 пациенту, который является гомозиготным по одному из маркера AIR 3 и маркера Air 10 и гетерозиготным по другому из указанных маркеров; гомозиготным по обоим маркерам AIR 3 и 10; или гомозиготным по маркеру AIR 3.
В других вариантах осуществления, изобретение относится к способам прогнозирования вероятности того, что пациент, страдающий астмой, будет отвечать на лечение с помощью антагониста IL-13. В одном таком варианте осуществления, способы включают анализ биологического образца от пациента на присутствие или отсутствие по меньшей мере одного маркера AIR, выбранного из группы, состоящей из маркеров AIR-1, 2, 3, 4, 5, 6, 7, 8 и 9, где:
a) присутствие по меньшей мере одного маркера AIR является показателем увеличенной вероятности того, что пациент будет отвечать на лечение с помощью антагониста IL-13; и
b) отсутствие по меньшей мере одного маркера AIR является показателем уменьшенной вероятности того, что пациент будет отвечать на лечение с помощью антагониста IL-13.
В другом таком варианте осуществления, способы включают стадию анализа биологического образца от пациента на присутствие или отсутствие по меньшей мере одного маркера AIR, выбранного из группы, состоящей из маркеров AIR-1, 2, 3, 4, 5, 6, 7, 8 и 9 в гомозиготной форме, где:
a) присутствие по меньшей мере одного маркера AIR в гомозиготной форме является показателем увеличенной вероятности того, что пациент будет отвечать на лечение с помощью антагониста IL-13; и
b) отсутствие по меньшей мере одного маркера AIR в гомозиготной форме является показателем уменьшенной вероятности того, что пациент будет отвечать на лечение с помощью антагониста IL-13.
В другом таком варианте осуществления, способы включают стадии:
a) анализа биологического образца от пациента на присутствие или отсутствие по меньшей мере одного маркера AIR, и
b) определения того, присутствует ли маркер AIR в гомозиготной или гетерозиготной форме, где
присутствие по меньшей мере одного маркера AIR в гомозиготной форме является показателем увеличенной вероятности того, что пациент будет отвечать на лечение с помощью антагониста IL-13, где указанный по меньшей мере один маркер AIR выбран из группы, состоящей из:
i) маркеров AIR 3 и 7, где каждый присутствует в гомозиготной форме;
ii) маркера AIR 3, присутствующего в гомозиготной форме, и маркера AIR 7 в гетерозиготной форме;
iii) маркера AIR 7, присутствующего в гомозиготной форме, и маркера AIR 3 в гетерозиготной форме; и
iv) маркера AIR 3 в гомозиготной форме.
В другом варианте осуществления, стадия анализа включает в себя анализ биологического образца по продукту нуклеиновой кислоты по меньшей мере одного маркера AIR, или полипептидному продукту по меньшей мере одного маркера AIR. В другом варианте осуществления, стадия анализа включает в себя анализ биологического образца по геномной последовательности по меньшей мере одного маркера AIR.
В другом варианте осуществления, биологический образец выбран из группы, состоящей из образцов крови, сыворотки, кала, плазмы, мочи, слез, слюны и ткани.
В другом варианте осуществления, стадия анализа включает в себя способ, выбранный из группы, состоящей из анализа Нозерн-блоттинга, полимеразной цепной реакции (ПЦР), обратной транскрипции-полимеразной цепной реакции (ОТ-ПЦР), анализов на основе TaqMan, прямого секвенирования, динамической аллель-специфической гибридизации, высокоплотных массивов олигонуклеотидных SNP, анализов полиморфизма длины рестрикционных фрагментов (RFLP), анализов достройки праймеров, лигазных анализов олигонуклеотидов, анализа одноцепочечного конформационного полиморфизма, электрофореза в геле с градиентом температуры (TGGE), денатурирующей высокоэффективной жидкостной хроматографии, высокоразрешающего анализа плавления, анализов белков, связывающих ДНК с несоответствиями, SNPLex®, капиллярного электрофореза, Саузерн-блоттинга, иммуноанализов, иммуногистохимии, ELISA, проточной цитометрии, Вестерн-блоттинга, ВЭЖХ и масс-спектрометрии.
В других вариантах осуществления, изобретение относится к способам получения пригодной для передачи формы информации для прогнозирования способности пациента, страдающего астмой, отвечать на лечение с помощью антагониста IL-13, включающим в себя определение увеличенной вероятности ответа пациента на лечение с помощью антагониста IL-13 в соответствии со способами по изобретению, указанными выше; и регистрацию результата стадии определения в форме материальных или нематериальных носителей для применения в передаче.
В другом варианте осуществления, антагонист IL-13, используемый в способе по изобретению, конкурирует с антителом 01951/G12 (SEQ ID No. 14 и 16) за связывание с IL-13 в условиях, способствующих конкуренции.
В другом варианте осуществления, антагонист IL-13 представляет собой полипептид или его фрагмент, антитело или его антигенсвязывающий фрагмент, Fab, ScFv.
В другом варианте осуществления, антагонист IL-13 представляет собой антитело или его фрагмент, который связывается с эпитопом IL-13, содержащим остатки FCPHKV (SEQ ID NO: 67), указанные как остатки 103-107 из SEQID NO: 1.
В другом варианте осуществления антагонист IL-13 представляет собой антитело 01951/G12 (SEQ ID No. 14 и 16).
В другом варианте осуществления, антагонист IL-13 представляет собой антитело, вводимое в дозе приблизительно 50-1000 мг i.v. каждые четыре недели (q4wk). В другом варианте осуществления, антагонист IL-13 представляет собой антитело, вводимое в дозе приблизительно 75 мг или 750 мг i.v. каждые четыре недели.
В другом варианте осуществления, антагонист IL-13 обладает KD приблизительно 100-200 пМ. В других вариантах осуществления антагонист обладает более высокой аффинностью для IL-13 и обладает KD менее 100 пМ. В конкретном варианте осуществления антагонист IL-13 представляет собой антитело, обладающее KD приблизительно 140 пМ.
В другом варианте осуществления, антагонист IL-13 обладает временем полужизни in vivo приблизительно 15-30 суток или приблизительно 21 сутки.
В другом варианте осуществления антагонист IL-13 представляет собой антитело, выбранное из группы, состоящей из:
i. антитела, содержащего одну или несколько из CDR, выбранных из списка, состоящего из: (a) CDR1 VH, показанных в SEQ ID NO: 2 или 5, (b) CDR2 VH, показанных в SEQ ID NO: 3 или 6, (c) CDR3 VH, показанных в SEQ ID NO: 4 или 7, (d) CDR1 VL, показанных в SEQ ID NO: 8 или 11, (e) CDR2 VL, показанных в SEQ ID NO: 9 или 12, (f) CDR3 VL, показанных в SEQ ID NO: 10 или 13;
ii. антитела, содержащего CDR1 вариабельной области тяжелой цепи из SEQ ID NO: 2; CDR2 вариабельной области тяжелой цепи из SEQ ID NO: 3; CDR3 вариабельной области тяжелой цепи из SEQ ID NO: 4; CDR1 вариабельной области легкой цепи из SEQ ID NO: 8; CDR2 вариабельной области легкой цепи из SEQ ID NO: 9; и CDR3 вариабельной области легкой цепи из SEQ ID NO: 10;
iii. антитела, содержащего CDR1 вариабельной области тяжелой цепи из SEQ ID NO: 5; CDR2 вариабельной области тяжелой цепи из SEQ ID NO: 6; CDR3 вариабельной области тяжелой цепи из SEQ ID NO: 7; CDR1 вариабельной области легкой цепи из SEQ ID NO: 11; CDR2 вариабельной области легкой цепи из SEQ ID NO: 12; и CDR3 вариабельной области легкой цепи из SEQ ID NO: 13,
iv. антитела, содержащего вариабельную область тяжелой цепи, как перечислено в SEQ ID NO: 14, и вариабельную область легкой цепи, как перечислено в SEQ ID NO: 16,
v. антитела, содержащего тяжелую цепь, как перечислено в SEQ ID NO: 20, и легкую цепь как перечислено в SEQ ID NO: 18.
В другом варианте осуществления, антагонист IL-13 представляет собой человеческое антитело.
В конкретном варианте осуществления изобретения антагонист IL-13 представляет собой антитело, предотвращающее связывание IL-13 с IL-13 Rα1. В другом варианте осуществления антагонист IL-13 предотвращает связывание IL-13 с IL-13 Rα1, но позволяет связывание с IL1-13 Rα2, также известным как рецептор-ловушка.
В другом варианте осуществления, пациент страдает умеренной астмой, и в другом - тяжелой астмой.
Дополнительные способы, применения и наборы представлены в следующем описании и прилагаемой формуле изобретения. Дополнительные признаки, преимущества и аспекты по настоящему описанию будут очевидны специалистам в данной области из следующего описания и прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 изображен анализ замен для связывания антитела 01951/G12 с избранными остатками IL-13. На фигуре описана SEQ ID NO: 33.
На фигуре 2 изображен риск обострений астмы по классам генотипов для пациентов, подвергнутых лечению антителом 01951/G12.
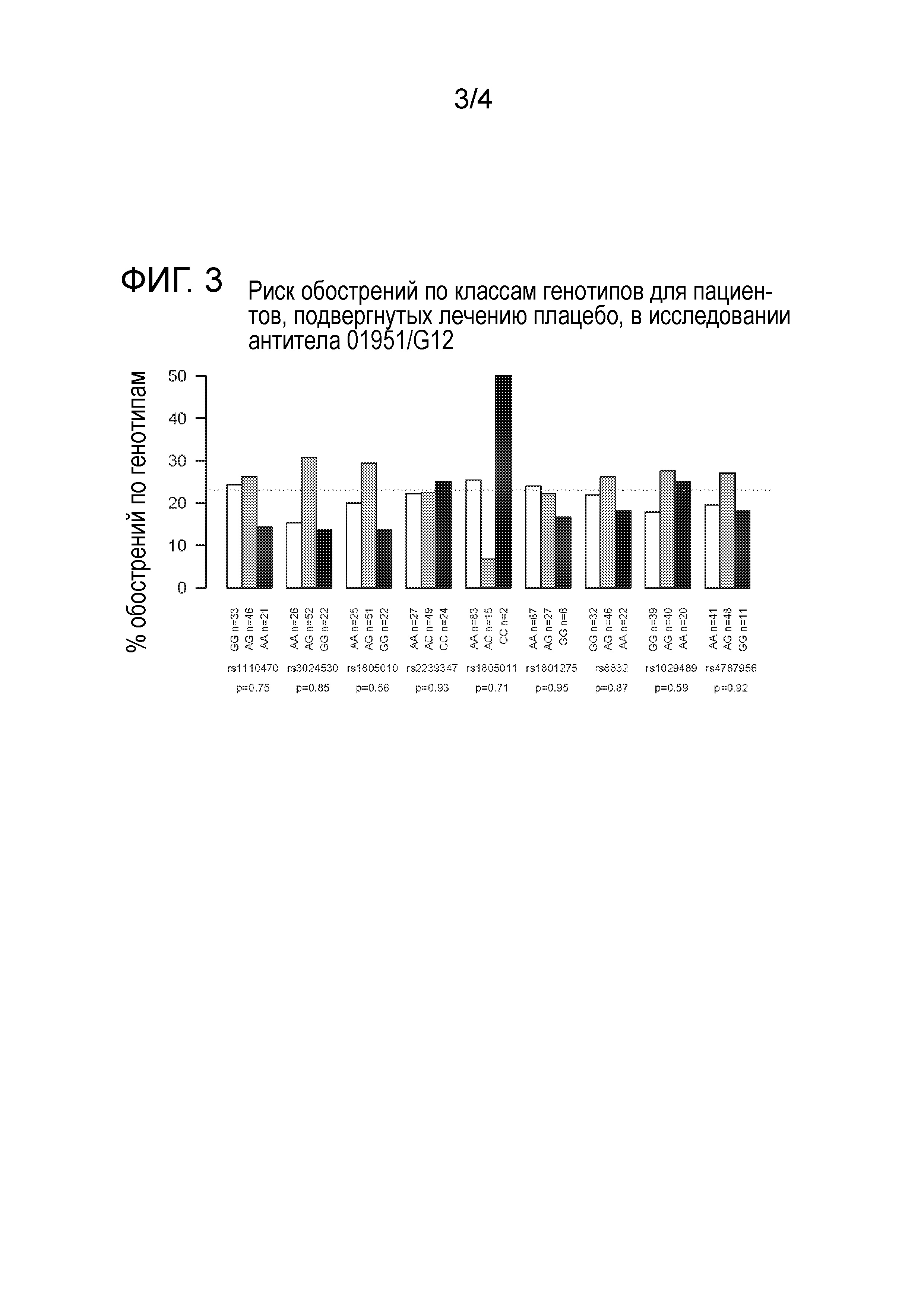
На фигуре 3 изображен риск обострений астмы по классам генотипов для пациентов, подвергнутых лечению плацебо, в исследовании антитела 01951/G12.
На фигуре 4 изображена идентификация двух блоков неравновесного сцепления среди SNP IL4-Rα.
ПОДРОБНОЕ ОПИСАНИЕ
Предусматривают, что тестирование субъектов на присутствие по меньшей мере одного из указанных выше отвечающих аллелей (маркеров AIR) можно использовать во множестве фармацевтических продуктов и способов, включающих в себя идентификацию пациентов с астмой, включая пациентов с астмой от тяжелой до умеренной, которые наиболее вероятно отвечают на антагонизм IL-13, и для помощи лечащим врачам в решении, предписывать ли антагонисты IL-13 (например, антитело 01951/G12) этим пациентам или предписывать альтернативное лекарственное средство.
Соответственно, в одном из аспектов изобретение относится к способам лечения пациента, страдающего астмой, посредством введения пациенту терапевтически эффективного количества антагониста IL-13, например, антитела против IL-13, такого как антитело 01951/G12, на основании конкретных аспектов профиля генотипирования пациента. В родственном аспекте, изобретение, кроме того, относится к способам идентификации пациента, страдающего астмой, который более вероятно может отвечать на лечение с помощью антагониста IL-13, например, антитела против IL-13, такого как антитело 01951/G12, на основании конкретных аспектов профиля генотипирования пациента. В дополнительном родственном аспекте, изобретение относится к способам определения вероятности того, что пациент, страдающий астмой, будет отвечать на лечение с помощью антагониста IL-13, например, антитела против IL-13, такого как антитела 01951/G12, на основании конкретных аспектов профиля генотипирования пациента. В другом родственном аспекте, изобретение относится к различным способам избирательного лечения пациента, страдающего астмой.
Способы по изобретению, описанные в настоящем документе, включают в себя применение по меньшей мере одного маркера AIR, выбранного из группы, состоящей из девяти указанных маркеров AIR, указанных в настоящем документе. Термин «по меньшей мере один маркер AIR» подразумевает, что один, два, три, четыре, 5, шесть, семь, восемь или девять маркеров AiR можно комбинировать и использовать в способах по изобретению. Более того, каждый маркер AIR - член таких комбинаций, может присутствовать в гетерозиготной или гомозиготной форме. В конкретных вариантах осуществления изобретения указаны конкретные комбинации девяти маркеров AIR (маркеров AIR-1-9) и, кроме того, указана желательная зиготность в отношении конкретного маркера AIR.
Термин «содержащий» охватывает «включающий в себя», а также «состоящий из», например, композиция, «содержащая» X, может состоять исключительно из X или может включать что-либо дополнительное, например X+Y.
Термин «приблизительно» в отношении численного значения x означает +/-10%, если контекст не требует иного.
Термин «анализ» используют для обозначения действия идентификации, скрининга, исследования с помощью зонда, тестирования, измерения или определения, где это действие можно проводить любыми общепринятыми способами. Например, образец можно анализировать на присутствие конкретного генетического или белкового маркера с использованием анализа ELISA, Нозерн-блоттинга, визуализации, серотипирования, клеточного типирования, секвенирования генов, фенотипирования, гаплотипирования, иммуногистохимии, Вестерн-блоттинга, масс-спектрометрии и т.д. Термин «детекция» (и подобные) обозначает действие извлечения конкретной информации из данного источника, которое может являться прямым или опосредованным. В некоторых вариантах осуществления прогностических способов, описанных в настоящем документе, присутствие данного предмета (например, аллеля, уровня белка и т.д.) детектируют в биологическом образце опосредованно, например, посредством запроса в базе данных. Термины «анализ» и «определение» подразумевают трансформацию вещества, например, трансформацию биологического образца, например, образца крови или образца другой ткани, от одного состояния до другого посредством подвергания этого образца физическому тестированию.
Термин «получение» означает приобретение, например, сбор для обладания любым способом, например, посредством физического вмешательства (например, биопсии, забора крови) или нефизического вмешательства (например, передачи информации через сервер) и т.д.
Фразу «анализ биологического образца...» и т.п., используют для обозначения того, что образец можно тестировать (либо напрямую, либо опосредованно) на присутствие данного маркера AIR. Следует понимать, что в ситуации, когда присутствие вещества означает одну вероятность, и отсутствие вещества означает другую вероятность, тогда либо присутствие, либо отсутствие такого вещества можно использовать для руководства в терапевтическом решении. Например, можно определять, обладает ли пациент маркером AIR посредством определения фактического существования конкретного отвечающего аллеля у пациента или посредством определения отсутствия конкретного отвечающего аллеля у пациента. В обоих таких случаях, определяют, присутствует ли у пациента маркер AIR. Описанные способы включают в себя, среди прочего, определение того, обладает ли конкретный индивидуум маркером AIR. Это определение осуществляют посредством идентификации того, обладает ли пациент одним или несколькими из маркеров AIR, описанных в таблице 1, указанной выше. Каждое из этих определений (т.е. присутствие или отсутствие), само по себе, предоставляет аллельный статус пациента и таким образом, каждое из этих определений эквивалентно предоставляют указание на то, будет ли или не будет конкретный индивидуум отвечать более благоприятным образом на антагонизм IL-13. Для предоставления показателя увеличенной способности отвечать для пациента с астмой, биологический образец необходимо только анализировать по одному или нескольким маркерам AIR, указанным в таблице 1.
«Антагонист IL-13», как применяют в настоящем документе, относится к молекуле, которая проявляет антагонизм (например, снижает, ингибирует, уменьшает, задерживает, прекращает) к функции, экспрессии и/или передаче сигнала IL-13 посредством блокирования связывания IL-13 с комплексом рецепторов IL-13. В конкретном варианте осуществления изобретения, антагонист IL-13 предотвращает связывание IL-13 с IL-13 Rα1. В другом, антагонист IL-13 предотвращает связывание с IL-13 Rα1, но позволяет связывание с IL1-13 Rα2 (также известным как рецептор-ловушка). См. Ingram and Kraft (2012) J Allergy Clin Immunol 130(4): 829-842.
Реакцию связывания можно показывать стандартными способами (качественными или количественными анализами), включая, например, анализ связывания, конкурентный анализ или биоанализ для определения ингибирования связывания IL-13 с его рецептором, или любой вид анализов связывания, по отношению к тесту отрицательного контроля, в котором используют антитело неродственной специфичности, но в идеале, такого же изотипа, например, антитело против CD25. Такие способы включают в себя способы, указанные ниже в примерах.
Термин «антитело», как обозначают в настоящем документе, включает в себя полноразмерные антитела и любые их антигенсвязывающие части или отдельные цепи. Природное «антитело» представляет собой гликопротеин, содержащий по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, связанные друг с другом дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначенной в настоящем документе как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначенной в настоящем документе как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL можно далее подразделять на области гипервариабельности, названные гипервариабельными областями или определяющими комплементарность областями (CDR), перемежающиеся областями, которые являются более консервативными, названными каркасными областями (FR). Каждая из VH и VL состоит из трех CDR и четырех FR, аранжированных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
Термин «антигенсвязывающая часть» антитела, как применяют в настоящем документе, относится к фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, IL-13). Показано, что антигенсвязывающую функцию антитела можно осуществлять посредством фрагментов полноразмерного антитела. Примеры связывающих фрагментов, охваченных термином «антигенсвязывающая часть» антитела, включают в себя фрагмент Fab, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; фрагмент F(ab)2, двухвалентный фрагмент, содержащий два фрагмента Fab, связанных посредством дисульфидного мостика в шарнирной области; фрагмент Fd, состоящий из доменов VH и CH1; фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела; фрагмент dAb (Ward et al., 1989 Nature 341:544-546), состоящий из домена VH; и выделенную CDR. Иллюстративные антигенсвязывающие участки включают в себя CDR, указанные в SEQ ID NO:1-6 и 11-13 (таблица 2), предпочтительно, CDR3 тяжелой цепи. Более того, хотя два домена фрагмента Fv, VL и VH, кодированы отдельными генами, их можно соединять, с использованием рекомбинантных способов, посредством синтетического линкера, позволяющего получать их в форме одной белковой цепи, в которой области VL и VH спарены с формированием одновалентной молекулы (известной как одноцепочечный Fv (scFv); см., например, Bird et al., 1988 Science 242:423-426; и Huston et al., 1988 Proc. Natl. Acad. Sci. 85:5879-5883). Такие одноцепочечные антитела также предназначены для включения в термин «антитело». Одноцепочечные антитела и антигенсвязывающие части получают с использованием общепринятых способов, известных специалистам в данной области.
«Выделенное антитело», как применяют в настоящем документе, относится к антителу, которое является в основном свободным от других антител, обладающих другой антигенной специфичностью (например, выделенное антитело, которое специфически связывается с IL-13, является в основном свободным от антител, специфически связывающих антигены, отличные от IL-13). Термин «моноклональные антитело» или «композиция моноклонального антитела», как применяют в настоящем документе, относятся к препарату молекул антитела одного молекулярного состава. Термин «человеческое антитело», как применяют в настоящем документе, предназначен, чтобы включать антитела, обладающие вариабельными областями, в которых как каркасные области, так и области CDR, получены из последовательностей человеческого происхождения. Нет необходимости, чтобы «человеческое антитело» было продуцировано человеком, тканями человека или клетками человека. Человеческие антитела по описанию могут включать аминокислотные остатки, не кодируемые человеческими последовательностями (например, мутации, введенные посредством случайного или сайт-специфического мутагенеза in vitro, посредством добавления N-нуклеотида на стыках in vivo в ходе рекомбинации генов антител, или посредством соматической мутации in vivo). В некоторых вариантах осуществления описанных способов, антагонист IL-13 представляет собой человеческое антитело, выделенное антитело, и/или моноклональное антитело.
Термин «KD» предназначен для обозначения скорости диссоциации для конкретного взаимодействия антитело-антиген. Термин «KD», как применяют в настоящем документе, предназначен для обозначения константы диссоциации, которую получают из соотношения Kd к Ka (т.е. Kd/Ka) и выражают как молярную концентрацию (M). Значения KD для антител можно определять с использованием способов, хорошо разработанных в данной области. Способ определения KD антитела представляет собой использование поверхностного плазмонного резонанса или использование биосенсорной системы, такой как система Biacore®.
Термин «аффинность» относится к силе взаимодействия между антителом и антигеном в отдельных антигенных участках. Внутри каждого антигенного участка, вариабельная область плеча антитела взаимодействует посредством слабых нековалентных сил с антигеном в нескольких участках; чем больше взаимодействий, тем сильнее аффинность. Стандартные анализы для оценки аффинности связывания антител с IL-13 из различных видов известны в данной области, включая, например, виды ELISA, Вестерн-блоттинга и RIA. Кинетику связывания (например, аффинность связывания) антител также можно оценивать посредством стандартных анализов, известных в данной области, таких как анализ Biacore.
Антитело, которое «ингибирует» одно или несколько из этих функциональных свойств IL-13 (например, биохимические, иммунохимические, клеточные, физиологические или другие виды биологической активности, или т.п.), как определено в соответствии со способами, известными в данной области и описанными в настоящем документе, следует понимать как относящееся к статистически значимому уменьшению конкретной активности п сравнению с тем, что наблюдают в отсутствие антитела (или когда присутствует контрольное антитело не относящейся к делу специфичности). Антитело, которое ингибирует активность IL-13, вызывает статистически значимое уменьшение, например, по меньшей мере приблизительно на 10%, измеряемого параметра, по меньшей мере на 50%, 80% или 90%, и в конкретных вариантах осуществления описанных способов, используемое антитело против IL-13 может ингибировать функциональную активность IL-13 более чем на 95%, 98% или 99%.
Термин «производное», если не указано иначе, используют для определения вариантов аминокислотной последовательности и ковалентных модификаций (например, пегилирования, дезамидирования, гидроксилирования, фосфорилирования, метилирования и т.д.) антагониста IL-13 (например, антитела против IL-13 или его антигенсвязывающей части), например, указанной последовательности (например, вариабельного домена). «Функциональное производное» включает в себя молекулу, обладающую качественно общей биологической активностью с описанными антагонистами IL-13. Функциональное производное включает в себя фрагменты и пептидные аналоги антагониста IL-13, как описано в настоящем документе. Фрагменты содержат области внутри последовательности полипептида по настоящему описанию, например, указанной последовательности. Функциональные производные антагонистов IL-13, описанных в настоящем документе, предпочтительно содержат домены VH и/или VL, обладающие по меньшей мере приблизительно 65%, 75%, 85%, 95%, 96%, 97%, 98%, или даже 99% общей идентичности последовательности с последовательностями VH и/или VL связывающих IL-13 молекул, описанных в настоящем документе (например, последовательностями VH и/или VL из таблицы 2), и по существу сохраняют способность связывать IL-13.
Фраза «по существу идентичный» означает, что соответствующая аминокислотная или нуклеотидная последовательность (например, домен VH или VL) являются идентичными или обладают незначительными различиями (например, из-за консервативных аминокислотных замен) по сравнению с конкретной контрольной последовательностью. Незначительные различия включают в себя незначительные изменения аминокислот, такие как 1 или 2 замены (например, консервативные замены, такие как замена серина на треонин, или замены в положениях, не вовлеченных в активность антитела, структурную целостность, фиксацию комплемента и т.д.) в последовательности из 5 аминокислот указанной области (например, VH или VL). В случае антител, второе антитело обладает такой же специфичностью и обладает по меньшей мере 50% аффинностью. Последовательности, по существу идентичные (например, по меньшей мере приблизительно с 85% идентичностью последовательности) последовательностям, описанным в настоящем документе, также являются частью этого описания. В некоторых вариантах осуществления, идентичность последовательности производного антитела против IL-13 может составлять приблизительно 90% или более, например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше по сравнению с описанными последовательностями.
«Идентичность» в отношении природного полипептида и его функционального производного определяют в настоящем документе как процент аминокислотных остатков в последовательности-кандидате, которые являются идентичными остаткам соответствующего природного полипептида, после выравнивания последовательности и внесения пропусков, если необходимо, для достижения максимального процента идентичности, и не рассматривая никаких консервативных замен как части идентичности последовательности. Ни продления с N- или C-конца, ни вставки, не следует рассматривать как уменьшающие идентичность. Способы и компьютерные программы для выравнивания хорошо известны. Процент идентичности можно определять посредством стандартных алгоритмов выравнивания, например, базового инструментария поиска локальных блоков (BLAST), описанного в Altshul et al. ((1990) J. Mol. Biol., 215: 403 410); алгоритма Needleman et al. ((1970) J. Mol. Biol., 48: 444 453); или алгоритма Meyers et al. ((1988) Comput. Appl. Biosci., 4: 11 17). Набор параметров может представлять собой оценочную матрицу Blosum 62 со штрафом за пропуск 12, штрафом за расширение пропуска 4, и штрафом за пропуск со сдвигом рамки считывания 5. Процент идентичности между двумя аминокислотными или нуклеотидными последовательностями можно также определять с использованием алгоритма E. Meyers and W. Miller ((1989) CABIOS, 4:11-17), который включен в программу ALIGN (версии 2.0), с использованием таблицы веса остатков PAM120, штрафа за длину пропуска 12 и штрафа за пропуск 4.
«Аминокислота(аминокислоты)» относятся, например, ко всем природным L-α-аминокислотам, и включают в себя D-аминокислоты. Фраза «вариант аминокислотной последовательности» относится к молекулам с некоторыми различиями в их аминокислотных последовательностях по сравнению с последовательностями по настоящему описанию. Варианты аминокислотной последовательности полипептида антагониста IL-13 по настоящему описанию, например, указанной последовательности, все еще обладают способностью связывать IL-13. Варианты аминокислотной последовательности включают в себя варианты с заменами (варианты, обладающие по меньшей мере одним удаленным аминокислотным остатком и другой аминокислотой, вставленной на его место в том же самом положении в полипептиде по настоящему описанию), варианты с вставками (варианты с одной или несколькими аминокислотами, вставленными непосредственно рядом с аминокислотой в конкретном положении в полипептиде по настоящему описанию) и варианты с делециями (варианты с одной или несколькими аминокислотами, удаленными из полипептида по настоящему описанию).
Термин «фармацевтически приемлемый» обозначает нетоксичный материал, который не создает помех для эффективности биологической активности активного ингредиента(ингредиентов).
Термин «введение» по отношению к соединению, например, к связывающей IL-13 молекуле или другому средству, используют для обозначения доставки этого соединения пациенту любым способом.
Как применяют в настоящем документе, «терапевтически эффективное количество» относится к количеству антагониста IL-13, (например, антитела против IL-13 или его антигенсвязывающей части), которое является эффективным, при введении однократной или множественной дозы пациенту (такому как человек), для лечения, предотвращения, предотвращения начала, лечения, задержки, уменьшения тяжести, облегчения по меньшей мере одного симптома нарушения или рецидива нарушения, или для продления выживаемости пациента дольше, чем ожидают в отсутствие такого лечения. При применении к индивидуальному активному ингредиенту (например, антагонисту IL-13) введенному отдельно, термин относится к этому ингредиенту отдельно. При применении в комбинации, термин относится к объединенному количеству активных ингредиентов, приводящему к терапевтическому эффекту, вне зависимости от того, вводят ли их в комбинации, последовательно или одновременно.
Термины «лечение» или «лечить» относятся к профилактическому или превентивному лечению (соответственно), а также к радикальному лечению или к лечению, модифицирующему течение заболевания, включая лечение пациента, подверженного риску приобретения заболевания или предположительно приобретшего заболевание, а также пациентов, страдающих или диагностированных как страдающие заболеванием или медицинским состоянием, и включают в себя супрессию клинического рецидива или обострения. Лечению можно подвергать пациента, имеющего медицинское нарушение, или пациента, который в конечном итоге может приобрести нарушение, для предотвращения, излечения, задержки начала, уменьшения тяжести или облегчения одного или нескольких симптомов нарушения или рецидива нарушения, или для продления выживаемости пациента дольше, чем ожидают в отсутствие такого лечения.
Фразу «отвечают на лечение» используют для обозначения того, что для пациента, после подвергания конкретному лечению, например, с помощью антагониста IL-13, показано клинически значимое преимущество от указанного лечения. В случае астмы, включая астму от тяжелой до умеренной, такие критерии включают в себя уменьшение обострений. Фразу «отвечает на лечение» понимают как подразумевающую сравнительный, а не абсолютный ответ. Например, прогнозируют, что пациент с астмой, обладающий маркером AIR, будет получать больше преимуществ от лечения с помощью антагониста IL-13, чем пациент, не обладающий маркером AIR. Эти носители маркеров AIR отвечают более благоприятным образом на лечение с помощью антагониста IL-13, и «отвечают на лечение» с помощью антагониста IL-13. В конкретных вариантах осуществления изобретения, пациент, который отвечает на лечение с помощью антагониста IL-13 в соответствии со способами, описанными в настоящем документе, обладает поддающемуся определению уменьшению обострений астмы в течение по меньшей мере 24 недель, по меньшей мере 24-52 недель, по меньшей мере 52 недель, или дольше. В конкретных вариантах осуществления изобретения, уменьшение обострений составляет по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, или 100% у пациента, отвечающего на лечение с помощью антагониста IL-13 в соответствии со способами, описанными в настоящем документе.
Фразу «получение данных» используют для обозначения получения обладания информацией любыми доступными способами, например, в устной форме, в электронной форме (например, посредством электронной почты, закодированной на дискете или другом носителе), записанной и т.д.
Как применяют в настоящем документе, «отбор» и «отобранный» по отношению к пациенту используют для обозначения того, что конкретный пациент специфическим образом выбран из большей группы пациентов на основании того (из-за того), что конкретный пациент удовлетворяет предопределенным критериям, например, пациент обладает маркером AIR. Подобным образом, «избирательное лечение» относится к предоставлению лечения пациенту, обладающему конкретным заболеванием, где пациент специфическим образом выбран из большей группы пациентов на основании того, что конкретный пациент удовлетворяет предопределенным критериям, например, пациент с астмой специфическим образом выбран для лечения из-за того, что пациент обладает маркером AIR. Подобным образом, «избирательное введение» относится к введению лекарственного средства пациенту, который специфическим образом выбран из большей группы пациентов на основании того (из-за того), что конкретный пациент удовлетворяет предопределенным критериям, например, обладает конкретным генетическим или другим биологическим маркером. Под отбором, избирательным лечением и избирательным введением, понимают, что пациента подвергают персонифицированной терапии на основании конкретных биологических признаков пациента, а не подвергают стандартной схеме лечения единственно на основании того, что пациент страдает конкретным заболеванием. Отбор, по отношению к способу лечения, как применяют в настоящем документе, не относится к случайному лечению пациента, обладающего маркером AIR, но вместо этого относится к осмысленному выбору введения антагониста IL-13 пациенту на основании того, что пациент обладает маркером AIR. Таким образом, избирательное лечение отличается от стандартного лечения, с помощью которого доставляют конкретное лекарственное средство всем пациентам, вне зависимости от их аллельного статуса.
Как применяют в настоящем документе, «прогнозирование» обозначает, что способы, описанные в настоящем документе, обеспечивают информацию, чтобы обеспечить возможность поставщику услуг в сфере здравоохранения определения вероятности того, что индивидуум, страдающий астмой, будет отвечать или будет отвечать более благоприятным образом на лечение с помощью антагониста IL-13. Оно не относится к возможности прогнозирования ответа со 100% точностью. Вместо этого, специалисту в данной области понятно, что оно относится к увеличенной вероятности.
Как применяют в настоящем документе, «правдоподобие» и «правдоподобно» представляет собой меру того, насколько вероятно то, что событие произойдет. Его можно использовать взаимозаменяемо с «вероятностью». Правдоподобие относится к вероятности, которая составляет более чем предположение, но менее, чем уверенность. Таким образом, событие является правдоподобным, если здравомыслящий человек с использованием здравого смысла, обучения или опыта заключает, что, с учетом условий, событие является вероятным. В некоторых вариантах осуществления, убедившись в правдоподобии, пациента можно лечить (или продолжать лечение, или продолжать лечение с увеличением дозы) с помощью антагониста IL-13, или пациента можно не лечить (или прекращать лечение, или продолжать лечение с понижением дозы) с помощью антагониста IL-13.
Фраза «увеличенная вероятность» относится к увеличению вероятности того, что событие произойдет. Например, некоторые способы в настоящем документе позволяют прогнозирование того, будет ли пациент обладать увеличенной вероятностью ответа на лечение с помощью антагониста IL-13 или увеличенной вероятностью лучшего ответа на лечение с помощью антагониста IL-13 по сравнению с пациентом, страдающим астмой, не обладающим AIR.
Как применяют в настоящем документе «SNP» относится к «однонуклеотидному полиморфизму». Однонуклеотидный полиморфизм представляет собой вариант последовательности ДНК, возникающий, когда один нуклеотид в геноме (или другой общей последовательности) различается между членами биологического вида или парными хромосомами индивидуума. Большинство SNP обладают только двумя аллелями, и один, как правило, является более распространенным в популяции. SNP может присутствовать в экзоне или интроне гена, в верхней или нижней нетранслируемой области гена, или в чисто геномном положении (т.е. не транскрибируемом). Когда SNP встречается в кодирующей области гена, SNP может представляет собой молчащий (т.е. синонимический полиморфизм) из-за вырожденности генетического кода, или SNP может приводить к изменению последовательности кодируемого полипептида (т.е. несинонимический полиморфизм). По настоящему описанию, SNP идентифицируют по их номеру rs в базе данных однонуклеотидного полиморфизма (dbSNP), например, rs1805010. dbSNP представляет собой бесплатный публичный архив генетической изменчивости внутри различных видов и между различными видами, разработанный и поддерживаемый Национальным центром биотехнологической информации (NCBI) в сотрудничестве с Национальным научно-исследовательским институтом генома человека США (NHGRI).
Полиморфному участку, такому как SNP, как правило, предшествуют и следуют за ним консервативные последовательности в геномах представляющих интерес популяций, и таким образом, локализацию полиморфного участка часто можно осуществлять по отношению к консенсусной последовательности нуклеиновой кислоты (например, от тридцати до шестидесяти нуклеотидов), обрамляющей полиморфный участок, который в случае SNP обычно обозначают как «контекстную последовательность SNP». Контекстные последовательности для SNP, описанных в настоящем документе, можно найти в базе данных SNP NCBI, доступной на: www.ncbi.nlm.nih.gov/snp. Альтернативно, локализацию полиморфного участка можно идентифицировать по его локализации в контрольной последовательности (например, в депозите GeneBank) относительно старта гена, транскрипта мРНК, клона BAC или даже относительно инициирующего кодона (ATG) для трансляции белка. Специалисту в данной области понятно, что локализация конкретного полиморфного участка может не встречаться в точно таком же положении в эталонной или контекстной последовательности у каждого индивидуума в представляющей интерес популяции из-за присутствия одной или нескольких вставок или делеций в геноме этого индивидуума по сравнению с консенсусной или контрольной последовательности. Для специалистов в данной области является обычной разработка надежных, специфических и точных анализов для детекции альтернативных аллелей в полиморфном участке любого данного индивидуума, когда специалисту в данной области предоставлена идентификация альтернативных аллелей полиморфного участка, подлежащих детекции, и одна или обе из контрольной последовательности или контекстной последовательности, в которой встречается полиморфный участок. Таким образом, специалисту в данной области понятно, что указание локализации любого полиморфного участка, описанного в настоящем документе по отношению к конкретному положению в эталонной или контекстной последовательности (или в отношении инициаторного кодона в такой последовательности), присутствует просто для удобства, и что любое конкретно пронумерованное положение нуклеотида буквально включает любое положение нуклеотида, в котором тот же полиморфный участок фактически локализован в том же локусе у любого индивидуума, тестируемого по гентическому маркеру по изобретению с использованием любого из способов генотипирования, описанных в настоящем документе, или других способов генотипирования, известны в данной области.
В дополнение к SNP, генетические полиморфизмы включают в себя транслокации, вставки, замены, делеции и т.д., которые встречаются в энхансерах, экзонах, интронах, промоторах, 5ʹ-UTR, 3ʹ-UTR генов и т.д.
Как применяют в настоящем документе, «rs1110470» относится к SNP C/T (по обратной цепи), локализованному в интроне гена IL-4RA человека (IL-4Rα; рецептор IL-4 альфа) (No. доступа в GeneBank NM_000418.3). Полиморфный участок rs1110470 локализован в положении на хромосоме 27336427 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27276427 в контиге NT_010393,16.
Как применяют в настоящем документе, «rs3024530» относится к SNP A/G (по прямой цепи), локализованному в интроне гена IL-4RA (No. доступа в GeneBank NM_000418.3). Полиморфный участок rs3024530 локализован в положении на хромосоме 27350687 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27290687 в контиге NT_010393.16.
Как применяют в настоящем документе, «rs1805010» относится к SNP A/G (по прямой цепи), локализованному в экзоне гена IL-4RA gene (No. доступа в GeneBank NM_000418.3), и кодирующему замену Ile на Val. Полиморфный участок rs1805010 локализован в положении на хромосоме 27356203 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27296203 в контиге NT_010393.16.
Как применяют в настоящем документе «rs2239347» относится к SNP G/T (по обратной цепи), локализованному в интроне гена IL-4RA (No. доступа в GeneBank NM_000418.3). Полиморфный участок rs2239347 локализован в положении на хромосоме 27359021 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27299021 в контиге NT_010393.16.
Как применяют в настоящем документе «rs1805011» относится к SNP A/C (по прямой цепи), локализованному в экзоне гена IL-4RA gene (No. доступа в GeneBank NM_000418.3) и кодирующему замену Glu на Ala. Полиморфный участок rs1805011 локализован в положении на хромосоме 27373872 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27313872 в контиге NT_010393.16.
Как применяют в настоящем документе «rs1801275» относится к SNP A/G (по прямой цепи), локализованному в экзоне гена IL-4RA (No. доступа в GeneBank NM_000418ю3) и кодирующему замену Gln на Arg. Полиморфный участок rs1801275 локализован в положении на хромосоме 27374400 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27314400 в контиге NT_010393.16.
Как применяют в настоящем документе «rs8832» относится к SNP A/G (по прямой цепи), локализованному в 3ʹ-UTR (нетранслируемой) области гена IL-4RA (No. доступа в GeneBank NM_000418.3). Полиморфный участок rs8832 локализован в положении на хромосоме 27375787 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27315787 в контиге NT_010393.16.
Как применяют в настоящем документе «rs1029489» относится к SNP C/T (по обратной цепи), локализованному на 3ʹ вблизи гена IL-4RA (No. доступа в GeneBank NM_000418,3). Полиморфный участок rs1029489 локализован в положении на хромосоме 27376217 (построение 138; сборка GRCh37.p10), которое представляет собой положение 27316217 в контиге NT_010393.16.
Как применяют в настоящем документе «rs4787956» относится к SNP A/G (по прямой цепи), локализованному на 3ʹ вблизи гена IL-4RA (No. доступа в GeneBank NM_000418,3). Полиморфный участок rs4787956 локализован в положении на хромосоме 27378249 (построение 138; сборка GRCh37.p10), которое представляет собой положение27318249 в контиге NT_010393,16.
Как понятно специалисту в данной области, образцы нуклеиновой кислоты, содержащей конкретный SNP, могут представлять собой комплементарные двухцепочечные молекулы и таким образом, ссылка на конкретный участок на смысловой цепи относится также к соответствующему участку на комплементарной антисмысловой цепи. Подобным образом, ссылка на конкретный генотип, полученный для SNP на обеих копиях одной цепи хромосомы является эквивалентной комплементарному генотипу, полученному для того же SNP на обеих копиях другой цепи.
Как применяют в настоящем документе, «геномная последовательность» относится к последовательности ДНК, присутствующей в геноме, и включает в себя область внутри аллеля, собственно аллель или более длинную последовательность ДНК на хромосоме, содержащей представляющий интерес аллель.
Продукты маркеров AIR по изобретению могут включать в себя продукты нуклеиновой кислоты и полипептидные продукты. «Полипептидный продукт» относится к полипептиду, включающему аминокислоту, кодируемую маркером AIR, и его фрагментам. «Продукт нуклеиновой кислоты» относится к любым продуктам маркеров AIR - ДНК (например, геномной, кДНК и т.д.) или РНК (например, пре-мРНК, мРНК, мкРНК и т.д.) и их фрагментам.
«Эквивалентный генетический маркер» относится к генетическому маркеру, который коррелирует с представляющим интерес аллелем, например, для него показано неравновесное сцепление (LD) или он находится в генетическом сцеплении с представляющим интерес аллелем. Эквивалентные генетические маркеры можно использовать для определения того, обладает ли пациент маркером AIR, вместо того, чтобы напрямую исследовать в биологическом образце от пациента аллель как таковой. Существуют различные программы для помощи в определении LD для конкретных SNP, например, HaploBlock (доступная на bioinfo.cs.technion.ac.il/haploblock/), HaпМap, WGA Viewer.
Термин «зонд» относится к любой смеси химически связанных веществ, которую можно использовать для специфической детекции другого вещества, например, вещества, относящегося к маркеру AIR. Зонд может представлять собой олигонуклеотид (включая коонъюгированный олигонуклеотид), который специфически гибридизуется с геномной последовательностью маркера AIR, или продуктом нуклеиновой кислоты маркера AIR. Коонъюгированный олигонуклеотид относится к олигонуклеотиду, ковалентно связанному с хромофором или молекулами, содержащими лиганд (например, антиген), который является высоко специфическим для молекулы рецептора (например, антитело, специфическое для антигена). Зонд также может представлять собой праймер для ПЦР, например, вместе с другим праймером, для амплификации конкретной области внутри маркера AIR. Кроме того, зонд может представлять собой антитело, которое специфически связывается с полипептидными продуктами этих аллелей. Кроме того, зонд может представлять собой любую смесь химически связанных веществ, способную детектировать (например, связываться или гибридизоваться) эквивалентный генетический маркер для маркера AIR. В предпочтительных вариантах осуществления, зонд специфически гибридизуется с последовательностью нуклеиновой кислоты (предпочтительно геномной ДНК) или специфически связывается с полипептидной последовательностью представляющего интерес аллеля.
Фразу «специфически гибридизуется» используют для обозначения гибридизации в строгих условиях гибридизации. Строгие условия известны специалистам в данной области, и их можно найти в Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6. Можно использовать водные и неводные способы, описанные в этой и других ссылках. Одним из примеров строгих условий гибридизации является гибридизация в 6X хлориде натрия/цитрате натрия (SSC) при приблизительно 45°C, с последующей по меньшей мере одной отмывкой в 0,2X SSC, 0,1% SDS при 50°C. Вторым примером строгих условий гибридизации является гибридизация в 6X SSC при приблизительно 45°C, с последующей по меньшей мере одной отмывкой в 0,2X SSC, 0,1% SDS при 55°C. Другим примером строгих условий гибридизации является гибридизация в 6X SSC при приблизительно 45°C, с последующей по меньшей мере одной отмывкой в 0,2X SSC, 0,1% SDS при 60°C. Дополнительным примером строгих условий гибридизации является гибридизация в 6X SSC при приблизительно 45°C, с последующей по меньшей мере одной отмывкой в 0,2X SSC, 0,1% SDS при 65°C. Условия высокой строгости включают в себя гибридизацию в 0,5 M фосфате натрия, 7% SDS при 65°C, с последующей по меньшей мере одной отмывкой в 0,2X SSC, 1% SDS при 65°C.
Фразу «область нуклеиновой кислоты» используют для обозначения меньшей последовательности внутри большей последовательности нуклеиновой кислоты. Например, ген является областью хромосомы, экзон является областью гена и т.д.
Термин «специфически связывается» в контексте полипептидов используют для обозначения того, что зонд связывается с данным полипептидом-мишенью (например, полипептидным продуктом маркера AIR) вместо того, чтобы случайным образом связывать нежелательные полипептиды. Однако, «специфически связывается» не исключает некоторой перекрестной реакционной способности по отношению к нежелательным полипептидам, при условии, что эта перекрестная реакционная способность не создает помех для способности зонда обеспечивать применимое измерение присутствия данного полипептида-мишени.
Термин «способный» используют для обозначения возможности достигать данного результата, например, зонд, способный детектировать присутствие конкретного вещества, означает, что зонд можно использовать для детекции конкретного вещества.
«Олигонуклеотид» относится к короткой последовательности нуклеотидов, например, 2-100 оснований.
Термин «биологический образец», как применяют в настоящем документе, относится к образцу от пациента, который можно использовать для целей идентификации, диагностики, прогнозирования или мониторирования. Предпочтительные образцы представляют собой синовиальную жидкость, кровь, получаемый из крови препарат (такой как лейкоцитарный слой, сыворотка и плазма), лимфу, мочу, слезы, слюну, клетки волосяной луковицы, спинномозговую жидкость, буккальные мазки, кал, синовиальную жидкость, синовиальные клетки, мокроту или образцы ткани (например, образцы хряща). Кроме того, специалисту в данной области понятно, что некоторые образцы можно более легко анализировать после процедуры фракционирования или очистки, например, выделения ДНК из цельной крови.
Термин «IL-13» включает в себя IL-13 дикого типа из различных видов (например, человека, мыши и обезьяны), полиморфные варианты IL-13 и функциональные эквиваленты IL-13. Функциональные эквиваленты IL-13 по настоящему описанию предпочтительно обладают по меньшей мере приблизительно 85%, 95%, 96%, 97%, 98% или даже 99% общей идентичностью последовательности с IL-13 дикого типа (например, IL-13 человека). Более конкретно, IL-13 относится к полипептидной последовательности, указанной в следующем абзаце.
Полипептид IL-13 обладает указанной ниже последовательностью. 34 N-концевых аминокислотных остатка (курсивом) составляет сигнальный пептид. Зрелый цитокин, таким образом, обладает 112 аминокислотными остатками. Антитела против IL-13 связываются с эпитопом на зрелом полипептиде.
Аминокислотная последовательность интерлейкина 13:
1 MHPLLNPLLL ALGLMALLLT TVIALTCLGG FASPGPVPPS TALRELIEEL VNITQNQKAP
61 LCNGSMVWSI NLTAGMYCAA LESLINVSGC SAIEKTQRML SGFCPHKVSA GQFSSLHVRD
121 TKIEVAQFVK DLLLHLKKLF REGRFN (SEQ ID No. 1)
Как также далее подробно указано в примерах, в конкретных вариантах осуществления способов по изобретению, антагонист IL-13, используемый в способах, включая антитело 01951/G12, связывает эпитоп, включающий остатки: FCPHKV (SEQ ID NO: 67) (подчеркнутые как остатки 103-107 из SEQ ID NO.1).
Антагонисты IL-13
В принципе, любые антагонисты против IL-13, включая антитела, которые ингибируют или нейтрализуют активность IL-13, можно использовать по изобретению, при условии, что антагонист или антитело против IL-13 до поддающейся определению степени и избирательно уменьшает обострения у пациента с астмой, который является положительным по меньшей мере по одному маркеру AIR, выбранному из указанной группы, состоящей из маркеров AIR-1, 2, 3, 4, 5, 6, 7, 8 и 9, как указано в способах по изобретению. Такие антитела можно выбирать среди антител, известных в данной области, см., например, в WO2005/007699, US6468528, WO03007685, WO03034984, US20030143199, US2004028650, US20040242841, US2004023337, US20040248260, US20050054055, US20050065327, WO2006/124451, WO2006/003407, WO2005/062967, WO2006/085938, WO2006/055638, WO2007/036745, WO2007/080174 или WO2007/085815 Такие антитела известны в данной области, см., например, в WO2005/007699, US6468528, WO03007685, WO03034984, US20030143199, US2004028650, US20040242841, US2004023337, US20040248260, US20050054055, US20050065327, WO2006/124451, WO2006/003407, WO2005/062967, WO2006/085938, WO2006/055638, WO2007/036745, WO2007/080174 или WO2007/085815, WO2012/049278, и WO2008/106116.
В одном варианте осуществления, антитела, используемые в способах по изобретению, содержат одну или несколько из следующих CDR. CDR, перечисленные в таблице 2a и 3a, определяли в соответствии с определением Kabat (E. Kabat et al, 1991, Sequences of Proteins of immunological Interest, 5th edition, public health Service, HIH, Bethesda, MD:
Таблица 2
|
Таблица 2a
|
Таблица 3
|
Таблица 3a
|
Константные области легкой и тяжелой цепи полноразмерного антитела IgG1 также показаны ниже, включая, в качестве примера, вариабельные области антитела 01951/G12 (выделены жирным шрифтом).
Последовательность антитела 01951/G12
(i) вариабельная область HC
Вариабельная аминокислотная последовательность HC 01951/G12 показана в SEQ ID NO: 14 и кодирована нуклеотидной последовательностью, показанной в SEQ ID NO: 15
E V Q L V E S G G G V V Q P G R S L R L
gaagtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactc 60
S C A A S G F T F S S Y G M H W V R Q A
tcctgtgcagcgtctggattcaccttcagtagctatggcatgcactgggtccgccaggct 120
P G K G L E W V A I I W Y D G S N K Y Y
ccaggcaaggggctggagtgggtggcaattatatggtatgatggaagtaataaatactat 180
A D S V K G R F T I S R D N S K N T L Y
gcggactccgtgaagggccgattcaccatctccagagacaattccaagaacacgctgtat 240
L Q M N S L R A E D T A V Y Y C A R L W
ctgcaaatgaacagcctgagagccgaggacacggctgtgtattactgtgcgaggctatgg 300
F G D L D A F D I W G Q G T M V T (SEQ ID NO: 14)
ttcggggacttagatgcttttgatatctggggccaagggacaatggtcacc 351 (SEQ ID NO: 15)
(ii) вариабельная область LC
Вариабельная аминокислотная последовательность LC для 01951/G12 показана в SEQ ID NO: 16 и кодирована нуклеотидной последовательностью, показанной в SEQ ID NO: 17
E I V L T Q S P A T L S L S P G E R A I
gaaattgtgttgacgcagtctccagccaccctgtctttgtctccaggggaaagagccatc 60
L S C R A G Q S V S S Y L V W Y Q Q K P
ctctcctgcagggccggtcagagtgttagcagttacttagtctggtaccaacagaaacct 120
G Q A P R L L I Y D A S N R A T G I P A
ggccaggctcccaggctcctcatctatgatgcatccaacagggccactggcatcccagcc 180
R F S G S G S G T D F T L T I S S L E P
aggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagcctagagcct 240
E D F A V Y Y C Q Q R S S W P P V Y T F
gaagattttgcagtttattactgtcagcagcgcagcagctggcctccggtgtacactttt 300
G Q G T (SEQ ID NO:16)
ggccaggggacc 312 (SEQ ID NO:17)
Последовательность легкой цепи полноразмерного антитела IgG1, включая вариабельную область антитела 01951/G12 (выделена жирным шрифтом)
Аминокислотная последовательность LC показана в SEQ ID NO: 18 и кодирована нуклеотидной последовательностью из SEQ ID NO: 19
M S V L T Q V L A L L L L W L T G
1 ATGAGTGTGC TCACTCAGGT CCTGGCGTTG CTGCTGCTGT GGCTTACAGG
T R C E I V L T Q S P A T L S L S
51 TACGCGTTGT GAAATTGTGT TGACGCAGTC TCCAGCCACC CTGTCTTTGT
P G E R A I L S C R A G Q S V S
101 CTCCAGGGGA AAGAGCCATC CTCTCCTGCA GGGCCGGTCA GAGTGTTAGC
S Y L V W Y Q Q K P G Q A P R L L
151 AGTTACTTAG TCTGGTACCA ACAGAAACCT GGCCAGGCTC CCAGGCTCCT
I Y D A S N R A T G I P A R F S G
201 CATCTATGAT GCATCCAACA GGGCCACTGG CATCCCAGCC AGGTTCAGTG
S G S G T D F T L T I S S L E P
251 GCAGTGGGTC TGGGACAGAC TTCACTCTCA CCATCAGCAG CCTAGAGCCT
E D F A V Y Y C Q Q R S S W P P V
301 GAAGATTTTG CAGTTTATTA CTGTCAGCAG CGCAGCAGCT GGCCTCCGGT
Y T F G Q G T K L E I K R T V A A
351 GTACACTTTT GGCCAGGGGA CCAAGCTTGA AATCAAACGA ACTGTGGCTG
P S V F I F P P S D E Q L K S G
401 CACCATCTGT CTTCATCTTC CCGCCATCTG ATGAGCAGTT GAAATCTGGA
T A S V V C L L N N F Y P R E A K
451 ACTGCCTCTG TTGTGTGCCT GCTGAATAAC TTCTATCCCA GAGAGGCCAA
V Q W K V D N A L Q S G N S Q E S
501 AGTACAGTGG AAGGTGGATA ACGCCCTCCA ATCGGGTAAC TCCCAGGAGA
V T E Q D S K D S T Y S L S S T
551 GTGTCACAGA GCAGGACAGC AAGGACAGCA CCTACAGCCT CAGCAGCACC
L T L S K A D Y E K H K V Y A C E
601 CTGACGCTGA GCAAAGCAGA CTACGAGAAA CACAAAGTCT ACGCCTGCGA
V T H Q G L S S P V T K S F N R G
651 AGTCACCCAT CAGGGCCTGA GCTCGCCCGT CACAAAGAGC TTCAACAGGG
E C * (SEQ ID NO:18)
701 GAGAGTGTTA G (SEQ ID NO:19)
Последовательность тяжелой цепи полноразмерного антитела IgG1, включая вариабельную область антитела 01951/G12 (выделена жирным шрифтом)
Аминокислотная последовательность HC показана в SEQ ID NO: 20 и кодирована нуклеотидной последовательностью из SEQ ID NO: 21
M A W V W T L P F L M A A A Q S V
1 ATGGCTTGGG TGTGGACCTT GCCATTCCTG ATGGCAGCTG CCCAAAGTGT
Q A E V Q L V E S G G G V V Q P G
51 CCAGGCAGAA GTGCAGCTGG TGGAGTCTGG GGGAGGCGTG GTCCAGCCTG
R S L R L S C A A S G F T F S S
101 GGAGGTCCCT GAGACTCTCC TGTGCAGCGT CTGGATTCAC CTTCAGTAGC
Y G M H W V R Q A P G K G L E W V
151 TATGGCATGC ACTGGGTCCG CCAGGCTCCA GGCAAGGGGC TGGAGTGGGT
A I I W Y D G S N K Y Y A D S V K
201 GGCAATTATA TGGTATGATG GAAGTAATAA ATACTATGCG GACTCCGTGA
G R F T I S R D N S K N T L Y L
251 AGGGCCGATT CACCATCTCC AGAGACAATT CCAAGAACAC GCTGTATCTG
Q M N S L R A E D T A V Y Y C A R
301 CAAATGAACA GCCTGAGAGC CGAGGACACG GCTGTGTATT ACTGTGCGAG
L W F G D L D A F D I W G Q G T M
351 GCTATGGTTC GGGGACTTAG ATGCTTTTGA TATCTGGGGC CAAGGGACAA
V T V S S A S T K G P S V F P L
401 TGGTCACCGT CTCCTCAGCC TCCACCAAGG GCCCATCGGT CTTCCCCCTG
A P S S K S T S G G T A A L G C L
451 GCACCCTCCT CCAAGAGCAC CTCTGGGGGC ACAGCGGCCC TGGGCTGCCT
V K D Y F P E P V T V S W N S G A
501 GGTCAAGGAC TACTTCCCCG AACCGGTGAC GGTGTCGTGG AACTCAGGCG
L T S G V H T F P A V L Q S S G
551 CCCTGACCAG CGGCGTGCAC ACCTTCCCGG CTGTCCTACA GTCCTCAGGA
L Y S L S S V V T V P S S S L G T
601 CTCTACTCCC TCAGCAGCGT CGTGACCGTG CCCTCCAGCA GCTTGGGCAC
Q T Y I C N V N H K P S N T K V D
651 CCAGACCTAC ATCTGCAACG TGAATCACAA GCCCAGCAAC ACCAAGGTGG
K R V E P K S C D K T H T C P P
701 ACAAGAGAGT TGAGCCCAAA TCTTGTGACA AAACTCACAC ATGCCCACCG
C P A P E L L G G P S V F L F P P
751 TGCCCAGCAC CTGAACTCCT GGGGGGACCG TCAGTCTTCC TCTTCCCCCC
K P K D T L M I S R T P E V T C V
801 AAAACCCAAG GACACCCTCA TGATCTCCCG GACCCCTGAG GTCACATGCG
V V D V S H E D P E V K F N W Y
851 TGGTGGTGGA CGTGAGCCAC GAAGACCCTG AGGTCAAGTT CAACTGGTAC
V D G V E V H N A K T K P R E E Q
901 GTGGACGGCG TGGAGGTGCA TAATGCCAAG ACAAAGCCGC GGGAGGAGCA
Y N S T Y R V V S V L T V L H Q D
951 GTACAACAGC ACGTACCGTG TGGTCAGCGT CCTCACCGTC CTGCACCAGG
W L N G K E Y K C K V S N K A L
1001 ACTGGCTGAA TGGCAAGGAG TACAAGTGCA AGGTCTCCAA CAAAGCCCTC
P A P I E K T I S K A K G Q P R E
1051 CCAGCCCCCA TCGAGAAAAC CATCTCCAAA GCCAAAGGGC AGCCCCGAGA
P Q V Y T L P P S R E E M T K N Q
1101 ACCACAGGTG TACACCCTGC CCCCATCCCG GGAGGAGATG ACCAAGAACC
V S L T C L V K G F Y P S D I A
1151 AGGTCAGCCT GACCTGCCTG GTCAAAGGCT TCTATCCCAG CGACATCGCC
V E W E S N G Q P E N N Y K T T P
1201 GTGGAGTGGG AGAGCAATGG GCAGCCGGAG AACAACTACA AGACCACGCC
P V L D S D G S F F L Y S K L T V
1251 TCCCGTGCTG GACTCCGACG GCTCCTTCTT CCTCTATAGC AAGCTCACCG
D K S R W Q Q G N V F S C S V M
1301 TGGACAAGAG CAGGTGGCAG CAGGGGAACG TCTTCTCATG CTCCGTGATG
H E A L H N H Y T Q K S L S L S P
1351 CATGAGGCTC TGCACAACCA CTACACGCAG AAGAGCCTCT CCCTGTCCCC
G K * (SEQ ID NO:20)
1401 GGGTAAATGA (SEQ ID NO:21)
В различных вариантах осуществления, изобретение относится к описанным фармацевтическим композициям, режимам, процессам, применениям, способам и наборам с использованием антагониста IL-13 (например, антитела против IL-13 или его антигенсвязывающей части), указанным в настоящем документе. В конкретных вариантах осуществления наборы содержат зонды нуклеиновой кислоты для детекции маркера AIR, указанного в настоящем документе.
В следующих вариантах осуществления, наборы дополнительно содержат инструкции, включающие диагностику или лечение астмы.
В конкретном варианте осуществления, изобретение относится к набору для определения присутствия по меньшей мере одного маркера AIR, выбранного из группы, состоящей из маркеров AIR 1, 2, 3, 4, 5, 6, 7, 8 или 9, в образце, полученном от пациента с астмой, где набор содержит: контейнер, содержащий один или несколько зонда, которые специфически гибридизуется в строгих условиях с нуклеиновой кислотой, содержащей отвечающий аллель в одном или нескольких SNP, выбранных из группы, указанной в таблице 1.
В другом варианте осуществления, набор содержит инструктивные материалы, указывающие, что присутствие по меньшей мере одного маркера AIR в образце нуклеиновой кислоты от пациента указывает на то, что пациент является кандидатом для лечения с помощью антагониста IL-13, как указано в настоящем документе.
В другом варианте осуществления, набор содержит инструктивные материалы, указывающие, что присутствие по меньшей мере 2 маркеров AIR в образце нуклеиновой кислоты от пациента указывает на то, что пациент является кандидатом для лечения с помощью антагониста IL-13, как указано в настоящем документе.
В другом варианте осуществления, набор содержит инструктивные материалы, указывающие, что присутствие по меньшей мере 3,4,5,6,7,8 или 9 маркеров AIR в образце нуклеиновой кислоты от пациента указывает на то, что пациент является кандидатом для лечения с помощью антагониста IL-13, как указано в настоящем документе.
В другом варианте осуществления, набор содержит контейнер, содержащий один или несколько зондов, которые специфически гибридизуются в строгих условиях с нуклеиновой кислотой, содержащей отвечающий аллель в одном или нескольких SNP, выбранных из группы, указанной в таблице 1. В другом варианте осуществления, нуклеиновая кислота содержит два или более SNP, выбранных из группы, указанной в таблице 1. В другом варианте осуществления, нуклеиновая кислота содержит 2, 3, 3, 4, 5, 6, 7, 8 или 9 или более SNP, выбранных из группы, указанной в таблице 1.
В другом варианте осуществления, один или несколько зондов, специфически гибридизуются в строгих условиях с нуклеиновой кислотой, содержащей отвечающий аллель в SNP rs 8832 и/или rs 1050.
В другом варианте осуществления, один или несколько зондов и/или праймеров содержат зонды и/или праймеры для применения в реакции амплификации нуклеиновой кислоты.
Способы анализа, диагностические способы и способы получения пригодных для передачи форм информации
Описанные способы можно использовать для лечения, предотвращения, или облегчения заболевания астмой, а также прогнозирования вероятности для пациента с астмой отвечать на лечение с помощью антагониста IL-13. В этих способах используют, среди прочего, определение того, обладает ли пациент маркером AIR, в образце от пациента.
Биологический образец от пациента можно анализировать на присутствие маркера AIR любыми применимыми общепринятыми способами, которые выбирают в зависимости от того, попадает ли конкретный маркер в экзон, интрон, некодирующую часть мРНК или некодирующую геномную последовательность.
Многочисленные биологические образцы можно использовать для идентификации присутствия аллелей или белков, уровня экспрессии генов или белков и активности белков, например, кровь, синовиальную жидкость, лейкоцитарный слой, сыворотку, плазму, лимфу, кал, мочу, слезы, слюну, спинномозговую жидкость, буккальные мазки, мокроту или ткань. Различные источники внутри биологического образца можно использовать в описанных способах, например, можно анализировать геномную ДНК, полученную из биологического образца, для детекции маркера AIR, или можно анализировать продукты маркера AIR, например, продукты нуклеиновой кислоты (например, ДНК, пре-мРНК, мРНК, микроРНК и т.д.) и полипептидные продукты (например, экспрессированные белки), полученные из биологического образца.
Открытие по изобретению включает в себя определение того, что различные маркеры AIR из таблицы 1 можно использовать для прогнозирования ответа конкретного пациента на лечение посредством антагонизма IL-13. Из SNP в Таблице 1, большинство обнаружены в геномной ДНК и интронах, так что аллельный статус пациента можно определять посредством исследования, например, пре-мРНК или геномной ДНК. Однако, присутствие маркеров AIR, соответствующих экзонным локализациям, можно определять посредством анализа последовательности геномной ДНК, РНК и/или белка. Соответственно, специалисту в данной области понятно, что можно идентифицировать, обладает ли субъект данным маркером AIR посредством анализа продукта нуклеиновой кислоты маркера AIR, полипептидного продукта маркера AIR или эквивалентного генетического маркера для маркера AIR, при необходимости. В предпочтительных вариантах осуществления, геномную последовательность маркера AIR анализируют для определения того, обладает ли субъект маркером AIR.
Многочисленные способы и устройства доступны для идентификации присутствия маркера или полиморфизма AIR, приводящего к уменьшенному уровню экспрессии, уровню кодируемого белка или уровню белковой активности. ДНК (геномную и кДНК) для детекции SNP можно получать из биологического образца способами, хорошо известными в данной области, например, посредством экстракции фенолом/хлороформом, системы очистки PUREGENE DNA® от GentAS Systems (Qiagen, CA). Детекция последовательности ДНК может включать в себя проверку нуклеотида(нуклеотидов), локализованных либо в смысловой, либо в антисмысловой цепи в этой области. Присутствие полиморфизмов у пациента можно детектировать с ДНК (геномной или кДНК), полученной при ПЦР с использованием специфических для последовательности зондов, например, гидролиза зондов из Taqman, маяков, «скорпионов»; или гибридизации зондов, детектирующих маркер или полиморфизм. Для детекции полиморфизма, специфические для последовательности зонды можно разрабатывать так, чтобы они специфически гибридизовались с геномной ДНК с представляющими интерес аллелями или, в некоторых случаях, с представляющей интерес РНК. Праймеры и зонды для полиморфных участков (например, SNP) можно разрабатывать на основании контекстных последовательностей, обнаруженных в базе данных SNP NCBI, доступной на: www.ncbi.nlm.nih.gov/snp. Эти зонды можно метить для прямой детекции или приводить в контакт со второй, поддающейся детекции молекулой, которая специфически связывается с зондом. Продукты ПЦР также можно детектировать посредством связывающих ДНК средств. Такие продукты ПЦР можно затем секвенировать посредством любого способа секвенирования ДНК, доступного в данной области. Альтернативно, присутствие аллеля можно детектировать посредством секвенирования с использованием любых способов секвенирования, таких как, но без ограничения, секвенирование на основе способа Сэнгера, пиросеквенирование или секвенирование нового поколения (Shendure J. и Ji, H., Nature Biotechnology (1998), Vol. 26, Nr 10, pages 1135-1145). Оптимизированные аллельные дискриминантные анализы для SNP можно приобретать из Applied Biosystems (Foster City, California, USA).
Различные способы можно использовать для исследования конкретного полиморфизма (например, SNP), включая, например, способы на основе гибридизации, такие как генотипирование посредством динамической аллель-специфической гибридизации (DASH), детекция полиморфного участка (например, SNP) посредством молекулярных маяков (Abravaya K., et al. (2003) Clin Chem Lab Med. 41:468-474), технология Luminex xMAP®, технология Illumina Golden Gate® и коммерчески доступные высокоплотные массивы олигонуклеотидных SNP (например, на Affymetrix Human SNP 5.0 GeneChip® проводят полногеномный анализ, который позволяет генотипирование более 500000 SNP человека), наборы BeadChip® от Illumina, например, Human660W-Quad и Human 1.2M-Duo); способы на основе ферментов, такие как полиморфизм длины рестрикционных фрагментов (RFLP), способы на основе ПЦР (например, ARMS-ПЦР с четырьмя праймерами), анализы Invader (Olivier M. (2005) Mutat Res. 573(1-2):103-10), различные анализы для достройки праймеров (включенные в форматы детекции, например, масс-спектрометрию MALDI-TOF, электрофорез, блоттинг и подобные ELISA способы), анализы TaqMan® и лигазные анализы олигонуклеотидов; и другие способы анализов после амплификации, например, анализ одноцепочечного конформационного полиморфизма (Costabile et al. (2006) Hum. Mutat. 27(12):1163-73), электрофорез в геле с градиентом температуры (TGGE), денатурирующая высокоэффективная жидкостная хроматография, высокоразрешающий анализ плавления, анализы белков, связывающих ДНК с несоответствиями (например, белок MutS из Thermus aquaticus связывает места несовпадения различных одиночных нуклеотидов с различной аффинностью, и его можно использовать в капиллярном электрофорезе для дифференцировки всех шести наборов несовпадений), SNPLex® (запатентованная система детекции SNP, доступная из Applied Biosystems), капиллярный электрофорез, масс-спектрометрия, и различные способы секвенирования, например, пиросеквенирование и секвенирование нового поколения, и т.д. Коммерческие наборы для генотипирования SNP включают в себя, например, Fluidigm Dynamic Array® IFC (Fluidigm), анализ генотипирования SNP TaqMan® (Applied Biosystems), MassARRAY® iPLEX Gold (Sequenom), набор зондов для ПЦР SNP Type-it Fast® (Quiagen) и т.д.
В некоторых вариантах осуществления, присутствие полиморфного участка (например, SNP) у пациента детектируют с использованием анализа гибридизации. В анализе гибридизации, присутствие генетического маркера определяют на основании способности нуклеиновой кислоты из образца гибридизоваться с комплементарной молекулой нуклеиновой кислоты, например, олигонуклеотидным зондом. Доступно множество анализов гибридизации. В некоторых гибридизацию зонда с представляющей интерес последовательностью детектируют напрямую посредством визуализации связанного зонда, например, Нозерн или Саузерн анализ. В этих анализах, ДНК (Саузерн) или РНК (Нозерн) является выделенной. Затем ДНК или РНК расщепляют с помощью рестрикционных ферментов, которые осуществляют редкое расщепление в геноме и не поблизости от любого из маркеров, подвергаемых анализу. Затем ДНК или РНК разделяют, например, в агарозном геле, и переносят на мембрану. Меченому зонду или зондам, например, посредством включения радиоактивного нуклеотида или связывающего вещества (например, SYBR® Green), позволяют вступать в контакт с мембраной в условиях низкой, средней или высокой строгости. Несвязавшийся зонд удаляют, и присутствие связывания детектируют посредством визуализации меченого зонда. В некоторых вариантах осуществления, массивы, например, систему MassARRAY® (Sequenom, San Diego, California, USA) можно использовать для генотипирования субъекта.
Традиционные способы генотипирования также можно модифицировать для применения в генотипировании. Такие традиционные способы включают в себя, например, способы амплификации ДНК, такие как ПЦР и ее варианты, прямое секвенирование, гибридизация SSO в сочетании с технологией Luminex xMAP®, типирование SSP и SBT.
В типировании с использованием специфических для последовательности олигонуклеотидов (SSO) используют ПЦР амплификацию мишени, гибридизацию продуктов ПЦР с панелью иммобилизированных специфических для последовательности олигонуклеотидов на бусинах, детекцию связанного с зондом продукта амплификации посредством появления окраски с последующим анализом данных. Специалистам в данной области понятно, что описанную гибридизацию описанных специфических для последовательности олигонуклеотидов (SSO) можно проводить с использованием различных коммерчески доступных наборов, таких как наборы, поставляемые One Lambda, Inc. (Canoga Park, CA) или наборы для типирования HLA Lifecodes (Tepnel Life Sciences Corp.) в сочетании с технологией Luminex® (Luminex, Corporation, TX). SSO LABType® представляет собой раствор обратных SSO (rSSO) для типирования ДНК, в котором используют зонды специфических для последовательностей олигонуклеотидов (SSO) и микросферы с цветовым кодом для идентификации аллелей HLA. ДНК-мишень амплифицируют посредством полимеразной цепной реакции (ПЦР) и затем гибридизуют с массивом зондов на бусинах. Анализ происходит в отдельной лунке 96-луночного планшета для ПЦР; таким образом, 96 образцов можно обрабатывать одновременно.
Типирование с использованием специфических для последовательностей (SSP) представляет собой способ на основе ПЦР, в котором используют специфические для последовательностей праймеры для типирования на основе ДНК. Способ SSP основан на том принципе, что только праймеры с последовательности, полностью соответствующими последовательностям-мишеням, приводят к продуктам амплификации в контролируемых условиях ПЦР. Специфические для последовательностей аллелей пары праймеров разрабатывают для избирательной амплификации последовательностей-мишеней, которые являются специфическими для отдельного аллеля или группы аллелей. Продукты ПЦР можно визуализировать в агарозном геле. Контрольные пары праймеров, соответствующие не относящимся к аллелям последовательностям, присутствующим во всех образцах, действуют в качестве внутреннего контроля ПЦР для верификации эффективности амплификации ПЦР. Специалистам в данной области понятно, что генотипирование низкого, среднего и высокого разрешения с помощью описанного типирования со специфическими для последовательности праймерами можно проводить с использованием различных коммерчески доступных наборов, таких как наборы Olerup SSP™ (Olerup, PA) или (Invitrogen) или Allset и SSP с низким разрешением ™Gold DQA1 (Invitrogen).
Типирование прямым секвенированием (SBT) основано на ПЦР амплификации мишени, с последующим секвенированием продуктов ПЦР и анализом данных.
В некоторых случаях, РНК, например, зрелую мРНК, пре-мРНК, также можно использовать для определения присутствия конкретных полиморфизмов (см. Таблицу 1). Анализ последовательности мРНК, транскрибированной с данного гена, можно проводить с использованием любого известного в данной области способа, включая, но без ограничения, анализ Нозерн-блоттингом, анализы защиты от нуклеаз (NPA), гибридизацию in situ, обратную транскрипцию-полимеразную цепную реакцию (ОТ-ПЦР), ОТ-ПЦР ELISA, количественную ОТ-ПЦР на основе TaqMan (количественную ОТ-ПЦР на основе зондов) и количественную ОТ-ПЦР на основе SYBR green. В одном примере, детекция уровней мРНК включает в себя приведение выделенной мРНК в контакт с олигонуклеотидом, который может гибридизоваться с мРНК, кодируемой маркером AIR. Зонд нуклеиновой кислоты может, как правило, представлять собой, например, полноразмерную кДНК, или ее часть, такую как олигонуклеотид длиной по меньшей мере 7, 15, 30, 50 или 100 нуклеотидов и достаточный для специфической гибридизации в строгих условиях с мРНК. Гибридизация мРНК с зондом указывает на то, что рассматриваемый маркер экспрессируется. В одном формате, РНК иммобилизуют на твердой поверхности и приводят в контакт с зондом, например, посредством разделения выделенной РНК в агарозном геле и переноса мРНК с геля на мембрану, такую как нитроцеллюлоза. Праймеры для амплификации определяют как пару молекул нуклеиновой кислоты, которые могут гибридизоваться с 5'- или 3'-областями гена (плюс- и минус-цепями, соответственно, или наоборот) и содержат короткую область между ними. Как правило, праймеры для амплификации составляют приблизительно от 10 до 30 нуклеотидов в длину и фланкируют область приблизительно от 50 до 200 нуклеотидов в длину. В подходящих условиях и с использованием подходящих реагентов, такие праймеры позволяют амплификацию молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, фланкированную праймерами. Продукты ПЦР можно детектировать любым пригодным способом, включая, но без ограничения, электрофорез в геле и окрашивание с использованием специфического для ДНК красителя или гибридизацию с меченым зондом.
Уровень экспрессии гена можно определять посредством измерения уровней РНК (или кДНК после обратной транскрипции) с использованием различных способов, например, анализы на основе ПЦР, анализ ПЦР после обратной транскрипции (ОТ-ПЦР), Нозерн-блоттинг и т.д. Можно использовать также количественную ОТ-ПЦР со стандартизованными смесями конкурентных матриц.
В некоторых случаях, присутствие полиморфизма у пациента можно определять посредством анализа полипептидных продуктов маркеров AIR (см. таблицу 1). Детекцию полипептидных продуктов можно проводить с использованием любого известного способа в данной области, включая, но без ограничения, иммуноцитохимическое окрашивание, ELISA, проточную цитометрию, Вестерн-блоттинг, спектрофотометрию, ВЭЖХ и масс-спектрометрию.
Применение иммобилизованных антител, специфических для белков или полипептидов, также предусмотрено по настоящему описанию. Антитела можно иммобилизовать на множестве твердых подложек, таких как магнитные частицы или частицы хроматографической смолы, на поверхности любого места для анализа (такого как лунки планшета для микротитрования), на фрагментах твердого материала субстрата (такого как пластик, нейлон, бумага) и т.п. Полоску для анализа можно получать посредством покрытия твердой подложки антителом или множеством антител в массиве. Эту полоску можно затем погружать в тестируемый образец и затем быстро проводить через стадии отмывки и детекции для получения поддающегося измерению сигнала, такого как окрашенное пятно.
В двухстадийном анализе, иммобилизованные полипептидные продукты маркера AIR или белок ERAP1 можно инкубировать с немеченым антителом. Затем комплекс с немеченым антителом, если он присутствует, связывается со вторым, меченым антителом, которое является специфическим для немеченого антитела. Образец промывают и анализируют на присутствие метки. Выбор маркера, используемого для мечения антител, может меняться в зависимости от применения. Однако, выбор маркера легко может осуществить специалист в данной области. Антитела можно метить с использованием радиоактивного атома, фермента, хромофорной или флуоресцентной группы или колориметрической метки. Выбор метки для мечения также сильно зависит от желательных пределов детекции. Ферментные анализы (ELISA), как правило, позволяют детекцию окрашенного продукта, сформированного посредством взаимодействия меченного ферментом комплекса с субстратом фермента. Некоторые примеры радиоактивных атомов включают в себя 32P, 125I, 3H и 14P. Некоторые примеры ферментов включают в себя пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу и глюкоза-6-фосфатдегидрогеназу. Некоторые примеры хромофорных групп включают в себя флуоресцеин и родамин. Антитела можно конъюгировать с этими метками посредством способов, известных в данной области. Например, ферменты и хромофорные молекулы можно конъюгировать с антителами посредством связывающих средств, таких как диальдегиды, карбодиимиды, дималеинимиды и т.п. Альтернативно, конъюгация может происходить посредством пар лиганд-рецептор. Некоторые пригодные пары лиганд-рецептор включают в себя, например, биотин-авидин или -стрептавидин и антитело-антиген.
В одном аспекте по настоящему описанию предусматривают применение сэндвич-способа для детекции полипептидных продуктов в биологических образцах. Для способа необходимы два антитела, способные связывать представляющий интерес белок: например, одно, иммобилизованное на твердой подложке, и одно свободное в растворе, но меченное каким-либо легко поддающимся детекции химическим соединением. Примеры химических меток, которые можно использовать для второго антитела, включают в себя, но без ограничения, радиоактивные изотопы, флуоресцентные соединения и ферменты или другие молекулы, образующие окрашенные или электрохимически активные продукты при воздействии реагента или субстрата фермента. Когда образцы, содержащие полипептидные продукты, помещают в эту систему, полипептидные продукты связываются как с иммобилизованным антителом, так и с меченым антителом. Результатом является иммунный «сэндвич»-комплекс на поверхности подложки. Входящий в комплекс белок детектируют посредством отмывки не связавшихся компонентов образца и избытка меченого антитела, и измерения количества меченого антитела, входящего в комплекс с белком на поверхности подложки. Сэндвич-иммуноанализ является высокоспецифичным и очень чувствительным, при условии, что используют метки с хорошими пределами детекции.
Предпочтительно, присутствие полипептидных продуктов в образце детектируют посредством радиоиммунных анализов или твердофазных иммуноферментных анализов, твердофазных иммуноферментных анализов с конкурентным связыванием, дот-блоттинга, Вестерн-блоттинга, хроматографии, предпочтительно, высокоэффективной жидкостной хроматографии (ВЭЖХ) или других анализов, известных в данной области. Специфическое иммунологическое связывание антитела с белком или полипептидом можно детектировать напрямую или опосредованно.
Блоттнг является общепринятым для специалистов в данной области для детекции описанного белка с использованием антитела в качестве зонда (Promega Protocols and Applications Guide, Second Edition, 1991, Page 263, Promega Corporation). Образцы наносят на мембрану с использованием устройства для дот-блоттигнга. Меченый зонд инкубируют с мембраной, и детектируют белок.
Анализ Вестерн-блоттингом хорошо известен специалисту в данной области (Sambrook et al., Molecular Cloning, A Laboratory Manual, 1989, Vol. 3, Chapter 18, Cold Spring Harbor Laboratory). В Вестерн-блоттинге, образец разделяют посредством SDS-PAGE. Гель переносят на мембрану. Мембрану инкубируют с меченым антителом для детекции желательного белка.
Анализы, описанные выше, включают в себя такие стадии, как, но без ограничения, иммуноблоттинг, иммунодиффузия, иммуноэлектрофорез или иммунопреципитация. В некоторых вариантах осуществления, автоматический анализатор используют для определения присутствия маркера AIR.
При осуществлении любого из способов, описанных в настоящем документе, требующих определения присутствия маркера или полиморфизма AIR, такое определение можно осуществлять посредством обращения за информацией в архив данных, содержащий достаточно информации по генетическому составу пациента для определения того, обладает ли пациент представляющим интерес маркером. Предпочтительно, в архиве данных приведен генотип, присутствующий (или отсутствующий) у индивидуума. Архив данных может включать в себя записи для индивидуального пациента, медицинскую карту, файл (например, простой файл ASCII), доступные посредством компьютера, или другие электронные или не относящийся к электронным носители, на которых можно хранить соответствующую информацию или генетические данные. Как применяют в настоящем документе, медицинская карта представляет собой портативное устройство для хранения, такое как магнитная карта с данными, смарт-карта, которая обладает встроенным процессором и которую продают такие поставщики, как Siemens из Munich Germany, или карта флэш-памяти. Если архив данных представляет собой файл, доступный посредством компьютера, такие файлы могут быть локализованы на различных носителях, включая: сервер, клиент, жесткий диск, CD, DVD, персональное цифровое вспомогательное устройство, такое как смартфон, карманный компьютер, цифровое устройство записи на магнитную ленту, zip-диск, внутреннюю ROM (память только для чтения) компьютера или интернет или всемирную сеть. Другие носители для хранения файлов, доступные посредством компьютера, очевидны специалисту в данной области.
Как правило, после определения присутствия маркера или полиморфизма AIR, терапевтов или генетических консультантов, или пациентов, или других исследователей, можно проинформировать о результате. Конкретно, результат можно преобразовать в пригодную для передачи форму информации, которую можно сообщать или передавать другим исследователям или терапевтам, или генетическим консультантам, или пациентам. Такая форма может меняться и может являться материальной или нематериальной. Результат для тестированного индивидуума можно заключать в описательное изложение, диаграммы, фотографии, графики, изображения или любые другие визуальные формы. Например, изображения электрофореза в геле продуктов ПЦР можно использовать для объяснения результатов. Диаграммы, показывающие, где вариант встречается в аллеле индивидуума, также можно использовать для указания результатов тестирования. Утверждения относительно присутствия маркера или полиморфизма AIR также можно использовать для указания результатов тестирования. Эти утверждения и визуальные формы можно регистрировать на материальных носителях, таких как бумага, машиночитаемые носители, такие как дискеты, компакт-диски и т.д., или на нематериальных носителях, например, электронных носителях в форме электронного письма или веб-сайта в интернет или интранет. Кроме того, результат можно также регистрировать в звуковой форме и передавать посредством любых пригодных носителей, например, аналоговых или цифровых кабельных линий, оптоволоконных кабелей и т.д., через телефон, факсимильный аппарат, беспроводной мобильный телефон, телефонную связь через интернет и т.п. Все такие формы (материальные и нематериальные) составляют «пригодные для передачи формы информации». Таким образом, информацию и данные по результату теста можно получать в любом месте мира и передавать в другую локализацию. Например, когда анализ генотипирования проводят за рубежом, информацию и данные по результату теста можно получать и переводить в пригодную для передачи форму, как описано выше. Результат теста в пригодной для передачи форме, таким образом, можно импортировать в США. Соответственно, настоящее описание также относится к способу получения пригодной для передачи формы информации, содержащей присутствие или отсутствие маркера или полиморфизма AIR у индивидуума. Эту форму информации можно использовать для прогнозирования способности отвечать пациента, страдающего астмой, и для избирательного лечения пациента в зависимости от этой информации.
Способы лечения и применения антагонистов IL-13
Описанные способы позволяют врачам-клиницистам предоставлять персонифицированную терапию для пациентов с астмой, т.е. они позволяют определение того, проводить ли избирательное лечение пациента с помощью антагониста IL-13. Таким образом, врач-клиницист может максимизировать преимущество и минимизировать риск антагонизма IL-13 в целой популяции пациентов, пораженных астмой. Следует понимать, что антагонисты IL-13 можно использовать для лечения, предотвращения или облегчения астмы, включая умеренную или тяжелую астму. Антагонисты IL-13, можно использовать in vitro, ex vivo или включать в фармацевтические композиции и вводить индивидуумам (например, пациентам-людям) in vivo для лечения, облегчения или предотвращения астмы, например, у пациентов, обладающих маркером AIR. Фармацевтическую композицию составляют, чтобы она являлась совместимой с намеченным способом введения (например, пероральные композиции, как правило, включают инертный разбавитель или съедобный носитель). Другие неограничивающие примеры введения включают в себя парентеральное (например, внутривенное), внутрикожное, подкожное, пероральное (например, ингаляцию), чрескожное (местное), трансмукозальное и ректальное введение. Фармацевтические композиции, совместимые с каждым намеченным способом введения хорошо известны в данной области.
Антагонисты IL-13 можно использовать в качестве фармацевтической композиции при комбинации с фармацевтически приемлемым носителем. Такая композиция может содержать, в дополнение к антагонисту IL-13, носители, различные разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы и другие материалы, хорошо известные в данной области. Характеристики носителя зависят от способа введения.
Антитела, например, антитела против IL-13, как правило, составляют либо в водной форме, готовой для парентерального введения, либо в форме лиофилизатов для разведения пригодным разбавителем перед введением. В некоторых вариантах осуществления описанных способов и применений, антагонист IL-13, например, антитело IL-13, составляют в форме лиофилизата. Пригодные составы лиофилизатов можно разводить в небольшом объеме жидкости (например, 2 мл или менее), чтобы позволять подкожное введение, и они могут обеспечивать растворы с низкими уровнями агрегации антител. Применение антител в качестве активного ингредиента лекарственных средств в настоящее время является широко рапространенным, включая продукты герцептин® (трастузумаб), ритуксан® (ритуксимаб), синагис® (паливизумаб) и т.д. Способы очистки антител до фармацевтической степени хорошо известны в данной области. Когда терапевтически эффективное количество антагониста IL-13 вводят посредством внутривенной, внутрикожной или подкожной инъекции, антагонист IL-13 может присутствовать в форме апирогенного, парентерально приемлемого раствора. Фармацевтическая композиция для внутривенной, внутрикожной или подкожный инъекции может содержать, в дополнение к антагонисту IL-13, изотонический носитель, такой как хлорид натрия, раствор Рингера, декстроза, декстроза и хлорид натрия, лактированный раствор Рингера или другой носитель, как известно в данной области.
Подходящую дозу можно, разумеется, менять в зависимости, например, от конкретных антагонистов IL-13, подлежащих применению, хозяина, способа введения и характера и тяжести состояния, подвергаемого лечению, и от характера предшествующего лечения, которому подвергали пациента. В конечном счете, лечащий поставщик услуг в сфере здравоохранения принимает решение о количестве антагониста IL-13, с помощью которого лечат каждого индивидуального пациента.
В практическом осуществлении некоторых способов лечения или применений по настоящему описанию, терапевтически эффективное количество антагониста IL-13 вводят пациенту, например, млекопитающему (например, человеку). В то время как понятно, что описанные способы предоставляют избирательное лечение пациентов в зависимости от присутствия маркера AIR, это не исключает того, что, если пациента в конечном счете лечат с помощью антагониста IL-13, такая терапия с помощью антагониста IL-13 обязательно представляет собой монотерапию. Действительно, если пациент выбран для лечения с помощью антагониста IL-13, тогда антагонист IL-13 можно вводить в соответствии со способом по описанию либо отдельно, либо в комбинации с другими лекарственными средствами для лечения астмы. При совместном введении с одним или несколькими дополнительными лекарственными средствами, антагонист IL-13 можно вводить либо одновременно с другими лекарственными средствами, либо последовательно. При введении последовательно, лечащий врач принимает решение о подходящей последовательности введения антагониста IL-13 в комбинации с другими лекарственными средствами, а также о подходящих дозах для совместной доставки.
Антагонист IL-13, удобным образом вводят парентерально, внутривенно, например, в латеральную подкожную вену руки или другую периферическую вену, внутримышечно или подкожно. Длительность внутривенной (i.v.) терапии с использованием фармацевтической композиции по настоящему описанию можно менять, в зависимости от тяжести заболевания, подвергаемого лечению, и состояния и персонального ответа каждого индивидуального пациент. Предусматривают также подкожную (s.c.) терапию с использованием фармацевтической композиции по настоящему описанию. Поставщик услуг в сфере здравоохранения может принимать решение о подходящей длительности i.v. или s.c. терапии и расписании применения терапии, с использованием фармацевтической композиции по настоящему описанию.
Дозы можно вводить на основании массы, например, 3 мг/кг, 10 мг/кг, 15 мг/кг, или в форме фиксированного количества, например, 75 мг, 150 мг, 300 мг, 1000 мг, в зависимости от тяжести заболевания.
Наборы
Изобретение относится также к наборам для детекции маркера или полиморфизма AIR, уровня экспрессии, уровня или активности белка, в биологическом образце (тестируемом образце) от пациента с астмой. Такие наборы можно использовать для прогнозирования вероятности для пациента, страдающего астмой, отвечать (или обладать более сильным ответом) на лечение с помощью антагониста IL-13. Например, набор может содержать зонд (например, олигонуклеотид, антитело, меченое соединение или другое средство), способный детектировать маркер или полиморфизм AIR, продукты этих аллелей и/или эквивалентный генетический маркер для этих аллелей в биологическом образце. Набор может также содержать инструкции для предоставления прогноза вероятности того, что пациент будет отвечать на лечение с помощью антагониста IL-13.
Зонды могут специфически гибридизоваться с геномными последовательностями, продукты нуклеиновой кислоты, или полипептидные продукты. Иллюстративные зонды представляют собой олигонуклеотиды или конъюгированные олигонуклеотиды, которые специфически гибридизуются с отвечающими аллелями из таблицы 1; антитело, способное к дифференцировке между полипептидными продуктами, кодируемыми описанными аллелями; олигонуклеотиды для достройки праймеров, аллель-специфические праймеры, комбинацию аллель-специфических праймеров, аллель-специфические зонды, и праймеры для достройки праймеров, и т.д. Необязательно, набор может содержать зонд, нацеленный на аллель внутреннего контроля, который может представлять собой любой аллель, присутствующий в общей популяции. Детекцию аллеля внутреннего контроля разрабатывают для того, чтобы убедиться в эффективности набора. Описанные наборы могут также содержать, например, забуферивающее средство, консервант или стабилизатор белка. Набор может также содержать компоненты, необходимые для детекции поддающегося детекции средства (например, фермент или субстрат). Набор может также содержать контрольный образец или серию контрольных образцов, которые можно анализировать и сравнивать с содержащимся тестируемым образцом. Каждый компонент набора, как правило, заключен в индивидуальный контейнер, и все из различных контейнеров находятся внутри одной упаковки вместе с инструкциями для применения.
Такие наборы могут также содержать антагонист IL-13 или фармацевтическую композицию, содержащую антагонист IL-13. Такие наборы можно использовать для избирательного лечения пациентов с астмой с использованием антагониста IL-13. Кроме того, такие наборы могут содержать средства для введения антагониста IL-13 (например, шприц и ампулу, предварительно заполненный шприц, a предварительно заполненный шприц-ручку) и инструкции для применения. Эти наборы могут содержать дополнительные лекарственные средства для лечения астмы, например, для доставки в комбинации с описанным антагонистом IL-13.
Фразу «средства для введения» используют для обозначения любых доступных инструментов для системного введения лекарственного средства пациенту, включая, но без ограничения, предварительно заполненный шприц, ампулу и шприц, шприц-ручку для инъекций, шприц для самоинъекции, i.v. капельницу и мешок, насос и т.д. С такими предметами, пациент может самостоятельно вводить лекарственное средство (т.е. вводить лекарственное средство своими силами), или терапевт может вводить лекарственное средство.
Подробности одного или нескольких вариантов осуществления описания указаны в прилагаемом описании выше. Хотя любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, можно использовать в практическом осуществлении или тестировании настоящего описания, в настоящее время описаны предпочтительные способы и материалы. Другие признаки, объекты и преимущества описания очевидны из описания и из формулы изобретения. В описании и прилагаемой формуле изобретения, формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иначе. Если не определено иначе, все технические и научные термины, применяемые в настоящем документе, обладают тем же значением, которое является общепринятым для специалиста в области, к которой относится описание. Все числовые диапазоны в этом описании включают конечные точки и все целые числа, десятичные дроби и дроби между ними, вне зависимости от того, указаны ли они конкретно или нет. Содержание всех патентов и публикаций, процитированных в этом описании, включено в качестве ссылки. Следующие примеры представлены, чтобы более полно проиллюстрировать предпочтительные варианты осуществления описания. Эти примеры никаким образом не следует рассматривать как ограничивающие объем описанного объекта патента, как определено посредством прилагаемой формулы изобретения.
ПРИМЕРЫ
Список сокращений
|
ПРИМЕР 1:
Идентификация антагонистов Il-13
Для целей по изобретению, антагонисты IL-13, конкурирующие с указанным антителом против IL-13, приведенным в настоящем документе, включая антитело 01951/G12 (SEQ ID NO:14 и 16), за связывание с IL-13, можно идентифицировать способами, известными в данной области, и кроме того, как описано в следующем способе.
Все эксперименты проводят с использованием устройства Biacore T200. Программное обеспечение Biacore T200 Control и программное обеспечение Biacore T200 Evaluation используют для контроля и анализа экспериментов, соответственно.
ЧАСТЬ 1: Антитело против IL-13 человека антитело 01951/G12 иммобилизуют на поверхности сенсорного чипа CM5 с использованием способа связывания по аминогруппам. Кратко, поверхность измеряющей проточной ячейки активируют с помощью EDC/NHS, с последующим добавлением в течение 700 секунд 50 мкг/мл антитела 01951/G12 в 10 мМ ацетате натрия pH 4,5. На основании предшествующих экспериментов, эти буферы и периоды времени инъекции являются подходящими, чтобы обеспечивать насыщение поверхности чипа антителом 01951/G12, хотя время воздействия можно уменьшать, если насыщения достигают до 700 секунд. Буферы для иммобилизации, которые потенциально являются более подходящими, можно определять посредством подбора буферов. Затем любые оставшиеся активные поверхностные блокируют с помощью этаноламина. Поверхность эталонной проточной ячейки активируют с помощью EDC/NHS и затем блокируют с помощью этаноламина без иммобилизации белка (нулевая иммобилизация) или посредством добавления антитела для контроля изотипа. На основании предшествующих исследований с использованием иммобилизации антитела 01951/G12, подходящим буфером для анализа является HBS-EP+, содержащий 10 мМ HEPES, 150 мМ NaCl, 0,005% (масс./об.) полисорбата 20 и 3 мМ ЭДТА при pH 7,4.
ЧАСТЬ 2: Кривую зависимости ответа от концентрации для IL-13 человека получают для определения подходящей концентрации IL-13 для использования в последующих конкурентных анализах эпитопов. IL-13 разбавляют в буфере для анализа и, начиная с 25 нМ, пропускают через эталонную и измеряющую проточную ячейку при скорости потока 30 мкл/мин. Оптимальную скорость можно корректировать экспериментально. Время связывания составляет 120 секунд, и время диссоциации составляет 120 секунд, хотя время диссоциации можно продлевать до 180 секунд, или 600 секунд, или более, если необходимо измерение аффинности (KD). Регенерация поверхности с помощью 30 секунд инъекции 10 мМ глицина при pH 2,0, при скорости потока 10 мкл/мин, является необходимой для удаления IL-13 с антитела 01951/G12 после стадии диссоциации. Иногда необходима вторая стадия регенерации сразу после первой. Эти стадии повторяют для следующих серий разведения IL-13: 25, 12,5, 6,25, 3,13, 1,56 и 0 нМ. На основании предшествующих исследований, эти серии разведения могут являться пригодными для предварительных экспериментов, но может возникнуть необходимость из изменения, соответственно. Серии разведения анализируют дважды для получения n=2. Температура анализа составляет 25°C. Буфер для анализа представляет собой HBS-P+, содержащий 10 мМ HEPES, 150 мМ NaCl, 0,005% (масс./об.) и полисорбат 20 при pH 7,4. данные оценивают с использованием модели связывания 1:1 с помощью программного обеспечение Biacore T200 Evaluation.
ЧАСТЬ 3: Конкурентные исследования эпитопов выполняют с использованием способа двойного связывания. На основании данных из части 2, концентрацию IL-13, дающую приблизительно 50 RU связывания с антителом 01951/G12, инъецируют в течение 120 секунд при 30 мкл/мин. НЕ присутствует фаза диссоциации; вместо нее немедленно следует вторая инъекция конкурирующего антитела против IL-13, в 10 раз* большей концентрации, чем IL-13. В предшествующих исследованиях в отношении IL-25 использовали фазу связывания 120 секунд, со скоростью потока 30 мкл/мин, отражающую добавление IL-13. Для любого конкурента, который связывается с IL-13 с использованием эпитопа, отличного от эпитопа антитела 01951/G12, получают ответ связывания. Для тех, которые связываются с IL-13 с использованием того же эпитопа, что и антитело 01951/G12, не получают ответа связывания. Можно применять различные периоды диссоциации, с последующей стадией кислотной отмывки для удаления добавленных как IL-13, так и конкурента. Эту стадию может делать обращенной, с конкурентным антителом, иммобилизованным на поверхности чипа, и антителом 01951/G12 в качестве второго добавления, для подтверждения результатов. Буфер для анализа представляет собой HBS-P+, содержащий 10 мМ HEPES, 150 мМ NaCl, 0,005% (масс./об.) и полисорбат 20 при pH 7,4.
ПРИМЕР 2
Идентификация остатков эпитопа для антитела 01951/G12:
Пептидное картирование:
Последовательность IL-13 анализировали на уровне пептидов для идентификации участка связывания с антителом 01951/G12. Тридцать четыре 15-членных пептида синтезировали, чтобы сканировать полную последовательность, с перекрыванием 12 остатков, начиная с N-конца. Синтез пептидов, получение стекол с массивами пептидов, инкубацию с антителами и анализ данных проводили, как описано в Maksimov et al. (PLoS ONE 7(3): e34212).
Результаты показаны в таблице 4. Наблюдаемая интенсивность сигнала связывания (световые единицы) указана для каждого пептида, в столбце 1 для контрольного неродственного антитела человека и в столбце 2 для антитела 01951/G12. Сигналы выше 10000 световых единиц как значимые. Для 2 перекрывающихся пептидов в наборе из 34 пептидов получили сигнал выше этого порога, для пептида 22 (TQRMLSGFCPHKVSA) (SEQ ID NO: 31) и пептида 23 (MLSGFCPHKVSAGQF) (SEQ ID NO: 32). Перекрывающаяся последовательность для обоих пептидов представляет собой MLSGFCPHKVSA (SEQ ID NO: 33).
Для верификации того, что эта последовательность является важной для связывания IL-13 с антителом 01951/G12, и для ее сужения в конечном итоге, проводили анализ замен.
Для этого анализа замен получали массив пептидов, где каждый остаток последовательности MLSGFCPHKVSA заменяли на каждую из возможных 20 стандартных аминокислот, получая набор из 240 пептидов, в которых 228 пептидов отличались от исходной последовательности на 1 аминокислоту за один раз. Результат исследования связывания с антителом 01951/G12 представлен на фигуре 1. Заключенная в рамку область обозначает остатки, для которых связывание сильно уменьшается или прекращается, когда их заменяют почти на любую аминокислоту. Таким образом, этот участок последовательности, FCPHKV (SEQ ID NO: 67), представляет собой минимальную область связывания IL-13 с антителом 01951/G12.
Последовательность IL-13, использованная для пептидного картирования:
SPGPVPPSTALRELIEELVNITQNQKAPLCNGSMVWSINLTAGMYCAALESLINVSGCSAIEKTQRMLSGFCPHKVSAGQFSSLHVRDTKIEVAQFVKDLLLHLKKLFREGRFN (SEQ ID NO: 34).
Таблица 4: Интенсивность сигнала (световые единицы) пептидов IL-13 при инкубации с контрольным антителом и целевым антителом (антитело 01951/G12).
|
ПРИМЕР 3
Фармакогенетический анализ SNP IL4-Rα и обнаружение маркеров AIR 1-9:
Антитело 01951/G12 представляет собой полностью человеческое моноклональное антитело IgG1/κ. CQAX576A2207 представляло собой клиническое исследование фазы II для оценки эффективности и безопасности антитела 01951/G12 у пациентов со стойкой астмой, от умеренной до тяжелой, после множественных доз, при добавлении к существующей терапии астмы.
Для оценки ассоциаций нескольких однонуклеотидных полиморфизмов (SNP) в гене IL4-Rα и риска обострений астмы у пациентов, подвергнутых лечению антителом 01951/G12, ДНК собирали от пациентов, зарегистрированных для исследования CQAX576A2207, и девять SNP в гене IL4-Rα генотипировали в этих образцах. Проводили статистическое тестирование ассоциации для оценки доказательства ассоциации SNP в гене IL4-Rα с риском обострений астмы, а также с другими клиническими конечными точками для астмы, у пациентов, подвергнутых лечению антителом 01951/G12.
Таким образом, проводили фармакогенетический анализ с целью:
- Оценить, ассоциированы ли конкретные SNP в гене IL4-Rα с риском обострений астмы у пациентов, подвергнутых лечению антителом 01951/G12.
- Оценить, ассоциированы ли конкретные SNP с изменением от исходного баллов ACQ7, FEV1 или уровня IgE у пациентов, подвергнутых лечению антителом 01951/G12.
- Оценить, ассоциированы ли указанные выше SNP с риском обострений астмы у пациентов, подвергнутых лечению плацебо.
Популяция для исследования
Популяция для исследования включала в себя всех пациентов, удовлетворяющих следующим критериям:
- Включены в конечную популяцию для клинического исследования CQAX576A2207, и
- Не обладают несоответствием по полу между тем, как зарегистрировано в базе клинических данных, и тем, как определено генетически
Оцененные клинические конечные точки
Проводили статистическое тестирование для оценки доказательства ассоциации между SNP IL4-Rα и следующими клиническими конечными точками для астмы:
- Риск возникновения по меньшей мере одного обострения астмы от исходной точки до недели 24
- Среднее абсолютное изменение баллов ACQ7 от исходной точки до недели 24
- Среднее процентное изменение уровня FEV1 от исходной точки до недели 24
- Среднее процентное изменение уровня IgE от исходной точки до недели 24
Оцененные генетические маркеры:
Следующие способы использовали для идентификации генетических вариантов, ассоциированных с ответом на антитело 01951/G12.
SNP-кандидаты
9 SNP, использованные в этом фармакогенетическом анализе, перечислены в таблице 5 вместе с их локализацией относительно структуры гена и, где это применимо, с их эффектом на продукт гена. Они перечислены в физическом порядке на протяжении гена. SNP генотипировали с использованием платформы Taqman.
Таблица 5
|
UTR, нетранслируемая область
Полногеномное исследование ассоциаций (GWAS)
Полногеномное исследование ассоциаций (GWAS) проводили с использованием чипа Illumina Omni5Exome. Оценивали все SNP, картированные в гене IL4-Rα.
Повторное секвенирование гена IL4-Rα
Секвенирование по Сэнгеру проводили для большинства экзонов в гене IL4-Rα, а также 3ʹ-нетранслируемой области (UTR), для определения того, можно ли идентифицировать какие-либо дополнительные варианты, не включенные в чип Omni5Exome.
Способы генотипирования:
SNP-кандидаты
Реакционные смеси для образцов получали, следуя протоколу, рекомендованному поставщиком, TaqMan SNP Genotyping Assays Protocol (PN 4332856D), и с использованием универсальной готовой к использованию смеси Taqman (PN 4326614), за следующими исключениями:
- 2,00 мкл образца ДНК на реакцию
- 0,25 мкл воды добавляли на реакцию
Реакции ПЦР проводили в GeneAmp 9700 (Applied Biosystems) с использованием программы, указанной в протоколе поставщика, за следующим исключением:
- Используют стандартный термический профиль с 50 циклами вместо 40
Считывания конечных точек проводили на системе детекции последовательностей ABI PRISM 7900HT, с анализом данных посредством SNP Manager и SDS 2.2.2 (Applied Biosystems).
GWAS
Данные генотипов для GWAS получали с использованием платформы микромассивов Illumina HumanOMNI5Exome.
Повторное секвенирование гена IL4-Rα
SNP идентифицировали посредством секвенирования по Сэнгеру в IL4Rα (NT_010393.15). ПЦР проводили с использованием уникальных праймеров, несущих универсальные метки последовательностей M13. Ампликоны для каждой кодирующей области секвенировали в двух направлениях с помощью уникальных или уникальных праймеров и BigDye Terminator v3.1 (Applied Biosystems, 4337456). Продукты для секвенирования анализировали с помощью CleanSEQ (Beckman, A29154) и анализировали в 3730xl Genetic Analyzer (Applied Biosystems) с POP-7 для детекции последовательность. Записи выравнивали с эталонными последовательностями для каждого ампликона из NCBI с использованием PhredPhrap (University of Washington) и затем визуально проверяли на расхождения с канонической последовательностью с использованием Consed (University of Washington, версия 19.0). Отмечали варианты последовательности и характеризовали любые соответствующие изменения кодирования, где это возможно.
Статистические способы:
Анализ риска обострений астмы
Все тестирования ассоциации между SNP и риском обострений астма проводили посредством модели условной логистической регрессии с использованием PROC LOGISTIC в SAS версии 9.3, со страной в качестве условного фактора. Все тесты разрабатывали для оценки гипотезы аддитивной связи между генотипом и риском обострений (на шкале логитов), что означает, что риск среди гетерозигот является промежуточным между рисками для двух классов гомозигот. Гипотезу аддитивности тестировали посредством определения генотипа как непрерывной переменной, равной количеству копий минорного (т.е. менее распространенного в выборке CQAX576A2207) аллеля, несомого пациентом.
Известно, что раса и этническая принадлежность являются общераспространенными искажающими факторами в исследованиях генетических ассоциаций; поэтому рекомендуется коррекция по расе и этнической принадлежности при тестировании ассоциаций, где это возможно. В исследовании CQAX576A2207 распределение по расе и этнической принадлежности было слишком несбалансированным, чтобы позволить коррекцию по этим факторам, поэтому логистическую регрессию проводили в зависимости от страны в качестве заместителя этих факторов.
Статистику вкладов использовали для оценки статистической значимости. Не проводили коррекций для множественных сравнений.
Анализ изменений от исходного уровня для ACQ7, FEV1 и IgE
Все тестирования ассоциации между SNP и абсолютным изменением от исходного уровня для ACQ7, процентным изменением от исходного уровня для FEV1 и процентным изменением от исходного уровня для IgE проводили посредством линейной модели с использованием PROC GENMOD в SAS версии 9.3. Все тесты оценивали гипотезу аддитивной связи между генотипом и конечной точкой, как описано в разделе 3.4.1. Страну, атопию в анамнезе, продолжение использования пероральных кортикостероидов и исходный уровень для соответствующей конечной точки включали в модель в качестве ковариаций. Критерий хи-квадрат Вальда использовали для оценки статистической значимости. Не проводили коррекций для множественных сравнений.
Тест перестановки для оценки суммарной значимости
Тест перестановки для оценки вероятности обнаружения того, что каждый из верхних 7 SNP в таблице 5 (т.е. исключая нижние 2 SNP: rs1029849 и rs4787956) обладает гомозиготным классом генотипа, при котором не присутствовало обострений среди пациентов, подвергнутых лечению антителом 01951/G12, если в реальности не присутствовало ассоциации между каким-либо из SNP и риском обострений для антитела 01951/G12.
Тест перестановки проводили в соответствии со следующими стадиями:
- Для первой перестановки, статус наличия обострений (да/нет) случайным образом переставляли для 94 пациентов, подвергнутых лечению антителом 01951/G12, так чтобы это напоминало случай, когда только 12 из 94 пациентов испытывали обострение, но этих 12 пациентов выбирали случайным образом. Все данные генотипирования оставляли неизменными.
- С использованием этого подвергнутого перестановке набора данных, каждый SNP оценивали, чтобы определить, обладает ли он гомозиготным классом генотипов, при котором не присутствовало обострений. Если обнаружено, что все 7 SNP обладают таким классом генотипов, подвергнутый перестановке набор данных снабжали меткой для регистрации этого обнаружения.
- Первые 2 стадии повторяли 1000 раз. Процент подвергнутых перестановке наборов данных, снабженных меткой для указания того, что каждый из 7 SNP обладает гомозиготным классом генотипов без обострений, представляет собой эмпирический уровень значимости этого обнаружения. Таким образом, небольшой процент снабженных меткой наборов данных указывает на низкую вероятность наблюдения такого результата по случайному шансу, и его можно принимать за доказательство того, что на риск обострений астмы среди пациентов, подвергнутых лечению антителом 01951/G12, влияют SNP в гене IL4-Rα.
Расчет значений r-квадрат на графике неравновесного сцепления
Значения r2 на графике LD рассчитывали с использованием программного обеспечения Haploview (Barrett et al, 2004).
Анализ посредством перекрестной проверки для оценки оптимального количества SNP для прогнозирования
Перекрестная проверка представляет собой статистический способ, который можно использовать для сравнения альтернативных способов построения прогностических моделей для оценки того, каким способом наиболее вероятно получить модель с наивысшей точностью прогноза. Способ включает в себя разделение доступной выборки пациентов на обучающую выборку и тестируемую выборку, применение альтернативных способов построения моделей только к обучающей выборке, использование полученных моделей для прогнозирования исхода для пациентов в тестируемой выборке и определение того, какая модель дает наиболее точный прогноз. Эту процедуру повторяют много раз, прогноз усредняют среди тестируемых выборок. Если конкретный способ проявляет тенденцию к получению в результате более точных прогнозов, чем другие способы, это позволяют предположить, что этим способом можно также получить в результате модель с наиболее высокой точностью прогноза при применении в будущих исследованиях.
При этом применении перекрестной проверки, после определения выбранных SNP для каждого из способов построения моделей, перечисленных ниже, линейный дискриминантный анализ (LDA) применяли для построения прогностической модели. Набор маркеров, доступных для отбора, состоял из 6 из верхних 7 SNP IL4-Rα, перечисленных в таблице 5. rs3024530 удаляли, поскольку он почти полностью коррелировал с rs1805010. Затем способ применяли для пациентов, подвергнутых лечению антителом 01951/G12, для сравнения следующих способов построения моделей:
- Включение наиболее значимого SNP из каждого из 2 блоков неравновесного сцепления (LD)
- Включение 2 SNP, выбранных выше, а также следующего наиболее значимого SNP
- Включение 2 наиболее значимых SNP из каждого из 2 блоков LD
- Включение 4 SNP, выбранных выше, а также следующего наиболее значимого SNP
- Включение всех 6 SNP.
Результаты сравнивали для оценки того, будет ли прогностическая модель, включающая дополнительные SNP, вероятно обладать значительно более высокой точностью прогноза, чем модель, которая содержит только один наиболее значимый SNP из каждого из 2 блоков LD.
Результаты:
Частоты генотипов SNP IL4-Rα
Всего 94 пациентов, подвергнутых лечению антителом 01951/G12, и 102 пациентов, подвергнутых лечению плацебо, генотипировали по 9 SNP в гене IL4-Rα, перечисленных в таблице 5. Два пациента, оба подвергнутые лечению плацебо, обладали несоответствием по полу между тем, как зарегистрировано в базе клинических данных, и тем, как определено генетически, и удалены из анализа. Оба были из одной и той же страны, что позволяет предполагать возможный обмен образцов.
Двенадцать из 94 пациентов, подвергнутых лечению антителом 01951/G12 (12,8%), испытывали по меньшей мере одно обострение астмы на протяжении исследования, по сравнению с 23 из 100 пациентов, подвергнутых лечению плацебо (23,0%). Распределение соответствовало равновесию Харди-Вайнберга для каждого SNP.
Таблица 0-1 Распределение частот генотипов в исследованиях антитела 01951/G12 и питракинра
|
Частоты генотипов рассчитывали посредством объединения групп с лечением антителом 01951/G12 и плацебо.
Ассоциация между SNP IL4-Rα и риском обострений
Доля пациентов, подвергнутых лечению антителом 01951/G12, которые испытали по меньшей мере одно обострение астмы на протяжении исследования, показана на фигуре 2 по классу генотипов для каждого из 9 генотипированных SNP, вместе с уровнями значимости для соответствующих тестов ассоциации между SNP и риском обострений. Шесть из этих 7 SNP также являлись значимо ассоциированными с ответом на антитело 01951/G12, с значениями p в диапазоне от 0,005 до 0,015, в то время как оставшиеся SNP обладали близкой значимостью со значением p 0,066. Более того, для SNP в общем показан аддитивный эффект на риск обострений в обоих исследованиях, что означает, что риск для гетерозигот являлся в общем промежуточным по отношению к двум гомозиготным классам, что позволяет предполагать, что риск обострений для обоих видов терапии увеличивается с количеством аллелей риска, несомых индивидуумом, в ассоциированном SNP.
Поскольку хорошо известно, что раса являются общераспространенным искажающим фактором в исследованиях генетических ассоциаций, тестирование ассоциаций для пациентов, подвергнутых лечению антителом 01951/G12, повторяли с использованием только пациентов, самоопределяемых как европеоиды, но значения p не изменялись. Это, вероятно, происходит из-за того, что 89 из 94 пациентов (94,7%) являлись европеоидами, и все 5 не европеоидов были из стран, где не присутствовало обострений.
Следует отдельно отметить, что в исследовании антитела 01951/G12, для каждого из 7 SNP существовал один гомозиготный класс, для которого не наблюдали обострений среди пациентов, подвергнутых лечению антителом 01951/G12, результат, который маловероятно мог возникнуть посредством случайного шанса.
По результатам для двух нижних SNP, перечисленных в таблице 5, которые кодируют аминокислотные замены в рецепторе IL-4RA, показано более слабое доказательство ассоциации с значениями p 0,091 и 0,10.
Доля пациентов, подвергнутых лечению плацебо, в исследовании антитела 01951/G12, которые испытывали по меньшей мере одно обострение астмы, показана на фигуре 3 по классам генотипов для 9 генотипированных SNP. В отличие от результатов группы антитела 01951/G12, для пациентов, подвергнутых лечению плацебо, не показано доказательств ассоциации между генотипом и риском обострений для какого-либо из SNP.
SNP, показанные во всех таблицах и на фигурах для этого фармакогенетического анализа, расположены по порядку в соответствии с их физической локализацией в гене.
Ассоциация между SNP IL4-Rα и другими конечными точками для астмы
9 генотипированных SNP также оценивали у пациентов, подвергнутых лечению антителом 01951/G12, для доказательства ассоциации с 3 другими конечными точками для астмы: изменением от исходного значения для баллов ACQ7, процентным изменением от исходного значения для FEV1 и процентным изменением от исходного значения для IgE. Все конечные точки оценивали на неделе 24. Поскольку все тестирования ассоциаций оценивали гипотезу аддитивного эффекта аллелей (т.е. то, что средний ответ среди гетерозигот является промежуточным между ответами для двух классов гомозигот), в таблице 6 показан эффект одной дополнительной копии минорного аллеля (т.е. менее распространенного аллеля в этой выборке) на каждую из этих 3 конечных точек. Например, по аддитивной модели, носительство одной дополнительной копии минорного аллеля в rs8832 - независимо от того, носительство ли это 1 копии вместо 0, или 2 копий вместо 1 - ассоциировано со средним увеличением от исходного значения для FEV1 на 7,6%. Таким образом, носительство 2 копий вместо 0 ассоциировано со средним увеличением на 15,2%.
Соответствующие результаты для конечной точки обострения астмы также представлены для сравнения. В этом случае уровень эффекта представляет собой отношение шансов, ассоциированное с одной дополнительной копией минорного аллеля. Таким образом, носительство одной дополнительной копии минорного аллеля в rs8832 ассоциировано с увеличением шансов испытать обострение в 3,8 раз. Поскольку отношения шансов являются мультипликативными, носительство 2 копий вместо 0 ассоциировано с увеличением шансов испытать обострение в 3,82 или 14,6 раз.
Никакие SNP не достигали или не приближались к статистической значимости для конечных точек для ACQ7 или IgE, даже без какой-либо коррекции на множественные сравнения. Для конечной точки FEV1, 4 SNP достигали значимости, включая кластер из 3 SNP с p<0,002 (rs8832, rs1029489 и rs4787956). Однако, эффект этих 3 SNP на ответ на антитело 01951/G12 проявлялся в обратном направлении по сравнению с эффектом, наблюдаемым для обострений астмы: конкретно, для каждого из 3 SNP минорный (менее распространенный в выборке) аллель был ассоциирован с более высоким риском обострений, но также со средним увеличением от исходного уровня для FEV1. Другой SNP, rs1110470, также достигал пограничной значимости, но также в обратном направлении по сравнению с наблюдаемым для обострений, и никакие другие SNP в его окружении не достигали или не приближались к значимости.
Таблица 6 Результаты тестирования ассоциаций между SNP и конечными точками для астмы на неделе 24
|
1 Среднее абсолютное изменение для ACQ7 от исходной точки до недели 24, ассоциированное с одной дополнительной копией минорного аллеля
2 Среднее процентное изменение для FEV1 или IgE от исходной точки до недели 24, ассоциированное с одной дополнительной копией минорного аллеля
3 Отношение шансов для риска испытать обострение астмы между исходной точкой и неделей 24, ассоциированное с одной дополнительной копией минорного аллеля
4 Не поддается расчету, поскольку все пациенты с обострением обладали одинаковым генотипом (AA)
Тест перестановки для оценки суммарной значимости ассоциаций с обострением. Тест перестановки проводили для оценки того, насколько вероятно было бы получить результаты для ассоциаций, сходные с результатами для обострений для антитела 01951/G12, если бы в реальности не присутствовало ассоциации между SNP и риском обострений - т.е. в качестве артефакта по случайному шансу. Представляло особый интерес обнаружение того, что для каждого из верхних 7 SNP, перечисленных в таблице 5, анализ с антителом 01951/G12 выявил один гомозиготный класс, в котором не присутствовало обострений; таким образом, тест перестановки был сфокусирован на том, насколько часто можно было бы ожидать возникновения этого по случайному шансу. Среди 1000 полученных подвергнутых перестановке наборов данных, только для 2 получили результат, в котором каждый из 7 SNP обладал одним гомозиготным классом без обострений. Таким образом, вероятность наблюдения этого результата, если бы не присутствовало истинных ассоциаций, определяли как 0,002.
Анализ неравновесного сцепления SNP
Аллели, локализованные поблизости друг от друга на хромосоме, проявляют тенденцию к совместному наследованию. Когда эти аллели также обладают сходными частотами в популяции, они с вероятностью коррелируют друг с другом, так что знание генотипа субъекта по данному SNP может позволять прогнозировать генотип того же субъекта по соседнему SNP с относительно высокой точностью. Эту концепцию обозначают как «неравновесное сцепление» (LD). Значение для исследований генетических ассоциаций имеет то, что для множества SNP в небольшой области можно получить доказательство ассоциации с фенотипом; однако, поскольку эти SNP могут находится в LD друг с другом, любой данный SNP может не обеспечивать существенный уровень независимого доказательства ассоциации с фенотипом, помимо того, который уже получен от других соседних SNP.
Известно, что LD возникает в структуре «блоков» на всем протяжении генома. Каждый блок, или «кластер», содержит группу SNP, так что корреляции между парами SNP в пределах одного и того же блока являются относительно высокими, в то время как корреляции между парами SNP в различных блоках являются относительно низкими. Анализ LD между верхними 7 SNP, перечисленными в таблице 5, и риском обострений для антитела 01951/G12 выявил присутствие 2 блоков LD, как проиллюстрировано на фигуре 4. Числовые значения в ячейках представляют собой значение r2 (умноженное на 100), стандартное измерение корреляции - или силы LD - между соответствующими парами SNP. Значение r2 100 указывает на полную корреляцию 2 SNP, в то время как 0 указывает на полную независимость.
Как можно видеть на фигуре, первые 4 SNP формируют один блок, внутри которого корреляции между парами SNP лежат в диапазоне от 56 до 95. SNP rs3024530 и rs1805010 почти полностью коррелируют. Последние 3 SNP формируют второй блок, с попарной корреляцией в диапазоне от 59 до 80. В отличие от этого, ни для одного SNP из первого блока не показано высокой корреляции с каким-либо SNP из второго блока, где наивысшая попарная корреляция составляет 32.
Анализ посредством перекрестной проверки для оценки оптимального количества SNP для прогнозирования
Анализ посредством перекрестной проверки проводили для сравнения способов использования 6 из верхних 7 SNP IL4-Rα, перечисленных в таблице 5 (rs3024530 исключали, поскольку он почти полностью коррелировал с rs1805010), для прогнозирования риска обострений астмы для пациента после лечения с помощью антитела 01951/G12. Поскольку анализ LD идентифицировал 2 в основном независимых блока SNP, для каждого из которых показано доказательство ассоциации с риском обострений, разумно ожидать, что прогностическая модель с представительством из обоих блоков, вероятно, будет обладать лучшей способностью идентифицировать пациентов с низким риском обострений, чем модель с представительством только из одного блока. Однако, это поднимает вопрос, будет ли является достаточным выбор только одного SNP из каждого блока, или будет ли предоставлять преимущества включение дополнительных SNP. Анализ посредством перекрестной проверки показал, что ожидаемая способность прогностической модели идентифицировать пациентов с низким риском обострений астмы существенно не улучшалась, если включали дополнительные SNP помимо одного из каждого блока.
Дополнительная информация
Распределение частот генотипов для 7 SNP перечислено для стран и этнических популяций в таблицах 7 и 8.
Таблица 7 Распределение частот генотипов для SNP IL4-Rα по странам
|
Таблица 8 Распределение частот генотипов для SNP IL4-Rα по этническим популяциям
|
Источник: база данных dbSNP, Национальный центр биотехнологической информации
В этом исследовании обнаружено, что 7 верхних SNP, перечисленных в таблице 5, ассоциированы с риском обострений среди пациентов, подвергнутых лечению антителом 01951/G12. Для шести из 7 SNP получили значимые значения p в диапазоне от 0,005 до 0,015, в то время как оставшиеся SNP приближались к значимости. Такие же значения p получали, когда анализ ограничивали европеоидными пациентами для уменьшения риска смещения. Более того, конкретный характер ассоциации ответа на антитело 01951/G12 с большинством SNP обладает аддитивной связью с риском обострений; т.е. наблюдали, что риск среди гетерозигот является промежуточным для риска среди 2 гомозиготных классов. Наконец, наблюдали, что среди пациентов, подвергнутых лечению антителом 01951/G12, каждый из 7 SNP обладает конкретным гомозиготным классом, в котором не присутствует обострений. Тест перестановки показал, что вероятность наблюдения этого результата в отсутствие каких-либо истинных ассоциаций составляет 0,002. Взятые вместе, вместе с важностью гена IL4-Rα для механизма действия антитела 01951/G12, эти результаты позволяют предполагать высокую вероятность того, что на риск обострений астмы у пациентов, подвергнутых лечению антителом 01951/G12, влияют SNP в гене IL4-Rα.
Кроме того, два других SNP в гене IL4-Rα (перечисленные как два нижних SNP в таблице 5) оценивали по возможной ассоциации с риском обострений у пациентов, подвергнутых лечению антителом 01951/G12, из-за опубликованной для них ассоциации с фенотипами заболевания астмы и поскольку они кодируют аминокислотные замены. Хотя оба являлись менее значимыми, чем другие 7 SNP (p=0,091 и 0,10).
Не обнаружено доказательств ассоциации между SNP в гене IL4-Rα и риска обострений среди пациентов, подвергнутых лечению с помощью плацебо, в исследовании антитела 01951/G12. Взятое вместе со знаниями о механизме действия антитела 01951/G12, это позволяет предположить, что влияние этих SNP на риск обострений является специфическим для механизма действия лекарственного средства и не отражает более общую ассоциацию с тяжестью заболевания. Более того, не обнаружено ассоциации между этими SNP и изменением от исходного балла ACQ7 или уровня IgE, и только немногие SNP являлись значимо ассоциированными с изменением FEV1, где эти ассоциации указывают в противоположном направлении по сравнению с ассоциациями, наблюдаемыми для риска обострений. Это позволяет предположить, что генетический механизм, влияющий на чувствительность пациента к обострениям, отличается от генетического механизма для других конечных точек астмы.
Твердое доказательство этой фармакогенетической ассоциации среди пациентов, подвергнутых лечению антителом 01951/G12, позволяет предполагать применение конкретных генотипов или комбинации генотипов в этих SNP для прогнозирования риска для пациента обострений астмы после лечения с помощью антитела 01951/G12.
Как показано в таблице 5, rs1805010 вызывает аминокислотную замену, в то время как rs8832 находится в 3ʹ-нетранслируемой области (UTR), в области, как известно, влияющую на уровень транскрипции генов. Поскольку rs1805010 находится в первом блоке LD, в то время как rs8832 находится во втором, эти 2 SNP можно использовать в разработке прогностической модели для риска обострений. Сводная таблица частот генотипов для этих 2 SNP в исследовании CQAX576A2207 показана в таблице 9.
Таблица 9 Сводная таблица частот генотипов для rs1805010 и rs8832
|
Частоты генотипов рассчитывали посредством объединения групп антитела 01951/G12 и плацебо.
ПРИМЕР 4
Способы оценки уменьшения обострений астмы известны специалисту в данной области и включают в себя применение ACQ-5 и/или AQLQ-S:
|