Результат интеллектуальной деятельности: Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина]
Вид РИД
Изобретение
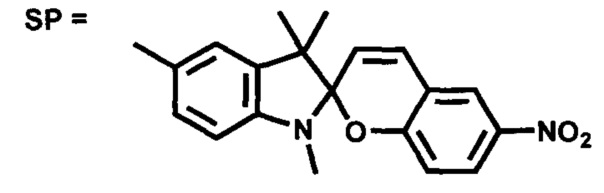
Изобретение относится к новым соединениям в ряду индолиновых спиробензопиранов (SP), которые могут быть использованы в качестве фотоактивных комплексообразователей с квантовыми точками (QD) и катионами металлов. Изобретение может найти применение в области нанофотоники для создания молекулярных переключателей, сенсорных устройств, для детекции ионов и для расширения компонентной базы устройств молекулярной электроники.
Оптическими свойствами таких систем можно обратимо управлять, воздействуя светом с контролируемой длиной волны. Хорошо известно, что в молекулах спиропиранов при освещении светом с длиной волны ≤ 300-350 нм происходит раскрытие пиранового цикла с образованием окрашенной мероцианиновой формы (В). Данный процесс обратим: обратный переход в спироформу (А) происходит или путем самопроизвольной циклизации в темноте, или при освещении мероцианиновой формы видимым светом.
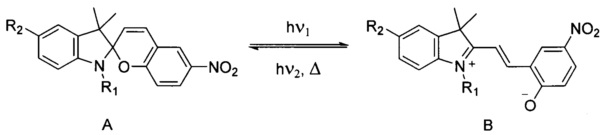
Спектральные свойства и параметры фотопревращений спиробензопиранов зависят от типа и места расположения имеющихся в молекуле заместителей, поэтому направленное варьирование природы и места введения терминальной якорной группы (спейсера), позволяет проводить поиск новых структур фотохромов с требуемыми фотохимическими характеристиками и заданной селективностью связывания с целевыми лигандами и мишенями.
Известно, что введение заместителей по индолиновой части молекулы спиробензопиранов не приводит к существенным изменениям максимума поглощения окрашенной мероцианиновой формы [Панцырный В.И., Гальберштам М.А., Донская Н.А. О влиянии заместителей в положениях 5- и 8'- на скорость реакции темнового обесцвечивания фотоокрашенных растворов 1,3,3-триметилспиро[индолин-2,2'-[2Н-1]бензопиранов] // Химия гетероциклических соединений. 1973, №5, с. 653-658], что позволяет вводить реакционно-способные спейсеры различной природы путем прямой модификации индолинового фрагмента молекулы спиропирана. В частности, разработаны способы направленной модификации спиробензопиранового фотохрома по 5-положениюиндолинового фрагмента [RU 2458927, С1, опубл. 20.08.2012].
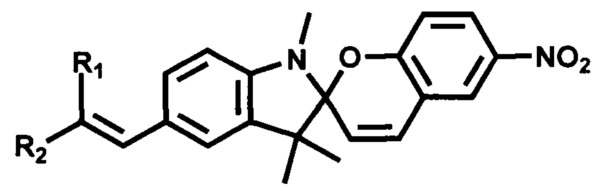
Серия фотохромных производных 5'-винил-6-нитроспиробензопиранов, в которых где R1=R2=H; R1=CN, R2=H; R1=CHO, R2=H; R1=NO2, R2=H; R1=CN, R2=CN; R1=CO2CH3, R2-CN; R1=R2=C(O)-O-C(CH3)2-O-(O)C получена олефинированием по Виттигу или Хорнеру-Эммонсу карбонильного предшественника илидами или анионами фосфонатов, или нуклеофильным присоединением по карбонильной группе реагентов, содержащих активные метальные или метиленовые группы (нитрометан, малонодинитрил, цианоуксусная кислота и ее эфиры, кислота Мельдрума). Исходным соединением служил 6-нитро-1',3',3'-триметил-5'-формилспиро[2Н-1-бензопиран-2,2'-индолин], способ получения которого защищен патентом [RU 2358977, С1, опубл. 20.06.2009].
Описаны 6-нитро-замещенные спиробензопираны, содержащие реакционно-способные спейсеры с терминальной тройной связью, присоединенные по 5' положению индолиновой части молекулы и предназначенные для модификации компонентов и фрагментов нуклеиновых кислот по реакции Соногаширы [Laptev A.V.; Lukin A.Yu.; Belikov N.E.; Barachevskii V.A.; Demina O.V.; Khodonov A.A.; Varfolomeev S.D.; Shvets V.I. Ethynyl-equipped Spirobenzopyrans as Promising Photochromic Markers for Nucleic Acid Fragments // Mendeleev Communications 2013, v. 23, №3, p. 145-146]. В работе [Laptev A.V.; Lukin A.Yu.; Belikov N.E.; Demina O.V.; Khodonov A.A.; Shvets V.I. New maleimide spirobenzopyran derivatives as photochromic labels for macromolecules with sulfhydryl groups // Mendeleev Communications, 2014, v. 24, p. 245-246] представлены 5'-малеинимидные производные спиробензопиранов, предназначенные для модификации белковых фрагментов, содержащих остатки цистеина.
Общим недостаткам упомянутых фотоактивных спиропирановых производных является отсутствие в их структуре серу-содержащих групп, что ограничивает возможности их применения для модификации таких неорганических наноструктур, как квантовые точки.
Описаны гибридные фотоактивные системы, представляющие собой комплексы катионов или наночастиц металлов или наносистемы на основе квантовых точек с фотохромными лигандами, с терминальной якорной серу-содержащей-группой, расположенной в разных положениях молекулы фотохрома в качестве ионофорного фрагмента молекулы. Например, описана фотохромная система на основе квантовых точек QD CdSe-ZnS и CdS и фотохромного лиганда 2-[3',3'-диметил-6-нитроспиро(2H-1-бензопиран-2,2'-индолин)-1'-ил]этилового эфира 5-(1,2-дитиолан-3-ил)пентановой кислоты, в которой бидентантный серу-содержащий фрагмент этилового эфира 5-(1,2-дитиолан-3-ил)пентаноата бьш введен в положение N1 индолинового фрагмента молекулы спиропирана [Tomasulo М., Yildiz I., Raymo F.M. Luminescence Modulation with Semiconductor Quantum Dots and Photochromic Ligands // Australian J. Chem., 2006, v. 59, №3, p. 175-178; Tomasulo M., Yildiz I., Raymo F.M. Nanoparticle-induced transition from positive to negative photochromism // Inorganic Chim. Acta, 2007, v. 360, №3, p. 938-944;]. Топография подобных фотоактивных систем на основе спиропирановых лигандов, содержащих спейсеры с терминальными серу-содержащими группами по положению N1, имеет пространственные ограничения, допускающие реализацию лишь перпендикулярной взаимной ориентации фрагментов как в спиро- (А), так и в фотоиндуцированной мероцианиновой формах (В) фотохрома, что отрицательно сказывается на квантовом выходе реакции раскрытия пиранового цикла и времени жизни фотоиндуцированной мероцианиновой формы (В). Подходы к их получению требуют применения сложных и многостадийных методов формирования молекулы целевых спиропиранов.
В качестве альтернативного подхода авторами была предложена структура фотоактивного лиганда, содержащая серу-содержащий фрагмент по положению 5' индолиновой части молекулы фотохрома [Звездин К.В., Беликов Н.Е., Лаптев А.В., Лукин А.Ю., Демина О.В., Левин П.П., Бричкин С.Б., Спирин М.Г., Разумов В.Ф., Швец В.И., Ходонов А.А. Новые гибридные фотохромные материалы с переключаемой флуоресценцией // Российские нанотехнологии, 2012, т. 7, №5-6, с. 112-118]. В работе описано получение, взятого в качестве прототипа, 2-меркаптоэтиламида 3-[6-нитро-1',3',3'-триметилспиро(2H-1-бензопиран-2,2'-индолин)-5'-ил]пропеновой кислоты и его применение в качестве фотохромного лиганда для модификации поверхности квантовых точек QD CdSe. Продукт получают активированием карбоксильной группы 3-[6-нитро-1',3',3'-триметилспиро(2H-1-бензопиран-2,2'-индолин)-5'-ил]пропеновой кислоты при помощи метода смешанных ангидридов с использованием изобутилхлорформиата с последующим ее превращением в целевой амид взаимодействием с цистеамином. Топография и размеры молекулы этого лиганда существенно отличаются от ранее известных производных, где спейсер вводился в положение N1. К недостаткам прототипа следует отнести невысокие суммарные выходы целевого соединения, а также ограниченные возможности диверсификации структуры молекулы целевого лиганда из-за отсутствия коммерчески доступных источников серу-содержащих аминов с различной длиной спейсера. Также следует отметить, что прототип характеризуется невысокими значениями эффективности фотоокрашивания ΔDBфот=0,25-0,65.
Проблема, решаемая настоящим изобретением, состоит в расширении арсенала спиробензопирановых фотохромных лигандов, которые могут быть применены в качестве фотоактивных комплексообразователей с квантовыми точками и катионами металлов.
Проблема решена предлагаемой серией новых фотоактивных сложноэфирных производных 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолина] общей формулы
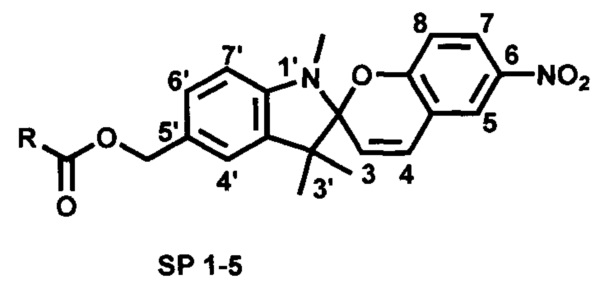
где R=
HS-(CH2)n-; где n=1 (SP 1), n=2 (SP 2), n=10 (SP 3);
HOOC(CH2)2SS(CH2)2- (SP 4);
Сущность изобретения состоит в том, что в качестве лигандов для образования комплексов между фотоиндуцированной мероцианиновой формой спиропирановых фотохромных соединений с квантовыми точками и ионами металлов предложены новые сложные эфиры 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолина], содержащие фрагмент с терминальной серу-содержащей группой. Наличие нитро-группы в 6-положении фотохромного звена необходимо для проявления выраженных фотохромных свойств. Предлагаемые структуры соединений SP 1-5 отличаются от прототипа строением спейсеров, обеспечивающих комплексообразование молекулы фотохрома с поверхностью квантовых точек. Соединения SP 1-5 также способны образовывать фотоактивные комплексы с катионами некоторых металлов.
Сущность изобретения поясняется следующими иллюстрациями:
На Фиг. 1 показаны спектры поглощения растворов соединения SP 3 в хлороформе, этаноле, тетрагидрофуране и толуоле до УФ облучения (кривые 1, 3, 5 и 7 соответственно) и после УФ облучения (кривые 2, 4, 6, 8 соответственно). Концентрация растворов С=10-5÷5×10-5 моль/л.
На Фиг. 2 показаны спектры флуоресценции в хлороформе: препарат квантовых точек QD CdSe, 3.7 нм (кривая 9); мероцианиновая форма лиганда SP 5 (кривая 10); конъюгат SP 5-QD CdSe (кривая 11).
На Фиг. 3 показаны спектры поглощения в этаноле: спиро-форма лиганда SP 5 (кривая 12); мероцианиновая форма лиганда SP 5 (кривая 13); комплекс мероцианиновой формы лиганда SP 5 с Al(NO3)3 (кривая 14); комплекс мероцианиновой формы лиганда SP 5 с La(NO3)3 (кривая 15).
На Фиг. 4 показаны спектры поглощения в этаноле: спиро-форма лиганда SP 4 (кривая 16); мероцианиновая форма лиганда SP 4 (кривая 17); комплекс мероцианиновой формы лиганда SP 4 с Al(NO3)3 (кривая 18), комплекс мероцианиновой формы лиганда SP 4 с La(NO3)3 (кривая 19).
Получение заявленных соединений SP 1-5 показано на схемах 1-4, где
Ключевое соединение 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолин] (2) получают по ранее разработанному нами методу [Laptev A.V.; Lukin A.Yu.; Belikov N.E.; Barachevskii V.A.; Demina O.V.; Khodonov A.A.; Varfolomeev S.D.; Shvets V.I. Ethynyl-equipped Spirobenzopyrans as Promising Photochromic Markers for Nucleic Acid Fragments // Mendeleev Communications 2013, v. 23, №3, p. 145-146, DOI: 10.1016/j.mencom.2013.05.008, Supplementary Materials] восстановлением 6-нитро-1',3',3'-триметил-5'-формилспиро[2H-1-бензопиран-2,2'-индолина] (1) борогидридом натрия.
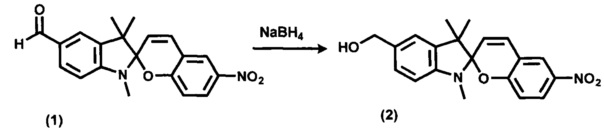
Исходный 6-нитро-1',3',3'-триметил-5'-формилспиро[2H-1-бензопиран-2,2'-индолин] (1) получают согласно [RU 2358977 С1, опубл. 20.06.2009].
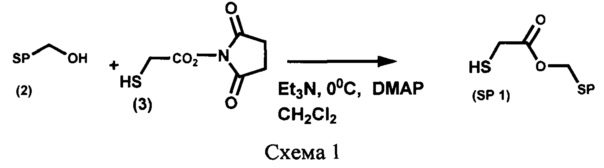
Пример 1. Получение [6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолин]-5'-ил]метилового эфира 2-меркаптоуксусной кислоты (SP 1) (Схема 1)
К охлажденному до -5°С раствору 300 мг (1,59 ммоль) N-гидроксисукцинимидного эфира тиогликолевой кислоты (3) и 352 мг (1 ммоль) 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолина] (2) в 30 мл абсолютного дихлорометана при перемешивании в атмосфере аргона добавляют 0,44 мл (3,18 ммоль) триэтиламина и затем - 20 мг (0,159 ммоль) 4-(диметиламино)пиридина (DMAP). Реакционную смесь оставляют при перемешивании при 20°С в течение 3 дней, затем разбавляют 100 мл дихлорометана, промывают 1М раствором соляной кислоты до рН 4-5, водой до рН 7, органический экстракт сушат над сульфатом натрия и затем растворитель удаляют.
Для выделения целевого продукта используют флеш-хроматографию на силикагеле, элюент - смесь дихлорометана с 95% этанолом с градиентом последнего от 0 до 40%.
Выход продукта реакции SP 1 218 мг (51%), в виде масла, Rf 0,58, система петролейный эфир (т. кип. 40-70°С) - этилацетат 8:2, по объему, пластинка "Kieselgel 60F254", детекция пятен воздействием на проявленную пластинку УФ-света.
Спектр ЯМР 1Н (500 МГц, CDCl3, δ, м.д., J/Гц): 1,18 (3Н, с, 3'а-СН3), 1,28 (3Н, с, 3'b-СН3), 2,71 (2Н, т, J 7,1, 2''-СН2СО), 2,72 (3Н, с, 1'-СН3), 5,01 (2Н, с, 5'-СН2), 5,84 (1Н, д, J 10,4, 3-Н), 6,51 (1H, д, J 7,8, 7'-Н), 6,76 (1Н, д, J 8,6, 8-Н), 6,92 (1Н, д, J 10,4, 4-Н), 7,11 (1Н, с, 4'-Н), 7,18 (1Н, д, J 7,8, 6'-Н), 7,99 (1Н, д, J 2,4, 5-Н), 8,01 (1Н, дд, J 8,8/2,8, 7-Н).
Масс-спектр [m/z]: 426,1 (М+).
Найдено (%): С 62,05; Н 5,29; N 6,52. C22H22N2O5S. Вычислено (%): С, 61,96; Н, 5,20; N, 6,57.
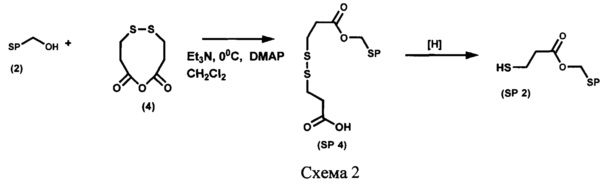
Пример 2. Получение 6-карбокси-1-{6-нитро-1',3',3'-триметилспиро[(2H-1-бензопиран-2,2'-индолин)-5'-ил]метоксикарбонил}-3,4-дитиагексана (SP 4) (Схема 2)
Необходимый реагент для проведения процесса ацилирования спирта (2)-ангидрид 3,3'-дитио-3,3'-дипропионовой кислоты (4) получают с выходом 65%, как описано в работе [Liu С., Yuan J., Luo X., Chen M., Chen Z., Zhao Y., Li X. Folate-Decorated and Reduction-Sensitive Micelles Assembled from Amphiphilic Polymer-Camptothecin Conjugates for Intracellular Drug Delivery // Mol. Pharmaceutics, 2014, v. 11, №11, p. 4258-4269].
К раствору, содержащему 218 мг (1,13 ммоль) ангидрида 3,3'-дитио-3,3'-дипропионовой кислоты (4), 200 мг (0,568 ммоль) 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолина] (2) и 7 мг (0,057 ммоль) 4-(диметиламино)пиридина (DM АР) в 30 мл абсолютного дихлорометана, при перемешивании в атмосфере аргона по каплям добавляют раствор 0,16 мл (1,13 ммоль) триэтиламина в 2 мл абсолютного дихлорометана и перемешивают при 20°С в течение 48 ч, затем реакционную массу промывают 3% раствором соляной кислоты до рН 4-5, водой до рН 7, органический слой сушат над сульфатом натрия и растворитель удаляют. Целевой продукт SP 4 выделяют при помощи колоночной хроматографии на силикагеле, элюент - смесь петролейного эфира (т. кип. 40-70°С) с этилацетатом с градиентом последнего от 0 до 100%.
Выход продукта реакции 133 мг (43%) в виде масла, Rf 0,28, система - петролейный эфир (т. кип. 40-70°С) - этилацетат 4:6 по объему, пластинка "Kieselgel 60F254", детекция пятен воздействием на проявленную пластинку УФ-света.
Спектры ЯМР 1Н (500 МГц, CDCl3, δ, м.д., J/Гц): 1,18 (3Н, с, 3'а-СН3), 1,29 (3Н, с, 3'b-СН3), 2,74 (3Н, с, 1'-СН3), 2,77 (4Н, тд, J 7,1/2,6, 2'',2'''-СН2СО), 2,90 (2Н, т, J 7,1, 2'''-СН2), 2,95 (2Н, т, J 7,1, 3''-СН2), 5,09 (2Н, с, 5'-СН2), 5,84 (1Н, д, J 10,3, 3-Н), 6,51 (1Н, д, J 7,9, 7'-Н), 6,76 (1Н, д, J 8,6, 8-Н), 6,92 (1Н, д, J 10,3, 4-Н), 7,08 (1Н, д, J 1,4, 4'-Н), 7,20 (1Н, дд, J 7,9/1,5, 6'-Н), 7,99 (1Н, д, J 2,4, 5-Н), 8,01 (1Н, дд, J 8,8/2,7, 7-Н).
Пример 3. Получение [6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолин]-5'-ил]метилового эфира 3-меркаптопропионовой кислоты (SP 2) (Схема 2)
133 мг (0,024 ммоль) 6-карбокси-1-{6-нитро-1',3',3'-триметилспиро[(2H-1-бензопиран-2,2'-индолин)-5'-ил]метоксикарбонил}-3,4-дитиагексана SP 4 растворяют в 10 мл этанола, добавляют 12 мг борогидрида на полимерной подложке (Amberlite А-26 BH4-форма, Fluka) и встряхивают на шейкере IKA Vortex Genius-3 4 ч, после чего восстановитель отделяют декантированием, промывают 5 мл этанола, этанол упаривают. Целевой продукт SP 2 выделяют при помощи колоночной хроматографии на силикагеле, элюент - смесь петролейного эфира (т. кип. 40-70°С) с этилацетатом с градиентом последнего от 0 до 100%.
Выход продукта реакции 76 мг (71%), в виде масла, Rf 0,87, система петролейный эфир (т. кип. 40-70°С) - этилацетат 4:6 по объему, пластинка "Kieselgel 60F254", детекция пятен воздействием на проявленную пластинку УФ-света.
Спектр ЯМР 1Н (500 МГц, CDCl3, δ, м.д., J/Гц): 1,18 (3Н, с, 3'а-СН3), 1,29 (3Н, с, 3'b-СН3), 2,72 (3Н, с, 1'-СН3), 2,81 (2Н, т, J 7,1, 2''-СН2СО), 3,77 (2Н, т, J 6,0, 3''-СН2), 4,64 (2Н, с, 5'-СН2), 5,85 (1Н, д, J 10,3, 3-Н), 6,52 (1Н, д, J 7,9, 7'-Н), 6,75 (1Н, д, J 8,7, 8-Н), 6,92 (1Н, д, J 10,3, 4-Н), 7.12 (1Н, д, J 1.3, 4'-Н), 7.19 (1Н, дд, J 7.9/1.5, 6'-Н), 7.99 (1Н, д, J 2,6, 5-Н), 8,01 (1Н, дд, J 8,8/2,6, 7-Н).
Масс-спектр [m/z]: 440,5 (М+).
Найдено (%): С 62,65; Н 5,43; N 6,42. C23H24N2O5S. Вычислено (%):С, 62,71; Н, 5,49; N, 6,36.
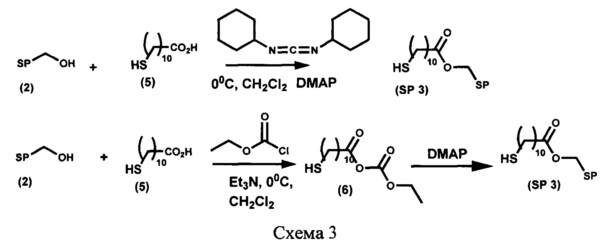
Пример 4. Получение [6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолин]-5'-ил]метилового эфира 11-меркаптоундекановой кислоты (SP 3) (схема 3)
Вариант 1.
К охлажденному до -5°С раствору 47 мг (0,215 ммоль) 11-меркаптоундекановой кислоты (5) в 30 мл абсолютного дихлорометана при перемешивании в атмосфере аргона по каплям добавляют раствор 53 мг (0,256 ммоль) N,N-дициклогексилкарбодиимида в 5 мл абсолютного дихлорометана и перемешивают в течение 30 мин, после чего добавляют раствор 50 мг (0,142 ммоль) 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолина] (2) и 17 мг (0,142 ммоль) 4-(диметиламино)пиридина (DMAP) в 10 мл абсолютного дихлорометана. Через 6 ч перемешивания выпавший осадок N,N-дициклогексилмочевины отделяют фильтрованием, фильтрат промывают 3% раствором соляной кислоты до рН 4-5, водой до рН 7, органический слой сушат над сульфатом натрия и затем растворитель удаляют. Целевой продукт SP 3 выделяют при помощи колоночной хроматографии на силикагеле, элюент - смесь петролейного эфира (т. кип. 40-70°С) с этилацетатом с градиентом последнего от 0 до 100%.
Выход продукта реакции 39 мг (50%), в виде масла, Rf 0,61, система петролейный эфир (т. кип. 40-70°С) - этилацетат 2:1, по объему, пластинка "Kieselgel 60F254", детекция пятен воздействием на проявленную пластинку УФ-света.
Спектр ЯМР 1Н (500 МГц, CDCl3, δ, м.д., J/Гц): 1,18 (3Н, с, 3'а-СН3), 1,24 (3Н, с, 3'b-СН3), 1,26-1,30 (8Н, м, 5''-8''-СН2), 1,31 (2Н, м, 4''-СН2), 1,36 (2Н, т, J 7,2, 9''-СН2), 1,59 (2Н, т, J 7,4, 10''-СН2), 1,61 (2Н, м, 3''-СН2), 2,33 (2Н, т, J 7,4, 2''-СН2), 2,50 (2Н, дд, J 7,4/14,7, 11''-СН2), 2,73 (3Н, с, 1'-СН3), 5,06 (2Н, с, 5'-СН2), 5,84 (1H, д, J 10,4, 3-Н), 6,52 (1Н, д, J 7,9, 7'-Н), 6,76 (1Н, д, J 8,8, 8-Н), 6,92 (1Н, д, J 10,4, 4-Н), 7,07 (1Н, с, 4'-Н), 7,20 (1Н, д, J 7,9, 6'-Н), 7,99 (1Н, д, J 2,6, 5-Н), 8,01 (1Н, дд, J 8,8/2,7, 7-Н).
Масс-спектр [m/z]: 552,3 (М+).
Найдено (%): С 67,29; Н 7,21; N 5,04. C31H40N2O5S. Вычислено (%): С, 67,36; Н, 7,29; N, 5,07.
Вариант 2.
К охлажденному до -5°С раствору 94 мг (0,43 ммоль) 11-меркаптоундекановой кислоты (5) в 30 мл абсолютного дихлорометана при перемешивании в атмосфере аргона по каплям добавляют раствор 0,2 мл (0,86 ммоль) триэтиламина в 2 мл абсолютного дихлорометана, затем - раствор 0,08 мл (0,86 ммоль) этилхлорформиата в 5 мл абсолютного дихлорометана и перемешивают в течение 30 мин, после чего добавляют раствор 100 мг (0,284 ммоль) 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолина] (2) и 34 мг (0,284 ммоль) 4-(диметиламино)пиридина (DMAP) в 10 мл абсолютного дихлорометана. Через 24 ч перемешивания при 20°С реакционную массу промывают 3% раствором соляной кислоты до рН 4-5, водой до рН 7, органический слой сушат над сульфатом натрия и затем растворитель удаляют. Целевой продукт SP 3 выделяют при помощи колоночной хроматографии на силикагеле, элюент смесь петролейного эфира (т. кип. 40-70°С) с этилацетатом с градиентом последнего от 0 до 100%.
Выход продукта реакции 86 мг (55%), в виде масла, Rf 0,61, система петролейный эфир (т. кип. 40-70°С) - этилацетат 2:1 по объему, пластинка "Kieselgel 60F254", детекция пятен воздействием на проявленную пластинку УФ-света.
Физико-химические и спектральные характеристики продукта идентичны образцу, полученному по варианту 1.
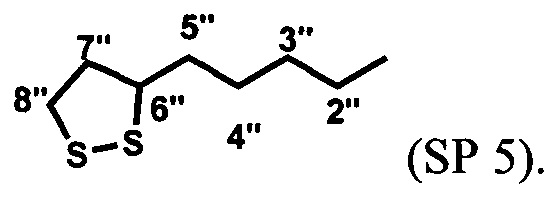
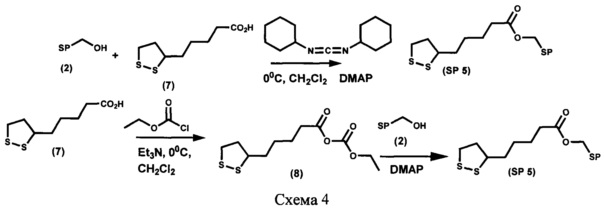
Пример 5. Получение [6-нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолин]-5'-ил]метилового эфира 5-(1,2-дитиолан-3-ил)пентановой кислоты (SP 5) (схема 4)
Вариант 1.
[6-Нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолин]-5'-ил]метиловый эфир 5-(1,2-дитиолан-3-ил)пентановой кислоты SP 5 получают с выходом 72% аналогично примеру 4, вариант 1 с отличием, которое состоит в том, что вместо 11-меркаптоундекановой кислоты (5) в реакции ацилирования используют 5-(1,2-дитиолан-3-ил)пентановую кислоту (7).
Вариант 2.
[6-Нитро-1',3',3'-триметилспиро[2H-1-бензопиран-2,2'-индолин]-5'-ил]метиловый эфир 5-(1,2-дитиолан-3-ил)пентановой кислоты SP 5 получают с выходом 42%, аналогично примеру 4, вариант 2 с отличием, которое состоит в том, что вместо 11-меркаптоундекановой кислоты (5) в реакции ацилирования используют 5-(1,2-дитиолан-3-ил)пентановую кислоту (7).
Спектры ЯМР 1Н (500 МГц, CDCl3, δ, м.д., J/Гц): 1,18 (3Н, с, 3'а-СН3), 1,29 (3Н, с, 3'b-СН3), 1,48 (2Н, м, 4''-СН2), 1,68 (4Н, м, 3''- и 5''-СН2), 1,88 (1H, тд, J 13,8/6,9, 7''-СН2), 2,36 (2Н, т, J 7,4, 2''-СН2), 2,44 (1Н, тд, J 12,1/5,8, 7''-СН2), 2,73 (3Н, с, 1'-СН3), 3,10 (1Н, дт, J 11,1/7,0, 8''-СН2), 3,16 (1H, ддд, J 12,3/7,0/5,6, 8''-СН2), 3,55 (1H, м, 6''-СН), 5,06 (2Н, с, 5'-СН2), 5,84 (1Н, д, J 10,4, 3-Н), 6,52 (1Н, д, J 7,9, 7'-Н), 6,76 (1Н, д, J 8,8, 8-Н), 6,92 (1Н, д, J 10,4, 4-Н), 7.07 (1Н, с, 4'-Н), 7,20 (1Н, д, J 7,9, 6'-Н), 7,99 (1Н, д, J 2,6, 5-Н), 8,01 (1Н, дд, J 8,8/2,7, 7-Н).
ЯМР 13С (126 МГц, CDCl3, δ, м.д.): 20,1/26,1 (3'-СН3), 24,9 (3''-СН2), 28,9 (1'-СН3), 29,1 (4''-СН2), 34,4 (2'-СН2), 34,8 (5''-СН2), 38,7 (8'-СН2), 40,4 (7''-СН2), 52,4 (3'-С), 56,5 (6''-СН), 66,9 (5'-СН2), 106,6 (2-С), 107,0 (7'-С), 115,7 (8-С), 118,8 (4а-С), 121,6 (3-С), 122,7 (4'-С), 122,9 (5-С), 126,1 (7-С), 127,4 (5'-С), 128,6 (4-С), 129,2 (6'-С), 136,8 (3'a-С), 141,2 (6-С), 148,1 (7а'-С), 159,8 (8а-С), 173,7 (1''-С).
Масс-спектр [m/z,]: 540,2 (М+).
Найдено (%): С 62,25; Н 6,03; N 5,12. C28H32N2O5S2. Вычислено (%):С, 62,20; Н, 5,97; N, 5,18.
Физико-химические и спектральные характеристики образцов SP 5, полученные по вариантам 1 и 2, идентичны.
Электронные спектры поглощения полученных соединений регистрируют на спектрофотометре "Shimadzu 1240РС" с приставкой для термостатирования образцов. Фотоиндуцированные формы полученных соединений получают облучением светом ксеноновой лампы Hamamatsu модель Lightingcure - LC8 (Hamamatsu, Япония) через светофильтр УФС-2.
Спектры поглощения фотоиндуцированных форм регистрируют при помощи системы модульных оптоволоконных спектрофотометров фирмы Ocean Optics (США): электронные спектры поглощения получают на спектрофотометре модель HR-2000+, а спектры флуоресценции - на спектрофлуориметре модель USB4000-FL.
Определенные по стандартным методикам спектрально-абсорбционные и спектрально-флуоресцентные характеристики спиро- (А) и мероцианиновых форм (В) при 25°С приведены в Табл. 1 и на Фиг. 1-4.
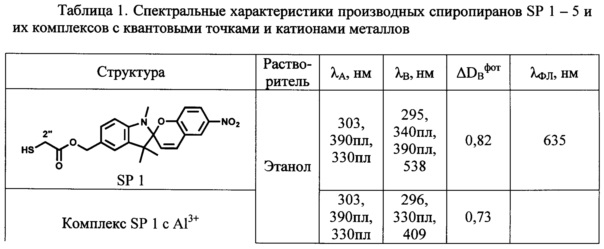
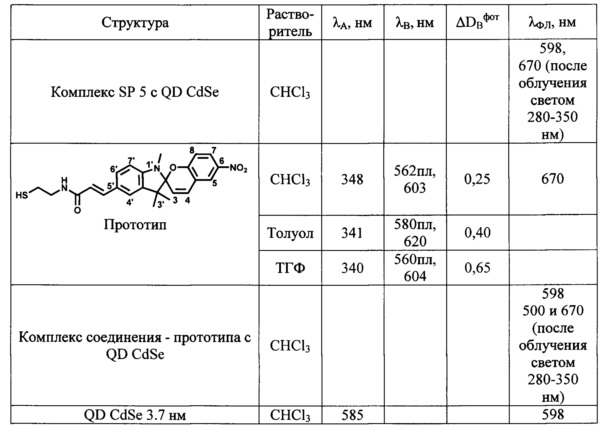
λA, λB - максимумы полос в спектрах поглощения соответственно спиро-формы (А) и фотоиндуцированной мероцианиновой формы (В) производных спиропирана;
λФЛ максимумы полос в спектрах флуоресценции.
ΔDBфот - эффективность фотоокрашивания определяют как максимальное фотоиндуцированное изменение оптической плотности в максимуме полосы поглощения фотоиндуцированной формы И в состоянии фоторавновесия при одинаковой величине оптической плотности (D≈0.8) в максимуме полосы поглощения исходной формы А.
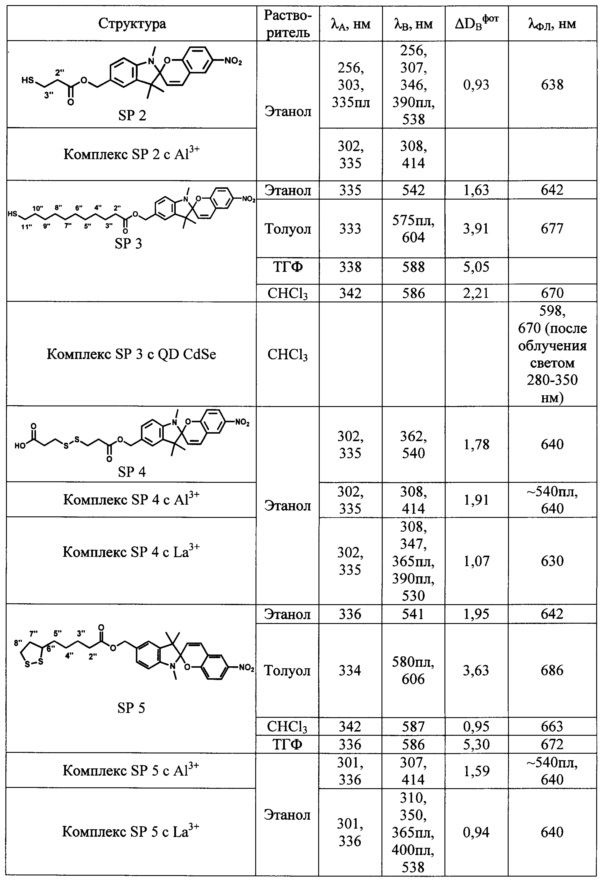
Максимумы λA в спектрах поглощения спиро-форм (А) соединений SP 1-5 расположены в интервале 330-342 нм и мало зависят от природы растворителя. В спектрах поглощения фотоиндуцированных окрашенных мероцианиновых форм (В) соединений SP 1-5 наблюдается явление сольватохромизма. В качестве примера на Фиг. 1 показаны спектры поглощения растворов соединения SP 3 в хлороформе, этаноле, ТГФ и толуоле до УФ облучения (кривые 1, 3, 5 и 7 соответственно) и после УФ облучения (кривые 2, 4, 6, 8 соответственно). В полярном этаноле (кривая 4) спектр фотоиндуцированной мероцианиновой формы соединения SP 3 характеризуется единственной полосой поглощения λB=542 нм, которая смещена в коротковолновую область относительно соответствующей полосы в толуольном растворе λB=604 нм (кривая 8). Спектры поглощения фотоиндуцированных мероцианиновых форм соединений SP 3, SP 5 в толуоле содержат полосу с характерным максимумом и плечом в области 580 нм (Фиг. 1, табл. 1).
Таким образом, все предлагаемые спиробензопираны SP 1-5 обладают ярко выраженными фотохромными свойствами. Все соединения характеризуются значениями эффективности фотоокрашивания ADBфот, в 3-5 раз превышающими соответствующие значения для прототипа.
Возможность применения заявленных соединений в качестве фотоактивных лигандов для образования гибридных структур с квантовыми точками продемонстрирована на следующем примере, в котором в качестве фотохромных лигандов взяты соединения SP 3 и SP 5.
Пример 6. Получение конъюгатов QD CdSe с фотохромными лигандами.
Препарат квантовых точек QD CdSe 3.7 нм приготовлен как описано в работе [Николенко Д.Ю., Бричкин С.Б., Разумов В.Ф. Неизотермический высокотемпературный коллоидный синтез наночастиц CdSe. // Российские нанотехнологии. 2009. Т. 4. №11-12. С. 92-95].
Конъюгаты QD CdSe с фотохромными лигандами получают смешиванием растворов компонентов в хлороформе в соотношении молярных концентраций QD CdSe:SP=1:100. Смесь перемешивают в темноте при комнатной температуре в течение 2 ч.
В табл. 1 сопоставлены спектральные характеристики фотоактивных гибридных комплексов (конъюгатов), включающих квантовые точки QD CdSe и лиганды SP 3 или SP 5, со спектральными характеристиками исходных компонентов.
Флуоресценцию нанокристаллов CdSe возбуждают облучением их раствора в хлороформе УФ-светом через фильтр УФС-2 (300-350 нм). Максимум флуоресценции раствора препарата QD CdSe в хлороформе приходится на 598 нм, ширина полосы на полувысоте 30 нм. На Фиг. 2 в качестве примера сопоставлены спектры флуоресценции в хлороформе: препарата QD CdSe, 3.7 нм (кривая 9), раствора мероцианиновой формы лиганда SP 5 (кривая 10) и конъюгата SP 5-QD CdSe (кривая 11). При освещении образца в этих условиях модификация поверхности квантовых точек QD CdSe фотохромными лигандами вызывает тушение их собственной флуоресценции при λФЛ=598 нм и индукцию флуоресценции мероцианиновой формы спиропиранового фрагмента лиганда при λФЛ=670 нм. При переходе спиропиранового лиганда в окрашенную мероцианиновую форму под действием УФ-облучения флуоресценция исходных квантовых точек QD CdSe исчезает вследствие, по-видимому, явления резонансного переноса энергии флуоресценции. Вместо нее появляется флуоресценция мероцианиновой формы при λФЛ=670 нм. Аналогичные процессы имеют место при использовании в качестве фотохромного лиганда любого из заявленных соединений SP 1-5. Процесс фотоуправляемого циклического переключения флуоресценции комплексов квантовых точек QD CdSe со спиропирановыми лигандами может быть проведен неоднократно простым изменением длины волны возбуждающего света с 300-350 нм на 500-530 нм и обратно.
Все полученные соединения SP 1-5 образуют фотоуправляемые системы с катионами металлов. В качестве примеров в Табл. 1 и на Фиг. 3 и 4 приведены спектральные характеристики фотоактивных комплексов, включающих лиганды SP 1, SP 2, SP 4 и SP 5 с ионами Al3+ и La3+, полученных, как описано в примере 7.
Пример 7. Получение комплексов катионов металлов со спиропирановыми лигандами.
Комплексы фотохромных лигандов с катионами металлов получают добавлением от 1 до 100 эквивалентов нитратов одно-, двух- и трехвалентных металлов к раствору 1 эквивалента лиганда в этаноле и последующей засветкой образца светом ксеноновой лампы фирмы Hamamatsu модель Lightingcure - LC8 (Hamamatsu, Япония) через светофильтр УФС-2. Процесс контролируют регистрацией спектров поглощения в диапазоне длин волн 350-700 нм.
Образцы фотохромных лигандов растворяют в этаноле (С=10-5÷5×10-5 моль/л), измеряют спектры поглощения растворов, определяют максимумы полос поглощения. Затем растворы облучают УФ светом ксеноновой лампы LC-8 фирмы "Hamamatsu" через светофильтр УФС-2, повторно измеряют спектры поглощения растворов и определяют максимумы полос поглощения в видимой области спектра.
Совпадение максимумов полос поглощения фотоиндуцированной мероцианиновой формы с максимумом этой формы в растворе, содержащем ионы металла, свидетельствует об отсутствии в растворе комплексов с этим катионом.
Об образовании комплекса свидетельствует гипсохромный сдвиг основной полосы фотоиндуцированной мероцианиновой формы ΔλB=λB(свободный лиганд)-λВ(комплекс).
Обнаружено, что изменения максимума полосы поглощения при λB=530-540 нм мероцианиновой формы спиропирановых лигандов при взаимодействии с нитратами лития, натрия, калия, магния, кальция, бария, кобальта, никеля не превышают 3-5 нм и не представляют практического интереса.
Катионы Al3+ взаимодействуют с мероцианиновой формой лигандов с образованием комплексов с гипсохромным сдвигом максимума полосы поглощения ΔλB=124-129 нм.
Таким образом, приведенные данные подтверждают достижение технического результата - получение серии новых спиробензопирановых фотохромных лигандов, способных выступать в качестве фотоактивных комплексообразователей с квантовыми точками и катионами металлов.
![Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина]](https://fips.edrid.ru/images/rid/27/a0/ae/729d8ed3f84bd78acae70b34edaf1313.jpg)
![Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина]](https://fips.edrid.ru/images/rid/27/a0/ae/ada3f45bbae67733666086b22be148bb.jpg)
![Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина]](https://fips.edrid.ru/images/rid/27/a0/ae/175c59330b0ea7ee67ac0bb149502f5a.jpg)
![Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина]](https://fips.edrid.ru/images/rid/27/a0/ae/f360945388825e10e56017c497b36b19.jpg)
![Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина]](https://fips.edrid.ru/images/rid/27/a0/ae/140bc2b0465e09a67fe9597ab388a56e.jpg)
![Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина]](https://fips.edrid.ru/images/rid/27/a0/ae/ddaf0c8af3980345c38dea57994b3a83.jpg)

