Результат интеллектуальной деятельности: Способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции
Вид РИД
Изобретение
Предлагаемое изобретение относится к области ветеринарной биотехнологии, молекулярно-генетической диагностики вирусных болезней животных, научных исследований в ветеринарии, диагностическому способу обнаружения вируса лейкоза крупного рогатого скота (ВЛКРС) в тканях и секретах животных с использованием молекулярно-биологического метода.
В комплексе мероприятий по оздоровлению стад от лейкоза крупного рогатого скота (КРС) ведущее место принадлежит диагностике.
Проблема своевременной эффективной диагностики лейкоза КРС в связи с крайне неблагополучной эпизоотической ситуацией по данному заболеванию и отсутствием средств специфической профилактики, стоит по-прежнему остро.
При проведении оздоровительных мероприятий в хозяйствах с высоким уровнем инфицированности, выращивание свободного от вируса молодняка с последующей заменой им маточного поголовья для формирования здорового поголовья является основным направлением работы. Совершенствование методов прижизненной диагностики лейкоза КРС у молодняка КРС на самых ранних стадиях инфекционного процесса становится более актуальным. Циркуляция в организме телят пассивно приобретенных колостральных антител усложняет задачу своевременной постановки диагноза серологическими методами, что делает прямую диагностику инфекции в возрасте 0-6 месяцев наиболее эффективной и приводит к сокращению сроков противолейкозных мероприятий.
Вирус лейкоза крупного рогатого скота (ВЛКРС) является представителем дельтаретровирусов семейства Retroviridae и индуцирует злокачественное лимфопролиферативное заболевание - энзоотический лейкоз.
Среди болезней животных лейкоз КРС представляет одну из наиболее сложных проблем ветеринарной медицины. Несмотря на определенные усилия в борьбе против этого заболевания в России, лейкоз прочно занимает первое место среди инфекционных болезней КРС. В последние годы на него приходится более 50% учитываемых случаев инфекционной патологии.
По статистике у инфицированных коров рождается не более 3-5% инфицированного потомства, однако, перинатальная передача при наличии отягчающих условий (например, контаминация кормов плесневыми грибами, факторы патогенности микроорганизмов, нарушающих плацентарный барьер) может достигать практически 30%.
При отсутствии клинических признаков (например, увеличение лимфатических узлов) у инфицированных коров уровень В-лимфоцитов может быть повышенным (Panei C.J. et al., 2013). Это свидетельствует о том, что наличие таких животных с иммунологической дисрегуляцией ведет к экономическим потерям вследствие снижения молочной продуктивности (Nekouei О. et al., 2016), репродуктивной способности (Bartlett Р.С. et al., 2013), высокой пораженности заболеванием (Sandev N. et al., 2004). Приблизительно у 1/3 животных развивается персистентный лимфоцитоз - доброкачественная форма с пролиферацией не трансформированных лимфоцитов. У менее 5% животных в возрасте обычно старше 4-5 лет развивается злокачественная В-клеточная лимфома после длительного латентного периода (Ferrer J.F. et al., 1978).
ВЛКРС циркулирует в мире повсеместно (данные OIE по состоянию на март 2017, Polat et al., 2017). Успешный опыт искоренения данной ретровирусной инфекции на государственном уровне характерен для некоторых стран западной Европы (Германия, Финляндия, Швейцария, Эстония, Нидерланды, Польша) (Nuotio L. et al.,2003; Acaite J. et al., 2007; Kautzsch S. et al., 1990; Maresca C. et al., 2015; Gottschau A. et al., 1990; Stark K.D. et al., 1996; More S.J. et al., 2017), которые остаются свободными от лейкоза крупного рогатого скота. Однако, страны восточной Европы (Украина, Хорватия) (Balic D. et al., 2012; Rola-Luszczak M. et al., 2013; Zhao X.R. et al., 2007; Sandev N. et al.,2015; EPAHW, 2015) и остальные страны западной Европы (Италия, Португалия, Белоруссия, Латвия, Греция, Румыния, Болгария), остаются неблагополучными по заболеванию (OIE, 2009). По состоянию на декабрь 2013 Австралия (99,7% молочных стад) и с 2008 года Новая Зеландия были свободными от ВЛКРС при проведении оздоровительных мероприятий с 1983 и 1996 годов, соответственно (EPAHW,2015; Chethanond U-S. et al., 1999). В США и Канаде инфицированность крупного рогатого скота наиболее высокая и достигает 83,9% и 89%, соответственно (APHIS, 2007; United states department of agriculture, 2008; VanLeeuwen J.A. et al., 2001, 2005; Nekouei O.A. et al., 2015). В Бразилии уровень инфицированности находится в диапазоне от 17,1% до 60,8% (Samara S.I. et al., 1997;  J.L. et al.,1998; Camargos M.F. et al., 2002, 2007); в Аргентине - от 77,4% до 90,9% (Polat М. et al., 2016; Monti G. et al., 2005; Trono K.G. et al., 2001); в Чили, Боливии, Перу, Венесуэле, Уругвае, Парагвае и Колумбии - от 19,8% до 54,7% (Polat М. et al., 2016; Felmer R. et al., 2005;
J.L. et al.,1998; Camargos M.F. et al., 2002, 2007); в Аргентине - от 77,4% до 90,9% (Polat М. et al., 2016; Monti G. et al., 2005; Trono K.G. et al., 2001); в Чили, Боливии, Перу, Венесуэле, Уругвае, Парагвае и Колумбии - от 19,8% до 54,7% (Polat М. et al., 2016; Felmer R. et al., 2005; C. et al., 1978; Moratorio G. et al., 2010; Rama G. et al., 2011; Alfonso R. et al., 1998;
C. et al., 1978; Moratorio G. et al., 2010; Rama G. et al., 2011; Alfonso R. et al., 1998;  D.Y. et al., 2011; Benavides B. et al., 2013). В Китае инфицированность достигает 49,1% (Yang Y. et al.,2016), в Японии - 78% (Murakami К. et al.,2013), в Таиланде - до 58,7% (Lee E. et al., 2016), в Корее - 86,8% (Lee Е. et al.,2015). Менее 6% инфицированных животных выявляется в Монголии (3,9%) (Ochirkhuu N. et al., 2016), Камбодже (5,3%) (Meas S. et al., 2000), Тайване (5,8%) (Wang C.T. et al., 1991). Менее 10% инфицированности крупного рогатого скота обнаружено в Филиппинах (от 4,8% до 9,7%) (Polat М. et al., 2015) и в Мьянме (9,1%) (Polat М. et al., 2016). Для Израиля характерна инфицированность ВЛКРС на уровне 5% (Trainin Z. et al., 2005), для Саудовской Аравии - 20,2% (Hafez S.M. et al., 1990), для Турции - 48,3% (Burgu I. et al., 2005).
D.Y. et al., 2011; Benavides B. et al., 2013). В Китае инфицированность достигает 49,1% (Yang Y. et al.,2016), в Японии - 78% (Murakami К. et al.,2013), в Таиланде - до 58,7% (Lee E. et al., 2016), в Корее - 86,8% (Lee Е. et al.,2015). Менее 6% инфицированных животных выявляется в Монголии (3,9%) (Ochirkhuu N. et al., 2016), Камбодже (5,3%) (Meas S. et al., 2000), Тайване (5,8%) (Wang C.T. et al., 1991). Менее 10% инфицированности крупного рогатого скота обнаружено в Филиппинах (от 4,8% до 9,7%) (Polat М. et al., 2015) и в Мьянме (9,1%) (Polat М. et al., 2016). Для Израиля характерна инфицированность ВЛКРС на уровне 5% (Trainin Z. et al., 2005), для Саудовской Аравии - 20,2% (Hafez S.M. et al., 1990), для Турции - 48,3% (Burgu I. et al., 2005).
В настоящее время возросла актуальность проблемы передачи ВЛКРС с молоком, в связи с увеличением инфицированности крупного рогатого скота, принадлежащего частным владельцам и употреблением в пищу молока, не прошедшего пастеризацию («парного молока»). Учитывая научные факты повсеместного распространения ВЛКРС и, особенно, в странах с неблагоприятной эпизоотической ситуацией по лейкозу крупного рогатого скота (например, в США, России), потребление молока, мяса и других побочных продуктов от инфицированных животных, постоянное воздействие на вирус со стороны иммунного ответа, в конечном счете, приводит к выявлению провируса в человеческом геноме (Ochoa-Cruz A. et al., 2006; Buehring G.C. et al., 2007, 2014, 2015; Nikbakht G. et al., 2010; Mesa G. et al., 2013; Villalobos A. et al., 2016; Lawson J.S. et al., 2017), РНК-транскриптов в клетках крови человека (Сырцев А.В. и др., 2015)), в геноме экспериментальных гетерологичных[ животных (Гулюкин М.И. и др., 2015), что связано с потенциальным риском преодоления вирусом лейкоза крупного рогатого скота межвидовых барьеров.
В естественных условиях ВЛКРС может передаваться крупному рогатому скоту, зебу, буйволам, овцам. Зарегистрирован случай носительства антител к ВЛКРС у шведских лосей (Burny A. et al., 1985; Dimitrov Р et al., 2012; Hirsch V.M. et al., 1995; Wolfe N.D. et al., 2005).
Передача ВЛКРС восприимчивому крупному рогатому скоту может осуществляться через кровь, а также всеми секретами и экскретами при попадании в них лимфоцитов, зараженных вирусом (Valikhov A.F. et al., 1983).
Механизм передачи ВЛКРС обусловлен биологической приспособленностью возбудителя инфекции паразитировать в клетках и превращать эти клетки в злокачественные. Вирус инфицирует различные популяции иммунных клеток (CD5+/CD5" IgM+ В-лимфоциты, CD2+/CD3+/CD4+/CD8+ и γ/δ Т-лимфоциты, моноциты, гранулоциты периферической крови и лимфоидной ткани) (Aida Y. et al., 1993). Сегодня существует независимый механизм передачи отдельных ретровирусных частиц в направлении клеточного контакта типа «клетка-клетка» (cell-to-cell), который представляет собой вирусную транспортировку из инфицированных в неинфицированные клетки с привлечением тонких мостиков типа филоподий. Распространение ретровирусов при физическом взаимодействии клеток друг с другом на 2-3 порядка более эффективнее. Детали данного механизма в значительной степени неизвестны, но считается, что передача происходит через обширные поверхности контакта, так называемые вирусологические или инфекционные синапсы (Nathan М. et al., 2007; Jing Jin et al., 2009).
Репликационная стратегия вируса в организме хозяина реализуется двумя отдельными друг от друга процессами: в первом случае инфекционный цикл представляет собой связывание вирионов с клетками-мишенями, высвобождением одноцепочечной вирусной РНК, обратной транскрипцией и интеграцией в форме провируса в геном хозяина; во втором случае вирусная стратегия размножения связана с управлением клеточной пролиферацией при помощи вирусного регуляторного белка Tax, в результате чего продуцируется группа инфицированных клеточных популяций, состоящих из отдельных клонов (Gillet et al, 2007).
Основными методами диагностики ВЛКРС инфекции являются серологические -реакция диффузной преципитации (РДП) и иммуноферментный анализ (ИФА), основанные на выявлении в биоматериале от животных антител против антигенов вируса на ранних стадиях заболевания. Для диагностики инфекции используют также гематологические методики на более поздних стадиях заболевания для выявления больных животных; клинические; патоморфологические методики - при посмертном исследовании; метод биопробы.
Серологическая диагностика имеет некоторые ограничения, связанные с низкой чувствительностью, не возможностью дифференцировать материнские антитела от инфекционных в первые периоды жизни теленка в возрасте 0-6 месяцев. Это делает прямую диагностику инфекции, нацеленную на выявление генома возбудителя крайне актуальной.
При применении полимеразной цепной реакции (ПЦР) как прямого высокочувствительного и высокоспецифичного молекулярно-биологического способа, становится возможным быстро идентифицировать фрагменты и достоверно обнаруживать единичные копии провирусной ДНК ВЛКРС (М. Jimba, et al., 2010) на самых ранних этапах инфекционного процесса (через 1-2 недели после заражения).
ПЦР в реальном времени - метод молекулярной биологии, основанный на принципе метода ПЦР. Используемый вариант ПЦР в реальном времени основан на количественной детекции флуоресцентного сигнала, который увеличивается пропорционально количеству ПЦР-продукта, что позволяет определить количество искомой молекулы ДНК. Результат ПЦР в реальном времени регистрируется в процессе реакции в каждый момент времени.
Для молекулярно-эпизоотологического анализа исследуются генетические последовательности области поверхностного гликопротеида gp51 ВЛКРС, что связано со значительной изменчивостью этого участка генома вируса. На сегодняшний день в мире выявлено 10 генетических вариантов ВЛКРС на основе гена env [Rodriguez S.M. et al., 2009; Шаева и соавт., 2012; Вафин P.P. и соавт., 2013; Polat М. et al., 2016;  М. et al., 2013; Lee et al., 2016, Pluta A. et al.,2017].
М. et al., 2013; Lee et al., 2016, Pluta A. et al.,2017].
Известен способ дифференциации варианта tax гена вируса лейкоза крупного рогатого скота с использованием праймеров, способных выявить полную последовательность tax гена ВЛКРС с целью дальнейшего выявления мутаций в кодируемых этим геном аминокислотных последовательностях и определения вариантов tax гена ВЛКРС. В известном способе используют следующие праймеры: Btax2: 5' AG ТСТ AGA GCT GAC GTC ТСТ GTC TG 3'; Btax3: 5' АСС TCG AGA TGG САА GTG TTG TTG GTT GG 3' [1].
В настоящее время также известен способ диагностики лейкоза крупного рогатого скота методом полимеразной цепной реакции, включающий прямой и обратный олигонуклеотидные праймеры для выявления фрагмента гена 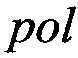 провируса лейкоза крупного рогатого скота с электрофоретическим определением размера амплифицируемого фрагмента нуклеотидной последовательности, отличающийся тем, что использует в качестве праймеров олигонуклеотиды следующей структурой - PF2: 5'-TGA ACG GAC AAA TGG ACT GCT C-3'; PR2: 5'-CCG АСА GAG AGC GAG GAG AG-3', которые имеют следующие характеристики: отсутствие самокоплементарных участков внутри каждого праймера и между прямым и обратным, температура плавления составляет 66°С для обоих олигонуклеотидов, GC состав - 50% для PF2 и 65% для PR2 и фланкируют область консервативного гена
провируса лейкоза крупного рогатого скота с электрофоретическим определением размера амплифицируемого фрагмента нуклеотидной последовательности, отличающийся тем, что использует в качестве праймеров олигонуклеотиды следующей структурой - PF2: 5'-TGA ACG GAC AAA TGG ACT GCT C-3'; PR2: 5'-CCG АСА GAG AGC GAG GAG AG-3', которые имеют следующие характеристики: отсутствие самокоплементарных участков внутри каждого праймера и между прямым и обратным, температура плавления составляет 66°С для обоих олигонуклеотидов, GC состав - 50% для PF2 и 65% для PR2 и фланкируют область консервативного гена 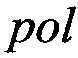 вируса лейкоза крупного рогатого скота размером 438 пар нуклеотидов высококонсервативного гена
вируса лейкоза крупного рогатого скота размером 438 пар нуклеотидов высококонсервативного гена 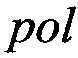 провируса лейкоза крупного рогатого скота [2]. Прототип.
провируса лейкоза крупного рогатого скота [2]. Прототип.
Поскольку, даже хорошо подобранная пара праймеров может давать нежелательные продукты амплификации, использование способа с регистрацией накопления только лишь целевых/искомых фрагментов ДНК является более надежным экспериментальным подходом (Ребриков Д.В. и др., 2014). Для этого был разработан олигонуклеотидный зонд с флуоресцентной меткой, что позволяет достоверно регистрировать накопление фрагмента ДНК строго определенной последовательности, сокращен размер ампликона до 110 нуклеотидов в случае гена 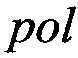 и выбран участок размером 76 нуклеотидов в случае гена tax, за счет чего повышены консерватизм выбранных участков и, в целом, специфичность и чувствительность методики. Все разработанные конструкции олигонуклеотидов не имеют самокомплементарных участков. Выбор варианта ПЦР в режиме реального времени снижает риск контаминации за счет исключения стадии детекции продуктов амплификации методом электрофореза, при котором необходимо производить вскрытие пробирок. При ПЦР-РВ детекция продуктов амплификации проводят непосредственно во время прохождения реакции, пока пробирки находятся в приборе.
и выбран участок размером 76 нуклеотидов в случае гена tax, за счет чего повышены консерватизм выбранных участков и, в целом, специфичность и чувствительность методики. Все разработанные конструкции олигонуклеотидов не имеют самокомплементарных участков. Выбор варианта ПЦР в режиме реального времени снижает риск контаминации за счет исключения стадии детекции продуктов амплификации методом электрофореза, при котором необходимо производить вскрытие пробирок. При ПЦР-РВ детекция продуктов амплификации проводят непосредственно во время прохождения реакции, пока пробирки находятся в приборе.
Результаты наших исследований и данные литературы показали, что внутри подгруппы ВЛКРС для генов 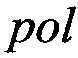 расхождения в нуклеотидных последовательностях составляют менее 6%, что свидетельствует о высокой степени консерватизма штаммов вируса из различных географических регионов мира (N. Gillet et al., 2007). Анализ генетического полиморфизма участков генов ВЛКРС, циркулирующего на территории некоторых регионов РФ, с применением способа, указанного в прототипе, позволил установить, что целевой фрагмент консервативного гена
расхождения в нуклеотидных последовательностях составляют менее 6%, что свидетельствует о высокой степени консерватизма штаммов вируса из различных географических регионов мира (N. Gillet et al., 2007). Анализ генетического полиморфизма участков генов ВЛКРС, циркулирующего на территории некоторых регионов РФ, с применением способа, указанного в прототипе, позволил установить, что целевой фрагмент консервативного гена 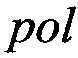 менее всего подвержен влиянию генетического полиморфизма. Вариабельность изученного участка гена
менее всего подвержен влиянию генетического полиморфизма. Вариабельность изученного участка гена 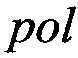 ВЛКРС не превышала 3%.
ВЛКРС не превышала 3%.
Мессенджер tax/rex, расположенный в регионе X генома ВЛКРС, обнаруживается в цитоплазме на ранней стадии, предшествующей накоплению других мРНК (Haas L., et al., 1992), последовательности которого высоко консервативны между разными изолятами ВЛКРС с менее чем 5%-ой степенью вариации (Choi Е.А., et al., 2005).
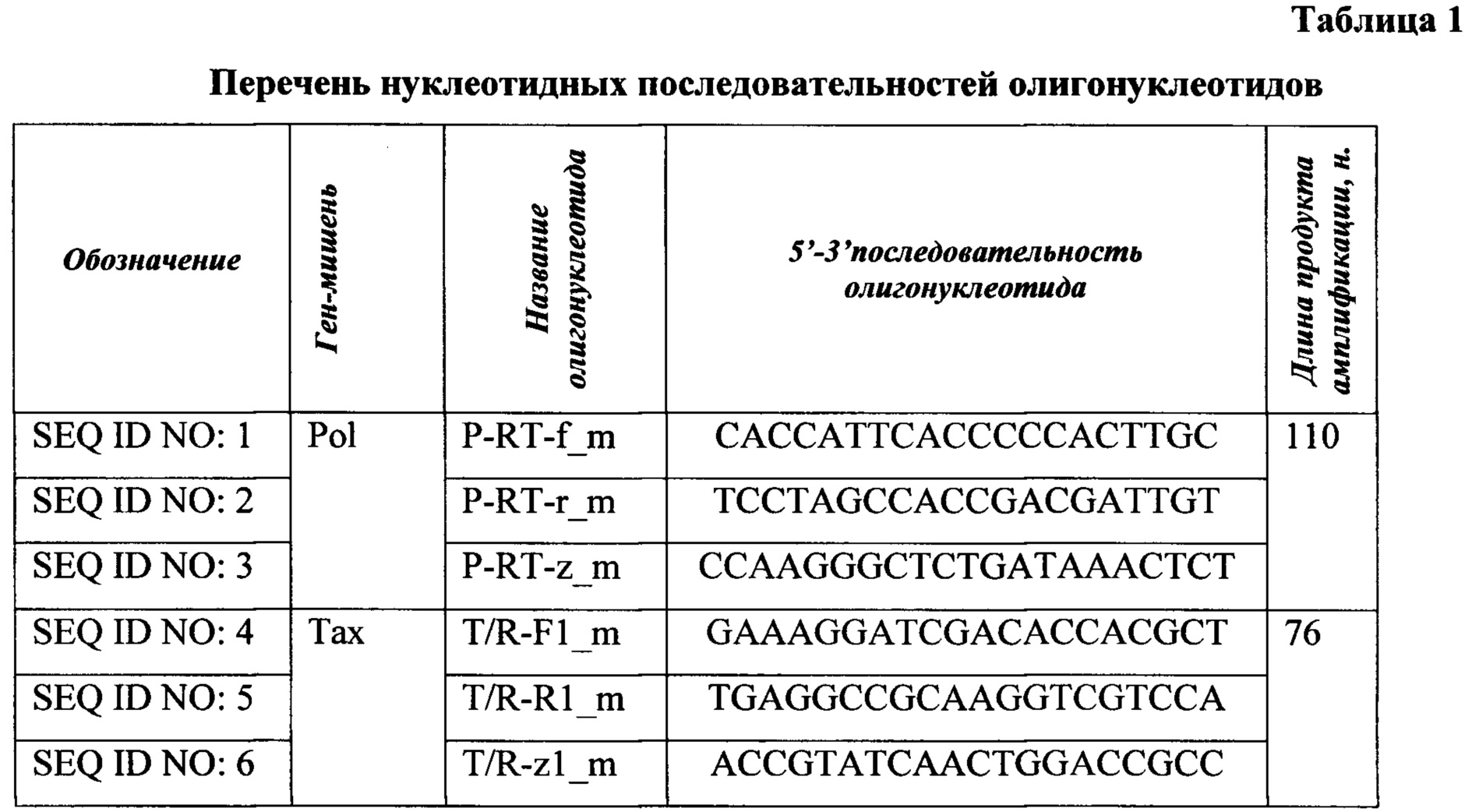
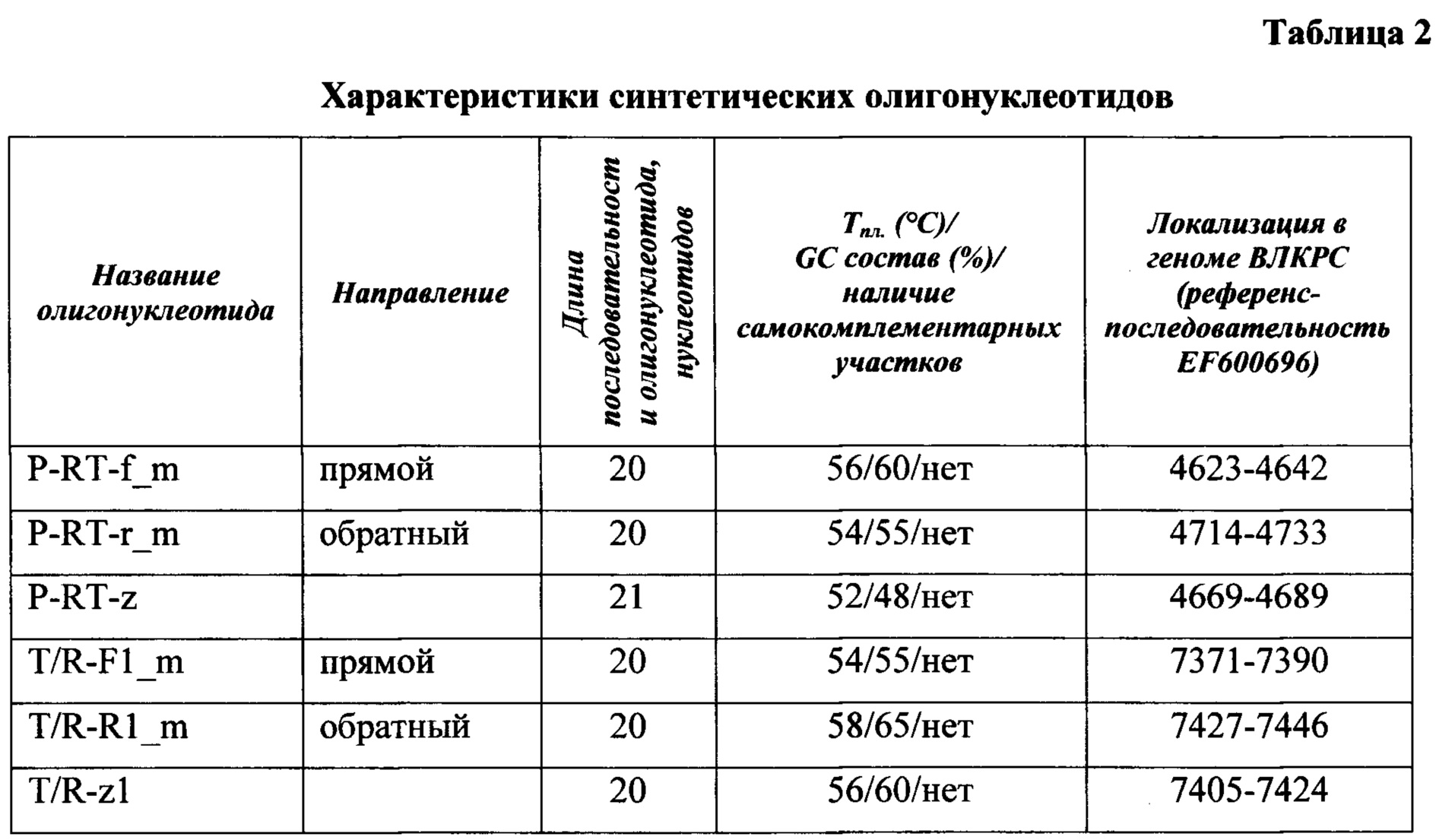
В задачу исследований входило - разработать олигонуклеотидные праймеры и зонды P-RT-f_m; P-RT-r_m; P-RT-z_m (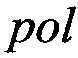 ) и T/R-Fl_m; T/R-Rl_m; T/R-zl_m (tax) для амплификации участков двух целевых генов со структурой, представленной в таблице 1 и имеющих следующие характеристики (Таблица 2): температура плавления находится в диапазоне 52-58°С; GC-состав - 48-65%; фланкируют фрагменты высоконсервативного гена
) и T/R-Fl_m; T/R-Rl_m; T/R-zl_m (tax) для амплификации участков двух целевых генов со структурой, представленной в таблице 1 и имеющих следующие характеристики (Таблица 2): температура плавления находится в диапазоне 52-58°С; GC-состав - 48-65%; фланкируют фрагменты высоконсервативного гена 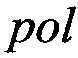 размером 110 нуклеотидов и гена tax, выявляемого на самых ранних стадиях инфекции, размером 76 нуклеотидов, вариабельность которых не превышет 3% и 5%, соответственно; комплементарность выбранным областям генома ВЛКРС, отсутствие палиндромных участков.
размером 110 нуклеотидов и гена tax, выявляемого на самых ранних стадиях инфекции, размером 76 нуклеотидов, вариабельность которых не превышет 3% и 5%, соответственно; комплементарность выбранным областям генома ВЛКРС, отсутствие палиндромных участков.
Предложенный способ заключается в одновременном использовании двух наборов сконструированных олигонуклеотидов, каждый из которых состоит из двух праймеров и одного зонда, комплементарных высоконсервативной области целевого гена 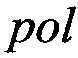 и фрагменту целевого гена tax - одного из первых вирусных транскриптов, обнаруживаемых на ранних стадиях данной медленной инфекции, для выявления в тканях и секретах животных (кровь, молозиво, суспензии культур клеток) провирусной ДНК возбудителя при проведении диагностики лейкоза КРС на ранних стадиях заболевания методом ПЦР-РВ.
и фрагменту целевого гена tax - одного из первых вирусных транскриптов, обнаруживаемых на ранних стадиях данной медленной инфекции, для выявления в тканях и секретах животных (кровь, молозиво, суспензии культур клеток) провирусной ДНК возбудителя при проведении диагностики лейкоза КРС на ранних стадиях заболевания методом ПЦР-РВ.
Вариант ПЦР в режиме реального времени (ПЦР-РВ) позволяет сократить время проведения анализа и риск появления ложноположительных результатов (снизить риск контаминации). В результате гибридизации происходит нарастание интенсивности флуоресценции, что позволяет регистрировать накопление специфических продуктов амплификации путем измерения интенсивности флуоресцентного сигнала по двум каналам FAM (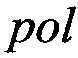 ), ROX (tax), в результате чего детекция продуктов амплификации целевых участков генома ВЛКРС осуществляется непосредственно в ходе прохождения реакции с помощью прибора с системой детекции флуоресцентного сигнала в режиме реального времени в формате мультиплекс.
), ROX (tax), в результате чего детекция продуктов амплификации целевых участков генома ВЛКРС осуществляется непосредственно в ходе прохождения реакции с помощью прибора с системой детекции флуоресцентного сигнала в режиме реального времени в формате мультиплекс.
Синтез олигонуклеотидов проводят стандартным способом. Целевой продукт представляет собой концентрированный водный раствор или лиофильно высушенный препарат. В паспорте для каждого олигонуклеотида указывают концентрации (ое/мл, пмоль/мл) и количество (ОЕ).
Экстракцию, очистку, элюцию НК, получение кДНК методом обратной транскрипции проводят с использованием стандартных приемов.
В процессе конструирования дизайна олигонуклеотидов - анализа структуры и термодинамического анализа - основными параметрами являются следующие: степень гомологии, отсутствие самокоплементарных (палиндромных) участков внутри праймеров, процентное содержание гуанина и цитозина (GC-состав) (допустимо 40-60%), длина олигонуклеотида (допустимо 18-24 нуклеотидов) и комплементарность друг другу, близость значений температур плавления (Тпл) (допустимо различие в 3-6°С). При этом используют программу OLIGO DNA/RNA primer analysis, v.4.0 (W. Rychlik, 1989), эмпирически определяют наиболее оптимальное сочетание прямого, обратного праймеров и зонда для эффективного прохождения ПЦР.
Дополнительно в качестве внутреннего контроля прохождения ПЦР анализа возможно использование олигонуклеотидов, разработанных на регион Bola-DRA генома КРС ([3] - M. Jimba, et al.,2010), с предварительной модификацией и оптимизацией. Для данных олигонуклеотидов диапазоны характеристик следующие: Тпл - 55-56°С, GC-состава - 57-67%, длины - 18-21 нуклеотид; самокомплементарные участки отсутствуют.
Для верификации результатов исследований используют стандартный набор для выявления лейкоза крупного рогатого скота (КРС) методом полимеразной цепной реакции в режиме реального времени отечественного производства.
Сущность изобретения поясняется таблицами и рисунками, в которых отображается следующая информация:
Пример 1.
При проверке специфичности олигонуклеотидов выявляют наличие 100 % идентичности со всеми известными полногеномными штаммами ВЛКРС (BLAST, ресурс NCBI). Анализ структуры и термодинамических параметров разработанных олигонуклеотидов представлены в таблице 2.
Оценивают консерватизм выбранных целевых участков генома возбудителя, ограниченных разработанными олигонуклеотидами. Выявленная степень дивергенции составила 1,8 % для участка гена 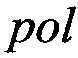 и 3,9% для фрагмента гена tax.
и 3,9% для фрагмента гена tax.
Проводят расчет рабочей концентрации (пмоль/мкл) олигонуклеотидов для добавления их в реакционную смесь и дальнейшей оптимизации условий проведения ПЦР. Рабочая концентрация праймеров составляла 10 пмоль/мкл, зондов - 3 пмоль/мкл.
Полученные характеристики разработанных олигонуклеотидов свидетельствуют о возможности использования их для проведения молекулярно-генетической диагностики лейкоза крупного рогатого скота методом ПЦР-РВ.
Пример 2.
В качестве контрольных образцов (КО) используют: а) отрицательный контроль этапа выделения (ОКО) - вместо ДНК-пробы вносят в пробирку 100 мкл дистиллированной воды; б) отрицательный контроль этапа ПЦР (К-) - вместо ДНК-пробы вносят в пробирку 5 мкл дистиллированной воды; в) положительный контроль этапа ПЦР (ПКО) - вносят в пробирку 5 мкл ДНК ВЛКРС (ДНК выделяют из монослоя вируспродуцирующей культуры клеток FLK-BLV).
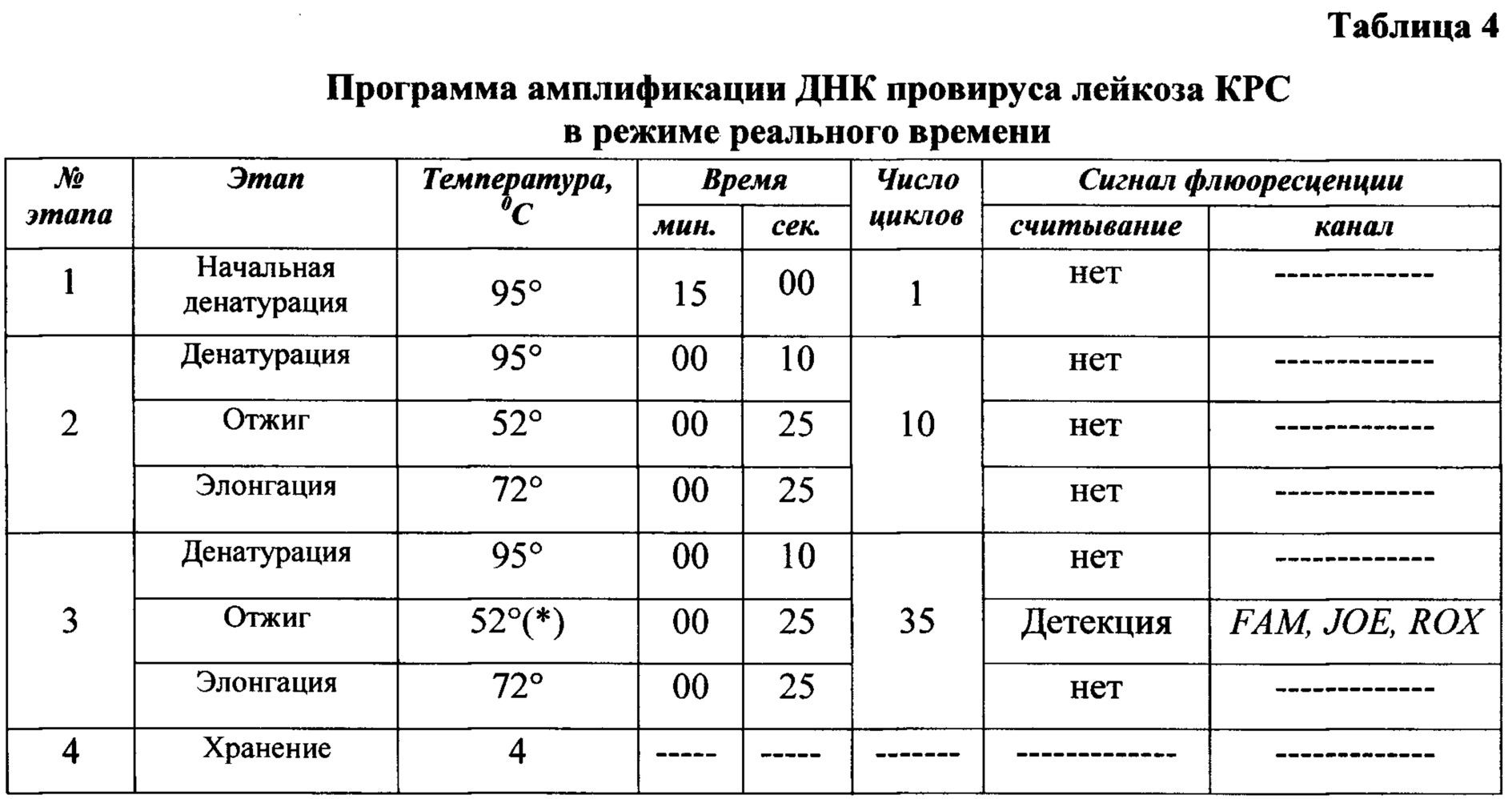
Подбор программы амплификации, температуры отжига проводят эмпирическим способом с учетом приближения близких температур плавления при разработке дизайна праймеров и зондов сначала в формате моноплекс, затем для всех используемых олигонуклеотидов к единому значению в формате мультиплекс. При отработке условий проведения реакции амплификации выбрана оптимизированная программа, включающая «слепые» циклы и снижена температура отжига до 52°С для повышения чувствительности способа выявления провирусной ДНК ВЛКРС (Таблица 4).
Рассчитывают минимальные концентрации (пмоль/мкл) олигонуклеотидов, количества компонентов и общий объем реакционной смеси, включая объем ДНК-пробы сначала в формате моноплекс, затем проводят испытания в формате мультиплекс. Используют рабочие концентрации праймеров - 10 пмоль/мкл, зондов - 3 пмоль/мкл, дНТФ - 10 мМ, полимераза 5 единиц, 5х ПЦР-буфер (15мМ MgCl2).
Амплификацию осуществляют на флуоресцентном ПЦР-детекторе для проведения полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией в режиме реального времени с планшетным форматом реакционного модуля путем измерения интенсивности флуоресцентного сигнала по соответствующим каналам. ПЦР проводят в общем объеме 25 мкл: 20 мкл реакционной смеси и 5 мкл ДНК пробы.

Соответствие детектируемых участков геномов и каналов флуоресцентной детекции представлено в таблице 3.
Обработку данных проводят по следующим параметрам для каналов FAM, JOE, ROX, задаваемым в приборе: корректировка наклона кривой флюоресценции, пороговый уровень, оптимизация сигнала (диапазон оптического окна). Для этого в меню программы используют режим анализа с помощью двух методов: 1) установленных точек - устанавливает базовую линию и пороговое значение, затем выводится линия порогового значения, при этом используется несколько точек (рекомендовано от 2 до 8) на флуоресцентной кривой, соответствующей образцу, находящихся выше базовой линии в экспоненциальной фазе. Место пересечения прямой линии, построенной по установленным точкам, с пороговой линией является значением порогового цикла - Ct; 2) максимума 2-ой производной, при котором автоматически рассчитывается значение второй производной для каждой точки на флуоресцентной кривой и определяется максимальное значение как значение порогового цикла - Ct.
Результаты анализа работы праймеров и зондов оценивают по усредненным значениям следующих критериев: для ненормированных кривых по каналам FAM, JOE, ROX - фоновый уровень флюоресценции (Fcp), конечный уровень флюоресценции 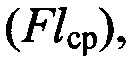 разгорание
разгорание 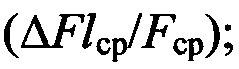 для нормированных кривых - конечный уровень флюоресценции
для нормированных кривых - конечный уровень флюоресценции 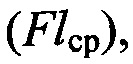 пороговый цикл (Ctср) (Таблица 5). При учете результатов прохождения ПЦР-РВ в первую очередь оценивают контрольные образцы. Результат считается достоверным только в случае адекватного прохождения положительных и отрицательных контролей ПЦР-анализа согласно таблице 6.
пороговый цикл (Ctср) (Таблица 5). При учете результатов прохождения ПЦР-РВ в первую очередь оценивают контрольные образцы. Результат считается достоверным только в случае адекватного прохождения положительных и отрицательных контролей ПЦР-анализа согласно таблице 6.
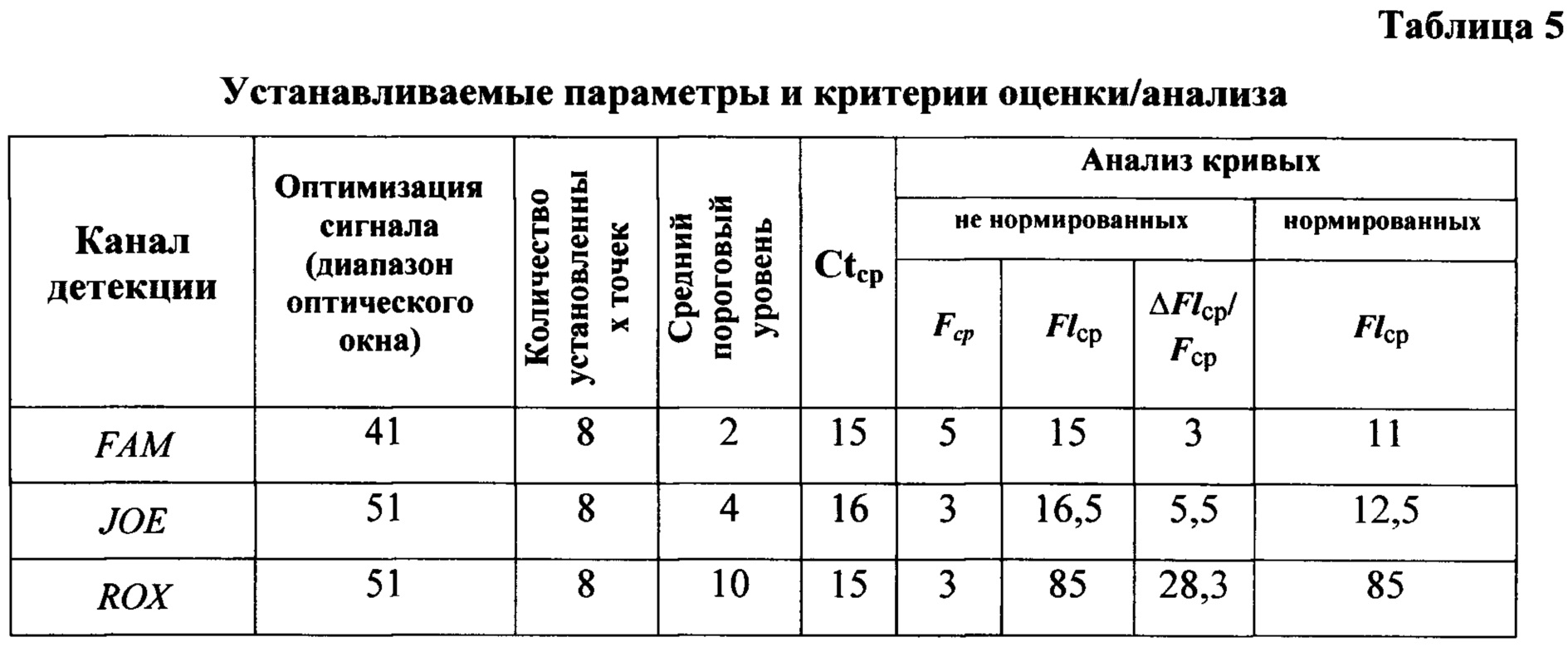
После прохождения реакции амплификации интерпретируют результаты прохождения ПЦР-РВ в пробирках с контрольными образцами.
Интерпретация результатов реакции всех используемых контрольных образцов ПЦР-РВ с применением предложенного способа выявления провирусной ДНК ВЛКРС соответствовала критериям согласно таблице 6.
В соответствии с адекватным прохождением реакции амплификации в пробирках с КО приступают к оценке результатов анализа исследуемых образцов. Интерпретируют результаты детекции ДНК ВЛКРС согласно описанным в таблице 7 критериям.
При исследовании 632 образцов ДНК, выделенных из крови животных в возрасте до 3 месяцев, выявлено 43 положительных пробы, т.е. провирусная ДНК ВЛКРС обнаруживается у 7,3% телят-вирусоносителей.
По итогам проведения верификации получено 100 % совпадение результатов ПЦР-РВ.
Данные результаты подтверждают возможность использования разработанных олигонуклеотидов для выявления вирусоносителей среди телят методом ПЦР-РВ.

Пример 3.
Диагностические характеристики (специфичность и чувствительность) разработанного способа испытывают на различных контингентах инфицированных ВЛКРС животных: естественно инфицированном крупном рогатом скоте (532 образцов крови молодых животных в возрасте 0 дней до 3 месяцев), экспериментально инфицированных животных разных видов (образцы крови от 254 кроликов, 18 козлят, 15 крупного рогатого скота, 49 лошадей и 24 собак, образцы молозива от коровы-донора) в динамике развития инфекционного процесса.
Полученные результаты реакции амплификации при проверке диагностических характеристик представлены в таблицах 8,9.
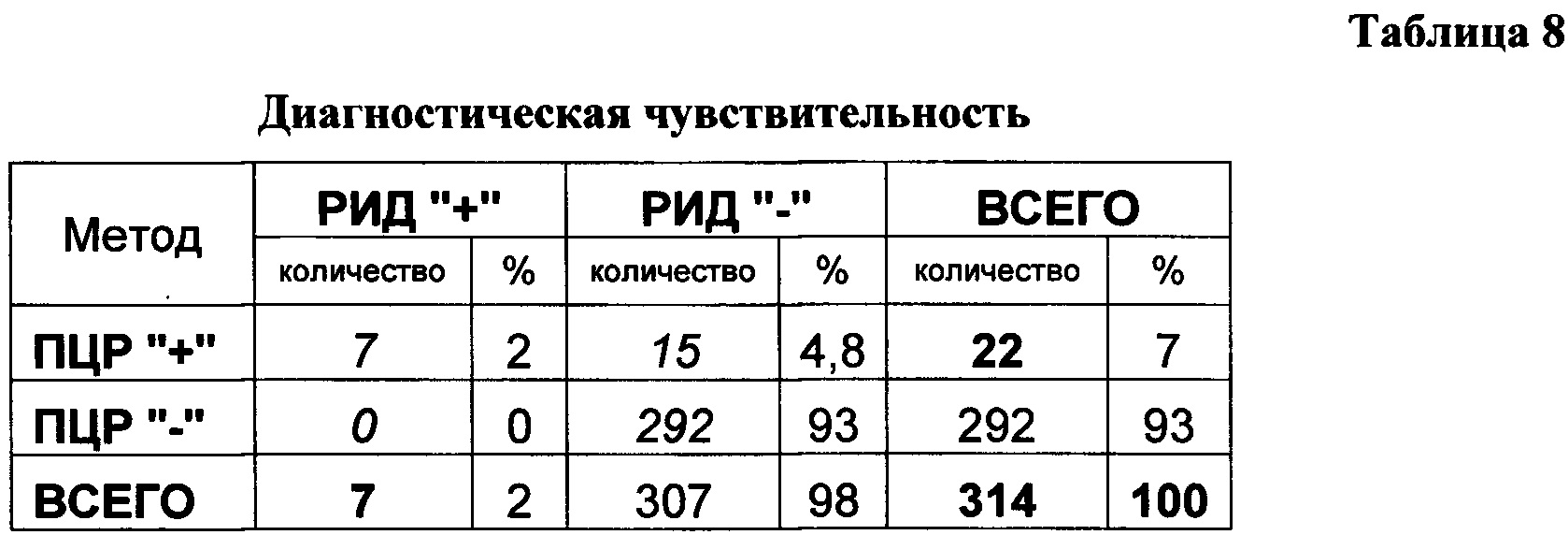
В процессе испытания диагностической чувствительности проводят ПЦР-РВ анализ 314 проб ДНК, выделенной из крови молодых животных возрасте 7-30 дней. По полученным данным выявлено несколько групп животных: ПЦР+/ РИД+ - в 7 случаях, ПЦР+/РИД- - в 15 случаях, ПЦР-/РИД+ - не выявлено, ПЦР-/РИД- - в 292 случаях. С помощью предложенного способа выявления провирусной ДНК ВЛКРС показано, что уровень перинатальной инфицированности в 3,14 раза выше, чем при серологическом исследовании молодняка до приема молозива методом РДП и подтверждено превышение относительной чувствительности ПЦР по сравнению с серологической диагностикой перинатальной передачи ретровирусной инфекции.
При изучении диагностической специфичности (доля негативных результатов теста в группе здоровых животных) из 292 животных с отрицательными результатами анализа методом РДП по результатам ПЦР с использованием предложенного способа выявления провирусной ДНК ВЛКРС получено: негативных результатов - 292, позитивных - 0.
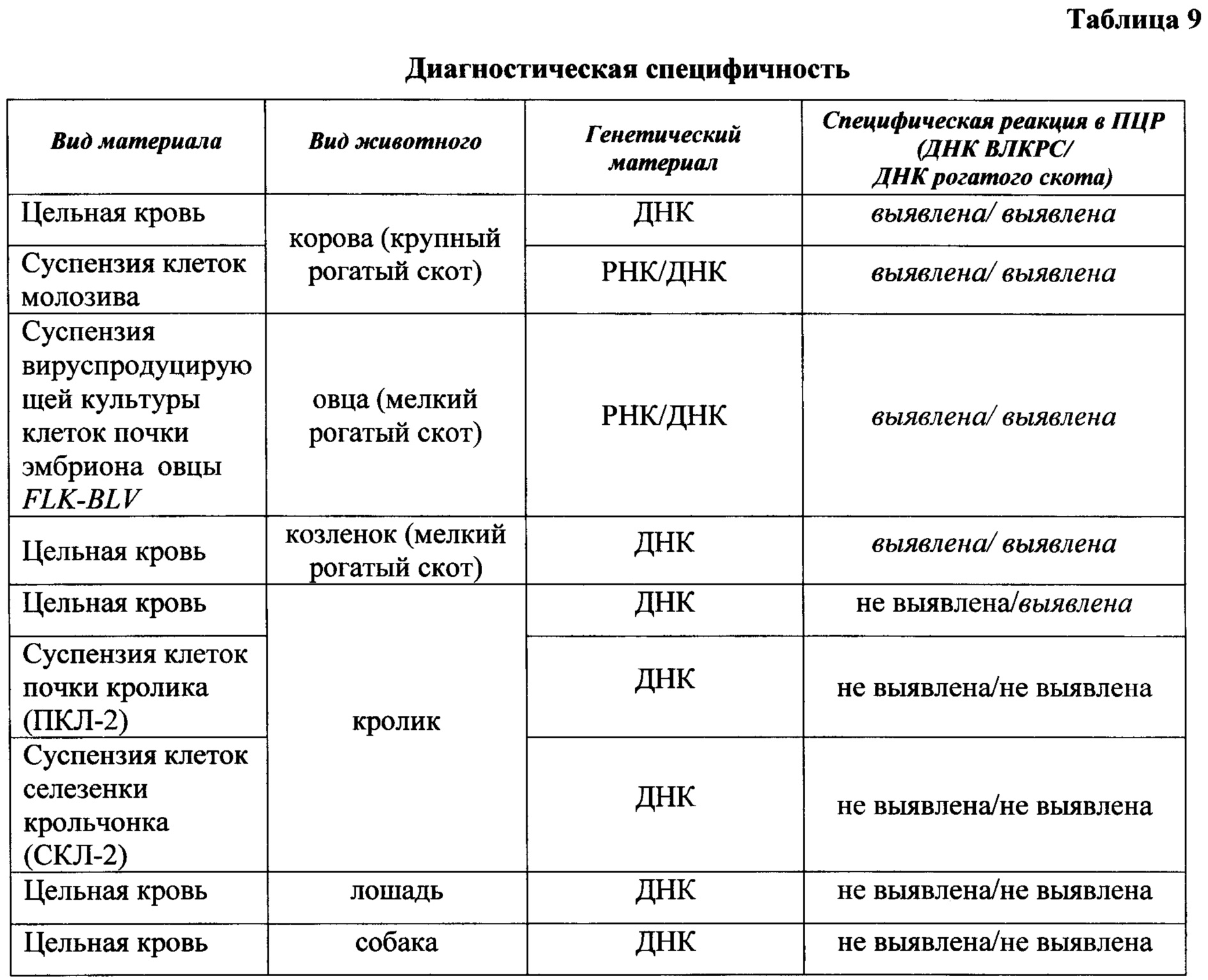
При тестировании данных образцов с использованием предложенного способа детекции провирусной ДНК ВЛКРС не специфических реакций не выявлено.
При анализе проб молозива выявлено наличие как ДНК провируса, так и вирусную РНК (последовательности ВЛКРС в пробах кДНК).
По результатам исследований выявлены высокие диагностические характеристики разработанного способа детекции провирусной ДНК ВЛКРС методом ПЦР-РВ.
Пример 4.
Результаты реакции амплификации при проверке аналитических характеристик представлены в таблицах 10, 11.
Аналитическую специфичность испытывают с применением культуральных (28 образцов суспензий клеток культур (СКЛ, ПКЛ, FLK)), вакцинных штаммов вирусов и бактерий, поддерживаемых на базе ВИЭВ: «ТНЛ» вируса инфекционного ринотрахеита крупного рогатого скота, «NADL» вируса вирусной диареи крупного рогатого скота, Chlamydophila psittaci (лиофилизированный препарат антигена из серологического набора); лептоспир, бруцелл: Brucella melitensis, Brucella abortus, Brucella suis, вируса гриппа H1N1 (лиофилизированный препарат антигена из серологического набора).
Аналитическую чувствительность анализируют при исследовании десятикратных разведений суспензии культуры клеток, продуцирующей штамм FLK-BLV и генно-инженерной конструкции - плазмиды 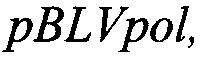 разработанной ранее на базе ВИЭВ, с известной концентрацией (таблица 10); аналитическую специфичность - при проведении анализа генетического материала культуральных штаммов микроорганизмов, перечисленных в таблице 11.
разработанной ранее на базе ВИЭВ, с известной концентрацией (таблица 10); аналитическую специфичность - при проведении анализа генетического материала культуральных штаммов микроорганизмов, перечисленных в таблице 11.
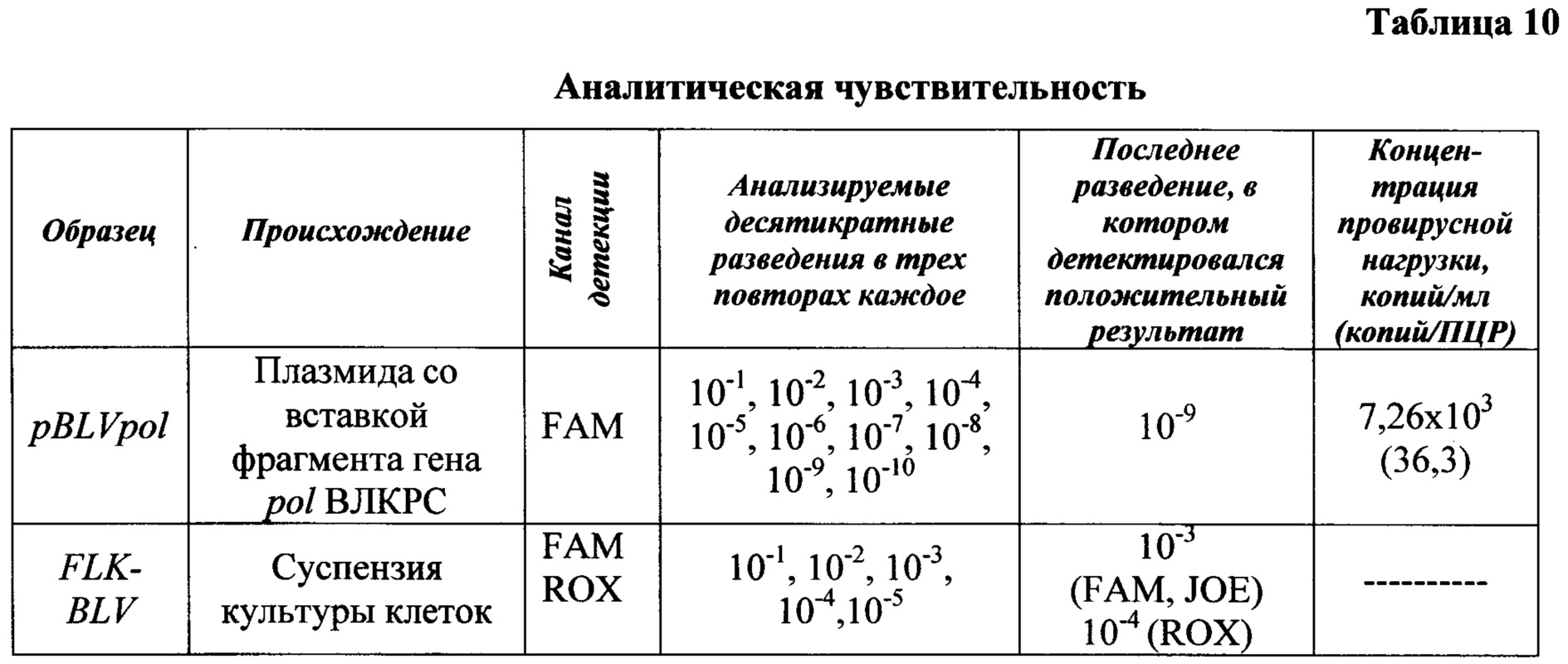
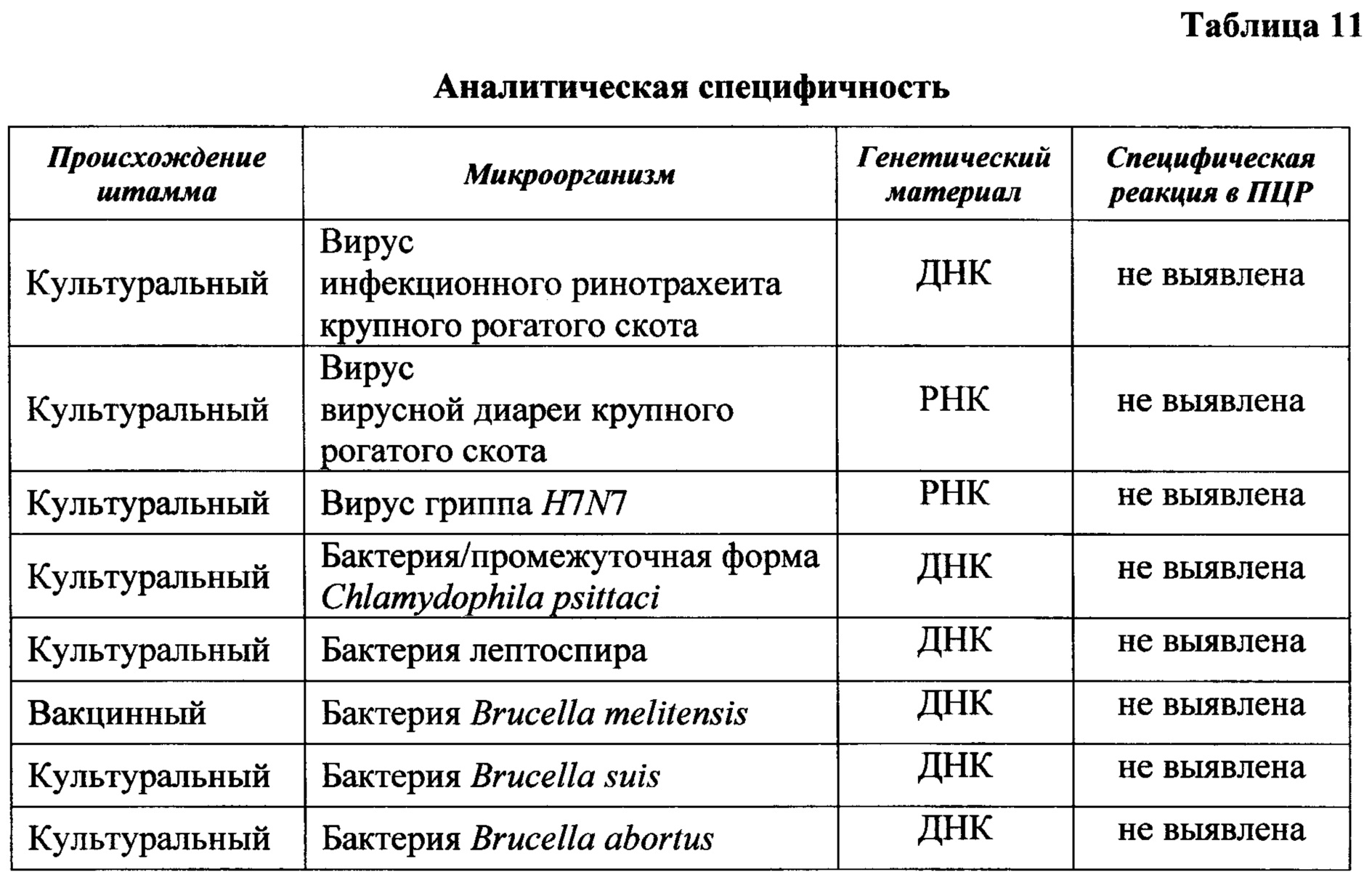
Полученные результаты исследований свидетельствуют о высоких аналитических характеристиках (специфичность и чувствительность) разработанного способа детекции провирусной ДНК ВЛКРС методом ПЦР-РВ в короткие сроки и на ранних стадиях ретровирусной инфекции крупного рогатого скота.
При сравнении результатов ПЦР анализа различных видов биологического материала установлено, что разработанный способ позволяет выявлять ДНК провируса ВЛКРС в цельной крови, полученной от инфицированных животных - крупного и мелкого рогатого скота, кроликов, молозиве КРС, суспензии клетов вируспродуцирующей культуры.
При применении предлагаемого способа диагностики ВЛКРС выявление уровня перинатальной инфицированности в 3,14 раза выше, чем при серологическом исследовании молодняка до приема молозива. Подтверждено превышение относительной чувствительности ПЦР по сравнению с серологической диагностикой перинатальной передачи ретровирусной инфекции. Отсутствие иммуноглобулинов сыворотки крови приводит к быстрой контаминации биоматериала и образованию колоний микроорганизмов в геле агара, что препятствует правильному учету результатов реакции диффузной преципитации и снижает чувствительность метода РДП. Помимо этого, необходимость взятия материала у новорожденных телят до приема молозива создает дополнительные трудности в работе зооветеринарного персонала.
Техническим результатом, на достижение которого направлено данное изобретение, является достоверный, высокочувствительный и высокоспецифичный способ выявления фрагментов провирусного генома ВЛКРС в биологическом материале в короткие сроки на ранних стадиях лейкозной инфекции.
Апробация данного способа с положительными результатами и регулярной воспроизводимостью этих результатов проведена на 1159 пробах ДНК, полученных из крови животных ряда хозяйств Московской области в период 2013-2018 гг. в лабораторных условиях на базе ФГБНУ ФНЦ ВИЭВ РАН.
Предложенный способ найдет широкое применение как при диагностике ВЛКРС на ранних стадиях заболевания для формирования свободного от ретровирусной инфекции стада в животноводческих хозяйствах страны в качестве эффективного инструмента контроля биологических рисков, так и при проведении научных исследований для обнаружения генетического материала вируса лейкоза КРС методом ПЦР-РВ.
Источники информации:
1. Патент-US 6646116 В1, 11.11.2003, С07/Н 21/04.
2. Патент - RU 2445370 С1, 20.03.2012. C12Q 1/68. Прототип.
3. Выявление нового (8-го) генотипа ВЛКРС в различных регионах мира / P.P. Вафин, Н.З. Хазипов, А.Ю. Шаева [и др.] // Фундаментальные исследования. - 2013. - N 10. - Ч. 7. -с. 1467-1471.
4. Идентификация нового генотипа ВЛКРС / А.Ю. Шаева, З.Р. Гараева, [и др.] // Ученые записки КГАВМ. - 2012. - Т. 211. - С. 192-197.
5. Межвидовая передача вируса лейкоза крупного рогатого скота в эксперименте / Гулюкин М.И., Козырева Н.Г., Иванова Л.А. [и др.] // Вопросы вирусологии. - 2015. - Т. 60. -N 5. - C. 32-37.
6. Пилотные исследования по обнаружению RNA-транскриптов bovine leukemia virus у доноров крови человека / Сырцев А.В., Алимов А.А., Галецкий С.А. [и др.] // Успехи молекулярной онкологии: сб. тр. IV всерос. конф. «Молекулярная онкология: итоги и перспективы». - М., 2015. - Т. 2. - N 4. - С. 25-26.
7. ПЦР в реальном времени [Электронный ресурс] / Д. В. Ребриков [и др.]; под ред. д. б. н. Д. В. Ребрикова. - 6-е изд. (эл.). - Электрон, текстовые дан.
8. A bovine leukemia virus, a versatile agent with various pathogenic effects in various animal species / Burny A., Brack C, Cleuter V., et al. // Cancer Res. - 1985. - V. 45 (9, suppl.). - P. 4578-82.
9. A new genotype of bovine leukemia virus in South America identified by NGS-based whole genome sequencing and molecular evolutionary genetic analysis / M. Polat, S.-n. Takeshima, K. Hosomichi, et al. // Retrovirology J. - 2016. - V. 13:4. - 23 p. URL: http://retrovirology.biomedcentral.com/ai1icles/ l0.H86/sl2977-0l6-0239-z.pdf.
10. Aida Y. Phenotype and ontogeny of cells carrying a tumor-associated antigen that is expressed on bovine leukemia virusinduced lymphosarcoma / Aida Y., Okada K., Amanuma H. // Cancer Res. - 1993. - V. 53. - P. 429-37.
11. Assembly of the Murine Leukemia Virus Is Directed towards Sites of Cell-Cell Contact / J. Jin, N.M. Sherer, G. Heidecker, et al. // PLoS Biology. - 2009. - V.7 (7) URL: https://doi.org/10.1371 /journal.pbio.1000163.
12. BLV-CoCoMo-qPCR: Quantitation of bovine leukemia virus proviral load using the CoCoMo algorithm / Jimba M., Takeshima S.N., Matoba K., Endoh D., Aida Y. // Retrovirology. - 2010. - V. 2. - V. 30 №7. - P.91. URL: https://doi:10.1186/1742-4690-7-91.
13. Bovine leukemia virus and cow longevity in Michigan dairy herds / Bartlett P.C., Norby В., Byrem T.M., et al. // J. Dairy Sci. - 2013. - V. 96. - P. 1591-7.
14. Bovine leukemia virus can be classified into seven genotypes: evidence for the existence of two novel clades / S.M. Rodriguez, M.D. Golemba, R.H. Campos, et al. // J. of Gen. Virol. - 2009. -V. 90. - P. 2788-2797.
15. Bovine leukemia virus DNA in human breast tissue / Buehring G.C., Shen H.M., Jensen H.M., et al. // Emerg. Infect. Dis. - 2014. - V. 20 (5). - P. 772-782. URL: https://doi:10.3201/eid2005.131298.
16. Bovine Leukemia Virus Gene Segment Detected in Human Breast Tissue / Mesa G., Ulloa J.C., Uribe A.M., Gutierrez M.F. // Open J. Med. Microbiol. - 2013. - V.3 (1). - P. 84-90.
17. Bovine leukemia virus infection is significantly associated with risk of breast cancer / Buehring G.C., Shen H.M., Jensen H.M., Block G. // Proc. Amer. Assoc. Cancer Res. - 2007. - V. 48. - P. 1747.
18. Bovine leukemia virus linked to breast cancer in Australian women and identified before breast cancer development / Buehring G.C., Shen H., Schwartz D.A., Lawson J.S. // PLoS One. - 2017. - 12: e0179367. URL: https://doi:10.1371/journal.pone.0179367.
19. Choi E.A. Mutational analysis of bovine leukemia virus Rex: identification of a dominant-negative inhibitor / Choi E.A., Hope T.J. // J. Virol. - 2005. - V. 79. - P. 7172-7181.
20. Emergence of unique primate T-lymphotropic viruses among central African bushmeat hunters / Wolfe N.D., Heneine W., Carr J.K., et al. // Proc. Natl. Acad. Sci. USA. - 2005. - V. 102 (22). - P. 7994-9.
21. Estimation of bovine leukemia virus (BLV) proviral load harbored by lymphocyte subpopulations in BLV-infected cattle at the subclinical stage of enzootic bovine leucosis using BLV-CoCoMo-qPCR / Panei C.J., Takeshima S.N., Omori T. et al. // BMC Vet. Res. - 2013 - V. 9: 95. URL: https://doi.org/10.1186/1746-6148-9-95.
22. Exposure to bovine leukemia virus is associated with breast cancer: a case-control study / Buehring G.C., Shen H.M., Jensen H.M., et al. // PLoS One. - 2015. - V. 10: e0134304. URL: https://doi:10.1371/iournal.pone.0134304.
23. Haas L. Bovine leukemia virus gene expression in vivo / Haas L., Divers Т., Casey J.W. // J. Virol. - 1992. - V. 66. - P. 6223-6225.
24. Influence of enzootic bovine leucosis virus upon the incidence of subclinical mastitis in cows at a different stage of infection / Sandev N., Koleva M., Binev R., Ilieva D., et al. // Veterinarski Archiv. - 2004. - V. 76. - P. 411-6.
25. Lifetime effects of infection with bovine leukemia virus on longevity and milk production of dairy cows / Nekouei O., VanLeeuwen J., Stryhn H., et al. // Prev.Vet.Med. - 2016. - V. 133. - P. 1-9.
26. Mechanisms of leukemogenesis induced by bovine leukemia virus: prospects for novel anti-retroviral therapies in human / Gillet N., Florins A., Boxus M. et al. // Retrovirology. - 2007. - V. 4. - P. 18-50.
27. Molecular characterization of bovine leukemia virus from Moldovan dairy cattle /А. Pluta, M.  P.
P.  et al. // Arch. Virol. - 2017. - V. 162 (6). - P. 1563-1576.
et al. // Arch. Virol. - 2017. - V. 162 (6). - P. 1563-1576.
28. Molecular epidemiological and serological studies of bovine leukemia virus (BLV) infection in Thailand cattle / Lee E., Kim E.J., Ratthanophart J et al. // Infect. Genet. Evol. - 2016. - V. 41. - P. 245-254.
29. Oncogenic viruses and Breast Cancer: Mouse Mammary Tumor virus (MMTv), Bovine Leukemia virus (BLv), Human Papilloma virus (HPv), and Epstein-Barr virus (eBv) / J.S. Lawson, B. Salmons, W.K. Glenn // Frontiers in Oncology. - 2018. - V. 8. URL: https://doi.org/10.3389/fonc.2018.00001.
30. Pathological features of experimental bovine leukaemia viral (BLV) infection in rats and rabbits / Dimitrov P., Simeonov K., Todorova K., et al. // Bull. Vet. Inst. Pulawy. - 2012. - V. 56. - P. 115-20.
31. Persistent lymphocytosis in cattle: its cause, nature and relation to lymphosarcoma / Ferrer J.F., Marshak R.R., Abt D.A., et al. // Ann. Rech.Vet. - 1978. - V. 9. - P. 851-7.
32. Polat M. Epidemiology and genetic diversity of bovine leukemia virus /М. Polat, S.-n. Takeshima, Y. Aida// Virol. J. - 2017. - V. 14: 209. URL: https://doi.org/10.1186/s12985-017-0876-4.
33. Phylogeny and natural history of the primate Antiviruses, SIV and HIV / Hirsch V.M., Dapolito G., Goeken R., Campbell B.J. // Curr. Opin. Genet. Dev. - 1995. - V. 5. - P. 798-806.
34. Retroviruses can establish filopodial bridges for efficient cell-to-cell transmission / Sherer N. M., Lehmann M. J., Jimenez-Soto L.F., et al. // Nat. Cell Biol. - 2007. - V. 9 (3), - P. 310-5. URL: https://doi:10.1038/ncb1544.
35. The molecular characterization of bovine leukaemia virus isolates from Eastern Europe and Siberia and its impact on phylogeny /  M., Pluta A., Olech M., et al. // PLoS ONE: electronic recource. - 2013. - V.8 (3). URL: http://joumals.plos.org/plosone/article?id==10.1371/iournal.pone. 0058705.
M., Pluta A., Olech M., et al. // PLoS ONE: electronic recource. - 2013. - V.8 (3). URL: http://joumals.plos.org/plosone/article?id==10.1371/iournal.pone. 0058705.
36. Valikhov A.F., Immunological and virologic examination of milk, blood and sperm form cattle infected with onkornavirus. Leukoses of farm animals / Valikhov A.F., Burba L.G., Shishkov V.P. // In: Materials of the Soviet and Netherlands symposium. Proceedings of the All-Russian Research Institute of Experimental Veterinary Medicine. Y.R. Kovalenko. [Materialy Sovetsko-Niderlandskogo simpoziuma. Trudy Vserossiyskogo  instituta
instituta  veterinarii im. Ya.R. Kovalenko]. Moscow. - 1983. - V. 59. - P. 71-2. (in Russian).
veterinarii im. Ya.R. Kovalenko]. Moscow. - 1983. - V. 59. - P. 71-2. (in Russian).

