Результат интеллектуальной деятельности: Способы получения N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропитпиридазин-3-карбоксамида (варианты)
Вид РИД
Изобретение
Изобретение относится к новым фармацевтическим композициям и лекарственным средствам, содержащим соединение N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксамид в качестве позитивного аллостерического модулятора mGluR4 рецептора, которое может применяться при лечении болезни Паркинсона и сопутствующих заболеваний, к способам его получения и применения.
Болезнь Паркинсона - медленно-прогрессирующее хроническое нейродегенеративное заболевание, проявляющееся двигательными нарушениями (сочетанием гипокинезии с ригидностью, тремором покоя, постуральной неустойчивостью) и, так называемыми, не моторными симптомами. Вызывается прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, - прежде всего в черной субстанции, а также и в других отделах центральной нервной системы. Недостаточная выработка дофамина ведет к активирующему влиянию базальных ганглиев на кору головного мозга. Современная медицина пока не нашла методов излечения заболевания, однако существуют методы консервативного и оперативного лечения позволяющие значительно улучшить качество жизни больных и замедлить прогрессирование болезни.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Агонисты» означают соединения, которые, связываясь с рецепторами определенного типа, активно способствуют передаче этими рецепторами свойственного им специфического сигнала и тем самым вызывают биологический ответ клетки.
«Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
МАО - моноаминоксидаза. Ингибиторы моноаминоксидазы (ИМАО, MAOI) - биологически активные вещества, способные ингибировать фермент моноаминоксидазу, содержащийся в нервных окончаниях, препятствуя разрушению этим ферментом различных моноаминов (серотонина, норадреналина, дофамина, фенилэтиламина, триптаминов, октопамина) и тем самым способствуя повышению их концентрации в синаптической щели.
«Нейродегенеративное заболевание» означает специфическое состояние и заболевание, характеризующиеся повреждением и первичной гибелью популяций нервных клеток в определенных областях центральной нервной системы (ЦНС). Нейродегенеративные заболевания включают, но не ограничивают, болезни Альцгеймера и Паркинсона; болезнь (хорею) Хантингтона; рассеянный склероз; мозжечковую дегенерацию; амиотрофический латеральный склероз; деменцию с тельцами Леви; спинальную мускульную атрофию; периферическую нейропатию; губчатый энцефалит («коровье бешенство», Creutzfeld-Jakob Disease); СПИД-ассоциированную деменцию; мультиинфарктную деменцию; лобно-височную деменцию; лейкоэнцефалопатию (болезнь исчезающего белого вещества); хронические нейродегенеративные заболевания; инсульт; ишемическое, реперфузионное и гипоксическое повреждение мозга; эпилепсия; церебральная ишемия; глаукома; черепно-мозговая травма; синдром Дауна; энцефаломиелит; менингит; энцефалит; нейробластома; шизофрения; депрессия. Кроме того, нейродегенеративные заболевания включают патологические состояния и расстройства, развивающиеся при гипоксии, злоупотреблении веществами, вызывающими зависимость, при воздействии нейротоксинов, инфекционных и онкологических заболеваниях головного мозга, а также нейрональные повреждения, ассоциированные с аутоиммунными и эндокринными заболеваниями; и прочие нейродегенеративные процессы.
«Фармацевтически приемлемые эксципиенты» под фармацевтически приемлимыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители.
Современные разрешенные к применению антипаркинсонические препараты делятся на 2 группы: дофаминомиметики и центральные холино-блокаторы.
К лекарственным средствам, способным усиливать дофаминергическую передачу в ЦНС, относятся леводопа, агонисты дофаминовых рецепторов, ингибиторы МАО типа В и катехол-О-метилтрансферазы (КОМТ) и др. Леводопа устраняет дефицит эндогенного дофамина в нейронах стриопаллидарной системы. Она представляет собой физиологический предшественник дофамина, который не обладает способностью проникать через гемато-энцефалический барьер (ГЭБ). Леводопа проникает через ГЭБ по аминокислотному механизму, подвергается декарбоксилированию при участии ДОФА-декарбоксилазы и эффективно повышает уровень дофамина в стриатуме. Однако процесс декарбоксилирования леводопы происходит и в периферических тканях (где нет необходимости в повышении уровня дофамина), обусловливая развитие нежелательных эффектов, таких как тахикардия, аритмия, гипотензия, рвота и др. Экстрацеребральная продукция дофамина предотвращается ингибиторами ДОФА-декарбоксилазы (карбидопа, бенсеразид), которые не проникают через ГЭБ и не влияют на процесс декарбоксилирования леводопы в ЦНС. Примером комбинаций леводопа + ингибитор ДОФА-декарбоксилазы являются препараты Мадопар, Синемет и др. Значительное повышение уровня дофамина в ЦНС может приводить к нежелательным эффектам, таким как появление непроизвольных движений (дискинезия) и психических расстройств.
Повысить содержание дофамина в стриопаллидарной системе можно не только за счет увеличения его синтеза, но и за счет торможения катаболизма. Так, МАО типа В разрушает дофамин в полосатом теле. Этот изофермент селективно блокируется селегилином, что сопровождается угнетением катаболизма дофамина и стабилизацией его уровня в ЦНС. Кроме того, антипаркинсонический эффект селегилина обусловлен нейропротективными механизмами, в т.ч. угнетением образования свободных радикалов. Деградация леводопы и дофамина путем метилирования блокируется ингибиторами другого фермента - КОМТ (энтакапон, толкапон).
Агонисты дофаминовых рецепторов также могут устранять признаки дефицита дофаминергической нейротрансмиссии. Некоторые из них (бромокриптин, лизурид, каберголин, перголид) являются производными алкалоидов спорыньи, другие - неэрготаминовыми субстанциями (ропинирол, прамипексол). Эти лекарственные средства стимулируют D1, D2 и D3 подтипы дофаминовых рецепторов и, по сравнению с леводопой, характеризуются меньшей клинической эффективностью.
Во вторую группу входят центральные холинолитики (антихолинергические средства): дифенилтропин (Тропацин, Паркопан, Ромпаркин), биперидин (Акинетон), тригексифенидил (Циклодол), Динезин, Трифен.
Холинолитики способствуют восстановлению нейромедиаторного баланса в ЦНС за счет угнетения холинергической гиперактивности. Периферические холинолитические эффекты, наряду с нарушением когнитивных функций, в значительной мере ограничивают использование этой группы препаратов. Однако, они являются препаратами выбора при лекарственном паркинсонизме.
В настоящее время перспективной является разработка препаратов для лечения болезни Паркинсона, основанных на модуляции метаботропного глутаматного рецептора 4 (далее mGluR4). Это новый, более мягкий, по сравнению с ныне применяемыми, терапевтический подход к лечению паркинсонизма. Активация mGluR4 рецепторов в стриопаллидарном синапсе, приводит к торможению ГАМК-ергических рецепторов стриопаллидарной системы непрямого пути активации таламуса, приводя к ликвидации дисбаланса между прямым (возбуждающим) и непрямым (тормозящим) путями активации таламуса, а тем самым, к устранению симптомов болезни Паркинсона.
Согласно этому подходу, именно специфическое действие PAM-ов, а не прямое воздействие на глутаматную зону, рассматривается как возможный вариант лечения болезни Паркинсона.
Из уровня техники известны соединения, заявленные как аллостерические средства потенцирования mGlur4, а также композиции и способы лечения неврологических дисфункций, в том числе связанных с болезнью Паркинсона.
Например, описанные в опубликованной 20.12.2013 г. Заявке RU № 2012121631 (VANDERBILT UNIVERSITY), арил- и гетероарилсульфоны как аллостерические средства потенцирования mGlur4, со структурой, представленной формулой
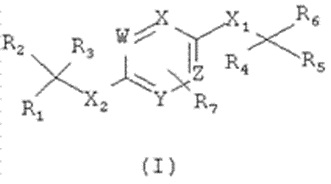 ,
,
а также композиции и способы лечения неврологических дисфункций типа нейротрансмиссии и других болезненных состояний, связанных с активностью mGluR4 у млекопитающего, включающие стадию введения в организм упомянутого млекопитающего по меньшей мере одного соединения, или фармацевтически приемлемой соли этого соединения, или фармацевтически приемлемого производного этого соединения, в дозировке и количестве, эффективных для лечения упомянутой дисфункции у млекопитающего.
Аллостерические средства потенцирования mGlur4 в опубликованной 27.11.2013 г. заявке RU №2012121633 (VANDERBILT UNIVERSITY), где заявлены соединения со структурой, представленной формулой
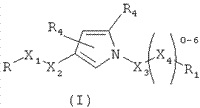
а также композиции и способы лечения неврологических дисфункций, в числе которых упомянута и болезнь Паркинсона.
Соединения со структурой, представленной формулой
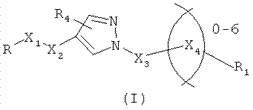
как аллостерические средства потенцирования mGlur4, а также композиции и способы лечения неврологических дисфункций, в том числе связанных с болезнью Паркинсона, описанные в опубликованной 27.11.2013 г. Заявке RU № 2012121630 (VANDERBILT UNIVERSITY).
Соединения со структурой, представленной формулой
а также способы лечения дисфункции нейротрансмиссии и других болезненных состояний, связанных с активностью mGluR4 у млекопитающего в опубликованной 10.10.2013 г. заявке RU № 2012114770 (VANDERBILT UNIVERSITY).
Задача настоящего изобретения заключается в расширении арсенала противопаркинсонических препаратов, основанных на модуляции mGluR4, разработке способов получения соединения, фармацевтических композициях на ее основе и способе их использования.
Было неожиданно обнаружено, что соединение (N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксамид - соединение формулы 1
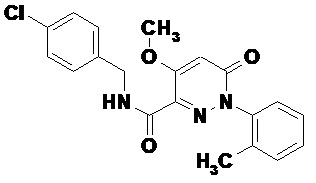
I
является эффективным позитивным аллостерическим модулятором mGluR4 рецепторов и может быть использовано для разработки на его основе лекарственных средств для лечения болезни Паркинсона.
Поставленная задача достигается:
- соединением (N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксамидом формулы I в качестве эффективного позитивного аллостерического модулятора mGluR4 рецепторов;
- способом получения (N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксамида формулы I исходя из орто-метиланилина 2 и диметилового или диэтилового эфиров ацетондикарбоновой кислоты 4 (схема 1). Дазониевая соль, полученная из метианилина реагирует с активной метиленовой группой диэфира ацетондикарбоновой кислоты давая гидразон 5, который при нагреве в инертном высококипящем растворителе дает 1,6-дигидропиридазин 6, который после метилирования йодистым метилом посредством последующего щелочного гидролиза переводится в кислоту 8; кислота 8 в присутствии конденсирующих реагентов типа карбодиимида реакцией с п-хлорбензиламином переводится в структуру I.
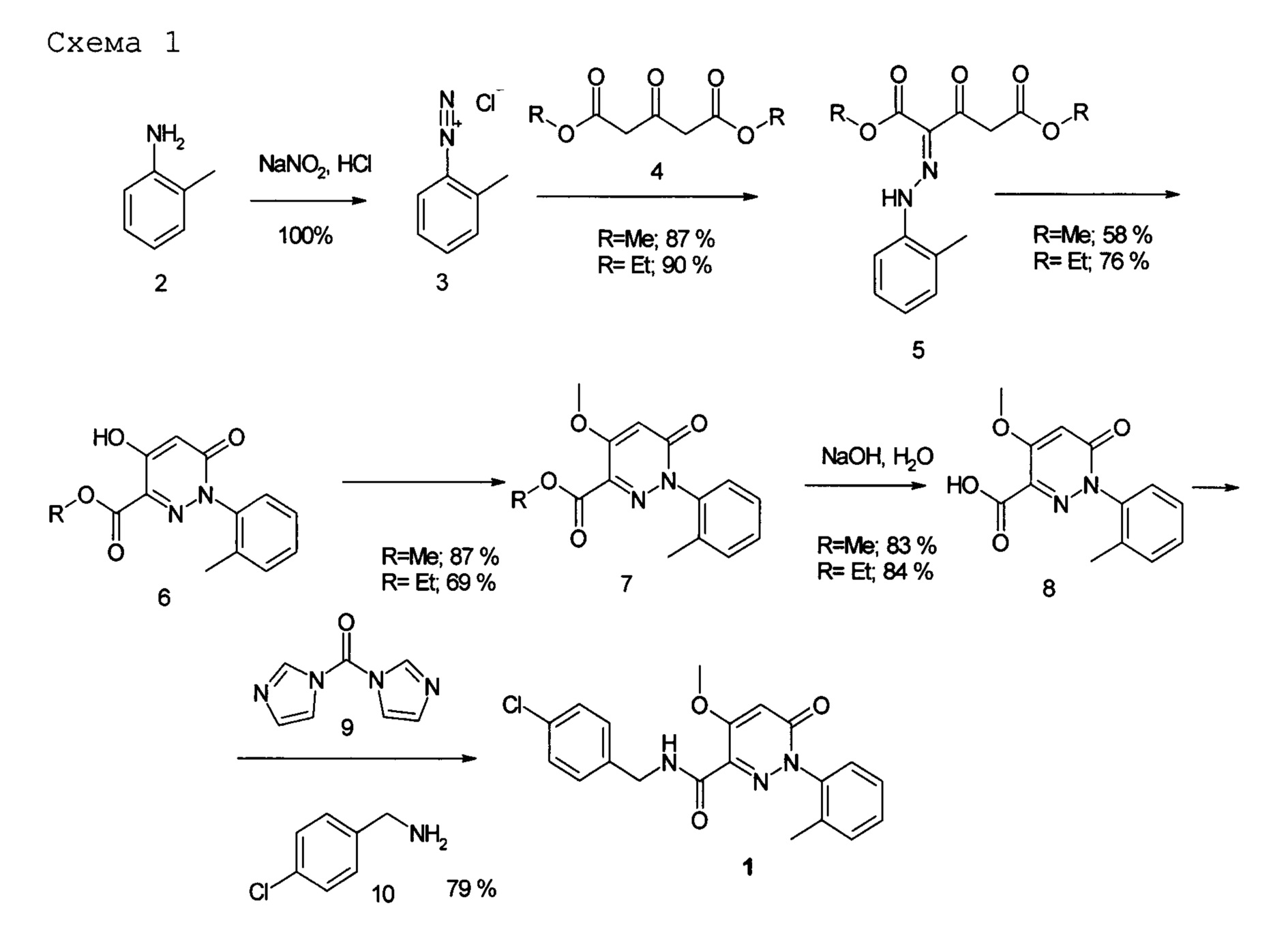
Предпочтительный вариант способа получения соединения формулы I по схеме 1 предусматривает следующие этапы:
а) к водно-солянокислому раствору 2-метиланилина добавляют водный раствор нитрита натрия с получением хлорида 2-метилфенилдиазония;
б) к водно-этанольному раствору диэтил 3-оксопентандиоата и ацетата натрия добавляют полученный на этапе а) раствор хлорида 2-метилфенилдиазония, выпавший осадок диэтил-(2 Z и Е)- 2-[(2-метилфенил)гидразоно]-3-оксопентандиоата отфильтровывают, промывают водой и высушивают;
в) диэтил-(2 Z и E)- 2-[(2-метилфенил)гидразоно]-3-оксопентандиоат, полученный на этапе б) растворяют в высококипящем инертном растворителе, кипятят, растворитель удаляют, образовавшийся осадок этил 4-гидрокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата промывают и затем сушат;
г) этил 4-гидрокси-1-(2-метилфенил)-6-оксо-1, 6-дигидропиридазин-3-карбоксилат полученный на этапе в) растворяют в диметилформамиде и добавляют йодистый метил, осадок этил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата отфильтровывают, промывают и высушивают;
д) полученный на этапе г), этил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата диспергируют в метаноле, добавляют водный раствор NaOH, перемешивают до полного растворения, затем добавляют водный 6 M раствор HCl до pH 2, выпавший осадок 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты отфильтровывают, промывают и лиофилизируют;
е) к дисперсии 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты, полученной на этапе д) в сухом тетрагидрофуране (далее ТГФ), добавляют дисперсию 1,1'-карбонилбис-1H-имидазола в сухом ТГФ, затем добавляют раствор 4-хлорбензиламина в сухом ТГФ, с получением осадка соединения формулы I, который выделяют и высушивают.
Другой вариант способа получения включает следующие этапы:
а) к водно-солянокислому раствору 2-метиланилина добавляют водный раствор нитрита натрия с получением хлорида 2-метилфенилдиазония;
б) к водно-этанольному раствору диметил 3-оксопентандиоата и ацетата натрия добавляют полученный на этапе а) раствор хлорида 2-метилфенилдиазония, выпавший осадок диметил-(2 Z и E)- 2-[(2-метилфенил)гидразоно]-3-оксопентандиоата отфильтровывают, промывают водой и высушивают;
в) диметил-(2Z и 2E)-2-[(2-метилфенил)гидразоно]-3-оксопентандиоат полученный на этапе б) растворяют в высококипящем инертном растворителе, кипятят, растворитель удаляют, образовавшийся осадок метил 4-гидрокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат, промывают и высушивают;
г) метил 4-гидрокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат, полученный на этапе в) растворяют в диметилформамиде, добавляют йодистый метил, выпавший осадок метил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата отфильтровывают, промывают и высушивают;
д) метил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат, полученный на этапе г) диспергируют в метаноле и добавляют водный раствор NaOH, смесь перемешивают до полного растворения, добавляют водный раствор 6 M HCl до pH 2, выпавший осадок 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты отфильтровывают, промывают и лиофилизируют;
е) к дисперсии 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты, полученной на этапе д), в сухом ТГФ добавляют последовательно при перемешивании сухой диметилформамид и оксалилхлорид до образования гомогенного раствора, далее отгоняют летучие компоненты, полученный 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбонил хлорида растворяют в сухом ТГФ;
ж) к раствору 4-хлорбензиламина и триэтиламина в ТГФ добавляют раствор 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбонил хлорида, полученный на этапе е), полученное соединение формулы I выделяют, промывают, очищают и высушивают.
Конкретные режимы / условия осуществления способов получения могут быть подобраны специалистом экспериментальным путем.
Кроме того, поставленная задача достигается фармацевтической композицией, предназначенной для лечения болезни Паркинсона и связанных с ней нейродегенеративных заболеваний, содержащей в эффективном количестве активный компонент, обладающий свойством позитивных аллостерических модуляторов mGuR4 рецепторов, представляющий собой N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксамид формулы I и фармацевтически приемлемые добавки в форме таблеток, капсул и инъекций, помещенных в фармацевтически приемлемую упаковку.
Новая фармацевтическая композиция может быть получена смешением с инертным наполнителем и/или растворителем активного компонента, представляющего собой, по крайней мере, соединение формулы I. Фармацевтическая композиция может включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются компоненты, выбранные из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как, консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты.
Фармацевтическая композиция для перорального, сублингвального, внутримышечного, внутривенного или подкожного введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями.
Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения; подкожные, внутримышечные и внутривенные формы введения. Фармацевтические композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного соединения с жидким или тонко измельченным твердым носителем.
Фармацевтическая композиция наряду с активным компонентом по настоящему изобретению может включать и другие активные ингредиенты, при условии, что они не вызывают нежелательных эффектов, например, аллергических реакций.
При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители; например, пероральные формы, такие как, таблетки, желатиновые капсулы, пилюли, растворы или суспензии; формы для инъекций, такие как, растворы или суспензии для инъекций, или сухой порошок для инъекций, который требует лишь добавления растворителя для инъекций перед использованием. Клиническая дозировка активного компонента (субстанции), фармацевтической композиции или лекарственного комбинированного средства, включающих фармацевтически эффективное количество активного компонента соединения формулы I, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 1 - 300 мг, предпочтительно 5 - 100 мг. Поэтому во время приготовления фармацевтических композиций по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 1 - 300 мг, предпочтительно - 5 - 100 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени, предпочтительно - от одного до шести раз.
Поставленная задача решается способом модуляции метаботропного глутаматного mGluR4 рецептора введением в эффективном количестве соединения формулы I или новой фармацевтической композиции, включающей фармацевтически эффективное количество активного компонента, представляющего собой соединение формулы I, нуждающемуся в этом реципиенту для профилактики и лечения болезни Паркинсона и связанных с ней нейродегенеративных заболеваний.
Представленные ниже примеры иллюстрируют, но не ограничивают изобретение.
Структуры полученных соединений подтверждались данными химического, хроматографического и спектрального анализа.
Пример 1. Получение хлорида 2- метилфенилдиазония (3).
К раствору 2-метиланилина (2) (108.1 г, 1008.9 ммоль, 1.00 экв.) в смеси 12 M водной HCl (6 экв., 515 мл) и воды (1000 мл) в температурном интервале ~ -3 ~ +5°C добавляют по каплям при интенсивном перемешивании раствор нитрита натрия (1.00 экв., 1008.9 ммоль, 69.6 г) в воде (750 мл). По окончании прикапывания смесь перемешивают в этих же условиях в течение 1 часа. Данную смесь используют в следующей стадии без спектральных анализов и выделения целевого продукта в индивидуальном состоянии. Выход (3) 156.0 г (100.00%) постулирован.
Пример 2. Получение смеси изомеров (2Z и 2Е) диметил 2-[(2-метилфенил)гидразоно]-3-оксопентандиоата (5а).
К охлажденному до ~0°С раствору диметил 3-оксопентандиоата (4а) (175.7 г, 1008.8 ммоль, 1.00 экв) в смеси этанола (600 мл), воды (2000 мл) и ацетата натрия (7.35 экв., 7526.3 ммол, 617.4 г) добавляют тонкой струей при энергичном перемешивании полученный ранее охлажденный до ~0°С раствор хлорида 2-метилфенилдиазония (1008.9 ммол) 2 в 12 М водной HCl (515 мл) и воде (1750 мл). При этом тотчас начинается осаждение желтого кристаллического продукта. Смесь перемешивают, давая ей нагреться до амбиентной температуры, после чего перемешивают в этих условиях в течение 1 часа. Желтый кристаллический осадок отфильтровывают, промывают на фильтре водой до нейтрального рН (по индикаторной бумаге) и высушивают сначала на воздухе в течение ночи, а затем в вакуумном сушильном шкафу при 60°С и 20 мбар. Выход (5а) 267.3 г (90.6%).
Спектр ЯМР 1H (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 2.32 (s.) и 2.34 (s). (3Н, СН3); 3.62 (s,) и 3.64 (s,) (3Н, СН3); 3.77 (s.) и 3.84, (s.) (3Н, СН3); 3.87 (s.) и 3.97 (s.) (2Н, СОСН2СО); 7.03 … 7.21 (m. 1Н С6Н4); 7.21…7.43 (m. 2Н С6Н4); 7.52…7.72 (m. 1Н С6Н4); 12.67 (s.) и 14.74 (s.) (1Н, NH) - смесь изомеров ~1:3
LCMS: два пика с временами удерживания 16.96 мин. (М+Н+=293.3) и 17.84 мин. (М+Н+=293.3) и с суммарным содержанием вещества 99.3…99.9% по УФ-детекторам и 96.2% по ELSD.
Пример 3. Получение метил 4-гидрокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (6а).
Раствор смеси изомеров (2Z и 2Е) диметил 2-[(2-метилфенил)гидразоно]-3-оксопентандиоата (5а) (415.3 г, 1420.8 ммоль, 1.00 экв) в 1, 2-дихлорбензоле (1600 мл) кипятят при перемешивании в течение 3 часов (температура в масляной бане 200°С). Далее смесь охлаждают до амбиентной температуры и помещают на ночь в холодильник. Выпавший кристаллический осадок отфильтровывают, промывают на фильтре гексаном (2 раза по 150 мл) и высушивают на воздухе. Масса осадка (6а) 215.8 г (58.4%).
Спектр ЯМР 1Н (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 2.04 (s. 3Н. С6Н4СН3); 3.82 (s. 3Н. СООСН3,); 6.24 (в, 1Н, СН pyrazinone); 7.10-7.55 (m, 4Н, С6Н4); 11.99 (br. s. ОН);
LCMS: один пик с временем удерживания 13.00 мин. (М+Н+=261.3) с содержанием вещества 96.4…99.3% по УФ-детекторам и 83.9% по ELSD.
Пример 4. Получение смеси изомеров (2Z и 2Е)диэтил 2-[(2-метилфенил)гидразоно]-3-оксопентандиоата (5b).
К охлажденному до ~0°С раствору диэтил 3-оксопентандиоата (4b) (252.0 г, 124 6.2 ммоль, 1.00 экв) в смеси этанола (730 мл), воды (2500 мл) и ацетата натрия (7.35 экв., 9159.8 ммол, 751.4 г) добавляют тонкой струей при энергичном перемешивании полученный ранее охлажденный до ~0°С раствор хлорида 2-метилфенилдиазония (3) (124 6.2 ммол) в смеси 12 М водной HCl (640 мл) и воды (2200 мл). При этом тотчас начинается осаждение желтого кристаллического продукта. Смесь перемешивают, давая ей нагреться до амбиентной температуры, после чего перемешивают в этих условиях в течение 1 часа. Желтый кристаллический осадок отфильтровывают, промывают на фильтре водой до нейтрального рН (по индикаторной бумаге) и высушивают сначала на воздухе в течение ночи, а затем в вакуумном сушильном шкафу при 60°С и 20 мбар. Выход (5b) 368.2 г (92.2%).
Спектр ЯМР 1H (400.13МГц, ДМСО-d6, δ, м.д., J/Гц: 1.08…1.24 (m.) (3Н, СН2СН3); 1.25…1.40 (m.) (3Н, СН2СН3); 2.32 (s,) и 2.35 (s,) (С6Н4СН3); 3.85 (s.) и 3.95, (s.) (2Н, СОСН2СО); 4.01…4.18 (m., 2Н, СН2СН3); 4.19…4.41 (m., 2Н, СН2СН3); 7.06…7.19 (m., 1Н, С6Н4); 7.23…7.37 (m., 2Н, С6Н4); 7.55…7.70 (m., 1Н, С6Н4); 12.58 (s.) и 14.71 (s.) (1Н, NH) - смесь изомеров ~1:3;
LCMS: два пика с временами удерживания 13.20 мин. (М+Н+=321.3) и 13.70 мин. (М+Н+=321.3) и с суммарным содержанием вещества 99.3% по УФ-детекторам и 95.2% по ELSD.
Пример 5. Получение этил 4-гидрокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (6b)
Раствор диэтил (2Z и Е) - 2-[(2-метилфенил)гидразоно]-3-оксопентандиоата (5b) (721.0 г, 1149.4 ммоль, 1.00 экв) в 1,2-дихлорбензоле (1975 мл) кипятят при перемешивании и 190°С (в масляной бане) в течение 4 часов. Смесь охлаждают до 90°С (в масляной бане) и отгоняют из реакционной смеси 1,2-дихлорбензола (~1650 мл). Температуру масляной бани повышают до 100°С. Затем смесь охлаждают до ~50°С, после чего тонкой струей при перемешивании выливают в эфир (1000 мл). Образовавшийся кристаллический осадок диспергируют и отфильтровывают. Осадок на фильтре промывают эфиром (2 раза по 500 мл). Объединенные эфирные фильтраты отбрасывают. Затем осадок сушат на воздухе, измельчают в ступке до порошкообразного состояния, диспергируют в эфире (750 мл), отфильтровывают, промывают на фильтр эфиром (500 мл) и высушивают на воздухе. Эфирный фильтрат отбрасывают. Выход (6b) 467.9 г (75.8%).
Спектр ЯМР 1Н (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 1.26 (t., J=7.2 Hz, 3Н, СН2СН3); 2.04 (s., 3Н, С6Н4СН3) 4.43 (q., J=7.2 Hz, 2H. СН2СН3); 6.23 (s, 1H, CH pyrazinone); 7.10-7.59 (m, 4H, C6H4); 11.94 (br. s. OH);
LCMS: один пик с временем удерживания 14.14 мин. (М+Н+=275.3) с содержанием вещества 96.5…97.0% по УФ-детекторам и 99.1% по ELSD.
Пример 6. Получение метил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (7а).
К раствору метил 4-гидрокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (6а) (382.5 г, 14 69.7 ммоль, 1 экв.)] в сухом диметилформамиде (2900 мл) добавляют последовательно при перемешивании и ~0°С прокаленный K2СО3 (2.60 экв., 3821.3 ммол, 528.67 г) и йодистый метил (1.40 экв., 2057.6 ммол 292.1 г, 128 мл). Смеси дают нагреться до амбиентной температуры перемешивают при этих условиях в течение 3-х дней. Мониторинг полноты прохождения реакции осуществляют с помощью ТСХ (EtOAc - гексан 2:1 v/v. К реакционной смеси добавляют при перемешивании ТГФ (1000 мл) и перемешивают 30 минут. Реакционную смесь профильтровывают. Осадок промывают на фильтре ТГФ (2 раза по 250 мл). Объединенные фильтраты упаривают в вакууме на РПИ, (в бане 47°С) до объема ~700 мл. Остаток выливают в воду (3500 мл) и перемешивают при амбиентной температуре 1 час. Выпавший осадок отфильтровывают, промывают на фильтре водой (2 раза по 1000 мл) и высушивают на воздухе. Выход продукта (7а) 350.5 г (86.9%).
Спектр ЯМР 1Н (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 2.05 (s. 3Н. С6Н4СН3); 3.82 (s, 3Н, СООСН3); 3.91 (s, 3Н, ОСН3); 6.58 (в, 1Н, pyrazinone); 7.14…7.54 (m., 4Н, С6Н4):
LCMS: один пик с временем удерживания 13.24 мин. (М+Н+=275.3) с содержанием вещества 98.9…99.3% по УФ-детекторам и 100% по ELSD:
Пример 7. Получение этил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (7b).
К раствору этил 4-гидрокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (6b) (233.3 г, 850.6 ммоль, 1 экв.) в сухом диметилформамиде (17 00 мл) добавляют при перемешивании и ~0°С прокаленный K2СО3 (2.60 экв., 2211.5 ммол, 305.7 г). Смесь перемешивают при этой температуре до прекращения активного газовыделения (~15 минут). Затем при этих же условиях добавляют одномоментно йодистый метил (1.40 экв., 1190.8 ммоль 292.1 г, 74 мл). Смесь перемешивают при амбиентной температуре в течение 3-х дней. Мониторинг полноты прохождения реакции осуществляют с помощью ТСХ (EtOAc - гексан 2:1 v/v). К реакционной смеси добавляют при перемешивании ТГФ (600 мл) и перемешивают 30 минут. После этого смесь профильтровывают от нерастворимых неорганических примесей. Осадок промывают на фильтре ТГФ (2 раза по 250 мл). Объединенные фильтраты упаривают в вакууме на РПИ (температуру в бане постепенно повышают от 50 до 70°С) до объема ~500 мл. Остаток выливают в воду (4500 мл) при перемешивании и смесь перемешивают при амбиентной температуре 30 минут. Выпавшая масса постепенно закристаллизовалась. Осадок отфильтровывают, промывают последовательно на фильтре водой (2 раза по 500 мл), охлажденным (~0°С) этанолом (2 раза по 300 мл) и высушивают на воздухе. Все водные и спиртовые фильтраты отбрасывают. Выход продукта (7b) 169.1 г (69.0%).
Спектр ЯМР 1Н (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 1.26 (t. 3Н, J=7.1 Hz, СН2СН3); 2.06 (s., 3Н С6Н4СН3); 3.91 (s, 3Н, ОСН3); 4.29 (q., 2Н, J=7.1 Hz, СН2СН3); 6.58 (s, 1Н, pyrazinone); 7.19…7.52 (m., 4H, C6H4):
LCMS: пик целевого продукта с временем удерживания 14.41 мин. (М+Н+=275.3) с содержанием вещества 90.7…97.4% по УФ-детекторам и 99.9% по ELSD.
Пример 8. Получение 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (8) из метил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (7а).
К дисперсии метил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (7а) (17 4.0 г, 634.4 ммоль, 1.0 экв.) в метаноле (400 мл) при перемешивании и амбиентной температуре добавляют воду (200 мл) и далее раствор NaOH (1.12 экв., 710.0 ммол, 28.4 г) в воде (400 мл). Смесь перемешивают при этих же условиях до полного растворения 7 (30…40 минут). Полученный гомогенный раствор и охлаждают на водяной бане до 10…15°С К раствору при перемешивании и амбиентной температуре добавляют порциями по ~10 мл (всего ~120 мл) водную 6 М HCl до рН ~ 2 (по индикаторной бумаге). При этом выпадает объемный осадок почти белого цвета. Далее к смеси при перемешивании добавляют последовательно ТГФ (200 мл) и воду (200 мл). Выпавший осадок отфильтровывают на широком (диаметр 25 см) фильтре. Влажный осадок суспендируют в диэтиловом эфире (1000 мл) и вновь отфильтровывают. Окончательно осадок диспергируют в воде (1000 мл) и отфильтровывают. Влажный осадок замораживают в при ~ - 40°С и высушивают на лиофильной сушилке. Выход кислоты (8) 137 г (83%).
Спектр ЯМР 1H (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 2.05 (s., 3Н С6Н4СН3); 3.90 (s, 3Н, ОСН3); 6.54 (s, 1Н, pyrazinone); 7.13…7.57 (m., 4Н, С6Н4); 13.67 (br. s., 1Н, СООН):
LCMS: пик целевого продукта с временем удерживания 9.90 мин. (М+Н+=261.3) с содержанием вещества 95.4…97.0% по УФ-детекторам и 99.6% по ELSD.
Пример 9. Получение 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (8) из этил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (7b).
К дисперсии этил 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата (7b) (180.0 г, 624.3 ммоль, 1.0 экв.) в метаноле (4 00 мл) при перемешивании и амбиентной температуре добавляют воду (200 мл) и далее раствор NaOH (1.12 экв., 699.0 ммол, 27.9 г) в воде (400 мл). Смесь перемешивают при этих же условиях до полного растворения 7 (около 2 часов). Полученный гомогенный раствор и охлаждают на водяной бане до 10…15°С. К раствору при перемешивании и амбиентной температуре добавляют порциями по ~10 мл (всего ~120 мл) водную 6 М HCl до рН ~2 (по индикаторной бумаге). При этом выпадает объемный осадок почти белого цвета. Далее к смеси при перемешивании добавляют последовательно ТГФ (200 мл) и воду (200 мл). Выпавший осадок отфильтровывают на широком (диаметр 25 см) фильтре. Влажный осадок суспендируют в диэтиловом эфире (1000 мл) и вновь отфильтровывают. Окончательно осадок диспергируют в воде (1000 мл) и отфильтровывают. Влажный осадок замораживают в при ~ - 40°С и высушивают на лиофильной сушилке. Выход кислоты (8) 138 г (84%).
Спектр ЯМР: 1Н (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 2.06 (s., 3Н С6Н4СН3); 3.90 (s, 3Н, ОСН3); 6.54 (s, 1Н, pyrazinone); 7.10…7.64 (m., 4Н, С6Н4); 13.75 (br. s., 1Н, СООН);
LCMS: пик целевого продукта с временем удерживания 9.98 мин. (М+Н+=261.3) с содержанием вещества 98.7…99.8% по УФ-детекторам и 99.8% по ELSD.
Пример 10. Получение 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбонил хлорида (8а)
К дисперсии 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (8) 5.83 г (22.42 ммоль, 1 экв.) из в сухом ТГФ (90 мл) добавляют последовательно при перемешивании и амбиентной температуре сухой диметилформамид (0.055 экв., 1.2 4 ммол, 90 мг, 96 мкл) и по каплям оксалилхлорид (2.20 экв., 49.33 ммол, 6.26 г, 4330 мкл). После добавления оксалилхлорида дисперсия растворилась с образованием гомогенного раствора. Смесь перемешивают при тех же условиях в течение ночи (>15 часов). Далее в вакууме на РПИ отгоняют летучие компоненты. Кристаллический остаток диспергируют в сухом толуоле (75 мл) и еще раз в вакууме на роторном вакуумном испарителе РПИ отгоняют летучие компоненты. Кристаллический остаток растворяют в сухом ТГФ (100 мл). Раствор хлорангидрида (8а) в ТГФ (тетрагидрофуран) используют в следующей стадии без какой-либо дополнительной очистки. Выход (8а) 6.25 г (100%) постулирован.
Пример 11. Получение N-(4-хлобензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропитпиридазин-3-карбоксамида (1) через хлорангидрид кислоты (8а)
К раствору 4-хлорбензиламина (10) (2728 мкл, 3.18 г, 22.42 ммол, 1.00 экв.) и ТЭА (34 30 мкл, 2.50 г, 24.66 ммол, 1.1 экв.) в сухом ТГФ (100 мл) добавляют по каплям при перемешивании и амбиентной температуре раствор 4-метокси-1-(2-метилфенил)-6-оксо-1, 6-дигидропиридазин-3-карбонил хлорида (8а) (6.25 г, 22.42 ммол, 1.00 экв) в сухом ТГФ (100 мл). при охлаждении на водяной бане с водой амбиентной температуры. Смесь перемешивают при тех же условиях в течение ночи (>16 часов). Мониторинг за прохождением реакции осуществляют с помощью LCMS. Реакционную смесь профильтровывают от осадка гидрохлорида триэтиламина. Осадок на фильтре промывают сухим ТГФ (2 раза по ~25 мл). Объединенные фильтраты досуха упаривают в вакууме на РПИ. Остаток растворяют в дихлорметане ДХМ (100 мл). Органический раствор последовательно промывают 2 N водной HCl (2 раза по 25 мл), насыщенным водным NaHCO3 (2 раза по 25 мл), высушивают над безводным MgSO4/ профильтровывают и досуха упаривают в вакууме на РПИ. Остаток перекристаллизовывают из кипящего толуола (110 мл), отфильтровывают, промывают на фильтре последовательно толуолом (2 раза по 30 мл), гексаном (2 раза по 30 мл) и высушивают на воздухе. Выход продукта (1) ~ 6.56 г (76.20%).
Спектр ЯМР 1H: (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 2.08 (s., 3Н С6Н4СН3); 3.90 (s, 3Н, ОСН3); 4.40 (d., 2Н, J=6.0 Hz, CH2NH) 6.53 (s, 1Н, pyrazinone); 7.05…7.62 (m., 8H, CH двух групп С6Н4); 9.04 (t., 1Н, J=6.0 Hz, CH2NH);
LCMS: пик целевого продукта с временем удерживания 15.70 мин. (М+Н+=384.0 и 386.3) с содержанием вещества 98.9…99.9% по УФ-детекторам и 100% по ELSD.
Пример 12. Получение N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксамида (1) через 1,1ʹ-карбонилбис-1Н-имидазол (9)
К дисперсии 4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (8) (14 8.0 г, 568.7 ммол, 1 экв.) в сухом ТГФ (1000 мл) при перемешивании и 50°С добавляют по каплям при энергичном перемешивании дисперсию 1,1ʹ-карбонилбис-1Н-имидазола (9) (0,94 экв., 536.5 ммоль, 87 г) в сухом ТГФ (300 мл) с такой скоростью, чтобы обеспечить приемлемое газовыделение и пенообразование. По окончании добавления реакционную смесь перемешивают при 55°С в течение 2 часов. Затем смесь охлаждают до амбиентной температуры и добавляют по каплям при энергичном перемешивании раствор 4-хлорбензиламина (10) (1. 00 экв., 568.7 ммол, 80.5 г) в сухом ТГФ (150 мл). Реакционную смесь перемешивают при 50°С в течение 1 часа, после чего охлаждают до амбиентной температуры и упаривают досуха в вакууме на РПИ. Остаток диспергируют в смеси ДХМ (1000 мл) - вода (300 мл) и энергично перемешивают до его растворения. Органический слой отделяют, водный слой экстрагируют ДХМ (2 раза по 300 мл). Водный слой отбрасывают. Объединенные органические слои последовательно промывают 2% водной соляной кислотой (300 мл), водой (300 мл) и профильтровывают через целит 545 (высота слоя 5 см). Целит промывают ДХМ (3 раза по 100 мл). Объединенные фильтраты упаривают досуха в вакууме на РПИ. Вязкий остаток растворяют в этилацетате (400 мл) при перемешивании и 40…50°С. После охлаждения до амбиентной температуры к раствору при перемешивании добавляют диэтиловый эфир (400 мл) и перемешивают в этих условиях в течение часа. Выпавший осадок отфильтровывают, промывают на фильтре последовательно смесью этилацетат - диэтиловый эфир 1:1 v/v (3 раза по 150 мл), гексаном (1 раз 300 мл) и высушивают сначала на воздухе, а затем в вакууме при 40°С и 0.7 мбар. Выход целевого продукта (1) 172.0 г (78.8%). Белое или белое с желтоватым оттенком кристаллическое вещество.
Спектр ЯМР 1Н (400.13МГц, ДМСО-d6, δ, м.д., J/Гц): 2.08 (s., 3Н С6Н4СН3); 3.90 (s, 3Н, ОСН3); 4.40 (d., 2Н, J=6.0 Hz, CH2NH) 6.53 (s, 1Н, pyrazinone); 6.55…7.68 (m., 8H, CH двух групп С6Н4); 9.04 (t., 1Н, J=6.0 Hz, CH2NH).
LCMS: пик целевого продукта с временем удерживания 15.70 мин. (М+Н+=384.0 и 386.3) с содержанием вещества 98.9…99.9% по УФ-детекторам и 100% по ELSD.
Пример 13. Исследование активности in vitro.
Вещество формулы 1 протестировано на активацию/блокирование рецептора mGluR4 с использованием скрининговой платформы FLIPR (Fluorometric Imaging Plate Reader). Вещество формулы 1 вызвало активацию mGluR4 рецептора >50% при концентрации в 5 мкМ. Было проведено дальнейшее тестирование в диапазоне концентраций от 10 нМ до 100 мкМ для определения параметра ЕС50.
Данные анализировали в программе GraphPad Prizm (GraphPad Software, Inc., San Diego, CA). Для построения концентрационной зависимости было выбрано уравнение
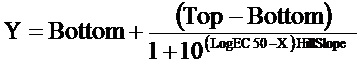
Вещество формулы 1 показало ЕС50 на уровне 734 нМ.
Пример 14. Исследование противопаркинсонической активности in vivo
В качестве модели заболевания Паркинсона была выбрана модель каталепсии - «удержания позы лектора», индуцированной галоперидолом и скополамином.
Дизайн исследования каталепсии у мышей
Исследование проведено на 24 самцах мышей линии CD1 в возрасте 8 недель. В начале эксперимента масса животных составляла 33,5±0,4 г. Было использовано 3 группы мышей (табл. 1).
Мышам из 2-х экспериментальных групп перорально (РО) при помощи внутрижелудочного зонда вводили вещество формулы 1 в дозах 0,3 и 3,0 мг/кг. Животным из контрольной группы аналогичным образом вводили растворитель. Через 30 мин всем мышам интраперитониально (IP) вводили раствор галоперидола (1 мг/кг) и раствор скополамина (1 мг/кг). После введения галоперидола через 30 мин, 60 мин, 120 мин, 180 мин всех животных тестировали на длительность удержания позы на горизонтальном стержне.
По окончании исследования животных эвтаназировали при помощи СО2-ингаляции.
Таблица 1. Мыши, распределение по группам и дозы тестируемых веществ
|
Тестирование на каталепсию с использованием горизонтального стержня
Для тестирования использовали горизонтальный стержень диаметром 0,5 см, закрепленный в штативе на высоте 4 см.
|
* - р<0,05, ** - р<0,005 в сравнении с группой Контроль (ANOVA, post-hoc критерий Ньюмана-Кеулса)
Таким образом, приведенные примеры подтверждают достижение поставленной задачи по расширению арсенала противопаркинсонических препаратов на основе соединения N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропитпиридазин-3-карбоксамид как позитивного аллостерического модулятора mGluR4 рецептора, разработке способов получения указанного соединения, фармацевтических композициях на его основе и способе использования.
Каждую мышь располагали у стержня так, чтобы она опиралась на обе передние лапки (поза лектора). На протяжении 1 мин регистрировали время пребывания животного в неподвижном состоянии. При изменениях положения тела животного до окончания 1-мин периода, мышь снова устанавливали в «позу лектора», но не более 3 раз. Оценивали общую продолжительность каталепсии.
Анализ данных
Межгрупповое сравнение исследованных параметров проводили при помощи однофакторного дисперсионного анализа (ANOVA) с последующим сравнением по критерию Ньюмана-Кеулса (Statistica 6.0).
Длительность удержания «позы лектора» на горизонтальном стержне
Результаты представлены в Таблице 2. Согласно представленным данным, через 30, 60 и 120 мин после введения галоперидола длительность удержания «позы лектора» в группах мышей, получивших вещество формулы 1 в дозах 0,3 и 3,0 мг/кг, была с высоким уровнем статистической значимости меньше, чем в контрольной группе животных. Через 180 мин после введения галоперидола данное отличие было достоверным только в группе животных, получивших исследуемое соединение в дозе 0,3 мг/кг.
Таблица 2. Длительность (сек) удержания мышами «позы лектора» на горизонтальном стержне
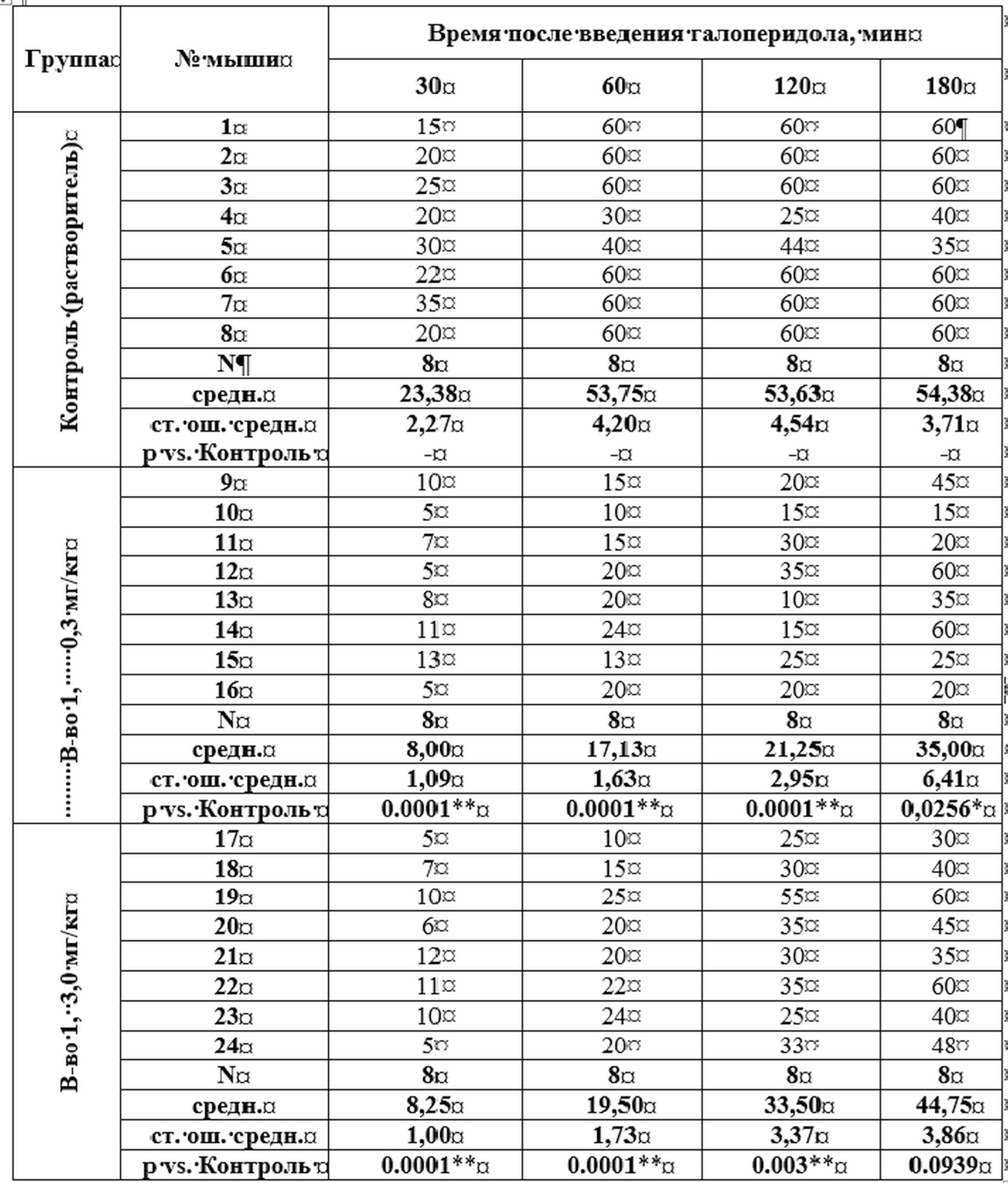
* - р<0,05, ** - р<0,005 в сравнении с группой Контроль (ANOVA, post-hoc критерий Ньюмана-Кеулса)
Таким образом, приведенные примеры подтверждают достижение поставленной задачи по расширению арсенала противопаркинсонических препаратов на основе соединения N-(4-хлорбензил)-4-метокси-1-(2-метилфенил)-6-оксо-1,6-дигидропитпиридазин-3-карбоксамид как позитивного аллостерического модулятора mGluR4 рецептора, разработке способов получения указанного соединения, фармацевтических композициях на его основе и способе использования.

