Результат интеллектуальной деятельности: Водорастворимое производное триптантрина, обладающее противоопухолевой, противовоспалительной и противомикробной активностью, и повышающее терапевтическую активность противоопухолевых антибиотиков
Вид РИД
Изобретение
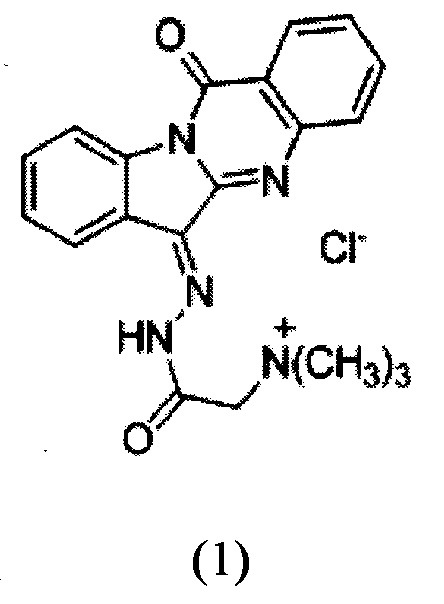
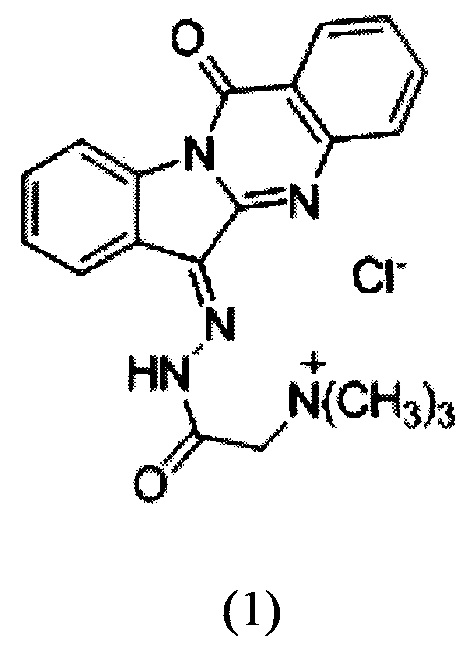
Изобретение относится к химико-фармацевтической промышленности, конкретно к новому химическому соединению - водорастворимому производному триптантрина формулы 1,
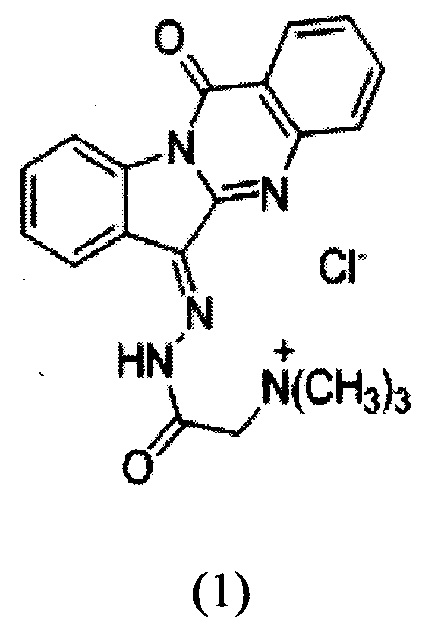
обладающему противоопухолевой, противовоспалительной и противомикробной активностью, и повышающему терапевтическую активность противоопухолевых антибиотиков, что сделает возможным его использование в медицине в качестве фармацевтического средства.
Хиназолиновый алкалоид триптантрин, который можно рассматривать в качестве прототипа предлагаемого средства, давно привлекает внимание исследователей, разрабатывающих новые лекарственные препараты эффективные при лечении различных заболеваний.
Интерес к триптантрину связан с его разносторонним фармакологическим действием [Jahng Y. Progress in the studies on tryptanthrin, an alkaloid of history // Arch. Pharm. Res. 2013. V. 36(5). P. 517-535]. Этот алкалоид был выделен из ряда высших растений, например Couroupita guianensis, Isatis tinctoria, а также некоторых дрожжевидных грибов (Candida lypolitica и Malassezia furfur) и морских бактерий Oceanibulbus indolifex [Wagner-Dobler I., et. al. Oceanibulbus indolifex gen. nov., sp. nov., a North Sea alphaproteobacterium that produces bioactive metabolites // Int. J. System. Evol. Microbial. 2004. V. 54. P. 1177-1184; Vlachos C, et. al. Malassezia-derived indoles activate the aryl hydrocarbon receptor and inhibit Toll-like receptor-induced maturation in monocyte-derived dendritic cells // Br. Assoc. Dermatol. 2012. V. 167. P. 496-505].
В многочисленных исследованиях медико-биологической активности триптантрина было показано, что он проявляет, прежде всего, противовоспалительные, противоопухолевые и противомикробные свойства, а также обладает противопаразитарным действием.
Действительно, триптантрин, являясь ингибитором каскада арахидоновой кислоты и тормозя биосинтез простагландинов и лейкотриенов через супрессию активности циклооксигеназы СОХ-2 и 5-липоксигеназы (5-LOX), проявляет сильные противовоспалительные свойства [Pergola С, et al. On the inhibition of 5-lipoxygenase product formation by tryptanthrin: mechanistic studies and efficacy in vivo // Brit. J. Pharm. 2012. V. 165. P. 765-776]. Триптантрин также ингибирует активность толл-подобных рецепторов (TLR) и сопряженных с ними некоторых факторов транскрипции, например, сигнальных трансдукторов и активаторов транскрипции (STAT), в частности STAT3 и STAT5, и ядерного фактора-кВ (NF-кВ). Следовательно, триптантрин препятствует развитию воспалительного процесса в организме, так как TLR, STAT и NF-кВ являются основными регуляторами активности врожденного и адаптивного иммунитета, а их избыточная активность приводит к инициации и прогрессии различных воспалительных патологий [Hui-Man Cheng, et. al. // Clinical efficacy and IL-17 targeting mechanism of Indigo naturalis as a topical agent in moderate psoriasis // BMC Complementary and Alternative Medicine 2017. V. 17 (439)]. Кроме того, показано, что этот алкалоид эффективно подавляет экспрессию ряда противовоспалительных цитокинов и ростовых факторов и блокирует их эффекторное действие на различные клетки.
Противомикробное действие триптантрина предположительно реализуется путем его интеркалирования в микробную ДНК [Bandekar P.P., et al. Antimicrobial activity of tryptanthrins in Escherichia coli // J. Med. Chem. 2010. V. 53. P. 3558-3565; Schindler F., Zahner H. Metabolic products of microorganisms. Tryptanthrin, a tryptophan derived antibiotic from Candida lipolytica // Arch. Microbiol. 1971. V. 79. P. 187-203]. Триптантрин ингибирует рост различных видов стафилакокков (Staphylococcus aureus, S. epidermis), Bacillus subtilis, Mycobacterium tuberculosis и Helicobacter pylori, с которой связан патогенез язвы желудка [Scovill J., et al. Antimicrob Agents Chemother. 2002. V. 46(3). P. 882-883; Hwang J.M., et al. Design, synthesis, and structure-activity relationship studies of tryptanthrins as antitubercular agents // J. Nat. Prod. 2013. V. 76(3). P. 354-367]. Он известен также как высокоспецифический противогрибковый агент в отношении возбудителя стригущего лишая Trichophyton mentagraphites [Honda G, et al. The antimicrobial specificity of tryptanthrin // Planta Med. 1979. V. 37. P. 172-174].
Исследования in vitro и in vivo, выполненные отечественными и зарубежными учеными, показали, что триптантрин проявляет противоопухолевую активность. В многочисленных тестах in vitro было зарегистровано, что он ингибирует пролиферацию различных линий опухолевых клеток человека и животных [Jao C.W., et al. Isolation, Structure Elucidation, and Synthesis of Cytotoxic Tryptanthrin Analogues from Phaius mishmensis // J. Nat. Prod. 2008. V. 71. P. 1275-1279].
Кроме того, триптантрин является ингибитором синтеза некоторых белковых факторов, которые принимают участие в злокачественной трансформации клеток, например фактора роста гепатоцитов (HGF), содействующего пролиферации, росту, инвазии и метастазированию опухолевых клеток [Motoki Т, et al. Inhibition of hepatocyte growth factor induction in human dermal fibroblasts by tryptanthrin // Biol Pharm Bull. 2005. V. 28(2). P. 260-266].
Показано, что пероральное введение триптантрина уменьшает случаи рака кишечника крыс, индуцированного азоксиметаном [Koya-Miyata S., et al. Prevention of azoxymethane-induced intestinal tumors by a crude ethyl acetate-extract and tryptanthrin extracted from Polygonum tinctorium Lour // Anticancer Res. 2001. V. 21. P. 3295-3300].
Следует отметить, что в тестах на человеческих моноцитарных (U-937) и промиелоцитарных (HL-60) лейкемических клетках высокие концентрации триптантрина приводят к апоптотической гибели лейкемических клеток, а его низкие дозы индуцируют редифференцировку опухолевых клеток, переключая их развитие с пути злокачественной трансформации в сторону нормального клеточного фенотипа путем активации маркеров клеточной дифференцировки [Kimoto Т., Hino К., et. al. Cell differentiation and apoptosis of monocytic and promyelocytic leukemia cells (U-937 and HL-60) by tryptanthrin, an active ingredient of Polygonum tinctorium Lour Pathol. Int. 2001. V. 51. P. 315-325].
Предполагают, что противоопухолевое действие триптантрина может осуществляться за счет его супрессорного эффекта в отношении STAT3 и NF-κВ - универсальных клеточных регуляторов, которые усиливают экспрессию генов, ответственных не только за развитие воспалительного ответа, но также и за синтез ростовых и других факторов, обеспечивающих ангиогенез, пролиферацию, инвазию и метастазирование опухолевых клеток [Pathania A.S., et al. The Synthetic Tryptanthrin Analogue Suppresses STAT3 Signaling and Induces Caspase Dependent Apoptosis via ERK Up Regulation in Human Leukemia HL-60 Cells. PLoS One. 2014. V. 9(11)]. Необходимо отметить способность триптантрина ингибировать сигнальный путь, включающий фактор роста эндотелия/рецептор эпидермального фактора роста/экстраклеточную-сигнал-регулируемую киназу (VEGF/EGFR/ERK), что подавляет активацию ангиогенеза и препятствует промоции и прогрессии опухолевого процесса [Liao Xl, et al. Tryptanthrin inhibits angiogenesis by targeting the VEGFR2-mediated ERK1/2 signalling pathway PLoS One. 2013, 8 (12)].
Широкий спектр фармакологического действия этого соединения создает реальные предпосылки для разработки на его основе лекарственных средств для лечения различных патологий.
Важным преимуществом триптантрина перед многими другими природными соединениями является то, что разработаны его доступные и дешевые синтезы, включая одностадийный синтез триптантрина из изатина [Московкина Т.В. Новый синтез 6,12-дигидро-6,12-диоксоиндоло[2.1-b]хиназолина (триптантрина, коуропитина) // Жур. орг. хим. 1997. Т. 33. С. 138-139]. В последствии был разработан другой одностадийный синтез - окислением изатина, что делает его более безопасным из-за отсутствия в нем хлорорганических примесей [Московкина Т.В., Денисенко М.В. и др. Синтез соединений ряда триптантрина путем окисления изатина // Жур. орг. хим. 2013. Т. 49. вып. 12, С. 1760-1763].
Среди наиболее существенных недостатков триптантрина можно отметить:
- прежде всего, его плохую биодоступность, связанную с низкой растворимостью в воде, а также фармакологически приемлемых водных средах и биологических жидкостях;
- проявление токсических для организма свойств при его внутреннем применении, прежде всего, при инъекционных способах введения;
- ярко-выраженную иммуносупрессорную активность, которая снижает его противоопухолевое действие in vivo из-за ингибирования противоопухолевого иммунитета.
В связи с этим практическое использование триптантрина ограничивается лишь наружным применением в составе различных мазевых и гелевых фармацевтических композиций для лечения воспалительных, преимущественно дерматологических, заболеваний [RU 2366408 С1, 10.09.2009; RU 2549475 С1, 27.04.2015].
Технический результат, обеспечиваемый изобретением, заключается в получении нового химического соединения - производного алкалоида триптантрина формулы (1),

обладающего достоверно высокой противоопухолевой активностью, повышающего терапевтическую активность противоопухолевых антибиотиков, а также проявляющего противовоспалительные и противомикробные свойства.
Преимуществом нового соединения по сравнению с триптантрином является то, что, во-первых, оно растворимо в воде, фармакологически приемлемых водных средах и биологических жидкостях, что способствует его применению в виде водных растворов; во-вторых, гораздо менее токсично, что повышает безопасность и эффективность его терапевтического использования; в-третьих, снижение иммуносупрессорного действия и повышение противоопухолевого потенциала заявляемого вещества (1) позволяет существенно повысить эффективность его применения при лечении онкологических заболеваний.
Заявляемое водорастворимое производное триптантрина (1) расширяет арсенал фармацевтических средств, обладающих ярко выраженной противоопухолевой активностью и повышающих эффективность применения известных противоопухолевых препаратов, например, доксорубицина, а также обладающих противовоспалительными и противомикробными свойствами.
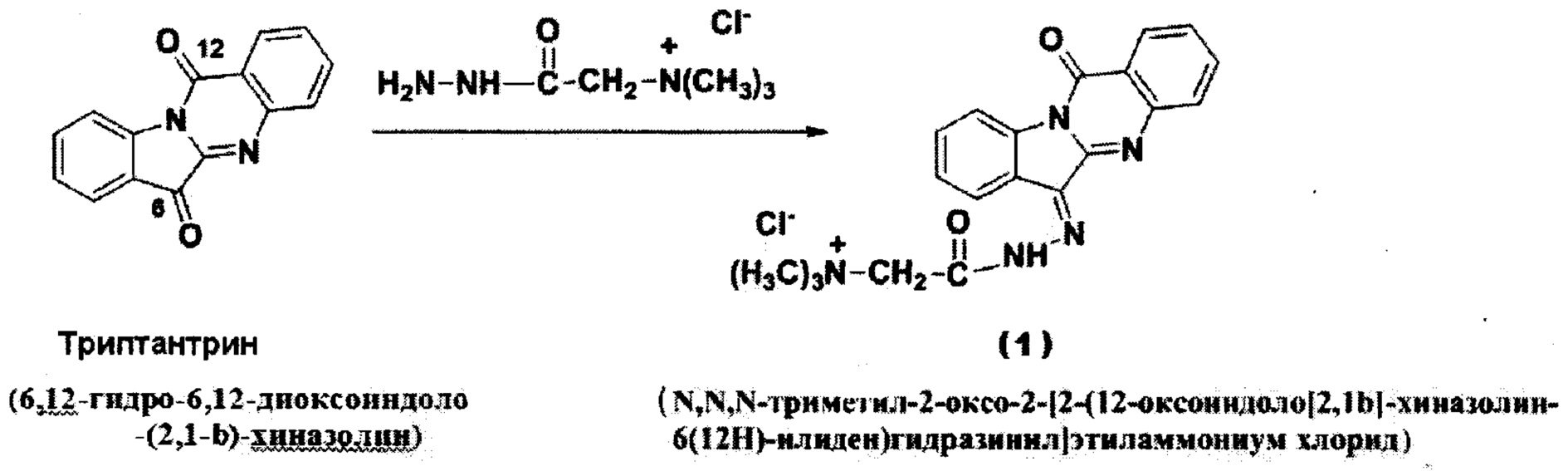
Синтез нового производного триптантрина был осуществлен при реакции триптантрина с реагентом Жирара Т по схеме:
Эксперименты in vivo по изучению противоопухолевой активности соединения формулы (1) выполнены на белых беспатогенных мышах линии CD-1, которые были получены из питомника лабораторных животных «Пущино» и разведены в виварии ТИБОХ ДВО РАН. Животных содержали в стандартных условиях вивария с естественным световым режимом на полнорационной сбалансированной по содержанию питательных веществ диете для лабораторных животных (ГОСТ Р 50258-92). Эксперименты были осуществлены согласно методическим руководствам, нормативным документам и правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ Р 53434-2009).
В качестве препарата сравнения, при моделировании системного воспаления использовали коммерческий противовоспалительный препарат «Офтан Дексаметазон» (Сантэн АО, Финляндия) - синтетический глюкокортикостероид, обладающий системным противовоспалительным и иммунодепрессивным действием. В качестве основного препарата сравнения в онкологических исследованиях использовали известный противоопухолевый антибиотик антрациклинового ряда «Доксорубицин-Тева» (Pharmachemie).
Изобретение иллюстрируется следующими примерами.
Пример 1. Способ получения производного триптантрина N,N,N-триметил-2-оксо-2-[2-(12-оксоиндоло[2,1b]-хиназолин-6(12Н-илиден)гидразинил]этиламмониум хлорида (1).
В двухгорловую колбу, снабженную капельной воронкой, обратным холодильником и магнитной роторной мешалкой, помещают 0,508 г (2 μмол) триптантрина и 20 мл ледяной уксусной кислоты и нагревают при перемешивании в глицериновой бане до 90°С в течение 1 ч. К образовавшейся суспензии в течение 10 мин прикапывают раствор 0,458 г (2,7 μмол) реактива Жирара Т в 4 мл ледяной уксусной кислоты и перемешивают еще 4 ч при этой же температуре. Уже через 1 час перемешивания раствор становится гомогенным и приобретает коричнево-красную окраску. По окончанию реакции реакционную смесь концентрируют в вакууме (роторный испаритель) до полного удаления уксусной кислоты. К остатку добавляют 15 мл воды и, тщательно перемешанный раствор, профильтровывают.
Водный раствор концентрируют в вакууме роторного испарителя с добавлением небольших порций н-бутанола как пеногасителя. К полученному при этом твердому остатку добавляют 20 мл этанола и перемешивают.
Нерастворившийся осадок отфильтровывают, промывают этанолом, высушивают в вакууме и получают 0,54 г соединения (1) (выход 67%).
ИК спектр (Perkin-Elmer Spectrum BX-II, KBr):3413 (NH), 2937 (CH2), 1688 см-1 (C=O), 1632 см-1 (C=N). Масс-спектр (Agilent 6210, TOF, ESIc регистрацией катионов в режиме LC/MS, ацетонитрил-вода, 7:3), m/z: 362 (рассчитано для катиона C20H20N5O2362,16), 338 (M+-Cl-N(CH3)3. ЯМР 1Н спектр, Brucker Avance-700 (D2O, d6-ацетон, 2.19 м.д.): 7.83 (1Н, д.), 7.76 (1Н, д.), 7.66 (1H, т.), 7.45 (1H, т.), 7.38 (1H, д.), 7.45 (1Н, т.), 7.32 (1H, д.), 7.17 (1Н, т.), 4,64 (2Н, с, СН2), 3.49 [9Н, с., (СН3)3].
Водорастворимое производное триптантрина (1) представляет собой порошок желтого цвета, который хорошо растворяется в воде без нагревания. Растворимость при 20°С - примерно 5 мг/мл. Препарат устойчив в водном растворе более двух суток, но разрушается при кипячении со щелочами; не гигроскопичен, не разрушается влагой; рН 1-2% раствора - нейтральный, температура плавления (разложения) >248°С. Флаконы с субстанцией и водные рабочие растворы соединения (1) необходимо хранить в темном месте, защищать от воздействия UV-излучения и солнечного света.
Пример 2. Определение острой токсичности заявляемого водорастворимого производного триптантрина (1).
Определение острой токсичности соединения (1) и расчет LD50 проводили по методу Кербера. Лабораторные животные были рандомно разделены на 4 группы по 5 животных в каждой. Тестируемое вещество вводили, используя метод последовательного двукратного серийного разведения: 1 - 500 мг/кг, 2 - 250 мг/кг, 3 - 125 мг/кг, 4 - 50 мг/кг. Препарат, в указанных дозах, вводили животным однократно внутрибрюшино в виде водного раствора в объеме 0,5 мл. В течение 24 ч после инъекции за каждой группой животных вели наблюдение, в ходе которого учитывали смертность и изменение основных физиологических показателей, таких, как моторика, поведенческие реакции, физическая активность.
Спустя 24 ч LD50 вычисляли по формуле:
LD50=LD100-∑Zd/n, где
LD100 - максимальная доза, вызывающая гибель всех животных в группе, Z - среднее арифметическое из числа животных, у которых отмечен токсический эффект под влиянием двух смежных доз; d - интервал между двумя смежными дозами, n - количество животных в каждой группе.
Острое токсическое действие заявляемого соединения (1) проявлялось в течение первых 15-60 мин после введения и прослеживалось в дозах от 125 до 500 мг/кг. Были отмечены следующие внешние признаки интоксикации: понижение температуры тела, отдышка, потеря аппетита, снижение подвижности и общей физической активности. При введении дозы 500 мг/кг, в течение 30-60 мин наступала гибель всех животных в группе. В остальных экспериментальных группах смертность не была зарегистрирована, и спустя 24 ч у животных наблюдалось восстановление нормального физического состояния. Результаты представлены в таблице 1.

При расчете выявлено, что у заявляемого соединения (1) LD50 составляет 375 мг/кг, что позволяет по классификации токсичности веществ отнести его к классу среднетоксичных (средняя летальная доза которых 200-1500 мг/кг). Следует отметить, что для самого триптантрина ранее установленная величина LD50 составляла около 75 мг/кг, т.е. триптантрин примерно в 5 раз токсичнее, чем заявляемое водорастворимое соединение (1).
Пример 3. Оценка ингибирующей активности заявляемого соединения (1) в отношении ряда линий опухолевых клеток in vitro.
Сравнительное исследование антипролиферативной активности в МТТ-тесте нового производного триптантрина и его прототипа проводили в отношении следующих линий опухолевых клеток человека: НСТ-116 (аденокарцинома толстой кишки), К-562 (промиелоцитарный лейкоз), MCF-7 (инвазивная карцинома протоков молочной железы) (все линии клеток дикого типа были приобретены в АТСС (США)). В качестве контрольного препарата был использован противоопухолевый антибиотик доксорубицин (Sigma, USA).
Данные об антипролиферативной активности (IC50) заявляемого соединения приведены в таблице 2. Определение IC50 проводилось с помощью МТТ-теста по стандартной методике, описанной в литературе [A.S. Tikhomirov, et. al. Tri-armed ligands of G-quadruplex on heteroarene-fusedanthraquinone scaffolds: design, synthesis and prescreening ofbiological properties, Eur. J. Med. Chem. 159, (2018), 59-73].
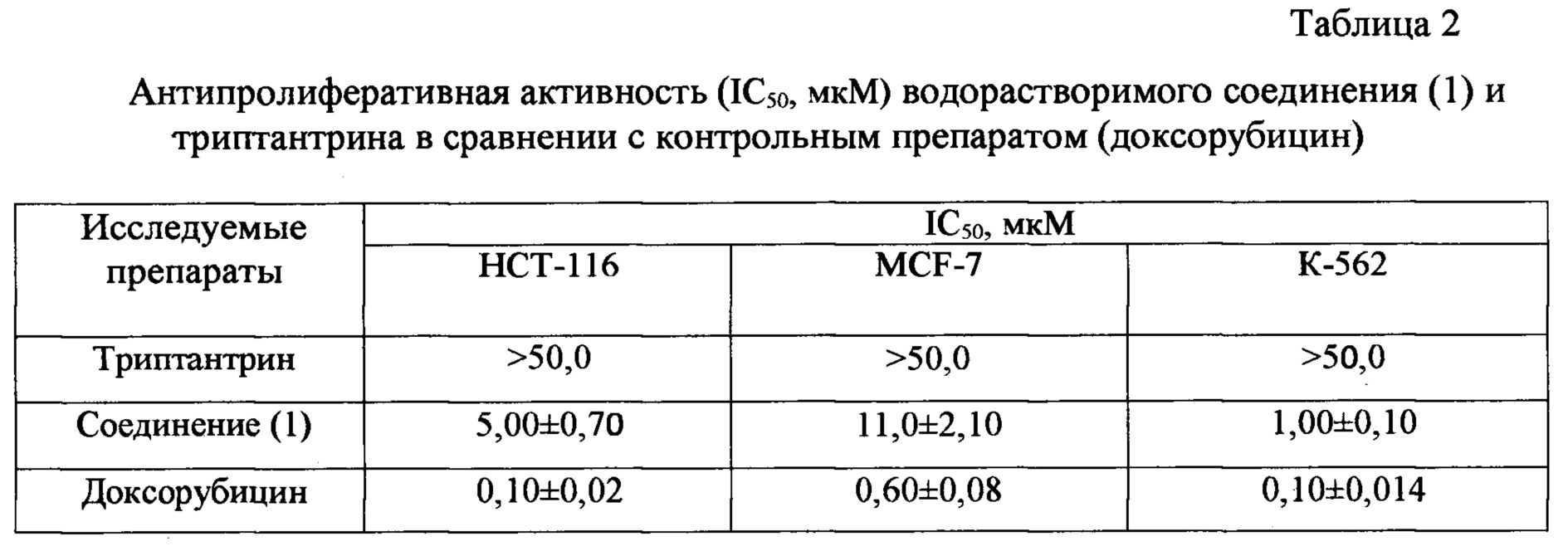
Как видно из данных, представленных в таблице 2, заявляемое соединение (1) более эффективно, чем исходный триптантрин, ингибирует рост всех протестированных линий клеток. Антипролиферативная активность водорастворимого производного триптантрина в отношении линий НСТ-116 и К-562 на порядок выше, чем у прототипа. При этом сам триптантрин в используемых диапазонах концентраций не проявлял активности в отношении клеточных линий НСТ-116, MCF-7 и фибробластов, а также оказался в 40 раз менее активным в отношении линии клеток промиелоцитарного лейкоза человека (К-562), чем его водорастворимое производное (1), и неактивным в отношении остальных линий клеток, использованных в эксперименте. В то же время соединение (1) проявило антипролиферативную активность на всех этих линиях клеток.
Согласно полученным результатам, заявляемое соединение обладает антипролиферативным действием на исследованных линиях опухолевых и неопухолевых клеток. Следовательно, его можно рассматривать в качестве кандидатского препарата для лечения различных онкологических заболеваний.
Пример 4. Оценка противовоспалительной активности заявляемого водорастворимого соединения (1) на модели системного воспаления (СВ).
СВ индуцировали липополисахаридом (ЛПС) из Е. coli (Sigma, США) в дозе 0,1 мг/кг. Оба изучаемых препарата (заявляемое соединение и прототип) и препарат сравнения «Дексаметазон» вводили животным внутрибрюшинно в дозе 10 мг/кг за 1 час до индукции ЛПС. Через 1,5 ч после индукции СВ проводили заборы крови для иммунологических и биохимических анализов.
Функциональное состояние иммунной системы оценивали путем определения уровня цитокинов в иммуноферментном анализе (ИФА), используя диагностические наборы (BD Bioscience OptEIA US).
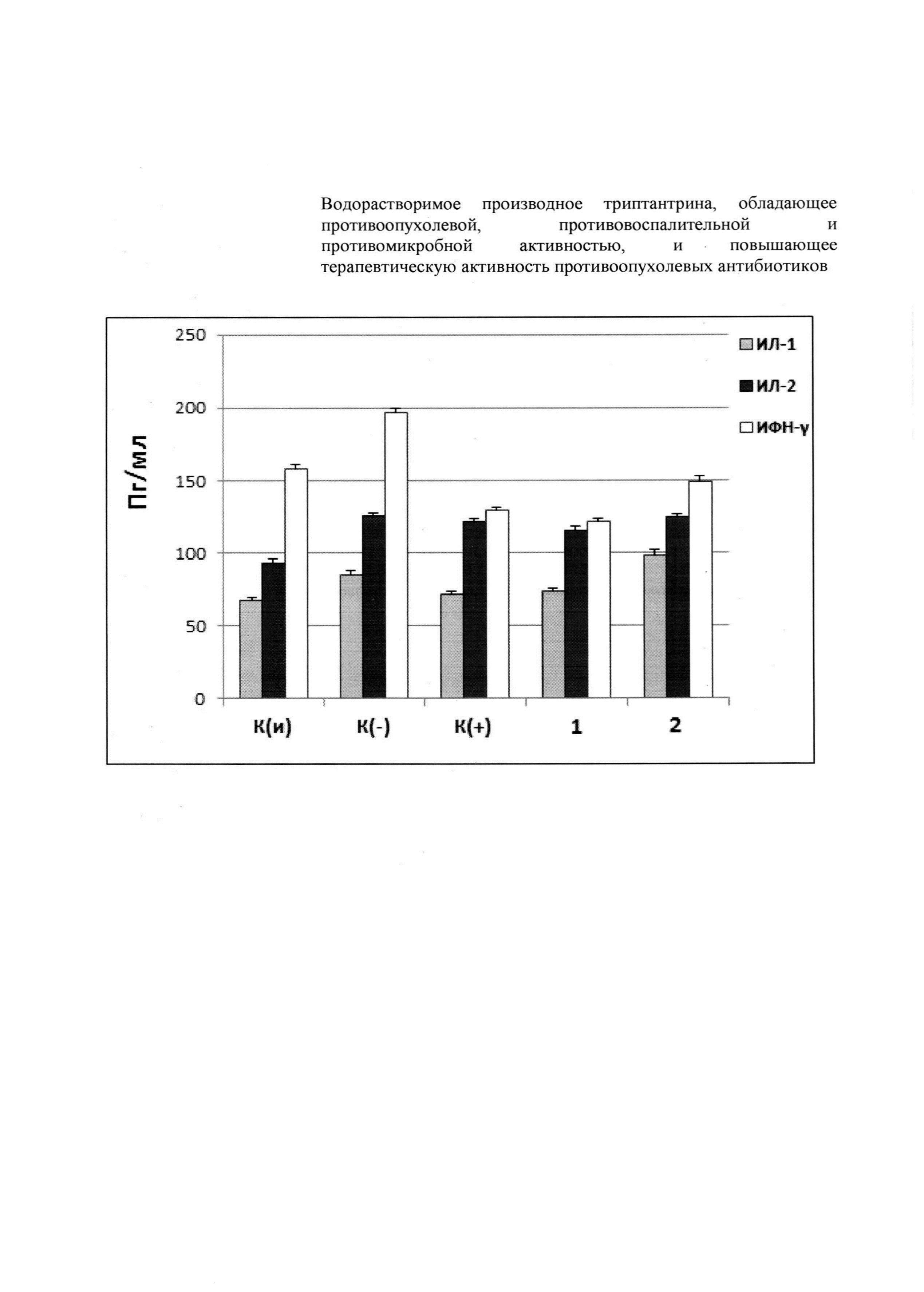
На фигуре представлен уровень провоспалительных цитокинов: ИФН-γ - интерферон гамма, ИЛ-1,2 - интерлейкин-1,2 в сыворотке крови животных разных экспериментальных групп: К(и) - интактный контроль, К(-) - отрицательный контроль, К(+) - положительный контроль (дексаметазон), 1 - триптантрин, 2 - заявляемое соединение (1).
Иммунологический анализ крови, при моделировании СВ, показал, что заявляемое водорастворимое производное триптантрина (1) и его прототип (триптантрин) способствовали снижению сывороточного уровня провоспалительных цитокинов ИЛ-1 и ИЛ-2, содержание которых повышалось под действием ЛПС в группе К(-). При этом заявляемое соединение по сравнению триптантрином показывает менее выраженное цитокин-ингибирующее действие в отношении указанных цитокинов, а также повышает уровень ИФН-γ при сравнении с действием триптантрина.
Таким образом, заявляемое соединение (1) обладает меньшим иммуносупрессивным действием, чем триптантрин.
Пример 5. Исследование противоопухолевой активности заявляемого соединения (1) на модели асцитного варианта аденокарциномы Эрлиха.
При тестировании противоопухолевой активности соединения (1) использовали асцитный вариант опухоли Эрлиха, перевиваемой на беспатогенной линии мышей CD-1, весом 20±2 г. Для трансплантации опухоли внутрибрюшинно вводили по 3×106 опухолевых клеток/мышь в 0,5 мл 1% фосфатно-солевого буфера (Sigma, USA). Курс лечения начинали через сутки после инокуляции опухоли. Соединение (1) в дозах 10, 25 и 50 мг/кг применяли как в режиме монотерапии, так и в сочетании с препаратом «Доксорубицин», используемая доза которого составляла 0,25 мг/кг. Препараты вводили однократно внутрибрюшинно в объеме 0,5 мл.
Животные были разделены на шесть групп по 8 особей в каждой: К(-) - отрицательный контроль; доксорубицин - 0,25 мг/кг; соединение (1) - 10 мг/кг; (1) - 25 мг/кг; (1) - 50 мг/кг; доксорубицин + (1) - 0,25 мг/кг + 10 мг/кг, соответственно.
Противоопухолевый эффект оценивали по средней продолжительности жизни (СПЖ, дни), увеличению продолжительности жизни (УПЖ, %) и выживаемости животных опухоленосителей (% животных, выживших к концу эксперимента) по сравнению с группой К(-).
УПЖ рассчитывали по формуле:
УПЖ % = (СПЖо - СПЖк)/СПЖк × 100,
где СПЖо и СПЖк - средняя продолжительность жизни (сутки) в опытных и контрольных группах животных, соответственно.
Результаты представлены в таблице 3.
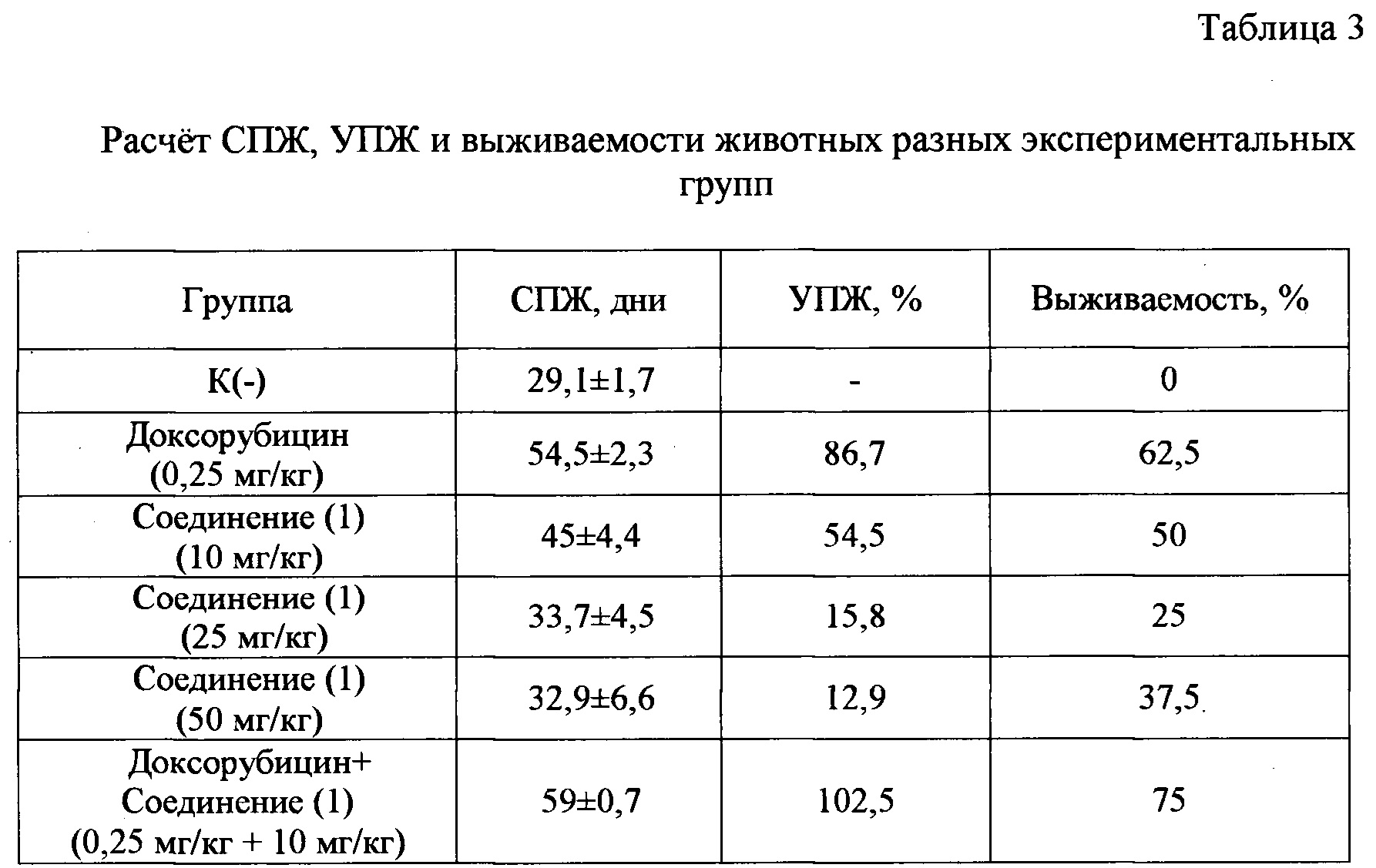
Примечание: СПЖ - средняя продолжительность жизни; УПЖ - увеличение средней продолжительности жизни животных; выживаемость животных - % выживших животных к моменту окончания эксперимента - 60 суток после индукции опухоли.
Как видно из данных, приведенных в таблице 3, заявляемый препарат при его применении в режиме монотерапии обладает достоверным противоопухолевым действием. Его влияние на показатели эффективности противоопухолевого действия и выживаемости животных опухоленосителей в значительной степени зависят от лечебной дозы. Применение самой высокой из исследованных доз заявляемого препарата (50 мг/кг) приводило к гибели 50% животных спустя 4-7 суток со дня начала, лечения, что, очевидно, является результатом проявления им отсроченной токсичности.
В лечебной дозе 25 мг/кг показатель выживаемости экспериментальных животных составил 25%. В группе, получавшей заявляемый препарат в дозе 10 мг/кг, выживаемость была в 2 раза выше, а повышение активности при снижении дозы также можно объяснить неспецифическим токсическим действием соединения (1) в более высоких дозах, чем 10 мг/кг.
Таким образом, наибольшие показатели СПЖ, УПЖ и выживаемости были получены в группе животных, прошедших терапию заявляемым соединением в дозе 10 мг/кг. При этом 50% животных, прошедших курс лечения в указанной дозе, выжили в условиях данного эксперимента и, что примечательно, 90% из них не имели опухолевых зачатков к концу эксперимента (2 месяца).
Наиболее оптимальную дозу заявляемого соединения (1) - 10 мг/кг использовали при проведении сочетанной терапии с препаратом «Доксорубицин». Комбинированная терапия заявляемого соединения (1) с препаратом «Доксорубицин» более эффективна, чем монотерапия доксорубицином или заявляемым соединением (1), что можно видеть из данных, приведенных в таблице 3, свидетельствующих об увеличении СПЖ, УПЖ и выживаемости экспериментальных животных. Кроме того, в группе доксорубицин + заявляемое соединение (1), среди выживших к концу эксперимента животных, у 65% особей не было обнаружено вторичного опухолевого роста. Важно подчеркнуть, что в группе «доксорубицин» у 35% выживших животных зафиксирована асцитная опухоль на прогрессирующей стадии роста, с объемом асцитной жидкости приблизительно 2,5-3 мл.
Таким образом, как показывают экспериментальные исследования, заявляемое водорастворимое производное триптантрина (1) обладает достоверно высокой противоопухолевой активностью, как при моно-, так и при сочетанной терапии с доксорубицином.
Пример 6. Противомикробная активность заявляемого соединения (1).
Противомикробную активность заявляемого соединения в сравнении с триптантрином исследовали в отношении следующих штаммов микроорганизмов из музея ФГБНУ «НИИНА». Staphylococcus aureus АТСС 29213, метициллин-резистентный клинический изолят Staphylococcus aureus 88 (MRSA), ванкомицин-резистентный Enterococcus faecalis 583 (VRE), Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853, Bacillus cereus ATCC 10702, Candida parapsilosis ATCC 22019, Mycobacterium spp. R (быстро растущий нетуберкулезный штамм).
Для активации после криоконсервации микроорганизмы высевали на агаризованные питательные среды: бактериальные штаммы - на CASO-Agar (Sifin, Германия), Candida parapsilosis - на Сабуро (ФБНУ ГНЦ ПМБ). Культивирование всех бактериальных штаммов осуществляли в течение 18-20 ч, за исключением Mycobacterium spp. - 3-5 суток, Candida parapsilosis - 48 ч при температуре 35±2°С. После культивирования биомассу микроорганизмов разбавляли в физиологическом растворе до мутности суспензии 0,5 ед. по стандарту мутности McFarland, которую измеряли на приборе McFarland Densitometer (Biosan, Латвия).
Полученный иннокулят каждого микроорганизма рассевали в лунки 96-луночного планшета (Медполимер, Россия) в объеме 190 мкл на лунку; для бактериальных клеточных культур с титром инокулята 2,5×105 КОЕ/мл - в среде Mueller-Hinton Broth («Sifin»), для Candida parapsilosis с титром 2,5×103 КОЕ/мл - в среде RPMI 1640 (ПанЭко, Россия) с добавлением 0,2% глюкозы. Затем в лунки с микроорганизмами добавляли по 10 мкл исследуемых соединений в диапазоне концентраций от 0,06-128 мкг/мл.
Планшеты с тестируемыми штаммами инкубировали в обычной атмосфере при температуре (35±2)°С в течение 16-24 ч для бактериальных культур (Mycobacterium spp. R - 96 ч), в течение 24-48 ч для Candida spp. Интенсивность роста микроорганизмов в каждой лунке измеряли по мутности/абсорбции клеточного инокулята с помощью микропланшетного ридера при длине волны между 405 и 530 нм. Противомикробную активность исследуемых соединений определяли по минимальной подавляющей концентрации. Анализ проводили в соответствии с рекомендациями ГОСТ Р ИСО 20776-1-2010 и ГОСТ Р ИСО 16256-2015.
В таблице 4 приведены сравнительные данные по спектру активности триптантрина и заявляемого соединения (1).
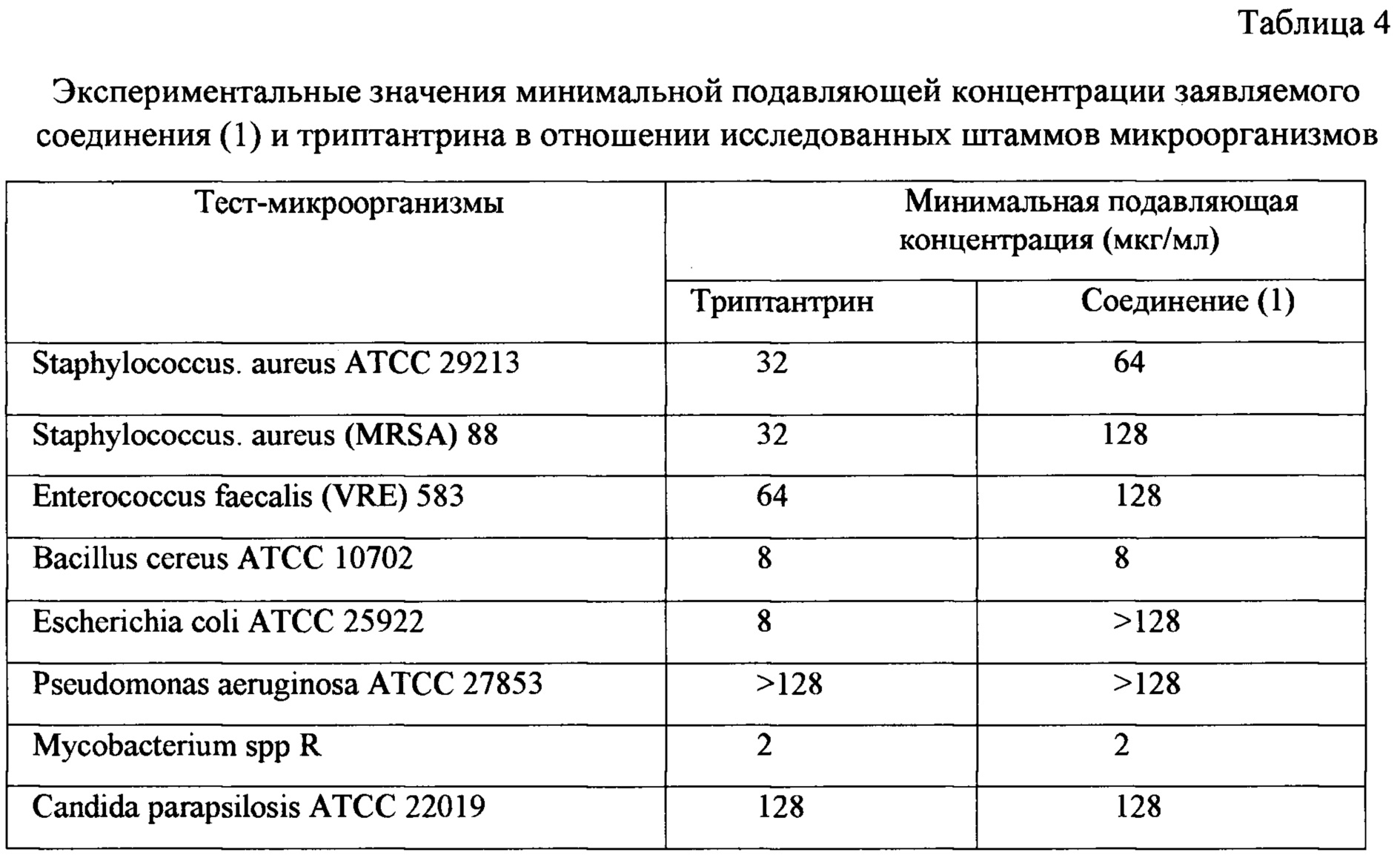
Полученные данные показывают, что заявляемое соединение и триптантрин не отличались по значениям в отношении В. cereus и Mycobacterium spp. Однако заявляемое соединение уступало по антибактериальной активности триптантрину в отношении S. aureus ATCC 29213 и Е. Faecalis (VRE) 583 на одно разведение, а в отношении S. aureus (MRSA) на 2 разведения, а также соединение (1) в отличие от триптантрина не проявляло антимикробного действия в отношении грамотрицательных микроорганизмов Е. coli и Р. aeruginosa
Тем не менее, заявляемое соединение (1) и триптатрин проявляют схожую активность в отношении Bacillus cereus и Mycobacterium spp.