Результат интеллектуальной деятельности: СПОСОБ ВЫЯВЛЕНИЯ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ, АНТИТЕЛА И НАБОР ДЛЯ ВЫЯВЛЕНИЯ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к способу выявления опухоли поджелудочной железы, т.е. рака поджелудочной железы или доброкачественной опухоли поджелудочной железы, включающему измерение количества вариантов APOA2 белка в образце испытуемого субъекта с помощью антител, специфически связывающихся с APOA2 белками (антитела против APOA2), антитела против APOA2 для использования в данном способе и набор, включающий антитела для обнаружения рака поджелудочной железы или доброкачественной опухоли поджелудочной железы.
Уровень техники
По данным статистики 2012 года, причиной смерти номер один в Японии являются онкологические заболевания. Раковые опухоли развивается из нормальных тканей, и характеризуются образованием опухолевых масс, вызванным аномальным ростом раковых клеток, проникновением раковых клеток, образующих опухолевую массу, в прилегающие ткани, и отдаленное метастазирование в различные органы посредством кровеносных сосудов или лимфатических протоков. Известно, что концентрации различных белков в биологических жидкостях пациентов, таких как кровь или моча, различаются при таком возникновении и прогрессировании раковых опухолей. Такие белки называют онкомаркерами (маркеры для выявления рака) и планируют для применения для различных диагностических целей, в том числе при раннем выявлении раковых опухолей и наблюдении после лечения (например, Патентная Публикация от 1 до 3). Тем не менее, проблемы обычных опухолевых маркеров, используемых в клинической диагностике, заключаются в том, что подавляющее большинство из них дает положительный ответ порядка от 50 до 70%, а большинство опухолевых маркеров показывают ложно-отрицательные, в частности, для ранних стадий раковых заболеваний. Так как прогрессирующие раковые заболевания или терминальные раковые заболевания, характеризующиеся проникновением в соседние ткани или отдаленным метастазированием, приводят к неблагоприятному прогнозу, раннее выявление является важным для эффективного лечения этих раковых заболеваний. Следовательно, требовалось открытие опухолевых маркеров, способных обнаруживать рак на ранней стадии с отличной чувствительностью.
Опухоли поджелудочной железы относятся ко всем опухолям, образующимся в поджелудочной железе, и подразделяются на рак поджелудочной железы, который является злокачественной опухолью, и доброкачественную опухоль поджелудочной железы, которая является доброкачественной опухолью.
Рак поджелудочной железы известен среди многих раковых заболеваний как трудноизлечимый рак. Кроме хирургической операции пока не разработано ни одного эффективного метода лечения. Поэтому, особенно важным является его раннее выявление или предотвращение возникновения. Онкомаркеры сыворотки крови, спиральная компьютерная томография, аппарат магнитно-резонансной томографии (МРТ), эндоскопическое ультразвуковое исследование (эндо-УЗИ), или тому подобное используется в качестве способа диагностики рака поджелудочной железы (не Патентная Публикация 1). Однако рак поджелудочной железы редко проявляет признаки в ранней стадии и часто обнаруживается после того, как становится прогрессирующим раком. Поэтому, этот вид рака, как правило, трудно поддается лечению. Таким образом, существует потребность в новой диагностической технике, способной точно и легко обнаруживать рак поджелудочной железы.
С другой стороны, доброкачественная опухоль поджелудочной железы является патологическим состоянием на этапе, предшествующем рак поджелудочной железы, и было предположено ее участие в возникновении рака поджелудочной железы. Однако доброкачественная опухоль поджелудочной железы предлагает лучший прогноз, чем рак поджелудочной железы и, как ожидается, приводит к предотвращению появления рака поджелудочной железы путем ее иссечения с помощью хирургической операции. Таким образом, раннее выявление доброкачественной опухоли поджелудочной железы также считается важным.
APOA2 (аполипопротеин А2 или аполипопротеин А-II) белок (GenBank Accession NP_001634.1) является членом семьи аполипопротеинов представляющих собой липопротеины плазмы. До сих пор были известны десять или больше аполипопротеинов, и их основными функциями являются, например, структурная стабилизация липопротеинов, активация ферментов, вовлеченных в метаболизм липопротеинов, и действия в качестве лигандов для рецепторов липопротеинов находящихся на поверхности клетки. Белок APOA2 синтезируется в виде 100-аминокислотного предшественника, содержащего сигнальный пептид в ткани печени. Его зрелая форма, присутствующая в крови, состоит из 77 аминокислот. Зрелая форма APOA2 белка является аполипопротеином, представляющим собой липопротеин высокой плотности (ЛПВП), содержащим глутаминовый остаток (Q) на его амино конце (N-конце), остаток треонина (Т) в 76-ом положении, считая от N конца, и остаток глутамина (Q) на С-конце (77-е положение считая от N конца). Кроме того, сообщалось, что белок APOA2 имеет варианты, отличающиеся по массе, в том числе APOA2-АТQ белок (полноразмерный APOA2 белок), APOA2-AT белок (APOA2 белок, лишенный С-концевого остатка глутамина (Q), и APOA2-А белок (APOA2 белок, лишенный С-концевых остатков треонина и глутамина (ТQ)) (Не Патентная Публикация 2).
Согласно анализу, основанному на конформационных данных APOA2 белка (PDB-ID: 1L6L), зарегистрированному в банке данных белковых структур (PDB; Protein Data Bank; http://www.rcsb.org/pdb/home.do), APOA2 белки димеризованы через дисульфидную связь (SS связь) между их остатками цистеина в N-концевом участке. Таким образом, было обнаружено, что APOA2 белок существуют в крови в виде димеров, имеющих различные молекулярные массы как результат комбинаций из 3 вариантов. В частности, известно, что эти димеры включают, например, димер, состоящий из полноразмерных APOA2-АТQ белков (APOA2-АТQ/АТQ белковый димер), димер из APOA2-АТQ белка и APOA2-AT белка (APOA2-АТQ/AT белковый димер), димера, состоящего из APOA2-AT белков (APOA2-AT/AT белковый димер), димера APOA2-AT белка и APOA2-А белка (APOA2-АТ/А белковый димер) и димера, состоящего из APOA2-А белков (APOA2-А/А белковый димер). Кроме того, также известно, что APOA2 белок образует димер через дисульфидную связь с другим белком, как например APOD белок, APOE белок, или APOA1-М белок, и существует в виде мономера (Не Патентные Публикации 3 и 4).
Известно, что эти различные APOA2 белковые димеры проявляют количественные изменения в крови у больных раком поджелудочной железы по сравнению с нормальными людьми. В частности, в результате масс-спектрометрии было обнаружено, что APOA2-АТQ/AT белковый димер является белком, имеющим значение массы молекулярного веса 17253 ± 9 (м/з). Было выявлено, что количество этого белкового димера значительно снижено у больных раком поджелудочной железы по сравнению с нормальными людьми; и рак поджелудочной железы при использовании белкового димера как маркера рака поджелудочной железы может быть определен с такой высокой точностью как значение AUC (площадь под Кривой) 0,85 или выше (Патентная Публикация 4 и 5 и Не Патентная Публикация 5).
Однако, для достижения точности распознавания значения AUC требуются 3 сложных этапа, включая измерение с помощью масс-спектрометра. Например, на первом этапе проба крови для использования в масс-спектрометрии предварительно обрабатывается 9 М мочевиной и 2% CHAPS. Однако, мочевина, подвержена деградации и, следовательно, непригодна для длительного хранения. Поэтому, для постоянных условий предварительной обработки, необходимо готовить раствор, содержащий мочевину, при каждом измерении. На следующем этапе, предварительно обработанная проба захватывается поверхностью белкового чипа (производства Ciphergen Biosystems К.К.). На этом этапе захвата адсорбция осуществляется за счет использования свойств белковой поверхности чипа, таких как состояние заряда или гидрофобность. Таким образом, известно, что условия отмывки или условия приготовления реактива имеют большое влияние на эффективность захвата. На заключительном этапе, захваченный образец анализируется с помощью масс-спектрометра. Масс-спектрометр требует навыков для работы, таких как лазерная регулировка интенсивности и имеет низкую пропускную способность в обработке образцов. В случае, когда в пробе содержится множество различных белков, сигнал, полученный от каждого белка, интерферирует с сигналами от других белков. Следовательно, такие сигналы трудно аттрибутировать. Кроме того, масс-спектрометр по-прежнему сталкивается с проблемами в количественных измерениях и поэтому не подходит для диагностических целей, которые требуют высокой точности измерения. Следовательно, проблемой данного подхода являются большие лимитирующие факторы ее фактического использования.
По сравнению с масс-спектрометрией, для измерения много образцов твердофазный ИФА известен как высокопропускной, недорогой и практичный метод. Твердофазный ИФА, который является универсальным подходом, не требует эксплуатационного мастерства. Кроме того, такой подход является высокоспецифичным, благодаря использованию двух антител, и позволяет высоко воспроизводимое количественное измерение при использовании стандартов. Поэтому твердофазный ИФА позволяет исчерпывающий и высоко количественный анализ вариантов белка APOA2, присутствующих в образце с различными молекулярными массами.
Список Публикаций
Патентные Публикации
Патентная Публикация 1: JP Patent Publication (Kokai) No 2001-289861 A (2001)No 2001-289861 A (2001)
Патентная Публикация 2: JP Patent Publication (Kokai) No 2002-323499 A (2002)
Патентная Публикация 3: JP Patent Publication (Kokai) No 2009-034071 A (2009)
Патентная Публикация 4: JP International Publication No WO 2006/098087
Патентная публикация 5: JP Patent Publication (Kokai) No 2010-175452 A (2010)
Не Патентные Публикации
Не Патентная Публикация 1: Clinical Practice Guidelines for Pancreatic Cancer based on evidence-based medicine, 2009, Japan Pancreas Society (Комитет по ревизии клинических руководств по раку поджелудочной железы), Kanahara & Co., Ltd.
Не Патентная Публикация 2: Pankhurst G. et al., 2003, J. Lipid Res., Vol. 44, p. 349-355
Не Патентная Публикация 3: Blanco-Vaca F. et al., 2001, J. Lipid Res., Vol. 42, p. 1727-1739
Не Патентная Публикация 4: Rocco AG. et al., 2006, Biophys J., Vol. 91, p. 3043-3049
Не Патентная Публикация 5: Honda K. et al., 2012, PLoS One, Vol. 7, p. e46908
Краткое изложение изобретения
Технические затруднения
В общем, онкомаркеры используются для обнаружения опухолей. Однако как известно, опухоли поджелудочной железы, трудно обнаружить с помощью опухолевых маркеров. Среди опухолей поджелудочной железы, пациентов с раком поджелудочной железы ранней стадии особенно трудно отличить от нормальных людей. Таким образом, раннее выявление рака поджелудочной железы с использованием онкомаркеров является очень сложным. До сих пор было известно несколько опухолевых маркеров, способных обнаруживать доброкачественные опухоли поджелудочной железы.
Объектом настоящего изобретения является предоставление способа для выявления опухоли поджелудочной железы, т.е. рака поджелудочной железы или доброкачественной опухоли поджелудочной железы, используя варианты онкомаркера поджелудочной железы APOA2 белка, с высокой чувствительностью выявления опухоли поджелудочной железы и с более высоким удобством и более высокой пропускной способностью, чем методы определения, описанные в Патентных Публикациях 4 и 5 и Не Патентной публикации 5, и набора для выявления опухоли поджелудочной железы.
Решение проблемы
Для того, чтобы достичь цели, авторы настоящего изобретения первой целью поставили разработку способа для выявления рака поджелудочной железы путем использования анализа твердофазного ИФА, нацеленного на APOA2-АТQ/A белковый димер. На основе обычно осуществляемого метода, авторы настоящего изобретения пытались выявить APOA2-АТQ/AT белковый димер с использованием антител против соответствующих С-концевых участков APOA2-АТQ белка и APOA2-AT белка (антител против конца APOA2), образующих APOA2-АТQ/AT белковый димер. Тем не менее, оказалось, что этот димер не может быть обнаружен с высокой точностью, вероятно, из-за мешающих веществ, присутствующих в крови, или влияния стерического затруднения, вызванного связыванием этих двух антител с одним и тем же антигеном.
Соответственно, авторы настоящего изобретения провели добросовестные исследования и, в результате, создали способ для раздельного измерения общего количества APOA2-АТQ белка и общего количества APOA2-АТ белка путем использования сэндвич- твердофазного ИФА с использованием в комбинации антител против конца APOA2, специфически связывающихся с к С-концевыми областями и антител, специфически связывающимися с участками отличными от С-концевых областей APOA2 белка (антитела не против конца APOA2). Вместо измерения количества APOA2-АТQ /АТ белкового димера, как обычно выполняли, авторы настоящего изобретения, получили значение измерения общего количества APOA2-АТQ белка и значения измерения общего количества APOA2-АТ белка, и объединили результаты. Путем использования этого способа анализа, пациенты с раком поджелудочной железы могут быть с высокой точностью дискриминированы от нормальных людей. Авторы настоящего изобретения дополнительно обнаружили неожиданный эффект, вызванный использованием этого способа анализа, т.е. обнаружение доброкачественной опухоли поджелудочной железы, которое было недостижимо при использовании онкомаркеров, описанных ранее. Авторы настоящего изобретения нашли, что опухоли поджелудочной железы, включая доброкачественные опухоли поджелудочной железы и рак поджелудочной железы на ранней стадии, могут быть обнаружены с очень высокой чувствительностью на основе этого способа, приводя к выполнению настоящего изобретения.
Настоящее изобретение включает в себя следующие аспекты:
(1) Способ для выявления опухоли поджелудочной железы путем измерения количества вариантов белка APOA2 в образцах жидкости организма испытуемого субъекта, способ детекции, включающий: (А) первый этап измерения в образце количества APOA2-АТQ белка с использованием антитела против конца APOA2-АТQ, специфически связывающегося с C-концевой областью APOA2-АТQ белка, содержащей последовательность аминокислот, представленную в SEQ ID NO: 1, и антитела не против конца APOA2-АТQ, связывающегося с аминокислотной последовательностью отличной от C-концевой области; (В) второй этап измерения количества APOA2-АТ белка в образце с использованием антитела против конца APOA2-АТ, специфически связывающегося с C-концевой области APOA2-АТ белка, содержащей аминокислотную последовательность, представленную в SEQ ID NO: 2 и антитела не против конца APOA2-АТ к аминокислотной последовательности отличной от C-концевой области; и (C) третий этап введения, для предварительной установки дискриминанта, значения измерения количества APOA2-АТQ белка, полученного на первом этапе, и значения измерения количества APOA2-АТ белка, полученного на втором этапе, и определения, имеет ли тестируемый субъект опухоль поджелудочной железы, когда полученное значение дискриминанта тестируемого субъекта статистически достоверно отличается в сравнении со значением измерения или значением дискриминанта нормального субъекта.
(2) Способ выявления согласно (1), в котором каждая из C-концевых областей APOA2-АТQ белка и APOA2-AT белка состоит из последовательности, включающей 6 или более последовательных аминокислот, включая С-конец.
(3) Способ детекции согласно (1) или (2), в котором дискриминант является любым, выбранным из группы, состоящей из выражения логистической регрессии, выражения составленного путем анализа с помощью метода опорных векторов, выражения составленного путем анализа нейронной сети, и выражения составленного дискриминантным анализом.
(4) Способ выявления согласно (3), в котором выражение логистической регрессии включает в качестве переменной, измеренную величину APOA2-АТQ белка, измеренную величину APOA2-АТ белка, и/или произведение измеренной величины APOA2-АТQ белка и измеренной величины APOA2-АТ белка.
(5) Способ согласно (4), в котором значение дискриминанта испытуемого субъекта, полученное из выражения логистической регрессии, составляет 2/3 или ниже от значения дискриминанта нормального субъекта.
(6) Способ выявления по любому пункту от (1) до (5), в котором опухоль поджелудочной железы является раком поджелудочной железы или доброкачественной опухолью поджелудочной железы.
(7) Способ выявления по пункту (6), дополнительно содержащий четвертый этап измерения количества маркера рака поджелудочной железы СА19-9 или DU-PAN-2 в образце жидкости организма испытуемого субъекта, у которого установлено наличие опухоли поджелудочной железы на третьем этапе, и определения, что испытуемый субъект имеет рак поджелудочной железы, когда значение измерения превышает предварительно определенное референсное значение, и определение, что испытуемый субъект имеет доброкачественную опухоль поджелудочной железы, когда значение измерения равно или меньше, чем референсное значение.
(8) Способ выявления, по любому пункту от (1) до (7), в котором образец жидкости организма является кровью, плазмой или сывороткой.
(9) Способ детекции по любому из пунктов от (1) до (8), в котором рак поджелудочной железы является раком поджелудочной железы начальной стадии.
(10) Моноклональное антитело или его фрагмент, моноклональное антитело, являющееся антителом против конца APOA2-АТQ, специфически связывающееся с C-концевой областью APOA2-АТQ белка, включающее последовательность аминокислот, представленную в SEQ ID NO: 1, в котором тяжелая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные в SEQ ID NOs 4, 5, и 6, соответственно, и легкая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные в SEQ ID NOs 7, 8, и 9, соответственно.
(11) Моноклональное антитело или его фрагмент, моноклональное антитело, являющееся антителом против конца APOA2-АТQ, специфически взаимодействующее с C-концевой областью APOA2-АТQ белка, включающее последовательность аминокислот, представленную в SEQ ID NO: 1, в котором тяжелая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные в SEQ ID NOs 10, 11, и 12, соответственно, и легкая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные в SEQ ID NOs 13, 14, и 15, соответственно.
(12) Моноклональное антитело или его фрагмент, моноклональное антитело, являющееся антителом против конца APOA2, распознающее аминокислотную последовательность отличную от C-концевой области белка APOA2, содержащую аминокислотную последовательность, представленную любой из SEQ ID NO: от 1 до 3, в котором тяжелая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные в SEQ ID NOs 16, 17, и 18, соответственно, и легкая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные в SEQ ID NOs 19, 20, и 21, соответственно.
(13) Моноклональное антитело или его фрагмент, моноклональное антитело являющееся антителом не против конца APOA2, распознающее аминокислотную последовательность отличную от C-концевой области белка APOA2, содержащую аминокислотную последовательность, представленную любой из SEQ ID NO: от 1 до 3, в котором тяжелая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные SEQ ID NOs 22, 23, и 24, соответственно, и легкая цепь CDR1, CDR2, и CDR3 содержит аминокислотные последовательности, представленные в SEQ ID NOs 25, 26, и 27, соответственно.
(14) Набор для выявления опухоли поджелудочной железы, включающий один или более видов антител или их фрагментов по пунктам от (10) до (13).
Настоящее описание изобретения охватывает содержание, описанное в описаниях изобретения и/или чертежах Japanese Patent Application № 2013-206682 и 2014-166188, на которых основан приоритет настоящей заявки.
Преимущественные результаты изобретения
Согласно настоящему изобретению, опухоль поджелудочной железы может быть беспрепятственно обнаружена с высокой пропускной способностью и высокой чувствительностью с помощью анализа в крови вариантов белка APOA2 - маркеров опухоли поджелудочной железы. Например, количества отдельных вариантов белка APOA2, содержащихся в образце жидкости организма, такой как кровь, взятой у пациента, могут быть просто измерены, чтобы определить, имеет или нет пациент опухоль поджелудочной железы или оценить возможность получения опухоли поджелудочной железы.
Краткое описание чертежей
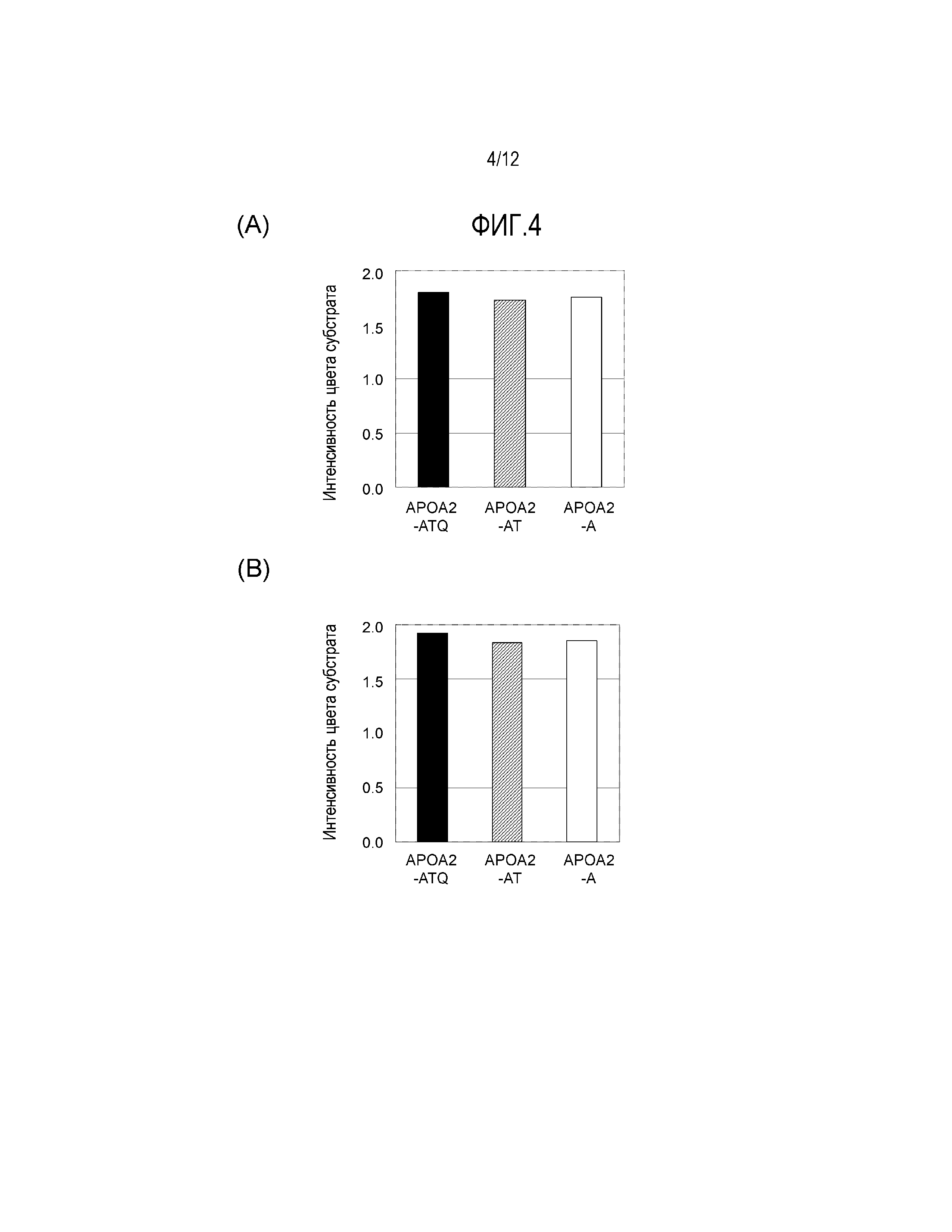
[Фиг. 1] Фиг. 1(А) демонстрирует результаты измерения активности связывания моноклонального антитела против конца APOA2-АТQ клон 7F2 с различными вариантами APOA2 белка. Фиг. 1(Б) демонстрирует результаты измерения активности связывания моноклонального антитела против конца APOA2-АТQ клон 6G2 с различными вариантами APOA2 белка.
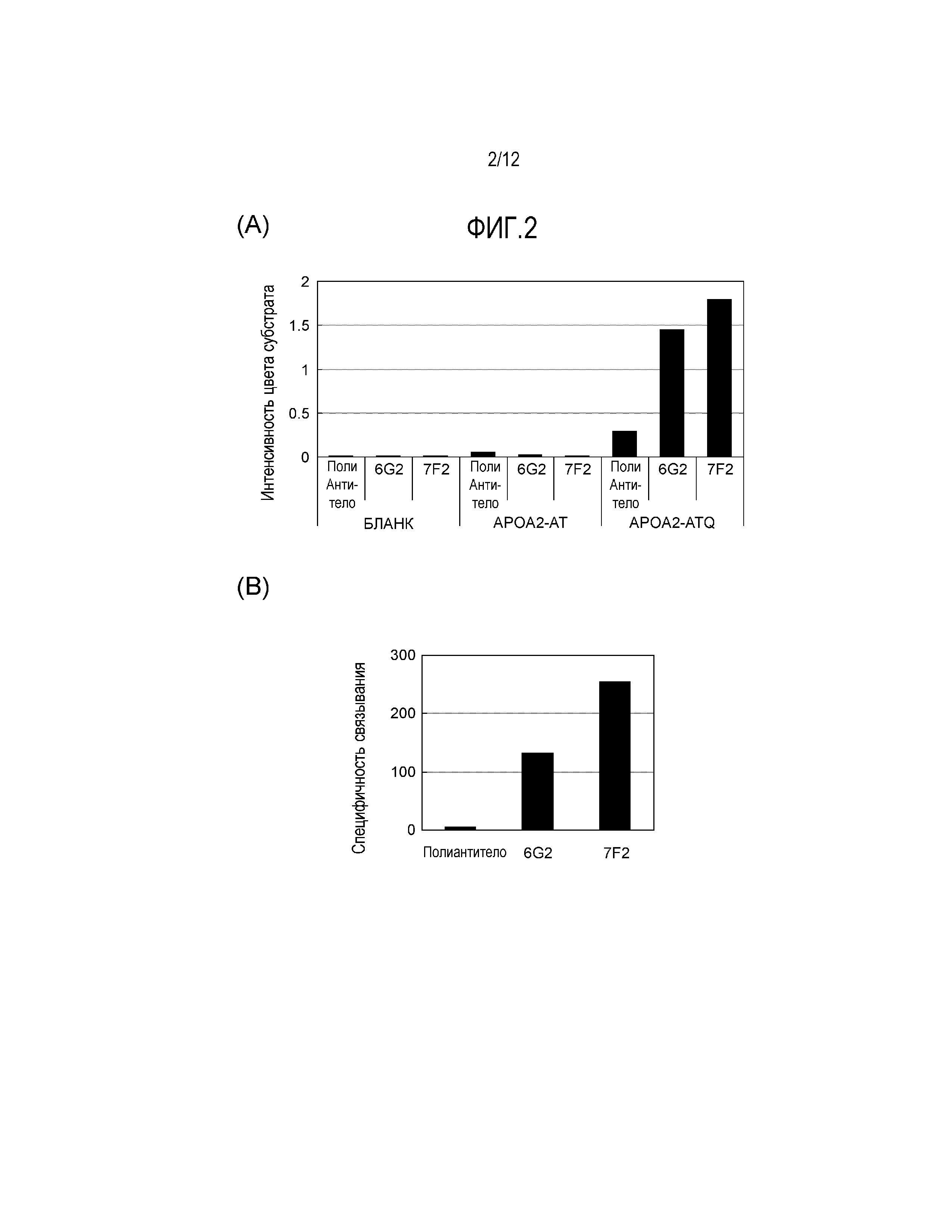
[Фиг. 2] Фиг. 2(А) демонстрирует результаты измерения активности связывания моноклонального антитела против конца APOA2-АТQ 7F2 или 6G2 или поликлонального антитела против конца APOA2-АТQ (на Фигуре обозначено "Поли антитело") с APOA2-АТQ белком или APOA2-AT белком. Фиг. 2(Б) - это график, на котором специфичность связывания каждого антитела оценивали путем деления значения измерения активности связывания антитела с APOA2-АТQ белком, полученного на Фиг. 2(А) на значение измерения его связывающей активности по отношению к APOA2-AT белку.
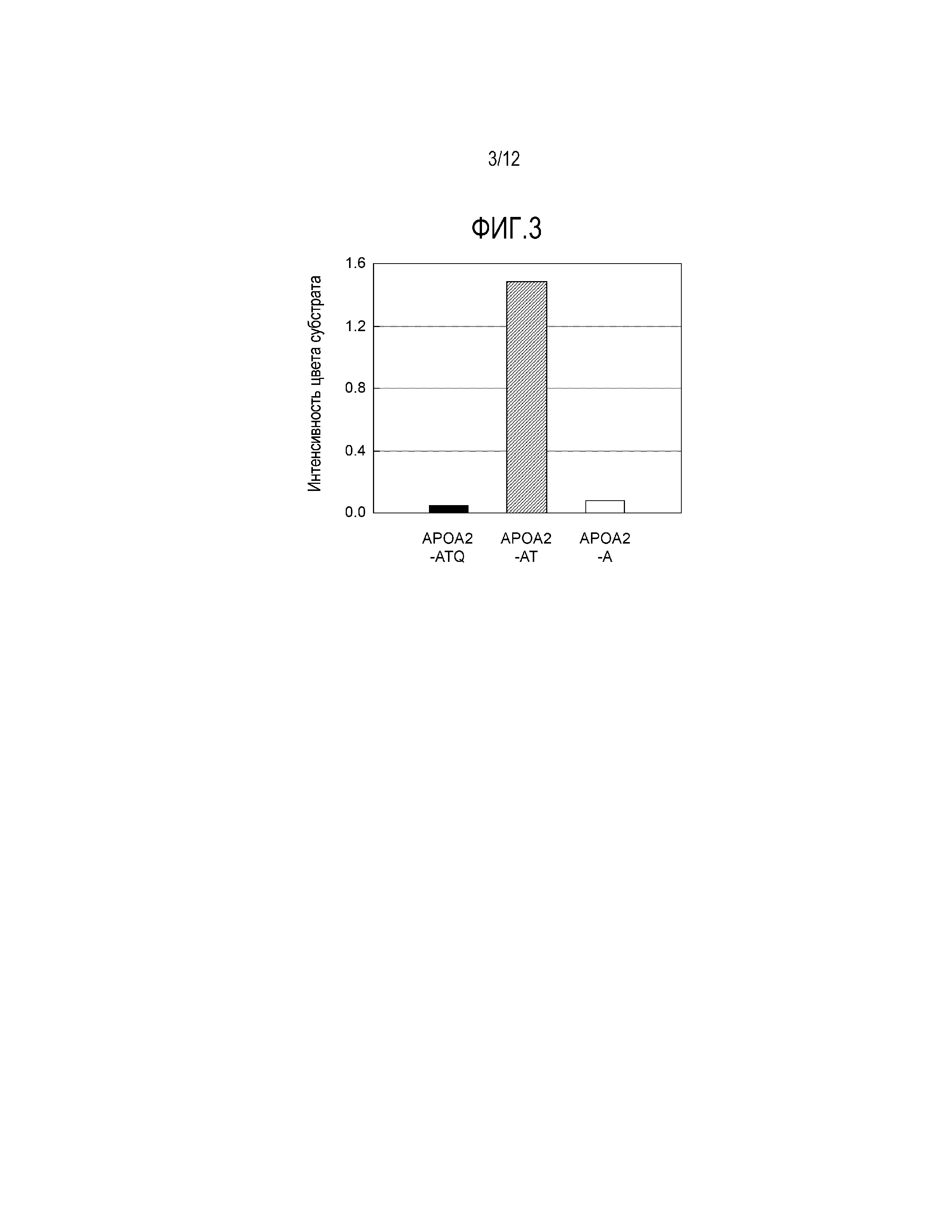
[Фиг. 3] Фиг. 3 демонстрирует результаты измерения активности связывания поликлонального антитела против конца APOA2-АТ с различными вариантами белка APOA2.
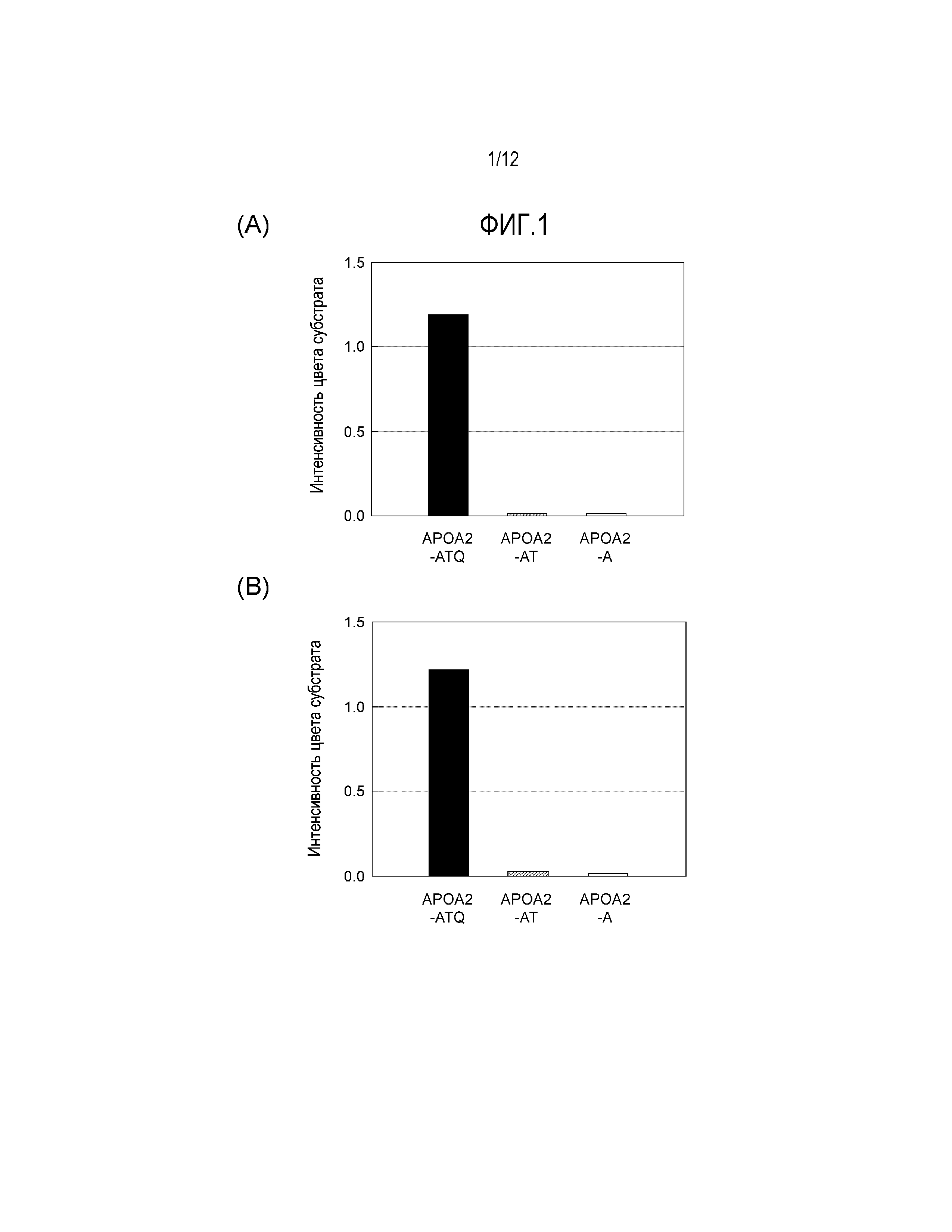
[Фиг. 4] Фиг. 4(А) Демонстрирует результаты измерения активности связывания моноклонального антитела MAB1 не против конца APOA2 с различными вариантами белка APOA2. Фиг. 4(Б) демонстрирует результаты измерения активности связывания моноклонального антитела MAB2 не против конца APOA2 с различными вариантами белка APOA2.
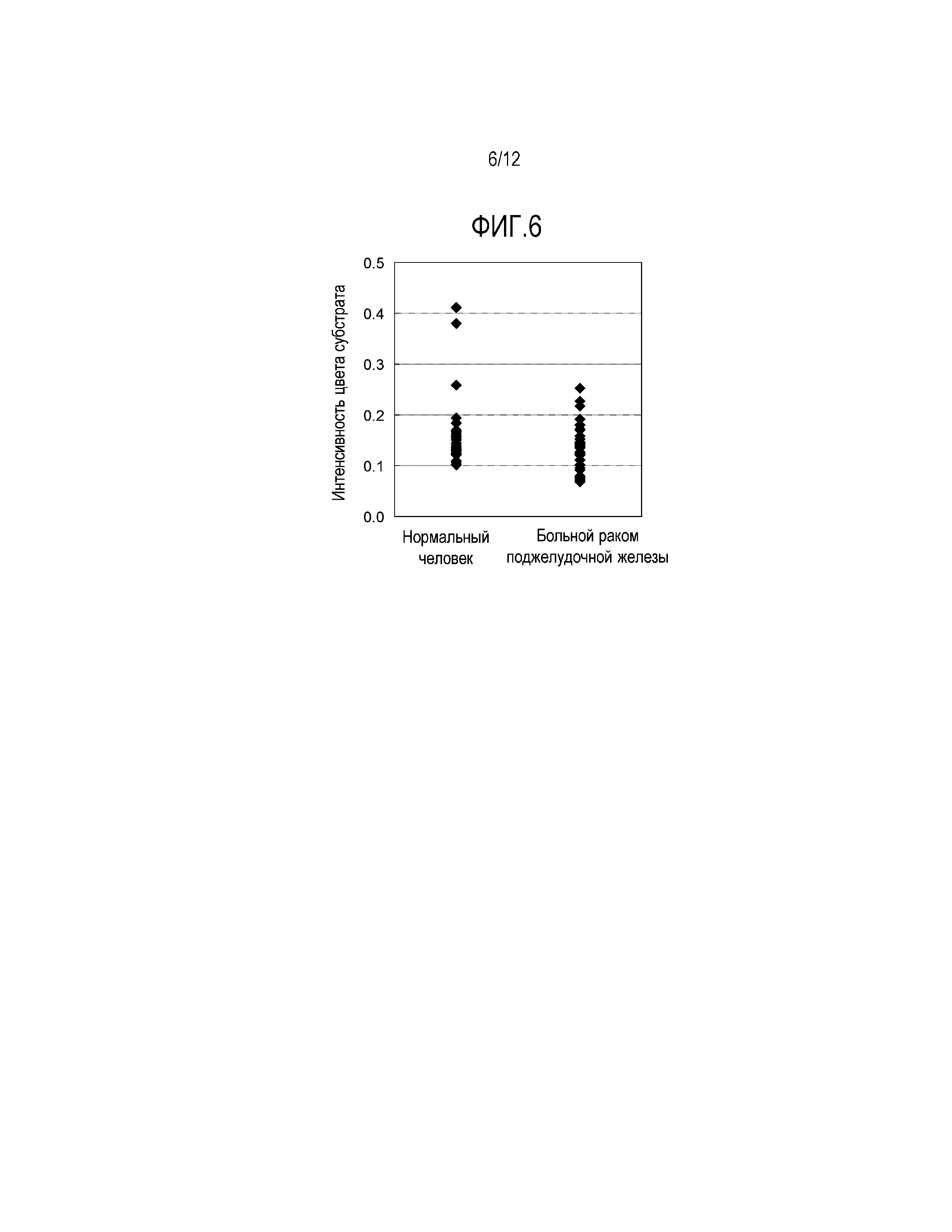
[Фиг. 5] Фиг. 5 демонстрирует результаты анализа с помощью масс-спектрометрии белкового димера APOA2 (APOA2-АТQ/AT), содержащегося в плазме больных раком поджелудочной железы и здоровых людей, каждых по 40 субъектов.
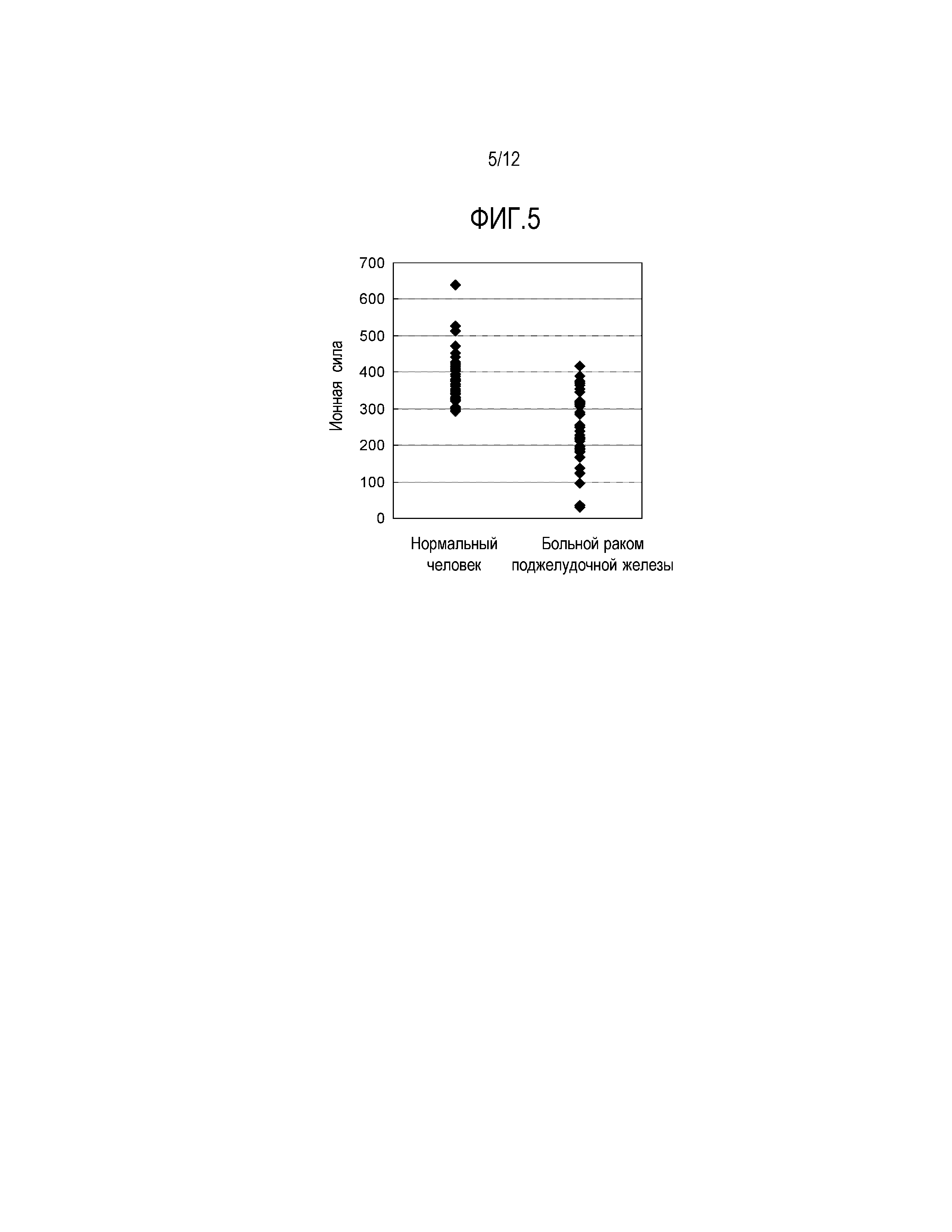
[Фиг. 6] Фиг. 6 демонстрирует результаты анализа белкового димера APOA2 (APOA2-АТQ/AT), содержащегося в плазме больных раком поджелудочной железы и здоровых людей по 40 субъектов каждых, с помощью метода сэндвич-твердофазного ИФА с использованием моноклонального антитела специфически узнающего аминокислотную последовательность в C-концевой области APOA2-АТQ белка (моноклональное антитело против конца APOA2-АТQ) и поликлонального антитела, специфически узнающего аминокислотную последовательность в С-концевой области APOA2-АТ (поликлональное антитело против конца APOA2-АТ).
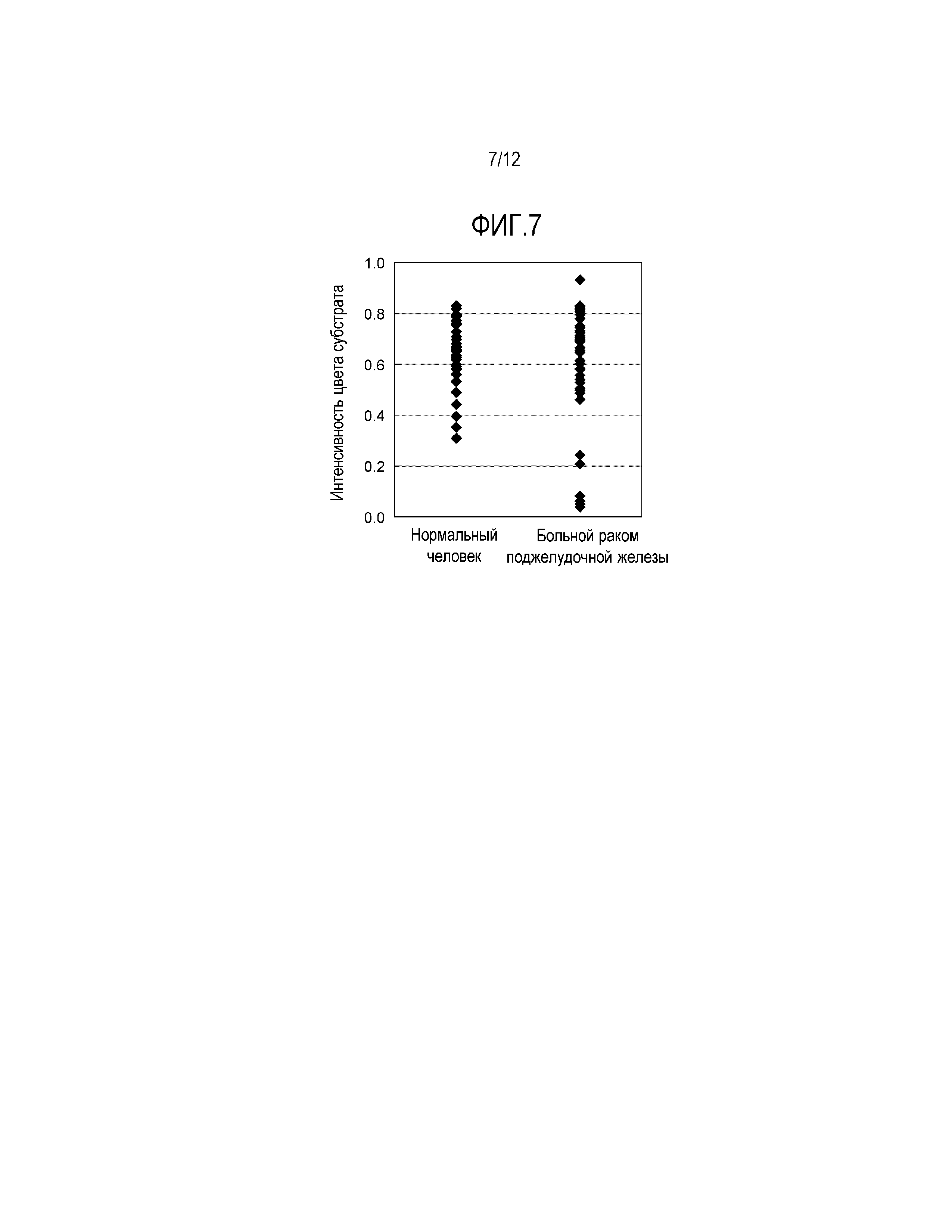
[Фиг. 7] Фиг. 7 демонстрирует результаты анализа APOA2-АТQ белка, содержащегося в плазме больных раком поджелудочной железы и здоровых людей по 40 субъектов каждых, с помощью метода сэндвич- твердофазного ИФА с использованием моноклонального антитела, специфически узнающего аминокислотную последовательность в С-концевой области APOA2-АТQ белка (моноклональное антитело против конца APOA2-АТQ) и антитела, специфически узнающего аминокислотную последовательность, отличную от C-концевой области (антитело не против конца APOA2-АТQ).
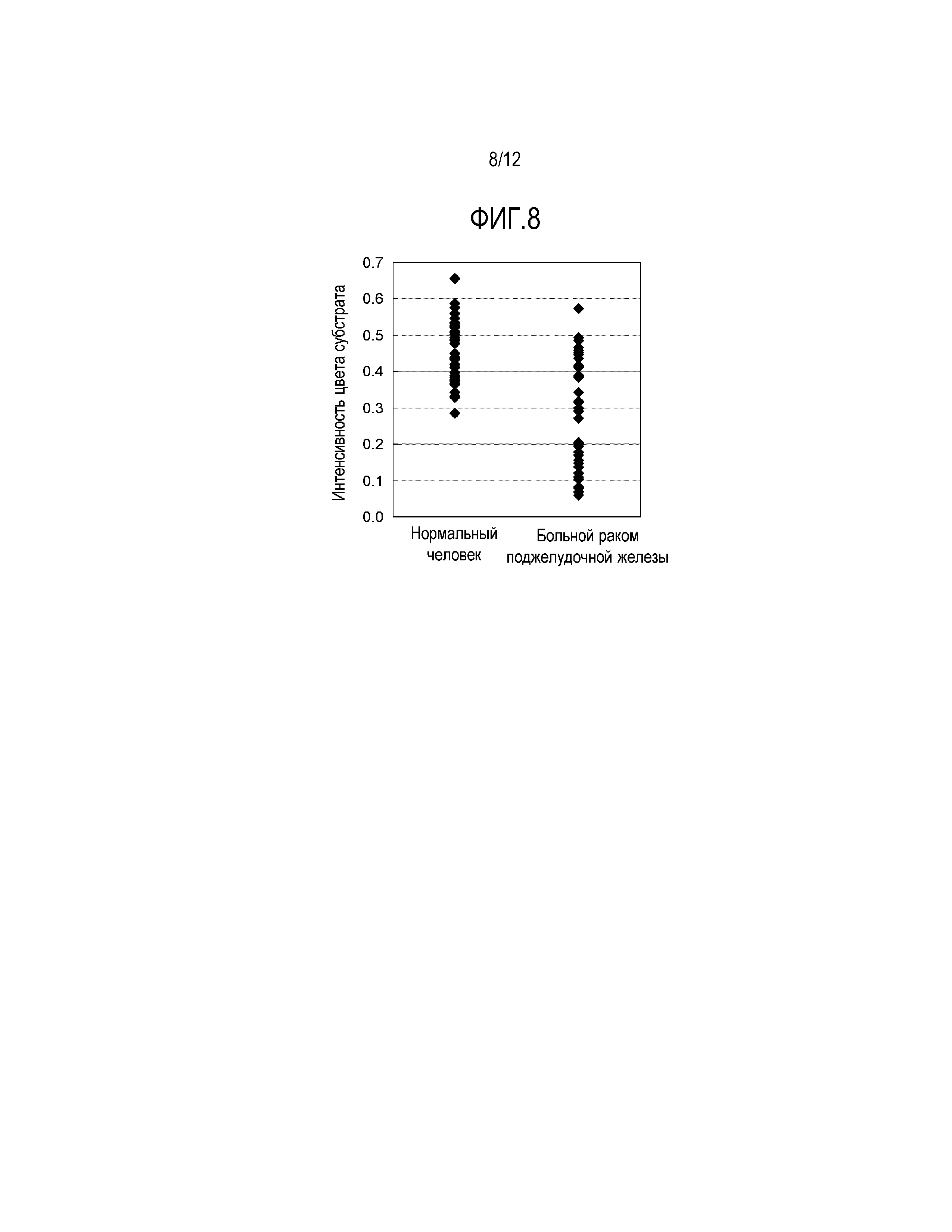
[Фиг. 8] Фиг. 8 демонстрирует результаты анализа APOA2-АТQ белка, содержащегося в плазме больных раком поджелудочной железы и здоровых людей по 40 субъектов каждых, методом сэндвич-твердофазного ИФА с использованием поликлонального антитела, специфически узнающего аминокислотную последовательность в С-концевой области APOA2-АТ белка (поликлональное антитело против конца APOA2-АТ) и антитела специфически узнающего аминокислотную последовательность отличную от C-концевой области (антитело не против конца APOA2-АТ).
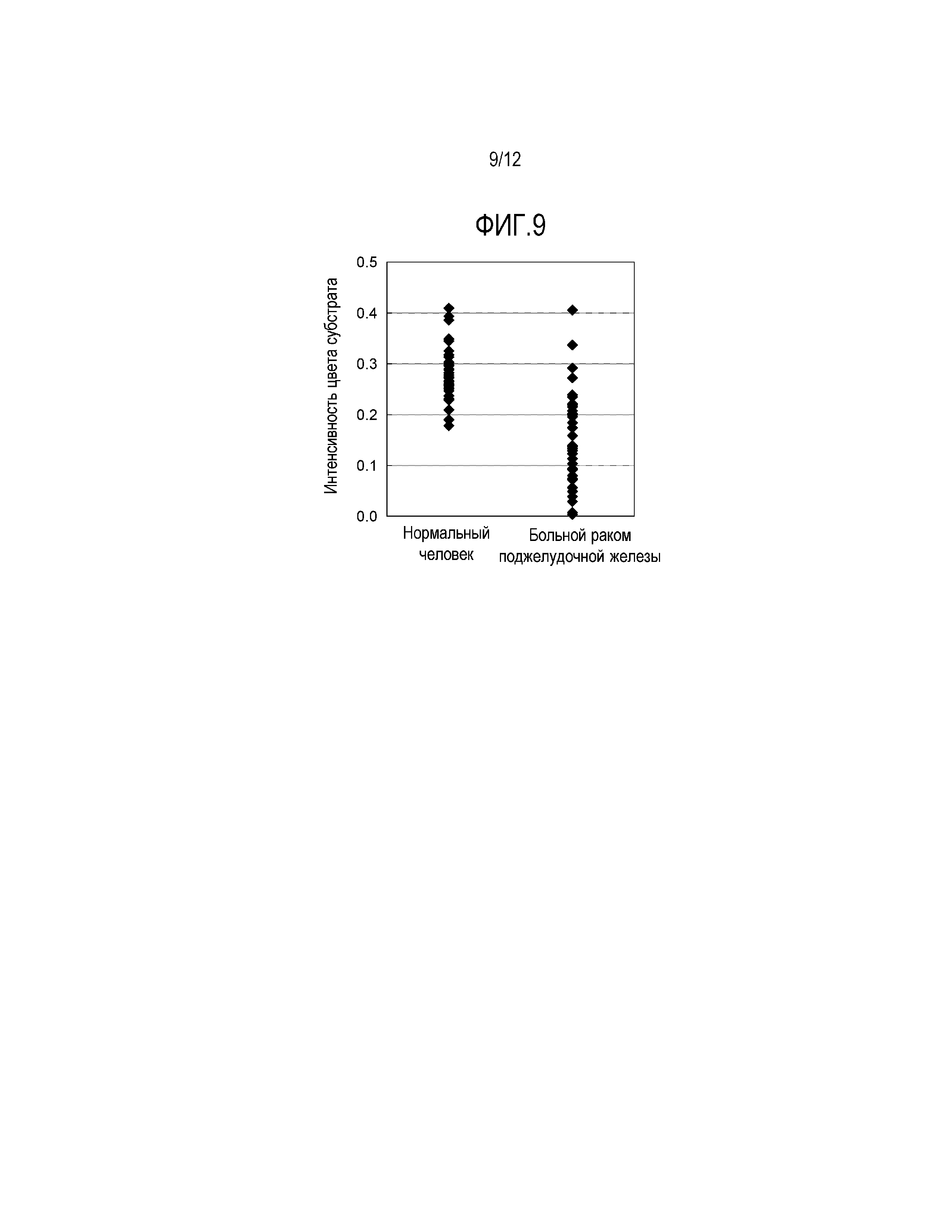
[Фиг. 9] Фиг. 9 является графиком умножения количеств двух вариантов APOA2 белка (APOA2-АТQ белка и APOA2-AT белка), содержащихся в плазме больных раком поджелудочной железы и здоровых людей, по 40 субъектов каждых.
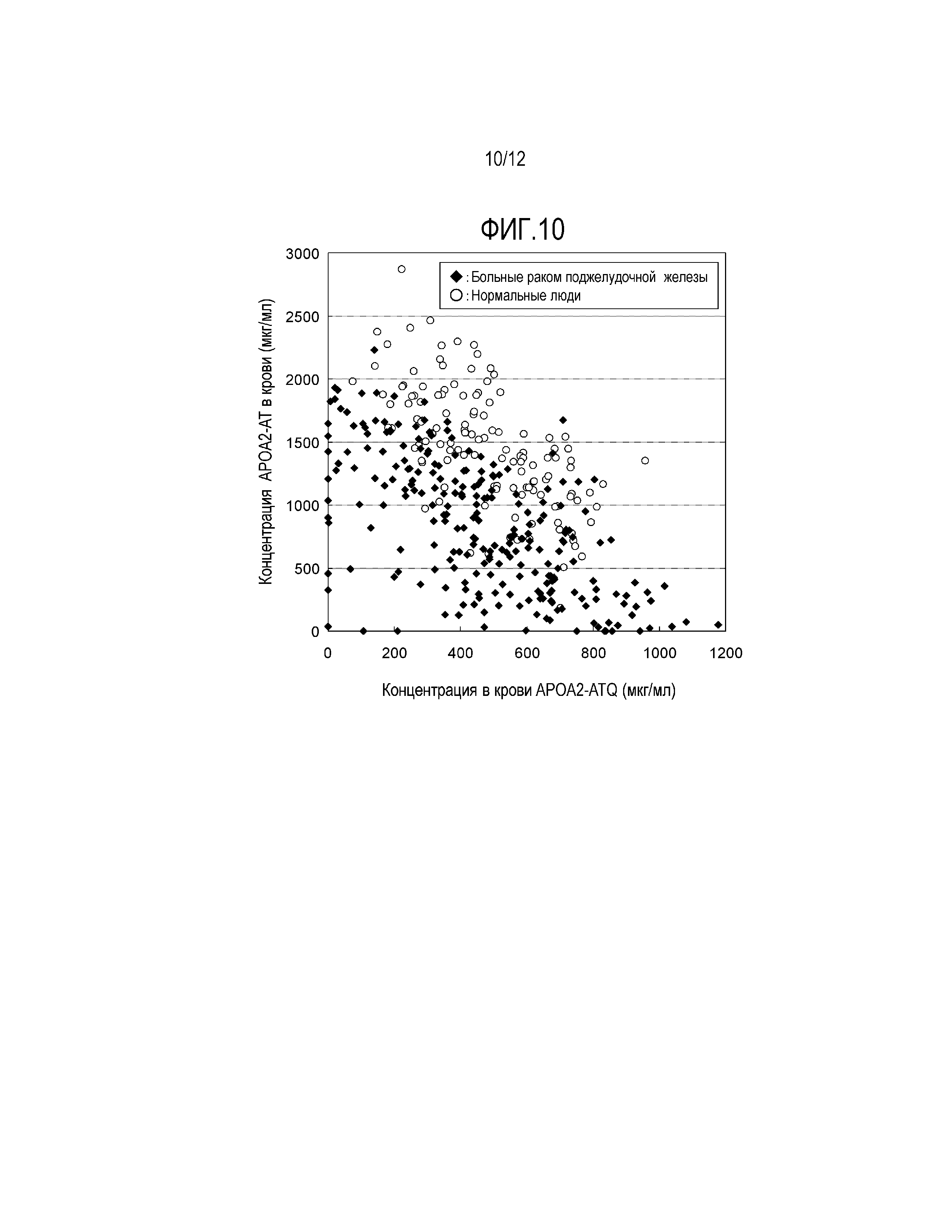
[Фиг. 10] Фиг. 10 является графиком умножения концентраций двух вариантов APOA2 белка (APOA2-АТQ белка и APOA2-AT белка), содержащихся в плазме 244 больных раком поджелудочной железы и 109 здоровых людей.
[Фиг. 11] Фиг. 11 демонстрирует ROC-кривую, полученную путем подстановки измеренных значений больных раком поджелудочной железы (стадии I и II в классификации UICC) и здоровых людей в выражение логистической регрессии. Фиг. 11(А) демонстрирует результаты анализа произведения значений измерения сэндвич-твердофазным ИФА двух вариантов APOA2 белков (APOA2-АТQ белка и APOA2-AT белка). Фиг. 11(B) демонстрирует результаты анализа белкового димера APOA2 (APOA2-АТQ/AT) путем масс-спектрометрии.
[Фиг. 12] Фиг. 12 демонстрирует ROC-кривую, полученную путем подстановки измеренных значений пациентов с доброкачественной опухолью поджелудочной железы и здоровых людей в выражение логистической регрессии. Фиг. 12(А) демонстрирует результаты анализа произведения значений измерения двух вариантов APOA2 белка (APOA2-АТQ белка и APOA2-AT белка) полученных методом сэндвич-твердофазного ИФА. Фиг. 12(Б) демонстрирует результаты анализа измеренного значения СА19-9.
Описание вариантов осуществления изобретения
Мишенью для анализа, в соответствии с настоящим изобретением является опухоль поджелудочной железы. В настоящем описании изобретения, "опухоль поджелудочной железы" относится к каждой опухоли, образованной в поджелудочной железе. В частности, опухоль поджелудочной железы является "раковой опухолью поджелудочной железы", которая является злокачественной опухолью, или «доброкачественной опухолью», поджелудочной железы, которая является доброкачественной опухолью.
В настоящем описании изобретения, "рак поджелудочной железы" относится к каждой злокачественной опухоли образованной в поджелудочной железе. В частности, рак поджелудочной железы включает в себя, например, инвазивную протоковую карциному поджелудочной железы, внутрипротоковую трубчатую карциному поджелудочной железы, карциному ацинарных клеток поджелудочной железы, серозную цистаденокарциному поджелудочной железы, муцинознкую цистаденокарциному поджелудочной железы (один тип муцинозного кистозного новообразования в поджелудочной железе), внутрипротоковую папиллярную муцинозную карциному поджелудочной железы (один тип внутрипротокового папиллярного муцинозного новообразования в поджелудочной железе) и нейроэндокринные опухоли поджелудочной железы (один тип эндокринного новообразования в поджелудочной железе) ("General Rules for the Study of Pancreatic Cancer", The 6th Edition, Revised Version, 2013, Japan Pancreas Society, Kanahara & Co., Ltd.). Являющаяся мишенью поджелудочная железа не ограничивается степенью развития. Любой рак на ранней стадии, рак на поздней стадии, и рак в терминальной стадии включены в область настоящего изобретения.
В настоящем описании, "рак на ранней стадии" относится к опухоли, которая ограничена локальной областью, где опухоль развилась (внутри мукозной мембраны) без инфильтрации в соседние ткани или с инфильтрацией только в ограниченную локальную область. В частности, рак на ранней стадии относится к раку в стадии 0, IА, IБ, IIА, или IIB согласно UICC (Unio Internationalis Contra Cancrum) классификации ("TNM Classification of Malignant Tumours", the 7th edition, Japanese version, 2012, TNM Committee of the Japan National Committee for UICC, Kanahara & Co., Ltd.). Как упоминалось выше, рак поджелудочной железы является трудноизлечимым раком с крайне неблагоприятным прогнозом. Тем не менее, если рак поджелудочной железы на ранней стадии может быть обнаружен, 5-летний показатель выживаемости может быть заметно улучшен.
"Доброкачественная опухоль поджелудочной железы" включает муцинозную цистаденому (один тип муцинозного кистозного новообразования в поджелудочной железе), внутрипротоковую папиллярную муцинозную аденому (один тип внутрипротокового папиллярного муцинозного новообразования в поджелудочной железе), нейроэндокринную опухоль поджелудочной железы (один тип эндокринных новообразований в поджелудочной железе), серозную цистаденому, и атипичный эпителий и карциному in situ, возникающие в поджелудочной железе. ("General Rules for the Study of Pancreatic Cancer", The 6th Edition, Revised Version, 2013, Japan Pancreas Society, Kanahara & Co., Ltd.).
1. Антитело против APOA2 и его фрагмент.
Первый вариант осуществления настоящего изобретения относится к антителам против APOA2 (включая антитела против конца APOA2 белка) и антитела не против конца APOA2-АТQ белка)) и их фрагментов.
1-1. Антитело не против APOA2.
В настоящем описании изобретения, "APOA2 белок" соответствует APOA2 белку каждого вида организма и предпочтительно APOA2 белку человека (GenBank Accession No. NP_001634.1). В частности, APOA2 белок включает варианты белка дикого типа APOA2 человеческого происхождения, представленные в SEQ ID NOs: 1, 2, и 3 и также включает их природные мутанты и их фрагменты.
В настоящем описании изобретения, "варианты" означают разные молекулярные формы APOA2 белка, которые могут присутствовать в плазме, сыворотке крови или других жидкостях организма человека или животных. Варианты APOA2 белка соответствуют, например, APOA2 белкам, отличающимся по структуре С-концевой области, или их природным мутантам. В частности, варианты APOA2 белка относятся, например, к APOA2-АТQ белку, который приведен в SEQ ID NO: 1 и имеет аминокислотную последовательность в C-концевой области заканчивающуюся АТQ, APOA2-AT белку, приведенному в SEQ ID NO: 2 с аминокислотной последовательностью в С-концевой области заканчивающейся АТ, и APOA2-белку, приведенному в SEQ ID NO: 3 с аминокислотной последовательностью в С-концевой области заканчивающейся А.
В настоящем описании, "C-концевая область (карбоксил-концевая область)" относится к области, состоящей из от 6 до 25 аминокислот, предпочтительно от 8 до 20 аминокислот или от 10 до 17 аминокислот, включая аминокислоты на C конце и нескольких последовательных аминокислот, примыкающих к нему в аминокислотной последовательности.
В настоящем описании "естественный мутант" относится к встречающимся в природе мутантам, имеющим, например, аминокислотную последовательность, производную от аминокислотной последовательности, представленной в SEQ ID NO: 1, 2, или 3, путем удаления, замены или добавления одной или нескольких аминокислот или имеющей 90% или больше, 92% или больше, или 94% или больше, предпочтительно 95% или больше, более предпочтительно 97% или больше, еще более предпочтительно 98% или больше, или 99% или более идентичности аминокислотной последовательности. "Идентичность" означает отношение (%) количества идентичных аминокислотных остатков в одной аминокислотной последовательности к числу всех аминокислотных остатков (включая количество пробелов) в другой аминокислотной последовательности, когда эти две аминокислотные последовательности выравниваются с или без пробелов, с тем чтобы достичь наибольшей степени совпадения. Термин "несколько" обозначает целое число от 2 до 10, например, целое число от 2 до 7, от 2 до 5, от 2 до 4, или 2 или 3. Конкретные примеры природных мутантов включают мутанты на основе полиморфизма, как например SNPs (однонуклеотидные полиморфизмы), и мутанты сплайсинга (варианты сплайсинга). Замена является предпочтительно консервативным аминокислотным замещением. Это объясняется тем, что консервативное аминокислотное замещение позволяет получаемому белку иметь структуру или свойства существенно эквивалентные APOA2 белку, имеющему аминокислотную последовательность, описанную выше. Консервативные аминокислоты обозначает родственные среди аминокислот, классифицирующихся в тех же аминокислотных группах. Например, известны как аминокислотные группы группа неполярных аминокислот (глицин, аланин, фенилаланин, валин, лейцин, изолейцин, метионин, пролин и триптофан), группа полярных аминокислот (аминокислоты, за исключением неполярных аминокислот), группа заряженных аминокислот (кислые аминокислоты (аспарагиновая и глутаминовая кислоты)) и группа основных аминокислот (аргинин, гистидин и лизин)), группа незаряженных аминокислот (аминокислоты, за исключением заряженных аминокислот), группа ароматических аминокислот (фенилаланин, триптофан и тирозин), группа разветвленных аминокислот (лейцин, изолейцин и валин), и группа алифатических аминокислот (глицин, аланин, лейцин, изолейцин и валин).
"Их фрагменты", обозначает фрагменты различных вариантов APOA2 белка и их природных мутантов, содержащих С-концевые области вариантов APOA2 белка и мутантов. В частности, их фрагменты соответствуют продуктам протеазного гидролиза различных вариантов APOA2 белков и их мутантов.
Настоящее изобретение предоставляет антитела против конца APOA2 белка, включая антитело против конца APOA2-АТQ и антитело против конца APOA2-АТ.
"Антитело против конца APOA2-АТQ" означает антитело, способное специфически распознавать и связываться с эпитопом, присутствующим в С-концевой области APOA2-АТQ белка, или его фрагмента. Фраза "в частности, специфически распознавать и связываться" означает, что антитело не может ни узнать, ни связаться или с трудом узнает и связывается с другими вариантами APOA2 белка из-за отсутствия или очень слабой перекрестной активности с вариантами APOA2 белка. В частности, антитело против конца APOA2-АТQ относится к антителу, которое специфически связывается с С-концевой областью APOA2-АТQ белка, но не проявляет никакого связывания с С-концевой областью APOA2-АТ белка и с С-концевой областью APOA2-А белка и т.д. Такое антитело, направленное к концу может быть любым поликлональным или моноклональным антителом или их фрагментами. Моноклональное антитело является предпочтительным для достижения крупномасштабного производства и получения однородных результатов.
С другой стороны, "антитело не против конца APOA2-АТ" относится к антителу, способному специфически распознавать и связываться с эпитопом, находящимся в С-концевой области APOA2-АТ белка, или его фрагмента. В частности, антитело не против конца APOA2-АТ относится к антителу, которое специфически связывается с С-концевой областью APOA2-АТ белка, но не проявляет никакого связывания с С-концевой областью APOA2-АТQ белка и с С-концевой областью APOA2-А белка и т.д.. Такое антитело, направленное на конец, может быть любым из поликлональных и моноклональных антител или их фрагментов. Моноклональное антитело является предпочтительным для достижения крупномасштабного производства и получения единообразных результатов.
Настоящее изобретение также предоставляет "антитело не против конца APOA2 белка" узнающее аминокислотную последовательность отличную от С-концевой области белка APOA2.
"Антитело не против конца APOA2 белка" относится к антителу против белка APOA2, узнающему и связывающему эпитоп, находящийся в области отличной от С-концевой области в полноразмерной аминокислотной последовательности каждого варианта белка APOA2. Таким образом, поэтому антитело не против конца белка APOA2 полностью отличается от антитела против конца белка APOA2 по узнаваемому эпитопу. Термин "не против конца" для антитела не против конца белка APOA2 используется ради удобства по отношению к антителам против конца белка APOA2. Таким образом, его эпитоп особо не ограничен, пока эпитоп, присутствует в области, отличной от C-концевой области. Антитело не против конца белка APOA2 может также включать антитело, узнающее и связывающееся с эпитопом находящемся в N конце.
Антитело не против конца белка APOA2, используемое в настоящем изобретении, является предпочтительно антителом, которое имеет почти тот же уровень связывающей активности по отношению к APOA2 белку, имеющему определенную C-концевую последовательность, и связывающей активности по отношению APOA2 белку, имеющему C-концевую последовательность отличную от последовательности APOA2 белка, когда связывающую активность сравнивают между этими APOA2 белками, и не ингибирует связывание антител не против конца белка APOA2 с С-концевой областью. Их конкретные примеры включают " антитело не против конца APOA2-АТQ", связывающееся с аминокислотной последовательностью отличной от C-концевой области APOA2-АТQ белка представленной в SEQ ID NO: 1, " антитело не против конца APOA2-АТ", связывающееся с аминокислотной последовательностью отличной от C-концевой области APOA2-АТ белка, представленной в SEQ ID NO: 2. В этом случае антитела имеют одинаковый уровень связывающей активности по отношению к этим APOA2 белкам, и никакие антитела не ингибируют связывание антитела против конца APOA2-АТQ и антитела против конца APOA2-АТ с С-концевой областью APOA2 белков. Антитело не против конца белка APOA2 может быть любым из поликлональных и моноклональных антител или их фрагментов. Моноклональное антитело является предпочтительным для достижения крупномасштабного производства и получения единообразных результатов.
"Моноклональное антитело", применяемое в настоящем описании, означает антитело, которое состоит из одного иммуноглобулина или включает области вариотипического детерминанта (далее именуются "FRs") и области, определяющие комплементарность (далее именуются "CDRs") и способное специфически распознавать и связываться с конкретным антигеном (эпитоп).
Типичная молекула иммуноглобулина является тетрамером, состоящим из двух пар полипептидных цепей, т.е. двух пар тяжелая-легкая цепей, в которых тяжелая цепь в каждой паре связана с ее партнером легкой цепью посредством дисульфидной связи. Каждая тяжелая цепь состоит из вариабильной области тяжелой цепи (V область Н цепи; далее именуются "VH") на N-концевой стороне и константной области тяжелой цепи (С область H цепи; в дальнейшем именуемая "СН") на С-концевой стороне. Каждая легкая цепь состоит из вариабельной области легкой цепи (V область L цепи; далее именуется "VL") на N-концевой стороне и константной области легкой цепи (C области L цепи; в дальнейшем именуемой "СL”) на С-концевой стороне. Из этих областей VH и VL являются особенно важными из-за их вовлеченности в специфичность связывания антитела. Эти VH и VL области, каждая, состоят из приблизительно 110 аминокислотных остатков и внутренне имеют уже три CDRs (CDR1, CDR2, и CDR3), участвующих непосредственно в специфичности связывания антигена и четыре FRs (FR1, FR2, FR3 и FR4), действующих в качестве остова структур вариабельной области. Известно, что CDRs конформационно комплементарны молекуле антигена и определяют специфичность антитела (E. А. Kabat et al., 1991, Sequences of proteins of immunological interest, Vol.1, eds.5, NIH publication). Аминокислотные последовательности константных областей редко различаются среди внутривидовых антител, в то время как аминокислотные последовательности CDRs высоко вариабельны среди антител и, следовательно, также называются гипервариабельными областями. В вариабельной области, CDRs и FRs расположены в порядке FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4 от N-конца в сторону C конца. В молекуле иммуноглобулина, VL и VH спарены путем димеризации для образования антиген-связывающего участка. Известно, что иммуноглобулин имеет все классы IgG, IgM, IgA, IgE, и IgD. Антитела настоящего изобретения могут быть любого класса. IgG является предпочтительным.
Моноклональное антитело против конца APOA2-АТQ настоящего изобретения специфически связывается с C-концевой областью APOA2-АТQ белка представленного в SEQ ID NO: 1, но не проявляет связывающей активности по отношению к APOA2-АТ белку SEQ ID NO: 2 и APOA2-белку, продемонстрированному в SEQ ID NO: 3. Конкретные примеры такого антитела включают клоны моноклонального антитела против конца APOA2-АТQ, представленные клонами антитела, именуемыми 7F2 и 6G2, описанными в Примере 1, упомянутом позже. Клон 7F2 имеет CDR1, состоящую из последовательности, представленной в SEQ ID NO: 4, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 5 и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 6, в тяжелой цепи, и CDR1, состоящую из последовательности, представленной в SEQ ID NO: 7, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 8, и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 9, в легкой цепи. Клон 6G2 имеет CDR1, состоящую из последовательности, представленной в SEQ ID NO: 10, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 11, и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 12, в тяжелой цепи и CDR1, состоящую из последовательности, представленной в SEQ ID NO: 13, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 14, и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 15, в легкой цепи.
Антитело не против конца белка APOA2 настоящего изобретения предпочтительно является антителом, имеющим одинаковые уровни связывающей активности по отношению к вариантам APOA2 белка, представленным в SEQ ID NOs: от 1 до 3, когда связывающая активность сравнивается между ними. Конкретные их примеры включают клоны антитела против APOA2, представленные названиями клонов антител MAB1 и MAB2, описанными в Примере 5 упомянутом ниже. Клон MAB1 имеет CDR1, состоящую из последовательности, представленной в SEQ ID NO: 16, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 17, и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 18, в тяжелой цепи и CDR1, состоящую из последовательности, представленной в SEQ ID NO: 19, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 20, и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 21, в легкой цепи. Клон MAB2 имеет CDR1, состоящую из последовательности, представленной в SEQ ID NO: 22, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 23, и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 24, в тяжелой цепи и CDR1, состоящую из последовательности, представленной в SEQ ID NO: 25, CDR2, состоящую из последовательности, представленной в SEQ ID NO: 26, и CDR3, состоящую из последовательности, представленной в SEQ ID NO: 27, в легкой цепи. Антитело не против конца APOA2-АТQ или антитело не против конца APOA2-АТ может быть использовано в качестве антитела не против конца белка APOA2.
"Их фрагменты" для "поликлональное и моноклональное антитело или их фрагменты" являются частичными фрагментами поликлональных и моноклональных антител и относятся к полипептидным цепям, имеющим активность существенно эквивалентную антиген-специфической связывающей активности антител, или их комплексов. Фрагменты, каждый из которых относится к части антитела, содержащей по меньшей мере один антиген-связывающий сайт, упомянутый выше, т.е. полипептидную цепь, имеющую по крайней мере одну VL-VH пару, или комплекс таковых. Их конкретные примеры включают большое количество достаточно охарактеризованных фрагментов антител, получившихся в результате расщепления иммуноглобулина различными пептидазами. Более конкретные их примеры включают Fab, F(аb')2, и Fab'. Fab - это фрагмент, полученный в результате расщепления папаином IgG молекулы в N-концевом участке дисульфидных связей в шарнирах и представлен полипептидом, состоящим из VH и СН1, который примыкает к VH, между тремя СН-составляющими доменами (СН1, СН2, и СН3), и легкой цепью. F(аb')2 - это Fab' димер, получаемый в результате расщепления пепсином молекулы IgG в С-концевом участке дисульфидных связей в шарнирах. Fab' является существенно структурно эквивалентным Fab, не смотря на то, что он несколько длиннее в H цепи чем Fab за счет включения шарнира (Fundamental Immunology, Paul ed., 3rd ed., 1993). Fab' может быть получен путем уменьшения F(аb')2 в мягких условиях и расщепления дисульфидных мостиков в области шарнира. Все эти фрагменты антитела содержат антиген-связывающий участок и обладают способностью специфически связываться с антигеном (т.е., в частности вариантом APOA2 белка в настоящем изобретении).
Фрагмент моноклонального антитела настоящего изобретения может быть синтезирован химически или с помощью метода рекомбинантной ДНК. Примеры таковых включают фрагменты антитела, вновь синтезированные с помощью метода рекомбинантной ДНК. В частности, фрагмент соответствует, но не ограничивается, мономерной полипептидной молекуле, в которой одна или более VLs и одна или более VHs моноклонального антитела настоящего изобретения являются искусственно соединенными через пептидный линкер или ему подобный, имеющий соответствующую длину последовательности, или мультимерный полипептид такового. Примеры таких полипептидов включают синтетические антитела, такие как одноцепочечные FV (scFv: одноцепочечный фрагмент переменной области) (см. Pierce catalog and Handbook, 1994-1995, Pierce Chemical co., Rockford, IL), диатело, триатело, и тетратело. В молекуле иммуноглобулина, VL и VH, в норме расположены на отдельных полипептидных цепях (L цепи и H цепи). Одноцепочечный Fv является синтетическим фрагментом антитела, имеющим структуру, в которой эти вариабельные области связаны через гибкий линкер, имеющий достаточную длину, такую, что VL и VH содержатся в одной полипептидной цепи. Обе вариабельные области в одноцепочечном Fv являются самообъединенными друг с другом для образования одного функционального антиген-связывающего сайта. Одноцепочечный Fv может быть получен путем интеграции рекомбинантной ДНК, кодирующей одноцепочечный FV, в геном фага с помощью метода, известного в данной области техники, с последующей экспрессией. Диатело представляет собой молекулу, имеющую структуру, основанную на димерной структуре одноцепочечных Fvs (Holliger et al., 1993, Proc. Natl. Acad. Sci USA, 90: 6444-6448). Например, когда линкер имеет длину короче, чем приблизительно 12 аминокислотных остатков, два вариабильных участка в одноцепочечном Fv не могут самообъединиться. Напротив, VL в одной цепи Fv может быть собрана с VH другой Fv цепи путем формирования диатела, т.е. в результате взаимодействия между двумя одноцепочечными Fvs. В результате, могут быть сформированы два функциональных антиген-связывающих сайта ((Marvin et al., 2005, Acta Pharmacol. Sin., 26: 649-658). Дальнейшее добавление остатков цистеина в С конец одноцепочечных Fvs позволяет дисульфидную связь между этими двумя цепями Fv так, что может быть образовано стабильное диатело. (Alafsen et al., 2004, Prot. Engr. Des. Sel., 17: 21-27). Хотя диатело является двухвалентным фрагментом антитела, как описано выше, его антиген-связывающие участки не должны связываться с одним и тем же эпитопом и могут соответственно обладать биспецифичностью в распознавании и связывании разных эпитопов. Триатело или тетратело имеют трихмерную или тетрамерную структуру, основанную на структуре одноцепочечного Fv как в диателе. Триатело или тетратело являются соответственно трехвалентным или квадровалентным фрагментами антитела, и каждый может быть мультиспецифичным антителом. Фрагмент антитела настоящего изобретения также включает фрагменты антител, выявленные с помощью библиотеки фагового дисплея (см., например, McCafferty et al., 1990, Nature, Vol. 348, 552-554) в которой эти фрагменты антител обладают способностью связываться с их антигенами. Также см., например,. Kuby, J., Immunology, 3rd Ed., 1998, W.H. Freeman & Co., New York.
В настоящем изобретении, каждое антитело против APOA2 или его фрагмент могут быть модифицированы. В этом контексте, модификация включает любые функциональные модификации (например, гликозилирование), необходимые для антитела против APOA2 или его фрагмента, чтобы иметь специфическую связывающую активность по отношению к APOA2 белку, и мечение, необходимое для обнаружения антитела настоящего изобретения или его фрагмента. Примеры мечения антитела включают мечение флуоресцентными красителями (FITC, родамин, Тexas Red, Cy3, и Су5), флуоресцентными белками (например, PE, APC, и GFP), ферментами (например, пероксидаза хрена, щелочная фосфатаза, глюкозооксидаза), или биотином или (стрепт)авидином. Гликозилирование антитела может быть ухудшено для того, чтобы увеличить сродство антитела к антигену. Такое ухудшение может быть достигнуто, например, путем изменения одного или более сайтов гликозилирования в последовательности антитела. Более конкретно, одна или более аминокислотных замен может быть введена в аминокислотную последовательность, содержащую один или более сайты гликозилирования, например, в FR, чтобы удалить сайты гликозилирования. В результате гликозилирование сайтов может быть отменено. Такое дегликозилирование эффективно для увеличения аффинности антитела к антигену (U.S. Patent Nos 5714350 и 6350861).
1-2. Подготовка иммуногена
В случае получения антител против белка APOA2 в настоящем изобретении, каждый вариант APOA2 белка сначала готовят в качестве иммуногена (антигена). Примеры варианта APOA2 белка, который может быть использован в качестве иммуногена в настоящем изобретении, включают APOA2 белки, имеющие аминокислотную последовательность, представленную любой из SEQ ID NO: от 1 до 3 и их мутанты, и полипептидные фрагменты белков или мутантов, и соединения их полипептидов с другими пептидами (например, сигнальные пептиды и пептиды-метки). Вариант APOA2 белка в качестве иммуногена может быть синтезирован любым образом, известным в данной области техники, например, методом твердофазного синтеза пептидов, например, с использованием информации об аминокислотной последовательности, представленной любой из SEQ ID NO: от 1 до 3. Вариант APOA2 белка может быть приготовлен, например, используя метод, приведенный ниже.
Любой из встречающихся в природе APOA2 белков и рекомбинантные APOA2 белки могут быть использованы в качестве варианта APOA2 белка. Синтетический APOA2 белок, целый или его часть, которые были химически синтезированы с помощью пептидного синтеза или ему подобным, могут быть использованы в качестве иммуногена. Например, вариант APOA2 белка, который готовят для того, чтобы получить каждое антитело, связывающееся с С-концом APOA2 белка (антитело против конца белка APOA2), может быть любым из встречающихся в природе белков APOA2, рекомбинантных белков APOA2 и синтетических APOA2 белков, все или часть которых были химически синтезированы путем пептидного синтеза или ему подобным, содержащие аминокислотную последовательность, состоящую из по крайней мере 6 или более последовательных аминокислот С-концевых областей различных вариантов APOA2 белка.
Встречающиеся в природе APOA2 белки могут быть извлечены из образцов, включая жидкости тела, как, например, кровь (в том числе сыворотка и плазма), или культуры супернатантов культивируемых клеток с применением метода разделения и очистка белка, известного в данной области техники, например, гель-фильтрации, ионообменной хроматографии, или аффинной хроматографии.
Рекомбинантные APOA2 белки могут быть экспрессированы в микробах, клетках насекомых или клетках животных, содержащих ДНК, кодирующую белки, и затем выделены из клеток с использованием метода разделения и очистки белков, известного в данной области техники.
Синтетические APOA2 белки могут быть синтезированы подходом, известным в данной области техники, например, методом твердофазного пептидного синтеза, используя, например, опубликованную информацию об аминокислотной последовательности белка APOA2. Каждый из этих синтетических APOA2 белков может быть связан с белком-носителем, как например KLH (гемоцианин лимфы улитки), ОВА (овальбумин), или БСА (бычий сывороточный альбумин).
В случае использования в приготовлении антитела против конца белка APOA2 в качестве иммуногена варианта фрагмента APOA2 белка, могут также быть использованы любые из встречающихся в природе фрагменты APOA2 белка, фрагменты рекомбинантного белка APOA2, и синтетические фрагменты APOA2 белка. Например, олигопептид или полипептид, состоящий из 6 или более, предпочтительно 10 или более, более предпочтительно 18 или более, еще более предпочтительно 30 или более последовательных аминокислотных остатков, включающих С-конец последовательности, представленной любой из SEQ ID NO: от 1 до 3, может быть использован в качестве APOA2 фрагмента белка, выступающего в качестве антигена. Например, может быть использован пептид, состоящий из аминокислотных последовательностей представленных SEQ ID NO: 28 или 29.
В случае использования в качестве иммуногена фрагмента APOA2 белка, встречающегося в природе, например, в приготовлении антитела против конца белка APOA2, очищенный APOA2 белок обрабатывают подходящей протеазой, как например трипсин и затем фракционируют на колонке с обращенной фазой для получения пиков. Аминокислотную последовательность пептида, содержащегося в каждом пике, определяют с помощью масс-спектрометра. Пик пептида, включающий, в качестве частичной последовательности, последовательность, состоящую из 6 или более последовательных аминокислот в С-концевой области белка APOA2, представленного в любой из SEQ ID NO: от 1 до 3, может быть использован в качестве иммуногена.
В случае использования в качестве иммуногена частичной аминокислотной последовательности рекомбинантного APOA2 белка, например для получения антитела против конца белка APOA2, часть последовательности ДНК, кодирующая частичную последовательность из 6 или более последовательных аминокислот, включающую С-концевые аминокислотные остатки белка APOA2, представленного в любой из SEQ ID NO: от 1 до 3, в последовательности ДНК, кодирующей упомянутый выше белок APOA2, может быть вставлена в векторы для экспрессии, которые затем вводятся в различные клетки для получения частичной аминокислотной последовательности каждого варианта белка APOA2, представленного любым из SEQ ID NO: от 1 до 3.
Также в случае получения в настоящем изобретении антитела не против конца белка APOA2, способ его получения может быть по существу таким же, как способ получения антитела против конца белка APOA2 за исключением того, что область, которая может быть использована в качестве иммуногена в APOA2 белке отличается от областей использованных в качестве иммуногена для получения антител против конца белка APOA2. В частности, вся или часть области, кроме С-концевой области белка APOA2, может быть использована в качестве иммуногена. В случае получения антитела против конца белка APOA2, как и в случае получения антител против конца белка APOA2, олигопептид или полипептид, содержащие аминокислотные остатки в области отличной от C-концевой области белка APOA2, могут быть также использованы в качестве антигена.
(Получение рекомбинантного белка APOA2)
Далее будет подробно описано приготовление APOA2 рекомбинантного белка (варианта рекомбинантного белка APOA2), представленного в любой из SEQ ID NO: от 1 до 3.
(a) Подготовка полинуклеотидов, кодирующих вариант рекомбинантного белка APOA2.
Фаги или плазмиды, способные автономно реплицироваться в микробе хозяине, могут быть использованы в качестве векторов для применения в экспрессии различных вариантов APOA2 белка.
Примеры плазмид включают плазмиды происходящие из E. coli (pET30a, pGEX6p, pUC118, pUC119, pUC18, pUC19 и т.д.), плазмиды происходящие из Bacillus-subtilis (pUB110, Ptp5 и т.д.), и фермент-производные плазмиды (YEp13, YEp24, YCp50 и др.). Примеры фагов включают λ фаги (λgt11, λZAP и т.д.). Кроме того, также могут быть использованы векторы вирусов животных, как, например, вирус коровьей оспы или вирусы насекомых, как, например, бакуловирус.
Способ включения в вектора полинуклеотида, кодирующего вариант белка APOA2, включает, например, расщепление очищенного полинуклеотида соответствующими ферментами рестрикции и лигирование с использованием ДНК-лигазы полученного фрагмента в векторы, расщепленные соответствующими ферментами рестрикции или тому подобное.
(б) Введение в хозяина вектора, экспрессирующего вариант APOA2 белка.
Полученные вектора, экспрессирующие вариант APOA2 белка, для получения трансформантов экспрессирующих варианты белка APOA2 вводятся в хозяина, способного экспрессировать экспрессионные вектора. Применяемые хозяева не особенно ограничены, если хозяева подходят для используемых векторов и способны экспрессировать вариант APOA2 белка. Например, предпочтительно используют бактерия E. сoli (Escherichia coli), Bacillus-subtilis, дрожжи, клетки насекомых или клетки животных (COS клетки и CHO клетки (Journal of immunology, 1998, Vol. 160, 3393-3402)). Способ введения вектора в бактерии особо не ограничен, если этот способ является способом для введения векторов в бактерии, известным в данной области техники. Примеры таковых включают способ теплового шока, способ с использованием ионов кальция и электропорацию. Все эти способы известны из этой области техники и описаны в различных публикациях. См., например, Greene & Sambrook, 2012, Molecular Cloning: A Laboratory Manual Fourth Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Липофектиновый способ (PNAS, 1989, Vol. 86, 6077; и PNAS, 1987, Vol. 84, 7413), электропорация, способ с фосфатом кальция (Virology, 1973, Vol. 52, 456-467), способ с ДЕАЕ-декстраном или подобные используют предпочтительно в трансформации клеток животных.
В случае использования бактерий в качестве хозяев, что предпочтительно, экспрессионные векторы варианта белка APOA2 способны автономно реплицироваться в бактерии и при этом состоят из последовательности промотора, последовательности связывающейся с рибосомами, последовательности ДНК, кодирующей вариант белка APOA2, и последовательности терминации транскрипции. Экспрессионные векторы могут также содержать ген, кодирующий регуляторный фактор, управляющий промотором. Может быть использован любой промотор, который может функционировать в хозяевах, таких как E. coli.
Кроме того, в случае использования в качестве хозяев эукариотических клеток, таких как дрожжи, клеток животных, клеток насекомых, трансформанты, экспрессирующие вариант APOA2 белка, могут также быть получены в соответствии с подходом, известным в данной области техники. Векторы, экспрессирующие вариант APOA2 белка, для применения в клетках эукариот содержат последовательность промотора и последовательность ДНК, кодирующую вариант белка APOA2, которая может быть связана, если требуется, с цис элементом (например, энхансер), сигналом сплайсинга (сайт донора, сайт акцептора, точки ветвления и т. д.), поли-А дополнительным сигналом, последовательностью селективного маркера, последовательностью связывания с рибосомой (SD последовательность), и тому подобное.
(с) Культура трансформанта и экспрессия рекомбинантного варианта белка APOA2
Затем, подготовленные трансформанты культивируют. Способ культивирования трансформантов в среде осуществляется в соответствии с обычным способом для использования в культуре хозяев. В случае использования, например, бактерии как хозяина, среда особо не ограничена, если среда содержит источник углерода, источник азота, неорганические соли и т.д., усвояемые бактериями, и бактерии способны расти или пролиферировать в среде. Может быть использована любая природная и синтетическая среда. Более конкретные ее примеры включают среду LB, но не лимитируются ею, как само собой разумеющееся. Для селективного культивирования трансформантов, антибиотик, как например ампициллин или тетрациклин может быть добавлен в среду, если это необходимо. Культивирование обычно проводят при 37°С в течение от 6 до 24 часов в аэробных условиях, как например культивирование при аэрации или перемешивании. В процессе периода культивирования, pH предпочтительно поддерживается при или около нейтральной pH. pH доводится с использованием неорганической или органической кислоты или щелочного раствора или подобных. Если трансформанты являются клетками животных, такими как CHO клетки, клетки хозяина могут быть посеяны в количестве 1 x 105 клеток/мл в среду DMEM, выпускаемой компанией Gibco/Thermo Fisher Scientific, Inc, и культивированы в 5% CO2 инкубаторе при 37°C. В процессе культивирования, если необходимо, в среду может быть добавлен антибиотик, как например ампицилин или тетрациклин.
Когда векторы экспрессирующие вариант APOA2 белка являются типами векторов индукционной экспрессии белка, содержащие систему контроля экспрессии белка (которая соответствует, например, гену репрессору и оператору для бактерии хозяина), экспрессия варианта белка APOA2 должна быть индуцирована заданной обработкой трансформантов. Способ индукции экспрессии отличается в зависимости от системы управления экспрессией белков, содержащейся в векторах. Следовательно, может быть осуществлена индукционная обработка, подходящая для этой системы. Например, наиболее обычно используемая в типе векторов для индукции экспрессии белков система управления экспрессией в хозяине бактерии, является система состоящая из гена lac- репрессии и lac-оператора. Эта система способна индуцировать экспрессию с помощью обработки ИПТГ (изопропил-1-тио-D-галактозид). Трансформантам, имеющим вектора экспрессии белков APOA2, содержащие данную систему, может быть позволено экспрессировать интересующий вариант APOA2 белка путем добавления ИПТГ в среду в соответствующем количестве (например, в конечной концентрации:1мМ).
(d) Экстракция и/или выделение варианта рекомбинантного белка APOA2
Когда вариант APOA2 белка производится внутри бактериальных тел или клетках после культивирования, бактериальные тела или клетки могут быть выделены и разрушены, с последующем выделением белка. Когда вариант APOA2 белка, производится за пределами бактериальных тел или клеток, раствор культуры может быть использован непосредственно, или может быть использована надосадочная жидкость, полученная путем удаления бактериальных тел или клеток путем центрифугирования или тому подобное. Затем вариант APOA2 белка может быть выделен и очищен от культур путем использования отдельно или в подходящей комбинации обычных методов очистки белка, например, осаждением сульфатом аммония, гель-фильтрацией, ионообменной хроматографией и аффинной хроматографией. Был получен вариант APOA2 белка или нет, может быть подтверждено с помощью SDS-полиакриламидного гель-электрофореза или тому подобное.
1-3. Подготовка моноклонального антитела
1-3-1 против APOA2. Способы приготовления моноклонального антитела против APOA2 и гибридомы.
Гибридомы, продуцирующие моноклональное антитело против APOA2 настоящего изобретения, могут быть созданы с помощью способа, описанного ниже. Тем не менее, способ создания не ограничивается этим, и любой из других способов, известных в данной области, может быть использован для создания.
(1) Способ получения моноклонального антитела против APOA2.
Для получения моноклонального антитела против APOA2, специфически связывающегося с C-концевой областью в аминокислотной последовательности, составляющей белок APOA2, любого APOA2 белка, представленного в SEQ ID NO: 1, 2, или 3, моноклональные антитела могут быть получены с использованием в качестве иммуногена варианта APOA2 белка или пептида, включающего С-концевую область варианта белка APOA2, и затем скринированы на связывание антител только с конкретным вариантом APOA2 белка с использованием APOA2 белка, приведенного в любой из SEQ ID NO: от 1 до 3 или пептида, включающего С-концевую область варианта APOA2 белка. Например, моноклональное антитело против конца APOA2-АТQ может быть отобрано путем скрининга с использованием, в качестве показателя специфическое связывание с С-концевой областью APOA2-АТQ белка, приведенного в SEQ ID NO: 1 без или почти без связывания с вариантом APOA2 белка, приведенном в SEQ ID NO: 2 или 3. Аналогично, моноклональное антитело против конца APOA2-АТ может быть отобрано путем скрининга с использованием, в качестве показателя специфическое связывание с С-концевой областью APOA2-АТ белка, приведенного в SEQ ID NO: 2 без или почти без взаимодействия с вариантом APOA2 белка, приведенном в SEQ ID NO: 1 или 3.
В целях получения антитела против конца белка APOA2, узнающего аминокислоты отличные от С-концевой области белка APOA2, моноклональные антитела могут быть получены с использованием в качестве иммуногена варианта APOA2 белка или пептида, содержащего его частичную последовательность, и затем скринированы на интересующее антитело с использованием, в качестве показателя, те же уровни активности связывания по отношению к вариантам APOA2 белка, приведенными в SEC ID NO: от 1 до 3, или их пептидам, различающимся С концами, когда активность связывания сравнивается между ними.
(2) Приготовление клеток, продуцирующих антитело против APOA2.
Рекомбинантный APOA2 белок, полученный в качестве иммуногена в пункте 1-2, растворяют в буферном растворе, чтобы приготовить раствор иммуногена. Для эффективной иммунизации к нему, если это необходимо, может быть добавлен адъювант. Примеры адъюванта включают коммерчески доступный полный адъювант Фрейнда (FCA) и неполный адъювант Фрейнда (FIA). Эти адъюванты могут быть использованы по отдельности или в виде смеси.
Далее млекопитающее, например, крысу, мышь (например, инбредная мышь BALB/c) или кролика, иммунизируют введением приготовленного раствора иммуногена. Примеры способов введения иммуногенов включают, но не лимитируются, подкожное введение с использованием FIA или FCA, внутрибрюшинное введение с использованием FIA и внутривенное введение с использованием 0,15 молярный хлорид натрия. Одна доза иммуногена определяется соответствующим образом с учетом типа животного, предназначенного для иммунизации, пути введения и т.д. и равна приблизительно от 50 до 200 мкг на животное. Интервалы между уколами иммунизации определенным образом не лимитированы. После сенсибилизации от 2 до 6, предпочтительно от 1 до 4, проводятся бустеры с интервалами от нескольких дней до нескольких недель, предпочтительно с интервалами от 1 до 4 недель. После сенсибилизации, титр антител в сыворотке крови иммунизированных животных измеряют методом твердофазного ИФА (иммуноферментный анализ) или тому подобным. При условии, что подтверждается достаточное повышение титра антител, иммуноген вводят внутривенно или внутрибрюшинно для окончательной иммунизации. Клетки, продуцирующие антитело собирают через от 2 до 5 дней, предпочтительно 3 дней, после даты окончательной иммунизации.
1-3-2. Способ создания гибридомы, продуцирующей моноклональное антитело против APOA2.
(1) Выделение клеток, продуцирующих антитело, из иммунизированного животного и слияние клеток.
Клетки, продуцирующие антитело, полученные из иммунизированного животного, могут быть подвергнуты клеточному слиянию с клетками миеломы для создания гибридом, продуцирующих моноклональное антитело специфически узнающее конкретную область APOA2 белка. Примеры клеток, продуцирующих антитела, включают клетки селезенки, клетки лимфатических узлов, и клетки периферической крови. Клетки селезенки или клетки локального лимфатического узла являются предпочтительными. Общедоступная созданная линия клеток, полученных от мышей или ей подобная, может быть использована в качестве клеток миеломы для слияния с клетками, продуцирующими антитело. Клеточная линия, используемая предпочтительно, обладает лекарственной избирательностью и имеет свойство быть не способной выживать в HAT селективной среде (содержащей гипоксантин, аминоптерин, и тимидин) в не слитом состоянии и быть способной в ней расти только в слитом состоянии с клетками, продуцирующими антитело. Кроме того, созданная клеточная линия, предпочтительно происходит от животного тех же видов что и иммунизированное животное. Конкретные примеры клеток миеломы включают производные от BALB/с клеточные линии мыши, дефицитные по гипоксантин-гуанин-фосфорибозил-трансферазе (HGPRT), P3X62-Аg.8 (ATCCTIB9), P3X63-Аg.8.U1 (JCRB9085), Р3/NSI/1-Ag4-1 (JCRB0009), P3x63Ag8.653 (JCRB0028) и SP2/0-Ag14 (JCRB0029).
Для слияния клеток миеломы и клеток, продуцирующих антитело, клетки продуцирующие антитело и клетки миеломы смешивают в отношении приблизительно от 1:1 до 20:1 в бессывороточной среде для культуры клеток животных, как например, среда DMEM или среда RPMI1640, и сливают друг с другом посредством реакции в присутствии промотора слияния клеток. Например, полиэтиленгликоль, имеющий средний молекулярный вес от 1500 до 4000 Да, может быть использован в качестве промотора слияния клеток в концентрации приблизительно от 10 до 80%. Если необходимо, в комбинации с ним для повышения эффективности слияния может быть использовано вспомогательное вещество как например диметилсульфоксид. Иначе, клетки, продуцирующие антитело и клетки миеломы могут быть слиты друг с другом с помощью имеющегося в продаже аппарата для слияния, в котором применяется электрическая стимуляция (например, электропорация)
(Nature, 1977, Vol. 266, 550-552)
(2) Селекция нужной гибридомы
В методе отбора гибридом, продуцирующих нужное моноклональное антитело против белка APOA2, из клеток после проведения слияния клеток, клеточную суспензию разводят соответствующим образом, например, в среде RPMI1640, содержащей бычью фетальную сыворотку, и затем сеют в количестве примерно 2 × 106 клеток/лунку в 96-луночный планшет. Селективную среду добавляют в каждую лунку, где клетки затем культивируют в селективной среде соответственно замененную на свежую среду. Температура культивирования составляет от 20 до 40°С, предпочтительно приблизительно 37°С.
Когда клетки миеломы являются линией дефицитной по HGPRT или линией дефицитной по тимидин киназе (ТК), только гибридомам клеток, продуцирующих антитело, и клеткам миеломы может быть селективно позволено расти или размножаться при использовании селективной среды, содержащей гипоксантин, аминоптерин и тимидин (среда HAT). Таким образом, клетки, растущие от 10 дней после начала культивирования в селективной среде, могут быть выбраны в качестве гибридом.
Гибридомы, отобранные в HAT среде, с использованием в качестве критерия связывающей активности по отношению к различным вариантам APOA2 белка, описанным в SEQ ID NO: от 1 до 3, являются первично отобранными. Затем для выбора приемлемых гибридом, гибридомы, продуцирующие антитело, имеющее связывающую активность по отношению к варианту APOA2 белка, тестируют на перекрестную активность. Допустимая перекрестная активность означает перекрестную активность на пренебрежительном уровне для назначения этого антитела. Например, моноклональное антитело для использования в иммунологическом анализе может рассматриваться, как практически не имеющее перекрестной активности, когда интенсивность сигнала от перекрестной реакции в окончательной системе анализа может быть подавлена при уровне фона до менее чем 1% от интенсивности сигнала специфической реакции.
Например, твердофазный ИФА может быть использован для подтверждения специфичности реакции для конкретного варианта APOA2 белка. В этом способе твердофазного ИФА, микропланшет, в котором различные варианты APOA2 белка или их фрагменты раздельно иммобилизованы как антигены в разных лунках, приготовлен и реагирует путем добавления образцов супернатантов культур гибридом, разведенных соответствующим образом. После достаточной реакции, лунки промывают и далее подвергают реакции путем добавления меченых форм второго антитела, направленного на иммуноглобулин. Лунки промывают еще раз, и они могут быть окончательно проанализированы путем использования метки вторых антител, связанных с лунками, для количественного определения активности связывания антитела, присутствующего в супернатанте культуры, по отношению к антигенам. Например, для получения моноклонального антитела против конца белка APOA2, специфичность может быть определена с использованием в качестве критерия проявление активности связывания только по отношению к С-концевой области конкретного варианта белка APOA2 без перекрестной активности с другими вариантами APOA2 белка. Для получения моноклонального антитела не против конца APOA2 белка, антитело выбрано путем использования в качестве критерия тех же уровней связывающей активности в отношении всех APOA2 белковых вариантов, отличающихся в C конце, без ингибирования полученным антителом связывания моноклонального антитела против конца APOA2 с С-концевой областью.
Гибридомы, могут также быть выбраны с использованием техники рекомбинантной ДНК. Сначала, мРНК выделяют из группы гибридом, полученной согласно вышеупомянутому способу. Выделение мРНК может быть осуществлено путем использования способа, известного в данной области техники. Далее, кДНК получают из мРНК с использованием Oligo dT праймеров или случайных праймеров. КДНК используют в качестве матрицы в ПЦР использующей набор праймеров, включающих нуклеотидную последовательность сигнальной последовательности на входе гена, кодирующего вариабельную область, и нуклеотидную последовательность на участке постоянной области. Полученные продукты амплификации могут быть вставлены в соответствующие векторы клонирования и клонированы для получения библиотеки генов вариабельной области антител, производимых гибридомами. В качестве более конкретного не лимитирующего примера, ПЦР проводят, используя Мышиные Ig Праймеры, предоставляемые Novagen/Merk KGaA, и продукты амплификации (кДНК переменной области иммуноглобулина мыши) вставляют в EcoRI сайты ZERO BLUNT PCR TOPO векторов, предоставляемых Invitrogen Corp. и клонируют. Полученная группа векторов может быть использована в качестве библиотеки генов, кодирующих аминокислотные последовательности переменной области. Далее, конструируется зонд на основе аминокислотной последовательности каждой вариабельной области или каждого CDR, раскрытых в настоящем изобретении. Библиотека может быть скринирована на позитивные клоны для выбора гибридом, продуцирующих антитела настоящего изобретения.
(3) Производство антител с использованием гибридомы
Гибридомы, согласно настоящему изобретению, могут быть использованы в производстве антител, путем формирования асцитов с помощью мыши. Как правило, гибридомы инокулируют внутрибрюшинно в мышь, являющуюся источником клеток партнеров слияния, используемых для создания гибридом или в «голую» мышь. Асциты могут быть надлежащим образом собраны, чтобы выделить асцитную жидкость, содержащую антитело. Точнее, гибридомы, полученные с помощью SP2/0 клеток как партнера слияния, инокулируют внутрибрюшинно в BALB/C мышь по истечении 10 дней после инокуляции пристина, и асцитная жидкость, содержащая антитело может быть собрана.
Гибридомы, согласно настоящему изобретению, могут быть использованы в производстве антител путем культивирования с использованием подходящей среды. В частности, гибридомы могут быть инокулированы в концентрации 1 x 105 клеток/мл в Hibridoma-SFM среду производства Gibco/Thermo Fissher Scientific Inc. и культивированы в 5% CO2 инкубаторе при 37°С до тех пор пока гибридомы не будут убиты, чтобы получить супернатант культуры, содержащей антитело, хотя согласно настоящему изобретению способ производства антитела не ограничивается этим.
(4) Способ получения рекомбинантного моноклонального антитела против APOA2 или его фрагмента путем манипуляции с рекомбинантной ДНК.
Антитело настоящего изобретения или его фрагмент может также быть получено путем манипуляции с рекомбинантной ДНК с использованием кДНК последовательности, кодирующей аминокислотную последовательность антитела.
Используют нуклеотидные последовательности, кодирующие аминокислотные последовательности вариабельных областей антитела, проиходящего от гибридомы, продуцирующей моноклональное антитело против APOA2, например, гибридомы продуцирующей моноклональное антитело против белка APOA2, полученной с помощью подхода, описанного в пункте "1-3-2(2)". Эти нуклеотидные последовательности VH и VL соединяют с нуклеотидными последовательностями, кодирующими произвольные СН и CL, соответственно, и полученные полинуклеотиды могут быть включены в соответствующие экспрессионные векторы, которые затем вводят в клетки хозяина, с последующей экспрессией в виде полной молекулы иммуноглобулина. Кроме того, согласно технологии CDR прививки антител, полинуклеотиды, кодирующие аминокислотные последовательности CDR последовательностей в аминокислотных последовательностях вариабельных областей, полученные подходом, описанным в пункте "1-3-2(2)", могут быть включены в соответствующие экспрессионные векторы, которые затем вводят в клетки хозяина, с последующей экспрессией полной молекулы иммуноглобулина. В этом отношении удобен такой подход, в котором тяжелая цепь и легкая цепь, предназначенные для образования пары, могли быть экспрессированы в одной и той же клетке хозяина и получены как димер тяжелой/легкой цепи. В частности, каждую клетку трансформируют одновременно, например, вектором экспрессии легкой цепи и вектором экспрессии тяжелой цепи, и антитела, согласно настоящему изобретению, могут также быть получены из этой трансформированной клетки. Альтернативно, полинуклеотиды, кодирующие аминокислотные последовательности, описанные выше, могут быть включены непосредственно в соответствующие экспрессионные векторы, которые затем вводят в клетки хозяина, с последующей экспрессией в качестве фрагментов молекулы иммуноглобулина. Кроме того, как упоминалось выше, полинуклеотиды, соответственно кодирующие VL и VH или легкую цепь и тяжелую цепь, включающие аминокислотные последовательности, могут быть соединены через нуклеотидную последовательность, кодирующую соответствующий линкер, затем введены в фаги и экспрессированы в виде одноцепочечного Fv или в виде синтетического фрагмента антитела, как например диатела. Кроме того, в соответствии с недавно разработанным методом фагового дисплея антител (Brinkmann et al., 1995, J. Immunol Methods, 182, 41-50; и международной публикации под № WO97/13844 и WO90-02809), который включает экспрессию рекомбинантных антител на поверхности фага, используя генно-инженерный метод, одноцепочечные антитела Fv диверсифицированные путем искусственной перетасовки генов, кодирующих тяжелые и легкие цепи, могут быть экспрессированы в качестве слитых с фагом белков для получения специфических антител.
Способы создания полинуклеотида, кодирующего рекомбинантное антитело не против APOA2 или его фрагмент, создания векторов, несущих полинуклеотид, и введения векторов в хозяина, могут быть реализованы путем использования техники рекомбинантной ДНК известной в данной области. Соответствующее рекомбинантное антитело против APOA2 белок или его фрагмент могут быть получены из раствора культуры трансформированных клеток или из внутренности клеток.
В качестве векторов экспрессии иммуноглобулина могут быть использованы, например, плазмиды, фагмиды, космиды, или вирусные векторы (например, SV40, основанный на вирусе вектор, EB, основанный на вирусе вектор, и BPV, основанный на вирусе вектор), хотя векторы не лимитируются этим. Например, вектор BCMGS Nео, который основан на BPV векторе, является желательным вектором для эффективной экспрессии чужеродного гена путем трансформации клеток COS7 или ему подобного (Hajime Karasuyama, "Bovine papilloma virus vector", Masami Muramatsu and Hiroto Okayama, ed., Experimental Medicine, Suppl.: Handbook of Gene Engineering, 1991, Yodosha Co., Ltd., 297-299).
В дополнение к полинуклеотиду, кодирующему антитело или его фрагмент, векторы могут содержать управляющие элементы (например, промотор, энхансер, терминатор, сайт полиаденилирования, и сайт сплайсинга), или если требуется селективный маркер, необходимые для экспрессии антитела или его фрагмента.
Хозяева, описанные в пункте "1-2. Получение иммуногена", а также SP2/0 клетки (миелома мыши) (European Journal of Cancer Research Prevention (1996) Vol. 5, 512-519; and Cancer Research (1990) Vol. 50, 1495-1502) предпочтительно используются в качестве хозяев для трансформации.
Согласно настоящему изобретению клетки хозяина, содержащие вектора для экспрессии антигена, или его фрагментов, могут быть культивированы в соответствии с общепринятым способом таким образом, что антитело образуется в супернатанте культуры клеток хозяина. В частности, когда хозяинами являются CHO клетки, клетки хозяина могут быть засеяны в среду DMEM , выпускаемую компанией Gibco/Thermo Fisher Inc., в концентрации 105 клеток/мл и культивированы в 5% CO2 инкубаторе при 37°С для получения супернатанта культуры содержащей антитело. Когда клетками хозяина являются, например, клетки E. Coli, клетки хозяина могут быть засеяны в обычную среду для использования культуры E. coli, такую как LB среду, и культивированы для индукции экспрессии белка для получения антитела в надосадочной жидкости культуры или клетках хозяина.
Продукт экспрессии антитело или его фрагмент, содержащий константные области, может быть очищен и выделен из надосадочной жидкости культуры или клеточных лизатов с использованием колонки с протеином А, колонки с протеином G, аффинной колонки с анти-иммуноглобулиновым антителом, или им подобных. Напротив, этот способ очистки не может быть применен к продукту экспрессии, состоящему из вариабельной области, не содержащей постоянные области. Поэтому к нему применяют другие надлежащие способы очистки. Антитело или его фрагмент могут быть экспрессированы в виде C-концевой структуры слитой, например, с последовательностью метки, подходящей для очистки, как например гистидиновая метка, и таким образом очищены с помощью аффинной хроматографии с использованием соответствующего лиганда. не будучи белком слитым с меткой, такое антитело или его фрагмент может быть очищено согласно общепринятому способу очистки белка, как например осаждение сульфатом аммония, ионообменная хроматография, хроматография обращенной фазы, гель-фильтрационная хроматография, или гидроксиапатитная хроматография.
Для того чтобы подтвердить специфичность для конкретного варианта белка APOA2 или его фрагмента, моноклональное антитело или его фрагмент, используемые в настоящем изобретении, прежде чем использовать, предпочтительно тестируют на перекрестную активность с другими вариантами, как упоминалось выше. Антигенами, для которых перекрестная активность с, например, моноклональным антителом против конца APOA2-АТQ настоящего изобретения или его фрагментом должна быть подтверждена, являются белок APOA2-АТ и белок APOA2-А.
Более предпочтительным является подтвердить перекрестную активность антитела или его фрагмента, используемых в настоящем изобретении, с белками, описанные выше, а также с другими белками, имеющими общую частичную структуру с вариантами APOA2 белка. Твердофазный ИФА с, например, белком APOA2-АТQ в качестве антигена может быть использован для подтверждения перекрестной реакции. Антитело, предназначенное для тестирования на специфичность реакции, т.е. антитело против конца белка APOA2 или его фрагмент, взаимодействует с вариантом белка APOA2 в присутствии других белковых антигенов, для которых перекрестная активность должна быть подтверждена. Перекрестная активность может быть подтверждена путем наблюдения за конкуренцией между вариантом APOA2 белка и белковыми антигенами. Такой способ подтверждения перекрестной активности через использование принципов конкурентного ингибирования устраняет необходимость подготовки реакционных систем для всех антигенов и, следовательно, позволяет быстрый скрининг.
1-3-3. Структурное подтверждение области в APOA2 белке распознаваемой полученным моноклональным антителом против конца белка APOA2.
Тип варианта APOA2 белка, специфически распознаваемого полученным моноклональным антителом против APOA2, может быть определен путем создания генов различных вариантов APOA2 белка с помощью ПЦР-реакции или ей подобной на основе гена белка APOA2, и анализа связывающей активности моноклонального антитела с различными варианты APOA2 белка, полученными из генов.
В случае моноклонального антитела против APOA2, такой способ конкретно осуществляется следующим образом: во-первых, готовят полноразмерный APOA2 ген или фрагменты разной длины с отсутствием 6 или 9 оснований, включая стоп-кодон гена APOA2 из стоп-кодона в направлении 5' конца, и составляют экспрессионные векторы, имеющие вставки этих фрагментов. Такой способ создания генных фрагментов, имеющих делеционные мутации, описан в "Zoku-Seikagaku Jikken Koza 1, Idenshi Kenkyuho II ((Experiments in Biochemistry, second series, Methods in Gene research in English), p. 289-305, The Japanese Biochemical Society ed"). Далее, различные варианты APOA2 белка готовят по вышеупомянутому методу из клеток хозяина, содержащих соответствующие экспрессионные вектора варианта белка APOA2. Затем оценивают связывающую активность моноклонального антитела против APOA2 против различных вариантов белка APOA2 методом твердофазного ИФА с использованием этих белков в качестве антигенов. Моноклональное антитело можно определить как моноклональное антитело против конца белка APOA2, специфически связывающееся с конкретным вариантом APOA2 белка, когда моноклональное антитело проявляет активность связывания только по отношению к конкретному варианту и не проявляет или почти не проявляет активность связывания по отношению к другим вариантам.
Вариант APOA2 белка, распознаваемый полученным моноклональным антителом против конца белка APOA2, может быть также подтвержден способом, как описано ниже.
Сначала, пептиды, имеющие последовательности С-концевых областей различных вариантов APOA2 белка, каждый синтезируют на твердой фазе способом, известным в данной области техники. Далее активность связывания моноклонального антитела против конца белка APOA2 по отношению к различным пептидам оценивают методом твердофазного ИФА с использованием этих пептидов в качестве антигенов. Моноклональное антитело против белка APOA2 может быть определено как моноклональное антитело против конца белка APOA2, специфически связывающееся с конкретным вариантом APOA2 белка, когда обнаружено, что моноклональное антитело имеет активность связывания только по отношению к пептиду, имеющему последовательность определенной С-концевой области.
1-4. Получение поликлонального антитела против APOA2.
Поликлональное антитело против APOA2 может быть получено способом, известным в данной области техники. Далее, способ получения антитела против конца белка APOA2, специфически связывающегося с конкретным вариантом APOA2 белка, будет конкретно приведен в качестве примера.
1-4-1. Получение антисыворотки
В целях получения поликлонального антитела против конца белка APOA2, во-первых, С-концевой фрагмент, имеющий длину по крайней мере 6 или более аминокислот в определенном варианте APOA2 белковой последовательности, например, пептид, приведенный в SEQ ID NO: 28 или 29, растворяют в буферном растворе, чтобы приготовить раствор иммуногена. Для эффективной иммунизации к нему, если это необходимо, может быть добавлен адъювант. Примеры адъювантов включают коммерчески доступные полный адъювант Фрейнда (FCA) и неполный адъювантом Фрейнда (FIA). Эти адъюванты могут быть использованы по отдельности или в виде смеси.
Далее, млекопитающее например крысу, мышь (например «голая» мышь BALB/c) или кролика иммунизируют введением приготовленного раствора иммуногена. Одна доза раствора иммуногена определяется подходящим образом в соответствии с типом животного предназначенного для иммунизации, пути иммунизации и т.д. и может включать приблизительно от 50 до 200 мкг иммуногена на животное. Примеры способов введения раствора иммуногена включают, но не лимитируются, подкожное введение использованием FIA или FCA, внутрибрюшинное введение с использованием FIA и внутривенное введение с использованием 150 мМ хлорида натрия. Интервалы между уколами иммунизации особенным образом не лимитированы. После сенсибилизации от 2 до 10, предпочтительно от 3 до 4, проводят бустеры с интервалами от нескольких дней до нескольких недель, предпочтительно с интервалами от 1 до 4 недель. После сенсибилизации, титр антитела в сыворотке иммунизированного животного неоднократно измеряют методом твердофазного ИФА (твердофазный иммуноферментный анализ) или ему подобным. При условии, что наблюдается достаточное повышение титра антител, раствор иммуногена вводят внутривенно или внутрибрюшинно для окончательной иммунизации. Антисыворотка, содержащая поликлональное антитело, узнающие APOA2 белок может быть получена из крови животных, иммунизированных таким образом.
1-4-2. Очистка антитела против APOA2.
(1) Подготовка колонки с иммобилизованным пептидом
Аффинные колонки готовят путем соответствующей иммобилизацией пептида C-концевой области APOA2 белка и пептида C-концевой области APOA2 белка с добавленной к С-концу амидной группой. Подробный способ описан в "Experimental Protocol for Anti-Peptide Antibodies", the 2nd edition, Gakken Medical Shujunsha Co., Ltd. Например, формил-целлюлофин или CNBr агарозные носители имеющие функциональные группы, способные связывать аминогруппы пептидов, или носители, способные связываться с остатки цистеина в пептидной последовательности через малеимидные группы, ковалентно связанные с носителями, могут быть использованы в качестве носителей для использования в аффинных колонках. Длина пептида для иммобилизации составляет 6 или более аминокислот, предпочтительно 10 или более аминокислот, более предпочтительно 18 или более аминокислот, еще более предпочтительно 30 или более аминокислот, включая С-конец APOA2 белка.
(2) Очистка антител
Поликлональное антитело против конца белка APOA2 может быть очищено из антисыворотки с использованием аффинных колонок с иммобилизованным пептидом. Например, антисыворотку разбавляют подходящим буферным раствором. IgG антитела, содержащиеся в антисыворотке адсорбируют на аффинной колонке с иммобилизованным пептидом C-концевой области APOA2 белка и эту адсорбированную фракцию выделяют. Далее, иммуноглобулины, проявляющие активность связывания по отношению к области, отличной от С-концевой области пептида, удаляют путем адсорбции с помощью аффинной колонки с иммобилизованным пептидом амидированного C-конца APOA2 белка. Наконец, полученную не адсорбированную фракцию, получают как поликлональное антитело против конца белка APOA2 специфически распознающее конкретный вариант APOA2 белка.
2. Способ выявления опухоли поджелудочной железы
Второй аспект настоящего изобретения относится к способу выявления опухоли поджелудочной железы, т.е. рака поджелудочной железы или доброкачественной опухоли поджелудочной железы, in vitro. Способ настоящего изобретения основан на обнаружении, что количества обоих или одного из двух вариантов APOA2 белка, т.е. APOA2-ATQ белка и APOA2-AT белка, в крови значительно снижено у пациентов с опухолью поджелудочной железы по сравнению с нормальными людьми. Особенностью этого способа является определение двух вариантов APOA2 белка с помощью антител, специфически распознающих С-концевые области вариантов APOA2 белка (антитела против конца белка APOA2) или их фрагменты и антител против белка APOA2, распознающих аминокислотные последовательности областей, отличных от С-концевых областей (не против конца белка APOA2) или их фрагменты. Еще одной особенностью способа для выявления опухоли поджелудочной железы является многофакторный анализ с использованием значений измерений двух проанализированных вариантов APOA2 белка.
Способ настоящего изобретения включает этап анализа маркеров для выявления опухоли поджелудочной железы и этап определения поражения. Далее, каждый этап будет подробно описан.
2-1. Этап анализа маркеров для выявления опухоли поджелудочной железы
"Этап анализа маркеров для выявления опухолей поджелудочной железы" является этапом измерения in vitro количества маркеров для выявления опухоли поджелудочной железы, т.е. двух вариантов APOA2 белка (APOA2-ATQ белка и APOA2-АТ белка), присутствующих в жидкости организма, полученной от испытуемого субъекта.
В настоящем описании, "испытуемый субъект" относится к индивидууму, который является субъектом, подлежащим выявлению опухоли поджелудочной железы, желательно индивидууму с подозрением на опухоль поджелудочной железы. В этом контексте, примеры индивидуума включают позвоночных. Индивидуум является предпочтительно млекопитающим, например, приматом (человек, обезьян, шимпанзе, орангутанг, горилла и др.), грызуном (мышь, крыса, морская свинка и др.), или копытным животным (крупный рогатый скот, лошадь, овца, коза и др.), более предпочтительно человек. В настоящем описании, когда испытуемый объект является человеком, этот испытуемый субъект в частности именуется ниже "человеческий испытуемый субъект".
В настоящем описании, "жидкость организма" - это образец, который подвергается выявлению опухоли поджелудочной железы, и означает биологическую жидкость. Жидкость организма особо не ограничена, пока жидкость организма является биологической жидкостью, возможно, содержащей маркеры для выявления опухоли поджелудочной железы, настоящего изобретения. Жидкость организма включает, например, кровь, мочу, супернатанты культуры лимфоцитов, спинномозговую жидкость, пищеварительный сок (в том числе, например, сок поджелудочной железы, сок толстой кишки, секреты желез пищевода, и слюну), пот, асциты, насморк, слезу, вагинальную жидкость и сперму. Кровь или моча являются предпочтительными. В настоящем описании, "кровь" включает в себя цельную кровь, плазму и сыворотку. Цельная кровь не ограничивается ее типом и может быть, например, венозной кровью, артериальной кровью или пуповинная кровью. Жидкость организма может быть комбинацией двух или более различных жидкостей организма, полученных от одного индивидуума. Способ выявления опухоли поджелудочной железы по настоящему изобретению позволяет выявление даже из слабо инвазивных крови или мочи и является поэтому очень полезным как удобный метод обнаружения.
"Жидкость организма, полученная от испытуемого субъекта" относится к жидкости организма уже полученной от испытуемого субъекта, и акт сбора жидкости организма не входит в рамки настоящего изобретения. Жидкость организма, полученная от испытуемого субъекта, может быть подвергнута действию способа настоящего изобретения сразу же после того, как взята у испытуемого субъекта. Кроме того, жидкость организма, полученная от испытуемого субъекта, может быть охлаждена или заморожена сразу после сбора или после соответствующей обработки и доведена до комнатной температуры, прежде чем подвергнуться действию способа настоящего изобретения. Соответствующая обработка перед охлаждением или заморозкой включает, например, обработку цельной крови антикоагулянтом с добавлением гепарина или тому подобное, с последующим отделением или плазмы или сыворотки. Такая обработка может быть проведена на основе метода, известного в данной области техники.
В настоящем описании "количества вариантов APOA2 белка" означает соответствующие количества двух вариантов APOA2 белка, присутствующих в жидкости организма, полученной от испытуемого субъекта. Количества могут быть любые в абсолютных и относительных величинах. Абсолютные величины относятся к массам или объемам двух вариантов APOA2 белка, содержащихся в заданном количестве жидкости организма. Относительные величины относятся, например, к относительным значениям измерения двух APOA2 белковых вариантов, полученным от испытуемого субъекта по отношению к значениям измерения применяемых стандартов. Примеры относительных значений включают концентрации, интенсивность флуоресценции и абсорбцию.
APOA2 белка могут быть измерены in vitro с помощью способа, известного в данной области техники. Примеры таковых включают способ измерения с использованием веществ, способных специфически связываться с двумя вариантами APOA2 белка, соответственно.
В настоящем описании, выражение "способный специфически связываться" означает, что определенное вещество может существенно связаться только с конкретным вариантом APOA2 белка как целью настоящего изобретения. В данном случае, наличие неспецифического связывания приемлемо, без влияния на обнаружение конкретного варианта APOA2 белка.
Примеры "веществ, способных специфически связываться" включают APOA2-связывающие белки. Более конкретно, веществами, способными специфически связываться, являются, например, "антитела против конца белка APOA2", узнающие различие в структуре С-концевой области и связывающиеся с вариантами APOA2 белка как их соответствующими антигенами, предпочтительно "антитела против конца человеческого белка APOA2", каждое распознающее и связывающееся только с одним из вариантов белка APOA2, когда варианты APOA2 белка человека, включающие аминокислотную последовательность, представленную в SEQ ID NO: 1, 2 или 3, используют в качестве антигенов, или фрагменты антител этих антител. Кроме того, могут быть использованы их химически модифицированные производные. В этом контексте "химически модифицированные производные" также включают, например, антитела против конца белка APOA2) или функционально модифицированные фрагменты этих антител, если требуется для получения или сохранения специфической активности по отношению к конкретному варианту APOA2 белка, или антитела против конца белка APOA2 или фрагменты антител, модифицированные метками необходимыми для детекции.
Примеры функциональной модификации включают гликозилирование, дегликозилирование, и ПЭГилирование. Примеры модификации с метками включают мечение флуоресцентными красителями (ФИТЦ, родамин, Техасский Красный, Cy3, и Су5), флуоресцентными белками (например, PE, APC, GFP и EGFP), ферментами (например, пероксидаза хрена, щелочная фосфатаза, и глюкозооксидаза), биотином, авидином или стрептавидином.
Антитела для использования в анализе вариантов APOA2 белка могут быть любыми поликлональными и моноклональными антителами. Моноклональные антитела являются предпочтительными для достижения специфичной детекции. Например, поликлональное антитело против конца белка APOA2, специфически связывающееся с концом APOA2 белка может быть получено упомянутым выше способом.
Два варианта белка APOA2 могут быть проанализированы с помощью иммунологического метода, используя антитела против белка APOA2, каждое из которых связывается только с определенным вариантом APOA2 белка. Иммунологический метод может быть любым методом, использующим антитела против белка APOA2 и является предпочтительно твердофазным ИФА с использованием антител против конца белка APOA2 в качестве иммобилизованных антител или меченых антител, которые комбинируют с другим антителом связывающимся с областью отличной от С-конца APOA2 белка (не против конца белка APOA2). Например, количество APOA2-АТQ белка может быть измерено с помощью сэндвич твердофазного ИФА с использованием антитела против конца белка APOA2-ATQ в качестве меченого антитела и с использованием антитела не против конца белка APOA2-ATQ в качестве иммобилизованного антитела. APOA2-AT белок может быть измерен с помощью сэндвич твердофазного ИФА с использованием антитела против конца белка APOA2-AT в качестве иммобилизованного антитела и с использованием антитела не против конца белка APOA2-AT в качестве меченого антитела. Антитело не против конца белка APOA2 коммерчески доступно от Abcam plc, Fitzerald Industries International, или тому подобное, и такой коммерчески доступный продукт может быть использован.
2-2 Этап определения предрасположенности
«Этап определения предрасположенности» - это этап определения (или оценки) in vitro, на основании количества белков, измеренных на этапе анализа маркеров для выявления опухоли поджелудочной железы, будет ли иметь место рак поджелудочной железы или доброкачественная опухоль поджелудочной железы. Количества проанализированных маркеров для выявления опухоли поджелудочной железы, т.е. вариантов APOA2 белка (количества APOA2-ATQ белка и APOA2-AT белка), в образце жидкости организма испытуемого субъекта измеряют для выявления опухоли поджелудочной железы, чтобы определить, имеет ли место или нет опухоль поджелудочной железы, или оценить возможность появления опухоли поджелудочной железы. Этот этап включает в себя 3 этапа (от первого до третьего этапа). Далее, каждый этап будет подробно описан.
На первом этапе количество APOA2-ATQ белка в образце жидкости организма испытуемого субъекта измеряют с использованием антитела против конца белка APOA2-ATQ, специфически связывающегося с C-концевой областью APOA2-ATQ белка, включающей аминокислотную последовательность, представленную в SEQ ID NO: 1, и антитела не против конца белка APOA2-ATQ, связывающегося с аминокислотной последовательностью отличной от C-концевой области.
Затем, на втором этапе, количество APOA2-AT белка измеряют с применением антитела против конца белка APOA2-AT, специфически связывающегося с C-концевой областью APOA2-АТ белка, включающей аминокислотную последовательность, представленную в SEQ ID NO: 2, и антитела не против конца белка APOA2-ATQ связывающийся с аминокислотной последовательностью отличной от C-концевой области. В этом контексте желательно, чтобы каждая из С-концевых областей APOA2-ATQ белка и APOA2-АТ белка состояла из последовательности, включающей 6 или более последовательных аминокислот, включая С-конец. Количества вариантов APOA2 белка может быть измерено, например, методом твердофазного ИФА, хотя способ измерения в соответствии с настоящим изобретением этим не ограничивается. Антитело не против конца белка APOA2-ATQ, используемое вместе с антителом против конца белка APOA2-ATQ на первом этапе могут быть идентичными так же как антитело против конца белка APOA2 антителу против конца белка APOA2-AT, используемому вместе с антителом против конца белка APOA2-AT на втором этапе. Коротко, антитело против конца белка APOA2 может быть также использовано на первом этапе, в то время как антитело не против конца белка APOA2-ATQ может также быть использовано на втором этапе.
На третьем этапе значение измерения количества APOA2-ATQ белка, полученное на первом этапе, и значение измерения количества APOA2-АТ белка, полученное на втором этапе, вводят в заданный дискриминант для определения значения дискриминанта тестируемого субъекта. Заключают, что тестируемый субъект имеет опухоль поджелудочной железы, если значение этого дискриминанта статистически достоверно отличается по сравнению со значением дискриминанта нормального субъекта. В этом контексте используемый дискриминант может быть установлен способом упомянутым позже.
Кроме того, даже без определения значения дискриминанта, у испытуемого человека может быть беспрепятственно установлено наличие опухоли поджелудочной железы, когда количество либо APOA2-ATQ белка или APOA2-AT белка в образце, полученном от испытуемого человека, значительно отличается от их количества в образце, взятом у нормального человека, а именно, значительно ниже, чем это количество.
Способ для выявления опухоли поджелудочной железы по настоящему изобретению может дополнительно содержать четвертый этап, если на третьем этапе установлено, что тестируемый субъект имеет опухоль поджелудочной железы. На четвертом этапе, количество известного маркера рака поджелудочной железы в образце жидкости организма данного испытуемого субъекта может быть измерено, для того чтобы различительно определить имеет ли тестируемый субъект рак поджелудочной железы или доброкачественную опухоль поджелудочной железы. В этом способе маркер, известный как способный выявлять рак поджелудочной железы, но не способный выявлять доброкачественную опухоль поджелудочной железы, используют в качестве известного маркера рака поджелудочной железы. В частности, могут быть использованы Sialyl-Lewis A антиген "СА19-9" (углеводный антиген 19-9) или муцин-подобный гликопротеин "DU-PAN-2" (антиген-2 ассоциированный с раком поджелудочной железы) (LAB DATA: test selection and interpretation 2013-2014, supervised by Fumimaro Takaku, Igaku Shoin Ltd., p. 636-638). Референсное значение для дискриминирования рака поджелудочной железы равно 37 (ед/мл) для СА19-9 и 150 (ед/мл) для DU-PAN-2. Количество СА19-9 или DU-PAN-2 может быть измерено, например, методом твердофазного ИФА, хотя способ измерения в соответствии с настоящим изобретением этим не ограничивается.
Определение рака поджелудочной железы или доброкачественной опухоли поджелудочной железы на четвертом этапе может быть конкретно осуществлено следующим образом: сначала измеряют количество СА19-9 или DU-PAN-2 в образце жидкости организма испытуемого человека. Далее может быть определено, что испытуемый субъект имеет рак поджелудочной железы, если значение измерения количества СА19-9 или DU-PAN-2 превышает соответствующее референсное значение для дискриминирования рака поджелудочной железы. Кроме того, может быть установлено, что испытуемый субъект имеет доброкачественную опухоль поджелудочной железы, когда значение измерения равно или ниже референсного значения. Это основано на том факте, что способ настоящего изобретения для измерения количества вариантов APOA2 белка обеспечивает выявление доброкачественной опухоли поджелудочной железы, что ранее было недостижимо.
Способ для выявления опухоли поджелудочной железы в соответствии с настоящем изобретением может также быть использован в сочетании с дополнительным вариантом APOA2 белка, как например APOA2-А белок, или общим количеством APOA2 белков. Такой вариант осуществления изобретения также включен в объем настоящего изобретения.
"Нормальный субъект" означает индивидуум, не имеющий по крайней мере опухоли поджелудочной железы, желательно здоровому индивидууму. Также требуется, чтобы нормальный субъект, был тем же видом организма, что и испытуемый субъект. Когда испытуемый для выявления субъект, является например, человеком (испытуемый человек), нормальный субъект должен также быть человеком (в настоящем описании, именуется ниже "нормальный человек"). Физическое состояние нормального субъекта является предпочтительно таким же или похожим на физическое состояние испытуемого субъекта. К физическому состоянию относится, например, раса, пол, возраст, рост и вес для человека.
Концентрации маркеров для выявления опухоли поджелудочной железы в жидкости организма нормального субъекта предпочтительно измеряют так же, как способом измерения концентраций маркеров для выявления опухоли поджелудочной железы в жидкости организма испытуемого субъекта, описанный в этапе анализа маркеров для выявления опухоли поджелудочной железы. Концентрации маркеров для выявления опухоли поджелудочной железы в жидкости организма нормального субъекта могут быть измерены каждый раз, когда измеряют концентрации маркеров для выявления опухоли поджелудочной железы в жидкости организма испытуемого субъекта. Альтернативно, для выявления опухоли поджелудочной железы могут быть также использованы концентрации маркеров измеренные заранее. В частности, концентрации маркеров для выявления опухоли поджелудочной железы измеряют заранее при различных физических состояниях нормальных субъектов. Значения вводят в компьютер и заносят в базы данных. Этот подход удобен тем, что концентрации маркеров для выявления опухоли поджелудочной железы нормального субъекта, имеющего оптимальное физическое состояние, для сравнения с тестируемым субъектом могут быть использованы сразу путем простого ввода физического состояния испытуемого субъекта в компьютер.
В настоящем описании, конкретные примеры выражения "статистически значимо", например, когда полученная величина имеет небольшое критическое значение (уровень значимости), включают р < 0,05, р < 0,01 или р < 0,001. В этом контексте, термин "p" или "значение р" представляет вероятность, что статистическая гипотеза верна по методу случайного выбора в гипотетическом распределении статистик в статистических анализах. Таким образом, меньше "p" или " значения р" означает, что гипотеза ближе к истине. Фраза "статистически значимо отличается" означает, что существует значительная разница в статистической обработке отличительных количеств маркеров для выявления опухоли поджелудочной железы, полученных от испытуемого субъекта и нормального субъекта, или отличительных значений дискриминантов, полученных путем ввода количеств в дискриминант. Испытуемый субъект определяют как имеющий опухоль поджелудочной железы, когда он статистически достоверно отличается по сравнению с нормальным субъектом. Способ исследования, известный в данной области техники, способный определить наличие или отсутствие значимости, может быть соответствующим образом использован в качестве способа исследования для статистической обработки без конкретных ограничений. Например, может быть использован t-критерий Стьюдента или способ критерия множественных сравнений.
В настоящем описании, "дискриминант" - это конечный продукт многовариантного анализа и характеризуется одним или более наборами значений. Значение дискриминанта в конечном итоге рассчитывают согласно этому дискриминанту. В настоящем описании, "многовариантный анализ" - это математический подход, который используют для построения дискриминанта путем использования измеренных значений маркеров для выявления опухоли поджелудочной железы. В настоящем описании "набор значений" означает комбинации значений, в качестве характерных особенностей маркеров для выявления опухоли поджелудочной железы, или диапазону этих значений. Этот набор значений и свойства значений в наборе зависят от типа характерных особенностей, присутствующих в маркерах для выявления опухоли поджелудочной железы, и многовариантного анализа, который используют для построения дискриминанта, определяющего набор значений.
В настоящем описании, "значение дискриминанта" - это значение, которое может быть использовано в качестве критерия для предсказания, что интересующий субъект может иметь опухоль поджелудочной железы. В качестве конкретного примера, по значению дискриминанта может быть предсказано, что рассматриваемый субъект имеет опухоль поджелудочной железы. В качестве другого примера, по значению дискриминанта может быть предсказано что рассматриваемый субъект не имеет опухоли поджелудочной железы.
Дискриминант может быть построен путем многофакторного анализа с использованием алгоритма анализа данных. Примеры алгоритма анализа данных, который может быть использован в построении дискриминанта, включают обобщенные линейные модели, включая логистический регрессионный анализ, нейронные сети, метод опорных векторов (SVM), дискриминантный анализ, непараметрические подходы, PLS (частных наименьших квадратов), дерево принятия решений, метод главных компонент, обобщенные аддитивные модели, нечеткая логика, СОМ (самоорганизующиеся карты), и генетический алгоритм. Среди них, логистический регрессионный анализ, нейронные сети, SVM, или дискриминантный анализ могут быть предпочтительно использованы, хотя алгоритма анализа данных, согласно настоящему изобретению, не ограничиваются ими. Подробности этих статистических методов находятся в следующих источниках: Ruczinski, I. et al., 2003, Journal of Computational and Graphical Statistics, Vol. 12, p. 475-511; Friedman, J., Journal of the American Statistical Association, 1989, Vol. 84, p. 165-175; Hastie, T. et al., 2001, The Elements of Statistical Learning, Springer Series in Statistics; Breiman, L., 1984, Classification and regression trees, Chapman and Hall: Breiman, L., 2001, Machine Learning, Vol. 45, p. 5-32; Pepe, M., 2003, The Statistical Evaluation of Medical Tests for Classification and Prediction, Oxford Statistical Science Series; and Duda, R. et al., 2000, Pattern Classification, Wiley Interscience, the 2nd edition.
В настоящем изобретении, анализ, использующий дискриминант, проводят следующими этапами: во-первых, событие, которое должно быть дискриминировано устанавливают как объективную переменную. "Объективная переменная" - это событие, которое предназначено для дискриминировании в соответствии с дискриминантом. В настоящем изобретении, объективная переменная означает, имеет или нет испытуемый человек опухоль поджелудочной железы. В случае, когда событием, предназначенным дискриминированию путем, например, логистического регрессионного анализа, является имеет или нет испытуемый человек опухоль поджелудочной железы, объективная переменная может быть установлена на"1", когда испытуемый человек является пациентом с опухолью поджелудочной железы , и на "0", когда испытуемый человек является нормальным человеком. Далее устанавливают независимые переменные для прогнозирования объективных переменных. "Независимые переменные" являются переменными, используемыми для предсказания объективной переменной в соответствии с дискриминантом. В случае, например, логистического регрессионного анализа, измеренные значения маркеров для выявления опухоли поджелудочной железы, т.е. APOA2-АТQ белка и APOA2-AT белка, могут быть установлены в качестве независимых переменных. Далее строят дискриминант, включающий вместе независимые переменные, путем использования любых данных аналитического алгоритма, описанного выше, и вычисляют значение дискриминанта. На основе полученного значения дискриминанта предсказывают событие, предназначенное для дискриминирования. В случае, например, логистического регрессионного анализа, по значению дискриминанта может быть предсказано, что испытуемый человечек является пациентом с опухолью поджелудочной железы (т.е. "1") или нормальным человеком (т.е. "0"). Наконец, результаты предсказания события сравнивают со значением объективной переменной для оценки выполнения дискриминирования дискриминантом. В этом контексте "выполнение дискриминирования " означает критерий, указывающий, в какой степени предсказание события предназначенного для дискриминирования может быть точным. Результаты дискриминирования (чувствительность и специфичность) или AUC значения рассматриваемых данных могут быть использованы как выполнение дискриминирования. Значение дискриминанта, полученное из дискриминанта, предпочтительно используют в качестве эталона для определения, имеется или нет опухоль поджелудочной железы или для оценки возможности наличия опухоли поджелудочной железы.
В настоящем описании, " значение AUC (область под кривой)" означает область под рабочей характеристической кривой (ROC-кривой) и служит критерием для измерения точности предсказания, определения, обнаружения, или диагностического способа для определения пациентов в позитивную группу и негативную группу. На этой кривой, значение (ложноположительная величина), определенное путем вычитания вероятности получения положительных результатов для положительных пациентов (чувствительность) и вероятности получения отрицательных результатов для отрицательных пациентов (специфичность) из 1, нанесено на график как результаты, полученные с помощью способа подлежащего оценки.
В настоящем описании "чувствительность" означает значение: (количество истинных положительных результатов) / (количество истинно положительных + количество ложно-отрицательных результатов). Более высокая чувствительность позволяет раннее выявление рака поджелудочной железы или обнаружение доброкачественной опухоли поджелудочной железы и приводит к полной резекции опухоли или снижению частоты рецидивов.
В настоящем описании, "специфичность" означает значение: (количество истинно отрицательных результатов) / (количество истинно отрицательных результатов + количество ложно-положительных результатов). Более высокая специфичность предотвращает ненужные дополнительные обследования, отнесенные к неправильной классификации нормальных испытуемых к пациентам больным раком поджелудочной железы в начальной стадии или пациентам с доброкачественной опухолью поджелудочной железы, и приводит к сокращению нагрузки на пациента или сокращению медицинских затрат.
Далее будет конкретно описан способ анализа, имеет или нет испытуемый человек опухоль поджелудочной железы согласно дискриминанту, основанный на логистическом регрессионном анализе, использующим значения измерений вариантов APOA2 белка.
2-2-1. Способ дискриминирования с помощью логистического регрессионного анализа
Способ получения дискриминанта с помощью логистического регрессионного анализа может быть использован в качестве способа анализа для определения того, имеет ли место или нет опухоль поджелудочной железы или оценить возможность образования опухоли поджелудочной железы.
Во-первых, всех испытуемых людей разделяют в зависимости от клинической информации на 2 группы: больных с опухолью поджелудочной железы и здоровых людей. Объективная переменная установлена на "1" для больных с опухолью поджелудочной железы и "0" для нормального людей. Далее дискриминант устанавливается от значений измерения двух вариантов APOA2 белка, полученных из биологических образцов, имеющих клиническую информацию. Дискриминант может быть предварительно установлен в качестве выражения логистической регрессии, включающего в качестве переменной (независимой переменной) значение измерения APOA2-АТQ белка, и/или значение измерения APOA2-AT белка, и/или произведение значения измерения APOA2-АТ белка и значения измерения APOA2-АТQ белка. Достоверность выражения логистической регрессии как дискриминанта может быть оценена с помощью критерия, как например значения AIC (информационный критерий Акайке) или значения BIC Швартца, относящихся к категории метода максимального правдоподобия.
Выражение, включающее величину измерения APOA2-АТQ белка, величину измерения APOA2-АТ белка и произведение величины измерения APOA2-АТ белка и величины измерения APOA2-АТQ белка в качестве независимых переменных, как в математическом выражении 1, математическом выражении 2, и математическом выражении 3, может быть использовано в качестве выражения логистической регрессии.
Математическое выражение 1: a х (APOA2-АТКQ) + b х (APOA2-AT) + d
Математическое выражение 2: a x (APOA2-ATQ) + b x (APOA2-AT) + c x (APOA2-ATQ) x (APOA2-AT) + d
Математическое выражение 3: c x (APOA2-ATQ) x (APOA2-AT) + d
(В математических выражениях от 1 до 3, а, b, c, и d каждое представляет любое действительное число, кроме нуля; (APOA2-АТQ) представляет значение измерения APOA2-АТQ белка; и (APOA2-АТ) представляет значение измерения APOA2-АТ белка)
В случае получения дискриминанта в виде выражения логистической регрессии, значения величин измерения APOA2-ATQ белка и APOA2-AT белка, полученных от испытуемого человека и нормального человека, вводят в выражение логистической регрессии, и полученные значения дискриминанта могут быть сравнены, чтобы определить что испытуемый человек имеет опухоль поджелудочной железы. Например, может быть установлено, что испытуемый человек имеет опухоль поджелудочной железы, когда статистически достоверное отличие значения дискриминанта испытуемого человека составляет 2/3 или ниже, более предпочтительно 1/2 или ниже, еще более предпочтительно 1/4 или ниже значения дискриминанта нормального человека.
3. Набор для выявления опухоли поджелудочной железы
Третий аспект настоящего изобретения относится к набору для выявления опухоли поджелудочной железы.
В настоящем описании, "набор для выявления опухоли поджелудочной железы" ссылается на статью, которую прямо или косвенно используют для оценки того, имеет место или нет опухоль поджелудочной железы, тяжести опухоли поджелудочной железы, наличия или отсутствия улучшения, или степени улучшения, или для скрининга кандидатного вещества полезного в профилактике, улучшении или лечении опухоли поджелудочной железы.
Набор настоящего аспекта включает, как составляющие, вещества, способные специфически распознавать и связываться с вариантами APOA2 белка, предпочтительно двумя вариантами APOA2 белка, представленными в SEQ ID NO: 1 и 2, экспрессия которых изменяется в образце жидкости организма, в частности крови, сыворотки или плазмы, в связи с возникновением опухоли поджелудочной железы. В частности, набор содержит, например, антитела против конца белка APOA2 и т.д., или их фрагменты, или химически модифицированные производные этих антител или фрагментов. Эти антитела могут быть связаны с твердофазным носителем, как описано выше. В этом случае, предпочтительно, чтобы антитела были связаны со стрипами для тестирования, как описано выше. Набор может дополнительно содержать, например, меченое второе антитело, субстрат, необходимый для детекции метки, носитель, отмывочный буфер, разбавитель образцов, субстрат для фермента, раствор для остановки реакции, очищенные APOA2 белки в качестве стандартов и инструкцию по применению.
Примеры
Здесь и далее, настоящее изобретение будет описано также ниже конкретно со ссылкой на Примеры. Тем не менее, настоящее изобретение не предназначено быть ограниченным этими примерами.
Примеры
(Пример 1) Получение моноклонального антитела, специфически узнающего С-концевую область APOA2-АТQ белка (моноклональное антитело против конца белка APOA2-ATQ)
(a) Подготовка клеток, производящих антитела, узнающие С-концевую область APOA2-АТQ белка
Пептид, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 29, которая является последовательностью С-концевой области APOA2-АТQ белка, плохо растворяется в воде и слабо антигенен. По этой причине, ему была придана гидрофильность путем добавления 3 остатков аргинина к N концу, и к N-концу были также добавлены остатки цистеина, чтобы синтезировать пептид. Впоследствии, белок ОВА был присоединен к цистеиновому остатку пептида с использованием Малеимид-активированного овальбумина (изготовлен Pierce Biotechnology, Inc.). Полученный пептид вводили внутрибрюшинно в качестве иммуногена в дозе 100 мкг иммуногена на мышь мышам (BALB/c) с 2-недельными интервалами. Для от первого до четвертого уколов иммунизации, раствор иммуногена также смешивали с адъювантной системой Sigma (производства компании Sigma-Aldrich Corp) и вводили. После четвертого укола, титр антител у мышей в сыворотке крови измеряли методом твердофазного ИФА.
Иммуноген доводили до 0,3 мкг/мл раствором PBS, затем вносили по 100 мкл/лунку в Immunoplate Maxisorp (иммунные планшеты с максимальной абсорбцией) (производства Nalge Nunc International), и иммобилизовали в течение ночи. На следующий день раствор сливали и добавляли туда по 400 мкл/лунку забивочный буферный раствор A (0.5% БСА, 0.05% Твин 20, и PBS). Планшет оставляли стоять при комнатной температуре в течение 1 часа. Раствор выливали из каждой лунки. Затем лунку отмывали добавлением 400 мкл PBS-T (0.05% Tвин 20 и PBS). Сыворотку мыши, разведенную забивочным буферным раствором А, добавляли в лунки по 100 мкл/лунка и оставляли взаимодействовать при комнатной температуре в течение 1 часа. Раствор сливали из каждой лунки. Затем лунку промывали PBS-T. Затем в нее добавляли по 100 мкл/лунку поликлональные кроличьи антимышиные иммуноглобулины/HRP (производства Dako, An Agilent Company), разведенные в 5000 раз забивочным буфером А, и оставляли реагировать 1 час при комнатной температуре. После промывки с помощью PBS-T туда добавляли TMB раствор (производства Pierce Biotechnology, Inc.) по 50 мкл/лунку для ферментативной реакции. Затем реакцию останавливали путем внесения 0,5 N раствора серной кислоты по 50 мкл/лунку. Абсорбцию измеряли при 450 нм. В результате было обнаружено значительное повышение титра антител. Поэтому раствор иммуногена вводили мышам для окончательной иммунизации. Через три дня после дня заключительной иммунизации клетки, вырабатывающие антитела, получали из селезенки каждой мыши
(б) выделение клеток, продуцирующих антитело из мыши и слияние клеток
Клетки, продуцирующие антитело, полученные от каждой мыши на этапе (а) и клетки SP2/0 (миелома мыши) смешивали в соотношении 1:10 в среде RPMI1640 и подвергали реакции слияния в присутствии 80% полиэтиленгликоля. Затем, слитые клетки культивировали в течение приблизительно 1 недели в HAT среде для селектирования гибридом.
(с) Выбор гибридомы, продуцирующей антитело, узнающее С-концевую области APOA2-АТQ белка
Далее, из гибридом, отселектированных в HAT среде, были отобраны антитела, специфически узнающие С-концевую область APOA2-АТQ белка, используя, в качестве критерия, разницу в активности связывания с рекомбинантным производным APOA2-АТQ белка человека и APOA2-АТ белком. В результате скрининга с помощью твердофазного ИФА таким же образом, как и на этапе (а), были получены две гибридомы, клон 7F2 и клон 6G2. В результате анализа последовательностей генов, кодирующих эти моноклональные антитела, было показано, что CDR последовательности 7F2 являются аминокислотными последовательностями, представленными в SEQ ID NO: от 4 до 9, и было показано, что CDR последовательности 6G2, являются аминокислотными последовательностями, представленными в SEQ ID NO: от 10 до 15.
(Пример 2) Выявление APOA2-АТQ белка методом твердофазного ИФА с использованием моноклонального антитела против конца белка APOA2-ATQ).
Моноклональные антитела 7F2 или 6G2 против конца белка APOA2-ATQ, полученные в Примере 1, использовали для обнаружения APOA2-АТQ белка методом твердофазного ИФА. Рекомбинантный человеческой природы APOA2-ATQ белок, APOA2-AT белок или белок APOA2-A доводили до 1 мкг/мл раствором PBS, затем вносили по 100 мкл/лунку в Immunoplate Maxisorp (иммунные планшеты с максимальной абсорбцией) и иммобилизовали в течение ночи. На следующий день раствор сливали и добавляли туда по 400 мкл/лунку забивочный буферный раствор A. Планшет оставляли стоять при комнатной температуре в течение 1 часа. Раствор был вылит из каждой лунки. Затем лунка была отмыта добавлением 400 мкл PBS-T. Антитело 7F2 или 6G2 разведенное до 0,2 мкг/мл разбавителем (1% NP40, 50 мМ трис-HCl, 150 мМ NaCl, 1 мМ ЭДТА, и 1% БСА, pH 8.0) добавляли в лунки по 100 мкл/лунка и оставляли взаимодействовать при комнатной температуре в течение 2 часов. Раствор сливали из каждой лунки. Затем после промывки с помощью PBS-T в нее добавляли по 100 мкл/лунку поликлональные кроличьи антимышинные иммуноглобулины/HRP разведенные в 5000 раз разбавителем, и оставляли реагировать 1 час при комнатной температуре. После промывки с помощью PBS-T туда добавляли TMB раствор по 100 мкл/лунку для ферментативной реакции. Затем реакцию останавливали путем внесения раствора серной кислоты по 100 мкл/лунку. Абсорбцию измеряли при 450 нм.
Результаты представлены на Фигуре 1. Было подтверждено, что оба моноклональных антитела против конца белка APOA2-ATQ клон 7F2 и клон 6G2, полученные в настоящем изобретении, специфически узнают APOA2-АТQ белок.
(Пример 3) Оценка специфичности связывания моноклонального антитела против конца белка APOA2-ATQ и поликлонального антитела против конца белка APOA2-ATQ с белком APOA2-АTQ.
В общей сложности 3 антитела, т.е. моноклональное антитело против конца белка APOA2-ATQ, клон 7F2 и клон 6G2, полученные в Примере 1 и поликлональное антитело против конца белка APOA2-ATQ, полученное методом, описанным в пункте "1-4. Получение поликлонального антитела против белка APOA2" (подробности метода описаны в "Experimental Protocol for Anti-Peptide Antibodies", the 2nd edition, Gakken Medical Shujunsha Co., Ltd.), были оценены по их специфичности по отношению к антигену. В этом эксперименте были использованы POD-меченые формы 7F2 клона, клона 6G2, и поликлонального антитела против конца белка APOA2-ATQ. POD меченье антител проводили с использованием PEROXIDASE LABELING KIT-SH (производства Dojindo Laboratories).
Рекомбинантный APOA2-ATQ белок человеческого происхождения или APOA2-AT белок доводили до количества 1 мкг/мл раствором PBS, затем вносили по 100 мкл/лунка в Immunoplate Maxisorp и иммобилизовали в течение 2 часов. После отмывки с помощью PBS-T, туда добавляли забивочный раствор B (1% обезжиренное молоко, 0,05% Твин 20 и БСА) в количестве 400 мкл/лунка. Планшет оставляли стоять при комнатной температуре в течение 1 часа. Раствор был слит из каждой лунки. Затем туда добавляли в количестве 100 мкл/лунка POD меченую форму моноклонального антитела 7F2 или 6G2 или поликлонального антитела против конца белка APOA2-ATQ, разведенного до 0,5 мкг/мл разбавителем и оставляли реагировать при комнатной температуре в течение 2 часов. После последующей промывки с помощью PBS-T, туда добавляли раствор TMB в количестве 100 мкл/лунка для развития окраски. В конце реакцию останавливали добавлением 0,5 N раствора серной кислоты по 100 мкл/лунка. Абсорбцию измеряли при 450 нм.
Фигура 2(А) демонстрирует значения измерений каждого антитела, прореагировавшего с лункой с неиммобилизованным белком (пустая), с лункой с иммобилизованным APOA2-AT белком, и с лункой с иммобилизованным APOA2-АТQ белком. Фигура 2(Б) - это график, изображающий значение, полученное как специфичность связывания каждого антитела против конца белка APOA2-ATQ путем умножения значения его активности связывания для APOA2-АТQ белка на значение его активности связывания для APOA2-AT белка, в котором значение активности связывания для APOA2-AT белка рассчитывали путем вычитания значения измерения антитела прореагировавшего с лункой с APOA2-AT иммобилизованным белком из пустой, и значение активности связывания для APOA2-АТQ белка рассчитывали путем вычитания значения измерения антитела, прореагировавшего с лункой с APOA2-ATQ иммобилизованным белком из пустой. Было подтверждено, что оба моноклональных антитела 7F2 и 6G2 против конца белка APOA2-ATQ имели более высокую специфичность связывания с APOA2-АТQ белком, чем специфичность связывания поликлонального антитела против конца белка APOA2-ATQ.
(Пример 4) Выявление APOA2-AT белка методом твердофазного ИФА с использованием антитела против конца белка APOA2-AT.
APOA2-АТ белок был определен методом твердофазного ИФА с использованием поликлонального антитела против конца белка APOA2-AT, специфически узнающего С-концевую область APOA2-АТ белка.
(a) Получение поликлонального антитела против белка APOA2.
Поликлональное антитело против белка APOA2 было получено путем использованием способа, описанного в пункте "1-4. Получение поликлонального антитела против белка APOA2" (подробности способа описаны в "Experimental Protocol for Anti-Peptide Antibodies", the 2nd edition, Gakken Medical Shujunsha Co., Ltd.). Применяемый иммуноген получали путем добавления остатков цистеина к N концу пептида, состоящего из C-концевой области APOA2-AT белка, приведенной в SEQ ID NO: 28, и далее присоединения к нему белка-носителя KLH. Этот иммуноген вводили кроликам с 1-недельными интервалами. После четвертого укола, титр антител в сыворотке крови кроликов измеряли методом твердофазного ИФА таким же образом, как в Примере 1. В качестве результата было обнаружено достаточное повышение титра антител. Поэтому, антисыворотка была получена через 1 неделю после даты конечной иммунизации.
Носитель formyl-Cellulofine пришивали к пептиду и использовали в качестве аффинной колонки для очистки антисыворотки. В частности, антисыворотку после очистки пропускали через аффинную колонку (носитель formyl -Cellulofine, связанный с амидированной с С-конца формой пептида) таким образом, что иммуноглобулины, проявляющие активность связывания по отношению к области, отличной от С-концевой области пептида, удаляли путем адсорбции. Наконец, получали эту не адсорбированную фракцию в качестве поликлонального антитела против белка APOA2-AT.
(б) Детекция APOA2-АТ белка методом твердофазного ИФА
Рекомбинантный человеческого происхождения APOA2-AT белок, APOA2-ATQ белок или APOA2-A белок доводили до 1 мкг/мл раствором PBS, затем вносили по 100 мкл/лунка в Immunoplate Maxisorp и иммобилизовали в течение ночи. На следующий день раствор сливали и туда добавляли забивочный раствор А в количестве 400 мкл/лунка. Планшет оставляли стоять при комнатной температуре в течение 1 часа. Раствор сливали из каждой лунки. Затем лунка была промыта добавлением 400 мкл PBS-T. Поликлональное антитело против конца APOA2-AT, разведенное разбавителем до 0,2 мкг/мл добавляли туда в количестве 100 мкл/лунка и оставляли реагировать в течение 2 часов при комнатной температуре. Раствор сливали из каждой лунки. Затем после промывки с помощью PBS-T, туда добавляли для ферментативной реакции по 100 мкл/лунка анти-кроличьи IgG, ослиные фрагменты F(ab')2 , связанные с HRP (производства GE Healthcare Japan Corp.) разведенные в 10000 раз разбавителем, и оставляли реагировать при комнатной температуре в течение 1 часа. После промывки с помощью PBS-T туда добавляли раствор TMB по 100 мкл/лунка для ферментативной реакции. Затем реакцию останавливали добавлением 0,5 N раствора серной кислоты по 100 мкл/лунка. Абсорбцию измеряли при 450 нм.
Результаты представлены на фигуре 3. Было подтверждено, что антитела, полученные в настоящем изобретении, специфически узнают среди вариантов APOA2 белка только APOA2-АТ белок.
(Пример 5) Выявление APOA2 белка методом твердофазного ИФА с использованием антитела не против конца белка APOA2. Антитела, узнающие аминокислотную последовательность, отличную от С-концевой области белка APOA2 получали с использованием способа, описанного в примере 1.
Чтобы выбрать антитела, гибридомы скринировали с использованием, в качестве критерия, активность связывания по отношению к не концевой области APOA2 белка. В результате этого скрининга были получены гибридомы, продуцирующие два моноклональных антитела не против конца белка APOA2, клон MAB1 и клон MAB2. В результате анализа последовательностей генов, кодирующих эти моноклональные антитела, было показано, что CDR последовательности MAB1 являются аминокислотными последовательностями, представленными в SEQ ID NO: от 16 до 21, и было показано, что CDR последовательности MAB2 являются аминокислотными последовательностями, представленными в SEQ ID NO: от 22 до 27.
Моноклональные антитела MAB1 или MAB2 не против конца белка APOA2 использовали для выявления вариантов APOA2 белка методом твердофазного ИФА. Рекомбинантные человеческие APOA2-AT белок, APOA2-АТQ белок, или APOA2-белок доводили до 1 мкг/мл раствором PBS, затем вносили по 100 мкл/лунка в Immunoplate Maxisorp и иммобилизовали в течение ночи. На следующий день раствор сливали и туда добавляли забивочный раствор А по 400 мкл/лунка. Планшет оставляли стоять при комнатной температуре в течение 1 часа. Раствор сливали из каждой лунки. Затем лунку промывали добавлением 400 мкл PBS-T. Каждое антитело разведенное до 0,5 мкг/мл забивочным буфером А добавляли туда по 100 мкл/лунка и оставляли реагировать при комнатной температуре в течение 1 часа. Раствор сливали из каждой лунки. Затем после промывки с помощью PBS-T, туда добавляли по 100 мкл/лунка анти-кроличьи IgG, ослиные фрагменты F(ab')2 , связанные с HRP (производства GE Healthcare Japan Corp.), разведенные в 5000 раз забивочным буфером А и оставляли реагировать при комнатной температуре в течение 1 часа. После промывки с помощью PBS-T туда добавляли раствор TMB по 100 мкл/лунка для ферментативной реакции. Затем реакцию останавливали добавлением 0,5 N раствора серной кислоты по 100 мкл/лунка. Абсорбцию измеряли при 450 нм.
Фигуры 4(A) и 4(Б) демонстрируют результаты анализа вариантов APOA2 белка методом твердофазного ИФА с использованием антител MAB1 и MAB2, соответственно. Оба моноклональных антитела MAB1 и MAB2, полученные в настоящем изобретении, имели одинаковый уровень активности связывания по отношению к вариантам APOA2 белка и, таким образом, было подтверждено, что они являются антитела не против конца белка APOA2, узнающие аминокислотную последовательность, отличную от C-концевой области.
(Сравнительный Пример 1) Выявление димера белка APOA2 (APOA2-АТQ/AT) в крови с помощью масс-спектрометрии
Ионную силу пептидного пика, имеющего массу 17252 (м/з) измеряли с применением SELDI-QqTOF-МS (поверхностно-усиленная лазерная десорбции/ионизации с производительностью высокого разрешения гибридного квадруполя время пролетная, масс-спектрометрия) согласно подходу, аналогичному Эксперименту 1, как описано в JP Patent № 5200246, плазмы, собранной в Национальном Онкологическом Центральном Госпитале от 40 субъектов, от каждых больных раком поджелудочной железы и здоровых людей, путем их обоснованного согласия.
Фигура. 5 демонстрирует результаты дискриминирования больных раком поджелудочной железы от нормальных людей. Этот подход давал значение AUC = 0.894 и таким образом подтверждал высокую точность дискриминирования рака поджелудочной железы.
(Сравнительный пример 2) Выявление димера белка APOA2 (APOA2-АТQ/AT) в крови с использованием сэндвич-твердофазного ИФА.
Плазму, полученную таким же способом, как в Сравнительном Примере 1, использовали в качестве образца. Была предпринята попытка выявление димера белка APOA2 (APOA2-АТQ/AT) путем сэндвич-твердофазного ИФА с использованием моноклонального антитела 7F2 против конца белка APOA2-ATQ, специфически узнающего С-концевую область APOA2-АТQ белка, и POD меченой формы поликлонального антитела против конца APOA2-AT, специфически узнающего С-область APOA2-АТ белка.
POD мечение моноклонального антитела против конца белка APOA2-ATQ проводили с использованием PEROXIDASE LABELING KIT-SH и детали придерживались приложенного протокола. Поликлональное антитело против конца APOA2-AT доводили до 5 мкг/мл раствором PBS, затем вносили по 100 мкл/лунку в Immunoplate Maxisorp и иммобилизовали в течение ночи. На следующий день раствор сливали и лунку промывали добавлением 400 мкл PBS-T. Туда добавляли забивочный буферный раствор С (1% BSA, 0.05% Твин- 20, и PBS) по 400 мкл/лунку и планшет оставляли стоять при комнатной температуре в течение 1 часа. Раствор сливали для приготовления планшета с иммобилизованным антителом. Затем туда добавляли плазму, разведенную в 16 раз разбавителем, по 100 мкл/лунку и оставляли реагировать при комнатной температуре в течение 1 часа. Раствор сливали из каждой лунки. Затем лунку промывали PBS-T. POD меченную форму моноклонального антитела против конца APOA2-ATQ разбавленную разбавителем до 0,4 мкг/мл добавляли туда по 100 мкл/лунку и оставляли реагировать при комнатной температуре в течение 1 часа. После промывки с помощью PBS-T туда добавляли раствор TMB по 100 мкл/лунку для ферментативной реакции. Затем реакцию останавливали внесением раствора 0,5N серной кислоты по 100 мкл/лунку. Абсорбцию измеряли при 450 нм.
Фигура 6 демонстрирует результаты дискриминирования пациентов с раком поджелудочной железы от нормальных людей. Этот подход давал значение AUC=0,529 и таким образом не дает точного дскриминирования рака поджелудочной железы эквивалентного масс спектрометрии Сравнительного Примера 1. Результаты этого эксперимента указывают на возможность, что из-за того что две С- концевых области APOA2-ATQ/AT димера белка расположены рядом друг с другом, поликлональное антитело против конца APOA2-AT и моноклональное антитело против конца APOA2-ATQ не могут с ним связываться из-за стерических затруднений.
(Сравнительный пример 3) Выявление APOA2-ATQ белка в крови с использованием сэндвич твердофазного ИФА
Плазму, полученную таким же образом, как и в Сравнительном Примере 1, использовали в качестве образца. APOA2-ATQ белок анализировали методом сэндвич твердофазного ИФА с использованием POD меченной формы моноклонального антитела 7F2 против конца белка APOA2-ATQ и поликлонального антитела против белка APOA2 (Fitzgerald Industries International), узнающего участок, отличный от С-концевой области APOA2 белка.
Мечение POD 7F2 антитела проводили тем же образом что и в Сравнительном Примере 2. Поликлональное антитело не против конца белка APOA2-AT доводили до 2 мкг/мл раствором PBS, затем вносили по 100 мкл/лунку в Immunoplate Maxisorp и иммобилизовали в течение ночи. На следующий день раствор сливали и лунку промывали внесением 400 мкл PBS-T. Туда добавляли забивочный буферный раствор С по 400 мкл/лунку и планшет оставляли стоять при комнатной температуре в течение 1 часа. Затем раствор сливали для приготовления планшета с иммобилизованным антителом. Затем туда добавляли плазму по 100 мкл/лунку, разведенную в 10000 раз разбавителем, и оставляли реагировать при комнатной температуре в течение 1 часа. Раствор антигена сливали из каждой лунки. Затем лунку промывали PBS-T. POD меченную форму 7F2 моноклонального антитела, разбавленную разбавителем до 0,2 мкг/мл, добавляли туда по 100 мкл/лунку и оставляли реагировать при комнатной температуре в течение 1 часа. После промывки с помощью PBS-T, туда добавляли раствор TMB по 100 мкл/лунку для ферментативной реакции. Затем реакцию останавливали внесением раствора 0,5N серной кислоты по 100 мкл/лунку. Абсорбцию измеряли при 450 нм.
Фигура 7 демонстрирует результаты дискриминирования больных раком поджелудочной железы и нормальных людей. Этот подход дает значение AUC = 0,515 и, следовательно, не дает отличной точности дискриминирования рака поджелудочной железы.
(Сравнительный Пример 4) Выявление APOA2-АТ белка в крови путем использования сэндвич-твердофазного ИФА
Плазму, полученной таким же способом, как в Сравнительном Примере 1, использовали в качестве образца. APOA2-АТ белок анализировали методом сэндвич-твердофазного ИФА с использованием поликлонального антитела против конца APOA2-AT и POD меченой формы поликлонального антитела не против конца белка APOA2. POD мечение поликлонального антитела не против конца белка APOA2 и сэндвич-твердофазный ИФА проводили таким же образом, как и в Сравнительном Примере 3. Величина разведения плазмы была установлена в 6000 раз.
Фигура 8 демонстрирует результаты дискриминирования больных раком поджелудочной железы от нормальных людей. Этот подход давал значение AUC = 0,814 и, таким образом, было подтверждено, что он имеет высокую точность дискриминирования рака поджелудочной железы, которая, однако, уступает в осуществлении дискриминирования масс-спектрометрии Сравнительного Примера 1.
(Пример 6) Дискриминирование рака поджелудочной железы путем комбинации значений измерений в крови двух APOA2 белков (APOA2-АТQ белка и APOA2-АТ белка)
Фигура 9 демонстрирует результаты дискриминирования рака поджелудочной железы у пациентов и нормальных людей путем нанесения произведения значений измерения APOA2-АТQ белка и APOA2-АТ белка, полученных в Сравнительном Примере 3 и Сравнительном Примере 4, соответственно. Этот подход показал значение AUC = 0,906 и тем самым подтвердил проявление дискриминирования с высокой точностью рака поджелудочной железы, которое превосходило даже масс-спектрометрию Сравнительного Примера 1.
(Пример 7) Дискриминирование рака поджелудочной железы с использованием сэндвич-твердофазного ИФА.
В качестве образца использовали плазму, собранную в Национальном Онкологическом Центральном Госпитале от 244 больных раком поджелудочной железы и 109 нормальных людей путем их информированного согласия. Два варианта APOA2 белка (APOA2-АТQ белок и APOA2-АТ белок) были проанализированы в крови в соответствии с подходом Примера 6. Растворы антигенов рекомбинантных человеческих белков APOA2-АТQ белка и APOA2-АТ белка использовали как препараты для расчета концентрации обоих белков в плазме.
Фигура 10 демонстрирует Диаграмму разброса, на которой были нанесены два белка в плазме каждого субъекта. Использование двух белков показало возможность отличать с высокой точностью больных раком поджелудочной железы от нормальных людей.
(Пример 8) Дискриминирование рака поджелудочной железы путем обработки значения измерения с помощью алгоритма анализа данных
Дискриминант, который обеспечивает высокую точность дискриминирования рака поджелудочной железы, может быть получен путем обработки статистическим анализом значений измерений, полученных в Примере 7. Статистическая обработка, приведенная ниже, была проведена и сравнена с аналогичным методом дискриминирования рака поджелудочной железы с использованием масс-спектрометрии как в Сравнительном Примере 1.
(а) Дискриминирование рака поджелудочной железы с помощью логистического регрессионного анализа
Объективная переменная была определена как "1" для больных с раком поджелудочной железы и как "0" для нормального человека. Концентрации двух вариантов APOA2 белка (APOA2-АТQ белка и APOA2-AT белка) в крови, полученной в (1) были использованы в качестве независимых переменных в логистическом регрессионном анализе, для вычисления дискриминанты. В таблице 1 приведены результаты расчета значений AUC и результаты дискриминирования (чувствительность и специфичность) данных пациентов в полученных дискриминантах. В этой таблице хорошее проведение дискриминирования ранней стадии рака поджелудочной железы (стадия I) было получено при дискриминанте, построенным с применением умножения двух концентраций белков (APOA2-АТQ белка и APOA2-AT белка) в качестве независимой переменной, как в Примере 6. Значения измерений APOA2-АТQ белка и APOA2-AT белка в каждом образце были вставлены в этот дискриминант, и результирующее значение дискриминанта было использовано для дискриминирования больных раком поджелудочной железы (стадии I и II) от нормальных людей. Полученная ROC-кривая представлена на Фигуре 11(А). Фигура 11(В) является ROC-кривой, полученной из дискриминирования больных с раком поджелудочной железы от нормальным людей с использованием количества димера APOA2-АТQ/AT белка, измеренного масс-спектрометрией. Таблица 2 демонстрирует результаты сравнения проведения дискриминирования для каждой стадии рака поджелудочной железы. В Таблице 2, стадия рака поджелудочной железы соответствует классификации стадий UICC: I стадия относится к IA и IB по классификации стадий UICC и II стадия относится к IIА и IIB согласно классификации стадий UICC. В Таблице 2, "Твердофазный ИФА" отображает результаты анализа, полученные из дискриминанта, при использовании в качестве независимой переменной произведения количеств двух белков (APOA2-АТQ белка и APOA2-AT белка), полученных методом твердофазного ИФА. "Масс-спектрометрия" отображает результаты анализа, полученные при использовании количества димера APOA2 белка (APOA2-АТQ/AT), полученного методом масс-спектрометрии. Было подтверждено, что этот подход способен выявлять ранний рак поджелудочной железы с очень высокой чувствительностью по сравнению с масс-спектрометрией.
|
AT и ATQ показывают значения измерений белка APOA2-AT и белка APOA2-ATQ соответственно методом твердофазного ИФА. AT×ATQ представляет произведение значений этих измерений
|
(Пример 9) Распознавание доброкачественной опухоли поджелудочной железы, путем обработки значения измерения с помощью алгоритма анализа данных.
APOA2 использовали в дискриминировании различных больных с доброкачественной опухолью поджелудочной железы от нормальных людей и сравнивали с СА19-9 для проведения дискриминирования.
Тот же дискриминант (произведение количества APOA2-АТQ белка и APOA2-AT белка), который использовали для дискриминирования больных раком поджелудочной железы больных от нормальных людей в Примере 8, использовали в дискриминировании с использованием APOA2. Результат дискриминирования полученный с использованием APOA2 рассчитывали таким же способом, как и при расчете результатов дискриминирования (чувствительность и специфичность) в Таблице 1.
Количество СА19-9 в образцах жидкости испытуемых людей измеряли с помощью иммунологического метода. Как правило, референсное значение дискриминанта составляет 37 (ед/мл) для дискриминирования пациентов раком поджелудочной железы от нормальных людей с помощью СА19-9. По дискриминанту испытуемых людей определяют здоровыми людьми, если количество СА19-9 равно или меньше референсного значения, и определяют, как больных раком поджелудочной железы, когда значение СА-19-9 превышает референсное значение (LAB DATA: test selection and interpretation 2013-2014, supervised by Fumimaro Takaku, Igaku Shoin Ltd., p. 636-637).). Этот Пример был предназначен, для проверки, могут ли пациенты с доброкачественной опухолью поджелудочной железы на основе референсного значения быть дискриминированы от нормальных людей с помощью СА19-9. Для этого, каждый испытуемый субъект был признан пациентом с доброкачественной опухолью поджелудочной железы путем дискриминирования, когда количество СА19-9 превышало референсное значение.
Фигура 12(А) демонстрирует ROC-кривую, полученную от дискриминирования больных с доброкачественной опухолью поджелудочной железы от нормальных людей с использованием APOA2. Фигура 12(Б) демонстрирует ROC-кривую, полученную от дискриминирования больных с доброкачественной опухолью поджелудочной железы от нормальных людей с помощью СА19-9. Таблица 3 демонстрирует результаты сравнения результата дискриминирования каждой доброкачественные опухоли поджелудочной железы. Было подтверждено, что способ дискриминированя настоящего изобретения с использованием APOA2 способен обнаруживать доброкачественные опухоли поджелудочной железы с очень высокой чувствительностью. Напротив, использование СА19-9 давало чувствительность практически равную нулю и, таким образом, оказалось, имело затруднение в обнаружении доброкачественной опухоли поджелудочной железы.
|
(Пример 10) Дискриминирование рака поджелудочной железы и доброкачественной опухоли поджелудочной железы путем сочетания APOA2 и СА19-9
Рак поджелудочной железы и доброкачественной опухоли поджелудочной железы были дискриминированы путем сочетания APOA2 и СА19-9. Во-первых, доброкачественная опухоль поджелудочной железы, рак поджелудочной железы ранней стадии (стадии I и II) и рак поджелудочной железы (все стадии) были выявлены с помощью способов с использованием APOA2, описанных в Примерах 8 и 9. Число затронутых лиц, у которых любое из этих заболеваний было обнаружено, рассчитывали как количество положительных APOA2.
Далее APOA2-положительные пациенты подвергались дискриминированию с помощью СА19-9 способом, описанным в Пример 9. Количество людей, у которых количество CA19-9 превышало референсное значение, рассчитывали как количество положительных CA19-9. Затем рассчитывали отношение количества положительных СА19-9 к количеству положительных APOA2. Эти результаты приведены в Таблице 4.
Было подтверждено, что этот подход, имеет высокую вероятность, что APOA2-положительные и СА19-9-положительные пациенты могут быть определены, как имеющие рак поджелудочной железы, в то время как APOA2-положительные и СА19-9 негативные пациенты могут быть определены, как имеющие доброкачественные опухоли поджелудочной железы. Эти результаты продемонстрировали, что по способу настоящего изобретения, по сочетанию APOA2 и СА19-9 может быть отличительно установлено, имеют ли испытуемые субъекты рак поджелудочной железы или доброкачественную опухоль поджелудочной железы
|
(Пример 11) Дискриминирование рака поджелудочной железы и доброкачественной опухоли поджелудочной железы путем сочетания APOA2 и DU-PAN-2
Рак поджелудочной железы и доброкачественной опухоли поджелудочной железы были дискриминированы по сочетанию APOA2 и DU-PAN-2. Дискриминирование проводили аналогично способу, описанному в Примере 10 за исключением того, что вместо СА19-9 использовали DU-PAN-2. Количество DU-PAN-2 в образцах жидкости организма испытуемых субъектов измеряли с помощью иммунологического метода. Как правило, при использовании DU-PAN-2 референсное значение дискриминирования составляет 150 (ед/мл) для дискриминирования пациентов с раком поджелудочной железы от нормальных людей. Путем дискриминирования исследуемые субъекты определяют как нормальных людей, когда количество DU-PAN-2 равно или ниже референсного значения, и определяют как больных раком панкреатической железы, когда значение DU-PAN-2 превышает референсное значение (LAB DATA: test selection and interpretation 2013-2014, supervised by Fumimaro Takaku, Igaku Shoin Ltd., p. 637-638). В этом Примере дискриминирование осуществляли с использованием референсного значения DU-PAN-2. Результаты приведены в таблице 5.
|
Было подтверждено, что этот подход, имеет высокую вероятность того, что APOA2-положительные и DU-PAN-2 -положительные пациенты могут быть определены, как имеющие рак поджелудочной железы, а APOA2-положительные и DU-PAN-2 -отрицательные пациенты могут быть определены, как имеющие доброкачественную опухоль поджелудочной железы. Эти результаты продемонстрировали, что по способу настоящего изобретения по сочетанию APOA2 и DU-PAN-2 может быть различимо установлено, что испытуемые субъекты имеют рак поджелудочной железы или доброкачественную опухоль поджелудочной железы.
Результаты Примеров с 7 по 11, описанные выше, показали, что Способ по настоящему изобретению является полезным для высокочувствительного обнаружения рака поджелудочной железы, в том числе рака поджелудочной железы на ранней стадии (стадии I и II) или доброкачественной опухоли поджелудочной железы, который ранее считался трудным, путем анализа с применением дискриминанта, основанного на значениях измерений вариантов APOA2. Эти результаты также показали, что Способ по настоящему изобретению является полезным в достижении высокой точности дискриминирования между раком поджелудочной железы и доброкачественной опухолью поджелудочной железы, которое ранее было недостижимо, путем анализа результатов определения в сочетании с маркером рака поджелудочной железы (СА19-9 иди DU-PAN-2).
Промышленная применимость
Согласно настоящему изобретению, опухоль поджелудочной железы может быть обнаружена с высокой пропускной способностью с помощью простого и неинвазивного метода. В результате реализуется раннее выявление опухоли поджелудочной железы.
Все публикации, патенты и патентные заявки, цитируемые в настоящем документе, включены в настоящий документ посредством ссылки во всей их полноте.