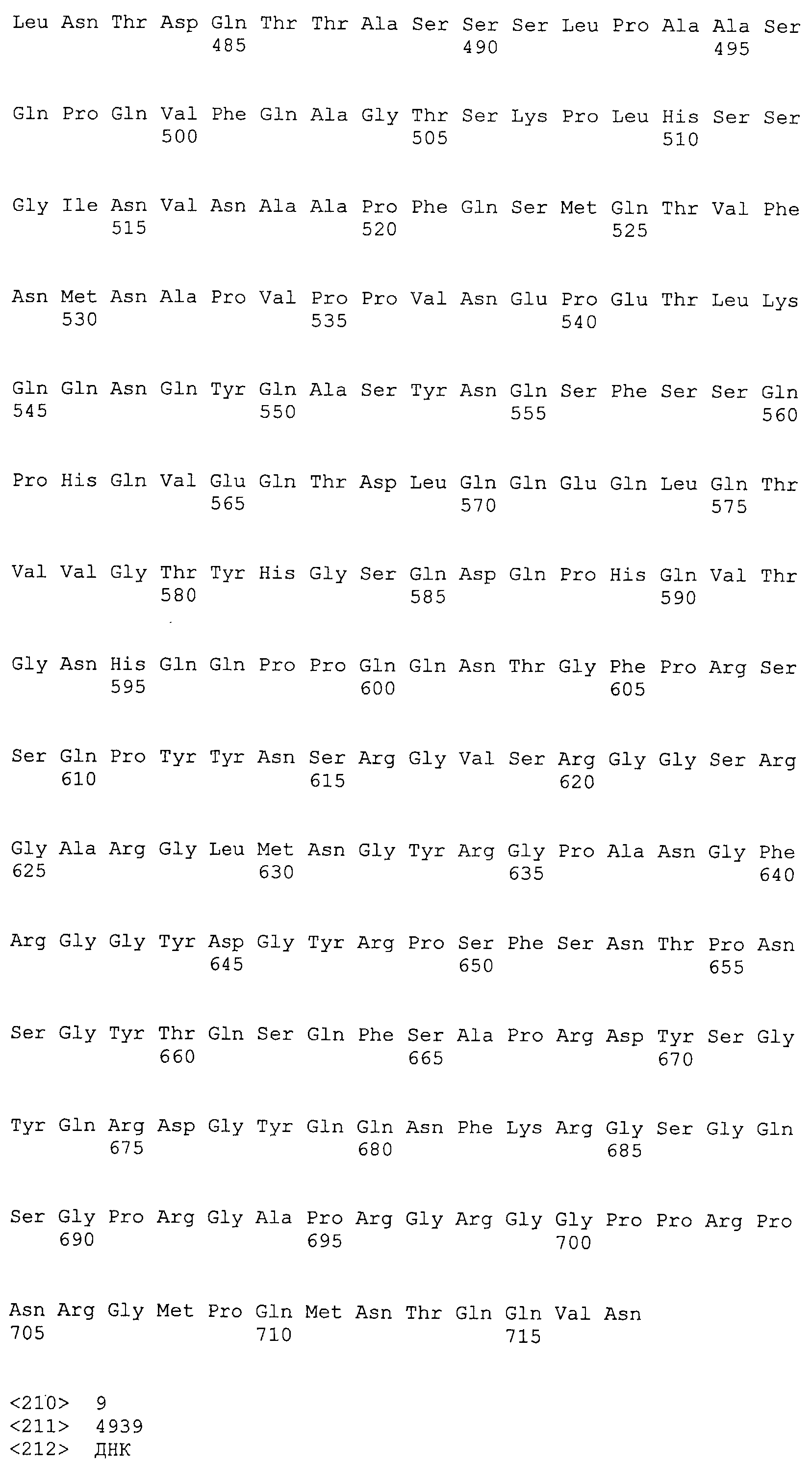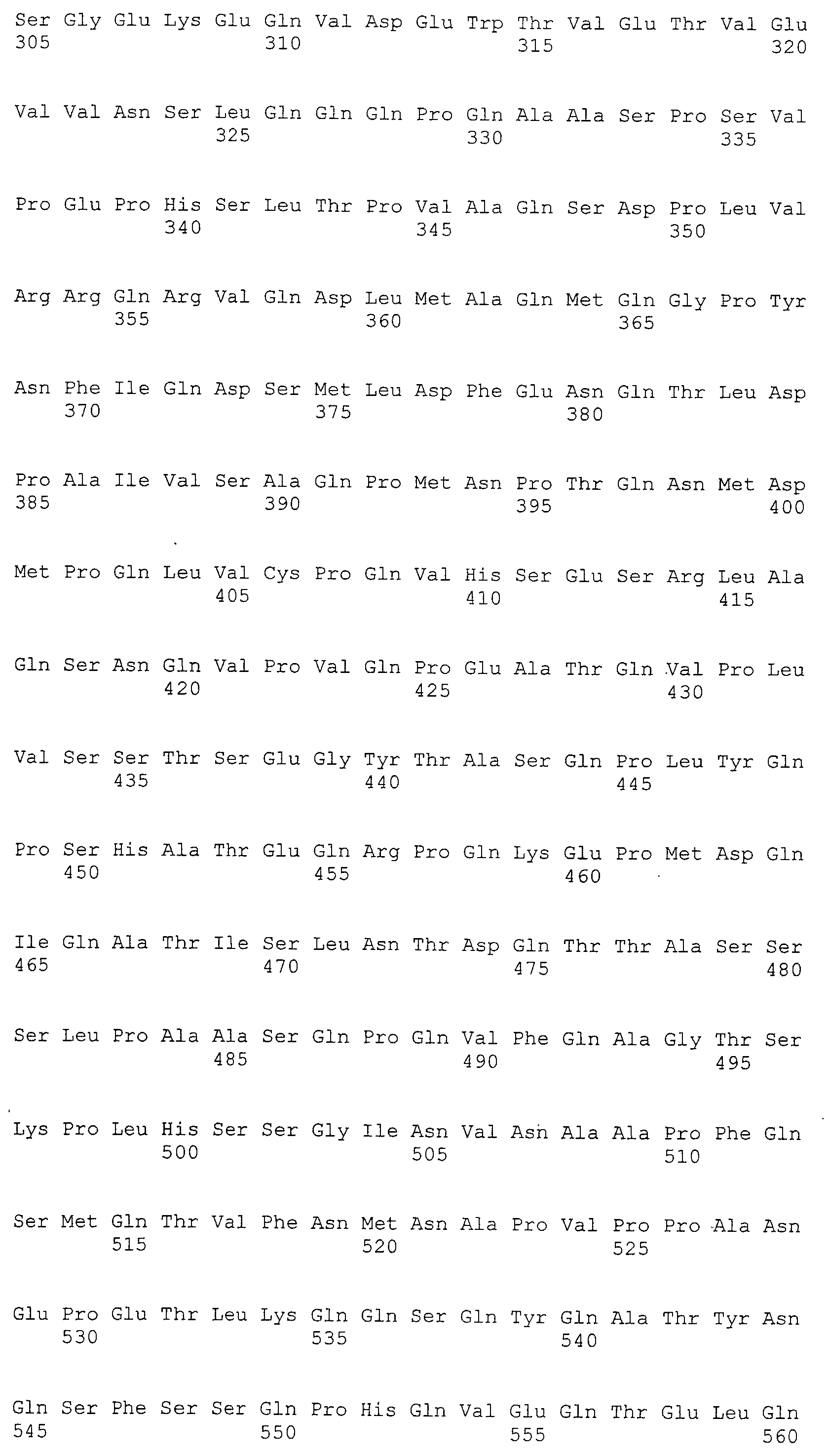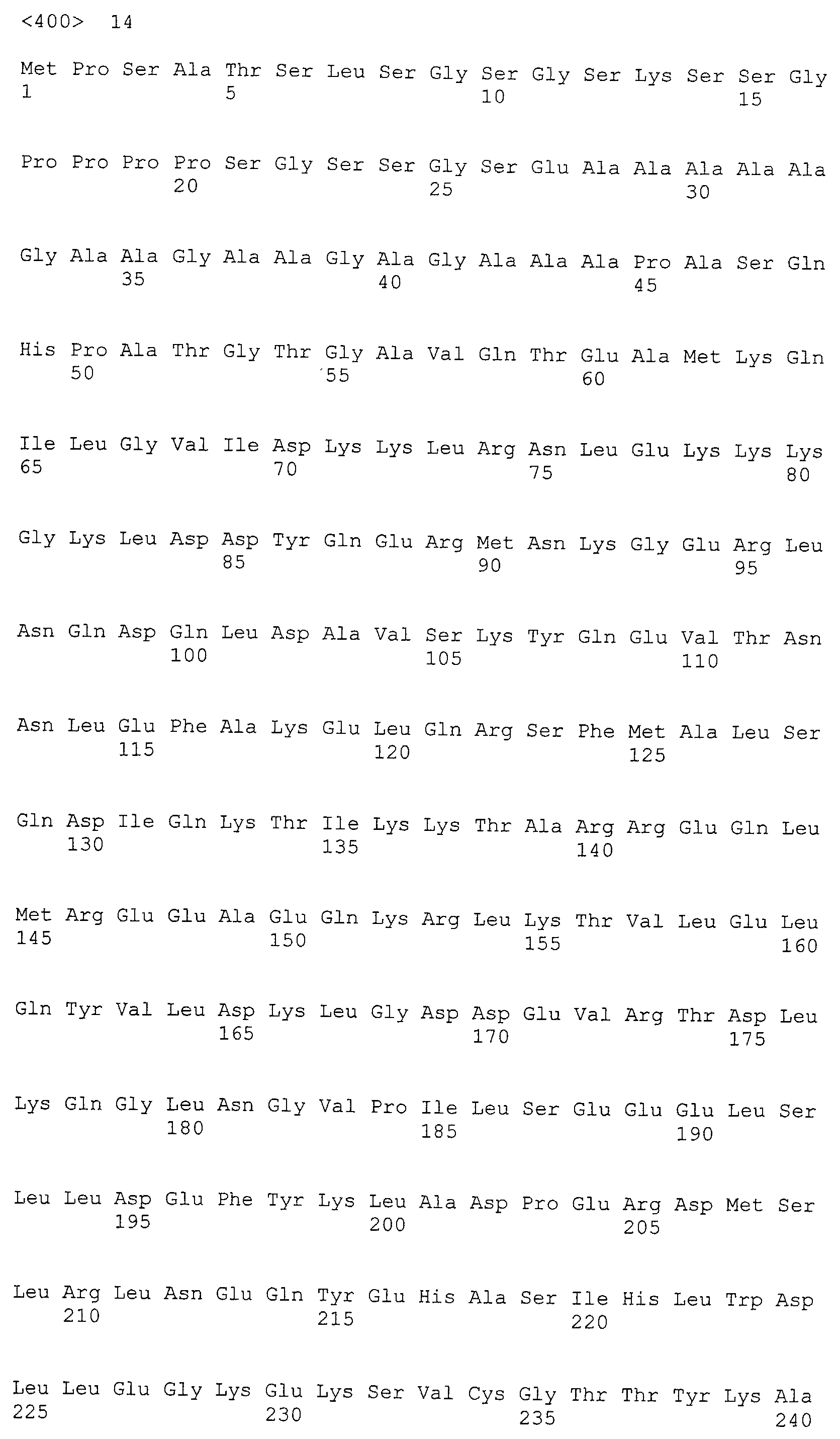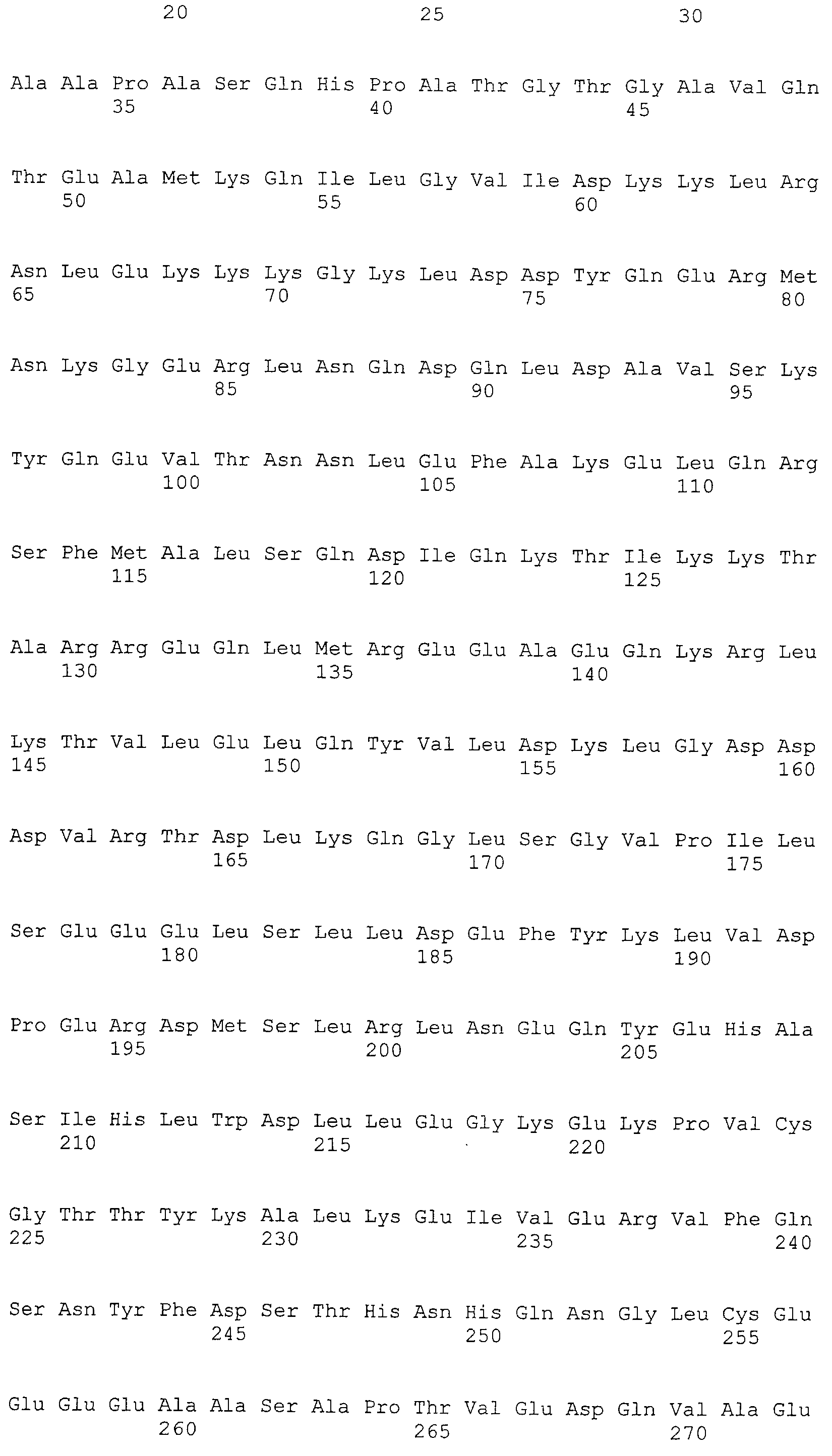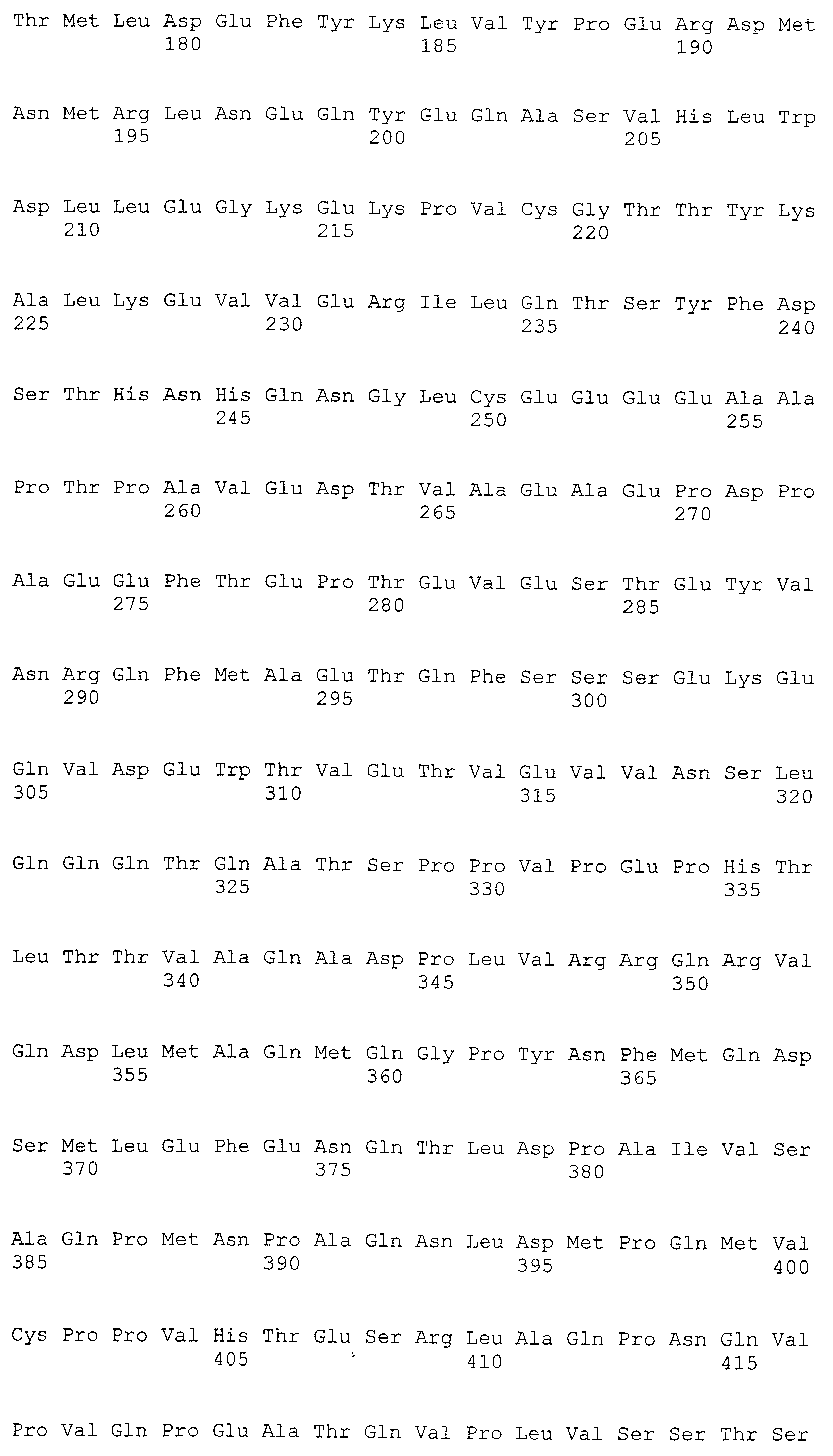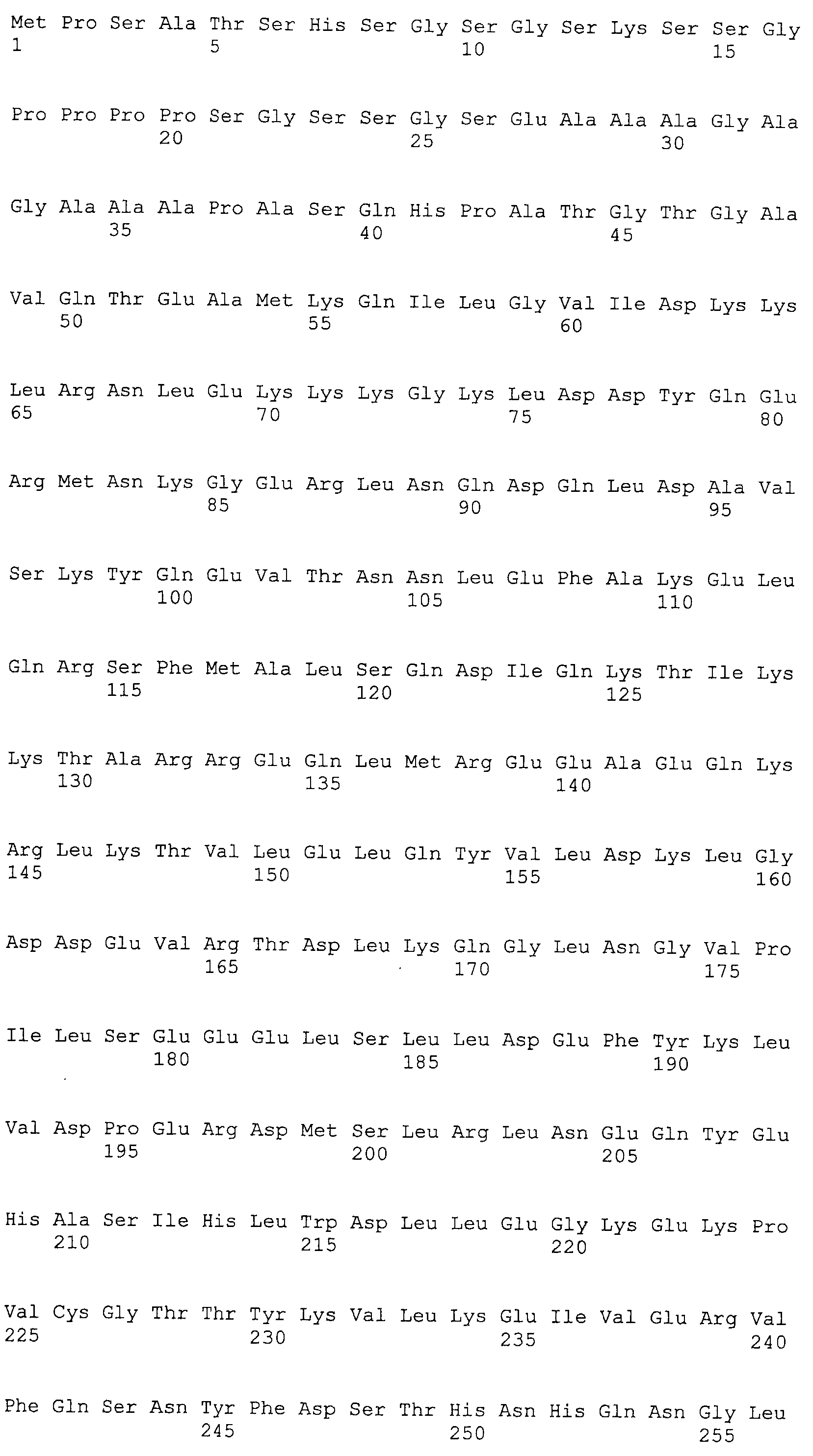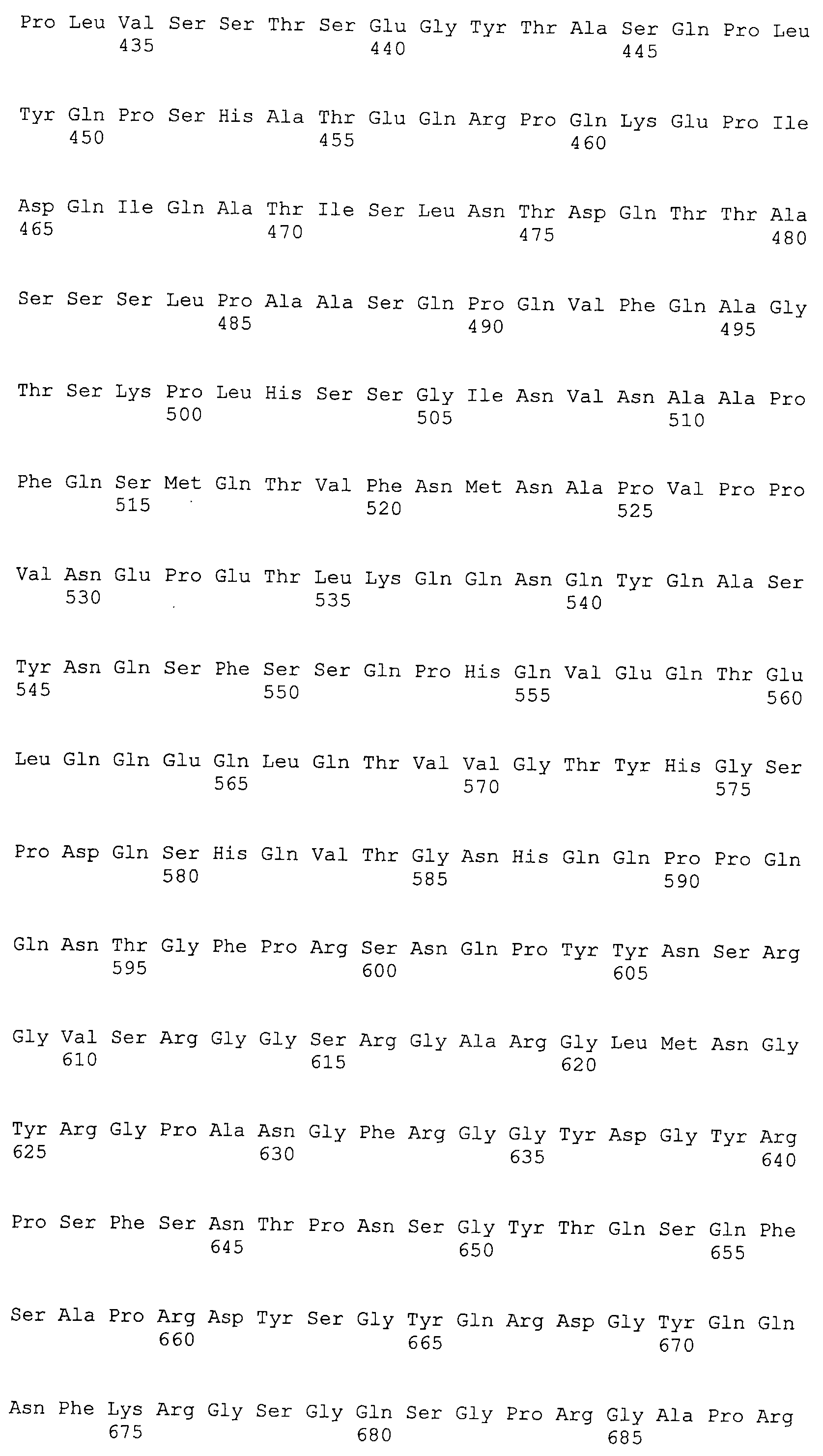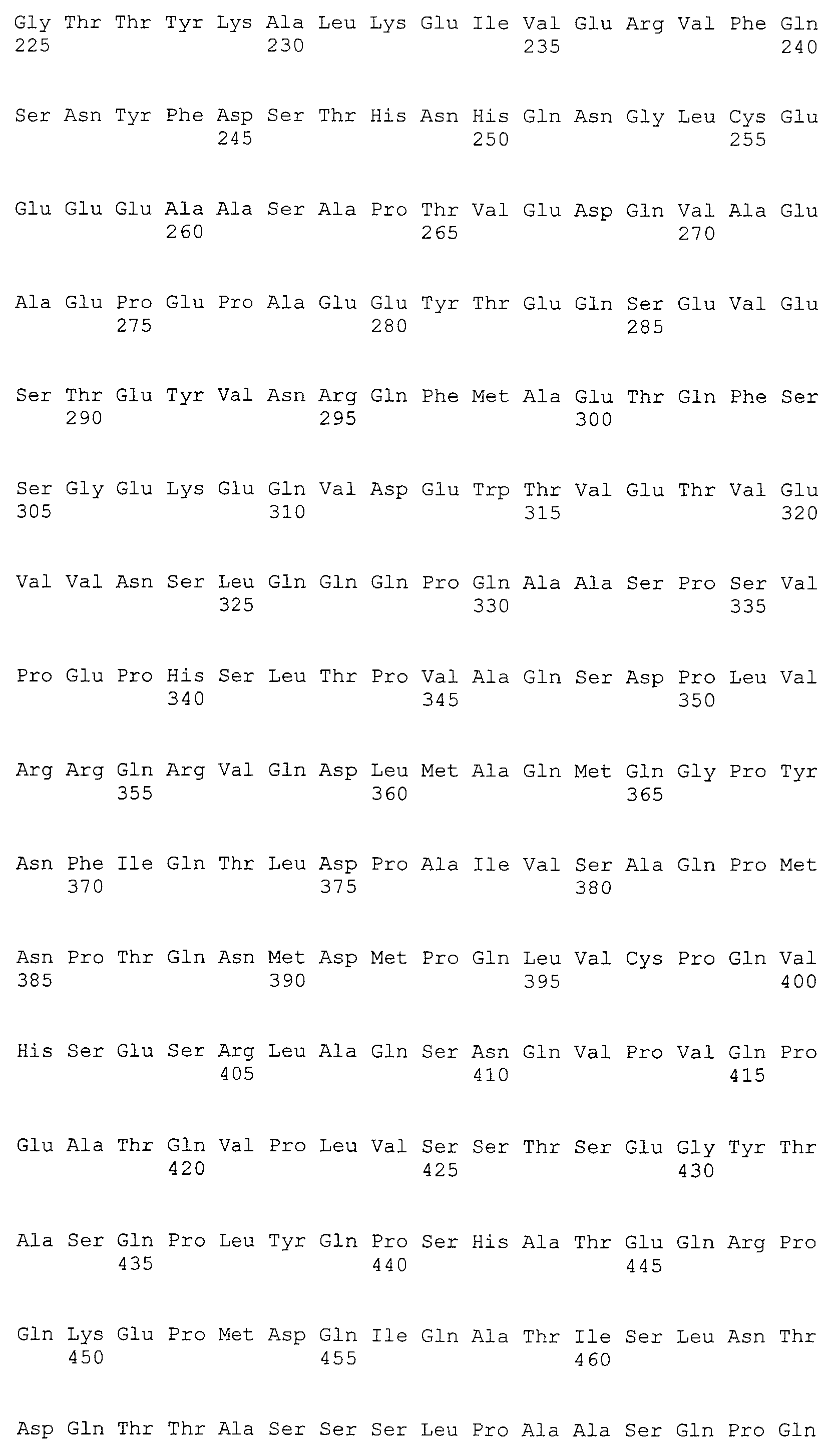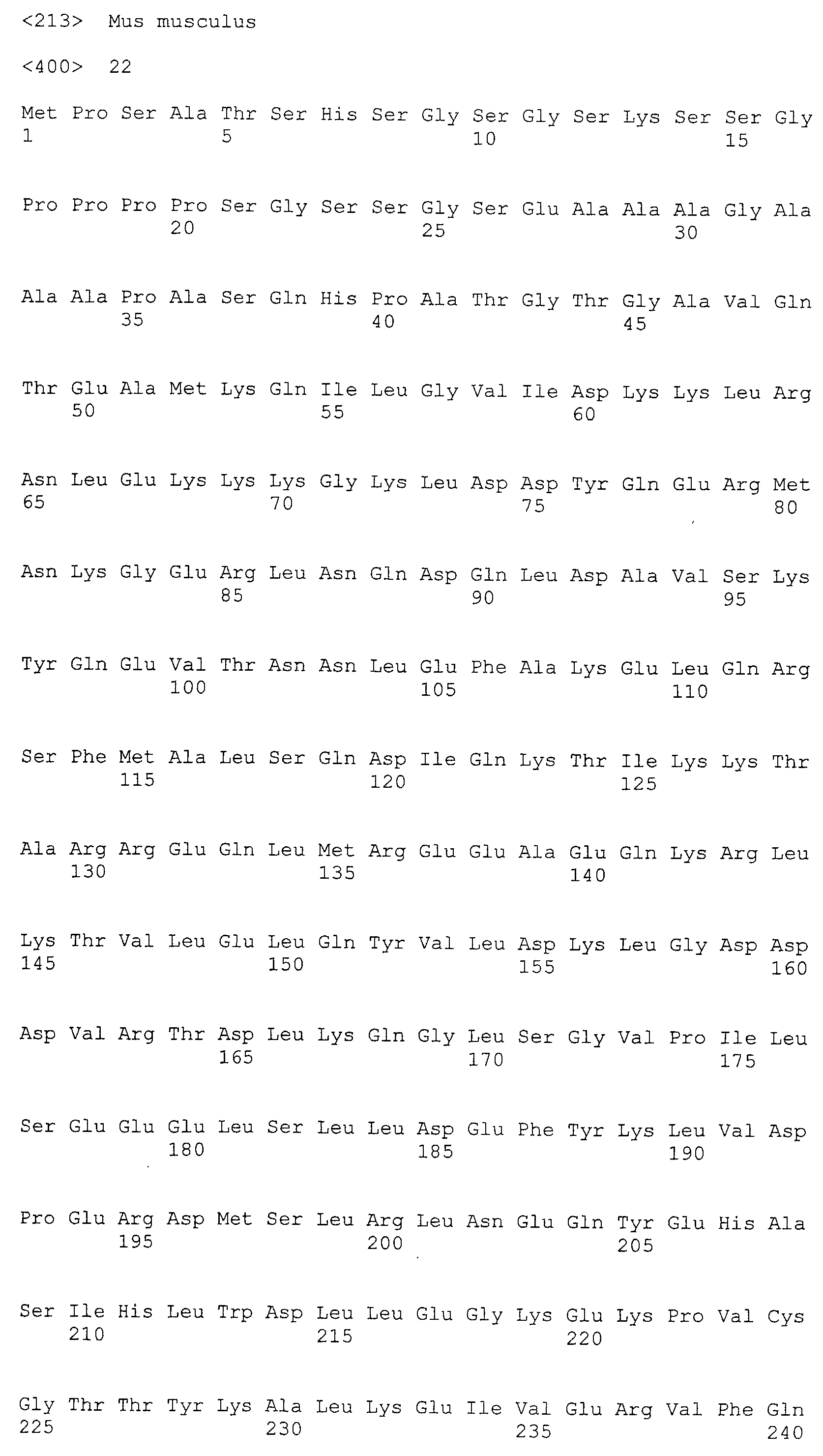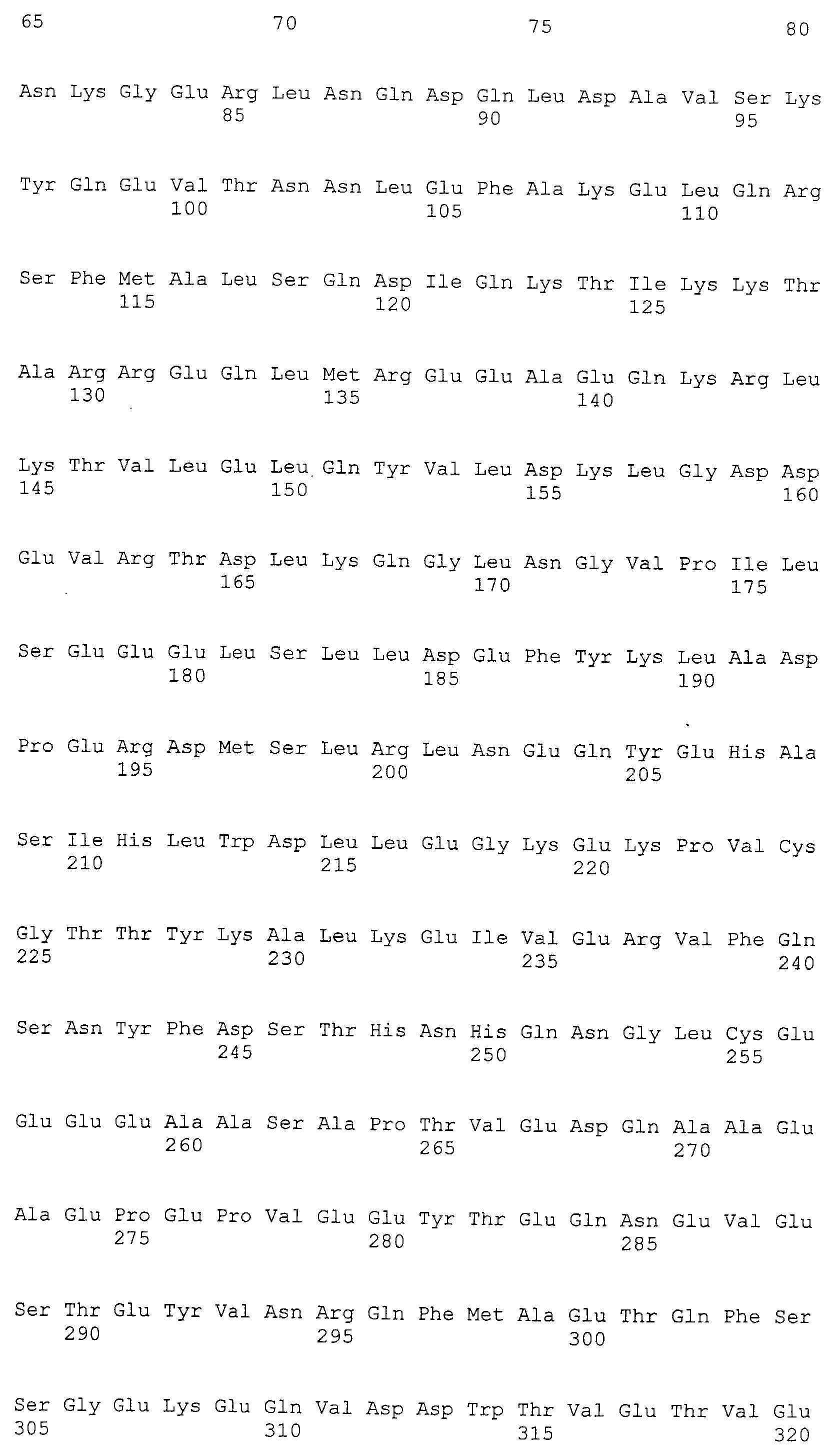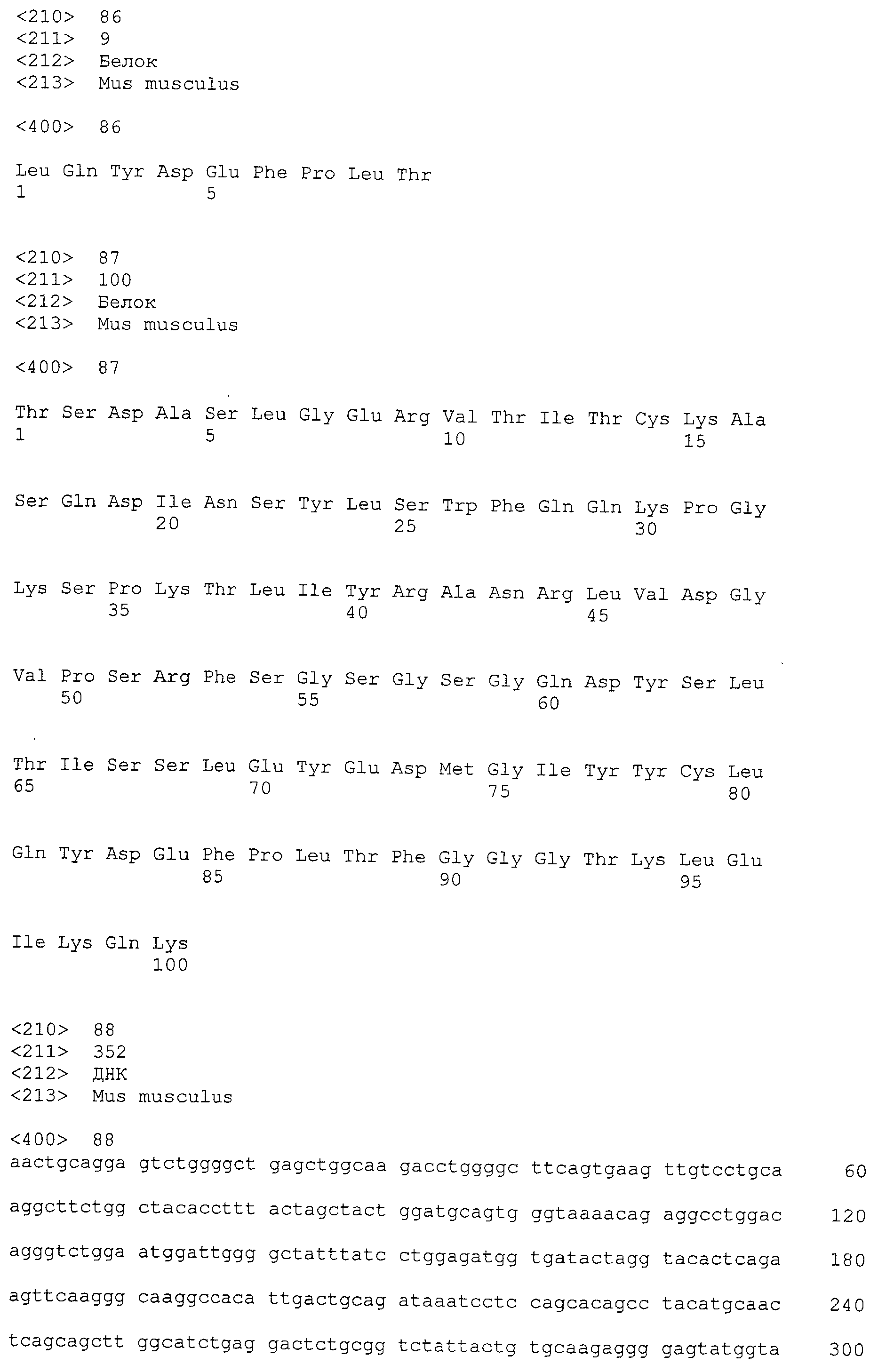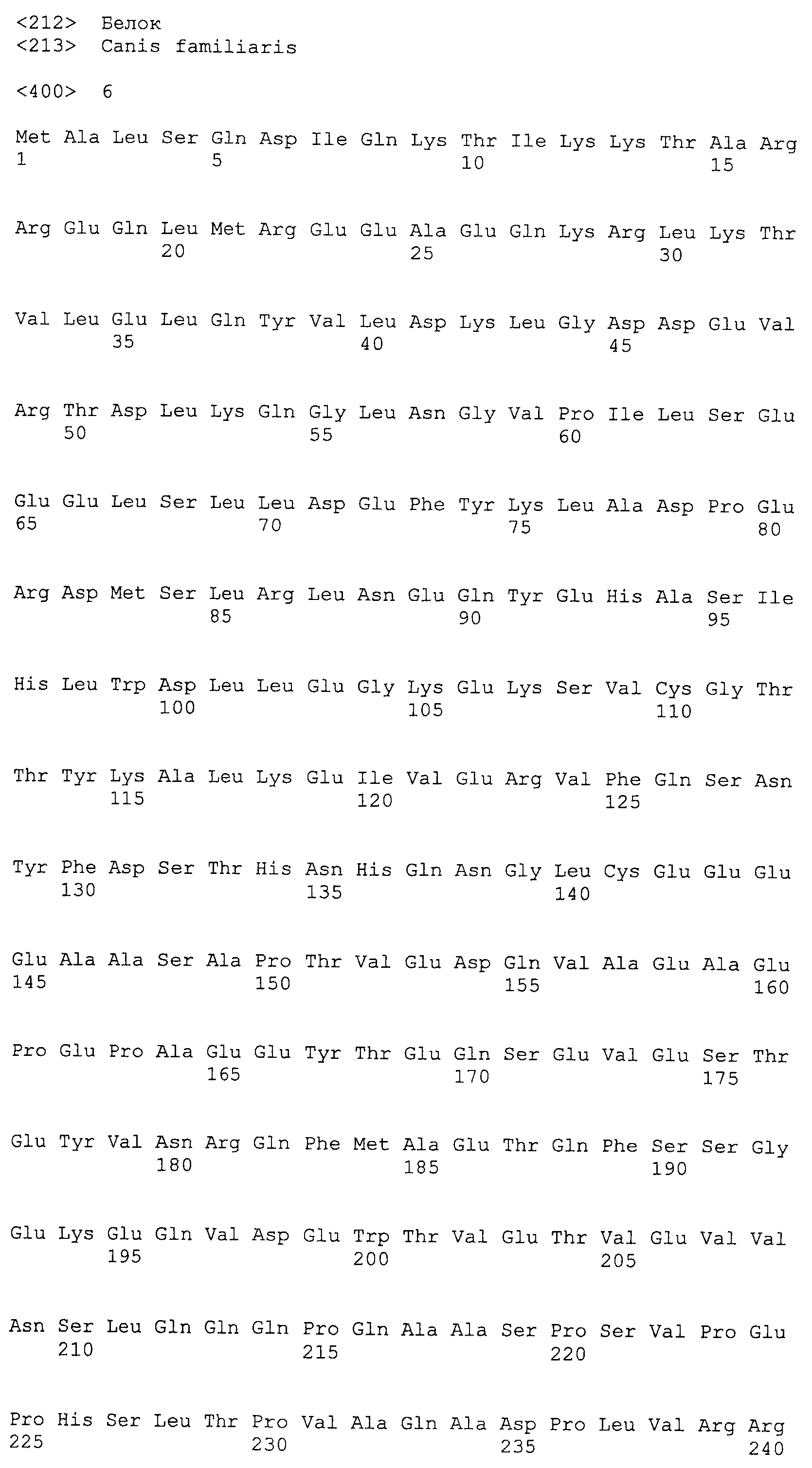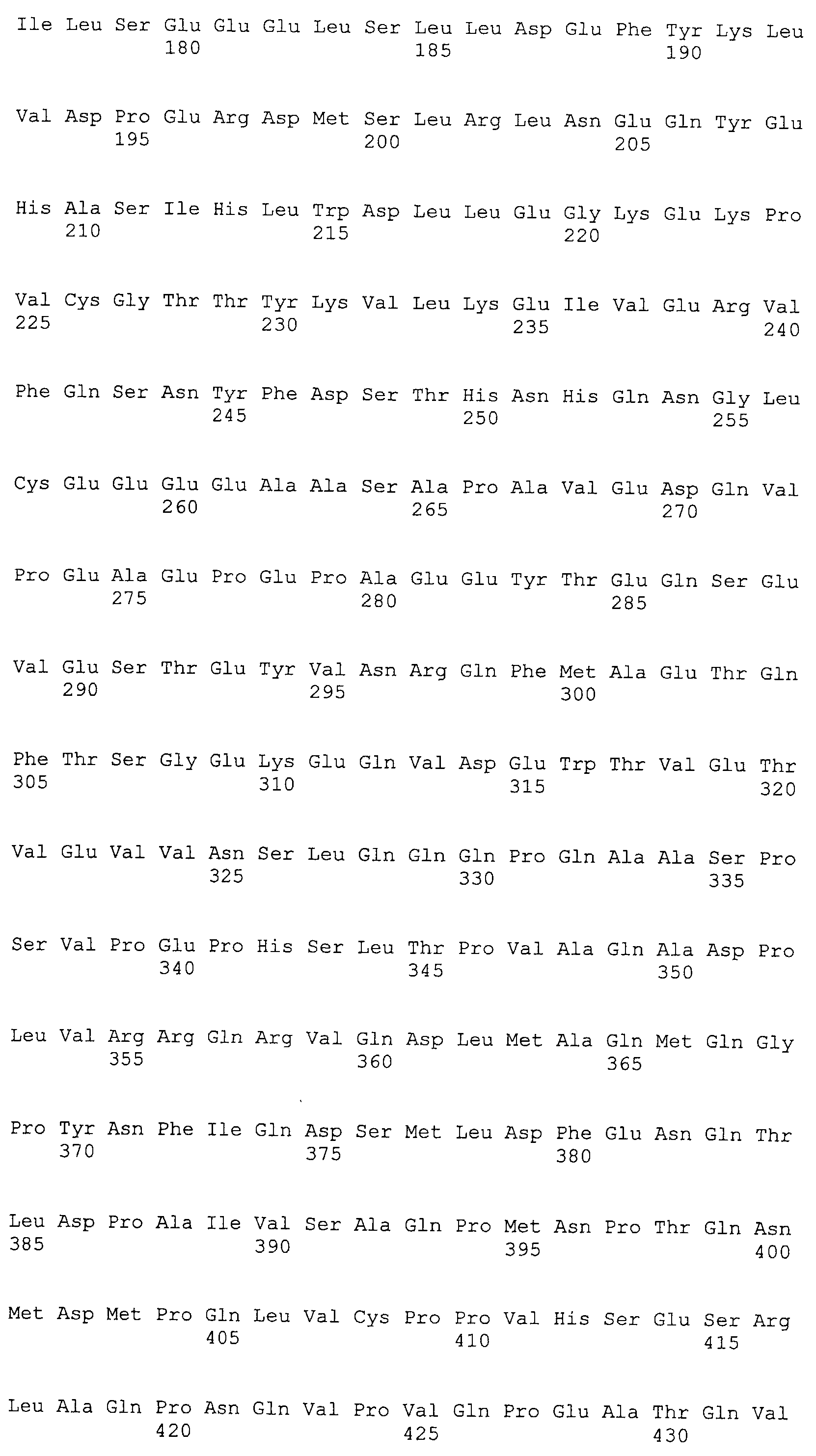Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому медицинскому применению антител против CAPRIN-1 или их фрагментов, например, в качестве терапевтических и/или профилактических средств для лечения злокачественных опухолей.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Злокачественные опухоли являются основной причиной смерти. Лечение злокачественных опухолей, проводимое в настоящее время, представляет собой главным образом, хирургическое вмешательство, которое может быть объединено с лучевой терапией или химиотерапией. Несмотря на развитие новых хирургических способов и открытие новых противоопухолевых средств в последнее время, результаты лечения злокачественных опухолей в настоящее время заметно не улучшились, за исключением некоторых типов злокачественных опухолей. В результате новых успехов в молекулярной биологии и иммунологии злокачественных опухолей, были идентифицированы антитела, которые специфически взаимодействуют со злокачественными опухолями, антигены злокачественных опухолей, распознаваемые цитотоксическими Т-клетками, а также гены, кодирующие антигены злокачественных опухолей, и были получены ожидаемые результаты для специфических иммунотерапевтических средств, направленных на антигены злокачественных опухолей (Tsuyoshi AKIYOSHI, "Gan To Kagaku-Ryoho (Cancer and Chemotherapy)", 1997, vol. 24, pp. 551-519 (Jp) (Cancer and Chemotherapy Publishers, Inc., Japan)).
В способах лечения злокачественных опухолей, для уменьшения побочных эффектов, желательно, чтобы пептиды, полипептиды или белки, распознаваемые в качестве антигенов злокачественных опухолей, отсутствовали почти во всех нормальных клетках, но специфически находились в злокачественных клетках. В 1991, Boon et al в Ludwig Institute в Бельгии выделили антиген меланомы человека MAGE 1, распознаваемый CD8-позитивными Т-клетками способом кДНК-экспресс клонирования, используя линию аутологичных злокачественных клеток и Т-клетки, реакционноспособные в отношении злокачественных опухолей (Bruggen P. et al., Science, 254:1643-1647 (1991)). В дальнейшем, сообщалось о способе SEREX (серологической идентификации антигенов путем рекомбинантного экспресс-клонирования), в котором опухолевые антигены, распознаваемые антителами, продуцированными посредством ответа на аутологичную злокачественную опухоль в организме, могут быть идентифицированы с использованием методики экспресс-клонирования генов (Proc. Natl. Acad. Sci. USA, 92:11810-11813 (1995); и патент США No. 5698396). С помощью способа SEREX, были выделены некоторые антигены злокачественных опухолей, которые по существу не экспрессируются в нормальных клетках, но специфически экспрессируются в злокачественных клетках (Int. J. Cancer, 72: 965-971 (1997); Cancer Res., 58: 1034-1041 (1998); Int. J. Cancer, 29: 652-658 (1998); Int. J. Oncol., 14: 703-708 (1999); Cancer Res., 56: 4766-4772 (1996); и Hum. Mol. Genet 6: 33-39, 1997). Далее, были проведены клинические испытания клеточной терапии с использованием иммуноцитов, которые специфически взаимодействуют с антигенами злокачественных опухолей, которые представляют собой некоторые из выделенных антигенов злокачественных опухолей, и иммунотерапии, специфичной в отношении злокачественных опухолей, с использованием вакцин, содержащих антигены злокачественных опухолей или подобное.
При этом, в последние годы, в жизнь вошел целый ряд антительных лекарственных средств для лечения злокачественных опухолей, которые направлены на антигенные белки на злокачественных клетках. Такие лекарственные средства, используемые в качестве специфичных к злокачественным опухолям терапевтических средств, в определенной степени демонстрируют лекарственную эффективность, и, следовательно, они привлекли внимание. Однако, большинство антигенных белков мишеней также экспрессируется на нормальных клетках. В результате введения антитела, не только злокачественные клетки, а также нормальные клетки, на которых экспрессируется антиген-мишень, могут быть повреждены, вызывая тем самым побочный (или неблагоприятный) эффект, который становится проблематичным. Следовательно, ожидается, что если становится возможным идентифицировать антигены злокачественной опухоли, которые специфически экспрессируются на поверхности злокачественной клетки, и использовать антитела, направленные на такие антигены, в качестве лекарственных средств, тогда можно было бы проводить лечение антительными лекарственными средствами, которые вызывают меньше побочных эффектов.
Белок 1, связанный с цитоплазмой и пролиферацией (CAPRIN-1), представляет собой внутриклеточный белок, который экспрессируется, когда нормальные клетки в фазе покоя активируются или подвергаются делению. Также известно, что CAPRIN-1 вовлечен в регуляцию транспорта и трансляции мРНК путем образования цитоплазматических стрессовых зерен с РНК в клетке. CAPRIN-1 имеет различные названия, такие как GPI-заякоренный мембранный белок 1 и белок 1 мембранного компонента поверхностного маркера (M11S1), как если бы было известно, что этот белок является мембранным белком. Эти различные названия происходят из сообщения (J. Biol. Chem., 270: 20717-20723, 1995), что генная последовательность CAPRIN-1 исходно имеет GPI-связывающую область, и CAPRIN-1 является мембранным белком, экспрессируемым в злокачественных клетках толстой кишки. Позже сообщалось о том, что последовательность гена CAPRIN-1, описанная в этом сообщении, является ошибочной; т.е., имеет место сдвиг рамки путем делеции единичного нуклеотида из последовательности гена CAPRIN-1, в настоящее время зарегистрированного GenBank или подобным, так что 80 аминокислот было делетировано с С-конца, и полученный в результате артефакт (74 аминокислоты) в этом сообщении представлял собой GPI связывающую часть; и другая ошибка также присутствует на 5' стороне генной последовательности, тем самым приводя в результате к делеции 53 аминокислот с N-конца (J. Immunol., 172: 2389-2400, 2004). Далее, сообщалось, что белок, кодируемый последовательностью гена CAPRIN-1 в настоящее время зарегистрированной GenBank или тому подобное, не являлся белком клеточной мембраны (J. Immunol., 172: 2389-2400, 2004).
Кроме того, на основании сообщения J. Biol. Chem., 270: 20717-20723, 1995, что CAPRIN-1 является белком клеточной мембраны, в US 2008/0075722 и WO 2005/100998 описывается, что CAPRIN-1 под названием M11S1 может быть использован для лечения злокачественных опухолей в качестве мишени антительных лекарственных средств для лечения злокачественных опухолей, и в качестве одного из белков клеточной мембраны; однако, в примерах не содержится описания лечения злокачественных опухолей с использованием антитела против указанного белка. Однако, как сообщалось в J. Immunol., 172: 2389-2400, 2004, было общепризнанным на дату подачи US 2008/0075722 вплоть до настоящего времени, что CAPRIN-1 не экспрессируется на поверхности клетки, и, следовательно, очевидно, что содержания US 2008/0075722 и WO 2005/100998, основанные только на ошибочной информации, что CAPRIN-1 является белком клеточной мембраны, не следует рассматривать в качестве общепринятого технического уровня знаний специалистов в данной области.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Задачей настоящего изобретения является идентификация антигенных белков злокачественной опухоли, специфически экспрессирующихся на поверхности злокачественных клеток, и применение антител, направленных на такие белки, в качестве терапевтических и/или превентивных (или профилактических) средств для лечения злокачественных опухолей.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМЫ
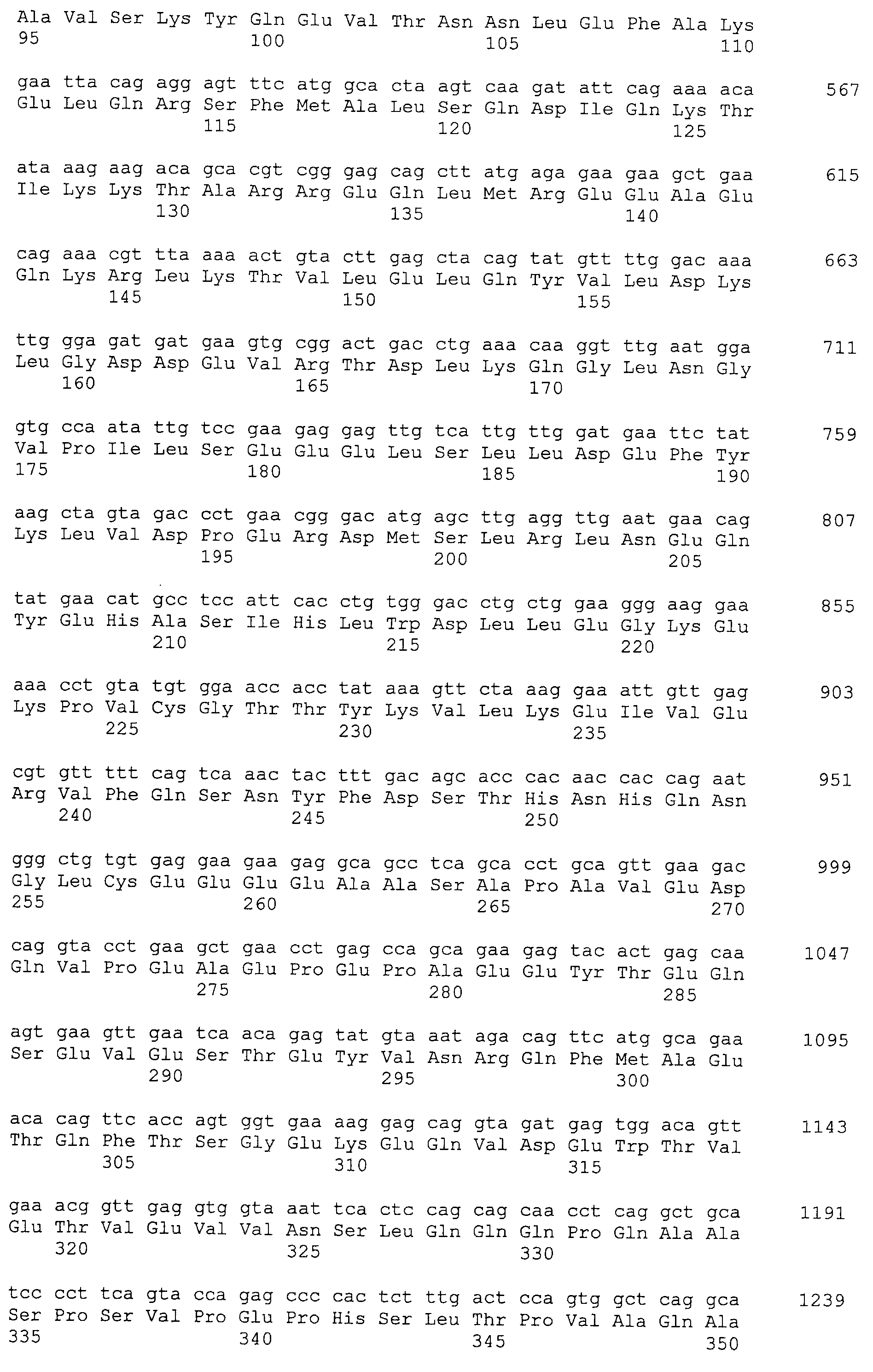
В результате тщательных исследований, авторы настоящего изобретения в настоящее время получили кДНК, кодирующую белок, который связывается с антителом, находящимся в сыворотке организма, несущего опухоль, с помощью способа SEREX, используя библиотеки кДНК, полученной из ткани семенников, и сыворотки от собак со злокачественной опухолью молочной железы. Используя полученные гены собаки и гомологичные им гены человека, быка, лошади, мыши и цыпленка, белки CAPRIN-1, имеющие аминокислотные последовательности с четными номерами SEQ ID NO:2-30 (т.е. четные последовательности SEQ ID NO:2-30), и были получены антитела против белков CAPRIN-1. Кроме того, авторы настоящего изобретения обнаружили, что CAPRIN-1 специфически экспрессируется в злокачественных клетках молочной железы, клетках опухоли головного мозга, при лейкозе, лимфоме, раке легких, раке пищевода, раке толстой кишки, раке желудка и раке почек, и эти части белков CAPRIN-1 специфически экспрессировались на поверхности таких злокачественных клеток. Далее, авторы настоящего изобретения в настоящее время обнаружили, что антитела против белков CAPRIN-1, экспрессируемых на поверхностях злокачественных клеток, могут повреждать (или поражать) злокачественные клетки, экспрессирующие CAPRIN-1. Эти сведения привели к созданию настоящего изобретения.
Таким образом, настоящее изобретение характеризуется описанными ниже признаками.
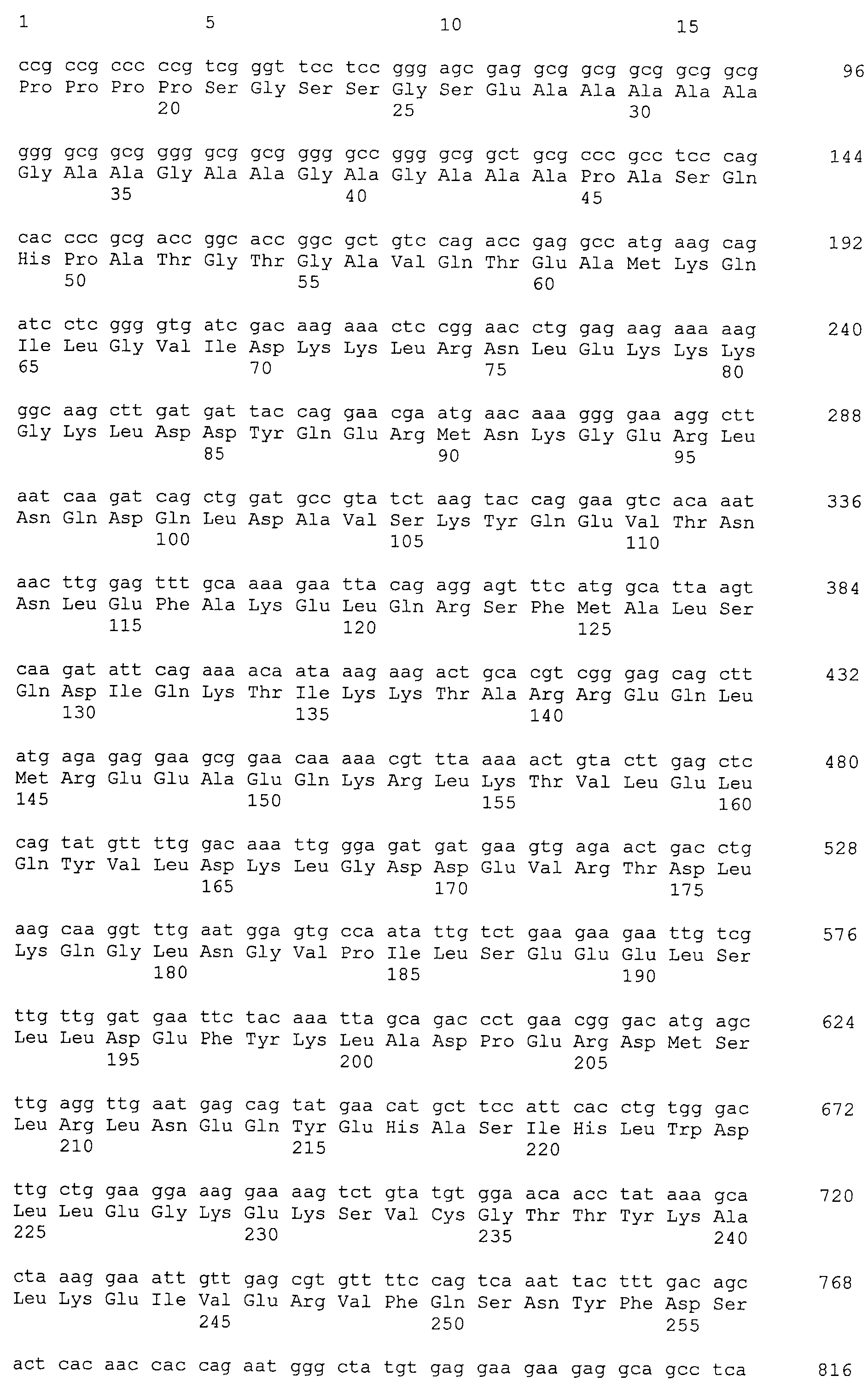
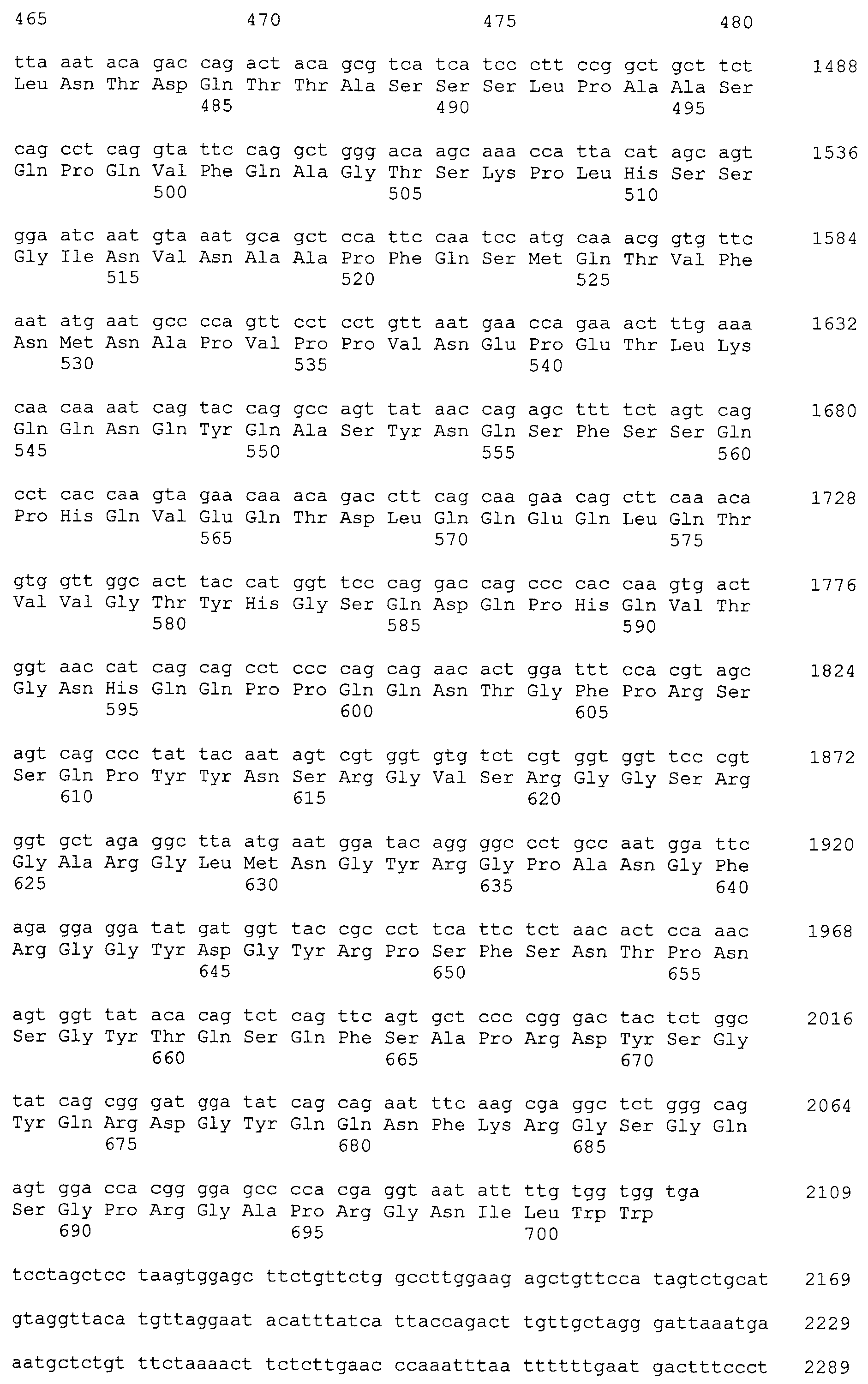
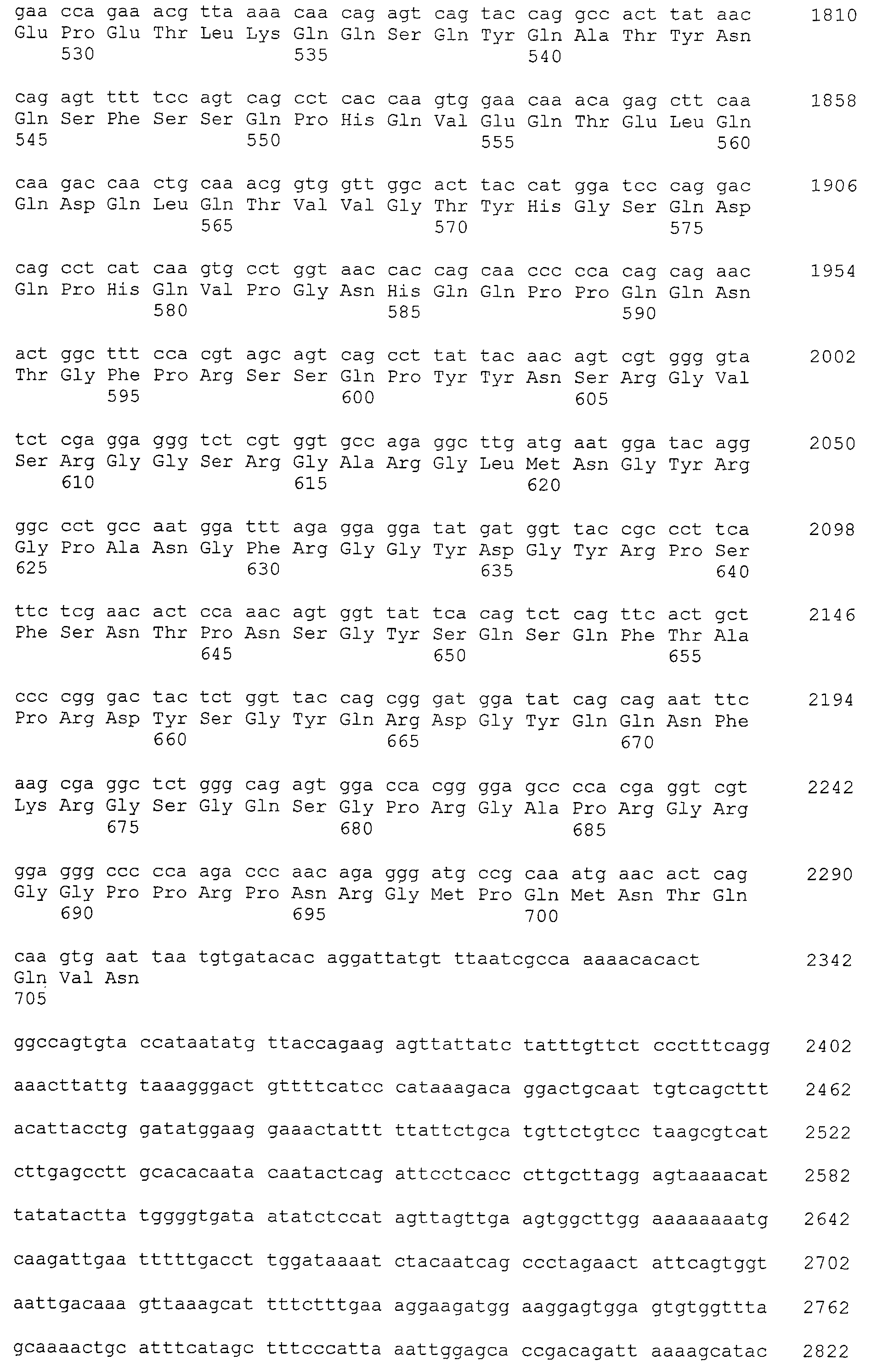
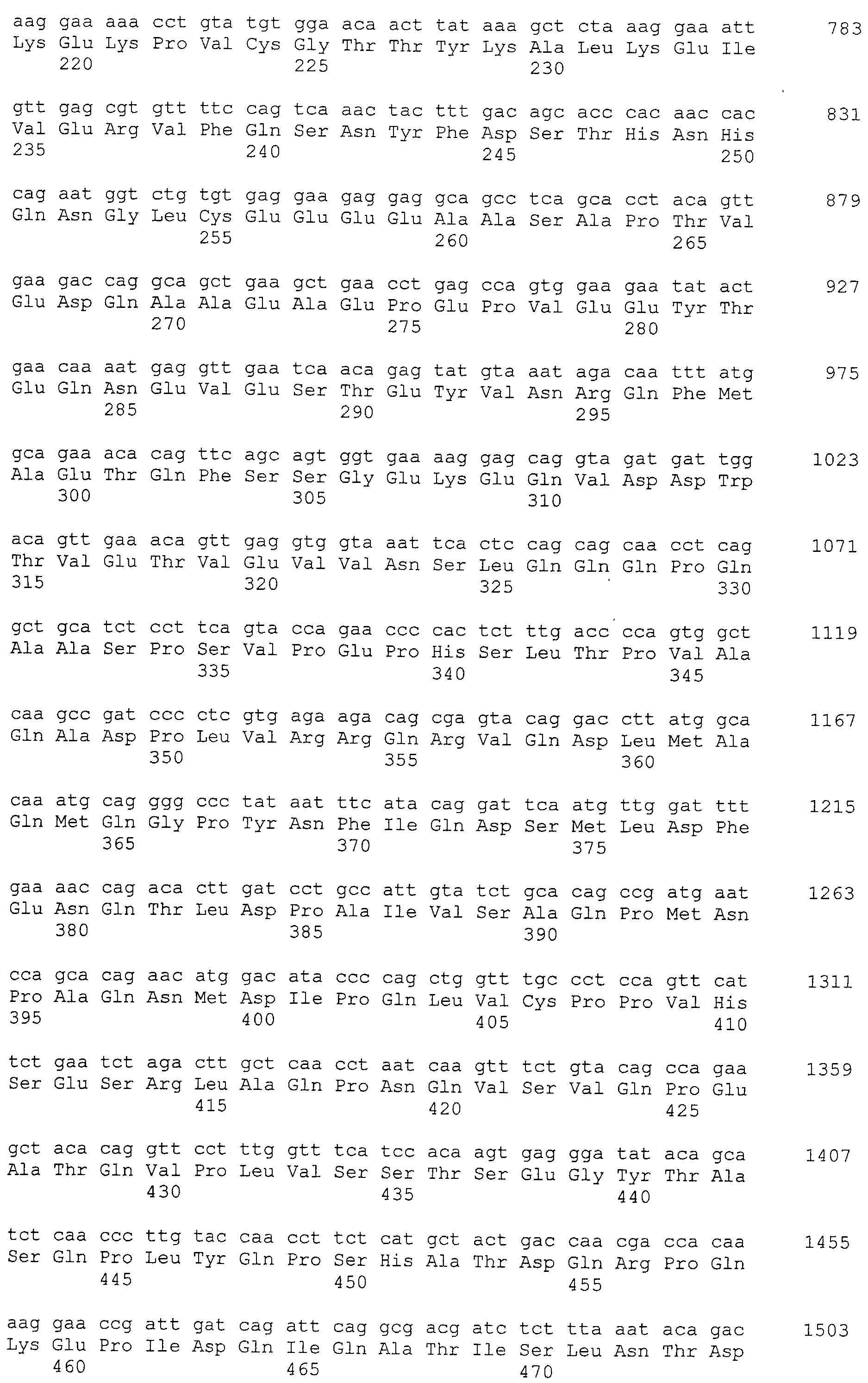
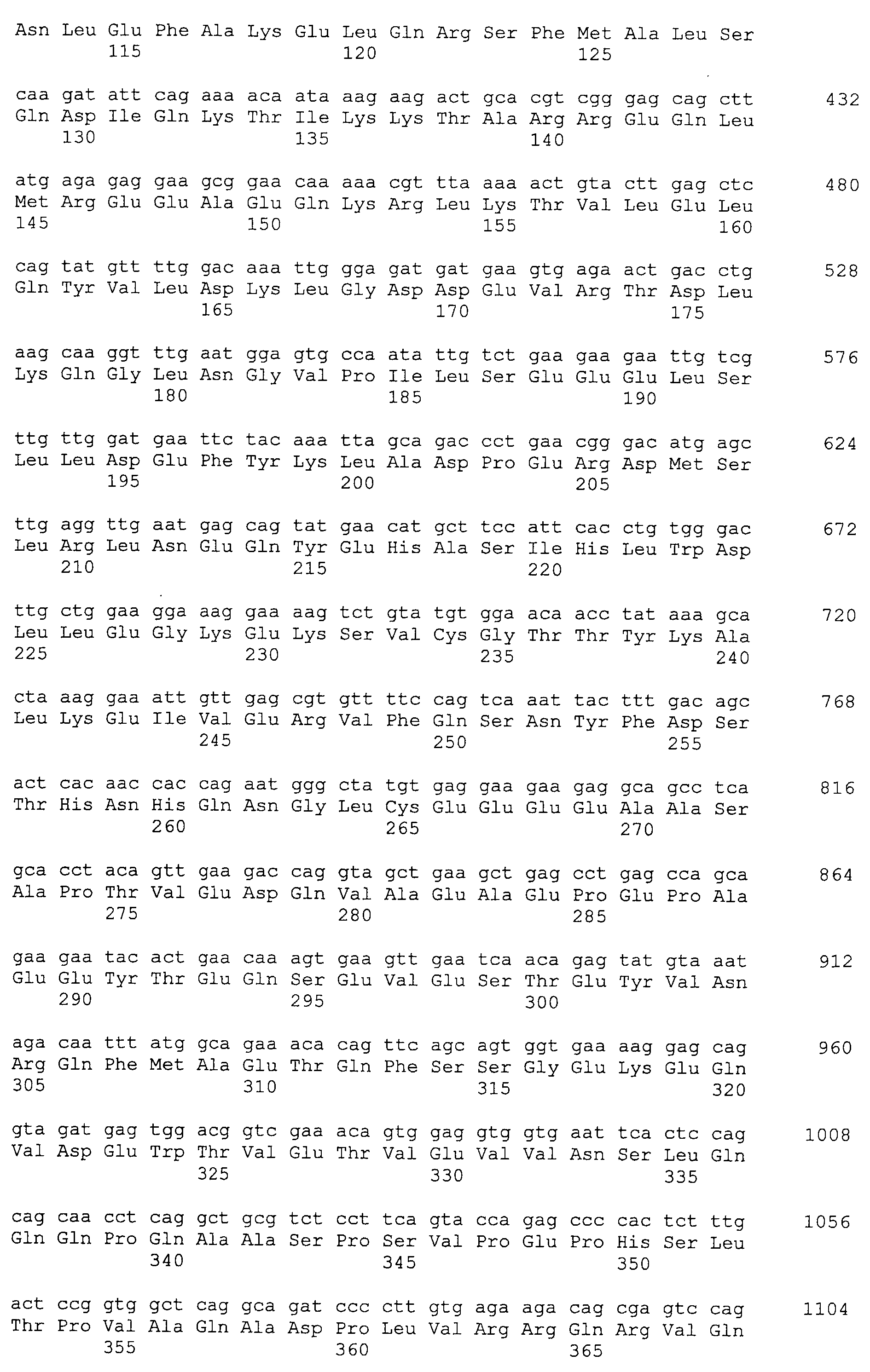
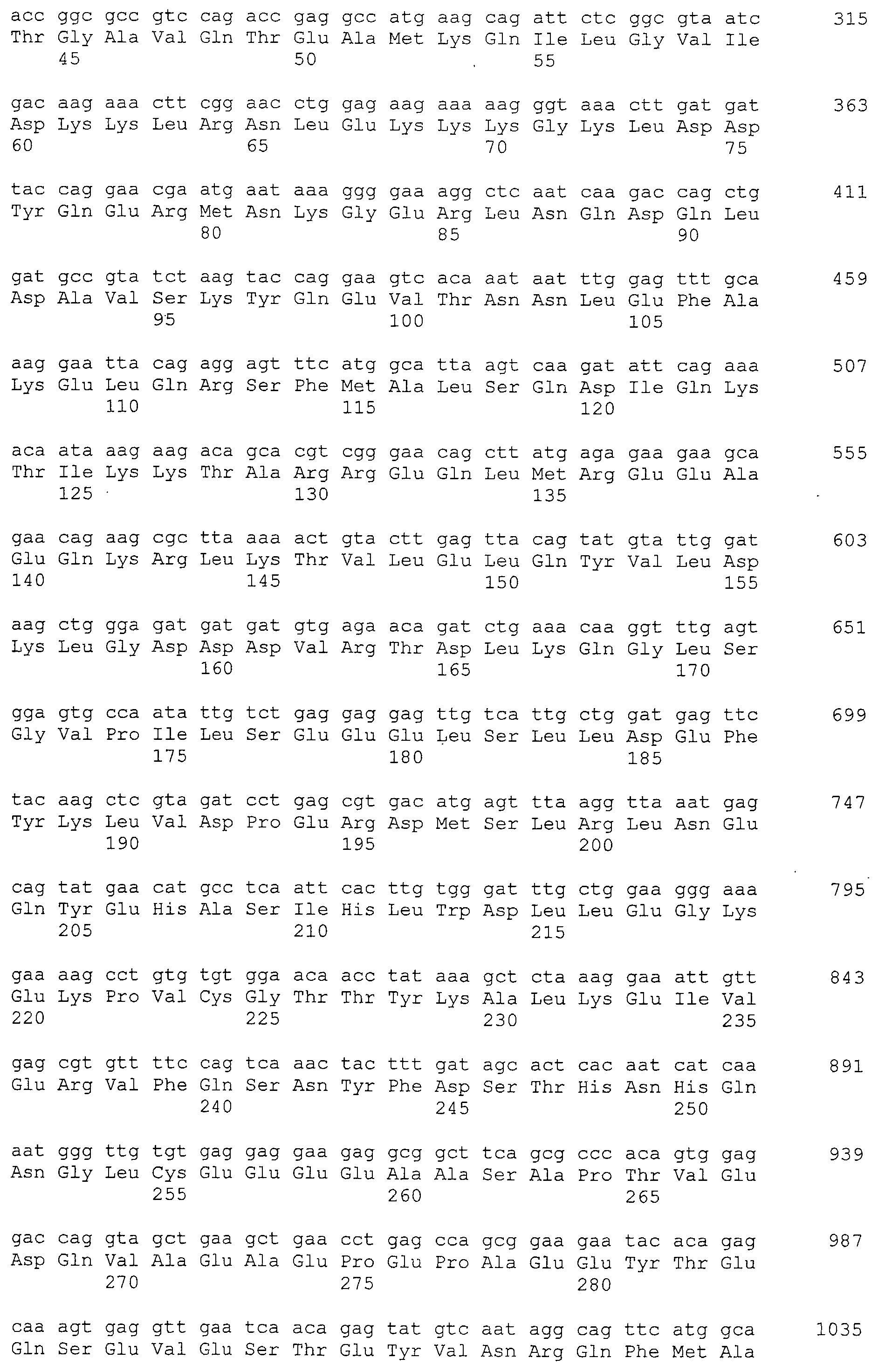
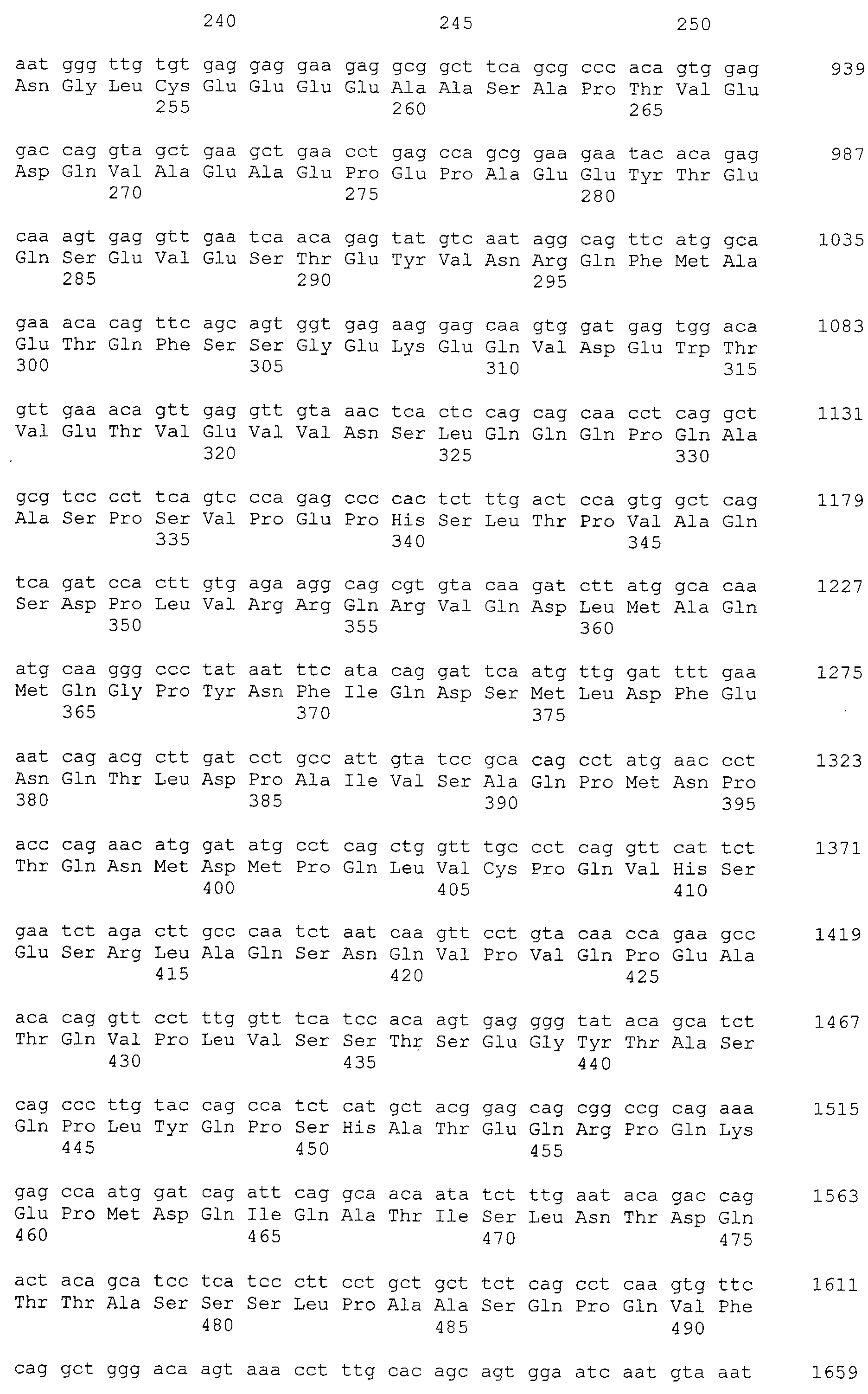
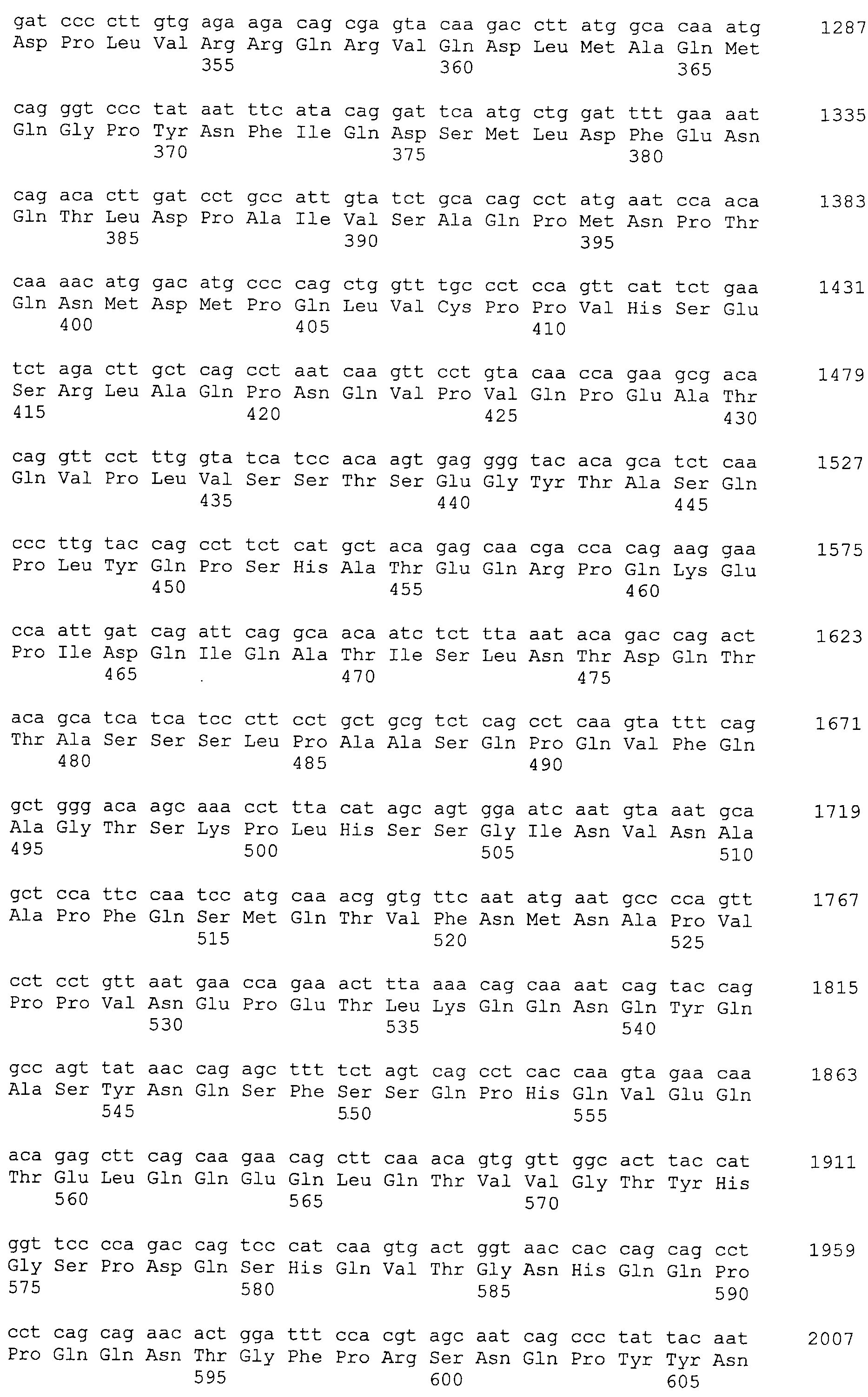
Настоящее изобретение относится к фармацевтической композиции для лечения и/или профилактики злокачественной опухоли, которая содержит в качестве активного ингредиента антитело или его фрагмент, обладающее иммунологической реактивностью в отношении белка CAPRIN-1, имеющего любую аминокислотную последовательность с четными номерами SEQ ID NO:2-30 или аминокислотную последовательность на 80% или более, предпочтительно, на 85% или более, более предпочтительно, на 90% или более, и более предпочтительно, на 95% или более идентичную любой аминокислотной последовательности с четными номерами SEQ ID NO:2-30, или фрагмента белка CAPRIN-1, содержащего 7 или более последовательных аминокислот.
В одном варианте осуществления настоящего изобретения, злокачественная опухоль представляет собой рак молочной железы, опухоль головного мозга, лейкоз, лимфому, рак легких, рак пищевода, рак толстой кишки, рак желудка или рак почек.
В другом варианте осуществления настоящего изобретения, антитело представляет собой моноклональное или поликлональное антитело.
В другом варианте осуществления настоящего изобретения, антитело представляет собой антитело человека, гуманизированное антитело, химерное антитело, одноцепочечное антитело или биспецифичное антитело.
В другом варианте осуществления настоящего изобретения, антитело представляет собой антитело, обладающее иммунологической реактивностью в отношении полипептида, имеющего аминокислотную последовательность, показанную в последовательности SEQ ID NO: 37 или SEQ ID NO: 136, или аминокислотную последовательность на 80% или более, предпочтительно, на 85% или более, более предпочтительно, на 90% или более, и, еще более предпочтительно, на 95% или более идентичную аминокислотной последовательности или фрагмента этого полипептида.
В другом варианте осуществления настоящего изобретения, в фармацевтической композиции для лечения и/или профилактики злокачественной опухоли, содержащей антитело в качестве активного ингредиента, указанное выше антитело представляет собой любое из антител с (a) по (k), описанное ниже, и обладает иммунологической реактивностью в отношении белка CAPRIN-1.
(a) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:40, 41 и 42 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO:44, 45, и 46.
(b) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:40, 41, и 42 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO:50, 51, и 52.
(c) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:40, 41, и 42 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO:55, 56, и 57.
(d) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:40, 41, и 42 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO:60, 61, и 62.
(e) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:40, 41 и 42 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO:65, 66 и 67.
(f) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:70, 71 и 72 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO:74, 75 и 76.
(g) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:80, 81 и 82 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO: 84, 85 и 86.
(h) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO:90, 91 и 92 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO: 94, 95 и 96.
(i) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO: 100, 101 и 102 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO: 104, 105 и 106.
(j) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO: 110, 111 и 112 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO: 114, 115 и 116.
(k) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности, показанные в SEQ ID NO: 120, 121 и 122 и вариабельную область легкой цепи, содержащую последовательности, показанные в SEQ ID NO: 124, 125 и 126.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Антитела против CAPRIN-1, используемые в настоящем изобретении, повреждают (или поражают) злокачественные клетки. Следовательно, такие антитела против CAPRIN-1 применимы для лечения или профилактики злокачественных опухолей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
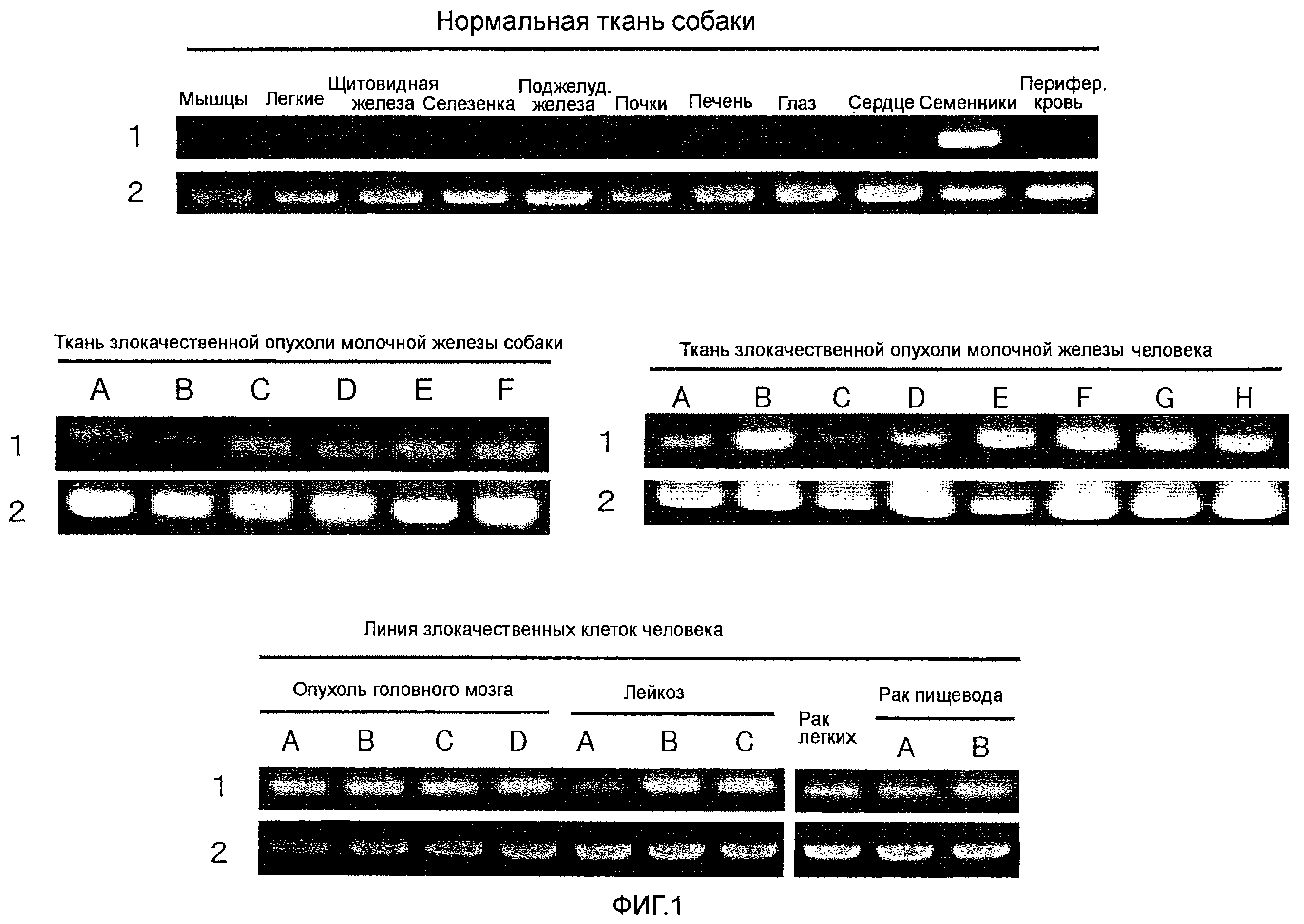
На Фиг. 1 показаны профили экспрессии генов, кодирующих белки CAPRIN-1 в нормальных тканях и линиях опухолевых клеток. На этой фигуре ссылка №1 показывает профиль экспрессии каждого гена, кодирующего CAPRIN-1, и ссылка №2 показывает профиль экспрессии гена GAPDH.
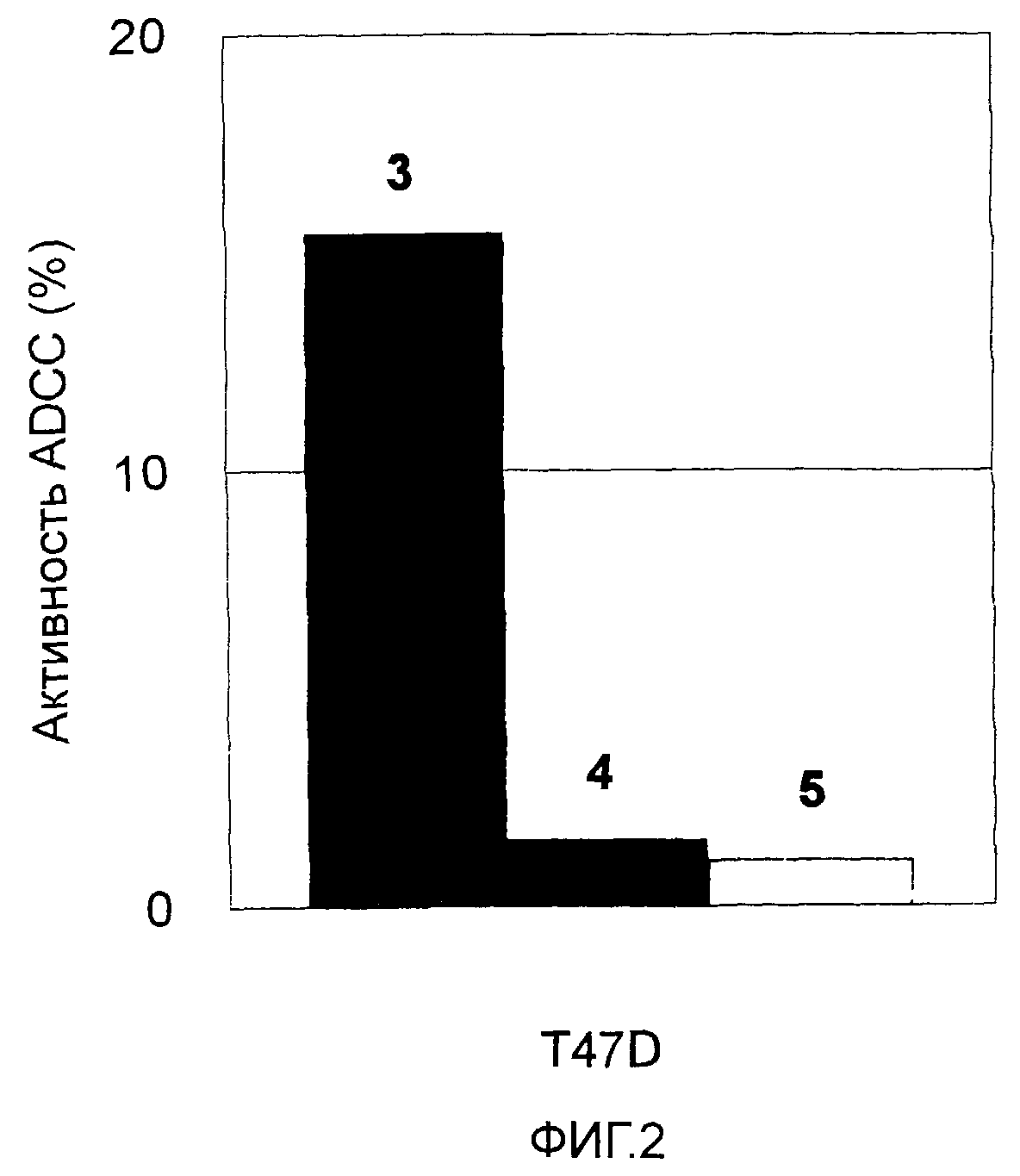
На Фиг. 2 показана цитотоксическая активность антитела против CAPRIN-1 (или антитела против CAPRIN-1) в отношении линии злокачественных клеток молочной железы, экспрессирующих ген CAPRIN-1 (T47D). На этой фигуре ссылка №3 показывает активность после добавления антитела против CAPRIN-1, ссылка №4 показывает активность после добавления контрольного антитела, и ссылка №5 показывает активность в отсутствие какого-либо антитела.
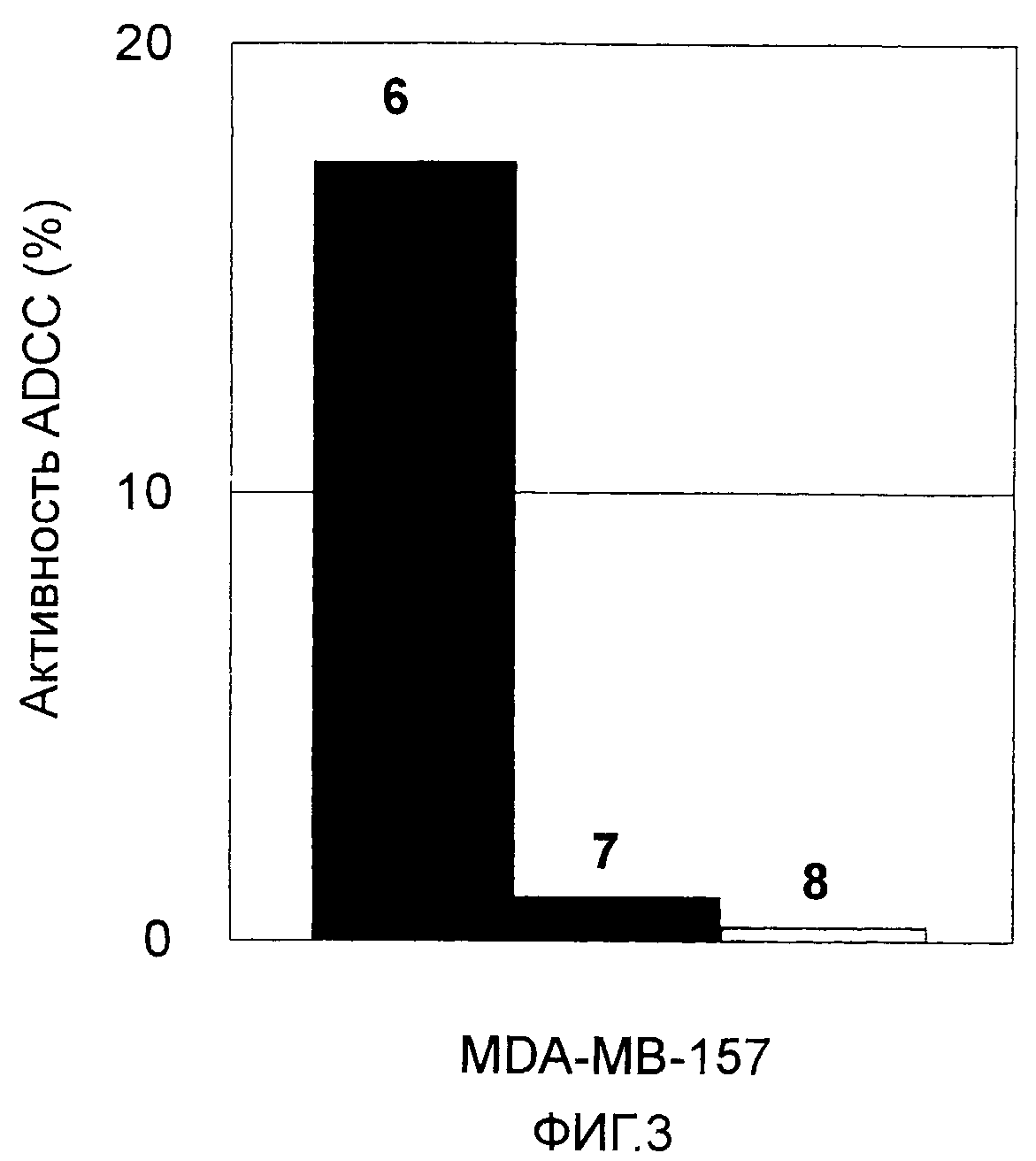
На Фиг. 3 показана цитотоксическая активность антитела против CAPRIN-1 (или антитела против CAPRIN-1) в отношении линии злокачественных клеток молочной железы, экспрессирующих ген CAPRIN-1 (MDA-MB-157). На этой фигуре ссылка №6 показывает активность после добавления антитела против CAPRIN-1, ссылка №7 показывает активность после добавления контрольного антитела, и ссылка №8 показывает активность в отсутствие какого-либо антитела.
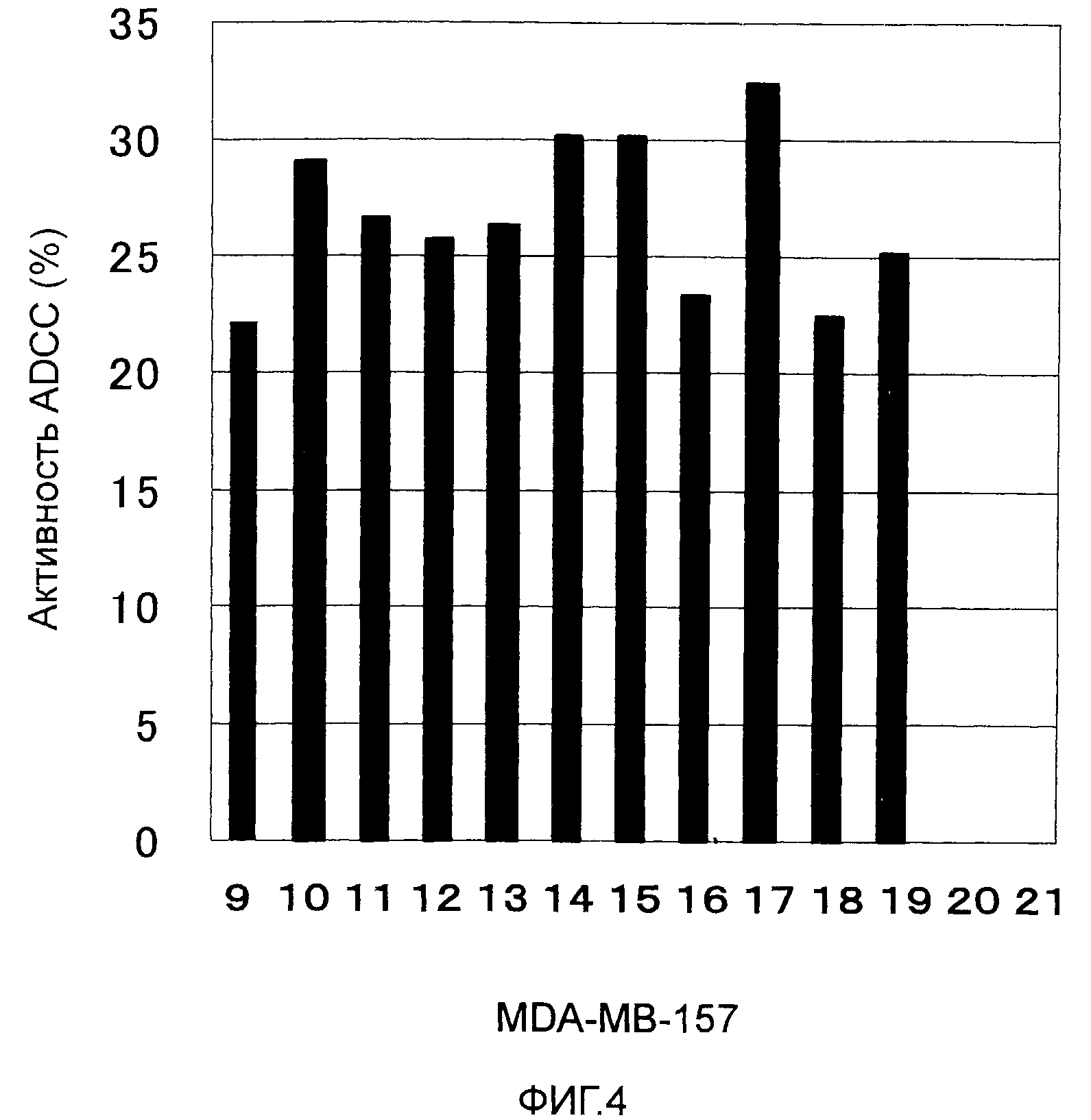
На Фиг. 4 показана цитотоксичность в отношении линии злокачественных клеток молочной железы MDA-MB-157, экспрессирующих CAPRIN-1, где цитотоксичность демонстрируется моноклональными антителами против CAPRIN-1 (т.е. моноклональными антителами #1-#11), которые являются реакционноспособными в отношении поверхности злокачественной клетки. В частности, на этой фигуре показаны уровни активности после добавления моноклонального антитела против CAPRIN-1 #1 (ссылка №9), моноклонального антитела против CAPRIN-1 #2 (ссылка №10), моноклонального антитела против CAPRIN-1 #3 (ссылка №11), моноклонального антитела против CAPRIN-1 #4 (ссылка №12), моноклонального антитела против CAPRIN-1 #5 (ссылка №13), моноклонального антитела против CAPRIN-1 #6 (ссылка №14), моноклонального антитела против CAPRIN-1 #7 (ссылка №15), моноклонального антитела против CAPRIN-1 #8 (ссылка №16), моноклонального антитела против CAPRIN-1 #9 (ссылка №17), моноклонального антитела против CAPRIN-1 #10 (ссылка №18), и моноклонального антитела против CAPRIN-1 #11 (ссылка №19), уровень активности после добавления моноклонального антитела, взаимодействующего с самим белком CAPRIN-1, но не с поверхностью злокачественной клетки (ссылка №20), и уровень активности после добавления PBS вместо каждого антитела (ссылка №21).
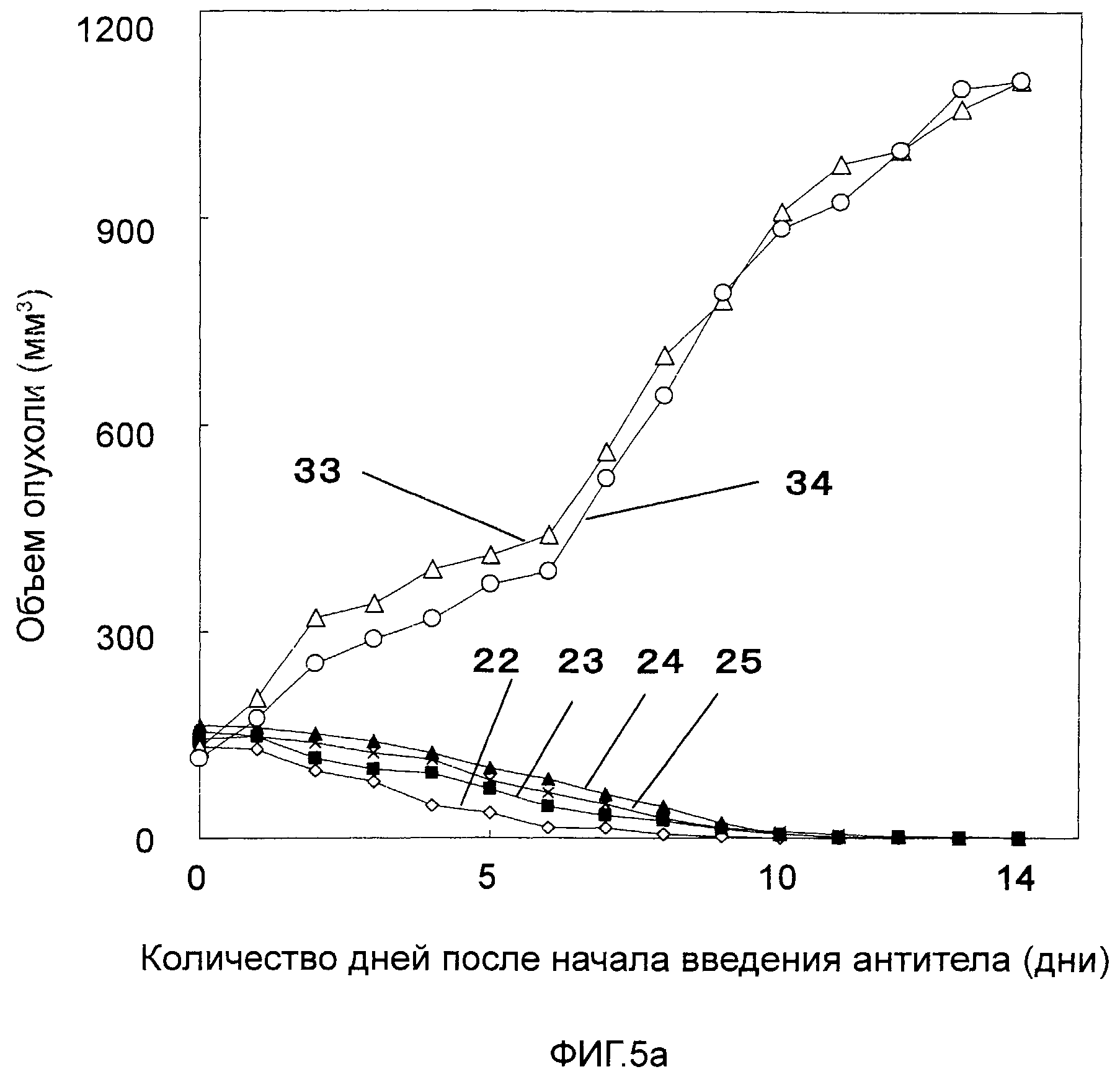
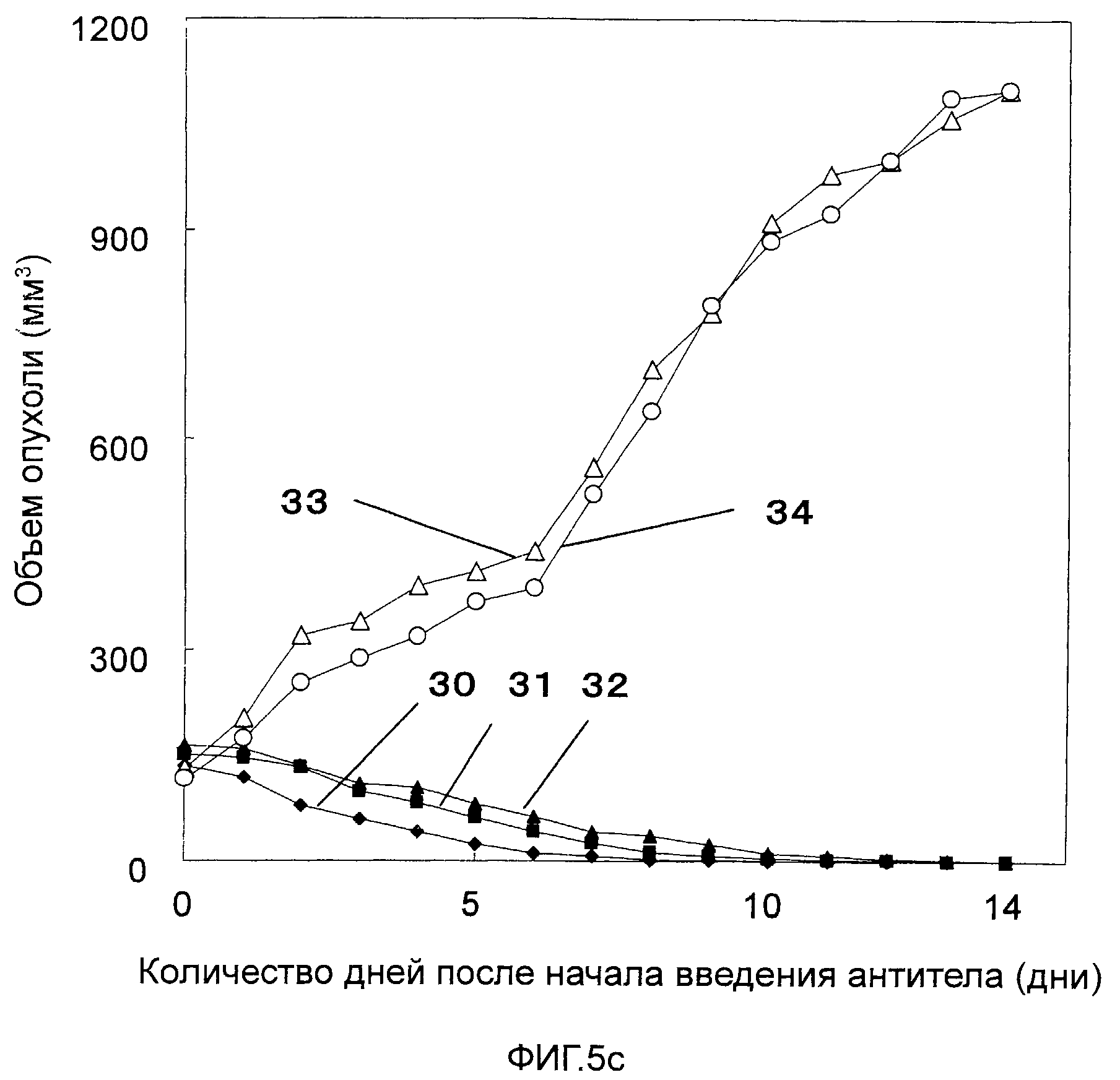
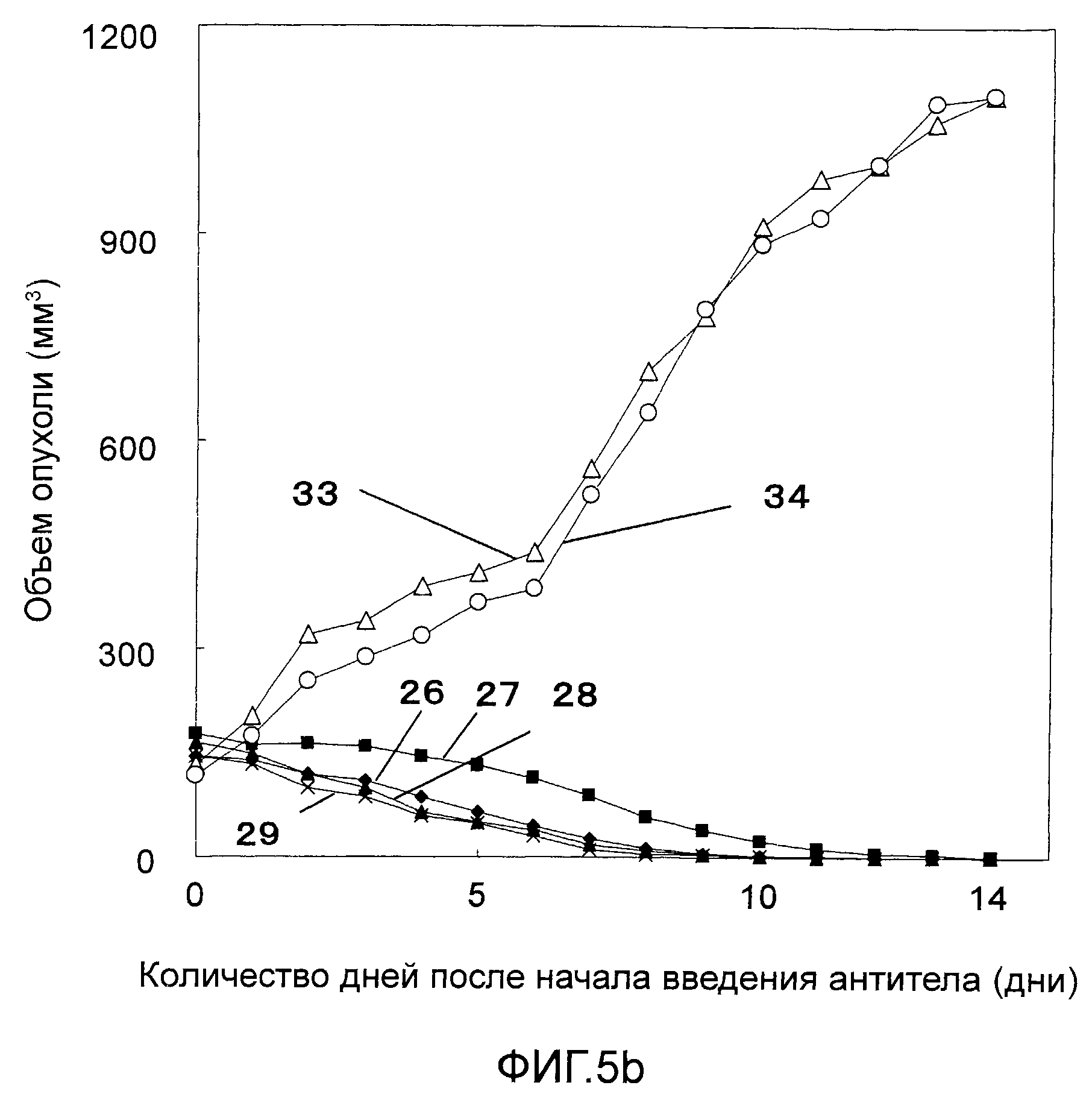
На Фигурах 5a-5c показано противоопухолевое действие моноклональных антител против CAPRIN-1 (т.е., моноклональных антител #1-#11), взаимодействующих с поверхностью злокачественной клетки, у мышей Balb/c, которым трансплантировали линию клеток саркомы мышей CT26, экспрессирующих CAPRIN-1. На этих фигурах показаны размеры опухоли у мышей после введения моноклонального антитела против CAPRIN-1 #1 (ссылка №22), моноклонального антитела против CAPRIN-1 #2 (ссылка №23), моноклонального антитела против CAPRIN-1 #3 (ссылка №24), моноклонального антитела против CAPRIN-1 #4 (ссылка №25), моноклонального антитела против CAPRIN-1 #5 (ссылка №26), моноклонального антитела против CAPRIN-1 #6 (ссылка №27), моноклонального антитела против CAPRIN-1 #7 (ссылка №28), моноклонального антитела против CAPRIN-1 #8 (ссылка №29), моноклонального антитела против CAPRIN-1 #9 (ссылка №30), моноклонального антитела против CAPRIN-1 #10 (ссылка №31), и моноклонального антитела против CAPRIN-1 #11 (ссылка №32), размер опухоли у мышей после введения моноклонального антитела, взаимодействующего с самим белком CAPRIN-1, а не с поверхностью злокачественной клетки (ссылка №33), и размер опухоли у мышей после введения PBS вместо каждого антитела (ссылка №34).
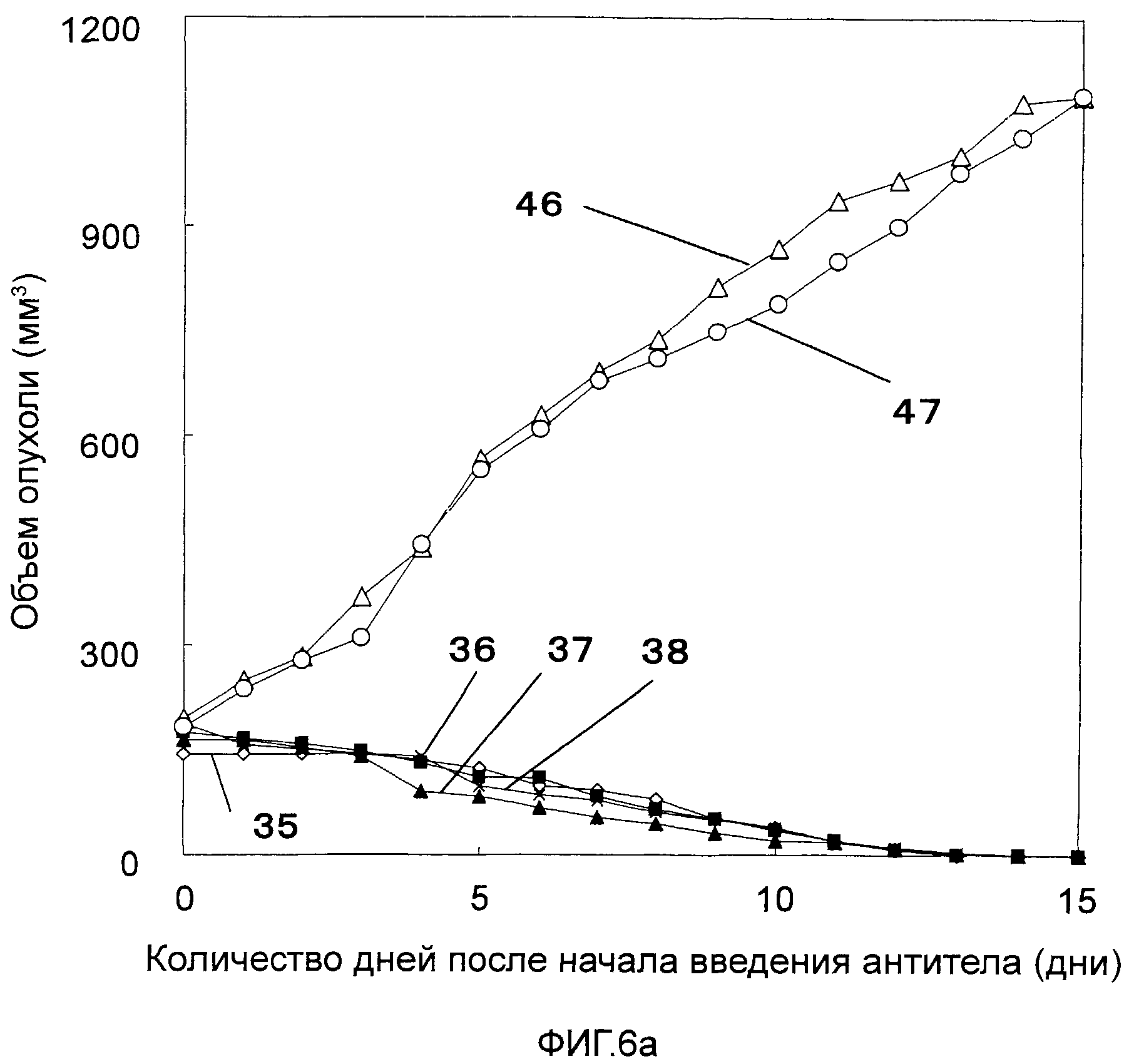
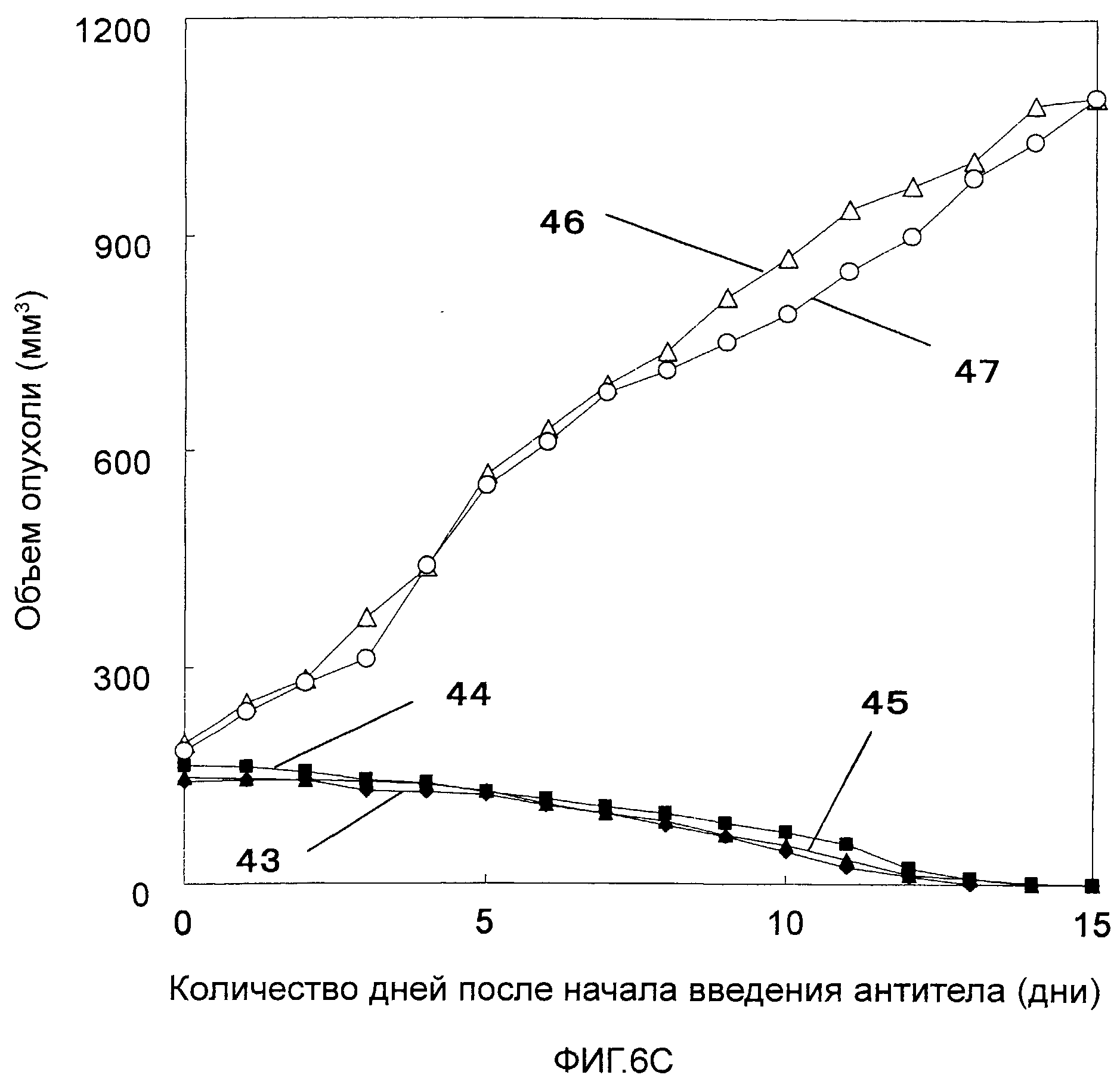
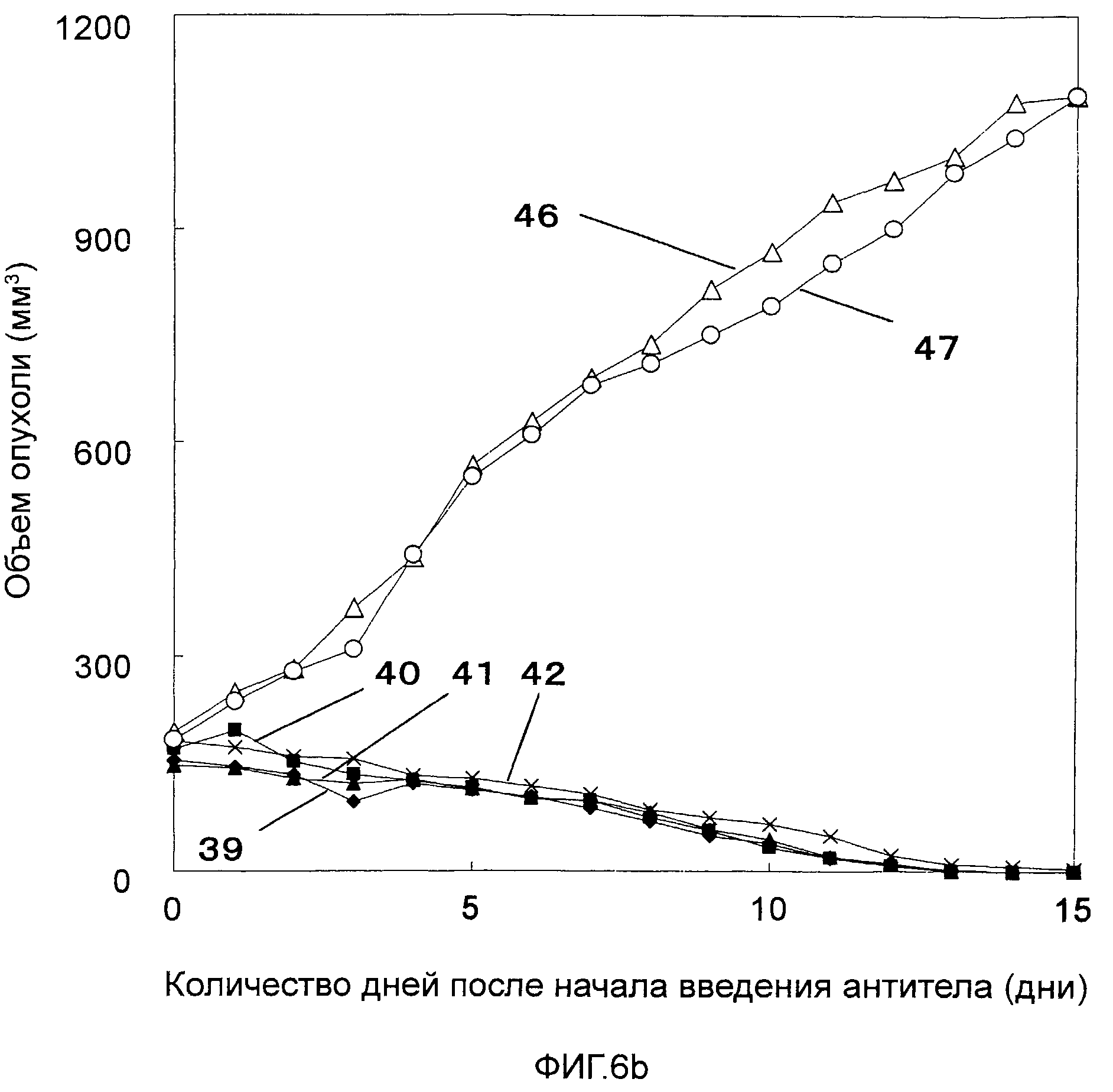
На Фигурах 6a-6c показано противоопухолевое действие моноклональных антител против CAPRIN-1 (т.е. моноклональных антител #1-#11), взаимодействующих с поверхностью злокачественной клетки, у мышей Balb/c, которым были трансплантированы клетки карциномы мышей линии N1E, экспрессирующих CAPRIN-1. На этих фигурах показаны размеры опухоли у мышей после введения моноклонального антитела против CAPRIN-1 #1 (ссылка №35), моноклонального антитела против CAPRIN-1 #2 (ссылка №36), моноклонального антитела против CAPRIN-1 #3 (ссылка №37), моноклонального антитела против CAPRIN-1 #4 (ссылка №38), моноклонального антитела против CAPRIN-1 #5 (ссылка №39), моноклонального антитела против CAPRIN-1 #6 (ссылка №40), моноклонального антитела против CAPRIN-1 #7 (ссылка №41), моноклонального антитела против CAPRIN-1 #8 (ссылка №42), моноклонального антитела против CAPRIN-1 #9 (ссылка №43), моноклонального антитела против CAPRIN-1 #10 (ссылка №44), и моноклонального антитела против CAPRIN-1 #11 (ссылка №45), размер опухоли у мышей после введения моноклонального антитела, взаимодействующего с самим белком CAPRIN-1, а не с поверхностью злокачественной клетки (ссылка №46), и размер опухоли у мышей после введения PBS вместо каждого антитела (ссылка №47).
СПОСОБ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Как описано ниже, противоопухолевая активность антител против полипептида с любой последовательностью с четными номерами SEQ ID NO:2-30, использованных в настоящем изобретении, может определяться путем исследования in vivo ингибирования опухолевого роста у животного с опухолью, или путем исследования in vitro проявляется или, или нет иммуноцит- или комплемент-опосредованная цитотоксическая активность против опухолевых клеток, экспрессирующих этот полипептид.
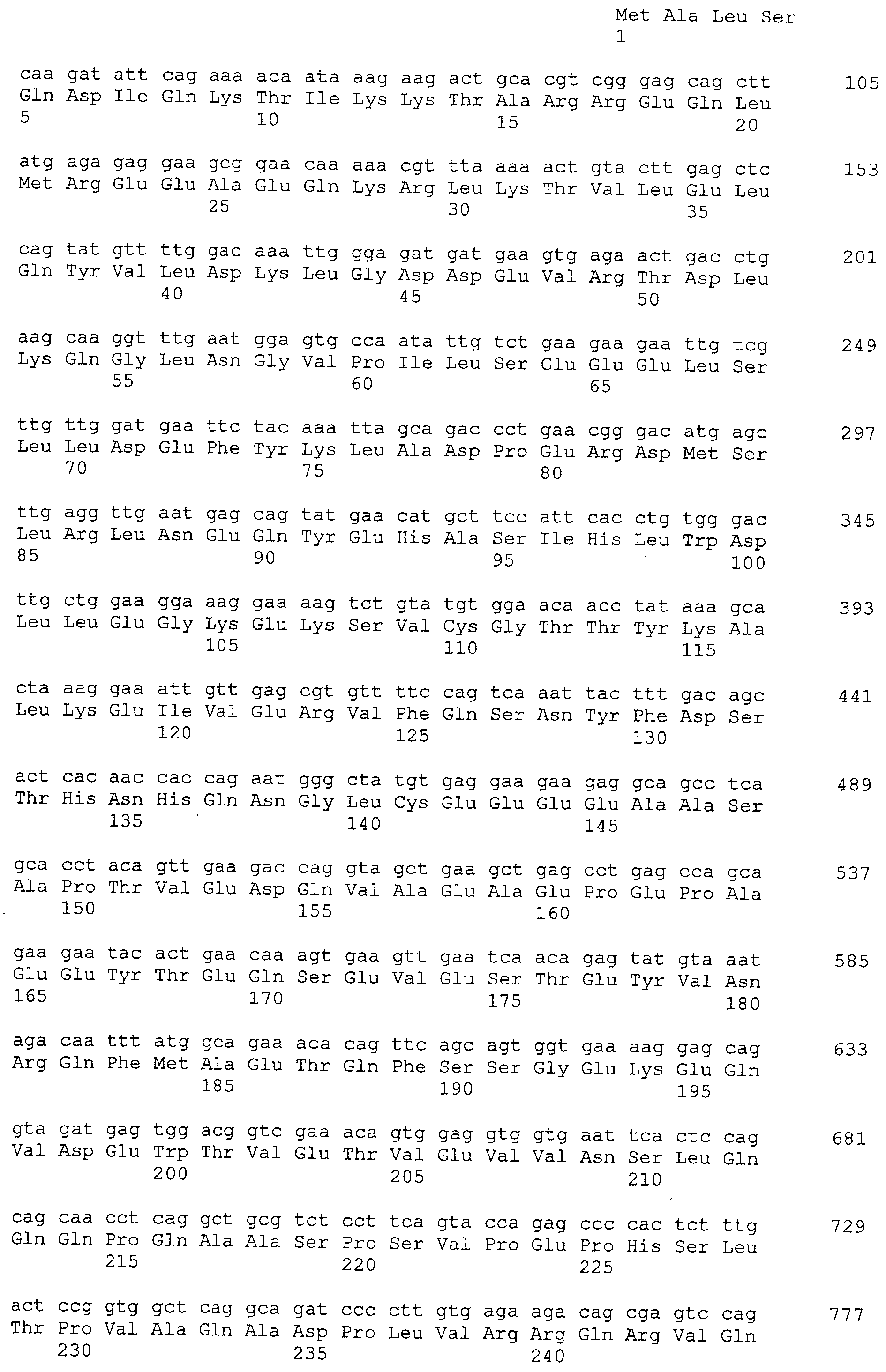
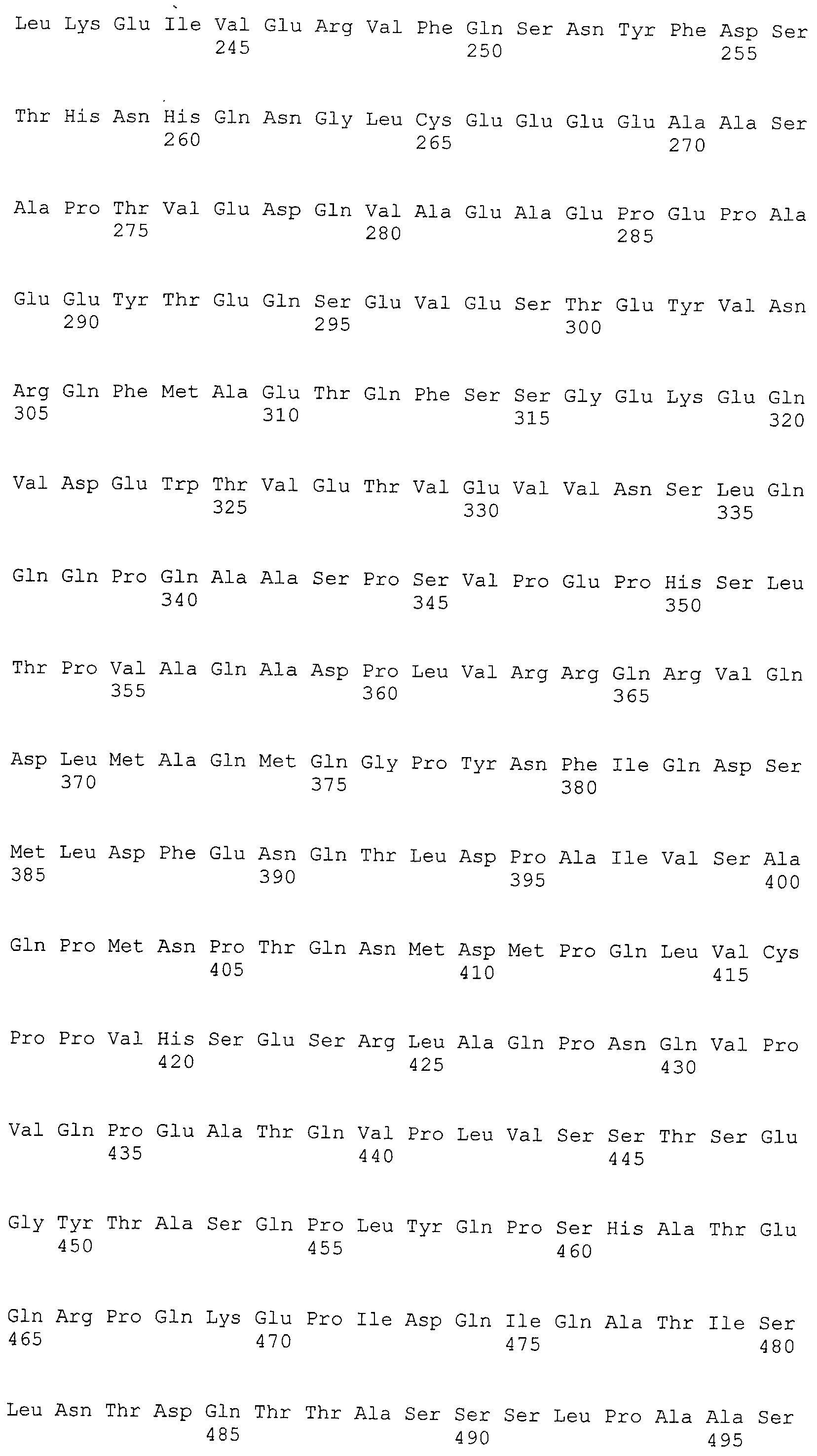
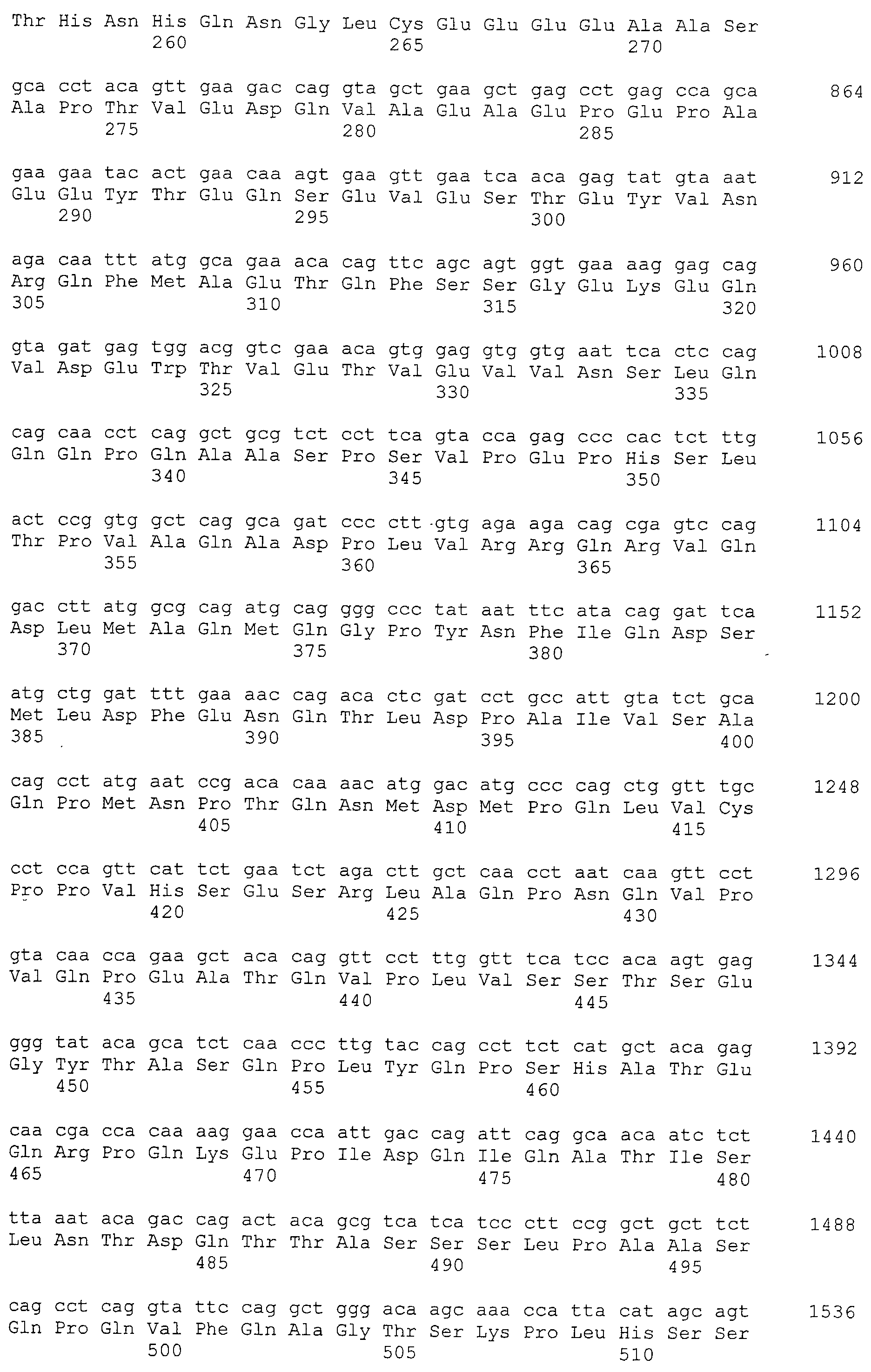
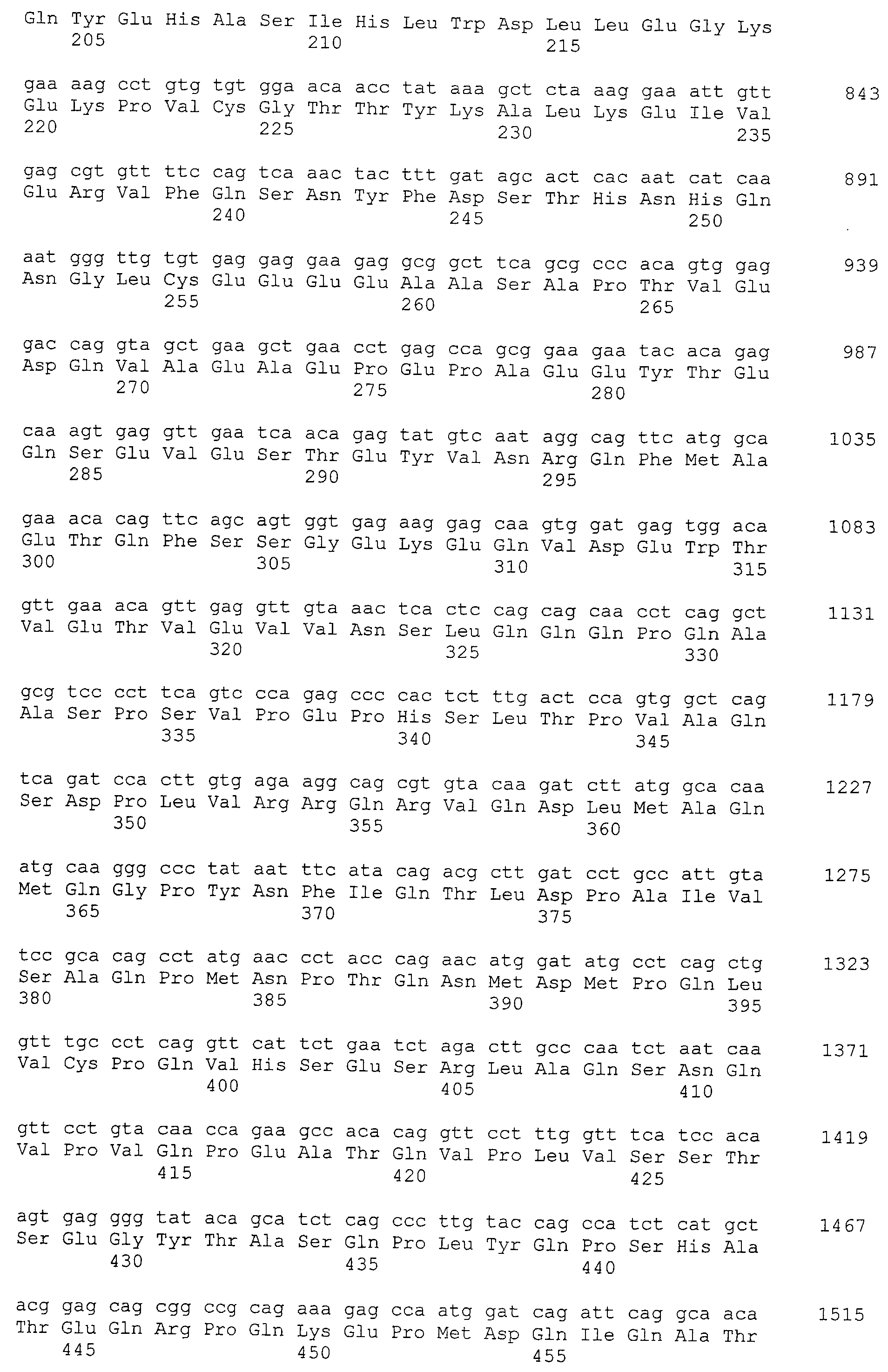
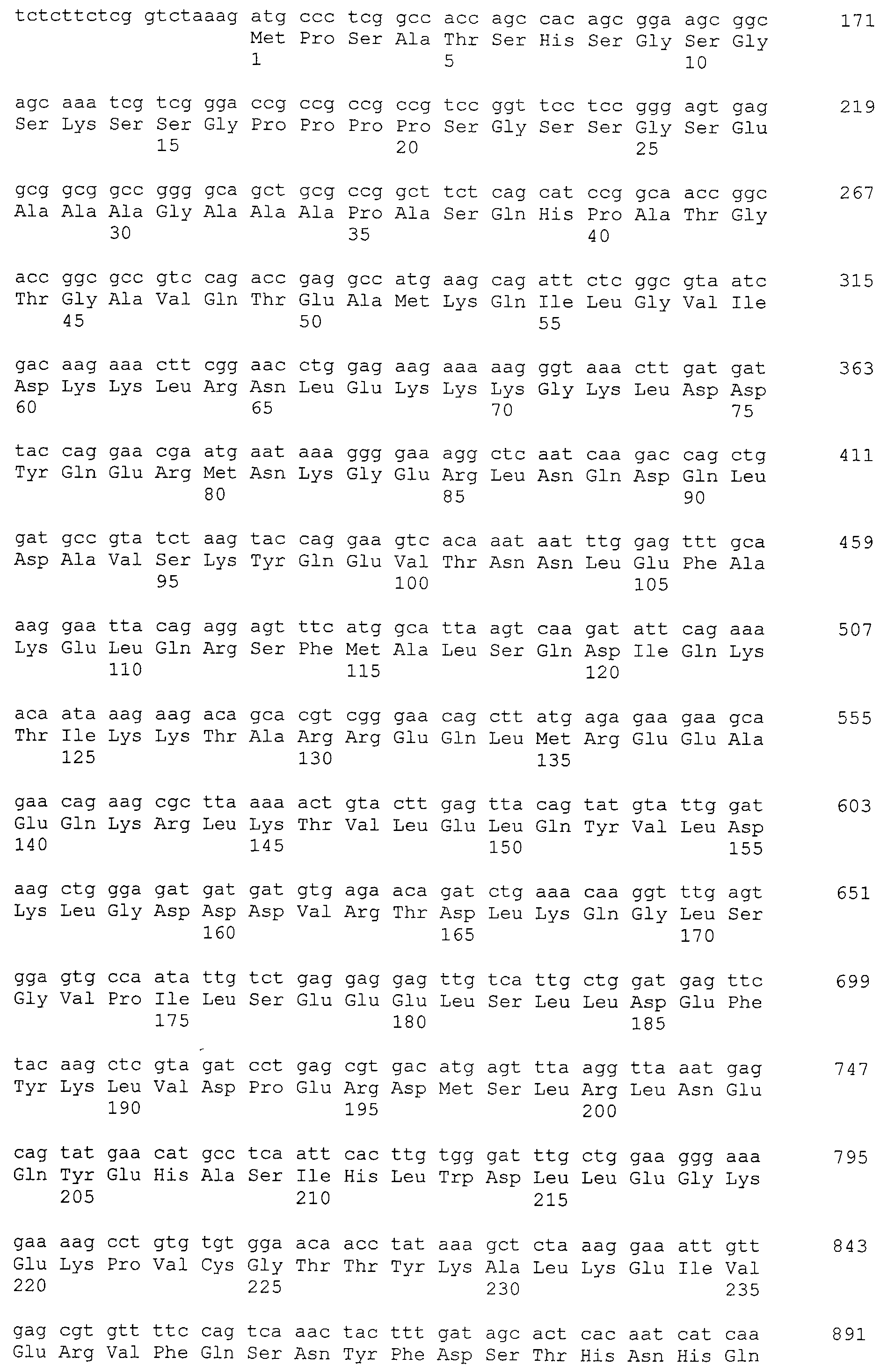
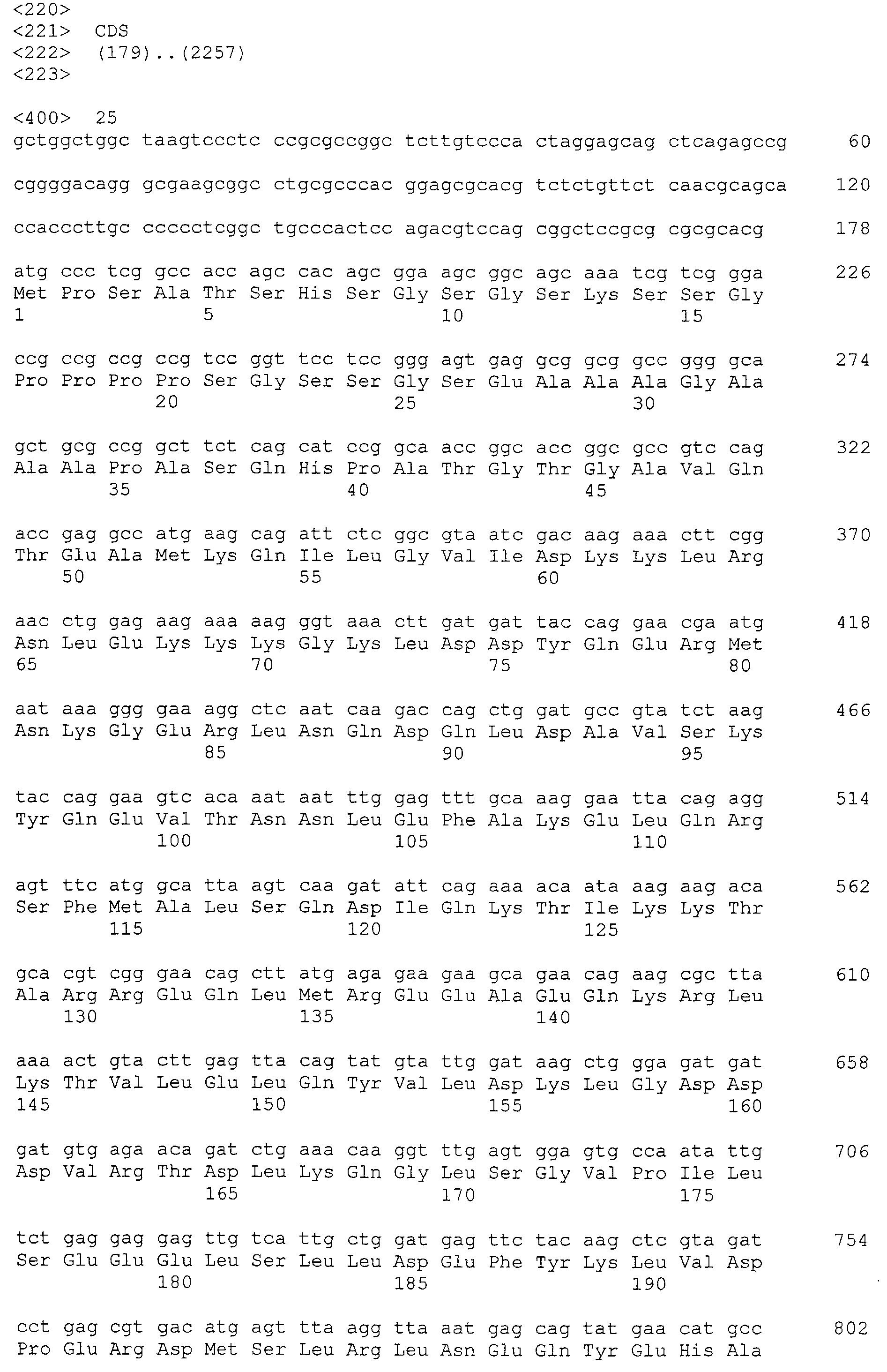
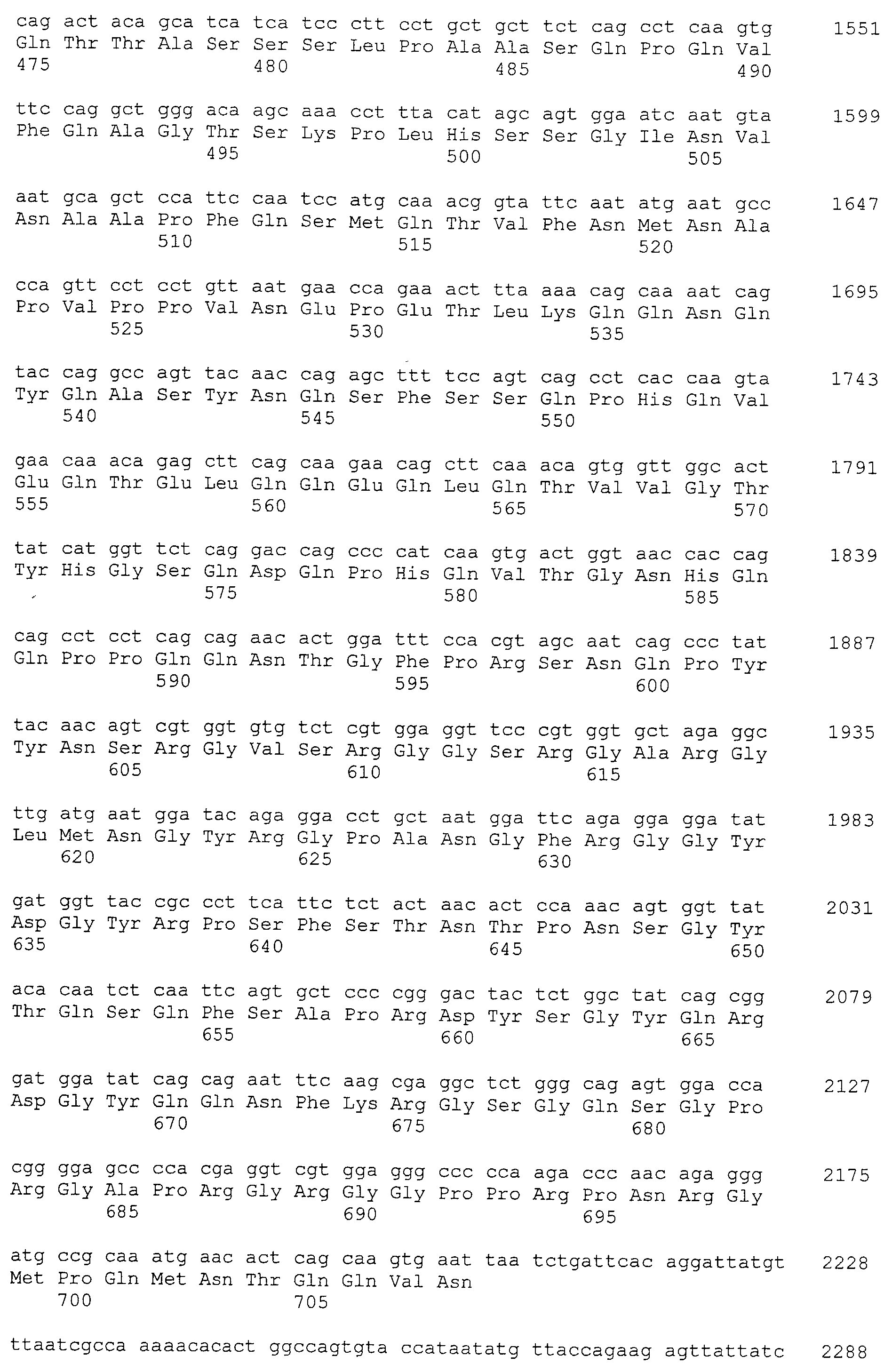
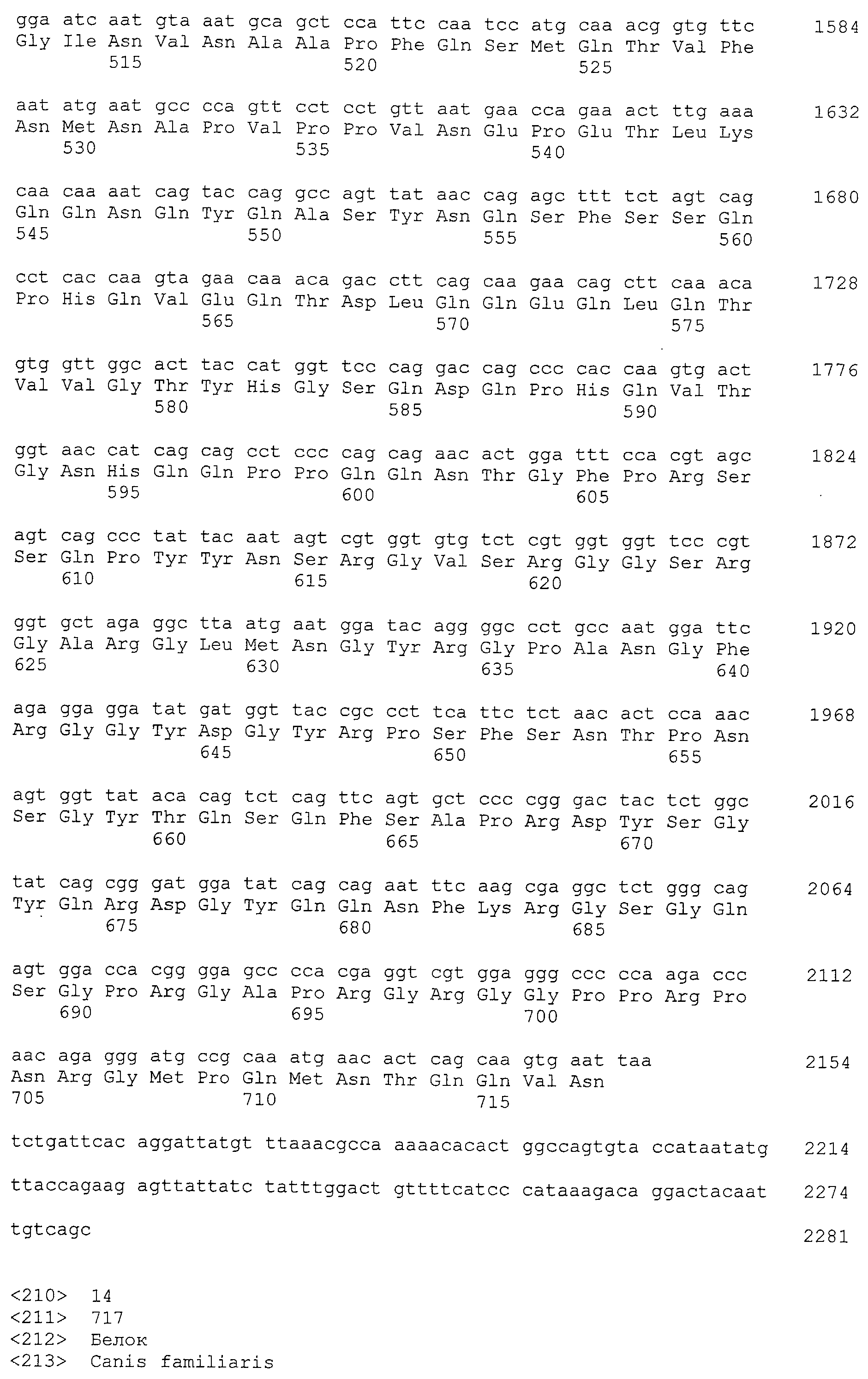
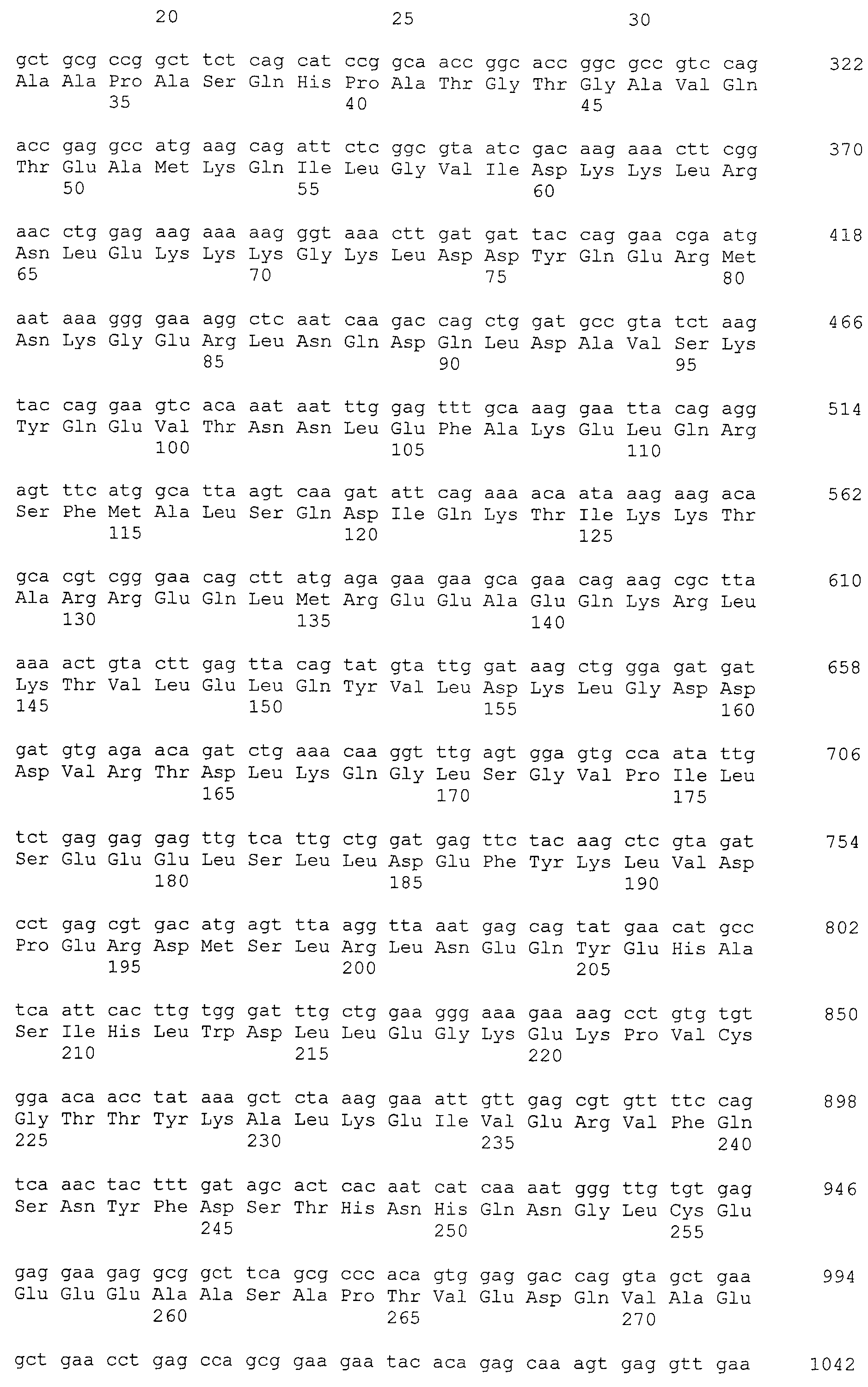
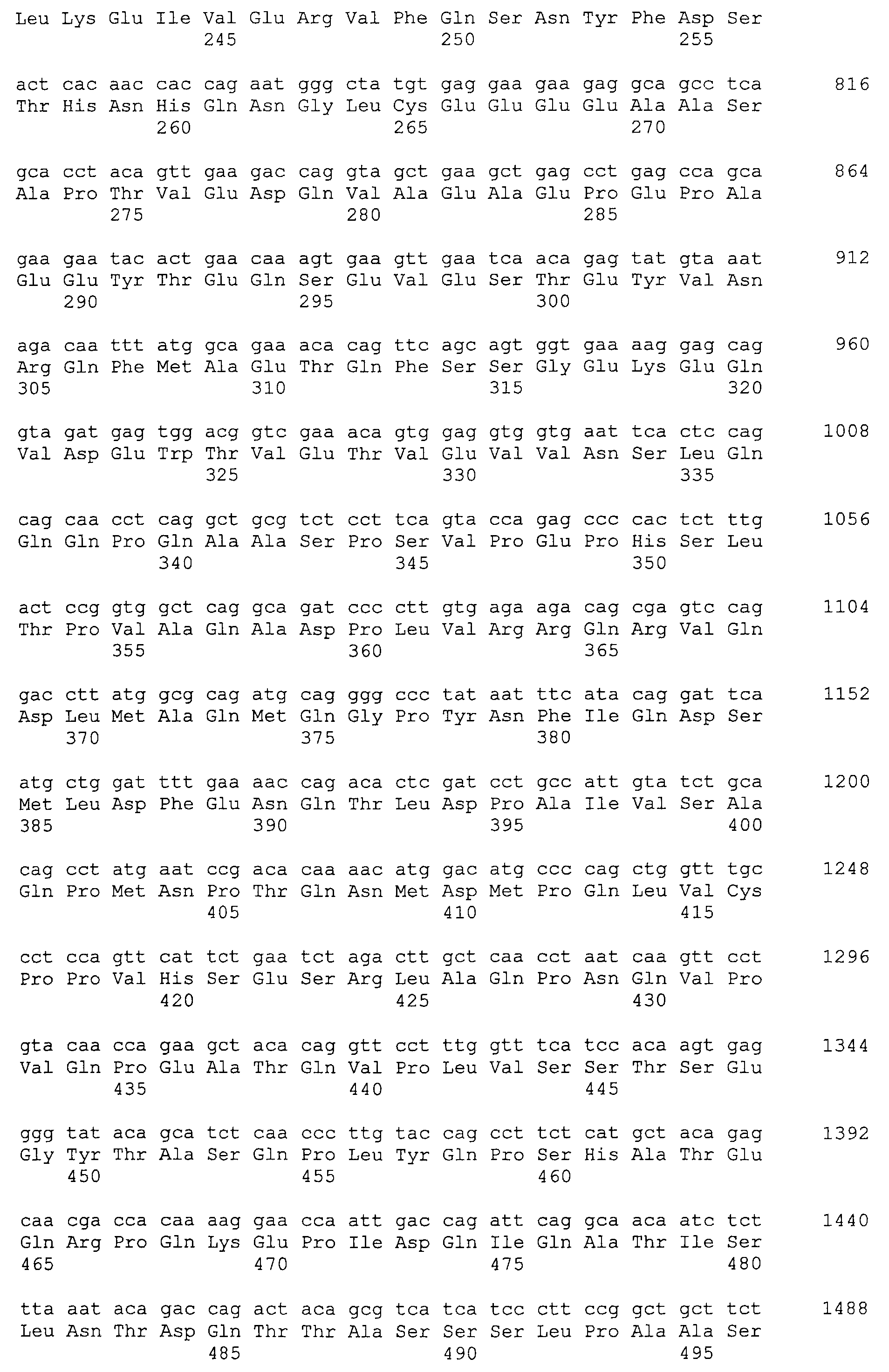
Кроме того, нуклеотидные последовательности полипептидов, кодирующих эти белки, состоящие из аминокислотных последовательностей с четными номерами SEQ ID NO: 2-30 (т.е., SEQ ID NO:2, 4, 6…28 и 30) показаны в последовательностях с нечетными номерами SEQ ID NO:1-29 (т.е., SEQ ID NO:1, 3, 5…27 и 29), соответственно.
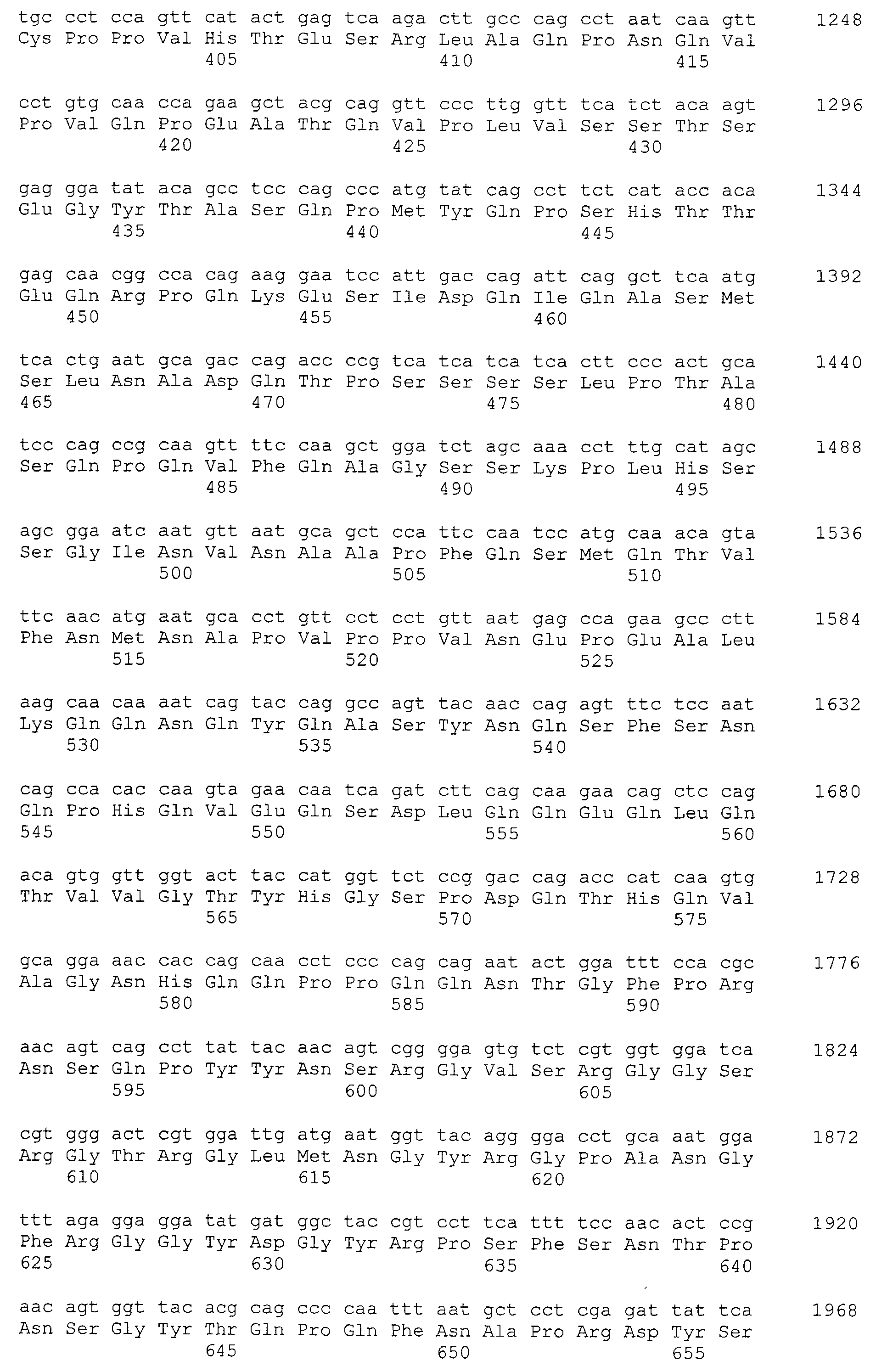
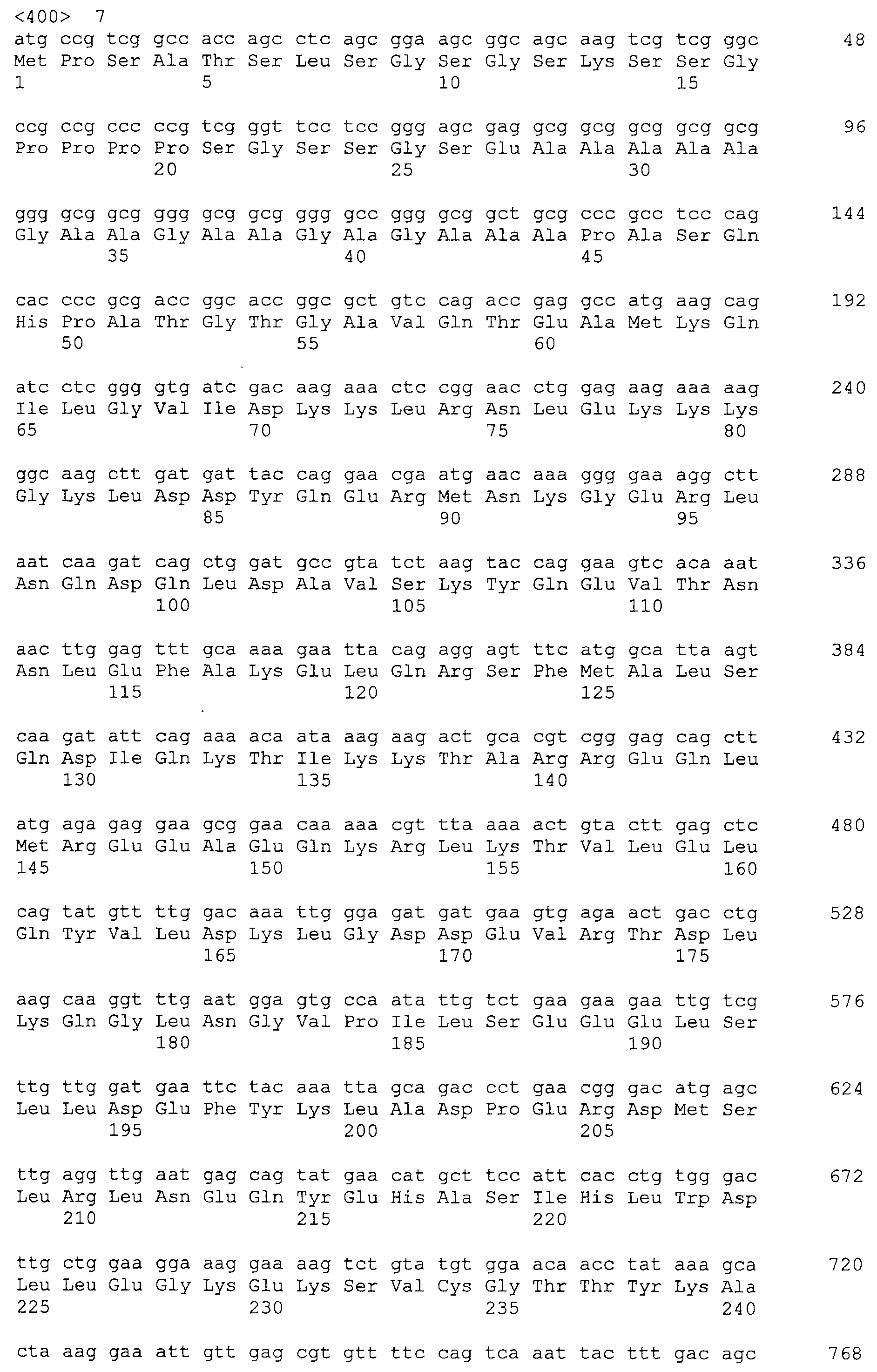
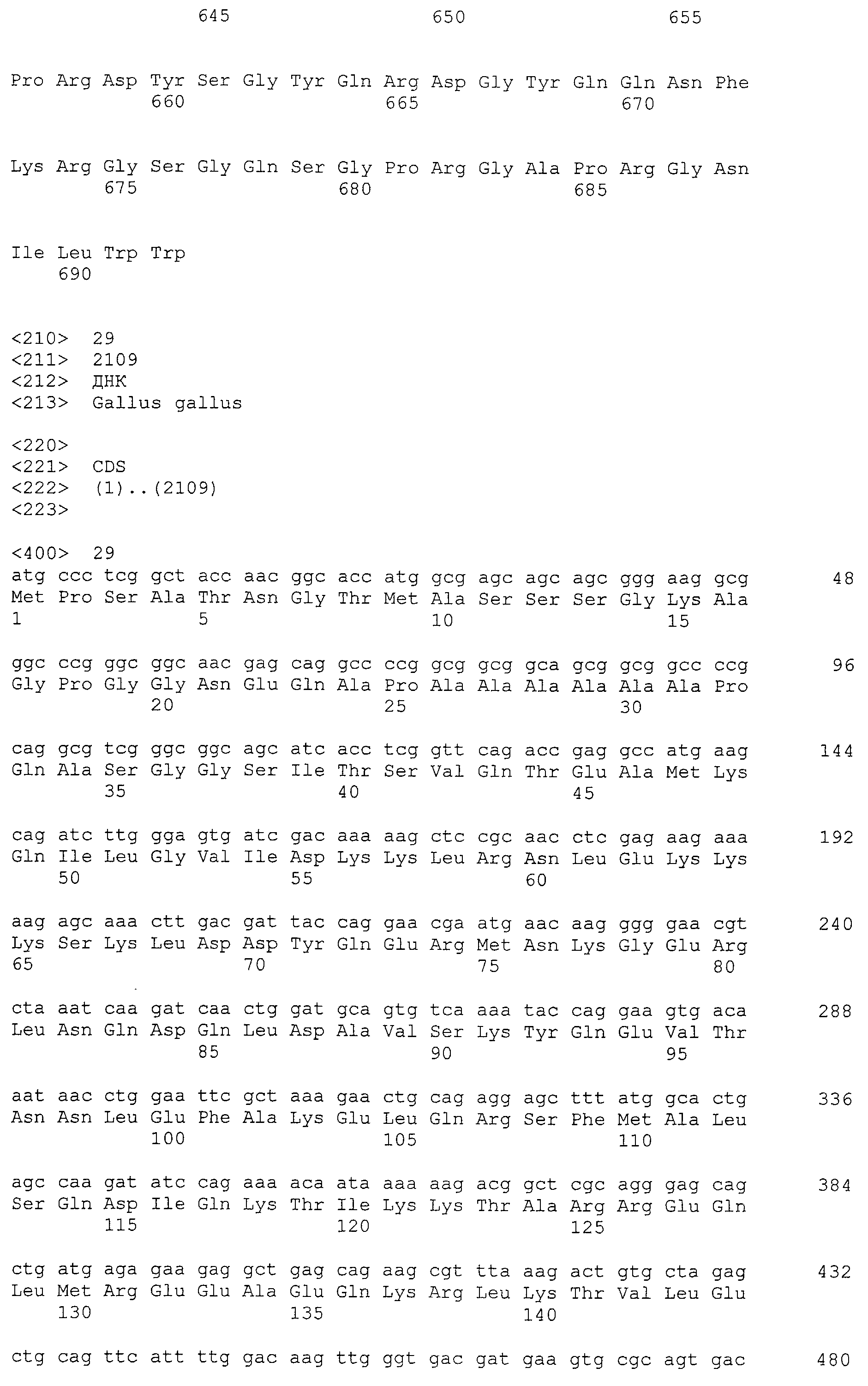
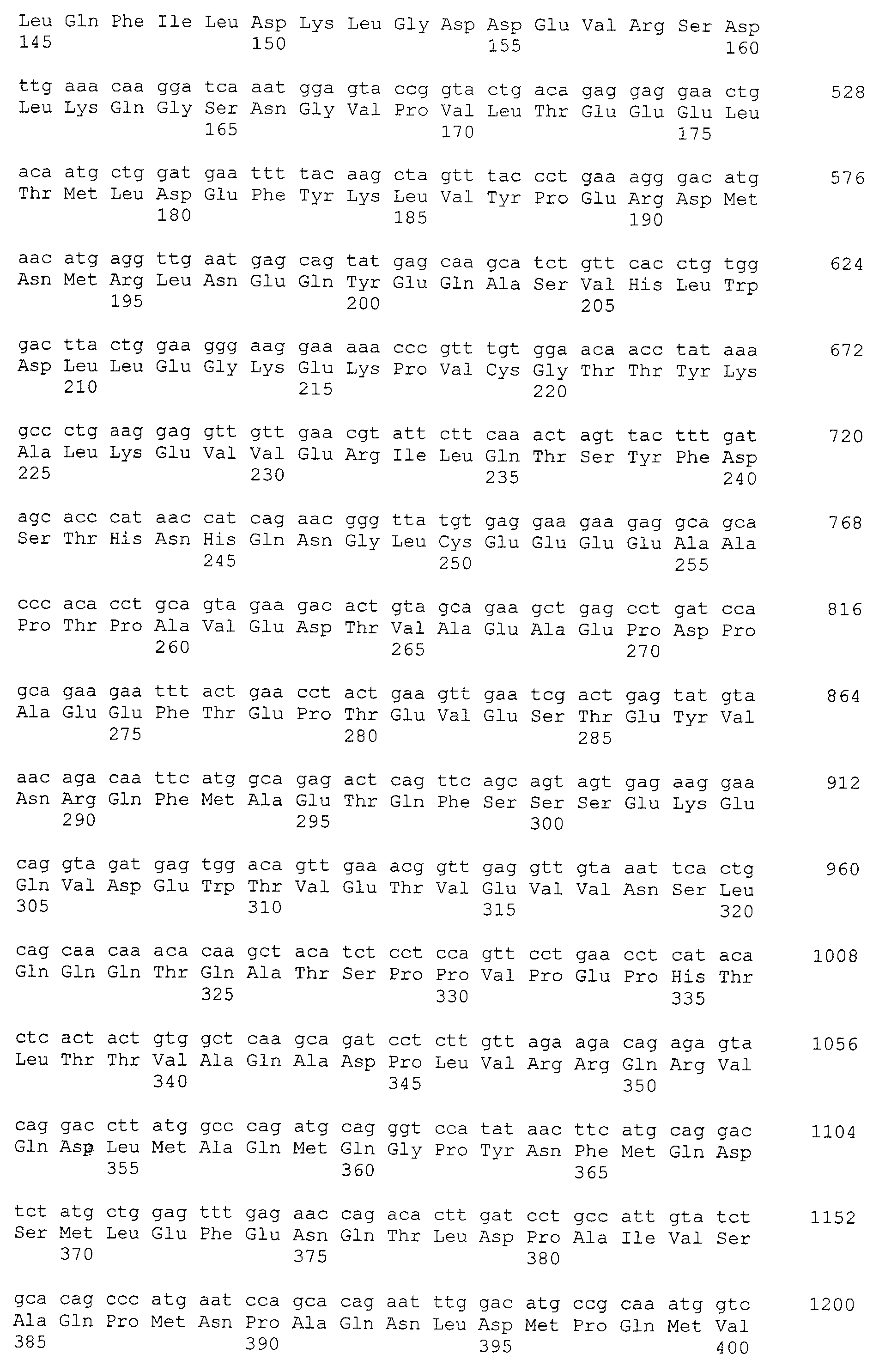
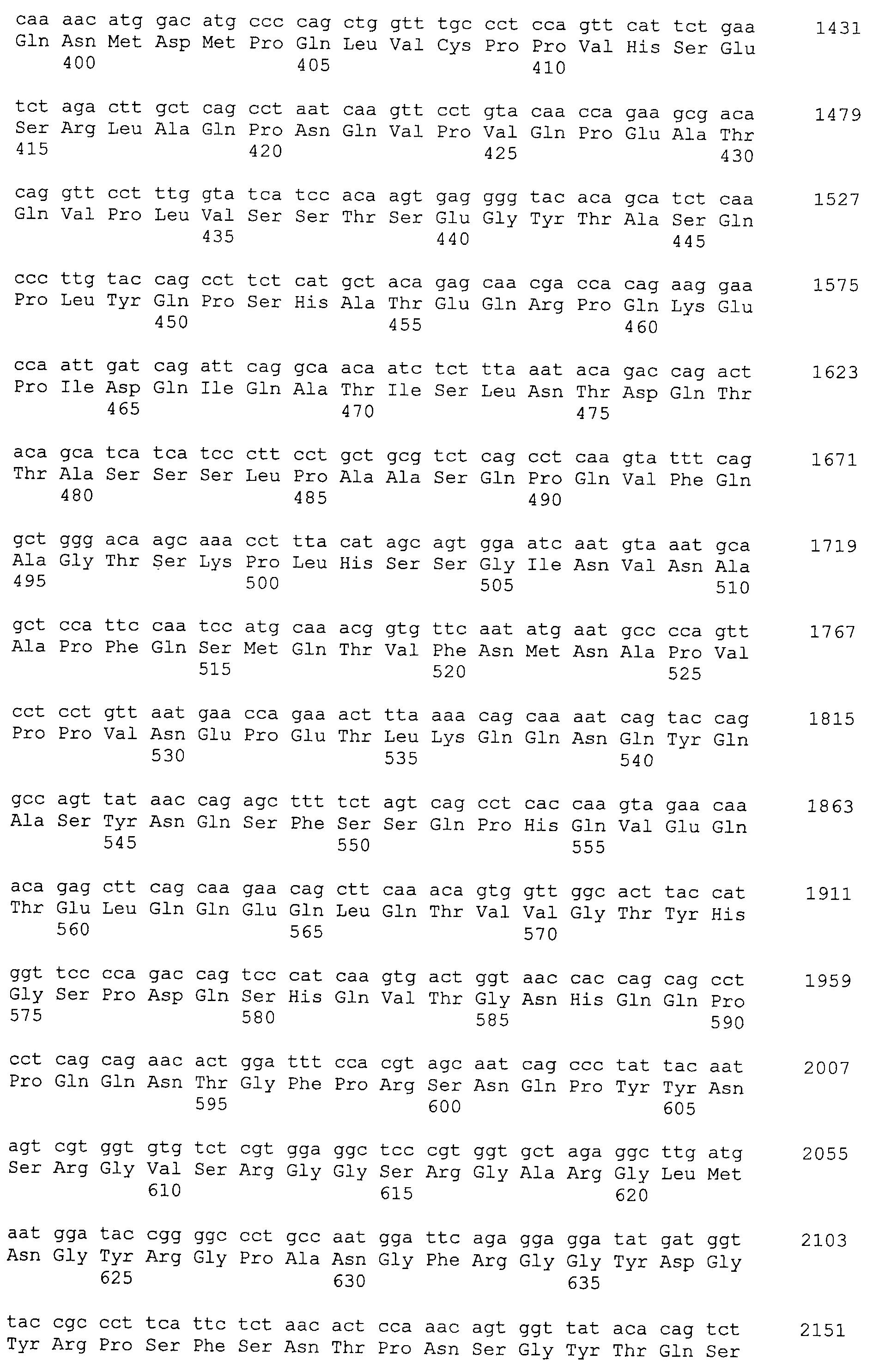
Аминокислотные последовательности, показанные в SEQ ID NO:6, 8, 10, 12 и 14 в списке последовательностей, описанные в соответствии с настоящим изобретением, представляют собой аминокислотные последовательности белков CAPRIN-1, которые были выделены способом SEREX с использованием библиотек кДНК из ткани семенников, и сыворотки, полученной от собак с раком молочной железы, в качестве полипептидов, обладающих способностью связываться с антителами, специфически находящимися в сыворотках, полученных от собак, имеющих опухоли; аминокислотные последовательности, показанные в SEQ ID NO:2 и 4 представляют собой аминокислотные последовательности белков CAPRIN-1, выделенных у человека в качестве гомологов указанных полипептидов собак; аминокислотная последовательность, показанная в SEQ ID NO:16 представляет собой аминокислотную последовательность белка CAPRIN-1, выделенного у быка в качестве гомолога указанного полипептида собак; аминокислотная последовательность, показанная в SEQ ID NO: 18 представляет собой аминокислотную последовательность белка CAPRIN-1, выделенную у лошади в качестве гомолога указанного полипептида собаки; аминокислотная последовательность, показанная в (четные номера) последовательностях SEQ ID NO:20-28 представляет собой аминокислотные последовательности белков CAPRIN-1, выделенных у мышей в качестве гомологов полипептидов собаки; и аминокислотная последовательность, показанная в SEQ ID NO:30 представляет собой аминокислотную последовательность белка CAPRIN-1, выделенного у цыпленка в качестве гомолога указанного полипептида собаки (см. Пример 1, описанный ниже). Известно, что CAPRIN-1 экспрессируется при активации или клеточном делении нормальных клеток в стадии покоя.
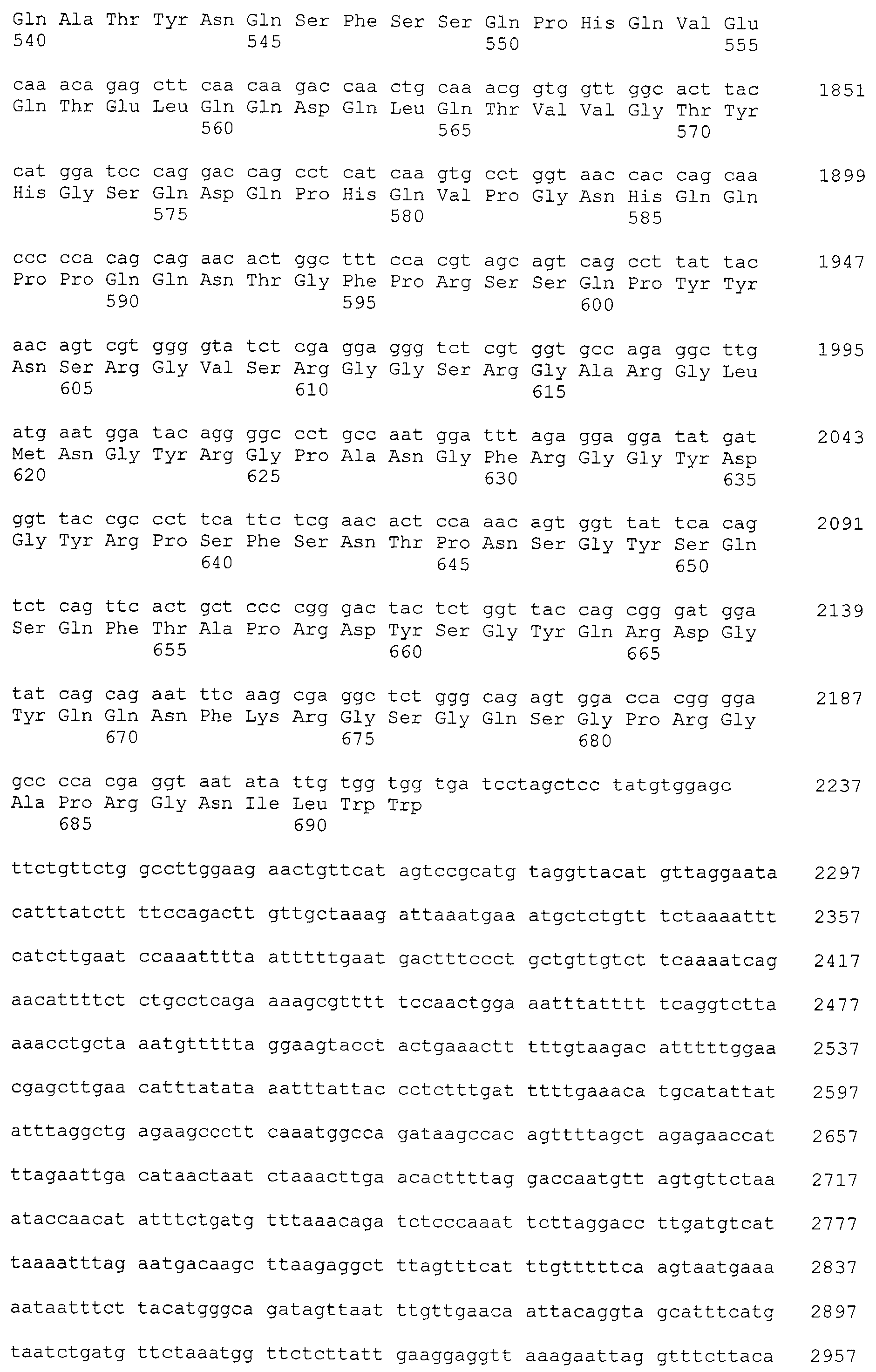
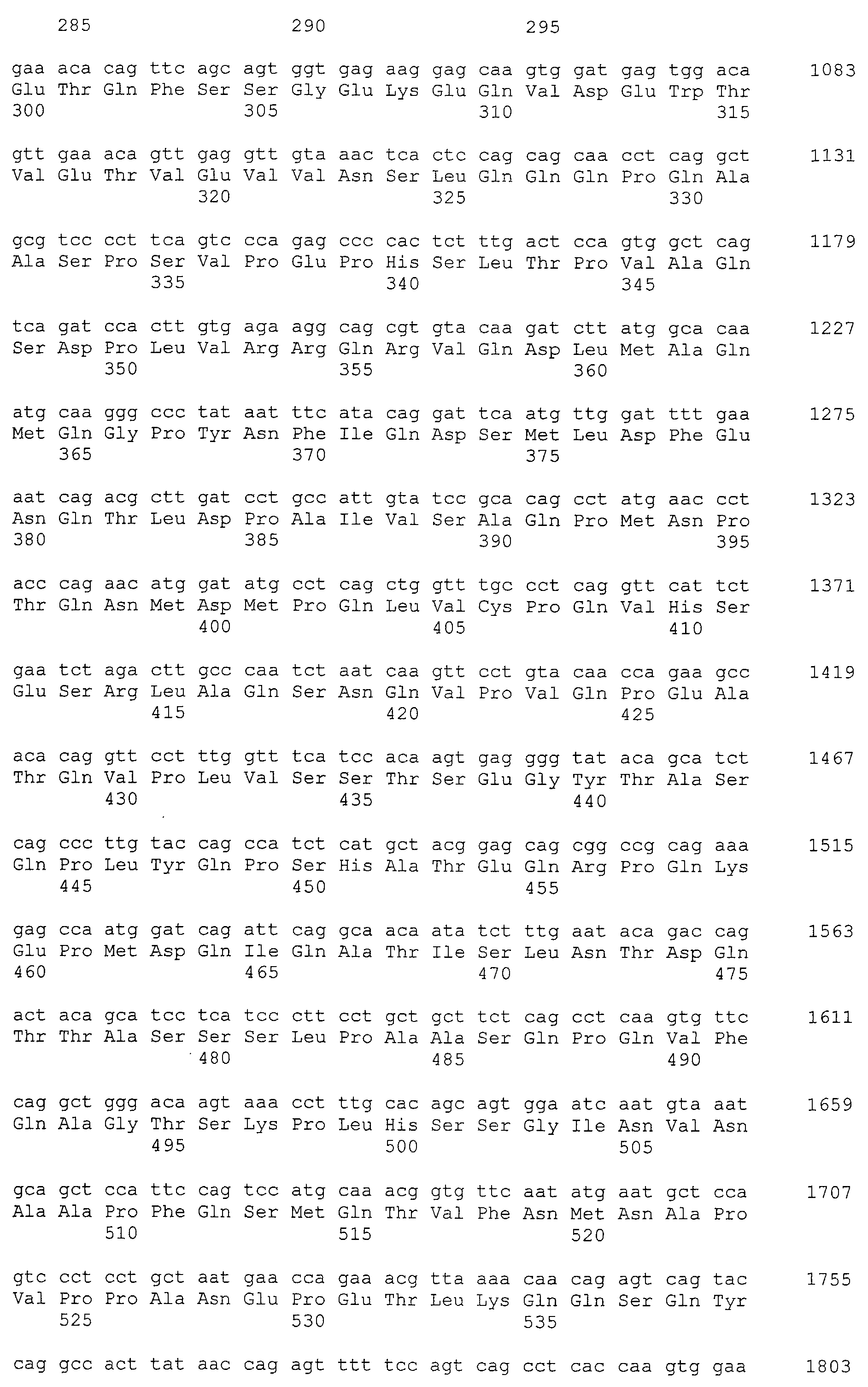
Было известно, что CAPRIN-1 не экспрессировался на поверхности клеток. Однако, в результате исследования связанного с настоящим изобретением, было обнаружено, что некоторые части белка CAPRIN-1 экспрессируются на поверхностях различных злокачественных клеток. В соответствии с настоящим изобретением, предпочтительно используется антитело, которое связывается с частью в пределах белка CAPRIN-1, экспрессируемой на поверхностях злокачественных клеток. Примеры частичных пептидов в пределах белка CAPRIN-1, экспрессируемых на поверхностях злокачественных клеток, включают полипептиды, состоящие из последовательности 7 или более непрерывных аминокислот в области аминокислотных остатков №№ (или аминокислот (aa)) 50-98 или аминокислотных остатков №№ (aa) 233-305 в любой аминокислотной последовательности с четными номерами SEQ ID NO:2-30, за исключением последовательностей SEQ ID NO:6 и 18, списка последовательностей. Их конкретные примеры включают аминокислотную последовательность SEQ ID NO:37 или 136 (предпочтительно, область аминокислотной последовательности SEQ ID NO:137 или 138 в аминокислотной последовательности SEQ ID NO:136), или аминокислотную последовательность на 80% или более, предпочтительно, на 85% или более, более предпочтительно, на 90% или более, и, еще более предпочтительно, на 95% или более идентичную указанным аминокислотным последовательностям. Антитела по настоящему изобретению включают все антитела, способные связываться с указанными выше пептидами и обладающие противоопухолевой активностью.
Антитела против CAPRIN-1, применимые в настоящем изобретении, как описано выше, могут быть любого типа, при условии, что они могут проявлять противоопухолевую активность. Их примеры включают моноклональные антитела, поликлональные антитела, синтетические антитела, мультиспецифичные антитела, антитела человека, гуманизированные антитела, химерные антитела, одноцепочечные антитела (scFV), и их фрагменты, такие как Fab и F(ab')2. Эти антитела и их фрагменты могут быть получены способами, известными специалистам в данной области. В настоящем изобретении, предпочтительными являются антитела, способные специфически связываться с белком CAPRIN-1. Такие антитела предпочтительно представляют собой моноклональные антитела; однако, при условии, что гомогенные антитела могут быть стабильно продуцированы, также могут быть использованы поликлональные антитела. Кроме того, если пациентом является человек, антитело человека или гуманизированное антитело является предпочтительным во избежание иммунологического отторжения или для его ингибирования.
Выражение "специфически связывающееся с белком CAPRIN-1", используемое в контексте настоящего изобретения, означает, что антитело, представляющее интерес, специфически связывается с белком CAPRIN-1 и по существу не связывается с другими белками.
Как описано ниже, противоопухолевую активность антитела, используемого в настоящем изобретении, можно оценивать путем исследования in vivo ингибирования опухолевого роста у животного имеющего опухоль, или исследования in vitro проявление, или нет иммуноцит- или комплемент-опосредованной цитотоксической активности против опухолевых клеток, экспрессирующих этот полипептид.
Более того, пациентами, нуждающимися в лечении и/или профилактике злокачественных опухолей в соответствии с настоящим изобретением, являются млекопитающие, такие как человек, домашние животные, скот, или спортивные животные. Предпочтительным пациентом является человек.
Получение антигенов, получение антител и фармацевтические композиции, относящиеся к настоящему изобретению, будут рассмотрены ниже.
Получение антигенов, используемых для получения антител
Белки или их фрагменты, используемые в качестве сенсибилизирующих антигенов для получения антител против CAPRIN-1, используемых в настоящем изобретении, не ограничиваются их происхождением, например, животным, включая, например, людей, собак, быков, лошадей, мышей, крыс или цыплят. Однако, такие белки или их фрагменты предпочтительно выбирают, принимая во внимание их совместимость с родительскими клетками, используемыми для слияния клеток. Белки млекопитающих в основном являются предпочтительными, и белки человека являются особенно предпочтительными. Например, если CAPRIN-1 представляет собой CAPRIN-1 человека, может быть использован белок CAPRIN-1 человека, его частичный пептид или клетки, способные экспрессировать CAPRIN-1 человека.
Нуклеотидные последовательности и аминокислотные последовательности CAPRIN-1 человека и их гомологи могут быть получены, например, путем доступа в GenBank (NCBI, USA) и с использованием алгоритма BLAST или FASTA (Karlin and Altschul, Proc. Natl. Acad. Sci. USA, 90:5873-5877,1993; Altschul et al., Nucleic Acids Res. 25:3389-3402, 1997).
В соответствии с настоящим изобретением, в тех случаях, когда нуклеотидную последовательность (SEQ ID NO: 1 или 3) или аминокислотную последовательность (SEQ ID NO: 2 или 4) CAPRIN-1 человека используют в качестве основной последовательности, мишенями являются нуклеиновые кислоты или белки, состоящие из последовательности, на 70%-100%, предпочтительно, на 80%-100%, более предпочтительно, на 90%-100%, и, еще более предпочтительно, на 95%-100% (например, на 97%-100%, 98%-100%, 99%-100%, или 99,5%-100%) идентичной нуклеотидной последовательности или аминокислотной последовательности ORF или зрелой части основной нуклеотидной последовательности или аминокислотной последовательности. Термин "% идентичности последовательности", используемый в контексте настоящего изобретения, означает процент (%) числа идентичных аминокислот (или нуклеотидов), от общего числа аминокислот (или нуклеотидов) в случае выравнивания двух последовательностей, так, чтобы максимальное сходство могло достигаться с введением или без введения разрывов.
Фрагменты белка CAPRIN-1 имеют длину в диапазоне от аминокислотной длины эпитопа (или антигенной детерминанты), который является наименьшей единицей антигена, распознаваемого антителом, до менее чем полноразмерной длины этого белка. Эпитоп относится к полипептидному фрагменту, обладающему антигенностью или иммуногенностью у млекопитающих и, предпочтительно, у людей. Наименьшая единица полипептидного фрагмента состоит приблизительно из 7-12 аминокислот, и, например, от 8 до 11 аминокислот. Их конкретным примером является аминокислотная последовательность, показанная в SEQ ID NO:37, SEQ ID NO:137, или SEQ ID NO:138, аминокислотная последовательность на 80% или более, предпочтительно, на 85% или более, более предпочтительно, на 90% или более, и еще более предпочтительно, на 95% или более идентичная указанной аминокислотной последовательности.
Полипептиды, содержащие указанный выше белок CAPRIN-1 человека и его частичные пептиды, могут быть синтезированы в соответствии со способами химического синтеза, такими как способ Fmoc (флуоренилметилоксикарбонильный способ) или способ tBoc (т-бутилоксикарбонильный способ) (Japanese Biochemical Society (ed.), "Biochemical Experimentation Course (Seikagaku Jikken Koza) 1", Protein Chemistry IV, Chemical Modification and Peptide Synthesis, Kagaku-dojin Publishing Company, Inc. (Japan), 1981). Также они могут быть синтезированы общими способами с использованием целого ряда коммерчески доступных синтезаторов пептидов. Кроме того, полипептиды, представляющие интерес, могут быть получены путем получения полинуклеотидов, кодирующих указанные выше полипептиды с использованием известных способов генной инженерии (Sambrook et al., Molecular Cloning, 2nd edition, Current Protocols in Molecular Biology (1989), Cold Spring Harbor Laboratory Press; Ausubel et al., Short Protocols in Molecular Biology, 3rd edition, A Compendium of Methods from Current Protocols in Molecular Biology (1995), John Wiley & Sons, etc.), встраивая каждый из полинуклеотидов в вектор экспрессии, и вводя этот вектор в клетку-хозяина, тем самым давая возможность клетке-хозяину продуцировать этот полипептид. Таким путем могут быть получены желаемые полипептиды.
Полинуклеотиды, кодирующие указанные выше полипептиды, легко могут быть получены с помощью известных методик генной инженерии или общих способов, с использованием коммерчески доступных синтезаторов нуклеиновых кислот. Например, ДНК, содержащая нуклеотидную последовательность, показанную в SEQ ID NO: 1, может быть получена с помощью ПЦР с использованием библиотеки хромосомной ДНК человека или кДНК в качестве матрицы и пары праймеров, обеспечивающих амплификацию нуклеотидной последовательности, показанной в SEQ ID NO: 1. Условия ПЦР могут быть определены соответствующим образом. Например, такие условия могут включать проведение 30 циклов стадий реакции (в качестве одного цикла), состоящих из: 94°C, 30 секунд (денатурация); 55°C, от 30 секунд до 1 минуты (отжиг); и 72°C, 2 минуты (элонгация) с использованием термостабильной ДНК полимеразы (например, Taq полимеразы) и Mg2+-содержащего ПЦР буфера, с последующим взаимодействием при 72°C в течение 7 минут после завершения 30 циклов. Однако настоящее изобретение не ограничено приведенными выше примерами условий для ПЦР. Методики проведения ПЦР и условия описаны, например, у Ausubel et al., Short Protocols in Molecular Biology, 3rd edition, A Compendium of Methods from Current Protocols in Molecular Biology (1995), John Wiley & Sons (Глава 15, в частности).
Кроме того, желаемая ДНК может быть выделена путем получения соответствующих зондов и праймеров на основании информации о нуклеотидных и аминокислотных последовательностях, показанных в SEQ ID NO:1-30 в списке последовательностей, описанных в настоящей заявке, и скрининга библиотеки кДНК человека, или подобной, с использованием таких зондов и праймеров. Предпочтительно такую библиотеку кДНК получают из клетки, органа или ткани, в которых экспрессируется белок с любой последовательностью с четными номерами SEQ ID NO:2-30. Примеры клеток или тканей включают клетки или ткани из семенников и злокачественных опухолей или опухолей, таких как лейкоз, рак молочной железы, лимфома, опухоль головного мозга, рак легких и рак толстой кишки. Проведение таких работ, как получение зондов или праймеров, конструирование библиотек кДНК, скрининг библиотек кДНК и клонирование представляющих интерес генов, как описано выше, известно специалистам в данной области, и они могут быть выполнены, например, в соответствии со способами, описанными у Sambrook et al., Molecular Cloning, 2nd edition, Current Protocols in Molecular Biology (1989) и Ausbel et al. (ibid.). ДНК, кодирующие белок CAPRIN-1 человека и его частичные пептиды, могут быть получены из полученных таким образом ДНК.
Описанными выше клетками-хозяевами могут быть любые клетки, при условии, что они могут экспрессировать описанные выше полипептиды. Пример прокариотических клеток-хозяев включает, но не только, Escherichia coli. Примеры эукариотических клеток-хозяев включают, но не только, клетки млекопитающих, такие как клетки почек мартышки (COS1), ооциты китайского хомячка (CHO), линию клеток эмбриональных почек человека (HEK293), и линию клеток эмбриональной кожи мыши (NIH3T3), клетки дрожжей, таких как почкующиеся дрожжи и делящиеся клетки дрожжей, клетки тутового шелкопряда и яйцеклетки Xenopus.
В тех случаях, когда прокариотические клетки используют в качестве клеток-хозяев, может быть использован вектор экспрессии, имеющий точку начала репликации для прокариотических клеток, промотор, сайт связывания с рибосомой, сайт множественного клонирования, терминатор, ген резистентности к лекарственным средствам, ген ауксотрофной комплементарности, или подобное. В качестве векторов экспрессии для Escherichia coli, можно привести в пример pUC векторы, pBluescriptII, системы экспрессии pET, системы экспрессии pGEX, и подобные. ДНК, кодирующую указанный выше полипептид, встраивают в такой вектор экспрессии, прокариотическую клетку-хозяина трасформируют этим вктором, а затем культивируют полученную таким образом клетку, так, чтобы полипептид, кодируемый ДНК, мог экспрессироваться в этой прокариотической клетке-хозяине. Одновременно, этот полипептид также может быть экспрессирован в виде слитого белка с другим белком.
В тех случаях, когда эукариотические клетки используют в качестве клеток-хозяев, могут быть использованы векторы экспрессии для эукариотических клеток, имеющие промотор, область сплайсинга, сайт добавления поли(А) или подобное. Примеры таких векторов экспрессии включают pKA1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, вектор EBV, pRS, pcDNA3, и pYES2. С помощью методик, аналогичных упомянутым выше, ДНК, кодирующую указанный выше полипептид, встраивают в такой вектор экспрессии, эукариотическую клетку-хозяина трансформируют этим вектором, а затем культивируют полученную таким образом трансформированную клетку, так, чтобы полипептид, кодируемый указанной выше ДНК, мог быть экспрессирован в эукариотической клетке-хозяине. В тех случаях, когда в качестве вектора экспрессии используют pIND/V5-His, pFLAG-CMV-2, pEGFP-N1, pEGFP-C1, или тому подобное, указанный выше полипептид может быть экспрессирован в качестве слитого белка с меткой, такой как His-метка (например, (His)6-(His)10), FLAG-метка, myc-метка, HA-метка или GFP.
Для введения вектора экспрессии в клетку-хозяина, могут быть использованы хорошо известные способы, такие как электропорация, способ с использованием фосфата кальция, липосомный способ, способ с использованием DEAE декстрана, микроинъекция, вирусное инфицирование, липофекция и связывание с пептидом, проникающим через клеточную мембрану.
Выделение и очистку полипептида, представляющего интерес, из клеток-хозяев, можно проводит с использованием известных методик выделения в сочетании. Примеры таких известных методик включают, но не только, обработку с использованием денатурирующего вещества, такого как мочевина или поверхностно-активное вещество, обработку ультразвуком, ферментативное расщепление, высаливание, фракционирование растворителем и преципитацию, диализ, центрифугирование, ультрафильтрацию, гель-фильтрацию, SDS-PAGE, изоэлектрофокусирующий электрофорез, ионообменную хроматографию, гидрофобную хроматографию, аффинную хроматографию и хроматографию с обращенной фазой.
Структура антитела
В основном, антитела представляют собой гетеромультимерные гликопротеины, содержащие по меньшей мере две тяжелые цепи и две легкие цепи. При этом, антитела, за исключением IgM, являются гетеротетрамерными гликопротеинами (приблизительно 150 кДа), содержащими две идентичные легкие (L) цепи и две идентичные тяжелые (H) цепи. Обычно, каждая легкая цепь соединена с тяжелой цепью посредством одной ковалентной дисульфидной связи. Однако, количество дисульфидных связей между тяжелыми цепями варьирует среди различных изотипов иммуноглобулинов. Каждая тяжелая цепь и легкая цепь также имеет внутрицепочечную дисульфидную связь(и). Каждая тяжелая цепь имеет вариабельный домен (область VH) на одном своем конце, с которым последовательно соединено несколько константных областей. Каждая легкая цепь имеет вариабельный домен (область VL) с одного своего конца, и имеет одну константную область на своем противоположном конце. Константную область легкой цепи выравнивают с первой константной областью тяжелой цепи и вариабельный домен легкой цепи выравнивают с вариабельным доменом тяжелой цепи. Особая область вариабельного домена антитела, которая называется "областью, определяющей комплементарность (CDR)", демонстрирует специфическую вариабельность, чтобы придать антителу специфичность связывания. Относительно консервативная часть в вариабельной области называется "каркасной областью (FR)". Полный вариабельный домен тяжелой цепи или легкой цепи содержит 4 FR, соединенные друг с другом посредством 3 CDR. Такие CDR называются "CDRH1", "CDRH2", и "CDRH3", соответственно, в таком порядке от N-конца в тяжелой цепи. Аналогично, для легкой цепи они называются "CDRL1", "CDRL2", и "CDRL3", соответственно. CDRH3 играет наиболее важную роль в отношении специфичности связывания антитела с антигеном. Кроме того, CDR в каждой цепи удерживаются FR областями в положении, в котором они близки друг к другу, и они вносят вклад в формирование сайтов связывания антитела с антигеном с CDR в соответствующей цепи. Константные области непосредственно не вносят вклад в связывание антитела с антигеном. Однако они демонстрируют различные эффекторные функции, такие как связь с антителозависимой клеточноопросредованной цитотоксичностью (ADCC), фагоцитоз, посредством связывания с рецептором Fcγ, период полужизни/скорость выведения через неонатальный Fc рецептор (FcRn), и комплемент-зависимая цитотоксичность (CDC) через компонент C1q в каскаде реакций системы комплемента.
Продукция антител
Термин "антитело против CAPRIN-1", используемый в настоящем изобретении, относится к антителу, обладающему иммунологической реактивностью в отношении полноразмерного белка CAPRIN-1 или его фрагмента.
Термин "иммунологическая реактивность", используемый в настоящем описании, обозначает характеристики связывания антитела in vivo с антигеном CAPRIN-1. Функция поражения опухоли (например, гибель, ингибирование или регрессия) может быть выражена как результат такого связывания. В частности, в настоящем изобретении может быть использован любой тип антител, при условии, что антитело может связываться с белком CAPRIN-1 для поражения опухоли или злокачественной опухоли, такой как лейкоз, лимфома, рак молочной железы, опухоль головного мозга, рак легких, рак пищевода, рак желудка, рак почек или рак толстой кишки.
Примеры таких антител включают моноклональные антитела, поликлональные антитела, синтетические антитела, мультиспецифичные антитела, антитела человека, гуманизированные антитела, химерные антитела, одноцепочечные антитела и фрагменты антител (например, Fab и F(ab')2). Кроме того, примеры условных классов иммуноглобулинов включают IgG, IgE, IgM, IgA, IgD, и IgY, и примеры условных подклассов иммуноглобулинов включают IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Антитела могут быть дополнительно модифицированы посредством ацетилирования, формилирования, амидирования, фосфорилирования или пэгилирования (PEG), помимо гликозилирования.
Примеры получения целого ряда антител описаны ниже.
В случае, когда интересующее антитело, представляет собой моноклональное антитело, линию злокачественных клеток молочной железы SK-BR-3, экспрессирующих CAPRIN-1, или тому подобное, вводят мышам для иммунизации, с последующим извлечением селезенки у мышей. Клетки выделяют из каждой селезенки, а затем сливают с миеломными клетками мыши. Клоны, способные продуцировать антитело, обладающее активностью, ингибирующей рост злокачественных клеток, выбирают из полученных слитых клеток (гибридом). Гибридому, продуцирующую моноклональные антитела, обладающие действием, ингибирующим рост злокачественных клеток, выделяют и культивируют. Антитело, представляющее интерес, может быть получено путем очистки из культурального супернатанта обычным способом аффинной очистки.
Также, гибридома, продуцирующая моноклональное антитело, может быть получена способом, описанным ниже, например. Сначала животное иммунизируют сенсибилизирующим антигеном с помощью известного способа. В обычном способе иммунизацию проводят путем внутрибрюшинного или подкожного введения млекопитающему сенсибилизирующего антигена. В частности, сенсибилизирующий антиген разбавляют или суспендируют в PBS (фосфатно-буферный солевой раствор), физиологическом растворе или подобном до получения в результате подходящего количества. При желании, соответствующее количество общепринятого адъюванта (например, полного адъюванта Фрейнда) смешивают с этим раствором. После эмульгирования, полученную в результате смесь вводят млекопитающему несколько раз каждые 4-21 день. Кроме того, подходящий носитель может быть использован для иммунизации сенсибилизирующим антигеном.
Как описано выше, после иммунизации млекопитающего и подтверждения повышения желаемого уровня антител в сыворотке, у животного получают иммуноциты и подвергают клеточному слиянию. Особенно предпочтительными примерами иммуноцитов являются спленоциты.
Клетки миеломы млекопитающих используют в качестве релевантных родительских клеток, подвергаемых слиянию с указанными выше иммуноцитами. Для таких миеломных клеток, предпочтительно, используют следующие различные примеры известных клеточных линий: P3U1 (P3-X63Ag8U1), P3 (P3x63Ag8.653) (J. Immunol. (1979) 123, 1548-1550), P3x63Ag8U.1 (Current Topics in Microbiology and Immunology (1978) 81, 1-7), NS-1 (Kohler. G. and Milstein, C. Eur. J. Immunol. (1976). 6, 511-519), MPC-11 (Margulies. D. H. et al., Cell (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), FO (de St. Groth, S. F. et al., J. Immunol. Methods (1980) 35, 1-21), S194 (Trowbridge, I. S. J. Exp. Med. (1978) 148, 313-323), и R210 (Galfre, G. et al., Nature (1979) 277, 131-133).
В основном, клеточное слияние иммуноцитов и миеломных клеток, описанное выше, может быть выполнено в соответствии с известным способом, таким как способ Kohler и Milstein et al. (Kohler, G. and Milstein, C. Methods Enzymol. (1981) 73, 3-46).
Более конкретно, клеточное слияние, описанное выше, проводят в присутствии фактора, стимулирующего слияние клеток в обычном культуральном растворе, содержащем питательные вещества, например. Примеры используемого слитого промотора, включают полиэтиленгликоль (PEG) и вирус Сендай (HVJ: японский гемагглютинирующий вирус). При желании, дополнительно может быть добавлен адъювант, такой как диметилсульфоксид, для повышения эффективности слияния.
Относительное число используемых иммуноцитов, к используемым миеломным клеткам может быть определено произвольно. Например, соотношение иммуноцитов к миеломным клеткам, предпочтительно, составляет от 1:1 до 10:1. Примеры культурального раствора, который может быть использован для слияния клеток, описанного выше, включают культуральный раствор RPMI1640 и культуральный раствор MEM, подходящий для роста указанных выше линий миеломных клеток, а также другие обычные культуральные растворы, используемые для этого типа клеточной культуры. Далее, в сочетании с этим может быть использована замена сыворотки, такой как эмбриональная сыворотка теленка (FCS).
Для слияния клеток, указанные выше иммуноциты и миеломные клетки перемешивают в достаточной мере в заранее определенных количествах в культуральном растворе. Раствор PEG (например, со средней молекулярной массой приблизительно от 1000 до 6000), который предварительно был нагрет приблизительно до 37°C, добавляют в концентрации в основном от 30% до 60% (масс./об.), с последующим перемешиванием. В результате это приводит к образованию представляющих интерес гибридом. После этого, функциональные стадии последовательного добавления соответствующего культурального раствора и удаление супернатанта посредством центрифугирования повторно проводят для удаления агента(ов) клеточного слияния и подобного, которые не являются предпочтительными для роста гибридом.
Полученные таким образом гибридомы культивируют в обычном селективном культуральном растворе, таком как культуральный раствор HAT (культуральный раствор, содержащий гипоксантин, аминоптерин и тимидин) для селекции. Культивирование в таком культуральном растворе HAT непрерывно проводят в течение достаточного периода времени (как правило, от нескольких дней до нескольких недель) для гибели клеток (неслитых клеток), отличных от гибридом, представляющих интерес. Далее, обычный способ предельных разведений используют для скрининга гибридом, продуцирующих антитела, представляющие интерес, и для проведения однократного клонирования.
Далее, также возможно получить гибридомы, продуцирующие антитела человека, обладающие желаемой активностью (например, активностью, ингибирующей рост клеток), следующим образом, а также для получения указанных выше гибридом путем иммунизации антигенами животных, не являющихся человеком. Лимфоциты человека (например, лимфоциты человека, инфицированные вирусом EB) сенсибилизируют in vitro белком, белок-экспрессирующими клетками или их лизатом и сенсибилизированные лимфоциты сливают с миеломными клетками человека, способными постоянно делиться (например, U266) (регистрационный номер TIB196).
Гибридомы, продуцирующие моноклональные антитела, как указано выше, могут быть субкультивированы в обычном культуральном растворе. Кроме того, они могут храниться в жидком азоте в течение длительного периода времени.
В частности, иммунизацию проводят с использованием желаемого антигена или клеток, экспрессирующих желаемый антиген в качестве сенсибилизирующего антигена(ов) в соответствии с обычным способом иммунизации. Полученные иммуноциты сливают с известными родительскими клетками с помощью обычного способа слияния клеток. Затем, клетки, продуцирующие моноклональные антитела (гибридомы) подвергают скринингу обычным способом. Таким образом можно проводить получение антител.
Другие примеры антител, которые могут быть использованы в настоящем изобретении, включают поликлональные антитела. Например, поликлональные антитела могут быть использованы способом, описанным ниже.
Сыворотку получают путем иммунизации небольших животных, таких как мыши, мыши, продуцирующие антитела человека, или кролики с природным белком CAPRIN-1, рекомбинантным белком CAPRIN-1, который был экспрессирован как белок, слитый с GST или подобным, в микроорганизме, таком как Escherichia coli, или его частичным пептидом. Сыворотку очищают посредством преципитации сульфатом аммония, колоночной хроматографии с белком A/белком G, DEAE ионообменной хроматографии, аффинной колоночной хроматографии с колонкой, к которой присоединен белок CAPRIN-1 или синтетический пептид, или аналогичной методикой для получения поликлональных антител. В примерах, описанных ниже, получали поликлональное антитело кролика, и были подтверждены его противоопухолевые эффекты, это антитело направлено против частичного пептида (с последовательностью, показанной в SEQ ID NO: 37) домена в аминокислотной последовательности белка CAPRIN-1, который экспрессируется на поверхностях злокачественных клеток.
Известной мышью, продуцирующей антитела человека, используемой в настоящем изобретении, является, например, мышь KM (Kirin Pharma/Medarex) или XenoMouse (Amgen) (например, WO 02/43478 и WO 02/092812). Когда таких мышей иммунизируют белками CAPRIN-1 или их фрагментами, из крови могут быть получены полные поликлональные антитела человека. Кроме того, моноклональные антитела человека могут быть получены способом слияния спленоцитов, полученных от иммунизированных мышей, с миеломными клетками.
Получение антигена может проводиться в соответствии с таким способом как способ с использованием клеток животных (патентная публикация (Kohyo) JP No. 2007-530068) или способ с использованием бакуловируса (например, WO 98/46777). Если иммуногенность антигена является низкой, антиген связывают с макромолекулой, обладающей иммуногенность, такой как альбумин. Затем, антиген может быть использован для иммунизации.
Далее, возможно использовать геннорекомбинантное антитело, продуцируемое путем клонирования гена антитела из гибридомы, встраивая клон в соответствующий вектор, вводя вектор в клетку-хозяина, и используя технологию рекомбинантных генов. (Смотри, например, Carl, A. K. Borrebaeck, James, W. Larrick, THERAPEUTIC MONOCLONAL ANTIBODIES, Published in the United Kingdom by MACMILLAN PUBLISHERS LTD, 1990). В частности, кДНК вариабельной области (V-область) антитела синтезируют из мРНК гибридомы с использованием обратной транскриптазы. После получения ДНК, кодирующей V-область антитела, представляющего интерес, такую ДНК лигируют в желаемую ДНК, кодирующую константную область антитела (C-область). Полученный в результате продукт встраивают в вектор экспрессии. Альтернативно, ДНК, кодирующая V область антитела, может быть встроена в вектор экспрессии, содержащий ДНК С-области антитела. Такую ДНК встраивают в вектор экспрессии таким образом, чтобы она экспрессировалась под контролем области контролирующей экспрессию, такой как энхансер или промотор. Далее, клетки-хозяева трансформируют таким вектором экспрессии, тем самым позволяя осуществлять экспрессию антитела.
Антитела против CAPRIN-1 по настоящему изобретению предпочтительно представляют собой моноклональные антитела. Однако, они могут представлять собой поликлональные антитела, генномодифицированные антитела (такие как химерные антитела и гуманизированные антитела), и подобные.
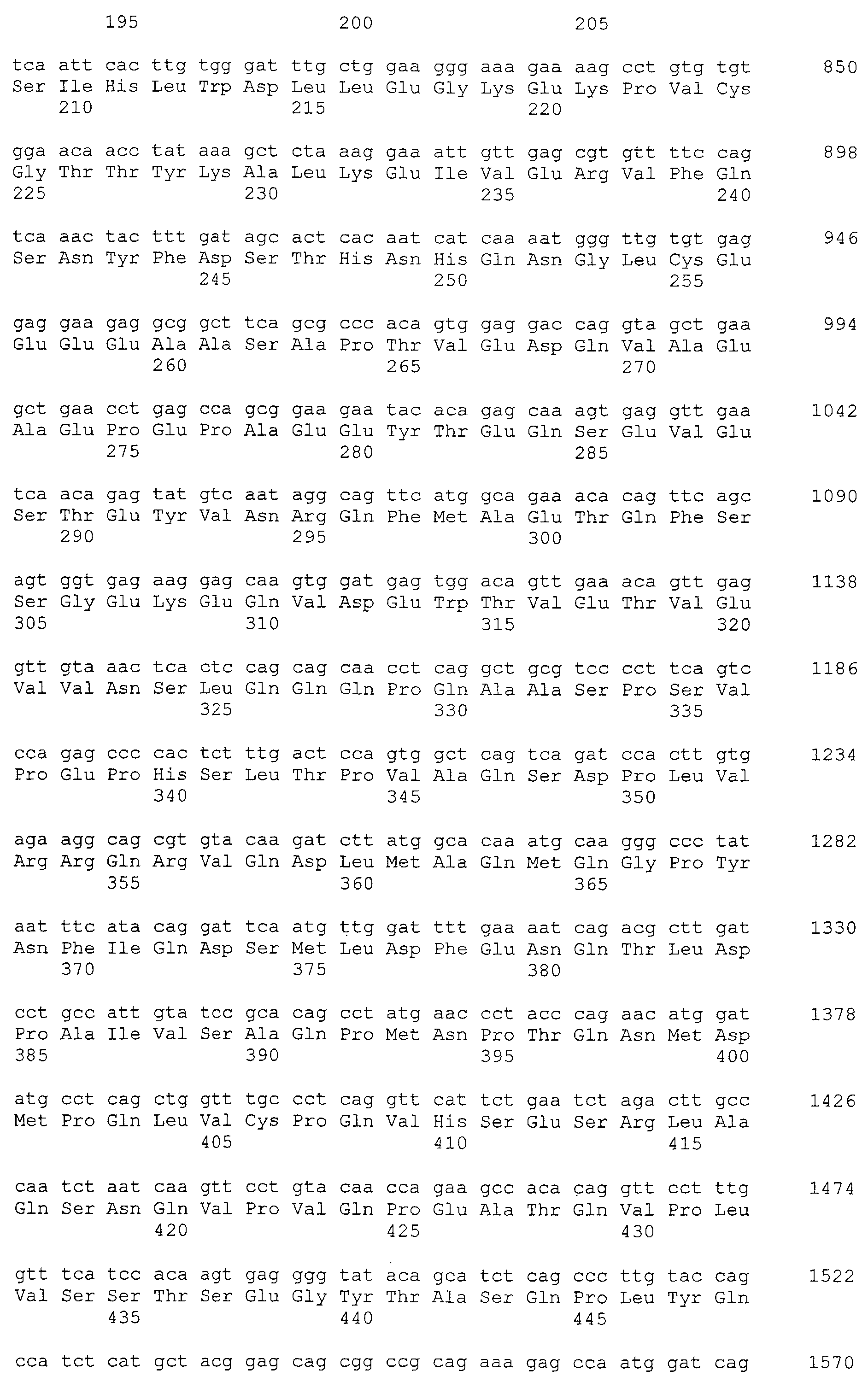
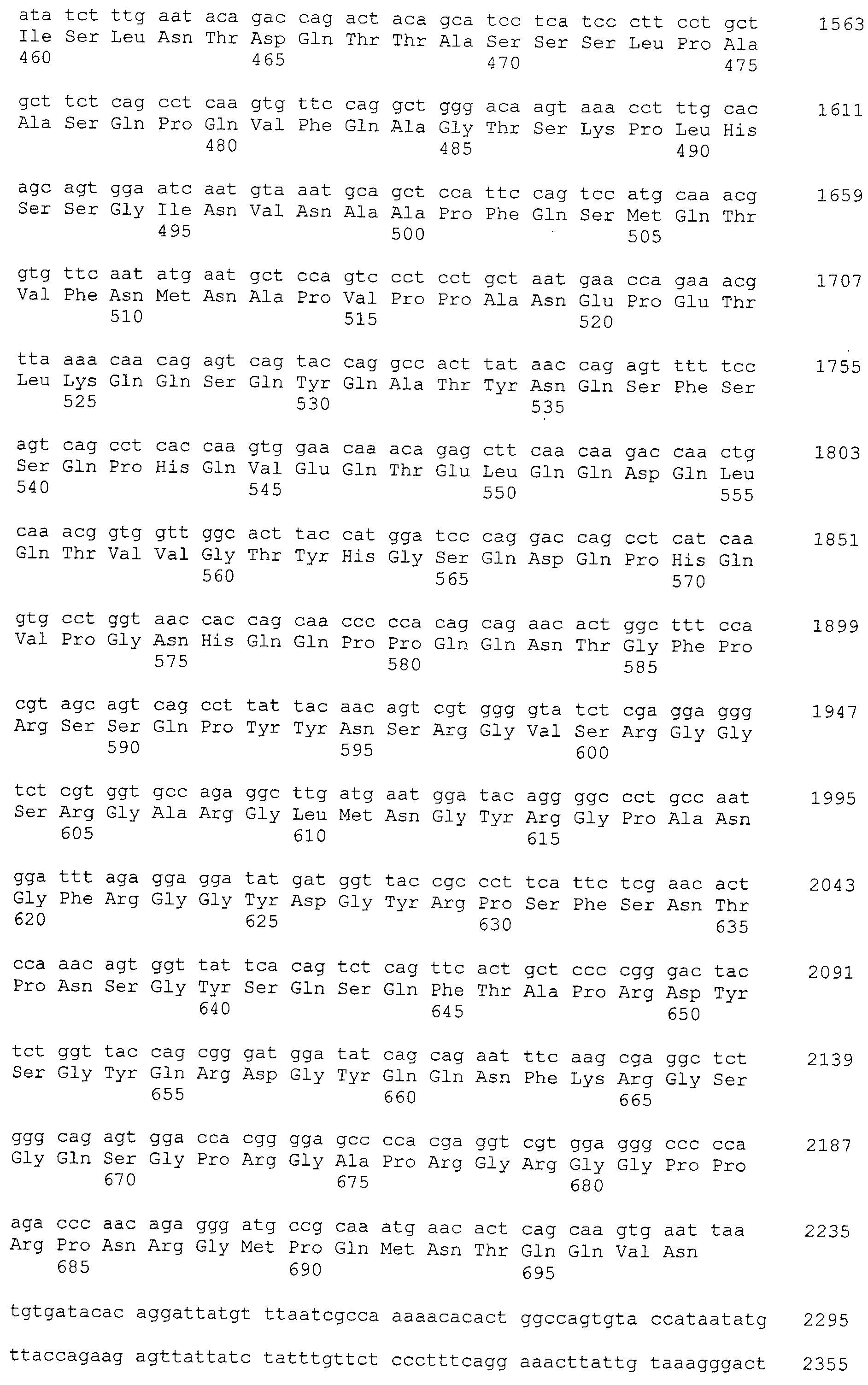
Моноклональные антитела включают моноклональные антитела человека и моноклональные антитела животных, не являющихся человеком (например, моноклональные антитела мыши, моноклональные антитела крысы, моноклональные антитела кролика и моноклональные антитела цыпленка). Моноклональные антитела могут быть получены путем культивирования гибридом, полученных путем слияния миеломных клеток и спленоцитов, полученных от млекопитающих, не являющихся человеком (например, мышей или мышей, продуцирующих антитела человека), иммунизированных белками CAPRIN-1. В “Примерах”, описанных ниже, были получены моноклональные антитела мыши и были подтверждены их противоопухолевые эффекты. Такое моноклональное антитело содержит вариабельную область тяжелой цепи (VH), имеющую аминокислотную последовательность SEQ ID NO: 43, SEQ ID NO: 73, SEQ ID NO: 83, SEQ ID NO: 93, SEQ ID NO: 103, SEQ ID NO: 113, или SEQ ID NO: 123 и вариабельную область легкой цепи (VL), имеющую аминокислотную последовательность, показанную в SEQ ID NO: 47, SEQ ID NO: 53, SEQ ID NO: 58, SEQ ID NO: 63, SEQ ID NO: 68, SEQ ID NO: 77, SEQ ID NO: 87, SEQ ID NO: 97, SEQ ID NO: 107, SEQ ID NO: 117, или SEQ ID NO: 127. В настоящем изобретении область VH содержит: CDR1, представленную аминокислотной последовательностью SEQ ID NO: 40, SEQ ID NO: 70, SEQ ID NO: 80, SEQ ID NO: 90, SEQ ID NO: 100, SEQ ID NO: 110, или SEQ ID NO: 120; CDR2, представленную аминокислотной последовательностью SEQ ID NO: 41, SEQ ID NO: 71, SEQ ID NO: 81, SEQ ID NO: 91, SEQ ID NO: 101, SEQ ID NO: 111, или SEQ ID NO: 121; и CDR3, представленную аминокислотной последовательностью SEQ ID NO: 42, SEQ ID NO: 72, SEQ ID NO: 82, SEQ ID NO: 92, SEQ ID NO: 102, SEQ ID NO: 112, или SEQ ID NO: 122. Область VL содержит: CDR1, представленную аминокислотной последовательностью SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 55, SEQ ID NO: 60, SEQ ID NO: 65, SEQ ID NO: 74, SEQ ID NO: 84, SEQ ID NO: 94, SEQ ID NO: 104, SEQ ID NO: 114, или SEQ ID NO: 124; CDR2, представленную аминокислотной последовательностью SEQ ID NO: 45, SEQ ID NO: 51, SEQ ID NO: 56, SEQ ID NO: 61, SEQ ID NO: 66, SEQ ID NO: 75, SEQ ID NO: 85, SEQ ID NO: 95, SEQ ID NO: 105, SEQ ID NO: 115, или SEQ ID NO: 125; и CDR3, представленную аминокислотной последовательностью SEQ ID NO: 46, SEQ ID NO: 52, SEQ ID NO: 57, SEQ ID NO: 62, SEQ ID NO: 67, SEQ ID NO: 76, SEQ ID NO: 86, SEQ ID NO: 96, SEQ ID NO: 106, SEQ ID NO: 116, или SEQ ID NO: 126.
Химерное антитело представляет собой антитело, полученное путем объединения последовательностей от разных животных. Примером такого антитела является антитело, состоящее из вариабельных областей тяжелой цепи антитела мыши и легкой цепи и константных областей тяжелой цепи антитела человека и легкой цепи антитела человека. Такое химерное антитело может быть получено известным способом. Например, оно может быть получено путем лигирования ДНК, кодирующей V-область антитела, с ДНК, кодирующей С-область антитела человека, встраивания полученной в результате конструкции в вектор экспрессии, и введения этого вектора в клетку-хозяина для продукции антител.
Поликлональные антитела включают антитела, полученные путем иммунизации животных, продуцирующих антитело человека (например, мышей), белками CAPRIN-1.
Гуманизированное антитело представляет собой модифицированное антитело, и его иногда называют "реконструированным антителом человека". Известно, что гуманизированное антитело конструируют путем трансплантации CDR антитела, полученного от иммунизированного животного, в области, определяющие комплементарность, антитела человека. Также, для осуществления этого, известны общие технологии рекомбинантных генов.
В частности, последовательность ДНК, сконструированная таким образом, чтобы была возможность лигировать CDR антитела мыши с каркасными областями антитела человека (FR), синтезируют с помощью ПЦР с использованием нескольких олигонуклеотидов, полученных таким образом, чтобы эти олигонуклеотиды имели части, перекрывающиеся друг с другом на одном конце каждого из них. Гуманизированное антитело может быть получено путем лигирования полученной выше ДНК с ДНК, кодирующей константную область антитела человека, встраивания полученной в результате конструкции в вектор экспрессии, и введения этого вектора в клетку-хозяина для продукции антител (см. EP-A-239400 и WO 96/02576). FR антитела человека, лигированные друг с другом посредством CDR, выбирают на основании предположения, что области, определяющие комплементарность, могут образовывать хороший сайт связывания с антигеном. При необходимости, аминокислоты в каркасных областях вариабельной области антитела могут быть замещены таким образом, чтобы области, определяющие комплементарность в реконструированном антителе человека образовывали соответствующий сайт связывания с антигеном (Sato K. et al., Cancer Research 1993, 53: 851-856). Кроме того, каркасные области могут быть заменены каркасными областями из другого антитела человека (см. WO 99/51743).
Каркасные области антитела человека, лигированные друг с другом посредством CDR, выбирают на основании предположения, что области, определяющие комплементарность, могут образовывать хорошие сайты связывания с антигеном. При необходимости, аминокислоты в каркасных областях вариабельной области антитела могут быть заменены таким образом, чтобы области, определяющие комплементарность, в реконструированном антителе человека образовывали соответствующие сайты связывания с антигеном (Sato K. et al., Cancer Research 1993, 53: 851-856).
После получения химерного антитела или гуманизированного антитела, аминокислоты в вариабельной области (например, FR) или константной области, могут быть заменены, например, другими аминокислотами.
В настоящем изобретении аминокислотная замена представляет собой замену, например, менее 15, менее 10, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3, или не более 2 аминокислот, предпочтительно, от 1 до 5 аминокислот, и более предпочтительно, 1 или 2 аминокислот. Замещенное антитело должно быть функционально эквивалентным незамещенному антителу. Замещение предпочтительно представляет собой консервативную аминокислотную замену, которая представляет собой замену между аминокислотами, имеющими сходные характеристики в отношении заряда, боковых цепей, полярности, ароматичности и тому подобное. Например, сходные по свойствам аминокислоты могут быть классифицированы на следующие типы: основные аминокислоты (аргинин, лизин и гистидин); кислые аминокислоты (аспарагиновая кислота и глутаминовая кислота); незаряженные полярные аминокислоты (глицин, аспарагин, глутамин, серин, треонин, цистеин и тирозин); неполярные аминокислоты (лейцин, изолейцин, аланин, валин, пролин, фенилаланин, триптофан и метионин); аминокислоты с разветвленной цепью (треонин, валин, изолейцин); и ароматические аминокислоты (фенилаланин, тирозин, триптофан и гистидин).
Примером модификатора антитела является антитело, связанное с молекулой, такой как полиэтиленгликоль (PEG). Что касается модификаторов антитела по настоящему изобретению, вещества, которые связываются антителом, не ограничены. Такой модификатор антитела может быть получен путем химической модификации полученного антитела. Способ такой модификации уже является признанным в области, относящейся к настоящему изобретению.
Выражение "функциональный эквивалент", используемое в контексте настоящего изобретения, означает ситуацию, при которой антитело, представляющее интерес, имеет биологическую или биохимическую активность, сходную с таковой антитела по настоящему изобретению. В частности, такое антитело обладает функцией повреждения опухолей и по существу не вызывает реакции отторжения при применении у людей. Примером такой активности является активность, ингибирующая рост клеток или связывающая активность.
Известным способом для получения полипептида, функционально эквивалентного заданному полипептиду, который хорошо известен специалистам в данной области, является способ, предусматривающий введение мутации в полипептид. Например, специалист в данной области может соответствующим образом ввести мутацию в антитело по настоящему изобретению с использованием способа сайт-специфичного мутагенеза (Hashimoto-Gotoh, T. et al., (1995) Gene 152, 271-275; Zoller, MJ., и Smith, M. (1983) Methods Enzymol. 100, 468-500; Kramer, W. et al., (1984) Nucleic Acids Res. 12, 9441-9456; Kramer, W. и Fritz, HJ., (1987) Methods Enzymol. 154, 350-367; Kunkel, TA., (1985) Proc. Natl. Acad. Sci. USA. 82, 488-492; или Kunkel (1988) Methods Enzymol. 85, 2763-2766) или аналогичного способа. Таким образом, может быть получено антитело, функционально эквивалентное антителу по настоящему изобретению.
Указанное выше антитело, способное распознавать эпитоп белка CAPRIN-1, распознаваемого антителом против CAPRIN-1, может быть получено способом, известным специалистам в данной области. Например, оно может быть получено способом, предусматривающим определение эпитопа белка CAPRIN-1, распознаваемого антителом против CAPRIN-1, общим способом (например, картированием эпитопа) и продукцию антитела с использованием полипептида, имеющего аминокислотную последовательность, содержащуюся в эпитопе в качестве иммуногена; или способом, предусматривающим определение эпитопа, распознаваемого антителом, полученным общим способом, и выбор антитела, распознающего эпитоп, идентичный эпитопу, распознаваемому антителом против CAPRIN-1. В контексте настоящего изобретения термин "эпитоп" относится к полипептидному фрагменту, обладающему антигенностью или иммуногенностью у млекопитающих, и предпочтительно у людей. Его наименьшая единица состоит приблизительно из 7-12 аминокислот и, предпочтительно, 8-11 аминокислот.
Константа аффинности Ka (kon/koff) антитела по настоящему изобретению, предпочтительно, составляет по меньшей мере 107 M-1, по меньшей мере 108 M-1, по меньшей мере 5×108 M-1, по меньшей мере 109 M-1, по меньшей мере 5×109 M-1, по меньшей мере 1010 M-1, по меньшей мере 5×1010 M-1, по меньшей мере 1011 M-1, по меньшей мере 5×1011 M-1, по меньшей мере 1012 M-1, или по меньшей мере 1013 M-1.
Антитело по настоящему изобретению может быть конъюгировано с противоопухолевым средством. Связывание между антителом и противоопухолевым средством можно проводить через спейсер, имеющий группу, взаимодействующую с аминогруппой, карбоксильной группой, гидрокси группой, тиольной группой или подобной (например, имидилсукцинатной группой, формильной группой, 2-пиридилдитио группой, малеимидильной группой, алкоксикарбонильной группой или гидрокси группой).
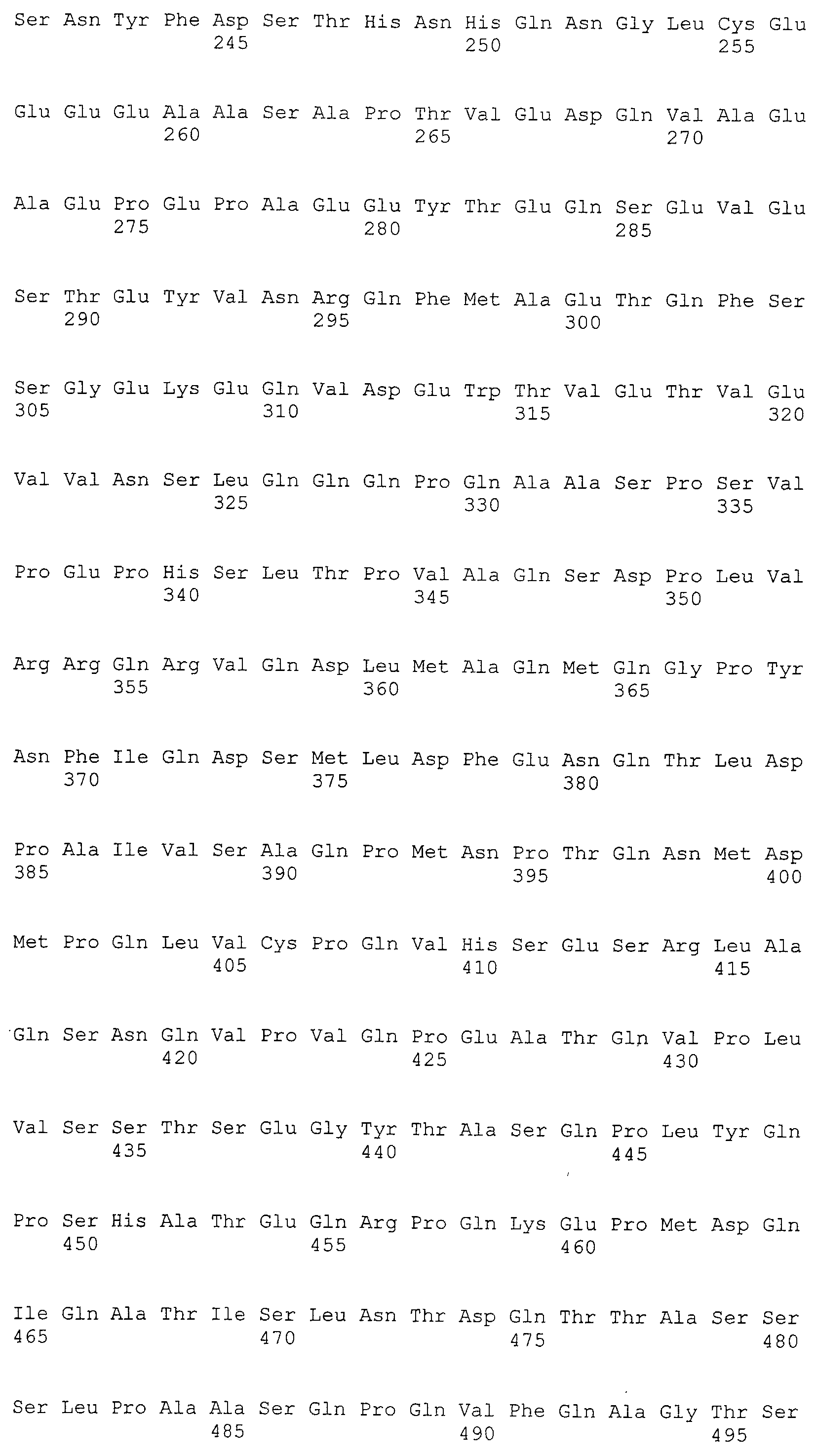
Примеры противоопухолевых средств включают следующие известные противоопухолевые средства или им подобные: паклитаксел, доксорубицин, даунорубицин, циклофосфамид, метотрексат, 5-фторурацил, тиотепа, бусульфан, импросульфан, пипосульфан, бензодопа, карбоквон, метуредопа, уредопа, алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид, триметилолмеламин, буллатацин, буллатицинон, каптотецин, бриостатин, каллистатин, криптофицин 1, криптофицин 8, доластатин, дуокармицин, элеутеробин, панкратистатин, саркодиктин, спонгистатин, хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, меклоретамин, меклоретамин оксид гидрохлорид, мелфалан, новембицин, фенестерин, преднимустин, трофосфамид, урацил мустард, кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин, калихеамицин, динемицин, клодронат, эсперамицин, аклациномицин, актиномицин, аутрамицин, азасерин, блеомицин, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицин, дактиномицин, деторбицин, 6-диазо-5-оксо-L-норлейцин, адриамицин, эпирубицин, эзорубицин, идарубицин, марселломицин, митомицин C, микофеноловую кислоту, ногаламицин, оливомицин, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин, деноптерин, птероптерин, триметрексат, флударабин, 6-меркаптопурин, триамиприн, тиогуанин, анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин, андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон, аминоглютетимид, митотан, трилостан, фролиновую кислоту, ацеглатон, альдофосфамид гликозид, аминолевулиновую кислоту, енилурацил, амсакрин, бестрабуцил, бисантрен, эдатраксат, дефофамин, демеколцин, диазиквон, элфорнитин, эллиптиум ацетат, эпотилон, этоглюцин, лентинан, лонидамин, маитансин, ансамитоцин, митогуазон, митоксантрон, мопиданмол, нитраерин, пентостатин, фенамет, пирарубицин, лозоксантрон, подофиллиновую кислоту, 2-этилгидразид, прокарбазин, разоксан, ризоксин, шизофиллан, спирогерманий, тенуазониевую кислоту, триазиквон, роридин A, ангуидин, уретан, виндезин, дакарбазин, манномустин, митобронитол, митолактол, пипоброман, гацитозин, доцетаксел, хлорамбуцил, гемцитабин, 6-тиогуанин, меркаптопурин, цисплатин, оксалиплатин, карбоплатин, винбластин, этопозид, ифосфамид, митоксантрон, винкристин, винорелбин, новантрон, тенипозид, эдатрексат, дауномицин, аминоптерин, кселода, ибандронат, иринотекан, ингибитор топоизомеразы, дифторметилорнитин (DMFO), ретиноевую кислоту, капецитабин и их фармацевтически приемлемые соли или производные.
Альтернативно, также возможно связывать радиоактивный изотоп, такой как 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 175Lu или 176Lu, известный в ссылках, и тому подобные, с антителом по настоящему изобретению. Желательно чтобы такие радиоактивные изотопы являлись эффективными для лечения опухолей или для диагностики.
Антитело по настоящему изобретению представляет собой антитело, обладающее иммунологической реактивностью в отношении CAPRIN-1 или антитело, обладающее способностью специфически распознавать CAPRIN-1. Такое антитело должно представлять собой антитело, имеющее структуру, которая дает возможность животному, которому вводят это антитело, полностью или почти полностью избежать реакции отторжения. Если животным, подвергающимся воздействию, является человек, примеры указанного выше антитела включают антитела человека, гуманизированные антитела, химерные антитела (например, химерные антитела человека-мыши), одноцепочечные антитела и биспецифичные антитела. Такое антитело представляет собой рекомбинантное антитело, имеющее вариабельные области тяжелой цепи антитела человека и легкой цепи, рекомбинантное антитело, имеющее вариабельные области тяжелой цепи и легкой цепи, каждая из которых состоит из областей, определяющих комплементарность (CDR1, CDR2, и CDR3), из антител животного, не являющегося человеком, и каркасных областей антитела человека, или рекомбинантное антитело, имеющее вариабельные области тяжелой цепи и легкой цепи из антитела, не являющегося антителом человека и константные области тяжелой и легкой цепи антитела человека. Предпочтительными являются первые два антитела.
Указанное выше рекомбинантное антитело может быть получено описанным ниже способом. ДНК, кодирующая моноклональное антитело против CAPRIN-1 человека (например, моноклональное антитело человека, моноклональное антитело мыши, моноклональное антитело крысы, моноклональное антитело кролика или моноклональное антитело цыпленка) клонируют из антителопродуцирующей клетки, такой как гибридома. ДНК, кодирующие вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела, получают с помощью ОТ-ПЦР или подобного с использованием полученного клона в качестве матрицы. Затем, последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи или последовательности CDR1, CDR2, и CDR3 определяют с помощью системы нумерации Kabat EU (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institute of Health, Bethesda, Md. (1991)).
Далее, такие ДНК, кодирующие вариабельные области, или ДНК, кодирующие CDR, получают с помощью технологии рекомбинантных генов (Sambrook et al., Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989)) или синтезатора ДНК. В настоящем изобретении указанная выше гибридома, продуцирующая моноклональные антитела человека, может быть получена путем иммунизации животного, продуцирующего антитела человека (например, мыши), CAPRIN-1 человека и слияния спленоцитов из селезенки, удаленной у животного, с миеломными клетками. Дополнительно к указанному выше, при необходимости, ДНК, кодирующие вариабельные и константные области легкой цепи или тяжелой цепи антитела человека, получают с помощью технологии рекомбинантных генов или синтезатора ДНК.
В случае гуманизированного антитела, получают ДНК, в которой последовательности, кодирующие CDR, в ДНК, кодирующей вариабельную область легкой цепи или тяжелой цепи антитела человека были заменены соответствующими последовательностями, кодирующими CDR антитела от животного, не являющегося человеком (например, мыши, крысы или цыпленка). ДНК, полученную как указано выше, лигируют с ДНК, кодирующей константную область легкой цепи или тяжелой цепи антитела человека. Таким образом, может быть получена ДНК, кодирующая гуманизированное антитело.
В случае химерного антитела, ДНК, кодирующую вариабельную область легкой цепи или тяжелой цепи антитела животного, не являющегося человеком (например, мыши, крысы или цыпленка), лигируют с ДНК, кодирующей константную область легкой цепи или тяжелой цепи антитела человека. Таким образом, может быть получена ДНК, кодирующая химерное антитело.
Одноцепочечное антитело представляет собой антитело, в котором вариабельная область тяжелой цепи и вариабельная область легкой цепи линейно лигированы друг с другом через линкер. ДНК, кодирующая одноцепочечное антитело, может быть получена путем связывания ДНК, кодирующей вариабельную область тяжелой цепи, ДНК, кодирующей линкер, и ДНК, кодирующей вариабельную область легкой цепи. В настоящем изобретении, вариабельная область тяжелой цепи и вариабельная область легкой цепи представляют собой области антитела человека или области антитела человека, в котором отдельно CDR были заменены CDR антитела животного, не являющегося человеком, (например, мыши, крысы или цыпленка). Кроме того, линкер состоит из 12-19 аминокислот. Его примером является (G4S)3, состоящий из 15 аминокислот (G. B. Kim et al., Protein Engineering Design и Selection 2007, 20 (9): 425-432).
Биспецифичное антитело (диатело) представляет собой антитело, способное специфически связываться с двумя различными эпитопами, в котором, например, ДНК, кодирующая вариабельную область А тяжелой цепи, ДНК, кодирующая вариабельную область В легкой цепи, ДНК, кодирующая вариабельную область В тяжелой цепи и ДНК, кодирующая вариабельную область А легкой цепи связаны друг с другом в таком порядке (при условии, что ДНК, кодирующая вариабельную область В легкой цепи и ДНК, кодирующая вариабельную область В тяжелой цепи связаны друг с другом через ДНК, кодирующую линкер, описанный выше). Таким образом, может быть получена ДНК, кодирующая биспецифичное антитело. В настоящем изобретении как вариабельная область тяжелой цепи, так и вариабельная область легкой цепи представляют собой области антитела человека или области антитела человека, в котором отдельно CDR были заменены CDR антитела животного, не являющегося человеком (например, мыши, крысы или цыпленка).
Рекомбинантную ДНК, полученную как указано выше, встраивают в один или множество соответствующих векторов. Каждый такой вектор вводят в клетку-хозяина (например, клетку млекопитающего, дрожжевую клетку или клетку насекомого) для (со)экспрессии. Таким образом может быть получено рекомбинантное антитело (P. J. Delves., ANTIBODY PRODUCTION ESSENTIAL TECHNIQUES., 1997 WILEY, P. Shepherd and C. Dean., Monoclonal Antibodies., 2000 OXFORD UNIVERSITY PRESS; J. W. Goding, Monoclonal Antibodies: Principles и Practice., 1993 ACADEMIC PRESS).
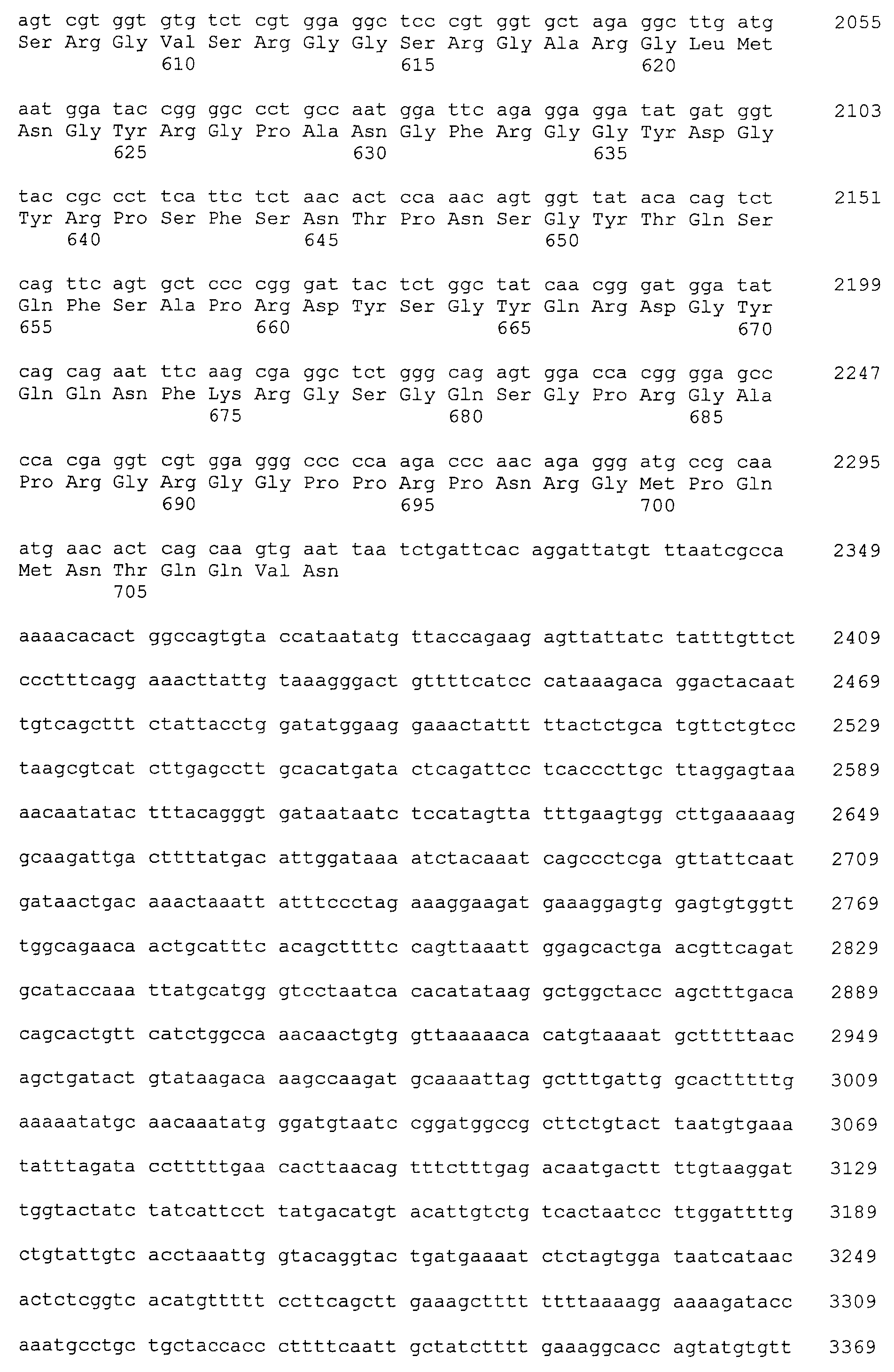
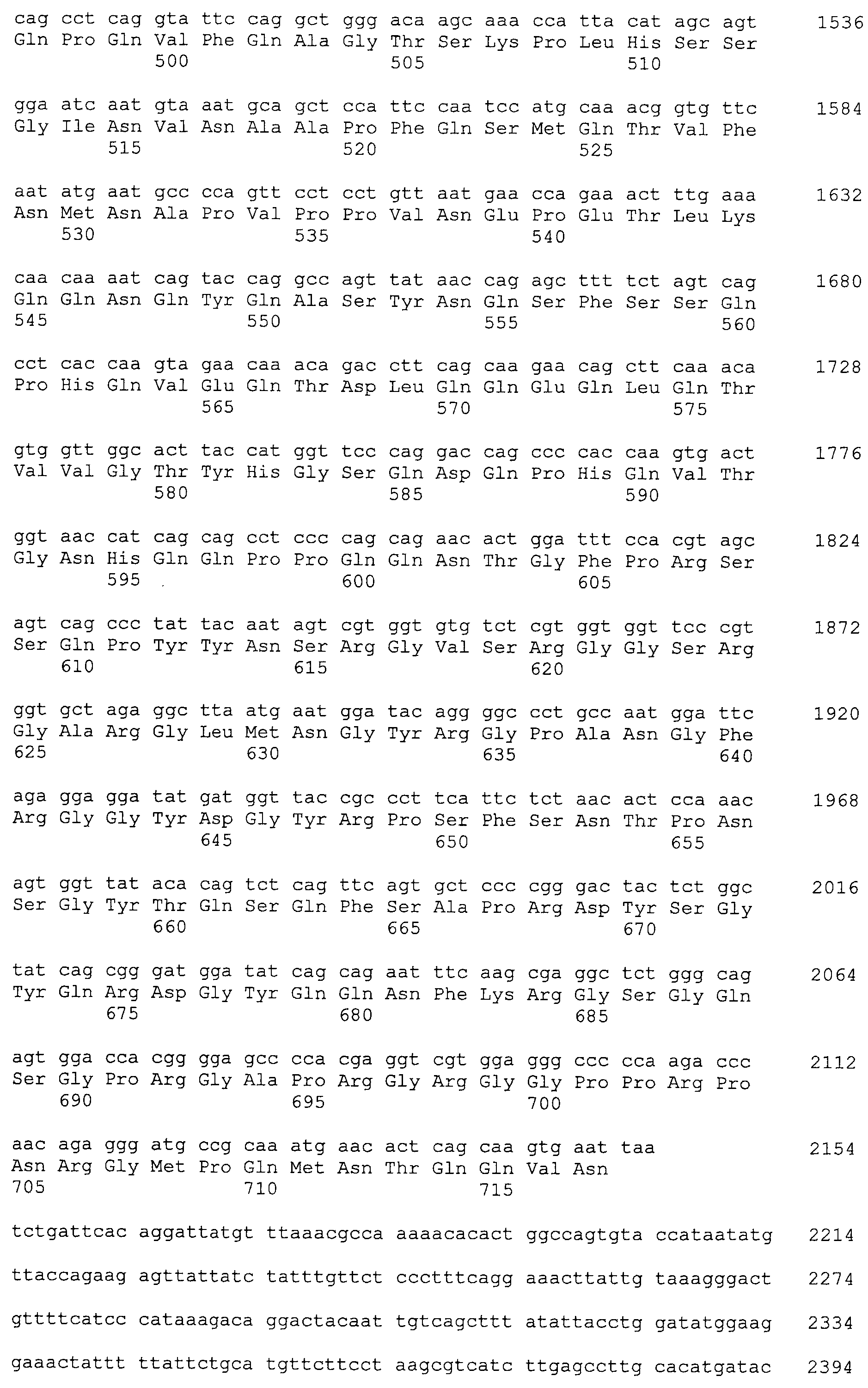
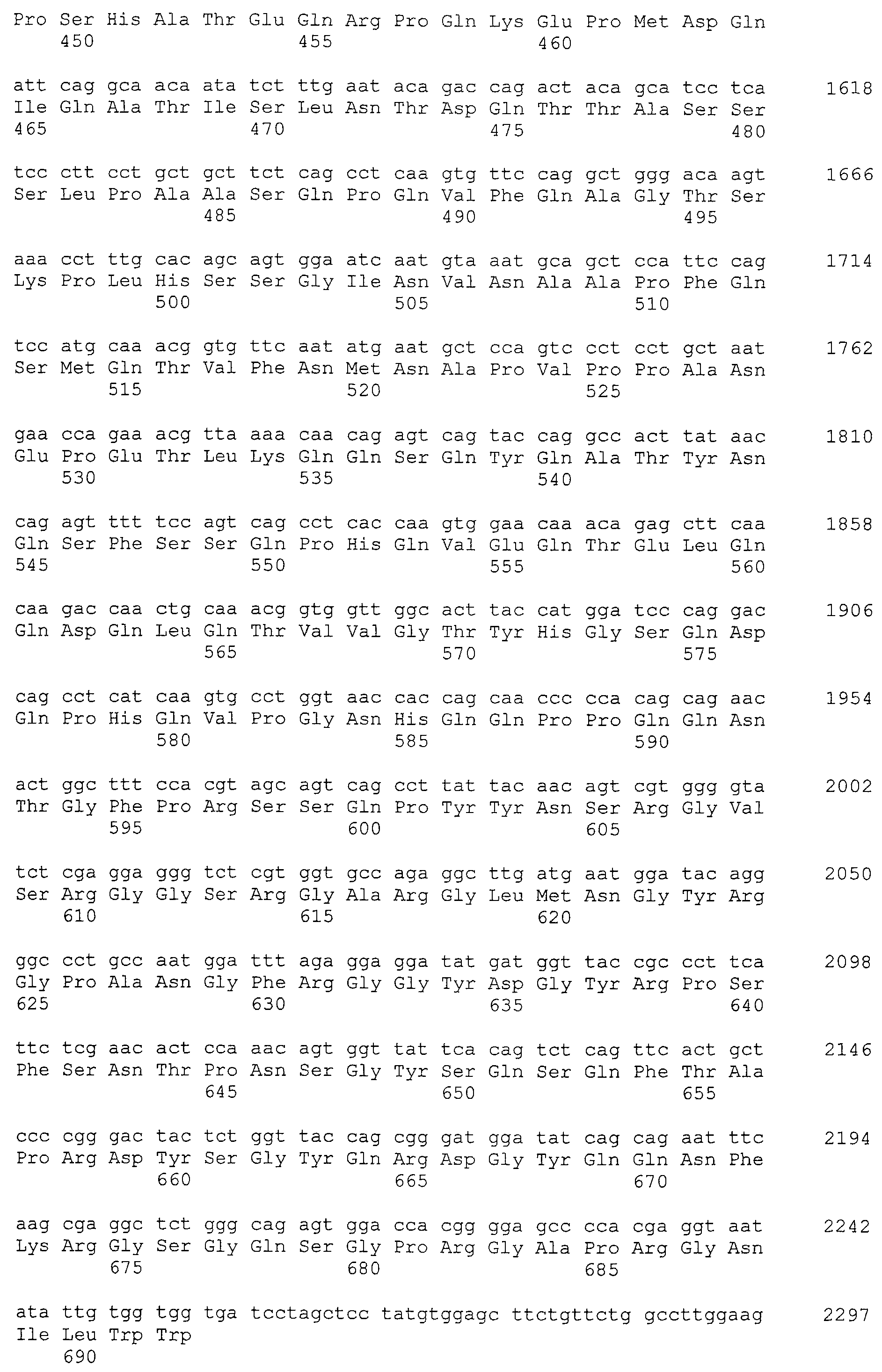
Примеры антитела по настоящему изобретению, полученного указанным выше способом, включают следующие антитела (a)-(k).
(a) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:40, 41 и 42, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:44, 45 и 46 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:43 и вариабельной области легкой цепи последовательности SEQ ID NO:47).
(b) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:40, 41 и 42, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:50, 51 и 52 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:43 и вариабельной области легкой цепи последовательности SEQ ID NO:53).
(c) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:40, 41 и 42, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:55, 56 и 57 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:43 и вариабельной области легкой цепи последовательности SEQ ID NO:58).
(d) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:40, 41 и 42, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:60, 61 и 62 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:43 и вариабельной области легкой цепи последовательности SEQ ID NO:63).
(e) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:40, 41 и 42, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:65, 66 и 67 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO: 43 и вариабельной области легкой цепи последовательности SEQ ID NO: 68).
(f) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:70, 71 и 72, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:74, 75 и 76 (и, предпочтительно3 антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:73 и вариабельной области легкой цепи последовательности SEQ ID NO:77).
(g) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:80, 81 и 82, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:84, 85 и 86 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO: 83 и вариабельной области легкой цепи последовательности SEQ ID NO: 87).
(h) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:90, 91 и 92, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:94, 95 и 96 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:93 и вариабельной области легкой цепи последовательности SEQ ID NO:97).
(i) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:100, 101 и 102, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:104, 105 и 106 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:103 и вариабельной области легкой цепи последовательности SEQ ID NO:107).
(j) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:110, 111 и 112, и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:114, 115 и 116 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:113 и вариабельной области легкой цепи последовательности SEQ ID NO:117).
(k) Антитело, содержащее вариабельную область тяжелой цепи, содержащую последовательности SEQ ID NO:120, 121 и 122 и вариабельную область легкой цепи, содержащую последовательности SEQ ID NO:124, 125 и 126 (и, предпочтительно, антитело, состоящее из вариабельной области тяжелой цепи последовательности SEQ ID NO:123 и вариабельной области легкой цепи последовательности SEQ ID NO:127).
В настоящем изобретении, аминокислотные последовательности, показанные в SEQ ID NO:40, 41 и 42, аминокислотные последовательности SEQ ID NO:70, 71 и 72, аминокислотные последовательности SEQ ID NO:80, 81 и 82, аминокислотные последовательности SEQ ID NO:90, 91 и 92, аминокислотные последовательности SEQ ID NO:100, 101 и 102, аминокислотные последовательности SEQ ID NO:110, 111 и 112, или аминокислотные последовательности SEQ ID NO:120, 121 и 122 соответствуют CDR1, CDR2, и CDR3 вариабельных областей тяжелой цепи антитела мыши, соответственно. Кроме того, аминокислотные последовательности SEQ ID NO:44, 45 и 46, аминокислотные последовательности SEQ ID NO:50, 51 и 52, аминокислотные последовательности SEQ ID NO: 55, 56 и 57, аминокислотные последовательности SEQ ID NO: 60, 61 и 62, аминокислотные последовательности SEQ ID NO:65, 66 и 67, аминокислотные последовательности SEQ ID NO: 74, 75 и 76, аминокислотные последовательности SEQ ID NO: 84, 85 и 86, аминокислотные последовательности SEQ ID NO: 94, 95 и 96, аминокислотные последовательности SEQ ID NO: 104, 105 и 106, аминокислотные последовательности SEQ ID NO: 114, 115 и 116, или аминокислотные последовательности SEQ ID NO: 124, 125 и 126 соответствуют CDR1, CDR2, и CDR3 вариабельных областей легкой цепи антитела мыши, соответственно.
Кроме того, гуманизированное антитело, химерное антитело, одноцепочечное антитело или биспецифичное антитело по настоящему изобретению представляет собой, например, следующее антитело (i) или (ii) (пример антитела (a) описан ниже).
(i) Антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:40, 41 и 42, и аминокислотную последовательность каркасной области антитела человека; и вариабельную область легкой цепи, содержащую аминокислотные последовательности SEQ ID NO:44, 45 и 46, и аминокислотные последовательности каркасных областей антитела человека (и, предпочтительно, антитело, содержащее аминокислотную последовательность SEQ ID NO: 43 в вариабельной области тяжелой цепи и аминокислотную последовательность SEQ ID NO: 47 в вариабельной области легкой цепи).
(ii) Антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 40, 41 и 42, и аминокислотные последовательности каркасных областей антитела человека; константную область тяжелой цепи, содержащую аминокислотную последовательность антитела человека; вариабельную область легкой цепи, содержащую аминокислотные последовательности SEQ ID NO:44, 45 и 46 и аминокислотные последовательности каркасных областей антитела человека; и константную область легкой цепи, содержащей аминокислотную последовательность антитела человека (и предпочтительно антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:43; константную область тяжелой цепи, содержащую аминокислотную последовательность антитела человека; вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:47; и константную область легкой цепи, содержащую аминокислотную последовательность антитела человека).
Кроме того, последовательности константных и вариабельных областей тяжелой цепи и легкой цепи антитела человека могут быть получены, например, из NCBI (U.S.A: GenBank, UniGene, etc.). Например, следующие последовательности могут быть использованы в качестве эталонных последовательностей для соответствующих областей: последовательность с регистрационным номером J00228 для константной области тяжелой цепи IgG1 человека; последовательность с регистрационным номером J00230 для константной области тяжелой цепи IgG2 человека; последовательность с регистрационным номером X03604 для константной области тяжелой цепи IgG3 человека; последовательность с регистрационным номером K01316 для константной области тяжелой цепи IgG4 человека; последовательность с регистрационным номером V00557, X64135, или X64133 для константной области легкой цепи κ человека; и последовательность с регистрационным номером X64132 или X64134 для константной области легкой цепи λ человека.
Указанные выше антитела предпочтительно обладают цитотоксической активностью, тем самым проявляя противоопухолевые эффекты.
Кроме того, указанные выше специфические последовательности вариабельных областей тяжелой цепи и легкой цепи, и CDR в антителе описаны всего лишь для пояснения на примере. Очевидно, что настоящее изобретение не ограничено конкретными последовательностями. Получают гибридому, способную продуцировать различные антитела человека или антитела животного, не являющегося человеком (например, антитело мыши), против CAPRIN-1 человека. Получают моноклональное антитело, продуцируемое этой гибридомой. Затем, определяют, является ли, или нет, полученное антитело антителом, представляющим интерес, используя в качестве показателей иммунологическую активность связывания и цитотоксическую активность в отношении CAPRIN-1 человека. Таким образом, идентифицируют гибридому, продуцирующую представляющие интерес моноклональные антитела. После этого, как описано выше, ДНК, кодирующие вариабельные области тяжелой цепи и легкой цепи антитела, представляющего интерес, получают из гибридомы для определения последовательности. ДНК используют для получения различных антител.
Далее, указанное выше антитело по настоящему изобретению может представлять собой любое из антител с (i) по (iv), указанное выше, имеющее замену, делецию или добавление одной или нескольких (и предпочтительно, 1 или 2) аминокислот, в частности, в последовательности каркасной области и/или последовательности константной области, при условии, что оно обладает специфическим свойством специфически распознавать CAPRIN-1. В настоящем изобретении термин "несколько аминокислот" означает от 2 до 5, и, предпочтительно, 2 или 3 аминокислоты.
Кроме того, в соответствии с настоящим изобретением, также представлена ДНК, кодирующая указанное выше антитело по настоящему изобретению, ДНК, кодирующая тяжелую цепь или легкую цепь антитела, или ДНК, кодирующая вариабельную область тяжелой цепи или легкой цепи антитела. Например, в случае антитела (a), примеры такой ДНК включают: ДНК, кодирующую вариабельную область тяжелой цепи, содержащую нуклеотидные последовательности, кодирующие аминокислотные последовательности SEQ ID NO:40, 41 и 42; и ДНК, кодирующую вариабельную область легкой цепи, содержащую нуклеотидные последовательности, кодирующие аминокислотные последовательности SEQ ID NO:44, 45 и 46.
Области, определяющие комплементарность (CDR), кодируемые ДНК указанных выше последовательностей, представляют собой области, которые определяют специфичность антитела. Следовательно, последовательности, кодирующие другие области (т.е., константные области и каркасные области) в антителе могут представлять собой последовательности из другого антитела. В настоящем изобретении другие антитела включают антитела из организмов, не являющихся человеком. Однако, принимая во внимание уменьшение побочных эффектов, предпочтительными являются антитела, полученные от человека. Другими словами, в указанном выше случае, области ДНК, кодирующие каркасные области и константные области тяжелых и легких цепей предпочтительно содержат нуклеотидные последовательности, кодирующие релевантные аминокислотные последовательности из антитела человека.
Далее, различные примеры ДНК, кодирующих антитело по настоящему изобретению, такое как антитело (a), включают ДНК, кодирующую вариабельную область тяжелой цепи, содержащую нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO:43, и ДНК, в которой область, кодирующая вариабельную область легкой цепи, содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO:47. В настоящем изобретении примером нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO:43, является нуклеотидная последовательность SEQ ID NO:48. Кроме того, примером нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO:47, является нуклеотидная последовательность SEQ ID NO:49. Также, указанные выше ДНК, кодирующие константные области тяжелой цепи и легкой цепи, предпочтительно содержат нуклеотидные последовательности, кодирующие соответствующие аминокислотные последовательности антител человека.
ДНК по настоящему изобретению может быть получена, например, с помощью указанных выше способов или следующими способами. Сначала, суммарную РНК получают из гибридомы для антитела по настоящему изобретению с использованием коммерчески доступного набора для экстракции РНК. Затем, синтезируют кДНК с помощью обратной транскриптазы с использованием случайных праймеров и подобного. Далее, кДНК, кодирующую антитело, амплифицируют методом ПЦР, используя в качестве праймеров олигонуклеотиды, имеющие последовательности, консервативные в вариабельных областях известных генов тяжелой цепи и легкой цепи антитела мыши. Последовательности, кодирующие константные области, могут быть получены путем амплификации известных последовательностей с помощью метода ПЦР. Нуклеотидная последовательность ДНК может быть определена общим способом, включающим, например, встраивание в плазмиду или фаг для определения последовательности.
Считается, что противоопухолевые эффекты антитела против CAPRIN-1, используемого в настоящем изобретении, на злокачественные клетки, экспрессирующие CAPRIN-1, демонстрируются посредством механизмов цитотоксичности, описанных ниже.
Цитотоксичность представляет собой эффекторную клеточно-опосредованную антителозависимую клеточную цитотоксичность (ADCC) в отношении клеток, экспрессирующих CAPRIN-1, и комплемент-зависимую цитотоксичность (CDC) в отношении клеток, экспрессирующих CAPRIN-1.
Соответственно, активность антитела против CAPRIN-1, используемого в настоящем изобретении, может быть оценена путем ex vivo определения ADCC активности или CDC активности в отношении злокачественных клеток, экспрессирующих CAPRIN-1, как конкретно описано в Примерах, приведенных ниже.
Антитело против CAPRIN-1, используемое в настоящем изобретении, связывается с белком CAPRIN-1 на злокачественных клетках и демонстрирует противоопухолевые эффекты на основании указанной выше активности. Следовательно, считается, что такое антитело подходит для лечения или профилактики злокачественных опухолей. В частности, в соответствии с настоящим изобретением, представлена фармацевтическая композиция для лечения и/или профилактики злокачественной опухоли, которая содержит в качестве активного ингредиента антитело против CAPRIN-1. В тех случаях, когда антитело против CAPRIN-1 используют для целей введения антитела людям (лечение антителами), его предпочтительно, использовать в виде антитела человека или гуманизированного антитела для уменьшения иммуногенности.
Кроме того, по мере увеличения аффинности связывания между антителом против CAPRIN-1 и белком CAPRIN-1 на поверхности злокачественных клеток, более сильная противоопухолевая активность может быть продемонстрирована антителом против CAPRIN-1. Следовательно, если может быть получено антитело против CAPRIN-1, имеющее высокую аффинность связывания с белком CAPRIN-1, может ожидаться проявление еще более сильных противоопухолевых эффектов. Соответственно, становится возможным использовать такое антитело в качестве фармацевтической композиции для лечения и/или профилактики злокачественных опухолей. Как описано выше, для высокой аффинности связывания константа аффинности Ka (kon/koff) предпочтительно составляет по меньшей мере 107 M-1, по меньшей мере 108 M-1, по меньшей мере 5×108 M-1, по меньшей мере 109 M-1, по меньшей мере 5×109 M-1, по меньшей мере 1010 M-1, по меньшей мере 5×1010 M-1, по меньшей мере 1011 M-1, по меньшей мере 5×1011 M-1, по меньшей мере 1012 M-1, или по меньшей мере 1013 M-1.
Связывание с клетками, экспрессирующими антиген
Способность антитела связываться с CAPRIN-1 может быть описана посредством анализа связывания с использованием, например, ELISA, Вестерн-блоттинга, иммунофлуоресценции или проточной цитометрии, как описано в “Примерах”.
Иммуногистохимическое окрашивание
Антитело, которое распознает CAPRIN-1, может быть протестировано в отношении взаимодействия с CAPRIN-1 с помощью иммуногистохимического способа, известного специалистам в данной области, с использованием замороженного среза ткани, фиксированного параформальдегидом или ацетоном, или заключенного в парафин среза ткани, фиксированного параформальдегидом. Такой срез получают из ткани, полученной от пациента во время хирургической операции или от животного с ксенотрансплантированной тканью, которое было инокулировано линией природных клеток или трансфектированной клеточной линией, которая экспрессирует CAPRIN-1.
Для иммуногистохимического окрашивания, антитело, взаимодействующее с CAPRIN-1, может быть окрашено различными способами. Например, оно может быть визуализировано путем взаимодействия с антителом козы против антитела мыши, конъюгированным с пероксидазой хрена, или антителом козы против антитела кролика.
Фармацевтическая композиция
Мишень для фармацевтической композиции для лечения и/или профилактики злокачественных опухолей по настоящему изобретению, конкретно не ограничена, при условии, что этой мишенью является злокачественная опухоль (клетка), экспрессирующая ген CAPRIN-1.
Оба термина "опухоль" и "злокачественная опухоль", используемые в контексте настоящего изобретения, относятся к злокачественному новообразованию и, следовательно они используются взаимозаменяемо.
Злокачественная опухоль, которая может быть мишенью в настоящем изобретении, представляет собой злокачественную опухоль, экспрессирующую ген, кодирующий полипептид, содержащий любую аминокислотную последовательность с четными номерами SEQ ID NO:2-30 или частичную последовательность, состоящую из 7 или более последовательных аминокислот указанной аминокислотной последовательности. Предпочтительные примеры злокачественных опухолей включают рак молочной железы, опухоль головного мозга, лейкоз, лимфому, мастоцитому, рак пищевода и рак толстой кишки.
Примеры этих конкретных злокачественных опухолей включают, но не только, аденокарциному молочной железы, аденокарциному молочной железы комбинированного типа, смешанную злокачественную опухоль молочной железы, внутрипротоковую папиллярную аденокарциному, аденокарциному легких, сквамозноклеточный рак, мелкоклеточный рак, крупноклеточный рак, глиому, которая представляет собой опухоль нейроэпителиальной ткани, эпендиому, нейрональную опухоль, эмбриональную нейроэктодермальную опухоль, шванному, нейрофиброму, менингиому, хронический лимфоцитарный лейкоз, лимфому, гастроинтестинальную лимфому, лимфому пищеварительного тракта, мелкоклеточную-промежуточноклеточную лимфому, рак слепой кишки, рак восходящей ободочной кишки, рак нисходящей ободочной кишки, рак поперечной ободочной кишки, рак сигмовидной кишки и рак прямой кишки.
Кроме того, животным, подвергающимся воздействию в соответствии с настоящим изобретением, является млекопитающее. Примеры включают таких млекопитающих как приматы, домашние животные-любимцы, крупный рогатый скот и спортивные животные. Особенно предпочтительными являются люди, собаки и кошки.
В тех случаях, когда антитело, используемое в настоящем изобретении, используют в качестве фармацевтической композиции, оно может быть получено в виде композиции способом, известным специалистам в данной области. Например, антитело может быть использовано парентерально в виде парентеральной инъекции асептического раствора, содержащего воду или фармакологически приемлемого не водного раствора; или жидкой суспензии. Например, в одном возможном случае, антитело может быть получено в виде композиции в сочетании с использованием фармацевтически приемлемого носителя или среды и специально стерилизованной воды, физиологического раствора, растительного масла, эмульгатора, суспензии, поверхностно-активного вещества, стабилизатора, вкусо-ароматического вещества, эксципиента, носителя, консерванта или связующего, соответствующим образом, путем перемешивания, в единичной лекарственной форме, необходимой для подходящей в целом фармацевтической композиции. Количество активного ингредиента в композиции определяют таким образом, чтобы достигалась соответствующая доза в указанном интервале.
Асептическая композиция для инъекционных целей может быть получена в соответствии с общей практикой получения композиций с использованием носителя, такого как дистиллированная вода для инъекционных целей.
Примеры водного раствора для инъекционных целей включают физиологический раствор и изотоничные растворы, содержащие глюкозу и другие адъюванты, такие как D-сорбит, D-манноза, D-маннитол и хлорид натрия. Такой раствор может быть использован с соответствующими веществами, способствующими растворению. Примеры таких веществ, способствующих растворению, включают спирты, такие как этанол и полиспирт, пропиленгликоль, полиэтиленгликоль и неионные поверхностно-активные вещества, такие как полисорбат 80(TM) и HCO-60.
Примеры жидких масел включают кунжутное масло и соевое масло. Такие жидкие масла могут быть использованы в сочетании с веществом, способствующим растворению, таким как бензилбензоат или бензиловый спирт. Кроме того, его можно смешивать с буферным агентом, таким как фосфатно-буферный раствор, ацетат натриевый буферный раствор, смягчающим средством, таким как прокаина гидрохлорид, стабилизатором, таким как бензиловый спирт, фенол или антиоксидант. В основном, полученный в виде композиции инъекционный раствор вводят в подходящую ампулу.
Указанную выше фармацевтическую композицию вводят перорально или парентерально. Предпочтительно, эту композицию вводят парентерально. Конкретные примеры лекарственных форм включают инъецируемые средства, средства, вводимые интраназально, средства, вводимые через легкие, и средства, вводимые через кожу. Например, инъецируемые средства могут быть введены системно или местно путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции или подкожной инъекции.
Кроме того, способ введения может быть определен соответствующим образом в зависимости от возраста пациента, массы тела, пола и симптомов. Однократная доза фармацевтической композиции, содержащей антитело или полинуклеотид, кодирующий антитело, может быть выбрана в интервале, например, от 0,0001 мг до 1000 мг на кг массы тела. Альтернативно, доза может быть выбрана в интервале, например, от 0,001 до 100000 мг на массу тела пациента; однако, необязательно ограничивать дозу этими значениями. Дозу и способ введения меняют в зависимости от возраста пациента, массы тела, пола и симптомов. Однако, специалисты в данной области могут соответствующим образом выбрать дозу и способ.
Полипептид и ДНК
В соответствии с настоящим изобретением, далее представлены следующие полипептиды и ДНК для антител (a)-(k), описанных выше.
(i) Полипептид, содержащий аминокислотные последовательности SEQ ID NO:43, SEQ ID NO:73, SEQ ID NO:83, SEQ ID NO:93, SEQ ID NO:103, SEQ ID NO:113, и SEQ ID NO:123, и ДНК, кодирующая этот полипептид.
(ii) Полипептид, содержащий аминокислотные последовательности SEQ ID NO:47, SEQ ID NO:53, SEQ ID NO:58, SEQ ID NO:63, SEQ ID NO:68, SEQ ID NO:77, SEQ ID NO:87, SEQ ID NO:97, SEQ ID NO:107, SEQ ID NO:117, и SEQ ID NO:127, и ДНК, кодирующая этот полипептид.
(iii) ДНК, содержащая нуклеотидные последовательности SEQ ID NO:48, SEQ ID NO:78, SEQ ID NO: 88, SEQ ID NO:98, SEQ ID NO: 108, SEQ ID NO:118, и SEQ ID NO:128.
(iv) ДНК, содержащая нуклеотидные последовательности SEQ ID NO: 49, SEQ ID NO: 54, SEQ ID NO:59, SEQ ID NO: 64, SEQ ID NO: 69, SEQ ID NO: 79, SEQ ID NO: 89, SEQ ID NO: 99, SEQ ID NO: 109, SEQ ID NO: 119, и SEQ ID NO: 129.
(v) Полипептид CDR тяжелой цепи, содержащий аминокислотные последовательности, выбранные из группы, состоящей из аминокислотных последовательностей SEQ ID NO:40, 41 и 42, аминокислотных последовательностей SEQ ID NO:70, 71 и 72, аминокислотных последовательностей SEQ ID NO:80, 81 и 82, аминокислотных последовательностей SEQ ID NO:90, 91 и 92, аминокислотных последовательностей SEQ ID NO:100, 101 и 102, аминокислотных последовательностей SEQ ID NO:110, 111 и 112, и аминокислотных последовательностей SEQ ID NO:120, 121 и 122, и ДНК, кодирующая этот полипептид.
(vi) Полипептид CDR легкой цепи, содержащий аминокислотные последовательности, выбранные из группы, состоящей из аминокислотных последовательностей SEQ ID NO:44, 45 и 46, аминокислотных последовательностей SEQ ID NO:50, 51 и 52, аминокислотных последовательностей SEQ ID NO:55, 56 и 57, аминокислотных последовательностей SEQ ID NO:60, 61 и 62, аминокислотных последовательностей SEQ ID NO:65, 66 и 67, аминокислотных последовательностей SEQ ID NO:74, 75 и 76, аминокислотных последовательностей SEQ ID NO:84, 85 и 86, аминокислотных последовательностей SEQ ID NO:94, 95 и 96, аминокислотных последовательностей SEQ ID NO:104, 105 и 106, аминокислотных последовательностей SEQ ID NO:114, 115 и 116, и аминокислотных последовательностей SEQ ID NO:124, 125 и 126, и ДНК, кодирующая этот полипептид.
Эти полипептиды и ДНК могут быть получены с помощью технологии рекомбинантных генов, как описано выше.
ПРИМЕРЫ
Настоящее изобретение будет описано более подробно со ссылкой на примеры, изложенные ниже; однако, технический объем настоящего изобретения не ограничен примерами.
Пример 1: идентификация нового антигенного белка злокачественной опухоли способом SEREX
(1) конструирование библиотеки кДНК
Суммарную РНК экстрагировали из ткани семенников здоровой собаки способом кислого гуанидия-фенол-хлороформа, а затем полиА РНК очищали, в соответствии с протоколами, включенными в набор для очистки Oligotex-dT30 mRNA (Takara Shuzo Co., Ltd.).
Фаговую библиотеку кДНК семенников собаки синтезировали, используя полученную таким образом мРНК (5 мкг). Фаговую библиотеку кДНК конструировали, используя набор для синтеза кДНК cDNA Synthesis Kit, ZAP-cDNA Synthesis Kit, и набор для клонирования ZAP-cDNA GigapackIII Gold Cloning Kit (STRATAGENE), в соответствии с протоколами, включенными в эти наборы. Размер сконструированной таким образом фаговой библиотеки кДНК составил 7,73×105 бляшкообразующих единиц/мл.
(2) Скрининг библиотеки кДНК с использованием сыворотки
Иммунологический скрининг проводили с использованием сконструированной выше фаговой библиотеки кДНК семенников собаки. В частности, клетка-хозяин Escherichia coli (XL1-Blue MRF') была инфицирована фагом на NZY агарозном планшете (Φ90×15 мм) так, чтобы получить 2210 клонов. Клетки E. coli культивировали при 42°C в течение 3-4 часов для образования бляшек. Планшет покрывали нитроцеллюлозной мембраной (Hybond C Extra: GE Healthcare Bio-Science), пропитанной IPTG (изопропил-β-D-тиогалактозид) при 37°C в течение 4 часов, так, чтобы белок был индуцирован, экспрессирован, а затем перенесен на эту мембрану. После этого, мембрану собирали, а затем погружали в TBS (10 мМ Tris-HCl, 150 мМ NaCl, и pH 7,5), содержащий 0,5% сухого обезжиренного молока, с последующим встряхиванием в течение ночи при 4°C, тем самым подавляя неспецифическую реакцию. Проводили взаимодействие фильтра с разведенной в 500 раз сывороткой пациента-собаки при комнатной температуре в течение 2-3 часов.
В качестве указанной выше сыворотки пациента-собаки, была использована сыворотка, полученная от собаки с раком молочной железы. Эти сыворотки хранили при -80°C, а затем подвергали предварительной обработке непосредственно перед использованием. Способ предварительной обработки сыворотки представляет собой следующее. В частности, клетка-хозяин Escherichia coli (XL1-Blue MRF') была инфицирована фагом λ ZAP Express, в который чужеродный ген не был встроен, а затем культивирована в течение ночи на NZY среде для чашек Петри при 37°C. После этого, буфер (0,2 M NaHCO3 и pH 8,3), содержащий 0,5 M NaCl, добавляли в чашку, чашку оставляли стоять при 4°C в течение 15 часов, а затем супернатант собирали в виде Escherichia coli/фаговый экстракт. Далее, полученный таким образом Escherichia coli/фаговый экстракт наносили на NHS-колонку (GE Healthcare Bio-Science), так, чтобы был иммобилизован белок, происходящий из фага Escherichia coli. Сыворотку пациента-собаки наносили на колонку с иммобилизированным белком для взаимодействия, а затем Escherichia coli и антитело, адсорбированное на фаге, удаляли из сыворотки. Фракцию сыворотки, которая прошла через колонку, разбавляли в 500 раз с использованием TBS, содержащего 0,5% сухого обезжиренного молока. Полученное в результате соединение использовали в качестве материала для иммуноскрининга.
Мембрана, на которую переносили обработанную сыворотку и указанный выше слитый белок, промывали 4 раза с использованием TBS-T (0,05% Tween20/TBS), а затем подвергали реакции с антителами козы против IgG собаки (Goat anti-Dog IgG-h+I HRP conjugated (BETHYL Laboratories)), разбавленными в 5000 раз с использованием TBS, содержащего 0,5% сухого обезжиренного молока, в качестве вторичного антитела, в течение 1 часа при комнатной температуре. Обнаружение проводили посредством цветовой ферментативной реакции с использованием реакционного раствора NBT/BCIP (Roche). Колонии, которые соответствовали участкам, положительным для цветовой реакции, собирали с NZY агарозных чашек (Φ90×15 мм), а затем суспендировали в 500 мкл SM буфера (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ Tris-HCl, 0,01% желатин, и pH 7,5). До тех пор, пока колонии, положительные для цветовой реакции, не были единообразными, вторичный и третичный скрининг повторяли способом, аналогичным описанному выше, так, чтобы 30940 фаговых колоний, взаимодействующих с сывороточным IgG, были подвергнуты скринингу. Таким образом, было выделено 5 позитивных клонов.
(3) Исследование гомологии выделенного гена антигена
Для анализа нуклеотидной последовательности 5 позитивных клонов, выделенных указанным выше способом, проводили процедуру конверсии из фаговых векторов в плазмидные векторы. В частности, было получено 200 мкл раствора, содержащего клетку-хозяина Escherichia coli (XL1-Blue MRF'), так, чтобы поглощение OD600 равнялось 1,0. Этот раствор перемешивали с 250 мкл очищенного фагового раствора, а затем с 1 мкл хелперного фага ExAssist (STRATAGENE), с последующим взаимодействием в течение 15 минут при 37°C. Добавляли три (3) мл среды LB, а затем проводили культивирование при 37°C в течение 2,5-3 часов. Сразу же после культивирования, температуру раствора поддерживали при 70°C с помощью водяной бани в течение 20 минут, центрифугирование проводили при 4°C и 1000×g в течение 15 минут, а затем супернатант собирали в виде раствора фагемиды. После этого, получали 200 мкл раствора, содержащего клетку-хозяина фагемиды Escherichia coli (SOLR), так, чтобы поглощение OD600 равнялось 1,0. Этот раствор перемешивали с 10 мкл очищенного раствора фага, с последующим взаимодействием в течение 15 минут при 37°C. Раствор (50 мкл) высевали на LB агаровую среду, содержащую ампициллин (конечная концентрация 50 мкг/мл), а затем культивировали в течение ночи при 37°C. Трансформированную SOLR одиночную колонию собирали, а затем культивировали в среде LB, содержащей ампициллин (конечная концентрация: 50 мкг/мл) при 37°C. Плазмидную ДНК, содержащую представляющую интерес вставку, очищали, используя набор QIAGEN plasmid Miniprep Kit (QIAGEN).
Очищенную плазмиду подвергали анализу полноразмерной последовательности вставки способом "блуждающей затравки", используя T3 праймер с последовательностью SEQ ID NO:31 и праймер T7 с последовательностью SEQ ID NO:32. В результате анализа последовательностей, были получены генные последовательности с SEQ ID NO:5, 7, 9, 11 и 13. Программа исследования гомологии, BLAST search (http://www.ncbi.nlm.nih.gov/BLAST/), была выполнена с использованием нуклеотидных последовательностей генов и соответствующих аминокислотных последовательностей (SEQ ID NO:6, 8, 10, 12 и 14). В результате исследования гомологии с известными генами, было установлено, что все из 5 полученных генов кодировали CAPRIN-1. Что касается областей, транслируемых в белки, идентичность последовательности среди 5 генов составляла 100% в отношении нуклеотидной последовательности и 99% в отношении аминокислотной последовательности. Также, что касается областей, транслируемых в белки, идентичность последовательности между этими генами и генами, кодирующими их факторы гомологии у человека (гомологи человека), составила 94% в отношении нуклеотидной последовательности и 98% в отношении аминокислотной последовательности. Нуклеотидные последовательности гомологов человека показаны в SEQ ID NO:1 и 3 и их же аминокислотные последовательности показаны в SEQ ID NO:2 и 4. Также, что касается областей, транслируемых в белки, идентичность последовательности между полученными генами собак и геном, кодирующим гомолог крупного рогатого скота, составляла 94% в отношении нуклеотидной последовательности и 97% в отношении аминокислотной последовательности. Нуклеотидная последовательность гомолога крупного рогатого скота показана в SEQ ID NO: 15 и его аминокислотная последовательность показана в SEQ ID NO: 16. Кроме того, что касается областей, транслируемых в белки, идентичность последовательности между генами, кодирующими гомологи человека, и геном, кодирующим гомолог крупного рогатого скота, была 94% в отношении нуклеотидной последовательности, и в интервале от 93% до 97% в отношении аминокислотной последовательности. Также, что касается областей, транслируемых в белки, идентичность последовательности между полученными генами собаки и геном, кодирующим гомолог лошадей, была 93% в отношении нуклеотидной последовательности и 97% в отношении аминокислотной последовательности. Нуклеотидная последовательность гомолога лошадей показана в SEQ ID NO: 17 и его аминокислотная последовательность показана в SEQ ID NO: 18. Кроме того, что касается областей, транслируемых в белки, идентичность последовательности между генами, кодирующими гомологи человека, и геном, кодирующим гомолог лошади, была 93% в отношении нуклеотидной последовательности и 96% в отношении аминокислотной последовательности. Также, что касается областей, транслируемых в белки, идентичность последовательности между полученными генами собаки и генами, кодирующими гомологи мыши, была в интервале от 87% до 89% в отношении нуклеотидной последовательности и в интервале от 95% до 97% в отношении аминокислотной последовательности. Нуклеотидные последовательности гомологов мыши показаны в SEQ ID NO:19, 21, 23, 25 и 27 и их же аминокислотные последовательности показаны в SEQ ID NO:20, 22, 24, 26 и 28. Кроме того, что касается областей, транслируемых в белки, идентичность последовательности между генами, кодирующими гомологи человека, и генами, кодирующими гомологи мыши, была в интервале от 89% до 91% в отношении нуклеотидной последовательности и в интервале от 95% до 96% в отношении аминокислотной последовательности. Также, что касается областей, транслируемых в белки, идентичность последовательности между полученными генами собаки и геном, кодирующим гомолог цыпленка, была 82% в отношении нуклеотидной последовательности и 87% в отношении аминокислотной последовательности. Нуклеотидная последовательность гомолога цыпленка показана в SEQ ID NO:29 и его аминокислотная последовательность показана в SEQ ID NO:30. Кроме того, что касается областей, транслируемых в белки, идентичность последовательности между генами, кодирующими гомологи человека, и геном, кодирующим гомолог цыпленка, была в интервале от 81% до 82% в отношении нуклеотидной последовательности и была 86% в отношении аминокислотной последовательности.
(4) Анализ экспрессии гена в каждой ткани
Экспрессию генов, полученных указанным выше способом, в нормальных тканях собак и людей и различных клеточных линиях исследовали способом ОТ-ПЦР. Реакцию обратной транскрипции проводили следующим образом. В частности, суммарную РНК экстрагировали из каждой ткани (50 мг-100 мг) и каждой клеточной линии (5-10×106 клеток) с использованием реагента TRIZOL (Invitrogen) в соответствии с протоколами, включенными с этим реагентом. кДНК синтезировали с использованием суммарной РНК и системы синтеза Superscript First-Strand Synthesis System для ОТ-ПЦР (Invitrogen) в соответствии с протоколами, включенными в эту систему. ПЦР проводили следующим образом с использованием праймеров, специфичных в отношении полученных генов (с SEQ ID NO:33 и 34). В частности, ПЦР проводили путем повторения 30 раз цикла 94°C/30 секунд, 60°C/30 секунд, и 72°C/30 секунд, используя термоциклер (BIO RAD). и реакционный раствор доводили до общего количества 25 мкл путем добавления каждого реагента и прилагаемого буфера (0,25 мкл образца, полученного путем реакции обратной транскрипции, указанные выше праймеры (2 мкМ каждого), dNTP (0,2 мМ каждого), и 0,65 Ед ExTaq полимеразы (Takara Shuzo)). Кроме того, ген-специфичные праймеры, упомянутые выше, использовали для амплификации области между нуклеотидом номер 206 и нуклеотидом номер 632 в нуклеотидной последовательности (ген CAPRIN-1 собаки) SEQ ID NO: 5 и области между нуклеотидом номер 698 и нуклеотидом номер 1124 в нуклеотидной последовательности (ген CAPRIN-1 человека) SEQ ID NO: 1. Для сравнительного контроля, использовали GAPDH-специфичные праймеры (SEQ ID NO:35 и 36). В результате, как показано на Фиг. 1, наблюдалась сильная экспрессия в семенниках в случае здоровых тканей собаки, хотя экспрессия наблюдалась в злокачественных тканях молочной железы собаки и аденокарциномы. Более того, была подтверждена экспрессия гомологов человека, гомологичных полученным генам. В результате, аналогично случаю с генами CAPRIN-1 собаки, экспрессия могла быть подтверждена только в семенниках в случае нормальных тканей. Однако, в случае злокачественных клеток, экспрессия была обнаружена во многих типах линий злокачественных клеток, таких как клеточные линии рака молочной железы, опухоли головного мозга, лейкоза, рака легких и рака пищевода. Экспрессия была подтверждена, в частности, в большом числе клеточных линий рака молочной железы. На основании этих результатов, было подтверждено, что экспрессия CAPRIN-1 не наблюдалась в нормальных тканях, отличных от тканей семенников, тогда как CAPRIN-1 экспрессировался во многих злокачественных клетках и, в особенности, в линиях злокачественных клеток молочной железы.
Кроме того, на Фиг. 1, стандарт № 1 вдоль продольной оси показан профиль экспрессии каждого из идентифицированных выше генов, и стандарт № 2 вдоль той же оси показывает профиль экспрессии гена GAPDH для сравнительного контроля.
(5) Получение поликлонального антитела против пептида, производного CAPRIN-1
Для получения антитела, связывающегося с CAPRIN-1, синтезировали CAPRIN-1-производный пептид (Arg-Asn-Leu-Glu-Lys-Lys-Lys-Gly-Lys-Leu-Asp-Asp-Tyr-Gln (SEQ ID NO: 37)). Пептид (1 мг) в качестве антигена перемешивали с раствором неполного адъюванта Фрейнда (IFA) в количестве, эквивалентном пептиду. Эту смесь вводили подкожно кроликам 4 раза каждые 2 недели. После этого брали кровь, так, чтобы была получена антисыворотка, содержащая поликлональные антитела. Далее, антисыворотку очищали, используя носитель белок G (GE Healthcare Bio-Sciences), а затем получали поликлональное антитело против CAPRIN-1-производного белка. Кроме того, антитело, полученное путем очистки сыворотки кроликов, которым антиген не был ввден, с использованием носителя белка G способом, описанным выше, принимали в качестве контрольного антитела.
(6) Анализ экспрессии антигенного белка на злокачественных клетках
Далее, было исследовано, экспрессировался ли, или нет белок CAPRIN-1 на поверхностях клеток 7 типов линий злокачественных клеток молочной железы (MDA-MB-157, T47D, MRK-nu-1, MDA-MB-231V, BT20, SK-BR-3, и MDA-MB-231T), в которых была убедительно подтверждена экспрессия гена CAPRIN-1. Каждую линию злокачественных клеток молочной железы человека, в которой была подтверждена экспрессия гена (106 клеток). как описано выше, центрифугировали в 1,5 мл центрифужной пробирке. Добавляли поликлональное антитело против пептида, производного CAPRIN-1 (2 мкг) (5 мкл), полученное в пункте (5), приведенном выше. Полученный в результате продукт дополнительно суспендировали в PBS, содержащем 0,1% эмбриональную сыворотку теленка (95 мкл), а затем оставляли стоять на льду в течение 1 часа. После промывания с использованием PBS, полученный в результате продукт суспендировали в PBS, содержащем FITC-меченное антитело козы против IgG кролика (Santa Cruz Biotechnology, Inc.) (5 мкл) и 0,1% эмбриональную сыворотку теленка (FBS)(95 мкл), а затем оставляли стоять на льду в течение 1 часа. После промывания с использованием PBS, измеряли интенсивность флуоресценции с использованием FACSCalibur (Becton, Dickinson and Company). При этом процедуру, аналогичную указанной выше, проводили с использованием контрольного антитела, полученного в пункте (5), приведенном выше, вместо поликлонального антитела против пептида, производного CAPRIN-1, для получения контроля. В результате, было обнаружено, что интенсивность флуоресценции была по меньшей мере на 30% сильнее во всех клетках, к которым было добавлено антитело против CAPRIN-1 человека, чем в контрольных клетках. В частности, были подтверждены следующие интенсивности флуоресценции: MDA-MB-157: 184%; T47D: 221%; MRK-nu-1: 115%; MDA-MB-231V: 82%; BT20: 32%; SK-BR-3: 279%; и MDA-MB-231T: 80%. На основании указанного выше, было подтверждено, что белок CAPRIN-1 экспрессировался на поверхностях клеток указанных выше линий злокачественных клеток человека. Кроме того, степень повышения интенсивности флуоресценции представлена степенью повышения средней интенсивности флуоресценции (величина MFI) в клетках. Она была вычислена с помощью следующего уравнения.
Степень повышения средней интенсивности флуоресцении (степень повышения интенсивности флуоресценции) (%) = ((величина MFI клеток, взаимодействовавших с антителом против CAPRIN-1 человека)-(величина контрольной MFI))/(величина контрольной MFI)×100
(7) Иммуногистохимическое окрашивание
(7)-1 Экспрессия CAPRIN-1 в нормальных тканях мышей и собак
Мышей (Balb/c, самки) и собак (собаки породы бигль, самки) обескровливали под эфирным наркозом и кетамин/изофлурановым наркозом. После лапаротомии, органы (желудок, печень, глазные яблоки, тимус, мышцы, костный мозг, матку, тонкий кишечник, пищевод, сердце, почки, слюнные железы, толстую кишку, молочные железы, головной мозг, легкие, кожу, надпочечники, яичники, поджелудочную железу, селезенку и мочевой пузырь) переносили в 10 см чашку, содержащую PBS. Каждый орган вскрывали в PBS, а затем фиксировали перфузией в течение ночи 0,1 M фосфатным буфером (pH 7,4), содержащим 4% параформальдегид (PFA). Перфузат отбрасывали, поверхность ткани каждого органа промывали PBS, а затем добавляли раствор PBS, содержащий 10% сахарозу, в 50 мл центрифужную пробирку. Затем каждую ткань помещали в каждую пробирку, а затем встряхивали с использованием ротора при 4°C в течение 2 часов. Каждый раствор заменяли раствором PBS, содержащим 20% сахарозу, а затем оставляли стоять при 4°C до преципитации тканей. Каждый раствор заменяли раствором PBS, содержащим 30% сахарозу, а затем оставляли стоять при 4°C до преципитации тканей. Каждую ткань удаляли, и необходимую часть отделяли хирургическим скальпелем. Далее, соединение OCT (Tissue Tek) наносили и распределяли по поверхности каждой ткани, а затем ткани помещали на Cryomold. Cryomold помещали на сухой лед для быстрого замораживания. Из ткани получали тонкие срезы 10-20 мкм толщиной, используя криостат (LEICA), а затем тонкие срезы ткани сушили на воздухе на предметных стеклах в течение 30 минут, используя фен, с получением предметных стекол, на которые были нанесены тонкие срезы тканей. Далее, каждое предметное стекло помещали в сосуд для окрашивания, наполненный PBS-T (солевой раствор, содержащий 0,05% Tween20), так, чтобы процедура, предусматривающая замену PBS-T каждые 5 минут, была выполнена 3 раза. Избыток воды вокруг каждого образца удаляли, используя Kimwipes, а затем каждый срез обогащали, используя DAKOPEN (DAKO). В качестве блокирующих растворов, MOM блокирующий реагент Ig мыши (VECTASTAIN) наносили на ткань мыши, и раствор PBS-T, содержащий 10% FBS наносили на ткань собаки. Полученные в результате образцы оставляли стоять во влажной камере при комнатной температуре в течение 1 часа. Далее, был получен раствор, содержащий моноклональное антитело (моноклональное антитело #6) против CAPRIN-1, имеющее вариабельную область тяжелой цепи последовательности SEQ ID NO: 73 и вариабельную область легкой цепи последовательности SEQ ID NO: 77 и взаимодействующее с поверхностями злокачественных клеток, полученных в примере 4, это антитело доводили до концентрации 10 мкг/мл в блокирующем растворе. Этот раствор наносили на каждое предметное стекло, а затем оставляли стоять во влажной камере при 4°C в течение ночи. После 3 раз по 10 минут промываний с использованием PBS-T, MOM биотин-меченное антитело против IgG (VECTASTAIN), разбавленное в 250 раз блокирующим раствором, наносили на каждое предметное стекло, а затем оставляли стоять во влажной камере при комнатной температуре в течение 1 часа. После 3 промываний по 10 минут с использованием PBS-T, наносили авидин-биотиновый реагент ABC (VECTASTAIN), а затем оставляли стоять во влажной камере при комнатной температуре в течение 5 минут. После 3 промываний по 10 минут с использованием PBS-T, наносили окрашивающий раствор DAB (DAB 10 мг + 30% H2O2 10 мкл/0,05 M Tris-HCl (pH 7,6) 50 мл), а затем предметные стекла оставляли стоять во влажной камере при комнатной температуре в течение 30 минут. Предметные стекла промывали дистиллированной водой, а затем наносили гематоксилиновый реагент (DAKO). После выдерживания при комнатной температуре в течение 1 минуты, предметные стекла промывали дистиллированной водой. Предметные стекла погружали в 70%, 80%, 90%, 95% и 100% растворы этанола в таком порядке в течение 1 минуты каждое, а затем оставляли стоять в ксилене в течение ночи. Предметные стекла удаляли, заклеивали средой Glycergel Mounting Medium (DAKO), а затем изучали. В результате, наблюдали экспрессию CAPRIN-1 до незначительной степени в клетках во всех слюнных железах, почках, толстом кишечнике и тканях желудка, но экспрессия CAPRIN-1 никогда не наблюдалась на клеточных поверхностях. Также, абсолютное отсутствие экспрессии CAPRIN-1 наблюдалось в тканях из других органов. Кроме того, аналогичные результаты были получены при использовании моноклонального антитела против CAPRIN-1, имеющего вариабельную область тяжелой цепи последовательности SEQ ID NO: 103 и вариабельную область легкой цепи последовательности SEQ ID NO: 107 (моноклональное антитело #9).
(7)-2 Экспрессия CAPRIN-1 в злокачественной ткани молочной железы собаки
Используя 108 замороженных образцов злокачественной ткани молочной железы собак, у которых диагностирована злокачественная опухоль молочной железы, получали замороженные срезы, способом, аналогичным описанному выше, и иммуногистохимическое окрашивание проводили, используя моноклональное антитело #6, полученное в Примере 4. В результате, экспрессия CAPRIN-1 была подтверждена в 100 из 108 образцов (92,5%). CAPRIN-1 особенно сильно экспрессировался на поверхностях сильно атипичных злокачественных клеток. Кроме того, аналогичные результаты были получена при использовании моноклонального антитела #9, полученного в Примере 4.
(7)-3 Экспрессия CAPRIN-1 в злокачественной ткани молочной железы человека
Иммуногистохимическое окрашивание проводили, используя 188 образцов злокачественной ткани молочной железы, заключенных в парафин злокачественных тканей молочной железы в виде матрицы (BIOMAX). После 3 часов обработки при 60°C, матрицу образцов злокачественной ткани молочной железы человека погружали в сосуд для окрашивания, заполненный ксиленом, а затем замену ксилена каждые 5 минут проводили 3 раза. Далее, аналогичную процедуру проводили с использованием этанола и PBS-T вместо ксилена. Матрицу с образцами злокачественной ткани молочной железы человека погружали в сосуд для окрашивания, заполненный 10 мМ цитратным буфером (pH 6,0), содержащим 0,05% Tween20, обрабатывали в течение 5 минут при 125°C, а затем оставляли стоять при комнатной температуре в течение 40 минут или более. Избыток воды вокруг каждого образца удаляли, используя Kimwipes, каждый срез обогащали, используя DAKOPEN, а затем соответствующее количество пероксидазы Peroxidase Block (DAKO) добавляли по каплям. Образцы оставляли стоять при комнатной температуре в течение 5 минут, а затем погружали в сосуд для окрашивания, наполненный PBS-T. Замену PBS-T каждые 5 минут проводили 3 раза. В качестве блокирующего раствора наносили раствор PBS-T, содержащий 10% FBS, а затем эту матрицу оставляли стоять во влажной камере при комнатной температуре в течение 1 часа. Далее, получали раствор, содержащий моноклональное антитело #6, взаимодействующее с поверхностью злокачественных клеток, полученное в Примере 4, в концентрации 10 мкг/мл, установленной с использованием раствора PBS-T, содержащего 5% FBS. Наносили раствор, а затем оставляли стоять в течение ночи во влажной камере при 4°C. После промывания 3 раза по 10 минут PBS-T, соответствующее количество полимерного конъюгата, меченного пероксидазой (Peroxidase Labeled Polymer Conjugated) (DAKO) добавляли по каплям, а затем предметные стекла оставляли стоять при комнатной температуре в течение 30 минут во влажной камере. После 3 промываний по 10 минут с использованием PBS-T, наносили окрашивающий раствор DAB (DAKO), а затем оставляли стоять при комнатной температуре в течение 10 минут. Окрашивающий раствор DAB отбрасывали, а затем 3 раза проводили 10 минутное промывание с использованием PBS-T. Предметные стекла промывали дистиллированной водой, а затем погружали в 70%, 80%, 90%, 95% и 100% растворы этанола в таком порядке на 1 минуту каждый, а затем оставляли стоять в ксилене в течение ночи. Предметные стекла удаляли, заклеивали средой Glycergel Mounting Medium (DAKO), а затем изучали. В результате, сильная экспрессия CAPRIN-1 наблюдалась в 138 (73%) из всех 188 образцов злокачественной ткани молочной железы. Кроме того, аналогичные результаты были получены при использовании моноклонального антитела #9, полученного в Примере 4.
(7)-4 Экспрессия CAPRIN-1 в злокачественной опухоли головного мозга человека
Используя 247 образцов злокачественной опухоли головного мозга человека матриц заключенных в парафин тканей злокачественной опухоли головного мозга человека (BIOMAX), иммуногистохимическое окрашивание проводили способом, аналогичным способу по приведенному выше пункту (7)-3, используя моноклональное антитело #6, полученное в Примере 4. В результате, сильная экспрессия CAPRIN-1 наблюдалась в 227 (92%) из всех 247 образцов ткани злокачественной опухоли головного мозга. Кроме того, аналогичные результаты были получены при использовании моноклонального антитела #9, полученного в Примере 4.
(7)-5 Экспрессия CAPRIN-1 в лимфатическом узле метастазирующей злокачественной опухоли молочной железы человека
Используя 150 образцов ткани метастаз в лимфатические узлы злокачественной опухоли молочной железы человека, заключенных в парафин матриц тканей лимфатического узла с метастазами злокачественной опухоли молочной железы человека (BIOMAX), иммуногистохимическое окрашивание проводили способом, аналогичным способу по п.(7)-3, описанному выше, используя моноклональное антитело #6, полученное в Примере 4. В результате, сильная экспрессия CAPRIN-1 наблюдалась в 136 (90%) из всех 150 образцов ткани лимфатических узлов с метастазами злокачественной опухоли молочной железы человека. В частности, было обнаружено, что CAPRIN-1 также сильно экспрессируется в злокачественной ткани, которая метастазировала из злокачественной опухоли молочной железы. Кроме того, аналогичные результаты были получены при использовании моноклонального антитела #9, полученного в Примере 4.
Пример 2: Противоопухолевые эффекты (ADCC активность) антитела
против CAPRIN-1 на злокачественные клетки
Далее, было исследовано, обладало ли способностью антитело против CAPRIN-1 повреждать опухолевые клетки, экспрессирующие CAPRIN-1. Оценку проводили, используя поликлональное антитело против CAPRIN-1-производного пептида человека, полученного в Примере 1. Два типа линий злокачественных клеток молочной железы человека (T47D и MDA-MB-157) (по 106 клеток в каждой), в которых была подтверждена экспрессия CAPRIN-1, отдельно помещали в 50 мл центрифужную пробирку. В эту пробирку добавляли хром 51 (100 мкКю), с последующим инкубированием при 37°C в течение 2 часов. После этого, клетки промывали 3 раза средой RPMI1640, содержащей 10% эмбриональную сыворотку теленка, и добавляли в лунки (103 клеток на лунку) в 96-луночные V-донные планшеты. В лунки добавляли указанное выше поликлональное антитело против CAPRIN-1-производного белка человека (1 мкг на лунку). Далее, в лунки добавляли лимфоциты, выделенные из периферической крови кролика (2×105 клеток на лунку), с последующим культивированием в условиях 37°C и 5% CO2 в течение 4 часов. После культивирования, определяли уровень хрома (Cr) 51, высвобожденного из поврежденных опухолевых клеток, в каждом культуральном супернатанте. Затем, вычисляли ADCC активность поликлонального антитела против CAPRIN-1-производного пептида в отношении злокачественных клеток. В результате, были подтверждены ADCC активности против T47D (15,4%) и MDA-MB-157 (17,3%) (смотри Фигуры 2 и 3). При этом по существу не наблюдалась активность в случае, в котором процедуру, аналогичную указанной выше, проводили с использованием контрольного антитела, полученного из периферической крови кролика, который не был иммунизирован антигеном (пример 1 (5)) или в случае, в котором антитело не добавляли (смотри Фигуры 2 и 3). Соответственно, было обнаружено, что опухолевые клетки, экспрессирующие CAPRIN-1, могут разрушаться под действием индукции ADCC активности при использовании антитела против CAPRIN-1.
Кроме того, для цитотоксической активности, антитело против CAPRIN-1, используемое в настоящем изобретении, лимфоциты мыши и 103 клеток, включающих хром 51, из линии лейкозных клеток, перемешивали вместе и культивировали в течение 4 часов. После этого, определяли уровень хрома 51, высвобожденного в среду. Затем, цитотоксическую активность в отношении линии лейкозных клеток вычисляли по следующему уравнению*.
*Уравнение: Цитотоксическая активность (%) = [(уровень хрома 51, высвобожденного из T47D или MDA-MB-157, к которым было добавлено антитело против CAPRIN-1 и лимфоциты мыши)/(уровень хрома 51, высвобожденного из клеток-мишеней, к которым была добавлена 1 н соляная кислота)]×100
Пример 3: Получение новых антигенных белков злокачественных опухолей человека
(1) Получение рекомбинантного белка
Рекомбинантный белок гомологичного гена человека получали следующим способом, на основании гена с последовательностью SEQ ID NO: 1, полученного в Примере 1. ПЦР проводили путем повторения 30 раз цикла 98°C/10 секунд и 68°C/2,5 минуты, используя термоциклер (BIO RAD), и реакционный раствор доводили до общего объема 50 мкл путем добавления каждого реагента и прилагаемого буфера (1 мкл кДНК (которая была получена из различных кДНК тканей/клеток, полученных в Примере 1, и экспрессию которой наблюдали с помощью ОТ-ПЦР), 2 типа праймеров (0,4 мкМ каждого; SEQ ID NO:38 и 39), содержащих последовательности расщепления рестриктазами SacI и XhoI, 0,2 мМ dNTP, 1,25 Ед полимеразы PrimeSTAR HS (Takara Shuzo)). Указанные выше 2 типа праймеров использовали для амплификации области, кодирующей полноразмерную аминокислотную последовательность SEQ ID NO: 2. После ПЦР, амплифицированную таким образом ДНК, подвергали электрофорезу на 1% агарозном геле, а затем фрагмент ДНК примерно 2,1 тыс. пар нуклеотидов очищали с использованием набора QIAquick Gel Extraction Kit (QIAGEN).
Очищенный фрагмент ДНК лигировали в клонирующий вектор pCR-Blunt (Invitrogen). Этот вектор был трансформирован в Escherichia coli, а затем была получена плазмида. Было подтверждено на основании последовательности, что амплифицированный генный фрагмент соответствовал целевой последовательности. Плазмиду, которая соответствовала последовательности, представляющей интерес, обрабатывали рестриктазами SacI и XhoI, а затем полученный в результате продукт очищали, используя набор QIAquick Gel Extraction Kit. Затем, генную последовательность, представляющую интерес, встраивали в вектор экспрессии pET30a (Novagen) для Escherichia coli, обработанный рестриктазами SacI и XhoI. Рекомбинантный белок, слитый с His меткой, может быть получен с использованием этого вектора. Плазмиду трансформировали в Escherichia coli BL21 (DE3) для экспрессии, а затем проводили индукцию экспрессии, используя 1 мМ IPTG, таким образом, чтобы целевой белок экспрессировался в Escherichia coli.
(2) Очистка рекомбинантного белка
Каждую, полученную выше рекомбинантную Escherichia coli, экспрессирующую SEQ ID NO: 1, культивировали при 37°C в среде LB, содержащей 30 мкг/мл канамицина до достижения поглощения при 600 нм примерно 0,7. Затем изопропил-β-D-1-тиогалактопиранозид добавляли до конечной концентрации 1 мМ, с последующими 4 часами культивирования при 37°C. После этого, клетки собирали путем 10 минутного центрифугирования при 4800 об/мин. Клеточный осадок суспендировали в фосфатно-буферном солевом растворе, а затем центрифугировали при 4800 об/мин в течение 10 минут для промывания клеток.
Клетки суспендировали в фосфатно-буферном солевом растворе, а затем подвергали воздействию ультразвука на льду. Подвергнутый таким образом воздействию ультразвука лизат Escherichia coli центрифугировали при 6000 об/мин в течение 20 минут. Полученный таким образом супернатант использовали в качестве растворимой фракции, а затем полученный преципитат использовали в качестве нерастворимой фракции.
Растворимую фракцию наносили на никель-хелатирующую колонку (носитель: Хелатирующая Сефароза (TradeMark) Fast Flow (GE Healthcare), емкость колонки: 5 мл, 50 мМ солянокислого буфера (pH 8,0) в качестве равновесного буфера)), полученную в соответствии с общепринятым способом. Неадсорбированную фракцию промывали 50 мМ солянокислым буфером (pH 8,0) в 10-кратном количестве емкости колонки, и 20 мМ фосфатным буфером (pH 8,0), содержащим 20 мМ имидазола. Сразу же после промывания, 6 слоев было элюировано 20 мМ фосфатным буфером (pH 8,0), содержащим 100 мМ имидазола. Элюированную фракцию 20 мМ фосфатного буфера (pH 8,0), содержащую 100 мМ имидазола (для которой элюция белка, представляющего интерес, была подтверждена окрашиванием Кумасси) наносили на сильную анионообменную колонку (носитель: Q Sepharose (TradeMark) Fast Flow (GE Healthcare), емкость колонки: 5 мл, и 20 мМ фосфатный буфер (pH 8,0) в качестве равновесного буфера). Неадсорбированную фракцию промывали 20 мМ фосфатным буфером (pH 7,0) в количестве 10-кратном емкости колонки, и 20 мМ фосфатным буфером (pH 7,0), содержащим 200 мМ хлорида натрия. Сразу же после промывания, 5 слоев было элюировано с использованием 20 мМ фосфатного буфера (pH 7,0), содержащего 400 мМ хлорида натрия. Таким образом, были получены очищенные фракции белков, каждая из которых имеет аминокислотную последовательность, показанную в SEQ ID NO: 2.
200 мкл каждого очищенного препарата, полученного указанным выше способом, распределяли в 1 мл реакционного буфера (20 мМ Tris-HCl, 50 мМ NaCl, 2 мМ CaCl2 pH 7,4), а затем добавляли 2 мкл энтерокиназы (Novagen). Полученную смесь оставляли стоять при комнатной температуре в течение ночи для взаимодействия, His метка отщеплялась, а затем проводили очистку в соответствии с прилагаемыми протоколами, используя набор Enterokinase Cleavage Capture Kit (Novagen). Далее, 1,2 мл каждого очищенного препарата, полученного указанным выше способом, заменяли физиологическим фосфатным буфером (Nissui Pharmaceutical Co., Ltd.), используя ультрафильтрацию NANOSEP 10K OMEGA (PALL). Стерильную фильтрацию проводили, используя 0,22-мкм HT Tuffryn Acrodisc (PALL), а затем полученные в результате продукты использовали для следующих экспериментов.
Пример 4: Получение моноклонального антитела против CAPRIN-1
Антигенный белок (CAPRIN-1 человека) (100 мкг), показанный в последовательности SEQ ID NO: 2, полученный в Примере 3, перемешивали с адъювантом MPL+TDM (Sigma) в количестве, эквивалентном количеству антигенного белка. Эту смесь использовали в качестве антигенного раствора для мышей. Антигенный раствор вводили внутрибрюшинно 6-недельным мышам Balb/c (Japan SLC Inc.), а затем дополнительно вводили 3 раза или 24 раза каждую неделю для завершения иммунизации. Селезенку удаляли на 3 день после последней иммунизации, а затем притерали между двумя стерильными предметными стеклами. Каждый полученный в результате препарат промывали PBS (-) (Nissui), а затем центрифугировали при 1500 об/мин в течение 10 минут, так чтобы процедура для удаления супернатантов повторялась 3 раза. Таким образом, были получены клетки селезенки. Полученные таким образом клетки селезенки смешивали с миеломными клетками SP2/0 (приобретенными из ATCC) в соотношении 10:1. Раствор ПЭГ, полученный путем перемешивания 200 мкл среды RPMI1640, содержащей 10% FBS, нагретой при 37°C, и 800 мкл PEG1500 (Boehringer) добавляли к клеткам. Раствор оставляли стоять в течение 5 минут для слияния клеток. Центрифугирование проводили при 1700 об/мин в течение 5 минут для удаления супернатантов. Клетки суспендировали в 150 мл среды RPMI1640 (селективная среда HAT), содержащей 15% FBS, к которой добавляли 2% эквивалент раствора HAT (Gibco), а затем высевали на пятнадцать 96-луночных планшетов (Nunc) в концентрации 100 мкл на лунку. Клетки культивировали в течение 7 дней в условиях 37°C и 5% CO2, с получением гибридом, полученных в результате слияния клеток селезенки с миеломными клетками.
Гибридомы выбирали, используя в качестве показателя аффинность связывания антитела, продуцированного полученными таким образом гибридомами, с белком CAPRIN-1. Раствор белка CAPRIN-1 (1 мкг/мл), полученного в Примере 3, добавляли в концентрации 100 мкл на лунку 96-луночных планшетов, а затем оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали 3 раза PBS-T, 0,5% раствор бычьего сывороточного альбумина (BSA) (Sigma) добавляли в концентрации 400 мкл на лунку, а затем планшеты оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, а затем каждую лунку промывали 3 раза с использованием 400 мкл PBS-T. Каждый культуральный супернатант гибридом, полученных выше, добавляли в концентрации 100 мкл на лунку, а затем оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали 3 раза с использованием PBS-T, добавляли HRP-меченное антитело против IgG мыши (H+L) (Invitrogen), разбавленное в 5000 раз PBS, в концентрации 100 мкл на лунку, а затем оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали 3 раза PBS-T, добавляли раствор субстрата TMB (Thermo) в концентрации 100 мкл на лунку, а затем оставляли стоять в течение 15-30 минут, для проведения цветовой реакции. После развития окраски, добавляли 1 н серную кислоту в концентрации 100 мкл на лунку, для остановки реакции. Измеряли поглощение при 450 нм и поглощение при 595 нм, используя абсорбционный спектрометр. В результате, было отобрано большое количество гибридом, продуцирующих антитела с высоким поглощением.
Отобранные таким образом гибридомы добавляли по 0,5 гибридом на лунку 96-луночных планшетов, а затем культивировали. Через 1 неделю, были получены гибридомы, образующие одиночные колонии в лунках. Клетки в этих лунках культивировали далее. Гибридомы отбирали, используя в качестве показателя аффинность связывания (антитела, продуцированного клонированными гибридомами) с белком CAPRIN-1. Раствор белка CAPRIN-1 (1 мкг/мл), полученного в Примере 3, добавляли по 100 мкл на лунку 96-луночных планшетов, а затем оставляли стоять при 4°C в течение 18 часов. Каждую лунку промывали 3 раза PBS-T, добавляли 0,5% раствор BSA по 400 мкл на лунку, а затем оставляли стоять при комнатной температуре в течение 3 часов. Раствор удаляли, а затем каждую лунку промывали 3 раза с использованием 400 мкл PBS-T. Каждый культуральный супернатант гибридом, полученных выше, добавляли по 100 мкл на лунку, а затем оставляли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали 3 раза PBS-T, добавляли HRP-меченное антитело против IgG мыши (H+L) (Invitrogen), разбавленное в 5000 раз PBS, по 100 мкл на лунку, а затем оставляли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали 3 раза PBS-T, добавляли раствор субстрата TMB (Thermo) по 100 мкл на лунку, а затем оставляли стоять в течение 15-30 минут, чтобы осуществлялась цветовая реакция. После развития окраски добавляли 1 н серную кислоту по 100 мкл на лунку для остановки реакции. Измеряли поглощение при 450 нм и поглощение при 595 нм, используя абсорбционный спектрометр. В результате, было получено 150 гибридомных клеточных линий, продуцирующих моноклональные антитела, демонстрирующих реакционную способность в отношении белка CAPRIN-1.
Далее, среди этих моноклональных антител, были выбраны моноклональные антитела, демонстрирующие реакционную способность в отношении поверхности злокачественных клеток молочной железы, экспрессирующих CAPRIN-1. В частности, 106 клеток линии злокачественных клеток молочной железы MDA-MB-231V центрифугировали в 1,5 мл центрифужных пробирках. Добавляли супернатант (100 мкл) каждой гибридомы, указанной выше, а затем оставляли стоять на льду в течение 1 часа. После промывания с использованием PBS, добавляли FITC-меченное антитело козы против IgG мыши (Invitrogen), разбавленное в 500 раз PBS, содержащим 0,1% FBS, а затем оставляли стоять на льду в течение 1 часа. После промывания с использованием PBS, измеряли интенсивность флуоресценции, используя FACSCalibur (Becton, Dickinson and Company). При этом, проводили процедуру, аналогичную указанной выше, используя необработанную сыворотку 6 недельных мышей Balb/c, разбавленную в 500 раз гибридомной культуральной средой вместо антитела, для получения контроля. В результате, было выбрано 11 моноклональных антител (#1-#11), имеющих интенсивность флуоресценции более сильную, чем интенсивность флуоресценции контроля; то есть, взаимодействующих с поверхностью злокачественных клеток молочной железы.
Пример 5: Характеристика отобранных антител
(1) Клонирование гена вариабельной области моноклонального антитела против CAPRIN-1
мРНК экстрагировали из гибридомных клеточных линий, продуцирующих 11 моноклональных антител, отобранных в Примере 4. Получали ген вариабельной области тяжелой цепи (VH) и ген вариабельной области легкой цепи (VL) для каждого моноклонального антитела против CAPRIN-1 с помощью ОТ-ПЦР, используя праймеры, специфичные в отношении FR1-производной последовательности мыши и FR4-производной последовательности мыши. Для секвенирования гены по-отдельности клонировали в векторы pCR2.1 (Invitrogen).
(1)-1 ОТ-ПЦР
мРНК получали из каждой гибридомной клеточной линии (106 клеток), используя набор для очистки мРНК микро (GE Healthcare). Каждую полученную мРНК подвергали обратной транскрипции, используя набор SuperScriptII 1st strand synthesis kit (Invitrogen) для синтеза кДНК. Указанные выше процедуры проводили в соответствии с протоколами, прилагаемыми к наборам.
Каждую полученную кДНК использовали для амплификации гена антитела с помощью ПЦР.
Для получения гена VH области, использовали праймер, специфичный в отношении последовательности FR1 тяжелой цепи мыши (SEQ ID NO: 130) и праймер, специфичный в отношении FR4 последовательности тяжелой цепи мыши (SEQ ID NO: 131). Кроме того, для получения гена VL области, использовали праймер, специфичный в отношении FR1 последовательности легкой цепи мыши (SEQ ID NO: 132) и праймер, специфичный в отношении FR4 последовательности легкой цепи мыши (SEQ ID NO: 133). Эти праймеры были получены со ссылкой на Jones, S. T. and Bending, M. M. Bio/Technology 9, 88-89 (1991). Для ПЦР использовали Ex-taq (Takara Bio Inc.). Образец каждой кДНК перемешивали с 10 x EX Taq буфером (5 мкл), смесью dNTP (2,5 мМ) (4 мкл), праймерами (1,0 мкМ)(2 мкл каждого), и Ex Taq (5 Ед/мкл) (0,25 мкл). Общий объем доводили до 50 мкл стерильной водой. ПРЦ проводили в условиях, включающих, после обработки при 94°C в течение 2 минут, 30 циклов сочетания денатурации при 94°C в течение 1 минуты, отжига при 58°C в течение 30 секунд, и элонгации при 72°C в течение 1 минуты.
(1)-2 Клонирование
Каждый продукт ПЦР, полученный выше, подвергали электрофорезу на агарозном геле, с последующим вырезанием полос ДНК области VH и области VL. ДНК очищали, с использованием набора для очистки QIAquick Gel purification kit (QIAGEN) в соответствии с протоколами, прилагаемыми к набору. Каждую очищенную ДНК клонировали в вектор pCR2.1, используя набор для клонирования TA cloning kit (Invitrogen). Каждый ДНК-лигированный вектор трансформировали в DH5a компетентные клетки (TOYOBO) в соответствии с общепринятым способом. Каждый трансформант (10 клонов) культивировали в течение ночи в среде (100 мкг/мл ампициллина) при 37°C. Полученную плазмидную ДНК очищали, используя набор Qiaspin Miniprep kit (QIAGEN).
(1)-3 Секвенирование
Анализ генной последовательности области VH и области VL в каждой плазмиде, полученной выше, проводили с использованием прямого праймера M13 (SEQ ID NO: 134) и обратного праймера M13 (SEQ ID NO: 135) с использованием флуоресцентного секвенатора (ABI; DNA sequencer 3130XL) и набора BigDye terminater Ver. 3.1 cycle sequencing kit (ABI) в соответствии с протоколами, прилагаемыми к этому набору. В результате, была определена каждая генная последовательность (идентичная в 10 клонах).
Полученные аминокислотные последовательности вариабельных областей тяжелой цепи моноклонального антитела показаны в последовательностях SEQ ID NO: 43, SEQ ID NO: 73, SEQ ID NO: 83, SEQ ID NO: 93, SEQ ID NO: 103, SEQ ID NO: 113, и SEQ ID NO: 123. Полученные аминокислотные последовательности вариабельных областей легкой цепи показаны в последовательностях SEQ ID NO: 47, SEQ ID NO: 53, SEQ ID NO: 58, SEQ ID NO: 63, SEQ ID NO: 68, SEQ ID NO: 77, SEQ ID NO: 87, SEQ ID NO: 97, SEQ ID NO: 107, SEQ ID NO: 117, и SEQ ID NO: 127.
В частности, моноклональное антитело #1 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 43 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 47. Моноклональное антитело #2 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 43 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 53. Моноклональное антитело #3 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 43 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 58. Моноклональное антитело #4 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 43 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 63. Моноклональное антитело #5 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 43 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 68. Моноклональное антитело #6 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 73 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 77. Моноклональное антитело #7 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 83 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 87. Моноклональное антитело #8 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 93 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 97. Моноклональное антитело #9 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 103 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 107. Моноклональное антитело #10 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 113 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 117. Моноклональное антитело #11 содержит вариабельную область тяжелой цепи последовательности SEQ ID NO: 123 и содержит вариабельную область легкой цепи последовательности SEQ ID NO: 127.
(2) Экспрессия CAPRIN-1 на клеточных поверхностях различных клеток, вызванная использованием полученных моноклональных антител
Далее, было исследовано, экспрессировался ли или нет белок CAPRIN-1 на клеточных поверхностях 7 типов линий злокачественных клеток молочной железы (MDA-MB-157, T47D, MRK-nu-1, MDA-MB-231V, BT20, SK-BR-3, и DA-MB-231T), в которых была подтверждена экспрессия гена CAPRIN-1, 3 типов других линий злокачественных клеток молочной железы (MDA-MB-231C, MCF-7, и ZR75-1), 6 типов линий клеток глиомы (T98G, SNB19, U251, и U87G), 3 типов линий злокачественных клеток почек (Caki-1, Caki2, и A498), 1 типа линии злокачественных клеток желудка (MKN45), 1 типа линии злокачественных клеток толстой кишки (Caco2), 3 типов линий злокачественных клеток легких (A549, QG56, и PC8), и 3 типов линии лейкозных клеток (Namalwa, BDCM, и RPI1788). Каждую клеточную линию (106 клеток) центрифугировали в 1,5 мл микроцентрифужной пробирке. Гибридомные супернатанты (100 мкл каждого), содержащие моноклональные антитела #1-#10 против CAPRIN-1, полученные в Примере 4, взаимодействующие с поверхностями злокачественных клеток, добавляли по-отдельности в эти пробирки, а затем оставляли стоять на льду в течение 1 часа. После промывания с использованием PBS, каждый полученный в результате продукт суспендировали в FITC-меченных антителах козы против IgG мыши (Invitrogen Corporation), разбавленных в 500 раз PBS, содержащим 0,1% FBS, а затем оставляли стоять на льду в течение 1 часа. После промывания с использованием PBS, измеряли интенсивность флуоресценции, используя FACSCalibur (Becton, Dickinson and Company). При этом, процедуру, аналогичную указанной выше, проводили, используя в качестве контроля контрольное антитело, полученное в пункте (5), приведенном выше, вместо гибридомных супернатантов, содержащих моноклональные антитела #1-#11 против CAPRIN-1, для получения контроля. В результате, было обнаружено, что интенсивность флуоресценции по меньшей мере на 30% сильнее во всех клетках, к которым были добавлены моноклональные антитела #1-#11, чем в контрольных клетках. В частности, следующие повышения интенсивности флуоресценции были подтвеждены в тех случаях, когда, например, использовали моноклональное антитело #9: MDA-MB-157: 211%; T47D: 145%; MRK-nu-1: 123%; MDA-MB-231V: 251%; BT20: 168%; и MDA-MB-231T: 94%. На основании указанного выше, было подтверждено, что белок CAPRIN-1 экспрессировался на поверхностях клеток указанных выше линий злокачественных клеток человека. Кроме того, степень повышения интенсивности флуоресценции представлена степенью повышения средней интенсивности флуоресценции (величина MFI) в клетках. Она была вычислена с помощью следующего уравнения:
Степень повышения средней интенсивности флуоресценции (степень повышения интенсивности флуоресценции) (%) = ((величина MFI клеток, взаимодействовавших с антителом против CAPRIN-1 человека)-(величина MFI контроля))/(величина MFI контроля)×100
(3) Противоопухолевые эффекты (ADCC активность) антител против CAPRIN-1 на злокачественные клетки
Отобранные выше моноклональные антитела #1-#11 против CAPRIN-1 оценивали по цитотоксической активности (ADCC активности) в отношении злокачественных клеток. Гибридомы, продуцирующие моноклональные антитела #1-#11 культивировали, используя гибридомную среду SFM (Invitrogen). Каждый полученный супернатант очищали, используя Hitrap ProteinA Sepharose FF (GE Healthcare), с последующей заменой на PBS (-) и очисткой с использованием фильтра 0,22 мкм (Millipore). Каждый полученный в результате продукт использовали в качестве антитела для определения активности. Злокачественные клетки молочной железы человека линии MDA-MB-157 (106 клеток) помещали в 50 мл центрифужную пробирку. В эту пробирку добавляли хром 51 (100 мкКю), с последующим инкубированием при 37°C в течение 2 часов. После этого клетки промывали 3 раза средой RPMI1640, содержащей 10% FBS. Клетки помещали в лунки (103 клеток на лунку) в 96-луночные V-донные планшеты. Таким образом, были получены клетки-мишени. В лунки добавляли указанные выше очищенные антитела (1 мкг на лунку). Далее, туда добавляли лимфоциты мыши, выделенные из селезенки (2×105 клеток), с последующим культивированием при 37°C и 5% CO2 в течение 4 часов. После культивирования определяли уровень хрома (Cr) 51, высвобожденного из поврежденных опухолевых клеток в каждом культуральном супернатанте. Затем, вычисляли ADCC активность каждого поликлонального антитела против CAPRIN-1-производного белка человека в отношении злокачественных клеток. В результате, все моноклональные антитела #1-#11 демонстрировали ADCC активность против MDA-MB-157 (20% или более). В частности, например, были получены следующие результаты цитотоксической активности: #1: 22,1%; #2: 29,1%; #6: 30,2%; и #9: 32,4% (смотри Фиг. 4). При этом цитотоксическая активность не подтверждалась в случае, в котором процедуру, аналогичную указанной выше, проводили с использованием моноклонального антитела, взаимодействующего с самим белком CAPRIN-1, а не с поверхностями злокачественных клеток, полученных в Примере 4 (смотри Фиг. 4). Указанные выше результаты показывают, что полученные моноклональные антитела против CAPRIN-1 (#1-#11) повреждали злокачественные клетки, экспрессирующие CAPRIN-1, проявляя ADCC активность.
(4) Противоопухолевые эффекты (CDC активность) антител против CAPRIN-1 на злокачественные клетки
Отобранные выше моноклональные антитела #1-#11 против CAPRIN-1 оценивали по цитотоксической активности (CDC активности) в отношении злокачественных клеток. Кровь, взятую у кроликов путем взятия пробы крови, добавляли в пробирку Eppendorf, а затем оставляли стоять при комнатной температуре в течение 60 минут, с последующим центрифугированием при 3000 об/мин в течение 5 минут. Таким образом была получена сыворотка для определения CDC активности. Линию злокачественных клеток молочной железы человека MDA-MB-231V (105 клеток) помещали в 50 мл центрифужную пробирку. В эту пробирку добавляли хром 51 (100 мкКю), с последующим инкубированием при 37°C в течение 2 часов. После этого клетки промывали 3 раза средой RPMI, содержащей 10% FBS, а затем суспендировали в среде RPMI, содержащей 50% сыворотку кролика, полученную выше. Эти клетки помещали в лунки (103 клеток на лунку) в 96-луночные V-донные планшеты. Антитела #1-#11, полученные в пункте (3), приведенном выше, по-отдельности вносили в лунки (1 мкг на лунку), с последующим культивированием в условиях 37°C и 5% CO2 в течение 4 часов. После культивирования определяли уровень хрома (Cr) 51, высвобожденного из поврежденных опухолевых клеток в каждом культуральном супернатанте. Вычисляли CDC активность против MDA-MB-231V, демонстрируемую моноклональным антителом против CAPRIN-1 в каждом гибридомном супернатанте. В результате, все моноклональные антитела #1-#11 демонстрировали CDC активность (30% или более). При этом цитотоксическая активность не подтверждалась в случае, в котором процедуру, аналогичную указанной выше, проводили с использованием моноклонального антитела, взаимодействующего с самим белком CAPRIN-1, а не с поверхностью злокачественных клеток, полученных в Примере 4 (смотри Фиг. 4). Соответственно, было обнаружено, что моноклональные антитела против CAPRIN-1 (#1-#11) могут повреждать опухолевые клетки, экспрессирующие CAPRIN-1, также проявляя CDC активность.
Пример 6: Противоопухолевые эффекты in vivo моноклональных антител против CAPRIN-1 у мышей
Далее, оценивали противоопухолевые эффекты in vivo полученных моноклональных антител #1-#11 против CAPRIN-1 у мышей с опухолями. Антитела, использованные в этом примере были получены путем колоночной очистки супернатанта каждой гибридомы описанным выше способом.
Противоопухолевые эффекты моноклональных антител #1-#11 против CAPRIN-1 изучали, используя мышей с опухолями, которым была трансплантирована линия злокачественных клеток мыши, экспрессирующих CAPRIN-1. Клетки CT26 (приобретенные из ATCC) трансплантировали подкожно на спину 70 мышам Balb/c (Japan SLC, Inc.)(106 клеток на мышь). Каждую опухоль выращивали, пока ее диаметр не становился приблизительно 7 мм. Мышам с опухолями (60 из 70) внутрибрюшинно вводили моноклональные антитела #1-#11 против CAPRIN-1 и один тип моноклонального антитела (взаимодействующего с самим белком CAPRIN-1, а не с поверхностью злокачественных клеток), полученные в Примере 4 (5 мышей на антитело) в дозе 300 мкг (300 мкл) на мышь. После этого, каждое антитело водили внутрибрюшинно в той же дозе релевантным мышам с опухолями 3 раза всего в течение 2 дней. Размер опухоли измеряли каждый день для наблюдения противоопухолевых эффектов. 10 оставшимся мышам с опухоляли вводили PBS(-) вместо антитела. Группу этих мышей принимали за контрольную группу. В результате наблюдения противоопухолевых эффектов в случае испытуемой группы, которой вводили моноклональные антитела #1-#11 против CAPRIN-1, происходила регрессия опухоли до такой степени, что объем опухоли в начале введения антитела (100%) уменьшался до 50% к 4 дню, приблизительно до 10% к 6 дню, и до нескольких процентов к 8 дню. По существу полная регрессия опухоли имела место с 11 по 14 день (смотри Фиг. 5). С другой стороны, в контрольной группе, объем опухоли увеличивался приблизительно до 260%, 350%, 550%, и 800% от исходного объема к 4, 6, 8, и 11 дню, соответственно (смотри Фиг. 5). Кроме того, в группе мышей, которым вводили моноклональное антитело (взаимодействующее с самим белком CAPRIN-1, а не с поверхностями злокачественных клеток), противоопухолевые эффекты не могли проявляться, и рост опухоли происходил как в контрольной группе. Эти результаты указывают на то, что полученные моноклональные антитела #1-#11 против CAPRIN-1 демонстрируют сильные противоопухолевые эффекты in vivo в отношении злокачественных клеток, экспрессирующих CAPRIN-1. Кроме того, размер опухоли был получен путем вычисления объема опухоли по следующей формуле: продольный диаметр × поперечный диаметр × поперечный диаметр × 0,5.
Далее, моноклональные антитела #1-#11 против CAPRIN-1 вводили способом, описанным выше, мышам с опухолями (Balb/c), которым были трансплантированы злокачественные клетки N1E (приобретенные из ATCC). Результатом этого была полная регрессия опухоли к 15 дню после введения антитела. С другой стороны, в контрольной группе, объем опухоли увеличился приблизительно до 950% от исходного объема (смотри Фиг. 6).
Пример 7: Идентификация пептида в белке CAPRIN-1, с которым связывается антитело против CAPRIN-1, взаимодействующее с поверхностью злокачественных клеток.
Используя моноклональные антитела #1-#11 против CAPRIN-1, взаимодействующие с поверхностями злокачественных клеток (полученных выше), были идентифицированы частичные последовательности в белке CAPRIN-1, распознаваемые этими моноклональными антителами.
Сначала, добавляли DTT (Fluka) до 100 мкл раствора, полученного путем растворения рекомбинантного белка CAPRIN-1 в концентрации 1 мкг/мкл с использованием PBS до конечной концентрации 10 мМ, с последующими 5 минутами взаимодействия при 95°C, для осуществления восстановления дисульфидных связей в белке CAPRIN-1. Далее, добавляли йодацетамид (Wako Pure Chemical Industries, Ltd.) с конечной концентрацией 20 мМ, а затем проводили реакцию алкилирования для тиольных групп при 37°C в течение 30 минут в затемненных условиях. Пятьдесят (50) мкг каждого из моноклональных антител #1-#11 против CAPRIN-1 добавляли к 40 мкг полученного таким образом восстановленного алкилированием белка CAPRIN-1, объем смеси доводили до 1 мл 20 мМ фосфатным буфером (pH 7,0), а затем эту смесь оставляли взаимодействовать в течение ночи при 4°C при взбалтывании и перемешивании каждой смеси.
Далее, добавляли трипсин (Promega) до конечной концентрации 0,2 мкг. Через 1 час, 2 часа, 4 часа, а затем 12 часов взаимодействия при 37°C, полученные в результате продукты перемешивали со стеклянными бусами с белком А (GE), которые предварительно блокировали PBS, содержащим 1% BSA (Sigma), а затем промывали PBS, в 1 мМ карбонате кальция и буфере NP-40 (20 мМ фосфатного буфера (pH 7,4), 5 мМ EDTA, 150 мМ NaCl, и 1% NP-40), с последующим 30 минутным взаимодействием.
Каждую реакционную смесь промывали 25 мМ карбонат-аммонийным буфером (pH 8,0), а затем комплексы антиген-антитело элюировали, используя 100 мкл 0,1% муравьиной кислоты. LC-MS анализ проводили для элюатов, используя Q-TOF Premier (Waters-MicroMass) в соответствии с протоколами, приложенными к этому прибору.
В результате, полипептид последовательности SEQ ID NO: 136 был идентифицирован в качестве частичной последовательности CAPRIN-1, который распознавался всеми моноклональными антителами #1-#11 против CAPRIN-1. Более того, пептид с последовательностью SEQ ID NO: 137 был идентифицирован в качестве частичной последовательности в полипептиде SEQ ID NO: 136, приведенном выше, этот пептид распознавался моноклональными антителами #2-#5, #6-#8, и #10. Дополнительно было обнаружено, что моноклональные антитела #2-#5 распознавали пептид с последовательностью SEQ ID NO: 138, которая являлась частичной последовательностью пептида SEQ ID NO: 137.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Антитела по настоящему изобретению применимы для лечения и/или профилактики злокачественных опухолей.
Настоящее описание включает полное или частичное содержание изложенное в описании и/или чертежах японской патентной заявки No. 2009-087285, по которой испрашивается приоритет настоящей заявки. Кроме того, все публикации, патенты и патентные заявки, процитированные в настоящем описании, включены в это описание путем ссылки в полном объеме.
ПРОИЗВОЛЬНЫЙ ТЕКСТ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Праймеры: SEQ ID NO:31-39 и 130-135