Результат интеллектуальной деятельности: Линия мышей, трансгенных по альфа-цепи Т-клеточного рецептора клеток памяти, для изучения их функциональной активности
Вид РИД
Изобретение
Изобретение относится к области молекулярной биотехнологии и касается линии мышей, имеющих новый рецептор Т-лимфоцитов. Изобретение может быть использовано при изучении фундаментальных и прикладных задач, касающихся функционирования и способов применения Т-клеток памяти, несущих рецептор с заданной специфичностью.
В процессе иммунного ответа на антигены бактерий, вирусов и опухолей в организме формируется популяция лимфоидных клеток, способных к ускоренному и усиленному ответу на тот же антиген, введенный повторно. Встреча организма с антигеном ведет к дифференцировке Т-лимфоцитов в эффекторные клетки, а затем в клетки памяти. Это пул клеток, составляющий около 5%, способных длительно персистировать и осуществлять эффективный иммунный ответ при повторной встрече организма с антигеном (Rocha В., 1997; Jacob J. et al., 1997, Rocha В., 1999, Murali К.К. et al., 1998). Все известные методы вакцинации основаны на возникновении клеток памяти, которые функционально и фенотипически отличаются как от наивных, так и от эффекторных клеток. Изучение клеток памяти in vivo открывает новые возможности в получении достоверной информации о происхождении, дифференцировке и предшественниках данной популяции.
Специфическое узнавание антигена Т-лимфоцитами происходит благодаря наличию Т-клеточного рецептора (ТКР). ТКР состоит из альфа- и бета-цепей. Роль отдельных цепей ТКР изучают на Т-лимфоцитах мышей, несущих трансгенные цепи ТКР.
Известна линия мышей с ТКР, имеющим трансгенные альфа и бета цепи (V. Rybakin, L. Westernberg, G. Fu, H.-O Kim, J. Ampudia, K. Sauer, N.R.J. Gascoigne. Allelic Exclusion of TCR a-Chains upon Severe Restriction of Va Repertoire. PLoS ONE. 2014 9(12)).
Недостатком данной линии мышей является следующее:
1) наряду с различными альфа-цепями, авторами статьи была трансдуцирована бета- цепь ТКР, экспрессия гена которой подчиняется правилам аллельного исключения, что приводит к сильному сокращению репертуара ТКР на уровне трансгенного организма и возникновению иммунодефицитного состояния;
2) созданные мыши имеют трансгенные рецепторы со специфичностями, отличающимися от предлагаемой и не характерными для ТКР клеток памяти.
Известна линия мышей с трансгенной альфа-цепью ТКР, специфичность которой направлена против вируса хориоменингита ( D, Brduscha-Riem К, Hayday AC, Owen MJ, Hengartner H, Pircher H. T cell development and repertoire of mice expressing a single T cell receptor alpha chain. Eur J Immunol. 1995 Sep; 25(9):2650-2655).
D, Brduscha-Riem К, Hayday AC, Owen MJ, Hengartner H, Pircher H. T cell development and repertoire of mice expressing a single T cell receptor alpha chain. Eur J Immunol. 1995 Sep; 25(9):2650-2655).
Недостатком данной линии мышей является следующее:
1) созданные мыши имеют трансгенные рецепторы со специфичностями (антигены вируса хориоменингита), отличающимися от предлагаемой и характерны для ТКР цитотоксических Т-лимфоцитов, но не Т-клеток памяти;
2) созданные мыши характеризуются иммунодефицитным состоянием, т.к. они имеют дефект развития CD4+ и CD8+ тимоцитов, что отражается в снижении (десятикратном и двукратном соответственно) по сравнению с нормой этих субпопуляций лимфоцитов на периферии;
3) функциональный анализ Т-клеточного репертуара трансгенных мышей выявил значительное уменьшение (30-кратное) иммунного ответа на аллогенный антиген, отсутствие иммунного ответа на вирус везикулярного стоматита, а также сниженную Т-хелперную активность при переключении изотипа антител.
Задачей заявляемого изобретения является создание линии генетически модифицированных мышей, содержащих в своем геноме реаранжированный генный локус альфа-цепи ТКР клеток памяти со специфичностью к молекуле гистосовместимости Н-2Kb.
Задача решается тем, что получена новая линия генетически модифицированных мышей, содержащих в геноме ген альфа-цепи ТКР клеток памяти, специфически распознающих молекулу гистосовместимости:
1. Кассетный вектор рТа, характеризующийся размером 15000 пар нуклеотидов, в который по сайтам XmaI - SacII вставлен фрагмент размером 804 пары нуклеотидов (SEQ ID NO: 3), содержащий полноразмерную кДНК альфа-цепи Т-клеточного рецептора клеток памяти, специфичную к молекуле главного комплекса гистосовместимости мыши Н-2Kb.
2. Способ получения кассетного вектора рТа по п. 1, характеризующийся следующими стадиями:
а) получение клеток памяти, специфичных к молекуле Н-2Kb через 2 месяца после иммунизации мышей линии B10.D2(R101) с генотипом Н-2KdDb взвесью клеток лимфомы EL-4 с генотипом (H-2KbDb);
б) избирательная активация клеток памяти (а) клетками селезенки, полученными от мышей C57BL/6 с генотипом (H-2KbDb) и подвергнутыми острому тепловому шоку при t=45°C в течение 60 мин;
в) получение пула клеток памяти с одинаковыми рецепторами к молекуле Н-2Kb осуществляют путем активации (б) в течение 10 дней клеток селезенки иммунных мышей (а);
г) клонирование клеток памяти (в) методом лимитирующих разведений в течение 1 месяца;
д) получение долгоживущего клона (г), способного к длительному воспроизведению in vitro;
е) получение гибридомы путем соединения клона (д) с клетками лимфомы BW5147;
ж) клонирование гибридомы (е) методом лимитирующих разведений;
з) определение функциональной активности отдельных клонов (ж) по секреции интерлейкина-2 в ответ на избирательную активацию (б).
и) отбор наиболее эффективного клона (з);
к) ген α-цепи ТКР клона (з) соответствует семейству Vα11 (SEQ ID NO: 3), что было определено при помощи полимеразной цепной реакции с обратной транскрипцией, используя последовательности: SEQ ID NO: 1 и SEQ ID NO: 2;
л) клонирование гена α-цепи ТКР клона (з) в кассетный вектор рТа размером 208 300 пар нуклеотидов (1);
м) удаление из кассетного вектора по п. 1 прокариотического генома (около 5000 п.н).
3. Способ получения линии мышей, трансгенных по альфа-цепи Т-клеточного рецептора клеток памяти, характеризующийся следующими стадиями:
а) микроинъекция генетической конструкции по п. 1 в мужской пронуклеус оплодотворенной яйцеклетки (зиготы) мыши линии F1(CBA×C57BL/6);
б) выявление жизнеспособных зигот, содержащих генетическую конструкцию по п. 1;
в) пересадка выживших зигот (б) псевдобеременным самкам-реципиентам, имеющим копулятивную пробку после ссаживания с вазэктомированными самцами;
г) получение новорожденных мышей на 21 день после пересадки зигот (в);
д) проведение анализа наличия генетической конструкции по п. 1 через 14-21 день после рождения мышей (г), используя последовательности SEQ ID NO: 4 и SEQ ID NO: 5;
е) отбор мышей, несущих генетическую конструкцию по п. 1;
ж) проведение не менее 7 возвратных скрещиваний животных, полученных на генетической основе F1(CBA×C57BL/6) (е), с мышами линии B10.D2(R101).
4. Способ получения линии мышей, трансгенных по альфа-цепи Т-клеточного рецептора клеток памяти по п. 3, отличающийся тем, что полученная линия мышей служит для изучения функциональной активности клеток памяти на основании констатации ускоренного отторжения клеток лимфомы EL-4 по сравнению с мышами линии B10D2(R101) дикого типа.
Технический результат изобретения заключается в получении новой линии генетически модифицированных мышей, содержащих в геноме ген альфа-цепи ТКР клеток памяти со специфичностью к аллогенной молекуле гистосовместимости (Н-2Kb), для изучения функциональной активности клеток памяти.
Клетки памяти получали путем иммунизации мышей линии B10.D2(R101) с генотипом H-2KdDb взвесью клеток лимфомы EL-4 (H-2KbDb) с наличием молекул Н-2Kb. Взвесь клеток лимфомы вводили внутрибрюшинно в количестве 107 клеток на одну мышь. Через 2 месяца в селезенке иммунизированных мышей накапливались Т-клетки памяти, рецептор которых был специфичен к молекуле Н-2Kb.
Получение заявляемой линии мышей осуществляли с использованием метода избирательной активации аллореактивных Т-клеток памяти в ответ на аллогенные стимуляторы, подвергнутые острому тепловому шоку при t=45°C в течение 60 мин. (Казанский Д.Б., Петрищев, В.Н., Штиль, А.А., Чернышева, А.Д., Сернова, Н.В., Абронина, И.Ф., Побезинский, Л.А., Агафонова, Е.Л. Использование теплового шока антигенпрезентирующих клеток для функционального тестирования аллоспецифических Т-клеток памяти. Биоорганическая химия. 1999, Т. 25, №2, с. 117-128).
Для получения пула Т-клеток памяти с одинаковыми рецепторами спленоциты иммунизированных мышей B10.D2(R101) (H-2KdDb) in vitro стимулировали прогретыми спленоцитами C57B L/10, которые также, как и клетки лимфомы EL-4, несут молекулу Н-2Kb. Реакцию смешанной культуры лимфоцитов (СКЛ) проводили в течение 10 дней, в результате получали Т-лимфобласты, представляющие собой лимфоциты, несущие специфический рецептор к молекуле Н-2Kb. После инкубации лимфоциты клонировали методом лимитирующих разведений в 96-луночном планшете (Costar, США) в присутствии интерлейкина-2 в течение 1 месяца. Далее использовали долгоживущий клон, способный к длительному воспроизведению in vitro, для чего клон соединили с клетками лимфомы BW5147 и получили Т-гибридому. Данную Т-гибридому клонировали методом лимитирующих разведений в 96-луночном планшете (Costar, США).
Функциональную активность отдельных клонов определяли по уровню секреции интерлейкина-2 в ответ на специфический антиген (спленоциты мышей C57BL/10). Уровень секреции интерлейкина-2 определяли по жизнеспособности интерлейкин-2-зависимой клеточной линии мышей (CTLL-2), добавляя в культуральную среду этих клеток различные количества среды роста клонов Т-гибридомы. В результате был отобран наиболее эффективный клон, который получил название 1D1.
Для характеристики цепей ТКР из гибридомы 1D1 выделяли тотальную матричную РНК (мРНК) и с помощью обратной транскриптазы (Superscript RT, Promega, США) синтезировали комплементарную ДНК (кДНК). Далее проводили полимеразную цепную реакцию с обратной транскрипцией (ОТ ПЦР) с применением праймеров для определения вариабельных и константного сегментов α-цепей ТКР. В результате секвенирования ПЦР продукта, полученного при помощи праймеров, -SEQ ID NO: 1 (ССС TGC АСА ТСА GGG ATG СС) и SEQ ID NO: 2 (TGG CGT TGG TCT CTT TGA AG) было определено, что ген α-цепи ТКР гибридомы 1D1 соответствует семейству Vα11 (TCRADV4-3).
Далее, кДНК, полученную обратной транскрипцией на матрице мРНК, выделенной из гибридомы 1D1, амплифицировали при помощи праймеров к полноразмерной α-цепи ТКР, содержащих сайты для рестриктаз XmaI и SacII. Продукты амплификации выделяли из агарозного геля и обрабатывали рестриктазами XmaI и SacII (Fermentas, Литва) с последующей очисткой с помощью набора фирмы QIAGEN (USA). Контроль отсутствия мутаций в амплифицированной ДНК α-цепи ТКР 1D1 (SEQ ID NO: 3)
SEQ ID NO: 3

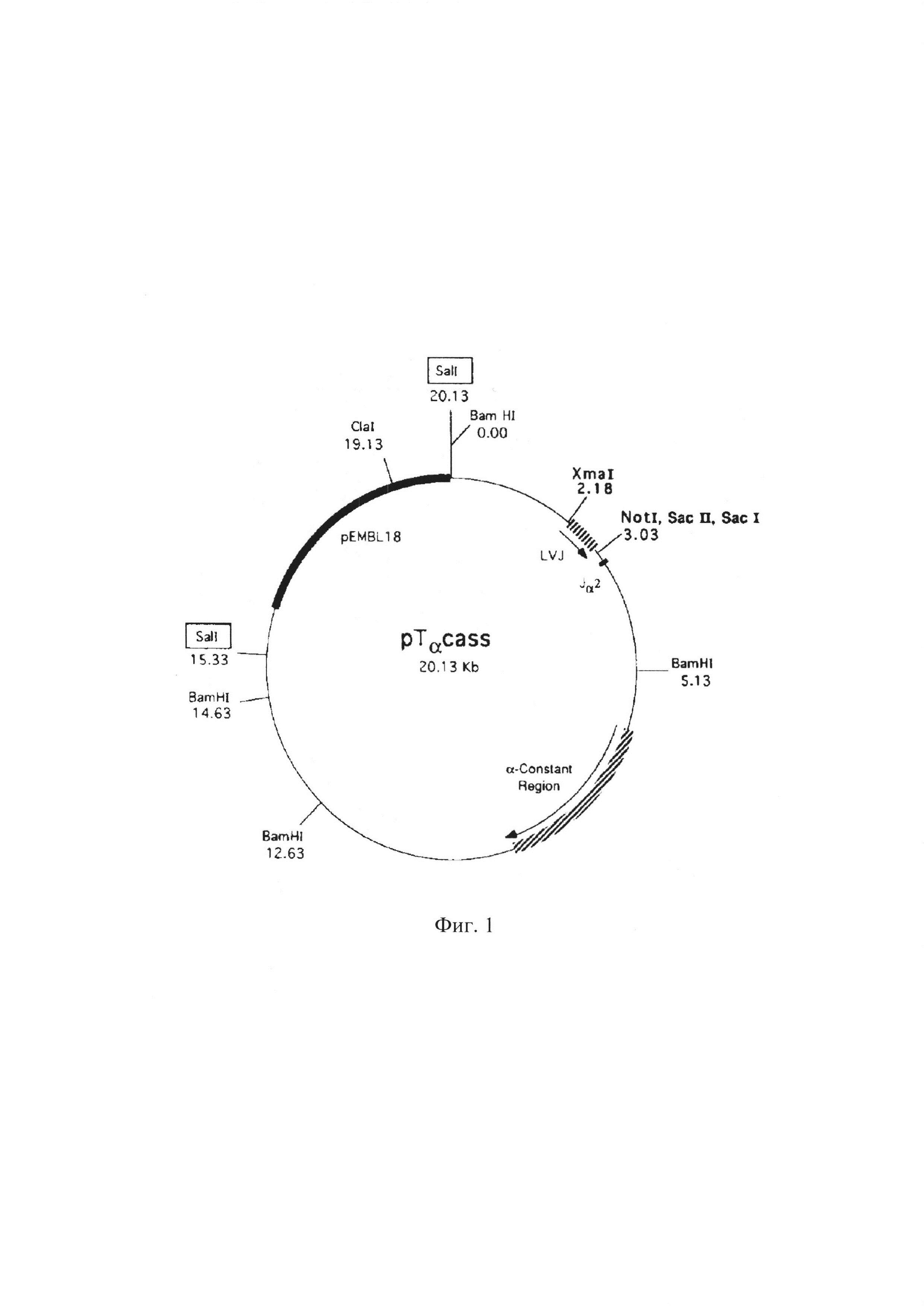
проводили методом секвенирования. Затем амплифицированную кДНК α-цепи ТКР гибридомы 1D1 клонировали в кассетный вектор рТα, (размером 20 300 п.н) (фиг. 1), (Dian Mathis, Франция), обработанный рестриктазами XmaI и SacII и щелочной фосфатазой CIAP. Данный кассетный вектор предназначен для экспрессии генов α-цепей ТКР (Kouskoff V, Signorelli K, Benoist С, Mathis D. Cassette vectors directing expression of T cell receptor genes in transgenic mice. J Immunol Methods. 1995; 180(2):273-280).
Перед инъецированием ДНК в яйцеклетку из кассетного вектора вырезали прокариотический геном (размером около 5000 п.н). при помощи фермента Sall. Размер генетической конструкции, инъецируемой в яйцеклетку, составил около 15000 п.н.
Изобретение иллюстрировано фиг. 1, фиг. 2 (А, Б, В, Г), фиг. 3 (а, б, в, г, д).
На фиг. 1 представлена структура вектора рТα, используемого для экспрессии генов α-цепей ТКР.
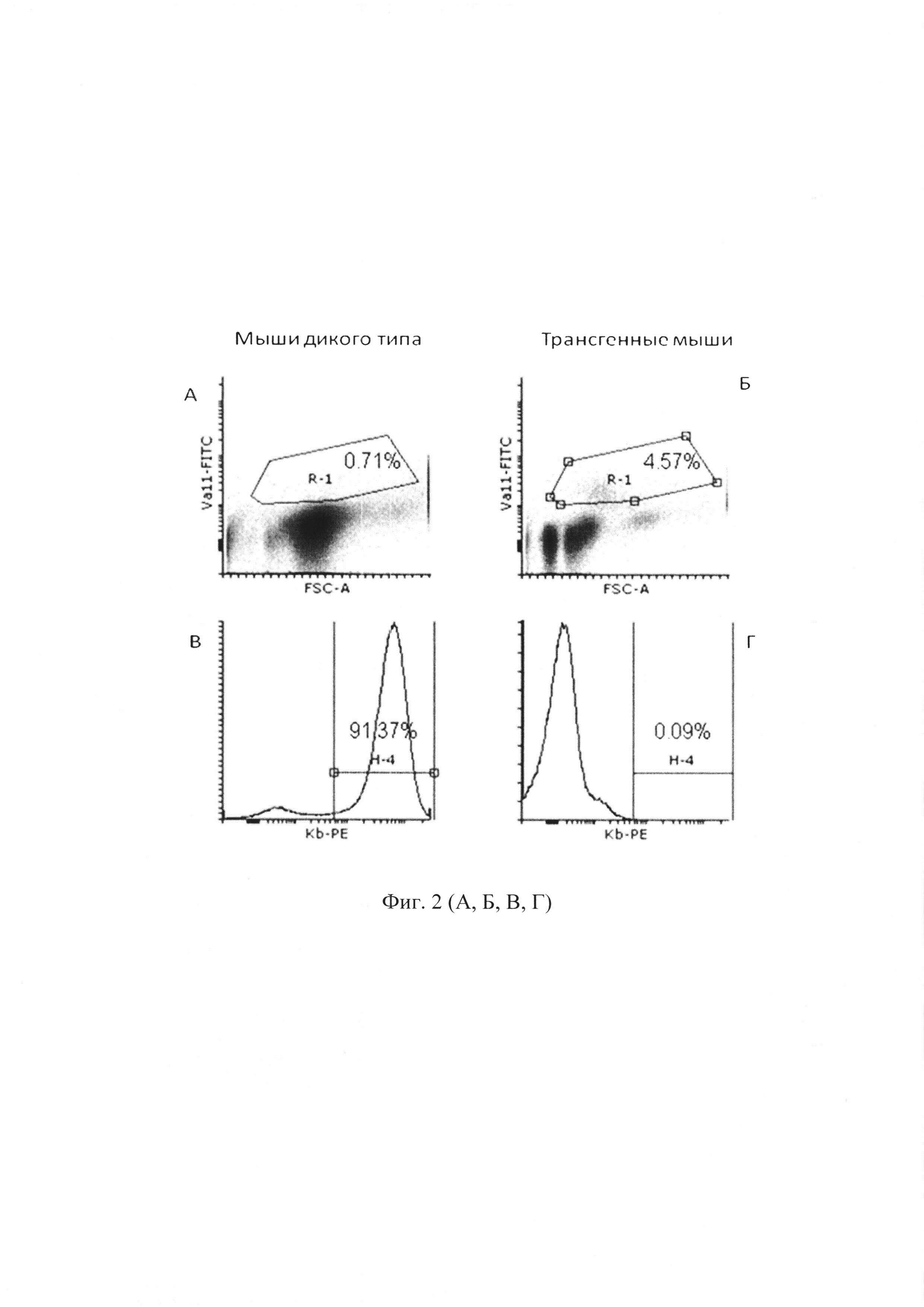
На фиг. 2 представлен сравнительный анализ содержания клеток, несущих трансгенный рецептор (Va11) (А, Б) и лимфому EL-4 (Н-2Kb) (В, Г) в перитонеальной жидкости мышей дикого типа и трансгенных мышей.
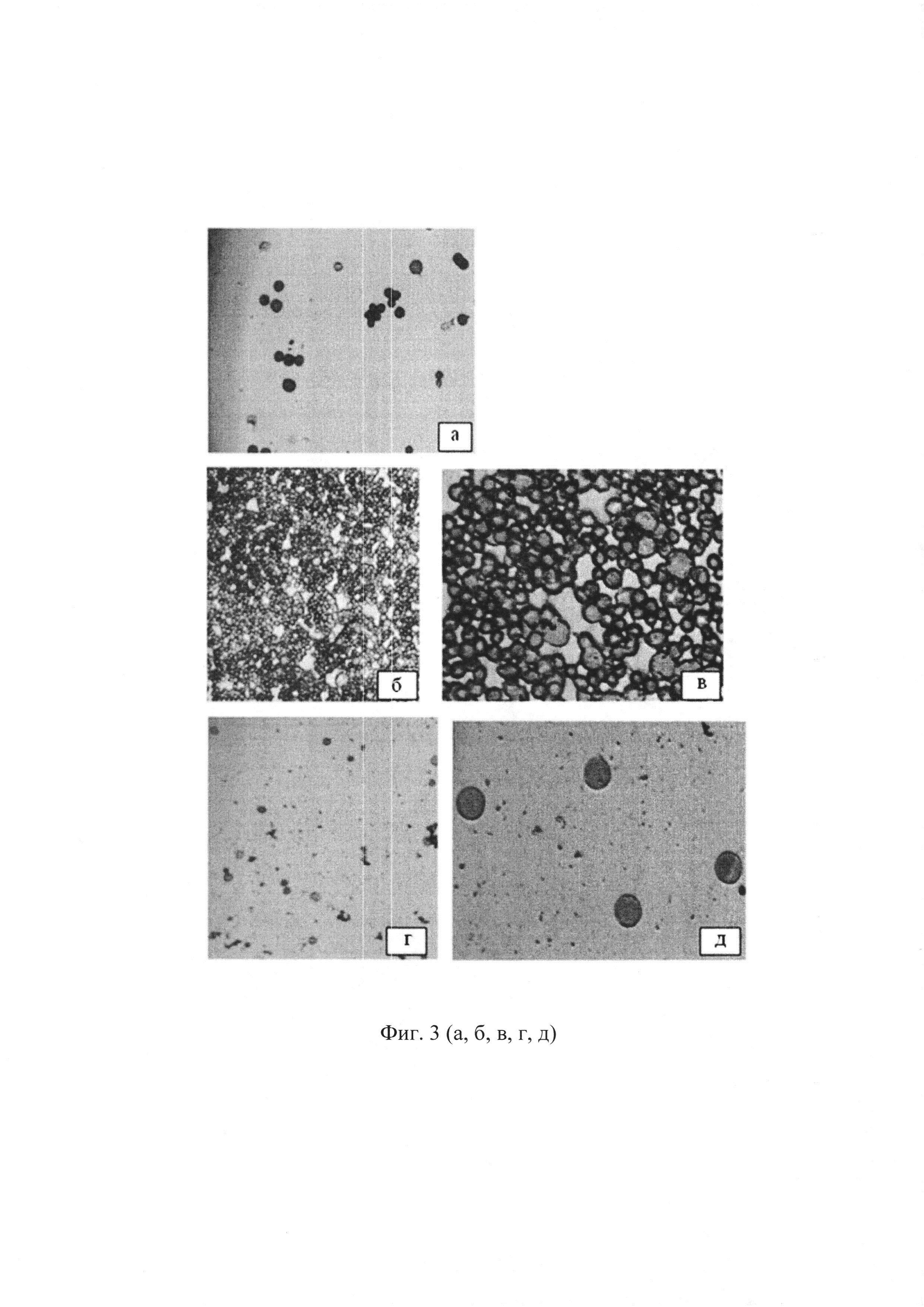
На фиг. 3 (а, б, в, г, д) представлена цитологическая картина клеток перитонеальной жидкости у мышей дикого типа B10.D2(R101) и у трансгенных мышей 1D1 (окраска гематоксилин эозином).
Изобретение иллюстрируется следующими примерами, но не ограничивается ими:
Пример 1. Получение трансгенных мышей
Трансгенные мыши были получены методом микроинъекции генетической конструкции, содержащей α-цепь ТКР гибридомы 1D1 в концентрации 5 нг/мкл, в мужской пронуклеус оплодотворенных яйцеклеток мышей - гибридов F1(CBA×C57BL/6) с последующей пересадкой выживших зигот псевдобеременным мышам-реципиентам.
Пример 2. Получение яйцеклеток мышей
Яйцеклетки для микроинъекции получали методом индукции суперовуляции. Для этого неполовозрелым самкам гибридам F1(CBA×C57BL/6) весом 12-13 г внутрибрюшинно вводили 8 ед. гонадотропина сыворотки жеребых кобыл (ГСЖК, МОСАГРОГЕН, Россия) и через 46 час - 8 ед. хорионического гонадотропина человека (ХгЧ, Московский эндокринный завод, Россия). После такой обработки самок ссаживали с самцами-производителями F1(CBA×C57BL/6). Факт спаривания констатировали на следующее утро по наличию копулятивной пробки.
Схема индукции суперовуляции: 13:00 - ГСЖК, через 46 часов в 11:00 - ХгЧ. В 17:00 этого же дня - подсадка к самцам-производителям. Отбор доноров производили на следующий день в 9:30. Световой режим в виварии был установлен с 7:00 до 19:00.
Через 12 часов самок умерщвляли, извлекали яйцеводы и яйцеклетки вымывали средой HEPES-KSOM с добавлением гиалуронидазы (Sigma, США) с помощью стеклянных капилляров. Процедуру проводили под бинокуляром (Zeiss Stemi DV4) с увеличением в 32 раза. Для вымывания яйцеклеток использовали стеклянные капилляры с внутренним диаметром примерно 100 мкм, изготовленные на пуллере Narishige PC-10 (Япония) и микрокузнице Narishige MF-900 (Япония). Полученные яйцеклетки культивировали в течение двух часов при t=37°C и 5% СО2 в капле среды HEPES-KSOM или KSOM под минеральным маслом (Sigma, США), затем помещали в микроинъекционную камеру. Микроинъекции проводили в среде HEPES-KSOM под микроскопом Zeiss Axiovert 200М при увеличении в 400-600 раз, используя микроманипуляторы Narishige. Для изготовления игл для микроинъекций использовали пуллер Sutter instrument Со Р-97 (США), для изготовления удерживающей пипетки использовали пуллер Narishige PC-10 и микрокузницу Narishige MF-900.
После окончания микроинъекций выжившие зиготы переносили в каплю среды KSOM или HEPES-KSOM под минеральное масло (Sigma) и культивировали в течение 1 часа для выявления жизнеспособных клеток.
Пример 3. Получение самок-реципиентов.
Самок-реципиентов яйцеклеток получали следующим образом: половозрелых самок F1(CBA×C57BL/6) весом не менее 24 г помещали с вазэктомированными самцами той же линии. Через 18 часов псевдобеременных реципиентов отбирали по наличию копулятивных пробок.
Пример.4. Операция вазэктомирования
Операцию вазэктомирования проводили заранее под наркозом (авертин, вводился внутрибрюшинно из расчета 15 мкл на 1 г веса животного). Через надрез в коже и брюшной стенке вытягивали из брюшной полости семенник, придатки семенника и семявыносящий проток, после чего раскаленным пинцетом разрушали семявыносящий проток. Органы возвращали в брюшную полость, и повторяли всю процедуру на другом семявыносящем протоке. На завершающем этапе на брюшную стенку и на кожу накладывали швы с последующей антисептической обработкой операционного поля.
Выжившие после микроинъекции зиготы трансплантировали в левый яйцевод псевдобеременной самки. В зависимости от количества клеток, выживших после микроинъекции, одной псевдобеременной самке пересаживали от 10 до 20 зигот под наркозом с использованием авертина.
Пример 5. Получение новорожденных мышей
В случае отсутствия естественных родов на 21 день после пересадки микроинъецированных яйцеклеток реципиента умерщвляли путем цервикальной дислокации и проводили кесарево сечение, после чего выживших детенышей помещали к заранее подготовленной кормилице. Через 14-21 день после рождения у мышат, рожденных после микроинъекций, брали образец ткани (кончик хвоста), выделяли ДНК и анализировали наличие трансгена методом ПЦР.
Пример 6. Анализ наличия трансгена в геноме мышей методом ПЦР
ДНК для ПЦР выделяли из тканей по стандартному протоколу (Molecular Cloning, США). Амплификацию фрагментов ДНК проводили с помощью Taq-полимеразы (Evrogen, Россия) в буфере (с 2,5 мМ MgCl2), прилагаемом фирмой-производителем, в присутствии 2 мМ dNTP и 10 пМ каждого праймера в следующих режимах: денатурация 94°С - 3 мин; далее следовало 4 цикла: 94°С - 20 сек, 62°С - 30 сек; 72°С - 35 сек; 8 циклов: 94°С - 20 сек, 60°С - 30 сек, 72°С - 35 сек; следовало 25 циклов: 94°С - 20 сек, 58°С - 30 сек, 72°С - 35 сек и, наконец, последний синтез 72°С - 10 мин.
ДНК для ПНР выделяли из тканей по стандартному протоколу (Molecular Cloning, США). Амплификацию фрагментов ДНК проводили с помощью Taq - полимеразы (Evrogen, Россия) в буфере с 2,5 мМ MgCl2, в присутствии 2 мМ dNTP и 10 пМ каждого праймера в следующем режиме: денатурация 94°С - 2 мин, далее 30 циклов: 94°С - 20 сек, 60°С - 15 сек, 72°С - 20 сек, последний синтез 72°С - 5 мин.
Для идентификации трансфицированного локуса гена α-цепи ТКР использовали следующие праймеры: SEQ ID NO: 4 (CCA GCT CGA GGA CAG GGG CCA TG), SEQ ID NO: 5 (AAC ACC GCG GTC TGT CTC AGA GTG T).
После завершения ПЦР 10 мкл реакционной смеси наносили на 1,5% агарозный гель, содержащий бромистый этидий и разделяли электрофорезом в трис-ацетатном буфере (Molecular Cloning, США). Гели фотографировали и анализировали, используя трансиллюминатор.
Пример 7. Получение линий трансгенных мышей на генетической основе линии В10.D2(R101)
Для получения линий трансгенных мышей на генетической основе линии B10.D2(R101) были проведены возвратные скрещивания трансгенных животных, полученных на генетической основе F1(CBA×C57BL/6), (скрещивание с мышами родительской линии B10.D2(R101)). Гибридное потомство анализировали методом ПЦР на наличие трансгена в геноме, и мышей, несущих трансген, использовали для возвратных скрещиваний с чистой линией B10.D2(R101). Для получения чистой линии трансгенных животных проведено 7 возвратных скрещиваний.
Пример 8. Анализ функциональной активности клеток памяти у трансгенных мышей
Тестирование функциональной активности клеток памяти, у трансгенных мышей проводили на основании констатации ускоренного отторжения клеток лимфомы EL-4, по сравнению с мышами линии B10D2R101 (дикого типа).
Иммунизацию трансгенных мышей клетками лимфомы EL-4 проводили внутрибрюшинно в количестве 107 клеток на мышь.
У мышей дикого типа иммунный ответ, приводящий к элиминации опухолевых клеток, развивался к 12-14 дню после их введения. На фиг. 2 (А и Б) показано, что в перитонеальной жидкости у трансгенных мышей на 6-й день после иммунизации увеличивается доля клеток, несущих ТКР, содержащий Vα11 по сравнению с мышами дикого типа (4,57% и 0,71% соответственно). На фиг. 2 (В и Г) показано, что на 6-й день после введения, клетки лимфомы EL-4 преобладали в перитонеальной жидкости мышей B10D2R101 дикого типа и составляли 91,37% клеток. У мышей с трансгенной α-цепью к 6 дню после иммунизации было обнаружено 0,09% опухолевых клеток.
На фиг. 3 (а, б, в, г, д) представлена цитологическая картина клеток перитонеальной жидкости: (а) - у интактных мышей дикого типа B10.D2(R101); (б, в) - у мышей линии B10.D2(R101) дикого типа на 6-й день после введения клеток лимфомы EL-4 (увеличение в 20 и 60 раз соответственно); (г, д) - у трансгенных мышей, иммунизированных клетками лимфомы EL-4 (увеличение в 20 и 60 раз соответственно).
Показано, что у мышей, несущих ТКР с трансгенной Vα11-цепью, специфичной к молекуле Н-2Kb, специфическая функциональная активность Т-клеток была в 2 раза выше по сравнению с мышами B10.D2(R101) дикого типа.