Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ АНТИКОАГУЛЯНТНОГО ПОТЕНЦИАЛА СОСУДИСТОЙ СТЕНКИ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к области лабораторной диагностики, кардиологии, терапии и может быть использовано для определения антикоагулянтного потенциала сосудистой стенки.
Атромбогенность эндотелия является одной из основных составляющих физиологического состояния интраваскулярного гомеостаза. Лимитирование фибриногенеза эндотелием происходит перманентно и реализуется, в основном, за счет наличия естественных антикоагулянтов прямого действия, выработка которых предшествует триггеру коагуляции - антитромбин III (AT III), гепариноподобные вещества, тромбомодулин (ТМ), протеазный нексин-1 (ПН-1), ингибитор пути тканевого фактора (TFPI), липопротеин-ассоциированный коагуляционный ингибитор (ЛАКИ) являются основными представителями антикоагулянтов сосудистой стенки. Основным составляющим, обеспечивающим большую часть антикоагулянтного потенциала крови, является AT III, антикоагулянтная активность которого многократно увеличивается при взаимодействии с гепарином и гепариноподобными веществами (гепаран сульфат, дерматан сульфат и др.). Помимо того, что AT III, ковалентно связываясь с тромбином, ингибирует активность последнего, антитромбин III является ингибитором множества сериновых протеаз, таких как ф.Ха, ф.IXa, ф.Xia, ф.XIIa. Считается, что активности AT III принадлежит до 90% всего антитромбинового потенциала крови [Строгий В.В., Войтович Т.Н., 2011]. ТМ представляется собой рецепторный гликопротеин, расположенный на люминальной поверхности эндотелиоцита. Его антикоагулянтный эффект реализуется посредством образования комплекса с тромбином, посредством которого происходит активация протеина С, который в синергизме со своим кофактором - протеином S - инактивирует ф.Va и ф.VIIIa, что препятствует дальнейшей наработке тромбина. Свободная форма ТМ - растворимый ТМ, образуется при структурном повреждении эндотелия. ПН-1 является нециркулирующим в кровотоке ингибитором множества протеаз (тромбина, активаторов плазминогена, ф.XIa и др.). «Пристеночное» действие ПН-1 обусловлено большой скоростью связывания с внеклеточным матриксом, преимущественно с гепаран-сульфатами. Антикоагулянтный эффект ПН-1 реализуется через комплексообразование при помощи ковалентных связей - ПН-1-тромбин, ПН-1-ф.XIa и т.д. Также ПН-1 был обнаружен на поверхности тромбоцитов, что обеспечивает возможность регуляции активности тромбина и протеина С. Антикоагулянтная активность TFPI реализуется через ф.Ха-опосредованное ингибирование комплекса внешней теназы (тканевый фактор - ф.VIIa), за счет чего происходит ингибирование каскада внешнего пути гемокоагуляции. Помимо TFPI ингибитором внешнего пути свертывания крови является ЛАКИ с аналогичным механизмом реализации антикоагулянтного эффекта. Помимо прямых антикоагулянтов можно выделить вещества, обладающие опосредованным антикоагулянтным действием, реализуемым через ингибирование адгезивно-агрегационной активности тромбоцитов оксид азота и простациклин. Базальный тип секреции данных веществ, обладающих вазодилататорным эффектом, способствует блокировке активации тромбоцитов и, как следствие, сохранению мембранной асимметрии, а также снижают секреторную активность тромбоцитов. Поимо этого оксид азота способствует ингибированию роллинга лейкоцитов на эндотелий. Однако оксид азота обладает крайне малым периодом полураспада, что скрывает проявление его эффектов в аликвоте крови.
Таким образом, практически все перечисленные продуценты могут находиться в циркулирующей крови либо в свободном состоянии, либо адсорбированными на мембранах форменных элементов крови. Исходя из этого, имеет место их присутствие в аликвотных концентрациях и в анализируемой пробе крови, где они принимают участие в регуляции фибриногенеза.
Антикоагулянтный потенциал сосудистой стенки, в основном, обеспечивается, вышеперечисленными факторами и его основная роль состоит в компенсаторном повышении напряженности при интенсификации гемокоагуляции, возникающей за счет увеличения напряжения сдвига, повышения уровня ангиотензина II, усиления липопероксидации, структурного повреждения эндотелиальной выстилки сосудов и др. Однако, в состоянии эндотелиальной дисфункции, сопровождающей течение большинства патологий (артериальная гипертензия, сахарный диабет и т.д.), сосудистая стенка не способна к компенсаторному купированию факторов, способствующих гиперкоагуляции, в результате чего возникает состояние тромбоопасности (Патент РФ №1110444, А61В 10/00, опубл. 30.08.1984 г.) - состоянию системы регуляции агрегатного состояния крови, сопровождающееся длительной тромбинемией, при которой противосвертывающая активность крови не в состоянии обеспечивать адекватную реакцию гемостатического потенциала при любой экзо-, эндо- и ятрогенной агрессии [Тютрин И.И., Удут В.В., 2004 г.], где значимая роль в предупреждении реализации тромботических событий отводится именно эндотелиальным продуцентам, обладающим противотромботическими эффектами. На сегодняшний день наборы для количественного и качественного определения антикоагулянтов сосудистой стенки, разрешенные для использования в клинической практике, отсутствуют, за исключением возможности определения AT-III хромогенным методом, что, однако, не позволяет составить представление об антикоагулянтном потенциале сосудистой стенки в целом.
Наиболее близким к заявляемому изобретению является способ определения противосвертывающей активности крови, заключающийся в проведении низкочастотной пьезотромбоэластографии и измерении следующих вязкостных характеристик крови (Патент РФ №2530584, G01N 33/49, опубл. 10.10.2014).
Данный способ заключается в оценке коэффициента противосвертывающей активности крови (КПА), который рассчитывается по формуле КПА=ИКД/ИПС, где ИКД - интенсивность коагуляционного драйва - имеет вид ИКД=(A3-А1)/t3, и при значении КПА в пределах 1,5-2 определяют нормальную противосвертывающую активность, а при значении меньше 1,5 определяют снижение противосвертывающей активности крови. Данный способ имеет ряд недостатков, среди которых: оценка противосвертывающей активности после желирования крови - на этапе полимеризации и ретракции сгустка, отсутствие оценки антикоагулянтного потенциала сосудистой стенки, длительное время проведения исследования, недостаточная информативность.
Новый технический результат заявленного изобретения -оценка противосвертывающей активности от начальных этапов гемокоагуляции до точки желирования крови, возможность оценки антикоагулянтного потенциала сосудистой стенки, сокращение времени проведения исследования, повышение информативности способа.
Для решения поставленной задачи в способе определения антикоагулянтного потенциала сосудистой стенки, заключающегося в двукратной регистрации вязкостных параметров крови методом низкочастотной пьезотромбоэластографии (НПТЭГ) - до и после разведения аликвоты цельной крови 0,9% физиологическим раствором с определением следующих параметров: A11 - показатель минимального уровня амплитуды кривой НПТЭГ цельной крови, где «t11» - время его достижения; t31 - время достижения точки желирования в цельной крови - начала этапа полимеризации фибрина; А12 - показатель минимального уровня амплитуды кривой НПТЭГ после внесения в аликвоту цельной крови физиологического раствора, где «t12» - время его достижения; t32 - время достижения точки желирования крови - начала этапа полимеризации фибрина, после внесения в аликвоту цельной крови физиологического раствора, отличающийся тем, что антикоагулянтный потенциал сосудистой стенки оценивается сравнением анализируемых параметров до и после разведения аликвоты крови 0,9% физиологическим раствором, для этого в силиконированный трехкомпонентный шприц объемом 1 мл вносят 0,3 мл 0,9% физиологического раствора комнатной температуры и после этого производят забор крови из кубитальной вены без наложения жгута в объеме 0,6 мл и при значении показателей А12 ниже, чем A11 и при значении t12, t32 больше, чем t11, t31 антикоагулянтный потенциал сосудистой стенки определяют как нормальный, а при значении показателей А12 выше, чем A11 и при значении t12, t32 меньше, чем t11, t31 антикоагулянтный потенциал сосудистой стенки определяют как сниженный.
Способ осуществляют следующим образом: Забор крови осуществляется из кубитальной вены трехкомпонентым силиконированным шприцем объемом 1 мл без наложения жгута. После этого, в течение 10 сек, содержимое шприца помещают в кювету объемом 0,45 мл, расположенную в термостате прибора АРП-01М «Меднорд» (Регистрационное удостоверение № ФСР 2010//09767 от 30 декабря 2010 года) и начинают исследование с применением программы ИКС-ГЕМО 3, выводящей динамику изменения вязкостных характеристик крови на экран персонального компьютера в виде интегрированной кривой. При этом оценивают следующие параметры:
A11 - показатель минимального уровня амплитуды кривой НПТЭГ за время достижения «t11»;
t11 - время достижения минимальной амплитуды кривой НПТЭГ (А1);
t31 - время достижения желирования крови, начало этапа полимеризации фибрина.
После этого проводят повторное исследование, при этом в силиконизрованный трехкомпонентный шприц объемом 1 мл вносят 0,35 мл физиологического раствора (раствор NaCl 0,9%) комнатной температуры и после этого производят забор крови из кубитальной вены без наложения жгута в объеме 0,55 мл. После этого содержимое шприца помещают в кювету объемом 0,45 мл, расположенную в термостате прибора АРП-01М «Меднорд» и начинают исследование с оценкой следующих параметров:
А12 - показатель минимального уровня амплитуды кривой НПТЭГ за время достижения «t11» после внесения в аликвоту крови физиологического раствора;
t12 - время достижения минимальной амплитуды кривой НПТЭГ (А1) после внесения в аликвоту крови физиологического раствора;
t32 - время достижения желирования крови, начало этапа полимеризации фибрина после внесения в аликвоту крови физиологического раствора
И при значении показателей А12 ниже, чем А11 и при значении t12, t32 больше, чем t11, t31 антикоагулянтный потенциал сосудистой стенки определяют как нормальный, а при значении показателей А12 выше, чем A11 и при значении t12, t32 меньше, чем t11, t31 антикоагулянтный потенциал сосудистой стенки определяют как сниженный.
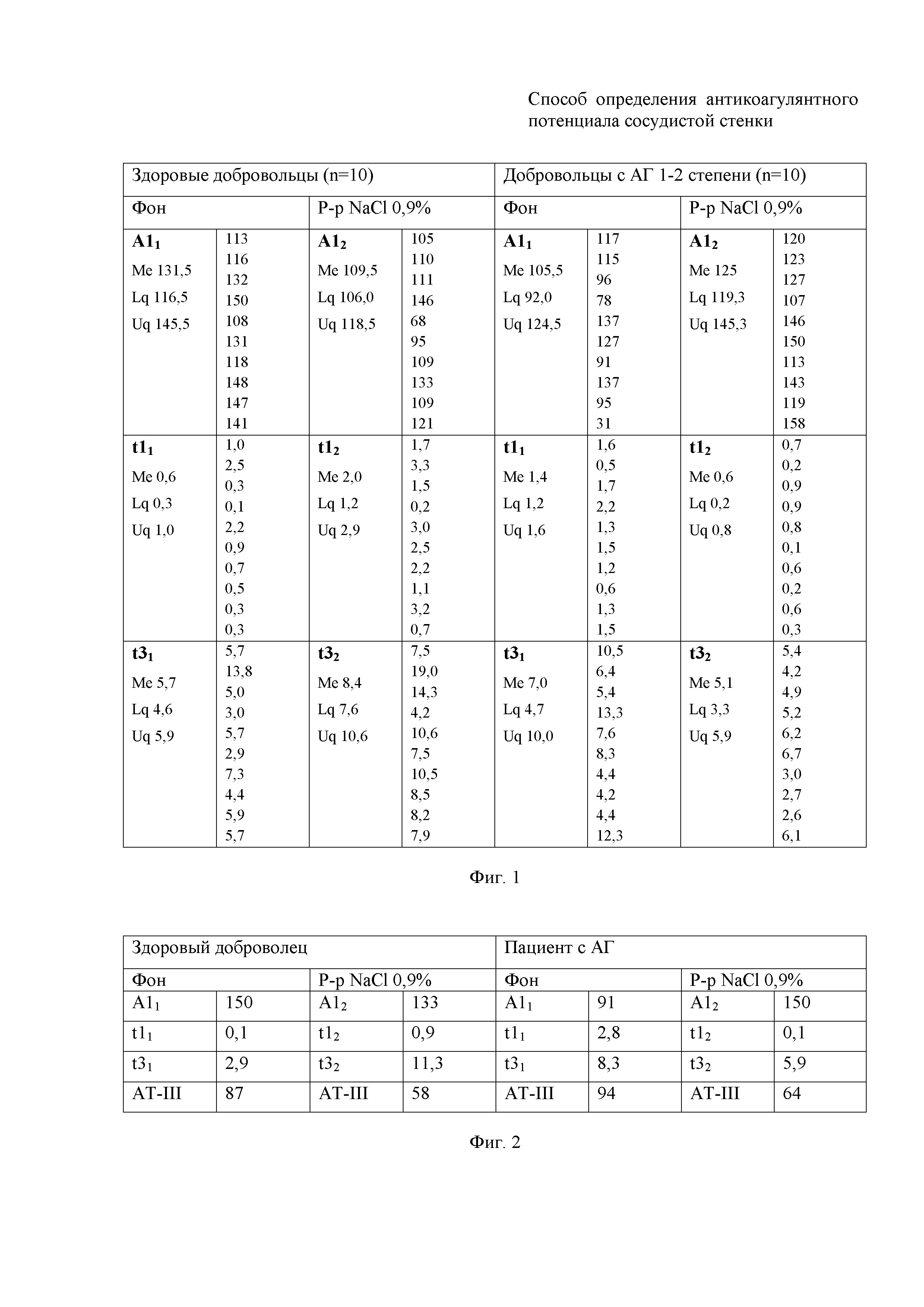
Предлагаемый способ основан на анализе данных клинических исследований, проведенных у группы здоровых добровольцев (n=10) и группы добровольцев с артериальной гипертензией 1-2 степени (n=10) после получения информированного согласия исследуемых. Была проведена сравнительная оценка динамики показателей «А1», «t1», «t3», «АТ-III» дважды - до и после разведения аликвоты крови 0,9% физиологическим раствором. Определение показателей «А1», «t1», «t3» производили методом НПТЭГ с использованием АРП-01М Меднорд (Меднорд, Россия). Определение активности «АТ-III» производилось методом ИФА с использованием анализатора Erba LisaScan ЕМ (Erba Lachema, Чехия) с использованием тест-системы «ТЕХ-АНТИТРОМБИН-ТЕСТ» (Технология-Стандарт, Россия). Количественные данные представлены в виде Me [LQ; UQ], где Me - медиана, LQ - нижний квартиль, UQ - верхний квартиль, р - достигнутый уровень значимости и отображены в фиг. 1. Исходные значения исследуемых показателей в группе здоровых добровольцев составили: А11 131,5 о.е. [116,5; 14 5,5], t11 0,6 мин [0,3; 1,0], t31 5,7 мин [4,6; 5,9], после разбавления аликвоты крови: А12 109,5 о.е. [106,0; 118,5], t12 2,0 мин [1,2; 2,9], t32 8,4 мин [7,6; 10,6]. Исходные значения определяемых показателей в группе добровольцев с АГ 1-2 степени составили: A11 105,5 о. е. [92,0; 124,5], t11 1,4 мин [1,2; 1,6], t31 7,0 мин [4,7; 10,0], после разбавления аликвоты: А12 125 о.е. [119,3; 145,3], t12 0,6 мин [0,2; 0,8], t32 5,1 мин [3,3; 5,9].
Пример №1.
17.03.2018 Здоровый доброволец В., 4 6 лет. После получения информированного согласия произведена двукратная оценка антикоагулянтного потенциала сосудистой стенки - до и после разведения аликвоты крови физиологическим раствором.
08:55. Проведено обследование: уровень артериального давления систолического - 125, диастолического 75 мм. рт.ст, частота сердечных сокращений 74/мин.
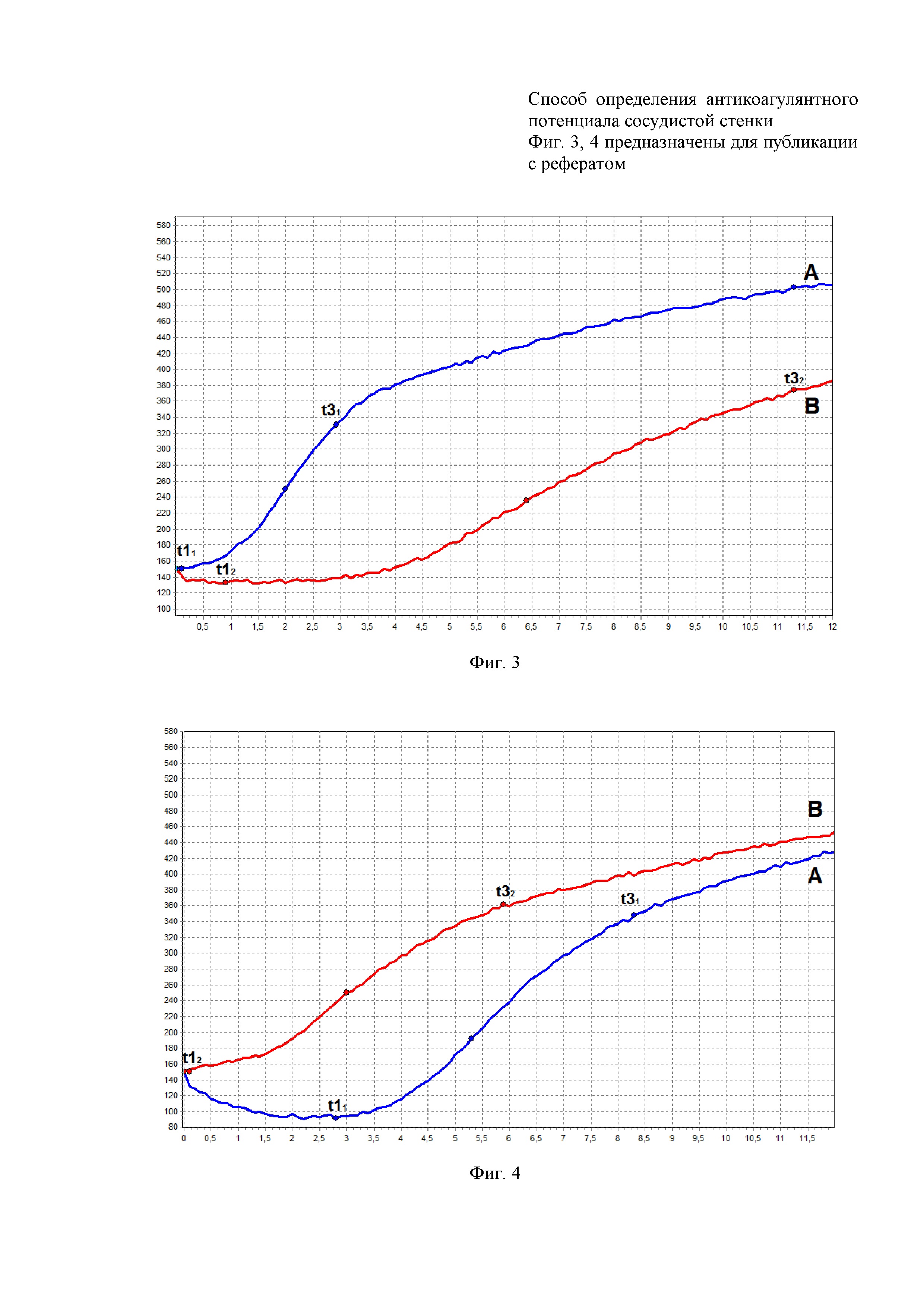
09:00. Проведение забора крови из кубитальной вены правой руки трехкомпонентым силиконированным шприцем объемом 1 мл без наложения жгута. Полученная аликвота крови, за интервал времени не превышающий 10 сек, помещалась в кювету объемом 0,45 мл расположенную в термостате прибора АРП-01М «Меднорд» (Россия) и начиналось исследование с использованием программы ИКС-ГЕМО 3. На фиг. 2 и 3 представлены значения и кривая НПТЭГ, отображающие исходное состояние антиакоагулянтного потенциала сосудистой стенки, оцениваемые показатели составили для A11 - 150 о.е., для t11 - 0,1 мин, для t31 - 2,9 мин и находились в пределах референтных значений. Из вены локтевого сгиба левой руки производили дополнительный забор крови в одноразовую стерильную вакуумную пробирку (BD Vacutainer), объемом 4,5 мл, содержащую буферный раствор цитрата натрия в соотношении кровь : цитрат 9:1. После этого, для получения бедной тромбоцитами плазмы, необходимой для исследования активности AT-III, пробирку центрифугировали 7 мин при 1000 об/мин (LABOFUGE, Германия), далее плазму переносили в другую пробирку и дополнительно центрифугировали 15 мин при 3000 об/мин. Исходная активность AT-III составила 87%.
10:00. В шприц объемом 1 мл вносили 0,35 мл физиологического раствора (раствор NaCl 0,9%) комнатной температуры. После этого, по вышеописанной методике, в этот же шприц производился забор венозной крови объемом 0,55 мл. После забора содержимое шприца помещали в кювету, расположенную в термостате прибора АРП-01М «Меднорд» и начинали повторное исследование. Повторный забор крови для определения активности AT-III проводился в трехкомпонентный силиконированный шприц объемом 5 мл, с заранее внесенным в него 1,5 мл физиологическим раствором (раствор NaCl 0,9%) комнатной температуры. Все последующие этапы пробоподготовки были описаны выше.
Оцениваемые показатели антикоагулянтного потенциала сосудистой стенки представлены на фиг. 2 и 3 и составили А12 - 133 о.е., для t12 - 0,9 мин, для t32 - 11,3 мин, для AT-III - 58%.
В ответ на разведение аликвоты крови 0,35 мл физиологического раствора (раствор NaCl 0,9%) фиксировали увеличение значений показателей t12 и t32 в 9 и 3,9 раз соответственно и снижение значения показателя А12 в 1,12 раз по сравнению с исходным, что демонстрировало хронометрическую и структурную гипокоагуляцию в ответ на разведение аликвоты. Активность AT-III снижалась соразмерно разведению аликвоты - в 1,5 раза по сравнению с исходным уровнем.
Пример №2.
18.03.2018 Пациент с диагнозом: Гипертоническая болезнь I стадии, степень артериальной гипертензии 2, дислипидемия, риск 2 (средний). Возраст: 51 год. После получения информированного согласия произведена двукратная оценка антикоагулянтного потенциала сосудистой стенки - до и после разведения аликвоты крови физиологическим раствором.
08:55. Проведено обследование: уровень артериального давления систолического - 154, диастолического 89 мм. рт.ст, частота сердечных сокращений 68/мин.
09:00. Проведение забора крови из кубитальной вены правой руки трехкомпонентым силиконированным шприцем объемом 1 мл без наложения жгута. Полученная аликвота крови, за интервал времени не превышающий 10 сек, помещалась в кювету объемом 0,45 мл расположенную в термостате прибора АРП-01М «Меднорд» (Россия) и начиналось исследование с использованием программы ИКС-ГЕМО 3. На фиг. 2 и 4 представлены значения и кривая НПТЭГ, отображающие исходное состояние антиакоагулянтного потенциала сосудистой стенки, оцениваемые показатели составили для А11 - 91 о.е., для t11 - 2,8 мин, для t31 - 8,3 мин и находились в пределах референтных значений. Из вены локтевого сгиба противоположной руки также производили дополнительный забор крови в одноразовую стерильную вакуумную пробирку (BD Vacutainer), объемом 4,5 мл, содержащую буферный раствор цитрата натрия в соотношении кровь : цитрат 9:1. После этого, для получения бедной тромбоцитами плазмы, необходимой для исследования активности AT-III, пробирку центрифугировали 7 мин при 1000 об/мин (LABOFUGE, Германия), далее плазму переносили в другую пробирку и дополнительно центрифугировали 15 мин при 3000 об\мин. Исходная активность AT-III составила 96%.
10:00. В шприц объемом 1 мл вносили 0,35 мл физиологического раствора (раствор NaCl 0,9%) комнатной температуры. После этого, по вышеописанной методике, в этот же шприц производился забор венозной крови объемом 0,55 мл. После забора содержимое шприца помещали в кювету, расположенную в термостате прибора АРП-01М «Меднорд» и начинали повторное исследование. Повторный забор крови с целью определения активности AT-III производился по вышеописанной методике. На фиг. 2 и 4 представлены оцениваемые показатели антикоагулянтного потенциала сосудистой стенки, числовое и графическое отображение динамики антикоагулянтного потенциала. Исследуемые показатели составили А12 - 150 о.е., для t12 - 0,1 мин, для t32 - 5,9 мин, для AT-III - 64%.
В ответ на разведение аликвоты крови 0,35 мл физиологического раствора (раствор NaCl 0,9%) фиксировали уменьшение значений показателей t12 и t32 в 28 и 1,4 раз соответственно и повышение значения показателя А12 в 1,6 раз по сравнению с исходным уровнем, что характеризовало хронометрическую и структурную гиперкоагуляцию. Уровень активности AT-III снижался соразмерно разведению - в 1,5 раза.
На фиг. 1 представлена таблица, в которой приведены значения показателей A1, t1, t3 до и после разбавления аликвот крови р-м NaCl 0,9% в группе здоровых добровольцев (n=10) и в группе пациентов с артериальной гипертензий 1-2 степени (n=10).
На фиг. 2 представлена таблица, в которой приведены значения показателей A1, t1, t3 до и после разбавления аликвот крови р-м NaCl 0,9% у здорового добровольца (пример 1) и пациента с артериальной гипертензий (пример 2).
На фиг. 3 представлено определение состояния гемостатического потенциала с помощью метода НПТЭГ (Пример 1):
А - исходное состояние гемостатического потенциала;
В - состояние гемостатического потенциала после внесения 0,9% р-ра NaCl в аликвоту крови.
На фиг. 4 представлено определение состояния
гемостатического потенциала с помощью метода НПТЭГ (Пример 2):
А - исходное состояние гемостатического потенциала;
В - состояние гемостатического потенциала после внесения 0,9% р-ра NaCl в аликвоту крови.
Способ определения антикоагулянтного потенциала сосудистой стенки, заключающийся в двукратной оценке вязкостных параметров крови методом низкочастотной пьезотромбоэластографии (НПТЭГ) до и после разведения аликвоты цельной крови 0,9% физиологическим раствором с определением следующих параметров: А1 - показатель минимального уровня амплитуды кривой НПТЭГ цельной крови, где t1 - время его достижения; t3 - время достижения точки желирования в цельной крови - начала этапа полимеризации фибрина; А1 - показатель минимального уровня амплитуды кривой НПТЭГ после внесения в аликвоту цельной крови физиологического раствора, где t1 - время его достижения; t3 - время достижения точки желирования крови - начала этапа полимеризации фибрина, после внесения в аликвоту цельной крови физиологического раствора, отличающийся тем, что антикоагулянтный потенциал сосудистой стенки оценивается сравнением анализируемых параметров до и после разведения аликвоты крови 0,9% физиологическим раствором, для этого в силиконированный трехкомпонентный шприц объемом 1 мл вносят 0,3 мл 0,9% физиологического раствора комнатной температуры и после этого производят забор крови из кубитальной вены без наложения жгута в объеме 0,6 мл и при значении показателей А1 ниже, чем A1, и при значении t1, t3 больше, чем t1, t3, антикоагулянтный потенциал сосудистой стенки определяют как нормальный, а при значении показателей А1 выше, чем А1, и при значении t1, t3 меньше, чем t1, t3, антикоагулянтный потенциал сосудистой стенки определяют как сниженный.