Результат интеллектуальной деятельности: Способ выявления генома возбудителя ротовирусной инфекции у сельскохозяйственных животных
Вид РИД
Изобретение
Изобретение относится к ветеринарной вирусологии, а именно к средствам диагностики ротавирусной инфекции у животных, как в практике ветеринарной службы, так и для научных исследований.
Ротавирусная инфекция («кишечный грипп») - инфекционное заболевание, вызванное ротавирусами. Для этого заболевания свойственно острое начало, умеренно выраженные симптомы гастроэнтерита или энтерита, частое сочетание кишечного и респираторного синдромов в начальном периоде болезни.
Известен способ идентификации Р[8]-1 субтипа ротавируса, включающий выделение РНК ротавирусов, проведение обратной транскрипции РНК, последующее проведение однораундовой полимеразной цепной реакции со специфичным праймером и анализ полученных фрагментов в агарозном геле (патент РФ 2264469, кл. C12Q 1/68, 2005 г.).
Также известен способ выявления кишечных вирусов, один из которых ротавирус в клинических образцах и воде методом мультиплексной ПЦР с детекцией в режиме реального времени (патент РФ №2506317, C12Q 1/68, 2014 г. - прототип), включающий выделение РНК из биологического материала, например из экстракта фекалий или фрагментов органов от инфицированных особей сорбционным методом, синтез кДНК на матрице РНК путем постановки одноэтагшой с добавлением внутреннего положительного контроля мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома ротавируса типа А олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией (Threshold).
Общим недостатком известных технических решений является отсутствие возможности получения достоверной диагностики ротавирусной инфекции типа А у животных.
Техническим результатом является получение достоверной диагностики с помощью ОТ - ПЦР в реальном времени.
Технический результат достигается тем, что в способе выявления генома возбудителя ротавируса типа А у сельскохозяйственных животных, включающем выделение РНК из биологического материала - экстракта фекалий или фрагментов органов от инфицированных животных сорбционным методом, синтез к ДНК на матрице РНК путем постановки одноэтапной с добавлением внутреннего положительного контроля мультиплексной реакции обратной транскрипции и полимеразной цепной реакции - с проведением 45 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома ротавируса типа А олигонуклеотидных праймеров флуоресцентно-меченного зонда и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией Threshold, согласно изобретению для выделения РНК используют биологический материал, взятый от инфицированных животных, для внутреннего контрольного образца - суспензию бактериофага MS2 с концентрацией 5×103/мл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса RVA и фрагмент генома бактериофага MS2, взятых в соотношении 1:1, которые имеют следующий нуклеотидный состав:
RVAF5 5'-ATTTCAGTTGATGAGACCA-3'; прямой праймер;
RVAR6 5'-CAATTCTAAGCGTGAGTCC-3' обратный праймер;
зонд RVAP FAM - 5'-AATATGACАССAGCGGTA-3'- BHQ1,
MS2F, 5'-TGGCACTACCCCTCTCCGTATTCAC-3' - прямой праймер;
MS2R, 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер;
зонд MS2P, Су5 5'-CACATCGATAGATCAAGGTGCCTACAAGC-3' BHQ2,
при этом накопление флуоресцентного сигнала измеряют по каналам: FAM/Green для специфического сигнала; Cy5/Red для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, если по каналу Cy5/Red значение Ct отсутствует или превышает 35 цикл и по каналу FAM/Green значение Ct также отсутствует, то проводят повторные исследования, начиная с этапа полимеразной ценной реакции.
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики ротавирусной инфекции типа А у животных используют две последовательные реакции: обратной транскрипции вирусной РНК для получения кДНК и полимеразной цепной реакции для амплификации фрагмента полученной кДНК матрицы. Обе реакции проводятся последовательно в одной ПЦР-пробирке (one-tube) с использованием специфичных для участка генома ротавируса типа А олигонуклеотидных праймеров флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага MS2: суспензия и фрагмент генома со с специфическими к нему праймерами и зондом. Такая постановка ОТ-ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации и возможность ошибки при переносе кДНК в другую пробирку для ПЦР. Кроме того, детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в ветеринарной вирусологии, а именно к средствам диагностики ротавирусной инфекции типа А у животных, как в практике ветеринарной службы, так и для научных исследований, что соответствует критерию «промышленная применимость».
Способ выявления генома возбудителя ротавирусной инфекции типа А у сельскохозяйственных животных осуществляется следующим образом
Предварительно выделяют РНК из биологического материала, например экстракт фекалий или фрагменты органов от инфицированных животных сорбционным методом. Проводят синтез кДНК на матрице РНК путем постановки одноэтапной мультиплексной реакции обратной транскрипции с использованием внутреннего контрольного образца - суспензию бактериофага MS2 и положительного контрольного образца в качестве которого используют смесь рекомбинантиых плазмидных ДНК, содержащих фрагмент генома вируса RVA и фрагмент генома бактериофага MS2 со следующими нуклеотидными последовательностями:
RVAF5 5'-ATTTCAGTTGATGAGACCA-3'; прямой праймер;
RVAR6 5'-CAATTCTAAGCGTGAGTCC-3' обратный праймер;
зонд RVAP FAM - 5'-AATATGACACCAGCGGTA-3' - BHQ1,
MS2F, 5'-TGGCACTACCCCTCTCCGTATTCAC-3' - прямой праймер;
MS2R, 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер;
зонд MS2P, Су5 5'-CACATCGATAGATCAAGGTGCCTACAAGC-3' BHQ2,
и полимеразной цепной реакции - с проведением 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома ротавируса типа А олигонуклеотидных праймеров и флуоресцентно-меченного зонда.
Затем измеряют накопление флуоресцентного сигнала по каналам: FAM/Green для специфического сигнала; Cy5/Red для сигнала внутреннего контроля и интерпретируют результаты на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией (Threshold). Если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Использование следующих олигонуклеотидных праймеров RVF5, RVR6 и флуоресцентно-меченного зонда RVP обеспечивает специфическое выявление РНК ротавируса типа А.
Использование для разных видов контроля различные формы материала бактериофага MS2: суспензии и фрагмента генома со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения РНК из образцов.
Выбор последовательности и расчет первичной структуры олигонуклеотидных праймеров и зондов.
Проведен сравнительный анализ доступных в базе данных GenBank нуклеотидных последовательности гена VP6, кодирующего белок внутренней оболочки капсида вируса и являющегося важнейшим компонентом вириона (inner capsid protein gene) ротавирусов, входящих в семейство реовирусов. Как и другие представители этого семейства, ротавирусы обладают двупитевой фрагментированной РНК, размером порядка 18 500 пар нукдеотидов. С помощью программы "BioEdit 7.0" выравнены нуклеотидные последовательности гена VP6 генома вирусов - представителей родов Ротавирусов (А-H видов) и орбивирусовс последовательностью гена VP6 генома ротавируса А изолята NCDV (Bovine rotavirus NCDV inner capsid protein VP6 mRNA (код доступа AF317127). В результате анализа построенного элайнмента внутри гена капсидного белка VP6 выбран участок между 500 и 900 нуклеотидами, содержащий уникальные нуклеотидные последовательности.
С помощью программы "Oligo 6.0" рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома.
Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд RVP, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров RVF5 и RVR6. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
Также с помощью программы "Oligo 6.0" проанализирована нуклеотидная последовательность бактериофага MS2 (Enterobacteria phage MS2 isolate ST4, complete genome. ACCESSION EF204940). Бактериофаг MS2 содержит однонитевую позитивно ориентрованную РНК размером 3569 оснований. В результате анализа внутри гена белка созревания (maturation protein) выбран участок между 200 и 350 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд MS2P, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров MS2F и MS2R. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
Пример конкретного осуществления способа выявления генома возбудителя ротавируса типа А у сельскохозяйственных животных
Для исследования используют следующий материал:
- фекалии весом 5 г. отбирают в стерильный пластиковый контейнер.
- из тканей кишечника вырезают кусочки размером 1 см и помещают в стерильный контейнер. Далее обрабатывают исследуемый материал.
Пробы тканей кишечника с содержимым (до 1 г) гомогенизируют с использованием стерильных фарфоровых ступок и пестиков, затем готовят 10% суспензию на стерильном физиологическом растворе. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 9000 об/мин в течение 1 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции РНК. Из фекалий (1-5 г) готовят 10% суспензию на стерильном физиологическом растворе. Взвесь фекалий декантируют в течение 5-10 минут. Отбирают 1 мл надосадочной жидкости и переносят в чистую пробирку 1,5 мл, центрифугируют при 5000 об./мин на центрифуге «MiniSpin», Eppendorf, в течение 5 мин. Экстракцию РНК из осветленного экстракта фекалий проводят по возможности, сразу. При необходимости хранения замораживают. Анализ проводят с помощью набора реагентов (см. таблицу 1 и 2) Анализ состоит из трех этапов:
- экстракция нуклеитидных кислот (НК);
- проведение реакции ОТ-ПЦР РВ с флуоресцентной детекцией в режиме реального времени;
- учет результатов анализа.
Реакция ОТ-ПЦР РВ проводится в одной пробирке.
Экстракция (выделение) НК из исследуемых проб
Отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для ОКО (отрицательный контрольный образец), по 10 мкл ВКО RV (внутренний контрольный образец).
В набор не входят реактивы для экстракции НК. Выделение РНК может проводиться, например, с помощью наборов на основе сорбционного метода, в состав которых входит силика или микроцентрифужные колонки, наборов на основе фенол-хлороформной экстракции и т.п. Рекомендуется использовать набор ««ПЦР-РОТАВИРУС-ФАКТОР» Технические условия ТУ 21.10.60-102-51062356-2015, ранее 9398-102-51062356-2015 «ПЦР-РОТАВИРУС-ФАКТОР, http://www.vetfaktor.ru/ » набор реагентов для выявления РНК ротавируса типа А в клиническом материале методом обратной транскрипции и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени» либо аналогичный.
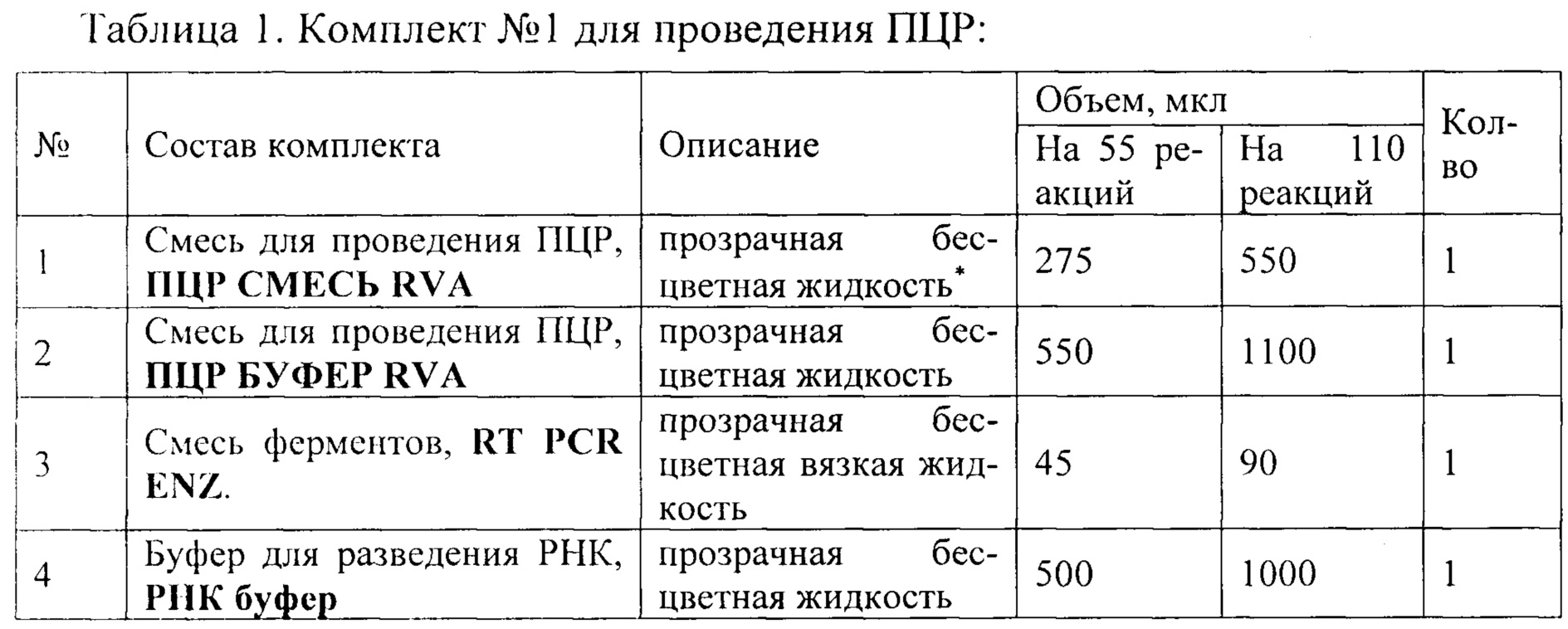
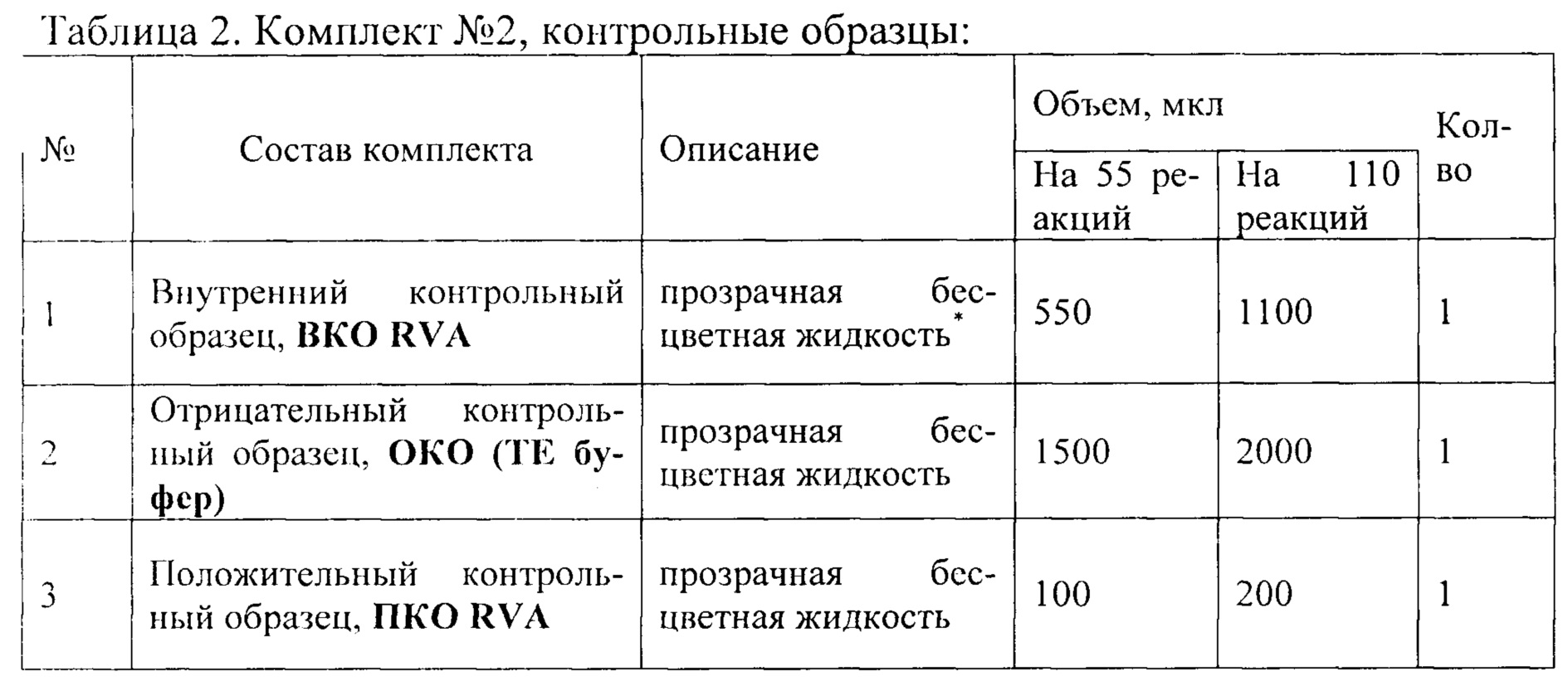
Подготовка образцов к проведению ПЦР
Общий объем реакционной смеси - 25 мкл, объем РНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют использованием ПКО RVA, ВКО RVA и РНК буфера.
Буфер для проведения ОТ-ПЦР, ПЦР буфер RV; состав: 2,5× ПЦР-буфер (хлорид калия, 100 мМ, Трис-HCl, рН 8,8 100 мМ, глицерол 1%, Tween-20 0.02%); хлорид магния, 5 мМ; деионизированная вода.
Смесь для проведения ПЦР, ПЦР-смесь RV состав: эквимолярная смесь дсзоксинуклеозидтрифосфатов (дНТФ) в концентрации 0,25 мМ («Синтол», Россия); деионизированная вода, смесь праймеров и флуоресцентного зонда на ротавирус А (прямой и обратный праймеры RVAF и RVAR в концентрации 0,2 мкМ, зонд RVAP-FAM в концентрации 0,1 мкМ, взятых в соотношении 1:1:0,5), смесь праймеров и флуоресцентного зонда на ПКО (прямой и обратный праймеры MS2F и MS2R в концентрации 0,2 мкМ, зонд MS2P-Cy5 в концентрации 0,1 мкМ, взятых в соотношении 1:1:0,5).
Смесь ферментов, RT PCR ENZ, состав: ДНК полимераза с антителами, ингибирующими активность фермента, TAQ POLYMERASE (5 ед/мкл) («Альфа-фермент», Россия), обратная транскриптаза MMLV REVERSE TRANSCRIPTASE (100 ед/мкл) («Альфа-фермент», Россия).
Буфер для разведения РНК, РНК буфер, состав: деионизованная вода.
Внутренний контрольный образец, ВКО RVA; состав: суспензия бактериофага MS2 (5×103/мл)
- Отрицательный контрольный образец, ОКО (ТЕ буфер); состав: ТЕ буфер (10 мМ Tris-HCl, 0,5 мМ EDTA, рН 8,0)
- Положительный контрольный образец, ПКО RVA; состав: смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса RVА и фрагмент генома бактериофага MS2, взяты в соотношении 1:1, которые имеют следующий нуклеотидный состав:
RVAF5 5'-ATTTCAGTTGATGAGACCA-3'; прямой праймер;
RVAR6 5'-CAATTCTAAGCGTGAGTCC-3' обратный праймер;
зонд RVAP FAM - 5'-AATATGACАССAGCGGTA-3' - BHQ1,
MS2F, 5'-TGGCACTACCCCTCTCCGTATTCAC-3'- прямой праймер;
MS2R, 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер;
зонд MS2P, Су5 5'-CACATCGATAGATCAAGGTGCCTACAAGC-3' BHQ2,
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
10 мкл ПЦР БУФЕР RVA
5 мкл ПЦР СМЕСЬ RVA
0,75 мкл RT PCR ENZ.
Перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием. Отбирают необходимое количество пробирок для амплификации НК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси.
Используя наконечники с фильтром в подготовленные пробирки вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл РНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую внести по 10 мкл НК соответствующей пробы;
в) в пробирку с положительным контролем ПЦР (К+) 10 мкл ПКО RVA. Проводят реакции ПЦР РВ с флуоресцентной детекцией на приборах «Rotor-Gene Q», «ДТ-96» и «СРХ96».

Помещают подготовленные для проведения ПЦР пробирки в ячейки ам-плификатора и программируют прибор.
Синтез кДНК проводят при температуре 55°С в течение 15 мин, а затем терминируют реакцию 5-минутным прогреванием реакционной смеси при температуре 95°С. Далее следует стадия ПЦР.
Температурный режим для проведения ПЦР включает 40 циклов амплификации (95°С - 15 сек, 58°С - 30 сек, 72°С - 20 сек). Обе реакции проводятся в одной пробирке последовательно, без открывания пробирки и переноса материала.
Детекция продуктов амплификации осуществляется методом регистрации флуоресценции, генерируемой в результате разрушения гибридизационного зонда, содержащего на 5'-конце флуорофор (FAM7Cy5), а на 3'-конце - гаситель (BHQ1/BHQ2). В реакции используется два зонда одновременно, пара FAM-BHQ1 для мишени RVA и пара Су5 - BHQ2 для MS2. В отсутствие мишени флуорофор и гаситель сближены и наблюдается лишь незначительная флуоресценция, так как гаситель поглощает испускаемое флуорофором излучение. При накоплении в ходе ПЦР специфических продуктов зонд гибридизуется на ампликон, что ведет к его разрушению за счет 5'-экзонуклеазной активности Taq-полимеразы. В результате флуорофор отделяется от гасителя и его излучение может быть детектировано. Таким образом, увеличение количества синтезированного ПЦР-продукта приводит к росту флуоресценции.
В результате ПЦР получают данные - кривые накопления флуоресцентного сигнала, которые анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени».
Учет результатов ОТ-ПЦР проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца.
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции НК в соответствии с таблицей 4.
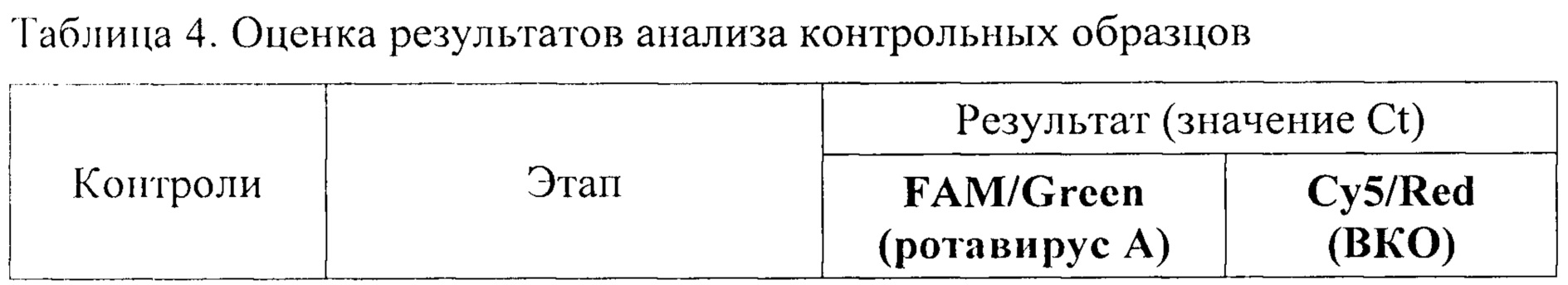
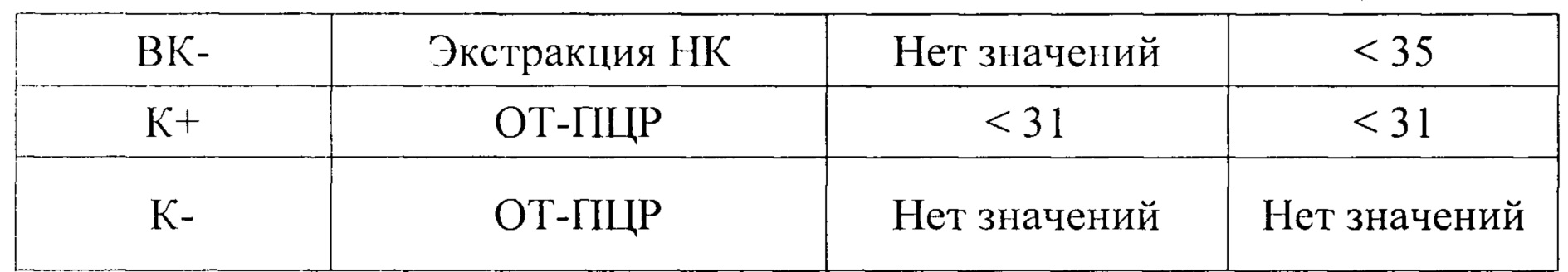
Появление любого значения Ct в таблице результатов для отрицательного контроля этапа экстракции (ВК-) на канале FAM/Green и для отрицательного контроля этапа ПЦР (К-) на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Образцы, для которых по каналу Cy5/Red значение Ct отсутствует или превышает 35 цикл (при этом по каналу FAM/Green значение Ct также отсутствует) требуют повторного проведения исследования с этапа ПЦР. Задержка в значениях пороговых циклов для исследуемых образцов на канале Cy5/Red указывает на присутствие ингибиторов в пробах или на ошибки при постановке реакции ОТ-ПЦР. Требуется провести исследование, начиная с э тапа экстракции НК.
Образец считается положительным, РНК ротавируса типа А присутствует, если наблюдается рост специфического сигнала на канале FAM/Green, при этом значения Ct контрольных образцов находятся в пределах нормы (см. Табл. 4). Если для исследуемого образца по каналу FAM/Green значение Ct определяется позднее 35 цикла при корректном прохождении положительных и отрицательных контролей - он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (наблюдается рост специфического сигнала на канале FAM/Green) - образец считается положительным.

