Результат интеллектуальной деятельности: Способ диагностики у детей астено-вегетативного синдрома в условиях экспозиции алюминием
Вид РИД
Изобретение
Изобретение относится к биологическим исследованиям и медицине, и предназначено для идентификации неблагоприятного воздействия алюминия, поступающего из окружающей среды, в виде нарушений нервной системы (т.е. неблагоприятного воздействия алюминия на модификацию астено-вегетативного синдрома) ребенка, проживающего на территории с повышенным содержанием этого токсиканта в окружающей среде, и может быть использовано для диагностики и прогнозирования токсического действия алюминия на нервную систему.
Изобретение может быть использовано для постановки предварительного диагноза как в специализированных клиниках при обследовании пациентов, так и в обычных учреждениях здравоохранения. Результаты указанных обследований необходимы для разработки индивидуальных программ наблюдения и лечения в зависимости от тяжести нарушения нервной системы ребенка, а, кроме того, могут быть использованы при формировании санитарно-гигиенических мероприятий по предупреждению и устранению воздействия вредных химических веществ, обуславливающих формирование указанной патологии.
Для задач диагностики нарушений здоровья, в частности, нарушения нервной системы от воздействия алюминия, а также для оценки эффективности профилактики и лечения, актуальным является выделение маркерных показателей астено-вегетативного синдрома, которые можно использовать в качестве дополнительных диагностических показателей, характеризующих ответ организма на специфическое средовое окружение, в частности, алюминия.
Под термином «астено-вегетативный синдром» понимается функциональное расстройство вегетативной нервной системы, регулирующей нормальную деятельность всех внутренних органов и систем организма (код, согласно Международной классификации болезней 10-го пересмотра - МКБ10: G90.8 «Другие расстройства вегетативной (автономной) нервной системы»). У детей астенические расстройства зачастую характеризуются продолжительным инкубационным периодом и отсутствием каких-либо ярко выраженных клинических признаков на начальных этапах развития болезни. В процессе своего развития патологическое состояние начинает проявляться более интенсивно, проявляется раздражительностью, быстрой утомляемостью, нарушениями сна у ребенка.
Под термином «модификация астено-вегетативного синдрома» понимается изменение течения данного состояния, характеризующееся наличием отклонений лабораторных показателей, не типичных для клиники изучаемой патологии.
В связи с широчайшим использованием химических технологий в различных производственных циклах и сферах человеческой деятельности пристальное внимание ученых и медиков привлекает проблема выявления пороговых критериев, позволяющих на ранних этапах оценить, что воздействие вредного химического вещества превышает компенсаторные возможности организма и наносит вред здоровью человека. Актуальность исследования неблагоприятного воздействия алюминия особенно обусловлена на территориях, вблизи которых размещены предприятия цветной металлургии.
Токсичность алюминия проявляется во влиянии на обмен веществ, в особенности минеральный, на функцию нервной системы, в способности действовать непосредственно на клетки - их размножение и рост. В основе механизма многих проявлений интоксикации лежит действие алюминия непосредственно на ядерный хроматин, а также косвенно - путем замещения других элементов или изменения активности ряда ферментных систем.
Отсутствие специализированной технологии, ориентирующей врача на выявление случаев функциональных заболеваний центральной нервной системы (ЦНС), связанных с воздействием опасных химических факторов, ограничивает его диагностические возможности, снижает эффективность проводимых лечебных мероприятий и не позволяет в полной мере предупреждать развитие тяжелых и осложненных форм в старших возрастных группах.
Действующие стандарты и протоколы, устанавливающие объем и порядок диагностических мероприятий детям с функциональными заболеваниями ЦНС, не предусматривают проведение химико-аналитических исследований для идентификации токсикантов в биосредах, специальных лабораторных исследований для оценки морфофункционального состояния клеток ЦНС и функциональных исследований для оценки уровня развития когнитивных функций, что исключает возможность формирования доказательной базы развития этой патологии в связи с действием химических факторов.
Например, из информации, размещенной на сайте интернет-ресурсов https://diseases.medelement.com/disease/view/mtm4nzm%253d/fdb8, известно, что для диагностики заболевания по МКБ10: G90.8 «Другие расстройства вегетативной (автономной) нервной системы» проводят следующие основные и дополнительные диагностические мероприятия:
основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне:
• измерение артериального давления, частоту сердечных сокращений, частоту дыхания в покое, при физической, умственной и эмоциональной нагрузках;
• клиноортопробу;
• общий анализ крови (6 параметров);
• определение натрия, кальция, калия в сыворотке крови;
• определение глюкозы в сыворотке крови;
• общий анализ мочи;
• электрокардиографическое исследование (в 12 отведениях);
Дополнительные (рекомендуемые) диагностические обследования, проводимые на амбулаторном уровне:
• биохимический анализ крови: определение аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), общего билирубина, прямого билирубина, тимоловой пробы, С - реактивного белка.
То есть, действительно, при диагностике функциональных расстройств ЦНС не предусматривается проведение химико-аналитических исследований для идентификации токсикантов в биосредах и специальных лабораторных показателей, отражающих токсическое действие токсичных химических соединений, что делает известный способ не эффективным в условиях воздействия контаминантов из среды обитания окружающей среды.
Из уровня техники известны следующие технические решения, релевантные заявляемому изобретению.
Из патента РФ №2449722 известен способ прогноза формирования нарушений вегетативной нервной системы (ВНС) у детей раннего возраста, перенесших церебральную ишемию в периоде новорожденности. Согласно этому способу у детей раннего возраста, перенесших церебральную ишемию в периоде новорожденности, выявляют наиболее информативные параметры и вычисляют прогностический индекс S как сумму этих параметров в баллах: S=П1+П2+П3-0,5хП4+0,6хП5+П6+П7+П8+П9+П10+0,4, где П1 - наличие среднего образования у матери=+0,4; П2 - выкидыши, медицинские аборты в анамнезе=- 1,5; П3 - воспалительные заболевания половых органов=-0,5; П4 - оценка по шкале Апгар на первой минуте; П5 - оценка по шкале Апгар на пятой минуте; П6 - гипоксия=-0,9; П7 -начало грудного вскармливания в родильном зале=+4,6; П8 - наличие двигательных нарушений=-0,7; П9 - наличие гипертензионно-гидроцефального синдрома=-0,7; П10 - нормальная картина нейросонографии=+0,5. Получив значение S менее 0, прогнозируют высокую вероятность развития у ребенка нарушений вегетативной нервной системы в период раннего детского возраста, а при S более 0 делают заключение об отсутствии угрозы развития нарушений вегетативной нервной системы.
Недостатком указанного способа является то, что он позволяет прогнозировать развитие нарушений ВНС в будущем, а не провести оценку нарушений в настоящий момент, и при этом условиями прогноза являются исключительно нарушения вегетативной нервной системы у детей раннего возраста, перенесших церебральную ишемию в периоде новорожденности.
Известен лабораторный способ диагностики шизотипического расстройства (Патент РФ №2569741). Сущность изобретения заключается в определении количества глутамата в сыворотке крови больных эндогенными психозами. При выявлении в сыворотке крови психических больных количества глутамата выше 20,12 нмоль/мл диагностируют шизотипическое расстройство. Исследование изменений количества глутамата в сыворотке крови больных эндогенными психическими расстройствами было выбрано в известном способе в связи с выявленным дисбалансом деятельности глутаматных и дофаминовых рецепторов, обусловливающей нейротрансмиттерные расстройства при эндогенных психозах. Одна из ведущих гипотез патогенеза шизофрении и пограничных расстройств на сегодняшний день является глутаматная гипотеза. Получены достоверные различия в уровне глутамата в сыворотке крови у больных шизотипическим расстройством личности в отличие от пациентов с другими психическими расстройствами и здоровыми людьми, что позволит проводить известным способом дифференциальную диагностику данного расстройства с другими эндогенными психозами.
Недостатком указанного способа является то, что способ ориентирован на диагностику состояния психического здоровья, ассоциированного с нарушениями высшей нервной деятельности, а не на диагностику изменений астено-вегетативного синдрома, а также в этом способе не учитывается возможность генетической предрасположенности по критериям полиморфности генов.
Из уровня техники известна диссертационная работа «Состояние эфферентного отдела нервной системы, психологического статуса и конституционально-генетические особенности у больных с вегетативными кризами (ВК)», автор: Закирова Д.Д., Казань, 2011 г. (Медицинские Диссертации http://medical-diss.com/medicina/sostoyanie-efferentnogo-otdela-nervnoy-sistemy-psihologicheskogo-statusa-i-konstitutsionalno-geneticheskie-osobennosti-u-#ixzz5BIkC5WjL), в которой указано, что при синдроме вегетативной дисфункции возникают сочетанные изменения в эфферентном звене анимальной нервной системы и психологическом статусе, проявляющиеся в ускорении процессов эфферентации и особом (демонстративном) типе акцентуации личности. Изучался полиморфизм генов: 1) G603A гена транспортера глутамата ЕААТ; 2) rs545098 G/A гена ионотропного рецептора глутамата GLUR 1 (GRIA1); 3) rs9307959 С/Т гена ионотропного рецептора глутамата GLUR 2 (GRIA2); 4) G49S гена бета-адренорецептора ADRB1. Была выявлена достоверная связь генотипов ADRB1 GG, Glurl GG, Glur2 СТ, Glur2 СС, ЕААТ AG, ЕААТ АА, ADRB1 SG с нарушениями вегетативного гомеостаза, влияние генотипов Glur2 и ЕААТ на тяжесть, длительность заболевания и клинические проявления. В группе с гипервентиляционными вегетативными кризами прослежена связь «неблагоприятного» вегетативного гомеостаза с генотипом ADRB1 GG, GLUR2 СС.Полученные данные свидетельствуют о наличии предрасположенности к вегетативными кризам у лиц с определенным генотипом.
Недостатком указанного способа является то, что способ позволяет характеризовать исключительно предрасположенность к развитию вегетативных кризов, при этом не оценивается фактическое состояние вегетативной нервной системы по уровню экспрессии самих геноопосредованных белков, например, глутамата.
Известен способ прогнозирования перинатальных гипоксических поражений центральной нервной системы у новорожденных (Патент РФ №2313095). Для прогнозирования данной патологии проводят определение содержания интерлейкина-1β в периферической венозной крови беременной с 35 недели беременности, осложненной гестозом. При его значении, большем 40 пкг/л, прогнозируют перинатальные гипоксические поражения центральной нервной системы у новорожденных.
Также известен способ прогнозирования перинатальных гипоксических поражений центральной нервной системы у новорожденных (патент РФ №2542463), согласно которому у пациенток с угрожающими преждевременными родами в 22-27 недель гестации в периферической венозной крови определяют содержание sRAGE и при его значении, равном 659,5 пкг/л или менее, прогнозируют развитие перинатального гипоксического поражения центральной нервной системы у новорожденного с точностью 75,6%.
Недостатком указанных способов является то, что они позволяют прогнозировать исключительно перинатальные гипоксические поражения центральной нервной системы у новорожденных, причем по маркерам периферической венозной крови беременной и без учета состояния полиморфизма генов.
Известен способ диагностики перинатальной патологии центральной нервной системы, ишемически-гипоксического генеза у детей (Заявка РФ №2008108877), включающий забор крови, определение ее параметров и сравнительный анализ с нормами здорового ребенка, при этом забор периферической крови из безымянного пальца производят по стандартной методике, определяют среднее число эритроцитов (RBC), уровень гемоглобина (Нb), гематокрит (НСТ), средний объем эритроцита (HCV), среднее содержание гемоглобина в одном эритроците (МСН) и по совокупному отклонению их от норм судят о степени тяжести заболевания.
Из патента РФ №2092157 известен способ диагностики поражения периферической нервной системы вибрационного генеза. Способ позволяет повысить чувствительность и снизить опасность инфицирования обследуемого. Для этого на тыльную поверхность кисти, волярную поверхность плеча и предплечья в их средней трети наносят смесь, состоящую из 9-ти частей хлороформа и 1-й части этанола. Затем измеряют латентный период до появления жжения в точке нанесения смеси и при увеличении латентного периода не менее, чем в двух точках, -на тыльной поверхности кисти свыше двух мин и в области предплечья или плеча свыше 1 мин - относят обследуемого к лицам с поражением периферической нервной системы вибрационного генеза. Однако этот способ предназначен для установления профзаболевания и может быть использован для выявления лиц с поражением периферической нервной системы. Способ неприменим для детей.
При этом из уровня техники не были выявлены известные способы оценки нарушений нервной системы, ассоциированных с внешнесредовым воздействием алюминия, поэтому сделать выбор ближайшего аналога к заявляемому объекту не представляется возможным.
Технический результат, достигаемый предлагаемым изобретением, заключается в обеспечении достоверности установления на ранней стадии оценки влияния алюминия на возникновение астено-вегетативного синдрома, за счет использования в качестве информативного критерия совокупности маркеров, а именно: уровня контаминации алюминием и наличия генетического полиморфизма в отношении генов ионотропного рецептора глутамата GRIA1 rs545098 и гена глиального глутаматного транспортера SLC2A1 rs841839.
Поставленный технический результат достигается предлагаемым способом диагностики у детей астено-вегетативного синдрома в условиях экспозиции алюминием, характеризующимся тем, что определяют в пробе мочи ребенка содержание алюминия, также у указанного ребенка отбирают пробу буккального эпителия и осуществляют выделение из указанной пробы дезоксирибонуклеиновой кислоты, затем на детектирующем амплификаторе с использованием полимеразной цепной реакции в режиме реального времени проводят генотипирование полиморфизма генов ионотропного рецептора глутамата GRIA1 (rs545098) и гена глиального глутаматного транспортера SLC2A1 (rs841839), устанавливая при этом состояние генотипа для каждого из указанных генов: гетерозиготное GA, нормальное гомозиготное GG и вариантное гомозиготное АА для гена GRIA1 (rs545098), гетерозиготное TG, нормальное гомозиготное ТТ и вариантное гомозиготное GG для гена SLC2A1 (rs841839), и при одновременном выполнении следующих условий: наличие вариантного гомозиготного или гетерозиготного генотипов гена ионотропного рецептора глутамата GRIA1 (rs545098) и гена глиального глутаматного транспортера SLC2A1 (rs841839), при условии одновременного обнаружения у пациента превышения содержания алюминия в моче более, чем в 1,3 раза по сравнению с референтным значением содержания алюминия в моче, равным 0,01 мг/дм3, диагностируют у ребенка наличие астено-вегетативного синдрома в условиях экспозиции алюминием.
Указанный технический результат обеспечивается за счет следующего. GRIA1 (глутамат-ионотропный рецептор АМРА-тип субъединицы 1) представляет собой ген кодирования данного белка. Заболевания, связанные с GRIA1, включают различные гиперкинезы и вегетативные отклонения. Среди элементов его функционала - циркадное 10
увлечение и метаболизм белков. Нейро-физиологические механизмы, связанные с этим геном, включают связывание домена PDZ и активность канала с экстрацеллюлярным глутаматом. Ионотропный глутаматный рецептор L-глутамат действует как возбуждающий нейротрансмиттер во многих синапсах центральной нервной системы. Связывание L-глутамата возбуждающего нейротрансмиттера индуцирует изменение конформации, приводящее к открытию канала катиона, и тем самым превращает химический сигнал в электрический импульс. Затем рецептор быстро дезактивируется и переходит в переходное неактивное состояние, характеризующееся наличием связанного агониста (GeneCards [Электронный ресурс] // genecards.org: Glutamate Ionotropic Receptor АМРА Type Subunit 1. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=GRIA1 (дата обращения 31.05.2018)). Традиционно глутаматные рецепторы подразделяются на ионотропные, связанные с ионными каналами, и метаботропные, индуцирующие изменение метаболических процессов в нейронах через систему вторичных мессенджеров и сопряженные с G-белками. Ионотропные глутаматные рецепторы отвечают за быструю синаптическую передачу. Характерной чертой ионотропных рецепторов NMDA-класса является присущая им функция регуляции проводимости ионных каналов для Са2+. Благодаря этому NMDA-рецепторы играют важную роль в регуляции длительности возбуждающего потенциала, тем самым участвуя в осуществлении когнитивных функций. Ионотропные рецепторы различных классов также подвергаются сложному взаимному влиянию. Быстрый синаптический ответ, опосредуемый каинатными или АМРА-рецепторами, приводит к изменению мембранного потенциала (деполяризации), снятию так называемого "магниевого блока" с NMDA-рецепторов и их активации. Вследствие этого увеличивается проницаемость клеточной мембраны для ионов Са2+, что приводит к запуску различных Са2+-зависимых сигнальных механизмов, в частности, активации ряда протеинкиназ, что, в свою очередь, оказывает влияние на другие классы ионотропных глутаматных рецепторов.
Глютаматные рецепторы являются преобладающими возбуждающими рецепторами нейротрансмиттеров в мозге млекопитающих и активируются в различных нормальных нейрофизиологических процессах. Эти рецепторы представляют собой гетеромерные белковые комплексы, состоящие из нескольких субъединиц, образованных с образованием лиганд-ионных каналов (ELISA kit - наборы ИФА, антитела, рекомбинантные белки [Электронный ресурс] // http://xn--80aabqbqbnift4db.xn--plai: Glutamate Receptor, Ionotropic, AMPA 4 (GRIA4) (дата обращения 31.05.2018).).
Ген SLC2A1(GLUT) кодирует крупный транспортер глюкозы в гематоэнцефалическом барьере млекопитающих. Закодированный белок находится в основном в клеточной мембране и на поверхности клетки, где он также может функционировать как рецептор для вируса лейкоза Т-клеток человека (HTLV) I и П. Мутации этого гена были обнаружены в семействе с пароксизмальной дискинезией. SLC2A1 (Solute Carrier Family 2 Member 1) представляет собой ген, кодирующий белок. Заболевания, связанные с SLC2A1, включают в себя неврологические дефекты и синдром дефицита глют-1. Среди путей реализации его эффектов: перенос глюкозы и других Сахаров, желчных солей и органических кислот, ионов металлов и аминных соединений и метаболизм гликозаминогликана. Механизмы, связанные с этим геном, включают связывание с белком и трансмембранную активность транспортера (GeneCards [Электронный ресурс] // genecards.org: Solute Carrier Family 2 Member 1. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=SLC2Al (дата обращения 31.05.2018)).
Ген SLC2A1 определяет экспрессию белка, называемого белком-транспортером глюкозы типа 1 (GLUT1). Белок GLUT1 встроен во внешнюю мембрану, окружающую клетки, где он транспортирует простой сахар, называемый глюкозой, в клетки из крови или из других клеток для использования в качестве топлива. Белок GLUT1 перемещает глюкозу между клетками в головном мозге, называемых глиальными клетками, которые защищают и поддерживают нервные клетки (нейроны). Имеются сообщения о более, чем о 150 мутациях гена SLC2A1 у людей с синдромом дефицита GLUT1. Это расстройство приводит к различным неврологическим симптомам, которые могут включать неврологические расстройства (астению), задержку развития, умственную инвалидность, проблемы с движением (кинезы). Мутации, которые вызывают синдром дефицита GLUT1, уменьшают или устраняют функцию белка GLUT1. Наличие менее функционального белка GLUT1 снижает количество глюкозы, доступной клеткам мозга, что влияет на развитие и функцию мозга (Genetics Home Reference [Электронный ресурс] // ghr.nlm.nih.gov: SLC2A1 gene. URL: https://ghr.nlm.nih.gov/gene/SLC2Al (дата обращения 31.05.2018)).
Поиск биологических генетических маркеров и разработка методов, позволяющих идентифицировать патологию нервной системы у детей на ранних этапах ее возникновения, является одной из важнейших задач фундаментальной медицины на современном этапе (Иванова С.А. и др., 2013; Craig-Schapiro R., Fagan А. М., 2009). Генетические биомаркеры -это индикаторные показатели, объективно измеряемые и оцениваемые, которые могут служить предикторами нормальных и патофизиологических процессов. Они позволяют проводить анализ и прогнозировать предполагаемый механизм возникновения и развития патологических состояний (Craig-Schapiro R., Fagan А. М., 2009; Grandjean P., Budtz-Jorgensen Е., 2010).
Алюминий относится к нейротропным и иммунотоксичным элементам [Hartwell, B.L., Pember, F.R. The presence of aluminum as a reason for the difference in the effect of so-called acid soil on barley and rye // Soil Sci., 1998, vol. 6, p. 259-281]. Алюминий кумулируется и подавляет функцию макрофагов, Т-лимфоцитов и В-лимфоцитов. При этом он вызывает не только супрессию клеточных реакций, но и митогенный эффект лимфоцитов [Golub M.S., Takeuchi Р.Т., Gershvin M.E., Yoshida S.H. Influence of dietary aluminum on cytokine production by mitogen-stimulated spleen cells from Swiss Webster mice // Immunofarmacology and Immunotoxicology. - 1993. - vol. 15, №5. - P. 605.]. Предполагают, что алюминий может быть одной из причин старческого клеточного иммунодефицита [Цидильковская, Э.С., Автореф. дис.… канд. биол.наук, Москва, 2005, 129 с]. Кроме того, алюминий может вызывать аллергию, что обусловлено супрессивным влиянием этого микроэлемента на мутаген-опосредованный иммунный ответ [Караулов А.В. Вторичные иммунодефицитные состояния: молекулярно-биохимические механизмы развития и методы коррекции // Аллергия, астма и клиническая иммунология - 2000. - №1. - С. 24-25.] В то же время алюминий способствует обострению целого ряда аутоиммунных заболеваний в пожилом и старческом возрасте. Считается, что соединения алюминия проникают при контактном воздействии через кожу и оказывают системное воздействие на иммунную систему, не вызывая развития контактного дерматита [Литовская А.В., Егорова И.В. Состояние иммунной системы работающих в условиях влияния биологического, химического и физического факторов // Медицина труда и промышленная экология. - 2000. - №2. С. 8-11].
Алюминиевые соединения дали отрицательные результаты в большинстве краткосрочных мутагенных анализов. Было показано, что еще в 1976 году алюминий (Al2(SO4)3) уменьшает синтез ДНК, не влияя на точность репликации (Sirover & Loeb, 1976). При концентрациях от 20 мкМ до 150 мМ поддерживалась точность синтеза ДНК in vitro. Было показано, что в клеточной линии крысиного остеобласта, UMR 106, синтез ДНК, определяемый включением 3Н-тимидина, снижается в отсутствие увеличения синтеза белка, как определено введением 3Н-лейцина при воздействии 30 мкМ алюминия (Blair et Al., 1989). Концентрации алюминия от 0,01 мМ до 0,1 М, как и АlСl3, не показали возможности индуцировать депуринизацию ДНК, измеряемую высвобождением аденина или гуанина в ДНК теленка-тимуса (Schaaper et al., 1987). ДНК теленка-тимуса использовали Ahmad et al. (1996) для изучения изменений связывания ДНК АlСl3 (0,6-25 мМ).
В настоящее время установлена связь между алюминием и следующими заболеваниями: болезнью Альцгеймера, рака молочной железы, деменцией, аутизмом, болезнью Паркинсона. Алюминий является сильнейшим нейротоксином. Ученые считают, что свободный ион алюминия, Al (3+), обладает высокой биологической реактивностью и уникальными возможностями, чтобы нанести ущерб нейронам человека.
Особенно склонны к негативному воздействию алюминия дети и пожилые люди. У детей избыток алюминия вызывает повышенную возбудимость, нарушения моторных реакций, анемию, головные боли, заболевание почек, печени, колиты. Гиперактивность, повышенная возбудимость, агрессивность подростков, нарушения памяти и трудности в учебе, могут быть результатом даже небольшого повышения количества ионов алюминия в организме. Алюминий также оказывает общее отравляющее и засоряющее действие на организм человека. Токсичность алюминия проявляется во влиянии на обмен веществ, в особенности минеральный, на функцию нервной системы, в способности действовать непосредственно на клетки - их размножение и рост.
В качестве критерия нарушений физиологической функции вегетативной нервной системы в условиях контаминации алюминием рекомендуется использовать наличие вариантного гомозиготного или гетерозиготного генотипов гена ионотропного рецептора глутамата GRIA1 (rs545098) и гена глиального глутаматного транспортера SLC2A1 (rs841839), фенотипирующих глутамат и характеризующих нарушения нервной регуляции и развитие астено-вегетативного синдрома.
Реализующим процесс вегетативных нарушений служит экспозиция алюминия, превышающая референтную концентрацию его содержания в моче (референтный уровень алюминия в моче 0,01 мг/л).
Благодаря тому, что в заявляемом способе в качестве диагностических критериев предлагается использовать именно полиморфизм гена GRIA1 (rs545098) и гена SLC2A1 (rs841839), обеспечивается точность исследования, т.к. у ребенка учитывается детерминация вероятных нарушений вегетативной нервной системы (а именно, по снижению экспрессии глутамата), а также предрасположенность к нарушению функции переноса глюкозы в клетки глии, что усугубляет нарушения вегетативной регуляции. А избыточные концентрации алюминия в биосредах реализуют (инициируют) имеющийся дефект (полиморфизм) нейрорегуляторных генов. По этим показателям можно судить о генетически детерминированном характере функциональных нарушений нервной системы и разрабатывать индивидуальные программы диагностики и коррекции.
Благодаря использованию в качестве исследуемого материала проб буккального эпителия, крови и мочи, а также стандартных методик изучения иммунологических и генетических параметров, обеспечивается простота, надежность и доступность исследований, а также получение результатов нужной информативности.
Установление содержания химического контаминанта - алюминия, именно в моче обусловлено тем, что моча является средой преимущественной элиминации из организма данного элемента, имеющего реферируемые уровни в данной биологической среде.
Благодаря использованию в качестве исследуемого материала буккального эпителия (пробы биологического материала со слизистой щеки), обеспечивается простота и надежность исследований, а также получение нужной информативности в плане выделения из указанной пробы дезоксирибонуклеиновой кислоты (ДНК) и посредством полимеразной цепной реакции (ПНР) проведения генотипирования полиморфизма указанных генов: гена GRIA1 (rs545098) и гена SLC2A1 (rs841839). При этом устанавливается для каждого гена одно из следующих его состояний: гетерозиготное, или нормальное гомозиготное, или вариантное гомозиготное.
У гена GRIA1 (rs545098) 2 аллеля (1 пара аллелей) G и A (G - дикий или нормальный, А - мутантный или вариантный), причем полиморфные генотипы - GA (гетерозиготный) или АА (вариантный гомозиготный).
У гена SLC2A1 (rs841839) 2 аллеля (1 пара аллелей), Т и G (Т - дикий или нормальный, G - мутантный или вариантный), причем полиморфные генотипы - TG (гетерозиготный) или GG (вариантный гомозиготный).
Таким образом, при оценке влияния алюминия на нарушение состояния вегетативной нервной системы в предлагаемом способе рекомендуется использовать следующие критерии: наличие вариантного гомозиготного или гетерозиготного генотипов гена GPJA1 (rs545098) и наличие вариантного гомозиготного или гетерозиготного генотипов гена SLC2A1 (rs841839), а также превышение концентрации алюминия в моче более, чем в 1,3 раза, по отношению к фоновому уровню.
Именно благодаря расширению информационных показателей, связанных с полиморфными вариантами генов, тропных к вегетативной нервной системе, и одновременно с количеством химического токсиканта - алюминия в моче, и будет обеспечена точность оценки модифицирующего влияния алюминия на возникновение астено-вегетативного синдрома.
Исходя из вышеизложенного, можно сделать вывод, что поставленный технический результат обеспечивается за счет совокупности операций предлагаемого способа, их последовательности и режимов его реализации.
Предлагаемый способ реализуется следующим образом.
1. Выбирают территорию экологического риска, характеризующуюся наличием химических токсикантов, обусловленных экологической средой обитания. Исследования были проведены на территории Иркутской области, характеризующейся наличием предприятия цветной металлургии, выбрасывающего в атмосферный воздух отходы с высоким содержанием алюминия. Качество атмосферного воздуха селитебной застройки, расположенной в зоне влияния алюминиевого производства, характеризуется постоянным присутствием алюминия на уровне 0,1-0,5 ПДКс.с.
2. На указанной территории производят отбор группы детей одной этнической популяции. Затем производят отбор пробы крови у обследуемого ребенка в специальные пробирки с антикоагулянтом ЭДТА (этилендиаминтетрауксусная кислота) (0,05М раствор ЭДТА в соотношении 500 мкл крови на 50 мкл антикоагулянта) - для определения содержания глутамата.
Содержание алюминия в моче определяют по Методике масс-спектрометрии с индуктивно связанной плазмой «Методы контроля. Химические факторы. Определение содержания химических элементов в диагностируемых биосубстратах, препаратах и биологически активных добавках методом масс-спектрометрии с индуктивно связанной аргоновой плазмой», изложенной в МУК 4.1.1483-03, с использованием масс-спектрометра с индуктивно связанной плазмой Agilent 7500сх с октопольной реакционной/столкновительной ячейкой (USA). В качестве референтного значения содержания алюминия в моче был принят показатель равный 0,01 мг/дм3. (верхняя граница референтных пределов 6,5±3,5 мкг/л по Н. Тиц, 2003, с. 21).
Содержание глутамата в крови определяют по методике, изложенной в инструкции «Иммуноферментный набор для количественного in vitro определения глутамата в образцах ЭДТА сыворотки или плазмы крови» («Sigma», США, Кат №К7731). В качестве физиологического диапазона содержания глутамата был принят диапазон равный 83,24-131,24 мкмоль/дм3. (Н. Тиц, 2003).
3. Также у указанного ребенка отбирают пробу буккального эпителия (в виде мазка со слизистой оболочки щеки), причем забор осуществляют сухими стерильными зондами с ватными тампонами вращательными движениями без травматизации после предварительного полоскания полости рта водой. После забора материала тампон (рабочую часть зонда с ватным тампоном) помещают в стерильную пробирку типа «Эппендорф» с 500 мкл транспортной среды (стерильный 0,9%-ный раствор NaCl). Конец зонда отламывают или отрезают, с расчетом, чтобы он позволил плотно закрыть крышку пробирки. Пробирку с раствором и рабочей частью зонда закрывают.
Далее производят выделение ДНК из пробы. Для этого пробы в количестве 100 мкл лизируют 300 мкл лизирующего раствора, представляющего собой 0,5%-ный раствор саркозила и протеиназы К (20 мг/мл) в ацетатном буфере (рН 7,5). Затем добавляют сорбент (каолин) и последовательными процедурами промывки отмывают фосфатно-солевым буфером (рН 7,2) пробы от белков и смесью изопропиловый спирт: ацетон от липидов. Нуклеиновые кислоты остаются при этом на сорбенте. Далее адсорбированные на сорбенте ДНК из пробы экстрагируют ТЕ-буфером, представляющим собой смесь 10 мМ трис-HCl и 1 мМ ЭДТА (рН 8,0). Экстракт подвергают центрифугированию. После центрифугирования пробирки надосадочная жидкость содержит очищенную ДНК.
Полученный материал готов к постановке полимеразной цепной реакции (ПЦР). Полимеразную цепную реакцию проводят на детектирующем амплификаторе с гибридизационно-флуоресцентной детекцией в режиме «реального времени» с использованием готовых наборов праймеров и зондов производства ЗАО «Синтол», Россия, в котором в качестве праймеров использовались участки ДНК: гена GRIA1 (rs545098)H гена SLC2A1 (rs841839).
Проводят реакцию амплификации, это достигается тем, что для исследования аллельного состояния каждого гена у отдельного человека готовят свою реакционную смесь. В каждую пробирку вносят 0,1 мкл готовой смеси праймеров (принятый в генетике термин, обозначающий конечные нуклеотиды с меткой, ограничивающие (отрезающие) амплифицируемую цепочку нуклеотидов гена) и зондов для выбранных генов: гена GRIA1 (rs545098) и гена SLC2A1 (rs841839) (использованы Наборы реагентов для определения полиморфизма G/A гена GRIA1 (rs545098) и полиморфизма T/G гена SLC2A1 (rs841839) ЗАО «Синтол», Россия). В каждую пробирку добавляют остальные компоненты необходимые для осуществления ПЦР: нуклеотиды (дезоксинуклеозидтрифосфаты: по 10 мМ дАТФ, дТТФ, дГТФ, дЦТФ), буфера (100 мМ трис-НС1-буфера, 500 мМ КСl, 40 мМ MgCl2) и Tag F-полимеразы. Вносят пробу в количестве 10 мкл. Таким образом, общий объем реакционной смеси составляет 25 мкл. Каждая пробирка плотно закрывается пробкой и устанавливается в амплификатор.
При проведении ПЦР амплификацию и детекцию проводят на детектирующем амплификаторе CFX96 фирмы Bio-Rad.
Используется универсальная программа амплификации, подобранная производителем реактивов. Она включает в себя несколько этапов: 1 этап -активация TaqF-полимеразы (режим «горячего старта») продолжается 15 мин при 95°С; 2 этап - установочные циклы амплификации без измерения флуоресценции (5 циклов); 3 этап - рабочие циклы амплификации с измерением флюоресценции (40 циклов).
Каждый цикл амплификации включает в себя денатурацию ДНК (5 с при 95°С), отжиг праймеров (20 с при 60°С) и саму реакцию полимеризации ДНК (15 с при 72°С).
Регистрация сигнала флюоресценции, возникающего при накоплении продуктов амплификации участков ДНК проводится в режиме «реального времени» после стадии отжига праймеров для выбранных генов по каналу VIC - для детекции одного из аллельных вариантов генов, и по каналу FAM - для альтернативного варианта.
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на заданном уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла (N) в соответствующей графе в таблице результатов, отображаемой в программном обеспечении для амплификатора CFX96.
По соотношению пороговых циклов, полученных по двум каналам детекции, определяют состояние гена GRIA1 в исследуемом участке ДНК G/A (rs545098), а также гена SLC2A1 в исследуемом участке ДНК T/G (rs841839) (метод аллельной дискриминации). Возможных вариантов состояния гена было два: гомозиготное - в случае, когда одно из значений порогового цикла не определяется (ниже пороговой линии) и гетерозиготное - в случае, когда получено два значения пороговых циклов и по этим каналам получены параболические кривые флюоресценции. В зависимости от того, накопление какого продукта амплификации происходит в реакции, устанавливается гетерозиготное, или нормальное гомозиготное, или вариантное гомозиготное состояние гена GRIA1 (гз545098)и гена SLC2A1 (rs841839).
4. И при одновременном выполнении следующих условий:
- наличие вариантного гомозиготного или гетерозиготного генотипов гена ионотропного рецептора глутамата GRIA1 frs545098) и наличие вариантного гомозиготного или гетерозиготного генотипов гена глиального глутаматного транспортера SLC2A1 (rs841839),
- при превышении концентрации алюминия в моче выше фонового уровня более, чем в 1,3 раза,
диагностируют у ребенка наличие астено-вегетативного синдрома в условиях экспозиции алюминием.
При проведении испытаний по реализации предлагаемого способа выполнено обследование детского населения, проживающего в условиях влияния выбросов отходов комбината цветной металлургии.
Группу наблюдения составили 57 детей, страдающих астено-вегетативным синдромом. Клинические признаки, характеризующие данное состояние: головная боль, головокружение, постоянная усталость, бессонница, слабость, депрессия; усиленное потоотделение, диспепсические явления (тошнота), подавленность, учащенное сердцебиение (Кильдиярова P.P. Нарушения адаптации детей к школе: лечение и профилактика. Пособие для врачей. - М.: ООО «Медицинское информационное агентство», 2016 - 40 с. ISBN 978-5-8948-1974-7).
Группа контроля - 24 ребенка, не имеющие патологии нервной системы.
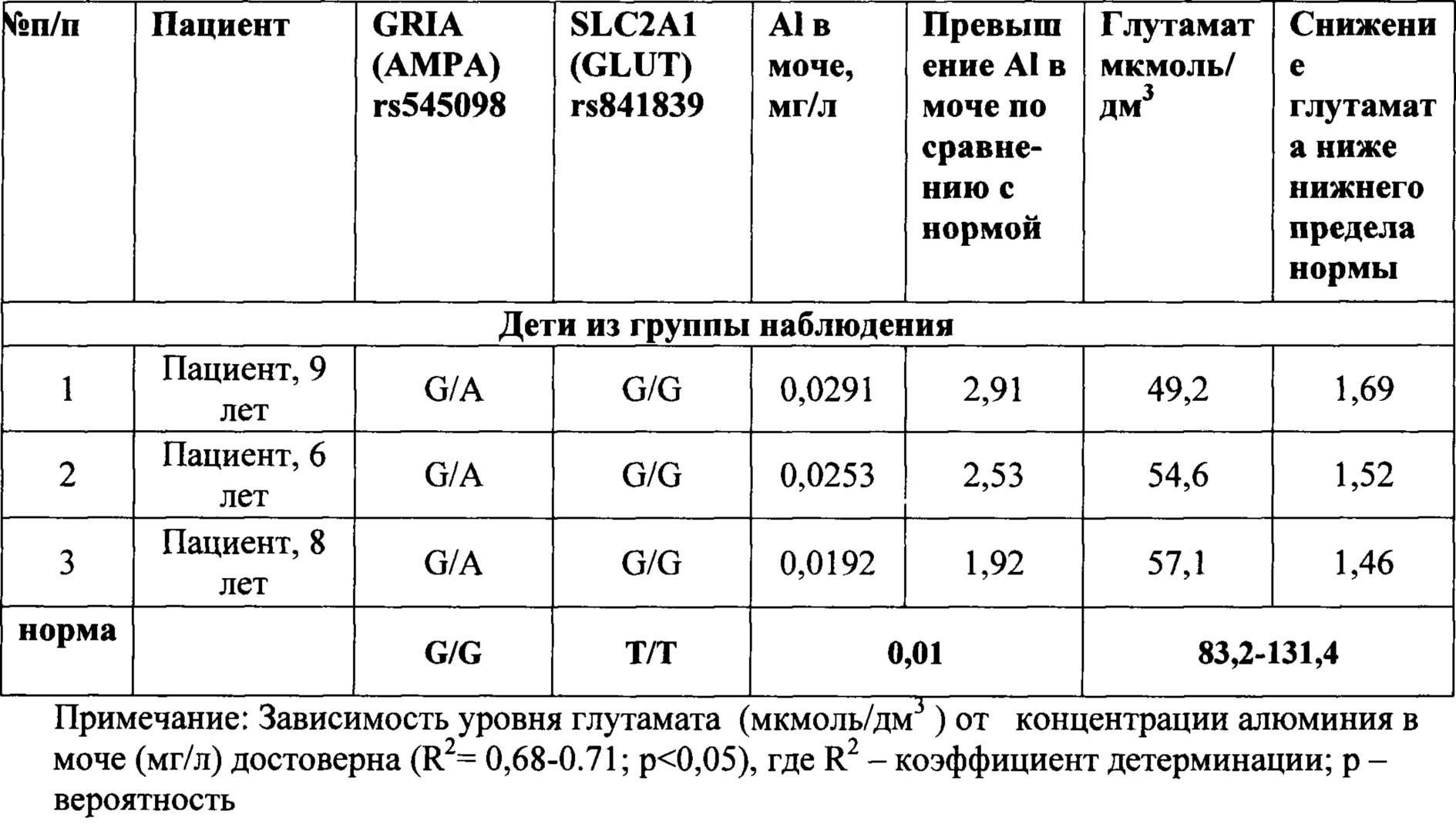
Группа наблюдения и группа контроля были сопоставимы по полу, возрасту, соматической заболеваемости. Результаты обследования детей из указанных групп, приведены в таблице 1.
В качестве маркера, доказывающего, что у ребенка возник астено-вегетативный синдром под влиянием алюминия, использовали уровень глутамата в крови ребенка.
Глутамат, представляет собой основной возбуждающий нейротрансмиттер в нервной системе позвоночных, что подтверждается многочисленными клиническими и экспериментальными данными. Нейромедиаторные свойства глутамата ассоциированы с патологическими состояниями, характеризующими воспалительные процессы в ЦНС, в частности, ишемии головного мозга, рассеянному склерозу, болезни Альцгеймера и другими.
Глутаматергические механизмы передачи представлены примерно в 40% нейронов ЦНС. В реализации действия глутамата участвуют различные классы глутаматных рецепторов, различающихся по своей структуре и функции. В результате глутамат, в дополнение к классической нейротрансмиттерной функции, выступает как регулятор множества процессов, протекающих в нервной системе на разных этапах ее развития, начиная с регуляции пролиферации эмбриональных клеток-предшественников и процессов нейрональной дифференцировки вплоть до формирования различных форм синаптической пластичности, лежащих в основе когнитивных функций. В процессе развития ЦНС стимуляция глутаматных рецепторов модулирует процессы миграции нейронов, обеспечивает их выживаемость и формирование нейрональных сетей.
Подтверждающим фактором эндотелиальных нарушений служит изменение содержания в крови ребенка самого глутамата (истощение, т.е. снижение концентрации глутамата в крови по сравнению с нижней границей нормы), что характеризует возникновение функциональных изменений вегетативной нервной системы и проявление астено-вегетативного синдрома.
Данные, приведенные в таблице 1, показывают, что при сочетании вариантного (гетерозиготное или патологическое гомозиготное состояние генотипа) аллеля гена GRIA1 (rs545098) и вариантного (гетерозиготное или патологическое гомозиготное состояние генотипа) аллеля гена SLC2A1 (rs841839), при одновременном превышении концентрации виновного фактора экспозиции (алюминия) выше референтной концентрации в моче более, чем в 1,3 раза (референтная - 0,01 мг/л), наблюдается понижение содержание глутамата в сыворотке крови у ребенка ниже физиологического уровня (опыты 1-3, 5, 8, 11). То есть при этом фиксируется реализация алюминием негативной генетической программы у ребенка.
Тогда как при допустимом (на уровне фоновой концентрации) содержании алюминия в моче (опыты 12-15), даже в условиях наследования вариантного генотипа предлагаемых генов (опыт 14), указанный показатель глутамата находится в пределах физиологической нормы.
И, наоборот, в случае превышения содержания алюминия в моче по сравнению с референтным уровнем, но при отсутствии полиморфных изменений указанных генов (опыты 6,7,9), содержание глутамата в крови также находится в пределах физиологической нормы.
Кроме того, данные таблицы 1 показывают, что даже в случае превышения содержания алюминия в моче по сравнению с референтным уровнем, но при отсутствии полиморфных изменений только в одном или только в другом указанных генах (опыты 4,10), содержание глутамата в крови также находится в пределах физиологической нормы.
Это указывает на то, что только одновременное превышение содержания алюминия в моче по отношению к референтному уровню, наличие одновременно полиморфных генотипов и у гена GRIA1 (rs545098) и у гена SLC2A1 (rs841839), характеризуется проявлением негативных эффектов в виде отклонения от нормы содержания глутамата в крови, и таким образом подтверждает точность и достоверность предлагаемого способа.
Для иллюстрации реализации предлагаемого способа приведены два примера по конкретным пациентам одного возраста и этнической принадлежности из группы пациентов с повышенным содержанием алюминия в моче и наличием полиморфности генотипа (гетерозиготного и вариантного гомозиготного генотипа) гена GRIA1 (rs545098) и одновременно гена SLC2A1 (rs841839); и из группы пациентов с повышенным содержанием алюминия в моче и отсутствием полиморфности генотипов гена GR1A1 (rs545098) и гена SLC2A1 (rs841839).
Пример 1. Пациент, 7 лет, русский, страдающий астено-невротическим синдромом. Определяется уровень алюминия в моче выше фонового уровня - 0,0204 мг/дм3.
Определено наличие у ребенка вариантного гомозиготного генотипа гена GRIA1 (rs545098) - АА и наличие гетерозиготного генотипа гена SLC2A1 (rs841839) - TG. Содержание глутамата в крови - медиатора нервной регуляции - 64,6 мкмоль/дм3, т.е. ниже нижней границы нормы (83,2-131,4 мкмоль/дм3) в 1,29 раза. Таким образом, установлены низкие содержания глутамата на фоне повышенных по отношению к фоновому уровню значений содержания алюминия в моче, а также наличие вариантного гомозиготного полиморфизма гена GRIA1 (rs545098) и гетерозиготного полиморфизма гена SLC2A1 (rs841839), кодирующих белки, ответственные за глутаматную нервную регуляцию, что указывает на реализацию нарушений нервной регуляции у данного пациента, инициированной действием алюминия.
Пример 2. Пациент, 7 лет, русский, здоров, не имеет патологии нервной системы. Определяется в моче уровень алюминия, который более, чем на 10%, выше фонового уровня - 0,011 мг/дм. Отсутствуют полиморфные (вариантные) аллели гена GRIA1 (rs545098) и гена SLC2A1 (rs841839). Содержание глутамата - нейромедиатора - 86.7 мкмоль/дм, т.е. в диапазоне нормы (83,2-131,4 мкмоль/дм). Таким образом, отсутствии полиморфизма генов GRIA1 (rs545098) и гена SLC2A1 (rs841839) на фоне повышенного по отношению к фоновому уровню содержания алюминия в моче, не приводит к развитию негативных эффектов в виде отклонения от нормы глутамата, то есть в отсутствии негативной генетической программы только лишь превышение референтной концентрации алюминия в моче не формирует развитие нарушений нервной регуляции и не формирует состояние астено-невротического синдрома у данного пациента.
Таким образом, приведенные данные показывают, что при реализации предлагаемого способа с использованием предлагаемых критериев по содержанию алюминия в моче и вариантов гетерозиготного и вариантного гомозиготного генотипов генов GRIA1 (rs545098) и SLC2A1 (rs841839) обеспечивается его назначение.
Таким образом, реализация способа оценки модификации течения астено-вегетативного синдрома в условиях экспозиции алюминием, позволяет предложить систему критериев возникновения и течения данной патологии у детей, включающую: полиморфные изменения генов: гена глутаматного рецептора GRIA (AMPA) rs545098 и гена переносчика глюкозы (глутаматного транспортера) SLC2A1(GLUT) rs841839; и повышение содержания алюминия в моче по сравнению с референтным уровнем в 1,3 раза, которые в совокупности позволяют определить состояние неврологического процесса, наличие интоксикации и оптимизировать мероприятия по коррекции данного состояния.
Предлагаемый способ идентификации нарушения состояния здоровья у детей, характеризующееся развитием астено-вегетативного синдрома в условиях экспозиции алюминием, позволяет установить наличие ранних проявлений нарушений нервной регуляции.
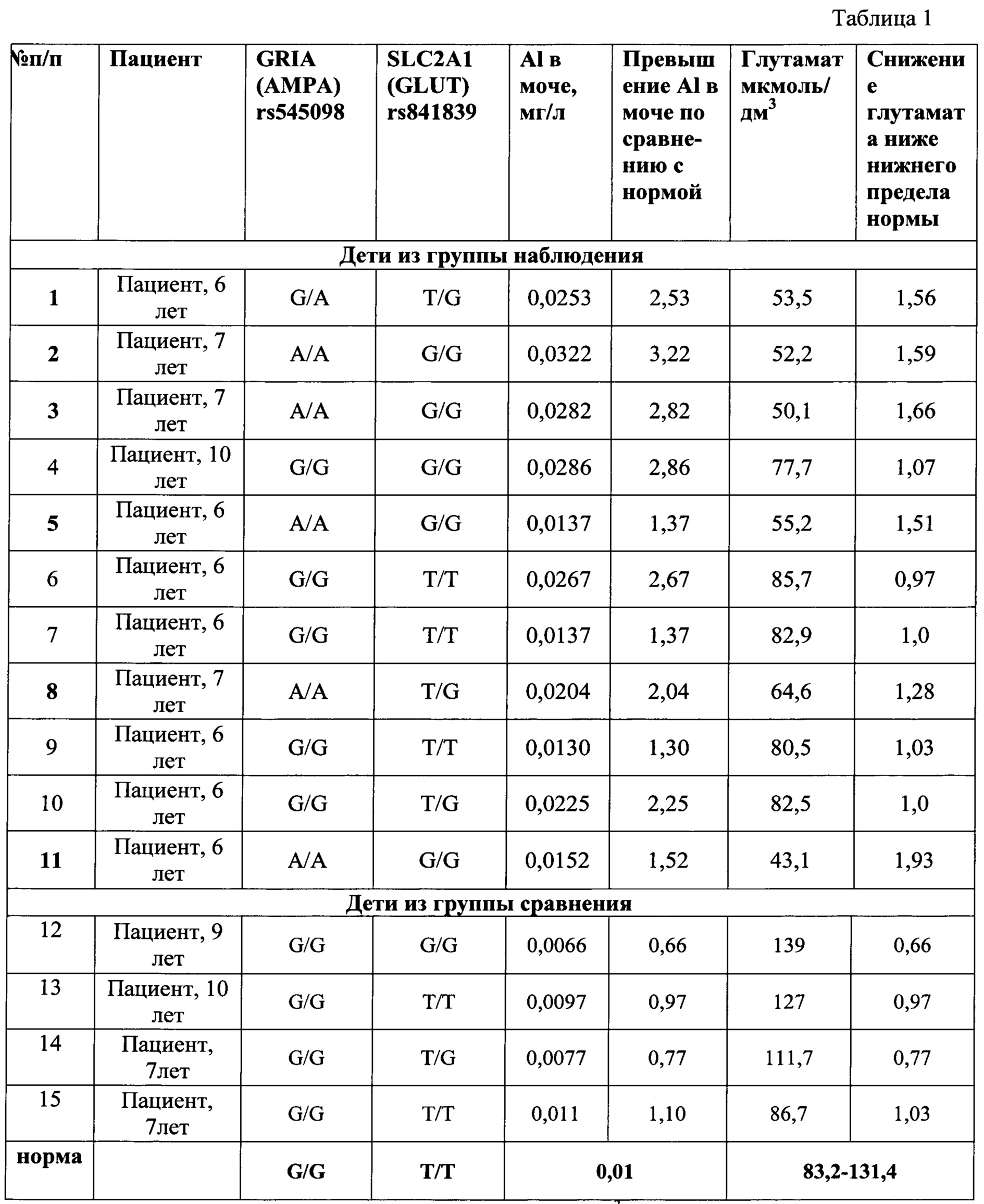
Примечание: Зависимость уровня глутамата (мкмоль/дм3) от концентрации алюминия в моче (мг/л) достоверна (R2=0,64-0.82; р<0,05), где R2 - коэффициент детерминации; р – вероятность