Результат интеллектуальной деятельности: Способ коррекции стрептозотоцин-индуцированного сахарного диабета у крыс с использованием лекарственного средства на основе амида гетероциклических кислот
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к экспериментальной фармакологии.
По известным литературным источникам – сахарный диабет (СД) является одной из актуальных медико-социальных проблем современного общества. Рост заболеваемости позволил говорить о глобальной эпидемии СД [Javeed N, Matveyenko AV. Circadian Etiology of Type 2 Diabetes Mellitus. Physiology (Bethesda). 2018;33(2):138-150. DOI: 10.1152/physiol.00003.2018; Schmidt AM. Highlighting Diabetes Mellitus: The Epidemic Continues. Arterioscler Thromb Vasc Biol. 2018;38(1):e1-e8. DOI: 10.1161/ATVBAHA.117.310221]. Широкая распространенность СД и многообразие патогенетических вариантов данного заболевания обусловливают актуальность поиска и разработки новых пероральных противодиабетических препаратов.
Известны химические вещества органической природы, потенцирующие имидазолиновые рецепторы и повышающие чувствительность к инсулину [Su CH, Liu IM, Chung HH, Cheng JT. Activation of I2-imidazoline receptors by agmatine improved insulin sensitivity through two mechanisms in type-2 diabetic rats. Neurosci Lett. 2009;457(3):125-128] и восстанавливающие инсулинпродуцирующую функцию [Efendic S, Efanov AM, Berggren PO, Zaitsev SV. Two generations of insulinotropic imidazoline compounds. Diabetes. 2002;51 Suppl 3:S448-454].
В патенте AU 2004/200272 раскрываются соединения общей формулы 1, 2 и 3 с бис-арильным молекулярным каркасом, к которому ковалентно присоединены амидиновые функциональные группы, для которых постулируется способность связываться с имидазолиновыми рецепторами I и II типов in vitro и in vivo. Указанные соединения, в частности с общей структурной формулой 1, являются структурными аналогами пентамидина (1, R1=R2=R3=H; n=5), антимикробного лекарственного препарата.
Патент US 6,057,317 указывает на возможность применения соединений общей формулы 4 при гипертонических состояниях, вызванных различными патологиями, в том числе диабетом и ожирением. Для соединений 4 методом вытеснения тритий-меченных лигандов установлено связывание с имидазолиновыми рецепторами I и II типов в наномолярном диапазоне концентраций.
В патенте US 2011/0118289 методом конкурентного связывания с радиоактивно-меченным лигандом установлено взаимодействие соединений общей формулы 6 с имидазолиновыми рецепторами II типа. Для соединений 6 на животных моделях показаны антидепрессантная и противоболевая активности. Эти же соединения и указанная для них активность запатентованы в РФ (патент RU № 2472508).
В патенте WO 2016/105449 широкий круг лигандов имидазолиновых рецепторов I типа заявляется в качестве анальгетиков при болевых синдромах различной этиологии. Большая часть применяемых соединений относится к имидазолинам различного строения, в том числе к известным из научных информационных источников агонистам имидазолиновых рецепторов I и II типов.
Однако в приведенных патентных источниках нет данных об использовании агонистов имидазолиновых рецепторов I и II типов для лечения СД 2 типа, относящихся по химической структуре к амидам гетероциклических кислот.
Известно соединение (±)-цис-3-(2'-бензимидазолил)-1,2,2-триметилциклопентанкарбоновая кислота, проявляющая сахароснижающее и антидиабетогенное действие (RU № 2205826, опубл. 10.06.2003). Данное соединение проявляет высокую сахароснижающую и антидиабетогенную активность и может быть использовано как сахароснижающее средство при манифестных формах СД 1 и 2 типа, а также как антидиабетогенное средство, которое предупреждает и/или ослабляет развитие инсулиновой недостаточности на ранних стадиях заболевания.
Действующим веществом препарата Диакамф (Diacamph) является (±)-цис-3-(2'-бензимидазолил)-1,2,2-триметилциклопентанкарбоновая кислота (http://nuph.edu.ua/ru/diakamf-3/). Это оригинальное антидиабетическое средство для лечения патологических состояний, связанных с инсулинорезистентностью (СД и его сосудистые осложнения и др.). Относится к агонистам I типа (центральных) и II типа (периферических) имидазолиновых рецепторов.
Недостатком данного решения является низкая терапевтическая эффективность препарата.
Задачей предлагаемого изобретения является создание более эффективного способа коррекции стрептозотоцин-индуцированного СД у крыс с использованием лекарственного средства на основе амида гетероциклических кислот.
Техническим результатом предлагаемого изобретения является эффективный способ коррекции стрептозотоцин-индуцированного СД у крыс с использованием лекарственного средства на основе амида гетероциклических кислот, подтверждаемый более выраженным снижением концентрации глюкозы в крови крыс по сравнению с терапией диакамфом и статистически значимым улучшением показателей морфометрического и иммуногистохимического исследования поджелудочной железы, превосходящим значения в группе с терапией диакамфом.
Поставленная задача достигается тем, что предложен способ коррекции стрептозотоцин-индуцированного сахарного диабета у крыс с использованием лекарственного средства на основе амида гетероциклических кислот, включающий моделирование экспериментального сахарного диабета типа 2 путем внутрибрюшинного однократного введения стрептозотоцина в дозе 65 мг/кг с предварительным, за 15 мин, однократным внутрибрюшинным введением никотинамида в дозе 230 мг/кг, затем коррекцию патологии путем внутрижелудочного введения крысам препарата BSD24 в дозе 8,6 мг/кг, начиная с 7 дня по 21 день включительно после введения стрептозотоцина.
Основным преимуществом предлагаемого способа является то, что введение лекарственного средства на основе амида гетероциклических кислот под лабораторным шифром BSD24 в дозе 8,6 мг/кг приводит к более выраженному снижению концентрации глюкозы в крови крыс на 7-е и 21-е сутки после введения стрептозотоцина по сравнению с терапией диакамфом в дозе 8,6 мг/кг (р<0,05). Также установлено, что при внутрижелудочном введении BSD24 в дозе 8,6 мг/кг выявлено статистически значимое улучшение показателей морфометрического и иммуногистохимического исследования поджелудочной железы, превосходящее значения в группе с терапией диакамфом в дозе 8,6 мг/кг.
В связи с вышесказанным следует отметить актуальность исследования нового лекарственного средства на основе амида гетероциклических кислот под лабораторным шифром BSD24 (табл. 1, 2), а именно амида 4-(4,5-дигидро-1H-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоновой кислоты, С15Н20N4O, для коррекции стрептозотоцин-индуцированного СД в эксперименте, являющегося агонистом имидазолиновых рецепторов I и II типа.
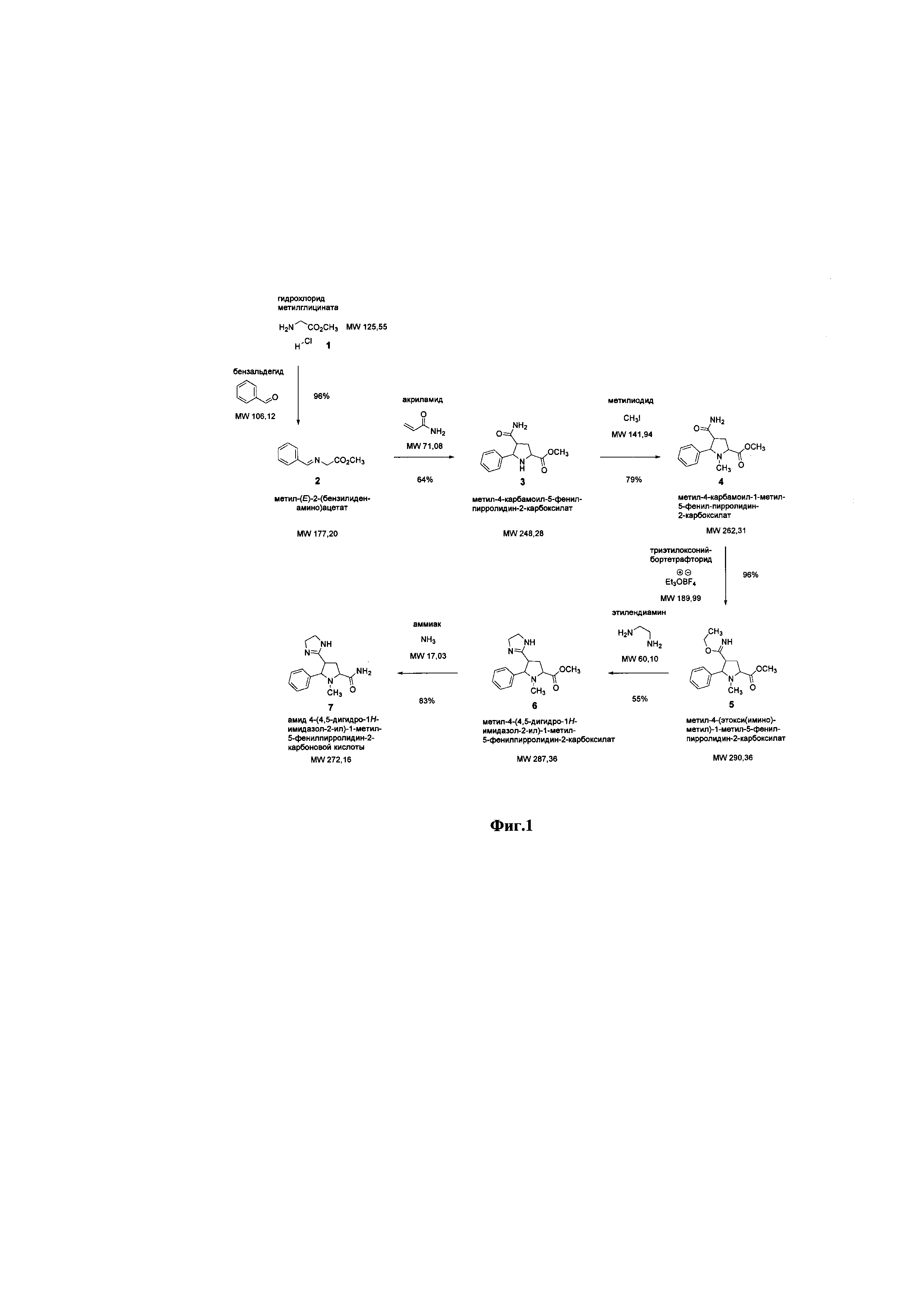
Способ получения амида 4-(4,5-дигидро-1H-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоновой кислоты.
Химическая схема синтеза амида 4-(4,5-дигидро-1H-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоновой кислоты представлена на схеме 1 (Фиг.1).
Лабораторная технология производства фармацевтической субстанции: в технологический прибор, состоящий из трёхгорлой колбы объёмом 3000 мл, термометра, капельной воронки, магнитного якоря и коаксиально размещённой магнитной мешалкой последовательно при перемешивании загружают сухой дихлорметан, гидрохлорид метилглицината, безводный сульфат магния. При перемешивании добавляют по каплям через капельную воронку триэтиламин, не допуская увеличения температуры реакционной смеси выше +20 °С. При перемешивании добавляют по каплям через капельную воронку бензальдегид. Перемешивают реакционную смесь в течение 24 ч. Добавляют 500 мл воды, отделяют органическую фазу. Органическую фазу промывают насыщенным раствором гидрокарбоната натрия, водой, насыщенным раствором хлорида натрия. Высушивают органическую фазу сульфатом натрия и концентрируют в вакууме на ротационном испарителе. Получают метил-(Е)-2-(бензилиденамино)ацетат.
Далее в технологический прибор, состоящий из трёхгорлой колбы объёмом 2000 мл, термометра, капельной воронки, магнитного якоря и коаксиально размещённой магнитной мешалкой последовательно при перемешивании загружают тетрагидрофуран, метил-4-карбамоил-5-фенилпирролидин-2-карбоксилат из ТП-1, охлаждают до минус 5 °С. При перемешивании добавляют по каплям через капельную воронку раствор бромида лития в тетрагидрофуране, не допуская превышения температуры реакционной смеси выше +5 °С. При перемешивании добавляют по каплям через капельную воронку в реакционную смесь триэтиламин, не допуская превышения температуры реакционной смеси выше +10 °С. Перемешивают реакционную смесь в течение 24 ч. Промывают реакционную смесь насыщенным раствором хлорида аммония. Экстрагируют реакционную смесь трижды диэтиловым эфиром. Высушивают органическую фазу сульфатом натрия и концентрируют в вакууме на ротационном испарителе. Остаток хроматографируют на силикагеле в системе петролейный эфир-этилацетат (2:1). Получают метил-4-карбамоил-5-фенилпирролидин-2-карбоксилат.
На следующем этапе в технологический прибор, состоящий из трёхгорлой колбы объёмом 2000 мл, термометра, капельной воронки, магнитного якоря и коаксиально размещённой магнитной мешалкой последовательно при перемешивании загружают сухой диметилформамид, карбонат калия, метил-4-карбамоил-5-фенилпирролидин-2-карбоксилат из ТП-2. При перемешивании добавляют по каплям через капельную воронку метилйодид, не допуская увеличения температуры реакционной смеси выше +20°С. Перемешивают реакционную смесь в течение 48 ч. Полученную суспензию фильтруют, фильтрат концентрируют в вакууме на ротационном испарителе. Остаток хроматографируют на силикагеле в системе петролейный эфир-этилацетат (5:1). Получают метил-4-карбамоил-1-метил-5-фенилпирролидин-2-карбоксилат.
Далее в технологический прибор, состоящий из трёхгорлой колбы объёмом 1000 мл, термометра, капельной воронки, магнитного якоря и коаксиально размещённой магнитной мешалкой последовательно при перемешивании загружают этиловый спирт, метил-4-(этокси(имино)метил)-1-метил-5-фенилпирролидин-2-карбоксилат из ТП-4. При перемешивании добавляют по каплям через капельную воронку этилендиамин, не допуская превышения температуры реакционной смеси выше +25°С. Перемешивают реакционную смесь в течение 48 ч. Добавляют в реакционную смесь насыщенный раствор хлорида аммония. Экстрагируют реакционную смесь трижды диэтиловым эфиром. Высушивают органическую фазу сульфатом натрия и концентрируют в вакууме на ротационном испарителе. Остаток хроматографируют на силикагеле в системе петролейный эфир-этилацетат-триэтиламин (2:1:0.01). Получают метил-4-(4,5-дигидро-1Н-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоксилат.
На конечном этапе в технологический прибор, состоящий из трёхгорлой колбы объёмом 2000 мл, термометра, капельной воронки, магнитного якоря и коаксиально размещённой магнитной мешалкой последовательно при перемешивании загружают метиловый спирт, метил-4-(4,5-дигидро-1Н-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоксилат из ТП-5. При перемешивании пропускают газообразный аммиак из баллона, не допуская превышения температуры реакционной смеси выше +25°С, в течение 12 часов. Перемешивают реакционную смесь в течение 48 ч. В течение 2 часов пропускают в реакционную смесь аргон из баллона. Концентрируют реакционную смесь в вакууме на ротационном испарителе. Остаток хроматографируют на силикагеле в системе петролейный эфир-этилацетат-триэтиламин (3:1:0.01). Получают амид 4-(4,5-дигидро-1Н-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоновой кислоты.
Субстанция представляет собой кристаллический порошок белого или почти белого цвета. Испытание проводят визуально в соответствии ГФ XIII, ОФС.1.1.0006.15.
Порошок практически нерастворим в воде, растворим в метаноле, тетрагидрофуране (ГФ XIII ОФС.1.2.1.0005.15). Раствор 0,75 г субстанции в 25 мл тетрагидрофурана должен быть прозрачным или выдерживать сравнение с эталоном I. (ГФ XIII ОФС.1.2.1.0007.15).
Подлинность – ВЭЖХ: Время удерживания основного пика на хроматограмме испытуемого раствора, полученной при количественном определении, должно соответствовать времени удерживания основного пика на хроматограмме раствора стандартного образца амида 4-(4,5-дигидро-1H-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоновой кислоты.
Таблица 1
СПЕЦИФИКАЦИЯ
Таблетки BSD24, покрытые пленочной оболочкой, 50 мг
ООО «НЦ Белфарма», Российская Федерация
|
Таблица 2
Состав на одну таблетку
|
СПОСОБ ОСУЩЕСТВЛЯЕТСЯ СЛЕДУЮЩИМ ОБРАЗОМ
Исследование выполнено на 40 крысах линии Wistar массой 200±20 г. Негенетическая форма экспериментального СД типа 2 воспроизводилась по методике Islam S., Choi H. (2007). СД моделируется стрептозотоцином («Sigma», США) (внутрибрюшинно – 65 мг/кг) с предварительным (за 15 мин) введением никотинамида (внутрибрюшинно – 230 мг/кг). Количественное определение глюкозы в крови и в моче проводилось на 3, 7, 21 сутки после введения стрептозотоцина.
На 22-е сутки после введения стрептозотоцина животных выводили из эксперимента путем передозировки этилового эфира. Фиксацию ткани поджелудочной железы, почек и печени осуществляли в 10% растворе нейтрального забуференного формалина в течение 24 ч. Срезы для стандартного гистологического исследования окрашивали гематоксилином и эозином, а также по Ван Гизон и Маллори с использованием стандартных наборов.
После обзорного гистологического исследования в каждом блоке выбирали стандартные репрезентативные участки площадью 5х5 мм2, которые вырезали и перезаливали в тканевые мультиблоки по 10-15 кусочков из разных групп эксперимента. С полученных стандартных мультиблоков изготавливали срезы толщиной 4 мкм для иммуногистохимического исследования. Таким образом, на одном стекле одновременно выполняли иммуногистохимические реакции на 10-15 образцах в идентичных условиях. Демаскировку антигенов выполняли по стандартному протоколу высокотемпературной демаскировки в цитратном буфере с рН=7,0 или трис-ЭДТА буфере с рН=9,0 в зависимости от протокола исследования (табл. 3). Для выявления реакции применяются полимерные системы детекции Ultra Vision (ThermoScientific, Великобритания) и Histofine (Nichirei Biosciences, Япония) с хромогеном – диаминобензидином. Характеристики использованных антител в соответствии с задачами исследования и особенности протоколов представлены в таблице 3.
Иммуногистохимическое исследование выполнено в лаборатории научно-образовательного центра «Прикладной иммуноморфологии и цитогенетики» НИУ БелГУ. Для типирования А- и В-клеток островков использовали первичные антитела к инсулину и глюкагону, для изучения апоптоза и пролиферативной активности - первичные антитела к про- и антиапоптогенным белкам.
Таблица 3
Маркировка антител для проведения исследования фармакологической активности препарата BSD24
|
Основная часть морфологического исследования выполнена после создания электронной галереи изображений с помощью полуавтоматического сканера микропрепаратов Mirax Desk (Carl Zeiss Microimaging GMbH, Германия), что позволило полностью стандартизовать режимы морфометрии исследования. На компьютерных изображениях микропрепаратов определяли характер распределения иммуногистохимических реакций, определяли процентное соотношение площади, занимаемой в-инсулоцитами, к общей площади островка, которая составляет 100%, объемную долю (ОД, %) островков по отношению к экзокринной части железы, площадь островков (мкм2), а также размеры ядер инсулоцитов (мкм2) и их количество (% от общего количества клеток панкреатических островков).
С помощью программы для просмотра сканированных изображений «Panno-ramicViewer 1.15» производились линейные измерения. Определение площадей иммунореактивного вещества проводили с использованием программы для анализа изображений WCIF ImageJ (США) после преобразования изображений с выделением зон реакций по типу «компьютерного скелетирования».
Количественные данные регистрировали в электронных таблицах MS Excel, средствами которой проведена статистическая обработка после определения характера распределения признаков с применением параметрических (критерий t Стьюдента) и непараметрических (критерий Пирсона – χ2 и Фишера), критериев сравнения средних.
Животных разделяли на 4 группы:
1 группа (10 животных) – интактные животные;
2 группа (10 животных) – стрептозотоцин (внутрибрюшинно – 65 мг/кг) + никотинамид (внутрибрюшинно – 230 мг/кг);
3 группа (10 животных) – животным, начиная с 7 дня по 21 день включительно после введения стрептозотоцина, вводили внутрижелудочно исследуемый препарат BSD24 в дозе 8,6 мг/кг;
4 группа (10 животных) – животным, начиная с 7 дня по 21 день включительно после введения стрептозотоцина, вводили внутрижелудочно препарат диакамф в дозе 8,6 мг/кг.
ПРИМЕР КОНКРЕТНОГО ВЫПОЛНЕНИЯ
Уровень глюкозы в крови у крыс с моделированием СД на 3 день после введения стрептозотоцина и никотинамида как без терапии, так и с введением препаратов BSD24 и диакамфа достоверно превосходил таковой у интактных животных (табл. 5). В течение последующих дней наблюдений количество сахара в крови крыс достигало максимума в группе с моделью СД на 7 сутки и далее после введения стрептозотоцина. В группе животных, получавших BSD24 в дозе 8,6 мг/кг уровень сахара в крови достоверно не отличался от интактных животных (табл. 6, 7).
Таблица 4
Концентрация глюкозы в крови экспериментальных животных (n=10, ммоль/л). Исходные значения.
|
Примечание: здесь и везде далее * при р<0,05 по сравнению с интактными; ** при р<0,05 по сравнению с группой контроля
Таблица 5
Концентрация глюкозы в крови экспериментальных животных (n=10, ммоль/л). 3 день после введения стрептозотоцина.
|
Таблица 6
Концентрация глюкозы в крови экспериментальных животных (n=10, ммоль/л). 7 день после введения стрептозотоцина.
|
Таблица 7
Концентрация глюкозы в крови экспериментальных животных (n=10, ммоль/л). 21 день после введения стрептозотоцина.
|
При стрептозотоцин-индуцированном СД в поджелудочной железе отмечаются выраженные деструктивные и воспалительные изменения островков Лангерганса, что сопровождается статистически достоверным уменьшением их размера, объемной доли, а также количества и площади инсулин-позитивных клеток. У неповрежденных в-эндокриноцитов определяется выраженная гипертрофия ядер (табл. 8)
Таблица 8
Данные морфологического и иммуногистохимического исследования в группах экспериментальных животных (n=10)
|
При внутрижелудочном введении таблеток, покрытых пленочной оболочкой, содержащих 50 мг BSD24 в дозе 8,6 мг/кг установлено статистически значимое улучшение показателей морфометрического и иммуногистохимического исследования поджелудочной железы и исследуемые показатели статистически значимо не отличались от таковых в интактной группе животных (табл. 8).
Установлено, что лекарственное средство на основе амида 4-(4,5-дигидро-1H-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоновой кислоты под лабораторным шифром BSD24 в дозе 8,6 мг/кг обладает более выраженной терапевтической эффективностью на модели стрептозотоцин-индуцированного сахарного диабета у крыс по сравнению с препаратом диакамф в дозе 8,6 мг/кг. Это выражается в более выраженном снижении концентрации глюкозы в крови крыс на 7-е (на 23%) и 21-е (на 13%) сутки после введения стрептозотоцина по сравнению с терапией диакамфом (р<0,05). Также выявлено статистически значимое улучшение показателей морфометрического и иммуногистохимического исследования поджелудочной железы в группе с коррекцией BSD24, превосходящее значения в группе с терапией диакамфом.
Способ коррекции стрептозотоцин-индуцированного сахарного диабета у крыс с использованием лекарственного средства на основе амида гетероциклических кислот, включающий моделирование экспериментального сахарного диабета типа 2 путем внутрибрюшинного однократного введения стрептозотоцина в дозе 65 мг/кг с предварительным, за 15 мин, однократным внутрибрюшинным введением никотинамида в дозе 230 мг/кг, затем проводят коррекцию патологии путем внутрижелудочного введения амида 4-(4,5-дигидро-1Н-имидазол-2-ил)-1-метил-5-фенилпирролидин-2-карбоновой кислоты в дозе 8,6 мг/кг, начиная с 7 дня по 21 день включительно после введения стрептозотоцина.