Результат интеллектуальной деятельности: НОВЫЕ КРИСТАЛЛЫ УРАЦИЛЬНОГО СОЕДИНЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится настоящее изобретение
[0001]
Настоящее изобретение относится к новым кристаллам урацильного соединения. Более конкретно, настоящее изобретение относится к новым кристаллам урацильного соединения, которые можно стабильно поставлять высоковоспроизводимым способом в качестве кристаллов лекарственного вещества для применения в получении лекарственного средства и которые имеют превосходную всасываемость, и фармацевтической композиции, которая содержит их в качестве активного ингредиента и является пригодной в качестве усилителя противоракового эффекта.
Уровень техники настоящего изобретения
[0002]
Обычно, в случае применения в качестве активного ингредиента фармацевтического продукта, требуется получать одну кристаллическую форму, обладающую определенными свойствами, стабильно получаемую высоковоспроизводимым способом. Также предпочтительно, чтобы полученная в результате одна кристаллическая форма обладала превосходной всасываемостью.
[0003]
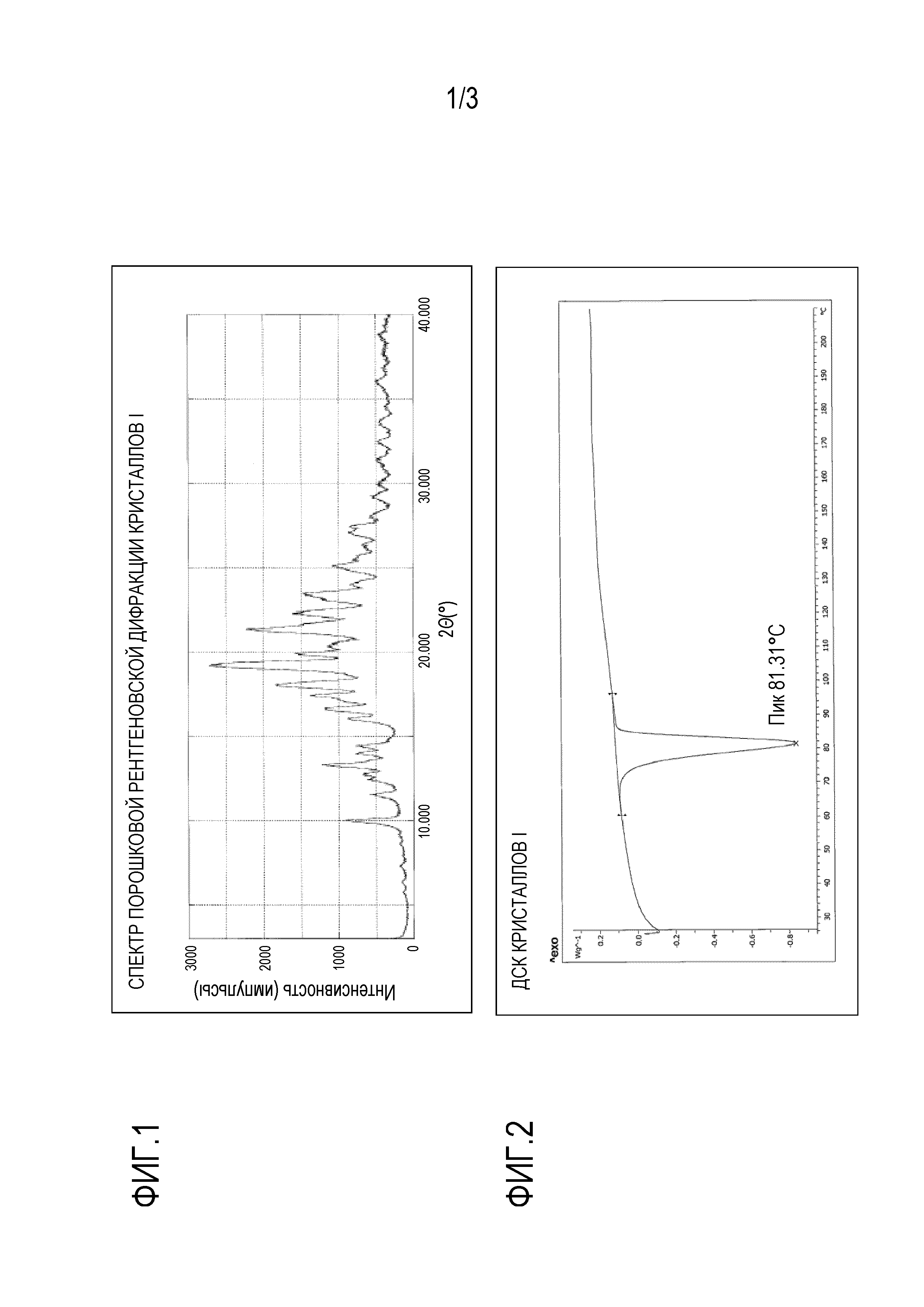
При этом (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфаниламид (называемый далее в настоящем изобретении "соединением (1)"), представленный формулой (1) ниже:
[0004]
[0005]
описан в патентном документе 1 в качестве соединения, обладающего активностью, ингибирующей дезоксиуридинтрифосфат. Более того, патентный документ 2 описывает, что соединение (1) выше потенцирует противоопухолевые эффекты противораковых агентов и проходит в настоящее время клинические исследования.
Что касается способа получения соединения (1), полученный в результате продукт реакции очищали колоночной хроматографией на силикагеле, и полученная в результате форма представляла собой пену (аморфную).
Следовательно, кристаллическая форма соединения (1), которая является предпочтительной в качестве кристаллов лекарственного вещества для применения в получении фармацевтического продукта, является совершенно неизвестной.
Список цитируемой литературы
Патентный документ
[0006]
Патентный документ 1:
Международная публикация No. WO 2009/147843
Патентный документ 2:
Международная публикация No. WO 2011/065541
Сущность настоящего изобретения
Проблемы, которые будет решать настоящее изобретение
[0007]
Цель настоящего изобретения заключается в обеспечении кристаллов соединения (1), пригодного в качестве, например, усилителя противоракового эффекта, которые обладают превосходной всасываемость и стабильностью при хранении в качестве лекарственного вещества для применения в получении фармацевтического продукта, и которые можно получить предпочтительно высоковоспроизводимым способом.
Способы решения проблем
[0008]
Изобретатели настоящего изобретения провели тщательное исследование для решения проблем выше и получили новые кристаллы I добавлением этилацетата/трет-бутилметилового эфира к неочищенному продукту соединения (1). Кроме того, изобретатели настоящего изобретения смогли получить новые кристаллы II перекристаллизацией соединения (1) при комнатной температуре или большей температуре, применяя стандартный органический растворитель, такой как эфирный или кетоновый растворитель. Конкретно, изобретатели настоящего изобретения обнаружили настоящие новые кристаллы I и II, обладающие превосходной всасываемостью и стабильностью при хранении, обнаружили, что в частности кристаллы II представляют собой кристаллы, которые можно получить высоковоспроизводимым способом, и завершили настоящее изобретение.
[0009]
Более конкретно, настоящее изобретение обеспечивает [1]-[10] ниже.
[0010]
[1] Кристаллы (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфаниламида.
[2] Кристаллы по [1] выше, которые представляют собой кристаллы, имеющие, по меньшей мере, два или более дифракционных (2θ±0,2°) пика, выбранных из 7,3°, 11,8°, 14,5°, 14,8°, 16,8°, 17,5°, 18,6°, 19,5°, 20,4°, 23,9°, 24,4°, 25,7°, 26,8° и 31,5° на спектре порошковой рентгеновской дифракции.
[3] Кристаллы по [1] или [2] выше, которые представляют собой кристаллы, имеющие, по меньшей мере, пять или более дифракционных (2θ±0,2°) пиков, выбранных из 7,3°, 11,8°, 14,5°, 14,8°, 16,8°, 17,5°, 18,6°, 19,5°, 20,4°, 23,9°, 24,4°, 25,7°, 26,8° и 31,5° на спектре порошковой рентгеновской дифракции.
[4] Кристаллы по любому из [1]-[3] выше, имеющие эндотермический пик при 108°C±5°C при дифференциальной сканирующей калориметрии.
[5] Кристаллы по любому из [1]-[4] выше, имеющие кристаллические данные ниже, полученные анализом монокристалла кристаллов:
Кристаллическая система: ромбическая система
Пространственная группа: P212121 (No. 19)
Постоянная решетки: a=9,3998(5) Å
b=10,3585(5) Å
c=23,5111(10) Å
объем элементарной ячейки: 2289,22(19) Å3
Z величина: 4.
[6] Фармацевтическая композиция, содержащая кристаллы по любому из [1]-[5] выше.
[7] Фармацевтическая композиция для перорального введения, содержащая кристаллы по любому из [1]-[5] выше.
[8] Применение кристаллов по любому из [1]-[5] выше для получения фармацевтической композиции.
[9] Применение по [8], где фармацевтическая композиция представляет собой фармацевтическую композицию для перорального введения.
[10] Кристаллы по любому из [1]-[5] выше для применения в качестве лекарственного средства.
Полезный эффект настоящего изобретения
[0011]
Согласно настоящему изобретению, новые кристаллы соединения (1), обладающие превосходной всасываемостью и стабильностью при хранении, можно получить высоковоспроизводимым способом, и их можно применять в качестве лекарственного вещества для применения в получении лекарственного средства.
Краткое описание чертежей
[0012]
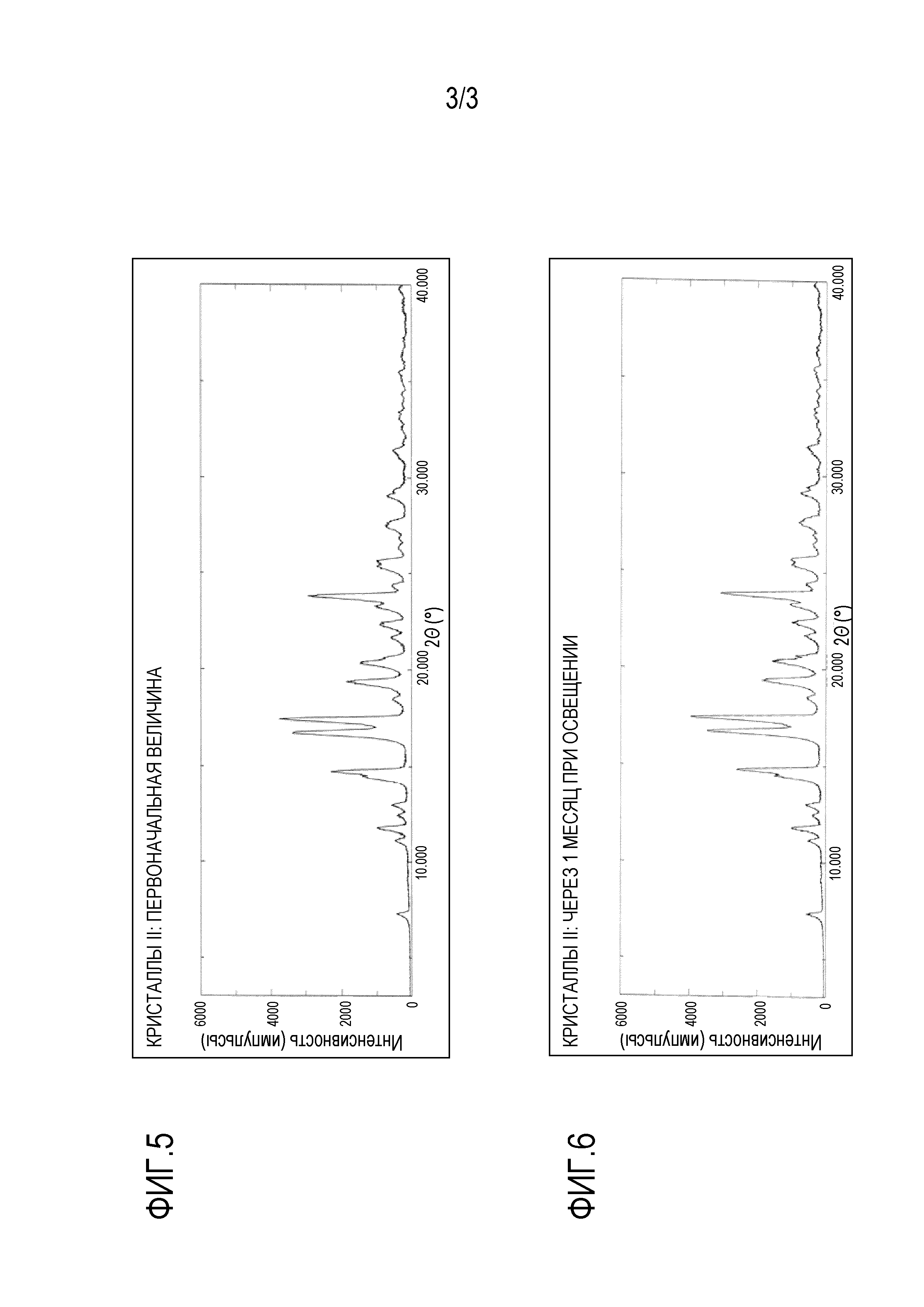
Фигура 1 показывает спектр порошковой рентгеновской дифракции кристаллов I (причем вертикальная ось показывает интенсивность (импульсы), и горизонтальная ось показывает угол дифракции (2θ±0,2°)).
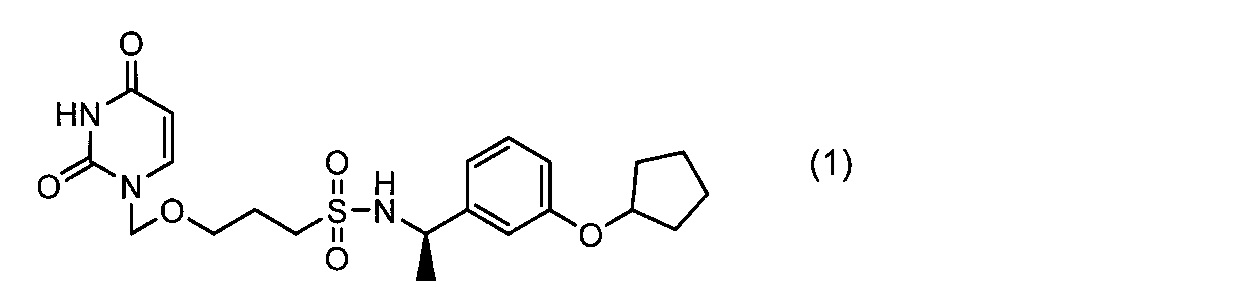
Фигура 2 показывает кривую дифференциальной сканирующей калориметрии (ДСК) кристаллов I.
Фигура 3 показывает спектр порошковой рентгеновской дифракции кристаллов II (причем вертикальная ось показывает интенсивность (импульсы), и горизонтальная ось показывает угол дифракции (2θ±0,2°)).
Фигура 4 показывает кривую дифференциальной сканирующей калориметрии (ДСК) кристаллов II.
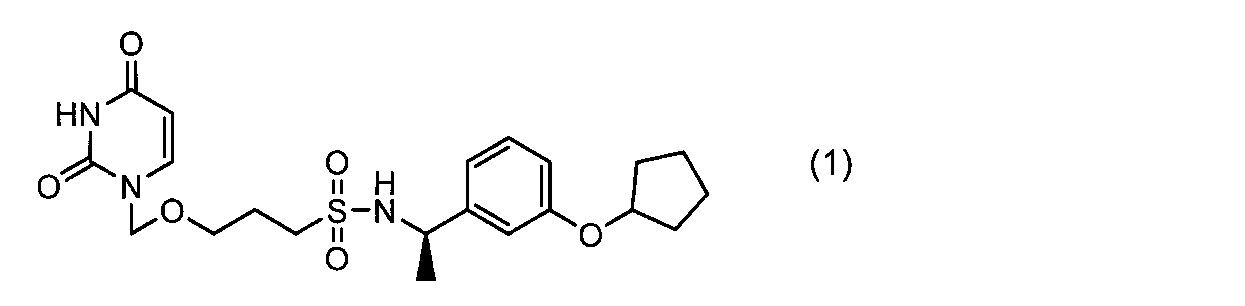
Фигура 5 показывает спектр порошковой рентгеновской дифракции кристаллов II перед испытанием на стабильность в твердом состоянии (при освещении) (причем вертикальная ось показывает интенсивность (импульсы), и горизонтальная ось показывает угол дифракции (2θ±0,2°)).
Фигура 6 показывает спектр порошковой рентгеновской дифракции кристаллов II после испытания на стабильность в твердом состоянии (при освещении) (причем вертикальная ось показывает интенсивность (импульсы), и горизонтальная ось показывает угол дифракции (2θ±0,2°)).
Подробное описание настоящего изобретения
[0013]
Настоящее изобретение будет описано более подробно ниже.
[0014]
Настоящее изобретение относится к кристаллам соединения (1). В настоящем изобретении имеются две кристаллические формы соединения (1), т.е., кристаллы I и кристаллы II. Тогда как обе формы обладают превосходной пероральной всасываемостью и стабильностью, кристаллы II среди них являются более предпочтительными также с точки зрения воспроизводимости при получении кристаллов.
[0015]
Как применяют в настоящем изобретении, термин "кристаллы" применяют в обычном смысле, и он обозначает твердое вещество, имеющее регулярное расположение атомов в пространстве. Является ли твердое вещество кристаллами или нет, можно установить спектром дифракции рентгеновских лучей.
[0016]
Что касается дифрактограммы рентгеновских лучей, углы дифракции и общая рентгенограмма являются важными при установлении идентичности кристаллов в связи с характером данных. Относительная интенсивность порошковой дифрактограммы рентгеновских лучей может изменяться в некоторой степени, в зависимости от направления роста кристаллов, размера частиц и условий измерения и, следовательно, не следует понимать ее в строгом смысле.
Могут возникать некоторые вариации в цифровых величинах, полученных из различных дифрактограмм, в зависимости от, например, направления роста кристаллов, размера частиц и условий измерения. Соответственно, как применяют в настоящем изобретении, термин угол дифракции (2θ±0,2°) на порошковой дифрактограмме рентгеновских лучей обозначает то, что он может быть в пределах диапазона±0,2° данной величины.
[0017]
Кристаллы соединения (1) настоящего изобретения можно получить кристаллизацией соединения (1) в аморфной форме, или кристаллизацией или перекристаллизацией продукта реакции после получения соединения (1).
[0018]
Соединение (1), применяемое в способе кристаллизации настоящего изобретения представляет собой, например, соединение, которое получают согласно способу, описанному в патентном документе 1. Для кристаллизации можно применять соединение (1), которое, после получения, сохраняется как есть без образования кристаллов или которое временно образует кристаллы (неочищенные кристаллы). Для того чтобы дополнительно увеличить чистоту кристаллов, предпочтительно применять соединение (1), которое временно образует кристаллы. В качестве временно образуемых кристаллов, и кристаллы I и кристаллы II являются пригодными.
[0019]
В качестве растворителей для кристаллизации, пригодные отдельные растворители представляют собой эфирные растворители, такие как этилацетат, н-пропилацетат и бутилацетат, кетоновые растворители, такие как метилэтилкетон и метилизопропилкетон, и спиртовые растворители, такие как метанол и этанол. Количество (об/вес) растворителя предпочтительно составляет от 5-кратного до 30-кратного, более предпочтительно от 5-кратного до 20-кратного, и даже более предпочтительно от 7-кратного до 10-кратного относительно количества соединения (1). Желательно, чтобы температура растворения составляла комнатную температуру или от комнатной температуры до температуры кипения каждого растворителя.
[0020]
Для того чтобы стимулировать кристаллизацию, подходящее количество кристаллов I, кристаллов II или смеси обеих кристаллических форм можно добавлять в качестве затравки кристаллов. Количество затравки кристаллов, которое будут добавлять, предпочтительно составляет 0,01-5 (вес/об)% и более предпочтительно 0,03-1 (вес/об)% относительно количества растворителя. Кристаллы можно высаживать при перемешивании для того, чтобы сократить время выпадения кристаллов и контролировать диаметр частиц.
[0021]
Выпавшие кристаллы можно выделить/очистить из раствора для растворения или смешанного раствора, например, известными способами разделения/очистки, такими как фильтрование, промывка органическим растворителем или сушка при пониженном давлении. Примеры органического растворителя, применяемого в промывке, включают низшие спирты, ацетон, ацетонитрил, трет-бутилметиловый эфир, этилацетат, н-пропилацетат, изопропилацетат, пентан и гептан.
[0022]
Кристаллы I получают из соединения (1) при кристаллизации, применяя смешанный растворитель хорошего растворителя, такого как эфирный растворитель или кетоновый растворитель, с плохим растворителем, таким как эфирный растворитель. С другой стороны, кристаллы II получают перекристаллизацией из одного растворителя, состоящего из эфирного растворителя или кетонового растворителя, который является хорошим растворителем. Кристаллы II можно получить более воспроизводимым способом, чем кристаллы I.
[0023]
Предпочтительно, чтобы кристаллы II осаждались добавлением растворителя, такого как эфирный или кетоновый растворитель, к соединению (1), нагреванием растворителя для растворения соединения, и затем обеспечением охлаждения раствора или медленным охлаждением раствора для осаждения. Количество (об/вес) применяемого растворителя предпочтительно является 5 кратным - 30 кратным, более того, 5 кратным - 20 кратным, и более того, 7 кратным - 10 кратным по отношению к количеству соединения (1).
[0024]
Таким образом полученные кристаллы I настоящего изобретения имеют спектр порошковой рентгеновской дифракции, как показано на фигуре 1, и имеют кристаллическую структуру. Характеристичные углы дифракции (2θ±0,2°) кристаллов I представляют собой два или более, предпочтительно четыре или более, более предпочтительно шесть или более и даже более предпочтительно девять, выбранных из группы, состоящей из 10,0°, 13,3°, 18,0°, 19,2°, 19,9°, 21,3°, 22,4°, 23,5° и 25,1°.
[0025]
Термин "вблизи", применяемый в сочетании с максимальной температурой эндотермического пика на кривой дифференциальной сканирующей калориметрии (ДСК), обозначает величину приблизительно при данной температуре, и предпочтительно обозначает то, что температура может быть в пределах диапазона±5°C от данной величины, и более предпочтительно обозначает то, что температура может быть в пределах диапазона±2°C от данной величины.
[0026]
Кривая дифференциальной сканирующей калориметрии (ДСК) кристаллов I показана на фигуре 2. Согласно фигуре 2, кристаллы I имеют эндотермический пик вблизи 81±5°C.
[0027]
Кристаллы II имеют спектр порошковой рентгеновской дифракции, как показано на фигуре 3. Характеристичные углы дифракции (2θ±0,2°) кристаллов II представляют собой, по меньшей мере, два или более, более предпочтительно четыре или более, даже более предпочтительно пять или более, даже более предпочтительно восемь или более, и даже более предпочтительно 14, выбранные из 7,3°, 11,8°, 14,5°, 14,8°, 16,8°, 17,5°, 18,6°, 19,5°, 20,4°, 23,9°, 24,4°, 25,7°, 26,8° и 31,5°.
[0028]
Кривая дифференциальной сканирующей калориметрии (ДСК) кристаллов II показана на фигуре 4. Согласно фигуре 4, кристаллы II имеют эндотермический пик вблизи 108°C±5°C.
[0029]
Ясно, что и кристаллы I и кристаллы II обладают высокой пероральной всасываемостью. Среди них, кристаллы II обладают особенно высокой пероральной всасываемостью.
Более того, ясно, что ни кристаллы I, ни кристаллы II не имеют сниженную чистоту даже после длительного хранения при освещении, и оба вида кристаллов имеют высокую стабильность при хранении. Среди них, кристаллы II обладают особенно высокой стабильностью при хранении.
[0030]
Таким образом, и кристаллы I и кристаллы II имеют высокую пероральную всасываемость и долгосрочную стабильность при хранении и являются пригодными в качестве фармацевтических ингредиентов фармацевтических композиций для перорального введения. В частности, кристаллы II обладают превосходной пероральной всасываемостью и долгосрочной стабильностью при хранении и, также, обладают превосходной воспроизводимостью при получении кристаллов.
[0031]
Кристаллы I или кристаллы II настоящего изобретения можно формулировать в виде различных форм фармацевтических композиций с или без измельчения, например, пероральных препаратов, таких как таблетки, капсулы, гранулы, высокодисперсные гранулы, порошки и сухие сиропы, внешние препараты, такие как суппозитории, ингалянты, капли для носа, мази, пластыри и аэрозоли, и препарат для инъекции, и предпочтительно применять их для перорального препарата. Данные фармацевтические композиции можно получить, применяя фармацевтически приемлемые носители, общепринятыми способами получения, известными специалистам в данной области техники. В случае получения перорального твердого препарата, например, разбавитель и необязательно связующее, разрыхлитель, смазывающее вещество, краситель, агент, улучшающий вкус и агент, улучшающий запах, добавляют к активному ингредиенту, и затем, например, таблетку, таблетку с покрытием, гранулу, порошок, сухой сироп или капсулу можно получить общепринятым способом. В случае получения перорального жидкого препарата, например, агент, улучшающий вкус, буфер, стабилизатор и агент, улучшающий запах, добавляют к активному ингредиенту, и, например, пероральный раствор или сироп можно получить общепринятым способом. В случае получения препарата для инъекции, например, регулятор pH, буфер, стабилизатор, агент, придающий изотоничность, и местный анестетик добавляют к активному ингредиенту, и препарат для подкожной, внутримышечной или внутривенной инъекции можно получить общепринятым способом. В случае получения ректального суппозитория, например, вспомогательное вещество и необязательно поверхностно-активное соединение добавляют к активному ингредиенту, и затем суппозиторий можно получить общепринятым способом. В случае получения мази в виде, например, пасты, крема и геля, общепринятую основу, стабилизатор, смачивающий агент и консервант добавляют при необходимости, и затем смешивают и формулируют общепринятым способом. Применимые основы представляют собой, например, белый вазелин, парафин, глицерин, производные целлюлозы, полиэтиленгликоль, силикон и бентонит. Применимые консерванты представляют собой, например, метилпараоксибензоат, этилпараоксибензоат и пропилпараоксибензоат. В случае получения пластыря, например, приведенную выше мазь, крем, гель или пасту наносят на общепринятую основу общепринятым способом. Подходящая основа представляет собой, например, тканую или нетканую материю из хлопка, штапельное волокно или химическое волокно или пленки или вспененный лист из гибкого поливинилхлорида, полиэтилена или полиуретана.
[0032]
Данные фармацевтические композиции являются пригодными в качестве, например, усилителей противоракового эффекта для других противораковых агентов (патентный документ 2).
[0033]
Количество кристаллов I или кристаллы II, которое будет содержаться в фармацевтических композициях выше, изменяется в зависимости от симптома пациента, для которого их применяют, или в зависимости от, например, лекарственной формы. В общем, количество желательно составляет 5-1000 мг пероральных препаратов, приблизительно 0,1-500 мг для препарата для инъекции, и приблизительно 5-1000 мг для суппозиториев или внешних препаратов, на единичную лекарственную форму. Кроме того, дневную дозу кристаллов I или кристаллы II в фармацевтических композициях выше нельзя обычно определить в зависимости от, например, симптома, пути введения или возраста пациента, и она определяется на усмотрение лечащего врача. Обычно, количество предпочтительно составляет приблизительно 0,1-5000 мг.
Примеры
[0034]
Хотя настоящее изобретение описано здесь более подробно посредством примеров, настоящее изобретение не ограничивается ими любым способом. Хотя настоящее изобретение в достаточной степени описано посредством примеров, ясно, что специалист в данной области техники может вносить различные изменения и модификации. Соответственно, данные изменения и модификации включены в настоящее изобретение при условии, что они не выходят за пределы объема настоящего изобретения.
[0035]
Различные реагенты, применяемые в примерах, представляли собой имеющиеся в продаже продукты, если не указано иначе. ЯМР спектры регистрировали AL 400 (400 МГц; JEOL Ltd.), Mercury 400 (400 МГц; Agilent Technologies, Inc.) спектрометром, или Inova 400 (400 MHz; Agilent Technologies, Inc.) спектрометром, снабженным 400 MNMR датчиком (Protasis), применяя тетраметилсилан в качестве внутреннего стандарта, когда тетраметилсилан содержался в дейтерированном растворителе или применяя ЯМР растворитель в качестве внутреннего стандарта в других случаях, и все δ величины приведены в ppm.
[0036]
Сокращения имеют следующие значения.
s: синглет
d: дуплет
dd: дуплет дуплетов
m: мультиплет
brs: широкий синглет
[0037]
Измерение порошковой рентгеновской дифракции
Порошковую рентгеновскую дифракцию измеряли в следующих условиях испытания после того, как подходящее количество испытуемого вещества слегка измельчали в агатовой ступке, при необходимости.
Прибор: Rigaku MiniFlex II
Мишень: Cu
Выходные параметры рентгеновского излучения: 15 мА, 30 кВ
Диапазон сканирования: 2,0-40,0°
Размер шага: 0,010°
Скорость сканирования: 5,00°/мин.
Щель расходимости: 1,25°
Щель рассеивания: открыта
Приемная щель: открыта
С приборами, включая прибор для обработки данных, обращались согласно способам и процедурам, приведенным для приборов.
Цифровые величины, полученные из различных спектров, могут слегка варьироваться, в зависимости, например, от направления роста кристаллов, размера частиц и условий измерения. Соответственно, данные цифровые величины не следует интерпретировать в строгом смысле.
[0038]
Термометрическое измерение (измерение дифференциальной сканирующей калориметрией (ДСК измерение))
ДСК измерение осуществляли в следующих условиях испытания.
Прибор: TA Instruments Q1000
Образец: Приблизительно 1 мг
Контейнер для образца: выполнен из алюминия
Скорость нагревания: нагревание до 300°C при 10°C/мин
Атмосферный газ: азот
Скорость тока газообразного азота: 50 мл/мин.
С приборами, включая прибор для обработки данных, обращались согласно способам и процедурам, приведенным для приборов.
[0039]
Пример 1: получение (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфаниламида (кристаллы I)
Этилацетат (16 мл) добавляли к неочищенному продукту (9,1 г) соединения (1), которое получали известным способом, описанным в патентном документе 1, растворяя соединение. Затем, трет-бутилметиловый эфир (160 мл) медленно добавляли по каплям, смесь перемешивали при комнатной температуре в течение 15 часов, и таким образом, кристаллы I соединения (1) получали в виде белого порошка (выход: 7,9 г, 87,0%). Как показано на спектре порошковой дифракции рентгеновских лучей фигуры 1, основные 2θ пики представляли собой 10,0°, 13,3°, 18,0°, 19,2°, 19,9°, 21,3°, 22,4°, 23,5° и 25,1°. Как видно на кривой дифференциальной сканирующей калориметрии (ДСК) фигуры 2, эндотермический пик составлял 81,3°C.
1H-ЯМР (CDCl3): δ ppm 1,53 (3H, д, J=6,8 Гц), 1,56-1,98 (10H, m), 2,67-2,78 (1H, м), 2,80-2,91 (1H, м), 3,42-3,60 (2H, м), 4,51-4,63 (1H, м), 4,74-4,89 (2H, м), 5,05 (2H, с), 5,76 (1H, дд, J=7,8 Гц, 2,2 Гц), 6,77-6,89 (3H, м), 7,20-7,27 (2H, м), 8,76 (1H, уш с): LRMS (ESI) m/z 452 [M+H]
[0040]
Пример 2: получение (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфаниламида (кристаллы II)
Бутилацетат (5 мл) добавляли к неочищенному продукту (500 мг) соединения (1), которое получали известным способом, описанным в патентном документе 1, и затем соединение полностью растворяли, применяя масляную баню, установленную на 70°C, и затем охлаждали на воздухе. Белый твердый остаток осаждался при внутренней температуре 45°C, его собирали фильтрованием и сушили при нагревании при пониженном давлении в течение 20 часов, и таким образом кристаллы II соединения (1) получали в виде белого порошка (выход: 412,5 мг, 82,5%). Как показано на спектре порошковой дифракции рентгеновских лучей фигуры 3, основные 2θ пики представляли собой 7,3°, 11,8°, 14,5°, 14,8°, 16,8°, 17,5°, 18,6°, 19,5°, 20,4°, 23,9°, 24,4°, 25,7°, 26,8° и 31,5°. Как видно на кривой дифференциальной сканирующей калориметрии (ДСК) фигуры 4, эндотермический пик составлял 108,0°C.
1H-ЯМР (CDCl3): δ ppm 1,53 (3H, д, J=6,8 Гц), 1,56-1,98 (10H, м), 2,67-2,78 (1H, м), 2,80-2,91 (1H, м), 3,42-3,60 (2H, м), 4,51-4,63 (1H, м), 4,74-4,89 (2H, м), 5,05 (2H, с), 5,76 (1H, дд, J=7,8 Гц, 2,2 Гц), 6,77-6,89 (3H, м), 7,20-7,27 (2H, м), 8,76 (1H, уш с): LRMS (ESI) m/z 452 [M+H]
[0041]
Пример 3: Анализ монокристалла (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфаниламида (кристаллы II)
(R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфаниламид термически растворяли в смеси вода/метанол (1:1) и оставляли при комнатной температуре, и таким образом подтверждали осаждение единичных кристаллов формы II.
Размер кристаллов: 0,26×0,20×0,08 мм
Цвет кристаллов: бесцветные
Кристаллическая форма: столбчатый кристалл
[0042]
Измерения проводили в следующих условиях измерения, и обработку данных осуществляли, применяя программное обеспечение для структурного анализа Crystal Structure (Ver.3.8.2), разработанное Rigaku Corporation.
Прибор для дифракции: Rigaku RAXIS-RAPID
Падающие рентгеновские лучи: CuKα облучение (λ=1,54187 Å)
Кристаллический монохроматор (графит) применяли
Выходные параметры 50 кВ, 100 мА
Диаметр коллиматора: 0,5 ммφ
Детектор: рентгенографическая пластина (460 мм x 256 мм)
Способ сканирования: ω-2θ развертывание
Скорость сканирования: 1,0°/мин (в омега)
2θmax: 143,5°
Количество измеренных отражений: 43629
Количество независимых отражений: 4392 (Rint=0,020)
Коррекция данных: фактор Лоренца
Коррекция абсорбции: коррекция Ψ сканированием (поправочный коэффициент: 0,687-0,879)
Температура измерения: приблизительно -180°C (пульверизация газообразного азота)
[0043]
Кристаллические данные показаны ниже.
Кристаллическая система: ромбическая система
Пространственная группа: P212121 (No. 19)
Постоянная решетки: a=9,3998(5) Å
b=10,3585(5) Å
c=23,5111(10) Å
объем элементарной ячейки: 2289,22(19) Å3
Z величина: 4
[0044]
Пример испытания 1: измерение концентрации в крови
Получали 0,5% ГПМЦ суспензию для дозирования (50 мг/10 мл/кг) каждых из кристаллов I и кристаллы II. Данные суспензии вводили перорально мышам (Balb/cA), которых выращивали в условиях кормления, в объеме 10 мл на кг веса тела, применяя трубку для принудительного кормления. После введения, мышей возвращали в клетку для мышей, и проверяли их состояние. В клетке обеспечивали свободный доступ к воде и пище. Через 0,5, 1, 2, 4, 6 и 8 часов после введения мышей анестезировали изофлураном, и 60 мкл крови собирали из глазничного венозного сплетения, применяя пробирку для сбора капиллярной крови. Отобранную кровь охлаждали на льду, и центрифугировали для удаления плазмы. После отбора крови мышей возвращали в клетку для выращивания животных, и проверяли их состояние после восстановления после анестезии. После последнего сбора крови, проверяли глубину анестезии изофлураном, и затем мышей подвергали эвтаназии цервикальной дислокацией.
Из концентраций соединения (1) в плазме, измеренных способом MRM, применяя LC-MS/MS, AUC0-24ч, рассчитывали линейно-логарифмическим способом трапеций, применяя программное обеспечение Phoenix WinNonlin (v6.3.0), разработанное Pharsight.
[0045]
Результаты показаны в таблице 1. Из данного испытания обнаружено, что кристаллы II показывает AUC0-24ч (площадь под кривой концентрация в крови-время 0-24 часа после введения) величину, аналогичную величине кристаллов I. Таким образом, установлено, что можно обеспечить кристаллы II согласно настоящему изобретению, которые обладают оптимальной пероральной всасываемостью, и которые можно получить высоковоспроизводимым способом.
[0046]
[Таблица 1]
|
[0047]
Пример испытания 2: испытание на стабильность в твердом состоянии (при освещении)
Стабильность в твердом состоянии кристаллов I и кристаллы II, полученных в примерах, при хранении в течение 1 месяца при освещении, измеряли в следующих условиях.
[0048]
Условия хранения: образец помещали в прозрачную стеклянную колбу, затем надевали крышку, и паз между крышкой и колбой герметично закрывали соединительной лентой.
Продолжительность измерения: 1 месяц
Хранимое количество: приблизительно 30 мг
Контейнер для хранения: прозрачная стеклянная колба
[0049]
Химическую чистоту соединения (1) в растворе образца измеряли ВЭЖХ анализом. С приборами, включая прибор для обработки данных, обращались согласно способам и процедурам, приведенным для приборов (прибор: Shimadzu Corporation LC-20AB).
Колонка: L-column 2 ODS, изготовленная Chemicals Evaluation and Research Institute, 4,6×150 мм, 5 мкм
УФ детекция: 220 нм
Температура колонки: 50°C
Скорость потока в колонке: 1,0 мл/мин
Подвижная фаза: A; вода, B; ацетонитрил
Вводимое количество: 10 мкл
Концентрация образца: 1,0 мг/мл
Градиент: таблица 2
[0050]
[Таблица 2]
|
[0051]
Измеренные результаты по химической чистоте соединения (1) показаны в таблице 3. Химическая чистота кристаллов I и кристаллы II не изменялась в течение 1 месяца при освещении, и также результаты порошковой рентгеновской дифракции не показали изменения кристаллической формы (фигура 5 и фигура 6).
[0052]
[Таблица 3]
|