Результат интеллектуальной деятельности: Способ оценки тяжести течения сепсиса
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к медицинской микробиологии, и может быть использовано в клинической практике для оценки тяжести течения заболевания у септических больных.
Актуальность проблемы ранней диагностики бактериемии и сепсиса обуславливается тем, что генерализованные бактериальные инфекции являются тяжелыми осложнениями у больных.
Разработаны шкалы по оценке тяжести состояния пациентов такие, как Acute Physiology and Chronic Health Evaluation (APACHE) II, Simplified Acute Physiology Score (SAPS) II, SOFA, Surviving Sepsis Campaign (SSC), РАСХИ и др., которые включают для расчетов общепринятые клинические и лабораторные данные. Существующие шкалы для оценки тяжести и исхода сепсиса громоздки и неудобны, поэтому на практике чаще используют простые, сокращенные формулы прогнозирования, состоящие из 4-5 критериев [Рудное В.А. Сепсис: современные подходы к диагностике и интенсивной терапии // Вестник анестезиологии и реаниматологии, 2010. Т. 7, №1, С. 48-57].
В последнее время в клинической практике для ранней диагностики некоторых патологических процессов стали использовать определение специфических белков - биомаркеров [Рудное В.А. Сепсис: современные подходы к диагностике и интенсивной терапии // Вестник анестезиологии и реаниматологии, 2010, Т. 7, №1, С. 48-57].
Известно около 200 биомаркеров сепсиса, однако только немногие из них находят клиническое применение. [Чеботкевич В.К, Кайтанджан Е.И., Бурылев В.В., Щетинкина Е.Е. Современные методы лабораторной диагностики сепсиса // Клиническая микробиологическая антимикробная химиотерапия, 2013, Том 15, №4, С. 295-300].
Известен способ определения прокальцитонина при диагностике сепсиса, который начал применяться только в последние годы как маркер инфекционного процесса [Tang В.М., Eslick G.D., Craig J.С, McLean A.S. Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: systematic review and metaanalysis // Lancet Infect Dis. 2007, Mar, 7 (3), p.210].
Недостатком использования определения прокальцитонина для диагностики сепсиса является несоответствие тяжести состояния, эффективности проводимой терапии и прогноза летального исхода. Отрицательным является его неспецифичность, так как прокальцитонин повышается не только при инфекционном процессе, но и при заболеваниях щитовидной железы и при некоторых опухолях [Cate С.С, Pettengill O.S., Sorenson G.D. Byosynthesis of Procalcitonin in small cell carcinoma of the lung Cancer Res. 1986, 46, p.812-8].
Известен способ обнаружения другого биомаркера инфекционного процесса - белка пресепсина, образующегося в результате бактериального фагоцитоза [Liu В, Chen YX, Yin Q, et al. Diagnostic value and prognostic evaluation of Presepsin for sepsis in an emergency department.// Crit Care, 2013, 17(5), R244]. Вместе с тем, известно о проникновении бактерий в эритроциты [Щуплова Е.А., Стадников А.А., Фадеев С.Б. Роль биологических свойств Staphylococcus epidermidis во внутриэритроцитарной инвазии и изменении активности каталазы и супероксиддисмутазы эритроцитов при экспериментальной генерализованной инфекции // Бюллетень экспериментальной биологии и медицины, 2015, №1, С. 79-82], которые не являются фагоцитирующими клетками и поэтому пресепсин не образуется. В связи с чем, данный биомаркер не является надежным критерием для диагностики сепсиса и оценки тяжести состояния больных, что говорит о недостатке данного способа.
Таким образом, с помощью биомаркеров определяют биохимическое состояние крови септических больных, но наличие возбудителей и идентификацию микроорганизмов биомаркеры не показывают, а также их значения могут повышаться при других заболеваниях. В связи с чем, для постановки точного диагноза и оценки тяжести состояния септических больных необходимо использовать методы обнаружения гемокультуры.
В настоящее время «золотым стандартом» лабораторной диагностики бактериемий и сепсиса является бактериологический метод выделения гемо-культур. При подозрении на инфекцию кровотока у пациента, еще до начала эмпирической терапии антибиотиками широкого спектра действия, производится забор крови для бактериального посева. Забор крови рекомендуется проводить 2-3 раза по 20-30 мл (по 10-15 мл для двух параллельных высевов на аэробные и анаэробные среды). Исследования показывают, что при меньшем объеме забираемой крови частота выявления возбудителей существенно снижается. [Lin Н. - H., Liu Y. - F., Tien N. at al. Evaluation of the blood volume effect on the diagnosis of bacteremia in automated blood culture system // Journal of Microbiology, Immunology and Infection., 2013., Vol. 46., p. 46-52]. Недостатком бактериологического метода является длительность культивирования посевов до 5-7 суток, длительное время для идентификации чистой культуры с помощью различных биохимических тестов, а также проведение теста на выявление резистентности к антибиотикам. Кроме того, эффективность бактериологического метода составляет около 45% [Рудное В.А. Сепсис: современные подходы к диагностике и интенсивной терапии // Вестник анестезиологии и реаниматологии, 2010. Т. 7, №1, С. 48-57] и данный метод не приемлем для прихотливых и некультивируемых бактерий, таких как микоплазмы, нокардии, риккетсии, хламидии и ряд других микроорганизмов [Киселева Е.Е. Алгоритм выявления и видовой идентификации бактерий в крови с использованием ПЦР // Вестник гематологии, 2017, Т. XIII, №1, С. 19-24]. Бактериологический метод диагностики сепсиса позволяет обнаружить возбудителя заболевания, но не выявляет критерии для оценки тяжести течения сепсиса.
По сравнению с бактериологическим методом, методы молекулярной диагностики, основанные на анализе белков или нуклеиновых кислот микроорганизмов лишены вышеуказанных недостатков. Примером молекулярно-генетических методов являются методы ПЦР-анализа гемокультуры, метод мультиплексного ПЦР-анализа в режиме реального времени. Главное преимущество данных методов в сокращении длительности анализов до 5-12 часов, возможность выявления некультивируемых форм возбудителей и одновременное выявление нескольких разных мишеней (как генетических маркеров патогенов, так и маркеров их антибиотикорезистентности) в одном клиническом образце [Гаврилое С.Н., Скачкова Т.С., Шипулина О.Ю., Савочкина Ю.А., Шипулин Г.А., Малеев В.В. Современные молекулярно-генетические методы, используемые для этиологической диагностики сепсиса // Журнал микробиологии, эпидемиологии и иммунобиологии. 2016,№2, С. 91-99].
Недостатком данного метода является выделение ДНК транзиторных микроорганизмов, не имеющих клинического значения, что приводит к ложноположительным результатам диагностики сепсиса, а также сложность при очистке бактериальной ДНК от генетического материала в образце крови больного человека. Для реализации методов ПЦР-анализа гемокультуры и мультиплексного ПЦР-анализа в режиме реального времени необходимо дорогостоящее оборудование и более трудоемкую подготовку исследуемого материала.
Известен современный молекулярно-генетический метод флуоресцентной in situ гибридизации (FISH), в котором используются флуоресцирующие молекулы для детекции специфических фрагментов ДНК и РНК [Sladjana Malic et. al. Detection and identification of specific bacteria in wound biofilms using peptide nucleic acid fluorescent in situ hybridization (PNA FISH). // Microbiology. 2009, 155, р. 2603-2611]. Материалом для исследования методом FISH может служить кровь, костный мозг, биоптат, плацента и др. В исследуемых образцах FISH позволяет выявлять нуклеиновые кислоты в клеточных структурах, морфологию и одновременно проводить идентификацию микроорганизмов.
В качестве прототипа изобретения выбран способ ранней диагностики сепсиса, основанный на методе FISH [Gosiewski Т, Pietrzyk A, Brzychczy-Wloch М, Heczko P.Use of PCR and FISH methods for rapid identification of bacterial bloodstream infections. // Ann Acad Med Siles 2011, 65, p. 14-22]. Недостатком данного способа является то, что авторы предлагают на основе обнаруженной бактериальной ДНК делать заключение о ранней диагностике развития сепсиса в отсутствии критериев оценки тяжести течения заболевания у септических больных, что затрудняет принятие решения лечения их эффективными антибактериальными препаратами.
Задачей заявляемого технического решения является создание способа оценки тяжести течения заболевания септических состояний у больных по количеству адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий с использованием метода FISH.
Для решения указанной задачи в заявляемом способе оценки тяжести течения сепсиса осуществляют подготовку образцов крови больных сепсисом для проведения флуоресцентной in situ гибридизации с последующим обнаружением бактерий в образцах крови с использованием люминесцентной микроскопии, определяют количество адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий и рассчитывают интегральный показатель по формуле:
ИП=1,527+0,333×X1-1,116×Х2-0,137×Х3+0,033×Х4+0,061×Х5-0,184×Х6+3,242×Х7+0,71×Х8+0,888×Х9+0,336×Х10,
где: X1 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo1;
Х2 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo2;
Х3 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo3;
Х4 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo4;
Х5 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo5;
Х6 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo1;
Х7 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo2;
Х8 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo3;
Х9 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo4;
Х10 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo5,
при этом при значении интегрального показателя меньше 2,5 - тяжесть течения сепсиса считают легкой, при значении от 2,5 до 5,6 - средней, а при значении больше 5,6 - тяжелой.
Технический результат от реализации изобретения выражается в создании способа оценки тяжести течения заболевания у больных сепсисом с возможностью обнаружения и одновременной идентификации микроорганизмов, находящихся на поверхности эритроцитов и внутри эритроцитов крови больных сепсисом.
Новым в заявляемом способе является то, что с использованием метода FISH установлена взаимосвязь между количеством адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий и степенью тяжести течения заболевания больных сепсисом.
Авторы с помощью метода FISH с использованием нескольких видов ДНК-зондов, представленных в таблице 1, обработали образцы крови больных с предварительным диагнозом: «Сепсис». Авторы для работы использовали характерные виды олигонуклеотидных зондов, комплементарных видоспецифическим участкам гена 16S рРНК микроорганизмов, как наиболее часто встречающихся возбудителей при сепсисе. В исследуемых образцах крови авторы подсчитывали количество адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий.
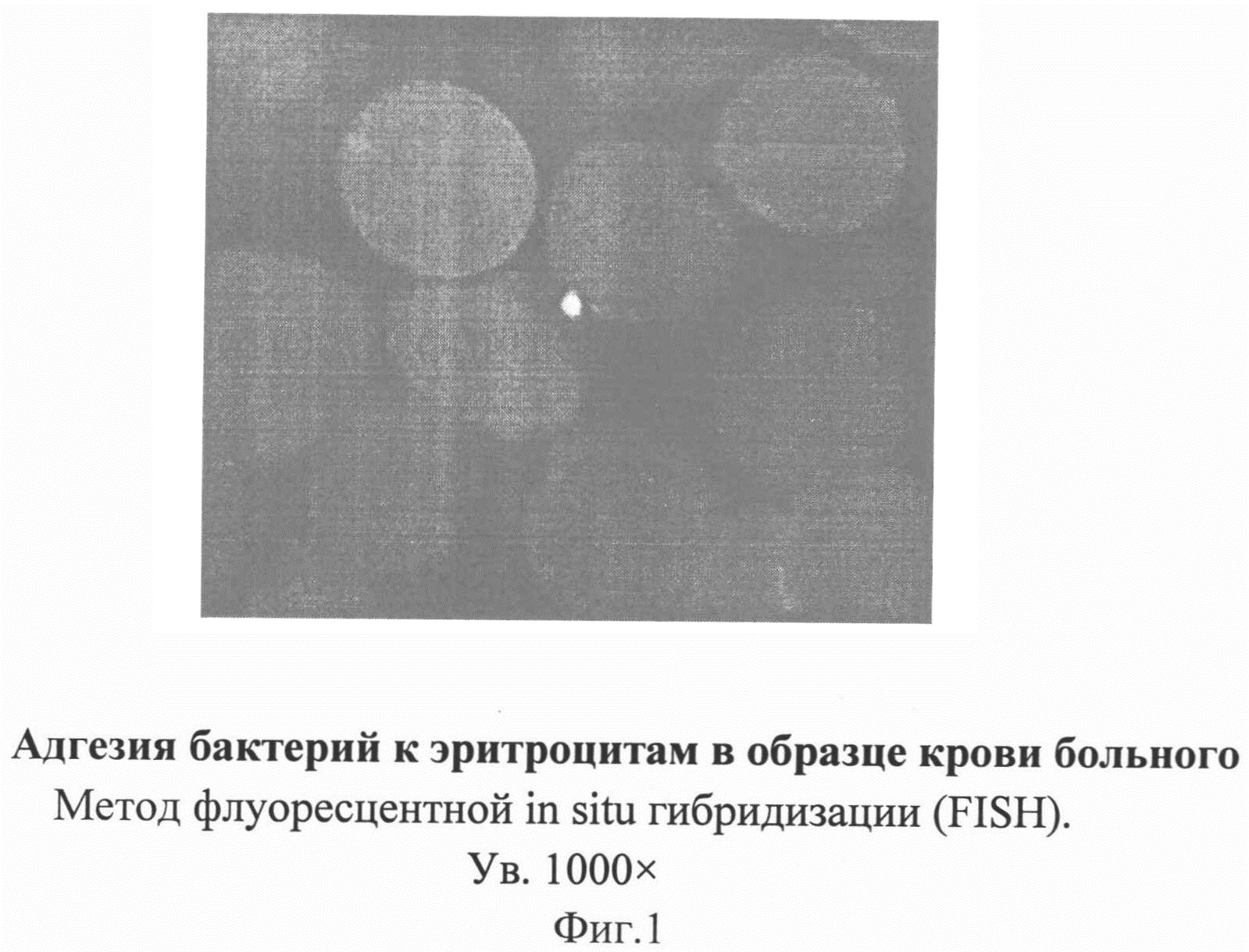
На фигуре 1 изображена адгезия бактерий к поверхности эритроцита в образце крови больного сепсисом.
На фигуре 2 представлено внутриэритроцитарное проникновение бактерий в исследуемом образце крови больного сепсисом.

Для выявления моно- или полимикробной инфекции авторы использовали одновременно все виды олигонуклеотидных зондов при обработке одного образца крови обследуемого больного.
В результате работы авторы определили процент бактериальных клеток адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий с использованием данных ДНК-зондов.
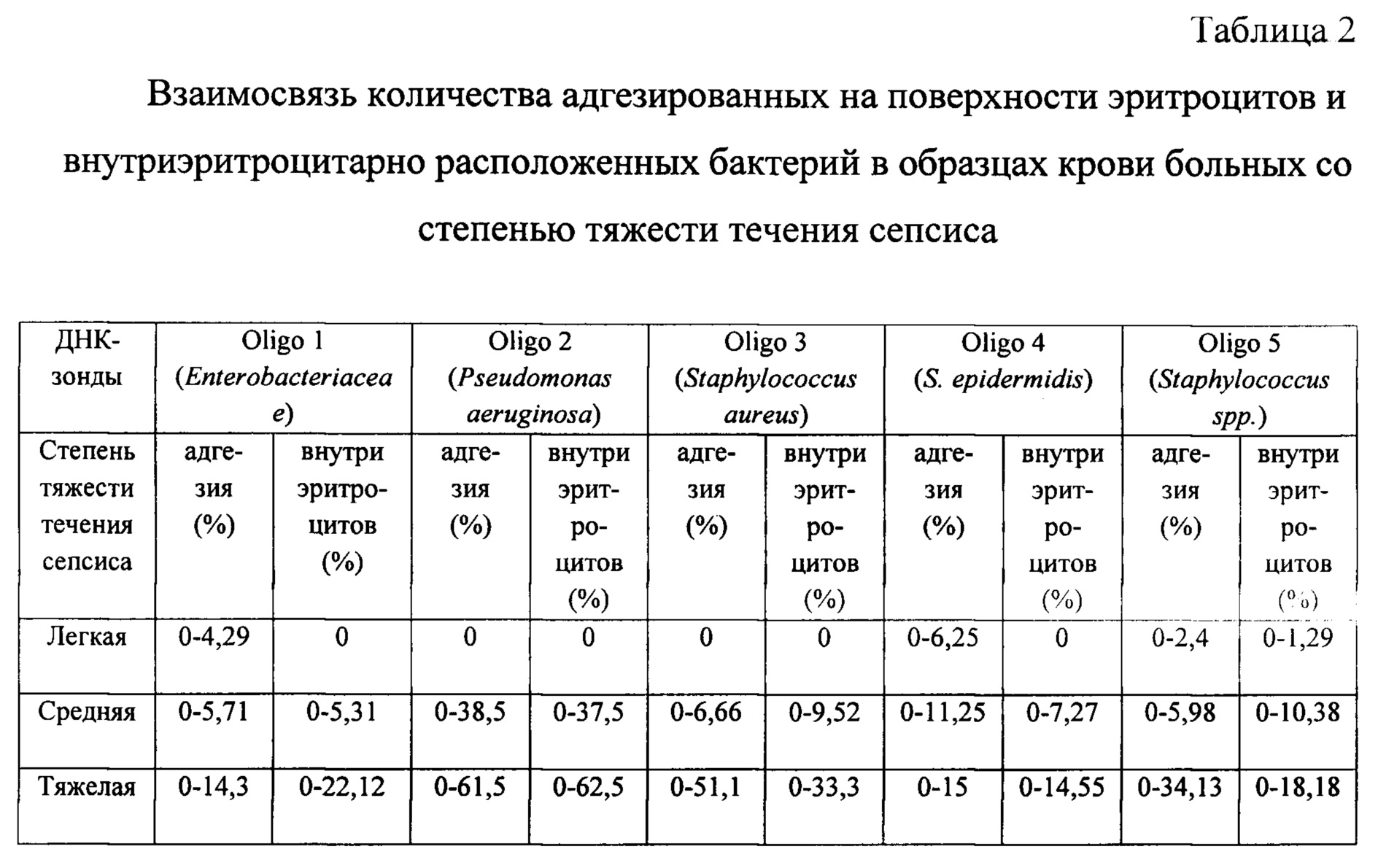
Далее полученные данные сопоставили с клиническим анамнезом больных сепсисом и получили три группы, отличающиеся по степени тяжести течения заболевания. Результаты представлены в таблице 2.
Как видно из таблицы 2 с увеличением степени тяжести течения сепсиса возрастает доля адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий.
Далее авторы провели оценку тяжести течения сепсиса у больных согласно прототипу и заявляемому способу. Результаты представлены в таблице 3.
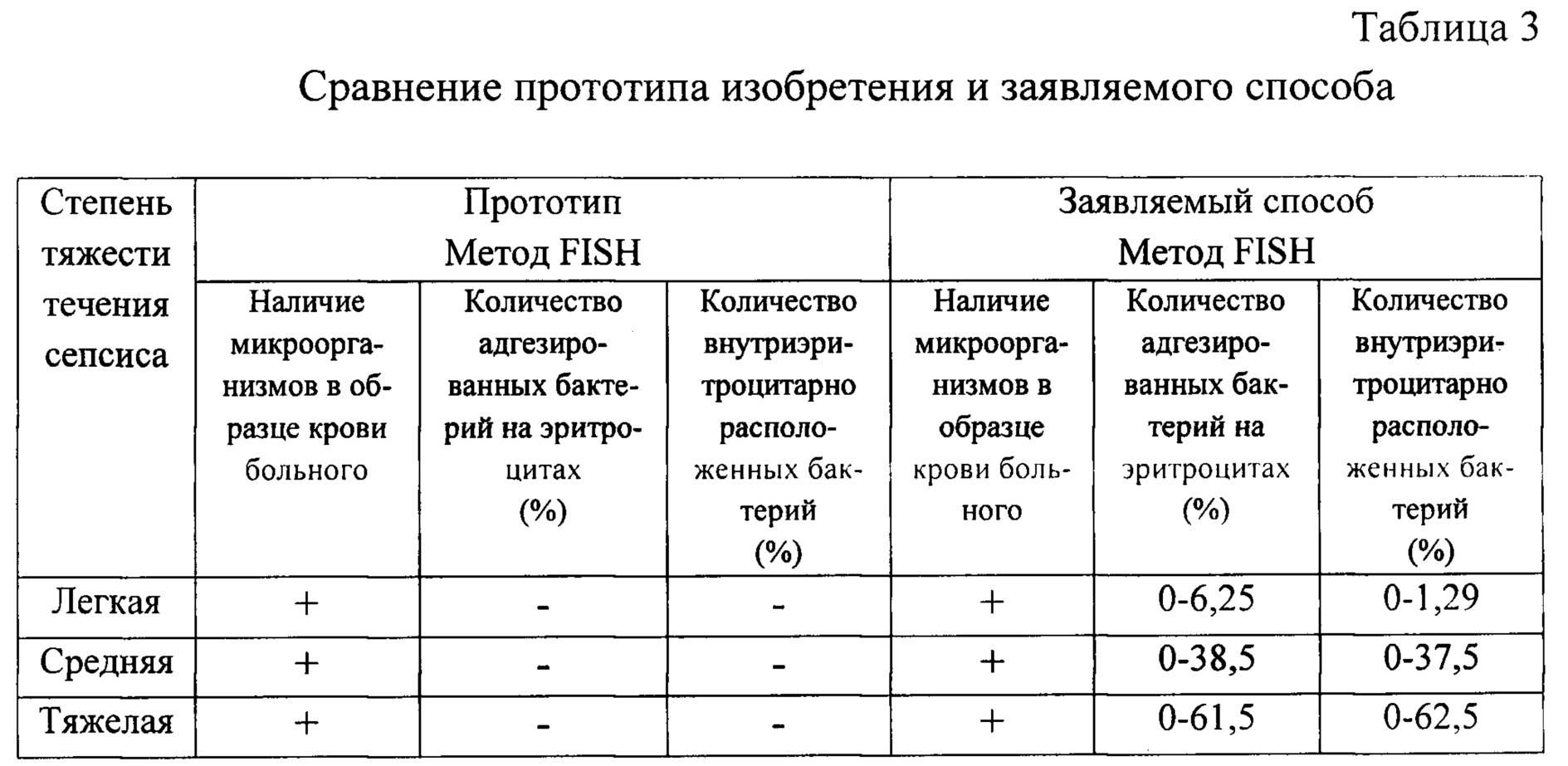
Как видно из таблицы 3, прототип изобретения позволяет только обнаружить микроорганизмы в образце крови септических больных, а с помощью заявляемого способа можно подсчитать количество как адгезированных бактерий на поверхности эритроцитов, так и их внутриэритроцитарное расположение. Полученные данные можно использовать в качестве критерия для оценки тяжести течения заболевания.
Для комплексной оценки тяжести течения заболевания у больных сепсисом с использованием одновременно нескольких ДНК-зондов был проведен статистический анализ полученных данных, результаты которого позволили получить регрессионную модель, описывающую взаимосвязь количества адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий со степенью тяжести течения заболевания у больных сепсисом.
Регрессионная модель представляет собой интегральный показатель, значения которого позволили дифференцировать степень тяжести течения сепсиса.
Интегральный показатель (ИП) рассчитывается по формуле:
ИП=1,527+0,333×X1-1,116×Х2-0,137×Х3+0,033×Х4+0,061×Х5-0,184×Х6+3,242×Х7+0,71×Х8+0,888×Х9+0,336×Х10,
где: X1 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo1;
Х2 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo2;
Х3 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo3;
Х4 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo4;
Х5 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo5;
Х6 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo1;
Х7 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo2;
Х8 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo3;
Х9 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo4;
Х10 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo5.
По результатам значений ИП и клинически подтвержденных диагнозов авторы получили 3 группы, отличающиеся по степени тяжести течения сепсиса: легкая, средняя и тяжелая форма. Диапазоны дифференциации тяжести течения сепсиса представлены в таблице 4.

Как видно из таблицы 4, что чем выше значения интегрального показателя (количество адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий), тем тяжелее состояние больного.
Таким образом, авторы сделали заключение о том, что определение количества адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий с использованием метода FISH, а также расчет интегрального показателя позволяет оценить тяжесть течения заболевания у больных сепсисом. Необходимо отметить, что данный способ гораздо дешевле и более легкий в обработке исследуемого материала, чем ПЦР-анализ гемокультуры и метод мультиплексного ПЦР-анализа в режиме реального времени.
Эффективность заявляемого способа оценки тяжести течения заболевания у больных сепсисом составляет 99%.
Способ осуществляется следующим образом:
1) Кровь от обследуемого больного трехкратно отмывают фосфатно-солевым буфером (ФСБ) (рН=7,4) центрифугированием при 1000 об/мин в течение 5 мин и доводят до одномиллионной концентрации клеток в миллилитре.
2) Пробу объемом 1 мл осаждают центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 400 мкл 0,5% раствора глутарового альдегида, фиксируют в течение 30 мин при 25°С.
3) Фиксированные клетки промывают ФСБ (рН=7,4) и ресуспендируют в растворах этанола с восходящей концентрацией 50, 80 и 100% по 400 мкл каждого раствора с последующей инкубацией в течение 10 мин при 4°С.
4) Эритроциты промывают ФСБ (рН=7,4) центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 300 мкл дистиллированной воде.
5) Аликвоты по 100 мкл фиксированных клеток осаждают центрифугированием при 1000 об/мин в течение 5 мин и ресуспендируют в 100 мкл буферного раствора для гибридизации (0,9 М NaCl и 20 mM Tris-HCl, рН=7), содержащего 500 нМ соответствующего ДНК-зонда, меченного на 5'-конце флуо-ресцеина изотиоцианатом (FITC) (ООО «ДНК-синтез», Москва).
6) Проводят гибридизацию в течение 5 ч при температуре соответствующей температуре отжига для каждого вида зонда.
7) После гибридизации клетки центрифугируют при 1000 об/мин в течение 5 мин и добавляют 500 мкл промывочного раствора для удаления ДНК-зондов, не связавшихся с ДНК исследуемых бактерий, инкубируют в течение 30 мин при соответствующей температуре.
8) Пробу центрифугируют и ресуспендируют в 300 мкл ФСБ, эритроциты дополнительно окрашивают синим Эванса.
9) С помощью люминесцентной микроскопии определяют количество адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий, а также одновременно проводят идентификацию бактерий по соответствующим зондам в образцах крови обследуемого больного.
10)Рассчитывают интегральный показатель по формуле:
ИП=1,527+0,333×X1-1,116×Х2-0,137×Х3+0,033×Х4+0,061×Х5-0,184×Х6+3,242×Х7+0,71×Х8+0,888×Х9+0,336×Х10,
где: X1 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo1;
Х2 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo2;
Х3 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo3;
Х4 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo4;
Х5 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo5;
Х6 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo1;
Х7 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo2;
Х8 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo3;
Х9 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo4;
Х10 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo5.
11) Оценивают степень тяжести течения сепсиса, используя значения интегрального показателя (ИП): ИП меньше 2,5 - тяжесть течения сепсиса считают легкой, при значении ИП от 2,5 до 5,6 - средней, а при значении ИП больше 5,6 - тяжелой.
Примеры конкретного выполнения способа.
Пример 1. Больной X., 1960 г.р. поступил в ООКБ №1 с предварительным диагнозом: «Менингит, сепсис». При осмотре отмечалась выраженная вялость, сероватый оттенок кожных покровов, отечность стоп. Тахипноэ достигало 96 в мин, что свидетельствовало о наличии дыхательной недостаточности. Температура тела в течение трех дней держалась в пределах 38,7-39°С. Лабораторные показатели общего анализа крови были значительно ниже нормы: Hb - 76 г/л, ц.п. - 0,82, эритроцитов - 2,89×1012/л, лейкоцитов - 2,94×106/л. При использовании заявляемого способа подготовки эритроцитов возможно выявление бактерий на поверхности и внутри эритроцитов, а также одновременная их идентификация, что позволит подтвердить поставленный диагноз у больного, а также с помощью расчета интегрального показателя оценить тяжесть течения заболевания. Для этого кровь от обследуемого больного трехкратно отмывали фосфатно-солевым буфером (ФСБ) (рН=7,4) центрифугированием при 1000 об/мин в течение 5 мин и доводили до одномиллионной концентрации клеток в миллилитре. Пробу объемом 1 мл осаждали центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 400 мкл 0,5% раствора глутарового альдегида, фиксировали в течение 30 мин при 25°С. Фиксированные клетки промывали ФСБ (рН=7,4) и ресуспендировали в растворах этанола с восходящей концентрацией 50, 80 и 100% по 400 мкл каждого раствора с последующей инкубацией в течение 10 мин при 4°С. Эритроциты промывали ФСБ (рН=7,4) центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 300 мкл дистиллированной воде. Аликвоты по 100 мкл фиксированных клеток осаждали центрифугированием при 1000 об/мин в течение 5 мин и ресуспендировали в 100 мкл буферного раствора для гибридизации (0,9 М NaCl и 20 mM Tris-HCl, рН=7), содержащего 500 нМ соответствующего ДНК-зонда, меченного на 5'-конце флуоресцеина изотиоцианатом (FITC) (ООО «ДНК-синтез», Москва). Далее в исследуемой пробе проводили гибридизацию в течение 5 ч при температуре соответствующей температуре отжига для каждого вида зонда. После гибридизации клетки центрифугировали при 1000 об/мин в течение 5 мин и добавляли 500 мкл промывочного раствора для удаления ДНК-зондов, не связавшихся с ДНК исследуемых бактерий, инкубировали в течение 30 мин при соответствующей температуре. Пробу центрифугировали и ресуспендировали в 300 мкл ФСБ. Эритроциты дополнительно окрашивали синим Эванса. С помощью люминесцентной микроскопии определяли количество адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий, а также одновременно проводили идентификацию бактерий по соответствующим зондам в образцах крови обследуемого больного. Далее рассчитывали интегральный показатель по формуле:
ИП=1,527+0,333×X1-1,116×Х2-0,137×Х3+0,033×Х4+0,061×Х5-0,184×Х6+3,242×Х7+0,71×Х8+0,888×Х9+0,336×Х10,
где: X1=20 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo1;
Х2=0 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом O1igo2;
Х3=0 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом O1igo3;
Х4=0 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo4;
Х5=12 - количество адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондом Oligo5;
Х6=5 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo1;
Х7=0 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo2;
Х8=0 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo3;
Х9=0 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo4;
Х10=16 - количество внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондом Oligo5.
Полученные экспериментальные значения были использованы для расчета интегрального показателя по вышеуказанной формуле:
ИП=1,527+0,333×20-1,116×0-0,137×0+0,033×0+0,061×12-0,184×5+3,242×0+0,71×0+0,888×0+0,336×16=13,375
В результате расчета получили значение интегрального показателя равное 13,375, которое соответствует 3 группе - тяжелая степень заболевания. Специфическое свечение обнаружили с зондами Oligo1 и Oligo6, комплементарных видоспецифическим участкам гена 16S рРНК микроорганизмов Enterobacteriaceae и Staphylococcus spp. У больного выявили полимикробную инфекцию. Последующее наблюдение пациента на основе клинических и лабораторных показателей подтвердило раннее выставленный диагноз.
Было сделано заключение о том, что у больного подтвердился диагноз: «Сепсис», с помощью заявляемого способа оценили тяжелую степень течения заболевания и определили возбудителей сепсиса - Enterobacteriaceae и Staphylococcus spp.
Пример 2. Больная Ф., 1935 г.р. поступила в ООКБ №1 с диагнозом: «Септический эндокардит, ишемический инсульт». При поступлении состояние тяжелое, температура тела - 38,7°С. Пульс - 102 в минуту; частота дыхания - 34 в минуту. Лабораторные показатели общего анализа крови были ниже нормы: Hb - 102 г/л, ц.п. - 0,98, эритроциты - 4,34×1012/л, общее количество лейкоцитов - 18,5×109/л. У больной взяли образец крови и обработали согласно примеру 1. В результате применения заявляемого способа получили значение интегрального показателя равное 4,8, что соответствует 2 группе - средняя степень тяжести течения сепсиса. Специфическое свечение обнаружили с зондом Oligo3, комплементарного видоспецифическому участку гена 16S рРНК микроорганизма - Staphylococcus aureus. Последующее наблюдение пациентки на основе клинических и лабораторных показателей подтвердило раннее выставленный диагноз.
Было сделано заключение о средней тяжести течения заболевания по количеству адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий, возбудителем является S. aureus.
Пример 3. Больная Б., 1975 г.р. поступила в ООКБ №1 с диагнозом: «Гнойный перитонит, сепсис». При поступлении общее состояние средней тяжести, температура тела - 38,4°С, артериальное давление 130/90 мм рт.ст., пульс 88 в минуту. Показатели общего анализа крови находились в пределах нормы: Hb - 118 г/л; эр - 3,8×1012/л; ц.п.- 1,5. У больной взяли образец крови и обработали согласно примеру 1. В результате применения заявляемого способа получили значение интегрального показателя равное 2,009, что соответствует 1 группе - легкая степень тяжести течения сепсиса. Специфическое свечение обнаружили с зондом Oligo1, комплементарного видоспецифическому участку гена 16S рРНК микроорганизма - представителя Enterobacteriaceae. Последующее наблюдение пациента на основе клинических и лабораторных показателей подтвердило раннее выставленный диагноз.
Было сделано заключение о легкой степени тяжести течения заболевания по количеству адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий.
Пример 4. Больной Н., 1957 г.р. поступил в ООКБ №1 с предполагаемым диагнозом «Сепсис». При осмотре общее состояние удовлетворительное, температура тела - 37,4°С, артериальное давление 130/90 мм рт.ст., пульс 68 в минуту. Показатели общего анализа крови находились в пределах нормы: Hb - 133 г/л; эр - 4,46×1012/л; ц.п. - 0,9. У больного взяли образец крови и обработали согласно примеру 1. В результате исследования в образце крови специфического свечения не обнаружили. Было сделано заключение о том, что у больного диагноз не подтвердился.
Таким образом, заявляемый способ оценки тяжести течения сепсиса позволяет повысить точность ранней диагностики и по количеству адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий оценить тяжесть течения заболевания у больных сепсисом. Данный способ гораздо дешевле и более легкий в обработке исследуемого материала, чем ПЦР-анализ гемокультуры и метод мультиплексного ПЦР-анализа в режиме реального времени, а также может достаточно широко применяться в условиях клинико-диагностических лабораторий.