Результат интеллектуальной деятельности: Тест-система для прогнозирования развития метастазов у больных раком желудка на основании определения числа копий HV2 мтДНК
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к молекулярной биологии, онкологии, и может быть использовано для прогнозирования вероятности развития метастазов у пациентов с диагнозом рак желудка.
Рак желудка занимает одно из ведущих мест в общей структуре онкологических заболеваний в РФ: 7,9% у мужчин и 5,2% у женщин (показатели заболеваемости). В структуре смертности населения России от злокачественных новообразований рак желудка занимает второе место с показателем 10,3% или 30409 человек в 2015 году (см. Под редакцией А.Д. Каприна, В.В. Старинского, Г.В. Петровой // Злокачественные новообразования в России в 2015 году (см. заболеваемость и смертность), Москва, 2017).
Метастазы возникают у 80-90% больных раком желудка, при этом выживаемость составляет 65% в случае ранней диагностики заболевания и менее 15% на поздних стадиях развития онкологического процесса (см. Takuji G., Yanagisawa A., Sasako М. Ono Н, Nakanishi Y., Shimoda Т., Kato Y. Incidence in lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. // Gastric Cancer. - 2000. - V. 3. - P. 219-225). Поэтому поиск потенциальных молекулярных маркеров, пригодных для ранней диагностики и прогнозирования тяжести течения этого заболевания является актуальной задачей.
Изменение копийности генов (Copy Number Variation или CNV) является одним из основных механизмов контроля раковой клеткой ключевых для выживания и малигнизации экспрессии генов. Копийность генов - вид генетического полиморфизма, возникающий в результате несбалансированных хромосомных перестроек, таких как делеции и дупликации. Результатом вариации может явиться снижение или повышение числа копий определенного гена, и, следовательно, пониженная или повышенная экспрессия продукта гена - белка или не кодирующей РНК. CNV представляют собой критические генетические события, которые способствуют развитию и прогрессированию злокачественных новообразований у человека (см. Кит О.И., Водолажский Д.И., Кутилин Д.С., Гудуева Е.Н. Изменение копийности генетических локусов при раке желудка // Молекулярная биология. - 2015. - Т. 49, №4. - С. 658-666.).
Изменение числа копий митохондриальной ДНК (определяемое по копийности локуса HV2), характерное для раковых клеток, отражает состояние окислительного фосфорилирования малигнизированных клеток (см. Scatena R. Mitochondria and cancer: a growing role in apoptosis, cancer cell metabolism and dedifferentiation. // Adv Exp Med Biol. - 2012. - V. 942. - P. 287-308). HV2 - гипервариабельный участок с 33 по 160 нуклеотид D-петли митохондриальной ДНК (мтДНК), относящийся к регуляторным не кодирующим элементам, поэтому он обладает высокой изменчивостью. Копийность мтДНК в лейкоцитах крови определяли во многих исследованиях при различных видах рака, хотя вопрос о ценности показателя копийности мтДНК в лейкоцитах для диагностики и прогноза лечения опухолей желудка остается дискуссионным.
Так, в широкомасштабном исследовании, включавшем в себя группы пациентов с раком желудка на различных стадиях и условно здоровых доноров, не было обнаружено значимой ассоциации между числом копий мтДНК в лейкоцитах и риском развития рака желудка, но, была показана достоверная корреляция данного показателя и прогрессии заболевания (см. Liao L.M. et al. Mitochondrial DNA Copy Number and Risk of Gastric Cancer: a Report from the Shanghai Women's Health Study // Cancer Epidemiol Biomarkers Prev; 2011, 20(9); 1944-9).
Результаты другого исследования продемонстрировали достоверную ассоциацию копийности мтДНК с риском малигнизации тканей желудка (см. Fernfndes J. et al. Circulating Mitochondrial DNA Level, a Noninvasive
Biomarker for the Early Detection of Gastric Cancer // Cancer Epidemiol Biomarkers Prev; 2014. 23(11); 2430-8).
Поэтому, в качестве маркеров для прогнозирования вероятности развития метастазов в лимфоузлы у пациентов с диагнозом рак желудка адекватно использование показателя относительной копийности HV2.
Из патентных источников известно следующее:
«Способ прогнозирования метастазов у больных раком желудка» (см. патент RU №2445632 С1, опубл. 20.03.2012. Бюл. №8). Сущностью способа является то, у больных раком желудка определяют маркер пролиферативной активности Ki-67 и маркеры апоптоза р53 и bcl-2. Проводят иммуногистохимическое исследование и устанавливают, что при абсолютных значениях экспрессии при перстневидно-клеточном раке: р53 - 10%, bcl-2 - 10%, Ki-67 - 12%; при недифференцированном раке: р53 - 13%, bcl-2 - 11%, Ki-67 - 9%; при аденокарциноме: р53 - 10%, bcl-2 - 9%, Ki-67 - 12%) прогнозируют возникновение метастазов в лимфоузлах. При р53 - 6%, bcl-2 - 5%, Ki-67 - 10% прогнозируют отсутствие метастатического поражения лимфоузлов.
«Способ прогнозирования метастазирования опухолевого процесса у больных раком желудка» (см. патент RU 2455924 С1, опубл. 20.07.2012, Бюл. №20). В периферической венозной крови обследуемых лиц определяют абсолютное содержание моноцитов и концентрацию фактора некроза опухоли альфа (TNF-α). При содержании моноцитов менее 0,35×109 кл/л и TNF-α более 55 пг/мл прогнозируют высокую вероятность метастазирования.
Способ позволяет сократить время и упростить методику прогнозирования, так как позволяет использовать материалы, реактивы и методы исследования, широко применяемые в стандартной клинико-лабораторной практике.
Однако эти способы принципиально отличаются от нашего, обладают меньшей чувствительностью или специфичностью, чем предлагаемая нами тест-система.
В патенте «Способ прогнозирования развития метастазов у больных раком желудка» (см. патент RU 2624505 С1, опубл. 04.07.2017, Бюл. №19) осуществляют амплификацию фрагментов генетических локусов В2М, HV2 и CFLAR методом полимеразной цепной реакции в реальном времени с помощью набора высокоспецифичных праймеров на матрице выделенной ДНК, проводят количественную интерпретацию результатов амплификации и расчет относительной копийности генов по формуле rC=2-(Ct(ген мишень)-Ct(В2М)) (rc - относительная копийность гена в опухолевой ткани, Ct - среднее значение сигналов флюоресценции), сравнивают полученные значения относительной копийности генов с прогностическими, и при значениях rCHV2<870 и rCCFLAR>0,40 прогнозируют отсутствие метастазов, а при значениях rCHV2>870 и rCCFLAR<0,40 прогнозируют развитие метастазов.
Однако предлагаемая авторами система более сложна для клинической реализации, так как обладает большей сложностью в интерпретации полученных результатов, и имеет более высокую себестоимость проведения одного исследования в пересчете на одного пациента.
Анализ патентных источников (www.fips.ru) также показал отсутствие действующих патентов и заявок на изобретение «Тест-система для прогнозирования развития метастазов у больных раком желудка на основании определения числа копий HV2 мтДНК».
Техническим результатом заявляемого изобретения является создание и внедрение новой, простой в исполнении, не дорогостоящей и точной тест-системы с уникальными высокоспецифичными последовательностями синтетических олигонуклеотидов (праймеров) для прогнозирования развития метастазов у больных раком желудка.
Технический результат достигается тем, что тест-система что содержит реагенты для амплификации ДНК в режиме реального времени (ПЦР-РВ) и контрольные смеси, смесь для ПЦР-РВ реакции, содержащую 0,57 мМ dNTPs, 7,1 мМ MgCl2, 2,7-кратный ПЦР-буфер с 2,9-кратной концентрацией красителя EvaGreen Dye и 7,1% ДМСО, ДНК-полимеразу Thermus aquaticus 5 ед/мкл и высокоспецифичные праймеры для генов HV2 и В2М с концентрацией 1,8 мкМ каждого в водном растворе, праймеры для гена HV2: прямой 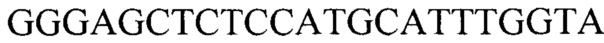 , обратный
, обратный 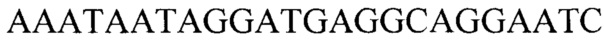 ; для гена В2М: прямой
; для гена В2М: прямой 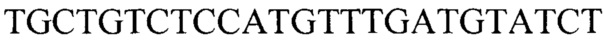 , обратный
, обратный 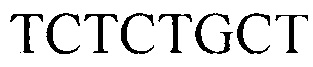
 .
.
Заявленный анализ основан на определении количества копий локуса HV2 относительно референсного локуса В2М (β-2 микроглобулин) в опухолевой ткани желудка, и последующем сравнении полученных значений с интервалом копийности rCHV2 характерным для развития метастазов или их отсутствия.
Заявленная тест-система включает следующие приемы: выделение тотальной ДНК из тканевых проб или из парафиновых блоков с помощью метода фенол-хлороформной экстракции; определение относительной копийности генетических локусов методом ПЦР-РВ в присутствии красителя EVA-Green и специфичных праймеров на матрице выделенной ДНК; анализ первичных данных с помощью программного продукта амплификатора; расчет относительной копийности гена (rC) на основании соотношения сигналов, продуцируемых амплификатами изучаемой и референсной последовательностей, сравнением rC пробы с прогностическими значениями копийности rC стандарт, определенными для больных раком желудка с метастазами или без метастазов в лимфоузлах.
Заявленная тест-система, рассчитанная на 50 определений, включает:
1. Смесь для ПЦР-РВ реакции (Mix_PCR) - 1500 мкл, содержащую 0,57 мМ dNTPs, 7,1 мМ MgCl2, 2,7 кратный ПЦР-буфер с 2,9 кратной концентрацией красителя EvaGreen Dye и 7,1% ДМСО.
2. ДНК-полимеразу Thermus aquaticus 5 ед/мкл (Taq) - 50 мкл
3. Смесь прямого и обратного праймеров с концентрацией 1,8 мкМ каждого для локуса HV2 (HV2_Mix) - 500 мкл (смесь включает Milli-Q воду для ПЦР - реакции)
4. Смесь прямого и обратного праймеров с концентрацией 1,8 мкМ каждого для гена В2М (RefMix)) - 1500 мкл (смесь включает Milli-Q воду для ПЦР - реакции)
5. Контроль реакционной смеси (стандартная ДНК с концентрацией 2 нг/мкл) - 500 мкл
6. Отрицательный контроль (контроль без матрицы, Milli-Q вода обработанная DEPC) - 500 мкл.
Из расчета на одну ПЦР-РВ реакцию смесь должна содержать перечисленные выше компоненты в следующем соотношении:
7,0 мкл Mix_PCR+0,2 мкл Taq+6,8 мкл HV2_Mix (или Ref_Mix)+6 мкл матрицы*
* - ДНК нормализованная до концентрации 2 нг/мкл, отрицательный контроль или контроль реакционной смеси.
Для тест-системы были разработаны специфичные олигонуклеотидные прямые и обратные праймеры для локусов HV2 и В2М. Дизайн специфичных олигонуклеотидных праймеров (таблица 1) осуществлялся с использованием референсных последовательностей NCBI GenBank на основе следующих принципов: область отжига олигонуклеотидных праймеров должна быть в диапазоне 58-63°C; GC-состав в диапазоне 40-60%; в последовательности праймера должны отсутствовать стабильные вторичные структуры - шпильки и димеры, e-value последовательности праймера должно стремится к нулю и быть не больше 0,05, a query coverage (покрытие целевой последовательности) 100% (для версии BLASTN 2.3.1+), температуры отжига
праймеров (forward и reverse) не должны различаться друг от друга более чем на 0,5°.

Работу с тест-системой, содержащей разработанные специфичные олигонуклеотидные праймеры, осуществляют следующим образом.
На первом этапе отбираются образцы опухолевых тканей из операционного или биопсийного материала. Для транспортировки в лабораторию и хранения образцы замораживаются в жидком азоте.
Фрагменты ткани измельчаются скальпелем и/или ножницами, затем растираются в фарфоровых ступках в присутствии лизирующего SDS-содержащего буфера. К лизатам добавляется протеиназа К и инкубируется при t=56°C в течение 1 часа.
ДНК выделяется из прозрачного лизата тканей с использованием фенол-хлороформной экстракции (см. Корниенко И.В., Водолажский Д.И., Вейко В.П. и др. Подготовка биологического материала для молекулярно-генетических идентификационных исследований при массовом поступлении неопознанных тел. - Ростов-н/Д: ООО Ростиздат, 2001). Концентрация полученных препаратов ДНК измеряется на флюориметре. Для проведения ПЦР-РВ концентрацию ДНК в каждом образце нормализуют до 2 нг/мкл. Реагенты для выделения ДНК и определения концентрации ДНК не входят в состав тест-системы.
Анализируемые последовательности генетических локусов амплифицировали в 20 мкл ПЦР-смеси, содержащей 12 нг ДНК, 0,20 мМ
dNTPs, 2,5 мМ MgCl2, 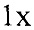 ПЦР-буфер,
ПЦР-буфер, 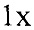 краситель EvaGreen, 2,5% ДМСО и 0,05 е.а./мкл реакционной смеси ДНК-полимеразы Thermus aquaticus, и по 612 нМ прямого и обратного праймеров для референсного гена или гена-мишени.
краситель EvaGreen, 2,5% ДМСО и 0,05 е.а./мкл реакционной смеси ДНК-полимеразы Thermus aquaticus, и по 612 нМ прямого и обратного праймеров для референсного гена или гена-мишени.
Количественную ПЦР-РВ амплификацию проводили на термоциклере по следующей программе: t=95°C в течение 4 мин. 40 циклов: t=95°C в течение 10 с, t=58°C в течение 30 с, t=72°C в течение 30 с. Разработанные праймеры обеспечивали специфичную амплификацию необходимого количества продукта и не образовывали между собой высокоэнергетических внутренних структур: шпилек и дуплексов.
Для выполнения анализа необходимо провести две амплификации (реакции ПЦР-РВ). В первой проверяется качество ДНК и работоспособность тест системы. Реакция проводится с использование смеси праймеров для В2М. Дальнейшее использование ДНК в тест-системе и тест-системы возможно, если соблюдаются следующие условия:
1) CtB2M для образца ДНК не превышает 26 цикла.
2) CtB2M контроля реакционной смеси должно быть не выше 24 цикла
3) CtB2M для отрицательного контроля должен отсутствовать.
Во второй амплификации определяется уровень сигналов, продуцируемых амплификатами локусов HV2 и референсного В2М.
Относительную копийность локуса HV2 вычисляется следующим образом:
- рассчитывали медиану Ct по трем повторам для целевого локуса HV2 и референсного В2М,
- далее рассчитывали величину ΔCt=Ct(HV2)-Ct(В2М)
- копийность генетического локуса относительно референсного гена (rC) рассчитывали по формуле 2-ΔCt.
Далее сравнивают полученные значения rC с интервалом прогностического коэффициента копийности, и при значениях rCHV2<800 прогнозируют отсутствие метастазов, а при значениях rCHV2>1000 прогнозируют развитие метастазов, при значениях rCHV2 между указанными интервалами считают полученный результат неопределенным.
Для доказательства прогностической ценности предлагаемой тест-системы приводится 2 выписки из историй болезни.
1) Больная Д., 1942 г.р., госпитализирована в отделении абдоминальной онкологии №1 РНИОИ 19.11.2014 г. с верифицированным диагнозом рак желудка, ФГС 09.10.2014 Cancer субкардиального отдела желудка. Атрофический анацидный (РН-5,0) Нр-не ассоциированный гастрит. Дуоденит.
При СРКТ органов грудной клетки, брюшной полости и малого таза 02.10.2014 г. перигастральных, периинтестинальных образований не выявлено. Легочная ткань - с обеих сторон в легких диффузный пневмосклероз, что позволило предположить до операции стадию II, T3NxM0. 19.11.2014 г. Лапаротомия, гастрэктомия с расширенной лимфаденкэктомией. При макроскопическом исследовании в удаленном желудке обнаружена опухоль до 6 см в диаметре по малой кривизне, инфильтративно язвенного типа, увеличенные лимфоузлы вдоль левых желудочных сосудов (до 10).
Результаты оценки копийности в биоптате у данной пациентки: rCHV2=1021,2 (находится в границах прогностического интервала развития метастазов rCHV2(прогност)>1000).
По данным патоморфологического исследования после операции: G2 аденокарцинома с изъязвлением инвазией всей толщи стенки желудка и подлежащей жировой ткани; в 1 из 10 лимфоузлов-метастаз аденокарциномы. Таким образом, степень распространения процесса, согласно классификации TNM соответствовала T3N1M0.
2) Больная Ш., 1940 г.р., госпитализирована в отделении абдоминальной онкологии №1 РНИОИ 30.06.2015 г. с верифицированным диагнозом рак желудка. ФГДС 17.06.2015 рак антрального отдела желудка, гистологическое исследование - малодифференцированная аденокарцинома.
КТ брюшной полости и забрюшинного пространства 23.06.2015 КТ-признаки диффузных изменений паренхимы печени по типу стеатоза, хронического холецистита, густой желчи в полости желчного пузыря, хронического панкреатита, признаков метастатического поражения не выявлено, что позволило предположить до операции стадию II, T3NxM0.
02.07.2015 была выполнена операция: дистальная субтотальная резекция желудка по Бильрот 2 с расширенной лимфаденэктомией.
При макроскопическом исследовании в удаленной части желудка обнаружена опухоль в выходном отделе до 6 см в диаметре, инфильтративно-язвенного типа, на разрезе - белесоватого цвета, в большом и малом сальнике увеличенных лимфоузлов не выявлено.
Результаты оценки копийности в биоптате у данной пациентки: rCHV2=481,9 (находится в границах прогностического интервала отсутствия метастазов rCHV2(прогност)<800).
По данным патоморфологического исследования после операции - G2-3 аденокарцинома с инвазией в клетчатку. Метастазов опухоли в лимфоузлах нет. Таким образом, степень распространения процесса, согласно классификации TNM соответствовала T4aN0M0.
Предлагаемым способом было осуществлено прогнозирование вероятности развития метастазов у 30 пациентов с диагностированным раком желудка.
Тест-система для прогнозирования развития метастазов у больных раком желудка на основании определения числа копий HV2 мтДНК позволяет с высокой точностью прогнозировать развитие такого заболевания как рак желудка, а именно развитие метастазов в лимфатические узлы.
Заявляемая тест-система, включает разработанные нами праймеры и является экономически оправданной для уточнения особенностей течения заболевания и дает возможность скорректировать тактику лечения, осуществляется в условиях стандартной лаборатории молекулярной биологии (ПЦР), без использования специального дорогостоящего оборудования; обладает высокой чувствительностью и специфичностью, осуществление анализа возможно с операционными биоптатами и парафиновыми блоками (FFPE-блоки), занимает не более 8 часов (с учетом подготовительных этапов), и не более 3 часов (при непосредственном использовании тест-системы).
Тест-система для прогнозирования развития метастазов у больных раком желудка на основании определения числа копий HV2 мтДНК, содержащая реагенты для амплификации ДНК в режиме реального времени (ПЦР-РВ) и контрольные смеси, смесь для ПЦР-РВ реакции, содержащую 0,57 мМ dNTPs, 7,1 мМ MgCl, 2,7-кратный ПЦР-буфер с 2,9-кратной концентрацией красителя EvaGreen Dye и 7,1% ДМСО, ДНК-полимеразу Thermus aquaticus 5 ед./мкл и высокоспецифичные праймеры для генов HV2 и В2М с концентрацией 1,8 мкМ каждого в водном растворе, праймеры для гена HV2: прямой GGGAGCTCTCCATGCATTTGGTA, обратный AAATAATAGGATGAGGCAGGAATC; для гена В2М: прямой TGCTGTCTCCATGTTTGATGTATCT, обратный TCTCTGCTCCCCACCTCTAAGT.
