Результат интеллектуальной деятельности: ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО И УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА
Вид РИД
Изобретение
Область техники
[0001]
Настоящее изобретение относится к противоопухолевому средству, содержащему комбинацию лекарственных средств трифлуридина и типирацила гидрохлорида, и антитела против VEGF или антитела против EGFR, и усилителю противоопухолевого эффекта антитела против VEGF или антитела против EGFR.
Предшествующий уровень техники
[0002]
Трифлуридин (также известный как α,α,α-трифтортимидин. Далее в настоящем описании также обозначаемый как "FTD") проявляет противоопухолевые эффекты посредством ингибирования синтеза ДНК в результате ингибирования продукции тимидилата и посредством блокирования функционирования ДНК в результате встраивания в ДНК. При этом типирацил гидрохлорид (химическое название: 5-хлор-6-[(2-иминопирролидин-1-ил)метил]пиримидин-2,4(1H,3H)-дион гидрохлорид. Далее в настоящем описании, также обозначаемый как "TPI") ингибирует тимидинфосфорилазу. Известно, что противоопухолевый эффект FTD повышается TPI, супрессирующим in vivo расщепление FTD тимидинфосфорилазой (патентный документ 1). В настоящее время, противоопухолевое средство, содержащее FTD и TPI в молярном соотношении 1:0,5 (далее в настоящем описании также обозначаемое как "комбинированное лекарственное средство FTD/TPI"), находится в стадии разработки в качестве терапевтического средства для солидного рака, такого как колоректальный рак (непатентные документы 1 и 2).
Кроме того, исследуют способы комбинированного лечения для повышения противоопухолевого эффекта комбинированного лекарственного средства FTD/TPI и, к настоящему времени, предполагают наличие комбинированного эффекта комбинированного лекарственного средства и иринотекана и оксалиплатина (непатентные документы 3 и 4).
[0003]
При этом, в последние годы активно осуществляют разработку лекарственного средства, направленного против молекулы, участвующей в ангиогенезе или клеточной пролиферации, такой как фактор роста эндотелия сосудов (далее в настоящем описании обозначаемый как VEGF) и рецептор эпидермального фактора роста (далее в настоящем описании обозначаемый как EGFR). Например, в случае VEGF в качестве лекарственного средства для молекулярно-таргетной терапии в клинических условиях в качестве терапевтического средства в случае карциномы, такой как колоректальный рак, немелкоклеточный рак легких, рак молочной железы и почечно-клеточный рак, используют бевацизумаб, являющийся гуманизированным моноклональным антителом против VEGF. Кроме того, в случае EGFR в качестве лекарственного средства для молекулярно-таргетной терапии в клинических условиях в качестве терапевтического средства в случае колоректального рака и рака головы и шеи используют цетуксимаб, являющийся химерным моноклональным антителом человека/мыши против EGFR, и в клинических условиях в качестве терапевтического средства в случае колоректального рака используют панитумумаб, являющийся полностью человеческим моноклональным антителом против EGFR, соответственно (непатентные документы 5, 6 и 7).
Как описано выше, хотя активно ведется разработка терапии, включающей комбинированное лекарственное средство FTD/TPI, комбинированное лечение с использованием комбинированного лекарственного средства FTD/TPI и лекарственного средства для молекулярно-таргетной терапии в случае VEGF или EGFR совершенно неизвестно.
Список ссылок
Патентные документы
[0004]
Патентный документ 1: WO96/30346 A
Непатентные документы
[0005]
Непатентный документ 1: Invest New Drugs 26(5): 445-54, 2008.
Непатентный документ 2: Lancet Oncol. 13(10): 993-1001, 2012.
Непатентный документ 3: Eur J Cancer. 43(1): 175-83, 2007.
Непатентный документ 4: Br J Cancer. 96(2): 231-40, 2007.
Непатентный документ 5: Curr Oncol Rep. 14(4): 277-84, 2012.
Непатентный документ 6: Curr Cancer Drug Targets. 10(1): 80-95, 2010.
Непатентный документ 7: Pathol Oncol Res. 16(2): 143-8, 2010.
Сущность изобретения
Техническая задача
[0006]
Целью настоящего изобретения является новый способ лечения злокачественного новообразования с использованием комбинированного лекарственного средства FTD/TPI, демонстрирующего в высшей степени исключительный противоопухолевый эффект и меньше неблагоприятных эффектов.
Решение задачи
[0007]
При рассмотрении таких ситуаций авторы настоящего изобретения обнаруживали, что одновременное использование комбинированного лекарственного средства FTD/TPI и антитела против VEGF или антитела против EGFR снижает частоту неблагоприятных эффектов и значительно повышает противоопухолевый эффект антитела против VEGF или антитела против EGFR.
[0008]
Т.е. настоящее изобретение относится к следующим пп. [1]-[21].
[0009]
[1] Противоопухолевое средство, где комбинированное лекарственное средство, содержащее трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, и антитело против VEGF или антитело против EGFR вводят в комбинации.
[2] Противоопухолевое средство по п. [1], где антитело против VEGF является бевацизумабом.
[3] Противоопухолевое средство по п. [1] или [2], где антитело против EGFR является цетуксимабом или панитумумабом.
[4] Противоопухолевое средство по любому из пп. [1]-[3], где злокачественным новообразованием-мишенью является колоректальный рак, рак легких, рак молочной железы, рак поджелудочной железы или рак желудка.
[5] Усилитель противоопухолевого эффекта, включающий комбинированное лекарственное средство, содержащее трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, для усиления противоопухолевого эффекта антитела против VEGF или антитела против EGFR.
[6] Противоопухолевое средство, включающее комбинированное лекарственное средство, содержащее трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, для лечения пациента со злокачественным новообразованием, которому вводят антитело против VEGF или антитело против EGFR.
[7] Набор препарата, включающий комбинированное лекарственное средство, содержащее трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, и инструкцию, где
в инструкции описывают, что комбинированное лекарственное средство, содержащее трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, вводят пациенту со злокачественным новообразованием в комбинации с антителом против VEGF или антителом против EGFR.
[8] Комбинированное лекарственное средство, содержащее трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, для усиления противоопухолевого эффекта антитела против VEGF или антитела против EGFR.
[9] Комбинированное лекарственное средство, содержащее трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, для лечения пациента со злокачественным новообразованием, которому вводят антитело против VEGF или антитело против EGFR.
[10] Комбинированное лекарственное средство по п. [8] или [9], где антитело против VEGF является бевацизумабом.
[11] Комбинированное лекарственное средство по любому из пп. [8]-[10], где антитело против EGFR является цетуксимабом или панитумумабом.
[12] Комбинированное лекарственное средство по любому из пп. [8]-[11], где злокачественным новообразованием-мишенью является колоректальный рак, рак легких, рак молочной железы, рак поджелудочной железы или рак желудка.
[13] Применение комбинированного лекарственного средства, содержащего трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, для получения усилителя противоопухолевого эффекта, повышающего противоопухолевый эффект антитела против VEGF или антитела против EGFR.
[14] Применение комбинированного лекарственного средства, содержащего трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, для получения противоопухолевого средства для пациента со злокачественным новообразованием, которому вводят антитело против VEGF или антитело против EGFR.
[15] Применение по п. [13] или [14], где антитело против VEGF является бевацизумабом.
[16] Применение по любому из пп. [13]-[15], где антитело против EGFR является цетуксимабом или панитумумабом.
[17] Применение по любому из пп. [13]-[16], где злокачественным новообразованием-мишенью является колоректальный рак, рак легких, рак молочной железы, рак поджелудочной железы или рак желудка.
[18] Способ лечения злокачественного новообразования, включающий введение комбинированного лекарственного средства, содержащего трифлуридин и типирацил гидрохлорид в молярном соотношении 1:0,5, и антитела против VEGF или антитела против EGFR в комбинации.
[19] Способ по п. [18], где антитело против VEGF является бевацизумабом.
[20] Способ лечения по п. [18], где антитело против EGFR является цетуксимабом или панитумумабом.
[21] Способ лечения по любому из пп. [18]-[20], где злокачественным новообразованием-мишенью является колоректальный рак, рак легких, рак молочной железы, рак поджелудочной железы или рак желудка.
Полезные эффекты изобретения
[0010]
В соответствии с противоопухолевым средством по настоящему изобретению, можно осуществлять лечение злокачественных опухолей, супрессирующее возникновение неблагоприятных эффектов и проявляющее высокий противоопухолевый эффект, и, таким образом, достигать длительной выживаемости пациента со злокачественным новообразованием.
Краткое описание чертежей
[0011]
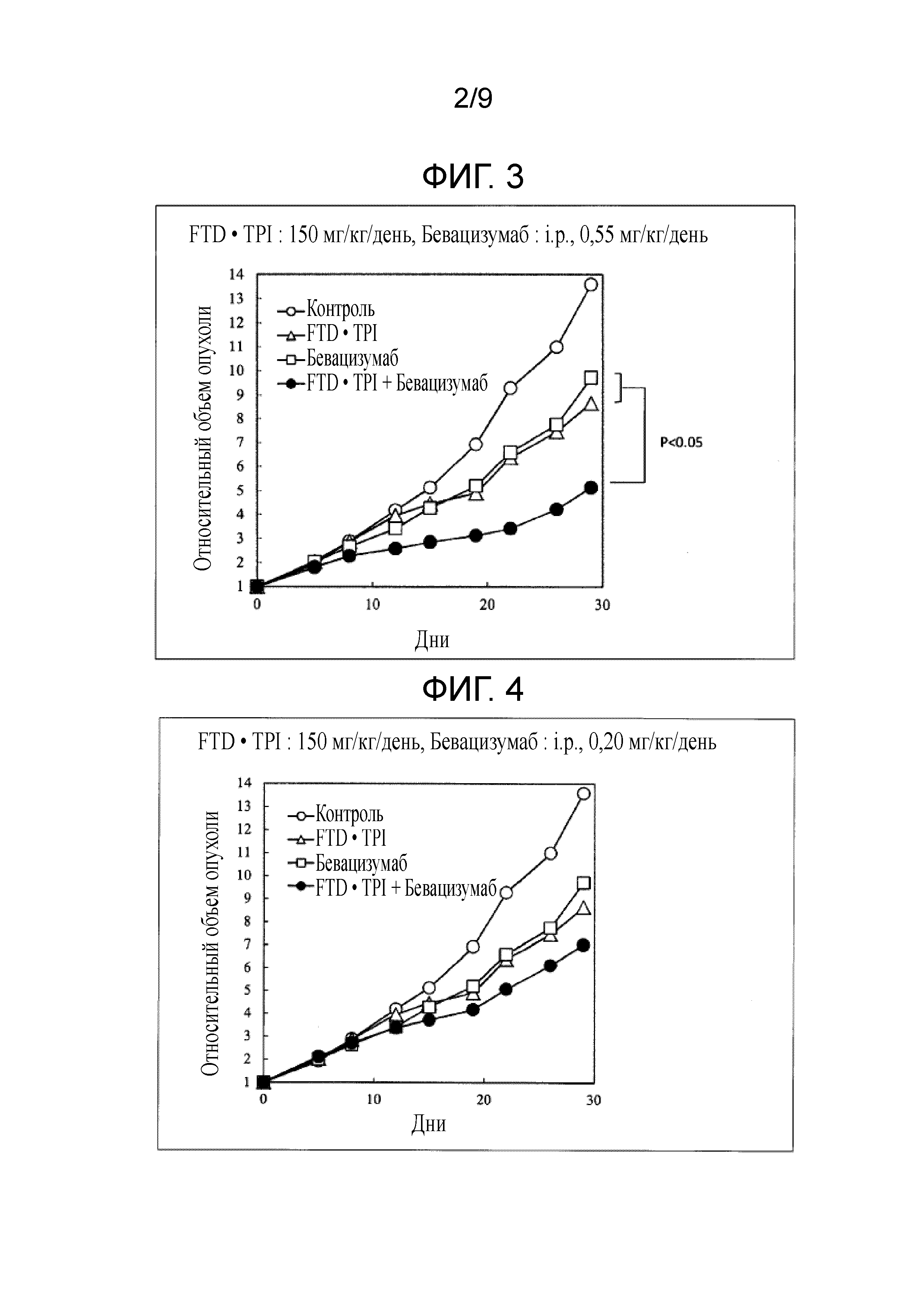
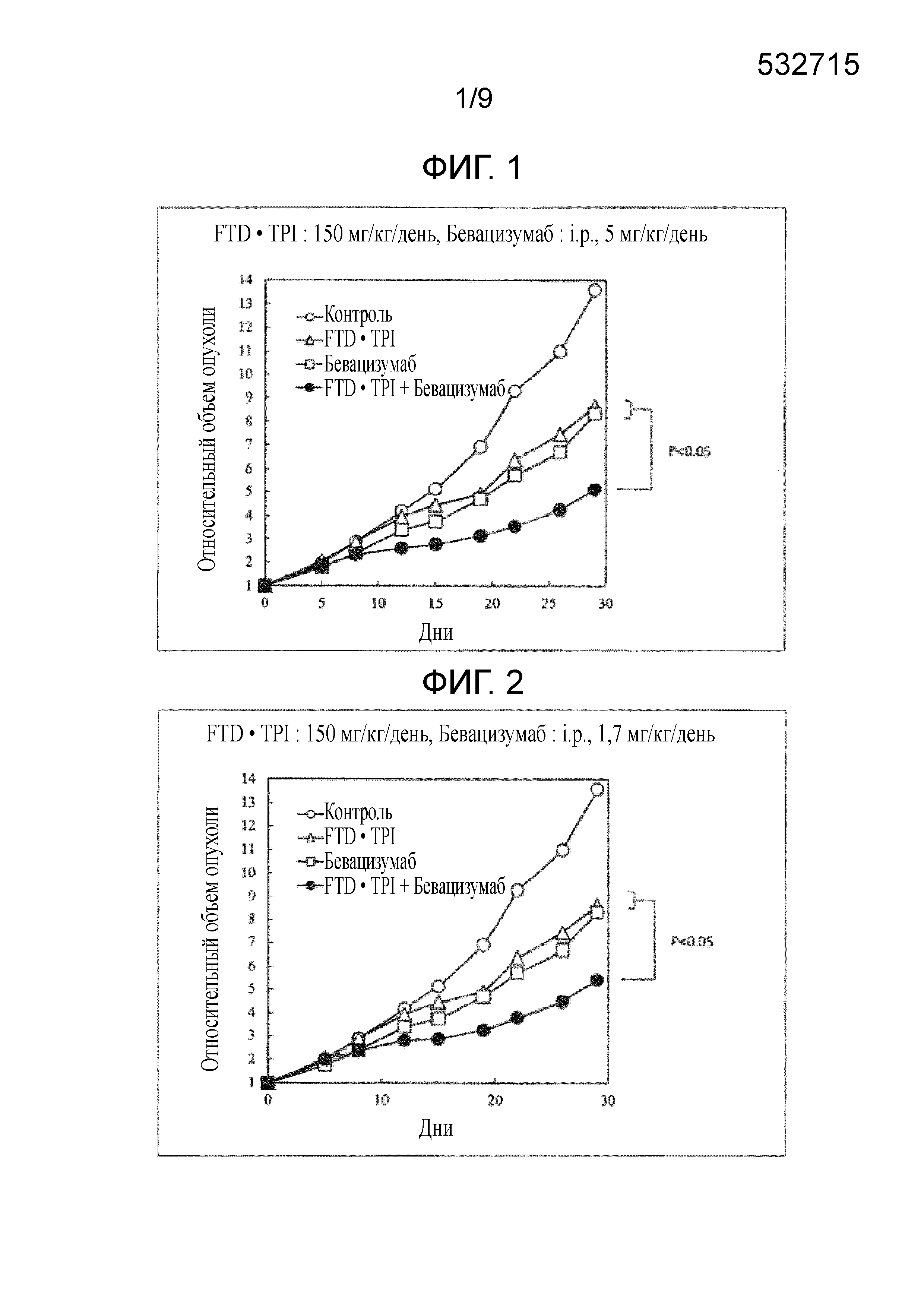
Фиг. 1 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и бевацизумаба в отношении рака толстого кишечника.
Фиг. 2 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и бевацизумаба в отношении рака толстого кишечника.
Фиг. 3 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и бевацизумаба в отношении рака толстого кишечника.
Фиг. 4 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и бевацизумаба в отношении рака толстого кишечника.
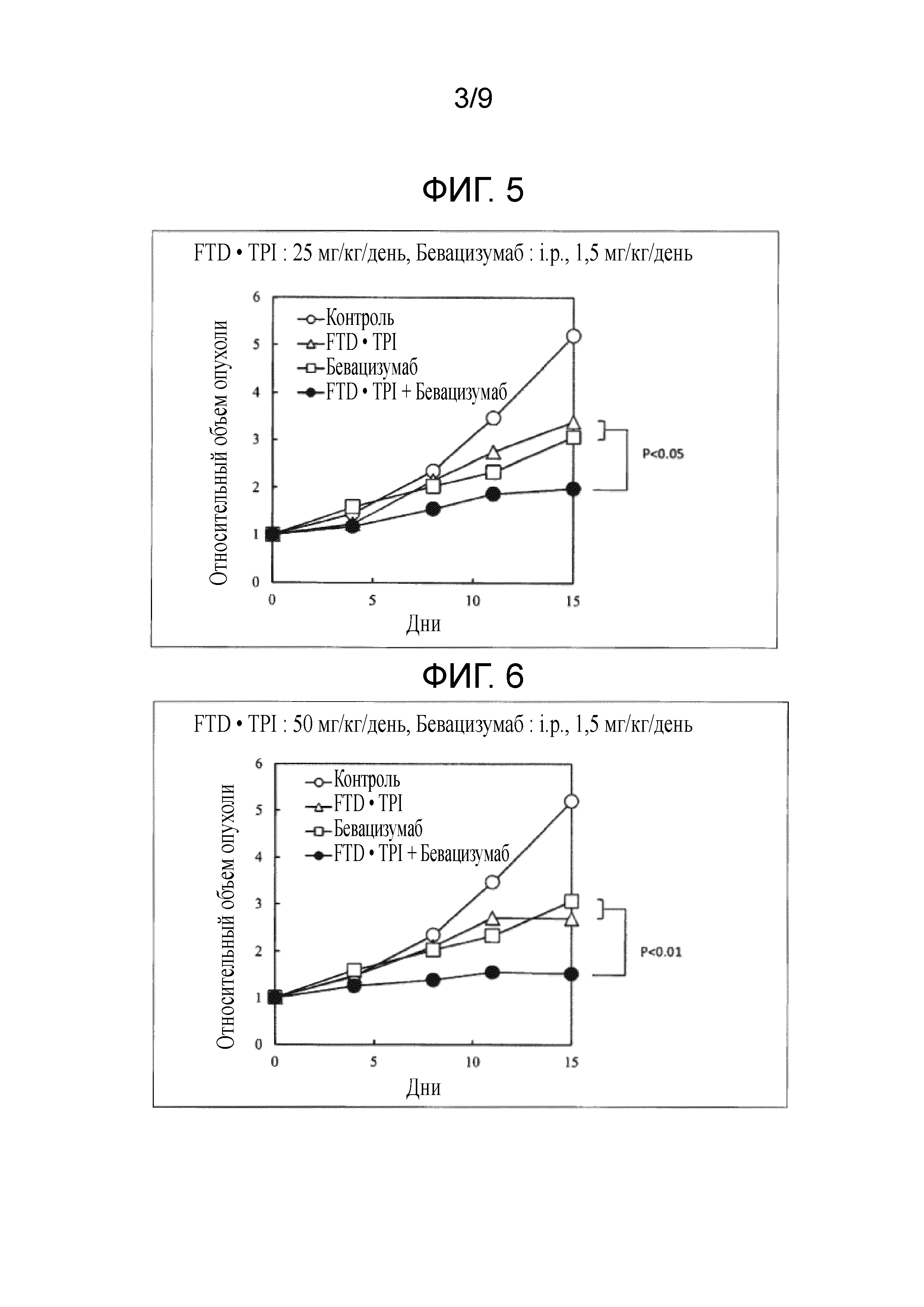
Фиг. 5 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и бевацизумаба в отношении рака толстого кишечника.
Фиг. 6 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и бевацизумаба в отношении рака толстого кишечника.
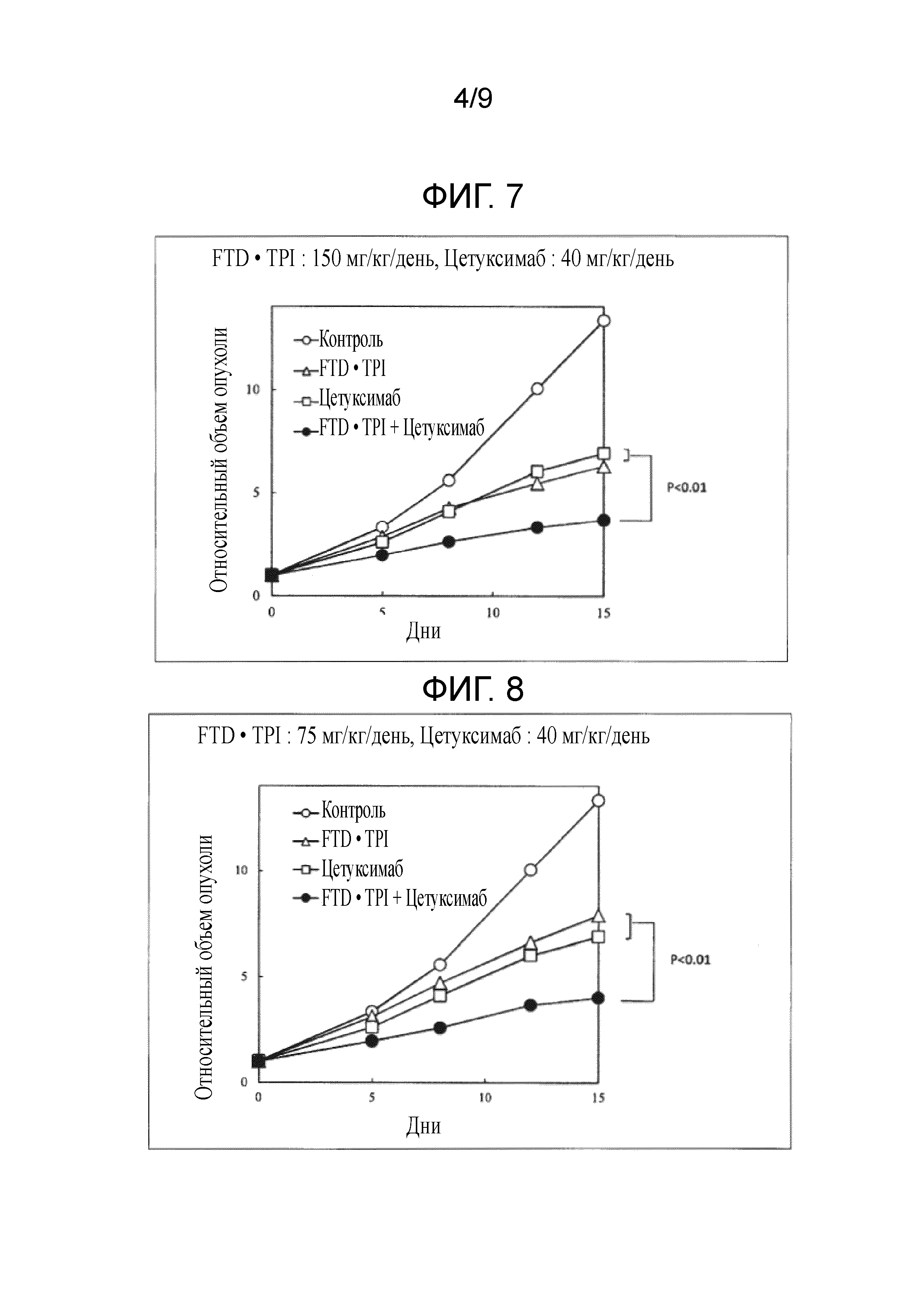
Фиг. 7 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и цетуксимаба в отношении рака толстого кишечника.
Фиг. 8 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и цетуксимаба в отношении рака толстого кишечника.
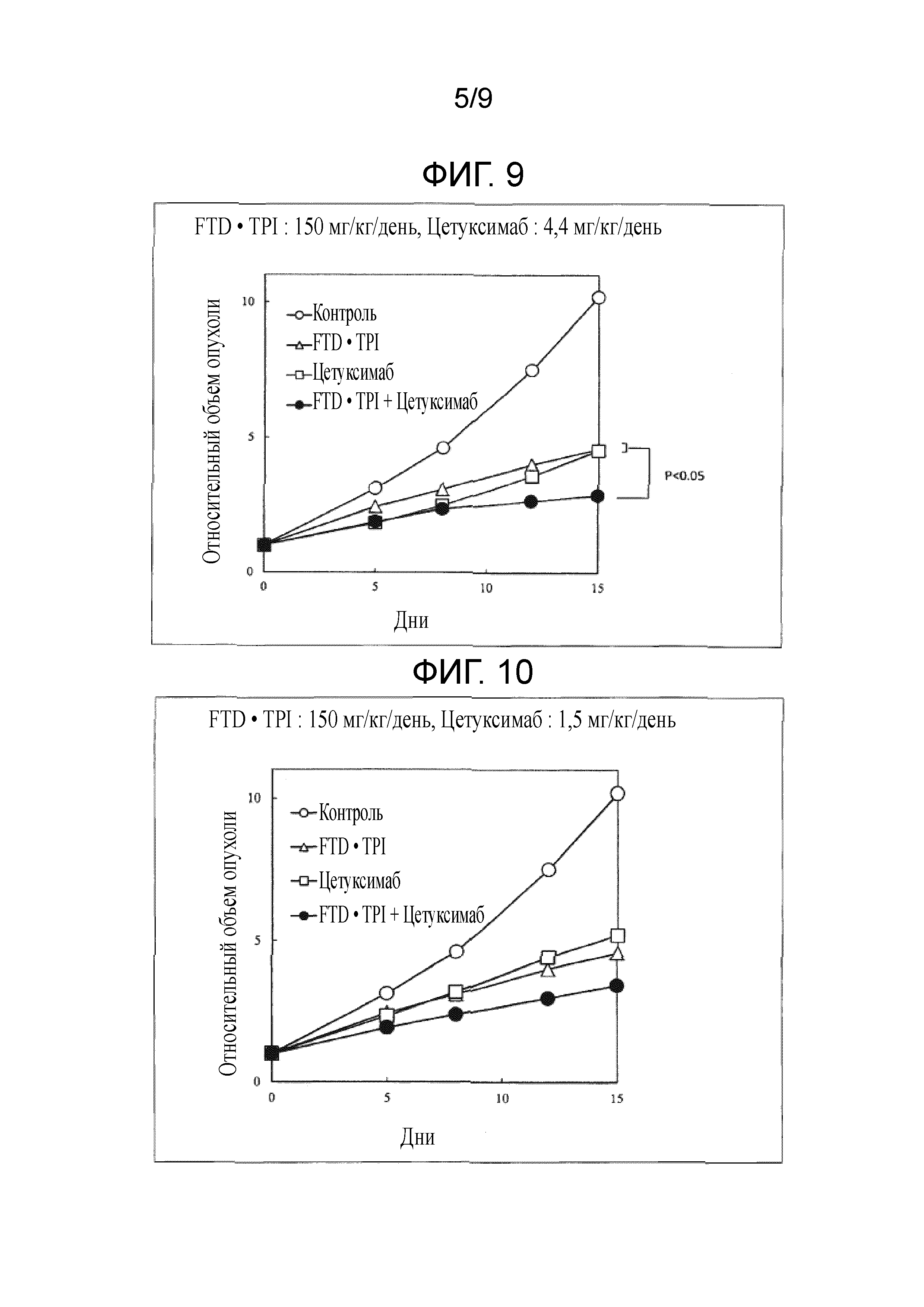
Фиг. 9 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и цетуксимаба в отношении рака толстого кишечника.
Фиг. 10 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и цетуксимаба в отношении рака толстого кишечника.
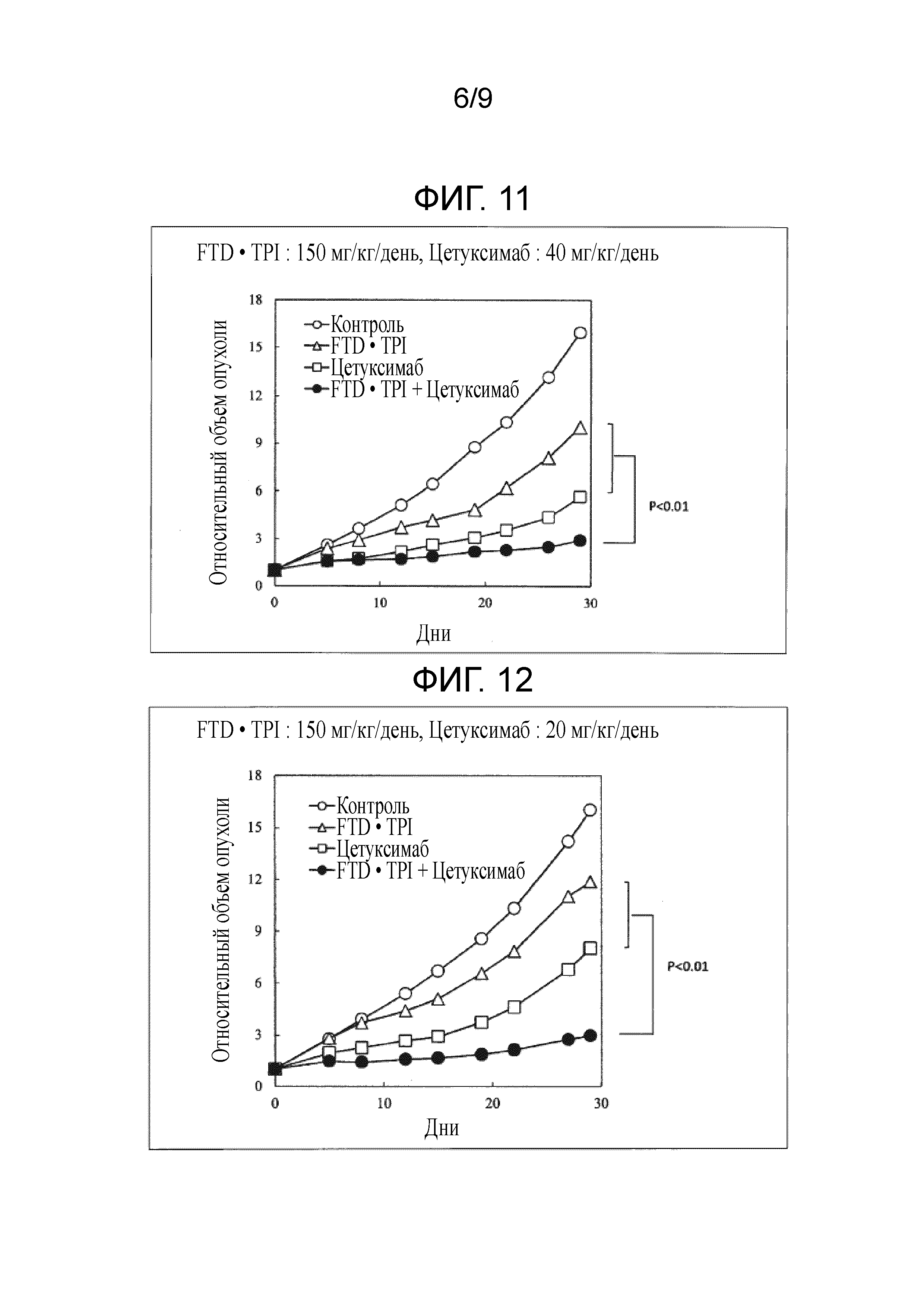
Фиг. 11 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и цетуксимаба в отношении рака толстого кишечника.
Фиг. 12 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и цетуксимаб в отношении рак толстого кишечника.
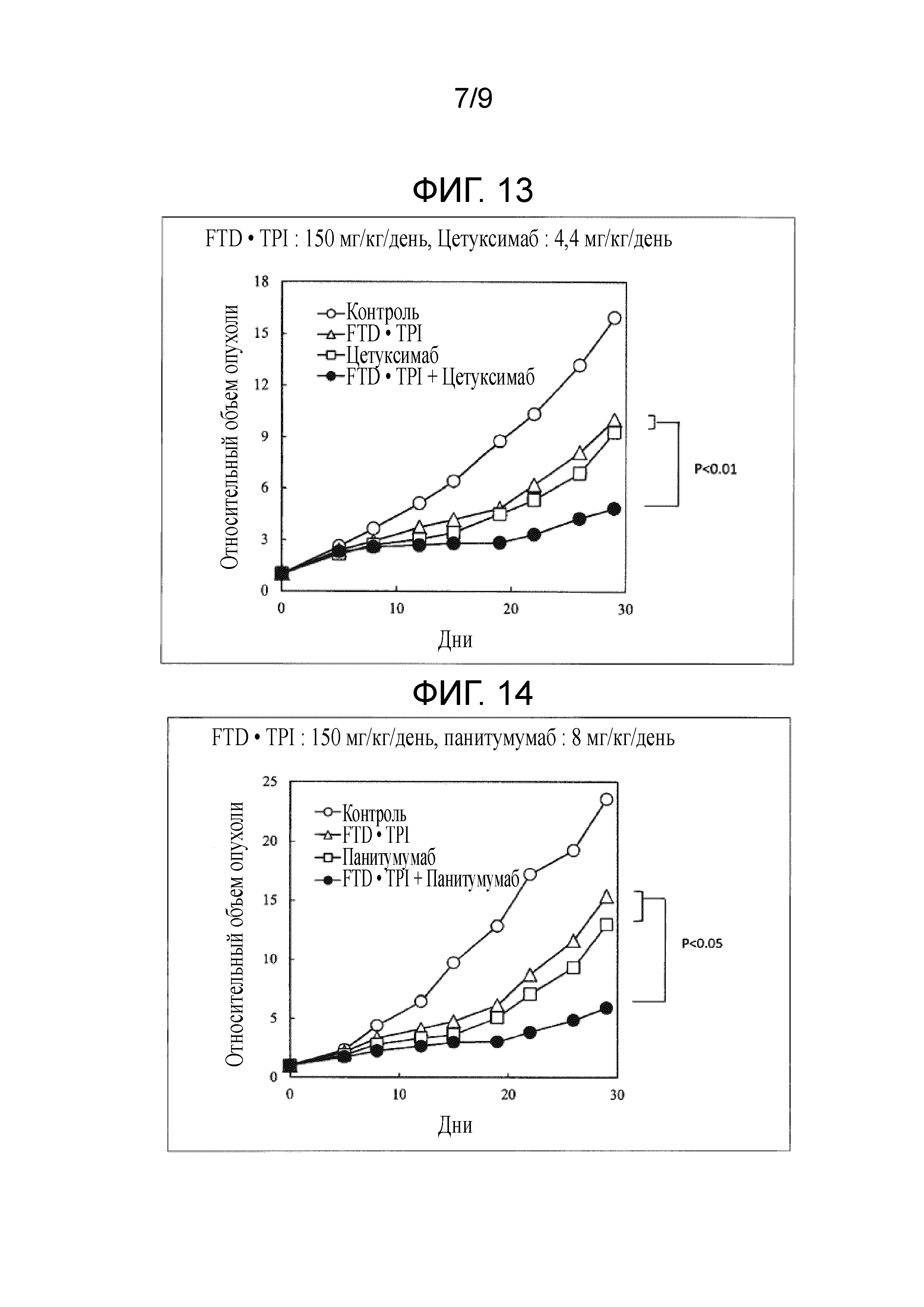
Фиг. 13 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и цетуксимаба в отношении рака толстого кишечника.
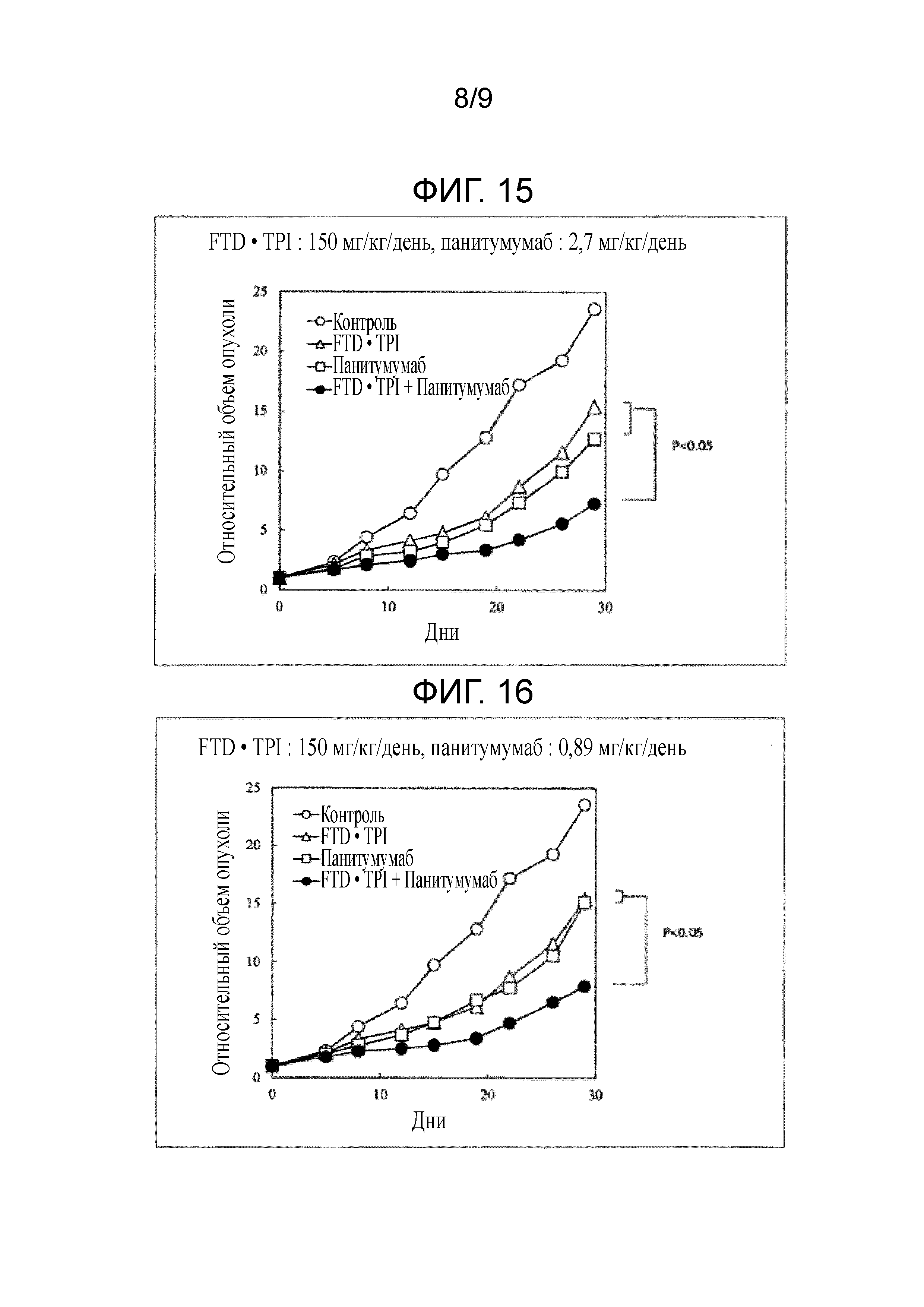
Фиг. 14 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и панитумумаба в отношении рака толстого кишечника.
Фиг. 15 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и панитумумаба в отношении рака толстого кишечника.
Фиг. 16 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и панитумумаба в отношении рака толстого кишечника.
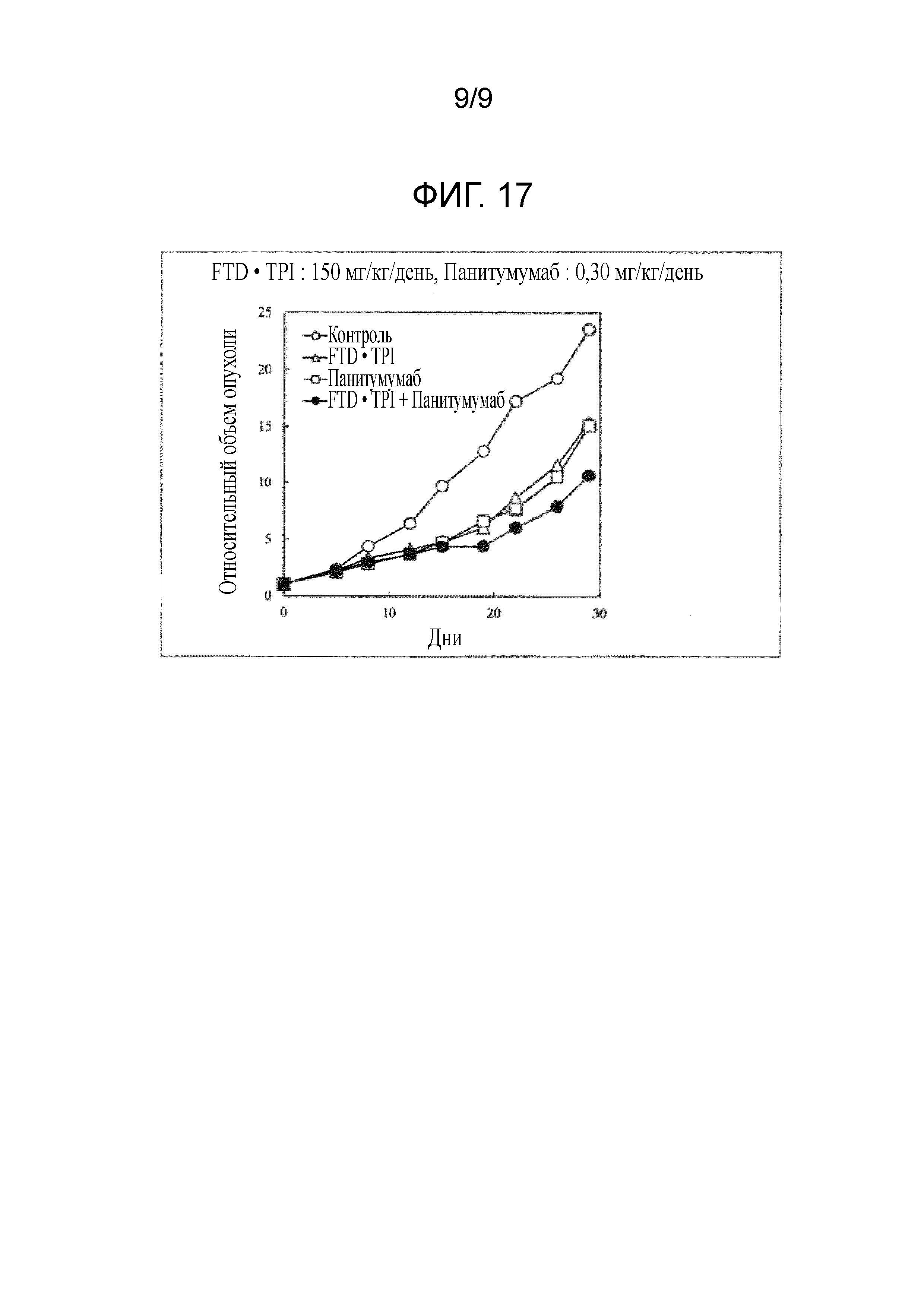
Фиг. 17 является фигурой, на которой показан комбинаторный эффект комбинированного лекарственного средства FTD/TPI и панитумумаба в отношении рака толстого кишечника.
Описание вариантов осуществления
[0012]
Противоопухолевое средство по настоящему изобретению отличается тем, что комбинированное лекарственное средство FTD/TPI и антитело против VEGF или антитело против EGFR вводят в комбинации. Можно дополнительно вводить другое противоопухолевое средство в комбинации при условии, что комбинированное лекарственное средство FTD/TPI и антитело против VEGF или антитело против EGFR вводят в комбинации.
[0013]
Соответственно, FTD и TPI в настоящем изобретении являются известными соединениями, и их можно синтезировать, например, способом, описываемым в публикации WO96/30346 A. Кроме того, также известно комбинированное лекарственное средство, содержащее FTD и TPI в молярном соотношении 1:0,5 (непатентные документы 1 и 2).
[0014]
VEGF, распознаваемый "антителом против VEGF" по настоящему изобретению, может являться любым из VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-D, VEGF-E, PLGF (плацентарного фактора роста)-1 и PLGF-2, представляющих собой семейство VEGF человека, и, предпочтительно, является VEGF-A человека. Нуклеотидная последовательность и аминокислотная последовательность VEGF-A человека зарегистрированы в GenBank под инвентарными номерами NM001171623 и NP001165094, соответственно, и информацию об этих последовательностях можно использовать в настоящем изобретении.
EGFR, распознаваемый "антителом против EGFR" по настоящему изобретению, предпочтительно, является EGFR человека. При этом нуклеотидная последовательность и аминокислотная последовательность EGFR человека зарегистрированы в GenBank под инвентарными номерами NM005228 и NP005219, соответственно, и информацию об этих последовательностях можно использовать в настоящем изобретении.
Кроме того, "антитело против VEGF" и "антитело против EGFR" по настоящему изобретению могут являться моноклональным антителом или поликлональным антителом, или фрагментом антитела, таким как Fab, Fab' и F(ab')2. Кроме того, антитело против VEGF может являться внеклеточным доменом рецептора VEGF. Кроме того, источником происхождения этих антител с точки зрения снижения иммуногенности, предпочтительно, является химерное антитело человека, гуманизированное антитело или антитело человека.
"Антитело против VEGF" и "антитело против EGFR" по настоящему изобретению, как правило, можно производить известным в этой области способом получения антитела. Также можно использовать коммерчески доступное антитело.
"Антитело против VEGF" по настоящему изобретению не имеет конкретных ограничений, если оно является антителом, специфически распознающим VEGF, и его примерами являются бевацизумаб, афлиберцепт, ранибизумаб и икрукумаб, и, предпочтительно, оно является бевацизумабом. В качестве этих антител также можно использовать коммерчески доступные продукты.
"Антитело против EGFR" по настоящему изобретению не имеет конкретных ограничений, если оно является антителом, специфически распознающим EGFR, и его примерами являются цетуксимаб, панитумумаб, матузумаб, нимотузумаб, залутумумаб и нецитумумаб, и, предпочтительно, оно является цетуксимабом или панитумумабом. В качестве этих антител также можно использовать коммерчески доступные продукты.
[0016]
Суточная доза комбинированного лекарственного средства FTD/TPI в противоопухолевом средстве по настоящему изобретению в день введения, предпочтительно, составляет от 17 до 115%, более предпочтительно - от 50 до 100%, более предпочтительно - от 70 до 100%, и особенно предпочтительно - 100% относительно рекомендуемой дозы в случае однократного введения комбинированного лекарственного средства FTD/TPI пациенту со злокачественным новообразованием с точки зрения усиления противоопухолевого эффекта антитела против VEGF или антитела против EGFR посредством комбинированного лекарственного средства FTD/TPI. В частности, доза комбинированного лекарственного средства FTD/TPI, предпочтительно, составляет от 11 до 80 мг/м2/день, более предпочтительно - от 35 до 70 мг/м2/день, более предпочтительно - от 50 до 70 мг/м2/день, и особенно предпочтительно - 70 мг/м2/день в пересчете на FTD.
[0017]
Суточная доза бевацизумаба в противоопухолевом средстве по настоящему изобретению в день введения, предпочтительно, составляет от 4 до 100%, более предпочтительно - от 11 до 100%, и особенно предпочтительно - от 34 до 100% относительно рекомендуемой дозы в случае однократного введения бевацизумаба пациенту со злокачественным новообразованием с точки зрения усиления противоопухолевого эффекта посредством комбинированного лекарственного средства FTD/TPI. В частности, доза бевацизумаба, предпочтительно, составляет от 0,4 до 15 мг/кг/день, более предпочтительно - от 0,4 до 10 мг/кг/день, более предпочтительно - от 1,10 до 10 мг/кг/день, и особенно предпочтительно - от 3,4 до 10 мг/кг/день.
[0018]
Суточная доза цетуксимаба в противоопухолевом средстве по настоящему изобретению в день введения, предпочтительно, составляет от 4 до 100%, более предпочтительно - от 11 до 100%, и особенно предпочтительно - от 50 до 100% относительно рекомендуемой дозы в случае однократного введения цетуксимаба пациенту со злокачественным новообразованием с точки зрения усиления противоопухолевого эффекта цетуксимаба посредством комбинированного лекарственного средства FTD/TPI. В частности, доза цетуксимаба, предпочтительно, составляет от 15 до 400 мг/м2/день, более предпочтительно - от 44 до 400 мг/м2/день, и особенно предпочтительно - от 200 до 400 мг/м2/день.
[0019]
Суточная доза панитумумаба в противоопухолевом средстве по настоящему изобретению в день введения, предпочтительно, составляет от 4 до 100%, более предпочтительно - от 11 до 100%, и особенно предпочтительно - от 34 до 100% относительно рекомендуемой дозы в случае однократного введения панитумумаба пациенту со злокачественным новообразованием с точки зрения усиления противоопухолевого эффекта панитумумаба посредством комбинированного лекарственного средства FTD/TPI. В частности, суточная доза панитумумаба, предпочтительно, составляет от 0,23 до 6 мг/кг/день, более предпочтительно - от 0,67 до 6 мг/кг/день, и особенно предпочтительно - от 2,03 до 6 мг/кг/день.
[0020]
В настоящем изобретении термин "введение в комбинации" означает, что комбинированное лекарственное средство FTD/TPI и антитело против VEGF или антитело против EGFR вводят в комбинации в течение конкретного периода времени в диапазоне достижения эффекта усиления противоопухолевого эффекта антитела против VEGF или антитела против EGFR по настоящему изобретению с одновременной супрессией возникновения неблагоприятных эффектов. Конкретный режим введения противоопухолевого средства по настоящему изобретению можно выбирать соответствующим образом в зависимости, например, от карциномы или стадии заболевания. Режим введения комбинированного лекарственного средства FTD/TPI, предпочтительно, представляет собой введение ежедневно в течение пяти дней и двухдневный перерыв, повторяемые дважды, а затем двухнедельный перерыв. Режим введения антитела против VEGF или антитела против EGFR, предпочтительно, представляет собой введение один раз каждые одну-три недели. Такой режим введения можно осуществлять однократно или повторять два или более раз.
[0021]
Примеры злокачественного новообразования-мишени противоопухолевого средства по настоящему изобретению, в частности, включают рак головы и шеи, рак желудочно-кишечного тракта (например, рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных протоков (например, рак желчного пузыря или желчных протоков), рак поджелудочной железы, рак тонкого кишечника и рак толстого кишечника (например, колоректальный рак, рак толстого кишечника и рак прямой кишки)), рак легких, рак молочной железы, рак яичников, рак матки (например, рак шейки матки и рак тела матки), злокачественную опухоль почки, рак мочевого пузыря и рак предстательной железы. Из них, злокачественное новообразование-мишень противоопухолевого средства по настоящему изобретению с точки зрения противоопухолевого эффекта и неблагоприятных эффектов, предпочтительно, является раком желудочно-кишечного тракта, раком легких или раком молочной железы, более предпочтительно - колоректальным раком, раком легких, раком молочной железы, раком поджелудочной железы или раком желудка, и особенно предпочтительно - колоректальным раком. Злокачественное новообразование в настоящем описании включает не только злокачественные новообразования в первичном очаге, но также и злокачественные новообразования, распространившиеся в другие органы (например, печень). Кроме того, противоопухолевое средство по настоящему изобретению можно использовать в послеоперационной адъювантной химиотерапии, осуществляемой для профилактики рецидива после хирургического удаления опухоли, или может являться предоперационной адъювантной химиотерапией, осуществляемой перед хирургическим удалением опухоли.
[0022]
Противоопухолевое средство по настоящему изобретению составляют во множестве лекарственных форм раздельно для каждого активного ингредиента, т.к. для каждого активного ингредиента способы введения и режимы введения отличаются, и все активные ингредиенты нельзя составить вместе в одной лекарственной форме. Предпочтительно составлять FTD и TPI в виде комбинированного лекарственного средства, а антитело против VEGF и антитело против EGFR - в виде препарата с одним активным ингредиентом.
[0023]
Каждый препарат можно получать и продавать вместе в одной упаковке, подходящей для введения в комбинации, или каждый препарат можно получать и продавать в отдельных упаковках, соответственно, при условии, что каждый активный ингредиент вводят в соответствии с дозой по настоящему изобретению.
[0024]
Лекарственная форма противоопухолевого средства по настоящему изобретению не имеет конкретных ограничений, и ее можно соответствующим образом выбирать в зависимости от терапевтической цели. Примеры лекарственной формы противоопухолевого средства по настоящему изобретению конкретно включают пероральное средство (например, таблетку, таблетку, покрытую оболочкой, порошок, гранулу, капсулу и жидкость), инъекционную форму, суппозиторий, пластырь и мазь. Комбинированное лекарственное средство FTD/TPI, предпочтительно, является пероральным средством, и антитело против VEGF и антитело против EGFR, предпочтительно, находится в инъекционной форме и, особенно предпочтительно, инъекционной форме для внутривенного введения.
[0025]
Противоопухолевое средство по настоящему изобретению, как правило, можно получать известным способом с использованием фармацевтически приемлемых носителей в зависимости от его лекарственной формы. Примеры такого носителя включают различные носители, как правило, используемые в общепринятых лекарственных средствах, например, эксципиент, связывающее средство, дезинтегрирующее средство, смазочное средство, дилюент, солюбилизатор, суспендирующее средство, средство, регулирующее тоничность, вещество, регулирующее pH, буфер, стабилизатор, краситель, вкусовую добавку и ароматизатор.
[0026]
Кроме того, настоящее изобретение также относится к усилителю противоопухолевого эффекта, включающему комбинированное лекарственное средство FTD/TPI, для усиления противоопухолевого эффекта антитела против VEGF или антитела против EGFR у пациента со злокачественным новообразованием (в частности, пациента с колоректальным раком). Усилитель противоопухолевого эффекта имеет описываемую выше лекарственную форму противоопухолевого средства.
[0027]
Настоящее изобретение также относится к противоопухолевому средству, включающему комбинированное лекарственное средство FTD/TPI, для лечения пациента со злокачественным новообразованием, которому вводят антитело против VEGF или антитело против EGFR (в частности, пациента с колоректальным раком). Противоопухолевое средство имеет описываемую выше лекарственную форму.
[0028]
Настоящее изобретение также относится к набору препарата, включающему комбинированное лекарственное средство FTD/TPI и инструкцию, в которой описывают, что комбинированное лекарственное средство FTD/TPI вводят пациенту со злокачественным новообразованием (в частности, пациенту с колоректальным раком) в комбинации с антителом против VEGF или против EGFR. В "инструкции" в настоящем описании можно описывать дозу, описываемую выше, предпочтительно, рекомендуя описываемую выше дозу, является ли это юридически обязательным или нет. В частности, примеры инструкции включают вкладыш в упаковку и публикацию. Кроме того, в набор препарата, включающий инструкцию, можно включать инструкцию, печатая ее на упаковке набора, или ее можно вкладывать вместе с противоопухолевым средством в упаковку набора препарата.
[0029]
Настоящее изобретение также относится к способу лечения злокачественного новообразования, отличающемуся введением комбинированного лекарственного средства FTD/TPI и антитела против VEGF или против EGFR в комбинации. Противоопухолевое средство, содержащее комбинированное лекарственное средство FTD/TPI и антитело против VEGF или против EGFR, имеет описываемую выше лекарственную форму противоопухолевого средства.
Примеры
[0030]
Далее настоящее изобретение будет более конкретно описано с использованием примеров и референсных примеров.
[0031]
Референсный пример
Культивируемые клетки линии злокачественных клеток толстого кишечника человека (KM20C) (1×107 клеток/мышь) трансплантировали в брюшную полость мыши BALB/cA Jcl-nu возрастом пять-шесть недель. Мышей распределяли по группам таким образом, что средняя масса в каждой группе была равной, и день распределения по группам (n=10) считали днем 0.
Получали комбинированное лекарственное средство FTD/TPI (смесь FTD и TPI в молярном соотношении 1:0,5) для достижения 75, 100, 150, 300 и 450 мг/кг/день в пересчете на FTD. Введение лекарственного средства начинали в день 3 и в течение шести недель осуществляли пероральное введение комбинированного лекарственного средства FTD/TPI ежедневно в течение пяти дней с двухдневным перерывом.
В качестве индекса противоопухолевого эффекта проверяли количество выживших мышей в каждой группе и сравнивали время дожития в каждой группе. Результаты представлены в таблице 1.
[0032]
|
[0033]
Как описано в таблице 1, у мышей время дожития являлось более высоким в группе, где вводили 150 мг/кг/день в пересчете на FTD в случае комбинированного лекарственного средства FTD/TPI. В связи с этим, рекомендуемая доза (RD) комбинированного лекарственного средства FTD/TPI у мыши составляет 150 мг/кг/день в пересчете на FTD. В отличие от этого, RD комбинированного лекарственного средства FTD/TPI у человека составляет 70 мг/м2/день в пересчете на FTD. В связи с этим, 150 мг/кг/день у мыши соответствует 70 мг/м2/день у человека.
[0034]
При использовании бевацизумаба безтимусным мышам, которым трансплантировали линию злокачественных клеток молочной железы человека MX-1, в течение трех недель каждые семь дней в брюшную полость вводили дозы 1,25 и 5, 20 мг/кг и исследовали оптимальную дозу. С учетом данных (Bevacizumab Interview Form) о том, что доза 5 мг/кг приводит к наиболее высокой степени ингибирования роста опухоли, и эффект достигал пика при более высокой дозе, чем доза, RD бевацизумаба у мыши составляет 5 мг/кг/день. В отличие от этого, RD бевацизумаба у человека составляет 10 мг/кг/день. В связи с этим, 5 мг/кг/день у мыши соответствует 10 мг/кг/день у человека.
[0035]
При использовании цетуксимаба безтимусным мышам, которым трансплантировали линию злокачественных клеток почки человека SK-RC-29, в течение пяти недель каждые три дня внутривенно инъецировали дозы 0,5 и 1 мг/дозу и исследовали оптимальную дозу. С учетом данных (Clinical cancer research (1998) 4, 2957-2966) о том, что доза 1 мг/дозу (соответствующая 40 мг/кг, если считать массой мыши 25 г) приводит к наиболее высокой степени ингибирования роста опухоли, RD цетуксимаба у мыши составляет 40 мг/кг/день. В отличие от этого, RD цетуксимаба у человека составляет 400 мг/м2/день. В связи с этим, 40 мг/кг/день у мыши соответствует 400 мг/м2/день у человека.
[0036]
При использовании панитумумаба безтимусным мышам, которым трансплантировали линию злокачественных клеток толстого кишечника человека HT29, в течение пяти недель дважды в неделю внутривенно инъецировали дозы 20, 200, 500 и 1000 мкг/дозу и исследовали оптимальную дозу. С учетом данных (Panitumumab Interview Form) о том, что эффект достигал пика при дозе, равной или выше 200 мкг/дозу (соответствующей 8 мг/кг, если считать массой мыши 25 г), RD панитумумаба у мыши составляет 8 мг/кг. В отличие от этого, RD панитумумаба у человека составляет 6 мг/кг/день. В связи с этим, таким образом, 8 мг/кг/день у мыши соответствует 6 мг/кг/день у человека.
[0037]
Пример 1
Линию злокачественных клеток толстого кишечника человека (KM20C) трансплантировали в правую часть грудной клетки мыши BALB/cA Jcl-nu возрастом пять-шесть недель. Измеряли длину (мм) и ширину (мм) опухоли после ее трансплантации и вычисляли объем опухоли (TV). Затем мышей распределяли по группам таким образом, что средний TV в каждой группе был равным, и день распределения по группам (n=от 6 до 7) считали днем 0.
Вводимая доза лекарственного средства составляла 10 мл/кг, и комбинированное лекарственное средство FTD/TPI (смесь FTD и TPI в молярном соотношении 1:0,5) получали в дозе 150 мг/кг/день в пересчете на FTD. Бевацизумаб (инъекционный авастин, Chugai Pharmaceutical Co., Ltd.) получали в дозе 0,20, 0,55, 1,7 и 5 мг/кг/день. Комбинированное лекарственное средство FTD/TPI вводили перорально ежедневно в дни 1-14, а бевацизумаб вводили в брюшную полость в течение двух недель с частотой дважды в неделю со дня 1. В группе, которой вводили комбинацию, комбинированное лекарственное средство FTD/TPI и бевацизумаб вводили в тех же дозах и с тем же режимом введения, что и в группе, которой вводили одно средство.
[0038]
В качестве индекса противоопухолевого эффекта, вычисляли TV в каждой группе, из представленного ниже уравнения получали относительный объем опухоли (RTV) в день 0 и строили его график. Хронологические изменения RTV сравнивали в группе, которой не вводили средство (контрольной), группе, которой вводили комбинированное лекарственное средство FTD/TPI, группе, которой вводили бевацизумаб, и группе, которой вводили комбинацию комбинированного лекарственного средства FTD/TPI и бевацизумаба. Кроме того, в качестве показателя токсичности оценивали потерю массы. Результаты представлены в таблице 2 и на фиг. 1-4.
TV (мм3)=(длина×ширина2)/2
RTV=(TV в день оценки)/(TV в день 0)
[0039]
|
[0040]
Затем таким же образом осуществляли тест с использованием линии злокачественных клеток молочной железы человека (MC-2). В этом случае комбинированное лекарственное средство FTD/TPI (смесь FTD и TPI в молярном соотношении 1:0,5) получали в дозе 25 и 50 мг/кг/день в пересчете на FTD, а бевацизумаб получали в дозе 1,5 мг/кг/день. Результаты представлены в таблице 3 и на фиг. 5-6.
[0041]
|
[0042]
Как показано в таблицах 2-3 и на фиг. 1-6, наблюдали значительное повышение противоопухолевого эффекта, когда доза комбинированного лекарственного средства FTD/TPI составляла от 25 до 150 мг/кг/день (соответствующая от 11 до 70 мг/м2/день у человека) в пересчете на FTD, а доза бевацизумаба составляла от 0,20 до 5 мг/кг/день (соответствующая от 0,40 до 10 мг/кг/день у человека), и достигали статистически значимого синергического противоопухолевого эффекта, когда доза бевацизумаба составляла от 0,55 до 5 мг/кг/день (соответствующая от 1,10 до 10 мг/кг/день у человека).
[0043]
В любой исследуемой группе наблюдали приемлемую степень потери веса и не наблюдали повышение неблагоприятного эффекта, вызываемого введением в комбинации. В тесте с использованием KM2°C обнаруживали, что потеря веса составляла -4,9% в группе, которой вводили комбинированное лекарственное средство FTD/TPI, в то время как она составляла от -2,6 до -3,7% в группах, которым вводили комбинацию комбинированного лекарственного средства FTD/TPI и от 1,7 до 5 мг/кг/день бевацизумаба, и, таким образом, потеря веса снижалась. Кроме того, в тесте с использованием MC-2 получали схожие результаты. Хотя введение противоопухолевых средств в комбинации, как правило, повышает неблагоприятные эффекты, т.к. повышается противоопухолевый эффект, при использовании настоящего изобретения неблагоприятные эффекты снижали при одновременном повышении противоопухолевого эффекта, что является весьма неожиданным результатом.
[0044]
Кроме того, проверяли эффект замедления роста опухоли посредством одновременного использования комбинированного лекарственного средства FTD/TPI (Clin Cancer Res. 2000; 6(2): 701-8.; J Radiat Res. 2007; 48(3): 187-95.; Invest New Drugs. 2008; 26(1): 1-5.; J Radiat Res. 2011; 52(5): 646-54.). Что касается периода времени, в течение которого объем опухоли увеличивается вдвое со дня 0 (а именно, RTV становится 2), результаты в группе, которой вводили комбинацию, прогнозировали по результатам для группы, которой вводили одно средство, представленным на фиг. 5 и 6. "Количество дней до того, как RTV фактически достигнет 2" в группе, которой вводили одно средство, представлено в таблице 4. "Количество дней до того, как RTV фактически достигнет 2" вычисляли, предполагая, что RTV в день измерения, когда RTV впервые превысит 2, изменяется в соответствии с линейной функцией относительно RTV в предыдущий день измерения.
[0045]
|
[0046]
В таблице 5 представлено "ожидаемое количество дней" для достижения RTV 2 в группе, которой вводили комбинацию, и "фактическое количество дней" для достижения RTV 2.
[0047]
|
[0048]
В частности, в группе, которой вводили комбинацию, в которой доза комбинированного лекарственного средства FTD/TPI составляла 50 мг/кг/день, а доза бевацизумаба составляла 1,5 мг/кг/день, "фактическое количество дней" до достижения RTV 2 в каждой из групп, которым вводили одно средство, составляло 7,33 дней и 7,71 дней. Таким образом, с учетом того, что действия и эффекты комбинированного лекарственного средства FTD/TPI и бевацизумаба не являются антагонистическими, "ожидаемое количество дней" до достижения RTV 2 в группе, которой вводили комбинацию, составляло 15,05 дней, что является суммой периодов времени. Однако, "фактическое количество дней" до достижения RTV 2, неожиданно, составило 26,25 дней. Эти результаты свидетельствуют о том, что действие по повышению противоопухолевого эффекта бевацизумаба с помощью комбинированного лекарственного средства FTD/TPI является синергическим.
[0049]
Пример 2
Линию злокачественных клеток толстого кишечника человека (Co-3) трансплантировали в правую часть грудной клетки мыши BALB/cA Jcl-nu возрастом пять-шесть недель. Измеряли длину (мм) и ширину (мм) опухоли после трансплантации и вычисляли объем опухоли (TV). Затем мышей распределяли по группам таким образом, что средний TV в каждой группе был равным, и день распределения по группам (n = от 3 до 7) считали днем 0.
Вводимая доза лекарственного средства составляла 10 мл/кг, и комбинированное лекарственное средство FTD/TPI (смесь FTD и TPI в молярном соотношении 1:0,5) получали в дозе 75, 150 мг/кг/день в пересчете на FTD. Цетуксимаб (инъекционный эрбитукс, Merck Serono Co., Ltd.) получали в дозе 1,5, 4,4 и 40 мг/кг/день. Комбинированное лекарственное средство FTD/TPI вводили перорально ежедневно в дни 1-14, и цетуксимаб вводили в брюшную полость в течение 2 недель с частотой дважды в неделю со дня 1. В группе, которой вводили комбинацию, комбинированное лекарственное средство FTD/TPI и цетуксимаб вводили в тех же дозах и с тем же режимом введения, что и в группе, которой вводили одно средство.
[0050]
В качестве индекса противоопухолевого эффекта вычисляли TV в дни 5, 8, 12 и 15 в каждой группе, по формуле, приведенной в примере 1, получали относительный объем опухоли (RTV) в день 0 и строили его график. Хронологические изменения RTV сравнивали в группе, которой не вводили средство (контрольной), группе, которой вводили комбинированное лекарственное средство FTD/TPI, и группе, которой вводили цетуксимаб, и группе, которой вводили комбинацию комбинированного лекарственного средства FTD/TPI и цетуксимаба. Кроме того, в качестве показателя токсичности оценивали потерю массы. Результаты представлены в таблицах 6-7 и на фиг. 7-10.
[0051]
|
[0052]
|
[0053]
Затем таким же образом осуществляли тест с использованием линии злокачественных клеток толстого кишечника человека (SW48). В этом случае цетуксимаб получали в дозе 4,4, 20 и 40 мг/кг/день. Результаты представлены в таблицах 8-9 и на фиг. 11-13.
[0054]
|
[0055]
|
[0056]
Как показано в таблицах 6-9 и на фиг. 7-13, наблюдали значительное повышение противоопухолевого эффекта, когда доза комбинированного лекарственного средства FTD/TPI составляла от 75 до 150 мг/кг/день (соответствующая от 35 до 70 мг/м2/день у человека) в пересчете на FTD, и доза цетуксимаба составляла от 1,5 до 40 мг/кг/день (соответствующая от 15 до 400 мг/м2/день у человека), и достигали статистически значимого синергического противоопухолевого эффекта, когда доза цетуксимаба составляла от 4,4 до 40 мг/кг/день (соответствующая от 44 до 400 мг/м2/день у человека).
[0057]
В любой исследуемой группе наблюдали приемлемую степень потери веса и не наблюдали повышение неблагоприятного эффекта, вызываемого введением в комбинации. В тесте с использованием Co-3 обнаруживали, что потеря веса составляла -13,2% (или -18,6%) в группе, которой вводили 150 мг/кг/день комбинированного лекарственного средства FTD/TPI, и -5,0% (или от -9,4 до -14,9%) в группе, которой вводили комбинацию 150 мг/кг/день комбинированного лекарственного средства FTD/TPI и от 1,5 до 40 мг/кг/день цетуксимаба, и, таким образом, потеря веса снижалась. Кроме того, в тесте с использованием SW48 получали схожие результаты. Хотя введение противоопухолевых средств в комбинации, как правило, повышает неблагоприятные эффекты, т.к. повышается противоопухолевый эффект, при использовании настоящего изобретения неблагоприятные эффекты снижали при одновременном повышении противоопухолевого эффекта, что является весьма неожиданным результатом.
[0058]
Кроме того, проверяли эффект замедления роста опухоли посредством одновременного использования комбинированного лекарственного средства FTD/TPI (Clin Cancer Res. 2000; 6(2): 701-8.; J Radiat Res. 2007; 48(3): 187-95.; Invest New Drugs. 2008; 26(1): 1-5.; J Radiat Res. 2011; 52(5): 646-54.). Что касается периода времени, в течение которого объем опухоли увеличивается вдвое со дня 0 (а именно, RTV становится 2), результаты в группе, которой вводили комбинацию, прогнозировали по результатам для группы, которой вводили одно средство, представленным на фиг. 11 и 13. "Количество дней до того, как RTV фактически достигнет 2" в группе, которой вводили одно средство, представлено в таблице 10. "Количество дней до того, как RTV фактически достигнет 2" вычисляли, предполагая, что RTV в день измерения, когда RTV впервые превысит 2, изменяется в соответствии с линейной функцией относительно RTV в предыдущий день измерения.
[0059]
|
[0060]
В таблице 11 представлено ожидаемое количество дней до достижения RTV 2 в группе, которой вводили комбинацию, и фактическое количество дней до достижения RTV 2.
[0061]
|
[0062]
В группе, которой вводили комбинацию, в которой доза комбинированного лекарственного средства FTD/TPI составляла 150 мг/кг/день, а доза цетуксимаба составляла 4,4 мг/кг/день, "фактическое количество дней" до достижения RTV 2 в каждой из групп, которым вводили одно средство, составляло 3,62 дней и 4,32 дней. Таким образом, с учетом того, что действия и эффекты
комбинированного лекарственного средства FTD/TPI и цетуксимаба не являются антагонистическими, "ожидаемое количество дней" до достижения RTV 2 в группе, которой вводили комбинацию, составляло 7,94 дней, что является суммой периодов времени. Однако, "фактическое количество дней" до достижения RTV 2, неожиданно, составило 13,66 дней. Кроме того, "ожидаемое количество дней" до достижения RTV 2 в группе, которой вводили комбинацию, в которой доза комбинированного лекарственного средства FTD/TPI составляла 150 мг/кг/день, а доза цетуксимаба составляла 20 мг/кг/день, получали таким же образом по результатам на фиг. 12, что составляло 8,50 дней. "Фактическое количество дней" до достижения RTV 2 составляло 20,70 дней. Эти результаты свидетельствуют о том, что действие по повышению противоопухолевого эффекта цетуксимаба с помощью комбинированного лекарственного средства FTD/TPI является синергическим.
[0063]
Пример 3
Линию злокачественных клеток толстого кишечника человека (Co-3) трансплантировали в правую часть грудной клетки мыши BALB/cA Jcl-nu возрастом пять-шесть недель. Измеряли длину (мм) и ширину (мм) опухоли после трансплантации и вычисляли объем опухоли (TV). Затем мышей распределяли по группам таким образом, что средний TV в каждой группе был равным, и день распределения по группам (n=6) считали днем 0.
Вводимая доза лекарственного средства составляла 10 мл/кг, и комбинированное лекарственное средство FTD/TPI (смесь FTD и TPI в молярном соотношении 1:0,5) получали в дозе 150 мг/кг/день в пересчете на FTD. Панитумумаб (инъекционный вектибикс (зарегистрированная торговая марка), Amgen Inc.) получали в дозе 0,30, 0,89, 2,7 и 8 мг/кг/день. Комбинированное лекарственное средство FTD/TPI вводили перорально ежедневно в дни 1-14, и панитумумаб вводили в брюшную полость в течение двух недель с частотой дважды в неделю со дня 1. В группе, которой вводили комбинацию, комбинированное лекарственное средство FTD/TPI и панитумумаб вводили в тех же дозах и с тем же режимом введения что и в группе, которой вводили одно средство.
[0064]
В качестве индекса противоопухолевого эффекта вычисляли TV в дни 5, 8, 12 и 15 в каждой группе, по формуле, приведенной в примере 1, получали относительный опухоли (RTV) в день 0 и строили его график. Хронологические изменения RTV сравнивали в группе, которой не вводили средство (контрольной), группе, которой вводили комбинированное лекарственное средство FTD/TPI, и группе, которой вводили панитумумаб, и группе, которой вводили комбинацию комбинированного лекарственного средства FTD/TPI и панитумумаба. Кроме того, в качестве показателя токсичности оценивали потерю массы. Результаты представлены в таблице 12 и на фиг. 14-17.
[0065]
|
[0066]
Как показано в таблице 12 и на фиг. 14-17, наблюдали значительное повышение противоопухолевого эффекта, когда доза комбинированного лекарственного средства FTD/TPI составляла 150 мг/кг/день (соответствующая 70 мг/м2/день у человека) в пересчете на FTD, и доза панитумумаба составляла от 0,3 до 8 мг/кг/день (соответствующая от 0,23 до 6 мг/кг/день у человека), достигали статистически значимого синергического противоопухолевого эффекта, когда доза панитумумаба составляла от 0,89 до 8 мг/кг/день (соответствующая от 0,67 до 6 мг/кг/день у человека).
[0067]
Кроме того, в любой исследуемой группе наблюдали приемлемую степень потери веса и не наблюдали повышение неблагоприятного эффекта, вызываемого введением в комбинации. Обнаруживали, что потеря веса составляла -16,2% в группе, которой вводили комбинированное лекарственное средство FTD/TPI, и от 8,7 до 10,6% в группе, которой вводили комбинацию комбинированного лекарственного средства FTD/TPI и от 0,89 до 8 мг/кг/день панитумумаба, и, таким образом, потеря веса снижалась. Хотя введение противоопухолевых средств в комбинации, как правило, повышает неблагоприятные эффекты, т.к. повышается противоопухолевый эффект, при использовании настоящего изобретения неблагоприятные эффекты снижали при одновременном повышении противоопухолевого эффекта, что является весьма неожиданным результатом.
[0068]
С учетом изложенного выше, выявлено, что комбинированное лекарственное средство FTD/TPI значительно повышает противоопухолевый эффект бевацизумаба, цетуксимаба или панитумумаба, одновременно супрессируя возникновение неблагоприятных эффектов.