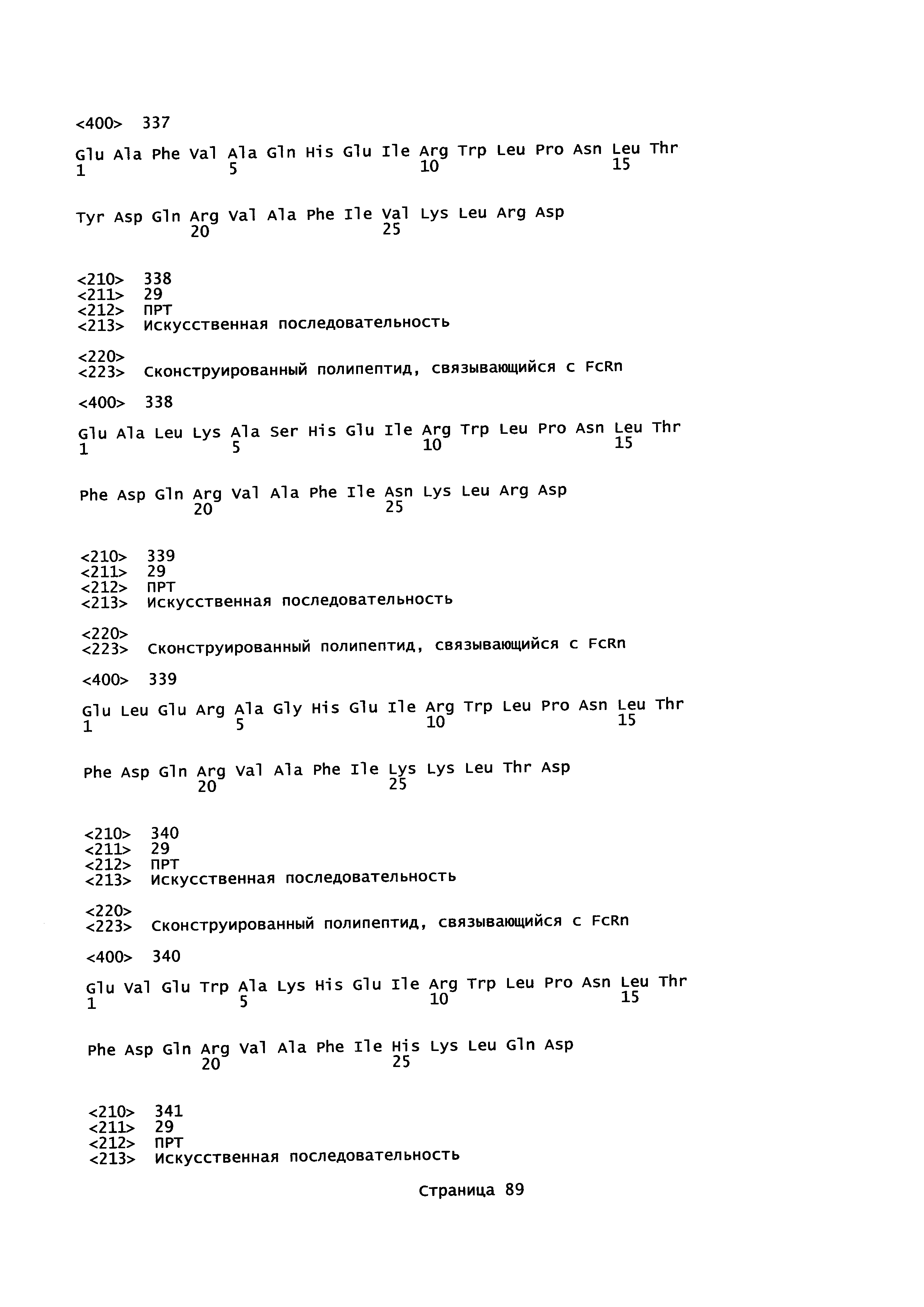Результат интеллектуальной деятельности: НОВЫЕ ПОЛИПЕПТИДЫ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее раскрытие относится к классу сконструированных полипептидов, имеющих аффинность связывания в отношении неонатального рецетора Fc (далее именуемого FcRn). Настоящее раскрытие также относится к применению таких полипептидов, связывающихся с FcRn, в качестве агента для модификации фармакокинетических и фармакодинамических свойств биомолекулы, например, фармацевтического средства, и в качестве терапевтического агента.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Неонатальный рецептор Fc (FcRn) представляет собой гетеродимерный белок, состоящий из тяжелой цепи, подобной трансмембранному МНС (главный комплекс гистосовместимости) класса I (α-цепь FcRn), и легкой цепи β2-микроглобулина, причем последняя также образует часть молекул МНС класса I (Simister and Mostov (1989) Nature 337:184-7; Burmeister et al. (1994) Nature 372:379-83).
FcRn преимущественно локализуется в эндосомах и способен связываться с сывороточным альбумином и иммуноглобулином G (IgG) при рН, меньшем или равном 6,5, и высвобождать их при рН, большем или равном 7,0 (обзор дается в публикации Roopenian (2007) Nat Rev Immunol 7:715-25).
FcRn выполняет несколько особых задач у млекопитающих (обзор дается в публикации Roopenian выше). FcRn участвует в рециркулировании эндоцитированного IgG и сывороточного альбумина, таким образом, отменяя их деградацию в лизосоме, придавая им более длительный период полужизни и большую доступность в крови, чем у других сывороточных белков. При пассивном пиноцитозе IgG, сывороточного альбумина и других сывороточных белков клетками, находящимися в контакте с кровью, рН в образованных эндосомах постепенно становится ниже, что обеспечивает связывание IgG и сывороточного альбумина с FcRn. Затем рецептор, совместно со связанным с ним лигандом, транспортируется посредством рециркулирующих эндосом обратно в плазматическую мембрану. После возвращения в плазматическую мембрану рН увеличивается примерно до 7 - точки, при которой высвобождается связанный лиганд.
FcRn также распознается по его способности транспортировать IgG через барьеры, такие как плацента, эпителий верхних дыхательных путей, гематоэнцефалический барьер и проксимальный отдел тонкого кишечника.
У млекопитающих свойства FcRn используются для трансцитоза IgG от матери к плоду через плаценту и для трансцитоза IgG из молока матери в кровоток младенца в проксимальном отделе тонкого кишечника.
Картина экспрессии FcRn отличается между видами. Однако FcRn широко экспрессируется клетками в гематоэнцефалическом барьере, эпителии верхних дыхательных путей, почках и сосудистых эндотелиях, и антигенпрезентирующими клетками, а также другими клетками гематопоэтического происхождения у большинства видов (обзор дается в публикации Roopenian (2007), выше).
Были разработаны антитела и пептиды с аффинностью к FcRn (Liu et al. (2007) J Immunol 179:2999-3011, Mezo et al. (2008) Proc Natl Acad Sci USA 105:2337-42) и β2-микроглобулину (Getman and Balthasar (2005) J Pharm Sci 94:718-29) с целью ингибирования связывания между эндогенным IgG и FcRn. Другим подходом было мутирование области Fc IgG для получения большей аффинности в отношении FcRn (Petkova et al. (2006) Int Immunol 18:1759-69, Vaccaro et al. (2005) Nat Biotechnol 23:1283-8).
Слияние с доменом Fc или с альбумином является широко используемой стратегией для увеличения периода полувыведения белков in vivo. Однако большой размер таких слитых белков вредно влияет на проникновение в ткань и уменьшает специфичность к партнеру связывания (Valles et al. (2011) J Interferon Cytokine Res 32:178-184). С другой стороны, для продления периода полувыведения во фрагменте Fc антител, вводимых приматам, не являющимся человеком, делали мутации (Hinton et al. (2004) J Biol Chem 279:6213-6). Однако данный подход ограничивается в применении только к терапевтическим антителам и не может быть экстраполирован на другие терапевтические белки, если рассматриваемые белки не слиты с фрагментами Fc, что также приводит к молекулам большого размера. Разработали целый ряд химических способов и способов генной инженерии для улучшения периода полувыведения белка, таких как ПЭГилирование и генетические слияния белка с доменом Fc IgG или альбумином (обзор дается в публикации Schellenberger et al. (2009) Nat Biotechnol 21:1186-1190). Сообщали о том, что ПЭГилирование белков снижает их эффективность и способствует их иммунореактивности.
Белки, слитые с Fc, также использовали для пероральной и легочной доставки, опосредованной FcRn (Low et al., (2005) Human reproduction Jul; 20(7): 1805-13), однако, сохраняются аналогичные проблемы, связанные с проникновением в ткань, и с пониженной специфичностью, из-за размера слитых молекул.
Следовательно, в данной области имеется большая потребность в постоянном предоставлении молекул с высокой аффинностью в отношнии FcRn. В частности, нужны маленькие связывающие молекулы, которые, при наличии в качестве партнера связывания, не оказывают вредного влияния на свойства молекул, с которыми они слиты, и не способствуют иммунореактивности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего раскрытия является предложение новых агентов, связывающихся с FcRn, для применения в модификации фармакокинетических и/или фармакодинамических свойств биомолекулы, например, фармацевтического средства.
Также целью настоящего раскрытия является предложение новых агентов, связывающихся с FcRn, для применения в качестве терапевтических агентов самих по себе, одних или в виде комбинированного лечения.
Целью настоящего раскрытия является предложение молекулы, обеспечивающей эффективное адресование к FcRn при уменьшении вышеупомянутых и других недостатоков современных терапий.
Эти и другие цели, которые очевидны специалисту из настоящего раскрытия, удовлетворяются разными аспектами изобретения, как заявлено в приложенной формуле изобретения и как, в общем, здесь раскрыто.
Таким образом, в первом аспекте данного раскрытия предложен полипептид, связывающийся с неонатальным рецептором Fc (FcRn), содержащий мотив связывания с FcRn - ВМ, который состоит из аминокислотной последовательности:
EX2X3X4AX6X7EIRWLPNLX16X17X18QRX21AFIX25X26LX28X29,
в которой, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, F, G, Н, I, K, L, М, N, Q, R, S, Т, V, W и Y;
Х4 выбран из A, D, Е, F, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х6 выбран из A, D, Е, F, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х7 выбран из A, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
X16 выбран из N и Т;
Х17 выбран из F, W и Y;
X18 выбран из A, D, Е и N;
Х21 выбран из A, S, V и W;
Х25 выбран из A, D, Е, F, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х26 выбран из K и S;
Х28 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y, и
Х29 выбран из D и R.
В приведенном выше определении класса родственных последовательностей полипептиды, связывающиеся с FcRn, основаны на статистическом анализе целого ряда случайных вариантов полипептида родительского каркаса, которые были отобраны в отношении их взаимодействия с FcRn в нескольких разных селекционных экспериментах. Идентифицированный мотив связывания с FcRn или «ВМ» соответствует области связывания мишени родительского каркаса, которая состоит из двух альфа-спиралей в пределах домена белка в виде пучка трех спиралей. В родительском каркасе варьирующие аминокислотные остатки двух спиралей ВМ составляют связывающую поверхность для взаимодействия с константной Fc частью антител. В настоящем раскрытии случайное варьирование остатков связывающей поверхности и последующая селекция вариантов заменили способность к взаимодействию с Fc способностью к взаимодействию с FcRn.
В одном воплощении указанного полипептида, связывающегося с FcRn, ВМ состоит из аминокслотной последовательности:
EX2X3X4AX6X7EIRWLPNLTX17X18QRX21AFIX25KLX28D,
в которой, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, F, G, Н, I, K, L, М, N, Q, R, S, Т, V, W и Y;
Х4 выбран из A, D, Е, F, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х6 выбран из A, D, Е, F, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х7 выбран из A, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
X17 выбран из F, W и Y;
X18 выбран из A, D, E и N;
X21 выбран из A, S, V и W;
X25 выбран из A, D, E, F, G, H, I, K, L, N, Q, R, S, T, V, W и Y; и
X28 выбран из A, D, E, F, H, I, K, L, N, Q, R, S, T, V, W и Y.
В другом воплощении первого аспекта данного раскрытия указанный полипептид, связывающийся с неонатальным рецептором Fc (FcRn), содержит мотив связывания с FcRn, ВМ, который состоит из аминокислотной последовательности:
EX2X3X4AX6X7EIRWLPNLX16X17X18QRX21AFIX25X26LX28X29,
в которой, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, F, G, Н, I, K, L, М, N, Q, R, S, Т, V, W и Y;
Х4 выбран из A, D, Е, F, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х6 выбран из А, Е, F, G, Н, I, K, Q, R, S и V;
Х7 выбран из A, F, Н, K, N, Q, R, S и V;
X16 выбран из N и Т;
Х17 выбран из F, W и Y;
X18 выбран из A, D, Е и N;
Х21 выбран из A, S, V и W;
Х25 выбран из D, Е, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х26 выбран из K и S;
Х28 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y; и
Х29 выбран из D и R.
В другом воплощении первого аспекта предложен полипептид, связывающийся с FcRn, в котором, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, F, Н, I, K, L, М, N, Q, R, S, Т, V, W и Y;
Х4 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х6 выбран из А, Е, F, G, Н, I, K, Q, R и S;
Х7 выбран из A, F, Н, K, N, Q, R, S и V;
Х16 выбран из N и Т;
Х17 выбран из F и Y;
X18 представляет собой D;
Х21 представляет собой V;
Х25 выбран из D, Е, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х26 выбран из K и S;
Х28 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V и W; и
Х29 выбран из D и R.
В другом воплощении первого аспекта ВМ состоит из аминокислотной последовательности, выбранной из:
1)EX2X3X4AX6HEIRWLPNLTX17X18QRX21AFIX25KLX28D,
в которой, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, G, Н, K, L, М, N, Q, R, S, Т, V и Y;
Х4 выбран из A, D, Е, F, G, I, K, L, N, Q, R, S, Т, V и Y;
Х6 выбран из A, G, K, R, S и V;
Х17 выбран из F, W и Y;
X18 выбран из A, D, Е и N;
Х21 выбран из A, S, V и W;
Х25 выбран из D, G, Н, K, L, N, R, V и W;
Х28 выбран из A, D, Е, Н, K, L, N, Q, R, S, Т, W и Y;
и
2) аминокислотной последовательности, которая имеет по меньшей мере 96%-ную идентичность с указанной последовательностью.
В еще одном другом воплощении указанного аспекта ВМ в последовательности 1) состоит из аминокислотной последовательности, выбранной из:
EX2X3X4AX6HEIRWLPNLTX17X18QRX21AFIX25KLX28D,
в которой, независимо друг от друга,
Х2 выбран из A, D, Е, F, N, Q, R, S и W;
Х3 выбран из D, Е, G, Н, K, М, N, Q, S и Т;
Х4 выбран из A, D, Е, G, N, Q, R, S, Т, V и Y;
Х6 выбран из A, G, S и V;
Х17 выбран из F, W и Y;
X18 выбран из A, D, Е и N;
Х21 выбран из A, S, V и W;
Х25 выбран из D, G, Н, K, L, N, R и V; и
Х28 выбран из А, Е, Н, L, N, Q, R, S, Т, W и Y.
Как будет понятно специалисту, функция любого полипептида, включая способность полипептида по настоящему раскрытию к связыванию с FcRn, зависит от третичной структуры полипептида. Следовательно, можно делать небольшие изменения последовательности аминокислот в полипептиде без влияния на его функцию. Таким образом, данное раскрытие охватывает модифицированные варианты полипептида, связывающегося с FcRn, которые являются такими, что сохраняются характеристики связывания с FcRn.
Следовательно, как описано выше, настоящим раскрытием также охватывается полипептид, связывающийся с FcRn, содержащий аминокислотную последовательность с 96%-й или большей идентичностью с полипептидом, как определено в 1).
В некоторых воплощениях такие изменения можно делать во всех положениях последовательностей полипептида, связывающегося с FcRn, как здесь раскрыто. В других воплощениях такие изменения можно делать только в невариабельных положениях, также обозначенных как аминокислотные остатки каркаса. В таких случаях в вариабельных положениях, т.е. положениях, обозначенных «X» в последовательности 1), не разрешаются изменения. Например, можно, чтобы аминокислотный остаток, принадлежащий к определенной функциональной группе аминокислотных остатков (например, гидрофобные, гидрофильные, полярные и т.д.) был бы заменен на другой аминокислотный остаток из той же самой функциональной группы.
Термин «% идентичности» в том, виде как он используется во всем данном описании изобретения, например, можно рассчитать следующим образом. Запрашиваемую последовательность выравнивают с последовательностью-мишенью с использованием алгоритма CLUSTAL W (Thompson etal. (1994) Nucleic Acids Research 22:4673-4680). Сравнение делают в окне, соответствующем самой короткой из выровненных последовательностей. Самая короткая из выровненных последовательностей в некоторых случаях может представлять собой последовательность-мишень. В других случаях запрашиваемая последовательность может составлять самую короткую из выровненных последовательностей. Сравнивают аминокислотные остатки в каждом положении, и процентную долю положений в запрашиваемой последовательности, которые имеют идентичные соответствия в последовательности-мишени, приводят как % идентичности.
Ниже следует список воплощений, которые дополнительно определяют аминокислотный остаток Xn, где n представляет собой целое число, которое обозначает положение указанного остатка в описанном здесь полипептиде. Для пояснения, в случаях, когда ВМ, содержащийся в полипептиде, может состоять либо из данной аминокислотной последовательности, либо из аминокислотной последовательности с по меньшей мере данным % идентичности с указанной данной аминокислотной последовательностью, тогда Xn, в том виде, как он здесь используется, относится к аминокислотному остатку в указанной данной аминокислотной последовательности. Например, когда это применимо, Xn относится к аминокислотному остатку в приведенной выше последовательности 1).
В одном воплощении Х2 выбран из A, D, Е, F, I, L, N, Q, R, S, Т, V, W и Y.
В одном воплощении Х2 выбран из A, D, F, I, L, N, Q, R, S, Т, V, W и Y.
В одном воплощении Х2 выбран из A, D, F, I, L, N, Q, R, S, V и W.
В одном воплощении Х2 выбран из A, I, L, N, Q, R, S, Т, V, W и Y.
В одном воплощении Х2 выбран из A, I, L, N, Q, S, Т, V и W.
В одном воплощении Х2 выбран из A, I, L, N, Q, V и W.
В одном воплощении Х2 выбран из A, I, L, Q, V и W.
В одном воплощении Х2 выбран из A, I, L и Q.
В одном воплощении Х2 выбран из I, L и Q.
В одном воплощении Х2 выбран из I и Q.
В одном воплощении Х2 представляет собой I.
В одном воплощении Х2 представляет собой Q.
В одном воплощении Х3 выбран из A, D, Е, G, Н, K, L, М, N, Q, R, S, Т, V и Y.
В одном воплощении Х3 выбран из A, D, Е, Н, K, L, М, N, Q, R, S, Т, V и Y.
В одном воплощении Х3 выбран из A, D, Е, G, Н, K, L, М, N, Q, R, S и Т.
В одном воплощении Х3 выбран из A, D, Е, G, Н, K, М, N, Q, S и Т.
В одном воплощении Х3 выбран из A, D, Е, G, Н, М, N, Q, S и Т.
В одном воплощении Х3 выбран из A, D, Е, K, N, Q, S и Т.
В одном воплощении Х3 выбран из A, D, Е, K, Q и Т.
В одном воплощении Х3 выбран из A, D, Е, Q и Т.
В одном воплощении Х3 выбран из D, Е и Т.
В одном воплощении Х3 выбран из D и Е.
В одном воплощении Х3 представляет собой D.
В одном воплощении Х3 представляет собой Е.
В одном воплощении Х4 выбран из A, D, Е, F, G, I, K, L, N, Q, R, S, Т, V и
В одном воплощении Х4 выбран из A, D, Е, G, N, Q, R, S, Т и V.
В одном воплощении Х4 выбран из A, D, Е, F, I, K, L, N, Q, R, S, Т и V.
В одном воплощении Х4 выбран из A, D, Е, I, K, N, Q, R, S и Т.
В одном воплощении Х4 выбран из A, D, Е, I, K, Q, S и Т.
В одном воплощении Х4 выбран из A, D, I, K, Q и S.
В одном воплощении Х4 выбран из A, D, Е, K и S.
В одном воплощении X4 выбран из A, D, K и S.
В одном воплощении Х4 выбран из A, D, Е и K.
В одном воплощении Х4 выбран из A, D и K.
В одном воплощении Х4 выбран из А и D.
В одном воплощении Х4 выбран из А и Е.
В одном воплощении X4 представляет собой А.
В одном воплощении Х4 представляет собой D.
В одном воплощении Х4 представляет собой Е.
В одном воплощении Х6 выбран из A, G, K, Q, R, S и V.
В одном воплощении Х6 выбран из A, G, K, R, S и V.
В одном воплощении Х6 выбран из A, G, K, R и S.
В одном воплощении Х6 выбран из A, G, K, S и V.
В одном воплощении Х6 выбран из A, G, K и V.
В одном воплощении Х6 выбран из A, G, K и S.
В одном воплощении Х6 выбран из A, G и K.
В одном воплощении Х6 выбран из A, G и V.
В одном воплощении Х6 выбран из А и G.
В одном воплощении Х6 представляет собой А.
В одном воплощении Х6 представляет собой G.
В одном воплощении Х7 выбран из А и Н.
В одном воплощении Х7 представляет собой Н.
В одном воплощении X16 представляет собой Т.
В одном воплощении X16 представляет собой N.
В одном воплощении Х17 выбран из F и Y.
В одном воплощении Х17 представляет собой F.
В одном воплощении X18 выбран из A, D и Е.
В одном воплощении X18 выбран из А и D.
В одном воплощении X18 представляет собой D.
В одном воплощении Х21 выбран из V и W.
В одном воплощении Х21 представляет собой V.
В одном воплощении Х25 выбран из D, Е, G, Н, K, L, N, Q, R, V и W.
В одном воплощении Х25 выбран из D, G, Н, K, L, N, R, V и W.
В одном воплощении Х25 выбран из D, G, Н, K, L, N, R и V.
В одном воплощении Х25 выбран из Н, L, R, V и W.
В одном воплощении Х25 выбран из Н, R, V и W.
В одном воплощении Х25 выбран из Н, R и V.
В одном воплощении Х25 выбран из Н, L и R.
В одном воплощении Х25 выбран из Н и R.
В одном воплощении Х25 выбран из Н и V.
В одном воплощении Х25 представляет собой Н.
В одном воплощении Х26 представляет собой K.
В одном воплощении Х26 представляет собой S.
В одном воплощении Х28 выбран из A, D, Е, Н, K, L, N, Q, R, S, Т, W и Y.
В одном воплощении Х28 выбран из A, D, Е, K, L, N, Q, R, S, Т, W и Y.
В одном воплощении Х28 выбран из A, D, Е, L, R, S, Т, W и Y.
В одном воплощении Х28 выбран из A, D, K, L, N, Q, R, S, Т и W.
В одном воплощении Х28 выбран из A, D и R.
В одном воплощении Х28 выбран из А и R.
В одном воплощении Х28 выбран из D и R.
В одном воплощении Х28 представляет собой А.
В одном воплощении Х28 представляет собой R.
В одном воплощении Х29 представляет собой D.
В одном воплощении Х29 представляет собой R.
В одном воплощении Х6Х7 выбран из АН и GH.
В одном воплощении Х6Х7 представляет собой АН.
В одном воплощении Х6Х7 представляет собой GH.
В одном воплощении Х17Х18 выбран из FD and YD.
В одном воплощении Х17Х18 представляет собой FD.
В более конкретном воплощении определения подкласса полипептида, связывающегося с FcRn, последовательность удовлетворяет по меньшей мере трем из шести условий I-VI:
I. Х6 выбран из A, G, K и S, например, в частности, из А;
II. Х7 представляет собой Н;
III. Х17 выбран из F и Y, например, в частности, из F;
IV. X18 представляет собой D;
V. Х21 выбран из V и W, например, в частности, из V;
VI. Х25 выбран из Н и R, например, в частности, из Н.
В некоторых примерах полипептида, связывающегося с FcRn, согласно первому аспекту указанная последовательность удовлетворяет по меньшей мере четырем из шести условий I-VI. Более конкретно, данная последовательность может удовлетворять по меньшей мере пяти из шести условий I-VI, например, всем шести условиям I-VI.
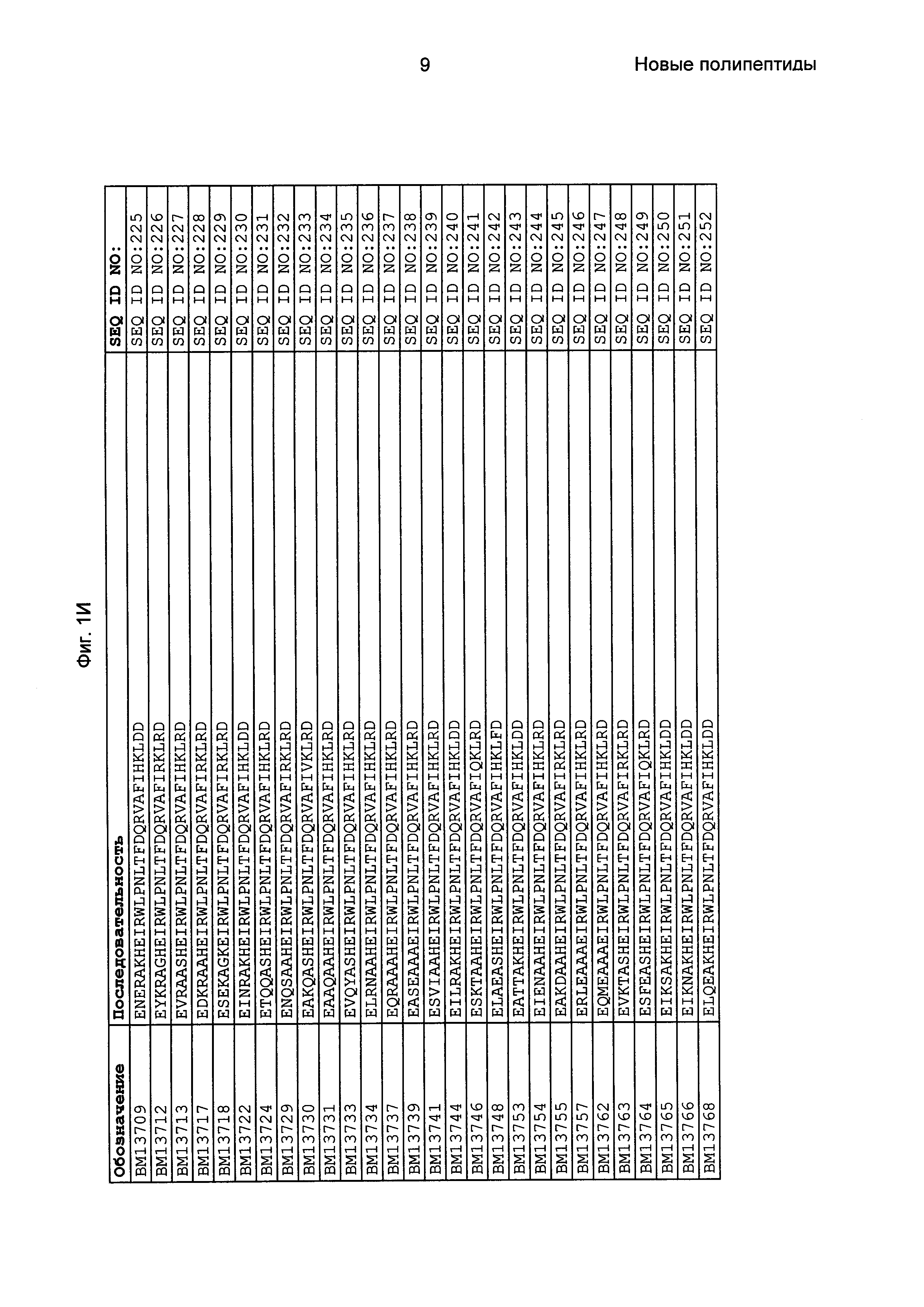
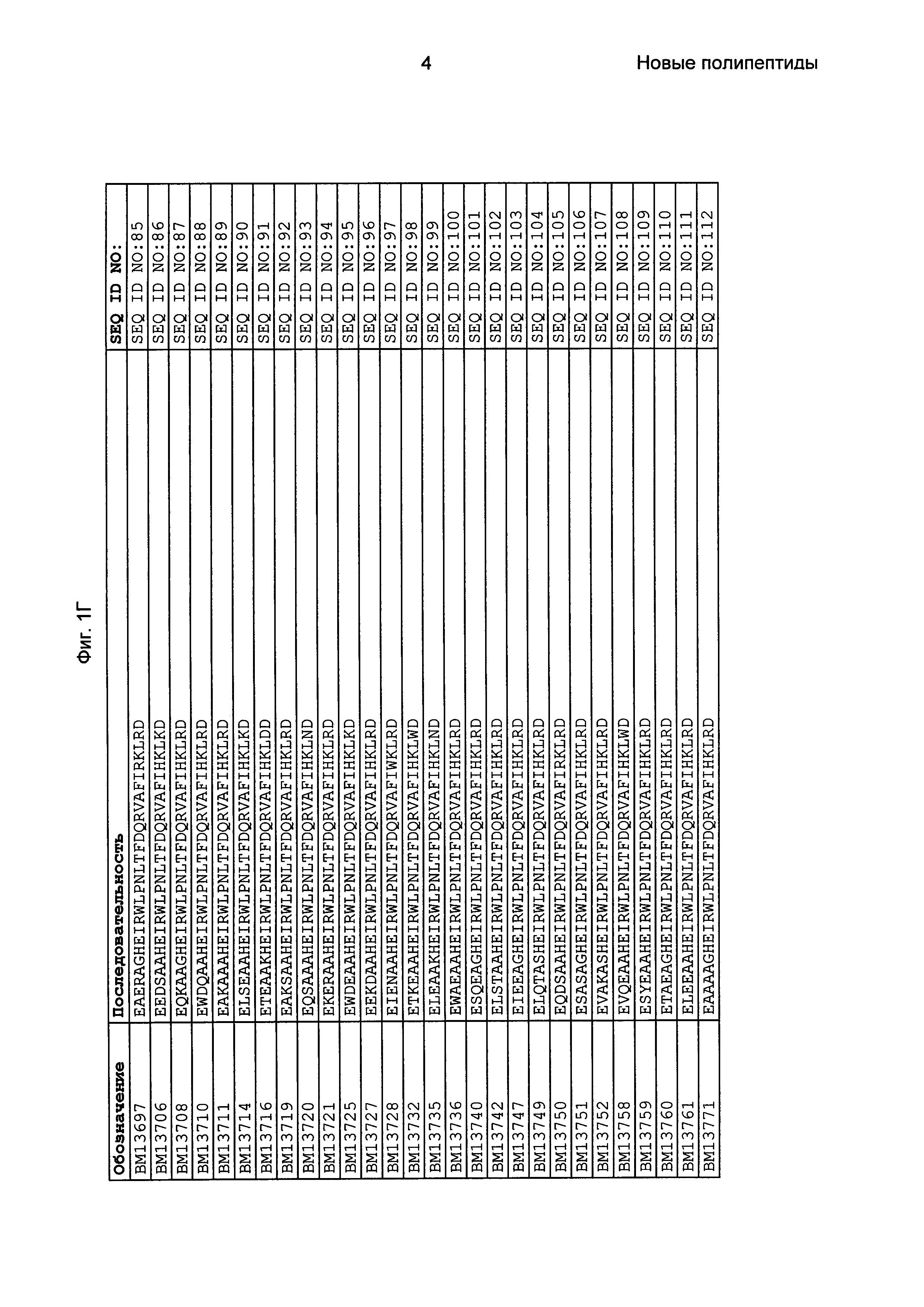
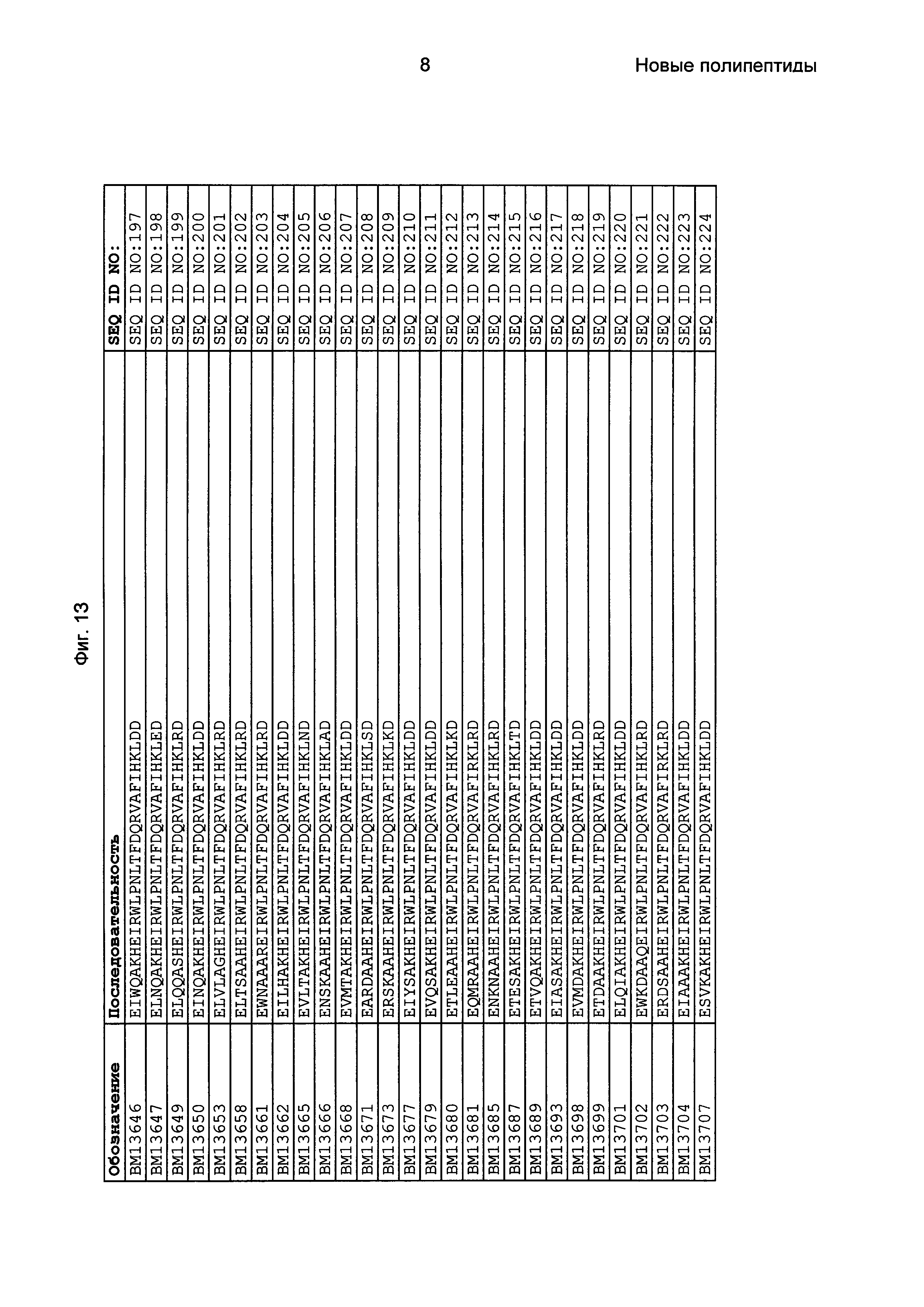
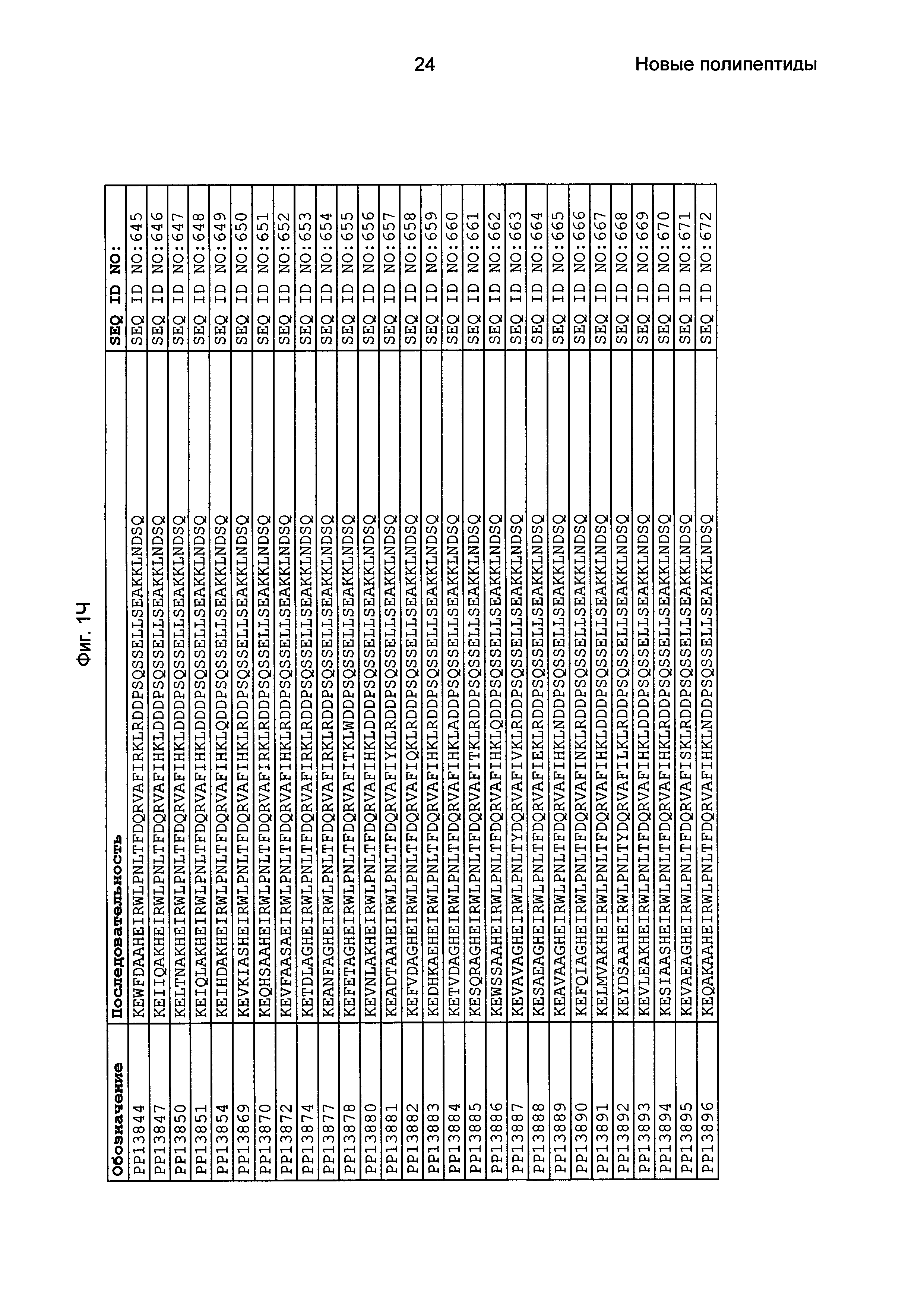
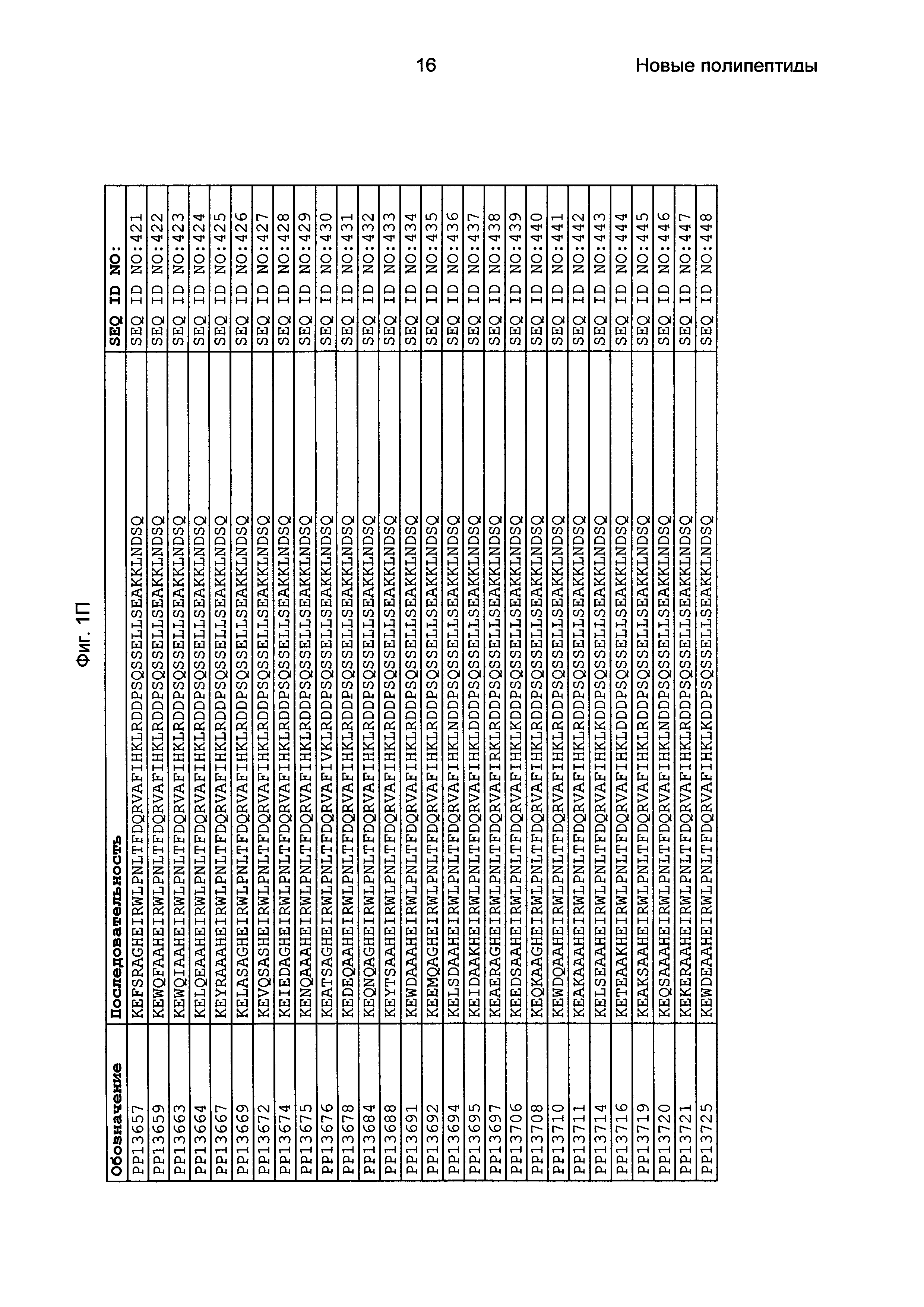
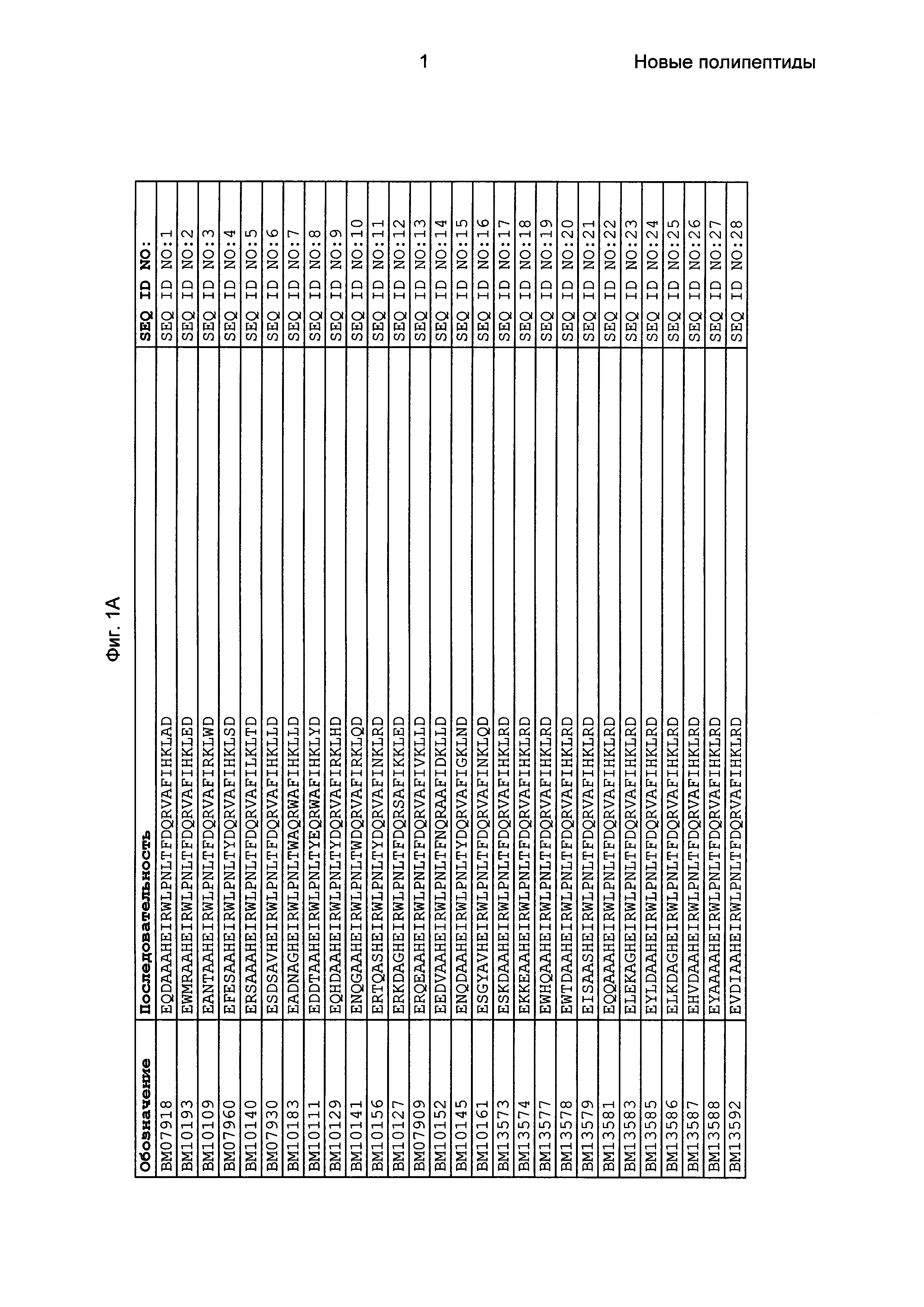
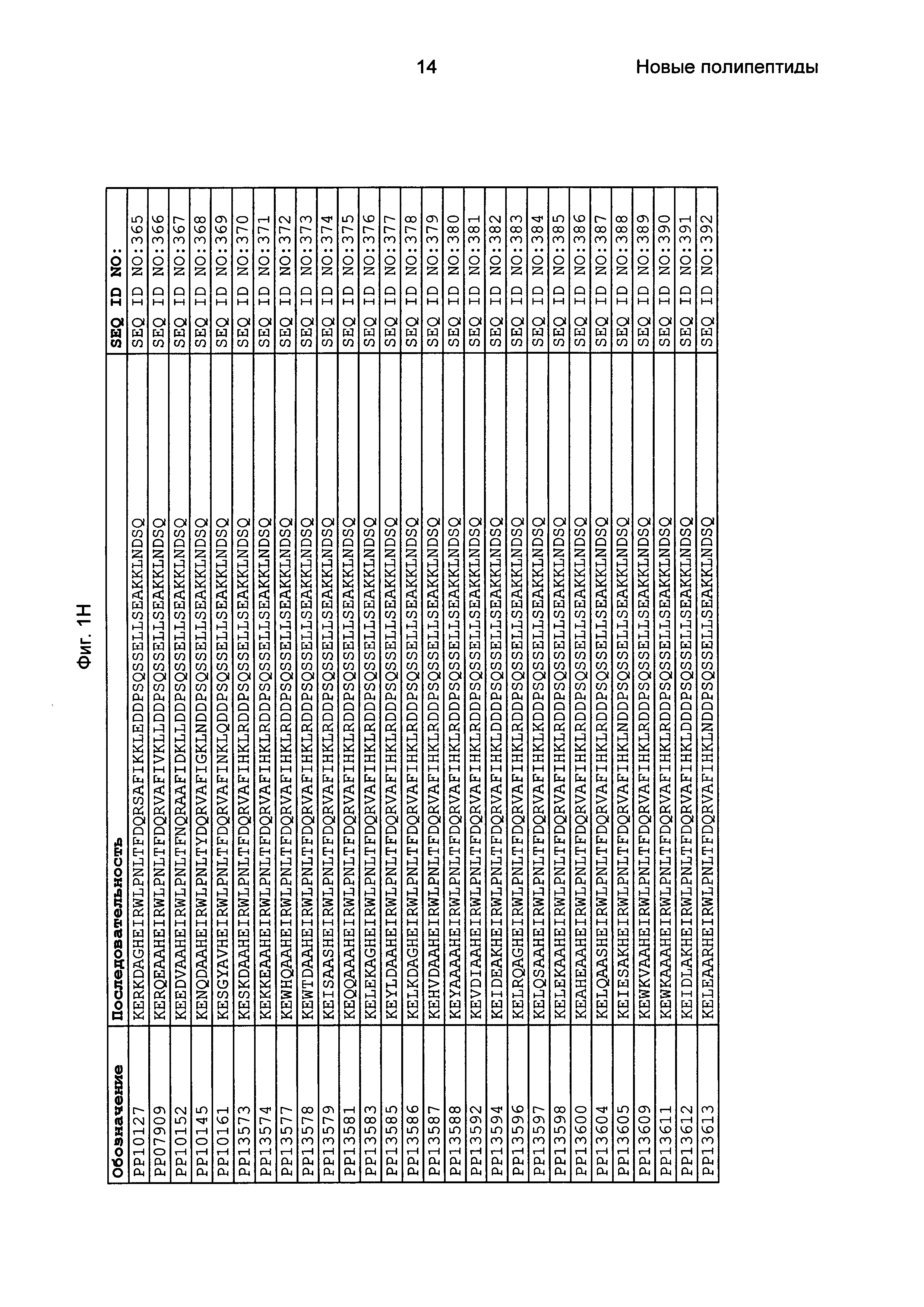
Как подробно описано в следующем экспериментальном разделе, селекция вариантов полипептидов, связывающихся с FcRn, привела к идентификации целого ряда индивидуальных последовательностей мотива связывания с FcRn (ВМ). Эти последовательности составляют индивидуальные воплощения согласно данному аспекту. Последовательности индивидуальных мотивов связывания с FcRn представлены на Фиг. 1 и в виде SEQ ID NO: 1-353. Следовательно, в одном воплощении полипептида, связывающегося с FcRn, согласно этому аспекту данная последовательность выбрана из группы, состоящей из SEQ ID NO: 1-353. В одном воплощении данная последовательность выбрана из группы, состоящей из SEQ ID NO: 1-15, SEQ ID NO: 17-140 и SEQ ID NO: 353. В одном воплощении данная последовательность выбрана из группы, состоящей из SEQ ID NO: 1-2 и SEQ ID NO: 17-140. В одном воплощении данная последовательность выбрана из группы, состоящей из SEQ ID NO: 1-2, SEQ ID NO: 17-92, SEQ ID NO: 94-103, SEQ ID NO: 105-125 и SEQ ID NO: 127-140. В одном воплощении данная последовательность выбрана из группы, состоящей из SEQ ID NO: 1-8, SEQ ID NO: 13, SEQ ID NO: 19-20, SEQ ID NO: 23, SEQ ID NO: 28, SEQ ID NO: 41, SEQ ID NO: 44, SEQ ID NO: 65, SEQ ID NO: 70, SEQ ID NO: 73, SEQ ID NO: 75-77 и SEQ ID NO: 353. В другом воплощении данная последовательность выбрана из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 23, SEQ ID NO: 28, SEQ ID NO: 41, SEQ ID NO: 44, SEQ ID NO: 65, SEQ ID NO: 73 и SEQ ID NO: 75-77. В еще одном другом воплощении данная последовательность выбрана из SEQ ID NO: 1, SEQ ID NO: 23, SEQ ID NO: 44, SEQ ID NO: 65, SEQ ID NO: 75 и SEQ ID NO: 77. В одном воплощении данная последовательность выбрана из SEQ ID NO: 1, SEQ ID NO: 23 и SEQ ID NO: 75. В одном воплощении данная последовательность представляет собой SEQ ID NO: 1.
В некоторых воплощениях настоящего раскрытия ВМ, как определено выше, «образует часть» домена белка в виде пучка трех спиралей. Понятно, что это означает, что последовательность ВМ «вставлена» или «привита» к последовательности исходного домена в виде пучка трех спиралей так, что ВМ заменяет аналогичный структурный мотив в исходном домене. Например, не желая быть связанными теорией, полагают, что ВМ составляет две из трех спиралей трехспирального пучка и может, следовательно, заменять такой двухспиральный мотив в любом трехспиральном пучке. Как будет понятно специалисту, замена двух спиралей домена в виде пучка трех спиралей двумя спиралями ВМ должна быть проведена так, чтобы не влиять на базовую структуру полипептида. То есть, общее сворачивание каркаса Сое полипептида согласно данному воплощению изобретения является по существу таким же, как и сворачивание домена белка в виде пучка трех спиралей, часть которого он образует, например, за счет наличия таких же элементов вторичной структуры в таком же порядке и т.д. Таким образом, ВМ согласно данному раскрытию «образует часть» домена в виде пучка трех спиралей, если полипептид согласно данному воплощению аспекта имеет такое же сворачивание, что и исходный домен, подразумевая то, что имеются общие базовые структурные свойства, причем такие свойства, например, приводят к аналогичным спектрам CD (круговой дихроизм). Специалист знает другие параметры, которые являются релевантными.
В конкретных воплощениях мотив связывания FcRn (ВМ), таким образом, образует часть домена белка в виде пучка трех спиралей. Например, ВМ может по существу составлять две альфа-спирали с соединительной петлей в пределах указанного домена белка в виде пучка трех спиралей. В конкретных воплощениях указанный домен белка в виде пучка трех спиралей выбран из доменов бактериальных рецепторых белков. Неограничивающими примерами таких доменов являются пять разных трехспиральных доменов белка А из Staphylococcus aureus, такие как домен В и его производные. В некоторых воплощениях домен белка в виде пучка трех спиралей представляет собой вариант белка Z, который происходит из домена В стафилококкового белка А.
В воплощениях, где полипептид, связывающийся с FcRn, по изобретению образует часть домена белка в виде пучка трех спиралей полипептид, связывающийся с FcRn, может содержать аминокислотную последовательность, выбранную из:
3) K-[BM]-DPSQSXaXbLLXcEAKKLXdXeXfQ:
где
[ВМ] представляет собой мотив связывания с FcRn, как здесь определено, при условии, что Х29 представляет собой D;
Ха выбран из А и S;
Xb выбран из N и Е;
Хс выбран из A, S и С;
Xd выбран из Е, N и S;
Хе выбран из D, Е и S;
Xf выбран из А и S; и
4) аминокислотной последовательности, которая имеет по меньшей мере 93%-ную идентичность с последовательностью, определенной 3).
В воплощениях, где полипептид, связывающийся с FcRn, по изобретению образует часть домена белка в виде пучка трех спиралей, полипептид, связывающийся с FcRn, может содержать аминокислотную последовательность, выбранную из:
5) K-[BM]-DPEQSXaXbLLXcEAKKLXdXeXfQ
где
[ВМ] представляет собой мотив связывания с FcRn, как здесь определено, при условии, что Х29 представляет собой R;
Ха выбран из А и S;
Xb выбран из N и Е;
Хс выбран из A, S и С;
Xd выбран из Е, N и S;
Хе выбран из D, Е и S;
Xf выбран из А и S;
и
6) аминокислотной последовательности, которая имеет по меньшей мере 93%-ную идентичность с последовательностью, определенной 5).
Как обсуждалось выше, полипептиды, содержащие небольшие изменения по сравнению с приведенными выше аминокислотными последовательностями, которые не оказывают значительного влияния на их третичную структуру и функцию, также находятся в пределах объема настоящего раскрытия. Таким образом, в некоторых воплощениях последовательность 4) или последовательность 6) имеет по меньшей мере 95%-ную, например, по меньшей мере 97%-ную идентичность с последовательностью, определенной 3) и 5) соответственно.
В одном воплощении Ха в последовательности 3) или 5) представляет собой А. В альтернативном воплощении Ха в последовательности 3) или 5) представляет собой S.
В одном воплощении Xb в последовательности 3) или 5) представляет собой N. В альтернативном воплощении Xb в последовательности 3) или 5) представляет собой Е.
В одном воплощении Хс в последовательности 3) или 5) представляет собой А. В альтернативном воплощении Хс в последовательности 3) или 5) представляет собой S. В еще одном альтернативном воплощении Хс в последовательности 3) или 5) представляет собой С.
В одном воплощении Xd в последовательности 3) или 5) представляет собой Е.
В одном воплощении Xd в последовательности 3) или 5) представляет собой N.
В одном воплощении Xd в последовательности 3) или 5) представляет собой S.
В одном воплощении Хе в последовательности 3) или 5) представляет собой D.
В одном воплощении Хе в последовательности 3) или 5) представляет собой Е.
В одном воплощении Хе в последовательности 3) или 5) представляет собой S.
В одном воплощении XdXe в последовательности 3) или 5) выбран из ЕЕ, ES, SE и SS.
В одном воплощении XdXe в последовательности 3) или 5) представляет собой ES.
В одном воплощении XdXe в последовательности 3) или 5) представляет собой SE.
В одном воплощении Xf в последовательности 3) или 5) представляет собой А. В альтернативном воплощении Xf в последовательности 3) или 5) представляет собой S.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой А, и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой С, и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S, и Xf представляет собой S.
В одном воплощении в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С, и Xf представляет собой S.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой A; XdXe представляет собой ND; и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой С; XdXe представляет собой ND; и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S; XdXe представляет собой ND; и Xf представляет собой S.
В одном воплощении, в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С; XdXe представляет собой ND; и Xf представляет собой S.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой A; XdXe представляет собой SE; и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой С; XdXe представляет собой SE; и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S; XdXe представляет собой SE; и Xf представляет собой S.
В одном воплощении в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С; XdXe представляет собой SE; и Xf представляет собой S.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой A; XdXe представляет собой ES; и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой С; XdXe представляет собой ES; и Xf представляет собой А.
В одном воплощении в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S; XdXe представляет собой ES; и Xf представляет собой S.
В одном воплощении в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С; XdXe представляет собой ES; и Xf представляет собой S.
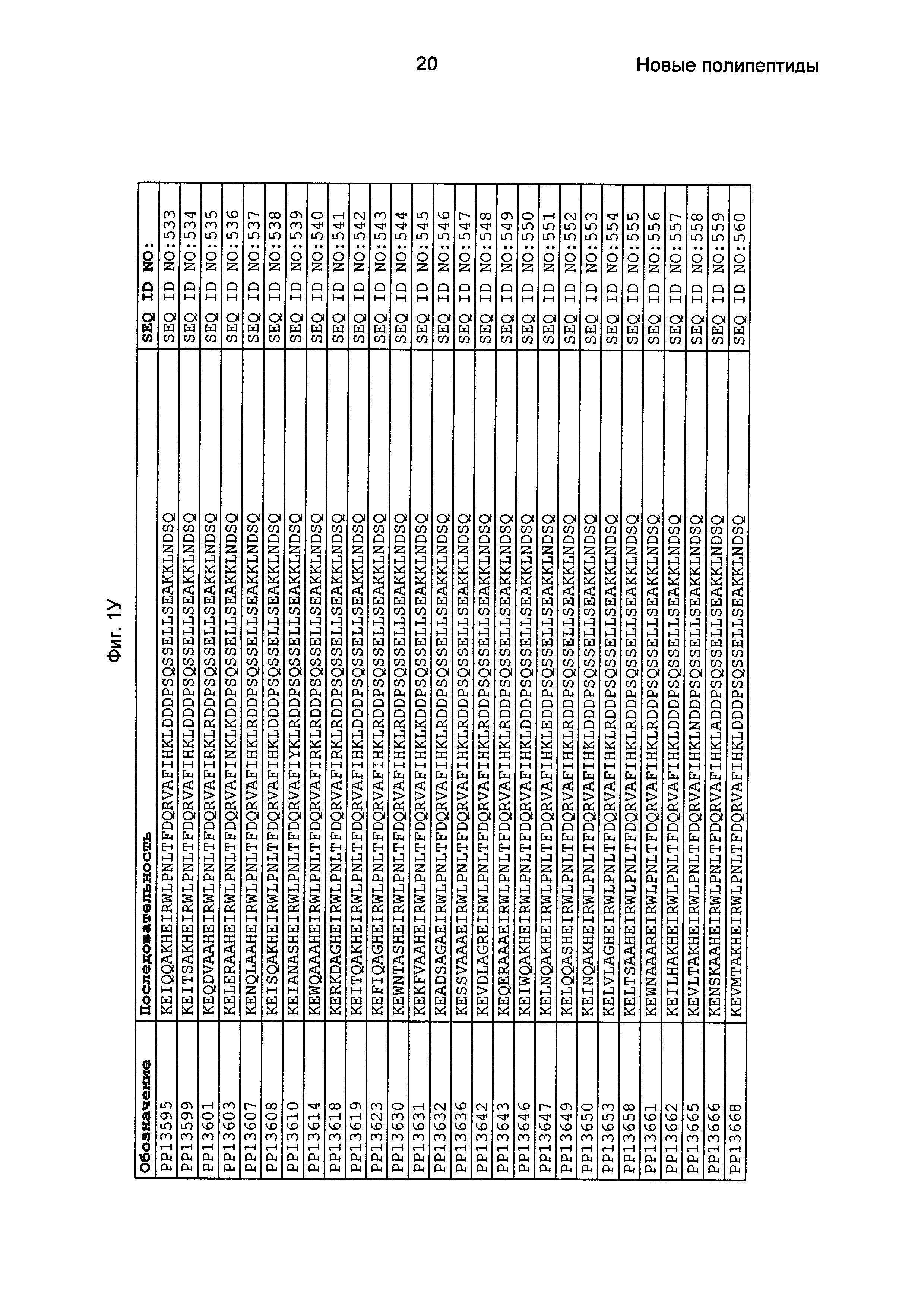
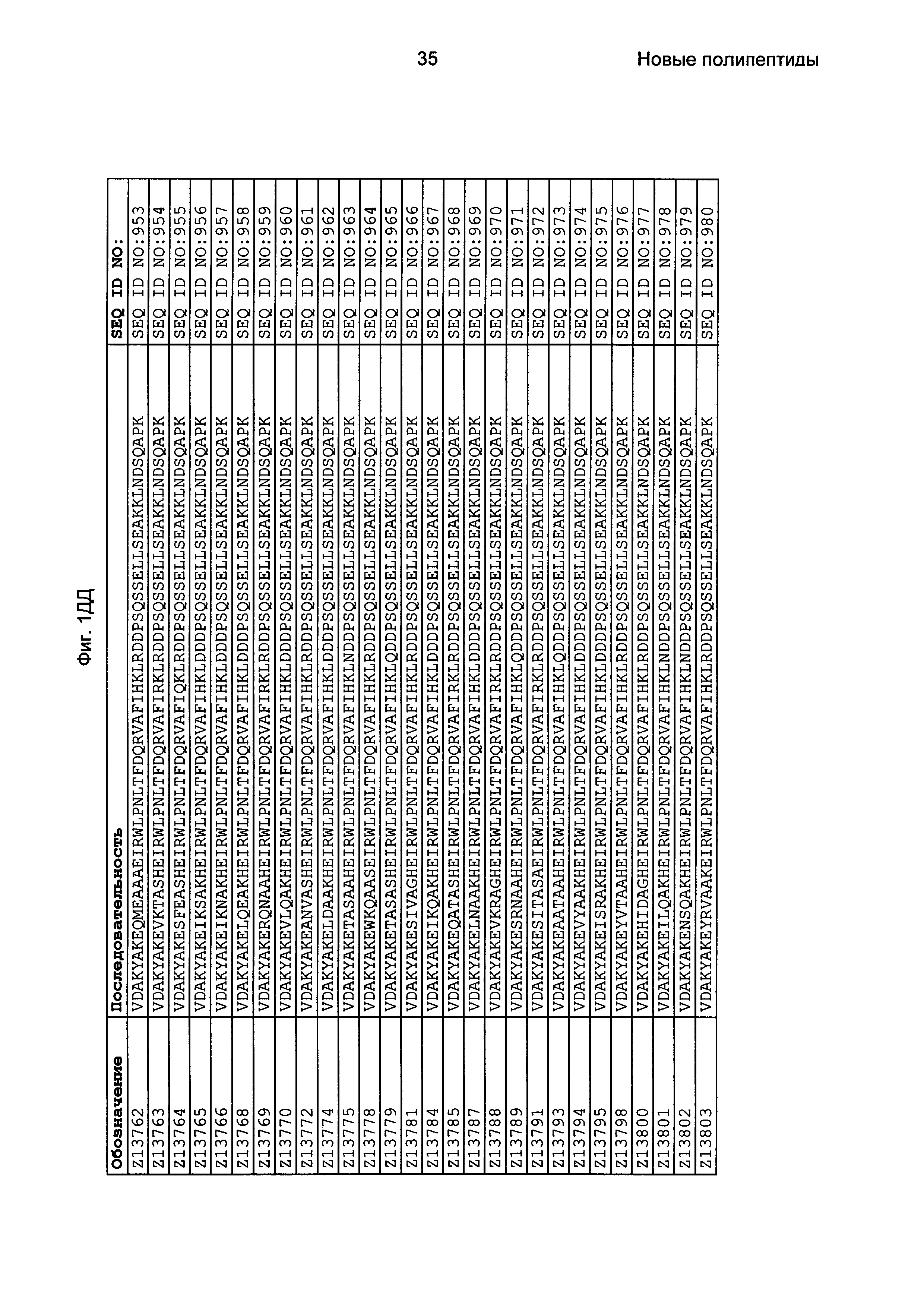
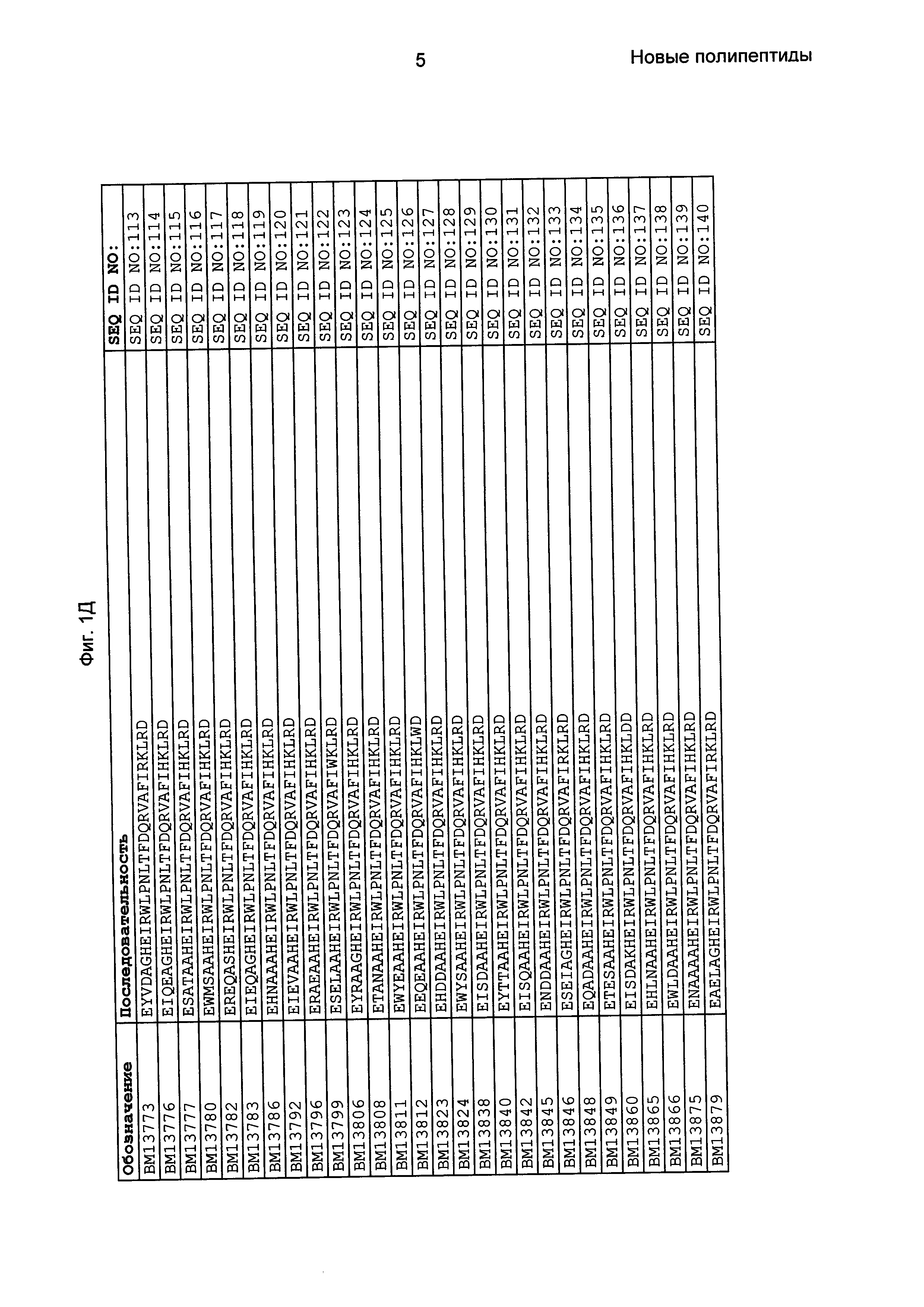
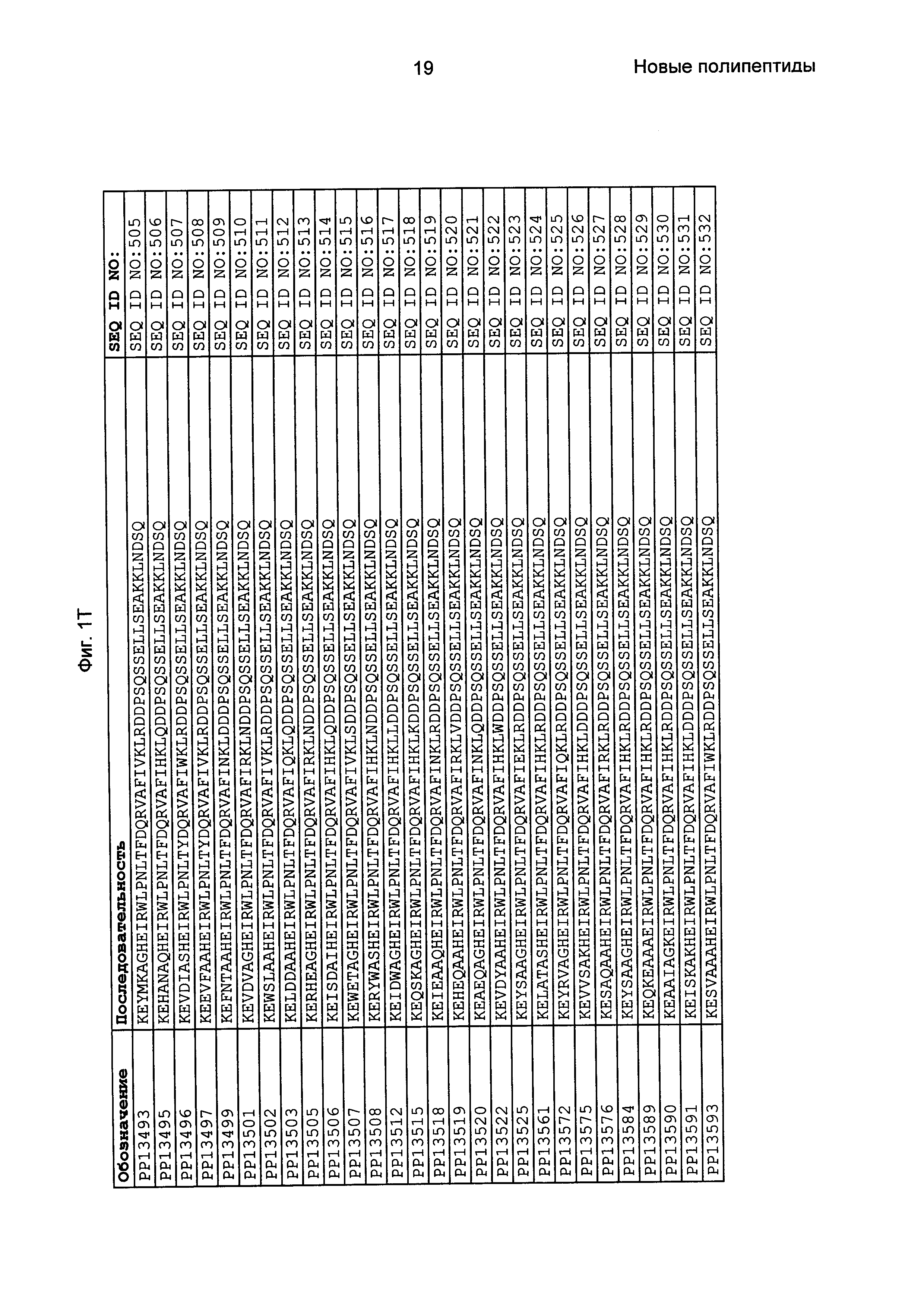
В еще одном другом воплощении последовательность 3) в приведенном выше определении полипептидов, связывающихся с FcRn, выбрана из группы, состоящей из SEQ ID NO: 354-706. В одном воплощении последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-368, SEQ ID NO: 370-493 и SEQ ID NO: 706. В одном воплощении последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-355 и SEQ ID NO: 370-493. В одном воплощении последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-355, SEQ ID NO: 370-445, SEQ ID NO: 447-456, SEQ ID NO: 458-478 и SEQ ID NO: 480-493. В одном воплощении последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-361, SEQ ID NO: 366, SEQ ID NO: 372-373, SEQ ID NO: 376, SEQ ID NO: 381, SEQ ID NO: 394, SEQ ID NO: 397, SEQ ID NO: 418, SEQ ID NO: 423, SEQ ID NO: 426, SEQ ID NO: 428-430 и SEQ ID NO: 706. В другом воплощении последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354, SEQ ID NO: 376, SEQ ID NO: 381, SEQ ID NO: 394, SEQ ID NO: 397, SEQ ID NO: 418, SEQ ID NO: 426 и SEQ ID NO: 428-430. В еще одном воплощении последовательность 3) выбрана из SEQ ID NO: 354, SEQ ID NO: 376, SEQ ID NO: 397, SEQ ID NO: 418, SEQ ID NO: 428 и SEQ ID NO: 430. В одном воплощении последовательность 3) выбрана из SEQ ID NO: 354, SEQ ID NO: 376 и SEQ ID NO: 428. В одном воплощении последовательность 3) представляет собой SEQ ID NO: 354.
Также в другом воплощении предложен полипептид, связывающийся с FcRn, как определено выше, который содержит аминокислотную последовательность, выбранную из:
7) YAK-[BM]-DPSQSSELLXcEAKKLNDSQAP;
где [BM] представляет собой мотив связывания с FcRn, как определено выше, и Хс выбран из A, S и С; и
8) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной 7).
В качестве альтернативы, предложен полипептид, связывающийся с FcRn, как определено выше, который содержит аминокислотную последовательность, выбранную из:
9) FNK-[BM]-DPSQSANLLXcEAKKLNDAQAP;
где [BM] представляет собой мотив связывания с FcRn, как определено выше, и Хс выбран из А и С; и
10) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной 9).
Как обсуждалось выше, полипептиды, содержащие небольшие изменения по сравнению с приведенными выше аминокислотными последовательностями, которые не оказывают значительного влияния на их третичную структуру и функцию, также находятся в пределах объема настоящего раскрытия. Таким образом, в некоторых воплощениях полипептид, связывающийся с FcRn, как определено выше, может содержать последовательность, которая по меньшей мере на 96%, например, по меньшей мере на 98% идентична последовательности, определенной 7) и 9).
В некоторых воплощениях мотив связывания с FcRn может образовать часть полипептида, содержащего аминокислотную последовательность, выбранную из:

где [BM] представляет собой мотив связывания с FcRn, как он определен выше.
В одном воплощении полипептид, связывающийся с FcRn, содержит аминокислотную последовательность, выбранную из:
11) AEAKYAK-[BM]-DPSQSSELLSEAKKLNDSQAPK;
где [ВМ] представляет собой мотив связывания с FcRn, как он определен выше; и
12) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной в 11).
В одном воплощении последовательность 11) выбрана из группы, состоящей из SEQ ID NO: 1060-1062.
В одном воплощении полипептид, связывающийся с FcRn, содержит аминокислотную последовательность, выбранную из:
13) VDAKYAK-[BM]-DPSQSSELLSEAKKLNDSQAPK;
где [ВМ] представляет собой мотив связывания с FcRn, как он определен выше; и
14) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной в 13).
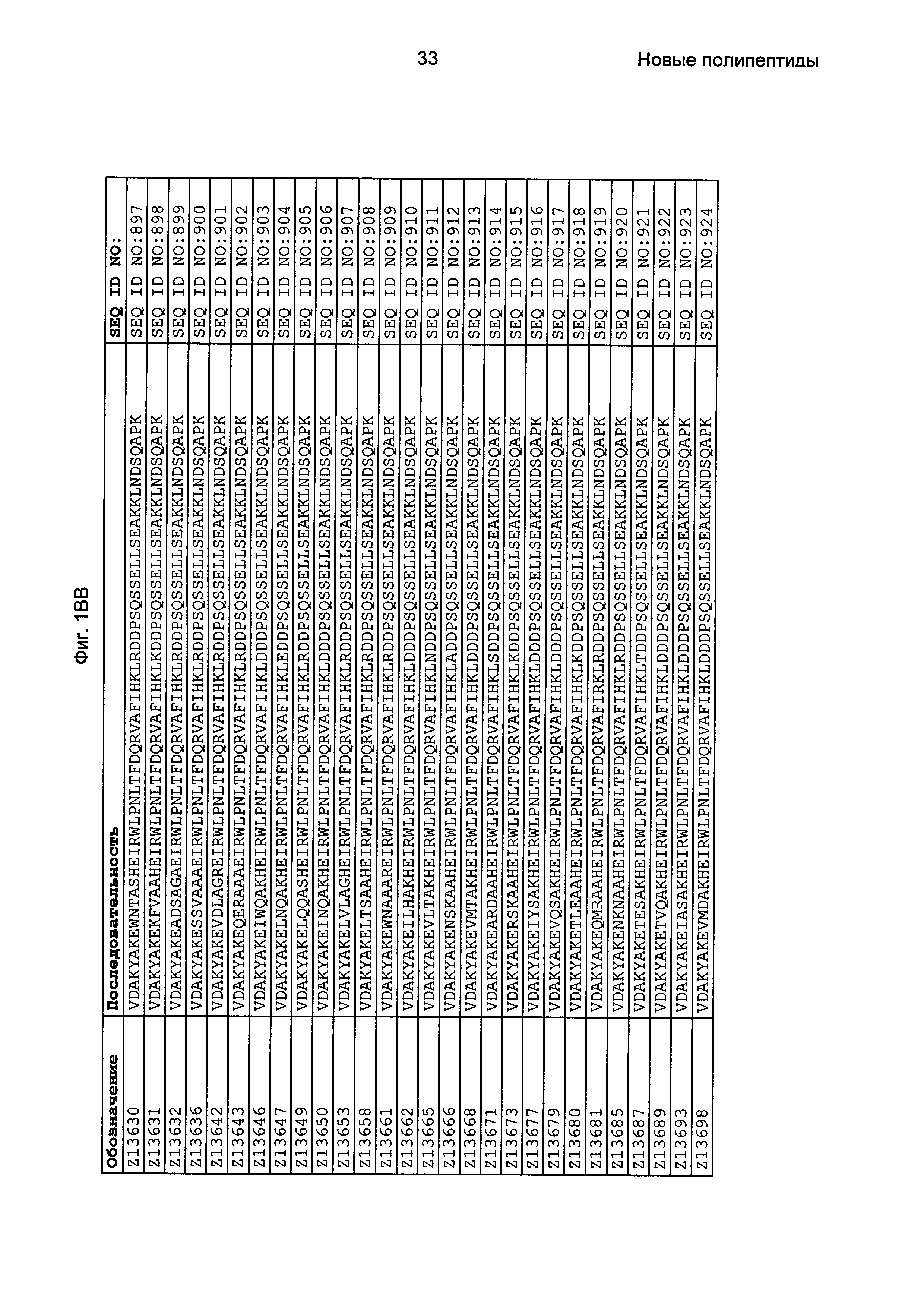
Последовательность 13) в таком полипептиде может, например, быть выбрана из группы, состоящей из SEQ ID NO: 707-1059. В одном воплощении последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-721, SEQ ID NO: 723-846 и SEQ ID NO: 1059. В одном воплощении последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-708 и SEQ ID NO: 723-846. В одном воплощении последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-708, SEQ ID NO: 723-798, SEQ ID NO: 800-809, SEQ ID NO: 811-831 и SEQ ID NO: 833-846. В одном воплощении последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-714, SEQ ID NO: 719, SEQ ID NO: 725-726, SEQ ID NO: 729, SEQ ID NO: 734, SEQ ID NO: 747, SEQ ID NO: 750, SEQ ID NO: 771, SEQ ID NO: 776, SEQ ID NO: 779, SEQ ID NO: 781-783 и SEQ ID NO: 1059. В другом воплощении последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707, SEQ ID NO: 729, SEQ ID NO: 734, SEQ ID NO: 747, SEQ ID NO: 750, SEQ ID NO: 771, SEQ ID NO: 779 и SEQ ID NO: 781-783. В еще одном воплощении последовательность 13) выбрана из SEQ ID NO: 707, SEQ ID NO: 729, SEQ ID NO: 750, SEQ ID NO: 771, SEQ ID NO: 781 и SEQ ID NO: 783. В одном воплощении последовательность 13) выбрана из SEQ ID NO: 707, SEQ ID NO: 729 и SEQ ID NO: 781. В одном воплощении последовательность 13) представляет собой SEQ ID NO: 707.
Вновь, полипептиды, содержащие небольшие изменения по сравнению с приведенными выше аминокислотными последовательностями, которые не оказывают значительного влияния на их третичную структуру и функцию, также находятся в пределах объема настоящего раскрытия. Таким образом, в некоторых воплощениях полипептид, связывающийся с FcRn, как определено выше, может содержать последовательность, которая является по меньшей мере на 96%, например, по меньшей мере на 98% идентичной последовательности, определенной 11) или 13).
Термины «связывающийся с FcRn» и «аффинность связывания в отношении FcRn» в том виде, в котором они используются в данном описании, относятся к свойству полипептида, которое может быть протестировано, например, посредством применения технологии поверхностного плазмонного резонанса (SPR) или ELISA (твердофазный иммуноферментный анализ).
Например, как описано в примерах, приведенных ниже, аффинность связывания в отношении FcRn можно тестировать в эксперименте, в котором FcRn или его правильно свернутый фрагмент иммобилизирован на сенсорном чипе прибора, и образец, содержащий полипептид, подлежащий тестированию, пропускается над чипом. В качестве альтернативы, полипептид, подлежащий тестированию, иммобилизируют на сенсорном чипе прибора, и образец, содержащий FcRn или его правильно свернутый фрагмент, пропускают над чипом. Специалист может затем интерпретировать результаты, полученные таким экспериментом, для установления по меньшей мере количественного измерения аффинности связывания полипептида в отношении FcRn. Если является желательным количественное измерение, например, для определения значения Ko для взаимодействия, также можно использовать способы поверхностного плазмонного резонанса. Значения связывания можно, например, определять на приборе Biacore (GE Healthcare) или ProteOn XPR 36 (Bio-Rad). FcRn подходящим образом иммобилизируют на сенсорном чипе прибора, и образцы полипептида, активность которых, следует определить, получают серийным разведением и инъецируют в случайном порядке. Затем можно рассчитывать значения Ko из результатов с использованием, например, модели связывания Лангмюра 1:1 программы BIAevaluation 4.1 или другой подходящей программы, предоставленной изготовителем прибора.
В качестве альтернативы, как описано в приведенных ниже примерах, аффинность связывания в отношении FcRn можно тестировать в эксперименте, в котором образцы полипептида захватываются на планшетах ELISA, покрытых антителом, и добавляют биотинилированные FcRn, с последующим добавлением стрептавидина, конъюгированного с HRP (пероксидаза хрена). Добавляют субстрат ТМВ (тетраметилбензидин), и измеряют поглощение при 450 нм с использованием планшет-ридера для многолуночных планшетов, такого как Victor3 (Perkin Elmer). Специалист может затем интерпретировать результаты, полученные в таких экспериментах, для установления по меньшей мере количественного измерения аффинности связывания полипептида в отношении FcRn. Если желательным является количественное измерение, например, для определения значения KD (полумаксимальная эффективная концентрация) для взаимодействия, также можно использовать ELISA. Ответ полипептидов против серии разведения биотинилированного FcRn измеряется с использованием ELISA, как описано выше. Специалист может затем интерпретировать результаты, полученные такими экспериментами, и значения KD можно рассчитывать из результатов с использованием, например, GraphPad Prism 5 и нелинейной регрессии.
В одном воплощении предложен полипептид, связывающийся с FcRn, который способен к связыванию с FcRn при рН 6 так, что значение KD взаимодействия составляет максимум 1×10-6 М, например, максимум 1×10-7 М, например, максимум 1×10-8 М, например, максимум 1×10-9 М, например, максимум 1×10-10 М. Полипептид, связывающийся с FcRn, согласно данному воплощению будет связываться или оставаться связанным с FcRn в условиях кислотного рН, такого как рН 6,0, например, в лизосоме. Если такой полипептид попадет во все более кислотную внутриклеточную среду, он будет рециркулировать в плазматическую мембрану через его взаимодействие с FcRn и, таким образом, избежит деградации.
В одном воплощении значение KD взаимодействия между полипептидом, связывающимся с FcRn, и FcRn при рН 7,4 выше, чем значение KD указанного взаимодействия при рН 6,0. Таким образом, полипептид, связывающийся с FcRn, будет связываться с FcRn с большей аффинностью при рН 6,0, чем при рН 7,4. В одном воплощении значение KD указанного взаимодействия при рН 7,4 по меньшей мере в 2 раза больше, например, по меньшей мере в 5 раз больше, например, по меньшей мере в 10 раз больше, например, по меньшей мере в 50 раз больше, например, по меньшей мере в 100 раз больше, чем значение KD указанного взаимодействия при рН 6,0.
В одном воплощении значение Ko взаимодействия между полипептидом, связывающимся с FcRn, и FcRn при рН 7,4 составляет по меньшей мере 1×10-8 М, например, по меньшей мере 1×10-7 М, например, по меньшей мере 1×10-6 М, например, по меньшей мере 1×10-5 М. В некоторых воплощениях единственным критерием для взаимодействия между полипептидом, связывающимся с FcRn, и FcRn при рН 7,4 является то, что любой полипептид, связывающийся с FcRn, который связался с FcRn во время более кислотных условий, быстрее высвобождается от FcRn при увеличении значения рН.
В альтернативном воплощении предложен полипептид, связывающийся с FcRn, для которого KD указанного взаимодействия при рН 7,4 является такой же или меньшей, чем KD указанного взаимодействия при рН 6,0. Полипептид, связывающийся с FcRn, согласно данному воплощению будет связываться или оставаться связанным с FcRn в условиях кислотного рН (т.е. иметь скорость диссоциации при рН 6,0, которая является достаточно низкой для того, чтобы избегать высвобождения), например, в лизосоме, а также в условиях нейтрального или слабоосновного рН, например, на плазматической мембране. В более конкретном воплощении значение KD указанного взаимодействия при рН 7,4 по меньшей мере в 2 раза меньше, например, по меньшей мере в 5 раз меньше, например, по меньшей мере в 10 раз меньше, например, по меньшей мере в 50 раз меньше, например, по меньшей мере в 100 раз меньше, чем значение KD указанного взаимодействия при рН 6,0.
В другом воплощении предложен полипептид, связывающийся с FcRn, который способен к связыванию с FcRn при рН 7,4, так, что значение KD взаимодействия составляет максимум 1×10-6 М, например, максимум 1×10-7 М, например, максимум 1×10-8 М, например, максимум 1×10-9 М, например, максимум 1×10-10 М. Полипептид, связывающийся с FcRn, согласно данному воплощению будет связываться или оставаться связанным с FcRn в течение увеличенного времени в условиях нейтрального или слабоосновного рН, такого как рН 7,4, например, на плазматической мембране. Термин «оставаться связанным» следует понимать как означающий взаимодействие, имеющее медленную скорость диссоциации при данных условиях.
В общем, специалист знает, что значение KD взаимодействия определяется как отношение между скоростью диссоциации (koff) и скоростью ассоциации (kon). Таким образом, высокое значение KD может быть обусловлено либо высокой koff, низкой kon или обеими, и наоборот, низкое значение KD может быть обусловлено либо низкой koff, высокой kon или обеими.
Специалист поймет, что с полипептидом, связывающимся с FcRn, согласно любому раскрытому здесь аспекту можно делать разные модификации и/или осуществлять присоединения для того, чтобы приспосабливать данный полипептид для конкретного применения, без отступления от объема настоящего раскрытия.
Например, в одном воплощении предложен полипептид, связывающийся с FcRn, как здесь описано, который был продлен на одну или более чем одну аминокислоту на С-конце и/или N-конце. Следует понимать, что такой полипептид представляет собой полипептид, имеющий один или более чем один дополнительный аминокислотный остаток в самом первом и/или самом последнем положении в полипептидной цепи. Таким образом, полипептид, связывающийся с FcRn, может содержать любое подходящее число дополнительных аминокислотных остатков, например, по меньшей мере один дополнительный аминокислотный остаток. Каждый дополнительный аминокислотный остаток может быть индивидуально или коллективно добавлен для того, чтобы, например, улучшать продукцию, очистку, стабилизацию in vivo или in vitro, связывание или выявление полипептида. Такие дополнительные аминокислотные остатки могут включать один или более чем один аминокислотный остаток, добавленный с целью химического связывания. Одним примером этого является добавление остатка цистеина. Такие дополнительные аминокислотные остатки также могут давать «метку» для очистки или выявления полипептида, такую как метка His6 или метка «туе» (с-myc), или метка «FLAG» для взаимодействия с антителами, специфичными в отношении метки, или аффинной хроматографии с иммобилизированным металлом (IMAC), в случае гексагистидиновой метки.
Дополнительные аминокислоты, как обсуждалось выше, могут быть связаны с полипептидом, связывающися с FcRn, посредством химического конъюгирования (с использованием известных способов органической химии) или любыми другими способами, такими как экспрессия полипептида, связывающегося с FcRn, в виде слитого белка или присоединение любым другим способом - либо непосредственно, либо через линкер, например, аминокислотный линкер.
Дополнительные аминокислоты, как обсуждалось выше, могут, например, содержать один или более чем один полипептидный домен. Дополнительный полипептидный домен может предоставлять полипептид, связывающийся с FcRn, с другой функцией, такой например, другая функция связывания, или ферментативная функция, или функция токсичности, или функция флуоресцентной сигнализации, или их комбинации.
Дополнительный полипептидный домен, кроме того, может предоставлять другую группировку, связывающуюся с FcRn, с той же самой функцией связывания с FcRn. Таким образом, в дополнительном воплощении предложен полипептид, связывающийся с FcRn, в мультимерной форме. Понятно, что указанный мультимер содержит по меньшей мере два полипептида, связывающихся с FcRn, как здесь раскрыто, в виде мономерных единиц, аминокислотные последовательности которых могут быть одинаковыми или разными. Мультимерные формы полипептидов могут содержать подходящее число доменов, причем каждый имеет мотив связывания с FcRn, и каждый образует мономер в пределах мультимера. Эти домены могут иметь одинаковую аминокислотную последовательность, но, в качестве альтернативы, они могут иметь разные аминокислотные последовательности. Другими словами, полипептид, связывающийся с FcRn, по изобретению может образовать гомо- или гетеромультимеры, например, гомо- или гетеродимеры. В одном воплощении предложен полипептид, связывающийся с FcRn, в котором указанные мономерные единицы связаны друг с другом ковалентно. В другом воплощении мономерные единицы указанного полипептида, связывающегося с FcRn, экспрессируются в виде слитого белка. В одном воплощении предложен полипептид, связывающийся с FcRn, в димерной форме.
Дополнительно также рассматриваются и попадают в объем настоящего раскрытия «гетерогенные» слитые полипептиды или белки, или конъюгаты, в которых описанный здесь полипептид, связывающийся с FcRn, или его мультимер составляет первый домен или первую группировку, и вторая и дополнительные группировки имеют другие функции, чем связывание с FcRn. Вторая и дополнительная группировка/группировки слитого полипептида или конъюгата в таком белке подходящим образом имеют желательную биологическую активность.
Таким образом, во втором аспекте настоящего раскрытия предложен слитый белок или конъюгат, содержащий первую группировку, состоящую из полипептида, связывающегося с FcRn, согласно первому аспекту, и вторую группировку, состоящую из полипептида, имеющего желаемую биологическую активность. В другом воплощении указанный слитый белок или конъюгат может дополнительно содержать другие группировки, имеющие желаемые биологические активности, которые могут быть или такими же, или отличными от биологической активности второй группировки.
Такие гетерогенные слитые полипептиды также могли бы использоваться для создания гетеромультимерных комплексов более высокого порядка. Один пример представляет собой гетеродимерный комплекс из двух слитых полипептидов, причем каждый содержит полипептид, связывающийся с FcRn, согласно настоящему раскрытию в слиянии с другой группировкой. Такой комплекс может, например, образовать гетеродимер in vivo или in vitro и может поддерживаться нековалентными и/или ковалентными взаимодействиями. Конкретным примером такого комплекса является фрагмент Fab, в котором и каждая легкая цепь, и каждая тяжелая цепь продуцируются в слиянии с полипептидом, связывающимся с FcRn, и который может включать междоменную дисульфидную связь. С использованием слитых белков, связывающихсяс FcRn, в качестве мономерных единиц можно сконструировать много биологически релевантных гетеродимерных комплексов, известных специалисту.
В одном воплощении указанного слитого белка или конъюгата общий размер молекулы ниже порога для эффективного почечного клиренса при введении субъекту-млекопитающему.
В другом воплощении указанного слитого белка или конъюгата общий размер молекулы выше порога для эффективного почечного клиренса при введении субъекту-млекопитающему.
В одном воплощении предложен слитый белок или конъюгат, где период полувыведения указанного слитого белка или конъюгата in vivo дольше, чем период полувыведения in vivo самого по себе полипептида, имеющего желаемую биологическую активность.
Неограничивающие примеры желательной биологической активности включают терапевтическую активность, активность связывания и ферментативную активность.
В одном воплощении указанная желаемая биологическая активность представляет собой активность связывания выбранной мишени.
Одним примером такой активности связывания является активность связывания, которая увеличивает период полувыведения слитого белка или конъюгата in vivo. Данный слитый белок или конъюгат может содержать по меньшей мере одну дополнительную группировку. В одном конкретном воплощении указанной мишенью является альбумин, связывание с которым увеличивает период полувыведения указанного слитого белка или конъюгата in vivo. В одном воплощении указанная активность связывания с альбумином обеспечена доменом связывания с альбумином (ABD) стрептококкового белка G или его производного. Например, указанный слитый белок или конъюгат, содержащий по меньшей мере одну дополнительную группировку, может содержать [группировка полипептида, связывающегося с FcRn]-[rpynnnpoBKa связывания с альбумином]-[группировка с аффинностью в отношении выбранной мишени]. Следует понимать, что три данные группировки в этом примере могут быть организованы в любом порядке от N- до С-конца полипептида.
В одном воплощении при образовании (или сохранении) комплекса между мишенью и слитым белком или конъюгатом, как здесь описано, при кислом рН, таком как рН 6,0, данная мишень спасается от элиминирования посредством лизосомальной деградации. Таким образом, удлиняется период полувыведения мишени. Удлинение периода полувыведения подразумевает то, что скорость устранения мишени меньше при взаимодействии с указанным слитым белком или конъюгатом, чем скорость устранения молекулы-мишени в отсутствие указанного слитого белка или конъюгата. Кроме того, в данном воплощении является желательным, что связывание мишени слитым белком или конъюгатом не должно существенно мешать функции мишени.
С другой стороны, когда комплекс между мишенью и слитым белком или конъюгатом, как здесь описано, не сохраняется или не образуется при кислом рН, данная мишень направляется в субклеточные лизосомы, где она деградирует.
В одном воплощении предложен слитый белок или конъюгат, где скорость устранения выбранной, нежелательной мишени из субъекта увеличена. Усиленное устранение нежелательной мишени подразумевает повышенную скорость устранения мишени из тела многоклеточного организма по сравнению с «нормальной» скоростью устранения молекулы мишени самой по себе, т.е. без предыдущего взаимодействия со слитым белком или конъюгатом.
В другом воплощении связывание выбранной нежелательной мишени могло бы инактивировать функцию мишени, блокируя, посредством этого, ее биологическую активность в ситуациях, когда это желательно. Такая биологическая активность может представлять собой, например, активацию или блокирование рецепторов или ферментативной или иным образом токсичой или нежелательной активности. Такая нежелательная мишень может представлять собой эндогенный гормон, фермент, цитокин, хемокин или мишень, имеющую некоторую другую биологическую активность. Посредством применения инактивирующего связывания мишени биологическая активность блокируется до тех пор, пока мишень не доставляется для деградации и не высвобождается при низком значении рН, и слитый белок, связывающий мишень, не рециркулирует в кровоток. Это рециркулирование слитого белка, связывающего мишень (через его группировку, связывающуюся с FcRn), позволяет ему «катализировать» удаление более чем одной молекулы выбранной нежелательной мишени.
Нежелательные мишени могут, например, быть чужеродными белками и соединениями или экспрессируемыми в природе белками, которые демонстрируют повышенные уровни в плазме после медицинского состояния, и где терапевтический эффект может достигаться устранением указанного белка. Нежелательная мишень не обязательно равномерно распределена в плазме, но может быть сконцентрирована в определенных участках, например, около опухоли или в местах воспаления.
Неограничивающие примеры мишеней представляют собой мишени, выбранные из группы, состоящей из аллергенов, амилоидов, антител, автоантигенов, факторов свертывания крови, гормонов, опухолевых клеток, молекул лекарственного средства, цитокинов, хемокинов, протеаз, медиаторов гиперчувствительности, провоспалительных факторов, токсинов, таких как бактериальные токсины и змеиные яды, загрязнителей, металлов и антиоксидантов.
При определенных условиях, например, при определенных раковых заболеваниях, желательно удалять эндогенные молекулы, например, VEGF (фактор роста эндотелия сосудов), PDGF (фактор роста тромбоцитов), HGF (фактор роста гепатоцитов) и другие гормоны стимуляции роста. Такие молекулы также могут быть подвергнуты направленному действию посредством связывающей функциональной группы в указанном слитом белке или конъюгате.
При других условиях, например, при определенных иммунологических заболеваниях, может быть желательным временное удаление эндогенных молекул, таких как избранные интерлейкины или TNF (фактор некроза опухоли). Такие молекулы также могут быть подвергнуты направленному действию посредством связывающей функциональной группы в указанном слитом белке или конъюгате.
В одном воплощении второй группировкой, имеющей желаемую биологическую активность, является терапевтически активный полипептид. Неограничивающими примерами терапевтически активных полипептидов являются биомолекулы, такие как молекулы, выбранные из группы, состоящей из ферментов, например, альгазидазы α и β, глюкоцереброзидазы, ларонидазы, арилсульфатазы, аглюкозидазы-α, аспарагиназы, Фактора VII, Фактора VIII, Фактора IX и Фактора Ха; гормонов и факторов роста, например, гормона роста, трансформирующего фактора роста-β2, эритропоэтина, инсулина, инсулиноподобного фактора роста-1, миостатина, фактора роста костной ткани и глюкагоноподобного пептида-1; хемокинов, например, CCL17, CCL19, CCL20, CCL21, CCL22, CCL27, XCL1 и CXC3CL1; и цитокинов, например, интерлейкина (IL)-2, IL-4, IL-7, IL-10, IL-12, IL-15, IL-18, IL-22, IL-27, интерферона (IFN)-α, IFN-β, IFN-γ, фактора некроза опухолей, гранулоцитарного колониестимулирующего фактора (G-CSF), макрофагального CSF и гранулоцитарно-макрофагального CSF.
Как понятно специалисту, полипептид, связывающийся с FcRn, согласно первому аспекту может быть полезным в слитом белке или в качестве конъюгатного партнера с любой другой группировкой. Следовательно, приведенные выше списки терапевтически активных полипептидов не следует каким-либо образом истолковывать как ограничивающие.
Также рассматриваются другие возможности для создания слитых полипептидов или конъюгатов. Таким образом, полипептид, связывающийся с FcRn, согласно первому аспекту изобретения может быть ковалентно связан со второй или дополнительной группировкой или группировками, которые, помимо или вместо связывания мишени, демонстрируют другие функции. Одним примером является слияние между одним или более чем одним полипептидом, связывающимся с FcRn, и ферментативно активным полипептидом, служащим в качестве репортерной или эффекторной группировки.
В том, что касается приведенного выше описания слитых белков или конъюгатов, включающих полипептид, связывающийся с FcRn, согласно данному раскрытию, следует отметить, что обозначение первой, второй и дополнительной группировок делается в целях ясности для различения между полипептидом, связывающимся с FcRn, или полипептидами согласно данному раскрытию, с одной стороны, и группировками, демонстрирующими другие функции, с другой стороны. Данные обозначения не предназначены для того, чтобы относиться к реальному порядку разных доменов полипептидной цепи слитого белка или конъюгата. Таким образом, например, указанная первая группировка, без ограничения, может оказаться на N-конце, в середине или на С-конце слитого белка или конъюгата.
В одном воплощении предложен полипептид, связывающийся с FcRn, слитый белок или конъюгат, который связывается с FcRn так, что связывание IgG с FcRn по меньшей мере частично ингибируется. Это ингибирование может быть обусловлено связыванием полипептида, связывающегося с FcRn, слитого белка или конъюгата с той же самой или по меньшей мере с частично перекрывающейся областью FcRn, что и IgG. В качестве альтернативы, полипептид, связывающийся с FcRn, слитый белок или конъюгат могут связываться с другой областью FcRn, чем IgG, но стерически ограничивают связывание IgG с FcRn. Таким образом, скорость устранения или клиренс IgG из кровеносной системы увеличиться из-за повышенной лизосомальной деградации IgG, так как рециркулирование IgG, опосредованное FcRn, будет полностью или частично недоступным из-за занятия сайтов связавания FcRn полипептидом, связывающимся с FcRn, согласно настоящему раскрытию. Другими словами введение полипептида, связывающегося с FcRn, слитого белка или конъюгата, или композиции согласно настоящему раскрытию будет действовать для увеличения катаболизма циркулирующих антител IgG.
В одном воплощении значение KD взаимодействия между полипептидом, связывающимся с FcRn, слитым белком или конъюгатом и FcRn меньше, чем KD взаимодействия между IgG и FcRn. Данная связь может иметь место и при рН 6,0, и при рН 7,4, или только при рН 6,0.
Приведенные выше аспекты дополнительно охватывают полипептиды, в которых полипептид, связывающийся с FcRn, согласно первому аспекту или полипептид, связывающийся с FcRn, содержащийся в слитом белке или конъюгате согласно второму аспекту, дополнительно содержит метку, такую как метка, выбранная из группы, состоящей из флуоресцентных красителей и металлов, хромофорных красителей, хемилюминисцентных соединений и биолюминисцентных белков, ферментов, радиоизотопов и частиц. Такие метки можно, например, использовать для выявления полипептида.
В других воплощениях меченый полипептид, связывающийся с FcRn, присутствует в виде группировки в слитом белке или конъюгате, также содержащем вторую группировку, имеющую желательную биологическую активность, и/или содержащем связывающую функциональную группу, как описано выше. В некоторых случаях метка может быть связана только с полипептидом, связывающимся с FcRn, и в некоторых воплощениях - и с полипептидом, связывающимся с FcRn, и со второй группировкой конъюгата или слитого белка. Кроме того, также возможно, что метка может быть связана только со второй группировкой, а не с группировкой, связывающейся с FcRn. Следовательно, в еще одном воплощении предложен полипептид, связывающийся с FcRn, содержащий вторую группировку, где указанная метка связана только со второй группировкой.
Когда делается ссылка на меченый полипептид, ее следует понимать как ссылку на все аспекты полипептидов, как здесь описано, включая слитые белки и конъюгаты, содержащие полипептид, связывающийся с FcRn, и вторую, и возможно дополнительные группировки. Таким образом, меченый полипептид может содержать только полипептид, связывающийся с FcRn, и, например, терапевтический радиоизотоп, который может быть хелатирован или ковалентно связан с полипептидом, связывающимся с FcRn, или содержать полипептид, связывающийся с FcRn, терапевтический радиоизотоп и вторую группировку, такую как маленькая молекула, имеющая желаемую биологическую активность, например, приводящую к терапевтической эффекивности.
В воплощениях, где полипептид, связывающийся с FcRn, слитый белок или конъюгат являются радиоактивно мечеными, такой радиоактивно меченый полипептид может содержать радиоизотоп. Большинство радиоизотопов имеют природу металлов, используются в ионной форме и обычно не могут образовать стабильные ковалентные связи с элементами, присутствующими в белках и пептидах. По этой причине мечение белков и пептидов радиоактивными металлами проводится с применением хелаторов, т.е. мультидентатных лигандов, которые образуют нековалентные соединения, именуемые хелатами, с ионами металлов. В одном воплощении полипептида, связывающегося с FcRn, слитого белка или конъюгата включение радиоизотопа обеспечивается посредством предоставления хелатирующего окружения, посредством которого радиоизотоп может быть координирован, хелатирован или комплексирован с полипептидом.
Одним примером хелатора является полиаминополикарбоксилатный тип хелатора. Можно различать два класса таких полиаминополикарбоксилатных хелаторов: макроциклические и ациклические хелаторы.
В одном воплощении полипептид, связывающийся с FcRn, слитый белок или конъюгат содержит хелатирующее окружение, предоставленное полиаминополикарбоксилатным хелатором, конъюгированным с полипептидом, связывающимся с FcRn, через тиольную группу остатка цистеина или эпсилон-аминогруппу остатка лизина.
Чаще всего используемыми макроциклическими хелаторами радиоизотопов индия, галлия, иттрия, висмута, радиоактивных актинидов и радиоактивных лантанидов являются разные производные DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота). В одном воплощении хелатирующее окружение полипептида, связывающегося с FcRn, слитого белка или конъюгата предоставлено DOTA или ее производным. Более конкретно, в одном воплощении хелатирующий полипептид, охватываемый настоящим раскрытием, получают путем проведения реакции производного DOTA 1,4,7,10-тетраазациклододекан-1,4,7-трис-уксусная кислота-10-малеимидоэтилацетамида (малеимидомоноамид-DOTA) с указанным полипептидом.
Дополнительно в качестве хелаторов могут быть использованы 1,4,7-триазациклононан-1,4,7-триуксусная кислота (NOTA) и ее производные. Следовательно, в одном воплощении предложен полипептид, связывающийся с FcRn, слитый белок или конъюгат, где полиаминополикарбоксилатный хелатор представляет собой 1,4,7-триазациклононан-1,4,7-триуксусную кислоту или ее производное.
Чаще всего используемыми ациклическими полиаминополикарбоксилатными хелаторами являются разные производные DTPA (диэтилентриамин-пентауксусная кислота). Следовательно, настоящим раскрытием также охватываются полипептиды, имеющие хелатирующее окружение, предоставленное диэтилентриаминпентауксусной кислотой или ее производными.
В другом воплощении полипептид, связывающийся с FcRn, продуцируемый рекомбинантно через экспрессию полинуклеотида или синтетически, конъюгируют с одним или более чем одним синтетическим полимером, например, для того, чтобы увеличить его гидродинамический радиус. С этой целью обычно используют полиэтиленгликоль (ПЭГ), но в данной области также использовали другие полимеры. Такое «ПЭГилирование» можно использовать для увеличения размера полипептида, связывающегося с FcRn, любого из описанных здесь типов до размера, превышающего порог эффективной почечной экскреции.
В одном воплощении синтетический полимер конъюгируют с одним или более чем одним химически синтезированным, мономерным полипептидом, связывающимся с FcRn. С тем же самым синтетическим полимером также могут быть конъюгированы другие функциональные группы. При химическом синтезе полипептида, связывающегося с FcRn, и других компонентов ни один из данных компонентов не должен быть получен в биологической системе, если это не желательно.
В предпочтительном воплощении один или более чем один синтетически или биологически изготовленный полипептид, связывающийся с FcRn, конъюгируют с синтетическим полимером для достижения размера, превышающего размер, ассоциированный с эффективным почечным клиренсом, и используют для блокирования связывания IgG с FcRn. Для сайт-специфичной конъюгации в каждом полипептиде, связывающемся с FcRn, можно использовать уникальный цистеин, например, цистеин, расположенный на С-конце, введенный для этой цели. При использовании разветвленного синтетического полимера с тем же самым полимером можно конъюгировать более чем две группировки, связывающиеся с FcRn, для усиления авидности и, следовательно, блокирования активности.
В третьем аспекте настоящего раскрытия предложен полинуклеотид, кодирующий полипептид, связывающийся с FcRn, или слитый белок, как здесь описано. Также данным раскрытием охватывается способ получения полипептида или слитого белка, как описано выше, включающий проведение экспрессии полинуклеотида; экспрессионный вектор, содержащий полинуклеотид; и клетка-хозяин, содержащая экспрессионный вектор.
Также охватывается способ получения полипептида, включающий культивирование указанной клетки-хозяина при условиях, допускающих экспрессию указанного полипептида от его экспрессионного вектора, и выделение полипептида.
Полипептид, связывающийся с FcRn, по настоящему раскрытию, в качестве альтернативы, может быть получен небиологическим пептидным синтезом с использованием аминокислот и/или производных аминокислот, имеющих защищенные реакционноспособные боковые цепи, причем небиологический пептидный синтез включает:
- поэтапное связывание аминокислот и/или производных аминокислот с образованием полипептида согласно первому аспекту, имеющего защищенные реакционноспособные боковые цепи,
- удаление защитных групп от реакционноспособных боковых цепей полипептида и
- сворачивание полипептида в водном растворе.
В четвертом аспекте данного раскрытия предложена композиция, содержащая полипептид, связывающийся с FcRn, слитый белок или конъюгат, как здесь описано, и по меньшей мере один фармацевтически приемлемый эксципиент или носитель. В одном его воплощении указанная композиция дополнительно содержит по меньшей мере один дополнительный активный агент, например, по меньшей мере два дополнительных активных агента, например, по меньшей мере три дополнительных активных агента. Неограничивающие примеры дополнительных активных агентов, которые могут оказаться полезными в такой комбинации, представляют собой иммунодепрессанты, противовоспалительные агенты, антимикробные агенты и ферменты.
В одном воплощении данного аспекта указанная композиция адаптирована для введения путем, выбранным из группы, состоящей из перорального введения, интраназального введения, легочного введения, вагинального введения, ректального введения, внутривенной инъекции, внутрибрюшинной инъекции, внутримышечной инъекции, подкожной инъекции и внутрикожной инъекции.
Термин «системное введение» в том виде, как он здесь используется, относится к такому пути введения, что интересующее вещество поступает в кровеносную систему, так что подвергается влиянию весь организм. Специалисту известно, что системное введение может происходить посредством энтерального введения (поглощение лекарственного средства через желудочно-кишечный тракт) или парентерального введения (обычно инъекция, инфузия или имплантация).
В одном воплощении указанная композиция адаптирована для системного или местного введения. В некоторых воплощениях можно использовать системное введение указанного соединения. В другом воплощении указанная композиция адаптирована для введения местным путем. Например, местное введение может представлять собой местное введение с использованием мази, пасты, пены или крема. В другом воплощении указанная композиция адаптирована для введения через эндотелиальный или эпителиальный слой. Здесь композиция может подвергаться трансцитозу через указанный слой.
В одном воплощении скорость поглощения композиции, содержащей слитый белок или конъюгат, как здесь описано, выше, чем скорость поглощения самих по себе полипептидов, соответствующих непосредственно второй или дополнительным группировкам. В одном воплощении скорость поглощения по меньшей мере в 2 раза выше, например, по меньшей мере в 5 раз выше, например, по меньшей мере в 10 раз выше, например, по меньшей мере в 25 раз выше, чем скорость поглощения второй или дополнительных группировок самих по себе.
Из приведенного выше раскрытия следует понимать, что полипептид, связывающийся с FcRn, слитый белок или конъюгат, или композиция, как здесь описано, могут быть, например, полезными в качестве терапевтического агента и/или как средство для продления периода полувыведения партнера по слиянию in vivo, и/или как средство для увеличения скорости устранения нежелательных мишеней.
Следовательно, в пятом аспекте настоящего раскрытия предложен полипептид, связывающийся с FcRn, слитый белок, конъюгат или композиция, как здесь раскрыто, для применения в качестве лекарственного средства.
В связанном шестом аспекте настоящего раскрытия предложен способ лечения субъекта, нуждающегося в этом, включающий стадию введения терапевтически активного количества полипептида, связывающегося с FcRn, слитого белка, конъюгата или композиция, как здесь раскрыто.
В одном воплощении любого из этих двух последних аспектов лекарственное средство или способ предназначены для лечения, при котором используется способность полипептида, связывающегося с FcRn, по меньшей мере частично блокировать связывание IgG с FcRn, т.е. лечения, при котором желательным является усиленный катаболизм антител IgG. В одном воплощении состоянием, при котором такое лечение может быть показано, является аутоиммунное состояние. В качестве неограничивающих примеров показанных состояний следует упомянуть тяжелую миастению, синдром Гийена-Барре, аутоиммунный энцефалит с поражением лимбической системы, детские аутоиммунные нейропсихиатрические расстройства, ассоциированные со стрептококковой инфекцией (PANDAS), нейромиотонию (синдром Исаака), синдром Морвана, рассеянный склероз, обыкновенную пузырчатку, листовидный буллезный пемфигоид, приобретенный буллезный эпидермолиз, пемфигоид беременных, пемфигоид слизистой оболочки, склероатрофический лишай, антифосфолипидный синдром, рецидивирующую полихондрию, аутоиммунную анемию, идиопатическую тромботическую пурпуру, аутоиммунный диффузный токсический зоб, дилатационную кардиомиопатию, васкулит, синдром Гудпасчера, идиопатическую мембранную нефропатию, ревматоидный артрит и системную красную волчанку.
В другом воплощении предложен полипептид, связывающийся с FcRn, слитый белок, конъюгат или композиция, как здесь описано, для применения в блокировании или удалении нежелательной мишени из кровотока. В одном воплощении указанная нежелательная мишень выбрана из группы, содержащей аллергены, амилоиды, антитела, аутоантигены, факторы свертывания крови, гормоны, опухолевые клетки, молекулы лекарственного средства, цитокины, хемокины, медиаторы гиперчувствительности, провоспалительные факторы, токсины, такие как бактериальные токсины и змеиные яды, загрязнители, металлы и антиоксиданты.
В то время как изобретение было описано со ссылкой на разные типичные аспекты и воплощения, специалистам в данной области будет понятно, что можно делать разные изменения, и эквиваленты могут быть заменены их элементами без отступления от объема данного изобретения. Кроме того, можно делать многие модификации для адаптации конкретной ситуации или молекулы к идеям изобретения без отступления от его существенного объема. Следовательно, подразумевается, что данное изобретение не ограничивается каким-либо конкретным рассматриваемым воплощением, но что данное изобретения будет включать все воплощения, попадающие в пределы объема приложенной формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
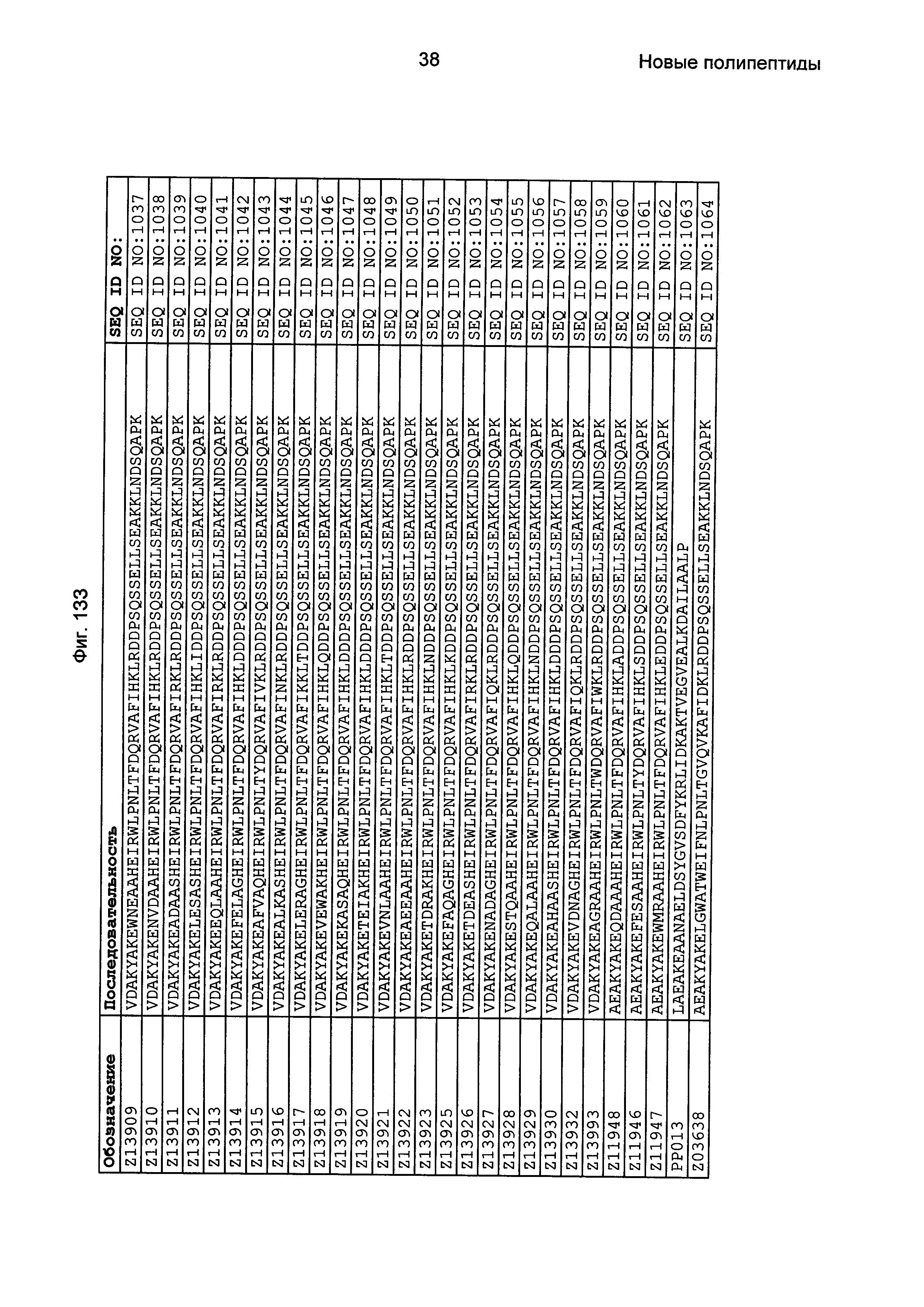
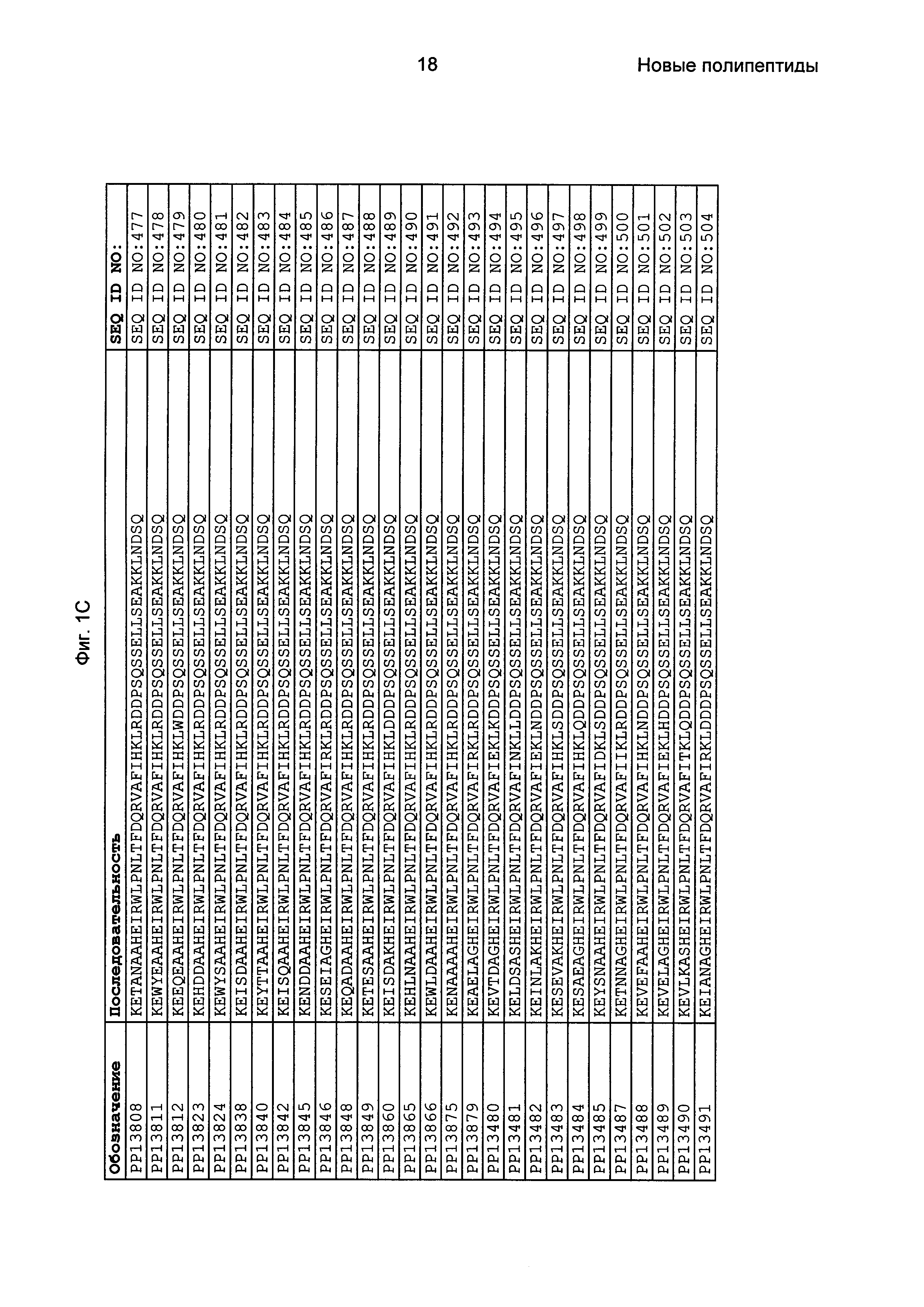
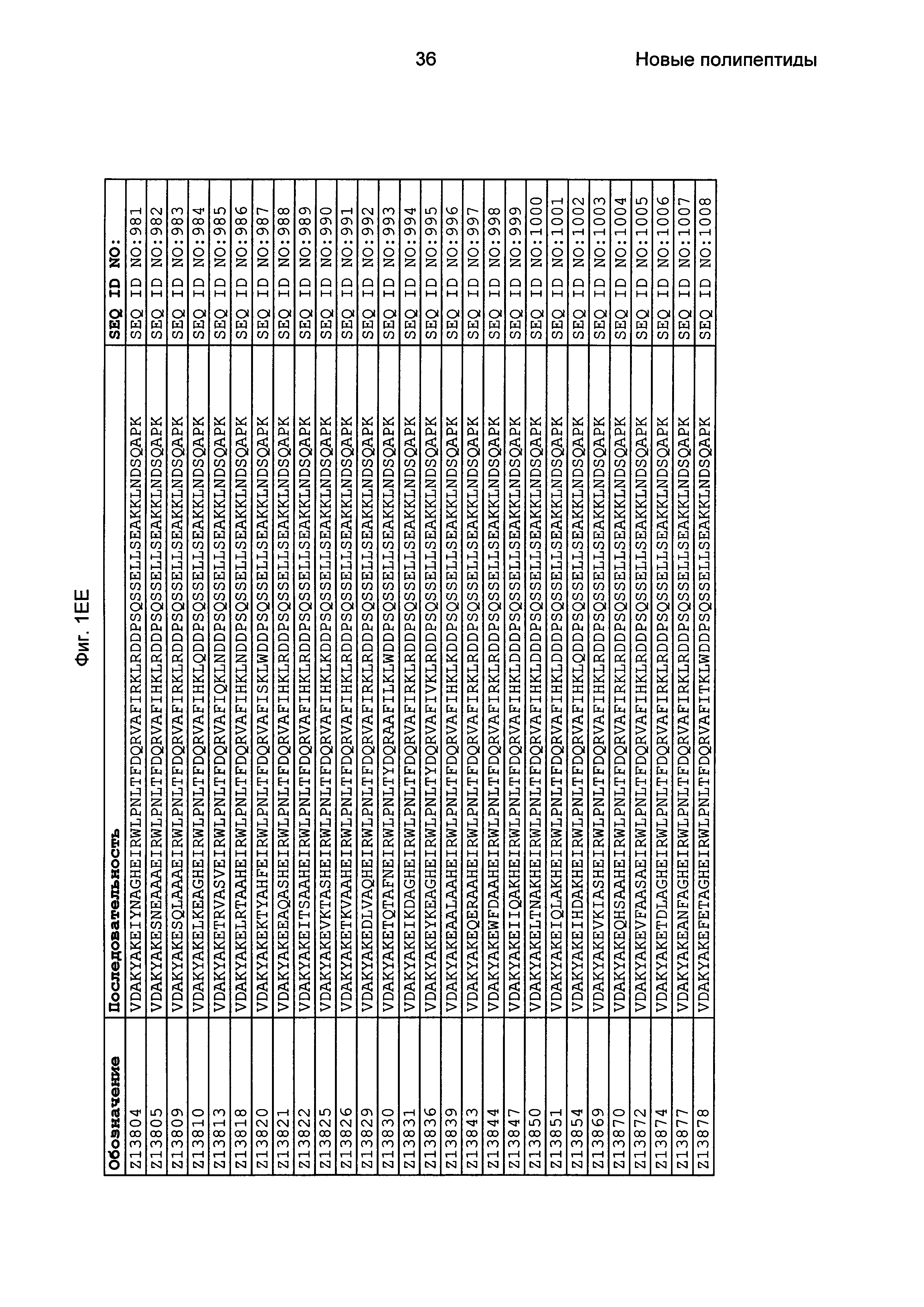
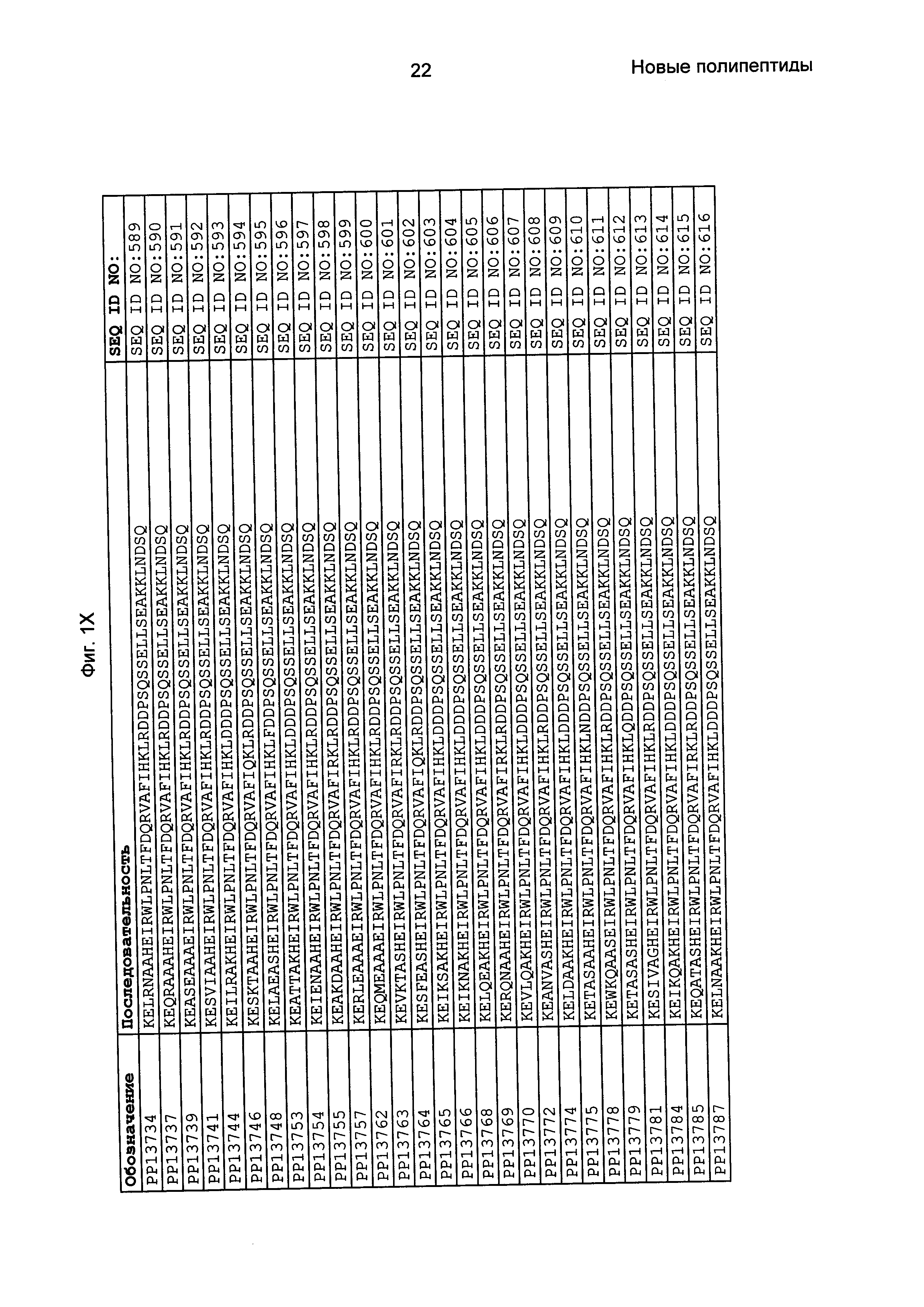
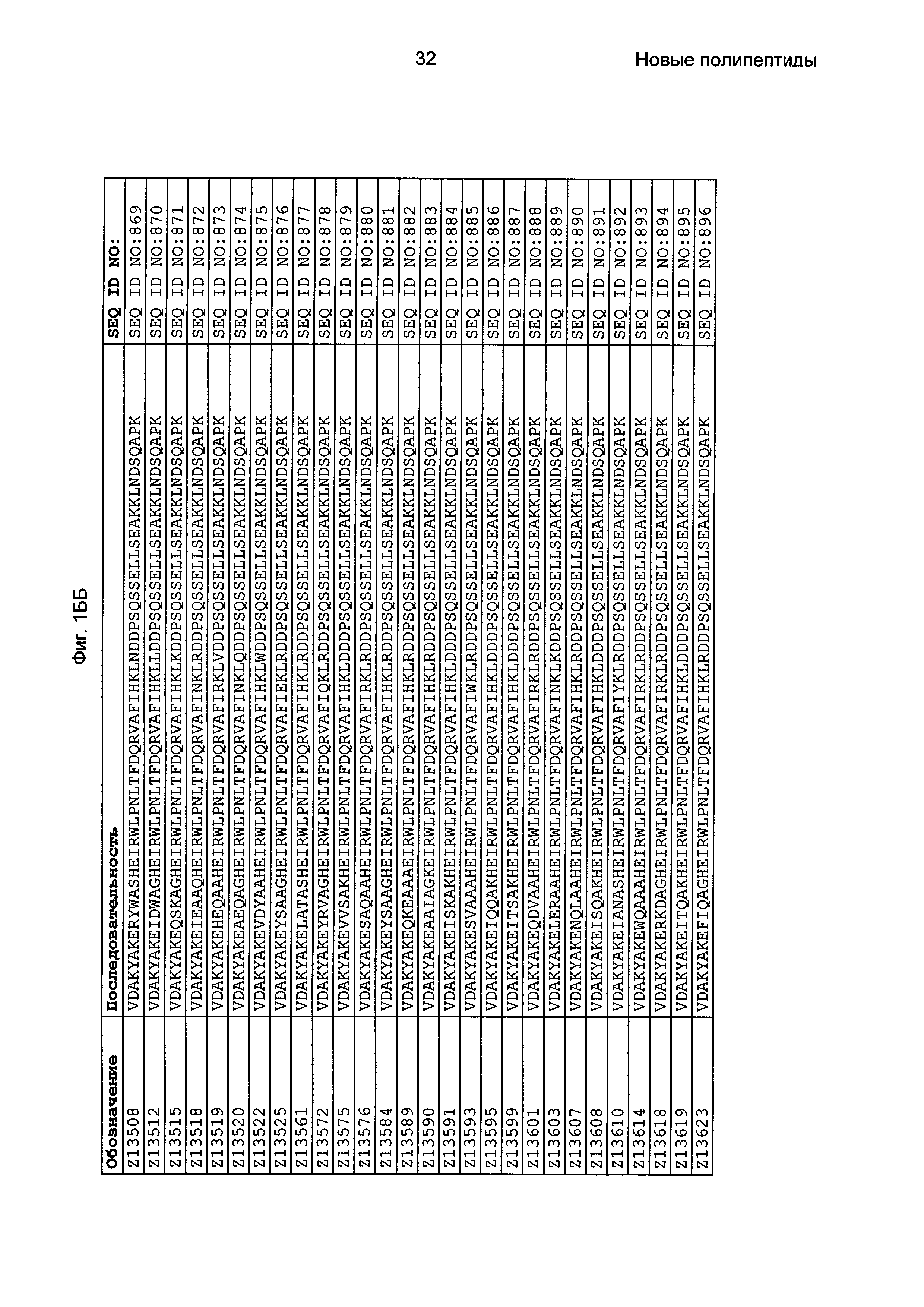
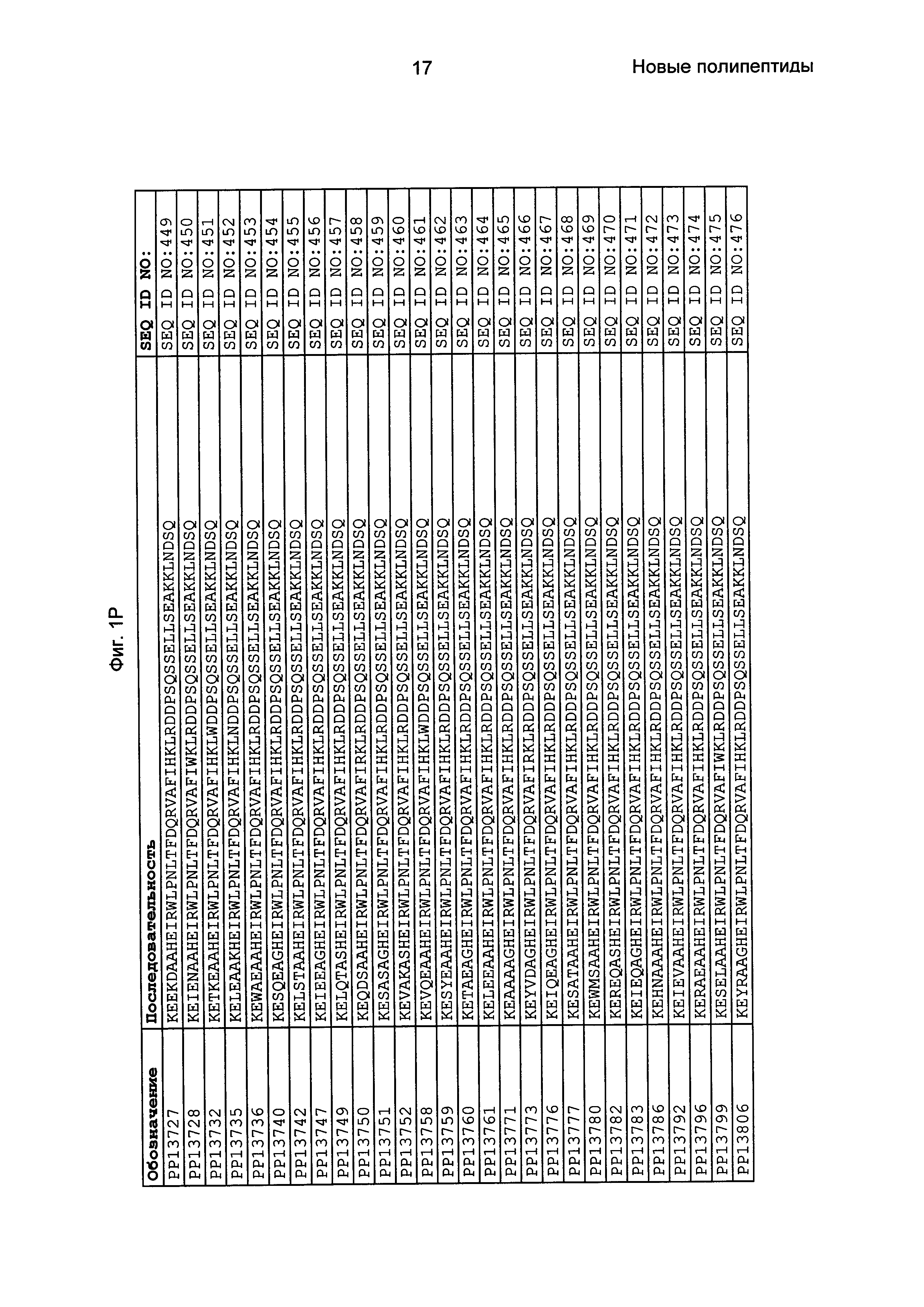
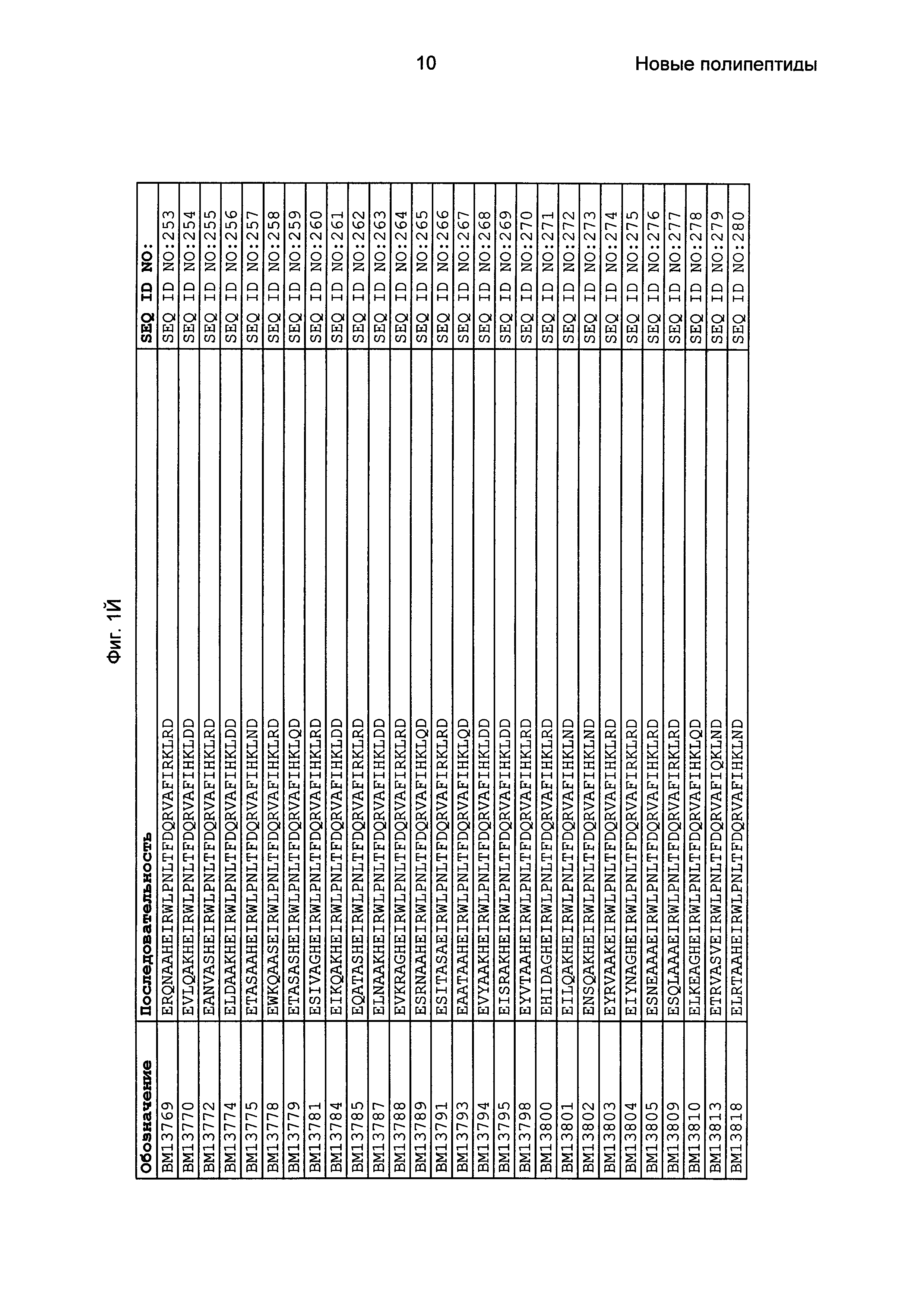
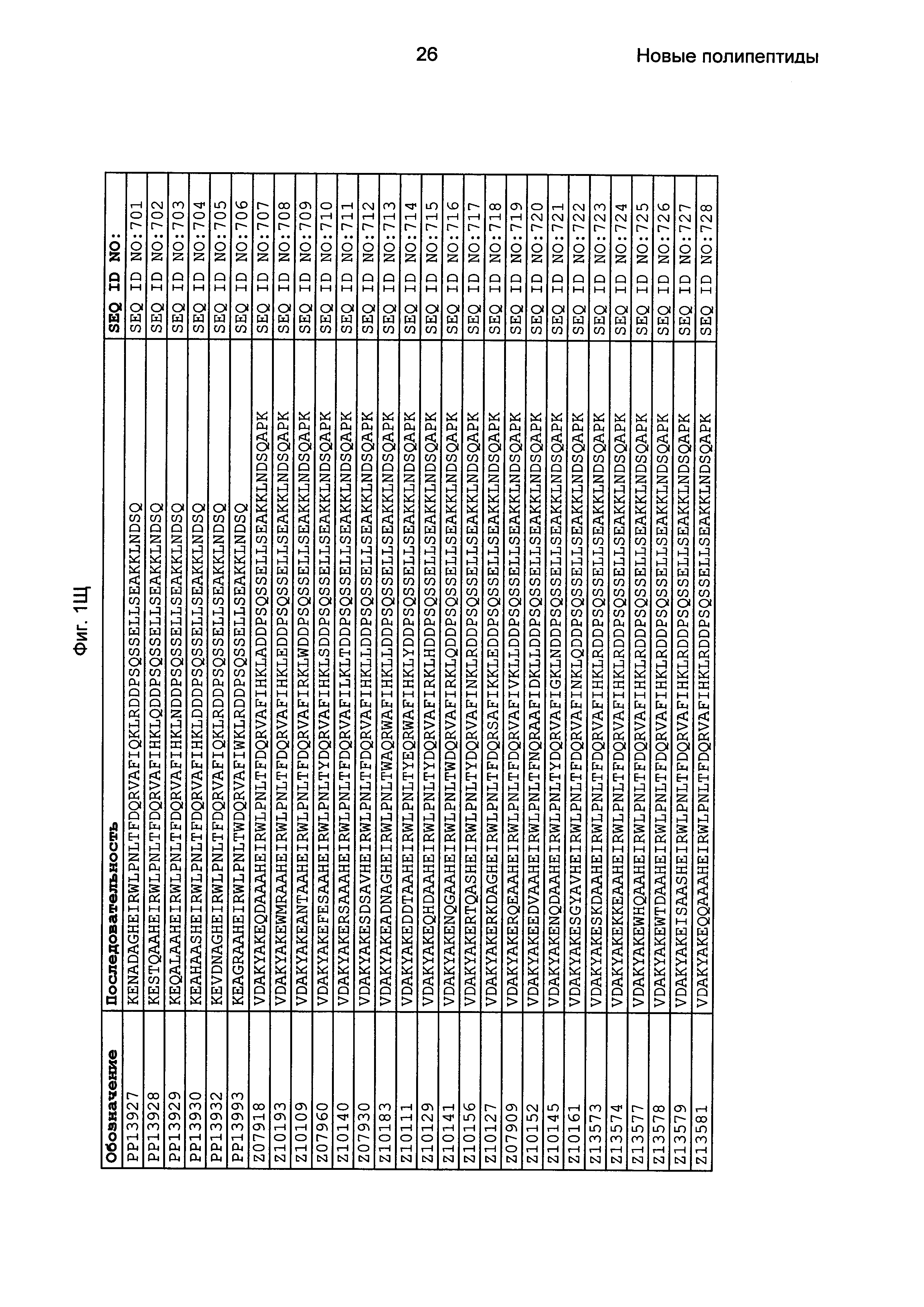
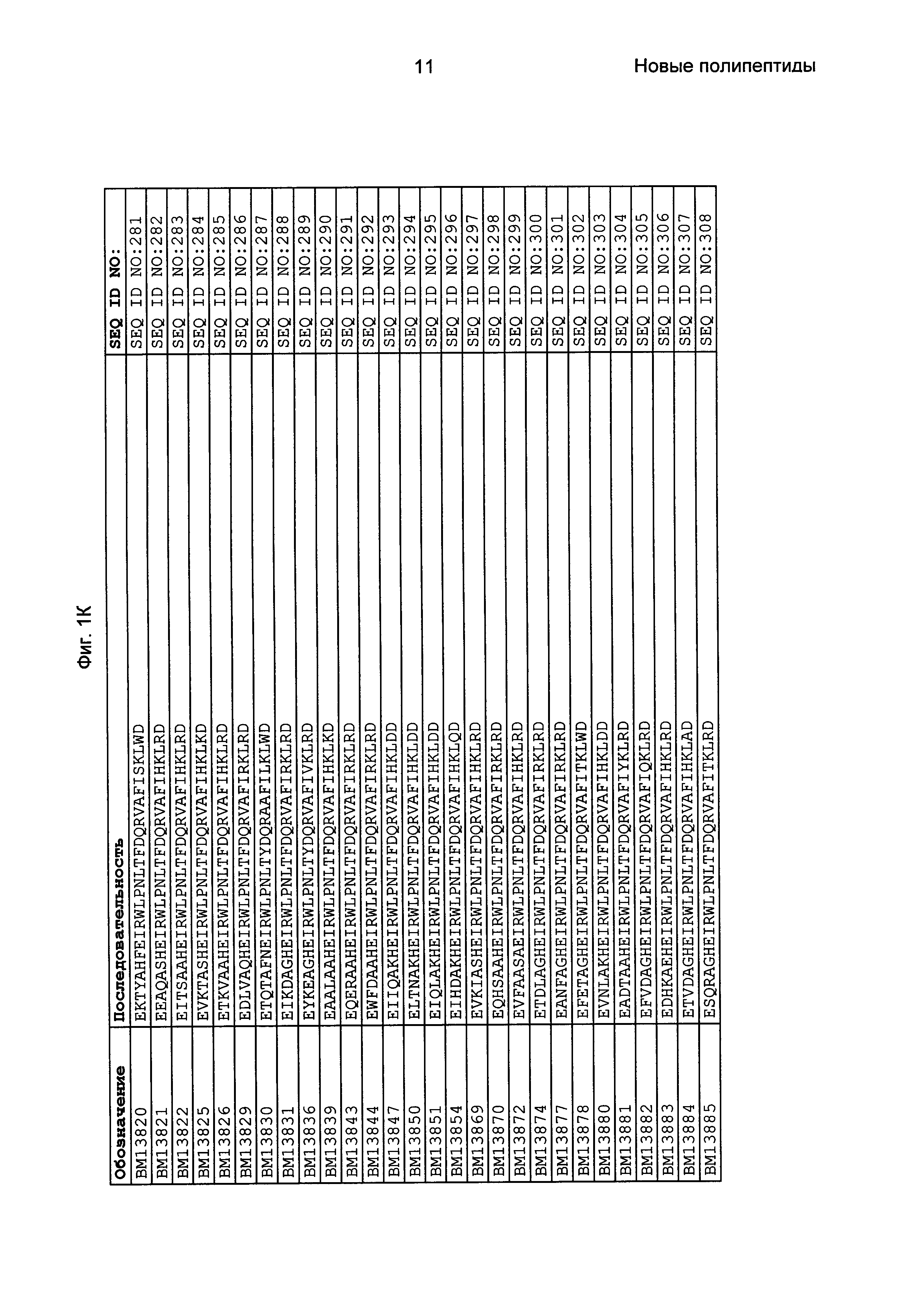
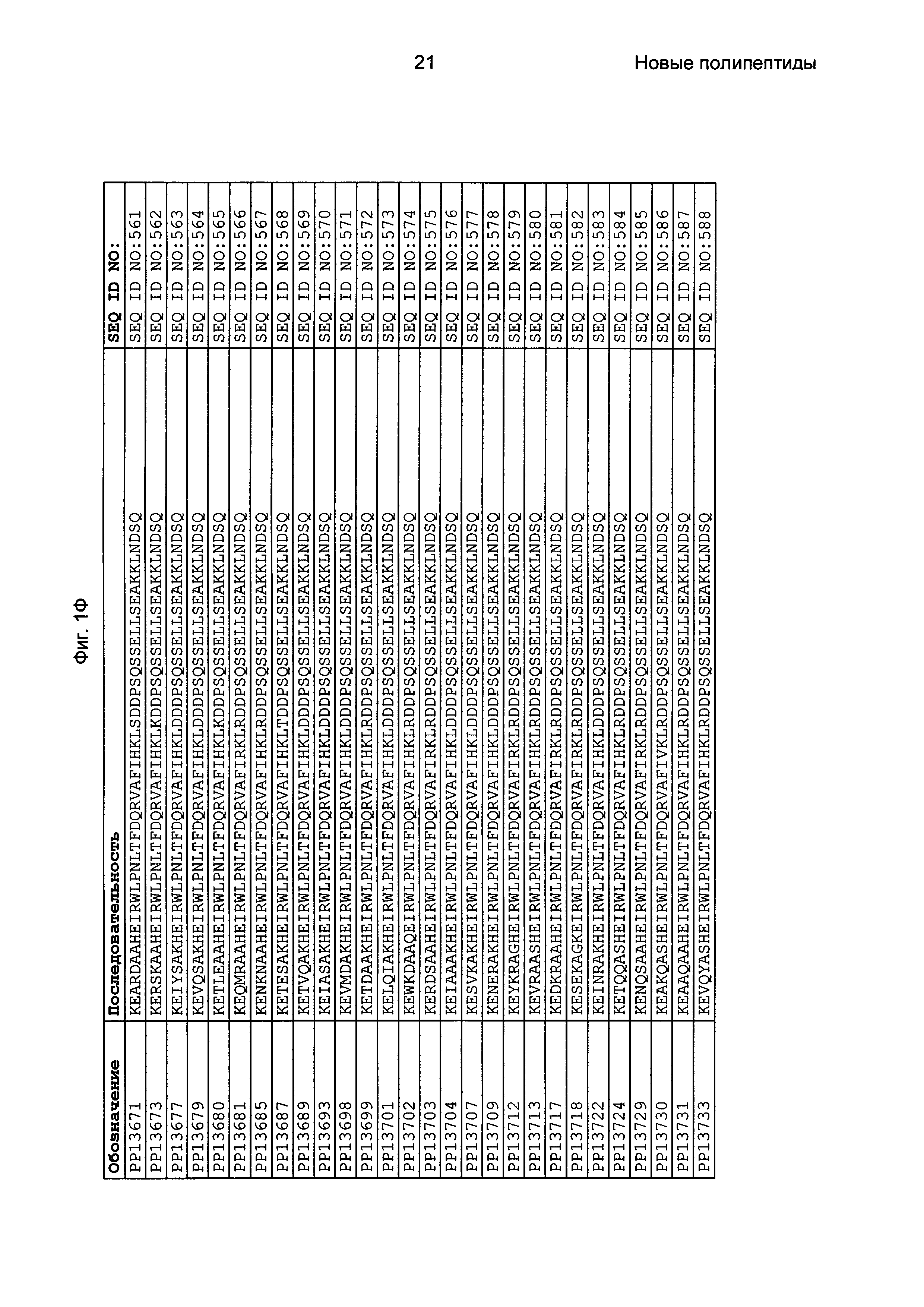
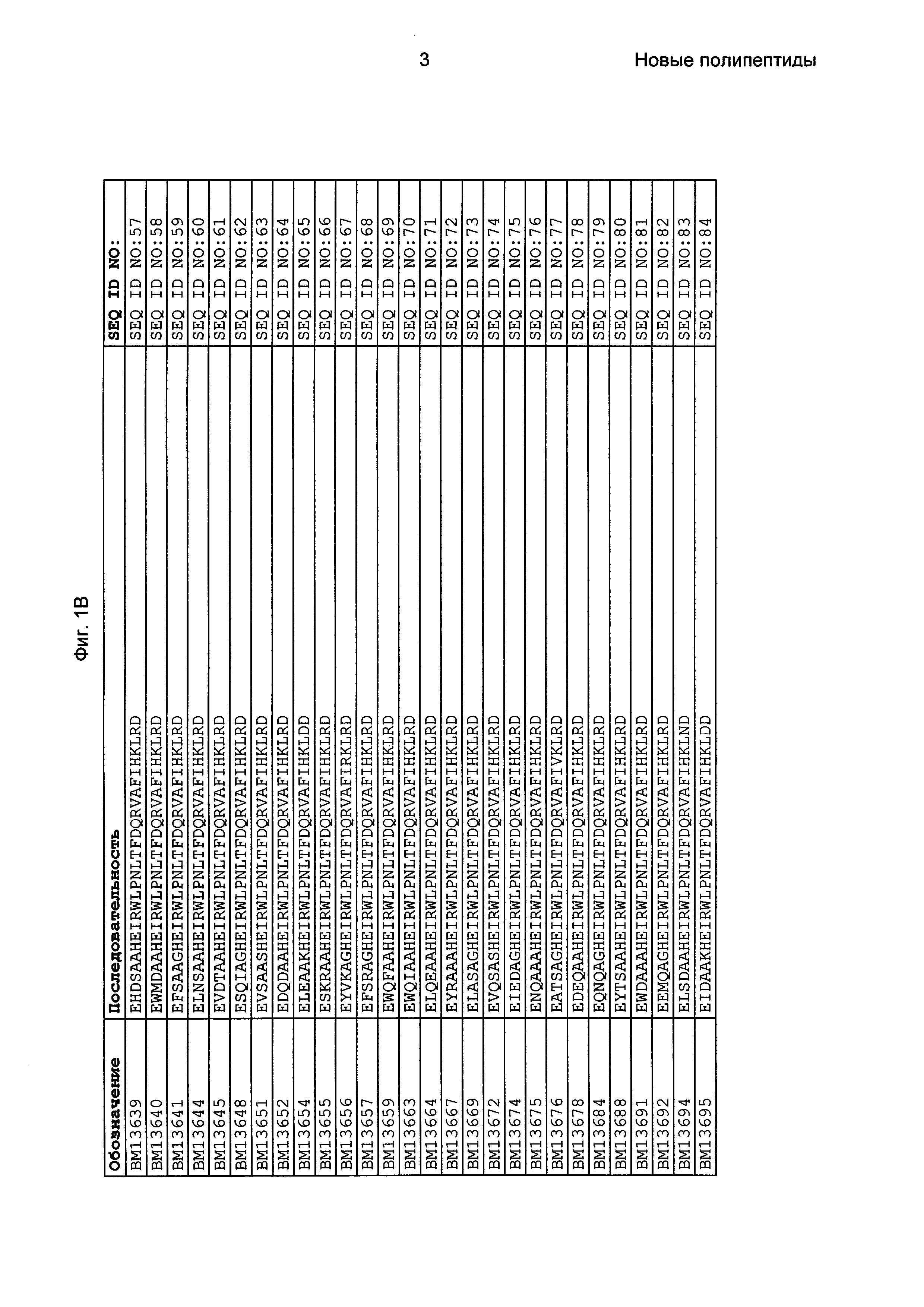
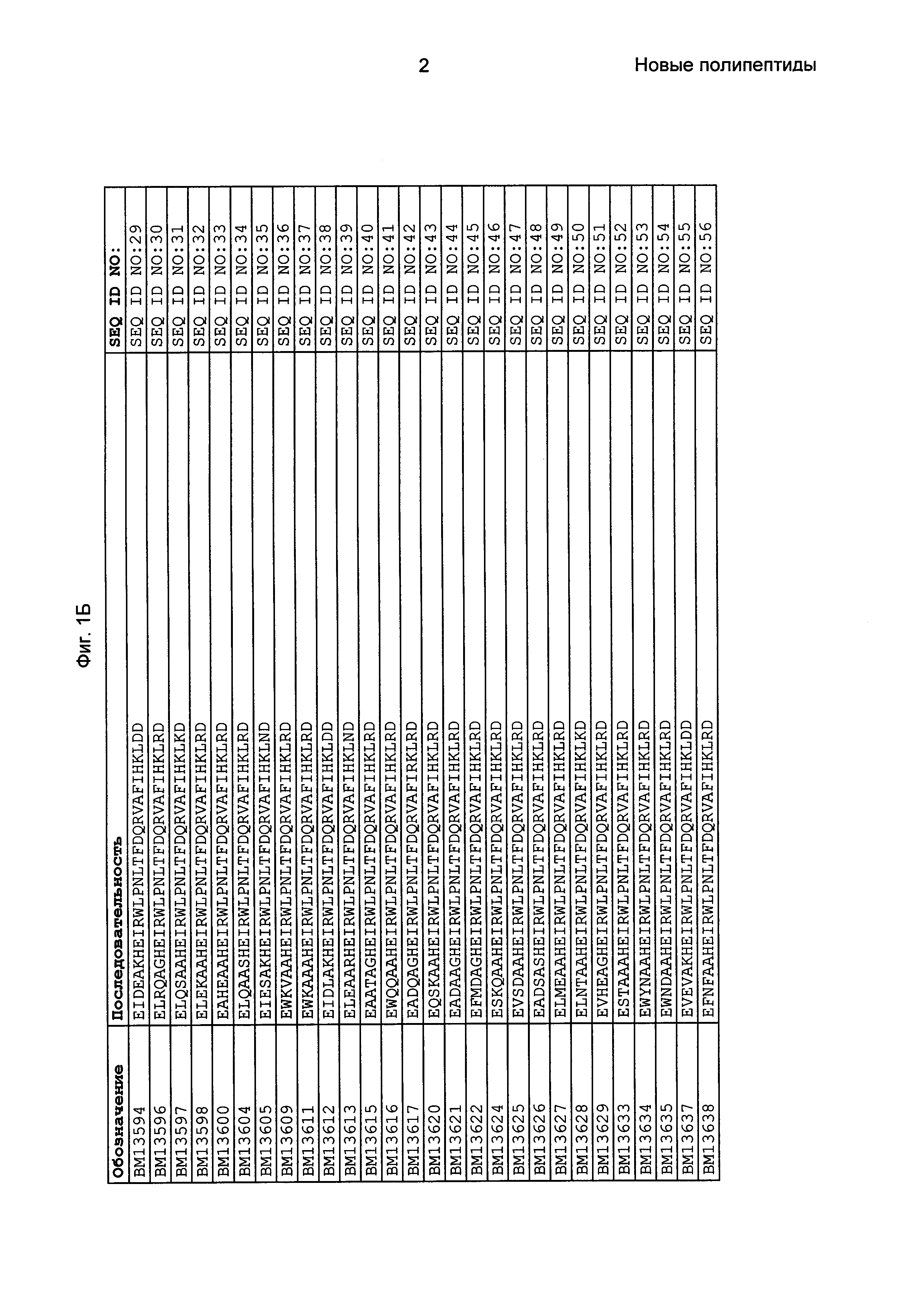
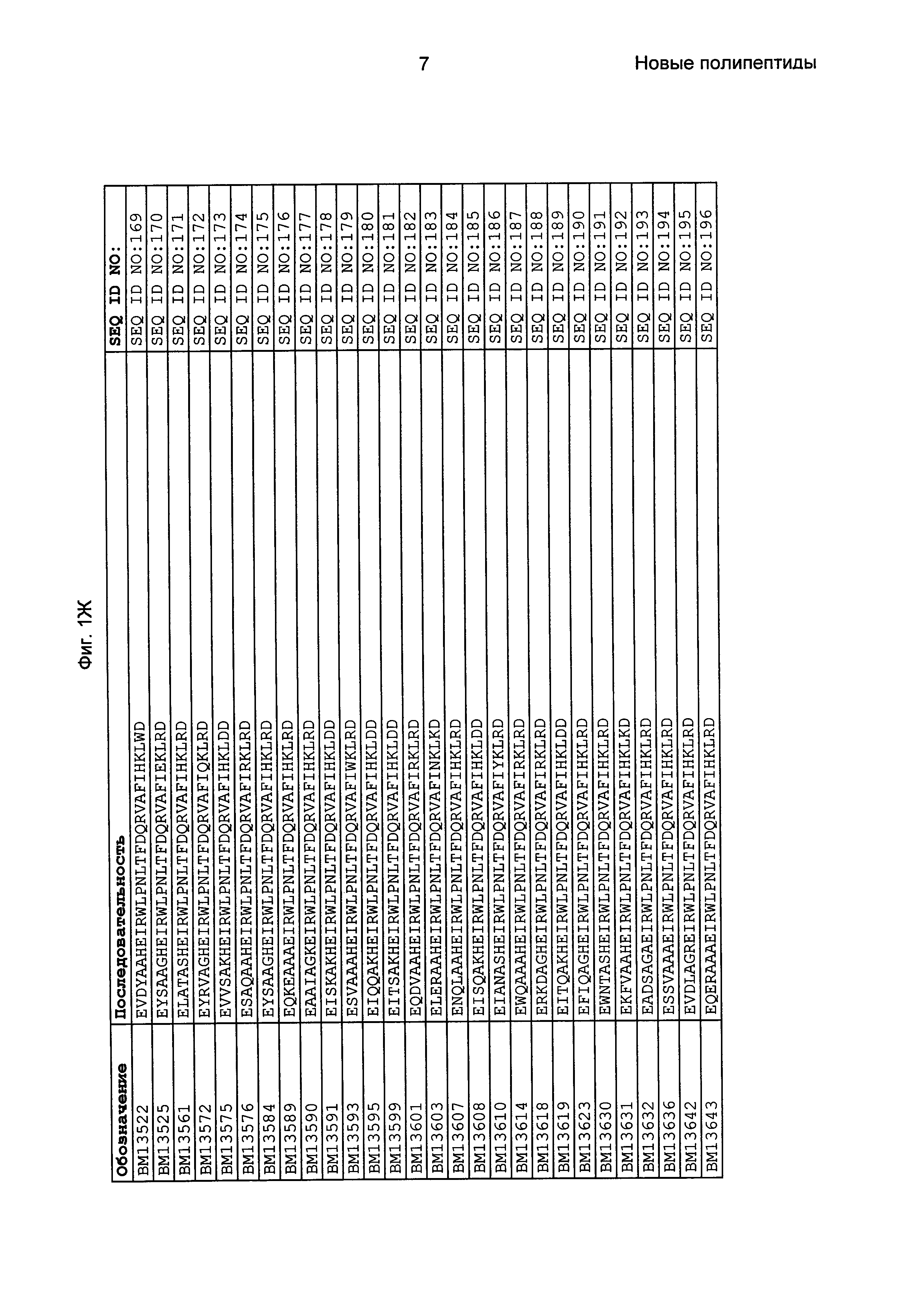
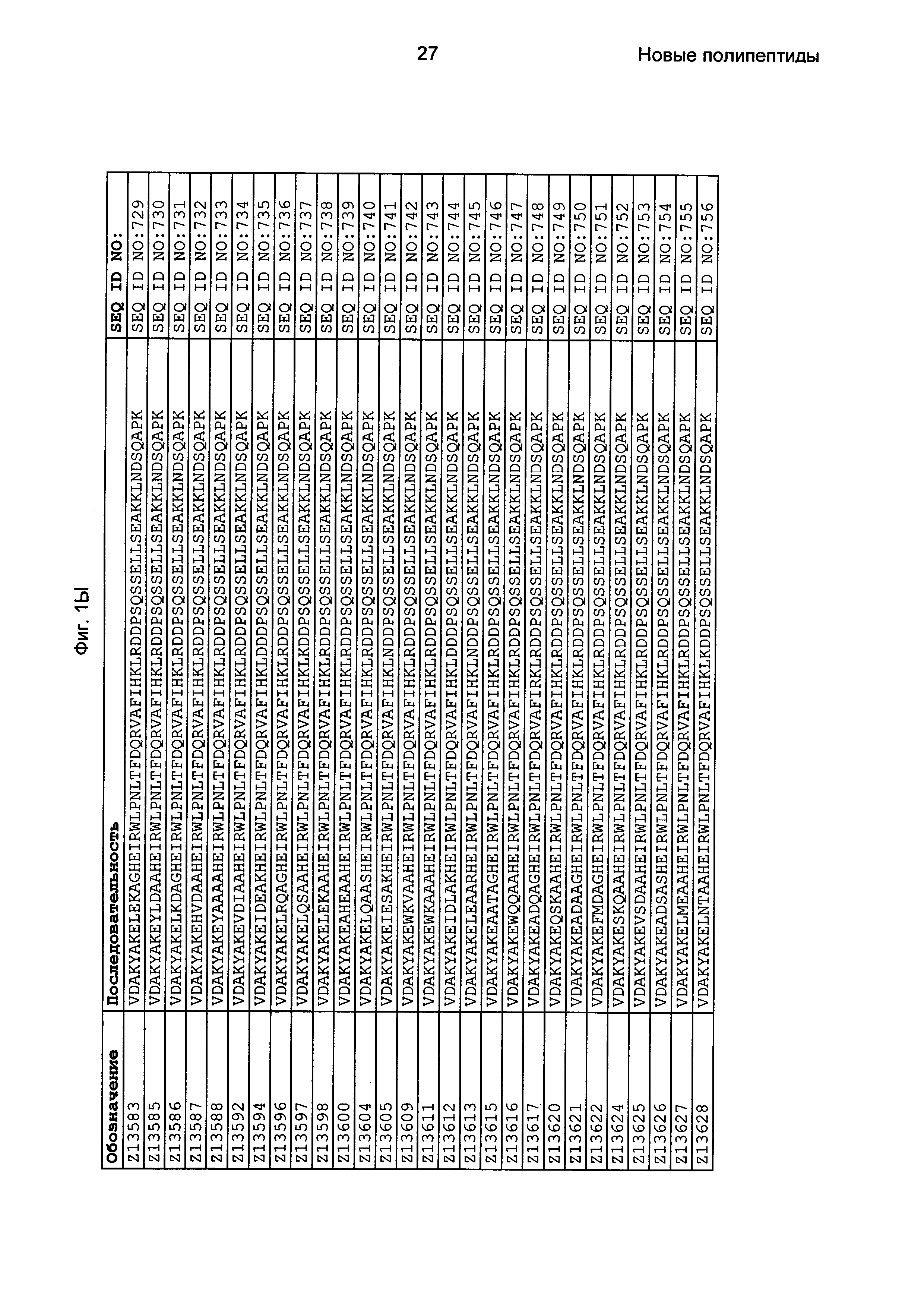
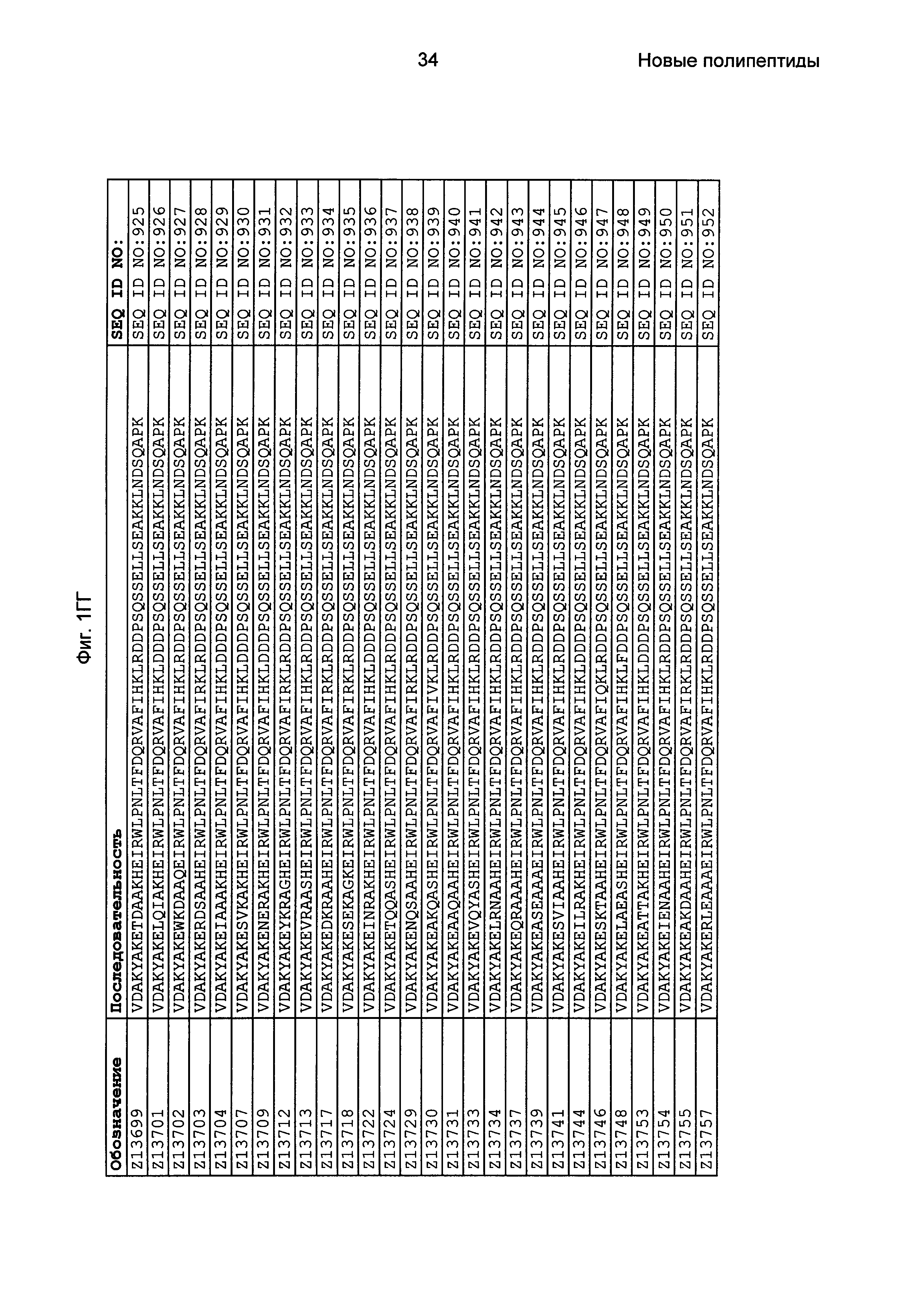
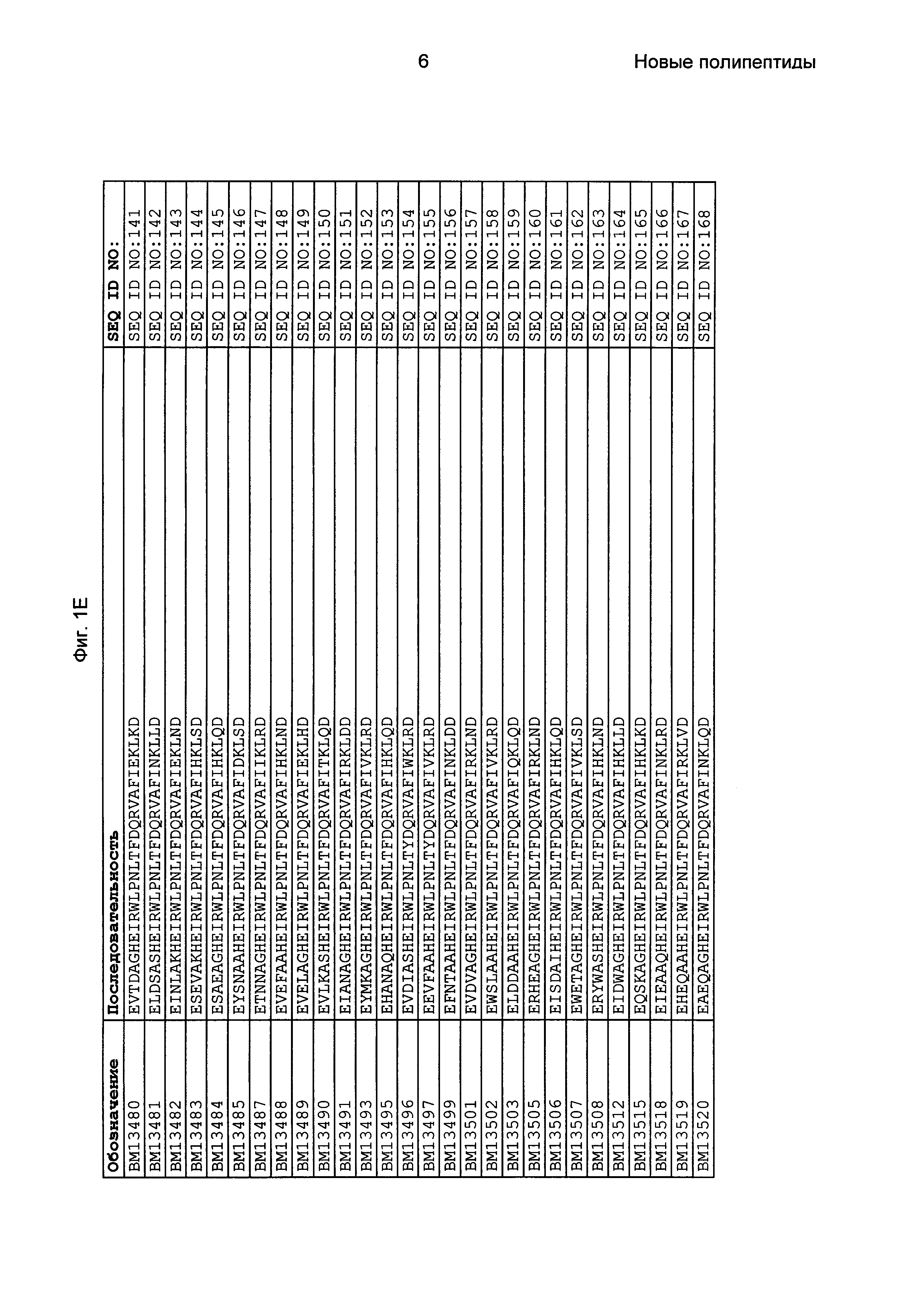
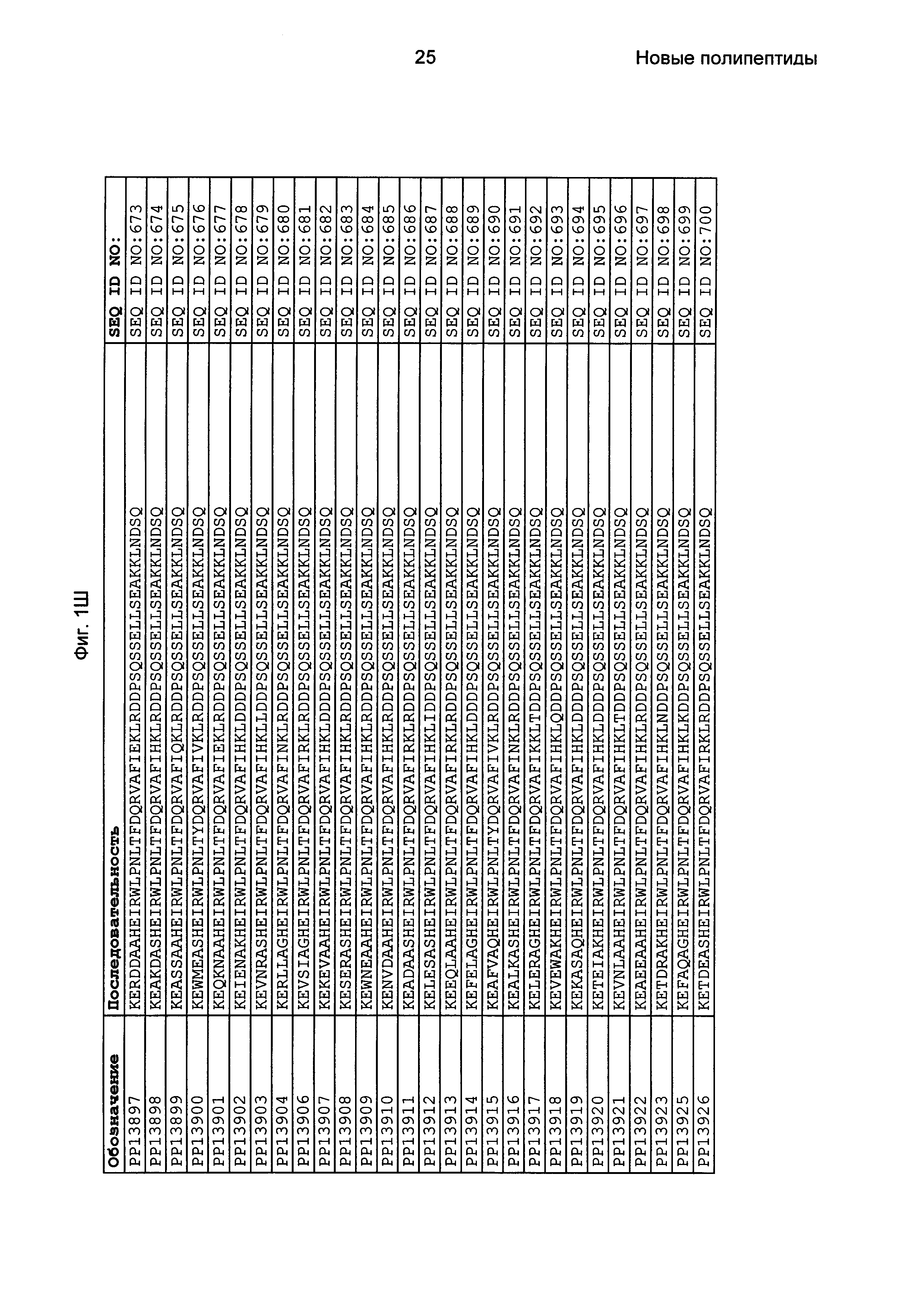
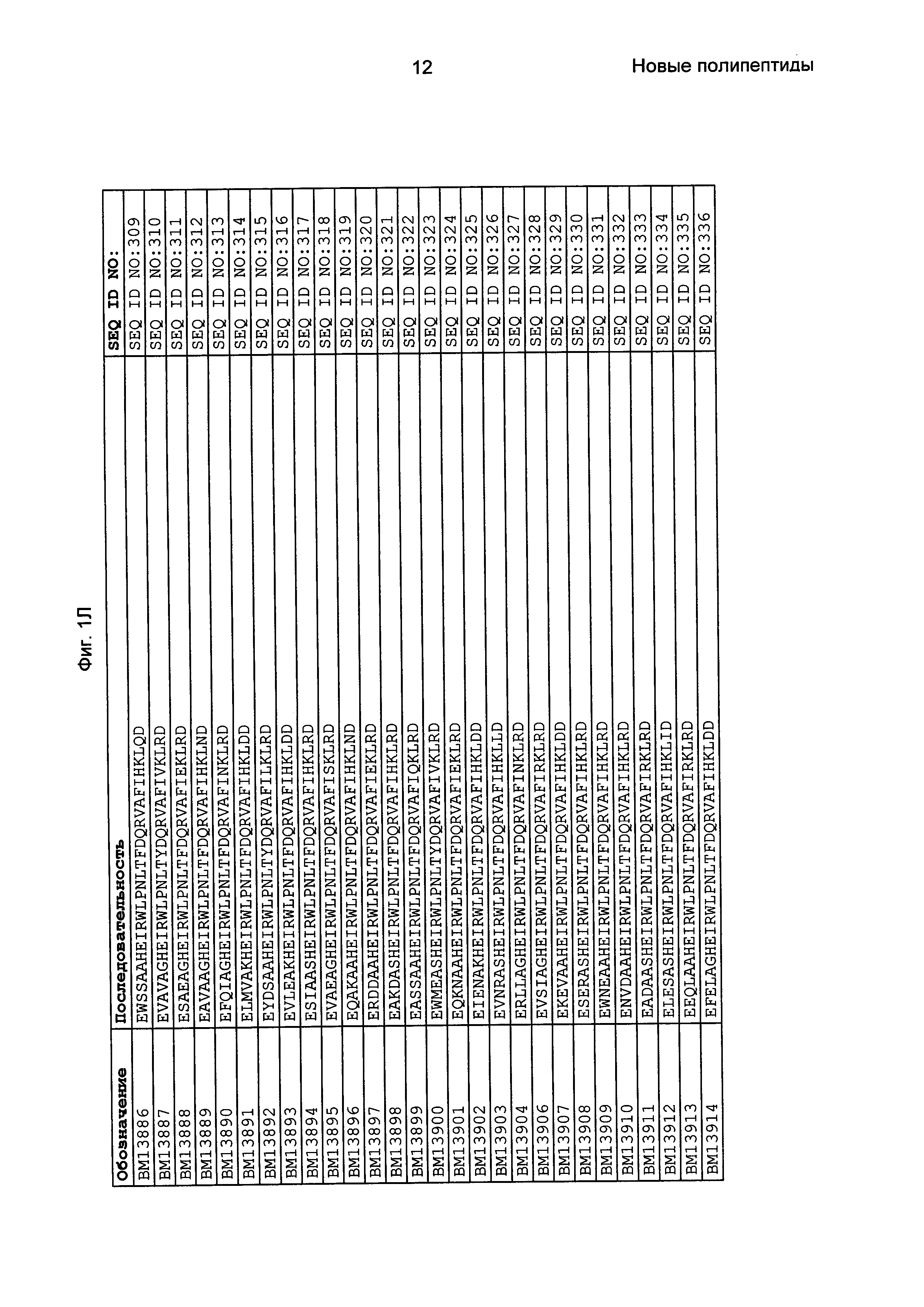
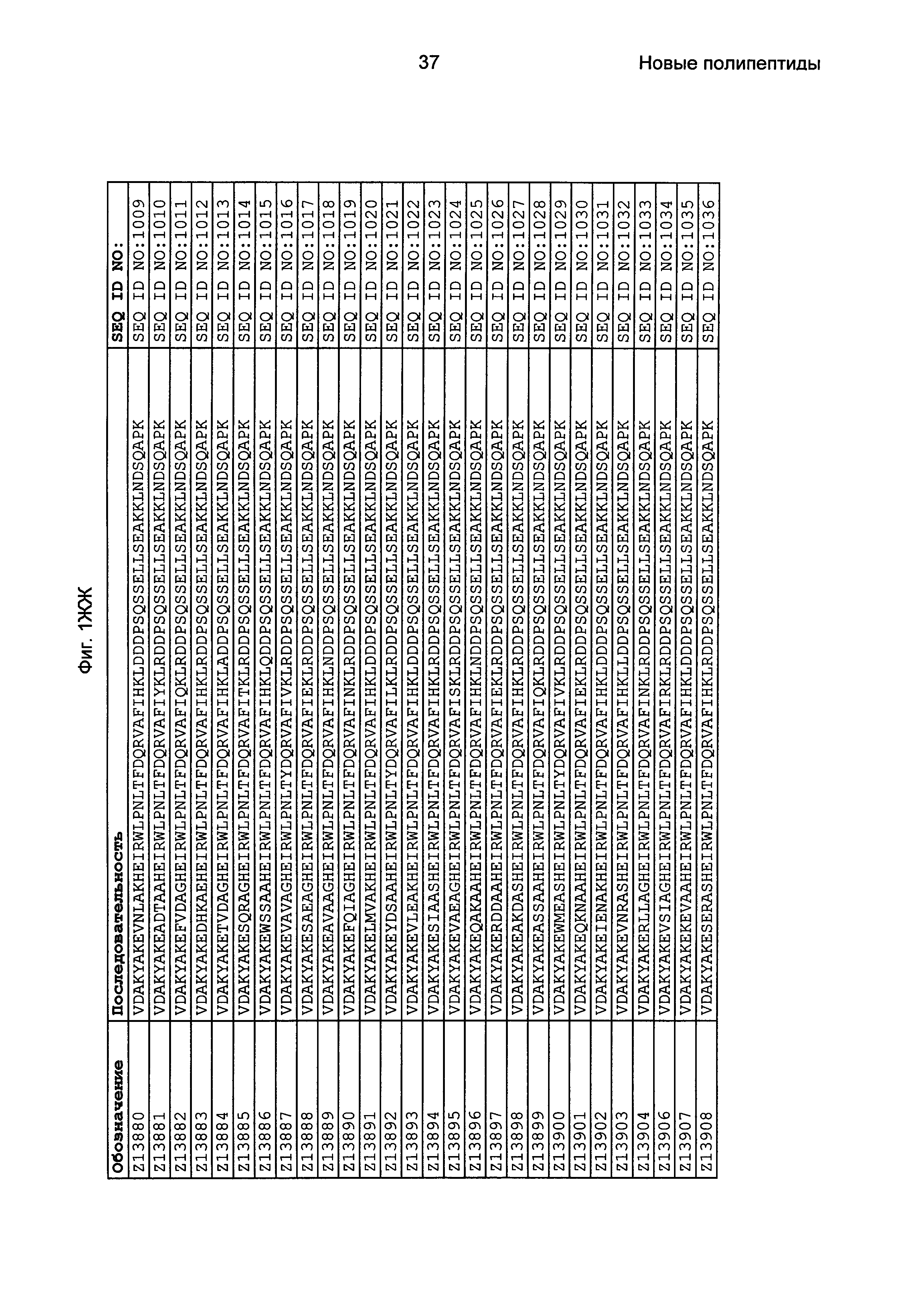
Фиг. 1 представляет собой перечень аминокислотных последовательностей примеров мотивов связывания с FcRn, содержащихся в полипептидах, связывающихся с FcRn, по изобретению (SEQ ID NO: 1-353), примеров 49-мерных полипептидов, связывающихся с FcRn, согласно данному раскрытию (SEQ ID NO: 354-706), примеров 58-мерных полипептидов, связывающихся с FcRn, согласно данному раскрытию (SEQ ID NO: 707-1062), а также аминокислотных последовательностей варианта РР013 альбуминсвязывающего полипептида (SEQ ID NO: 1063), Taq-полимеразы, связывающейся с вариантом Z Z03638 (SEQ ID NO: 1064), человеческого αFcRn (SEQ ID NO: 1065), мышиного αFcRn (SEQ ID NO: 1070), человеческого β2-микроглобулина (SEQ ID NO: 1066), мышиного β2-микроглобулина (SEQ ID NO: 1067), человеческого αFcRn (SEQ ID NO: 1068), когда он находится в составе человеческого FcRn-eGFP, и мышиного αFcRn (SEQ ID NO: 1069), когда он находится в составе мышиного FcRn-eGFP.
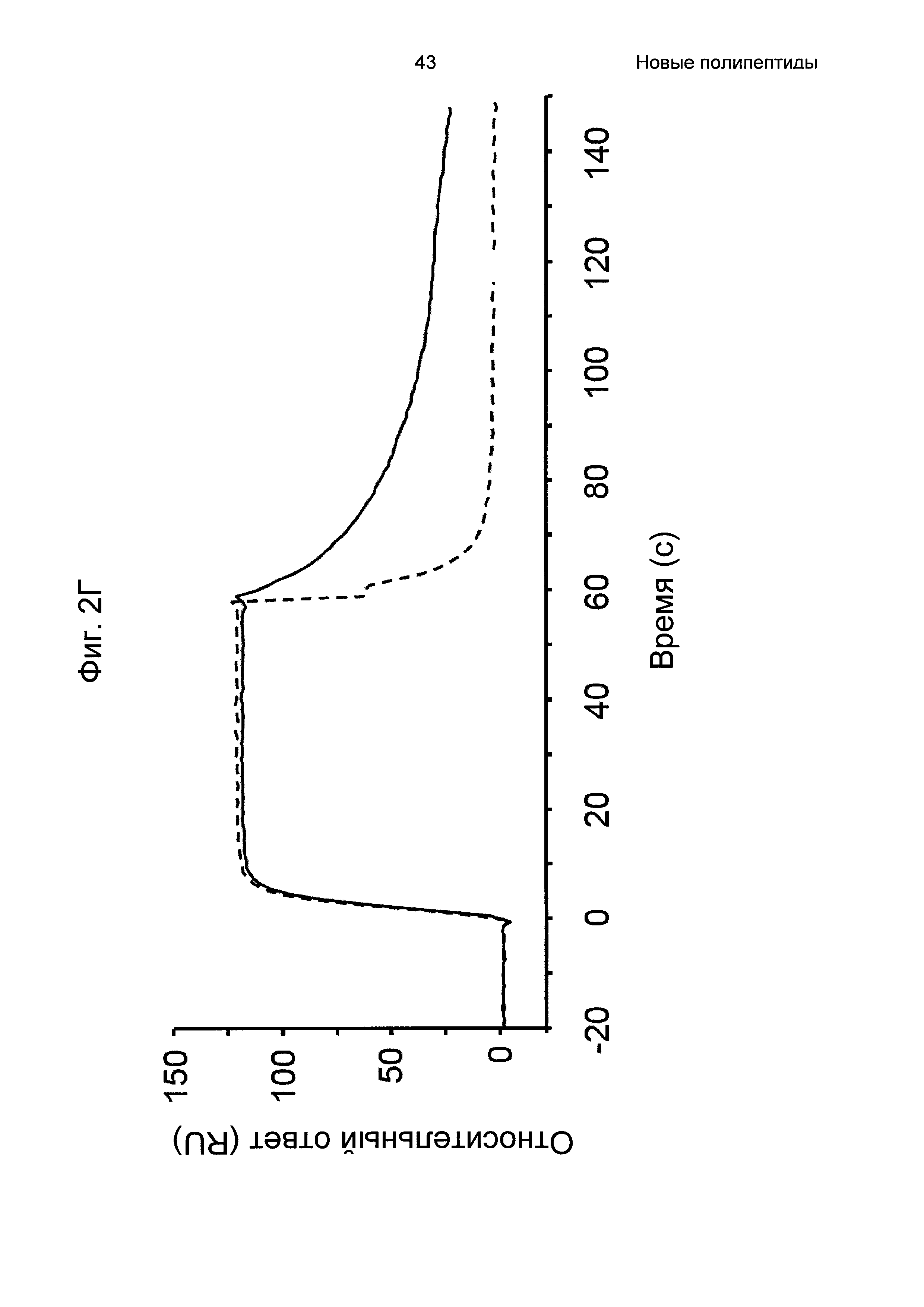
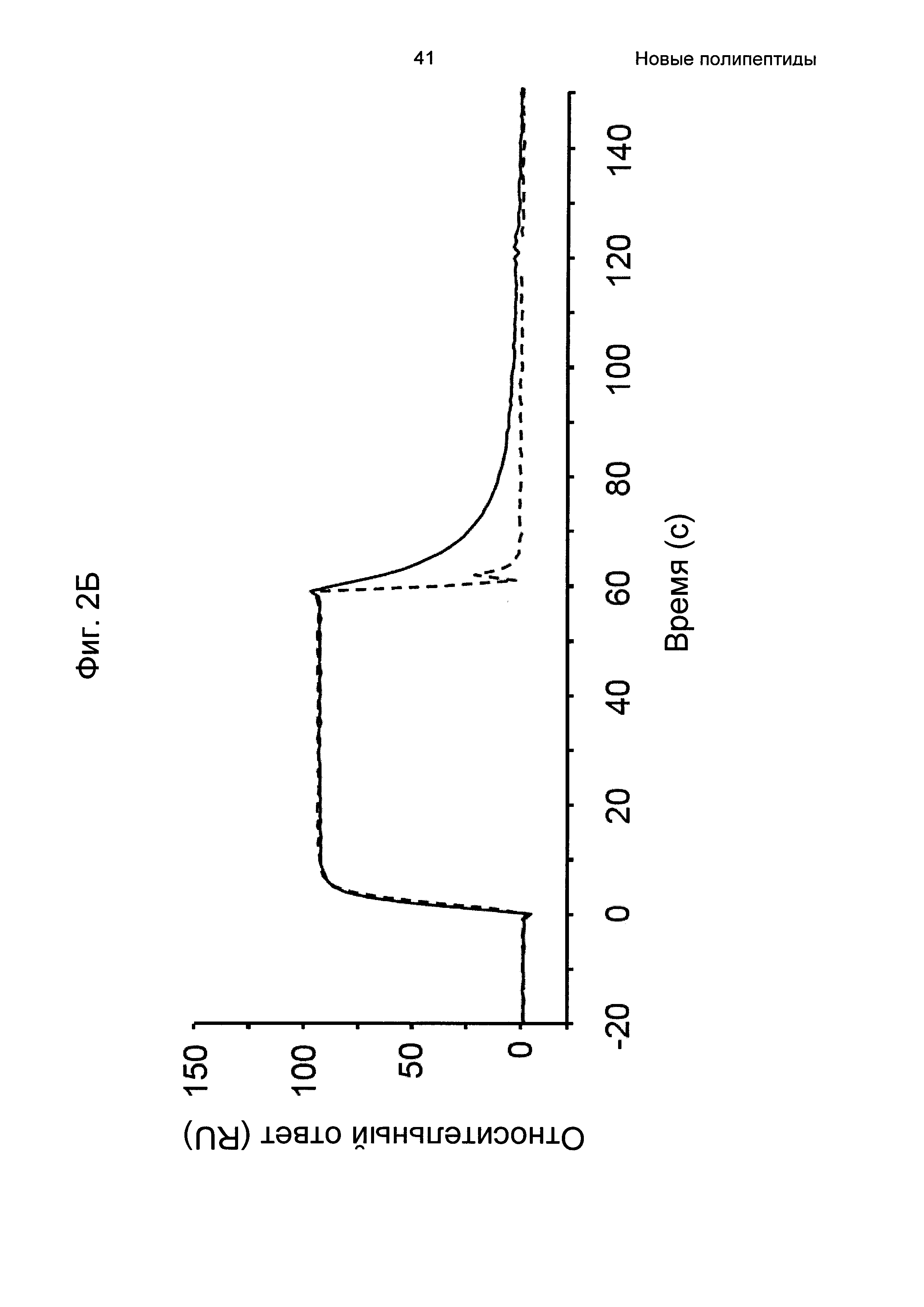
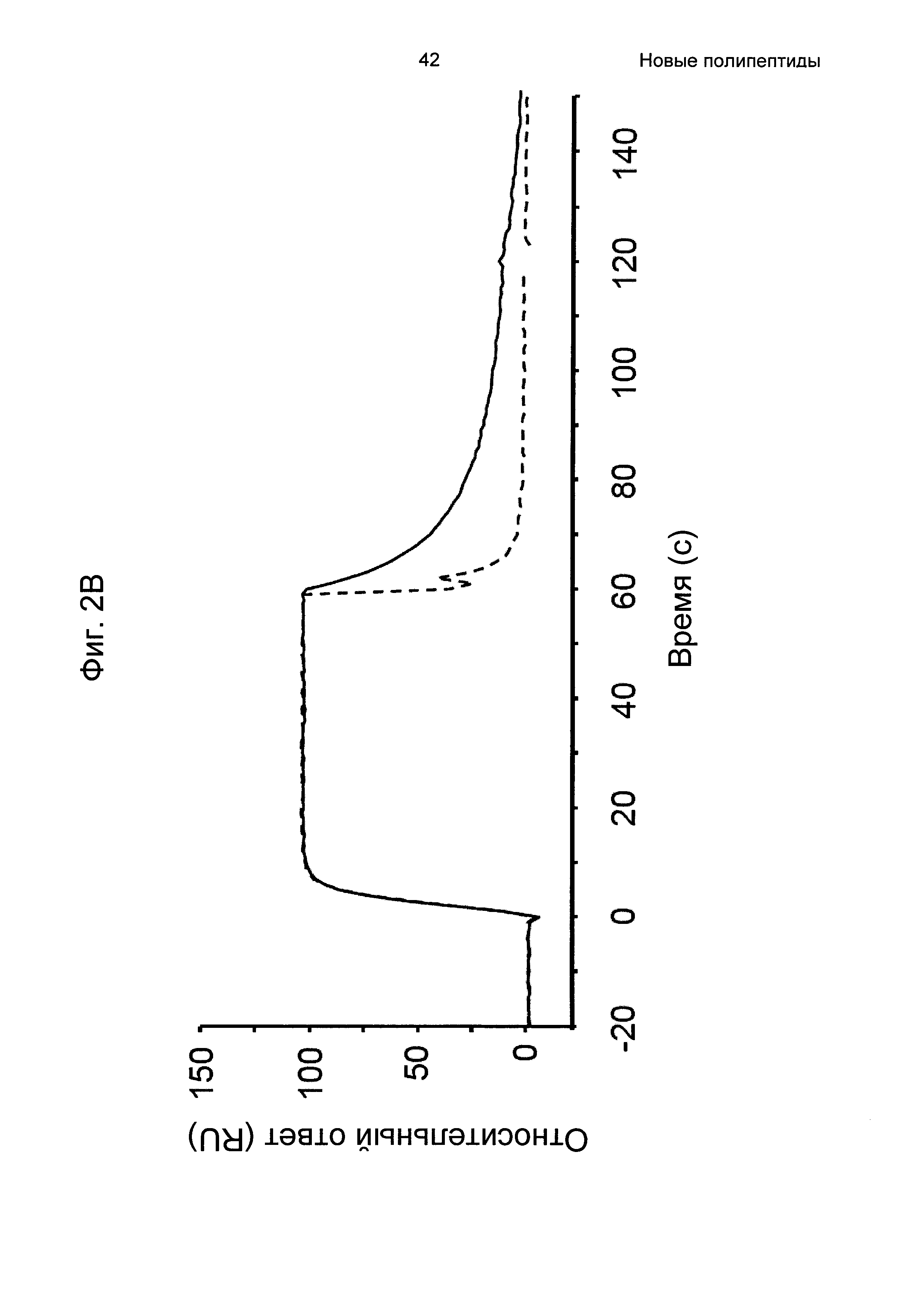
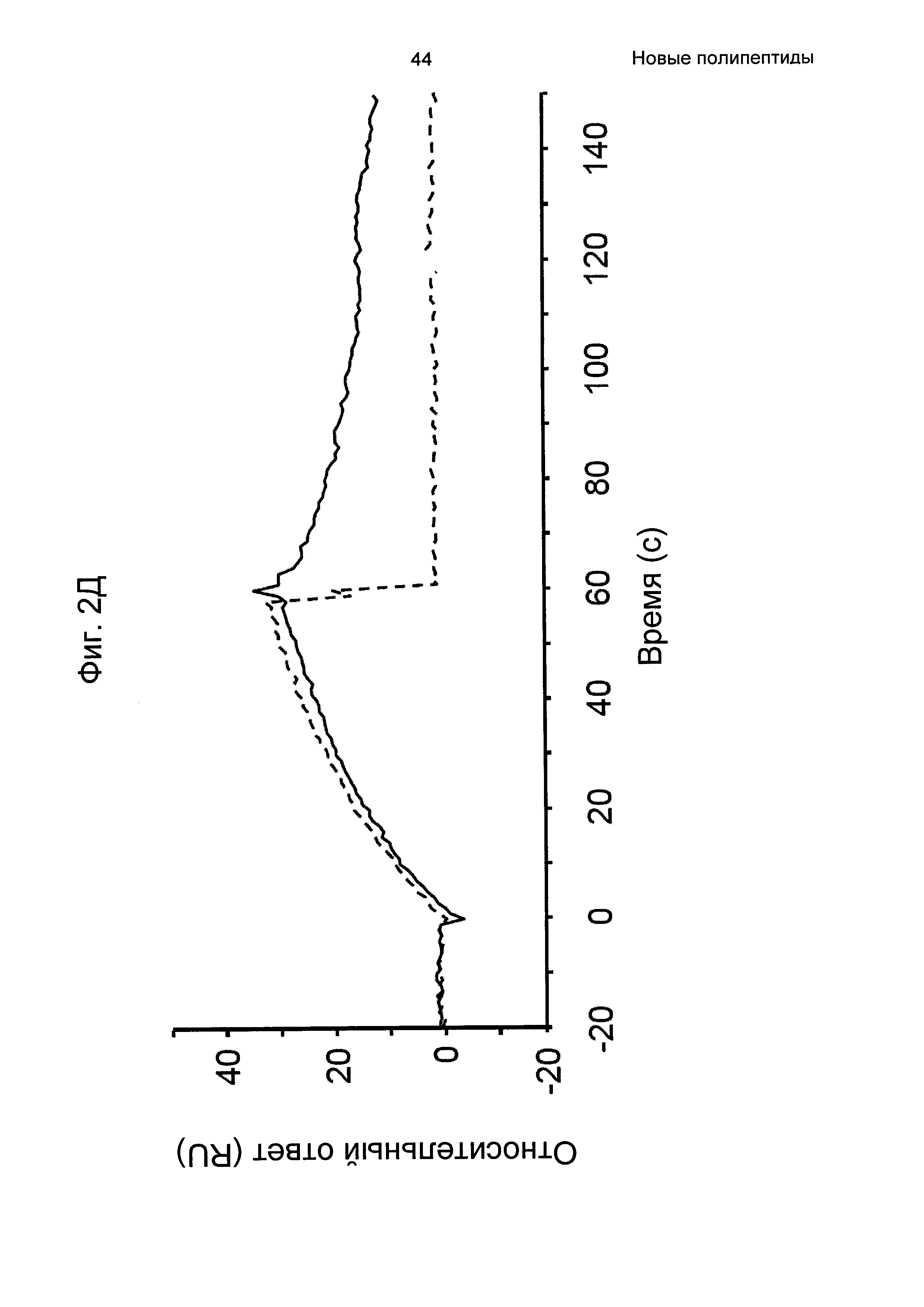
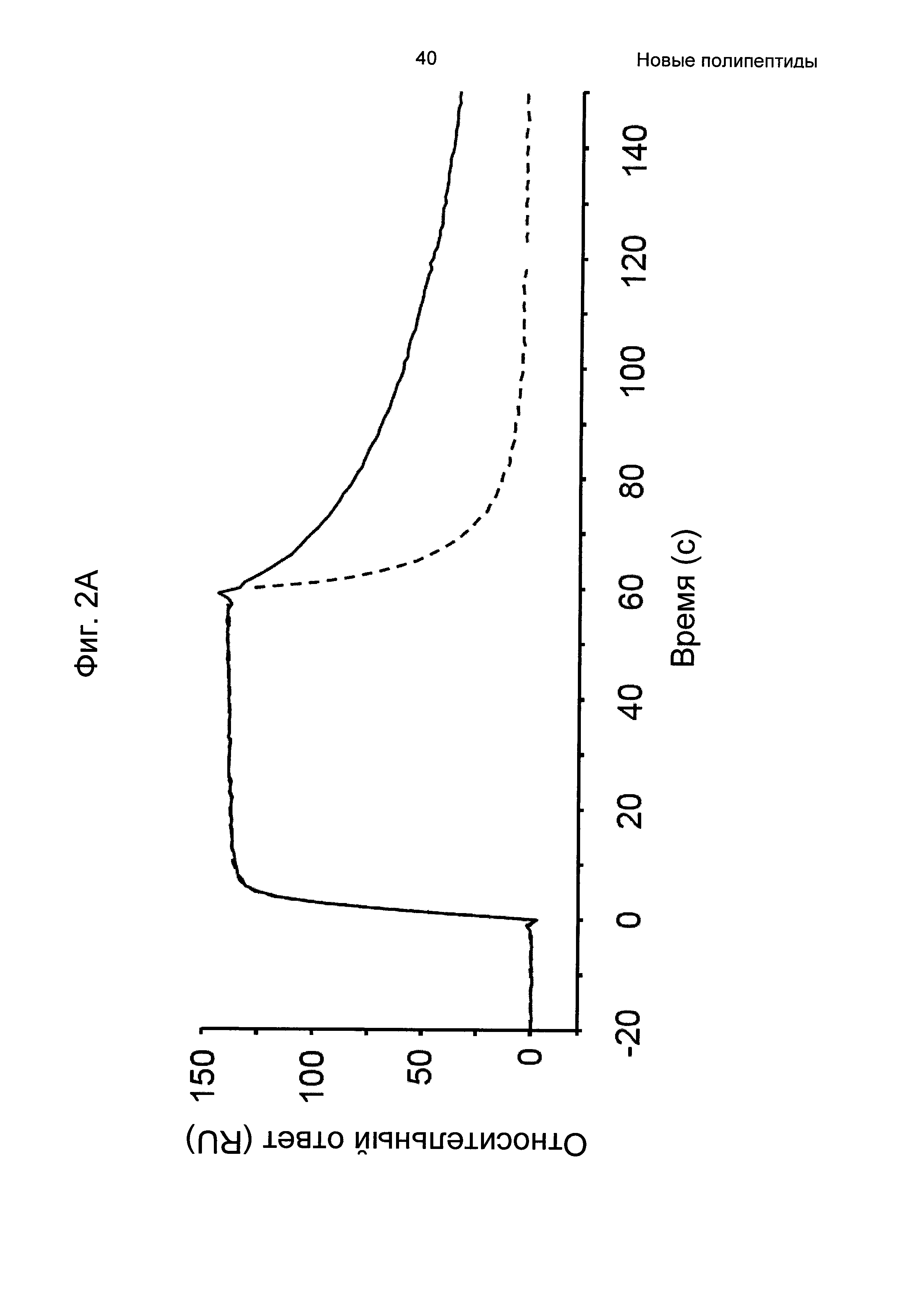
На Фиг. 2А-2Д показано связывание с человеческим FcRn при рН 6,0 и диссоциации при рН 6,0 и 7,4 для вариантов Z, меченных His6, и для IgG, как описано в Примере 3. Наложения сенсограмм, полученных от установки Biacore, представляющих инъекцию при рН 6,0, с последующей диссоциацией при рН 6,0 (сплошная линия), и инъекцию при рН 6,0, с последующей диссоциацией при рН 7,4 (пунктирная линия), показаны для (A) Z07918 (SEQ ID NO: 707), (Б) Z07960 (SEQ ID NO: 710), (В) Z10109 (SEQ ID NO: 709), (Г) Z10193 (SEQ ID NO: 708) и (Д) IgG.
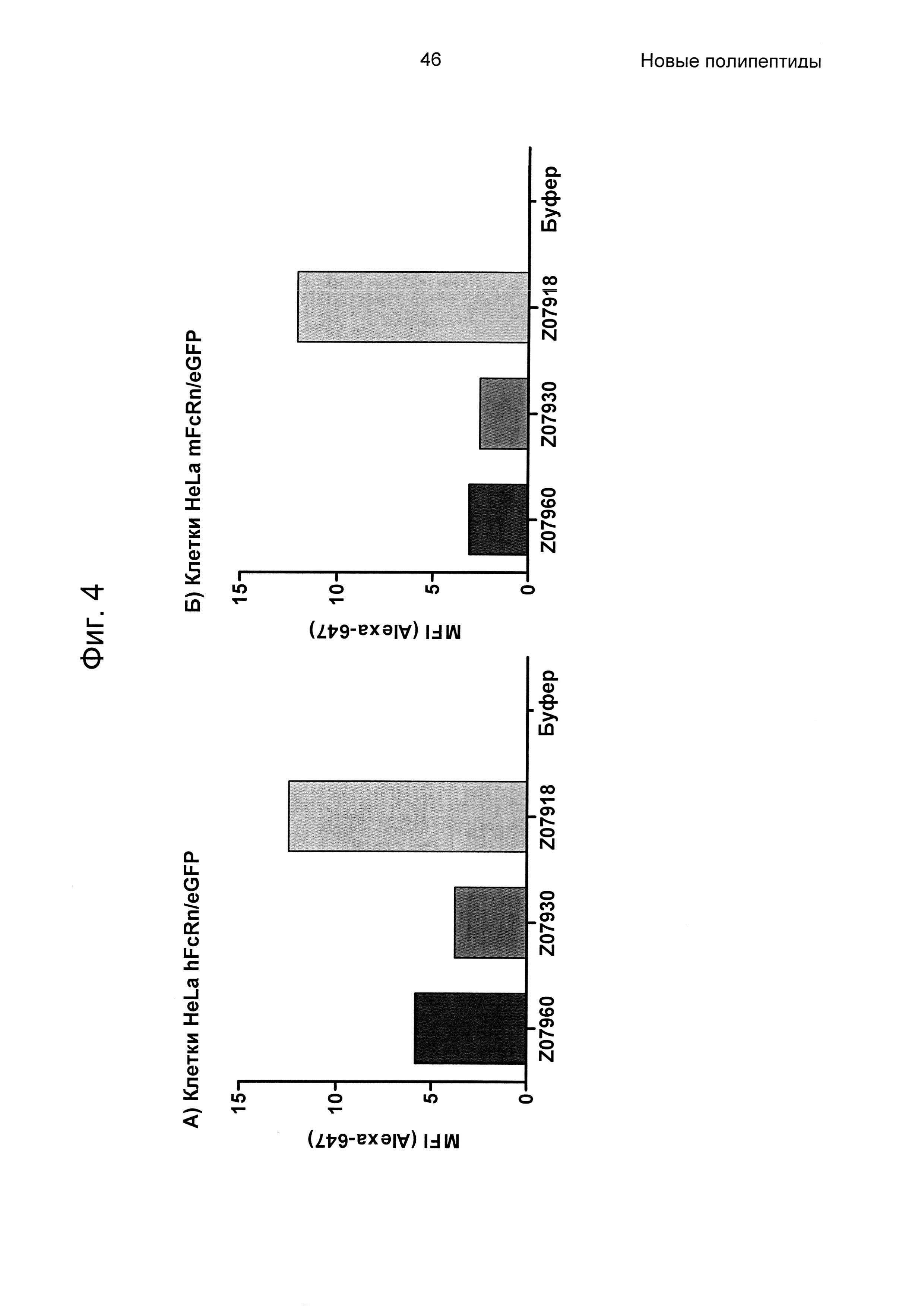
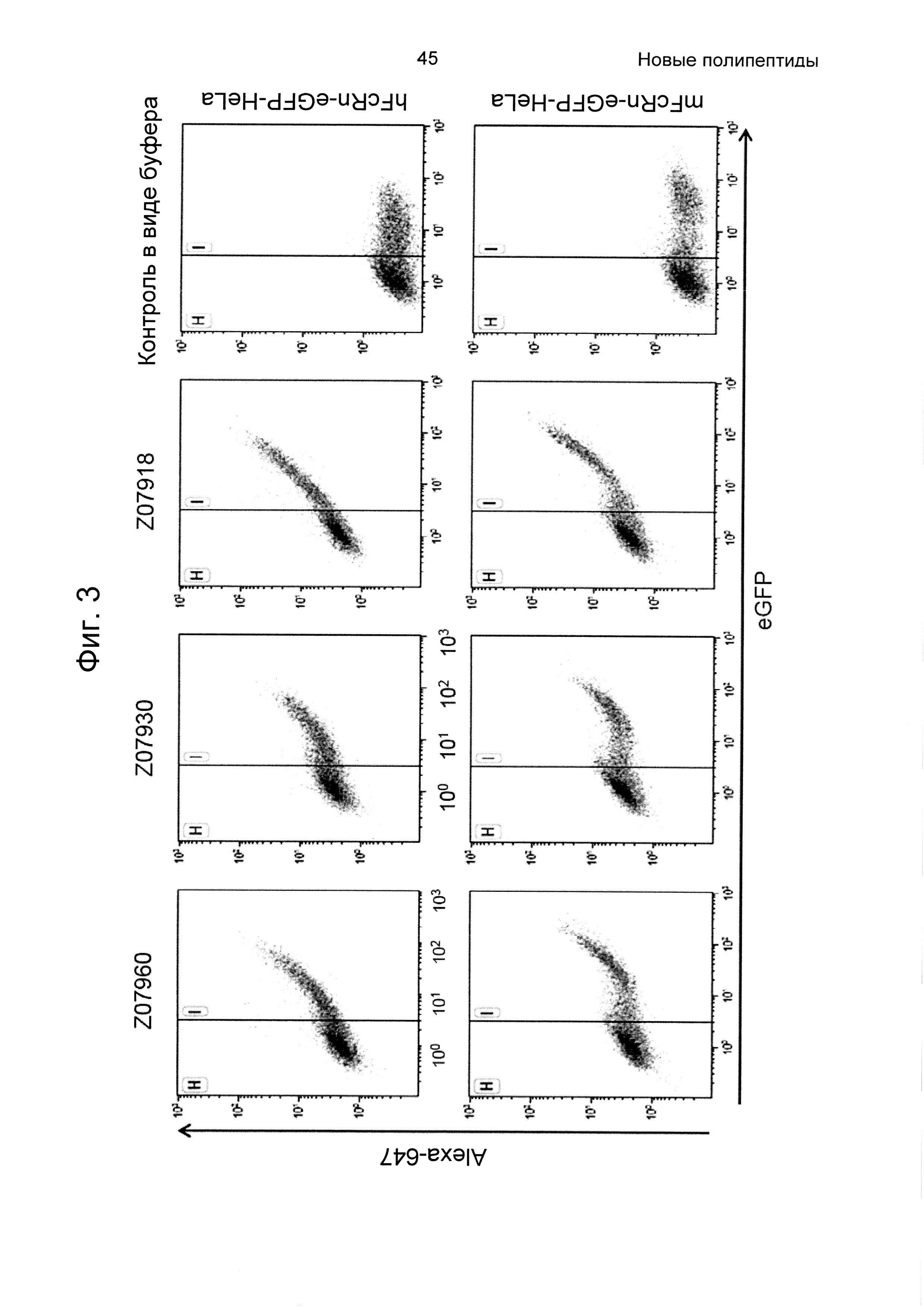
На Фиг. 3 показана точечная диаграмма из анализа проточной цитометрией связывания варианта Z, связывающегося с FcRn, с клетками HeLa, экспрессирующими человеческий (верхняя панель) и мышиный (нижняя панель) FcRn-eGFP, как описано в Примере 4. Из-за гетерогенной экспрессии FcRn-eGFP клетками HeLa, клетки пропускали через измерительную ячейку согласно уровню экспрессии FcRn-eGFP. Клетки в области Н считаются негативными в отношении FcRn-eGFP, и клетки в области I считаются позитивными. Инкубация с вариантами Z, меченными Alexa647, приводила к позитивной популяции в отношении и Alexa647, и eGFP, тогда как инкубация с буфером (контроль в виде буфера) не приводила. На данной Фиг. показано, что три варианта Z07960 (SEQ ID NO: 710), Z07930 (SEQ ID NO: 712) и Z07918 (SEQ ID NO: 707) связываются с человеческим FcRn и мышиным FcRn. По ординате показана интенсивность Alexa647, и по абсциссе показана активность eGFP.
На Фиг. 4 показаны значения средней интенсивности флуоресценции (MFI) Alexa647, меченных Z07960 (SEQ ID NO: 710), Z07930 (SEQ ID NO: 712) и Z07918 (SEQ ID NO: 707), измеренные в анализе связывания клеток, описанном в Примере 4. На диаграмме (А) показана MFI от клеток HeLa, трансдуцированных человеческим FcRn-eGFP, и на диаграмме (Б) показана MFI от клеток HeLa, трансдуцированных мышиным FcRn-eGFP.
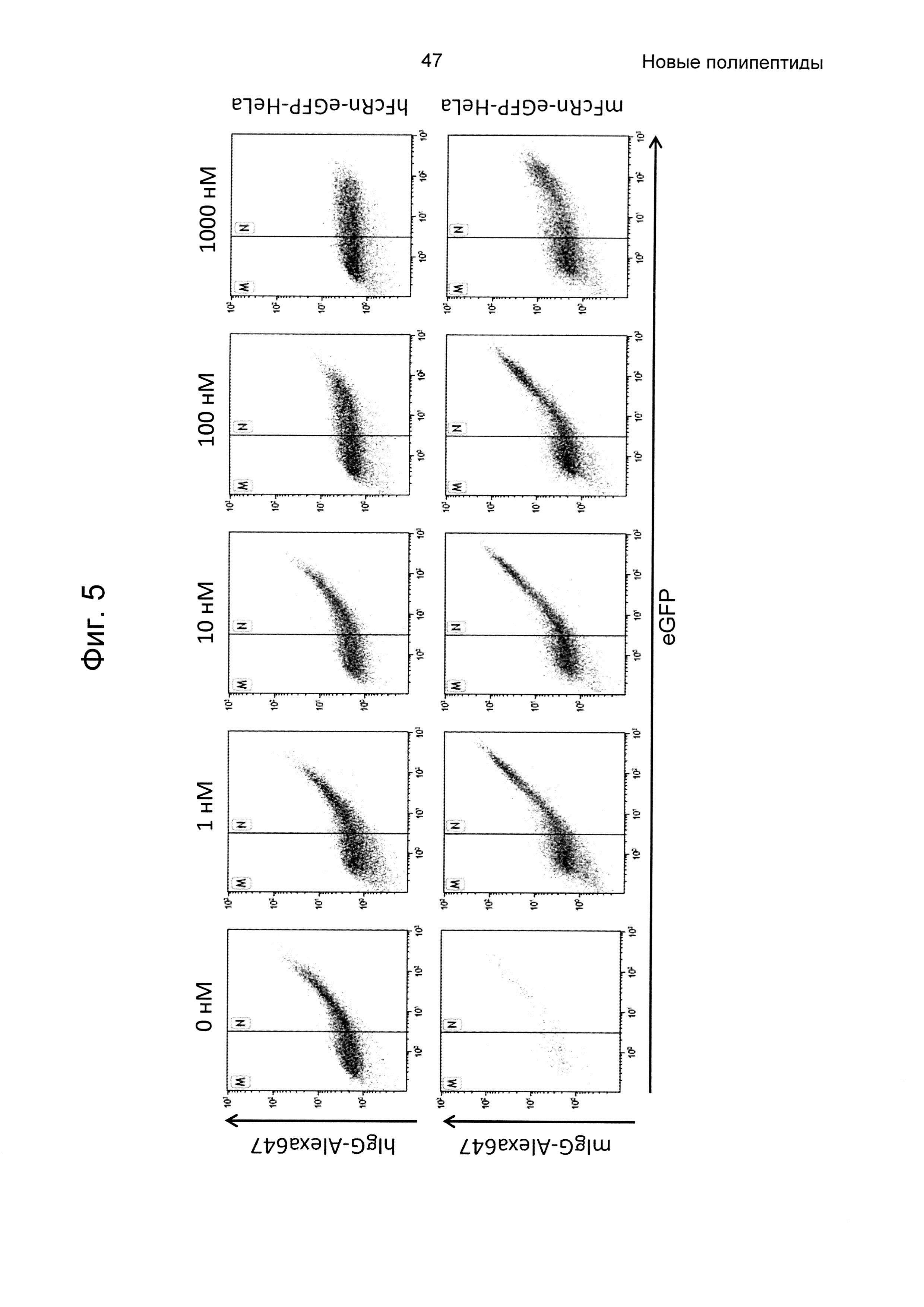
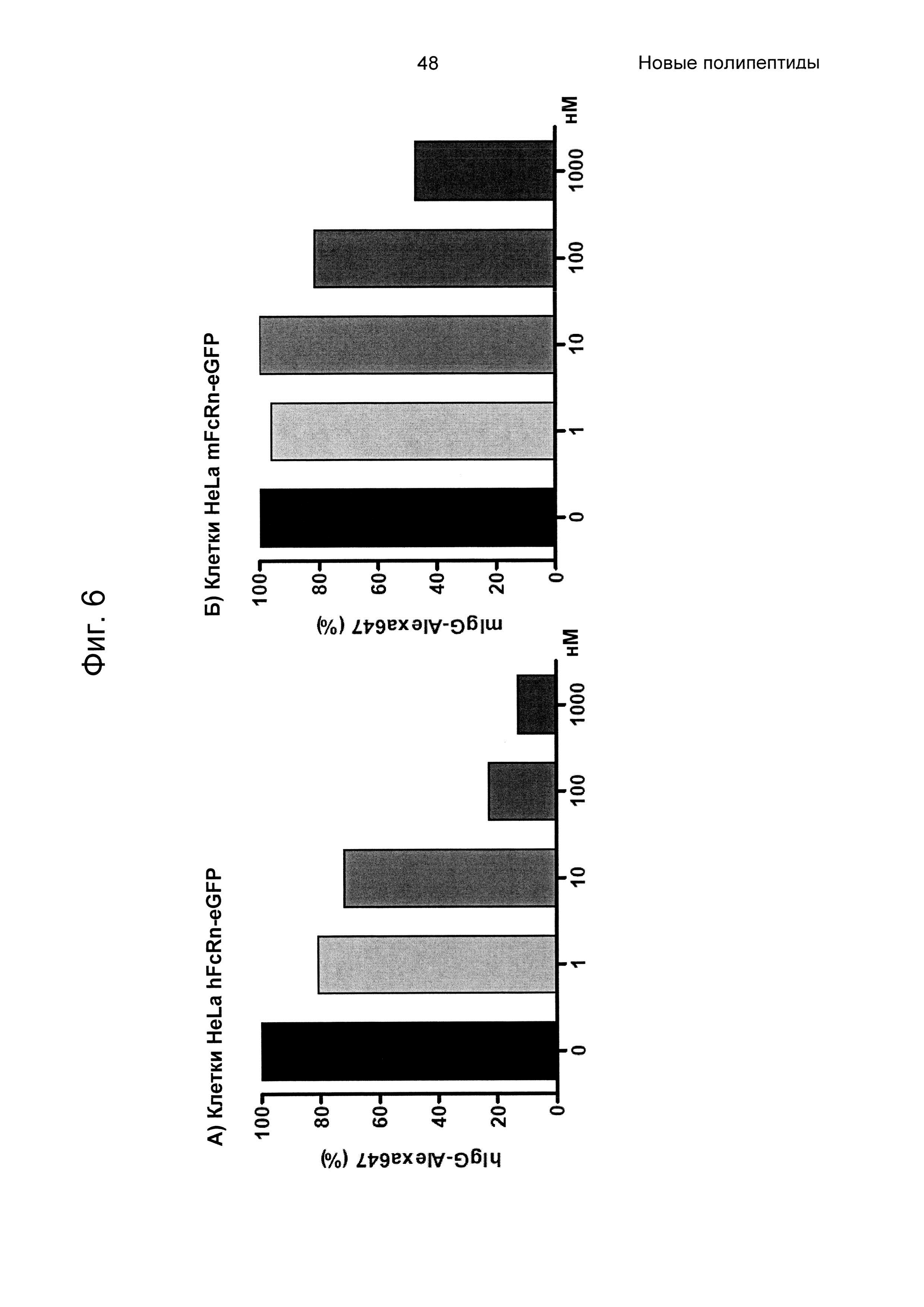
На Фиг. 5 показана точечная диаграмма из анализа проточной цитометрией связывания человеческого или мышиного lgG-Alexa647 с клетками HeLa, экспрессирующими человеческий (верхняя панель) и мышиный (нижняя панель) FcRn-eGFP, как описано в Примере 5. Из-за гетерогенной экспрессии FcRn-eGFP клетками HeLa, клетки пропускали через измерительную ячейку согласно количеству FcRn-eGFP на поверхности клеток. Клетки в области М считаются негативными в отношении FcRn-eGFP, и клетки в области N считаются позитивными. Связывание 100 нМ человеческого или мышиного IgG-Alexa647 с клетками HeLa, трансдуцированными FcRn, показано на левой панели (0 нМ). На Фиг. показано, что связывание IgG блокировалось Z07918, меченным His6 (SEQ ID NO: 707), дозозависимым образом (1, 10, 100 и 1000 нМ). По ординате показана интенсивность Alexa647, и по абсциссе показана активность eGFP.
На Фиг. 6 показаны средние значения интенсивности флуоресценции (MFI), возникающей в результате связывания с FcRn lgG-Alexa647 в присутствии разных концентраций Z07918, меченного His6 (SEQ ID NO: 707), на (А) клетках HeLa, трансдуцированных человеческим FcRn-eGFP, и (Б) клетках HeLa, трансдуцированных мышиным FcRn-eGFP, как описано в Примере 5. На Фиг. показано дозозависимое блокирование связывание IgG-FcRn вариантом Z.
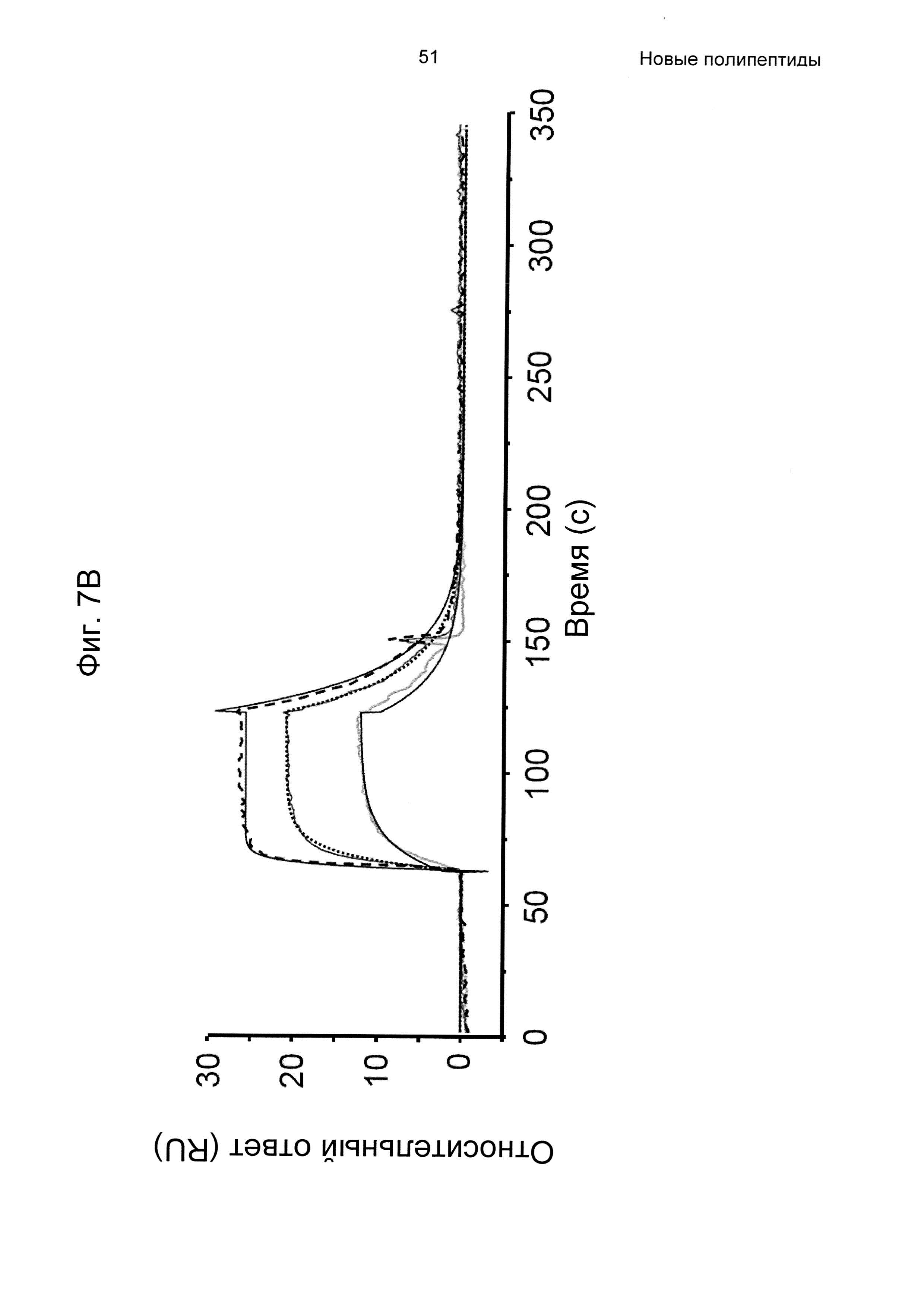
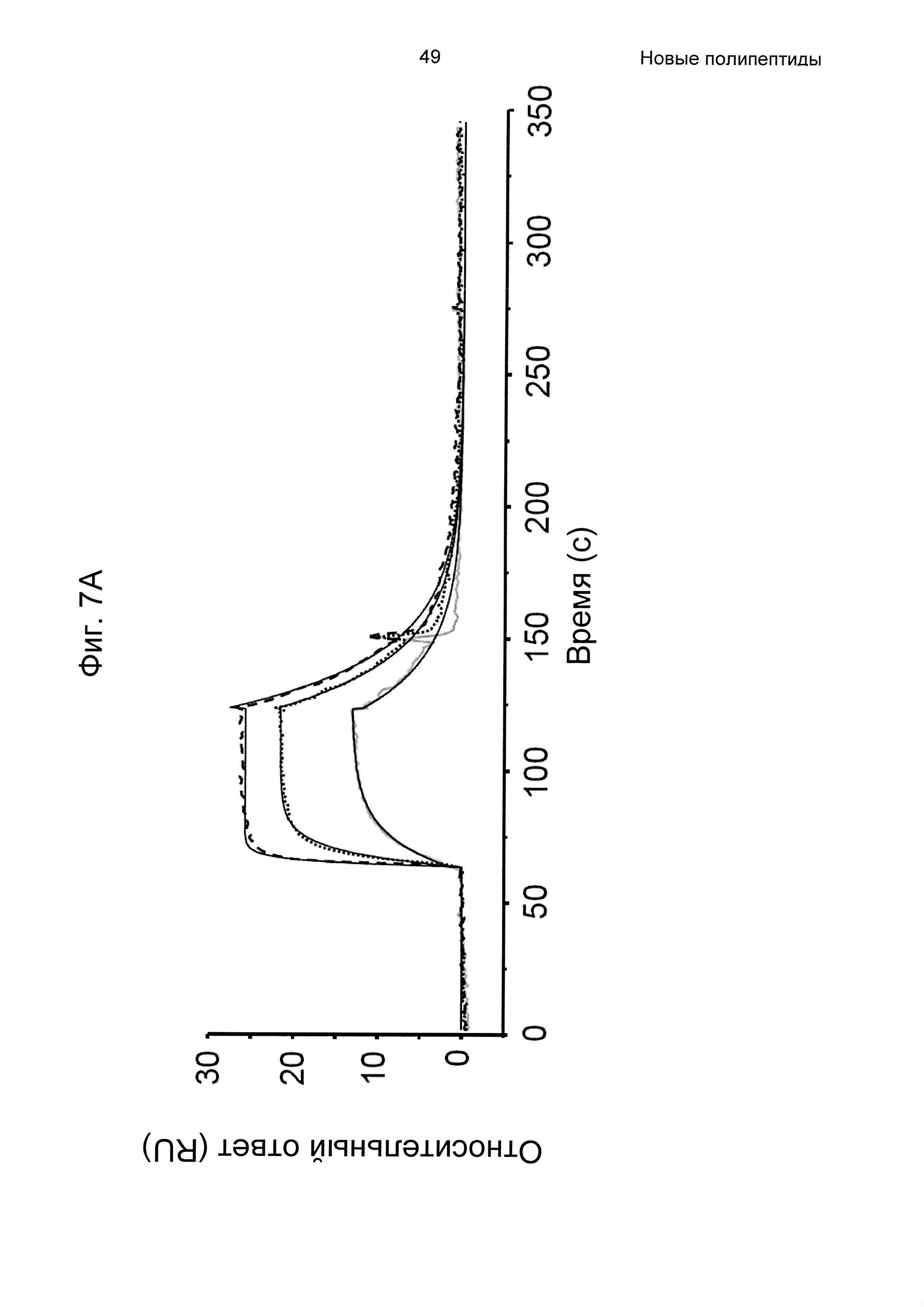
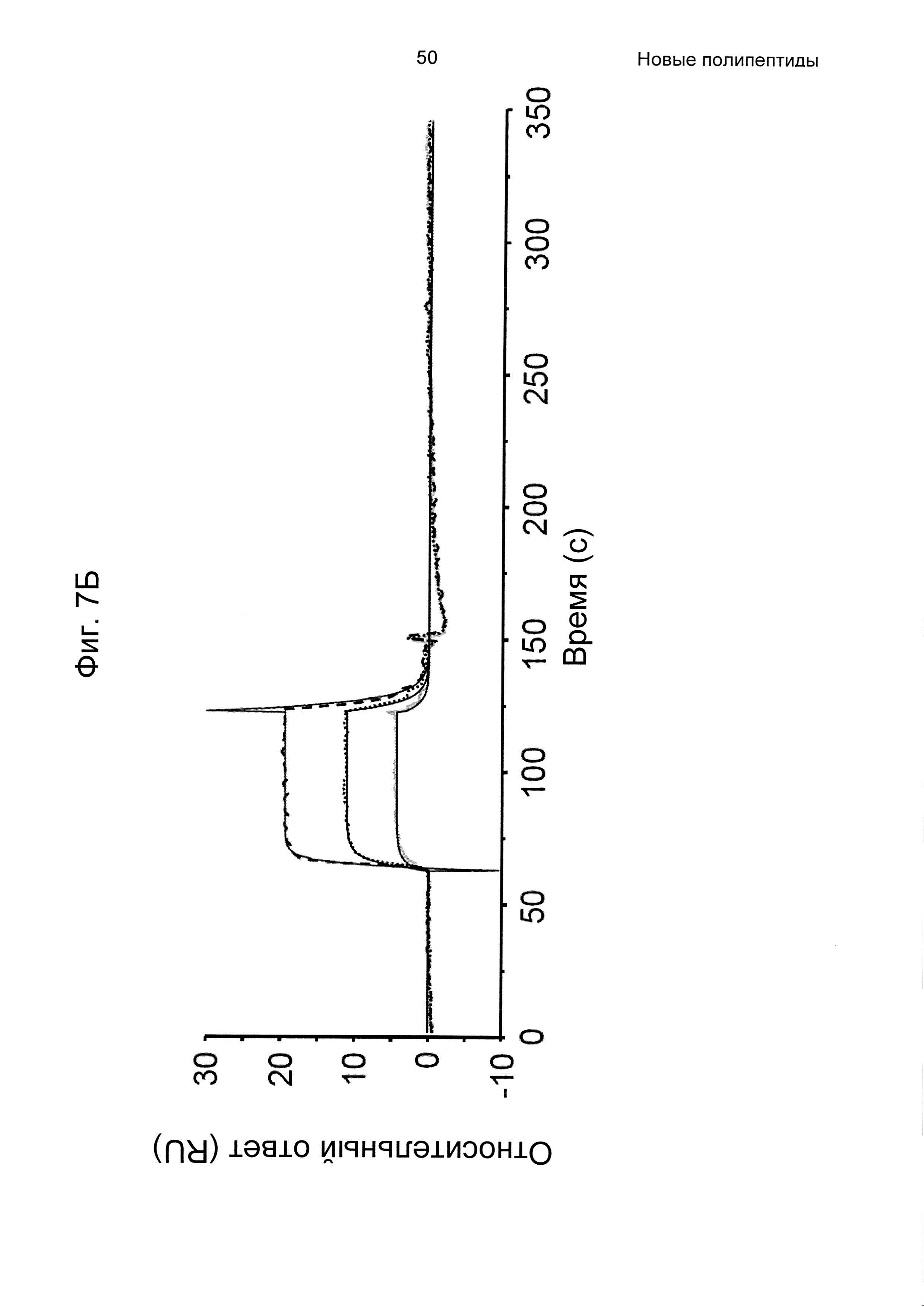
На Фиг. 7А-7В показана кинетика связывания трех вариантов Z с человеческим FcRn при рН 6,0, как описано в Примере 6, используя прибор Biacore. Показаны сенсограммы для серии концентраций (A) Z11948 (SEQ ID NO: 1060), (Б) Z11946 (SEQ ID NO: 1061) и (В) Z11947 (SEQ ID NO: 1062) соответственно в слиянии с альбуминсвязывающим полипептидом РР013 (SEQ ID NO: 1063), и контрольной молекулы варианта Z - Z03638 (SEQ ID NO: 1064; не специфична в отношении FcRn). Кривые от 640 нМ (штриховая линия), 160 нМ (пунктирная линия) и 40 нМ (сплошная серая линия) подвергали кинетическому анализу с использованием модели связывания Лангмюра 1:1. Кинетические параметры и аффинности рассчитывали для аппроксимированных кривых (сплошные черные линии), и они показаны в Таблице 5.
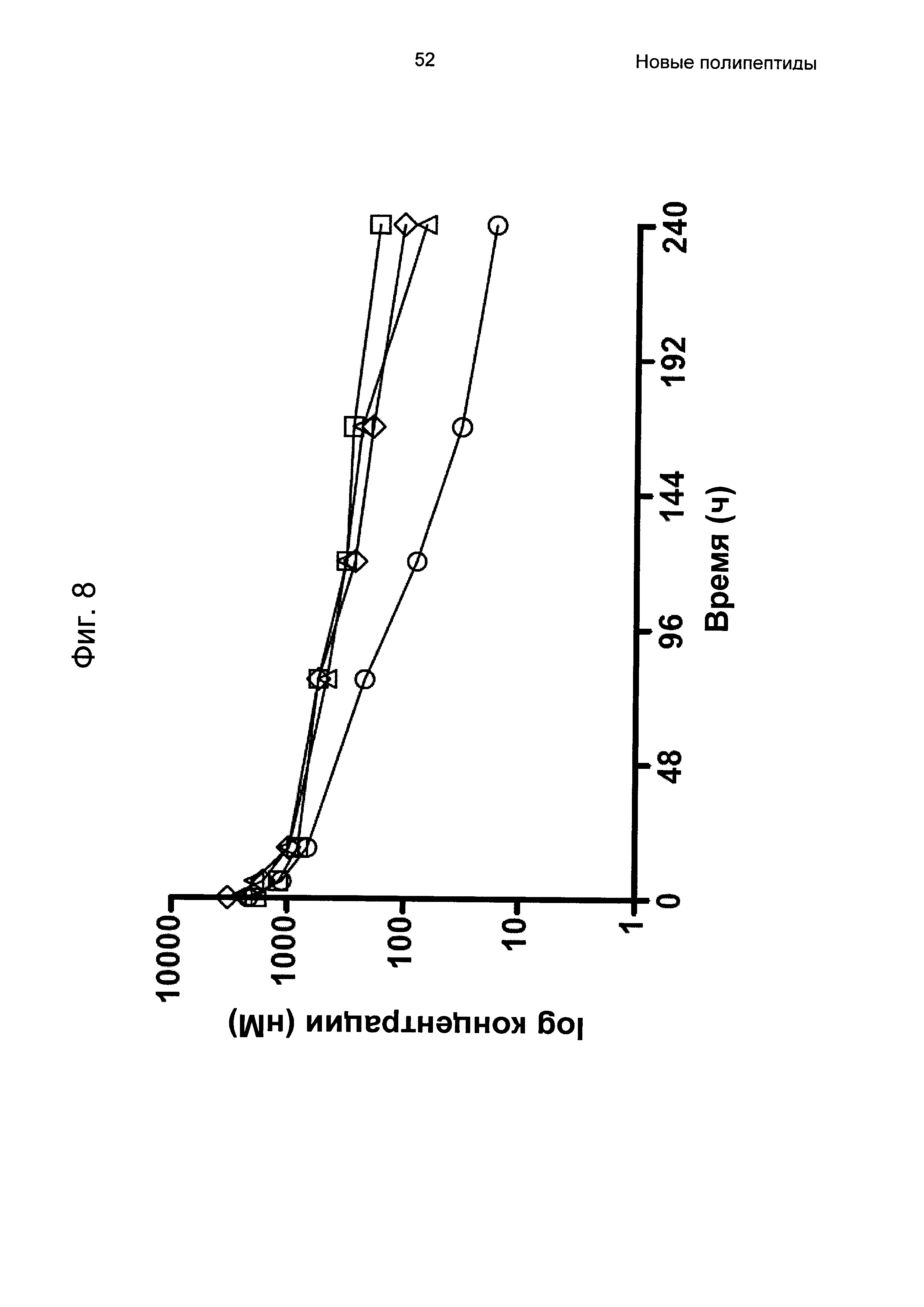
На Фиг. 8 показаны фармакокинетические профили для трех вариантов Z, связывающихся с FcRn, слитых с альбуминсвязывающим полипептидом РР013, полученные, как описано в Примере 6. Все варианты Z: Z11947 (SEQ ID NO: 1062, незакрашенные квадраты), Z11946 (SEQ ID NO: 1061, незакрашенные треугольники) и Z11948 (SEQ ID NO: 1060, незакрашенные ромбы) демонстрировали пролонгированный период полувыведения по сравнению с негативным контролем - PP013-Z03638 (незакрашенные круги).
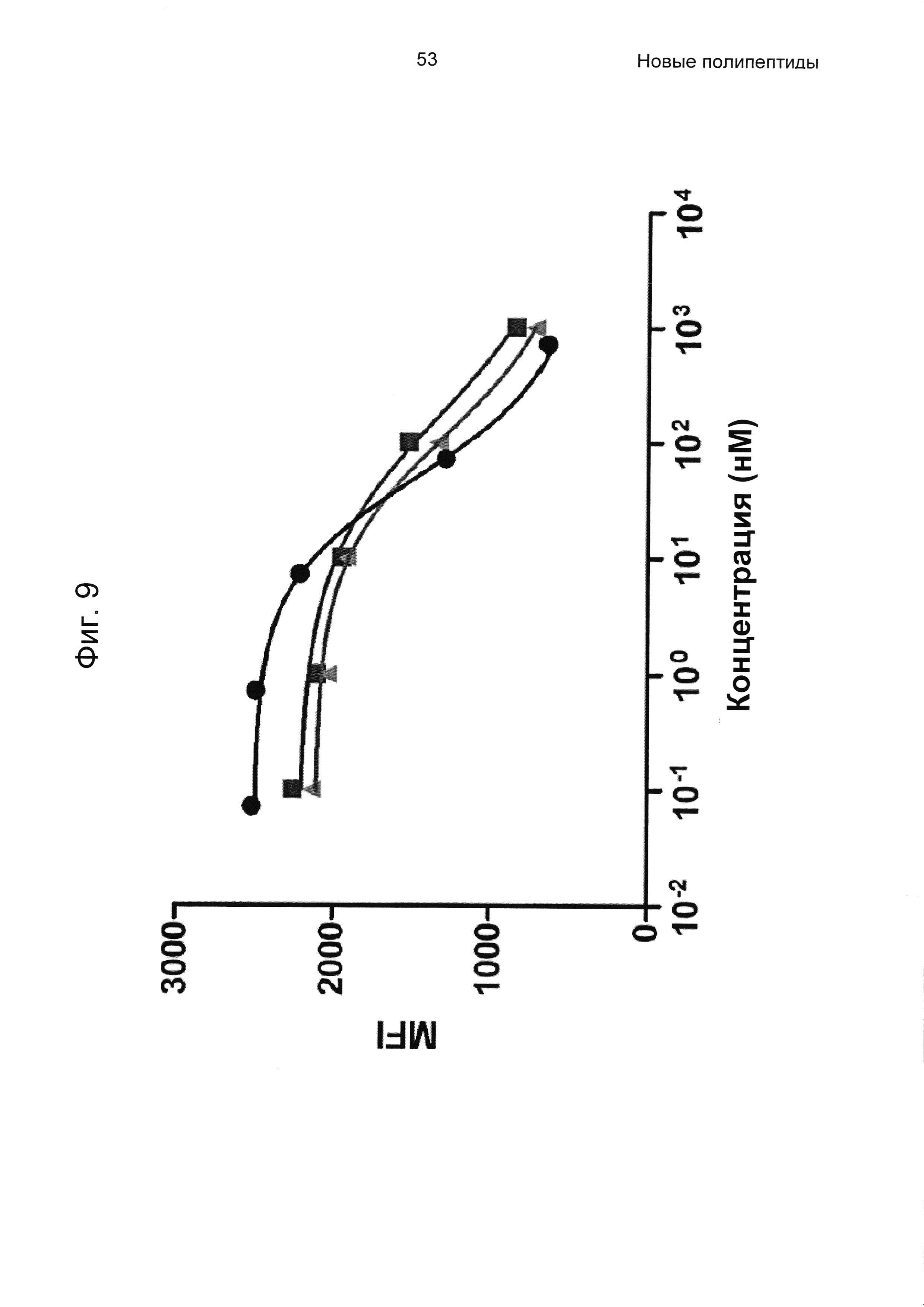
На Фиг. 9 показано блокирование связывания человеческого IgG с человеческим FcRn посредством His6-Z07918 (SEQ ID NO: 707; черные круги), IVIg (серые квадраты) и SCIg (серые треугольники) соответственно, проанализированного, как описано в Примере 10.
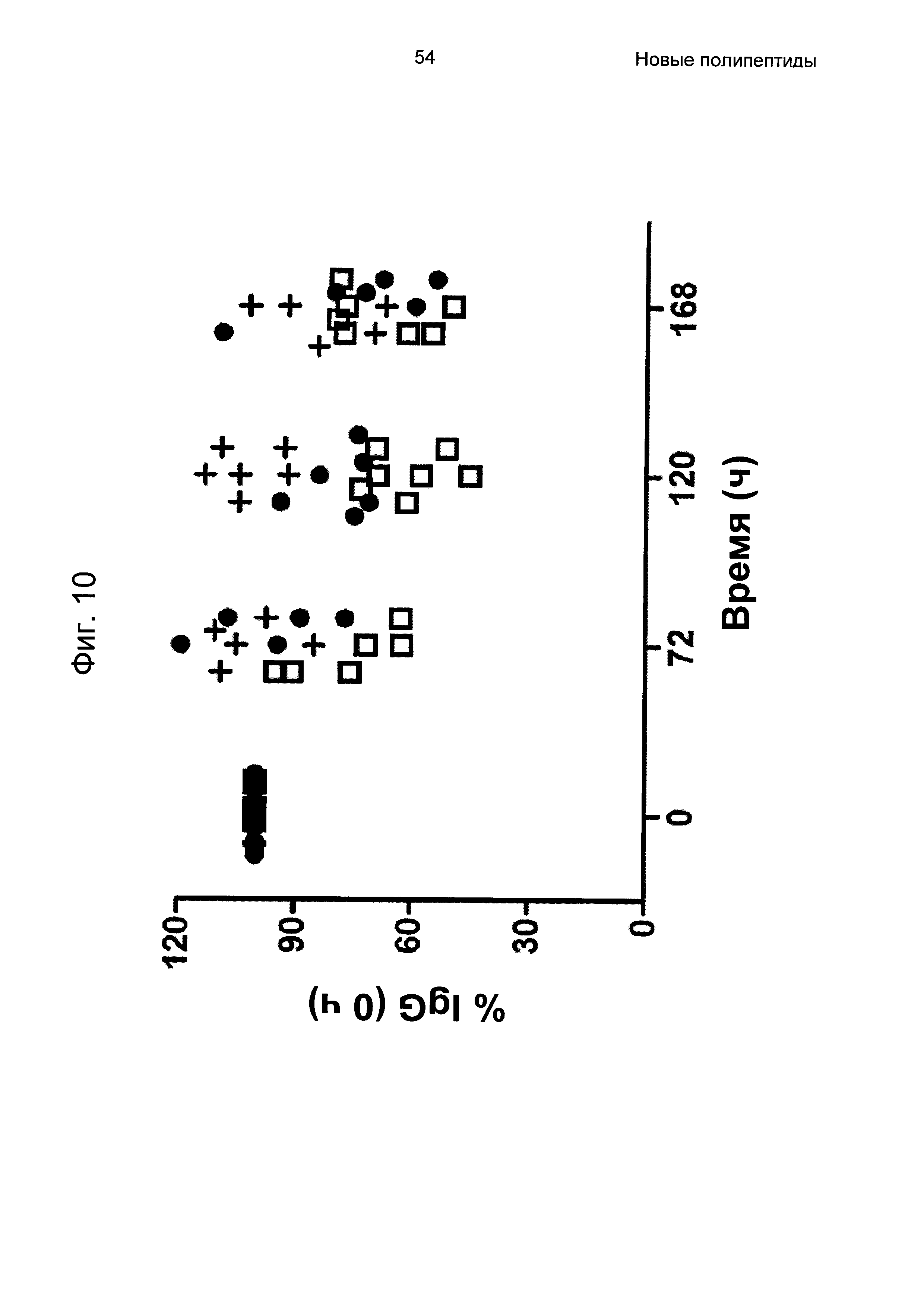
На Фиг. 10 показано, что блокирование взаимодействий IgG-FcRn с использованием вариантов Z, специфичных в отношении FcRn, у мышей приводит к пониженным уровням IgG. Как дополнительно описано в Примере 11, мышей обрабатывали пятью ежесуточными инъекциями носителя (+), варианта Z, слитого с ABD - Z07918-PP013 (незакрашенный квадрат) и Z11948 (SEQ ID NO: 1060; закрашенный круг). Концентрацию эндогенного IgG измеряли посредством ELISA (твердофазный иммуноферментный анализ). Концентрацию IgG у индивидуальных мышей в 24, 72, 120 и 168 ч связывали с уровнем в 0 ч, и результаты, следовательно, представлены в виде процентной доли IgG в 0 ч.
ПРИМЕРЫ
Краткое изложение
Следующие Примеры раскрывают разработку новых молекул вариантов Z, направленно действующих на неонатальный рецептор Fc (FcRn). Варианты Z получали с использованием технологии фагового дисплея. Гены, кодирующие описанные здесь полипептиды, связывающиеся с FcRn, секвенировали, соответствующие аминокислотные последовательности перечислены на Фиг. 1 и обозначены идентификаторами SEQ ID NO: 707-1059. Также на Фиг. 1 перечислены выведенные мотивы связывания этих отобранных связывающих вариантов с идентификаторами последовательности SEQ ID NO: 1-353.
Пример 1
Получение человеческого αFcRn и человеческого β2-микроглобулина (В2М)
В этом примере получали внеклеточный домен (ECD) человеческого αFcRn (SEQ ID NO: 1065) в комплексе с человеческим β2-микроглобулином (SEQ ID NO: 1066) (комплекс, обозначенный FcRn) и человеческий β2-микроглобулин в некомплексированой форме (обозначенный В2М) в виде растворимых белков. Человеческий FcRn и В2М, полученные в данном примере, использовали для селекции фага, анализов ELISA и Biacore в примерах 2 и 3.
Материалы и методы
Конструирование плазмид. содержащих гены человеческого αFcRn и человеческого β2-микроглобулина, подлежащие применению для соэкспрессии. Гены, кодирующие человеческий αFcRn (Genbank ВС008734.2) и человеческий β2-микроглобулин (В2М) (Genbank ВС032589.1) приобретали у OpenBiosystems. С использованием удлинения посредством ПЦР (полимеразная цепная реакция) с перекрывающимися праймерами амплифицировали фрагмент гена, кодирующий аминокислоты 24-290 человеческого αFcRn (αFcRnECD) (SEQ ID NO: 1065), с получением конструкции, состоящей из сайта attB1/последовательности Козака, с последующим геном, кодирующим лидерную последовательность цепи каппа lg, hFcRnECD, GS-линкером и меткой Flag, с последующим сайтом attB2. Делали аналогичную конструкцию, содержащую фрагмент гена, кодирующий аминокислоты 21-119 человеческого В2М (SEQ ID NO: 1066), за исключением того, что метка His6 заменяла метку Flag. Данные конструкции вставляли в плазмиду pDONOR221 (Invitrogen, кат. №12536-017) путем рекомбинации с использованием системы Gateway (Invitrogen, кат. №11789020, ферментативная смесь Gateway® BP Clonase® II) согласно рекомендациям изготовителя. После подтверждения правильных последовательностей, человеческую конструкцию aFcRnEcD вставляли в 2K7bsd (Suter et al. (2006) Stem Cells 24:615-623) с использованием многосайтового клонирования Gateway совместно с плазмидой pENTR-CMV, содержащей промотор (Tai et al. (2012) PLoS One 7(9):е46269), что приводило к вектору 2K7bsd-CMV-hFcRnECD. Конструкцию гена человеческого В2М аналогичным образом вставляли в 2K7neo (Suter et al., выше) с получением вектора 2K7neo-CMV-hB2M.
Культура клеток, получение рекомбинантных лентивирусных векторов и вставки генов в линию клеток SKOV-3. Линии клеток HEK293T и SKOV-3 получали от АТСС (Американская коллекция типовых клеточных культур). Клетки выращивали при 37°С в увлажненном инкубаторе в присутствии 5% СО2. Полной средой для линии клеток HEK293T была среда Дульбекко, модифицированная по Иглу (DMEM), дополненная 10% фетальной телячьей сыворотки (FBS), 1% раствора противогрибкового антибиотика (АА) и 1% MEM (минимальная питательная среда) на основе раствора заменимых аминокислот (NEAA). Полной средой для линии клеток SKOV-3 была среда Маккоя 5А, дополненная 10% FBS и 1% АА.
Плазмиды 2K7bsd-CMV-hFcRnECD и 2K7neo-CMV-hB2M по отдельности совместно сотрансфицировали с оболочкой VSV-G и пакующей плазмидой gag/pol в клетки HEK293T с использованием трансфекции с хлоридом кальция (Zufferey et al. (1997) Nat Biotechnol 15(9):871-5; Jakobsson et al. (2006) J Neurosci Res 84:58-67). Супернатанты культуры HEK293, содержащие сформированные лентивирусные частицы с человеческим αFcRnECD и человеческим В2М трансгенами соответственно, осветляли от клеточных обломков путем центрифугирования и фильтрования. Для последовательной трансдукции клеток SKOV-3 использовали два типа лентивирусных частиц. Успешных двойных интегрантов, содержащих и человеческий aFcRnECD и В2М гены, отбирали посредством добавления в культуральную среду бластицидина (Invitrogen) и G418 сульфата (Invitrogen) при пассировке клеток в течение двух недель. Образующуюся стабильно трансдуцированную линию клеток SKOV-3 обозначали SKOV-3 hFcRnECD/hB2M.
Экспрессия рекомбинантного человеческого FcRn. Клетки SKOV-3, соэкспрессирующие человеческий αFcRnECD и В2М, что дает человеческий FcRn, размножали, и 1,5×107 клеток высевали в HYPERFIask (Corning) в 560 мл полной ростовой среды. Через пять суток, когда клетки оседали и размножались, среду заменяли на полную ростовую среду без FBS. Через пять суток культуру завершали, и супернатант собирали, пропускали через 45 мкм фильтр и замораживали при -80°С.
Очистка рекомбинантного человеческого FcRn с использованием хроматографии на человеческом IgG. Очистку белка проводили в системе  Explorer (GE Healthcare). Человеческий IgG (Pharmacia), 1 мл в 0,2 М NaHCO3, 0,5 М NaCl, рН 8,3, в концентрации 10 мг/мл, связывали с 1 мл активированной NHS (N-гидроксисукцинимид) HP колонкой HiTrap (GE Healthcare) согласно инструкции изготовителя. Супернатант, содержащий рекомбинантный человеческий FcRn из клеток SKOV-3, оттаивали, и рН доводили до 5,8 с использованием HCl. Супернатант затем загружали на колонку, предварительно уравновешенную 20 мМ Bis-Tris, рН 5,8, партиями по 100 мл. Колонку промывали 20 мл 20 мМ Bis-Tris, рН 5,8, и элюировали во фракциях 1 мл с использованием 50 мМ Tris, рН 8,1. Производили замену буфера на PBS (фосфатно-солевой буферный раствор: 10 мМ фосфат, 137 мМ NaCl, 2,68 мМ KCl, рН 7,4) с использованием диализа.
Explorer (GE Healthcare). Человеческий IgG (Pharmacia), 1 мл в 0,2 М NaHCO3, 0,5 М NaCl, рН 8,3, в концентрации 10 мг/мл, связывали с 1 мл активированной NHS (N-гидроксисукцинимид) HP колонкой HiTrap (GE Healthcare) согласно инструкции изготовителя. Супернатант, содержащий рекомбинантный человеческий FcRn из клеток SKOV-3, оттаивали, и рН доводили до 5,8 с использованием HCl. Супернатант затем загружали на колонку, предварительно уравновешенную 20 мМ Bis-Tris, рН 5,8, партиями по 100 мл. Колонку промывали 20 мл 20 мМ Bis-Tris, рН 5,8, и элюировали во фракциях 1 мл с использованием 50 мМ Tris, рН 8,1. Производили замену буфера на PBS (фосфатно-солевой буферный раствор: 10 мМ фосфат, 137 мМ NaCl, 2,68 мМ KCl, рН 7,4) с использованием диализа.
SDS-PAGE и Вестерн-блоттинг. Чистоту элюированных фракций из очистки белка анализировали посредством SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и окрашивания реактивом GelCode Blue Stain (Pierce) и набором для окрашивания серебром SilverXpress® (Invitrogen). Вестерн-блоттинг проводили с использованием нитроцеллюлозной мембраны Amersham Hybond™-C Extra (GE Healthcare). Мембрану блокировали 5% нежирным сухим молоком (Semper) в TBS+T (50 мМ основание Trizma, 150 мМ NaCl, 0,05% Tween-20, рН 8) в течение 1 часа, затем зондировали смесью кроличьего поликлонального антитела против FCGRT (Atlas Antibodies) в концентрации 0,15 мкг/мл и кроличьего поликлонального антитела против В2М (Atlas Antibodies) в концентрации 0,23 мкг/мл в TBS+T. Мембрану затем инкубировали со стабилизированным антителом козы против кроличьего антитела, конъюгированным с пероксидазой хрена (Pierce), разведенным 1:10000 в TBS+T. После добавления субстрата ТМВ (тетраметилбензидин) (Pierce) изображение мембраны получали на Amersham Hyperfilm ECL (GE Healthcare). Hyperfilm проявляли с использованием проявителя GBX и фиксатора GBX (Sigma-Aldrich).
Получение некомплексированной формы человеческого В2М. Человеческий В2М получали в Е. coli. Экспрессию и очистку проводили по существу как описано в Sandalova et al. (2005) Acta Chryst F61:1090-1093 и Michaelsson et al. (2001) J Immunol 166:7327-7334. Очищенный белок, состоящий из аминокислот 21-119 человеческого В2М, в мочевине подвергали повторному сворачиванию в аргинине следующим образом: 0,5 мг В2М быстро добавляли в 2 мл буфера для повторного сворачивания (20 мл 1 М Tris-HCl, рН 8,0, 16,87 г L-аргинина (буферизован HCl), 0,8 мл 0,5 М EDTA (этилендиаминтетрауксусная кислота), 61 мг GSSG, 307 мг GSH и вода милли-Q до конечного объема 200 мл, рН 8,0, и дополненный ингибитором протеаз (Roche, кат. №11873580001)). Процедуру повторного сворачивания проводили при 4°С на протяжении 4 часов. Производили замену буфера повторно свернутого белка В2М на PBS с использованием колонки PD-10 (GE Healthcare).
Результаты
Конструирование плазмид, содержащих гены человеческого αFcRn и человеческого β2-микроглобулина, подлежащих применению для соэкспрессии. Гены, кодирующие внеклеточный домен α-цепи человеческого FcRn (αFcRnECD) и человеческий В2М, вставляли в лентивирусные плазмиды для переноса 2K7bsd и 2K7neo соответственно. В обоих случаях вставленный ген находится под контролем промотора CMV (вирус мозаики цветной капусты). Данные гены удлиняли так, чтобы образующиеся белки имели бы лидерную последовательность цепи каппа lg в N-конце для адресования белка для экспорта через эндоплазматический ретикулум в культуральную среду (сигнальная последовательность отщеплялась при секреции). Кроме того, αFcRnECD имел С-концевую спейсерную последовательность, с последующей меткой FLAG для потенциального выявления. Человеческий В2М имел С-концевую спейсерную последовательность, с последующей меткой His6 для потенциального выявления. Данную спейсерную последовательность добавляли для увеличения доступности метки. Лентивирусные плазмиды для переноса также содержали два разных гена устойчивости к антибиотикам для обеспечения отбора клеток, в которые были вставлены обе конструкции.
Экспрессия и очистка рекомбинантного человеческого FcRn. Гены, кодирующие αFcRnECD и В2М, вставляли в геном SKOV-3 посредством лентивирусов, и образующийся белок FcRn секретировался в культуральную среду. Для захвата только FcRn, сохранившего рН-зависимое связывание IgG, использовали аффинную хроматографию с использованием иммобилизованного IgG, где рецептор захватывали при рН 5,8 и элюировали при рН 8,1. Захваченный белок элюировали в трех фракциях.
SDS-PAGE и Вестерн-блоттинг. Для исследования присутствия двух пептидных цепей (αFcRnECD и В2М) продуцированного белка FcRn и для анализа чистоты элюированного вещества проводили анализ SDS-PAGE на элюированных фракциях. Для геля, окрашенного краситетем GelCode Blue, выявляли две полосы с молекулярными массами 12 и 36 кДа соответственно. Это приблизительно соответствует теоретическим молекулярным массам негликозилированных пептидных цепей 12 кДа для В2М и 31 кДа для αFcRnECD. Часть белка, представляющая собой αFcRnECD. содержит один сайт гликозилирования, и, следовательно, ожидалось, что ее молекулярная масса была бы выше, чем 31 кДа. Гель также окрашивали серебром для увеличения чувствительности и, возможно, для выявления примесей. Полосу приблизительно 66 кДа выявляли в первой элюированной фракции, которая могла бы соответствовать BSA (бычий сывороточный альбумин), возникающему в результате прикрепления клетки. Общее количество белка, выделенного во вракции 2 и 3, соответствовало 1,4 мг/л культуральной среды. Провели анализ вестерн-блоттингом на объединенном веществе, который продемонстрировал по существу только две главные полосы, помимо очень слабой полосы меньше 12 кДа, которая возможно соответствует продукту деградации.
Пример 2
Отбор и связывание в ELISA вариантов Z, связывающихся с FcRn
В данном примере человеческий FcRn использовали в качестве мишени в селекциях посредством фагового дисплея с использованием фаговой библиотеки вариантов Z. В отобранных клонах секвенировали ДНК, осуществляли продукцию в периплазматических фракциях Е. coli и анализировали относительно FcRn в ELISA.
Материалы и методы
Биотинилирование белка-мишени FcRn и В2М. Человеческий FcRn и человеческий В2М, полученные, как описано в Примере 1, биотинилировали с использованием No-Weigh EZ-Link сульфо-NHS-LC-биотина (Pierce, кат. №21327) при 31-кратном (FcRn) и 10-кратном (В2М) молярном избытке соответственно согласно рекомендациям изготовителя. Реакции проводили при комнатной температуре (RT) в течение 30 мин. Проводили последующую замену буфера на PBS с использованием диализных кассет Slide-a-lyzer (FcRn; Pierce, кат. №66380, 10000 MWCO (порог отсечения молекулярной массы) и В2М; Pierce, кат. №66333, 3500 MWCO) согласно инструкциям изготовителя.
Селекция посредством фагового дисплея вариантов Z, связывающихся с FcRn. Библиотеку случайных вариантов белка Z, подвергающихся дисплею на бактериофаге, сконструированную в фагмиде pAY02592, по существу как описано в Gronwall et al. (2007) J Biotechnol, 128:162-183, использовали для селекции вариантов Z, связывающихся с FcRn. В данной библиотеке в качестве партнера связывания вариантов Z используется альбуминсвязывающий домен (ABD, GA3 белка G из штамма G148 Streptococcus). Библиотека обозначена Zlib006Naive.II и имеет размер 1,5×1010 элементов библиотеки (вариантов Z). Клетки Е. coli RRIΔM15 ( et al., (1982) Nucleic Acids Res 10:5765-5772) из глицеринового маточного раствора, содержащего фагмидную библиотеку Zlib006Naive.II, инокулировали в 20 л среды определенного состава, не содержащей пролин [дикалия гидрофосфат 7 г/л, тринатрия цитрат дигидрат 1 г/л, урацил 0,02 г/л, YNB (дрожжевое азотистое основание без аминокислот Difco™, Becton Dickinson) 6,7 г/л, глюкозы моногидрат 5,5 г/л, L-аланин 0,3 г/л, L-аргинина моногидрохлорид 0,24 г/л, L-аспарагина моногидрат 0,11 г/л, L-цистеин 0,1 г/л, L-глутаминовая кислота 0,3 г/л, L-глутамин 0,1 г/л, глицин 0,2 г/л, L-гистидин 0,05 г/л, L-изолейцин 0,1 г/л, L-лейцин 0,1 г/л, L-лизина моногидрохлорид 0,25 г/л, L-метионин 0,1 г/л, L-фенилаланин 0,2 г/л, L-серин 0,3 г/л, L-треонин 0,2 г/л, L-триптофан 0,1 г/л, L-тирозин 0,05 г/л, L-валин 0,1 г/л], дополненной 100 мкг/мл ампициллина. Культуры выращивали при 37°С в ферментере (Belach Bioteknik, BR20). При достижении клетками оптической плотности 600 нм (ОП600) 0,75, приблизительно 2,6 л культуры инфицировали с использованием 10-кратного молярного избытка хелперного фага M13K07 (New England Biolabs, кат. №N0315S). Клетки инкубировали в течение 30 минут, после чего ферментер заполняли вплоть до 20 л TSB-YE (триптический соевый бульон-дрожжевой экстракт; 30 г/л TSB, 5 г/л дрожжевого экстракта), дополненного 100 мкМ изопропил-β-D-1-тиогалактопиранозидом (IPTG) для индукции экспрессии и 25 мкг/мл канамицина и 12,5 мкг/мл карбенициллина, и выращивали при 30°С в течение 22 ч. Клетки в культуре осаждали центрифугированием при 15900 g. Фаговые частицы дважды осаждали из супернатанта в PEG/NaCl (полиэтиленгликоль/хлорид натрия), фильтровали и растворяли в PBS и глицерине, как описано в
et al., (1982) Nucleic Acids Res 10:5765-5772) из глицеринового маточного раствора, содержащего фагмидную библиотеку Zlib006Naive.II, инокулировали в 20 л среды определенного состава, не содержащей пролин [дикалия гидрофосфат 7 г/л, тринатрия цитрат дигидрат 1 г/л, урацил 0,02 г/л, YNB (дрожжевое азотистое основание без аминокислот Difco™, Becton Dickinson) 6,7 г/л, глюкозы моногидрат 5,5 г/л, L-аланин 0,3 г/л, L-аргинина моногидрохлорид 0,24 г/л, L-аспарагина моногидрат 0,11 г/л, L-цистеин 0,1 г/л, L-глутаминовая кислота 0,3 г/л, L-глутамин 0,1 г/л, глицин 0,2 г/л, L-гистидин 0,05 г/л, L-изолейцин 0,1 г/л, L-лейцин 0,1 г/л, L-лизина моногидрохлорид 0,25 г/л, L-метионин 0,1 г/л, L-фенилаланин 0,2 г/л, L-серин 0,3 г/л, L-треонин 0,2 г/л, L-триптофан 0,1 г/л, L-тирозин 0,05 г/л, L-валин 0,1 г/л], дополненной 100 мкг/мл ампициллина. Культуры выращивали при 37°С в ферментере (Belach Bioteknik, BR20). При достижении клетками оптической плотности 600 нм (ОП600) 0,75, приблизительно 2,6 л культуры инфицировали с использованием 10-кратного молярного избытка хелперного фага M13K07 (New England Biolabs, кат. №N0315S). Клетки инкубировали в течение 30 минут, после чего ферментер заполняли вплоть до 20 л TSB-YE (триптический соевый бульон-дрожжевой экстракт; 30 г/л TSB, 5 г/л дрожжевого экстракта), дополненного 100 мкМ изопропил-β-D-1-тиогалактопиранозидом (IPTG) для индукции экспрессии и 25 мкг/мл канамицина и 12,5 мкг/мл карбенициллина, и выращивали при 30°С в течение 22 ч. Клетки в культуре осаждали центрифугированием при 15900 g. Фаговые частицы дважды осаждали из супернатанта в PEG/NaCl (полиэтиленгликоль/хлорид натрия), фильтровали и растворяли в PBS и глицерине, как описано в  et al. выше. Маточные растворы фага хранили до использования при -80°С.
et al. выше. Маточные растворы фага хранили до использования при -80°С.
Селекции против биотинилированного человеческого FcRn проводили в четырех циклах, разделенных на две разных группы. Получение маточного раствора фага и процедуру селекции проводили по существу, как описано для селекции против другой биотинилированной мишени в WO 2009/077175. Амплификацию фага между циклами селекции проводили посредством инфицирования Е. coli RRIΔM15 фагом, затем проведением культивирования в растворе следующим образом. Давали элюированному фагу и 10-кратному избытку хелперного фага M13K07 по сравнению с бактериями одновременно инфицировать бактерии в log фазе при 37°С в течение 30 мин без вращения, с последующими 30 мин с медленным вращением. Перед инфицированием бактерии выращивали до log фазы в среде определенного состава, не содержащей пролин, описанной выше. Инфицированные бактерии осаждали центрифугированием при 4300 g в течение 10 мин и ресуспендировали в 200 мл среды TSB+YE, дополненной 0,1 мМ IPTG, 25 мкг/мл канамицина и 100 мкг/мл ампициллина, и культивировали при 30°С в течение ночи для продукции фага.
Буфер для селекции состоял из 100 мМ фосфата натрия и 150 мМ хлорида натрия, доведенных до рН 5,5 соляной кислотой и дополненных 0,1% желатином и 0,1% Tween-20. Во время селекции в буфер для селекции добавляли человеческий сывороточный альбумин (HSA, Albucult, Novozymes) до конечной концентрации 1,5 мкМ. Для того чтобы уменьшить количество фоновых связывающих агентов, проводили предселекцию путем инкубации маточного раствора фага с Dynabeads® М-280, покрытых стрептавидином (SA-шарики, Dynal, кат. №112.06), в течение 1 часа при RT. Проводили вторую предселекцию на протяжении 30 мин при RT против человеческого В2М, иммобилизованного в иммунопробирках (Nunc, кат. №444474). 5 мкг/мл человеческого В2М в карбонатном буфере (Sigma, кат.№068K8214) иммобилизировали в пробирке при 7°С в течение больше чем 1 ч. После двухкратной промывки водой из под крана пробирки блокировали PBS плюс 0,5% казеин (Sigma, кат. №С8654) в течение 30 мин при RT перед применением. Все пробирки и шарики, используемые в селекции, предварительно блокировали PBS плюс 0,1% желатином. Селекцию проводили в растворе при RT, с последующим захватом комплексов мишень-фаг на SA-шариках, где использовали 1 мг шариков на 2,9 мкг биотинилированного FcRn. В цикле 1 селекции использовали 100 нМ биотинилированного FcRn, и проводили две промывки по две мин каждая с использованием буфера для селекции. В последующих циклах применяли повышенную жесткость с использованием пониженной концентрации мишени и увеличенного числа промывок: 50 нМ/5 промывок, 25 нМ/8 промывок и 10 нМ/12 промывок применяли в цикле 2, 3 и 4 соответственно. После промывок связавшийся фаг элюировали из двух групп селекции с использованием двух разных методик: 1) 500 мкл 0,1 М глицин-HCl, рН 2,2, с последующей немедленной нейтрализацией 50 мкл 1 М Tris-HCl, рН 8,0 и 450 мкл PBS или; 2) 500 мкл 100 мМ фосфата натрия и 150 мМ хлорида натрия, рН 8,0 и нейтрализация 500 мкл PBS.
Секвенирование: ПЦР-фрагменты амплифицировали из одиночных колоний с использованием стандартной программы ПЦР (полимеразная цепная реакция) и праймеров AFFI-21 (5'-tgcttccggctcgtatgttgtgtg (SEQ ID NO: 1071)) и AFFI-22 (5'-cggaaccagagccaccaccgg (SEQ ID NO: 1072)). Секвенирование амплифицированных фрагментов проводили с использованием биотинилированного олигонуклеотида AFFI-72 (5'-биотин-cggaaccagagccaccaccgg (SEQ ID NO: 1073)) и набора BigDye® Terminator v3.1 Cycle Sequencing (Applied Biosystems), используемых согласно протоколу изготовителя. Продукты реакций секвенирования очищали посредством связывания с магнитными шариками, покрытыми стрептавидином (Detach Streptavidin Beads, Nordiag, кат. №2012-01), с использованием Magnatrix 8000 (Magnetic Biosolution) и анализировали на генетическом анализаторе ABI PRISM® 3130xl (РЕ Applied Biosystems).
Получение вариантов Z для ELISA. Секвенированные варианты Z получали путем инокулирования одиночных колоний из селекции в 10 мл среды TSB-YE, дополненной 100 мкг/мл ампициллина и 0,1 мМ IPTG, и инкубирования в течение 24 ч при 37°С. Клетки осаждали посредством центрифугирования, ресуспендировали в 2 мл PBST (PBS, дополненный 0,05% Tween-20), замораживали при -80°С и оттаивали в водной бане для высвобождения периплазматической фракции клеток. Процедуру замораживания-оттаивания повторяли семь раз, и затем клетки осаждали центрифугированием. Супернатант периплазматического экстракта содержал варианты Z в виде слияний с ABD, экспрессируемых в виде AQHDEALE-[Z#####]-VDYV-[ABD]-YVPG ( et al., выше). Z##### относится к индивидуальным вариантам Z из 58 аминокислотных остатков.
et al., выше). Z##### относится к индивидуальным вариантам Z из 58 аминокислотных остатков.
Анализ KD вариантов Z посредством ELISA. Связывание вариантов Z с FcRn анализировали в анализах ELISA. Половину площади 96-луночных планшетов для ELISA покрывали 2 мкг/мл антитела козы против ABD (получено самостоятельно), разведенного в буфере для покрытия (50 мМ карбонат натрия, рН 9,6) при 4°С в течение ночи. Раствор антитела сливали, и лунки блокировали 100 мкл PBSC (PBS, дополненный 0,5% казеина) в течение 1,5 ч при RT. Блокирующий раствор отбрасывали, добавляли в лунки 50 мкл периплазматического раствора, разведенного 1:4, и инкубировали в течение 1,5 ч при RT при медленном встряхивании. Растворы сливали, и лунки промывали четыре раза либо 0,05% буфером РСТ, рН 6,0 (цитратно-фосфатный буфер Мак-Илвейна, рН 6,0, дополненный 0,05% Tween-20), либо 0,05% буфером РСТ, рН 7,4 (цитратно-фосфатный буфер Мак-Илвейна, рН 7,4, дополненный 0,05% Tween-20). В лунки добавляли белок-мишень - биотинилированный человеческий FcRn в серии разведения концентрации 1:3 от 2 мкг/мл (45 нМ) до 0,3 нг/мл (6,9 пМ), разведенный в буфере РСС, рН 6,0 или рН 7,4 (цитратно-фосфатный буфер Мак-Илвейна, рН 6,0 или рН 7,4, дополненный 0,5% казеином) соответственно. Планшеты инкубировали в течение 1,5 ч при RT, с последующими промывками, как описано выше. Стрептавидин, конъюгированный с HRP (Thermo Scientific, кат. №N100), разводили 1:30000 в буфере РСС, рН 6,0 или рН 7,4 соответственно и добавляли в лунки с последующей 45 мин инкубацией. После промывки, как описано выше, в лунки добавляли 50 мкл субстрата ImmunoPure ТМВ (Thermo Scientific, кат. №34021), и планшеты обрабатывали согласно рекомендациям изготовителя. Поглощение измеряли при 450 нм с использованием многолуночного планшет-ридера Victor3 (Perkin Elmer). Вариант Z, связывающийся с иррелевантным белком, использовали в качестве негативного контроля, и пустую пробу создавали, опуская периплазматическую стадию. Вариант Z, который связывался с FcRn в предварительном эксперименте (Z07918, SEQ ID NO: 707), использовали в качестве позитивного контроля. Измеренные значения анализировали с использованием GraphPad Prism 5 (GraphPad Software, LaJolla, CA, США) и нелинейной регрессии для того, чтобы определить аффинности (KD) взаимодействий.
Анализ специфичности вариантов Z и использованием ELISA. В другом эксперименте ELISA тестировали специфичности вариантов Z посредством их анализа против 2 мкг/мл биотинилированных человеческих белков В2М, PSMA (собственного производства) и IgG (поликлональное, Pharmacia, Швеция) и против буфера РСС, рН 6,0 или рН 7,4 соответственно. Данный анализ проводили при рН 6,0 и при рН 7,4 соответственно, как описано выше. На стадии белка-мишени в лунки добавляли биотинилированные белки или буфер вместо FcRn.
Результаты
Селекция посредством фагового дисплея вариантов Z, связывающихся с FcRn. Индивидуальные клоны получали после четырех циклов селекции посредством фагового дисплея против биотинилированного человеческого FcRn.
Секвенирование. Секвенирование проводили на клонах, взятых случайным образом из четвертого цикла селекции. Каждому варианту Z давали уникальный идентификационный номер #####, и индивидуальные варианты называются Z#####. Аминокислотные последовательности вариантов Z, имеющих длину 58 аминокислотных остатков, перечислены на Фиг. 1 в виде SEQ ID NO: 707-722 и SEQ ID NO: 1059.
Выведенные мотивы связывания с FcRn данных вариантов Z перечислены на Фиг. 1 в виде SEQ ID NO: 1-16 и SEQ ID NO: 353. Аминокислотные последовательности полипептидов, имеющих длину 49 аминокислотных остатков, для которых предсказано, что они составляют полный пучок трех спиралей в пределах каждого из этих вариантов Z, перечислены на Фиг. 1 в виде SEQ ID NO: 354-369 и SEQ ID NO: 706.
Анализы ELISA с вариантами Z. В Е. coli продуцировали шестнадцать клонов в виде слитых белков с ABD. В ELISA использовали периплазматические фракции против серии разведения человеческого FcRn. Клонами были: Z07909 (SEQ ID NO: 719), Z07918 (SEQ ID NO: 707), Z07930 (SEQ ID NO: 712), Z07960 (SEQ ID NO: 710), Z10109 (SEQ ID NO: 709), Z10111 (SEQ ID NO: 714), Z10127 (SEQ ID NO: 718), Z10129 (SEQ ID NO: 715), Z10140 (SEQ ID NO: 711), Z10141 (SEQ ID NO: 716), Z10145 (SEQ ID NO: 721), Z10152 (SEQ ID NO: 720), Z10156 (SEQ ID NO: 717), Z10161 (SEQ ID NO: 722), Z10183 (SEQ ID NO: 713) и Z10193 (SEQ ID NO: 708). Значения KD определяли для всех вариантов при рН 6,0, и для трех вариантов - при рН 7,4 (Таблица 1). Для тринадцати вариантов данные для анализа KD при рН 7,4 не были получены. Ни один из шестнадцати вариантов не демонстрировал неспецифичного связывания при анализе против человеческого В2М, IgG или PSMA.
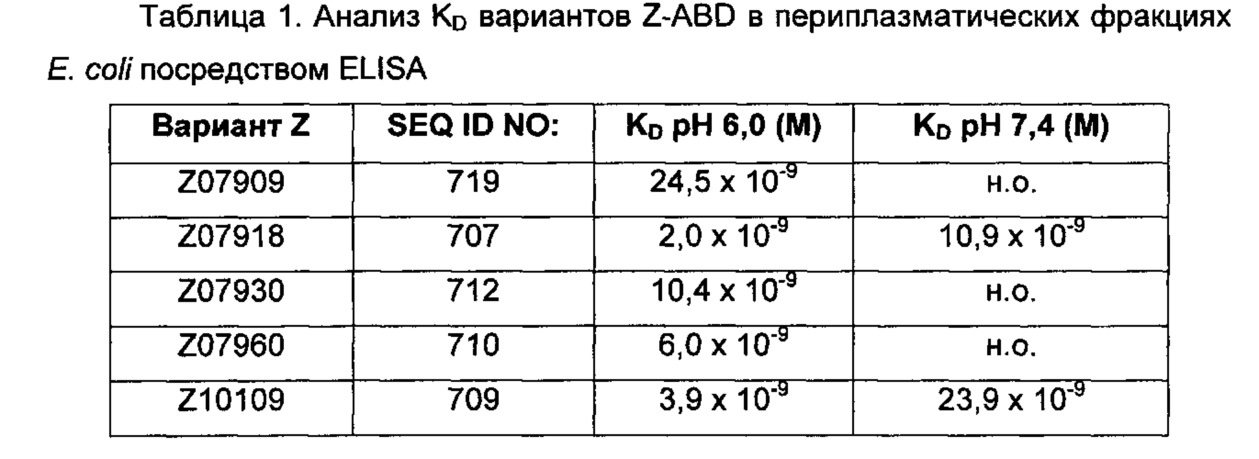
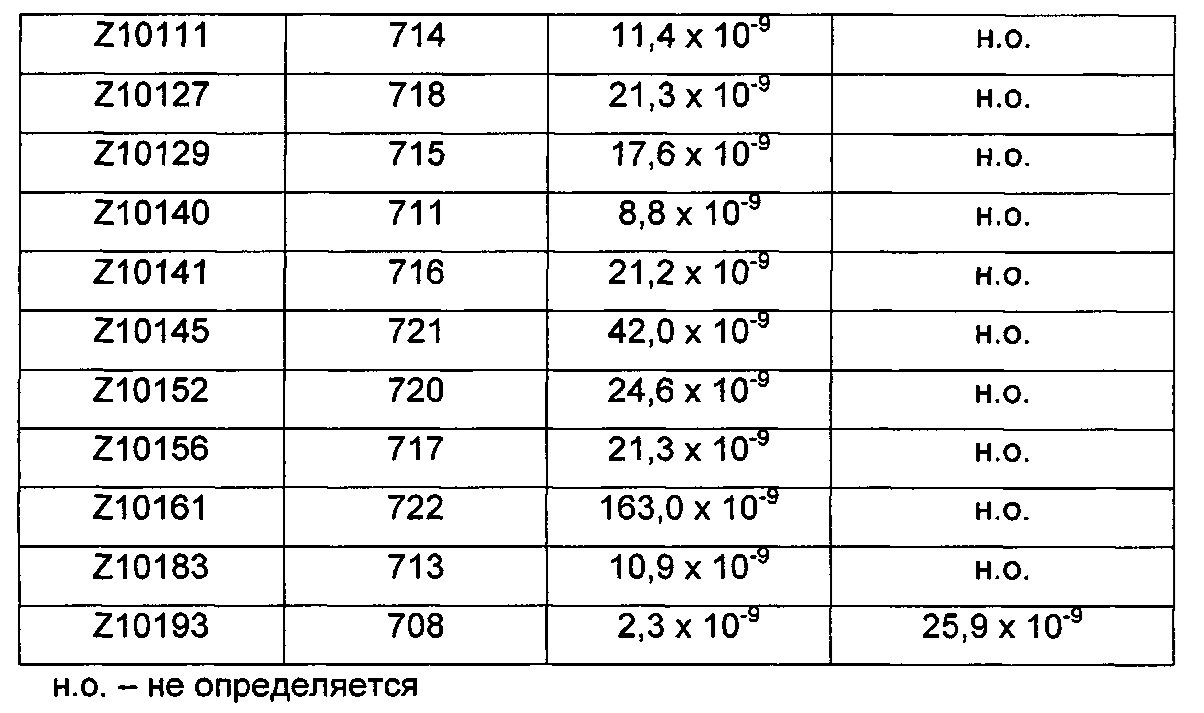
Пример 3
Продукция и характеризация вариантов Z, связывающихся с FcRn В данном примере в Е. coli продуцировали семнадцать вариантов Z, очищали и анализировали против человеческого FcRn в Biacore. Поднабор указанных вариантов также анализировали против мышиного FcRn. Для поднабора вариантов Z проводили спектроскопию кругового дихроизма (CD) для исследования их вторичной структуры.
Материалы и методы
Субклонирование вариантов Z. ДНК семнадцати вариантов Z, связывающихся с FcRn (SEQ ID NO: 707-722 и SEQ ID NO: 1059), амплифицировали из вектора библиотеки pAY02592. Применяли стратегию субклонирования для конструирования мономерных молекул вариантов Z с N-концевой меткой His6 с использованием стандартных методик молекулярной биологии (по существу, как подробно описано в WO 2009/077175 для вариантов Z, связывающихся с другой мишенью). Фрагменты гена Z субклонировали в экспрессионный вектор pAY01448, что приводило к кодируемой последовательности MGSSHHHHHHLQ-[Z#####]-VD.
Кроме того, вариант Z07918 (SEQ ID NO: 707), связывающийся с FcRn, но начинающийся с аминокислот АЕ вместо VD и обозначенный Z11948 (SEQ ID NO: 1060), клонировали в виде гомодимерных конструкций с двумя линкерами между вариантами Z и с последующей С-концевой меткой His6. Это осуществляли с использованием традиционных способов молекулярной биологии, включающих амплификацию ДНК, рестрикцию подходящими рестрикционными ферментами и лигирование ДНК. Два линкера были приобретены у Thermo Fisher Scientific. Фрагменты генов Z субклонировали в экспрессионный вектор (репликатор рЕТ-26, Novagen), что приводит к кодируемой последовательности [Z#####]-GT-(G4S)-PR-[Z#####]-LEHHHHHH и [Z#####]-GT-(G4S)3-[Z#####]-LEHHHHHH соответственно.
Культивирование и очистка. Клетки Е. coli BL21(DE3) (Novagen) трансформировали плазмидами, содержащими фрагмент гена каждого соответствующего варианта Z, связывающегося с FcRn, и культивировали при 37°С в 800 или 1000 мл среды TSB-YE, дополненной 50 мкг/мл канамицина. При ОП600, равной 2, добавляли IPTG в конечной концентрации 0,17 или 0,2 мМ для индукции экспрессии, и культуру инкубировали при 37°С в течение еще 5 ч. Клетки собирали посредством центрифугирования.
Приблизительно 2-5 г каждого клеточного осадка ресуспендировали в 10-25 мл буфера для связывания (20 мМ фосфат натрия, 0,5 М NaCl, 20 мМ имидазол, рН 7,4), дополненного Benzonase® (Merck, кат. №1.01654.0001) до концентрации 15 U/мл и лизоцимом (Sigma, кат. №L-7651) до концентрации 0,5 мг/мл. После разрушения клеток тремя циклами замораживания-оттаивания или обработки ультразвуком обломки клеток удаляли центрифугированием, и каждый супернатант наносили на 1 мл колонку GraviTrap IMAC (GE Healthcare, кат. №11-0033-99). Загрязнители удаляли промывкой промывочным буфером (20 мМ фосфат натрия, 0,5 М NaCl, 20 или 60 мМ имидазол, рН 7,4), и варианты Z, связывающиеся с FcRn, затем элюировали элюирующим буфером 1 (20 мМ фосфат натрия, 0,5 М хлорид натрия, 250 мМ имидазол, рН 7,4) или элюирующим буфером 2 (0,1 М уксусная кислота, 0,5 М хлорид натрия, рН 4,5). У очищенных вариантов Z производили замену буфера на PBS с использованием колонок PD-10 (GE Healthcare) согласно протоколу изготовителя. Концентрации белка определяли измерением поглощения при 280 нм с использованием спектрофотометра NanoDrop® ND-1000, и используя коэффициент экстинкции для соответствующего белка. Чистоту вариантов Z, связывающихся с FcRn, анализировали SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) с окрашиванием кумасси синим. Идентичность каждого очищенного варианта Z, связывающегося с FcRn, подтверждали с использованием анализа ЖХ/МС (жидкостная хроматография/масс-спектрометрия).
Анализ CD. Очищенные варианты Z, меченные His6, разводили до 0,5 мг/мл в PBS. Для каждого разведенного варианта Z получали спектр CD при 250-195 нм или 250-190 нм при 20°С. Кроме того, проводили измерение при изменяющейся температуре (VTM) для определения температуры плавления (Tm). При VTM поглощение измеряли при 221 нм, в то время как температура возрастала от 20 до 90°С с приростом температуры 5°С/мин. Новый спектр CD получали при 20°С после процедуры нагревания для того, чтобы исследовать способность вариантов Z к повторному сворачиванию. Измерения CD проводили на спектрополяриметре Jasco J-810 (Jasco Scandinavia АВ) с использованием ячейки с длиной оптического пути 1 мм.
Анализ связывания и кинетики посредством Biacore. Взаимодействие вариантов Z, связывающихся с FcRn, меченных His6, с человеческим FcRn анализировали на приборе Biacore 2000 (GE Healthcare). Человеческий FcRn иммобилизовали в проточной ячейке на слое карбоксилированного декстрана поверхности чипа СМ5 (GE Healthcare). Иммобилизацию проводили с использованием химии аминного связывания согласно протоколу изготовителя, и используя HBS-EP (GE Healthcare) в качестве подвижного буфера. Одну поверхность проточной ячейки на чипе активировали и дезактивировали для применения в качестве пустой пробы во время инъекций аналитов. В двух экспериментах по связыванию, представленных ниже, в качестве подвижного буфера использовали фосфатно-цитратный буфер Мак-Илвейна, рН 6,0, дополненный 0,005% Tween-20 (0,005% РСТ). Во всех экспериментах использовали скорость тока 50 мкл/мин.
В одном эксперименте диссоциацию при рН 6,0 сравнивали с диссоциацией при рН 7,4. Варианты Z, меченные His6, и человеческий моноклональный lgG1 разводили в подвижном буфере до конечной концентрации 250 нМ или 2,5 нМ соответственно и инъецировали над чипом FcRn в течение 1 минуты с использованием процедуры соинъекции. Вторая инъекция процедуры соинъекции, представляющая фазу диссоциации взаимодействий, содержала либо проточный буфер (рН 6,0), либо 0,005% РСТ, рН 7,4. Вариантам Z давали диссоциировать в течение 1 минуты, за исключением Z07918 и Z10193, которым давали диссоциировать в течение 4 минут, перед уравновешиванием поверхности на протяжении 5 минут в подвижном буфере. IgG давали диссоциировать в течение 4 минут перед уравновешиванием. Инъекции буфера проводили аналогичным образом; соинъекция буфера, рН 6,0, с последующим рН 6,0 или соинъекция буфера, рН 6,0, с последующим рН 7,4. Результаты анализировали в программе BiaEvaluation 4.1 (GE Healthcare). Кривые от пустой поверхности вычитали из кривых от поверхности с лигандом. Кроме того, кривые инъекций буфера вычитали из кривых Z вариантов и из кривых IgG для корректировки эффектов буфера.
В другом эксперименте определяли приблизительные кинетические константы (kon и koff) и аффинности (KD) для поднабора вариантов Z, меченных His6. Три концентрации вариантов Z инъецировали в течение 1 минуты с последующей диссоциацией в подвижном буфере в течение 1 минуты. Поверхности уравновешивали подвижным буфером на протяжении 7,5 минут перед началом следующего цикла. Инъецированные концентрации составляли либо 675 нМ, 225 нМ и 75 нМ (Z10140, Z10156 и Z10183), либо 225 нМ, 75 нМ и 25 нМ (Z07918 и Z10193). Кинетические константы рассчитывали из сенсограмм с использованием модели Лангмюра 1:1 программы BiaEvaluation 4.1 (GE Healthcare).
В отдельном эксперименте аффинность взаимодействий вариантов Z с hFcRn (SEQ ID NO: 1065) и mFcRn (SEQ ID NO: 1070) соответственно измеряли и при рН 6,0, и при рН 7,4 на приборе Biacore 3000 (GE Healthcare). hFcRn и mFcRn продуцировали по существу, как описано в Примере 1, но используя мышиные клетки 3Т3 вместо человеческих клеток SKOV-3 для продукции mFcRn, и иммобилизовали на отдельных проточных ячейках на чипе СМ5 в ацетатном буфере, рН 4,65. Уровень иммобилизации составлял приблизительно 1000 RU для обоих рецепторов. Контрольную проточную ячейку создавали активацией и дезактивацией. 0,005% РСТ, рН 6,0 или 7,4, использовали в качестве подвижного буфера и для разведения аналитов. Все анализы проводили при 25°С. Константы аффинности для вариантов Z, меченных His6, - Z07918 (SEQ ID NO: 707), Z07960 (SEQ ID NO: 710) и Z10193 (SEQ ID NO: 708), определяли путем инъецирования серии разведения от 1024 нМ до 0,5 нМ (рН 6,0) или от 10240 нМ до 5 нМ (рН 7,4). Аффинности получали с использованием программы GraphPad Prism 5, используя модель насыщения при связывании в одном сайте.
Анализ блокирования посредством AlphaLISA. Потенциал вариантов Z ингибировать связывание IgG с FcRn анализировали в анализе AlphaLISA с использованием мультипланшет-ридера EnSpire 2300 (Perkin Elmer). Человеческий IgG (Roactemra) иммобилизовали на акцепторных шариках AlphaLISA (Perkin Elmer, кат. №6772002) согласно рекомендациям изготовителя. В 384-луночном планшете (Perkin Elmer, кат. №G6005350) делали ступенчатые серийные разведения 1:3 вариантов Z, меченных His, до конечных концентраций от 250 нМ до 38 пМ и инкубировали в течение 45 мин с 10 нМ биотинилированным человеческим FcRn (Biorbyt, кат. №orb84388; биотинилирован по существу, как описано в Примере 2) в буфере для AlphaLISA (Perkin Elmer, кат. №AL000F), доведенном до рН 6,0 с использованием HCl. Акцепторные шарики, покрытые IgG, добавляли до конечной концентрации 10 мкМ и инкубировали в течение 45 мин. Наконец, добавляли донорные шарики, покрытые стрептавидином (Perkin Elmer, кат. №6772002) до конечной концентрации 40 мкг/мл и инкубировали в течение 30 мин. Все инкубации проводили при RT в темноте. Планшет анализировали на приборе EnSpire, и значения IC50 (полумаксимальная ингибирующая концентрация) рассчитывали с использованием GraphPad Prism 5.
Результаты
Культивирование и очистка. В Е. coli продуцировали семнадцать вариантов Z, связывающихся с FcRn (SEQ ID NO: 707-722 и SEQ ID NO: 1059), сконструированных с N-концевой меткой His6. Количество белка, очищенного IMAC из приблизительно 2-5 г бактериальных осадков, определенное спектрофотометрически измерением поглощения при 280 нм, варьировало от приблизительно 10 мг до 20 мг для разных вариантов Z, связывающихся с FcRn. Анализ SDS-PAGE каждого конечного препарата белка продемонстрировал то, что они преимущественно содержали вариант Z, связывающийся с FcRn. Правильная идентичность и молекулярная масса каждого варианта Z, связывающегося с FcRn, была подтверждена анализом HPLC-MS (высокоэффективная жидкостная хроматография-масс-спектрометрия).
Анализ CD. Спектры CD, определенные для шести вариантов Z, продемонстрировали то, что каждый имел α-спиральную структуру при 20°С.Данный результат был также подтвержден в измерениях при переменной температуре, где были определены температуры плавления (Tm) (Таблица 2). Для шести вариантов Z наблюдали обратимое сворачивание при измерении накладывающихся спектров до и после наревания до 90°С.
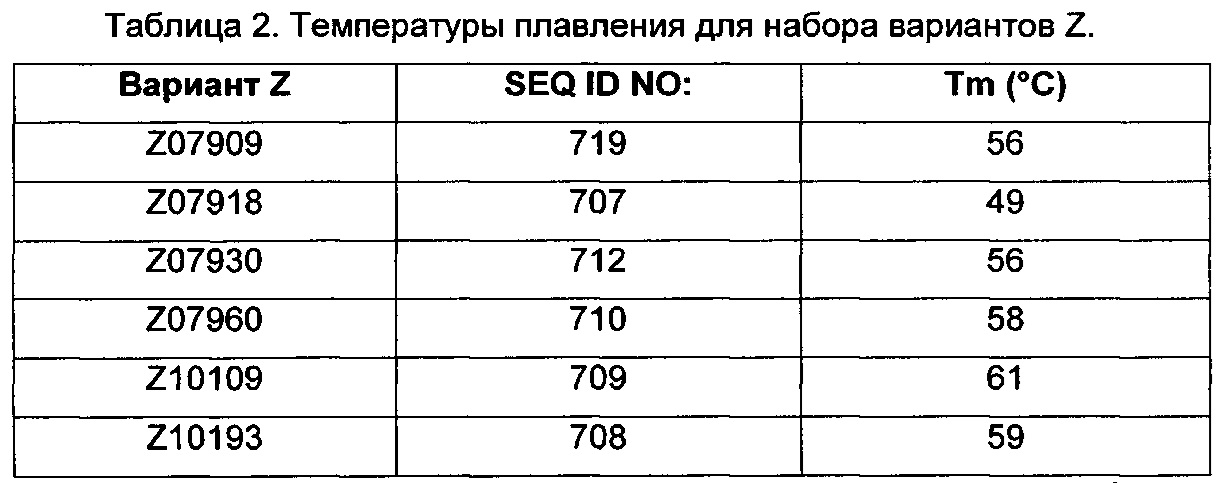
Анализы связывания и кинетики посредством Biacore. Связывание семнадцати вариантов Z с человеческим FcRn и диссоциацию при разных рН тестировали на приборе Biacore посредством последовательного инъецирования каждого варианта Z при рН 6,0 и либо буфера с рН 6,0, либо с рН 7,4 над поверхностью чипа, содержащей FcRn. Уровень иммобилизации лиганда поверхности составлял 1668 RU (резонансные единицы) человеческого FcRn. Семнадцать вариантов Z демонстрировали связывание с FcRn при рН 6,0, и для всех вариантов наблюдали более быстрые скорости диссоциации при рН 7,4 по сравнению с рН 6,0. Результат в отношении IgG был аналогичным, демонстрируя большую скорость диссоциации при рН 7,4. Варианты Z07918 и Z10193 демонстрировали кривые, характеризующие наименьшую скорость диссоциации. Сенсограммы для поднабора вариантов и IgG показаны на Фиг. 2 А-Д.

Определяли кинетическиеконстанты пяти вариантов Z, взаимодействующих с FcRn при рН 6,0 (см. Таблицу 3). Уровень иммобилизации поверхности составлял 2015 RU человеческого FcRn. Для каждого варианта Z рассчитывали кинетические константы с использованием набора кривых для трех инъецированных концентраций.
Константы аффинности (KD) также определяли для вариантов Z, меченных His6: Z07918 (SEQ ID NO: 707), Z07960 (SEQ ID NO: 710) и Z10193 (SEQ ID NO: 708), взаимодействующих с человеческим и мышиным FcRn при рН 6,0 и рН 7,4 (Таблица 4). Для всех трех вариантов значения KD были меньше при рН 6,0 по сравнению с рН 7,4.
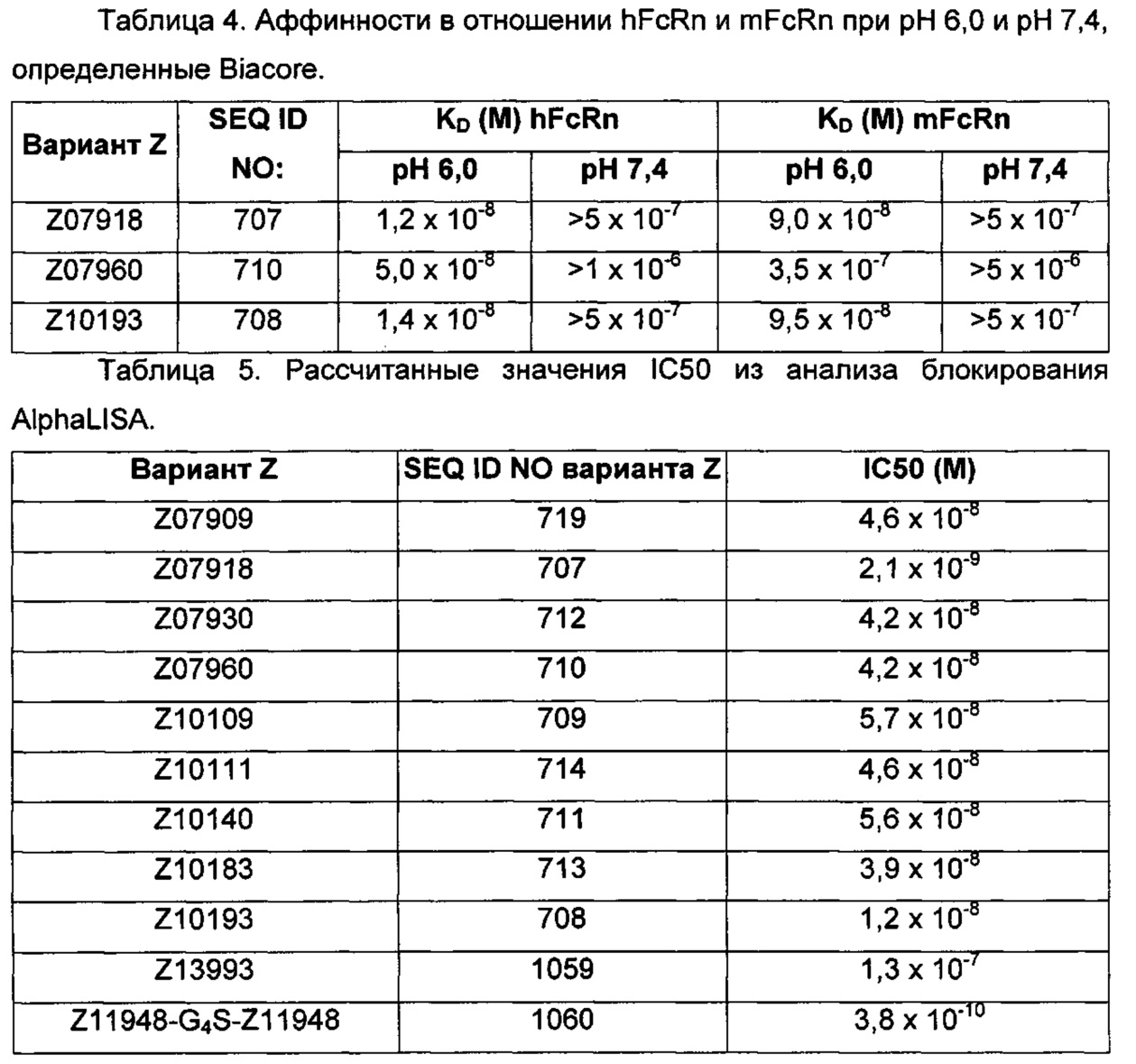
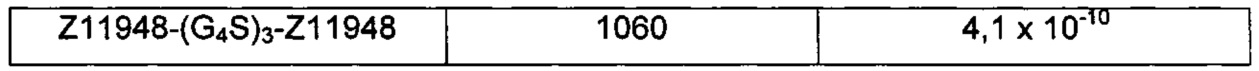
Анализ блокирования AlphaLISA. Способность семнадцати мономерных вариантов Z, меченных His6 (SEQ ID NO: 707-722 и SEQ ID NO: 1059), и двух димерных вариантов, Z11948-G4S-Z11948 и Z11948-(G4S)3-Z11948, ингибировать связывание IgG с FcRn тестировали в анализе блокирования AlphaLISA. Серийные разведения вариантов Z инкубировали с биотинилированым человеческим FcRn, и блокирующую способность каждого соответствующего варианта измеяли после добавления акцепторных шариков, покрытых IgG, и затем донорных шариков, покрытых стрептавидином. Ингибирование могло быть измерено как уменьшение баллов AlphaLISA для позитивных вариантов Z. Рассчитанные в данном анализе значения IC50 для десяти мономерных вариантов и двух димерных вариантов, для которых было показано, что они блокируют связывание IgG с FcRn, показаны в Таблице 5.
Пример 4
Связывание вариантов Z, связывающихся с FcRn. с клетками HeLa, трансфицированными человеческим или мышиным FcRn/eGFP
В данном примере исследовали способность к связыванию вариантов Z, связывающихся с FcRn. Описано получение клеток HeLa, экспрессирующих человеческий и мышиный ген FcRn-eGFP трансгена, и применение данных клеток для анализа проточной цитометрией с вариантами Z, меченными ALexa647.
Материалы и методы
Клонирование вирусных векторов FcRn-eGFP и В2М. Гены, кодирующие мышиный FcRn (mFcRn, Genbank ВС003786.1, OpenBiosystems) и мышиный В2М (mB2M, Genbank ВС085164.1, OpenBiosystems), амплифицировали аналогичным образом, что и гены человеческого FcRn и человеческого В2М, как описано в Примере 1. Гены человеческого и мышиного FcRn и В2М амплифицировали следующим образом: для hFcRn амплифицировали последовательность, кодирующую аминокислоты 1-365 (SEQ ID NO: 1068); для hB2M амплифицировали последовательность, кодирующую аминокислоты 21-119 (SEQ ID NO: 1066); для mFcRn амплифицировали последовательность, кодирующую аминокислоты 1-369 (SEQ ID NO: 1069); и для mB2M амплифицировали последовательность, кодирующую аминокислоты 21-119 (SEQ ID NO: 1067). Вектор pHR-cPPT-CMV-EGFP (Jakobsson et al. (2003) J Neurosci Res 73:876-85) и ампликоны ПЦР FcRn (человеческого и мышиного) вырезали с использованием рестрикционных ферментов BamHI (человеческий) или BclI (мышиный) и MluI (New England Biolabs, кат. №R0136M, R0160L и R0198L соответственно) и лигировали с использованием ДНК-лигазы Т4 (New England Biolabs, кат. №М0202М). Лигирующую смесь химически трансформировали в Е. coli PRIΔM15 и распределяли на чашках с ампициллином. Колонии собирали и подвергали скринингу с подходящими парами праймеров. Конструкцию, кодирующую исходный сигнальный пептид, человеческий или мышиный FcRn и eGFP на цитоплазматическом хвосте подтверждали секвенированием и обозначали pHR-cPPT-CMV-hFcRn-eGFP и pHR-cPPT-CMV-mFcRn-eGFP соответственно.
Ампликоны ПЦР человеческого и мышиного В2М вставляли в плазмиду pDONOR221 (Invitrogen, кат. №12536-017) посредством рекомбинации с использованием системы Gateway (Invitrogen, кат. №11789020, ферментативная смесь Gateway® BP Clonase® II) согласно рекомендациям изготовителей. После подтверждения правильных последовательностей человеческий или мышиный В2М вставляли в p2k7_gtc (Suter et at., выше) с использованием многосайтовой системы клонирования Gateway (Invitrogen, кат. №11791020, ферментативная смесь Gateway® LR Clonase® II) совместно с плазмидой pENTR-CMV, содержащей промотор (Tai et al. выше), что приводило к векторам 2k7neo-CMV-hB2M и 2k7neo-CMV-mB2M соответственно.
Лентивирусная трансдукция клеток HeLa. Пары векторов 2k7neo-CMV-hB2M и pHR-cPPT-CMV-hFcRn-eGFP или 2k7neo-CMV-mB2M и pHR-cPPT-CMV-mFcRn-eGFP совместно с упаковочной плазмидой для оболочки VSV-G и gag/pol сотрансфицировали в клетки HEK293T с использованием трансфекции с хлоридом кальция (Zufferey et al., выше; Jakobsson et al. (2006) выше). Супернатанты культуры HEK293T, содержащие сформированные лентивирусные частицы с трансгенами FcRn и В2М соответственно, использовали для последовательной трансдукции клеток аденокарциномы шейки матки HeLa (Cell Line Service) при малом числе пассажей. Образующиеся две стабильно трансдуцированные линии клеток HeLa далее обозначены hFcRn-eGFP (трансдуцированы генами человеческих FcRn-eGFP и hB2M) и mFcRn-eGFP (трансдуцированы генами мышиных FcRn-eGFP и mB2M).
Мечение вариантов Z, связывающихся с FcRn, посредством Alexa647. Три варианта Z, меченных His6 - Z07918, Z07930 и Z07960, метили сложным сукцинимидиловым эфиром карбоновой кислоты Alexa Fluor® 647 (Invitrogen, кат. №А20106). Перед мечением буфер заменяли на 0,2 М карбонатный буфер, рН 8,3, с использованием центрифужных фильтрующих элементов Vivaspin500 (MWCO (порог отсечения молекулярной массы) 10 кДа, Vivaproducts, кат. №512-2838), центрифугируя при 10000 д. Мечение проводили в Vivaspin500, и добавляли 1 мкл красителя - сложного сукцинимидилового эфира Alexa647 (40 мкг/мл в DMSO, что соответствует 1,3-кратному молярному избытку) к 200 мкг/25 мкл варианта Z. Смеси инкубировали при RT в темноте в течение 40 минут в покачивающем ротационном смесителе. Реакционные смеси затем помещали на лед на 3,5 часа, и свободный краситель удаляли промывкой с использованием 15×100 мкл PBS в Vivaspin500.
Иммунофлуоресцентное окрашивание клеток HeLa, трансфицированных человеческим и мышиным FcRn-eGFP, с использованием вариантов Z, связывающихся с FcRn. Клетки HeLa с hFcRn-eGFP и mFcRn-eGFP собирали посредством трипсинизации и дважды промывали в PBS при рН 6,0 до подсчета. Переносили пипеткой 100000 клеток на лунку 96-луночного планшета с v-образной формой дна лунок (Nunc, кат. №277143), и клетки в планшете затем осаждали при 1700 об./мин в течение 4 мин при 4°С. Супернатанты удаляли, и клетки фиксировали 50 мкл 2% формальдегида (Sigma Aldrich, кат. №F8775) в PBS при рН 6,0 в течение 10 мин при RT. Клетки затем промывали 2×100 мкл PBS, рН 6,0, насыщенным казеином (PBSC), и ресуспендировали в PBSC плюс 0,1% сапонин (AppliChem, кат. №А4518.0100), содержащем 620 нМ меченные Alexa647 варианты Z, меченные His6 - Z07960, Z07930 и Z07918. Трансдуцированные клетки HeLa, инкубированные с одним буфером, использовали в качестве контроля. Клетки инкубировали в течение 1 ч при 8°С на шейкере в темноте, промывали 2×100 мкл PBSC и ресуспендировали в 180 мкл PBS, рН 6,0, плюс 1% BSA (фракция V, Merck, кат. №1.12018.0100). 10000 клеток/лунку анализировали в проточном цитометре Gallios (Beckman Coulter), и данные анализировали с использованием программы Kaluza (Beckman Coulter).
Результаты
Анализ проточной цитометрией использовали для определения того, могли ли варианты Z, связывающиеся с FcRn, связываться с человеческим и/или мышиным FcRn на клетках HeLa, трансдуцированных человеческим или мышиным FcRn/eGFP. Эксперимент проводили при рН 6,0 с использованием меченных Alexa647 Z07960, Z07930 и Z07918 (SEQ ID NO: 710, 712 и 707 соответственно). Анализ посредством точечной диаграммы (ордината: Alexa647, абсцисса: eGFP) показал то, что популяция трансдуцированных клеток могла быть разделена на популяцию, негативную и позитивную в отношении FcRn-eGFP (Фиг. 3, области Н и I соответственно), указывая на гетерогенную экспрессию слитого белка FcRn-eGFP клетками HeLa (Фиг. 3). Соответственно, из средних значений интенсивности флуоресценции (MFI) для Alexa647 в области I вычитали фоновые значения MFI Alexa647 в области Н. Рассчитанные значения MFI представлены на Фиг. 4. Результаты показывают то, что Z07960, Z07930 и Z07918 способны к связыванию с клетками HeLa, осуществляющими дисплей человеческого (Фиг. 4А) или мышиного (Фиг. 4Б) FcRn-eGFP.
Пример 5
Блокирование связывания IgG с FcRn с использованием варианта Z, связывающегося с FcRn - Z07918
В данном примере в анализе на основе клеток исследовали потенциальную конкуренцию вариантов Z, связывающихся с FcRn, с IgG за связывание с FcRn. Такое связывание будет приводить к блокированию взаимодействия IgG-FcRn.
Материалы и методы
Блокирование иммунофлуоресцентного окрашивания IgG-FcRn. Клетки HeLa, трансдуцированные человеческим или мышиным FcRn-eGFP, получали, как описано в Примере 4. Фиксированные клетки ресуспендировали в 50 мкл смеси одного из: 100 нМ конъюгированного с Alexa647 человеческого или мышиного IgG (Jackson laboratories, кат. №009-600-003 и 015-600-003 соответственно) и 1000, 100, 10, 1 или 0 (контроль в виде буфера) нМ Z07918, меченного His6, разведенного в PBS-казеине, рН 6,0, плюс 0,1% сапонин (AppliChem). Клетки инкубировали в течение 1 ч при 37°С на шейкере в темноте, промывали 2×100 мкл PBS-казеином, рН 6,0, и ресуспендировали в 180 мкл PBS, рН 6,0, плюс 1% BSA. Данные от 10000 клеток/лунку (за исключением в некоторой степени меньшего числа клеток для мышиного 100 нМ mlgG-Alexa647) получали с использованием проточного цитометра Gallios (Beckman Coulter), и данные анализировали с использованием программы Kaluza (Beckman Coulter).
Результаты
Эксперимент проводили для определения того, блокирует ли вариант Z, связывающийся с FcRn - Z07918 (SEQ ID NO: 707), взаимодействие IgG-FcRn. Клетки HeLa, трансдуцированные человеческим или мышиным FcRn-eGFP, инкубировали с человеческим или мышиным IgG, конъюгированным с Alexa647. Связывание блокировали немеченым Z07918 в разных концентрациях. Из-за гетерогенной экспрессии FcRn трансдуцированными клетками HeLa (описанной в Примере 4) из значений MFI Alexa647 каждого образца в области N вычитали соответствующие значения MFI в области М (Фиг. 5). Процент связывания IgG-Alexa647 рассчитывали путем деления разных значений MFI с использованием MFI для пустого контроля. Результаты показали, что Z07918 эффективно блокировал связывание hlgG с hFcRn (Фиг. 6А) дозозависимым образом. Кроме того, Z07918 также блокировал связывание mlgG с mFcRn (Фиг. 6Б), хотя и менее эффективно, по сравнению со связыванием с hlgG.
Пример 6
Фармакокинетическое исследование трех вариантов Z. связывающихся с FcRn
В данном примере исследовали способность вариантов Z, связывающихся с FcRn, продлевать период полувыведения в сыворотке неспецифичного варианта Z посредством фармакокинетического исследования, проведенного у мышей.
Материалы и методы
Субклонирование вариантов Z. Поднабор вариантов Z (Z07918, Z07960 и Z10193) подвергали второму субклонированию. ДНК из субклонированных меченных His6 вариантов в Примере 3 использовали в качестве матрицы. Во-первых, проводили ПЦР-амплификацию с использованием подходящих пар праймеров для создания генов, кодирующих варианты Z, начинающиеся с аминокислот АЕ вместо VD. Мутантные варианты Z перечислены на Фиг. 1 и были обозначены Z11948 (SEQ ID NO: 1060), Z11946 (SEQ ID NO: 1061) и Z11947 (SEQ ID NO: 1062), соответствующие мутантным Z07918, Z07960 и Z10193 соответственно. Гены, кодирующие новые варианты Z, рестрикционно расщепляли и лигировали в вектор, несущий гены, кодирующие альбуминсвязывающий вариант - РР013 (SEQ ID NO: 1063) и Z03638 (SEQ ID NO: 1064) со спейсерными последовательностями, что приводит к слиянию генов, кодирующему [Z#####]-GAP(G4S)4TS-[PP013]-GT(G4S)4PR-[Z03638] (также обозначенному «Z#####-PP013-Z03638» или «вариант Z в слиянии с PP013-Z03638»). Молекулу негативного контроля [Z03638]-GAP(G4S)4TS-[РР013] субклонировали аналогичным образом путем лигирования Z03638 в вектор, содержащий линкер (G4S)4 и последовательность РР013. Последующие стадии для трансформации вектора в Е. coli проводили так же, как и в Примере 3.
Культивирование и очистка. Варианты Z в слиянии с PP013-Z03638 продуцировали в Е. coli, как описано в Примере 3. Приблизительно 3 г каждого клеточного пеллета ресуспендировали в 30 мл TST-буфера (25 мМ Tris-HCl, 1 мМ EDTA, 200 мМ NaCl, 0,05% Tween20, рН 8,0), дополненного Benzonase® (Merck). После разрушения клеток обработкой ультразвуком и осветления центрифугированием каждый супернатант наносили на колонку с током, обусловленным силой тяжести, с 5 мл агарозы с иммобилизованным лигандом против ABD (полученным самостоятельно). После промывки TST-буфером и 5 мМ буфером NH4Ac, рН 5,5, варианты Z элюировали 0,1 М НАс. K элюированным фракциям со стадии очистки аффинной хроматографией на агарозе с лигандом против ABD добавляли ацетонитрил (ACN) до конечной концентрации 10%, и образцы загружали на 3 мл колонку Resource 15RPC (GE Healthcare), ранее уравновешенную растворителем А для RPC (хроматография с обращенной фазой) (0,1% трифторуксусная кислота (TFA), 10% ACN, 90% воды). После промывки колонки растворителем А для RPC связавшийся белок элюировали линейным градиентом 0-50% растворителя Б для RPC (0,1% TFA, 80% ACN, 20% воды) в объеме 60 мл. Фракции, содержащие чистый вариант Z, идентифицировали посредством анализа SDS-PAGE и объединяли. После очистки RPC буфер объединенных фракций заменяли на PBS с использованием обессоливающей колонки HiPrep 26/10 (GE Healthcare). Наконец, варианты Z очищали на 1 мл колонках EndoTrap red (Hyglos, кат. №321063) для обеспечения низкого содержания эндотоксина.
Концентрации белка, чистоту и идентичность каждого очищенного варианта Z анализировали, как описано в Примере 3.
Анализ Biacore. Экспрессированные и очищенные варианты Z, слитые с PP013-Z03638, анализировали против человеческого FcRn, рН 6,0, по существу, как описано для кинетического анализа в Примере 3. Варианты Z и негативный контроль Z03638-PP013 инъецировали в концентрации 40 нМ, 160 нМ и 640 нМ на протяжении 1 минуты, с последующей диссоциацией в течение 2,5 минут и уравновешиванием в течение 1 минуты. Кинетические константы и аффинности определяли для вариантов Z с использованием программы BiaEvaluation.
Фармакокинетическое исследование. Z11947. Z11946 и Z11948, слитые с PP013-Z03638, внутривенно (в.в.) вводили самцам мышей NMRI (Charles River, Германия) в дозе 92 нмоль/кг массы тела. Сыворотку от групп из трех мышей получали в 0,08, 6, 18, 78, 120, 168 и 240 часов. Концентрацию соответствующего варианта Z определяли ELISA.
ELISA. Половину площади 96-луночных планшетов для ELISA покрывали 50 мкл/лунку антитела козы, специфичного в отношении Z (самостоятельно продуцированного), разведенного до 4 мкг/мл в буфере для покрытия (50 мМ карбонат натрия, рН 9,6), при 4°С в течение ночи. Раствор антитела сливали, и лунки блокировали 100 мкл PBSC в течение 1,5 ч при RT. Сыворотки разводили в PBSC плюс 1% мышиной сыворотки (матрикс) от 1:100 до 1:51200 в серии двухкратного разведения на планшете для разведения. На каждом планшете включали стандартное титрование в отношении соответствующего варианта Z и четыре контроля качества (контроль в очень низкой, низкой, средней и высокой концентрации), разведенные в матриксе. Переносили 50 мкл разведений на лунку, и планшеты для ELISA инкубировали в течение 1,5 ч при RT. Планшеты четыре раза промывали PBST. Связавшиеся варианты Z выявляли с использованием 50 мкл/лунку кроличьего lg против РР013 (самостоятельно продуцированного), разведенного до 4 мкг/мл в PBSC. Планшеты затем инкубировали в течение 1,5 ч при RT, с последующими промывками, как описано выше. Добавляли конъюгированное с HRP антитело осла против кроличьего антитела, приобретенное у Jackson laboratories (кат. №711-035-152), разведенное 1:20000 в PBSC, и планшеты инкубировали в течение 1 часа. После промывки, как описано выше, добавляли в планшеты 50 мкл субстрата ТМВ ImmunoPure, и планшеты проявляли согласно рекомендациям изготовителя. После 15 минут проявления измеряли поглощение при 450 нм с использованием многолуночного планшет-ридера (Victor3). Значения поглощения анализировали с использованием GraphPad Prism 5 для определения концентраций (аппроксимация кривой посредством кубического сплайна) и площади под кривой (AUC). Затем концентрации откладывали на графике в виде их натуральных логарифмов относительно времени. Полученные кривые следовали двухкомпартментной модели, и рассчитывали терминальный период полувыведения как In2, разделенный на наклон, на основе последних трех моментов времени.
Результаты
Культивирование и очистка: В Е. coli продуцировали три варианта Z, связывающихся с FcRn - Z11947, Z11946 и Z11948 (SEQ ID NO: 1062, 1061 и 1060), сконструированных в виде Z#####-PP013-Z03638, и негативный контроль Z03638-PP013. Количество очищенного белка из приблизительно 3 г бактериальных осадков, определенное спектрофотометрически посредством измерения поглощения при 280 нм, варьировало от приблизительно от 10 до 25 мг для разных вариантов Z, связывающихся с FcRn. Анализ SDS-PAGE каждого конечного препарата белка продемонстрировал то, что они преимущественно содержали соответствующий вариант Z, связывающийся с FcRn. Правильная молекулярная масса каждого варианта Z, связывающегося с FcRn, была подтверждена анализом ЖХ/МС.
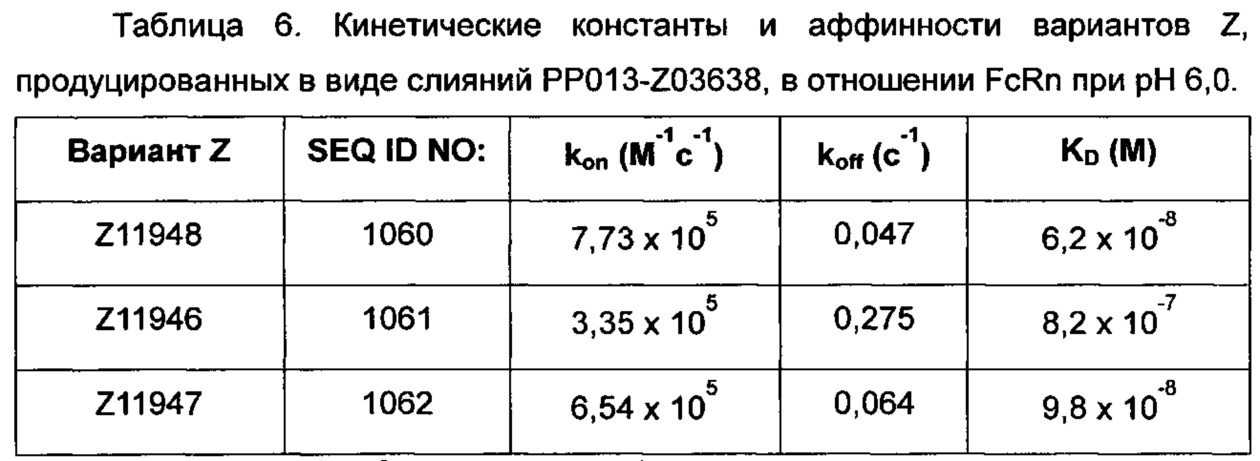
Анализ Biacore. Связывание с FcRn анализировали для трех вариантов Z, слитых PP013-Z03638. Уровень иммобилизации поверхности составлял 548 RU человеческого FcRn. Полученные грубые кинетические константы и аффинности в отношении связывания с мишенью при рН 6,0 продемонстрированы в Таблице 6. Аппроксимированные кривые показаны на Фиг. 7А-В. Негативный контроль Z03638-PP013 был негативным против FcRn.
Фармакокинетическое исследование. Фармакокинетические профили вышеупомянутых конструкций вариантов Z, слитых с PP013-Z03638, сравнивали с негативным контролем - Z03638-PP013 в мышином фармакокинетическом исследовании. В предыдущей работе, например, как описано в заявке РСТ WO 2009/016043, показано, что слитые белки с ABD имеют длительный период полувыведения в сыворотке, вызванный связыванием ABD с сывороточным альбумином. В соответствии с предыдущими результатами, терминальный период полувыведения молекулы варианта Z, слитого с ABD (Z03638-PP013), составлял приблизительно 43 часа, что сравнимо с периодом полувыведения мышиного альбумина (35 часов). Терминальные периоды полувыведения конструкций, содержащих, помимо ABD, молекулу варианта Z, связывающегося с FcRn, были в два-три раза дольше (Фиг. 8). Рассчитанные терминальные периоды полувыведения составляли 99 часов (Z11947), 69 часов (Z11946) и 58 часов (Z11948), свидетельствуя о том, что связывание вариантов Z с FcRn способствовало прологированному периоду полувыведения.
Пример 7
Планирование и конструирование библиотеки созревания вариантов Z, связывающихся с FcRn
В данном примере была сконструирована созревшая библиотека. Данную библиотеку использовали для селекции вариантов Z, связывающихся с FcRn. Обычно ожидается, что селекция из созревших библиотек приводит к связывающим агентам с повышенной аффинностью (Orlova et al., (2006) Cancer Res 66(8):4339-48). В данном исследовании получали рандомизированные одноцепочечные линкеры с использованием синтеза с расщепленным пулом, обеспечивающего включение в синтезе определенных кодонов в желательных положениях.
Материалы и методы
Планирование библиотеки. Библиотека была основана на шестнадцати последовательностях вариантов Z, связывающихся с человеческим FcRn, в Таблице 1 и дополнительно описанных в Примерах 2-6. В новой библиотеке 13 вариабельных положений в каркасе молекулы Z изменяли в направлении определенных аминокислотных остатков согласно стратегии, основанной, главным образом, на мотивах связывания вариантов Z, определенных в SEQ ID NO: 707-722. ДНК-линкер, полученный с использованием синтеза с расщепленным пулом, содержащий 147 п. о. (пар оснований) частично рандомизированной спирали 1 и 2 аминокислотной последовательности: 5'-АА ATA ААТ СТС GAG GTA GAT GCC AAA TAC GCC AAA GAA NNN NNN NNN GCG NNN NNN GAG АТС NNN NNN TTA CCT AAC TTA ACC NNN NNN CAA NNN NNN GCC TTC АТС NNN AAA TTA NNN GAT GAC CCA AGC CAG AGC TCA TTA TTT A-3' (SEQ ID NO: 1074; рандомизированные кодоны проиллюстрированы в виде NNN), фланкированный рестрикционными сайтами XhoI и SacI, заказывали у DNA 2.0 (Menlo Park, СА, США). Теоретические распределения аминокислотных остатков в новой библиотеке, включая восемь положений вариабельных аминокислот (9, 10, 11, 13, 14, 24, 32 и 35) и пять положений константных аминокислот (17, 18, 25, 27 и 28) в каркасе молекулы Z, приведены в Таблице 8. Полученный в результате теоретический размер библиотеки составляет 5,3×108 вариантов.
Конструирование библиотеки. Библиотеку амплифицировали с использованием полимеразы AmpliTag Gold (Applied Biosystems, кат. №4311816) на протяжении 12 циклов ПЦР, и объединенные продукты очищали с использованием набора для очистки ПЦР-продуктов QIAquick (QIAGEN, кат. №28106) согласно рекомендациям поставщика. Очищенный пул фрагментов рандомизированной библиотеки расщепляли рестрикционными ферментами XnoI и SacI-HF (New England Biolabs, кат. №R0146L и кат. №R3156M) и концентрировали с использованием набора для очистки ПЦР-продуктов. Затем продукт подвергали препаративному гель-электрофорезу на 2,5%-ной агарозе (агароза Nuisieve GTC, Cambrex, Invitrogen) и очищали с использованием набора для экстракции геля QIAGEN (QIAGEN, кат. №28706) согласно рекомендациям поставщика.
Фагмидный вектор pAY02592 (по существу такой же, что и pAffi1, описанный в  et al., выше) подвергали рестрикции такими же ферментами, очищали с использованием экстракции фенолом/хлороформом и осаждения этанолом. Полученные в результате рестрикции фрагменты и рестрицированный вектор лигировали в молярном соотношении 5:1 с использованием ДНК-лигазы Т4 (Fermentas, кат. №EL0011) в течение 2 часов при RT, с последующей инкубацией в течение ночи при 4°С. Лигированную ДНК выделяли экстракцией фенолом/хлороформом и осаждением этанолом, с последующим растворением в 10 мМ Tris-HCl, рН 8,5. Таким образом, полученная в результате библиотека в векторе pAY02592 кодировала варианты Z, причем каждый был слит с альбуминсвязывающим доменом (ABD), происходящим из стрептококкового белка G.
et al., выше) подвергали рестрикции такими же ферментами, очищали с использованием экстракции фенолом/хлороформом и осаждения этанолом. Полученные в результате рестрикции фрагменты и рестрицированный вектор лигировали в молярном соотношении 5:1 с использованием ДНК-лигазы Т4 (Fermentas, кат. №EL0011) в течение 2 часов при RT, с последующей инкубацией в течение ночи при 4°С. Лигированную ДНК выделяли экстракцией фенолом/хлороформом и осаждением этанолом, с последующим растворением в 10 мМ Tris-HCl, рН 8,5. Таким образом, полученная в результате библиотека в векторе pAY02592 кодировала варианты Z, причем каждый был слит с альбуминсвязывающим доменом (ABD), происходящим из стрептококкового белка G.
Продукты реакции лигирования (приблизительно 160 нг ДНК/трансформацию) электропорировали в электрокомпетентные клетки Е. coli ER2738 (50 мкл, Lucigen, Middleton, WI, США). Сразу после электропорации добавляли приблизительно 1 мл среды для выделения (поставляется с клетками ER2738). Трансформированные клетки инкубировали при 37°С в течение 60 мин. Образцы отбирали для титрования и для определения числа трансформантов. Клетки затем объединяли и культивировали в течение ночи при 37°С в 1 л среды TSB-YE, дополненной 2% глюкозы, 10 мкг/мл тетрациклина и 100 мкг/мл ампициллина. Клетки осаждали в течение 7 мин при 4000 g и ресуспендировали в растворе PBS/глицерина (приблизительно 40% глицерина). Клетки аликвотировали и хранили при -80°С. Клоны из библиотеки вариантов Z секвенировали для того, чтобы подтвердить содержание и для оценки результата от сконструированной библиотеки относительно проекта библиотеки. Секвенирование провели, как описано в Примере 1, и подтвердили распределение аминокислот.
Получение маточного раствора Фага. Маточный раствор фага, содержащий фагмидную библиотеку, получали в 20 л ферментере (Belach Bioteknik). Клетки из глицеринового маточного раствора, содержащего фагмидную библиотеку, инокулировали в 10 л TSB-YE (триптический соевый бульон-дрожжевой экстракт; 30 г/л TSB, 5 г/л дрожжевого экстракта), дополненного 1 г/л глюкозы, 100 мг/л ампициллина и 10 мг/л тетрациклина. При достижении клетками оптической плотности 600 нм (ОП600) 0,6, приблизительно 1,5 л культуры инфицировали с использованием 5-кратного молярного избытка хелперного фага M13K07. Клетки инкубировали в течение 30 мин, после чего ферментер заполняли вплоть до 10 л комплексной ферментационной среды [2,5 г/л (NH4)2SO4; 5,0 г/л дрожжевой экстракт; 30 г/л триптон, 2 г/л K2HPO4; 3 г/л KH2PO4, 1,25 г/л Na3C6H5O7⋅2 H2O; пеногаситель Breox FMT30 - 0,1 мл/л]. Добавляли следующие компоненты: 10 мл карбенициллина, 25 мг/мл; 5 мл канамицина, 50 мг/мл; 1 мл 1 М изопропил-β-D-1-тиогалактопиранозида (IPTG); 17,5 мл/л 300 г/л MgSO4 и 5 мл раствора следовых элементов [35 г/л FeCl3⋅6 H20O 10,56 г/л ZnSO4⋅7 H2O; 2,64 г/л CuSO4⋅5 H2O; 13,2 г/л MnSO4⋅H2O; 13,84 г/л CaCl2⋅2 H2O, растворенных в 1,2 М HCl]. Начинали лимитируемое глюкозой периодическое культивирование, где в реактор подавали 600 г/л раствора глюкозы (3,5 г/ч в начале, 37,5 г/ч через 20 ч и до конца культивирования). Контролировали рН на уровне рН 7 через автоматическое добавление 25% NH4OH, подавали воздух (5 л/мин), и скорость мешалки была установлена на уровне 500 об./мин. После 24 ч периодического культивирования ОП600 составляла 33,2. Клетки в культуре осаждали центрифугированием при 15900 g. Частицы фага осаждали из супернатанта дважды в PEG/NaCl, фильтровали и растворяли в PBS и глицерине так же, как и в Примере 2. Маточные растворы фага хранили при -80°С до применения в селекции.
Результаты
Конструирование библиотеки. Новую библиотеку планировали на основе набора 16 вариантов Z, связывающихся с FcRn, с подтвержденными свойствами связывания (Пример 2-6). Теоретический размер сконструированной библиотеки составлял 5,3×108 вариантов Z. Реальный размер библиотеки, определенный посредством титрования после трансформации клеток ER2738 Е. coli, составлял 4,5×109 трансформантов.
Качество библиотеки тестировали секвенированием 96 трансформантов и сравнением их реальных последовательностей с теоретическим планом. Было показано, что содержание реальной библиотеки по сравнению с запланированной библиотекой является удовлетворительным. Таким образом, успешно сконструировали созревшую библиотеку потенциальных агентов, связывающихся с FcRn.
Пример 8
Селекция и скрининг вариантов Z из созревшей библиотеки
Материалы и методы
Селекция посредством фагового дисплея созревших вариантов Z, связывающихся с FcRn. Белки-мишени - человеческий FcRn (Biorbyt, кат. №orb84388) и мышиный FcRn (Biorbyt, кат. №orb99076) биотинилировали, по существу как описано в Примере 2, с использованием биотина в 10-кратном молярном избытке. Селекции посредством фагового дисплея с использованием новой библиотеки молекул вариантов Z, описанных в Примере 7, проводили в четырех циклах против человеческого FcRn или мышиного FcRn, по существу так же, как и в Примере 2, но со следующими исключениями. Буферами для селекции были 0,1% буфер PCTG, рН 5,5 (фосфатно-цитратный буфер Мак-Илвейна, рН 5,5, дополненный 0,1% Tween-20 и 0,1% желатином) или 0,1% буфер PCTG, рН 7,4 (фосфатно-цитратный буфер Мак-Илвейна, рН 7,4, дополненный 0,1% Tween-20 и 0,1% желатином) соответственно. Перед селекцией в буферы для селекции добавляли HSA до конечной концентрации 1,5 мкМ. Все пробирки и шарики, используемые в селекции, предварительно блокировали с использованием одного из двух разных буферов для селекции. Стадию предселекции посредством инкубации маточного раствора фага с SA-шариками в течение 45 мин проводили в цикле 1. Для захвата комплексов фаг-мишень использовали 1 мг шариков на 1,1 мкг биотинилированного человеческого FcRn или 1,6 мкг биотинилированного мышиного FcRn. Промывки осуществляли 0,1%-ным буфером РСТ, рН 5,5 или рН 7,4, за исключением групп 2-1-2-1 и 2-1-2-2, где использовали 0,1% РСТ, дополненный 25 нМ IgG (Herceptin®) или 10 нМ IgG соответственно, как описано в Таблице 7.
Пять групп (1-5) в цикле 1 разделяли во втором-четвертом циклах, что приводило всего к семи группам (от 1-1 до 5-1) в цикле 2, одиннадцати группам (от 1-1-1 до 5-1-1) в цикле 3 и четырнадцати группам (от 1-1-1-1 до 5-1-1-1) в цикле 4. Связавшиеся частицы фага элюировали, как описано в Примере 2.
Обзор стратегии селекции, описывающий повышенную жесткость в последующих циклах с использованием пониженной концентрации мишени и увеличенного числа промывок, показан в Таблице 8.
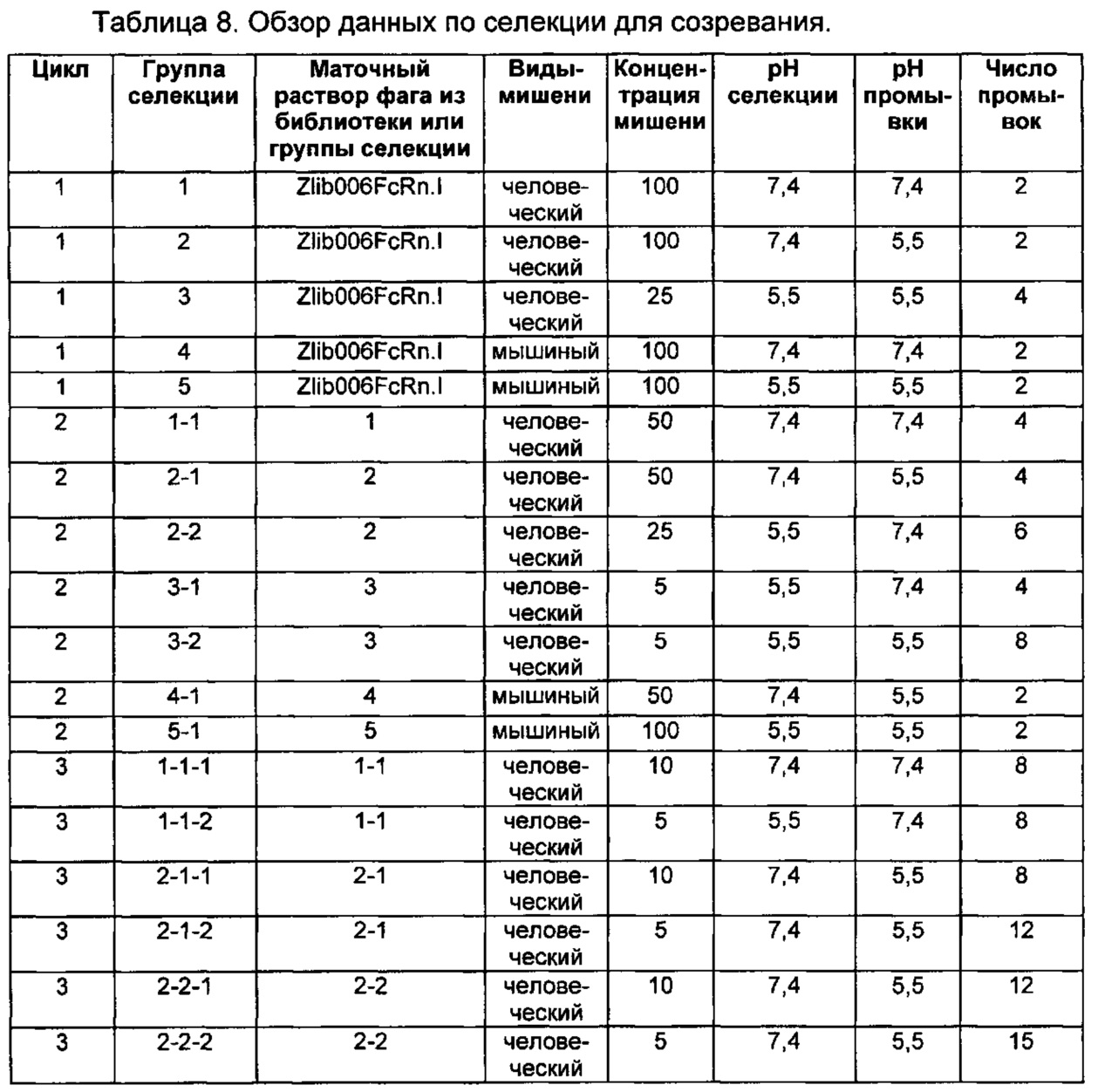
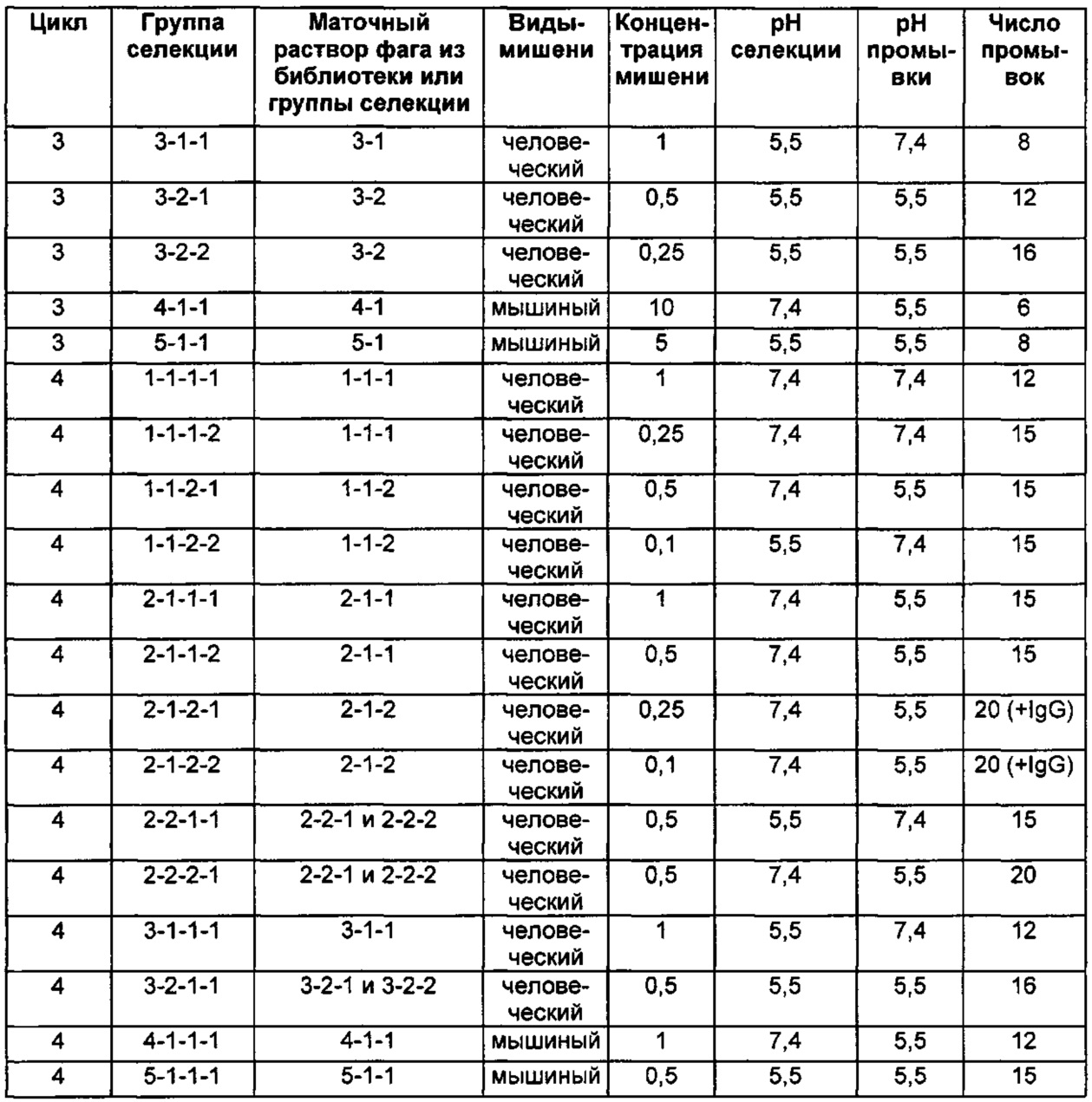
Амплификация Фаговых частиц. Амплификацию фаговых частиц между циклом 1 и 2 селекции проводили по существу, как описано в Примере 2, со следующими исключениями. Для амплификации фага использовали Е. coli ER2738, и хелперный фаг M13K07 использовали в 5-кратном избытке. Амплификацию фаговых частиц между циклами 2 и 4 селекции осуществляли путем проведения инфекции бактерий в растворе следующим образом. После инфекции Е. coli ER2738 в log фазе фаговыми частицами добавляли TSB, дополненный 2% глюкозы, 10 мкг/мл тетрациклина и 100 мкг/мл ампициллина, с последующей инкубацией с вращением в течение 30 мин при 37°С. Затем бактерии инфицировали хелперным фагом M13K07 в 5-кратном избытке. Инфицированных бактерий осаждали центрифугированием, ресуспендировали в среде TSB-YE, дополненной 100 мкМ IPTG, 25 мкг/мл канамицина и 100 мкг/мл ампициллина, и выращивали в течение ночи при 30°С. Выращенные в течение ночи культуры осаждали в центрифуге, и фаговые частицы в супернатанте дважды осаждали буфером на основе PEG/NaCl. Наконец, фаговые частицы ресуспендировали в буфере для селекции перед поступлением в следующий цикл селекции.
В конечном цикле селекции бактерии в log фазе инфицировали элюатом и разводили перед распределением на чашки с ТВАВ (30 г/л основы в виде триптозного кровяного агара, Oxoid, кат. №CMO233 В), дополненной 0,2 г/л ампициллина, для того чтобы образовать одиночные колонии, подлежащие применению в скрининге посредством ELISA.
Секвенирование потенциальных связывающих агентов. Индивидуальные клоны из разных групп селекции отбирали для секвенирования. Все клоны, прошедшие через скрининг посредством ELISA, секвенировали. Амплификацию фрагментов генов и анализ последовательности фрагментов генов осуществляли по существу, как описано в Примере 2.
Скрининг вариантов Z посредством ELISA. Одиночные колонии, содержащие варианты Z (экспрессируемые в виде слитых белков варианта Z с ABD, как описано в Примере 2), случайным образом отбирали из отобранных клонов созревшей библиотеки FcRn и выращенных в 1 мл культур по существу, как описано в Примере 2. Получение периплазматических супернатантов проводили, как описано в Примере 2, с использованием восьми циклов замораживания-оттаивания, и периплазматические фракции использовали при скрининге ELISA неразведенными. Скрининги ELISA проводили и при рН 6,0, и при рН 7,4 по существу, как описано в Примере 2, с использованием биотинилированного человеческого FcRn в концентрации 2 нМ в каждой лунке. Периплазматическую фракцию первичного агента, связывающегося с FcRn - Z10193 (SEQ ID NO: 708, проанализированного в приведенных выше экспериментах), использовали в качестве позитивного контроля. Периплазму, содержащую только группировку ABD, использовали в качестве негативного контроля.
Анализ KD вариантов Z, связывающихся с FcRn, посредством ELISA. Набор агентов, связывающихся с FcRn, подвергали анализу ответа против серии разведения биотинилированного человеческого FcRn с использованием ELISA и при рН 6,0, и при рН 7,4, как описано выше. Биотинилированный человеческий FcRn добавляли в концентрации 30 нМ и ступенчато разводили 1:3 до 14 пМ. В качестве контроля фона все варианты Z также анализировали без добавления белка-мишени. Периплазматические образцы, содержащие первичный агент, связывающийся с FcRn - Z07918 (SEQ ID NO: 707), включали и анализировали в качестве позитивного контроля. Периплазму, содержащую только группировку ABD, использовали в качестве негативного контроля. Данные анализировали с использованием GraphPad Prism 5 и нелинейной регрессии, и рассчитывали значения KD (полумаксимальная эффективная концентрация).
Результаты
Селекция посредством фагового дисплея созревших вариантов Z, связывающихся с FcRn.
Селекцию проводили всего в 14 паралелльных группах, каждая из которых содержала четыре цикла. Разные группы селекции отличались по концентрации мишени, типу мишени (человеческий FcRn или мышиный FcRn), времени селекции и условиям промывок.
Секвенирование потенциальных связывающих агентов. Секвенировали случайным образом отобранные клоны. Каждому индивидуальному варианту Z давали идентификационный номер, Z#####, как описано в Примере 2. Всего идентифицировали 445 новых уникальных молекул вариантов Z.
Аминокислотные последовательности из 58 аминокислотных остатков в длину вариантов Z перечислены на Фиг. 1 и в перечне последовательностей в виде SEQ ID NO: 723-1058. Выведенные мотивы связывания с FcRn данных вариантов Z перечислены на Фиг. 1 и в перечне последовательностей в виде SEQ ID NO: 17-352. Аминокислотные последовательности полипептидов из 49 аминокислотных остатков в длину, для которых предсказано, что они составляют полный пучок трех спиралей в пределах каждого из данных вариантов Z, перечислены на Фиг. 1 и в перечне последовательностей в виде SEQ ID NO: 370-705.
Скрининг вариантов Z посредством ELISA. Клоны, полученные после четырех циклов селекции, продуцировали в 96-луночных планшетах и подвергали скринингу в отношении активности связывания с FcRn с использованием ELISA. Анализировали все случайным образом отобранные клоны. Обнаружили, что при рН 6,0 333 из 445 уникальных вариантов Z дают ответ 0,3 AU (единица абсорбции) или выше (соответствующий по меньшей мере 3х негативного контроля) против человеческого FcRn в концентрации 2 нМ. Обнаружили, что при рН 7,4 278 из 445 уникальных вариантов Z дают ответ 0,3 AU или выше (соответствующий по меньшей мере 3-кратному относительно негативного контроля) против человеческого FcRn в концентрации 2 нМ. Клоны с позитивным сигналом против человеческого FcRn были обнаружены во всех группах (включая группы с мышиной мишенью), за исключением 1-1-1-1. Негативные контроли имели поглощения 0,070-0,096 AU (рН 6,0) и 0,060-0,112 AU (рН 7,4) соответственно. Средний ответ пустых контролей составлял 0,070 AU (рН 6,0) и 0,062 (рН 7,4).
Анализ KD вариантов Z, связывающихся с FcRn, посредством ELISA. Отбирали поднабор вариантов Z на основе результата описанного выше эксперимента ELISA (наивысшее значение ELISA при рН 6,0 и/или рН 7,4) и подвергали титрованию с мишенью в формате ELISA. Образцы периплазмы инкубировали с серийным разведением биотинилированного человеческого FcRn. Образец периплазмы с первичным связывающим агентом - Z07918 (SEQ ID NO: 707) также анализировали в качестве позитивного контроля. Проанализировали полученные значения, и рассчитали их соответствующие значения KD (Таблица 9).
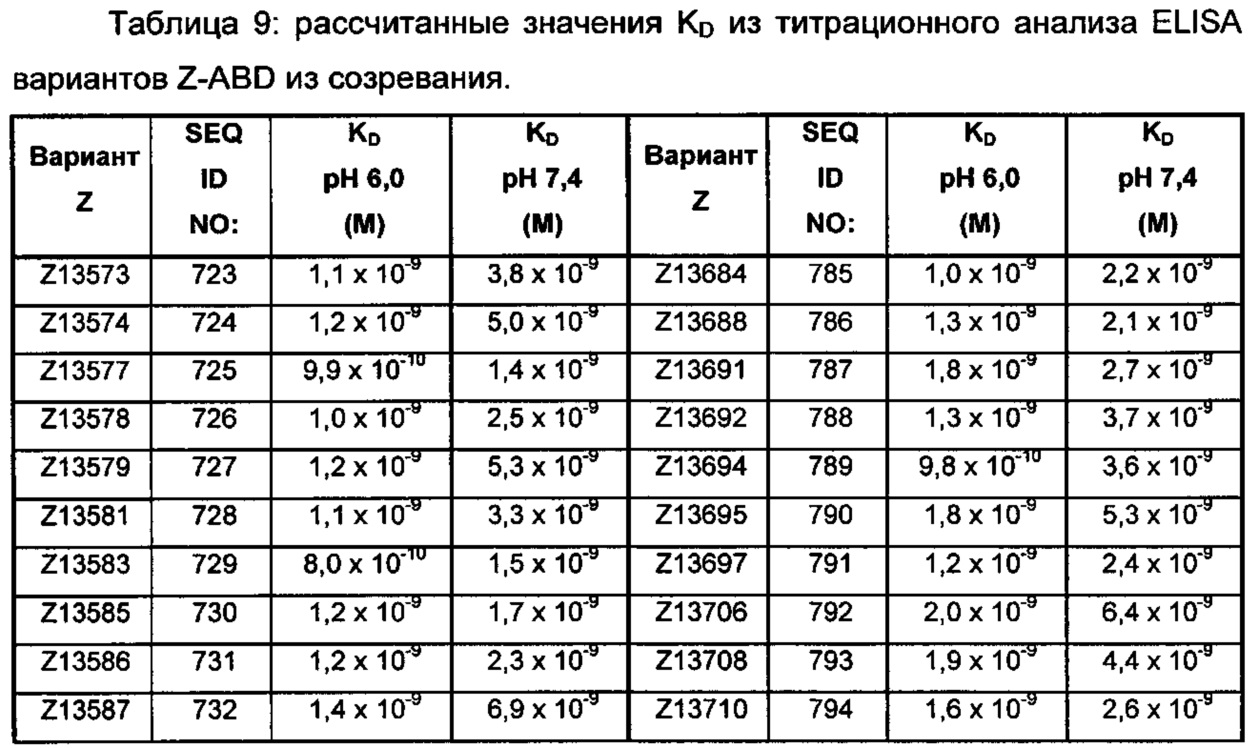
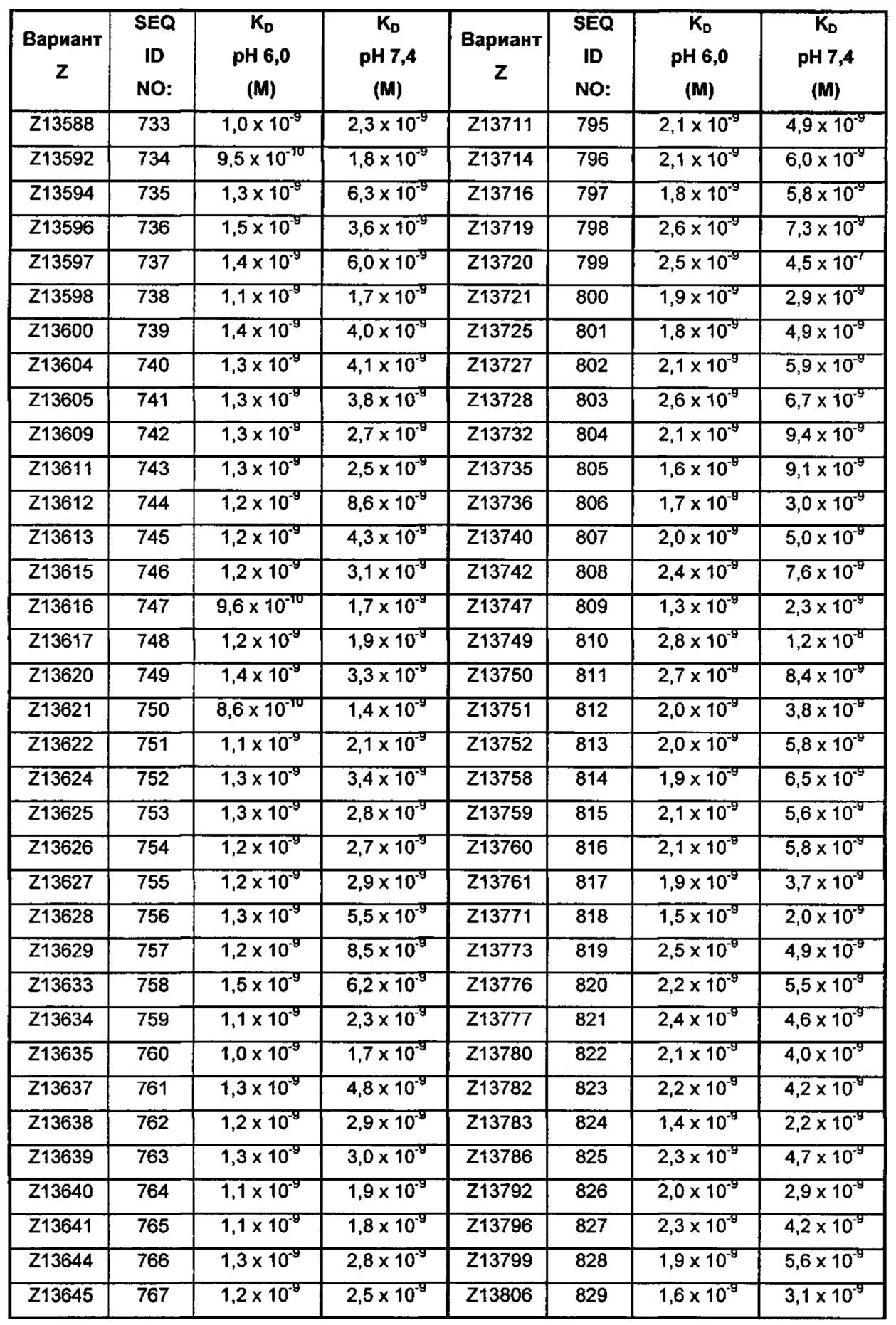
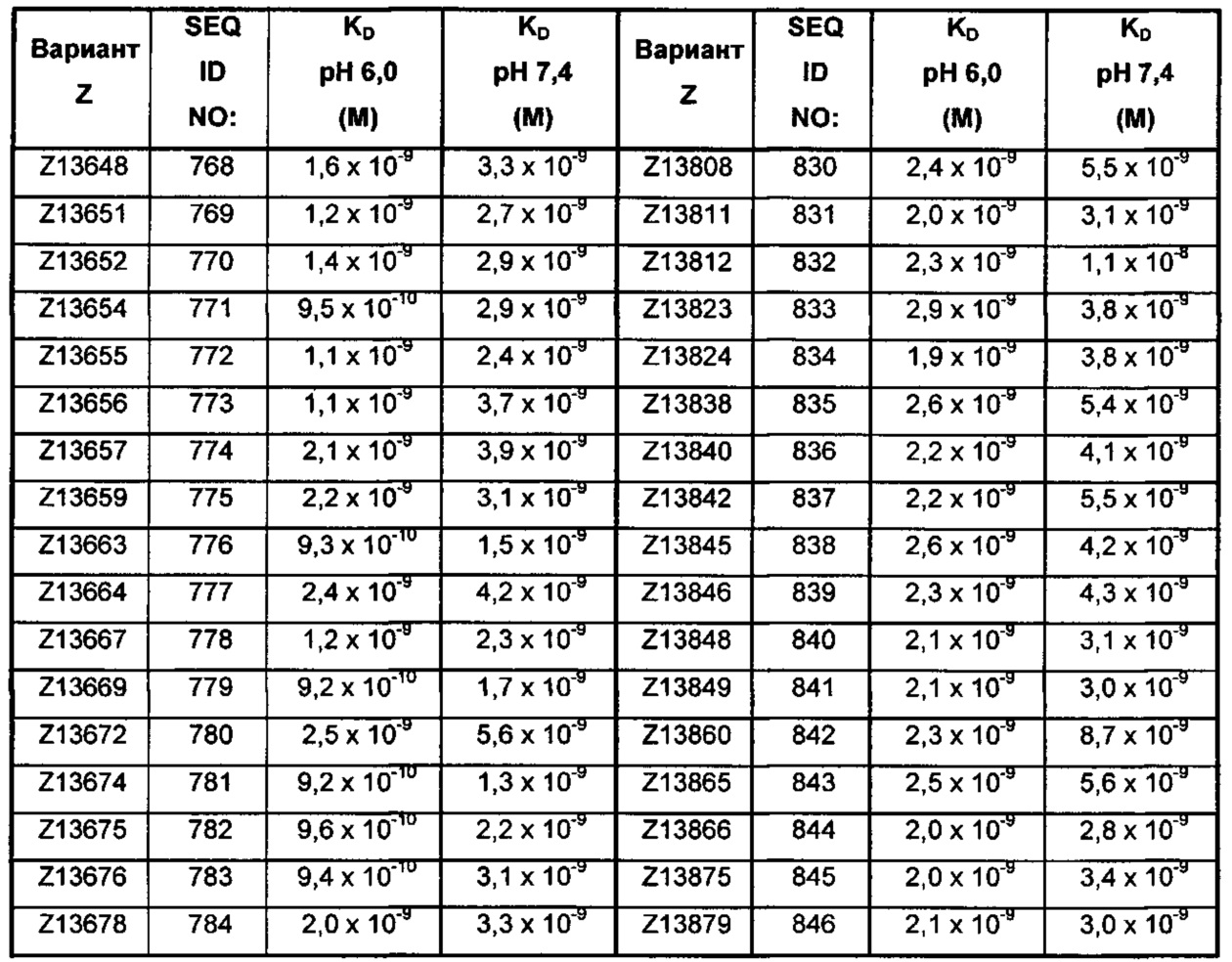
Пример 9
Получение и характеризация вариантов Z из созревшей библиотеки В данном Примере в Е. coli продуцировали двенадцать вариантов Z, очищали и анализировали на связывание с FcRn, а также на ингибирование связывания IgG с FcRn.
Материалы и методы
Субклонирование вариантов Z в экспрессионные векторы. ДНК двенадцати вариантов Z, связывающихся с FcRn (Z13577 (SEQ ID NO: 725), Z13578 (SEQ ID NO: 726), Z13583 (SEQ ID NO: 729), Z13592 (SEQ ID NO: 734), Z13616 (SEQ ID NO: 747), Z13621 (SEQ ID NO: 750), Z13654 (SEQ ID NO: 771), Z13663 (SEQ ID NO: 776), Z13669 (SEQ ID NO: 779), Z13674 (SEQ ID NO: 781), Z13675 (SEQ ID NO: 782) и Z13676 (SEQ ID NO: 783)) амплифицировали из вектора библиотеки pAY02592. Субклонирование проводили, как описано в Примере 3. Фрагменты гена Z субклонировали в экспрессионный вектор pAY01448, что приводило к кодируемой последовательности MGSSHHHHHHLQ-[Z#####]-VD.
Получение вариантов Z. Культивирование и очистку вариантов Z, меченных His6, проводили по существу, как описано в Примере 3.
Анализы связывания и кинетики посредством Biacore. Взаимодействие меченных His6 вариантов Z, связывающихся с FcRn, с человеческим FcRn анализировали на приборе Biacore 2000 по существу, как описано в Примере 3. В качестве белка-мишени использовали человеческий FcRn, приобретенный у Biorbyt (кат. №orb84388). Аналиты инъецировали на протяжении 2 минут со скоростью 30 мкл/мин. Фаза диссоциации составляла 4 минуты, и время уравновешивания между инъекциями аналита составляло 30 минут.
В одном эксперименте варианты Z инъецировали при рН 6,0, с последующей диссоциацией в буферах с рН 6,0 или 7,4 соответственно, используя методику соинъекции. Концентрация вариантов Z составляла 100 нМ.
В другом эксперименте для поднабора вариантов Z определяли приблизительные кинетические константы (kon и koff) и аффинности (KD). Инъецированные концентрации составляли 540 нМ, 180 нМ, 60 нМ, 20 нМ и 6,7 нМ.
Анализ блокирования посредством AlphaLISA. Потенциал вариантов Z ингибировать связывание IgG с FcRn анализировали в анализе AlphaLISA, описанном в Примере 3.
Результаты
Получение вариантов Z. Двенадцать вариантов Z, связывающихся с FcRn, сконструированных с N-концевой His6 меткой, продуцировали в Е. coli. Анализ SDS-PAGE каждого конечного белкового препарата продемонстрировал то, что они преиущественно содержали вариант Z, связывающийся с FcRn. Правильную идентичность и молекулярную массу каждого варианта Z, связывающегося с FcRn, подтверждали анализом ВЭЖХ-МС.
Анализы связывания и кинетики посредством Biacore. Связывание двенадцати вариантов Z с человеческим FcRn и диссоциацию при разных рН тестировали на приборе Biacore путем последовательного инъецирования каждого из вариантов Z при рН 6,0 и в одном из буферов с рН 6,0 или рН 7,4 над поверхностью чипа, содержащей FcRn. Уровень иммобилизации лиганда поверхности составлял 890 RU человеческого FcRn. Двенадцать вариантов Z продемонстрировали связывание с FcRn при рН 6,0, и для всех вариантов наблюдали более быстрые скорости диссоциации при рН 7,4 по сравнению с рН 6,0.
Определяли кинетические константы вариантов Z Z13577 (SEQ ID NO: 725) и Z13621 (SEQ ID NO: 750), взаимодействующих с FcRn, при рН 6,0 (см. Таблицу 10). Кинетические константы рассчитывали с использованием наборов кривых от двух или четырех инъецированных концентраций Z13577 и Z13621 соответственно.

Анализ блокирования AlphaLISA. Способность двенадцати созревших мономерных вариантов Z, меченных His6, ингибировать связывание IgG с FcRn тестировали в анализе блокирования AlphaLISA. Серийные разведения вариантов Z инкубировали с биотинилированным человеческим FcRn, и блокирующую способность каждого соответствующего варианта измеряли после добавления акцепторных шариков, покрытых IgG, и затем донорных шариков, покрытых стрептавидином. Ингибирование могло быть измерено как уменьшение баллов AlphaLISA в отношении позитивных вариантов Z. Было показано, что все двенадцать протестированных вариантов Z блокируют связывание IgG с FcRn, и рассчитанные значения IC50 показаны в Таблице 11.


Пример 10
Сравнение способности к блокированию связывания IgG с FcRn В данном примере способность варианта Z - Hise-Z07918 (SEQ ID NO: 707) к блокированию связывания IgG с FcRn сравнивали с внутривенным иммуноглобулином (IVIg) и подкожным иммуноглобулином (SCIg), используемыми в настоящее время в лечении некоторых аутоиммунных расстройств.
Материалы и методы
Блокирование иммунофлуоресцентного окрашивания IgG-FcRn. Клетки HeLa, трансдуцированные человеческим или мышиным FcRn-eGFP, получали, как описано в Примере 4. Зафиксированные клетки ресуспендировали в 50 мкл смеси 50 нМ человеческого IgG, конъюгированного с Alexa647 (Jackson laboratories, кат. №009-600-003), и Z07918, меченного His6, IVIg (Octagam®, Octapharma) или SCIg (Gammanorm®, Octapharma) соответственно, разведенных в концентрациях 1000, 100, 10, 1, 0,1 или 0 (контроль в виде буфера) нМ в буфере Мак-Илвейна, рН 6,0, плюс 2,5% FCS (фетальная телячья сыворотка) (Ultra low IgG, Life technologies) и 0,1% сапонин (AppliChem). Клетки инкубировали в течение 1 ч при 37°С в темноте, промывали 2×100 мкл буфером Мак-Илвейна, рН 6,0, плюс 2,5% FCS (Ultra low IgG), рН 6,0, и ресуспендировали в 180 мкл буфера Мак-Илвейна, рН 6,0, плюс 1% BSA (бычий сывороточный альбумин). Данные от 10000 клеток, позитивных в отношении GFP/FcRn, получали с использованием FACS Calibur (Beckman Coulter), и данные анализировали с использованием программы Flowing 2.5.0 (Университет Турку).
Результаты
Эксперимент проводили для определения того, блокирует ли вариант Z, связывающийся с FcRn - His6-Z07918 (SEQ ID NO: 707), взаимодействие IgG-FcRn и сравнения данного блокирующего эффекта с IVIg и SCIg. Клетки HeLa, трансдуцированные человеческим или мышиным FcRn-eGFP, инкубировали с человеческим IgG, конъюгированным с А1еха647. Связывание блокировали немеченым His6-Z07918, IVIg или SCIg в разных концентрациях. Результаты показали, что His6-Z07918 эффективно блокировал связывание hlgG с hFcRn в аналогичной степени, что и IVIg или SCIg (Фиг. 9).
Пример 11
Повышенный катаболизм IgG посредством вариантов Z, связывающихся с FcRn, у мышей
Способность варианта Z, связывающегося с FcRn - Z07918, блокировать связывание IgG с FcRn in vitro была показана в Примере 10. В данном примере блокирующую способность того же варианта Z оценивали in vivo. Блокирование взаимодействий IgG-FcRn in vivo будет приводить к повышенному катаболизму IgG и сопутствующим пониженным уровням IgG (Mezo 2008, выше).
Материалы и методы
Исследование на животных. Мышам NMRI (Charles River) вводили связывающиеся с FcRn варианты Z - Z11948 (SEQ ID NO: 1060) и Z07918-PP013 (Z07918 (SEQ ID NO: 707), идентичные Z11948, но с N-концом, начинающимся с аминокислот VD вместо АЕ, в слиянии с вариантом РР013 ABD (SEQ ID NO: 1063)) или буфер (буфер PBS) в дозе 16,3 мкмоль/кг.Мышей обрабатывали пятью внутривенными инъекциями, которые давали в 0, 24, 48, 72 и 96 ч. Образцы сыворотки отбирали в 0, 72, 120 и 168 ч (завершение исследования) и хранили при -20°С. Концентрацию мышиного IgG в сыворотке количественно измеряли посредством ELISA.
ELISA мышиного IgG. Концентрацию мышиного IgG в образцах мышиной сыворотки анализировали посредством набора ELISA для мышиного IgG (Mabtech 3825-1AD-6), и анализ проводили, как описано изготовителем. Концентрацию mlgG рассчитывали из стандартной кривой, предоставленной GraphPad Prism5, с использованием формулы нелинейной регрессии. Концентрация IgG у индивидуальной мыши в 24, 72, 120 и 168 ч была связана с уровнем в 0 ч, и результаты, следовательно, представлены в виде процентной доли IgG (0 ч).
Результаты
Результаты продемонстрировали уменьшение концентрации мышиного IgG у мышей, обработанных вариантами Z, специфичными в отношении FcRn. И Z11948, и слитый с ABD вариант Z07918-PP013 снижали концентрацию эндогенного IgG у мышей in vivo. Наиболее отчетливые эффекты получали с вариантом, слитым с ABD, и через 120 часов. Таким образом, результаты указывают на то, что варианты Z, специфичные в отношении FcRn, блокировали рециркулирование IgG, приводя к повышенному катаболизму IgG и последующим меньшим уровням IgG у мышей.
Пример 12
Трансцитоз вариантов Z, связывающихся с FcRn, in vitro
В данном примере варианты Z, связывающиеся с FcRn, тестировали на их способность транспортироваться через эпителиальные или эндотелиальные клетки, или рециркулировать посредством FcRn in vitro. Лекарственное средство, содержащее вариант Z, со способностью к трансцитозу будет облегчать поглощение лекарственного средства, например, после перорального или легочного введения. Материалы и методы
Клетки, например, клетки Т84, MDCK, HeLa, СаСо2, CaLu-1 и/или CaLu-3, с или без эндогенной или рекомбинантной экспрессии FcRn, выращивают в соответствующей ростовой среде на мембране в трансвеле с образованием монослоя. Целостность монослоев можно оценивать путем измерения электрического сопротивления или добавления зонда, который не способен к проникновению или активно транспортируется через монослой клеток. Определенный монослой клеток метят с апикальной или базолатеральной стороны лигандом, таким как варианты Z, связывающиеся с FcRn, HSA или IgG, в буфере, таком как HBSS (сбалансированный солевой раствор Хэнкса, SigmaAldrich, кат. №Н9269), или ростовая среда при подходящем рН и температуре, и осуществляют охоту на противоположной стороне с использованием буферов, таких как HBSS или ростовая среда, при подходящем рН и температуре.
В варианте данного анализа охоту за лигандами можно осуществлять с использованием буферов, таких как HBSS или ростовая среда при подходящем рН и температуре, на той же самой стороне, что и введение, для измерения также и рециркулирования лиганда. Это можно делать в трансвеле или в чашке для культуры клеток. Клетки высевали в трансвел или в чашки для культуры клеток и метили лигандами, такими как варианты Z, связывающиеся с FcRn, HSA или IgG. Эндоцитированные лиганды будут связываться с FcRn и возвращаться на поверхность клетки на той же самой или противоположной стороне относительно той, на которой они были загружены. После мечения свободные лиганды удаляют промывкой клеток холодным буфером. Для проведения охоты на лиганды к клеткам добавляют теплый буфер или среду и, после периода в интервале от 10 минут до нескольких часов буфер или среду удаляют и подвергают анализу на присутствие лигандов.
В варианте данного анализа лиганды, такие как варианты Z, связывающиеся с FcRn, HSA или IgG, можно использовать для блокирования связывания FcRn такими лигандами, как другие варианты Z, связывающиеся с FcRn, HSA или IgG, путем введения их к клеткам в то же самое время или последовательно.
Количество лиганда можно количественно измерять такими способами, как ELISA, ВЭЖХ-МС, мечение флуоресцентным красителем или радиоизотопом.
Ожидается, что описанные выше результаты эксперимента показывают то, что варианты Z, специфичные в отношении FcRn, могут подвергаться трансцитозу и/или рециркулированию in vitro.
ДЕТАЛИЗИРОВАННЫЙ СПИСОК ВОПЛОЩЕНИЙ
1. Полипептид, связывающийся с FcRn, содержащий мотив связывания с FcRn ВМ, который состоит из аминокислотной последовательности:
EX2X3X4AX6X7EIRWLPNLX16X17X18QRX21AFIX25X26LX28X29,
в которой, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, F, G, Н, I, K, L, М, N, Q, R, S, Т, V, W и Y;
Х4 выбран из A, D, Е, F, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х6 выбран из А, Е, F, G, Н, I, K, Q, R, S и V;
Х7 выбран из A, F, Н, K, N, Q, R, S и V;
X16 выбран из N и Т;
Х17 выбран из F, W и Y;
X18 выбран из A, D, Е и N;
Х21 выбран из A, S, V и W;
Х25 выбран из D, Е, G, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х26 выбран из K и S;
Х28 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y; и
Х29 выбран из D и R.
2. Полипептид, связывающийся с FcRn, по п. 1, в котором, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, F, Н, I, K, L, М, N, Q, R, S, Т, V, W и Y;
Х4 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х6 выбран из А, Е, F, G, Н, I, K, Q, R и S;
Х7 выбран из A, F, Н, K, N, Q, R, S и V;
X16 выбран из N и Т;
Х17 выбран из F и Y;
X18 представляет собой D;
Х21 представляет собой V;
Х25 выбран из D, Е, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х26 выбран из K и S;
Х28 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V и W; и
Х29 выбран из D и R.
3. Полипептид, связывающийся с FcRn, по п. 1, в котором ВМ состоит из аминокислотной последовательности, выбранной из:
1) EX2X3X4AX6HEIRWLPNLTX17X18QRX21AFIX25KLX28D,
в которой, независимо друг от друга,
Х2 выбран из A, D, Е, F, Н, I, K, L, N, Q, R, S, Т, V, W и Y;
Х3 выбран из A, D, Е, G, Н, K, L, М, N, Q, R, S, Т, V и Y;
Х4 выбран из A, D, Е, F, G, I, K, L, N, Q, R, S, Т, V и Y;
Х6 выбран из A, G, K, R, S и V;
Х17 выбран из F, W и Y;
X18 выбран из A, D, Е и N;
Х21 выбран из A, S, V и W;
Х25 выбран из D, G, Н, K, L, N, R, V и W;
Х28 выбран из A, D, Е, Н, K, L, N, Q, R, S, Т, W и Y;
и
2) аминокислотной последовательности, которая имеет по меньшей мере 96%-ную идентичность с последовательностью, определенной 1).
4. Полипептид, связывающийся с FcRn, по любому из пп. 1-3, в котором Х2 выбран из A, D, Е, F, I, L, N, Q, R, S, Т, V, W и Y.
5. Полипептид, связывающийся с FcRn, по п. 4, в котором Х2 выбран из А, D, F, I, L, N, Q, R, S, Т, V, W и Y.
6. Полипептид, связывающийся с FcRn, по п. 5, в котором Х2 выбран из А, D, F, I, L, N, Q, R, S, V и W.
7. Полипептид, связывающийся с FcRn, по п. 5, в котором Х2 выбран из А, I, L, N, Q, R, S, Т, V, W и Y.
8. Полипептид, связывающийся с FcRn, по п. 7, в котором Х2 выбран из А, I, L, N, Q, S, T, V и W.
9. Полипептид, связывающийся с FcRn, по п. 6 или 8, в котором Х2 выбран из A, I, L, N, Q, V и W.
10. Полипептид, связывающийся с FcRn, по п. 9, в котором Х2 выбран из A, I, L, Q, V и W.
11. Полипептид, связывающийся с FcRn, по п. 10, в котором Х2 выбран из A, I, L и Q.
12. Полипептид, связывающийся с FcRn, по п. 11, в котором Х2 выбран из I, L и Q.
13. Полипептид, связывающийся с FcRn, по п. 12, в котором Х2 выбран из I и Q.
14. Полипептид, связывающийся с FcRn, по п. 13, в котором Х2 представляет собой I.
15. Полипептид, связывающийся с FcRn, по п. 13, в котором Х2 представляет собой Q.
16. Полипептид, связывающийся с FcRn, по любому из пп. 1 и 3-15, в котором Х3 выбран из A, D, Е, G, Н, K, L, М, N, Q, R, S, Т, V и Y.
17. Полипептид, связывающийся с FcRn, по п. 2 или 6, в котором Х3 выбран из A, D, Е, Н, K, L, М, N, Q, R, S, Т, V и Y.
18. Полипептид, связывающийся с FcRn, по п. 16, в котором Х3 выбран из A, D, Е, G, Н, K, L, М, N, Q, R, S и Т.
19. Полипептид, связывающийся с FcRn, по п. 18, в котором Х3 выбран из A, D, Е, G, Н, K, М, N, Q, S и Т.
20. Полипептид, связывающийся с FcRn, по п. 19, в котором Х3 выбран из A, D, Е, G, Н, М, N, Q, S и Т.
21. Полипептид, связывающийся с FcRn, по п. 19, в котором Х3 выбран из A, D, Е, K, N, Q, S и Т.
22. Полипептид, связывающийся с FcRn, по п. 21, в котором Х3 выбран из A, D, Е, K, Q и Т.
23. Полипептид, связывающийся с FcRn, по п. 22, в котором Х3 выбран из A, D, Е, Q и Т.
24. Полипептид, связывающийся с FcRn, по п. 23, в котором Х3 выбран из D, Е и Т.
25. Полипептид, связывающийся с FcRn, по п. 24, в котором Х3 выбран из D и Е.
26. Полипептид, связывающийся с FcRn, по п. 25, в котором Х3 представляет собой D.
27. Полипептид, связывающийся с FcRn, по п. 25, в котором Х3 представляет собой Е.
28. Полипептид, связывающийся с FcRn, по любому из пп. 1 и 3-27, в котором Х4 выбран из A, D, Е, F, G, I, K, L, N, Q, R, S, Т, V и Y.
29. Полипептид, связывающийся с FcRn, по п. 28, в котором Х4 выбран из A, D, Е, G, N, Q, R, S, Т и V.
30. Полипептид, связывающийся с FcRn, по п. 2 или 28, в котором Х4 выбран из A, D, Е, F, I, K, L, N, Q, R, S, Т и V.
31. Полипептид, связывающийся с FcRn, по п. 30, в котором Х4 выбран из A, D, Е, I, K, N, Q, R, S и Т.
32. Полипептид, связывающийся с FcRn, по п. 31, в котором Х4 выбран из A, D, Е, I, K, Q, S и Т.
33. Полипептид, связывающийся с FcRn, по п. 32, в котором Х4 выбран из A, D, I, K, Q и S.
34. Полипептид, связывающийся с FcRn, по п. 32, в котором Х4 выбран из A, D, Е, K и S.
35. Полипептид, связывающийся с FcRn, по п. 33 или 34, в котором Х4 выбран из A, D, K и S.
36. Полипептид, связывающийся с FcRn, по п. 34, в котором Х4 выбран из A, D, Е и K.
37. Полипептид, связывающийся с FcRn, по п. 35 или 36, в котором Х4 выбран из A, D и K.
38. Полипептид, связывающийся с FcRn, по п. 37, в котором Х4 выбран из А и D.
39. Полипептид, связывающийся с FcRn, по п. 36, в котором Х4 выбран из А и Е.
40. Полипептид, связывающийся с FcRn, по п. 38 или 39, в котором Х4 представляет собой А.
41. Полипептид, связывающийся с FcRn, по п. 38, в котором Х4 представляет собой D.
42. Полипептид, связывающийся с FcRn, по п. 39, в котором Х4 представляет собой Е.
43. Полипептид, связывающийся с FcRn, по любому из пп. 1 или 4-42, в котором Х6 выбран из A, G, K, Q, R, S и V.
44. Полипептид, связывающийся с FcRn, по п. 3 или 43, в котором Х6 выбран из A, G, K, R, S и V.
45. Полипептид, связывающийся с FcRn, по п. 2 или 44, в котором Х6 выбран из A, G, K, R и S.
46. Полипептид, связывающийся с FcRn, по п. 44, в котором Х6 выбран из A, G, K, S и V.
47. Полипептид, связывающийся с FcRn, по п. 46, в котором Х6 выбран из A, G, K и V.
48. Полипептид, связывающийся с FcRn, по п. 45 или 46, в котором Х6 выбран из A, G, K и S.
49. Полипептид, связывающийся с FcRn, по п. 47 или 48, в котором Х6 выбран из A, G и K.
50. Полипептид, связывающийся с FcRn, по п. 47, в котором Х6 выбран из A, G и V.
51. Полипептид, связывающийся с FcRn, по п. 49 или 50, в котором Х6 выбран из А и G.
52. Полипептид, связывающийся с FcRn, по п. 51, в котором Х6 представляет собой А.
53. Полипептид, связывающийся с FcRn, по п. 51, в котором Х6 представляет собой G.
54. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-53, в котором Х7 выбран из А и Н.
55. Полипептид, связывающийся с FcRn, по п. 54, в котором Х7 представляет собой Н.
56. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-55, в котором X16 представляет собой Т.
57. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-55, в котором X16 представляет собой N.
58. Полипептид, связывающийся с FcRn, по любому из пп. 1 и 3-57, в котором Х17 выбран из F и Y.
59. Полипептид, связывающийся с FcRn, по любому из пп. 1-58, в котором Х17 представляет собой F.
60. Полипептид, связывающийся с FcRn, по любому из пп. 1 и 3-59, в котором X18 выбран из A, D и Е.
61. Полипептид, связывающийся с FcRn, по п. 60, в котором X18 выбран из А и D.
62. Полипептид, связывающийся с FcRn, по п. 61, в котором X18 представляет собой D.
63. Полипептид, связывающийся с FcRn, по любому из пп. 1 и 3-62, в котором Х21 выбран из V и W.
64. Полипептид, связывающийся с FcRn, по п. 63, в котором Х21 представляет собой V.
65. Полипептид, связывающийся с FcRn, по любому из пп. 1 и 4-64, в котором Х25 выбран из D, Е, G, Н, K, L, N, Q, R, V и W.
66. Полипептид, связывающийся с FcRn, по п. 65, в котором Х25 выбран из D, G, Н, K, L, N, R, V и W.
67. Полипептид, связывающийся с FcRn, по любому из пп. 2, 3 и 66, в котором Х25 выбран из Н, L, R, V и W.
68. Полипептид, связывающийся с FcRn, по п. 67, в котором Х25 выбран из Н, R, V и W.
69. Полипептид, связывающийся с FcRn, по п. 68, в котором Х25 выбран из Н, R и V.
70. Полипептид, связывающийся с FcRn, по п. 67, в котором Х25 выбран из Н, L и R.
71. Полипептид, связывающийся с FcRn, по п. 69 или 70, в котором Х25 выбран из Н и R.
72. Полипептид, связывающийся с FcRn, по п. 69, в котором Х25 выбран из Н и V.
73. Полипептид, связывающийся с FcRn, по п. 71 или 72, в котором Х25 представляет собой Н.
74. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-73, в котором Х26 представляет собой K.
75. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-73, в котором Х26 представляет собой S.
76. Полипептид, связывающийся с FcRn, по любому из пп. 1 и 3-75, в котором Х28 выбран из A, D, Е, Н, K, L, N, Q, R, S, Т, W и Y.
77. Полипептид, связывающийся с FcRn, по п. 76, в котором Х28 выбран из A, D, Е, K, L, N, Q, R, S, Т, W и Y.
78. Полипептид, связывающийся с FcRn, по п. 77, в котором Х28 выбран из A, D, Е, L, R, S, Т, W и Y.
79. Полипептид, связывающийся с FcRn, по п. 2 или 77, в котором Х28 выбран из A, D, K, L, N, Q, R, S, Т и W.
80. Полипептид, связывающийся с FcRn, по п. 78 или 79, в котором Х28 выбран из A, D и R.
81. Полипептид, связывающийся с FcRn, по п. 80, в котором Х28 выбран из А и R.
82. Полипептид, связывающийся с FcRn, по п. 80, в котором Х28 выбран из D и R.
83. Полипептид, связывающийся с FcRn, по п. 81, в котором Х28 представляет собой А.
84. Полипептид, связывающийся с FcRn, по п. 81 или 82, в котором Х28 представляет собой R.
85. Полипептид, связывающийся с FcRn, по п. 82, в котором Х28 представляет собой D.
86. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-85, в котором Х29 представляет собой D.
87. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-85, в котором Х29 представляет собой R.
88. Полипептид, связывающийся с FcRn, по любому из пп. 1, 2 и 4-87, в котором Х6Х7 выбран из АН и GH.
89. Полипептид, связывающийся с FcRn, по п. 88, в котором Х6Х7 представляет собой АН.
90. Полипептид, связывающийся с FcRn, по п. 88, в котором Х6Х7 представляет собой GH.
91. Полипептид, связывающийся с FcRn, по любому из пп. 1-90, в котором Х17Х18 выбран из FD и YD.
92. Полипептид, связывающийся с FcRn, по п. 91, в котором Х17Х18 представляет собой FD.
93. Полипептид, связывающийся с FcRn, по любому из пп. 1-92, в котором последовательность удовлетворяет по меньшей мере трем из шести условий I-VI:
I. Х6 выбран из A, G, K и S, например, в частности из А;
II. Х7 представляет собой Н;
III. Х17 выбран из F и Y, например, в частности из F;
IV. X18 представляет собой D;
V. Х21 выбран из V и W, например, в частности из V;
VI. Х25 выбран из Н и R, например, в частности из Н.
94. Полипептид, связывающийся с FcRn, по п. 93, в котором последовательность удовлетворяет по меньшей мере четырем из шести условий I-VI.
95. Полипептид, связывающийся с FcRn, по п. 94, в котором последовательность удовлетворяет по меньшей мере пяти из шести условий I-VI.
96. Полипептид, связывающийся с FcRn, по п. 95, в котором последовательность удовлетворяет всем шести условиям I-VI.
97. Полипептид, связывающийся с FcRn, по любому из пп. 1-96, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1-353.
98. Полипептид, связывающийся с FcRn, по п. 97, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1-15, SEQ ID NO: 17-140 и SEQ ID NO: 353.
99. Полипептид, связывающийся с FcRn, по п. 98, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1-2 и SEQ ID NO: 17-140.
100. Полипептид, связывающийся с FcRn, по п. 99, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1-2, SEQ ID NO: 17-92, SEQ ID NO: 94-103, SEQ ID NO: 105-125 и SEQ ID NO: 127-140.
101. Полипептид, связывающийся с FcRn, по п. 98, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1-8, SEQ ID NO: 13, SEQ ID NO: 19-20, SEQ ID NO: 23, SEQ ID NO: 28, SEQ ID NO: 41, SEQ ID NO: 44, SEQ ID NO: 65, SEQ ID NO: 70, SEQ ID NO: 73, SEQ ID NO: 75-77 и SEQ ID NO: 353.
102. Полипептид, связывающийся с FcRn, по п. 100 или 101, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 23, SEQ ID NO: 28, SEQ ID NO: 41, SEQ ID NO: 44, SEQ ID NO: 65, SEQ ID NO: 73 и SEQ ID NO: 75-77.
103. Полипептид, связывающийся с FcRn, по п. 102, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 23, SEQ ID NO: 44, SEQ ID NO: 65, SEQ ID NO: 75 и SEQ ID NO: 77.
104. Полипептид, связывающийся с FcRn, по п. 103, в котором последовательность выбрана из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 23 и SEQ ID NO: 75.
105. Полипептид, связывающийся с FcRn, по п. 104, в котором последовательность представляет собой SEQ ID NO: 1.
106. Полипептид, связывающийся с FcRn, по любому из пп. 1-105, в котором указанный мотив связывания с FcRn образует часть домена белка в виде пучка трех спиралей.
107. Полипептид, связывающийся с FcRn, по п. 106, в котором указанный мотив связывания с FcRn по существу образует часть двух спиралей с соединительной петлей в пределах указанного домена белка в виде пучка трех спиралей.
108. Полипептид, связывающийся с FcRn, по п. 107, в котором указанный домен белка в виде пучка трех спиралей выбран из доменов бактериальных рецепторов.
109. Полипептид, связывающийся с FcRn, по п. 108, в котором указанный домен белка в виде пучка трех спиралей выбран из доменов белка А из Staphylococcus aureus или его производных.
110. Полипептид, связывающийся с FcRn, по любому из пп. 1-109, который содержит аминокислотную последовательность, выбранную из:
3) K-[BM]-DPSQSXaXbLLXcEAKKLXdXeXfQ;
в которой
[ВМ] представляет собой мотив связывания с FcRn, как здесь определено, при условии, что Х29 представляет собой D;
Ха выбран из А и S;
Xb выбран из N и Е;
Хс выбран из A, S и С;
Xd выбран из Е, N и S;
Хе выбран из D, Е и S;
Xf выбран из А и S;
и
4) аминокислотной последовательности, которая имеет по меньшей мере 93%-ную идентичность с последовательностью, определенной 3).
111. Полипептид, связывающийся с FcRn, по любому из пп. 1-109, который содержит аминокислотную последовательность, выбранную из:
5) K-[SW]-QPEQSXaXbLLXcEAKKLXdXeXfQ;
в которой
[ВМ] представляет собой мотив связывания с FcRn, как здесь определено, при условии, что Х29 представляет собой R;
Ха выбран из А и S;
Xb выбран из N и Е;
Хс выбран из A, S и С;
Xd выбран из Е, N и S;
Хе выбран из D, Е и S;
Xf выбран из А и S;
и
6) аминокислотной последовательности, которая имеет по меньшей мере 93%-ную идентичность с последовательностью, определенной 5).
112. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором Ха в последовательности 3) или 5) представляет собой А.
113. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором Ха в последовательности 3) или 5) представляет собой S.
114. Полипептид, связывающийся с FcRn, по любому из пп. 110-113, в котором Xb в последовательности 3) или 5) представляет собой N.
115. Полипептид, связывающийся с FcRn, по любому из пп. 110-113, в котором Xb в последовательности 3) или 5) представляет собой Е.
116. Полипептид, связывающийся с FcRn, по любому из пп. 110-115, в котором Хс в последовательности 3) или 5) представляет собой А.
117. Полипептид, связывающийся с FcRn, по любому из пп. 110-115, в котором Хс в последовательности 3) или 5) представляет собой S.
118. Полипептид, связывающийся с FcRn, по любому из пп. 110-115, в котором Хс в последовательности 3) или 5) представляет собой С.
119. Полипептид, связывающийся с FcRn, по любому из пп. 110-118, в котором Ха в последовательности 3) или 5) представляет собой Е.
120. Полипептид, связывающийся с FcRn, по любому из пп. 110-118, в котором Ха в последовательности 3) или 5) представляет собой N.
121. Полипептид, связывающийся с FcRn, по любому из пп. 110-118, в котором Xd в последовательности 3) или 5) представляет собой S.
122. Полипептид, связывающийся с FcRn, по любому из пп. 110-121, в котором Хе в последовательности 3) или 5) представляет собой D.
123. Полипептид, связывающийся с FcRn, по любому из пп. 110-121, в котором Хе в последовательности 3) или 5) представляет собой Е.
124. Полипептид, связывающийся с FcRn, по любому из пп. 110-121, в котором Хе в последовательности 3) или 5) представляет собой S.
125. Полипептид, связывающийся с FcRn, по любому из пп. 110-119, 121, 123 и 124, в котором XdXe в последовательности 3) или 5) выбран из ЕЕ, ES, SE и SS.
126. Полипептид, связывающийся с FcRn, по п. 125, в котором XdXe в последовательности 3) или 5) представляет собой ES.
127. Полипептид, связывающийся с FcRn, по п. 125, в котором XdXe в последовательности 3) или 5) представляет собой SE.
128. Полипептид, связывающийся с FcRn, по любому из пп. 110-127, в котором Xf в последовательности 3) или 5) представляет собой А.
129. Полипептид, связывающийся с FcRn, по любому из пп. 110-127, в котором Xf в последовательности 3) или 5) представляет собой S.
130. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой А, и Xf представляет собой А.
131. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой С, и Xf представляет собой А.
132. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S, и Xf представляет собой S.
133. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С, и Xf представляет собой S.
134. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой A; XdXe представляет собой ND; и Xf представляет собой А.
135. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой С; XdXe представляет собой ND; и Xf представляет собой А.
136. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S; XdXe представляет собой ND; и Xf представляет собой S.
137. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С; XdXe представляет собой ND; и Xf представляет собой S.
138. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой А; XdXe представляет собой SE; и Xf представляет собой А.
139. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Xc представляет собой С; XdXe представляет собой SE; и Xf представляет собой А.
140. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S; XdXe представляет собой SE; и Xf представляет собой S.
141. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С; XdXe представляет собой SE; и Xf представляет собой S.
142. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой A; XdXe представляет собой ES; и Xf представляет собой А.
143. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой А; Xb представляет собой N; Хс представляет собой С; XdXe представляет собой ES; и Xf представляет собой А.
144. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой S; XdXe представляет собой ES; и Xf представляет собой S.
145. Полипептид, связывающийся с FcRn, по п. 110 или 111, в котором в последовательности 3) или 5) Ха представляет собой S; Xb представляет собой Е; Хс представляет собой С; XdXe представляет собой ES; и Xf представляет собой S.
146. Полипептид, связывающийся с FcRn, по любому из пп. 110 и 112-145, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-706.
147. Полипептид, связывающийся с FcRn, по п. 146, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-368, SEQ ID NO: 370-493 и SEQ ID NO: 706.
148. Полипептид, связывающийся с FcRn, по п. 147, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-355 и SEQ ID NO: 370-493.
149. Полипептид, связывающийся с FcRn, по п. 148, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-355, SEQ ID NO: 370-445, SEQ ID NO: 447-456, SEQ ID NO: 458-478 и SEQ ID NO: 480-493.
150. Полипептид, связывающийся с FcRn, по п. 147, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354-361, SEQ ID NO: 366, SEQ ID NO: 372-373, SEQ ID NO: 376, SEQ ID NO: 381, SEQ ID NO: 394, SEQ ID NO: 397, SEQ ID NO: 418, SEQ ID NO: 423, SEQ ID NO: 426, SEQ ID NO: 428-430 и SEQ ID NO: 706.
151. Полипептид, связывающийся с FcRn, по п. 149 или 150, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354, SEQ ID NO: 376, SEQ ID NO: 381, SEQ ID NO: 394, SEQ ID NO: 397, SEQ ID NO: 418, SEQ ID NO: 426 и SEQ ID NO: 428-430.
152. Полипептид, связывающийся с FcRn, по п. 151, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354, SEQ ID NO: 376, SEQ ID NO: 397, SEQ ID NO: 418, SEQ ID NO: 428 и SEQ ID NO: 430.
153. Полипептид, связывающийся с FcRn, по п. 152, в котором последовательность 3) выбрана из группы, состоящей из SEQ ID NO: 354, SEQ ID NO: 376 и SEQ ID NO: 428.
154. Полипептид, связывающийся с FcRn, по п. 153, в котором последовательность 3) представляет собой SEQ ID NO: 354.
155. Полипептид, связывающийся с FcRn, по любому из пп. 1-109, который содержит аминокислотную последовательность, выбранную из:
7) YAK-[BM]-DPSQSSELLXcEAKKLNDSQAP;
в которой [BM] представляет собой мотив связывания с FcRn, как определено по любому из пп. 1-105, и Хс выбран из A, S и С; и
8) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной 7).
156. Полипептид, связывающийся с FcRn, по любому из пп. 1-109, который содержит аминокислотную последовательность, выбранную из:
9) FNK-[BM]-DPSQSANLLXcEAKKLNDAQAP;
в которой [ВМ] представляет собой мотив связывания с FcRn, как определено по любому из пп. 1-105, и Хс выбран из А и С; и
10) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной 9).
157. Полипептид, связывающийся с FcRn, по п. 109, который содержит аминокислотную последовательность, выбранную из:

в которой [ВМ] представляет собой мотив связывания с FcRn, как он определен по любому из пп. 1-105.
158. Полипептид, связывающийся с FcRn, по любому из пп. 1-157, который содержит аминокислотную последовательность, выбранную из:
11) AEAKYAK-[BM]-DPSQSSELLSEAKKLNDSQAPK;
в которой [ВМ] представляет собой мотив связывания с FcRn, как он определен в любом из пп. 1-105;
и
12) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной 11).
159. Полипептид, связывающийся с FcRn, по п. 158, в котором последовательность 11) выбрана из группы, состоящей из SEQ ID NO: 1060-1062.
160. Полипептид, связывающийся с FcRn, по любому из пп. 1-159, который содержит аминокислотную последовательность, выбранную из:
13) VDAKYAK-[BM]-DPSQSSELLSEAKKLNDSQAPK;
в которой [ВМ] представляет собой мотив связывания с FcRn, как он определен в любом из пп. 1-105;
и
14) аминокислотной последовательности, которая имеет по меньшей мере 94%-ную идентичность с последовательностью, определенной в 13).
161. Полипептид, связывающийся с FcRn, по п. 160, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-1059.
162. Полипептид, связывающийся с FcRn, по п. 161, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-721, SEQ ID NO: 723-846 и SEQ ID NO: 1059.
163. Полипептид, связывающийся с FcRn, по п. 162, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-708 и SEQ ID NO: 723-846.
164. Полипептид, связывающийся с FcRn, по п. 163, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-708, SEQ ID NO: 723-798, SEQ ID NO: 800-809, SEQ ID NO: 811-831 и SEQ ID NO: 833-846.
165. Полипептид, связывающийся с FcRn, по п. 162, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707-714, SEQ ID NO: 719, SEQ ID NO: 725-726, SEQ ID NO: 729, SEQ ID NO: 734, SEQ ID NO: 747, SEQ ID NO: 750, SEQ ID NO: 771, SEQ ID NO: 776, SEQ ID NO: 779, SEQ ID NO: 781-783 и SEQ ID NO: 1059.
166. Полипептид, связывающийся с FcRn, по п. 163 или 165, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707, SEQ ID NO: 729, SEQ ID NO: 734, SEQ ID NO: 747, SEQ ID NO: 750, SEQ ID NO: 771, SEQ ID NO: 779 и SEQ ID NO: 781-783.
167. Полипептид, связывающийся с FcRn, по п. 166, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707, SEQ ID NO: 729, SEQ ID NO: 750, SEQ ID NO: 771, SEQ ID NO: 781 и SEQ ID NO: 783.
168. Полипептид, связывающийся с FcRn, по п. 167, в котором последовательность 13) выбрана из группы, состоящей из SEQ ID NO: 707, SEQ ID NO: 729 и SEQ ID NO: 781.
169. Полипептид, связывающийся с FcRn, по п. 168, в котором последовательность 13) представляет собой SEQ ID NO: 707.
170. Полипептид, связывающийся с FcRn, по любому из пп. 1-169, который способен к связыванию с FcRn при рН 6,0 так, что значение KD взаимодействия составляет максимум 1×10-6 М, например, максимум 1×10-7 М, например, максимум 1×10-8 М, например, максимум 1×10-9 М, например, максимум 1×10-10 М.
171. Полипептид, связывающийся с FcRn, по любому из пп. 1-170, в котором значение Ko взаимодействия между полипептидом, связывающимся с FcRn, и FcRn при рН 7,4 больше, чем значение KD указанного взаимодействия при рН 6,0, например, по меньшей мере в 2 раза больше, например, по меньшей мере в 5 раз больше, например, по меньшей мере в 10 раз больше, например, по меньшей мере в 50 раз больше, например, по меньшей мере в 100 раз больше, чем значение Ko указанного взаимодействия при рН 6,0.
172. Полипептид, связывающийся с FcRn, по любому из пп. 1-171, в котором значение KD указанного взаимодействия при рН 7,4 составляет по меньшей мере 1×10-8 М, например, по меньшей мере 1×10-7 М, например, по меньшей мере 1×10-6 М, например, по меньшей мере 1×105 М.
173. Полипептид, связывающийся с FcRn, по любому из пп. 1-170, в котором значение KD указанного взаимодействия при рН 7,4 является таким же как или меньшим, чем значение Ko указанного взаимодействия при рН 6,0.
174. Полипептид, связывающийся с FcRn, по любому из пп. 1-170, в котором значение KD указанного взаимодействия при рН 7,4 составляет максимум 1×10-6 М, например, максимум 1×10-7 М, например, максимум 1×10-8 М, например, максимум 1×10-9 М, например, максимум 1×10-10 М.
175. Полипептид, связывающийся с FcRn, по любому из пп. 1-174, который содержит по меньшей мере одну дополнительную аминокислоту на С-и/или N-конце.
176. Полипептид, связывающийся с FcRn, по п. 175, в котором указанное удлинение по меньшей мере на одну дополнительную аминокислоту улучшает продукцию, очистку, стабилизацию in vivo или in vitro, связывание или выявление полипептида.
177. Полипептид, связывающийся с FcRn, по любому из пп. 1-176 в мультимерной форме, содержащий по меньшей мере две мономерные единицы полипептида, связывающегося с FcRn, аминокислотные последовательности которых могут быть одинаковыми или разными.
178. Полипептид, связывающийся с FcRn, по п. 177, в котором мономерные единицы указанного полипептида, связывающегося с FcRn, ковалентно связаны друг с другом.
179. Полипептид, связывающийся с FcRn, по п. 177, в котором мономерные единицы полипептида, связывающегося с FcRn, экспрессируются в виде слитого белка.
180. Полипептид, связывающийся с FcRn, по любому из пп. 177-179 в димерной форме.
181. Слитый белок или конъюгат, содержащий
- первую группировку, состоящую из полипептида, связывающегося с FcRn, по любому из пп. 1-180; и
- вторую группировку, состоящую из полипептида, имеющего желательную биологическую активность.
182. Слитый белок или конъюгат по п. 181, где период полувыведения in vivo указанного слитого белка или конъюгата дольше, чем период полувыведения in vivo полипептида, имеющего желательную биологическую активность, как такового.
183. Слитый белок или конъюгат по любому из пп. 181-182, где указаная желательная биологическая активность представляет собой терапевтическую активность.
184. Слитый белок или конъюгат по любому из пп. 181-182, где указанная желательная биологическая активность представляет собой активность связывания с выбранной мишенью.
185. Слитый белок или конъюгат по п. 184, где указанная выбранная мишень представляет собой альбумин.
186. Слитый белок или конъюгат по п. 185, где указанная альбуминсвязывающая активность предоставляется альбуминсвязывающим доменом стрептококкового белка G или его производного.
187. Слитый белок или конъюгат по любому пп. 185-189, в котором указанная альбуминсвязывающая активность увеличивает период полувыведения in vivo слитого белка или конъюгата.
188. Слитый белок или конъюгат по любому пп. 181-182, в котором указанная желательная биологическая активность представляет собой ферментативную активность.
189. Слитый белок или конъюгат по любому пп. 181-183, в котором вторая группировка, имеющая желательную биологическую активность, представляет собой терапевтически активный полипептид.
190. Слитый белок или конъюгат по любому пп. 181-183 и 188-189, в котором вторая группировка, имеющая желательную биологическую активность, выбрана из группы, состоящей из ферментов, гормонов, факторов роста, хемокинов и цитокинов.
191. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по любому из пп. 1-190, который ингибирует связывание IgG с FcRn.
192. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по п. 191, где значение KD взаимодействия между указанным полипептидом, связывающимся с FcRn, слитым белком или конъюгатом и FcRn меньше, чем значение KD взаимодействия между IgG и FcRn.
193. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по любому из пп. 1-192, дополнительно содержащий метку.
194. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по п. 193, в котором указанная метка выбрана из группы, состоящей из флуоресцентных красителей и металлов, хромофорных красителей, хемилюминисцентных соединений и биолюминисцентных белков, ферментов, радиоизотопов и частиц.
195. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по любому из пп. 1-194, содержащий хелатирующее окружение, предоставленное полиаминополикарбоксилатным хелатором, конъюгированным с полипептидом, связывающимся с FcRn, через тиольную группу остатка цистеина или аминогруппу остатка лизина.
196. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по п. 195, в котором полиаминополикарбоксилатный хелатор представляет собой 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту или ее производное.
197. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по п. 196, в котором производное 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты представляет собой 1,4,7,10-тетраазациклододекан-1,4,7-трис-уксусной кислоты-10-малеимидоэтилацетамид.
198. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по п. 195, в котором полиаминополикарбоксилатный хелатор представляет собой 1,4,7-триазациклононан-1,4,7-триуксусную кислоту или ее производное.
199. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по п. 195, в котором полиаминополикарбоксилатный хелатор представляет собой диэтилентриаминпентауксусную кислоту или ее производное.
200. Полинуклеотид, кодирующий полипептид по любому из пп. 1-192.
201. Экспрессионный вектор, содержащий полинуклеотид по п. 200.
202. Клетка-хозяин, содержащая экспрессионный вектор по п. 201.
203. Способ получения полипептида по любому из пп. 1-192, включающий:
- культивирование клетки-хозяина по п. 202 при пермиссивных условиях для экспрессии указанного полипептида от указанного экспрессионного вектора и
- выделение указанного полипептида.
204. Композиция, содержащая полипептид, связывающийся с FcRn, слитый белок или конъюгат по любому из пп. 1-199 и по меньшей мере один фармацевтически приемлемый эксципиент или носитель.
205. Композиция по п. 204, дополнительно содержащая по меньшей мере один дополнительный активный агент.
206. Композиция по любому из пп. 204-205, которая адаптирована для введения путем, выбранным из группы, состоящей из перорального введения, интраназального введения, легочного введения, вагинального введения, ректального введения, внутривенной инъекции, внутрибрюшинной инъекции, внутримышечной инъекции, подкожной инъекции и внутрикожной инъекции.
207. Полипептид, связывающийся с FcRn, слитый белок или конъюгат по любому из пп. 1-199 или композиция по любому из пп. 204-206 для применения в качестве лекарственного средства.
208. Полипептид, связывающийся с FcRn, слитый белок, конъюгат или композиция для применения по п. 207, где указанное лекарственное средство предназначено для лечения аутоиммунного состояния.
209. Полипептид, связывающийся с FcRn, слитый белок, конъюгат или композиция для применения по п. 207 или 208, где указанное лекарственное средство предназначено для лечения состояния, выбранного из группы, состоящей из следующих: тяжелая миастения, синдром Гийена-Барре, аутоиммунный энцефалит с поражением лимбической системы, детские аутоиммунные нейропсихиатрические расстройства, ассоциированные со стрептококковой инфекцией (PANDAS), нейромиотония (синдром Исаака), синдром Морвана, рассеянный склероз, обыкновенная пузырчатка, листовидный буллезный пемфигоид, приобретенный буллезный эпидермолиз, пемфигоид беременных, пемфигоид слизистой оболочки, склероатрофический лишай, антифосфолипидный синдром, рецидивирующая полихондрия, аутоиммунная анемия, идиопатическая тромботическая пурпура, аутоиммунный диффузный токсический зоб, дилатационная кардиомиопатия, васкулит, синдром Гудпасчера, идиопатическая мембранная нефропатия, ревматоидный артрит и системная красная волчанка.
210. Способ лечения субъекта, нуждающегося в этом, включающий введение данному субъекту терапевтически активного количества полипептида, связывающегося с FcRn, слитого белка или конъюгата по любому из пп. 1-199 или композиции по любому из пп. 204-206.
211. Способ по п. 210 для лечения аутоиммунного состояния.
212. Способ по п. 210 или 211, где указанный субъект страдает от состояния, выбранного из группы, состоящей из следующих: тяжелая миастения, синдром Гийена-Барре, аутоиммунный энцефалит с поражением лимбической системы, детские аутоиммунные нейропсихиатрические расстройства, ассоциированные со стрептококковой инфекцией (PANDAS), нейромиотония (синдром Исаака), синдром Морвана, рассеянный склероз, обыкновенная пузырчатка, листовидный буллезный пемфигоид, приобретенный буллезный эпидермолиз, пемфигоид беременных, пемфигоид слизистой оболочки, склероатрофический лишай, антифосфолипидный синдром, рецидивирующая полихондрия, аутоиммунная анемия, идиопатическая тромботическая пурпура, аутоиммунный диффузный токсический зоб, дилатационная кардиомиопатия, васкулит, синдром Гудпасчера, идиопатическая мембранная нефропатия, ревматоидный артрит и системная красная волчанка.