Результат интеллектуальной деятельности: ПРОИЗВОДНОЕ 1",2",3"-ТРИМЕТОКСИБЕНЗО[5",6":5',4']1H-(aR,1S)-1-АЦЕТАМИДО-6',7'-ДИГИДРОЦИКЛОГЕПТА[2',3'-f]-2,3-ДИГИДРОФУРАНА И ЕГО ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Настоящее изобретение относится к области органической химии, к гетероциклическим соединениям, содержащим пятичленные кольца, конденсированные с другими ядрами, с одним атомом кислорода в качестве гетероатома, а именно к дигидрофуранам, только с атомами водорода или радикалами, содержащими только атомы водорода и углерода, непосредственно связанные с атомами углерода гетероциклического кольца, с замещенными углеводородными радикалами, связанными с атомами углерода гетероциклического кольца, и касается производных 1'',2'',3''-триметоксибензо[5'',6'':5',4']1H-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана и его применения в качестве активного компонента противоопухолевых лекарственных средств для лечения онкологических заболеваний.
В настоящее время онкологические заболевания являются одной из основных причин смерти во всем мире. В 2007 году зарегистрировано 7,9 миллиона случаев смерти от этой болезни. По прогнозам, число случаев смерти от онкологических заболеваний в мире будет продолжать расти и в 2030 году достигнет 12 миллионов. В связи с этим, синтез новых соединений и создание на их основе противоопухолевых препаратов, обладающих улучшенными фармакокинетическими свойствами, является актуальной задачей здравоохранения.
Известны химические соединения, противоопухолевое действие которых заключается в ингибировании митоза активно пролиферирующих опухолевых клеток.
Цитотоксическая и противоопухолевая активность известных антимитотических соединений обусловлена нарушением обратимости процесса полимеризации и деполимеризации белковых молекул α- и β-тубулина, что приводит к нарушению формирования митотического веретена, образование которого предшествует делению клетки (Biochem. Pharmacol., 1976, 25, 138).
Известно достаточно большое количество химических соединений, обладающих цитотоксической активностью по отношению ко многим видам опухолевых клеток. К таким соединениям относятся алкалоиды ряда колхицина, комбретастатин А-4 и его производные, 4-арилкумарины, а также индольные производные аллоколхицина. Однако, каждый из них имеет недостатки.
Недостатком комбретастатина А-4 (US 4996237 А, кл. С07С 43/23, C07D 317/64, A61K 31/075, опубл. 1991.02.26) и его производных (US 2009186857 А, кл. A61K 31/66, опубл. 2009.07.23,) является низкая эффективность за счет нежелательных побочных эффектов при применении in vivo вследствие их самопроизвольного превращения из активной цис-формы в неактивную транс-форму (Curr. Opin. Pharmacol., 2001, 1, 370). 4-арилкумарины проявляют низкую антипролиферацинную и апоптозиндуцирующую активность по сравнению с производными комбретастатина и колхицина (J. Med. С hem. 2003, 46, 5437; J. Med. Chem. 2011, 54, 3153).
Известны, например, колхицин и его производные из патентных документов: WO 2011022805 (А1), кл. A61K 31/165, А61Р 35/00, С07С 233/32, опубл. 2011.03.03 г.; WO 2010105172 (А1), кл. A01N 37/18, A61K 31/16, опубл. 2010.09.16 г.; ЕР 2056812 А1, кл. A61K 31/165, А61Р 35/04, опубл. 2009.05.13 г.; US 2004204370 А1, кл. С07С 323/41, С07С 323/42, С07С 323/60, опубл. 2004.10.14 г.
Известны соединения с колхициновым скелетом для получения лекарственнных препаратов с противоопухолевой активностью (RU 99100326 А, кл. С07С 49/755, С07С 323/22, C07D 265/34, A61K 31/12, А61Р 35/00, опубл. 20.11.2000 г.).
Известны производные колхицина, которые проявляют противоопухолевую и антипролиферативную активность (RU 2181354 C2, кл. С07С 49/755, C07D 265/36, A61K 31/1222, A61K 31/165, А61Р 35/00, опубл. 20.04.02 г.).
Известны производные N-деацитилтиоколхицина, которые обладают антипролиферативной активностью (RU 2257379 C2, кл. С07С 323/41, С07С 323/44, A61K 31/165, A61K 31/17, А61Р 35/00, А61Р 19/02, опубл. 27.07.05 г.).
Недостатком колхицина и его производных является возникновение побочных эффектов при их применении, в частности, значительная неспецифическая токсичность (Med. Res. Rev. 2008, 28, 155-183; Chem. Nat. Prod. 1998, 34, 343), что делает невозможным их использование в качестве противоопухолевых препаратов.
Известны производные индола, используемые в качестве ингибитора тирозинкиназы и противоопухолевого средства (RU 2155187 C2, кл. C07D 209/30, C07D 209/42, A61K 31/40, A61K 31/44, А61Р 35/00, опубл. 27.08.2000 г.)
Известно соединение 4-(1-(4-(4-метоксифенилтио)-2,5-диоксо-2,5-дигидро-1Н-пирро-3-ил)-1Н-индол-3-ил)бутилкарбамимидотиоат, содержащий 1Н-индольный фрагмент, для использования в терапии рака толстой кишки, молочной железы, меланомы, лейкоза (RU 2441000, кл. C07D 403/04, А61Р 35/00, опубл. 27.01.12 г.).
Известно индольное производное аллоколхицина (N.S. Sitnikjov et al., Chem. Eur. J. 2012, 18, 12096), представленное формулой:
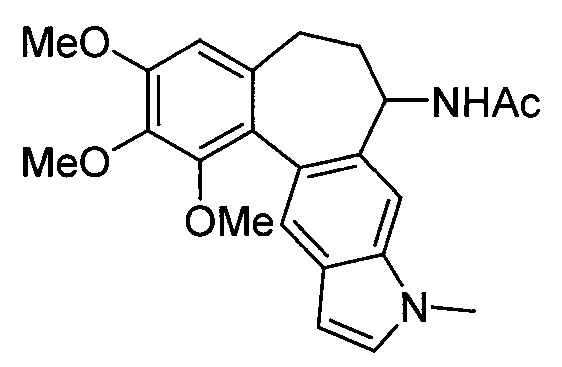
Известное индольное производное аллоколхицина представляет собой карбоциклическое соединение, содержащее конденсированное триметоксизамещенное бензольное кольцо, циклогептановое кольцо с ацетамидной группой и индольный фрагмент, обладает всеми вышеперечисленными недостатками.
Известно индольное производное аллоколхицина (Eur. J. Org. Chem., 2016, 5620-5623; Eur. J. Med. Chem., 2017, 141, 51-60, RU 2630303 C1), синтезированное из природного колхицина и представленное формулой:
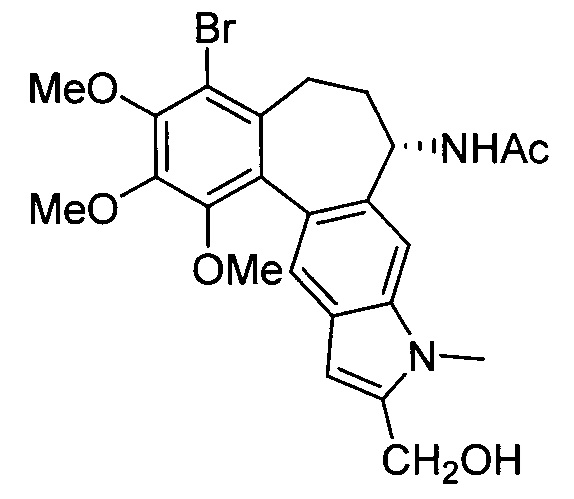
Известное индольное производное представляет собой конденсированное карбоциклическое соединение, содержащее монобромированное триметоксизамещенное бензольное кольцо, конденсированное с циклогептановым кольком, содержащим ацетамидный заместитель, и индольным ядром.
Известны фурановые производные аллоколхицина (RU 2593998 C1), представленные общей формулой:
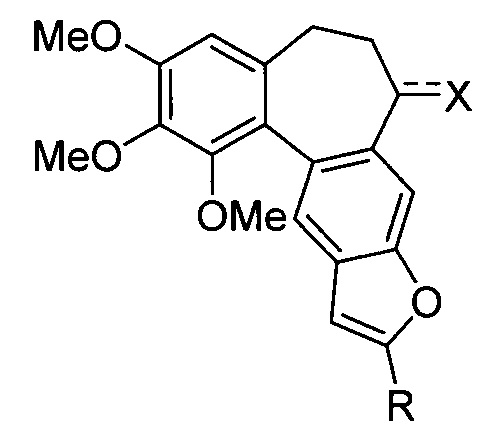
где Х=O, ОН, а заместитель R представляет собой группы -СН2ОН, -СН(СН3)ОН, -СН2СН2ОН, -СН2ОАс
Недостатками данных производных являются недостаточная противоопухолевая активность и высокая системная токсичность, сложность указанного в патентных и непатентных документах метода синтеза, а также ограничения для дальнейшей функционализации веществ.
Наиболее близкой по технической сущности и достигаемому результату к предлагаемой группе изобретений является группа изобретений «Производное N-((1S)-1',2',3'-триметокси-6,7-дигидро-1Н-бензо[5',6':5,4]циклогепта[3,2-f]бензофуран-1-ил) ацетамида и его применение», защищенная патентом RU 2538982 C1, опубл. 10.01.2015 г., кл. C07D 307/78, C07D 405/06, A61K 31/343, A61K 35/00 (Yu. V. Voitovich at al., J. Med. Chem. 2015, 58, 692).
Недостатком указанных соединений является недостаточная противоопухолевая активность в отношении многих клеточных линий, высокая системная токсичность для организма и неспособность к ковалентному взаимодействию с таргетным белком тубулином.
В задачу изобретения положено создание оптически чистых производных аллоколхицина с одним стереоцентром при ацетамидной группе и содержащих дигидрофурановый фрагмент, содержащий двойную углерод-углеродную экзо-связь в положении «3» гетероциклического фрагмента, а также создание оптически чистых производных аллоколхицина с одним стереоцентром при ацетамидной группе и содержащих пятичленный лактонный цикл, конденсированный с колхициновым скелетом, и двойную углерод-углеродную экзо-связь в положении «3» гетероциклического фрагмента, сопряженную с карбонильной группой лактона.
Технический результат от использования изобретения заключается в повышении способности взаимодействия соединения с внутриклеточным белком-мишенью, повышении апоптоз-индуцирующей активности и цитотоксичности в отношении многих типов раковых клеток посредством ковалентного связывания с группами, содержащими подвижный атом водорода, например, тиольными группами в составе остатков цистеина.
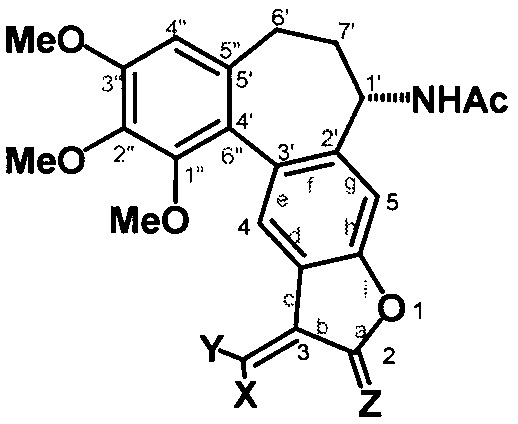
Это достигается тем, что производное 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана формулы:
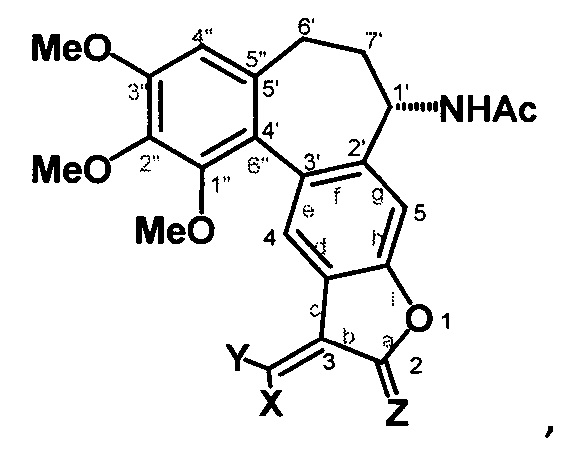
где X, Y, Z - заместители,
Х=Н; Me,
Y=H; Me; CF3; Cl,
Z=H, H, O,
При X=Y=H, Z=H, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-метиленбензофуран.
При X=Me, Y=H, Z=H, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-этилиденбензофуран.
При X=Y=Me, Z=H, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-(1-метил)этилиденбензофуран.
При X=Y=H, Z=O, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1H-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-метиленбензофуран-2-он.
При X=Y=Me, Z=O, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-(1-метил)-этилиденбензофуран-2-он.
При Х=Н, Y=Me, Z=O, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-этилиденбензофуран-2-он.
При Х=Н, Y=Cl, Z=O, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-хлорометиленбензофуран-2-он.
При Х=Н, Y=CF3, Z=O, H это 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидро-3-(2,2,2-трифтороэтилиден)-бензофуран-2-он.
Это достигается также тем, что производное 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана применяют в качестве активного компонента противоопухолевого лекарственного средства для лечения онкологических заболеваний.
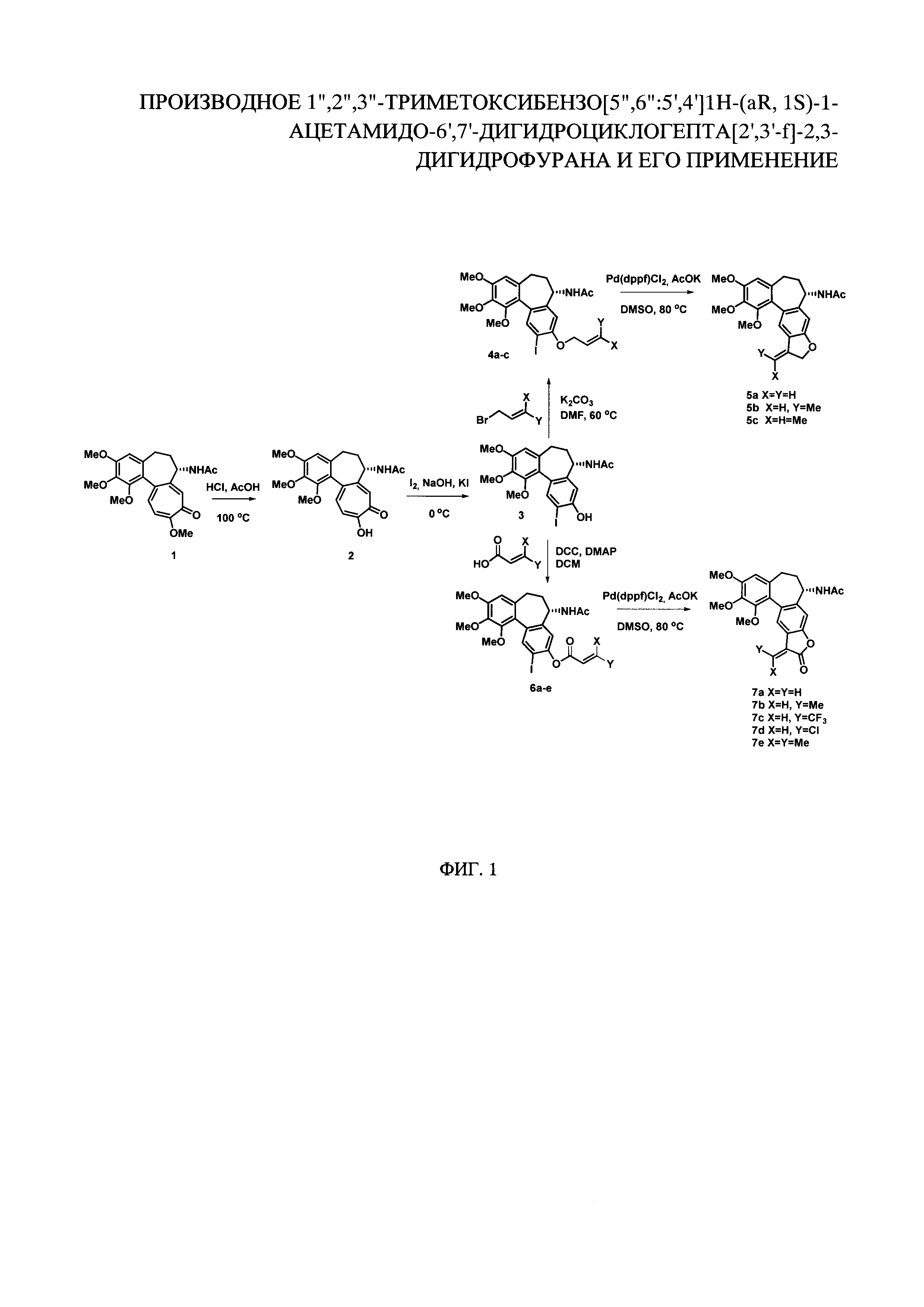
На фиг. 1 представлена схема получения производного 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана.
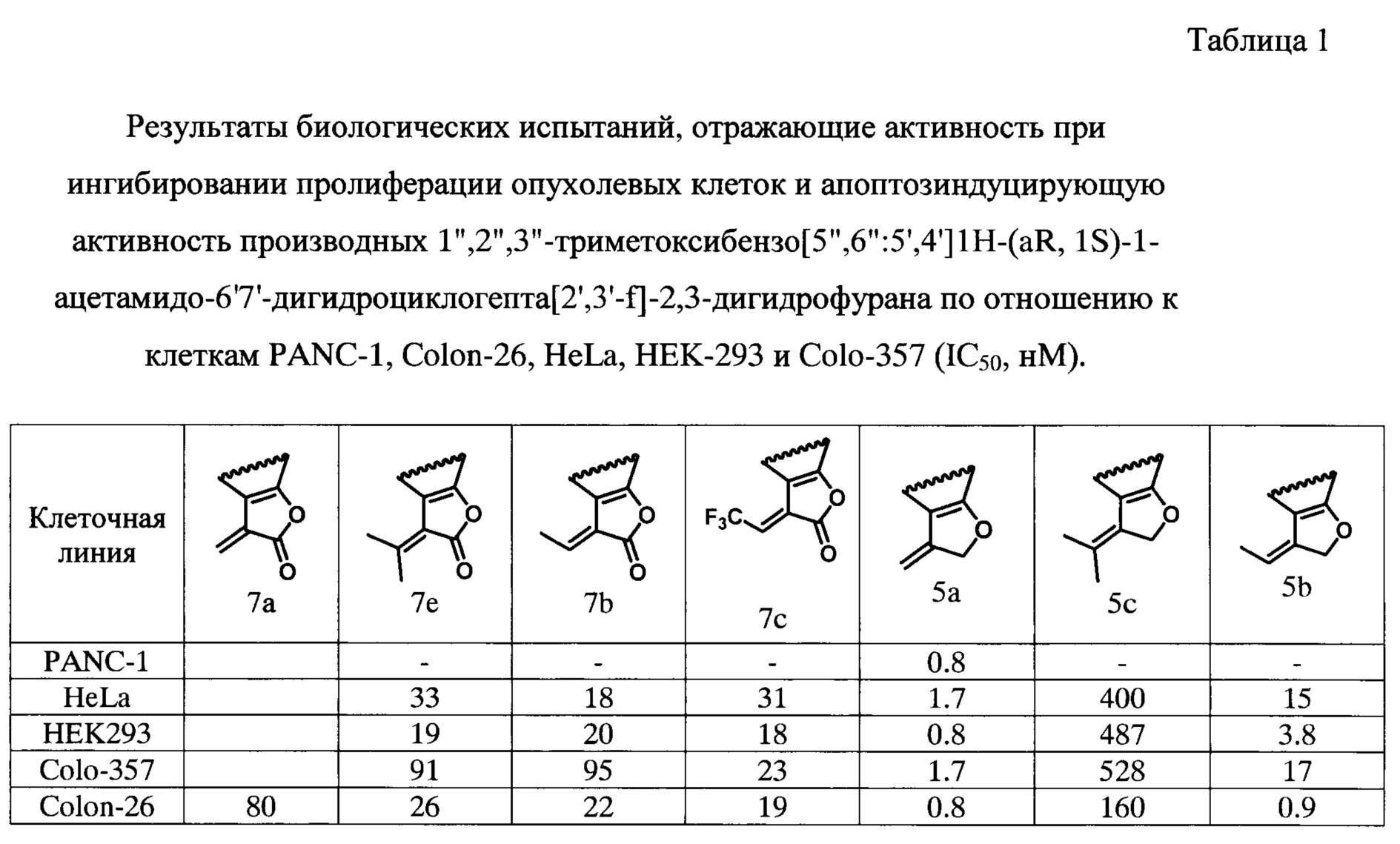
В Таблице 1 представлены результаты биологических испытаний, отражающие активность при ингибировании пролиферации опухолевых клеток производными 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана к клеткам НЕК, Colo, и Mia.
Получение производного 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана осуществляют следующим образом.
На первом этапе из колхицина синтезируют колхицеин. Для этого раствор колхицина (1.5 г, 3.75 ммоль) в 15 мл уксусной кислоты смешивают с 90 мл 0.1М раствора HCl. Полученную смесь перемешивают при 100°С в течение трех часов. Затем раствор охлаждают до комнатной температуры и добавляют Na2CO3 (тв.) до исчезновения запаха уксусной кислоты. Полученный желтый раствор экстрагируют CHCl3, органический слой промывают насыщенным раствором NaCl и сушат над Na2SO4. После упаривания растворителя и удаления всех летучих веществ в вакууме получают 1.42 г (3.63 ммоль, 98%) колхицеина в виде зеленоватой пены, который затем используют без дополнительной очистки.
1Н ЯМР (400 MHz, ДМСО) δ 8.63 (d, J=7.3 Hz, 1Н), 7.32 (d, 1H), 7.31 (s, 1H), 7.15 (d, J=11.8 Hz, 1H), 6.80 (s, 1H), 4.43-4.27 (m, 1H), 3.84 (s, 3H), 3.78 (s, 3H), 3.56 (s, 3H), 2.35-1.89 (m, 4H), 1.87 (s, 3H).
Тпл = 150°C. T пл. лит = 150°C.
Далее из колхицеина синтезируют иодо-колхинол. Для этого раствор колхицеина (1.42 г, 3.63 ммоль) в 29 мл воды охлаждают до 0°С, затем к раствору добавляют NaOH (1.45 г, 36.3 ммоль) с последующим добавлением по каплям раствора йода (2.82 г, 11.1 ммоль) и NaI (15.83 г, 85.1 ммоль) в 143 мл воды в течение часа. Полученный раствор перемешивают 90 минут при температуре 0-5°С. Затем полученный желто-коричневый раствор доводят до комнатной температуры и добавляют эквивалентное количество Na2SO3 для нейтрализации избытка йода, цвет раствора изменяется на оранжевый. После этого добавляли HCl (конц.) до рН=2, при этом выпадают желто-зеленые кристаллы, которые отделяют фильтрованием, промывают водой и сушат под вакуумом. Оставшийся маточный раствор трижды экстрагируют этилацетатом, органический слой промывают насыщенным раствором NaCl и сушат над сульфатом натрия. После упаривания растворителя полученные желтоватые кристаллы добавляют к кристаллам, выделенным ранее фильтрованием. После проведения колоночной хроматографии на силикагеле (элюент ПЭ/ЭА/EtOH 3:1:1) йод-колхинол получают в виде светло-желтого порошка (1.25 г, 2.6 ммоль, 70%).
1Н ЯМР (400 MHz, ДМСО) δ 10.28 (s, 1H), 8.38 (d, J=8.0 Hz, 1Н), 7.56 (s, 1H), 6.86 (s, 1H), 6.76 (s, 1H), 4.40-4.33 (m, 1H), 3.82 (s, 3H), 3.77 (s, 3H), 3.48 (s, 3H), 2.23-1.87 (m, 4H), 1.87 (s, 3Н). Тпл = 238°C. Тпл. лит = 238°C [12].
На следующем этапе синтезируют O-аллиловый эфир иод-колхинола. Для этого смесь иод-колхинола (1,00 г, 2,06 ммоль), аллилбромида (0,50 г, 4,12 ммоль) и карбоната калия (0,85 г, 6,18 ммоль) в N,N-диметилформамиде (15 мл) нагревают до 60°С и перемешивают в течение 15 ч, далее растворитель удаляют при пониженном давлении, а продукт выделяют с использованием колоночной хроматографии на силикагеле, элюент ПЭ/ЭА/EtOH 6:1:1. Аллиловый эфир иод-колхинола был получен в виде светло-бежевых кристаллов с выходом 73%.
Соединения 4b, 4с были синтезированы аналогично.
Соединение 4а.
1Н ЯМР (400 МГц, ДМСО-d6) 1Н NMR (400 MHz, dmso) δ 8.40 (d, J=8.5 Hz, 1H), 7.68 (s, 1H), 6.98 (s, 1H), 6.78 (s, 1H), 6.12-6.06 (m, 1H), 5.56 (d, J=17.2 Hz, 1H), 5.33 (d, J=10.5 Hz, 1H), 4.66 (br.s, 2H), 4.66-4.46 (m, 1H), 3.83 (s, 3H), 3.78 (s, 3H), 3.50 (s, 3H), 2.55-2.51 (m, 1H), 2.20-2.13 (m, 1H), 2.12-2.00 (m, 1H), 1.89 (s, 3H), 1.89-1.83 (m, 1H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.48, 155.69, 152.46, 150.15, 142.51, 140.51, 139.43, 134.82, 133.20, 128.32, 122.85, 117.55, 108.20, 107.79, 83.24, 69.13, 60.60, 60.55, 55.82, 48.16, 38.39, 30.00, 22.64.
Соединение 4b.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.40 (d, J=8.6 Hz, 1H), 7.66 (s, 1H), 6.95 (s, 1H), 6.78 (s, 1H), 5.95 (dt, J=13.0, 6.5 Hz, 1H), 5.77-5.68 (m, 1H), 4.58 (dd, J=3.0, 1.5 Hz, 2H), 4.48 (dt, J=12.1, 7.8 Hz, 1H), 3.83 (s, 3H), 3.77 (s, 3H), 3.50 (s, 3H), 2.56-2.51 (m, 1H), 2.21-2.11 (m, 1H), 2.10-2.00 (m, 1H), 1.90-1.88 (m, 3H), 1.88-1.81 (m, 1H), 1.77-1.72 (m, J=6.4, 1.2 Hz, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.42, 155.82, 152.44, 150.13, 142.43, 140.50, 139.42, 134.81, 129.89, 128.15, 125.95, 125.38, 122.88, 108.20, 107.79, 83.33, 69.03, 60.61, 60.54, 55.82, 48.14, 38.46, 22.63, 17.63.
Соединение 4c.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.39 (d, J=8.5 Hz, 1H), 7.65 (s, 1H), 6.96 (s, 1H), 6.78 (s, 1H), 5.47 (t, J=6.7 Hz, 1H), 4.62 (d, J=6.5 Hz, 2H), 4.48 (dt, J=12.0, 7.9 Hz, 1H), 3.83 (s, 3H), 3.77 (s, 3H), 3.50 (s, 3H), 2.16 (dt, J=12.1, 8.6 Hz, 1H), 2.10-2.01 (m, 1H), 1.88-1.80 (m, 1H), 1.77 (s, 3H), 1.76 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.47, 156.01, 152.44, 150.14, 142.46, 140.52, 139.42, 137.64, 134.83, 128.18, 122.91, 119.54, 108.21, 107.92, 83.57, 65.56, 60.61, 60.56, 55.83, 48.21, 38.36, 30.01, 25.50, 22.65, 18.16.
На последней стадии аллиловый эфир иод-колхинола вступал во внутримолекулярную реакцию Хека. В колбу Шленка поместили аллиловый эфир иод-колхинола (0,50 г, 0,95 ммоль), Pd(dppf)Cl2 (0,035 г, 0,05 ммоль) и ацетат калия (1,90 ммоль, 0,18 г), заполнили колбу аргоном и в инертной атмосфере прилили 15 мл диметилсульфоксида. Реакция протекала при 80°С в течение 10 часов. После окончания реакции в реакционную смесь добавляли воду и экстрагировали этилацетатом (3×50 мл), объединенный органический слой сушили над сульфатом натрия, растворитель удаляли при пониженном давлении. Продукт выделяли методом колоночной хроматографии на силикагеле с использованием элюента ПЭ/ЭА/этанол 7:1:1. Выход реакции составлял 86%, продукт выделяли в виде белых кристаллов, Т пл. = 198°С.
Соединения 5b, 5с были синтезированы аналогично.
Соединение 5а.
1Н ЯМР (400 МГц, ДМСО-d6) δ 8.37 (d, J=8.4 Hz, 1H), 7.41 (s, 1H), 6.86 (s, 1H), 6.77 (s, 1H), 5.46 (s, 1H), 5.14 (s, 2H), 5.02 (s, 1H), 4.51-4.43 (m, 1H), 3.83 (s, 3H), 3.79 (s, 3H), 3.48 (s, 3H), 2.19-1.99 (m, 3H), 1.87 (s, 3H), 1.85-1.78 (m, 1H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.38, 162.52, 152.19, 150.31, 143.89, 143.25, 140.56, 134.74, 126.57, 124.31, 123.61, 122.08, 108.03, 105.23, 99.63, 74.91, 60.55, 55.82, 48.50, 38.16, 29.94, 22.62.
Соединение 5b.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.38 (d, J=8.6 Hz, 1H), 7.64 (s, 1H), 6.94 (s, 1H), 6.73 (s, 1H), 5.71 (q, J=12.5, 1H), 4.61-4.52 (m, 2H), 4.48-4.45 (m, 1H), 3.81 (s, 3H), 3.76 (s, 3H), 3.48 (s, 3H), 2.14-2.00 (m, 4H), 1.87 (s, 3H), 1.72 (d, J=6.2 Hz, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.75, 159.16, 152.46, 150.75, 141.74, 140.99, 138.72, 135.20, 127.34, 126.56, 126.20, 125.06, 116.81, 108.51, 104.73, 76.19, 61.01, 60.95, 56.26, 48.69, 46.20, 38.94, 30.54, 23.08.
Соединения 5c.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.39 (d, J=8.5 Hz, 1H), 7.65 (s, 1H), 6.96 (s, 1H), 6.78 (s, 1H), 4.62 (d, J=6.5 Hz, 2H), 4.51-4.45 (m, 1H), 3.83 (s, 3H), 3.77 (s, 3H), 3.50 (s, 3H), 2.55-2.51 (m, 1H), 2.20-2.01 (m, 3H), 1.88 (s, 3H), 1.77 (s, 3H), 1.75 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.47, 156.01, 152.45, 150.15, 142.46, 140.52, 139.43, 137.65, 134.83, 128.18, 122.91, 119.55, 108.21, 107.93, 83.58, 65.57, 60.62, 60.56, 55.83, 48.21, 38.37, 30.01, 25.50, 22.65, 18.17.
Для соединений 7а-е предварительно были синтезированы сложные эфиры α, β-ненасыщенных карбоновых кислот и иодоколхинола. Для этого иодоколхинол (1 экв.), акриловую кислоту (1 экв.), 4-диметиламинопиридин (0,1 экв.) и дициклогексилкарбодиимид (1,2 экв.) перемешивали в дихлорметане в течение суток в атмосфере аргона. После окончания реакции растворитель удалили при пониженном давлении, продукт выделили с использованием колоночной хроматографии на силикагеле, элюент петролейный эфир - этилацетат - этанол 8-1-1. Сложный эфир иодоколхинола и акриловой кислоты был получен в виде серо-бежевых кристаллов с выходом 78%. Соединения 6b-е были синтезированы аналогично.
Соединение 6а.
1Н ЯМР (400 МГц, ДМСО-d6) δ 8.38 (d, J=8.5 Hz, 1H), 7.77 (s, 1H), 7.17 (s, 1H), 6.82 (s, 1Н), 6.64 (dd, J=17.2, 1.0 Hz, 1H), 6.48 (dd, J=17.2, 10.4 Hz, 1H), 6.25 (dd, J=10.4, 1.0 Hz, 1H), 4.50 (dt, J=12.0, 7.8 Hz, 1H), 3.85 (s, 3H), 3.79 (s, 3H), 3.56 (s, 3H), 2.59-2.52 (m, 1H), 2.23-2.13 (m, 1H), 2.13-2.05 (m, 1H), 1.94-1.87 (m, 1H), 1.86 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.50, 163.31, 152.99, 150.16, 149.71, 142.65, 140.48, 139.53, 134.90, 134.49, 133.64, 127.44, 122.15, 117.97, 108.22, 88.09, 60.78, 60.55, 55.86, 47.91, 38.30, 33.35, 22.64.
Соединение 6b.
1H ЯМР (400 МГц, ДМСО-d6) δ 7.75 (s, 1H), 7.22 (dd, J=15.4, 7.1 Hz, 1H), 7.13 (s, 1H), 6.82 (s, 1H), 6.21 (d, J=15.6 Hz, 1H), 4.49 (t, J=13.2 Hz, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.56 (s, 3H), 2.55 (dd, J=11.4, 5.8 Hz, 1H), 2.17 (d, J=6.0 Hz, 1H), 2.08 (dd, J=12.6, 6.9 Hz, 1H), 1.99 (d, J=6.8 Hz, 3H), 1.92-1.86 (m, 1H), 1.85 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.47, 163.34, 152.96, 150.15, 149.88, 148.80, 142.55, 140.48, 139.45, 134.89, 133.45, 122.19, 121.27, 118.05, 108.22, 88.30, 60.77, 60.54, 55.85, 47.88, 38.30, 29.85, 22.63, 18.06.
Соединение 6c.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.38 (d, J=8.2 Hz, 1H), 7.78 (s, 1H), 7.45 (dd, J=15.9, 6.7 Hz, 1H), 7.23 (s, 1H), 7.08 (dd, J=15.9, 2.1 Hz, 1H), 6.82 (s, 1H), 4.48 (dt, J=12.0, 7.7 Hz, 1H), 3.85 (s, 3H), 3.79 (s, 3H), 3.56 (s, 3H), 2.56 (dd, J=12.4, 5.4 Hz, 1H), 2.18 (dd, J=12.3, 6.4 Hz, 1H), 2.09 (dd, J=12.8, 6.7 Hz, 1H), 1.91 (dd, J=11.8, 6.9 Hz, 1H), 1.86 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.53, 161.53, 156.59, 153.04, 150.16, 149.41, 142.86, 140.48, 139.61, 134.91, 134.01, 132.69, 128.88, 122.07, 117.80, 108.22, 87.82, 60.78, 60.55, 55.86, 48.05, 33.35, 25.32, 22.64.
Соединение 6d.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.39 (d, J=8.4 Hz, 1H), 8.02 (d, J=13.4 Hz, 1H), 7.77 (s, 1H), 7.17 (s, 1H), 6.82 (s, 1H), 6.79 (d, J=13.4 Hz, 1H), 4.48 (dt, J=12.1, 7.8 Hz, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.56 (s, 3H), 2.55 (dd, J=12.8, 5.6 Hz, 1H), 2.24-2.14 (m, 1H), 2.11-2.03 (m, 1H), 1.89 (dd, J=11.5, 6.6 Hz, 1H), 1.86 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.50, 161.28, 156.59, 153.01, 150.15, 149.50, 142.72, 141.14, 140.48, 139.54, 134.90, 133.79, 123.93, 122.11, 117.97, 108.23, 88.11, 60.77, 60.55, 55.86, 47.49, 33.35, 25.32.
Соединение 6е.
1H ЯМР (400 МГц, ДМСО-d6) 8.37 (d, J=8.5 Hz, 1Н), 7.75 (s, 1H), 7.11 (s, 1H), 6.81 (s, 1H), 6.05 (s, 1H), 4.50 (dt, J=15.5, 7.8 Hz, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.55 (s, 3H), 2.55 (dd, J=12.7, 5.5 Hz, 1H), 2.20 (s, 3H), 2.16 (dd, J=12.3, 6.5 Hz, 1H), 2.08 (dd, J=12.7, 6.9 Hz, 1H), 2.02 (s, 3H), 1.89 (dd, J=8.1, 4.0 Hz, 1H), 1.85 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.46, 163.32, 161.62, 152.93, 150.16, 149.92, 142.46, 140.48, 139.39, 134.89, 133.30, 122.25, 118.16, 114.35, 108.22, 88.62, 60.76, 60.54, 55.85, 47.86, 47.49, 33.35, 27.14, 25.32, 24.46.
На последней стадии был сформирован лактонный фрагмент по реакции Хека. Для этого сложный эфир, полученный на предыдущей стадии (1 экв.), смешивали с хлоридом (дифенилфосфиноферроцен)палладия(II) (0.05 экв.) и ацетатом калия (3 экв.). Реакцию проводили в диметилсульфоксиде при 80°С в атмосфере аргона. После окончания реакции в смесь добавили дистиллированную воду, проэкстагировали этилацетатом, органический слой высушили над сульфатом натрия, растворитель удалили при пониженном давлении, продукт выделили методом колоночной хроматографии на силикагеле, элюент петролейный эфир - этилацетат - этанол 10-1-1.
Соединение 7а.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.38 (d, J=8.4 Hz, 1Н), 7.74 (s, 1H), 7.55 (d, J=4.2 Hz, 1H), 7.49 (d, J=4.1 Hz, 1H), 7.12 (s, 1H), 6.81 (s, 1H), 4.50-4.44 (m, J=10.8 Hz, 1H), 3.84 (s, 3H), 3.79 (s, 3H), 3.56 (s, 3H), 2.58-2.54 (m, 1H), 2.22-2.14 (m, 1H), 2.09-2.03 (m, 1H), 1.93-1.87 (m, 1H), 1.86 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.47, 152.97, 150.15, 149.99, 142.61, 140.47, 139.46, 134.89, 133.50, 130.71, 130.61, 128.54, 128.42, 122.17, 118.02, 108.20, 88.29, 60.78, 60.54, 55.86, 47.93, 39.52, 33.35, 29.83, 22.64, 21.01.
Соединения 7b-e были синтезировано аналогично. В случае соединения 7d вместо ацетата калия был использован триэтиламин.
Соединение 7b.
1H ЯМР (400 МГц, ДМСО-d6) δ 10.28 (s, 1Н), 8.38 (d, J=8.0 Hz, 1Н), 7.55 (s, 1H), 6.86 (s, 1H), 6.76 (s, 1H), 4.42-4.33 (m, 1H), 3.82 (s, 3H), 3.77 (s, 3H), 3.48 (s, 3H), 2.54 (s, 3H), 2.17-1.96 (m, 3H), 1.95-1.88 (m, J=10.9, 5.6 Hz, 1H), 1.86 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.31, 155.63, 152.21, 150.17, 142.41, 140.51, 139.17, 134.77, 126.59, 123.24, 110.05, 108.07, 81.42, 71.88, 69.78, 65.92, 62.78, 60.55, 60.52, 55.82, 48.23, 37.91, 29.98, 22.62.
Соединение 7c.
1H ЯМР (400 МГц, ДМСО-d6) δ 10.27 (s, 1Н), 8.36 (d, J=8.0 Hz, 1H), 7.54 (s, 1H), 6.84 (s, 1H), 6.74 (s, 1H), 4.40-4.29 (m, 1H), 3.80 (s, 3H), 3.75 (s, 3H), 3.46 (s, 3H), 2.20-1.95 (m, 2H), 1.94-1.85 (m, 1H), 1.85 (s, 3H).
13С ЯМР (101 МГц, ДМСО-d6) δ 168.31, 156.63, 155.94, 155.63, 152.21, 150.16, 142.41, 140.51, 139.17, 138.65, 134.77, 126.59, 123.24, 110.05, 108.07, 81.42, 60.55, 60.52, 55.82, 48.23, 40.43, 37.90, 29.97, 22.62.
Соединение 7d.
1Н ЯМР (400 МГц, ДМСО-d6) δ 10.29 (s, 1H), 7.62 (d, J=12.9 Hz, 1H), 7.56 (s, 1H), 6.87 (s, 1H), 6.76 (s, 1H), 4.40-4.34 (m, J=12.7, 6.7 Hz, 1H), 3.82 (s, 3H), 3.77 (s, 3H), 3.48 (s, 3H), 2.56-2.54 (m, J=5.7 Hz, 1H), 2.12-2.06 (m, J=12.1, 5.9 Hz, 3H), 1.87 (s, 3H).
Соединение 7e.
1H ЯМР (400 МГц, ДМСО-d6) δ 8.38 (d, J=8.1 Hz, 1H), 7.55 (s, 1H), 6.87 (s, 1H), 6.76 (s, 1H), 4.41-4.32 (m, J=7.1 Hz, 1H), 3.82 (s, 3H), 3.77 (s, 3H), 3.48 (s, 3H), 2.54 (s, 3H), 2.50 (s, 3H), 2.20-2.01 (m, J=6.5 Hz, 4H), 1.87 (s, 3H).
13C ЯМР (101 МГц, ДМСО-d6) δ 168.35, 155.65, 152.22, 150.17, 142.41, 140.52, 139.18, 134.78, 126.60, 123.25, 112.90, 110.07, 108.08, 81.43, 62.79, 60.56, 60.54, 60.40, 55.82, 48.25, 37.91, 29.98, 22.68, 22.63.
Биологические испытания.
Заявляемые производные 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6',7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана было испытаны с целью определения их активности при ингибировании пролиферации опухолевых клеток.
Цитотоксичность заявленных соединений была определена при помощи стандартного теста с 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразол бромидом (МТТ, Sigma). Были приготовлены серии растворов указанных соединений с концентрациями от 10 мкмоль до 0,1 пмоль. Данные растворы перенесли в планшет 100 мкл к испытуемыми клетками. Необработанные клетки использовались в качестве контрольной группы. Клетки инкубировали в течение 72 часов. В последние 6 часов 250 мкг/мл МТТ были добавлены на каждые 10 мкл к каждой из лунок. После выдерживания, питательная среда была удалена и 100 мкл диметилсульфоксида добавляли в каждую лунку. Клетки выдерживали 15 минут для растворения формазана. Оптическую плотность (OD) определяли на спектрофотометре Titertek (UK) при 540 нм. Цитотоксичность, при которой обнаруживалось 50% мертвых клеток (IC50) рассчитывали по кривым титрования. Ингибирование пролиферации (индекс ингибирования, II) рассчитывали как [1 - (OD экспериментальная/OD контроль)], где OD - оптическая плотность МТТ. Для анализа активности производных использовали клетки линиях PANC-1 (панкреатическая аденокарцинома), Colon 26 (колоректальная карцинома мыши), HeLa (эпителиальная аденокарцинома), HEK293 (почечный эпителий человека) и COLO357 (метастатическая аденокарцинома поджелудочной железы человека). Набор линий различного происхождения и из разных организмов позволяет исключить случайные эффекты, когда какая-то из линий оказывается более резистентной к препаратам.
Полученные данные демонстрируют, что заявляемое производное 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6'7'-дигидроциклогепта[2',3'-1]-2,3-дигидрофурана обладает более высокими значениями активности при ингибировании пролиферации опухолевых клеток по сравнению с прототипам - фурановым и индольным аналогом аллоколхицина.
Заявляемые производные 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6'7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана могут быть использованы для лечения онкологических заболеваний, связанных с неоваскуляризацией новообразований. Это относится, в частности, к солидным (твердым) опухолям типа карцином и аденокарцином молочной железы, раку легких и т.д. Кроме того, они могут применяться в терапии в сочетании с другими химиотерапевтическими препаратами, а также после хирургических операций и при облучении.
Применение предложенного производного 1'',2'',3''-триметоксибензо[5'',6'':5',4']1Н-(aR, 1S)-1-ацетамидо-6'7'-дигидроциклогепта[2',3'-f]-2,3-дигидрофурана в качестве активного компонента лекарственного средства для лечения онкологических заболеваний обеспечивает повышение активности при ингибировании пролиферации опухолевых клеток за счет эффективного встраивания в каталитическую нишу тубулина.