Результат интеллектуальной деятельности: Производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR, 1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-f]-1Н-индола и его применение
Вид РИД
Изобретение
Настоящее изобретение относится к области органической химии, к гетероциклическим соединениям, содержащим пятичленные кольца, конденсированные с другими ядрами, с одним атомом азота в качестве гетероатома, а именно к индолам, только с атомами водорода или радикалами, содержащими только атомы водорода и углерода, непосредственно связанные с атомами углерода гетероциклического кольца, с замещенными углеводородными радикалами, связанными с атомами углерода гетероциклического кольца, касается производного 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-индола и его применения в качестве активного компонента противоопухолевых лекарственных средств для лечения онкологических заболеваний.
В настоящее время онкологические заболевания являются одной из основных причин смерти во всем мире. В 2007 году зарегистрировано 7,9 миллиона случаев смерти от этой болезни. По прогнозам, число случаев смерти от онкологических заболеваний в мире будет продолжать расти и в 2030 году достигнет 12 миллионов. В связи с этим, синтез новых соединений и создание на их основе противоопухолевых препаратов, обладающих улучшенными фармакокинетическими свойствами, является актуальной задачей здравоохранения.
Известны химические соединения, противоопухолевое действие которых заключается в ингибировании митоза активно пролиферирующих опухолевых клеток.
Цитотоксическая и противоопухолевая активность известных антимитотических соединений обусловлена нарушением обратимости процесса полимеризации и деполимеризации белковых молекул α- и β-тубулина, что приводит к нарушению формирования митотического веретена, образование которого предшествует делению клетки (Biochem. Pharmacol., 1976, 25, 138).
Известно достаточно большое количество химических соединений, обладающих цитотоксической активностью по отношению ко многим видам опухолевых клеток. К таким соединениям относятся алкалоиды ряда колхицина, комбретастатин А-4 и его производные, 4-арилкумарины, а также индольные производные аллоколхицина. Однако, каждый из них имеет недостатки.
Недостатком комбретастатина А-4 (US 4996237 A, кл. С07С 43/23, C07D 317/64, A61K 31/075, опубл. 1991.02.26) и его производных (US 2009186857 A, кл. A61K 31/66, опубл. 2009.07.23,) является низкая эффективность за счет нежелательных побочных эффектов при применении in vivo вследствие их самопроизвольного превращения из активной цис-формы в неактивную транс-форму (Curr. Opin. Pharmacol., 2001, 7, 370). 4-арилкумарины проявляют низкую антипролиферацинную и апоптозиндуцирующую активность по сравнению с производными комбретастатина и колхицина [J. Med. Chem. 2003, 46, 5437; J. Med. Chem. 2011, 54, 3153].
Известны, например, колхицин и его производные из патентных документов: WO 2011022805 (A1), кл. А61K 31/165, А61Р 35/00, С07С 233/32, опубл. 2011.03.03 г.; WO 2010105172 (A1), кл. A01N 37/18, А61K 31/16, опубл. 2010.09.16 г.; EP 2056812 А1, кл. А61K 31/165, А61Р 35/04, опубл. 2009.05.13 г.; US 2004204370 A1, кл. С07С 323/41, С07С323/42, С07С 323/60, опубл. 2004.10.14 г.
Известны соединения с колхициновым скелетом для получения лекарственнных препаратов с противоопухолевой активностью (RU 99100326 А, кл. С07С 49/755, С07С 323/22, C07D 265/34, А61K 31/12, А61Р 35/00, опубл. 20.11.2000 г.).
Известны производные колхицина, которые проявляют противоопухолевую и антипролиферативную активность (RU 2181354 C2, кл. С07С 49/755, C07D 265/36, А61K 31/1222, А61K 31/165, А61Р 35/00, опубл. 20.04.02 г.).
Известны производные N-деацитилтиоколхицина, которые обладают антипролиферативной активностью (RU 2257379 C2, кл. С07С 323/41, С07С 323/44, А61K 31/165, А61K 31/17, А61Р 35/00, А61Р 19/02, опубл. 27.07.05 г.).
Недостатком колхицина и его производных является возникновение побочных эффектов при их применении, в частности, значительная неспецифическая токсичность (Med. Res. Rev. 2008, 28, 155-183; Chem. Nat. Prod. 1998, 34, 343), что делает невозможным их использование в качестве противоопухолевых препаратов.
Известны производные индола, используемые в качестве ингибитора тирозинкиназы и противоопухолевого средства (RU 2155187 C2, кл. C07D 209/30, C07D 209/42, А61K 31/40, А61K 31/44, А61Р 35/00, опубл. 27.08.2000 г.)
Известно соединение 4-(1-(4-(4-метоксифенилтио)-2,5-диоксо-2,5-дигидро-1Н-пирро-3-ил)-1Н-индол-3-ил)бутилкарбамимидотиоат, содержащий 1Н-индольный фрагмент, для использования в терапии рака толстой кишки, молочной железы, меланомы, лейкоза (RU 2441000, кл. C07D 403/04, A61P 35/00, опубл. 27.01.12 г.).
Известно индольное производное аллоколхицина (N.S. Sitnikjov et al., Chem. Eur. J. 2012,18,12096), представленное формулой:
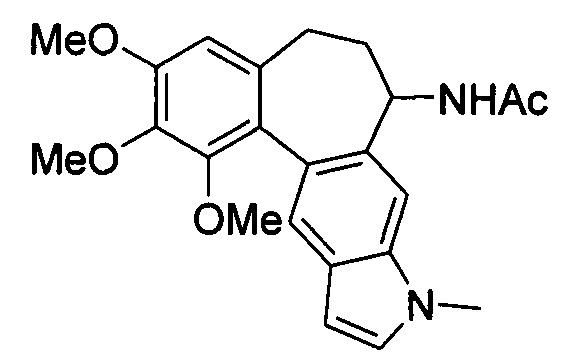
Известное индольное производное аллоколхицина представляет собой карбоциклическое соединение, содержащее конденсированное триметоксизамещенное бензольное кольцо, циклогептановое кольцо с ацетамидной группой и индольный фрагмент, обладает всеми вышеперечисленными недостатками.
Недостатками данных производных являются более низкая противоопухолевая активность и высокая системная токсичность, сложность указанного в патентных и непатентных документах метода синтеза, а также ограничения для дальнейшей функционализации веществ.
Наиболее близкими аналогами к предлагаемому изобретению являются антимитотические противоопухолевые агенты - структурные аналоги аллоколхицина: 1',2',3'-триметоксибензо[4',5':4,5]1Н-6,7-дигидроциклогепта-[2,3-е или 2,3-f или 3,2-f]1H-1''-метилиндолы и 1',2',3'-триметоксибензо[4',5':4,5]1Н-6,7-дигидроциклогепта[2,3-b]1Н-индолы, содержащие 1Н-индольный фармакофорный фрагмент (автореферат диссертации на соискание ученой степени кандидата химических наук Н.С. Ситникова «Методологии синтеза антимитотических противоопухолевых агентов колхицинового ряда», 2012 г., RU 2500671 C1, кл. C07D 209/56, А61Р 35/00, опубл. 10.12.13 г.). 1',2',3'-триметоксибензо[4',5':4,5]1Н-6,7-дигидро-1-гидроксициклогепта[2,3-е]1Н-1''-метилиндол ингибирует фазу G2/M клеточного цикла и индуцирует апоптоз нескольких штаммов клеток хронического лимфолейкоза в наномолярном интервале концентраций. Производные 1',2',3'-триметоксибензо[4',5':4,5]-6,7-дигидроциклогепта-[3,2-f]-1Н-1-метилиндола, имеют сходную с предлагаемым изобретением химическую структуру, одинаковый гетероциклический фрагмент и предназначены для использования в противоопухолевой терапии по одному и тому же механизму.
Недостатком указанных соединений является менее высокая противоопухолевая активность и способность связывания с таргетным белком из-за невозможности синтезировать их по разработанным в литературе схемам в этантиомерно чистом виде, так как второй энантиомер не способен взаимодействовать с каталитической нишей тубулина и блокировать митоз. Кроме того, указанные аналоги в отличие от предложенных в заявке соединений не содержали заместителей, позволяющих проводить функционализацию полученных веществ для создания их биологически доступных (липофильных и гидрофильных) форм.
В задачу изобретения положено создание оптически чистых производных аллоколхицина с одним стереоцентром при ацетамидной группе и содержащих 1Н-индольный фрагмент.
Технический результат от использования изобретения заключается в повышении способности взаимодействия соединения с внутриклеточным белком-мишенью, повышении апоптозиндуцирующей активности и активности при ингибировании пролиферации опухолевых клеток, а также в возможности создания биологически доступных (липофильных и гидрофильных) форм веществ с использованием разнообразных заместителей в гетероциклическом фрагменте.
Это достигается тем, что новое соединение, представляет собой производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ)-1Н-индола общей формулы:
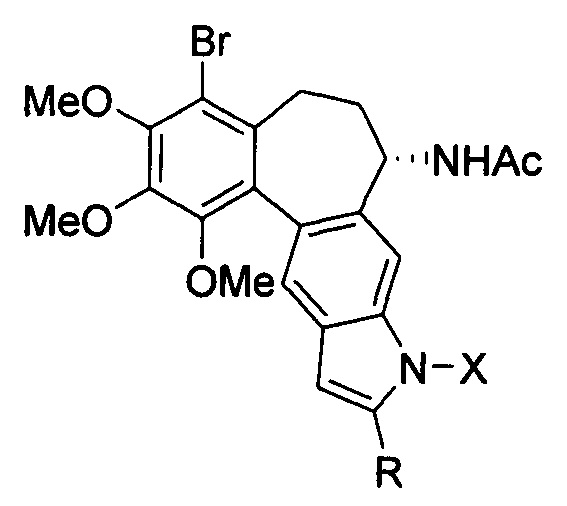
где X - заместитель, X=Н, Me; R - заместитель, R=Ph, CH2ОН, CH(CH3)ОН, CH2СН2ОН, CH2OAc; при X=Н, R=Ph, производное представляет собой 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-2-фенилиндол; при X=Н, R=CH2OH, производное представляет собой 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ)-1Н-2-гидроксиметилиндол; при X=Н, R=СН(CH3)OH, производное представляет собой 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-2-(1-гидроксиэтил)индол; при X=Н, R=СН2СН2ОН, производное представляет собой 1'-бpoмo-2',3',4'-тpимeтoкcибeнзo[5',6':4,5]-(aR,1S)-1-aцeтaмидo-6,7-дигидpoциклoгeптa-[3,4-ƒ]-lH-2-(2-гидpoкcиэти)линдол; при X=Н, R=CH2ОАс, производное представляет собой 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-2-ацетоксиметиллиндол; при X=Me, R=СН2ОН, производное представляет собой 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-1-метил-2-гидроксиметилиндол.
Это достигается также тем, что производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-индола применяют в качестве активного компонента противоопухолевого лекарственного средства для лечения онкологических заболеваний.
На фиг. 1 представлена общая схема получения производного 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-индола, в котором группа R соответствует Ph, СН2ОН, СН(СН3)ОН, СН2СН2ОН, СН2ОАс, а группа X соответствует Н или Me.
На фиг. 2 представлена Таблица 1 «Результаты биологических испытаний, отражающие активность при ингибировании пролиферации опухолевых клеток производными 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-индола по отношению к клеткам НЕК, Colo, и Mia».
На фиг. 1-2:
1a - 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ]-1Н-индол, в котором группа X соответствует водороду, a R соответствует фенильной группе;
1b - 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ]-1H-индол, в котором группа X соответствует водороду, a R соответствует гидроксиметильной группе,
1с - 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1-ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ)-1Н-индол, в котором группа X соответствует водороду, a R соответствует 1-гидроксиэтильной группе,
1d - 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ]-1Н-индол, в котором группа X соответствует водороду, a R соответствует 2-гидроксиэтильной группе;
1e - 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ]-1Н-индол, в котором группа X соответствует водороду, a R соответствует ацетоксиметильной группе;
1f - 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ]-1Н-индол, в котором группа X соответствует метилу, a R соответствует гидроксиметильной группе.
Получение производных 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ]-1Н-индола осуществляют следующим образом.
Сначала синтезируют 4-бромоколхицин. В колбу Шленка помещали 1000 мг (2,5 ммоль) колхицина 1, 492 мг (1,2 ммоль) N-бромсукцинимида, заполняли шленк аргоном. Добавили 10 мл смеси (8 мл трифторуксусной кислоты + 2 мл уксусной кислоты), перемешивали при комнатной температуре в течение 4 ч. После завершения реакции в смесь добавляли 200 мг Na2SO3, добавляли 2,5 Н раствор NaOH до достижения рН=6-7. Проводили экстракцию этилацетатом (70 мл*5), промывали насыщенным раствором NaCl, сушили над Na2SO4. Растворитель удаляли при пониженном давлении. Выход 95% (1032 мг). Полученный продукт - желто-зеленые кристаллы, Тпл=126-128°С. 1Н ЯМР (400 МГц, ДМСО-d6): δ 8.63 (д, J=7.2 Гц, 1Н, NHAc), 7.13 (с, 1Н, С8-Н), 7.10 (д, J=10.8 Гц, 1H, С12-Н), 7.02 (д, J=10.8 Гц, 1H, С11-Н), 4.25-4.19 (м, 1Н, С7-Н), 3.90 (с, 3Н, ОМе), 3.89 (с, 3Н, ОМе), 3.85 (с, 3Н, ОМе), 3.53 (с, 3Н, ОМе), 3.11-3.09 (м, 1Н, С5-Н), 2.23-2.14 (м, 1H, С5-Н), 1.99-1.91 (м, 1Н, С6-Н), 1.86 (с, 3Н, NHC(O)CH3), 1.82-1.76 (м, 1Н, С6-Н). 13С ЯМР (101 МГц, ДМСО-d6) δ 178.0, 168.7, 164.0, 150.3, 150.1, 149.9, 146.0, 134.8, 134.0, 133.1, 130.3, 130.2, 112.4, 111.8, 61.3, 60.8, 60.7, 56.1, 51.2, 33.8, 28.77, 22.4. Масс-спектр: 391.96 (100%), 389.96 (93%), 376.93 (41%), 374.95 (33%), 476.97 (30%), 477.98 (28%).
Затем синтезируют 4-бромоаллоколхициновую кислоту. В колбу Шленка поместили 816 мг (17 экв., 35,5 ммоль) металлического натрия и порционно добавляли к нему безводный метанол в атмосфере аргона при 0°C до полного растворения натрия. Полученный раствор метилата натрия в метаноле по каплям добавляли к 4-бромколхицину (1 г, 1 экв., 2,08 ммоль) в инертной атмосфере. Смесь перемешивали при 60°C в течение 6 часов, после чего растворитель удаляли при пониженном давлении, а к остатку добавляли 10 мл концентрированной соляной кислоты. Полученный раствор экстрагировали этилацетатом (70 мл*4), промывали насыщенным раствором хлорида натрия, сушили над Na2SO4. Продукт получили в виде желто-зеленых кристаллов с выходом 95% (947 мг.) Тпл=188°C. 1H ЯМР (400 МГц, ДМСО-d6): δ 13.06 (с, 1Н, СООН), 8.62 (д, J=8.1 Гц, 1Н, NHAc), 7.97 (с, 1H, С8-Н), 7.91 (д, J=8.0 Гц, 1Н, С10-Н), 7.46 (д, J =8.0 Гц, 1Н, C11-H), 4.49-4.42 (м, 1Н, С7-Н), 3.90 (с, 3Н, ОМе), 3.87 (с, 3Н, ОМе), 3.50 (с, 3Н, ОМе), 3.08-3.04 (м, 1H, С5-Н), 2.15-2.07 (м, 1Н, С5-Н), 1.98-1.93 (м, 1Н, С6-Н), 1.90 (с, 3Н, NHC(O)CH3), 1.89-1.81 (м, 1Н, С6-Н). 13С ЯМР (101 МГц, ДМСО-d6): δ 179.4, 168.6, 150.4, 150.0, 145.8, 140.5, 137.6, 133.7, 130.6, 129.8, 128.4, 127.2, 124.1, 112.9, 61.2, 60.8, 60.7, 48.1, 36.5, 29.5, 22.6. Масс-спектр: 405.93 (100%), 403.94 (97%), 464.92 (60%), 462.91 (59%), 390.92 (30%), 388.93 (28%), 406.90 (26%), 404.91 (25%).
Далее получали ацилазид 4-бромоаллоколхициновой кислоты. В колбу Шленка помещали 750 мг (1,56 ммоль, 1 экв.) 4-бромаллоколхициновой кислоты, 611 мг (9,4 ммоль, 6 экв.) азида натрия, 2,72 г (12,48 ммоль, 8 экв.) ди-трет.-бутилдикарбоната, заполнили шленк аргоном. В инертной атмосфере прилили 20 мл сухого тетрагидрофурана. Реакцию проводили при комнатной температуре в течение 24 часов. После окончания реакции смесь отфильтровали на фильтре Шотта, растворитель удалили при пониженном давлении, остаток растворили в минимальном количестве дихлорметана и выделили методом колоночной хроматографии, элюент PE-EtOAc-EtOH 8:1:1. Продукт получили в виде бело-желтых кристаллов с выходом 87% (700 мг.) Тпл=99°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 8.65 (д, J=8.0 Гц, 1Н, NHAc), 7.98 (с, 1Н, С8-Н), 7.94 (д, J=8.1 Гц, 1Н, С10-Н), 7.54 (д, J=8.0 Гц, 1Н, С11-Н), 4.48-4.42 (м, 1Н, С7-Н), 3.91 (с, 3Н, ОМе), 3.88 (с, 3Н, ОМе), 3.51 (с, 3Н, ОМе), 3.09-3.05 (м, 2Н, С5-Н), 2.15-2.09 (м, 2Н, С6-Н), 1.91 (с, 3Н, NHC(O)CH3). 13С ЯМР (101 МГц, ДМСО-d6): δ 171.7, 168.7, 150.7, 150.0, 145.8, 141.3, 139.8, 133.6, 130.4, 129.5, 127.9, 127.0, 123.8, 113.0, 61.1, 60.8, 60.7, 48.1, 36.3, 29.4, 27.1. Масс-спектр: 402.97 (100%), 400.97 (95%), 463.98 (83%), 461.97 (81%), 403.97 (50%), 405.97 (31%), 462.97 (34%), 464.99 (16%), 491.02 (5%), 489.03 (4%).
Затем синтезировали (аR,5S)-N-(3-трет.-бутилкарбамат-8-бромо-9,10,11-триметокси-6,7-дигидро-5H-дибензо[а,с]циклогептен-5-ил)ацетамид. В колбу Шленка поместили 1,6 г (1 экв., 3,17 ммоль) азида 4-бромаллоколхициновой кислоты, 4,15 г (6 экв., 19 ммоль) дитрет.-бутилдикарбоната, откачали воздух, заполнили аргоном. В колбу прилили 20 мл трет.бутиловый спирт. Реакция проходила при 85°C в течение 48 часов. После этого реакционную смесь охладили до комнатной температуры, растворитель удалили при пониженном давлении, продукт выделили методом колоночной хроматографии на силикагеле, элюент PE-EtOAc-EtOH 10:1:1 в виде белых кристаллов. Т пл.=105-106°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 9.44 (с, 1Н, NHBoc), 8.43 (д, J=7.9 Гц, 1Н, NHAc), 7.50 (с, 1H, С8-Н), 7.38 (д, J=8.4 Гц, 1Н, С10-Н), 7.22 (д, J=8.4 Гц, 1Н, С11-Н), 4.36-4.29 (м, 1Н, С7-Н), 3.88 (с, 3Н, ОМе), 3.84 (с, 3Н, ОМе), 3.44 (с, 3Н, ОМе), 3.05-3.02 (м, 1Н, С5-Н), 2.08-1.98 (m, 3Н, С5-Н, С6-Н), 1.88 (с, 3Н, NHC(O)CH3), 1.49 (с, 9Н, OBut). 13С ЯМР (101 МГц, ДМСО-d6): 168.5, 152.8, 150.0, 149.5, 145.8, 140.8, 139.3, 133.7, 129.6, 129.3, 126.7, 115.9, 112.9, 112.6, 79.0, 61.1, 60.7, 60.4, 48.4, 40.4, 36.3, 29.6, 28.1. Масс-спектр: 435.1 (100%), 437.1 (92%), 436.1 (88%), 434.2 (74%), 419.1 (49%), 421.1 (56%), 464.1 (40%), 465.2 (36%), 534.1 (42%), 536.2 (40%), 480.1 (30%), 478.0 (29%). Далее синтезировали (аR,5S)-N-(3-амино-8-бромо-9,10,11-триметокси-6,7-дигидро-5H-дибензо[а,с]циклогептен-5-ил)ацетамид. В колбу Шленка поместили 2 г N-Boc-защищенного амина в атмосфере аргона добавили 25 мл сухого дихлорметана и 5,5 мл концентрированной соляной кислоты. Реакцию проводили при комнатной температуре в течение 0,5 часов, после этого растворитель удалили при пониженном давлении, прилили 10 мл дистиллированной воды и добавили 2,5 М NaOH до рН=8. Полученный раствор экстрагировали этилацетатом (20 мл*5), промыли насыщенным раствором NaCl, высушили над Na2SO4. Продукт очищали перекристаллизацией из этилацетата с добавлением 15% петролейного эфира. Выделили продукт в виде желто-серых кристаллов массой 894 мг (55%), Тпл=230°С. 1Н ЯМР (400 МГц, ДМСО-d6) δ 8.43 (д, J=8.0 Гц, 1Н, NHAc), 7.00 (д, J=8.0 Гц, 1H, С8-Н), 6.55 (с, 1H, С11-Н), 6.51 (д, J=7.9 Гц, 1Н, С10-Н), 5.23 (с, 2Н, NH2), 4.35-4.24 (м, 1Н, С7-Н), 3.86 (с, 3Н, ОМе), 3.82 (с, 3Н, ОМе), 3.44 (с, 3Н, ОМе), 3.04-2.99 (м, 1Н, С5-Н), 2.13-1.99 (м, 3Н, С5-Н, С6-Н), 1.88 (с, 3Н, NHC(O)CH3). 13С ЯМР (101 МГц, ДМСО-d6): δ 168.4, 150.0, 148.8, 148.5, 145.7, 140.9, 133.7, 130.4, 130.0, 120.4, 112.5, 111.7, 108.6, 61.1, 60.8, 60.3, 48.2, 36.8, 29.9, 22.7. Масс-спектр: 433.96 (100%), 435.97 (98%), 376.96 (46%), 374.95 (43%), 361.92 (34%), 363.91 (31%).
На следующем этапе синтезировали (аR,5S)-N-(2-иодо-3-амино-8-бромо-9,10,11-триметокси-6,7-дигидро-5H-дибензо[а,с]циклогептен-5-ил)ацетамид. В колбу Шленка поместили 200 мг (0,445 ммоль, 1 экв.) 4-бромколхамина, 100 мг (0,445 ммоль, 1 экв.) N-иодосукцинимида. Колбу заполнили аргоном, прилили 5 мл ледяной уксусной кислоты. Реакцию проводили в течение суток при комнатной температуре. После окончания реакции добавляли избыток тиосульфата натрия, гидрокарбонат натрия до рН=8 и проэкстрагировали этилацетатом (×3). Органические слои объединили, высушили над Na2SO4, растворитель удалили при пониженном давлении. Продукт выделили методом колоночной хроматографии, элюент РЕ-EtOAc-EtOH 7:1:1 в виде оранжевых кристаллов. Т пл.=205°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 8.37 (д, J=7.9 Гц, 1Н, NHAc), 7.49 (с, 1Н, С8-Н), 6.71 (с, 1H, С11-Н), 5.38 (с, 2Н, NH2), 4.28-4.21 (м, 1Н), 3.88 (с, 3Н), 3.83 (с, 3Н), 3.47 (с, 3Н), 3.02-3.00 (м, 1Н), 2.07-2.04 (м, 2Н), 1.87 (с, 3Н), 1.84-1.81 (м, 1Н). 13С ЯМР (101 МГц, ДМСО-d6): δ 168.4, 151.5, 149.8, 149.3, 148.1, 145.7, 141.7, 138.9, 133.7, 128.6, 122.7, 112.6, 108.9, 80.1, 61.1, 60.7, 60.4, 48.1, 36.1, 22.6. Масс-спектр: 434.07 (100%), 426.08 (96%), 419.02 (67%), 421.06 (63%), 375.04 (65%). 377.05 (63%), 534.11 (42%), 536.15 (40%), 480.04 (39%), 478.07 (37%).
Затем получали (аR,5S)-N-(2-иодо-3-трифторацетамидо-8-бромо-9,10,11-триметокси-6,7-дигидро-5H-дибензо[а,с]циклогептен-5-ил)ацетамид. В колбу Шленка поместили 100 мг (0,174 ммоль, 1 экв.) (аR,5S)-N-(2-иодо-3-амино-8-бромо-9,10,11-триметокси-6,7-дигидро-5H-дибензо[а,с]циклогептен-5-ил)ацетамида, заполнили колбу аргоном. В колбу добавили 5 мл сухого дихлорметана. Смесь охладили до 0°C. К охлажденной смеси добавили 66 мг (0,313 ммоль, 1,8 экв.) ангидрида трифторуксусной кислоты и 39 мг (0,487 ммоль, 2,8 экв.) пиридина. Реакцию проводили при температуре 0°C в течение 3 часов. После окончания реакции в колбу добавили 5 мл дистиллированной воды и проэкстрагировали дихлорметаном (×3). Органические слои объединили, сушили над сульфатом натрия, растворитель удалили при пониженном давлении. Продукт получили в виде желто-оранжевых кристаллов. Т пл.=114°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 11.30 (с, 1Н, NHCOCF3), 8.48 (д, J=8.2 Гц, 1Н, NHAc), 7.89 (с, 1Н, С8-Н), 7.30 (с, 1Н, С11-Н), 4.42-4.35 (м, 1Н, С7-Н), 3.91 (с, 3Н, ОМе), 3.87 (с, 33H, ОМе), 3.55 (с, 3Н, ОМе), 3.10-3.06 (м, 1Н, С5-Н), 2.15-2.08 (м, 1Н, С5-Н), 2.03-1.98 (м, 1Н, С6-Н), 1.87 (с, 3Н, С(О)CH3), 1.85-1.82 (м, 1H, С6-Н). 13С ЯМР (101 МГц, ДМСО-d6): δ 168.7, 155.3, 154.9, 150.5, 149.9, 145.8, 141.9, 139.8, 133.7, 127.0, 123.0, 112.9, 108.2 (q, JC-F=208 Гц), 104.2, 95.1, 61.1, 60.8, 60.7, 47.9, 36.3, 29.5, 22.6. Масс-спектр: 473.05 (100%), 471.04 (94%), 532.11 (86%), 530.09 (74%), 655.93 (36%), 657.99 (26%), 598.89 (33%), 597.01 (27%).
Методика синтеза пирролоаллоколхициноидов 1а-е
В колбу Шленка поместили 30 мг (0,044 ммоль, 1 экв.) (аR,5S)-N-(2-иодо-3-трифторацетамидо-8-бромо-9,10,11-триметокси-6,7-дигидро-5H-дибензо[а,с]циклогептен-5-ил)ацетамида, 0,5 мг (2,2*10-3 ммоль, 0,05 экв.) диацетата палладия, 1,3 мг (4,4*10-3 ммоль, 0,1 экв.) иодида меди, 1,7 (6,6*10-3 ммоль, 0,15 экв.) трифенилфосфина и 13 мг (0,132 ммоль, 3 экв.) ацетата калия. Колбу заполнили аргоном, прилили 4 мл ацетонитрила и 0,053 ммоль алкина. Реакцию проводили в течение 4 часов, температуру плавно поднимали с 60°C до 80°C. После окончания реакции смесь охладили до комнатной температуры, растворитель удалили при пониженном давлении. Продукт выделяли методом колоночной хроматграфии на силикагеле, элюент PE-EtOAc-EtOH 15:1:1.
Для синтеза соединения 1а использовали 5,4 мг фенилацетилена. Продукт выделили в виде светло-желтых кристаллов с выходом 50%. Тпл=149°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 11.61 (с, 1Н, NH-индол), 8.58 (д, J=8.3 Гц, 1Н, NHAc), 7.87 (д, J=7.6 Гц, 2Н, С2-Н и С6-Н в фенильном заместителе), 7.50 (с, 1Н, С5''-Н), 7.46 (т, J=7.7 Гц, 2Н, С3-Н и С5-Н в фенильном заместителе), 7.39 (с, 1Н, С4''-Н), 7.31 (т, J=7.4 Гц, 1Н, С4-Н в фенильном заместителе), 6.92 (с, 1Н, С3''-Н), 4.55-4.49 (м, 1Н, С1-Н), 3.92 (с, 3Н, ОМе), 3.87 (с, 3Н, ОМе), 3.40 (с, 3Н, ОМе), 3.06-3.03 (м, 1Н, С6-Н), 2.09-2.05 (м, 2Н, С7-Н), 1.92 (с, 3Н, С(О)CH3), 1.90-1.86 (м, 1Н, С6-Н). 13С ЯМР (101 MHz, ДМСО-d6): δ 168.3, 150.2, 149.2, 145.9, 137.9, 137.0, 134.6, 133.8, 132.2, 130.8, 128.9, 128.6, 128.3, 127.0, 124.9, 124.8,121.1, 112.5, 105.7, 61.2, 60.7, 60.3, 54.9,48.5, 36.6, 22.7. Масс-спектр: 534.09 (100%), 536.10 (97%), 535.08 (32%), 537.12 (30%), 536.12 (5%), 538.12 (5%).
Для синтеза соединения 1b использовали 2,9 мг пропаргилового спирта, продукт выделили в виде белых кристаллов с выходом 40%. Т пл.=144-145°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 11.27 (с, 1Н, NH-индол), 8.53 (д, J=8.4 Гц, 1Н, NHAc), 7.47 (с, 1Н, С5''-Н), 7.33 (с, 1Н, С4''-Н), 6.47 (с, 1H, С3''-Н), 5.18 (д, J=12.8 Гц, 2Н, СН2ОН), 4.52-4.47 (м, 1Н, С1-Н), 3.90 (с, 3Н, ОМе), 3.86 (с, 3Н, ОМе), 3.04-3.00 (м, 1Н, С6-Н), 2.06-1.93 (м, 2Н, С7-Н), 1.90 (с, 3Н, С(О)CH3), 1.86-1.79 (м, 1Н, С6-Н). 13С ЯМР (101 МГц, ДМСО-d6): δ 168.4, 150.1, 149.2, 145.9, 136.3, 134.6, 133.7, 133.6, 130.8, 125.9, 124.5, 121.3, 112.5, 105.7, 102.2, 61.2, 60.7, 60.3, 59.0, 48.4, 31.3, 22.7, 20.7. Масс-спектр: 412.94 (100%), 410.90 (57%), 472.90 (74%), 470.94 (53%), 473.94 (61%), 471.91 (73%), 428.90 (45%), 430.96 (34%), 488.02 (27%), 488.96 (10%), 490.81 (7%).
Для синтеза соединения 1с было использовано 3,7 мг бутин-3-ола-2. Продукт был получен в виде светло-желтых кристаллов с выходом 48%. Т пл.=160°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 11.26 (с, 1Н, NH-индол), 8.54 (д, J=6.9 Гц, 1Н, NHAc), 7.45 (с, 1Н, С5''-Н), 7.32 (с, 1Н, С4''-Н), 6.42 (д, J=6.8 Гц, 1Н, С3''-Н), 5.99 (д, J=7.0 Гц, 1Н, СН(CH3)ОН), 4.52-4.45 (м, 1Н, С1-Н), 3.90 (с, 3Н, ОМе), 3.85 (с, 3Н, ОМе), 3.04-3.01 (м, 2Н, С6-Н), 2.05 (уш.с, 3Н, СН(ОН)СН3), 1.90 (с, 3Н, С(O)СН3), 1.86-1.81 (м, 2Н, С7-Н). 13С ЯМР (101 МГц, ДМСО-d6): δ 169.8, 168.4, 149.2, 145.9, 138.7, 136.0, 134.4, 133.8, 130.9, 125.7, 124.4, 121.2, 112.5, 105.6, 99.4, 66.0, 61.2, 60.7, 60.3, 48.5, 36.6, 31.0, 22.7, 21.0. Масс-спектр: 501.93 (100%), 503.92 (93%), 422.94 (79%), 444.93 (78%), 411.96 (61%), 413.99 (57%), 429.94 (41%), 427.93 (28%).
Для синтеза соединения 1d было использовано 3,7 мг бутин-3-ола-1. Продукт был получен в виде светло-желтых кристаллов с выходом 65%. Т пл.=127°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 10.92 (с, 1Н, NH-индол), 8.50 (д, J=8.4 Гц, 1Н, NHAc), 7.37 (с, 1Н, С5''-Н), 7.25 (с, 1Н, С4''-Н), 6.17 (с, 1Н, С3''-Н), 4.79-4.76 (м, 1Н, ОН), 4.52-4.46 (м, 1Н, С1-Н), 3.90 (с, 3Н, ОМе), 3.85 (с, 3Н, ОМе), 3.73-3.71 (м, 2Н, СН2СН2ОН), 3.00-2.88 (м, 1Н, С6-Н), 2.88-2.84 (м, 2Н, СН2СН2ОН), 2.08-1.99 (м, 2Н, С7-Н), 1.89 (cs, 3Н, С(О)CH3), 1.85-1.80 (м, 1Н, С6-Н). 13С ЯМР (101 МГц, ДМСО-d6): δ 205.4, 154.7, 153.0, 151.2, 141.4, 140.8, 140.4, 135.8, 128.3, 121.8, 112.3, 107.9, 107.8, 94.8, 91.0, 60.8, 60.5, 56.2, 55.9, 54.9, 47.6, 40.2, 40.0, 29.1. Масс-спектр: 502.11 (100%), 504.14 (98%), 503.01 (27%), 505.04 (26%), 506.09 (15%), 504.12 (11%).
Для синтеза соединения 1е было использовано 5,2 мг пропаргилацетата. Продукт был выделен с выходом 52% в виде светло-бежевых кристаллов. Т пл.=139°C. 1Н ЯМР (400 МГц, ДМСО-d6): 11.27 (с, 1Н, NH-индол), 8.53 (д, J=8.3 Гц, 1Н, NHAc), 7.47 (с, 1H, С5''-Н), 7.33 (с, 1H, С4''-Н), 6.47 (с, 1Н, С3''-Н), 5.18 (уш. с, 2Н, СН2ОАс), 4.51-4.46 (м, 1Н, С1-Н), 3.90 (с, 3H, ОМе), 3.85 (с, 3H, ОМе), 3.04-3.01 (м, 1Н, С6-Н), 2.03 (м, 1Н, С6-Н), 1.98 (с, 3H, С(O)CH3), 1.90 (с, 3H, NHC(O)CH3), 1.86-1.81 (м, 2Н, С7-Н). 13С ЯМР (101 МГц, ДМСО-d6): δ 168.4, 150.1, 149.2, 145.9, 136.3, 134.6, 133.7, 133.7, 130.8, 125.9, 124.5, 121.3, 118.9, 112.5, 105.7, 102.2, 61.2, 60.7, 60.3, 59.8, 59.0, 29.0, 22.7, 20.8, 20.7. Масс-спектр: 531.92 (100%), 529.94 (97%), 470.95 (88%), 472.92 (81%), 412.97 (68%), 410.97 (60%).
Синтез соединения 1f.
Получение алкина.
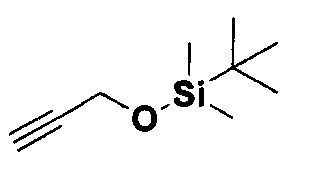
Соединение было получено согласно известной методике (J. Am. Chem. Soc, 2000, 122, 5017). К раствору пропаргилового спирта (44,1 мл, 0,758 моль) в DCM (300 мл), добавили трет.-бутилдиметилсилилхлорид (120 г, 0,796 моль) и имидазол (103,2 г, 1,516 моль) при 0°C. Через 1 час реакционную смесь промыли водой, органический слой просушили над Na2SO4 и сконцентрировали при пониженном давлении. The Продукт выделили в виде прозрачной жидкости с помощью колоночной хроматографии на силикагеле с использованием элюента петролейный эфир - этилацетат (10:1) с выходом 78%. 1H ЯМР (400 МГц CDCl3): δ 4.31 (с, 2Н, СН2), 2.38 (с, 1Н, С sp-H), 0.91 (с, 9Н, Si-But), 0.13 (с, 6Н, SiMe2).
Синтез 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]1H-(aR,1S)1-ацетамидо-6,7-дигидроциклогепта[3,4-I]1H-2-трет.-бутилдиметилсилилоксиметилиндола
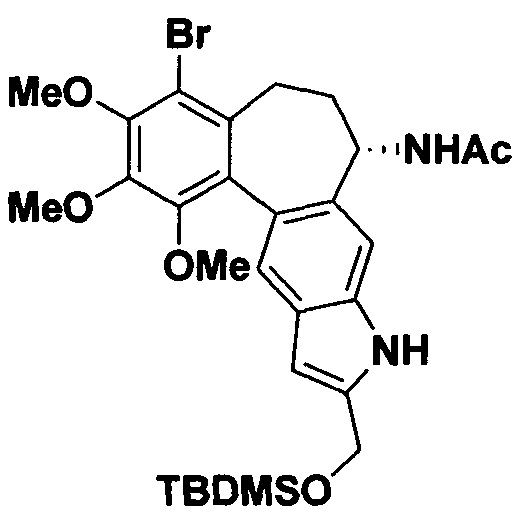
В колбу шленка поместили (aR,5S)-N-(2-иодо-3-трифторацетамидо-8-бромо-9,10,11-триметокси-6,7-дигидро-5Н-дибензо[а,с]циклогептен-5-ил)ацетамид (1 экв., 80 мг, 0,12 ммоль),палладий(дифенилфосфиноферроцен) дихлорид (0,05 экв., 4,4 мг, 0,006 ммоль), иодид меди (I) (0,1 экв., 2,3 мг, 0,012 ммоль). Колбу заполнили аргоном, добавили ацетонитрил. Далее прилили N,N-диизопропилэтиламин (3 экв., 95 мкл, 0,366 ммоль) и алкин (1,2 экв., 30 мкл, 0,146 ммоль). Температуру повысили до 90°C и перемешивали в течение 8 часов. После окончания реакции растворитель удалили при пониженном давлении, а продукт выделили методом колоночной хроматографии на силикагеле с элюентом петролейный эфир-этилацетат-этиловый спирт (5:1:1). Продукт выдели в виде светло-желтого масла с выходом 51%. 1Н ЯМР (400 МГц, ДМСО-d6): δ 11.06 (с, 1Н, NH-индол), 8.55 (д, J=8.5 Гц, 1Н, NHAc), 7.42 (с, 1Н, С5''-Н), 7.31 (с, 1H, С4''-Н), 6.31 (с, 1Н, С3''-Н), 4.78 (с, 2Н, CH2OTBDMS), 4.48-4.41 (м, 1Н, С1-Н), 3.89 (с, 3H, ОМе), 3.84 (с, 3H, ОМе), 3.36 (с, 3H, ОМе), 2.07-1.96 (м, 4Н, С6-Н, С7-Н), 1.90 (с, 3H, С(О)СН3), 0.89 (с, 9Н, Si-But), 0.09 (с, 6Н, SiMe2). 13С ЯМР (101 МГц, ДМСО-d6): δ 168.7, 150.3, 149.2, 146.0, 139.0, 136.3, 133.9, 133.9, 131.1, 126.2, 124.3, 121.1, 112.6, 105.7, 99.5, 61.3, 60.9, 60.5, 58.8, 48.6, 36.8, 29.9, 26.0, 22.8, 18.2, -5.0.
Метилирование и удаление защитной группы
Пирролоаллоколхициноид (1 экв., 48 мг, 0,079 ммоль), полученный на предыдущей стадии, смешали с гидридом натрия (60%, 2,3 экв., 0,19 ммоль, 7,6 мг) и йодистым метилом (1,5 экв., 0,125 ммоль, 17,7 мг) в ТГФ. Температуру постепенно изменяли от 0°C до 65°C. Реакция протекала в течение 6 часов, после чего растворитель удалили, а остаток пропустили через короткий слой силикагеля. Неочищенный продукт растворили в 4 мл ТГФ, добавили 45 мкл раствора 1Н тетрабутиламмоний фторида в ТГФ и перемешивали 3 часа. После окончания реакции растворитель удалили, а продукт выделили методом колоночной хроматографии, используя элюент петролейный эфир-этилацетат-этанол (15:1:1). продукт был выделен в виде белых кристаллов с выходом 55% для двух стадий. Т пл.=175-177°C. 1Н ЯМР (400 МГц, ДМСО-d6): δ 8.51 (д, J=8.3 Гц, 1Н, NHAc), 7.46 (с, 1Н, С5''-Н), 7.37 (с, 1Н, С4''-Н), 6.38 (с, 1H, С3''-Н), 5.22 (т, J=5.0 Гц, 1H, ОН), 4.64 (д, J=5.1 Гц, 2Н, СН2OН), 4.60-4.56 (м, 1H, С1-Н), 3.91 (с, 3H, ОМе), 3.86 (с, 3H, ОМе), 3.77 (с, 3H, NMe), 3.34 (с, 3H, ОМе), 3.04-2.99 (м, 1Н, С6-Н), 2.10-2.05 (м, 1Н, С6-Н), 2.02-1.97 (м, 1Н, С7-Н), 1.93 (с, 3H, С(О)СН3), 1.84-1.79 (м, 1Н, С7-Н). 13С ЯмР (101 МГц, ДМСО-d6): δ 168.5, 150.1, 149.1, 145.8, 140.7, 137.2, 133.8, 133.7, 130.2, 125.2, 124.3, 121.2, 112.5, 103.6, 100.1, 61.2, 60.7, 60.2, 55.5, 48.3, 37.0, 29.8, 29.7, 22.80. Масс-спектр: 502.08 (100%), 504.09 (91%), 443.09 (79%), 445.08 (78%), 431.10 (50%), 429.08 (39%) 414.06 (61%), 416.08 (60%), 401.07 (29%), 399.09 (28%).
Биологические испытания.
Заявляемые производные 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(аR,1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-ƒ]-1Н-индола были испытаны с целью определения их активности при ингибировании пролиферации опухолевых клеток.
Цитотоксичность заявленных соединений была определена при помощи стандартного теста с 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразол бромидом (МТТ, Sigma). Были приготовлены серии растворов указанных соединений с концентрациями от 10 мкмоль до 1 нмоль. Данные растворы перенесли в планшет 100 мкл к испытуемыми клетками. Необработанные клетки использовались в качестве контрольной группы. Клетки инкубировали в течение 72 часов. В последние 6 часов 250 мкг/мл МТТ были добавлены на каждые 10 мкл к каждой из лунок. После выдерживания, питательная среда была удалена и 100 мкл диметилсульфоксида добавляли в каждую лунку. Клетки выдерживали 15 минут для растворения формазана. Оптическую плотность (OD) определяли на спектрофотометре Titertek (UK) при 540 нм. Цитотоксичность, при которой обнаруживалось 50% мертвых клеток (IC50) рассчитывали по кривым титрования. Ингибирование пролиферации (индекс ингибирования, II) рассчитывали как [1 - (OD экспериментальная/OD контроль)], где OD - оптическая плотность МТТ.
Указанные активности позволяют применять полученные производные 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR,1S)-1ацетамидо-6,7-дигидро-циклогепта-[3,4-ƒ]-1Н-индола в качестве активного компонента противоопухолевого лекарственного средства для лечения онкологических заболеваний.
Наличие стереоцентра в молекуле и разнообразие заместителей, вводимых в гетероциклическое кольцо (содержащих гидроксильную и сложноэфирную функциональные группы), способствуют более эффективному взаимодействию данных веществ с внутриклеточным белком-мишенью, повышению апоптозиндуцирующей активности и активности при ингибировании пролиферации опухолевых клеток, а также позволяет проводить функционализацию полученных веществ для создания их биологически доступных (липофильных и гидрофильных) форм веществ.
![Производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR, 1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-f]-1Н-индола и его применение](https://fips.edrid.ru/images/rid/0a/ba/03/2e115f01aefdd37f2f2e6ee45c99dd67.png)
![Производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR, 1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-f]-1Н-индола и его применение](https://fips.edrid.ru/images/rid/0a/ba/03/5cd1f00af5ad9db137b0e4b2c2cbaacd.jpg)
![Производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR, 1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-f]-1Н-индола и его применение](https://fips.edrid.ru/images/rid/0a/ba/03/59e11186933c464c4f7cc340d83986ee.jpg)
![Производное 1'-бромо-2',3',4'-триметоксибензо[5',6':4,5]-(aR, 1S)-1-ацетамидо-6,7-дигидроциклогепта-[3,4-f]-1Н-индола и его применение](https://fips.edrid.ru/images/rid/0a/ba/03/1bb37e3a8152e2a6890eeab8dda9fd3b.png)

