Результат интеллектуальной деятельности: ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВОССТАНОВЛЕНИЯ ЧИСЛЕННОСТИ АНАЭРОБНЫХ БАКТЕРИЙ ПОСЛЕ НИЗКОТЕМПЕРАТУРНОГО ХРАНЕНИЯ
Вид РИД
Изобретение
Изобретение относится к микробиологии и биотехнологии, в частности к получению питательных сред для рекультивации производственных культур анаэробных бактерий после низкотемпературного хранения в лабораторной практике и на биотехнологическом производстве.
Часто объектом биотехнологических производств являются анаэробные бактерии (в первую очередь бифидобактерии и лактобациллы), входящие в состав пробиотических препаратов, широко представленных на отечественном и зарубежном рынках в качестве лекарственных препаратов и биологически активных добавок. Поддержание данных штаммов в рабочем состоянии, сохранение их ценных свойств являются важными условиями практически любой работы с микроорганизмами - от первичного изучения до использования их в производстве различных биопрепаратов. Одним из способов сохранения анаэробных микроорганизмов на биотехнологических производствах и в условиях исследовательских лабораторий является криоконсервация - низкотемпературное хранение живых биологических объектов с возможностью восстановления их биологических функций после размораживания. В настоящее время криоконсервирование широко используют для хранения микроорганизмов - объектов биотехнологии, так как данный метод обеспечивает сохранение генетической стабильности и основных физиолого-биохимических свойств культур. Процесс криоконсервации рассматривают как способ перевода клетки в состояние глубокого холодового анабиоза с последующим возвратом в исходное состояние, что реализуется с трудом из-за комплекса стрессовых факторов, которые влияют на выживаемость микроорганизмов при замораживании.
Несмотря на то, что метод низкотемпературной консервации оказывается относительно эффективным при поддержании производственных и лабораторных культур микроорганизмов, направление совершенствования технологии рекультивации (восстановление численности) микроорганизмов после низкотемпературного хранения остается актуальным. В лабораторной и производственной практике анаэробные микроорганизмы после низкотемпературного хранения восстанавливают, культивируя на плотных и жидких питательных средах
В частности из уровня техники известны питательные среды, используемые для культивирования анаэробных бактерий:
- Шедлера среда, содержащая 5% кровь барана,
- тиогликолевая среда, содержащая витамин К1 гемин и сыворотку крови,
- среда Китт-Тароцци, содержащая рубленное мясо и глюкозу (см. Поляк М.С., Сухаревич В.И., Сухаревич М.Э. Питательные среды для медицинской микробиологии. Санкт-Петербург. 2002);
- казеиново-дрожжевая среда, содержащая 20-25% дрожжевого аутолизата и 10-15% казеинового гидролизата (см. Патент N 2332454 C12N 1/20, А61К 35/74, опубл. 2008).
Данные питательные среды используются для культивирования анаэробных и микроаэрофильных бактерий, обеспечивая рост микроорганизмов за счет содержащихся в их составе питательных и минеральных компонентов.
Однако, при использовании известных питательных сред, микроорганизмы после первого пассажа (пересева) обладают пониженной жизнеспособностью, в связи с чем имеют низкую численность и для дальнейшей работы, с целью увеличения численности микробов, используют культуру второго и третьего пассажа, что приводит к увеличению расходов на этапе рекультивации микроорганизмов после хранения и удлинению сроков получения конечного продукта биотехнологического производства.
Наиболее близкой к заявляемому составу среды по совокупности существенных признаков и назначению является питательная среда Шедлера, включающая гидролизат казеина, протеозопептон, папаиновый перевар соевой муки, дрожжевой экстракт, глюкозу, натрия хлорид, калия гидрофосфат, трис (гидроксиметиламинометан), L-цистин, агар-агар, дистиллированную воду, гемин, при следующем соотношении ингредиентов, г/л:
|
(см. http://www.himedialabs.ru/m291-m292).
Известную среду готовят следующим образом:
Размешивают 43,41 г порошка в 1000 мл дистиллированной воды. При необходимости добавляют в бульон 0,02-0,2% агар-агара. Кипятят с частым помешиванием для полного растворения частиц. Стерилизуют автоклавированием при 1,1 атм (121°С) в течение 15 мин. Остужают и асептично добавляют (до 5% об/об) стерильной дефибринированной крови (при необходимости). Перед розливом среду тщательно перемешивают.
При приготовлении известной среды необходимо избегать перегревания среды или ее окисления на свету, так как это приводит к задержке роста бактерий.
Данная известная среда являются прекрасной основой, в которую для выделения прихотливых анаэробных бактерий можно добавлять кровь или другие обогатительные добавки. Данный бульон является наиболее эффективным для выращивания облигатно-анаэробных бактерий в атмосфере, содержащей 5% углекислого газа, 10% водорода и 85% азота. Его также можно использовать для определения чувствительности анаэробных микроорганизмов к антибиотикам. Известно его использование для определения МИК пробирочным методом. Комбинация гидролизата казеина, протеозопептона, папаинового перевара соевой муки, дрожжевого экстракта и L-цистина обеспечивает присутствие азотистых питательных веществ, витаминов и других факторов необходимых для роста микроорганизмов. Глюкоза является источником энергии. Гемин стимулирует рост прихотливых микроорганизмов. Антикоагулянт полианетолсульфонат натрия (SPS), помещенный в культуральные флаконы, способствует выделению гемокультур. Он подавляет фагоцитоз и нейтрализует антимикробную активность компонентов свежей крови.
Однако, известная питательная среда также не обеспечивает возможности эффективного восстановления численности анаэробных культур бактерий после низкотемпературного хранения при первом пассаже. Для получения требуемого количества анаэробных микроорганизмов, также как и на других известных питательных средах, необходимо проводить дополнительные пересевы культур, что приводит к увеличению затрат на расходные материалы и удлинению сроков получения конечного продукта биотехнологического производства.
Таким образом, техническим результатом, на достижение которого направлено заявляемое изобретение, является создание питательной среды, обеспечивающей эффективного восстановления численности анаэробных культур бактерий после низкотемпературного хранения при первом пассаже.
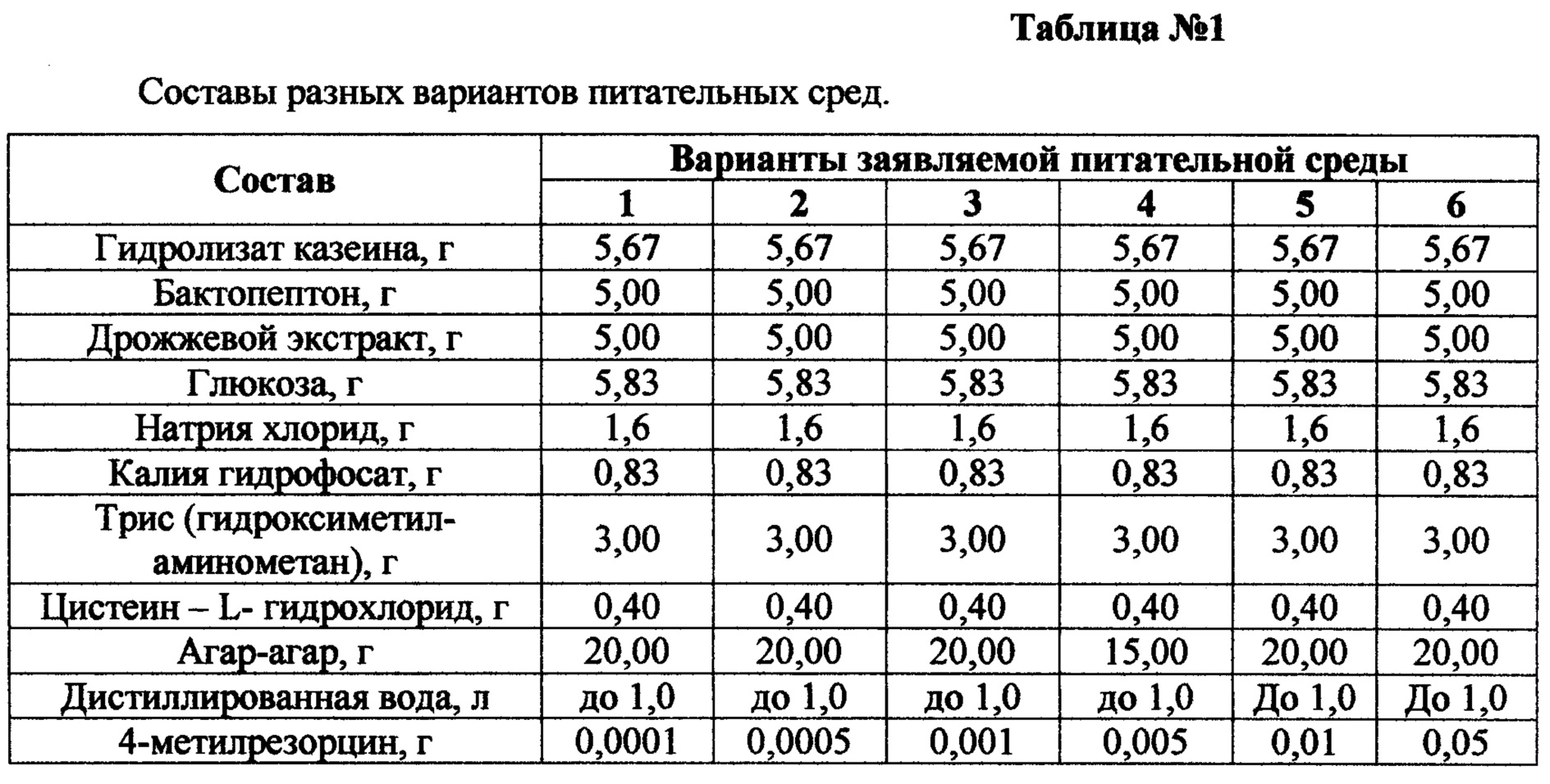
Указанный технический результат достигается тем, что питательная среда для рекультивации анаэробных бактерий после низкотемпературного хранения, содержащая гидролизат казеина, дрожжевой экстракт, глюкозу, натрия хлорид, калия гидрофосфат, пептон, трис, алифатическую серосодержащую аминокислоту, агар-агар и дистиллированную воду, согласно изобретению дополнительно содержит 4 - метилрезорцин, в качестве пептона используют бактопептон, а в качестве алифатической серосодержащей аминокислоты используют цистеин - L гидрохлорид, при следующем соотношении компонентов:
гидролизат казеина 5,67 г
бактопептон 5,00 г
дрожжевой экстракт 5,00 г
глюкоза 5,83 г
натрия хлорид 1,67 г
калия гидрофосфат 0,83 г
трис (гидроксиметиламинометан) 3,00 г
цистеин - L гидрохлорид 0,40 г
агар-агар 15-20 г
дистиллированная вода до 1 л.
4 - метилрезоцин 0,001-0,01 г
рН 7,6±0,2.
При этом, 4 - метилрезоцин стерильно добавляют в приготовленную без него и автоклавированную расплавленную агаровую основу.
Заявителем экспериментально установлено, что дополнительное введение в заявляемую среду 4 - метилрезорцина, использование в качестве пептона бактопептона, а в качестве алифатической серосодержащей аминокислоты - цистеин - L гидрохлорид, и заявляемое количество ингредиентов в питательной среде, способствует достижению заявленного технического результата, а именно созданию новой питательной среды, позволяющей обеспечить значительное повышение количества жизнеспособных клеток анаэробных бактерий после низкотемпературного хранения, что способствует эффективному осуществлению их рекультивации в условиях микробиологической лаборатории и на биотехнологическом производстве уже при первом пассаже.
При создании новой питательной среды использовали эталонные штаммы анаэробных бактерий Bifidobacterium bifidum 791 (№ депонента АС-1247 в коллекции промышленных м/о ГНЦ РФ ФГУП ГосНИИ Генетики и селекции пром-х м/о), Bifidobacterium adolescentis МС-42 (ГИСК им. Л.А. Тарасевича) (в настоящее время по данным полногеномного секвенирования идентифицирован как Bifidobacterium longum МС-42, https://www.ncbi.nim.nih.gov/biosample/4263942), Propionibacterium acnes №388 (коллекция микроорганизмов Института клеточного и внутриклеточного симбиоза УрО РАН) и микроаэрофильные бактерии Lactobacillus fermentum 90Т-С4 (ГИСК им. Л.А. Тарасевича).
Исследуемые штаммы анаэробных бактерий находились в условиях низкотемпературного хранения при - 74°С в морозильной камере «MDF-392» (Sanyo, Япония) в среде Шедлера без внесения криопротектора из-за его возможной токсичности в течение 1 месяца. Количество бактерий определяли путем подсчета выросших колоний бактерий на плотной питательной среде по методу Gould и выражали в колониеобразующих единицах на мл (КОЕ/мл) (Фельдман Ю.М. Количественное определение бактерий в клинических материалах // Лаб. дело. - 1984. - №10. - С. 616-619).
Исходное количество бактерий перед низкотемпературным хранением (до замораживания) составляло 1*108 КОЕ/мл.
Предлагаемую питательную среду для восстановления численности анаэробных бактерий после низкотемпературного хранения готовят следующим образом: в химически чистую стерильную посуду наливают дистиллированную воду, в которой последовательно растворяют питательные компоненты среды в количестве (г/л): гидролизат казеина 5,67 г; бактопептон 5,00 г; дрожжевой экстракт 5,00 г; глюкоза 5,83 г; натрия хлорид 1,67 г; калия гидрофосфат 0,83 г; трис (гидроксиметиламинометан) 3,00 г; цистеин - L гидрохлорид 0,40 г; агар-агар 15-20 г; за исключением 4 - метилрезорцина. Раствор автоклавируют при 0,9-1,1 атм. 15 мин. Затем к расплавленной агаровой основе стерильно добавляют 4-метилрезорцин до конечной концентрации 0,001-0,01 г/л и тщательно перемешивают. Готовую среду разливают в стерильные чашки Петри и оставляют до полного застывания. Чашки со средой подсушивают в термостате при 37°С в течение 10 мин, после чего среда готова для использования.
Исследуемые штаммы бактерий размораживают с учетом оптимальных скоростей оттаивания и обеспечением максимальной равномерности отогрева образца при +4°С. Затем, из каждого образца стандартной микробиологической петлей забирают бульонную культуру исследуемых бактерий, которую рассевают секторами на поверхность заявляемой среды по методу Gould [Фельдман Ю.М. Количественное определение бактерий в клинических материалах // Лаб. дело. - 1984. - №10. - С. 616-619]. Чашки Петри с посеянными культурами инкубируют в анаэробном термостате (Binder, Германия) при 37°С в течение 48 часов, затем рассевают по методу Gould, проводят подсчет выросших колоний бактерий и определяют их количество, выражая в колониеобразующих единицам на мл (КОЕ/мл) [Фельдман Ю.М. Количественное определение бактерий в клинических материалах // Лаб. дело. - 1984. - №10. - С. 616-619].
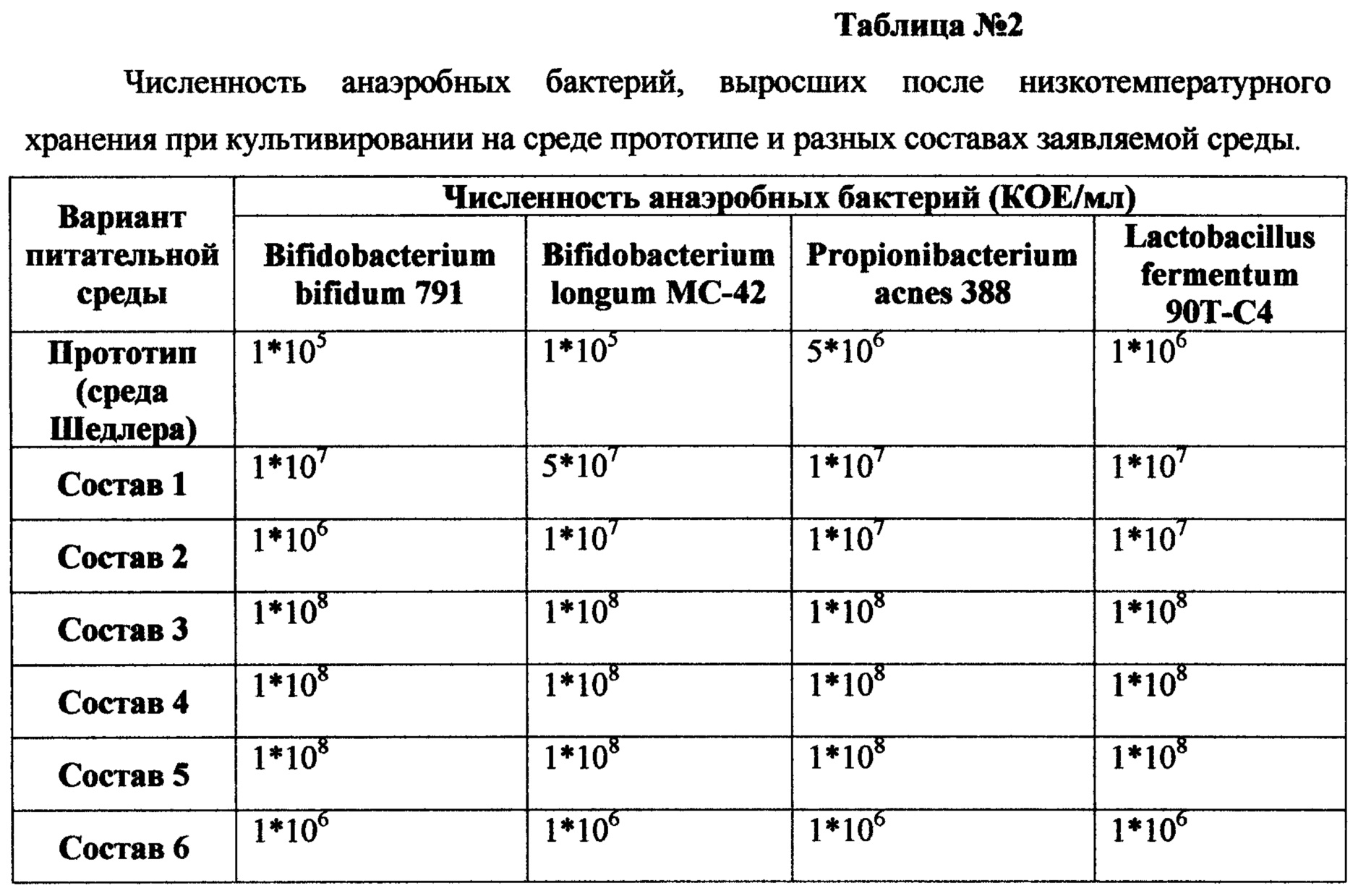
Заявляемая питательная среда для рекультивации анаэробных бактерий после низкотемпературного хранения иллюстрируется нижеследующими примерами, составы которых представлены в таблице №1. В таблице №2 представлены данные по численности анаэробных бактерий, выросших после низкотемпературного хранения при культивировании на среде прототипе и составах заявляемой среды, приведенных в таблице №1.
Как видно из таблицы №2, при культивировании бактерий на среде прототипе (среда Шедлера, HIMEDIA, Индия) после низкотемпературного хранения численность бактерий снижается в сравнении с исходным количеством бактерий до замораживания с 1*108 до 1*105 КОЕ/мл для культур Bifidobacterium bifidum 791 и Bifidobacterium longum МС-42 и с 1*108 до 1*106 КОЕ/мл для культур Propionibacterium acnes 388 и Lactobacillus fermentum 90Т-С4. Добавление в среду 4-метилрезорцина в количестве 0,0001-0,0005 г и остальных ингредиентов в заявляемых количествах (составы 1-2, Таблица №1) не приводит к увеличению численности микроорганизмов до их численности до замораживания.
Добавление в среду 4-метилрезорцина в количестве 0,001-0,01 г и остальных ингредиентов в заявляемых количествах (составы 3-5, Таблица №1) приводит к эффективному восстановлению численности анаэробных бактерий до их численности до замораживания уже в первом пассаже (составы 3-5 Таблица №2). Дальнейшее увеличение количества 4-метилрезорцина 0,05 г и остальных ингредиентов в заявляемых количествах (состав 6 Таблица №1 и таблица №2), способствует снижению численности до 1*106 КОЕ/мл для всех исследуемых культур Bifidobacterium bifidum 791, Bifidobacterium longum МС-42, Propionibacterium acnes 388 и Lactobacillus fermentum 90T-C4. Это позволило установить диапазон внесения концентрации 4-метилрезорцина в состав питательной среды для восстановления численности анаэробных бактерий после низкотемпературного хранения соответственно 0,001-0,01 г. и остальных ингредиентов в заявляемых количествах.
Пример 1.
Бульонную культуру штамма Bifidobacterium bifidum 791, применяемого в настоящее время для производства пробиотика «Бифидумбактерин», в количестве 1*108 КОЕ/мл помещали в условия низкотемпературного хранения при - 74°С в морозильной камере «MDF-392» (Sanyo, Япония) в среде Шедлера без внесения криопротектора на 1 месяц. Питательную среду для восстановления численности анаэробных бактерий после низкотемпературного хранения (состав 3, табл. 1) готовили следующим образом: в химически чистую стерильную посуду наливали дистиллированную воду, в которой последовательно растворяли питательные компоненты среды в количестве (г/л): гидролизат казеина 5,67 г; бактопептон 5,00 г; дрожжевой экстракт 5,00 г; глюкоза 5,83 г; натрия хлорид 1,67 г; калия гидрофосфат 0,83 г; трис (гидроксиметиламинометан) 3,00 г; цистеин - L гидрохлорид 0,40 г; агар-агар 20 г; за исключением 4-метилрезорцина. Раствор автоклавировали при 0,9-1,1 атм. 15 мин. Затем к расплавленной агаровой основе стерильно добавляли 4-метилрезорцин до конечной концентрации 0,001 г/л и тщательно перемешивали. Готовую среду разливали в стерильные чашки Петри и оставляли до полного застывания. Чашки со средой подсушивали в термостате при 37°С в течение 10 мин, после чего она готова для использования.
Штаммы Bifidobacterium bifidum 791 размораживали с учетом оптимальных скоростей оттаивания и обеспечением максимальной равномерности отогрева образца при +4°С. Затем, стандартной микробиологической петлей забирали культуру Bifidobacterium bifidum 791, которую рассевали секторами на поверхность заявляемой среды по методу Gould. Чашки Петри с посеянными культурами инкубировали в анаэробном термостате (Binder, Германия) при 37°С в течение 48 часов, затем рассевали по методу Gould, проводили подсчет выросших колоний бактерий и определяли их количество, выражая в колониеобразующих единицам на мл (КОЕ/мл).
Уже при первом пассаже количество Bifidobacterium bifidum 791 на заявляемой питательной среде (состав 3, табл. 1) составляло 1*108 КОЕ/мл, что соответствовало численности данных бактерий до замораживания.
Пример 2.
Штамм Lactobacillus fermentum 90Т-С4, использующийся для производства пробиотиков, в количестве 1*108 КОЕ/мл хранили в условиях криоконсервации и размораживали согласно примеру 1. Готовили новую питательную среду следующего состава (г/л): гидролизат казеина 5,67 г; бактопептон 5,00 г; дрожжевой экстракт 5,00 г; глюкоза 5,83 г; натрия хлорид 1,67 г; калия гидрофосфат 0,83 г; трис (гидроксиметиламинометан) 3,00 г; цистеин - L гидрохлорид 0,40 г; агар-агар 15-20 г и после автоклавирования среды добавляли 4 - метилрезорцин до конечной концентрации 0,005 г/л (состав 4, табл. 1), остужали и разливали в чашки Петри. Производили посев Lactobacillus fermentum 90Т-С4 по методу Gould. Количество выросших Lactobacillus fermentum 90Т-С4 составило 1*108 КОЕ/мл, что не требовало дополнительных пересевов для восстановления численности бактерий.
Таким образом, применение предложенной питательной среды дает возможность эффективно восстанавливать анаэробные культуры после низкотемпературного хранения, что позволяет повысить производительность биотехнологических производств и снизить его расходы за счет сокращения этапа репарации анаэробных культур после хранения. При этом сокращаются сроки получения конечного продукта производства (снижается количество пассажей культуры), что обосновывает практическую ценность и экономическую эффективность (снижение затрат на расходные материалы и времени получения необходимой биомассы бактерий) ее использования в качестве питательной среды для рекультивации анаэробных бактерий на начальном этапе биотехнологического производства.