Результат интеллектуальной деятельности: Способ детекции последовательностей нуклеотидов методом полимеразной цепной реакции в реальном времени с универсальным зондом
Вид РИД
Изобретение
Область техники, к которой относится изобретение:
Изобретение относится к области биотехнологии, а именно к способу одновременной детекции нескольких специфических нуклеотидных последовательностей и нуклеотидных замен с помощью мультиплексной полимеразной цепной реакции (ПЦР) и может быть использован при выявлении различных возбудителей заболеваний, генотипировании человека и животных, обнаружения генетически модифицированных организмов и т.п.
Уровень техники
Известны несколько способов детекции разных нуклеотидных последовательностей методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с универсальным зондом. Одним из первых сообщений об использовании универсального зонда при постановке ПЦР в реальном времени является статья (D. Whitcombe, J. Brownie, Н.L. Gillard, D. McKechnie, J. Theaker, C.R. Newton, S. Little. (1998). A homogeneous fluorescence assay for PCR amplicons: its application to real-time, single-tube genotyping. Clinical Chemistry 44:5 P. 918-923). В ней описана технология Three-Star, на которую впоследствии был получен патент компанией Zeneca (US 6,270,967 B1 Aug. 7, 2001). Сущность метода состоит в использовании "хвостатых" праймеров к матрице ДНК, содержащих на 5' конце участки, комплементарные последовательностям для отжига еще одного праймера и зонда Taq-Man. Это было сделано для того, чтобы зонд и дополнительный праймер не отжигались на основные праймеры, а могли отжечься только на полученные ампликоны. После получения ампликонов на матрице, появлялись места для отжига зонда и праймера. Дальнейшая ПЦР происходила уже с помощью этого дополнительного праймера, во время достройки которого происходил гидролиз зонда и появлялась флуоресценция. Однако, данный метод имел достаточно низкую эффективность, связанную с необходимостью отжига еще и дополнительного праймера.
В работе (Y. Zhang, D. Zhang, W. Li, J. Chen, Y. Peng, W. Cao. (2003). A novel real-time quantitative PCR method using attached universal template probe. Nucleic Acids Research, Vol. 31, N. 20) описан метод, похожий на Three-Star, однако использующий два праймера, один из которых является «хвостатым» и содержит участок для отжига зонда Taq-Man. Его недостатком является необходимость более высокой концентрации праймеров и зонда (100 мкМ, по сравнению с 10 мкМ в стандартных реакциях). Это связано с постоянным отжигом зонда на праймер, чего нет в предыдущей описанной методике - там зонд отжигается только на полученном от двух праймеров ампликоне. Кроме этого, если для метода Three-Star можно использовать и другие типы зондов (например, Beacon), то в данном случае это только Taq-Man.
Метод ТОСЕ от компании Seegene (Y. Lee, D. Kim, K. Lee & J.-Y. Chun. (2014) Single-channel multiplexing without melting curve analysis in real-time PCR. SCIENTIFIC REPORTS | 4 : 7439 | DOI: 10.1038/srep07439) условно также можно отнести к реакциям с универсальным зондом, так как в ходе амплификации матрицы от «хвостатого» зонда отщепляется 5' участок («питчер»), который служит праймером на заранее синтезированной матрице («кэтчер»). Таким образом, для многих праймеров с одинаковым 5' участком может быть в качестве репортера использован один и тот же «кэтчер». Принципиально реакция оказалась достаточно сложной и в реальных условиях показала низкую эффективность.
Метод генотипирования KASP (Н. Graves, A.L. Rayburn, J.L. Gonzalez-Hernandez, G. Nah, Do-Soon Kim and D.K. Lee. Validating DNA Polymorphisms Using KASP Assay in Prairie Cordgrass (Spartina pectinata Link) Populations in the U.S. Front. Plant Sci., 22 January 2016 | https://doi.org/10.3389/fpls.2015.01271) использует универсальный 5' конец праймера, меченый флуорофором, на котором отжигается зонд с тушителем. За счет переноса энергии такой комплекс не излучает свет. При амплификации на «хвосте» праймера достраивается последовательность, не дающая присоединится зонду с тушителем, и молекула флуоресцирует. Метод хорошо подходит для монореакций. При увеличении количества детектируемых последовательностей начинает возрастать фоновая флуоресценция за счет димеризации праймеров и неспецифического отжига. Кроме этого, метод недостаточно дешев, так как для каждой матрицы необходимо синтезировать меченый праймер.
Некоторые авторы относят к универсальным зонды Amplifluor и Scorpion (Е. Navarro, G. Serrano-Heras, M.J.  , J. Solera. Real-time PCR detection chemistry. Clinica Chimica Acta 439 (2015) 231-250). Однако, это не совсем верно. Действительно, например, у Amplifluor меченая флуорофорами часть может не отличаться при детекции разных матриц. Но она непосредственно связана с праймером и должна быть синтезирована вместе с ним, что не позволяет расценивать данную реакцию как ПЦР с универсальным зондом. Стоимость такой реакции не является низкой, кроме того такие сложные праймеры склонны к димеризации, что снижает эффективность реакции.
, J. Solera. Real-time PCR detection chemistry. Clinica Chimica Acta 439 (2015) 231-250). Однако, это не совсем верно. Действительно, например, у Amplifluor меченая флуорофорами часть может не отличаться при детекции разных матриц. Но она непосредственно связана с праймером и должна быть синтезирована вместе с ним, что не позволяет расценивать данную реакцию как ПЦР с универсальным зондом. Стоимость такой реакции не является низкой, кроме того такие сложные праймеры склонны к димеризации, что снижает эффективность реакции.
Таким образом, наиболее эффективной и специфичной из перечисленных является технология Three-Star. Положенный в ее основу принцип отжига зонда не на матрицу или праймер, а на полученный в результате работы обоих праймеров ампликон, позволяет добиться минимального расхода зонда в ходе реакции и повышения ее специфичности. Это особенно важно для мультиплексных систем, так как распределение зонда по не использующимся в реакции участкам нуклеотидных последовательностей приводит к уменьшению частоты отжига зонда на том участке, где его гарантированно гидролизует полимераза, и, соответственно снижается эффективность реакции.
Раскрытие изобретения
Задачей предлагаемого изобретения является разработка нового метода идентификации амплифицируемых в ходе ПЦР последовательностей нуклеотидов с использованием универсального зонда, позволяющего уменьшить количество используемых (особенно в мультиплексных реакциях) зондов, что в свою очередь существенно сократит время разработки новых тест-систем и уменьшит их стоимость. Метод особенно эффективен при использовании в генотипировании, когда необходимо в одном образце определять большое количество полиморфизмов генов, что требует при традиционном подходе синтеза огромного количества дорогостоящих зондов. Применение предложенного способа расширит сферу использования методов генотипирования человека и животных как в научно-исследовательских, так и в диагностических целях.
Технический результат изобретения достигается тем, что предложена новая конструкция праймеров для проведения ПЦР в реальном времени, использование которой позволяет применять универсальный зонд, конструкция которого не зависит от детектируемой последовательности нуклеотидов. Благодаря этому возможно использование одного и того же зонда для детекции любых последовательностей нуклеотидов.
Краткое описание чертежей и их материалов
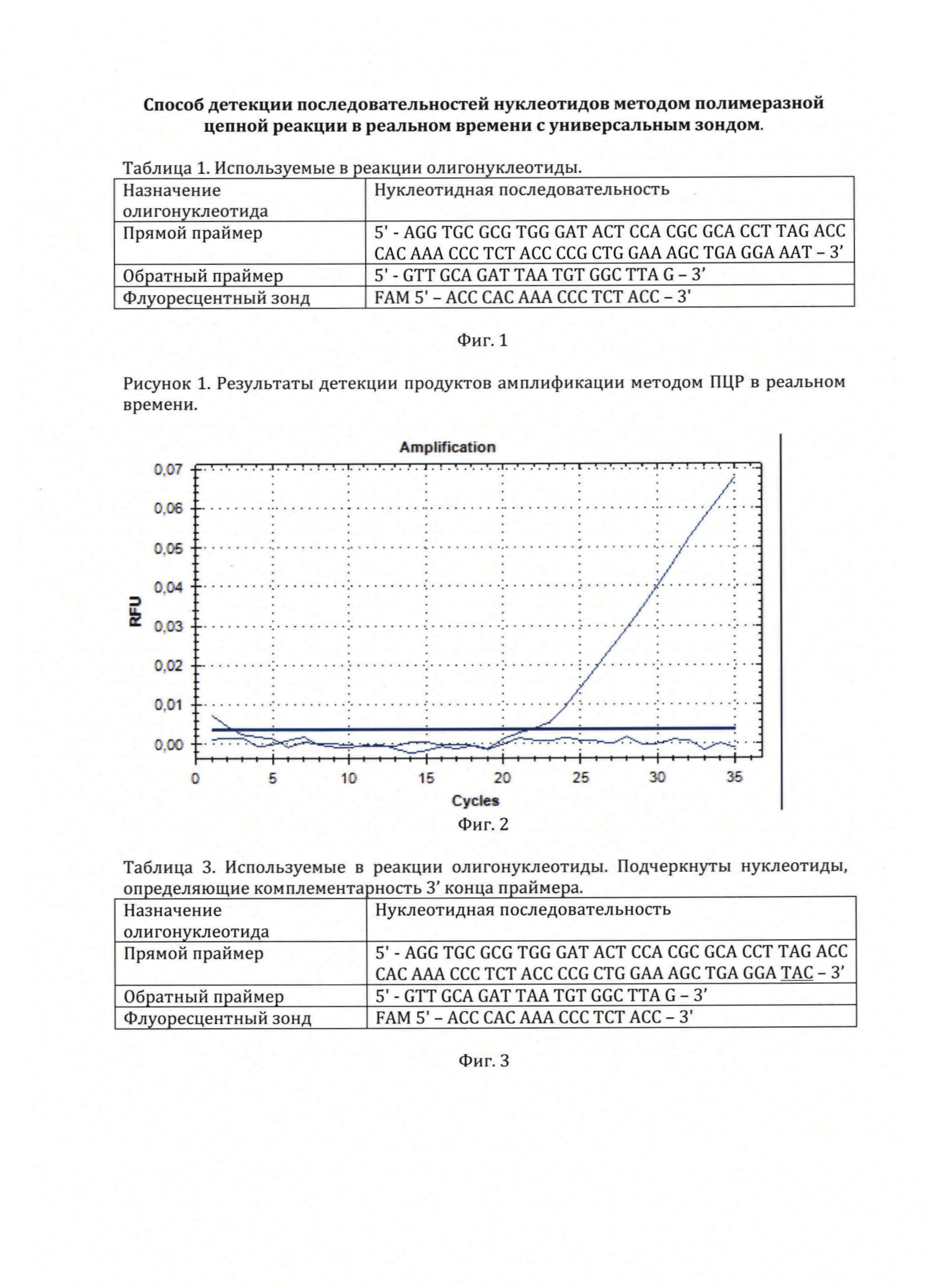
На фиг. 1, приведены олигонуклеотиды, использованные в примере 1 для детекции последовательности нуклеотидов в гене миостатина у овец.
На фиг. 2, приведены результаты оценки флюоресценции при проведении ПЦР в реальном времени для детекции последовательности нуклеотидов в гене миостатина у овец.
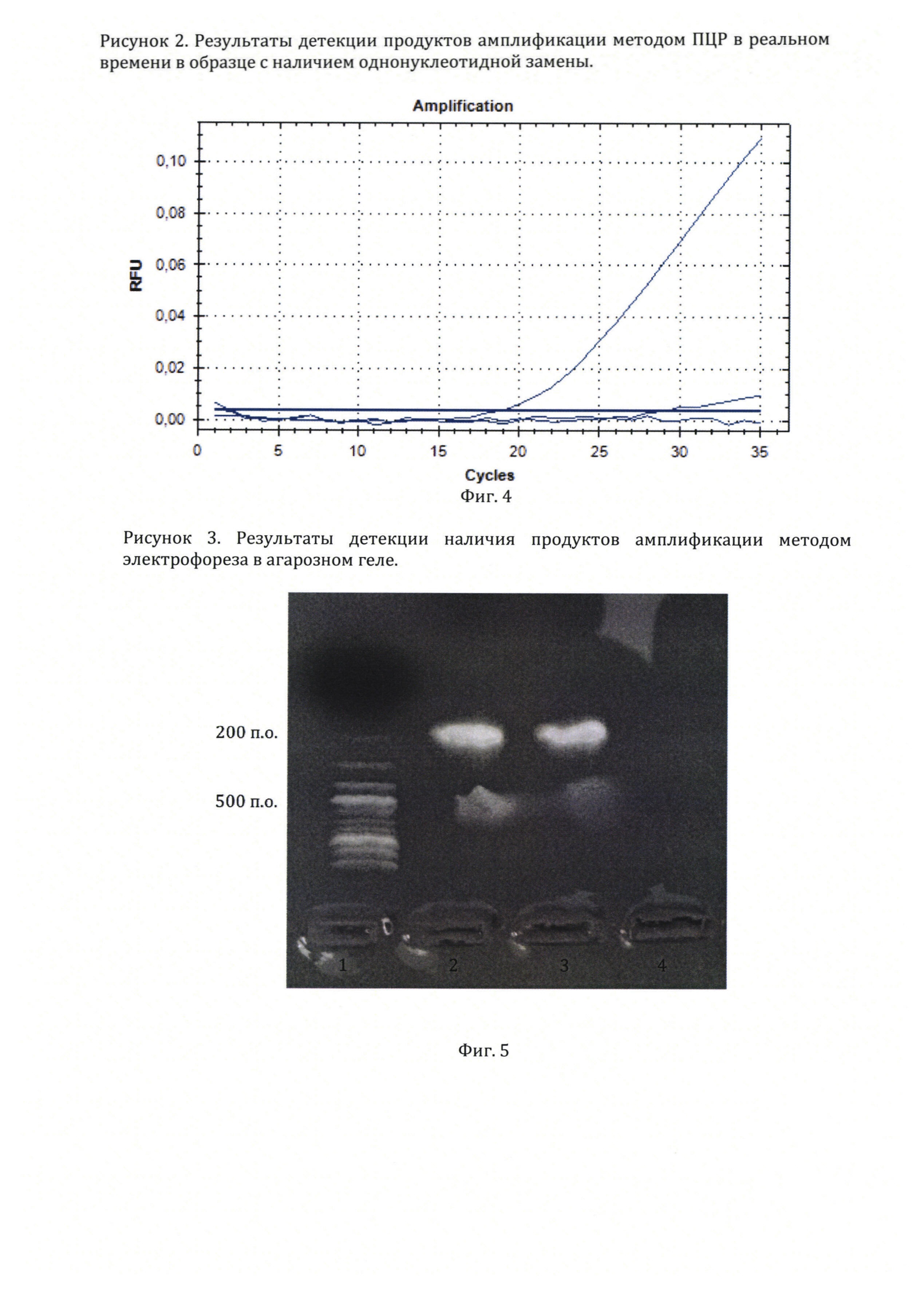
На фиг. 3, приведены олигонуклеотиды, использованные в примере 2 для детекции однонуклеотидной замены в последовательности нуклеотидов гена миостатина овец.
На фиг. 4, приведены результаты оценки флюоресценции при проведении ПЦР в реальном времени для детекции однонуклеотидной замены в последовательности нуклеотидов гена миостатина овец.
На фиг. 5, приведены результаты оценки амплификации методом электрофореза в агарозном геле при проведении детекции последовательности нуклеотидов в гене миостатина у овец.
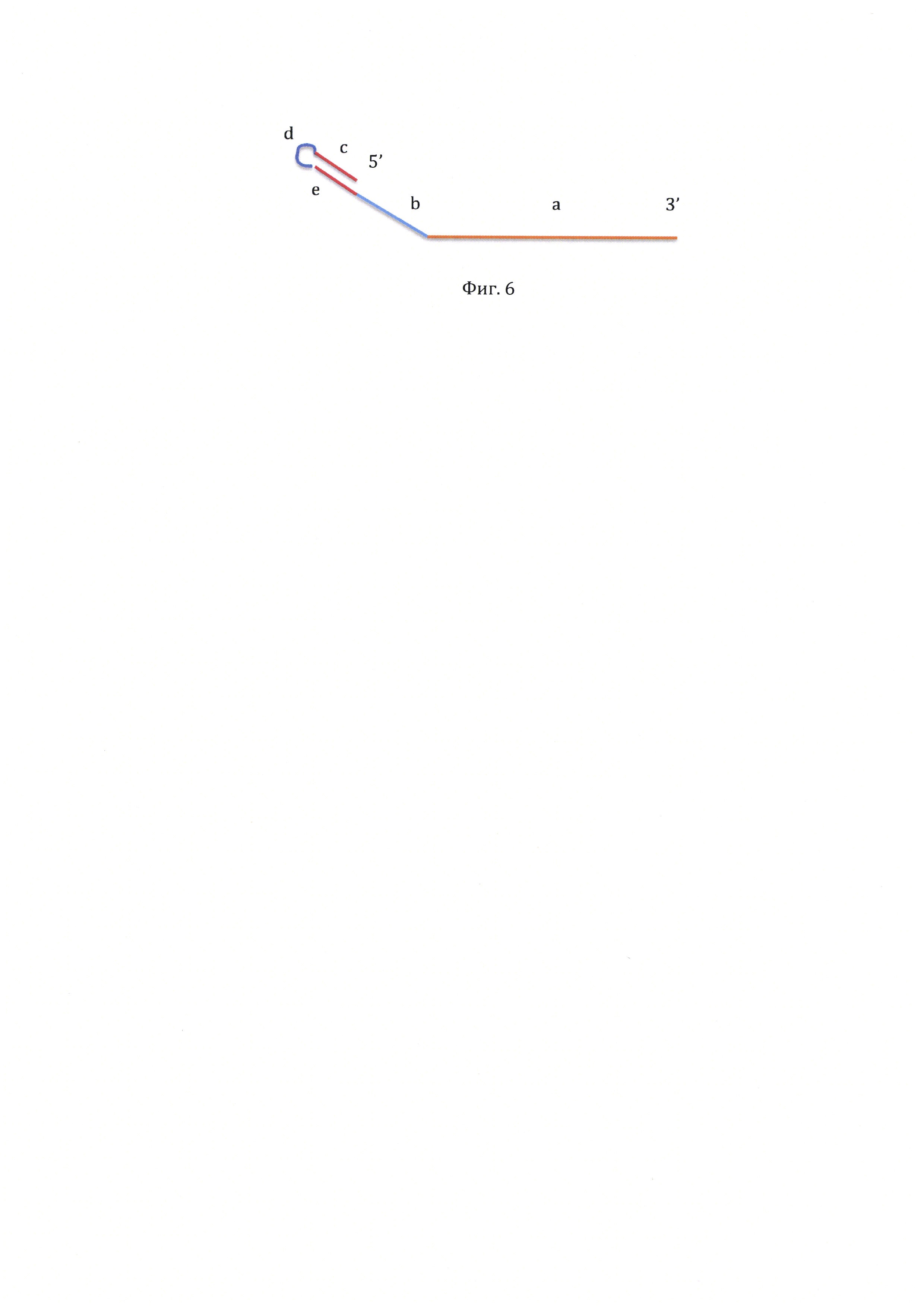
На фиг. 6, приведена структура прямого праймера, используемого при проведении ПЦР в реальном времени с универсальным зондом.
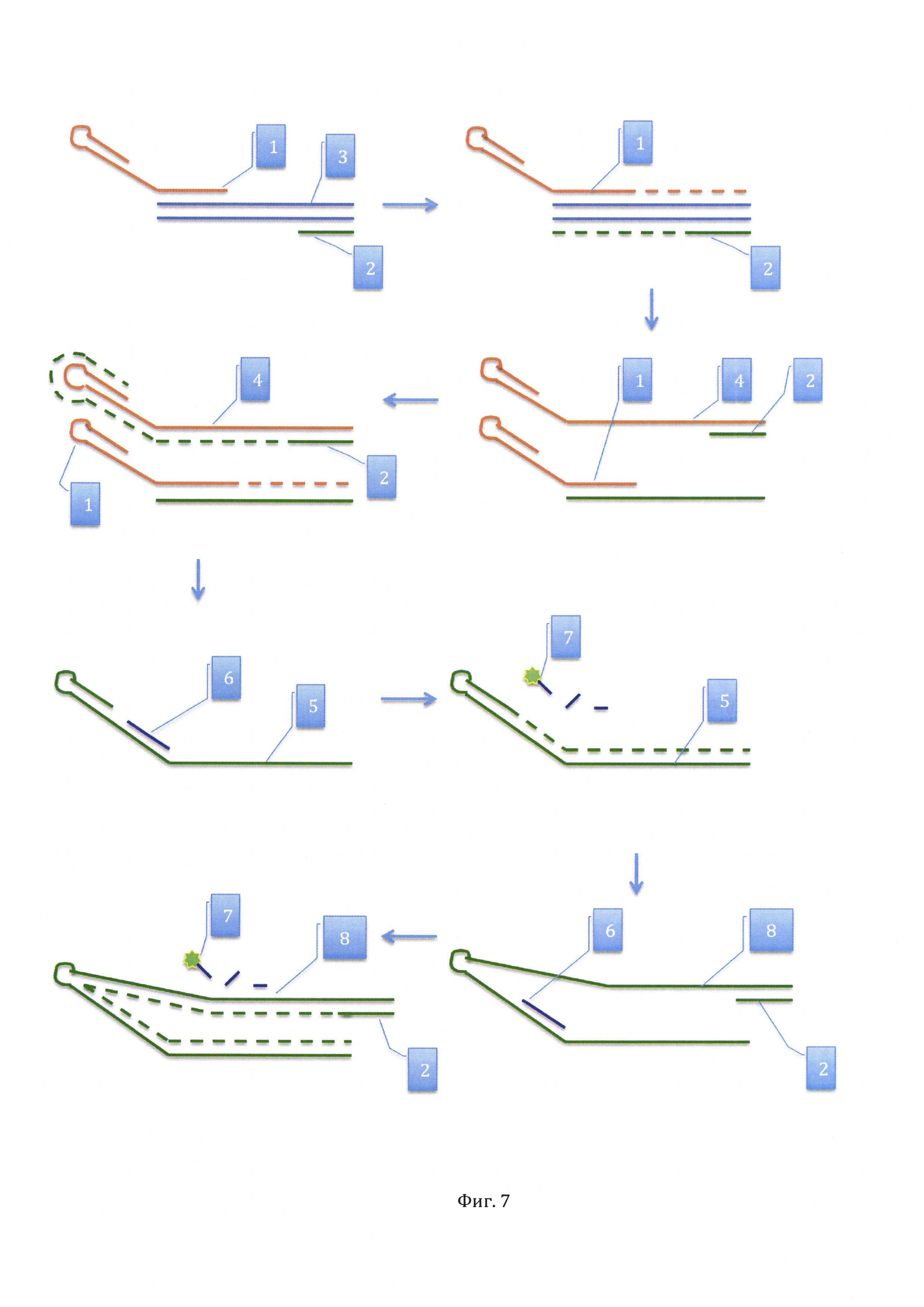
На фиг. 7, дан чертеж способа выполнения ПЦР в реальном времени с универсальным зондом.
Сущность способа состоит в том, что при проведении ПЦР в реальном времени используется прямой праймер особой конструкции, обеспечивающей образование в ампликоне последовательности нуклеотидов для отжига флуоресцентного зонда и формирование собственного праймера в виде «шпильки» на 3' конце, запускающего амплификацию и гидролиз зонда. Таким образом достигается возможность применения одного флуоресцентного зонда для детекции любых нуклеотидных последовательностей и повышение эффективности реакции за счет использования прикрепленного к 3' концу собственного праймера.
Строение прямого праймера представлено на фигуре 6. Участок праймера (а) расположен на 3' конце и комплементарен участку на детектируемой последовательности нуклеотидов. По сути, он представляет собой обычный праймер для ПЦР, с которого после гибридизации с детектируемой последовательностью нуклеотидов полимераза начинает достройку второй цепи. «Хвост» праймера, не комплементарный детектируемой последовательности нуклеотидов, содержит четыре участка. Участок (b) представляет собой последовательность нуклеотидов, идентичную структуре флуоресцентного зонда (например, зонда TaqMan). На самом праймере зонд не отжигается, так как имеет идентичную, а не комплементарную последовательность нуклеотидов. Но этот участок служит матрицей для образования на противоположной цепи участка для отжига флуоресцентного зонда. Участки (с) и (е) комплементарны друг другу и при достижении температуры отжига праймеров гибридизуются, образуя «шпильку», включающую промежуточный участок (d). Так как «шпилька» расположена на 5' конце, она не может служить собственный праймером и запускать амплификацию. Однако, она служит матрицей для образования на противоположной цепи «шпильки» с 3' концом нуклеотидной последовательности, которая может стать собственным праймером и запустить амплификацию.
Сущность предлагаемого способа ПЦР в реальном времени с универсальным зондом иллюстрирует фигура 7. Для амплификации детектируемой последовательности (3) используется два праймера: прямой (1) и обратный (2). Они отжигаются на противоположные цепи и запускают амплификацию навстречу друг другу. После амплификации и денатурации образуется два вида ампликонов: первый (4) является результатом достройки прямого праймера (1) и содержит участок для отжига обратного праймера (2); второй является результатом достройки обратного праймера (2) и содержит участок для отжига прямого праймера (1). На следующем цикле ПЦР прямой праймер (1) отжигается на ампликоне, полученном достройкой обратного праймера (2), а праймер (2) отжигается на ампликоне (4), полученном достройкой прямого праймера (1). В результате этого цикла формируется ампликон (5), представляющий собой последовательность нуклеотидов, комплементарную ампликону (4). Особенностью ампликона (5) является то, что в нем имеется участок, комплементарный флуоресцентному зонду (6) и «шпилька» расположена на 3' конце. В течение следующего цикла ПЦР происходит отжиг флуоресцентного зонда на ампликоне (5) и запуск амплификации с собственного праймера в области «шпильки». В результате происходит гидролиз флуоресцентного зонда с освобождением флуорофора (7) и появлением детектируемой прибором для ПЦР в реальном времени флуоресценции в реакционной смеси. После достройки последовательности нуклеотидов на ампликоне (5) образуется новый вид ампликона (8), который почти вдвое длиннее ампликона [5) и содержит участок для отжига обратного праймера (2). Обратный праймер (2) запускает достройку цепи на ампликоне (8), где также отжигается флуоресцентный зонд (6). При достройке цепи на ампликоне (8) происходит гидролиз зонда (6) с освобождением флуорофора (7) и увеличением детектируемой флуоресценции. В последующих цикла ПЦР описанные процессы происходят параллельно, то есть гидролиз флуоресцентных зондов идет на разных видах ампликонов, что повышает эффективность реакции.
Отличием и преимуществом предлагаемого метода над технологией Three-Star является использование всего двух праймеров вместо трех, использование обратного праймера обычной структуры (без «хвоста» для отжига третьего праймера), использование прямого праймера, содержащего «хвост» не с участком для отжига третьего праймера, а «шпильку», работающую в качестве собственного праймера. В результате эффективность предлагаемого метода гораздо выше, чем при использовании отдельного праймера, отжигающегося из реакционной смеси.
Осуществление изобретения.
Была оценена общая эффективность предлагаемого метода ПЦР в реальном времени с универсальным зондом. Примеры конкретного выполнения детекции разных нуклеотидных последовательностей с одним и тем же флуоресцентным зондом.
Пример 1.
Способ осуществляется следующим образом для выявления наличия определенной последовательности нуклеотидов в образце. В данном случае выполняется детекция наличия участка гена миостатина в образце ДНК овцы:
1. Синтезируется набор олигонуклеотидов, состоящий из прямого праймера, обратного праймера и меченого олигонуклеотида (флуоресцентного зонда) (фигура 1). Использовались олигонуклеотиды, синтезированные компаниями «Синтол» и «ГенТерра». Очищены электрофорезом в полиакриламидном геле. Поставлялись в лиофилизированном виде, перед использованием разводились согласно прилагаемым инструкциям.
2. Приготавливается реакционная смесь для ПЦР объемом 25 мкл. В качестве основы используется 10 мкл реакционной 2,5х смеси для проведения ПЦР-РВ фирмы «Синтол» с содержанием магния 6,25 мкМ. Готовая для проведения реакции смесь содержит прямой праймер в концентрации 0,8 мкМ, обратный праймер в концентрации 1,2 мкМ, флуоресцентный зонд в концентрации 0,8 мкМ. Смесь готовится в двух пробирках, в одну из которых (№1) добавляют 5 мкл тестового образца в концентрации 0.1 мкМ, состоящего из ДНК овцы, выделенной из клеток крови животного. В пробирку (№2) добавляется такое же количество дистиллированной воды.
3. Выполняется амплификация на амплификаторе «Mini Opticon» (BioRad) в следующем режиме:
1. Инициация денатурации 94°С - 2 минуты
2. Денатурация 94°С - 15 сек.
3. Отжиг праймеров 38°С - 30 сек.
4. Элонгация 72°С - 30 сек.
5. Детекция флуоресценции начиная с 10 цикла.
6. Повторение пунктов 2-4 44 раза.
4. График детекции флуоресценции в пробе и контрольной пробирке представлен на фигуре 2. В пробе, содержащей нуклеотидную последовательность гена миостатина отмечается начало детектируемой прибором флуоресценции на 32 цикле с экспоненциальным подъемом кривой флуоресценции на 32-44 циклах. В контрольной пробирке без образца флуоресценция не наблюдается. Полученный результат указывает на амплификацию участка гена миостатина праймерами, формирование на ампликонах участка для отжига флуоресцентного зонда и гидролиз зонда полимеразой в ходе амплификации.
Пример 2.
Способ осуществляется следующим образом для выявления наличия определенной последовательности нуклеотидов в образце. В данном случае выполняется детекция наличия однонуклеотидной замены на участке гена миостатина в образце ДНК овцы:
1. Синтезируется набор олигонуклеотидов, состоящий из прямого праймера, имеющего на 3' конце последовательность нуклеотидов, комплементарную участку с однонуклеотидной заменой, обратного праймера и меченого олигонуклеотида (флуоресцентного зонда) (фигура 3). Использовались олигонуклеотиды, синтезированные компаниями «Синтол» и «Бигль». Очищены электрофорезом в полиакриламидном геле. Поставлялись в лиофилизированном виде, перед использованием разводились согласно прилагаемым инструкциям.
2. Приготавливается реакционная смесь для ПЦР объемом 25 мкл. В качестве основы используется 10 мкл реакционной 2,5х смеси для проведения ПЦР-РВ фирмы «Синтол» с содержанием магния 6,25 мкМ. Готовая для проведения реакции смесь содержит прямой праймер в концентрации 0,8 мкМ, обратный праймер в концентрации 1,2 мкМ, флуоресцентный зонд в концентрации 0,8 мкМ. Смесь готовится в двух пробирках, в одну из которых (№1) добавляют 5 мкл тестового образца в концентрации 0.1 мкМ, состоящего из ДНК овцы, выделенной из клеток крови животного. В пробирку (№2) добавляется такое же количество дистиллированной воды.
3. Выполняется амплификация на амплификаторе «Mini Opticon» (BioRad) в следующем режиме:
1. Инициация денатурации 94°С - 2 минуты
2. Денатурация 94°С - 15 сек.
3. Отжиг праймеров 38°С - 30 сек.
4. Элонгация 72°С - 30 сек.
5. Детекция флуоресценции начиная с 10 цикла.
6. Повторение пунктов 2-4 44 раза.
4. График детекции флуоресценции в пробе и контрольной пробирке представлен на фигуре 4. В пробирке (№1), содержащей нуклеотидную последовательность гена миостатина с наличием однонуклеотидной замены в структуре гена отмечается начало детектируемой прибором флуоресценции на 32 цикле с экспоненциальным подъемом кривой флуоресценции на 32-44 циклах. В пробирке (№2) и контрольной пробирке (№3) без образца флуоресценция не наблюдается. Полученный результат указывает на амплификацию участка гена миостатина с наличием однонуклеотидной замены праймерами, формирование на ампликонах участка для отжига флуоресцентного зонда и гидролиз зонда полимеразой в ходе амплификации.
Пример 3.
Способ осуществляется аналогично описанному в Примере 1. После анализа результатов ПЦР в реальном времени выполняется детекция продуктов амплификации методом электрофореза в агарозном геле.
1. Подготавливается агарозный гель в концентрации 2%.
2. На гель наносится раствор, содержащий олигонуклеотиды известной длины (ладер, производство компании «Синтол») в количестве 10 мкл (лунка 1), 10 мкл содержимого пробирки (№1) в дубле (лунки 2 и 3) и 10 мкл содержимого пробирки (№2) в лунку 4.
3. Выполняется электрофорез напряжением 120 вольт в течение 35 минут.
4. Гель помещается в трансиллюминатор и фотографируется.
5. Фотография геля приведена на фигуре 5. Полоса (1) представляет результат разгона в электрическом поле олигонуклеотидов известной длины. Полосы (2) и (3) содержит результаты разгона олигонуклеотидов из пробирки (№1), в которой по данным анализа флуоресценции прошла амплификация участка гена миостатина. Полоса (4) содержит результаты разгона в электрическом поле содержимого контрольной пробирки (№3), в которой амплификация не зафиксирована. Как можно заметить, свечение в полосах (2) и (3) находится на уровне олигонуклеотидов длиной около 200-250 пар оснований в полосе (1), что соответствует длине амплифицируемого участка по данным базы GenBank NCBI. Таким образом, анализ результатов амплификации методом электрофореза в агарозном геле показал, что при использовании предлагаемого метода ПЦР в реальном времени с универсальным зондов происходит амплификация и детекция нужного участка гена миостатина.