Результат интеллектуальной деятельности: Способ лечения рассекающего остеохондрита коленного сустава
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к травматологии и ортопедии, и может быть использовано при лечении рассекающего остеохондрита коленного сустава.
Рассекающий остеохондрит относится к группе остеохондропатий. Заболевание является мультифакториальным, но основу патофизиологии данного процесса, по современным представлениям, составляет асептический некроз. Асептический некроз (аваскулярный некроз, остеонекроз) - инфаркт кости и костного мозга, возникающий, по всей видимости, в результате нарушения кровоснабжения. Современные теории развития данного патологического процесса придают большое значение локальному нарушению гомеостаза с развитием венозного застоя, возрастанию внутрикостного давления, нарушению целостности стенок сосудов [1]. В зависимости от локализации, в различных костях асептический некроз имеется ряд особенностей. Так при развитии аваскулярного некроза в зоне суставов очаг аваскулярного некроза имеет, как правило, клиновидную форму с основанием в субхондральной зоне. Суставной хрящ, непосредственно прилегающий к данному сегменту, остается, как правило, жизнеспособным, так как получает питание из синовиальной жидкости. Возникший очаг остеонекроза начинает подвергаться ремоделированию благодаря работе остеокластов, которые частично резорбируют некротизированные трабекулы. Нерезорбированные трабекулы служат в качестве остова для вновь формирующейся кости. Однако, в связи с нарушениями кровоснабжения, процесс этот оказывается малоэффективным, некротизированные трабекулы замещаются частично, в конечном итоге происходит окончательное спадение омертвевшей губчатой кости, и развивается деформация суставного мыщелка или эпифиза. В коленном суставе процесс чаще всего встречается в медиальном мыщелке бедренной кости - 80-85% случаев, реже - в латеральном мыщелке - до 10-12%, совсем редко в надколеннике - до 5%. [2].
Процесс претерпевает ряд стадий, выявляемых современными методами обследования. В таблице представлены сопоставление данных рентгенографии и MPT по Sanders и Crime, 2001 г. [3].

Длительность стадий по времени может сильно варьировать, при этом процесс может остановиться на любой стадии.
Современный подход в лечении асептического некроза предполагает дифференцированный подход в зависимости от того, какая стадия выявлена у пациента. Предложено ряд способов хирургического вмешательства, применяемых для лечения рассекающего остеохондрита коленного сустава.
Известен метод хирургического лечения, который подразумевает удаление остеохондрального фрагмента и микрофрактуринг зоны дефекта спицей, или шилом, без замещения чем-либо. Однако впоследствии у таких пациентов возникает прогрессирование остеоартроза в связи с тем, что оставшаяся часть суставного мыщелка не может выдерживать полноценную нагрузку [4].
Известен способ остеоперфорации очага некроза мыщелка бедренной кости до субхондральной зоны с помощью спицы, выполняемый ретроградно, под контролем электронно-оптического преобразователя. Однако при данном способе возможно «выталкивание» остеохондрального фрагмента и неточность наведения спиц на зону остеонекроза. Данный способ эффективен в основном у детей и подростков на ранних стадиях заболевания [5].
Известен способ замещения остеохондрального дефекта с использованием трансплантата кость-хрящ так называемая «мозаичная хондропластика», при которой зону остеонекроза высверливают с помощью полой фрезы. Однако данная методика подразумевает забор материала из донорского места (дополнительная травматизация), требуется жесткая фиксация, пересаженные трансплантаты не полностью покрывают зону дефекта, перестройка трансплантатов происходит не полностью. Данный способ показан при 3 и 4 стадиях заболевания [6].
Известен способ удаления остеохондрального фрагмента, с последующей остеоперфорацией и закрытием коллагеновой мембраной. При данном способе очаг остеонекроза не ликвидируется, образуется фиброзный хрящ, отличающийся по составу от гиалинового. Коллагеновая мембрана является чужеродным материалом и имеет высокую стоимость [7].
Для восстановления возникшего хондрального дефекта предложена имплантация аутологичных хондроцитов (АО), культивированных in vitro, затем пересаженных в зону дефекта, и закрепленных с помощью надкостницы, или искусственной мембраны. Предварительно, первым этапом, производят замещение костного дефекта с помощью собственной, или аллогенной кости. Данный способ предполагает несколько этапов лечения, длительные сроки получения культуры клеток (порядка 3 недель), многочисленные пассажи культивированных клеток, расширение хирургической агрессии при заборе надкостницы, кроме того, искусственная мембрана является чужеродным материалом, высока и стоимость такого лечения [8].
Существующие хирургические методы для замещения некротизированной костной ткани предполагают использование аутологичного, или аллогенного, костного материала, а также искусственных материалов. Искусственные заменители кости отличаются от натуральной кости по структуре и составу, что затрудняет их применение в процессе естественного остеогенеза. Безусловно, неоспоримым преимуществом обладает аутологичная костная ткать. Однако использование ее предполагает дополнительную травматизацию пациента, увеличение длительности реабилитационного периода, при недсклягочности реваскуляризации трансплантата, высока вероятность его резорбции. В основе использования аллогенных деминерализованных костных трансплантатов лежит компенсаторная способность организма к замещению дефекта костной ткани собственной костью с биодеградацией аллотрансплантата. Принцип действия аллотранплантата - временное замещение костной ткани, что позволяет активировать эндогенные клеточные процессы с привлечением различных ростовых факторов [9, 10]. Однако в условиях так называемой «остеогенной недостаточности», когда нарушена нормальная работа остеоиндуцирующих факторов системного, или локального уровня, может потребоваться повышение индуктивности «одинарных» костных материалов с использованием тканеинженфных решений [11].
В ряде современных исследований была показана способность мультипотентных клеток организма к дифференцировке в различных направлениях, в том числе, в остеогенном и хондрогенном. Клетки аутологичной стромальной васкулярной фракции являются перспективным источником для терапии патологий, связанных с костно-суставной системой. Наши предыдущие исследования показали, что клетки СВФ, полученные из аутологичной жировой ткани, подвергнутой ферментной обработке, содержат мезенхимные стволовые клетки, эндотелиальные предшественники, М2 поляризированные макрофаги и Т-лимфоциты, которые служат источником регенерации и закрытия дефекта хряща [12].
Более того, при прямой трансплантации аутологичных клеток СВФ в зону ложного сустава бедренной кости мы наблюдали эффект стимуляции регенерации костной ткани с образованием периостальной костной мозоли [13].
Таким образом, клетки СВФ могут рассматриваться как перспективный источник для терапии остеохондральных дефектов, в сочетании с трансплантацией костного матрикса.
Наиболее близким заявляемому способу, по своему техническому решению, является способ открытой или артроскопической фиксации фрагмента винтом, или биоабсорбируемым пином, с предварительной остеоперфорацией зоны остеонекроза с помощью спицы [14, 15]. К недостаткам данного способа можно отнести плохие условия для восстановления костной и хрящевой тканей, т.к. очаг остеонекроза не удаляют, не производят его замещения, а значит, возможно асептическое расшатывание, и миграция винта, раскалывание фрагмента.
Сущность изобретения состоит в совокупности существенных признаков, достаточной для достижения искомого технического результата, который заключается в создании способа одноэтапного хирургического лечения с надежной фиксацией остеохондрального фрагмента, с замещением некротизированной кости деминерализованными костными трансплантатами, и созданием условий для восстановления костной ткани, и приживления остеохондрального фрагмента.
Сущность способа лечения рассекающего остеохондрита коленного сустава включает остеоперфорацию зоны остеонекроза с помощью спицы и фиксацию остеохондрального фрагмента. Производят липосакцию жировой клетчатки из области передней брюшной стенки, и/или ягодичной области, и/или наружной поверхности бедер. Осуществляют забор аутологичной жировой ткани, после проведения ферментной обработки, из нее получают клетки СВФ. Производят эндоскопическое обследование - артроскопию коленного сустава, определяют локализации, размер, стабильность остеохондрального фрагмента. Выполняют мини-артротомию, туннелизацию фрагмента через хрящевую пластинку, отделяют остеохондральный фрагмент от ложа, по возможности сохранив частичную его связь с материнским местом в виде «створки», удаляют некротизированную кость. Выполняют множественную, не менее 5 отверстий, туннелизацию зоны костного дефекта, на глубину 1 см, и более, в различных направлениях. Производят костную пластику, с использованием деминерализованных костных трансплантатов, пропитанных аутологичной стромальной васкулярной фракцией (СВФ) из жировой ткани. Клетки СВФ вводят одновременно с фибриновым клеем, с использованием системы дуплоджект, точно в область дефекта кости. Остеохондральный фрагмент устанавливают на место, выдерживают 5 минут, накладывают, при необходимости, трансхондральный шов, выполняют 8-10 циклов пассивных сгибательно-разгибательных движений в суставе, рану послойно ушивают.
Артроскопическое исследование необходимо для выявления локализации, размера и стабильности дефекта, и определения стадии процесса.
Проведение мини-артротомии пораженного сустава обеспечивает доступ к поврежденному участку хряща
Туннелизация хондральной пластинки 3-4 отверстиями позволяет избежать повышения внутрикостного давления и венозного застоя.
Отделение остеохондрального дефекта в виде «створки» позволяет сохранить его связь с суставной поверхностью, что способствует лучшей регенерации.
Частичное удаление кости с внутренней поверхности «створки», с сохранением субхондрального слоя, улучшает регенеративный процесс в остеохондральном фрагменте.
Удаление некротизированной и склерозированной кости со дна дефекта мыщелка бедренной кости до здоровой кости подготавливает условия для восстановления кровоснабжения пораженного участка.
Множественная, не менее 5 отверстий, туннелизация зоны костного дефекта на глубину 1 см, и более, в различных направлениях, выполненная с помощью спицы диаметром 2 мм, обеспечивает улучшение приживления костного аллотрансплантата.
Использование деминерализованного костного аллотрансплантата позволяет, без дополнительной травматизации пациента, заполнить дефицит костной ткани и восстановить контур суставного хряща.
Жировая ткань пациента является богатым источником аутологичного материала, что предотвращает риск имуннологического отторжения, и позволяет получить в сжатые сроки большое количество клеток Клетки СВФ, полученные из аутологичной жировой ткани, подвергнутой ферментной обработке, содержат мезенхимные стволовые клетки, эндо-телиальные предшественники, М2 поляризированные макрофага и Т-лимфоциты, которые служат источником регенерации и восстановления костной и хрящевой тканей
Использование неэмбриональных клеток стромально-васкулярного фенотипа исключает риск развития необластических процессов.
Введение клеток СВФ в область остеохондрального дефекта улучшает регенераторный потенциал костной и хрящевой ткани.
Одновременное введение клеток СВФ с фибриновым клеем позволяет создать благоприятные условия для прикрепления, выживания и дифференцировки трансплантируемых клеток, предотвращает их неконтролируемую миграцию, а также способствует хорошей фиксации остеохондрального фрагмента и восстановлению хрящевой ткани по периметру, применение системы дуплоджект обеспечивает одновременное введение клеток ССФ и фибринового клея.
Выдержка сустава в течение 5 минут после нанесения клеток и фибринового клея обеспечивает фиксацию клеток СВФ в области дефекта, что соответствует инструкции по применению клея.
Выполнение трансхондрального шва биоабсорбируемой нитью позволяет получить более надежную фиксацию остеохондрального фрагмента, и начать более раннее реабилитационное лечение.
Выполнение 8-10 циклов пассивных сгибательно-разгибательных движений в суставе необходимо для контроля крепления остеохондрального фрагмента.
Предложенный способ не требует длительного выращивания клеток in vitro, что сокращает сроки лечения.
Способ поясняют приведенные иллюстрации:
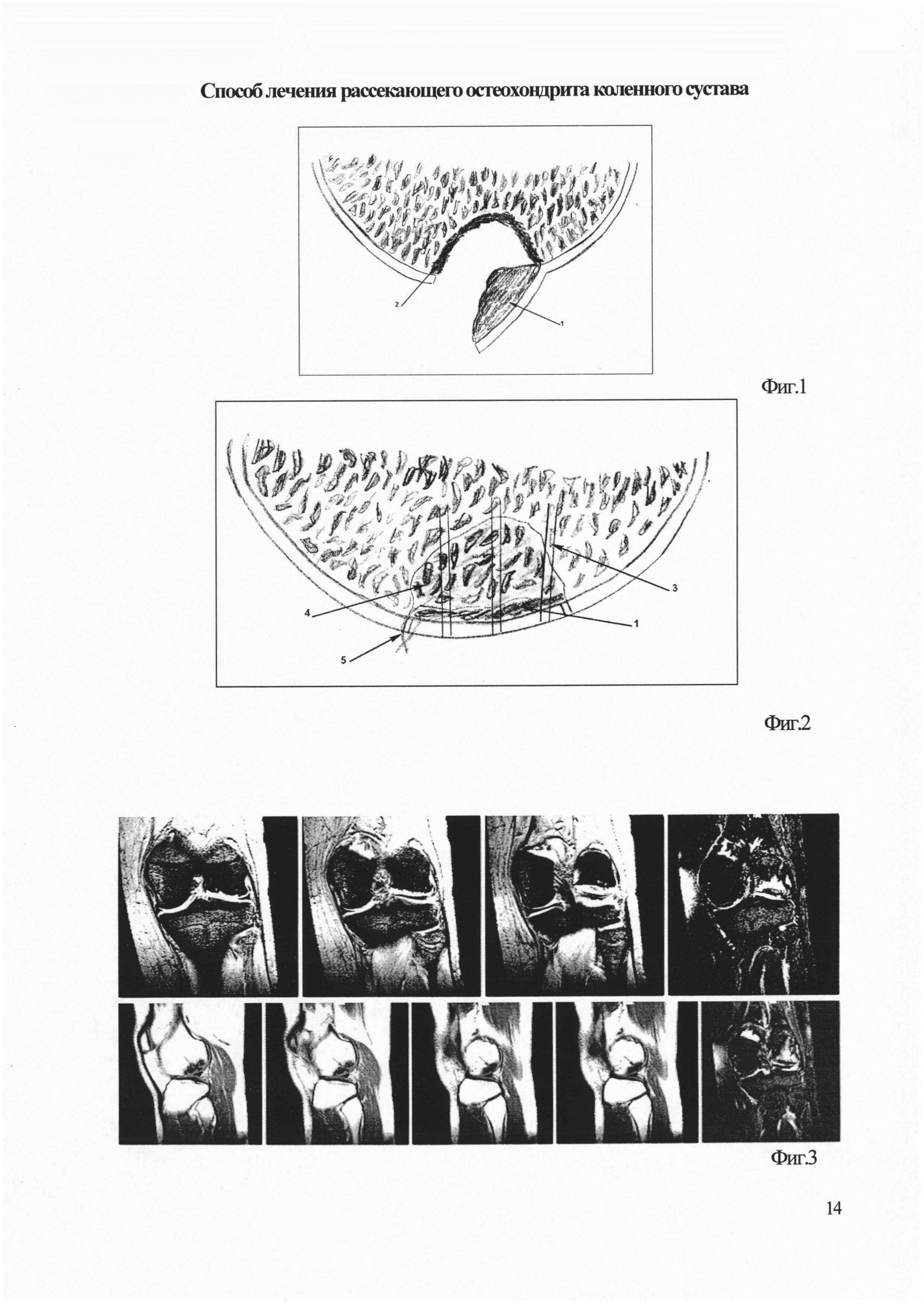
На фиг. 1 приведена схема отделения остеохондрального фрагмента от ложа, где: 1 - остеохондральный фрагмент в виде «створки», некротизированная кость до субхондрального слоя; 2 - склерозированная кость, подлежащая удалению;
На Фиг. 2 - схема восстановления контура суставного хряща, где: 1 - остеохондральный фрагмент в виде «створки», 3 - канал после туннелизации, 4 - аллотрансплантат, пропитанный СВФ, 5 - биоабсробируемый трансхондральный шов.
На Фиг. 3 - МРТ коленного сустава пациентки О. до операции;
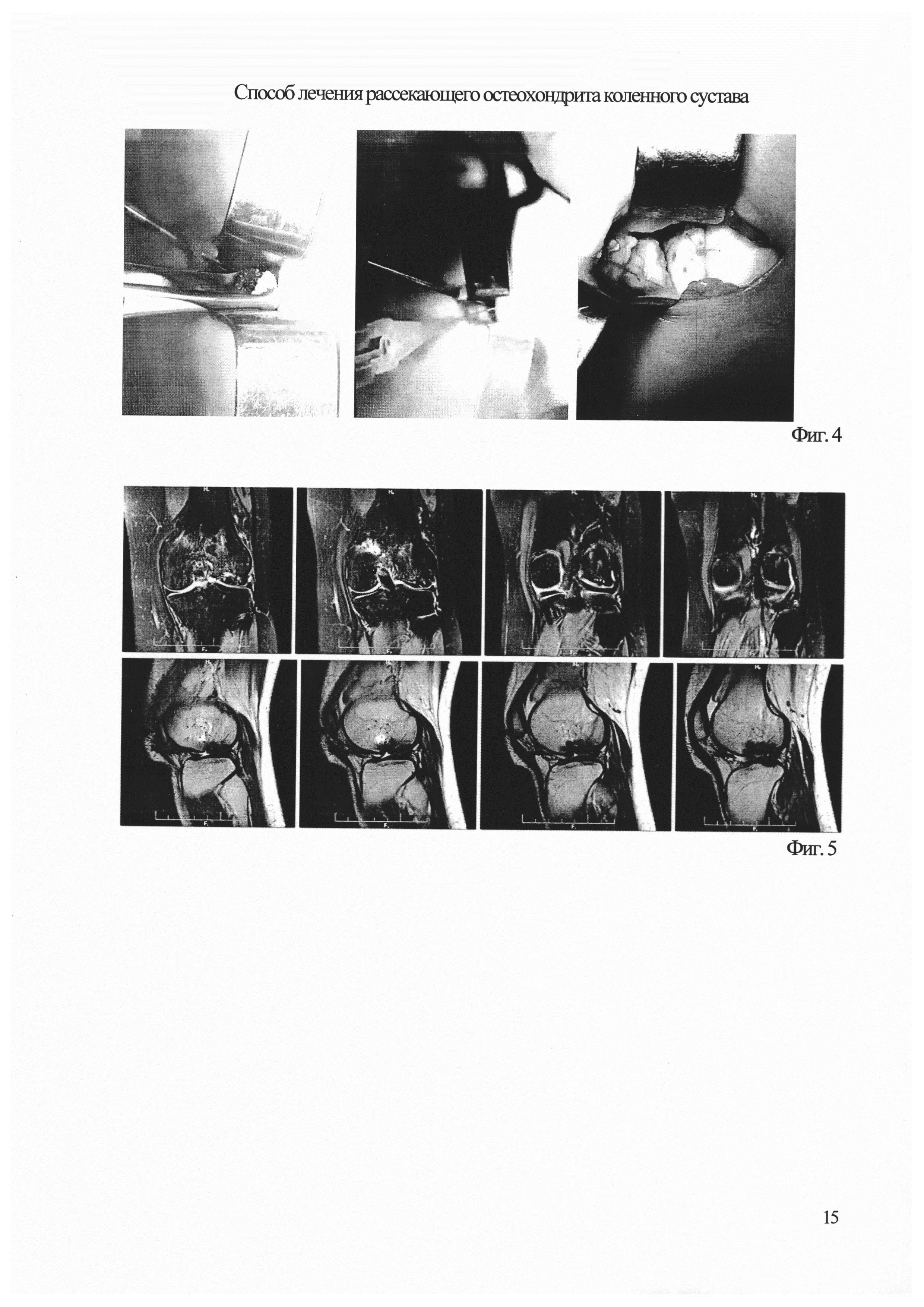
На Фиг. 4 - интраоперациооные фото клинического прмера;
На Фиг. 5 - МРТ коленного сустава пациентки О. на сроке 6 мес. после операции.
Способ выполняют следующим образом
Предварительно выполняют РКТ, или МРТ, обследование пораженного сустава, по результатам которого определяют локализацию, размер участка асептического некроза и стадию процесса. При сохранности основного контура суставной поверхности без проседания фрагмента, или неполном отделении фрагмента, планируют выполнение оперативного вмешательства по предлагаемому способу.
Под местной анестезией выполняют забор жировой ткани пациента из области передней брюшной стенки, и/или ягодичной области, и/или наружной поверхности бедер, с помощью липотома, в объеме 150-300 мл, из которой в лабораторных условиях получают СВФ.
Проводят артроскопию коленного сустава, в процессе которой оценивают состояние основных структур сустава и суставного хряща, определяют местоположение патологического участка, оценивают его размеры. Выполняют мини-артротомию. Производят туннелизацию 3-4 отверстиями хондральной пластинки, с помощью спицы диаметром 2 мм. Выполняют отделение остеохондрального фрагмента, по возможности сохранив частичную его связь с материнским местом в виде «створки». Производят частичное удаление костной ткани с внутренней поверхности «створки», сохранив субхондральную кость, и удаление некротизированной и склерозированной кости со дна дефекта мыщелка бедренной кости до здоровой кости (фиг. 1).
Выполняют множественную, не менее 5 отверстий, туннелизацию зоны костного дефекта, на глубину 1 см, и более, в различных направлениях, с помощью спицы диаметром 2 мм. Образовавшуюся полость заполняют деминерализованным костным трансплантатом, проверяя, чтобы при закрытии «створки» не было ее провала. Затем, открыв «створку», производят введение клеток СВФ одновременно с фибриновым клеем, используя систему дуплоджект. Закрывают «створку», выдерживают 5 минут, проверяют стабильность крепления «створки». При необходимости, для более надежной фиксации «створки» остеохондрального дефекта, выполняют трансхондральный шов биоабсорбируемой нитью 4/0 (фиг. 2). Выполняют 8-10 циклов пассивных сгибательно-разгибательных движений конечностью. Рану послойно ушивают. Накладывают иммобилизирующую лонгету в положении полного разгибания.
Аналогично производят лечение рассекающего остеохондрита при локализации в области надколенника.
В послеоперационном периоде рекомендуется ходьба с костылями, без нагрузки на оперированную ногу. Гипсовую лонгету и швы снимают на сроке 2 недели с момента операции. На 4-6 неделю разрешается нагрузка на ногу до 50% веса тела, на сроке 8 недель с момента операции - полная нагрузка на ногу. Сгибание до 90 градусов разрешается через 2 недели с момента операции, сразу после снятия швов; на сроке 8 недель - сгибание до 120 градусов. ЛФК, массаж, реабилитационное лечения - начиная с 4 недели с момента операции. Контрольные осмотры проводят на сроках 2, 4, 6, 12 месяцев с рентгенографией, РКТ, или МРТ, обследованиями.
Клинический пример.
Пациентка О., 27 лет, поступила в отделение ортопедии с жалобами на боли в наружном отделе левого коленного сустава в покое, и при нагрузках, периодическое припухание коленного сустава; боли ноющего характера, приходящие резкие боли при нагрузке. Больна около 5 лет, лечилась консервативно. Последние 6 месяцев отмечает усиление болей. При осмотре выявлена болезненность в наружном отделе левого коленного сустава, объем движений составил 0/0/100 гр. Признаков нестабильности не выявлено. По данным рентгенографии и МРТ левого коленного сустава: признаки рассекающего остеохондрита латерального мыщелка бедренной кости без нарушения контуров мыщелка (фиг. 3). Пациентке предложено оперативное лечение по предложенному способу.
Первым этапом, под местной анестезией, выполнена липосакция, забор жировой ткани в объеме 150 мл. В лабораторных условиях выделено 2,5 млн. клеток стромальной васкулярной фракции. В этот же день выполнена операция артроскопия левого коленного сустава, идентифицирован очаг остеохондропатии в наружном мыщелке бедренной кости овальной формы 15×25 мм в нагружаемой зоне, который имел четкие границы, и начал отделяться при пальпации артроскопическим щупом. Из наружного доступа L=4 выполнена мини-атротомия, остеохондральный фрагмент приподнят в виде «створки», без полного отделения дефекта, выполнена туннелизация хондральной пластинки 4 отверстиями. С помощью кюретки произведено удаление некротизированной и склерозированной кости с мыщелка бедренной кости, и частично - с внутренней поверхности остеохондрального фрагмента. Произведена множественная туннелизация зоны костного дефекта, на глубину 1 см, в различных направлениях, с помощью спицы диаметром 2 мм. Образовавшуюся полость заполнили деминерализованным костным трансплантатом, проверяя, чтобы при закрытии «створки» не было ее провала. Затем, открыв «створку», с использованием системы дуплоджект, произведено введение СВФ в объеме 2,5 млн. клеток с фибриновым клеем «Тиссукол-Кит». Фрагмент установили на место, выдержали 5 минут, проверили стабильность крепления с помощью шуга. Наложили 2 трансхондральных шва биоабсорбируемой нитью 4/0 для более надежной фиксации «створки» остеохондрального дефекта. Выполнили 10 циклов пассивных сгибательно-разгибательных движений. Рану послойно ушили. Наложили иммобилизирующую лонгету в положении полного разгибания (фиг. 4).
В раннем послеоперационном периоде отмечалась умеренная припухлость, не потребовавшая пункции. На сроке 2 недели сняты швы, к этому момента отечность коленного сустава спала, гипсовая лонгета удалена, разрешено сгибание конечности в коленном суставе до 90 градусов, ходьба с костылями, без нагрузки на оперированную конечность; с 5 по 8 неделю - нагрузка до 50% веса, объем движений до 120 градусов; курс реабилитационного лечения. Осмотрена на сроке 6 мес.: болевого синдрома нет, припухание не отмечается, восстановлен полный объем движения в коленном суставе, умеренная гипотрофия мышц бедра. По данным МРТ коленного сустава наблюдается процесс ремоделирования костной ткани в области костного аллотрансплантата, пропитанного СВФ, смещения фрагмента не отмечено (фиг. 5). Планируется дальнейшее наблюдение.
Источники информации:
1. Heyworth В.Е., Kocher М. S. Osteochondritis Dissecans of the Knee. JBJS Reviews: July 7th, 2015 - V. 3 - Issue 7 - doi: 10.2106/JBJS.RVW.N.00095.
2. Clanton Т.O., DeLee J.C. Osteochondritis dissecans: history, pathophysiology and current treatment concepts. ClinOrthop 1982; 167:50-64.
3. Sanders R.K., Crim J.R. Osteochondral injuries. Semin Ultrasound CT MR. 2001., Vol. 22, Issue 4: 352-370.
4. Steadman J.R., Rodkey W.G., Rodrigo J.J. Microfracture: surgical technique and rehabilitation to treat chondral defects. Clin Orthop Relat Res. 2001 Oct; (391 Suppl):S362-9.
5. Патент РФ №2476177, A61B 17|57, БИ №6, 2013 г.
6. Wahegaonkar A.L., Doi К., Hattori Y., Addosooki A. Technique of osteochondral autograft transplantation mosaicplasty for capitellar osteochondritis dissecans. J. Hand Surg. [Am]. 2007; 32(9):1454-1461.
7. Behrens P, Bitter T, Kurz B, Russlies M. Matrix-associated autologous chondrocyte transplantation/implantation: a 5-year follow-up. Knee. 2006; 13(3):194-202. [PubMed].
8. Brittberg, M. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation / M. Brittberg, A. Lindahl, A. Nilsson et al. // N. Engl. J. Med - 1994. - Vol. 331, №14. - P. 889-895.
9. Кирилова И.А. Сравнительная характеристика материалов для костной пластики: состав и свойства / И.А Кирилова, М.А Садовой, В.Т. Подорожная // Хирургия позвоночника. - 2012. - №3. - с. 72-83.
10. Zakaria S.М. Nanophase hydroxyapatite as a biomaterial in advanced hard tissue en-gineering: a review / S.M. Zakaria S.M., S.H. SharifZein., MR Othman et al. // Tissue Eng Part В Rev. 2013 Oct; 19(5):431-41.
11. Деев P.B. Одинарные и активированные остеопластические материалы. Обзор литературы. / Р.В. Деев, А.Ю. Дробышев, И.Я. Бозо // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2015. - №1. - с. 51-64.
12. Патент РФ №2559089, А61К 35/12, А61Р 19/02, Бюл. №22, 2015 г.
13. Масгутов Р.Ф. Применение клеток стромальной васкулярной фракции жировой ткани при ложном суставе бедренной кости: клинический случай / Р.Ф. Масгутов, Р.З. Салихов, Ю.А. Плаксейчук, И.И. Салафутдинов и др. // Гены и клетки, 2013, - Т 8, №3, с. 116-118.
14. Cain E.L, Clancy W.G. Treatment algorithm for osteochondral injuries of the knee, din Sports Med. 2001 Apr; 20(2):321-42.
15. Hughston, J.C., Hergenroeder, P.Т., Courtenay, B.G. Osteochondritis dissecans of the femoral condyles. J. Bone Joint Surg [Am] 1984; 66:1340-8.